STUD1 MOLEKULAR DAN UJI KETAHANAN
PAD1 TRANSGENIK TEREL4DAP
Rhizodonia solani
KUHN
DAN
Pyricularia oryzae
CAV
DJEMLU FILEMON PARERA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Studi Molekular dan Uji
Ketahanan Padi Transgenik terhadap Wtizoctoniu solani Khun dan Pyriculuria
o p a e Cav, adalah karya saya sendiri dan belum diajukan dalam bentuk apapun
kepada perguruan tinggi manapun. Sumber informasi atau yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain,
telah disebutkan dalain teks dan dicantumkan dalam daftar pustaka acuan di
bagian akhir tesis ini.
Bogor, Maret 2006
ABSTRAK
DJEhlLY FILEMON PARERA. Studi Molekular dan Uji Ketahanan Padi Transgenik Terhadap Rhizoctonia soluni K W dan Pyricularia oryzue CAV. Di bimbing oleh Agus Purwito dan Inez Hortense Slamet-Loedin.
Padi transgenik yang diuji di sini adalah tanaman padi yang mengalami peningkatan akumulasi asam salisilat (AS). AS menyebabkan terekspresi gen-gen ketahanan tanaman, dan ketahanan yang diperoleh secara systemic (Systemic Acquire Resistance, SAR). AS di dalam tanaman berperan dalam pusat pertahanan melawan serangan patogen. Gen-gen yang bertanggungawab dalam biosintesis AS melalui dua tahapan proses yaitu entC yang diisolasi dari
Escherichia coli menyandikan isokorimat synthase (ICS) menghasilkan
isokorismat dan pnzsB yang diisolasi dari Pseudomonus,jluerescens menyandikan isochorismat pyruvat lyase (IPL) menghasilkan AS.
Hasil uji hipromisin menunjukkan bahwa galur E-10-1 dan B-11-1 cenderung mengikuti pola segregasi Mendel 3 : 1.
Uji ketahanan padi transgenik terhadap cendawan Rhizoctonia solani
(Ag-I) didapat 2 galur transgenik asal kultivar rojolele yang memiliki ketahanan terhadap serangan cendawan Rlzizoctonia solani (Ag-I) yaitu galur E-10-1 dau B-1 1-1. Sedangkan untuk Galurtransgenik asal IRATl12 adalah G6.
Uji ketahanan padi transgenik terhadap cendawan Pyricularia oryzae (ras
173) di dapat 6 galur yang memiliki persentase intensitas penyerangan cendawan
Pyriculuria oryzae (ras 173) dibawah 50 persen yaitu GI, G3, G5, G6, E-10-1 danB-11-1.
STUDS MQLEKULAR DAN UJI KETAHANAN
PADS TRANSCENSK TERHADAP
Rhizoctonia solani
Kuknv
DAN
Pyricularia oryzae
CAV
DJEMLY FILEMON PARERA
Tesis
sebagai salah satu syarat untuk ineinperoleh gelar
Magister Sains pada
Program Studi Biotelcnologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Studi Molekular clan Uji Ketahanan Padi Transgenik Terhadap Rhizoctonia solani Kuhn
dm
Pyricularia olyzae Cav.Nama : Djemly Filemon Parera
NRP
: P28500001Program Studi : Bioteknologi
Disetujui,
Komisi Pembimbing
Dr. Ir. ~ s h ' ~ u r v v i t o . MSG. Ketua
Diketahui,
Ketua Program Studi Bioteknologi
da Manuwoto, MSc
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Tuhan Jesus Kristus atas segala limpahan kasih dan karuniaNya sehingga tesis ini bisa berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan
Maret 2004 ialah Ekspresi gen ketahanan terhadap Rhizoctoniu soluni Kuhn dan
Pyriculuriu orytrre Cav, dengan judul STUDI MOLEKULAR DAN UJI KETAHANAN
PADI TRANSGENM TERHADAP R h k ~ o n i u s o Z c m i K ~ dan J3riculariu o y z e CAV.
Terima kasih penulis ucapkan kepada Bapak Dr 11. Agus Purwito, MSc
dan Ibu Dr. Ir. Inez Hortense Slamet-Loedin, MSc selaku pembimbing serta
Prof Dr. Ir. G.A. Wattimena, MSc yang telah banyak memberikan saran,
disamping itu penghargaan penulis sampaikan kepada Ibu Ir. Enung
Mulyaningsih, MSi, Sri, Angki, Dwi, Carla, Juli, Avi, Taufik, Budi beserta
seluruh Staf kelompok Padi Pusat Penelitian Biotek LIP1 Cibinong yang telah
membantu penulis dalam pengambilan data bioassay dirumah kaca dan di laboratorium. Tak lupa juga penulis ucapkan terima kasih kepada Ibu Ir. Anggi
Nasution, Pak Ade Ahmad beserta Staf Rumah Kaca Kelti Rekayasa Protein clan
Imunologi, Balai Penelitian Bioteknologi dan Sumberdaya Genetika Bogor yang telah membantu menyuplai isolat cendawan dan pengambilan data. Ucapan terima
kasih yang tulus penulis sampaikan kepada keluarga besar 24B, Bu Jerry, Usi
Nona, Piet, Anne, Bu Ampi, Usi Meity, Usi Vivi, Bung Gys, Om Oloph, tante
Daar, Edwin, Lady, dan Bu Febby untuk semangat dan dukungan doa. Ungkapan
terima kasih yang tak terhingga disampaikan kepada Anthony Alexander Parera
dan Henderina Christina Locopessy selaku Ayah dan Bunda serta kedelapan
saudara kandungku yang selalu memberikan doa dan dana serta semangat.
Ucapan terima kasih yang sangat dalam kepada istriku Foni, dan kedua anak
tercinta Allda dan Daniel yang selalu memberikan dorongan, doa, semangat dan kasih sayangnya.
Semoga tesis ini bermanfaat.
Bogor Maret 2006
Penulis dilahirkan di Arnbon pada tanggal 26 Juni 1967 anak ke-enam dari pasangan Anthony Alexander Parera dan Henderina Christina Lokopessy. Pendidikan Sarjana ditempuh pada Program Studi Agronomi Jurusan Budidaya Pertanian, Fakultas Pertanian Universitas Pattimura Arnbon pada tahun 1993. Masuk pendidikan pascasarjana pada tahun 2000 pada Program Studi Bioteknologi, Program Pascasajana IPB Bogor.
Tahun 1995
-
1996 penulis bekerja sebagai Sarjana Penggerak Pembangunan Pedesaan di Desa Wainibe, Kecamatan Buru Utara Timur, Kabupaten Maluku Tengah, Propinsi Maluku. Tahun 1997 sampai saat ini penulis bekerja sebagai Dosen Tetap pada Fakultas Pertanian Universitas Pattimura, Ambon.DAFTAR IS1
Halaman
DAF~AR TABEL ... xi
DAF~AR GAMBAR
...
xii... DAFTAR LAMPIRAN
...
X I I ~ Latar belakang...
1Hipotesis
...
3. . Tujuan Penellban ... 4
Manfaat Hasil Penelitian
...
4Tanarnan Transgenik
...
5. . Asa~n Sallsllat ... 7
Penyakit Hawar Pelepah Daun
...
8Penyakit Blas
...
9Uji Ketahanan
...
9. .
Anahsls Molekuler...
10Polymerase Chain Reaction (PCR) ... 10
Uji Ketahanan Padi Transgenik Terhadap R/zizoctonia solani ...
...
Tingkat Kerclsakan Tanaman...
Jumlah Anakkan Baru...
Jumlah Malai Produktif
...
...
Persentase Tanaman Suwive
...
...
Uji Ketahanan Padi Transgenik Terhadap Pyricularia oryzae
...
Intensitas Penyerangan
...
Analisis MolekularKesimpulan ... 34 Saran
...
34DAFTAR TABEL
Halaman
1. Proyeksi Produksi dan Ketersediaan Beras untuk Konsumsi,
...
2001 - 2004 1
2. Kisaran ukuran fragmen DNA dengan berbagai konsentrasi
gel agasose
...
113. Hasil uji hgromisin dan analisis khi-kuadrat
...
204. Analisis Sidik Ragam uji ketahanan padi trransgenik terhadap
DAFTAR LAMPIRAN
Hataman
Konstruksi Vektor
...
ANOVA uji ketahanan padi galur transgenik kultivar rojolele untuk parameter malai produktif, jumlah anakan baru, tingkat kerusakan tanaman dan persentase tanaman survive setelah diinokulasi dengan Rhizoctonia solani
...
ANOVA uji ketahanan padi galur transgenik kultivar IRATI12 untuk parameter malai produktif, persentase timaman survive, jumlah anakan baru, tingkat kerusakan tanaman setelah diinokulasi dengan Rlzizoctonia solani
...
ANOVA persentase intensitas penyerangan 3 hsi, 6 hsi, dan 9 hsi Pyriculuria oryzae untuk semua galur yang dicobakan
...
Uji beda Duncan parameter malai produktif galur transgenik C-27-1, B-2-1, B-10-1, D-2-2, F-1-1, B-8-1, B-27-1, B-11-1, E-24-1, E-10-1 dan rojolele nontransgenik setelah diinokulasi
...
dengan Rhizoctonia solani AG-I
Uji beda Duncan parameter tingkat kerusakan tanaman galur transgenik C-27-1, B-2-1, B-10-1, D-2-2, F-1-1, B-8-1, B-27-1, B-1 1-1, E-24-1, E-10-1 dan rojolele nontransgenik
...
setelah diinokulasi dengan Rhizoctonia solani AG- 1
Uji beda Duncan parameter jumlah anakan baru, galur transgenik C-27-1, B-2-1, B-10-1, D-2-2, F-1-1, B-8-1, B-27-1, B-11-1, E-24-1, E-10-1 dan rojolele nontransgenik setelah
...
diinokulasi dengan Rlzizoctonia solani AG-1
Uji beda Dullcan parameter persentase tananlan survive, galur transgenik C-27-1, B-2-1, B-10-1, D-2-2, F-1-1, B-8-1, B-27-1, B-11-1, E-241, E-10-1 dan Rojolele nontransgenik
...
setelah diinokulasi dengan Rhizoctonia solani AG-1
Uji beda Duncan parameter jumlah malai produktif, galur transgenik G1, G3, G5, G6
dan
IRAT112 nontransgenik...
setelah diinokulasi dengan Rhizoctonia solani AG-1
Halaman
11. Uji beda Duncan parameter jurnlah anakan baru, galur transgenik G1, G3, G5, G6 dan IRAT112 nontransgenik
...
setelah diinokulasi dengan Nzisoctonia solani AG- 1 45
12. Uji beda Duncan parameter tingkat kerusakan, galur transgenik GI, G3, G5, G6 dan IRAT112 nontransgenik
setelah diinokulasi dengan Rhizoctonia solani AG-I
...
45 13. Uji beda Duncan parameter intensitas penyeranganpyriadaria oryi-ae terhadap galur padi transgenik dan
nontransgenik, 3 hsi (hari setelah inokulasi)
...
4614. Uji beda Duncan parameter intensitas penyerangan
pyriczrlaria oryzae terhadap galur padi transgenik clan
nontransgenik, 6 hsi (hari setelah inokulasi)
...
4715. Uji beda Duncan parameter intensitas penyerangan
pyricularia orpae terhadap galur padi transgenik antifungal
Latar Belakang
Padi adalah tanaman pangan utama di Indonesia disamping jagung, sagu dan urnbi-umbian. Ketersediaan beras untuk di konsumsi diperkirakan hanya meningkat sekitar 1 persen per 4 tahun dari 30,3 juta ton tahun 2001, menjadi 31,2 juta ton tahun 2004 (Tabel 1). Sementara tidak sebanding dengan jumlah pertambahan penduduk Indonesia per tahun yang meningkat rata-rata 2.61 persen per tahun (PPKP 2004).
Tabel 1. Proyeksi produksi dan ketersediaan beras untuk konsumsi, 2001 - 2004
Ketersediaan untuk Produksi
K$zzan
Kehilangan konsumsi Tahun(Ton)
(Ton) (Ton) Padi (Ton) Setara Beras (Ton)
2004 51.614.460 1.290.361 2.322.651 48.001.448 31.200.941 Sumber : PPKP (2004)
Ketersediaan
akan
lahan yang produktif untuk pertanian setiap tahun menurun. Pemanfaatan lahan marginal m e ~ p a k a n alternatif untuk meningkatkan produksi padi di masa mendatang. Di Indonesia tersedia 60 persen lahan pertanian merupakan lahan kering. Kendala utama pada pertanian lahan kering selain cekaman kekeringan adalah penyakit bias (Pyricukuria oryzae)Selain cekaman abiotik seperti kekeringan, banjir dan bencana dam, cekaman biotik seperti hama dan penyakit tanaman masih merupakan ancaman utama bagi petani (Baharsjah et a1 1998). Upaya untuk memacu peningkatan produktivitas usaha pangan mencakup : (i) penciptaan varietas unggul bary dan teknologi berproduksi yang lebih efisien; (ii) teknologi pasca panen untuk menekan kehilangan hasil; dan (iii) teknologi yang menunjang peningkatan intensitas tanam PPKP (2004).
yaitu merakit tanaman yang tahan terhadap serangan penyakit dengan memiliki stabilitas produksi yang optimal.
Ada beberapa penyakit utama pada tanaman padi diantaranya, penyakit hawar pelepah daun yang disebabkan oleh cendawan Rhizoctonia solani Kuhn dan blas yang disebabkan oleh cendawan Pyricularia olyzae Cav. Kedua penyakit ini telah lama dilaporkan sebagai penyakit penting baik pada padi gogo maupun padi sawah diseluruh dunia. Berdasarkan data Biro Pusat Statistik (1997), intensitas kerusakan tertinggi akibat blas di pulau jawa dan luar jawa adalah 12,60 persen (Jawa Barat) dan 34,7 persen (Riau). Sedangkan untuk penyakit hawar pelepah daun masing-masing 15,77 persen (Jawa Barat) dan 50 persen (Sulawesi Utara). Kerugian akibat penyakit blas cukup besar dibandingkan dengan penyakit lainnya (Ou 1972). Sedangkan akibat penyakit hawar pelepah daun produksi padi dapat menurun hingga 20 persen bila penyakit berkembang sampai ke dam bendera (Ou 1985) dan 1-35 persen (Kardin et a1 1997). Jika intensitas kedua penyakit ini meningkat, stabilitas produksi yang tinggi akan terancam, dan dapat mengganggu ketahanan pangan.
Selama ini pengendalian terhadap R solani dan P. o w e dilakukan dengan fungisida. Cara ini kurang efektif jika strain suatu patogen cukup banyak, seperti pada penyakit blas. Selain itu penggunaan fungisida secara terns-menerus dapat menyebabkan cendawan patogen menjadi kebal sehingga perlu dilakukan cara lain untuk pengendalian. Salah satu cara tersebut ialah dengan meralut tanaman agar memiliki ketahanan terhadap cendawan.
Persilangan tanaman secara konvensional untuk mendapatkan tanaman tahan terhadap cendawan sulit dilakukan karena membutuhkan waktu yang cukup lama dan perubahan suatu ras patogen terlalu cepat dalam waktu singkat seperti blas (P. o r p e ) . Prioritas utama dalam pengendaliannya adalah menggunakan varietas tahan. Perakitan varietas tahan penyakit menjadi bagian dari upaya pengendalian penyakit tertentu yang menjadi latar belakang heiptakannya padi transgenik yang tahan terhadap R solani dan P. oryzae.
serangan patogen cendawan diantamnya adalah gen-gen yang bertanggung jawab
dalam menghasilkan asam salisilat (AS). Adanya respons yang hipersensitif
setelah tanaman diserang patogen-patogen, tanaman menunjukkan peningkatan
akumulasi AS, menyebabkan terekspresi gen-gen ketahanan tanaman, dan
ketahanan yang diperoleh secara systemik (Systemic Acquired Resistance, SAR).
AS di dalam tanaman berperan dalam pusat pertahanan melawan serangan
patogen (Verberne et al 2000).
Biosintesis AS pada bakteri melalui dua tahapan proses yaitu gen entC
yang diisolasi dari Eschersiclzia coli, menyandikan isochorismate synthase
(ICS) lnenghasilkan isochorismate dan gen pmsB yang diisolasi dari
P.seudomona.s flu~re~scens, menyandikan isochorismat pyruvat lyase (IPL) yang
bertanggunjawab menghasilkan AS. Sebelum ditransformasikan ke dalam genom
A.
tumefaciens, kedua gen tersebut terlebih dahulu disisipkan ke dalam suatuvektor/plasmid rekombinan (Lampiran I.), kemudian di kokultivasi ke dalam
jaringan tanaman pa&. Teknik transformasi ini telah berhasil dikembangkan pada
tanaman padi oleh Slamet-Loedin (1996).
Penelitian ini akan diuji ketahanan padi transgenik terhadap cendawan
P. oryzae dan R. Solani dan analisis molekuler terhadap turunan 16 galur padi
generasi kedua (TI). Analisis molekuler yang digunakan adalah Polymerase Chain
Reaction (PCR).
Hipotesis
1. Transgen merupakan gen dominan yang terinteyasi pada satu lokus
2. Ekspresi gen entC da~z prnsB &lam menghasilkan asam salisilat berpengaruh dalam mekanisme ketahanan terhadap cendawan R. solani dan
P.
oryzae dibandingkan tanaman kontrol.3. Integrasi gen entC dan pmsB yang telah diintroduksi pada tanaman padl
Tujuan Penelitian
1. Menguji ketahanan tanaman transgenik yang mengandung gen entC dan
prnsB terhadap penyakit hawar pelepah (R. solani) dan blas (P. oryzae).
2. Menguji stabilitas dan pewarisan gen entC dan pmsB pada turunan kedua (TI)
Manfaat Hasil Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai
efekivitas ekspresi gen enrC danpmsB yang telah diintroduksi pada tanaman padi
TINJAUAN PUSTAKA
Tanaman Transgenik
Istilah tanaman transgenik dalam pengertian luas dipakai untuk tanaman
yang memiliki gen asing yang terintegrasi ke dalam genom tanaman dan gen
tersebut berfungsi (Uchimiya et a1 1989). Berbagai metode saat ini telah
dikembangkan
dan
digunakan untuk menghasilkan tanaman transgenik baikmelalui transformasi langsung maupun tidak langsung (Herman 1996).
Transformasi secara langsung antara lain dengan elektroporasi, fusi dengan PEG
('liethylene glycol), mikro injeksi dan penembakan DNA. Transformasi gen secan tidak langsung ialah melalui vektor Agrobacterium tumefaciens.
Transfonnasi melalui A. turrzefacier~s paling sering digurlakan dibandingkan teknik transformasi gel1 yang dikembangkan saat ini. Mulanya
transformasi ini dilakukan pada tanaman dikotil melalui eksplan yang berupa
potongan daun atau bagian lain dari jaringan tanaman yang mempunyai potensi
beregenerasi tinggi (Hinchee et a1 1988; Mullins et a l 1990). Perkembangannya
kemudian teknik ini digunakan pula untuk tanainan monokotil dengan
menggunakan modifikasi berupa penambahan senyawa asetosiringone pada media
kokultivasi. Keberhasilan yang pernah dilakukan dengan teknik ini antara lain
pada tanaman padi dan jagung (Herman 1996; Nasir 2002).
Bakteri A. tzmzefaciem merupakan patogen tanaman. Secara alami
mekanisrne yang kompleks dari Agrobacteriurn marnpu memindalkan suatu
sekuen gen ke dalam genom bnaman melalui suatu vektor plasmid yaitu Ti
(turnor inducing). Saat ini plasmid Ti yang digunakan merupakan hasil modifikasi
dengan sifat virulensi yang telah dilucuti. Pada plasmid Ti terdapat bagian-bagian
penting yang terkait dalam mekanisme transformasi gen. Bagian-bagian tersebut
adalah daerah T-DNA dan daerah virulence (vir) pada T-DNA. Gen target yang
akan ditransformasi disisipkan pada bagian T-DNA untuk selanjutnya
dipindahkan ke dalam genom tanaman. Gen vir berperan penting dalam
mekanisme pemindahan daerah T-DNA ke dalam genom tanaman. Selain plasmid
virulence
(chv).
Gen-gen ini berperan dalam pelekatan bakteri ke dalam seltanaman (Sheng and Citovsky 199G).
Asam Salisilat
Selama berabad-abad diketahui bahwa mengunyah kulit kayu dari pohon
willow (salix) dapat menyembuhkan sakit kepala dan demam, dan di abad 19
Asam Salisilat (AS) sudah teridentifikasi komponen aktif dari ekstrak kulit kayu
pohon willow. AS di dalam tanaman terlibat dalam berbagai proses fisiologis
seperti penutupan stomata, induksi pembungaan, heat produksi, dan berperan
dalam pusat pertahanan melawan serangan patogen.
Tanaman yang mengalami luka nekrotik, dengan penyebab serangan
patogen, akan mengaktiikan suatu jalur yang mendorong ke arah ketahanan yang
diperoleh secara systemic (Systemic Aqczrire Resistance, SAR). Karakteristik SAR
adalah memperpanjang ketahanan jaringan tanaman yang jauh dari lokasi awal
infeksi, keberadaannya bertahan berminggu-minggu sampai berbulan-bulan, dan
~nemproteksi tanaman melawan infeksi sekunder yang disebabkan oleh patogen-
patogen yang memiliki spektrum yang luas. AS eksogenous dapat menginduksi
SAR. AS tampaknya menjadi signal endogen yang memicu adanya SAR
(Verbene et ul2000).
Mekanisme pertahanan tanaman terhadap serangan patogen ditunjukkan
oleh adanya perubahan sifat fisik dan biokimia tanaman. Perubahan secara fisik
antara lain dinding sel tanaman menjadi lebih kuat oleh akumulasi hidrosiprolin,
glikoprotein, lignin, kalosa dan fenol. Secara biokimia ditandai oleh akumulasi
fitoaleksin dan inhibitor protease (Broglie et a1 1993) dan produksi protein
spesifik yang berhubungan dengan jenis patogen yang menginfeksi. Protein
spesifik tersebut antara lain pathogerresis related protein (PR-Protein) yang
berfungsi untuk menghambat proses infeksi patogen (Van Loon 1985).
Ditambahkan pula bahwa AS berperan di dalam pertahanan tanaman pada
tanaman tembakau yang ditransformasi dengan gen nahG dari Psettdornonus
putida. Produk gen nahG penyandi salicylate hydroxylase menyebabkan AS
dikonversi secara biologi menjadi catechol non-aktif. Sehingga AS tidak bisa lagi
menginduksi SAR. Secara genetis dan data biokimia yang diperoleh, bahwa kolnponen yang berada pada jalur signal AS bekerja secara upstream atau
downstream.
Biosintesis AS dalam tanaman adalah lewat jalur phenylpropanoid.
Setelah Biosintesis, sebagian besar AS terkonyugasi sebagai AS 2-6-f3-D- glucosida (ASG). Ditambahkan pula bahwa ASG berperan dalam mengaktifkan
SAR yang mungkin bertindak sebagai penyimpan non-aktif yang secara cepat
membelah untuk melepaskan AS aktif di lokasi infeksi (Verbeme et a1 2000).
Mikroorganisme, diantaranya Pseudomonas jluorescens dan Escherichia coli, yang memproduksi AS dan senyawa-senyawa terkait bekeja membangun
blok untuk iron-chelating siderophores. Sebagai contoh, Pseudomonasfluorescens
tertentu menghasilkan AS atas pertolongan
dari
jalur biosintesis yang singkat darichorismat, yang didahului oleh precursor dari senyawa aromatik. Substrat ini
dikonversi oleh isochorismat synthase (ICS), menjadi isochorismat kemudian
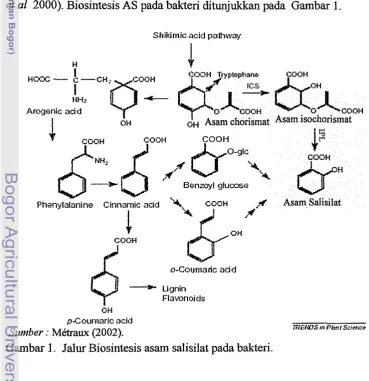
dibelah oleh isochorismat pyruvat lyase (IPL) untuk menghasilkan AS (Verbeme et a1 2000). Biosintesis AS pada bakteri ditunjukkan pada Gambar 1.
Shiliimic acid pahiway
Arognnic a a d
o-Gwmaric acid
Flawnnicls
OH
pCouinaric acid
[image:20.544.76.446.366.748.2]Surnber : M b u x (2002).
Penyakit Hawar Pelepah Daun
Penyakit hawar pelepah daun yang disebabkan oleh R solani mempakan salah satu penyakit utama padi. Cendawan ini biasanya menyerang pada saat padi
memasuki fase akan bunting brimordia). Sehingga menghambat proses
pembentukan bulir padi.
Cendawan ini menyerang dan membentuk bercak pada pelepah daun dan
batang. Bercak berukuran besar, bertepi tidak teratur, berbentuk jorong dengan
tepi coklat kemerahan, sedangkan pusatnya benvama seperti jerami (kuning
kehijauan). Bercak ini seringkali terdapat dekat dengan lidah daun. Ukuran bercak
pada batang lebih kecil dibandingkan pada pelepah daun. Jika lingkungan lembab
pada bercak akan tumbuh benang-benang miselium cendawan putih atau coklat
muda (Semangun 1990).
Benang-benang miselium cendawan Rhizoctonia mempunyai lebar
berkisar 6-10pm, dengan percabangan membentuk sudut mncing. Pada titik
percabangan terdapat lekukan dan didekatnya terdapat sekat. Jamur kemudian
membentuk hifa bersel pendek-pendek, mempunyai banyak percabangan yang
lnembentuk sudut siku. Sebagian dari benang-benang ini membentuk benang yang
tebal dan pendek. Badan jamur membentuk sklerotium dengan bentuk tidak
teratur, benvama coklat atau coklat kehitaman.
Beberapa falctor yang berpengaruh terhadap perkembangan penyakit ini
ialah jar& tanam yang rapat, penggunaan varietas (galur) unggul yang pendek dan mempunyai anakan banyak (:Amir dan Kardin 1991).
Cendawan R. .~oluni mempunyai sebaran inang luas selain pada padi dapat
pula bertahan pada gulma, sehingga sulit dikendalikan (Overseas Technical
Cooperation Agency 1973; Atkins et aE 1974; Kardin et a1 1997). Sumber
inokulum patogen ini adalah miselia dan sklerotia yang dapat bertahan pada
jerami dan rumput-rumputan. Banyak gulma yang dapat menjadi tumbuhan inang
Penyakit Blas
Penyakit blas yang disebabkan untuk cendawan P. oryzae merupakan salah satu penyakit tanaman padi yang sangat merugikan. Cendawan ini menyerang dan membentuk bercak pada daub batang, malai, bunga dan biji.
Bercak pada pelepah daun jarang ditemukan. Bentuk khas bercak blas adalah elips
yang kedua ujungnya kurang lebih runcing. Bercak yang telah berkembang pada
bagian tepi berwama coklat dan bagian tengah benvama putih keabu-abuan.
Dalam keadaan lembab bercak akan t e r n membesar terutama pada varietas peka.
(Amir clan Kardin 1991). Pada varietas padi peka, bercak tersebut dapat meluas
dan bersatu sehingga akhimya helai daun mengering dan mati. Pada padi yang
tahan, gejala serangan hanya berupa bintik kecil benvama coklat (Ou 1972).
Cendawan P. oryzue merupakan tipe patogen yang membunuh sel inang dengan cara menghasilkan toksin piricularin, a-picolinic acid, pyriculol dan tenuazonic
acid. Toksin yang dihasilkan mampu merusakdinding seltanaman sehingga
me~npermudah tejadinya penetrasi (Umelsu el a1 1972; Narayana
dan
Suryanarayana 1974).
Spora cendawan secara alami menyebar mulai tengah malam karena
adanya embun atau hujan (Hashioka 1963). Penyebaran spora akan bertambah
banyak sampai menjelang pagi hari dan berakhir pada saat terbit matahari.
Pelepasan spora di daerah tropis dapat terjadi pula pada siang hari setelah turun
huian. Pada periode embun ini sangat berpengaruh terhadap pelepasan spora dan
infeksi. Jika periode embun lebih lama, spora yang dilepaskan lebih banyak
sehingga infeksi yang tejadi semakin parah (IRRI 1975). Penyebaran spora dapat tejadi selain oleh embun atau hujan juga oleh angin, biji dan jerami sakit. Cendawan P. oryzue dapat bertahan dalam sisa jerami sakit dan gabah sakit selama lebih dari satu tahun pada suhu kamar. Sedangkan dalam bentuk miselia
mampu bertahan sampai lebih dari tiga tahun (Amir dan Kardin 1991).
Uji Ketahanan
Untuk menguji ketahanan tanaman terhadap suatu penyakit yang
Fase tanaman yang diinokulasi juga berbeda. Inokulasi R solani dilakukan pada
fase vegetatif (&I20 lwi) untuk cv. Rojolele (tanainan uinur dalam). Inokulasi
dilakukan dengan menyelipkan inokulum di antara anakan tanaman yang diikat
dengan karet gelang. Metode pengamatan berdasarkan tingkat kerusakan tanaman
(Anonim 1986). Sedangkan untuk P. oryzae inokulasi dilakukan pada fase
perkecambahan, keluar malai dan setelah berbunga penuh. Teknik inokulasi pada
fase kecambah dan keluar malai dilakukan dengan cara menyemprotkan suspensi
konidia dengan konsentrasi 2
x
lo5 konidiumlml. Uji ketahanan pada faseberbunga dilakukan dengan metode tempel, yaitu menempelkan potongan medium
OMA yang berukuran 1 cm x 1
cm
ke bagian pangkal daun bendera dengan kertas aluminium. Pengamatan dilahukan terhadap jumlah bercak yang terjadi pada tiapdaun tanrunan dan meneritukan skala kerusakan.
Pengujian tanaman kandidat transgenik dilakukan dengan menguji
keberadaan gen seleksi. Nasir (2002) mengemukakan bahwa T-DNA yang
terintegrasi dapat diwariskan ke generasi berikut menurut pola Mendel . Biasanya
pada gen-gen penanda seleksi resisten antibiotik yang berada dalam transgen pada
tanaman kandidat transgenik. Pada tanaman padi transgenik digunakan metode
Speulman el a2 (1999), yaitu dengan menggunakan pembercakkan 25 mglml
Higromisin yang dicampur dengan 0.001 persen triton-X-100 dan gelatin serta
tween 20 pada daun padi. Pengamatan yang dilakukan adalah jika terjadi halo
nekrotik maka dikatakan sensitif higromisin bukan kandiddat transgenik jika
resisten higromisin tidak terjadi lulo nekrotik.
Analisis Molekuler
Polymerase Chain Reaction (PCR)
Poly?zeruse Chain Rcacfion (PCR) merupakan suatu reaksi In vitro untuk
menggandakan jumlah molekul DNA target, dengan cara mensintesis molekul
DNA baru yang berkomplemen dengan molekul DNA target dengan bantuan
enzim polymerase dan primer (Muladno 2002). Panjang target DNA berkisar
antara puluhan sampai ribuan nukleotida yang posisinya diapit sepasang primer.
Primer diawal daerah target disebut primer forward dan diakhir daerah target
Sejak ditemukannya teknik ini pada tahun 1980-an, PCR banyak digunakan
untuk berbagai keperluan. Keuntungan analisis dengan PCR antara lain cepat,
DNA yang diperlukan sedikit, dapat dilakukan pada tahap dini dan teknik isolasi
DNA sederhana (Listanto et ~11996).
Reaksi PCR dilakukan untuk seri denaturasi-penempelan primer-sintesis
(n siklus) yang berlangsung secara otomatis. Tahap pertama DNA didenaturasi,
umumnya pada suhu 9 5 ' ~ . Pada saat denaturasi, DNA yang semula utas ganda
tenuai menjadi utas tunggal. Tahap ke dua suhu diturunkan sampai 50°C sehingga
primer menempel (annealing) pada DNA cetakan (target). Tahap terakhir suhu
dinaikkan lagi sampai 7 2 ' ~ untuk mengaktifkan enzim Tug Polynerase dan
mensintesis utas DNA (Muladno 2002).
Elektroforesis Gel Agarose sebagai Analisis Fragmen
Molekul DNA termasuk senyawa bermuatan negatif. Dengan sifat ini, jika
molekul DNA ditempatkan pada medan listrik maka molekul tersebut akan
bermigrasi menuju kutub positif. Kecepatan migrasi molekul DNA tergantung
pada dua faktor yaitu bentuk clan muatan listrik. Ukuran molekul DNA merupakan suatu faktor yang digunakan dalam pemisahan dengan teknik elektroforesis pada
suatu gel. Salah satu gel yang &pat digunakan adalah gel agarose. Dalam teknik
ini, agarose digunakan untuk menlisahkan, n~engidentifikasi, dan memurnikan
fragmen-fragmen DNA. Kisaran ukuran fragmen DNA yang dapat dipisahkan
dengan berbagai konsentrasi gel agarose dapat dilihat pada Tabel 2. Ukuran dan
konsentrasi fiagmen DNA yang diisolasi dapat ditentukan secara langsung setelah
gel di staining dan destuining dengan etidium bromida (EtBr) dan diamati dengan
sinar ultraviolet (W). Konsentrasi DNA yang dapat diamati antara 1-10 ng.
Tabel 2. Kisaran ukuran fragmen DNA dengan berbagai konsentrasi gel agarose
Agaroseh) -- Kisaran ukuran DNA Kilo basa
0.3 5-60
2.0 0.1-2
Mobilitas fragmen DNA pada gel elektroforesis sangat dipengaruhi oleh
komposisi dan kelarutan ion buffer elektroforesis. Jika konsentnsi ion-ion sangat
sedikit maka konduktivitas listrik sangat kecil dan migrasi ion DNA menjadi
larnban. Tetapi jika konsentrasi ion berlebihan maka dapat mengakibatkan gel
mencair dan DNA terdenaturasi. Selain buffer, teknik elektroforesis agarose juga
memerlukan loading btger. Loading buffer berguna untuk meningkatkan densitas
sampel (fragmen DNA) sehingga fragmen tersebut berada pada dasar sumur (well)
dan tidak menyebar. Fungsi lainnya adalah memberi warna pada fragmen DNA
sehingga mempermudah pengamatan proses elektroforesis. Buffer ini dapat juga
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilalakukan pada Laboratorium Biologi molekuler Tanaman
Bidang Biologi Molekuler dan Fasilitas Uji Terbatas (FUT) rumah kaca padi transgenik, Pusat Penelitian Bioteknologi, LIP1 Cibinong untuk analisis
molekuler. Sedangkan pengujian inokulasi tanaman dilakukan di rumah kaca
Kelti rekayasa dan Imunologi Balai Penelitian Bioteknologi dan Sumber daya
Genetika Bogor. Penelitian berlangsung bulan Maret 2004 sampai Agustus
2005.
Bahan Penelitian
Bahan-bahan untuk isolasi DNA meliputi: dam tanaman padi, isolation
buffer meliputi: lysis buffer (Tris-HC1 pH 7.5 0.2 M, EDTA 0.05 M, NaCl 2 M, dan CTAB 2 persen); extraction buffer (sorbitol 0.35 M, Tris-HC1 pH 7.5 0.1 M,
dan EDTA 5 mM), dan sarkosyl 5 persen, N2 cair, chlorofo~m:isoamylalkohol (24:1), isopropanol, etanol 70 persen, buffer TE (Tris-HCL pH 8.0 10 mM dan
EDTA pH 8.0 1 mM).
Bahan-bahan yang digunakan untuk analisis PCR ialah : DNA tanaman,
buffer PCR, dNTPs, Taq polymerase, primer entC Voward :
5'-AGTCGTGTTGTCACGGTTGA-3'dan reverse: 3'-ATcGCTGTGGAGAAGAAGCG~')
dan pmsB (forward : 5'-ATGCTGCCWTAAAACCWCACAA-3' dan reverse 3'-
TGACTTGGCCTGCGCCGAGTACGT-5')
m20,
a g m s e gel dan buffer Tris BoricAcid EDTA (TBE). Bahan untuk elektroforesis meliputi, gel agarose 1,2 persen,
buffer TBE 0,5 x (5 X TBE: Tris Base 54 g, Asam borat 27,5 g dan EDTA pH 8.0 0,5 M).
Bahan tanaman yang digunakan adalah tanaman padi transgenik generasi
kedua (TI) sebanyak 10 galur padi transgenik cv. Rojolele dan 4 Galur IRAT
Metode Kerja
Uji Higromisin
Pengujian kandidat transgenik untuk diseleksi yaitu dengan cara
pemberian tanda bulatan dengan spidol marker F pada daun terakhir. Selanjutnya
dilakukan pembercakan yang mengandung higromisin 0.2 mglml ditambah triton
x-100 0.001 persen dan gelatin 0.5 persen dengan volume 4 ~ 1 . Jika terjadi
nekrotik maka diduga bukan calon kandidat transgenik. Jika tidak tejadi nekrotik
pada daun kemm&nan sebagai kandidat transgenik. Pengamatan dilakukan 4 - 6
hari Kemudian diuji pola segregasi Mendel 3 : 1 berdasarkan ekspresi gen
higromisindengan menggunakan analisis statistik non parametrik khi-kuadrat.
Minimal 11 tanaman menurut Hartana (1992).
Tanaman yang menjadi kandidat transgenik selanjutnya dianalisis secara
molekular dengan menggunakan teknik PCR untuk mengetahui pewarisan gen
entC danpmsB di dalam genom tanaman.
Uji Ketahanan Padi Transgenik Terhadap Rliizoctonia. solani
Uji ketahanan pada padi kandidat transgenik generasi kedua (TI) 10 galur
padi kultivar rojolele dan 4 galur padi kultivar IRAT112 Serta Rojolele dan
RAT112 nontransgenik sebagai kontrol. Rancangan yang digunakan adalah
rancangan acak lengkap (RAL) dengan 5 kali ulangan. Data kemudian dianalisis
menggunakan Analisis Ragam dengan taraf kepercayaan 95 persen. Selanjutnya
dilakukan uji beda Duncan setelah lnengetahui signifikansi dari Analisis Ragam.
Pemhuatan inokulum
Isolat diambil dari koleksi laboratorium mikologi Balai Penelitian
Bioteknologi dan Sumber daya Genetika Bogor dan diperbanyak melalui 2 tahap
yaitu tahappertama Inokulum dibiakkan pada media Potato Dextrose Agar
(PDA) selama 4 sampai 5 hari, pada suhu 25 - 28 OC. Tahap kedua inokulum asal
dari PDA diperbanyak lagi pada media campuran Wheatbran dan sekam padi
dengan perbandingan
1
: 2, dengan cara, Media campuran wheatbran dan sekamdengan penutup di buat lubang 7 cm setelah itu botol ditutup dengan kapas. Media
dalam botol disterilkan dengan autoklave selama 40 menit pada suhu 125°C.
Biakan murni dipindahkan ke dalam media campuran wheatbran dan
sekam padi dalam ruang steril (clean bench) diinkubasi pada suhu 25-2S°C
selama 1 minggu, kemudian media dikeluarkan dari botol dan dikeringkan pada
suhu kamar sehari sebelum di inokulasi pada tanaman.
Inokulasi
Tanaman yang akan diinokulasi diikat dengan karet gelang, 2 hari sebelum
inokulasi. Inokulum yang telah disiapkan diselipkan sebanyak 5 gram diantara
anakan-anakan yang terikat. Letak inokulum sedekat mungkin dengan pangkal
batang. Uji ketahanan terhadap R soluni dilakukan pada saaat tanaman memasuki
fase vegetatif terakhir atau memasuki masa bunting ( t120 hari).
Pengamatan dilakukan pada 5, 10, dan 15 hari setelah inokulasi (hsi). Parameter yang dianlati adalah, jumlah malai produktif, jumlah anakan baru,
persentasi tanaman survive yang dihitung dengan m u s :
x
malai pengliasil benilrPersentuse Tanaman Survive =
x
x 100%aizakait
dan tingkat kerusakan tanaman yang ditentukan dengan m u s :
Tingkaf Kerusakan Tunurnan = 4N4
+
3 N ,+
2 N ,+
IN,+
ON, x 100%4N
Keterangan:
N4 = Jumlah anakan dengan skor 7
N3 = Jumlah anakan dengan skor 5
N2 = Jumlah anakan dengan skor 3
NI = Jumlah anakan dengan skor 1
No = Jumlah anakan dengan skor 0
N = Jumlah total (Nq + N3 + N2 + N1+
NO)
Skala kerusakan :0 = tidakada infeksi
5
= kerusakan pada pelepah ke I+
11+
1117 = semuapelepah rusak
Uji Ketahanan Padi Transgenik terhadap
Pyricularia
oryzaePengujian dilakukan terhadap 16 galur tanaman transgenik seperti yang
dilakukan pada uji ketahanan dengan R Solani ditambah 2 kultivar lokal sebagai
kontrol tahan dan rentan yaitu kultivar kencana bali (rentan) dan kultivar asahan
(tahan). Rancangan yang digunakan adalah rancangan acak lengkap (RAL)
dengan 3 kali ulangan yang terdiri dari 30 benih per ulangan. Data kemudian
dianalisis menggunakan Analisis Ragam dengan taraf kepercayaan 99 persen.
Selanjutnya dilakukan uji beda Duncan jika ada signifikansi
dari
Analisis Ragam.Pembuatan Inokulum
Isolat P. oyzae ras 173 adalah ras supervirulen yang diperoleh dari
koleksi laboratorium mikologi Balai Penelitian Bioteknologi dan Sumberdaya
Genetika Bogor diperbanyak biakan murni pada media PDA dalam cawan petri
selama 5 hari. Selanjutnya dilakukan pemindahan kembali dari medium PDA ke
medium OMA dan diinkubasi selama 10 hari pada suhu kamar di dalam inkubator bercahaya.
Untuk mendapatkan suspensi konidia terlebih dahulu dilakukan
penggosokan miselia yang tumbuh pada permukaan medium OMA. Penggosokan miselia dengan menggunakan h a s bulu gambar No. 10 dan air steril yang telah
dibubuhi streptomicin 0.01 grfliter air. Setelah miselia udara bersih terbuang
selanjutnya biakan tersebut diletakan dalam inkubator selama 2 hari pada suhu
kamar dan disinari lampu
TL.
10 W. Kemudian dilakukan penggosokan koloni untuk mendapatkan suspensi konidia. Penggosokan menggunakan kuas gambar No. 10 dan air steril yang dicampur dengan tween 20 dengan konsentrasi 0.02persen. Suspensi yang didapat disaring dengan kain kasa dan ditampung dalam
gelas erlenmeyer.
Inokulasi
Inokulasi dilakukan setelah tanaman padi berumur 18 hari dengan cara
volume semprot 200 ml per ulangan. Penyemprotan dilaksanakan diatas meja
putar dengan menggunakan gelas automizer yang dihubungkan dengan
kompresor. Tanaman yang telah diinokulasi dimasukkan dalam kamar lembab
selama 24 jam dan selanjutnya tanaman dipindahkan dalam kamar kaca. Dalam kamar kaca tersebut, pot-pot persemaian yang telah diinokulasi dengan isolat
P. o?yzae ditempatkan di atas meja kayu dan sekeliling dinding karnar kaca ditutup dengan kain blacu. Lantai diusahakan tetap lembab dengan membiarkan
air tergenang dan pada bagian atas pot digantungkan alat penyemprot air
(Sprinkle irrigation) yang menyemburkan air dalam bentuk kabut (smoke).
Penyemburan air berlangsung selama 24 jam setiap hari. Uji ketahanan dilakukan
pada fase bibit (18 'hari). Parameter yang diamati adalah menghitung jumlah bercak yang tejadi pada tiap daun tanaman serta penentuan skala kerusakan.
Skala kerusakan menggunakan standar evaluasi Internasional Rice Testing
Program
(IRTP
1988) dengan kriteria sebagai berikut:Skoring :
0 = tidakadabercak
1 = bercak sebesar ujung jarum
2 = bercak lebih besar dari ujung jarum
3 = bercak nekrotik abu-abq bentuk bundar, agak lonjong, panjang 1-2 mm dan tepi coklat
4 =
bercak
khas blas, panjang 1-2 cm, luas daun terserang kurang dari 2 persen 5 = bercak khas blas, luas daun terserang kurang dari 10 persen6 = bercak khas blas, luas daun terserang antara 11 - 25 persen 7 = bercak khas blas, luas daun terserang 26 - 50 persen
8 = bercak khas blas, luas daun terserang antara 5 1
-
75 persen 9 = semuadaun matiDari skoring selanjutnya dilakukan penentuan nilai intensitas serangan dengan
Keterangan :
I = Intensitas serangan
v = Nilai skala yang bersangkutan
N = Jumlah tanaman yang diamati
V = Nilai skoring pada skala tertinggi (Anonim, 1985)
Nilai skala :
0%
-
25% = Tanaman tahan (T) terhadap serangan26%
-
100% = Tanaman rentan (R) terhadap seranganAnalisis Molekular
Isolasi DNA
DNA yang akan diampifikasi pada mesin PCR, diisolasi dari daun
menggunakan modifikasi metode CTAB. Daun sepanjang
+
5 cm dimasukan kedalam tube 1.5 ml. Masukan tube berisi dam ke dalam N2 cair kemudian gems
dengan bantuan vortex dan N2 cair. Tambahkan 750 pl isolation buffer S lalu
inkubasi pada suhu 65°C selama 1 jam sambil di invert. Tambahkan 750 p1
chloroform:isoamylalkohol(24:1) dan disentrifuge selama 5 menit pada kecepatan
13.000
rpm
pada suhu 4°C. Lapisan paling atas diambil, ditambah dengan 400 p1isopropanol dingin, dan disentrifuge selama 6 menit pada kecepatan 13.000 rpm
pada suhu 4°C. Buang supernatan, cuci endapan dengan etanol 70 persen
kemudian disentrifuge pada kecepatan 13.000 rpm pada suhu 4°C selama 3 menit.
Selanjutnya supernatan dibuang keinbali lalu disentrifuge lagi pada kecepatan
13.000 rpm pada suhu 4°C selama 2 menit, keringkan pada vakum kemudian
dilarutkan dalam 50 pl buffer TE. Sampel DNA hasil isolasi disimpan pada -20°C.
PCR (Polymerase Chain Reactions)
Teknik PCR dilakukan untuk memperbanyak dan mengkonfimasi
keberadaan gen entC
dan
pnzsB pada generasi kedua (TI). DNA untuk analisisdiisolasi
dari
dam tanaman padi dengan jumlah sampel tanaman untuk masing-masing galur adalah 90 yang diambil secara acak. Volume yang digunakan untuk
Ix reaksi adalah 10 p1 dengan komposisi bahan sebagai berikut: l x buffer PCR
danpmsB reverse dan foiward2.5 nglpl, 1 pL DNA hasil isolasi dan dH20 bebas nuklease ditambah agar volume reaksi mencapai 10 p1. Kontrol negatif menggunakan DNA tanaman kontrol dan air sedangkan kontrol positif menggunakan plasmid yang mengandung enlC dan pmsB dan galur transgenik yang terdeteksi gen entC dan pmsB pada turunan pertama (TO). Kondisi PCR
yang digunakan untuk amplifikasi gen entC danpmsB ialah 40 siklus. Satu siklus terdiri dari denaturasi 95°C selama 1 menit, annealing 51°C selama 1 menit, sintesis 72OC selama 1 menit untuk gen entC, sedangkan untuk gen pmsB suhu
annealing 61°C, penyimpanan (4°C).
Elektroforesis
HASIL DAN PEMBAHASAN
Uji Pewarisan Mendel
Uji Pewarisan Mendel dilakukan berdasarkan ekspresi gen higromisin sehingga dapat mengindikasikan keberadaan transgen pada tanaman sebelumnya.
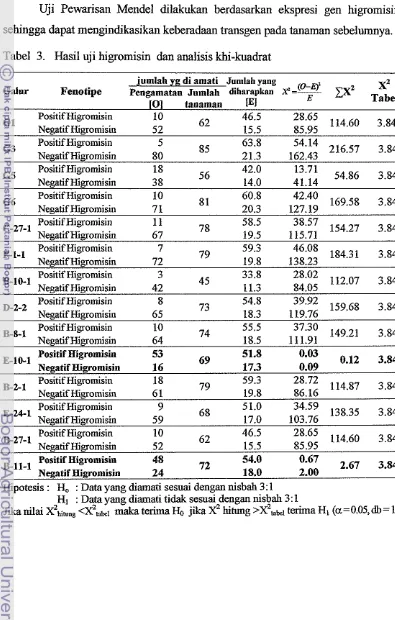
Tabel 3. Hasil uji higromisin dan analisis khi-kuadrat
jumlah yg di amati Jumlah yang
Galur Fenotipe Pengamatan Jumlah diharapkan Y=- P E I ' cxZ
xZ
mnl tanamma [El E Tabel
Positif Higromisin 10
62 46.5
6 1 p,-,.".:&-u:---:":.. C" ,< <
Positif Higromisin 5
85 63.8
G3
Negatif Higromisin 80 +, *
6 5 Positif Higromisin 18 56 42.0
Negatif Higrotnisin 38 14.0 41.14 13'71 54.86 3.84
6 6 Positif Higromisin 10 81 60.8
Negatif Higromisin 71 20.3 127.19 42.40 169.58 3.84 Positif Higromisin
C-27-1 11 78 58.5
Negatif Higromisin 67 19.5 115.71 38.57 154.27 3.84 Positif Higromisin
w-1-1 7 79 59.3
Negatif Higromisin 72 19.8 138.23 46'08 184.31 3.84 Positif Higromisin 3
45 33.8
Negatif Higromisin 42 11.3 28'02 84.05 112.07 3.84
D-2-2 Positif Higromisin 8 73 54.8
Negatif Higromisin 65 18.3 119.76 39.92 159.68 3.84 Positif Higromisin
B-8-1 10 74 55.5
Negatif Higromisin 64 18.5 11 1.91 37'30 149.21 3.84
:romum 10 1 1 3 Omo3 0.09 0.12 3.84
~ ~ g r o m l s m b I 1y.6 28.72 114.87 86.16 3.84
34'59 138.35 3.84 103.76
28.65 114.60 3.84 85.95
24 . -
misin 18.0 2.00 2.67 3.84
bah 3: 1 in nisbah 3:l
~g
>xZhkI
terima Hl (a=0.05,&= 1)Positif Higromisiu 53
69 51.8
E-10-1 atif Hi
.
.
-,.--
Positif Higromisin
.
.
18<.
79 59.3Negatif
.,.
,.Positif Higromisin 9
68 51.0
E24-1 Negatif Higromisin 59 17.0
Positif Higromisin
B-27-1 10 62 46.5
Negatif Higomisin 52 15.5
Positif Higromisin
B-11-1 48 72 54.0
Negatif Higrol
Hipotesis : H, : Data yang diamati sesuai dengan Nsl HI : Data yang diamati tidak sesuai deng:
[image:33.541.80.475.124.744.2]Tabel 3 menunjukkan bahwa secara keseluruhan terdapat individu dari
populasi galur-galur transgenik yang positif tahan terhadap higromisin dengan
nisbah yang berbeda-beda. Nisbah yang diharapkan adalah sesuai dengan pola
segregasi Mendel yaitu 3 : 1. Locus-locus dari suatu pasangan alel akan
bersegregasi satu terhadap laimya ke dalam gamet-gamet, sehingga separuh
gamet membawa salah satu gen dan separuh gamet lainnya dari pasangan alel tersebut. Kondisi ini disebut sebagai peristiwa segregasi (Nasir 2002).
Terdapat 2 galur transgenik yang sesuai dengan hipotesis
&
yaitucenderung mengikuti pola segregasi Mendel 3 : 1. Galur E-10-1 dan B-11-1
memiliki nilai X' hitung lebih kecil dibanding nilai x2tabel. Sedangkan galur transgenik laimya tidak mengikuti pola segregasi yang diharapkan. Diduga bahwa
transgen tidak terintegrasi secara kromosomal tetapi ekstra kromosomal atau lebih
dan satu kopi transgen terintegrasi pada lokus yang sama sehingga bias jumlah
sampel perlu diproses. Pewarisan ekstm kromosomal merupakan pewarisan yang
dikontrol oleh gen yang ada di luar nukleus. Menurut Hartana (1992) beberapa kejadian atau bukti yang dapat dipakai sebagai petunjuk bahwa suatu sifat
diwariskan secara ekstra kromosomal adalah nisbah segregasi tidak mendelian,
suatu sifat ditransmisikan lewat maternal, dan gen-gen tidak bisa dipetakan pada
kromosom/kelompok keterpautan tertentu.
Uji Ketahanan padi Transgenik terhadap Rhizoctonia solani
Berdasarkan pengamatan yang dilakukan pada tanaman transgenik dan
tanaman kontrol non transgenik varietas yang sama, tetapi tingkat serangan sangat
berbeda. Terlihat gejala serangan hawar pelepah daun yang berupa bercak pada
pelepah daun dan batang (Gambar 2). Secara umum gejala serangan ini berupa bercak berukuran besar, berbentuk elips, dengan tepi tidak teratur yang berwarna
coklat kemerahan, sedangkan pusatnya benvarna seperti jerami (kuning
kehijauan) (Semangun 1990). Bercak pertama timbul dari pelepah daun bagian
bawah dan selanjutnya berkembang ke pelepahmelai daun bagian atas, sesuai
dengan pendapat (Ou 1976) penyakit ini dapat menyebar secara vertikal yaitu dari
cendawan menjalar ke bagian atas tanaman dan menulari pelepah atau helaian daun dengan cara bersentuhan satu sama lain (Amir dan Kardin 1991). Pada varietas rentan bercak &pat berkembang sampai dam bendera dan pada serangan yang berat seluruh daun akan menjadi hawar (Amir dan Kardin 1991).
Gambar 2. Bercak hawar dan arah penularannya pada varietas yang rentan.
Dari Seluruh Parameter yang diamati pada pengujian ketahanan tanaman padi transgenik terhadap cendawan Rhizoctonia solani, terbukti bahwa kerusakan pada padi transgenik lebih kecil secara nyata nlelalui Analisis Ragam dengan tingkat signifikansi sangat nyata pada taraf kepercayaan 99 persen (Tabel 4). Sehingga dapat diuji lanjut ke tingkat uji beda Duncan, untuk mengetahui galur padi transgenik yang memiliki ketahanan untuk di seleksi.
Tabel 4. Analisis ragam uji ketahanan padi transgenik terhadap R solani untuk nilai F-hitung keseluruhan parameter yang diukur
Parameter Galur
Tingkat Kerusakan Malai Jumlah Persentase
Tanaman Produktif Anakan Baru Tanaman Survive Galur Transgenik 55.561 " 66.400 * 50.265 64.762 * Kultivar IRATl12
Galur Transgenik 24.580
-
13.876 " 45.241 21.709** Kultivar Rojolele
[image:35.541.45.476.25.714.2]Tingkat Kerusakan Tanaman
Perbedaan tingkat kerusakan tanaman antar galur transgenik dan
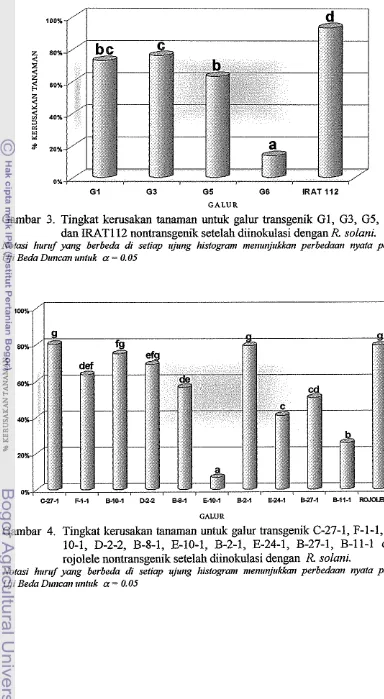
nontransgenik terlihat jelas pada Gambar 3, rata-rata galur tanaman transgenik
memiliki persentase tingkat kerusakan yang lebih kecil dibandingkan dengan
kontrol non transgenik (IRAT112). Tingkat kerusakan yang paling kecil pada
galur trangenik G6.
Galur yang diduga membawa transgen entC dan pmsB diperkirakan
mengakumulasikan asam salisilat. Secara statistik, uji beda Duncan menunjukkan
perbedaaan
untuk
a
= 0.05 yaitu galur transgenik (G6) berbeda nyata dibandingkan galur lainnya.Pada Gambar 4 galur transgenik kultivar rojolele menunjukkan galur
E-10-1 dan B-1 1-1 memiliki persentase tingkat kerusakan dibawah 30 persen dan
berbeda nyata dengan galur yang lainnya pada uji beda Duncan untuk
a
= 0.05.Kedua galur ini juga menunjukkan perbedaan nyata yaitu E-10-1 lebih kecil
persentase tingkat kemsakan dibandingkan dengan galur B-1 1-1.
Adanya respons hipersensitif yang disebabkan oleh serangan patogen
mengakibatkan AS terakumulasi secara berlebihan, sehingga meningkatkan
system pertahanan terhadap serangan beraneka patogen (Verberne et a1 2000).
Pengamatan visual menunjukkan bahwa pembesaran luka hawar pada pelepah
terhambat pada galur transgenik sehingga kerusakan pada pelepah daun padi tidak
menjadi lebih parah. Hal ini menunjukkan bahwa asam salisilat berada disekitar
G l 6 3 G5 GB IRAT 112
GALUR
Gambar 3. Tingkat kerusakan tanaman untuk galur transgenik GI, G3, G5, G6 dan IRATI 12 nontransgenik setelah diinokulasi dengan
R
solani. Nofasi 1111r1rfyintg berbeda di setiap zrju~rg histogram n ~ e n z i i ~ r i k ~ z perbedm1 n p f a padaUji Beda Dtmcmt trnitik a = 0.05
GhLUR
Gambar 4. Tingkat kerusakan tanaman untuk galur transgenik C-27-1, F-1-1, B- 10-1, D-2-2, B-8-1, E-10-1, B-2-1, E-24-1, B-27-1, B-111 dan rojolele nontransgenik setelah diinokulasi dengan
R
solani.Nofasi hrir~rf ymrg berbe& di setiap zrjung histogram merninjukkan perbedam1 ~ y a l a pada
[image:37.541.79.463.49.748.2] [image:37.541.97.450.54.267.2]Jumlah Anakau Baru
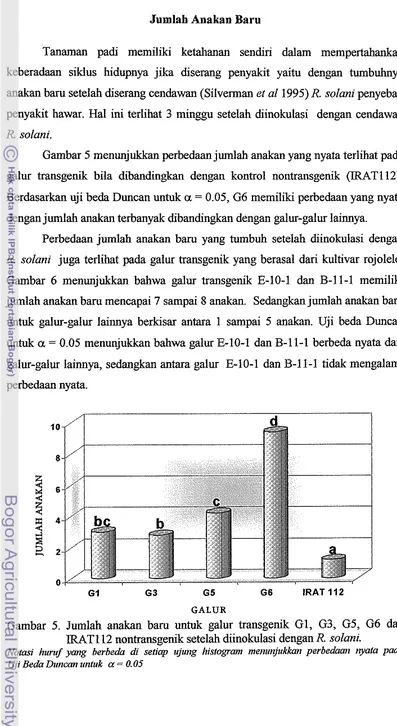
Tanaman padi memiliki ketahanan sendiri dalam mempertahankan
keberadaan siMus hidupnya jika diserang penyakit yaitu dengan turnbuhnya
anakan baru setelah diserang cendawan (Silveman et a1 1995) R. solani penyebab
penyakit hawar. Hal ini terlihat 3 minggu setelah diinokulasi dengan cendawan
[image:38.541.76.473.43.769.2]R solani.
Gambar 5 menunjukkan perbedaan jumlah anakan yang nyata terlihat pada
galur transgenik bila dibandingkan dengan kontrol nontransgenik (IRAT112).
Berdasarkan uji beda Duncan untuk a = 0.05, G6 memiliki perbedaan yang nyata
dengan jumlah anakan terbanyak dibandingkan dengan galur-galur lainnya.
Perbedaan jumlah anakan barn yang tumbuh setelah diinokulasi dengan
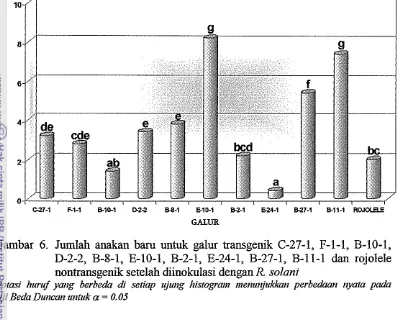
R solani juga terlihat pada galur transgenik yang berasal dari kultivar rojolele. Gambar 6 menunjukkan bahwa galur transgenik E-10-1 dan B-11-1 memiliki jumlah anakan barn mencapai 7 sampai 8 anakan. Sedangkan jumlah anakan barn
untuk galur-galur lainnya berkisar antara 1 sampai 5 anakan. Uji beda Duncan
untuk
a
= 0.05 menunjukkan bahwa galur E-10-1 dan B-11-1 berbeda nyata darigalur-galur lainnya, sedangkan antaa galur E-10-1 dan B-11-1 tidak mengalami
perbedaan nyata.
GALUR
Gambar 5. Jumlah anakan baru untuk galur transgenik GI, G3, G5, G6 dan IRATI 12 nontransgenik setelah diinokulasi dengan R. solani.
Gambar 6. Jumlah anakan barn untuk galur transgenik C-27-1, F-1-1, B-10-1, D-2-2, B-8-1, E-10-1, B-2-1, E-24-1, B-27-1, B-11-1 dan rojolele nontransgenik setelah diinokulasi dengan R solani
Notasi huruf p g krbeda di setiap ujuttg histogram rnerturrjukhm perbcdaati nyata pa&
Uji Beda D~rticarr r~titlrk a = 0.05
Jumlah Malai Produktif
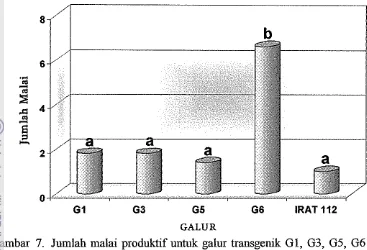
Jumlah malai produktif untuk galur transgenik G6 memiliki jumlah malai
produktif mencapai 6 malai sedangkan galur-galur lainnya berkisar antara 1-2
malai, ditunjukkan pada Gambar 7. Uji beda Duncan untuk
a
= 0.05 menunjukkanbahwa galur G6 berbeda nyata dengan galur lainnya. Sedangkan antar galur GI,
[image:39.541.77.482.55.780.2]G3, G5 dan IRAT112 tidak berbeda.
Gambar 8 menunjukkan bahwa galur transgenik yang berasal dari kultivar
rojolele E-10-1 mencapai jumlah malai produktif 9 malai sedangkan galur-galur lainnya berkisar 2 s m p a i 6 malai. Uji beda Duncan untuk a = 0.05 menunjukkan
bahwa galur transgenik E-10-1 berbeda nyata dibandingkan dengan galur-galur lainnya.
Kondisi ini menunjukkan bahwa galur transgenik mampu menekan luka
hawar pada pelepah sehingga dapat menyuplai energi yang banyak untuk
[image:39.541.87.485.65.385.2]*a
-
2
$
3
kG I G3 G5 G6 IRAT 112
GALUR
Gambar 7. Jumlah malai produktif untuk galur transgenik GI, G3, G5, G6 dan IRATl12 nontransgenik setelah diinokulasi dengan R. solani.
Notasi IttirNf )wig bcrbeda di setiap tgt~ilg histogram meilunjukkan perbedaait iqatin pa&
U j i Beda Du~~cwi uiituk a = 0.05
Gambar 8. Jumlah malai produktif untuk galur transgenik C-27-1, F-1-1, B-10-1, D-2-2, B-8-1, E-10-1, B-2-1, E-24-1, B-27-1, B-11-1 dan rojolele nontransgenik setelah diinokulasi dengan R solani.
Notasi hurt$ ya?g berbeda di setiinp ujting histogram meiit~njukkan perbedawl nyata padn
[image:40.541.80.463.55.748.2] [image:40.541.90.457.70.320.2]Persentase Tanaman Survive
Tanaman dikatakan survive jika dapat mempertahankan siklus hidupnya
sampai pada generasi berikutnya (Silverman et al 1995; Eyendi et al 1992;
Mercado-Blanco et al 1989). Pada tanaman padi indikator yang dilihat adalah
malai penghasil benih dan jumlah anakan setelah mengalami serangan patogen.
(IRTP 1988).
Gambar 9 menunjukkan persentase tanaman survive galur transgenik
kultivar IRAT112. Terlihat bahwa galur transgenik G6 menunjukkan persentase
tanaman survive 88 persen. Sedangkan galur-galur lainnya berkisar 6 persen
sampai dengan 37 persen. Uji beda Duncan untuk a = 0.05 menunjukkan galur
G6 berbeda nyata dengan galur-galur lainnya.
Garnbar 10 menunjukkan persentase tanaman survive untuk galur
transgenik kultivar rojolele. Terlihat bahwa persentase tanaman survive terbaik
ada pada galur transgenik E-10-1, B-1 1-1 dan E-24-1 mencapai 96 persen, 79
persen dan 65 persen Uji beda Duncan pada taraf kepercayaan 95 persen
menunjukkan bahwa galur E-10-1 berbeda nyata dengan galur-galur lainnya.
Sedangkan Galur B-1 1-1 dan E-24-1 tidak menunjukkan perbedaan yang nyata.
G A L U R
Gambar 9. Persentase tanaman survive untuk galur transgenik GI, G3, G5, G6 dan lRAT112 nonhansgenik setelah diinokulasi dengan R solani.
Notasi h m f p i g berbeda di seticp, zrjzizg histogrmn merwnjukkrm perbedam1 ?ryala pada
GALUR
Gambar 10. Persentase tanaman survive untuk galur eansgenik C-27-1, F-1-1, B-10-1, D-2-2, B-8-1, E-10-1, B-2-1, E-24-1, B-27-1, B-11-1 dan rojolele nontransgenik setelah diinokulasi dengan R solani.
Nolusi h i ~ r ~ ~ y m g berbeda di seiiap z~rr?zg histograni menu~~ukkmt perbedurn? zryata pada
Uji Beda Du?icrn? uiz~trk a = 0.05
Uji Ketahanan Padi Transgenik Terhadap Pyricularia oryzae
Berdasarkan hasil pengamatan, terdapat gejala serangan blas pada dam
yang berupa bercak berbentuk elips dengan kedua ujung yang kurang lebih runcing,
wama coklat pada bag'an tepi dan bagian tengah berwama putih keabuan. Pada kultivar yang rentan bercak-bercak dapat berkembang dan menyatu dengan yang
laimya sehingga akhimya helai daun mengering dan mati. Hal ini sesuai dengan
pendapat Amir dm Kardin (1991) bahwa bercak pada dam terus membesar pada
kultivar yang peka khususnya bila dalam keadaan lembab. Sedangkan pada padi
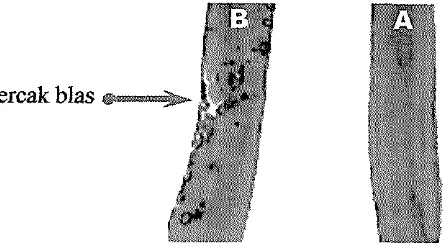
yang tahan tidak ada bercak atau walaupun ada hanya berupa bintik berwama coklat sebesar ujung jarum dan tidak berkembang. Gambar 11 menunjukkan perbedaan
daun dari galur transgenik yang tahan dan rentan
Cendawan
P.
oryzae ras 173 memiliki sifat virulensi tinggi tetapikemampuan bertahan
di
lapang yang rendah (Utami et a1 2000). Terlihat padahari kesepuluh setelah inokulasi, tanaman nontransgenik seperti cv IRATI 12 dan
rojolele, walaupun di atas 50 persen intensitas penyerangan (Gambar 12) tetapi
Bercak blas
Gambar 11. Perbandingan galur rentan
(B)
dan galur tahan (A).Intensitas Penyerangan
Berdasarkan hasil Analisis Ragam untuk 3, 6 dan 9 hsi (hari setelah
inokulasi) menunjukkan signifikansi sangat nyata (Lampiran 4). Sehingga dapat diuji lanjut sampai pada tingkat uji beda Duncan untuk
a
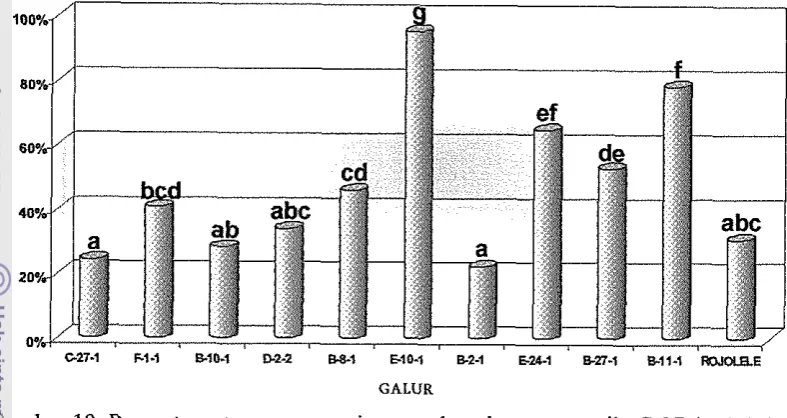
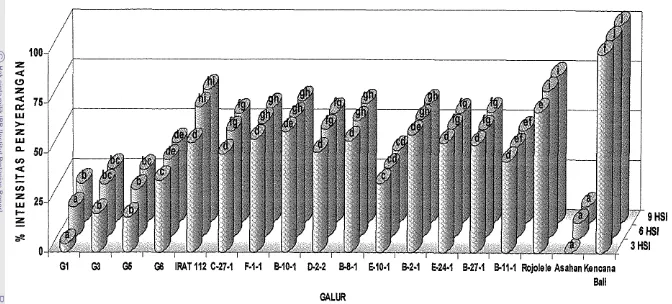
= 0.05.Gambar 12 menunjukkan intensitas penyerangan cendawan P. oryzae meningkat untuk semua galur dengan persentase yang berbeda-beda sejak 3 hsi, 6
hsi sampai 9 hsi. Dari seluruh galur yang dicobakan kultivar lokal asahan
memiliki persentase intensitas penyerangan terkecil di bandingkan dengan galur-
galur lainnya. Namun dilihat dari perbandingan antara galur kontrol nontransgenik
dan galur transgenik menunjukkan perbedaan yang signifikan. Galur transgenik
lebih kecil persentase intensitas penyerangan dibanding galur nontransgenik
kontrol (rojolele dm IRAT112). Ada beberapa galur yang memiliki intensitas
penyerangan dibawah 50 persen yaitu kultivar asahan, galur transgenik GI, G3,
G5, G6, E-10-1 dan B-1 1-1. Sedangkan galur lainnya berkisar antara 50 sampai 100 persen.
Galur transgenik yang berasal
dari
kultivar rojolele memiliki persentaseintensitas penyerangan lebih tinggi dibanding galur transgenik yang berasal dari
kultivar IRAT1 12. Hal ini disebabkan karena umur padi Mtivar IRAT112 lebih
genjah dibanding kdtivar rojolele. Sehingga faktor kematangan fisiologi jaringan
lebih baik pada galur transgenik IRAT112. Seperti yang dilaporkan oleh
Silverman et a1 (1995) bahwa padi pada fase bibit memiliki kandungan asam
GI
G3
Gb @ IRAT 112 C.27-1 F-1-I E10-1 0-2-2 B-84 E10-1 E2-I M 4 - 1 E27-1 E l l - 1 '~ojoieie~sahen ~encana Bali OALURGambar
12.
Intensitas penyerangan Pyricularia oryzae 3, 6 dan 9 hari setelah inokulasi (hsi) terhadap galur padi transgenik dan kontrol non transgenikUji beda Duncan untuk
a
= 0.05 menunjukkan bahwa pada pengamatan9 hsi kultivar asahan berbeda nyata terhadap galur-galur lainnya. Sedangkan untuk
kontrol nontransgenik kultivar IRATI 12 dan rojolele tidak berbeda nyata. Galur
transgenik asal kultivar rojolele E-10-1 berbeda nyata dengan galur (2-27-1, F-1-1,
B-10-1, D-2-2, B-8-1, B-2-1, E-24-1, B-27-1, B-1 1-1, Rojolele nontransgenik,
IRAT112, asahan dan kencana bali tetapi tidak berbeda nyata dengan galur transgenik G3, G5 dan G6.
Varietas lokal seperti asahan dan kencana bali yang digunakan sebagai
pembanding menunjukkan perbedaan yang nyata dibandingkan dengan galur
transgenik. Varietas asahan sangat tahan sedangkan varietas kencana bali sangat
rentan terhadap P. oryzae ras 173. Ini menunjukkan bahwa ekspresi gen tunggal
yang muncul pada varietas asahan sehingga hanya tahan terhadap satu ras
cendawan saja (Frinckh, 1994).
Analisis Molekular
Berdasarkan uji ketahanan terhadap cendawan Pyricdaria oiyzae
dan
ujihisomisin pada galur transgenik diambil masing-masing 7 individu secara acak
dari galur E-10-1
dan
B-11-1 untuk dianalisis amplifikasi gen entC dan pmsB.Kedua gen ini diamplifikasi dengan teknik PCR secara terpisah. Oleh karena
memiliki suhu pelekatan primer (annealing) yang berbeda. Diduga karena sumber
gen yang berbeda Gen entC berasal dari
E.
coli sedangkan genpmsB berasal dariPseudornonas flourescens yang menghendaki kondisi optimasi berbeda
Wnggraini 2003).
Gambar 13 menunjukkan amplifikasi gen entC positif terlihat pada
individu E-10-1.30, E-10-1.43; B-11-1.5; B-11-1.23, B-11-1.75; B-11-1.49 serta
Kontrol pSA dan kontrol positif t m a n pertama (TO).
Gambar 14 menunjukkan adanya gen pmsB yang teramplifikasi pa&
individu E-10-1.30; E-10-1.34; E-10-1.27; B-11-1.5; B-11-1.23; B-11-1.75;
Gambar 13. Hasil amplifikasi PCR gen en& pada individu galur transgenik
E-10-1 dan B-11-1.
Gambar 14. Hasil amplifikasi PCR gen pmsB pada individu galur transgenik
E-10-1 danB-11-1.
Pada Gambar 13 dan 14 ada pita yang muncul pada galur m s g e n i k individu Bll-1.75 dan E-10-1.27 yang pada awal pengujian higromisin menujukkan negatif higromisin, hal ini diduga karena p e m b u h a n tanaman tidak
seragam pada saat pembibitan sehingga kemunglnnan individu dari galur trangenik ini pertumbuhan awalnya terlambat.
SIMPULAN DAN SARAN
Kesimpulan
Berdasarkan uraian hasil dan pembahasan yang di kemukakan, dapat
simpulkan sebagai berikut :
1. Hasil uji higromisin menunjukkan bahwa pola segregasi gen galur E-10-1
dan B-11-1 cenderung mengikuti pola segregasi Mendel 3 :1 untuk gen
dominan yang terintegrasi pada satu lokus.
2. Hasil ujj ketahanan pa& transgenik terhadap cendawan Rhimctonia solani
(Ag-1) didapati 2 galur transgenik asal kultivar rojolele yang memiliki
ketahanan terhadap serangan cendawan Rhizoctonia solani (Ag-1) yaitu
galur 510-1 dan EL1 1-1. Sedangkan untuk Galur transgenik asal JRATl12 adalah
G6
3. Hasil uji ketahanan padi transgenik terhadap cendawan Pyriculnria o r y e
(ras 173) didapati 6 galur yang memiliki ketahanan dengan persentase
intensitas penyerangan cendawan Pyricularia oryzue (ras 173) di bawah
50 persen yaituG1, G3, G5, G6, E-10-1 dan B-11-1.
4. Hasil analisis PCR menunjukkan adanya amplifikasi gen entC dan pmsB
pada individu galur E-10-1 dan B-1 1-1 turunan kedua (TI).
Saran
Adapun saran yang dikembangkan dalam penelitian ini adalah :
1. Sebaiknya penelitian Ianjutan untuk generasi T2 dilakukan uji hibridisasi
Southern untuk mengetahui pola integrasi transgen di dalam organisme
transgenik
2. Perlu dilakukan penyljian ketahanan untuk generasi T2 dan generasi
DAFTAR PUSTAKA
Anonim.. 1986. Pengujian Lapangan Efikasi Fungisida ROVRAL 50 WP
Terhadap Penyakit hawar Pelepah Daun (Rhizoctoniu soluni) Pada Tanaman Padi Sawah. Departemen Pertanian. Hal 1-7.
Amir M, Kardin M. 1991. Pengendalian Penyakit Jamur. dulum Buku 3. Padi.
Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor. Hal 826.
Atkins R, John G. 1974. Rice diseases of the America. A Review of literature. ARS, U S D q Washington D. C. Agricultural Handbook No. 448. p. 47- 49. dulurr~ Kardin
,
M. K., H. Punvanti, A. Nasution dan Sutoyo. 1997. Penyakit Hawar Pelepah Daun Padi (Rhizoctoniu soluni): Permasalahan dan Prospek Pengendaliannya di Indonesia. Bul. Agro. Bio l(2): 9-14.Baharsjah S, Kasryno F, Darmawani D E 1988. Kedudukan Padi dalam
Perekonomian Indonesia. Badan Penelitian dan Pengembangan Tanaman Pangan. Bogor. Hal 12.
Biro Pusat Statistik 1997. Luas dan Intensitas Serangan Organisme Pengganggu
Tanaman dan Bencana Alam Padi, Palawija dan Sayuran. Jakarta.
Broglie K, Borgle R, Benhamau N, Chet I. 1993. The role of cell wall degrading enzymes in fungal diseases resistence. P. 139-156. dulum Priyatno, T. P., M. S. Sudjono, Chaerani, Y. Suryadi, H. Punvanti dan H. A. Y. Nunung. 1999. Laporan Hasil Penelitian Teknik Produksi Mikroba Anti Jamw Karat Kedelai. Pusat Penelitian dan Pengembangan Tanaman Pangan. Balai Penelitian Bioteknologi Tanaman Pangan Bogor.
Chong J, Pierre1 M-A, Tanassova RA, Werck-Reichhart D, Fritig B, Saindrenan P. 2001. Free and conjugated benzoic acid in tobacco plants and cell cultures. Induced accumulation upon elicitation of defense responses and role as salicylic acid precursors. Plant Physiol. Vol. 125 :
3 18-328.
Eyendi AJ, Yalpani N, Silverman P, Raskin I. 1992. Localization, conjugation, and function of Salicylic acid in tobacco during thr hypersensitive reaction to tobacco mosaic virus. Proc. Natl. Acad. Sci. USA Vol. 89, pp. 2480-2484.
Frinekh MR 1994. Draft to gene deployment for the management of rice disease and pest. Workshop on "Population Genetic and Rice Disease Management". CRIFC, Bogor, Indonesia Heinrichs. E.A. 1994
Hartana A. 1992. Genetika Tumbuhan. Departemen Pendidikan dan Kebudayaan Direktorat Jenderal Pendidikan Tinggi Pusat Antar Universitas Ilmu Hayat Institut Pertanian Bogor. Hal 1 13.
Hashioka Y. 1965. Effects of Environmental Factors on Developments of Causal
Fungus, Infection, Disease Developments and Epidemiology in Rice Blast Disease 265 p.
Herman M. 1996. Rekayasa Genetik untuk Perbaikan Tanaman. Bul. Agro. Bio
l(1): 24-34.
Hinchee MAW, Ward CDV, Newell CA, Mc Done11 RE, Sato SJ, Gasser CS,
Fischoff DA, Re DB, Fraley RT, Horsch
RB.
1988. Poduction oftransgenic soybean plants using Agrobacterium mediated DNA transfer. BioiTech. 6: 915-922.
[IRRI]
International Rice Research Institute. 1975. Research High Lights for 1974. Los Banos, philipines.[IRTP] International Rice Testing Program. 1988. Standard Evaluation System for Los Banos, Philippines.
Jeanguyot M. 1994. Rice blast and its control. Memories et Travanx DeU IRAT, NO. 3 : 11-42