Lampiran 1 Perhitungan % Peredaman Ekstrak Etanol Daun Keji Beling
% ��������� = ������� − �������
������� � 100%
Konsentrasi 20 ppm :
% ��������� = 0,955−0,849
0,955 � 100% = 11,099 % Konsentrasi 40 ppm :
% ��������� = 0,955−0,772
0,955 � 100% = 19,162 % Konsentrasi 60 ppm :
% ��������� = 0,955−0,745
0,955 � 100% = 21,989 % Konsentrasi 80 ppm
% ��������� = 0,955−0,720
0,955 � 100% = 24,607 %
Perhitungan nilai IC50 Ekstrak Etanol Daun Keji Beling
X Y XY X2
0 0 0 0
20 11,099 221,98 400
40 19,162 766,48 1600
60 21,989 1319,34 3600
80 24,607 1968,56 6400
∑X = 200 ∑Y = 76,857 ∑XY = 4276,36 ∑X2
= 12000
X = Konsentrasi (ppm)
� =�(∑��)− (∑�)(∑�)
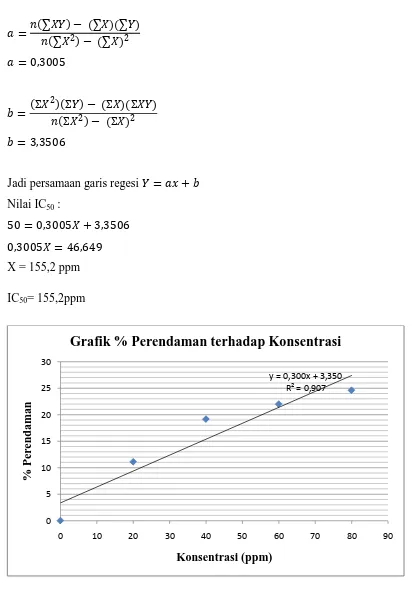
Grafik % Peredaman terhadap Konsentrasi (ppm) y = 0,300x + 3,350
Lampiran 2 Perhitungan Bilangan Peroksida Dari Minyak Ikan Nila
Bilangan Peroksida = ������ ��2�2�3����������� ��2�2�3� 1000
0,5 �
Normalitas Na2S2O3 yang dipakai = 0,0036N
1. Bilangan Peroksida Dari Minyak Ikan Nila Penyimpanan 5 Hari (S1)
Bilangan Peroksida = 3,5�0,0036 �� 1000
0,5 �
= 12,6
0,5 � = 25,5 meq/kg
2. Bilangan Peroksida Dari Minyak Ikan Nila + 20 ppm Ekstrak Etanol Daun Keji Beling Penyimpanan 5 Hari (S2)
Bilangan Peroksida = 3 �0,0036 �� 1000
0,5 �
= 10,8
0,5 � = 21,6 meq/kg
3. Bilangan Peroksida Dari Minyak Ikan Nila + 40ppm Ekstrak Etanol Daun Keji Beling Penyimpanan 5 Hari (S3)
Bilangan Peroksida = 2,6 �0,0036 �� 1000
0,5 �
= 9,36
4. Bilangan Peroksida Dari Minyak Ikan Nila + 60 ppm Ekstrak Etanol Daun Keji Beling Penyimpanan 5 Hari (S4)
Bilangan Peroksida = 2,2 �0,0036 �� 1000
0,5 �
= 7,92
0,5 � = 15,84 meq/kg
5. Bilangan Peroksida Dari Minyak Ikan Nila + 80 ppm Ekstrak Etanol Daun Keji Beling Penyimpanan 5 Hari (S5)
Bilangan Peroksida = 2 �0,0036 �� 1000
0,5 �
= 7,2
DAFTAR PUSTAKA
Bakar, M.F.A., Teh, A.H,. Rahmat, A., Othman, F., Hashim, N., Fakurazi, S. 2006. Antiproliferative Properties And Antioxidant Activity Of Various Types Of Strobilanthes Crispus Tea. Academic Journal Inc. USA
Bendra, A. 2012. Uji Aktivitas Antioksidan Ekstrak Daun Premna oblongata Miq. Dengan Metode DPPH dan Identifikasi Golongan Senyawa Kimia dari Fraksi Teraktif. [Skripsi]. Depok : Universitas Indonesia
Blois, MS. 1958. Antioxidant Determination by The Use of a Stable Free Radical. Nature.
Buckle, K.A., Edwards, R.A., Fleet, G.H., Wotton, M.,2007. Ilmu Pangan. UI Press. Jakarta
Currah, R. 1985. Taxonomy of the Onygenales Mycotaxon 24: 1–216
Dalimartha, S. 2006. Atlas Tumbuhan Obat Indonesia. Jilid 4. Puspa Swara. Jakarta
Depkes RI. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan Pertama. Direktorat Jendral Pengawasan Obat dan Makanan. Jakarta
Ekowati, N., Kasiamdari, R.S., Pusposendjojo, N., Soegihardjo, C.J. 2011. Daya Antimikroba Metabolit Bioaktif Jamur Shiitake (Lentinula edodes (Berk.) Pegler) yang Dikultur Pada Tiga Jenis Medium Fermentasi. Majalah Obat
Tradisional. 16(3) : 132-137
Fessenden, R.J.,Fessenden, J.S. 1994. Kimia Organik. Jilid 1. Erlangga. Jakarta
Green, R.J. 2004. Antioxidant Activity of Peanut Plant Tissues. [Thesis]. Raleigh : Faculty of North Carolina State University.
Gunawan, I. 2011. Efek Kejibeling (Sericocalyx Crispus L) Terhadap Penurunan Tekanan Darah Pria Dewasa. Skripsi Fakultas Kedokteran Universitas Kristen Maranatha. Bandung
Hale, T.L., Keusch, G.T. 1996. Shigella: Structure, Classification, and Antigenic
Types. In Baron, Samuel.
University of Texas Medical Branch
Hargono, D. 2012. Beberapa hasil Penelitian yang Mendukung Manfaat Tumbuhan Jambu Biji(Psidium guajava).Skripsi FakultasFarmasi, Universitas pancasila. Jakarta
Isnawati, A.,Alegantina, S., Raini, M., Nikmah, B. 2004. Karakterisasi Simplisia dan Ekstrak Daun Strobilanthes crispus. Media Litbang Kesehatan. Volume XIV. Nomor 2.: 23
Jawetz., Melnick., Adelberg’s. 2001. Mikrobiologi Kedokteran. Edisi Pertama. Penerbit Salemba Medika. Jakarta
Kotiranta A, Lounatmaa K, Haapasalo M. 2000. Epidemiology and pathogenesis of Bacillus cereus infections. Microbes Infect 2 (2): 189–98
Kesuma, F. 2010. Aktivitas Antibakteri Ekstrak Etanol Buah Mengkudu (Morinda
citrifolia Linnaeus) Terhadap bakteri Pembusuk Daging Segar. Surakarta :
FMIPA UNS
Ketaren, S. 1986. Minyak dan Lemak Pangan. Jakarta : UI-Press
Khamidinal., Hadipranoto, N., Mudasir. 2007. Pengaruh Antioksidan terhadap Kerusakan Asam Lemak Omega-3 Pada Proses Pengolahan Ikan Tongkol.
Kaunia. 3(2).
Mailandari, M. 2012. Uji Aktivitas Antioksidan Ekstrak Daun Garcinia kydia Roxb dengan Metode DPPH dan Identifikasi Senyawa Kimia Fraksi yang Aktif. FMIPA UI
McClary and Otho. 1952. Factors Affecting the Morphology of Candida Albicans. Annals of the Missouri Botanical Garden. 39 (2): 137–164
Nursiyah. 2013. Studi Deskriptif Tanaman Obat Tradisional Yang Digunakan Orangtua Untuk Kesehatan Anak Usia Dini Di Gugus Melati Kecamatan Kalikajar Kabupaten Wonosobo.Fakultas Ilmu Pendidikan Universitas Negeri Semarang
Pelczar, M.J dan Chan, E.C.S. 1988. Dasar dasar mikrobiologi 2. UI-Press. Jakarta
Pratiwi, S.T. 2008. Mikrobiologi Farmasi. Erlangga. Jakarta
Rahayu, T dan T. Rahayu. 2009. Uji Antijamur Kombucha Coffee Terhadap
Candida albicans dan Tricophyton mentagrophytes. Jurnal Penelitian
Sains & Teknologi,Vol. 10 (1)
Sastrohamidjojo, H. 1996. Sintesis Bahan Alam. Cetakan pertama. UGM-Press. Yogyakarta
Sirait, M. 2000. Penuntun Fitokimia dalam Farmasi. Penerbit ITB. Bandung
Sulkani. 2013. Mendongkrak Potensi Keji Beling dengan Perbanyakan Vegetatif.
keji-beling-dengan-perbanyakan-vegetatif.html
Utami, P. 2013. The miracle of herbs. Agromedia pustaka. Jakarta
Winarsi, H . 2007. Antioksidan Alami dan Radikal Bebas. Kanisius. Yogyakarta
Windono, T. 2001. Uji Peredaman Radikal Bebas Terhadap 1,1-Diphenyl-2-Picrylhydrazyl(DPPH) Dari Ekstrak Kulit Buah Dan Biji Anggur (Vitis
vinifera L) .Probolinggo Biru Dan Bali. Artocarpus Media Pharmaceutica
Indonesian
BAB 3
METODE PENELITIAN
3.1 Alat – Alat
Peralatan yang digunakan dalam penelitian ini meliputi :
- Rotary Vacum Evaporator Buchi Rotavapor
- Penangas uap Memmert
- Autoklaf Yamato SN 20
- Inkubator FiberScientific
- Cawan Petri
- Pipet mikro Eppendorf
- Kertas cakram Oxoid
- Spektrofotometri UV-Visible Spectronic 3000
- Lemari pendingin Toshiba
- Oven
- Hot Plate PMC
- Pinset
- Jarum Ose
- Jarum suntik
- Jangka sorong
- Corong pisah pyrex
- Pipet volume pyrex
3.2 Bahan – Bahan
Bahan yang digunakan dalam penenlitian ini meliputi :
- Daun Keji Beling
- 2,2-diphenyl-1-picryl-hydrazil (DPPH) p.a Aldrich
3.3 Prosedur Penelitian
3.3.1 Pembuatan Serbuk Daun Keji Beling
Daun Keji Beling (Strobilanthes crispus BI)segar yang telah dikumpulkan, dicuci
dengan air hingga bersih dari kotoran yang melekat dan ditiriskan. Daun
dikeringkan dengan cara diangin-anginkan. Kemudian dihaluskan dengan blender
hingga menjadi serbuk dan disimpan dalam wadah yang tertutup.
3.3.2 Pembuatan Ekstrak Etanol Daun Keji Beling
Pembuatan ekstrak etanol daun Keji Beling dilakukan dengan metode maserasi.
Sebanyak 230 g serbuk daun Keji Beling dimasukkan kedalam labu Erlenmeyer,
ditambahkan pelrut etanol 96 % hingga serbuk daun terendam. Didiamkan selama
± 48 jam dan ditutup dengan rapat. Selanjutnya filtrat yang dioeroleh dipekatkan
dengan Rotary vacum Evaporator untuk memisahkan pelarutbnya hingga
diperoleh ekstrak etanol dari daun Keji Beling, kemudian dipanaskan diatas
penangas uap untuk menguapkan pelarut yang masih tersisa.
3.3.3 Skrining Fitokimia Senyawa Metabolit Sekunder
3.3.3.1Uji Saponin
Filtrat etanol dari daun keji beling dimasukkan kedalam tabung reaksi lalu
ditambahkan akuades, kemudian dikocok kuat-kuat selama 10 detik.Jika terbentuk
busa yang stabil tidak kurang dari 10 menit menunjukan adanya senyawa saponin.
3.3.3.2Uji Terpenoid
Filtrat etanol dari daun keji beling diteteskanpada palt tipis, kemudian ditambah
dengan CeSO4 1 % dalam H2SO4 10 %. Jika terbentuk warna merah kecoklatan
menunjukkan adanya senyawa terpenoida.
Filtrat etanol dari daun keji beling dimasukkan kedalam tabung reaksi, kemudian
ditambahkan larutan pereaksi FeCl31 %.Jika terjadi warna biru atau kehitaman
menunjukkan adanya senyawa fenolik.
3.3.3.4Uji Alkaloida
Filtrat etanol dari daun keji beling dimasukkan kedalam 4 tabung reaksi dan
selanjutnya ditambahkan dengan pereaksi alkaloida diantaranya :
1. Tabung I ditambahkan larutan pereaksi Wagner. Jika terbentuk endapan
menggumpal berwarna coklat, menunjukkan adanya senyawa alkaloida.
2. Tabung II ditambahkan larutan pereaksi Mayer. Jika terbentuk endapan
menggumpal berwarna putih atau putih kekuningan, menunjukkan adanya
senyawa alkaloida.
3. Tabung III ditambahkan larutan pereaksi Bouchardat. Jika terbentuk endapan
berwarna coklat kemerahan, menunjukkan adanya senyawa alkaloida.
4. Tabung IV ditambahkan larutan pereaksi Dragendorff. Jika terbentuk endapan
warna merah atau jingga, menunjukkan adanya senyawa alkaloida.
3.3.4 Pengujian Aktivitas Antimikroba
3.3.4.1Pembuatan Media MHA (Muller Hinton Agar)
Ditimbang sebanyak 9,5 gram serbuk MHA, kemudian dimasukkan kedalam labu
Erlenmeyer dan dilarutkan dengan 250 ml aquadest, diaduk dan dipanaskan
hingga larut dan mendidih, lalu disterilkan dalam autoklaf pada 1210 C selama 15
menit.
Ditimbang sebanyak 9,75 gram media PDA, kemudian dimasukkan kedalam labu
Erlenmeyer dan dilarutkan dengan 250 ml aquadest, diaduk dan dipanaskan
hingga larut dan mendidih, lalu disterilkan dalam autoklaf pada 1210 C selama 15
menit.Kemudian dituangkan kedalam tabung reaksi sebnyak 3 ml dan dibiarkan
memadat pada posisi miring membentuk sudut 300-450. Diambil jamur Candida
albicansdan Microsporum gypseum dari strain utama dengan jarum ose lalu
digoreskan pada media PDA miring yang telah memadat. Diinkubasi pada suhu
220 C selama 48 jam.
3.3.4.3Pembuatan Media NA (Nutrien Agar) Miring dan Stok Kultur Bakteri
Ditimbang sebanyak 7 gram media NA, kemudian dimasukkan kedalam labu
Erlenmeyer dan dilarutkan dengan 250 ml aquadest, diaduk dan dipanaskan
hingga larut dan mendidih, lalu disterilkan dalam autoklaf pada 1210 C selama 15
menit. Kemudian dituangkan kedalam tabung reaksi sebnyak 3 ml dan dibiarkan
memadat pada posisi miring membentuk sudut 300-450. Diambil bakteri Bacillus
cereus danShigella dysentriaedari strain utama dengan jarum ose lalu digoreskan
pada media NA miring yang telah memadat. Diinkubasi pada suhu 350 C selama
24 jam.
3.3.4.4Pembuatan Media NaCl 0,9 %
Ditimbang sebanyak 2,25 gram NaCl, kemudian dimasukkan kedalam labu
Erlenmeyer dan dilarutkan dengan 250 ml aquadest, diaduk dan dipanaskan
hingga larut dan mendidih, lalu disterilkan dalam autoklaf pada 1210 C selama 15
menit.
Dimasukkan 5 ml media NaCl 0,9 % steril kedalam tabung reaksi. Diambil koloni
bakteri Bacillus cereus dari stok kultur bakteri dengan jarum ose, lalu
disuspensikan kedalam media NaCl. Diinkubasi selama 1-2 jam pada suhu 350 C.
Diukur kekruhan larutan pada panjang gelombang 560-600 nm hingga diperoleh
transmitan 25-28. Dilakukan cara yang sama terhadap bakteri Shigella dysentriae.
3.3.4.6Pembuatan Inokulum Jamur
Dimasukkan 5 ml media NaCl 0,9 % steril kedalam tabung reaksi. Diambil koloni
jamur Candida albicans dari stok kultur jamur dengan jarum ose, lalu
disuspensikan kedalam media NaCl. Diinkubasi selama 1-2 jam pada suhu 220 C.
Diukur kekruhan larutan pada panjang gelombang 580-600 nm hingga diperoleh
transmitan 25-28. Dilakukan cara yang sama terhadap jamur Microsporum
gypseum.
3.3.4.7Pembuatan Variasi Konsentrasi Ekstrak Etanol Daun Keji Belling
Ekstrak daun keji beling diencerkan dengan pelarut DMSO. Dengan
masing-masing konsentrasi 100, 200, 300, 400, dan 500 mg/ml.
3.3.4.8Uji Aktivitas Antibakteri Ekstrak Etanol Daun Keji Beling
Dimasukkan 0,1 ml inokulum bakteri Bacillus cereus kedalam cawan petri.
Ditambahkan 15 ml media MHA dengan suhu 450-500 C. Dihomogenkan sampai
media dan bakteri tercampur merata. Dibiarkan sampai media memadat.
Diletakkan kertas cakram yang telah direndam dengan berbagai variasi
konsentrasi ekstrak daun keji beling kedalam cawan petri. Diinkubasi selama 24
jam pada suhu 350 C. Diukur diameter zona bening yang ada disekitar kertas
cakram dengan jangka sorong. Dilakukan perlakuan yang sama untuk bakteri
Shigella dysentriae.
Dimasukkan 0,1 ml inokulum jamur Candida albicans kedalam cawan petri.
Ditambahkan 15 ml media PDA dengan suhu 450-500 C. Dihomogenkan sampai
media dan jamur tercampur merata. Dibiarkan sampai media memadat. Diletakkan
kertas cakram yang telah direndam dengan berbagai variasi konsentrasi ekstrak
daun keji beling kedalam cawan petri. Diinkubasi selama 48 jam pada suhu 220 C.
Diukur diameter zona bening yang ada disekitar kertas cakram dengan jangka
sorong. Dilakukan perlakuan yang sama untuk jamur Microsporum gypseum.
3.3.5 Uji Aktivitas Antioksidan Ekstrak Etanol Daun Keji Beling dengan Metode DPPH (2,2 Diphenyl-1-picrylhidrazyl)
3.3.5.1Pembuatan Larutan DPPH 0,3 mM
Ditimbang serbuk DPPH sebanyak 11,85 mg. kemudian dilarutkan dalam etanol
p.a pada labu takar 100 ml, dan dihomogenkan.
3.3.5.2Pembuatan Variasi Konsentrasi Ekstrak Etanol Daun Keji Beling
Ekstrak etanol daun keji beling ditimbang sebanyak 0,025 g dan dilarutkan
dengan etanol p.a kedalam labu takar 25 ml sehingga diperoleh larutan induk
1000 ppm. Kemudian dari larutan induk 1000 ppm dibuat larutan 100 ppm, dan
dari larutan 100 ppm dibuat variasi konsentrasi larutan 20. 40, 60, dan 80 ppm.
3.3.5.3Uji Aktivitas Antioksidan
a. Larutan Blanko
Sebanyak 1 ml larutan DPPH 0,3 mM dimasukkan kedalam tabung reaksi.
Ditambahkan 2,5 ml etanol p.a, dihomogenkan dan dibiarkan pada ruang gelap
selama 30 menit. Diukur absorbansi dengan panjang gelombang 517 nm.
Sebanyak 1 ml larutan DPPH 0,3 mM dimasukkan kedalam tabung reaksi.
Ditambahkan 2,5 ml ekstrak daun keji belling 20 ppm, dihomogenkan dan
dibiarkan pada ruang gelap selama 30 menit. Diukur absorbansi dengan
panjang gelombang 517 nm. Dilakukan cara yang sama untuk ekstrak daun keji
beling 40, 60 dan 80 ppm.
3.3.8 Aplikasi Antioksidan Pada Daging Ikan Nila 3.3.8.1Preparasi Daging Ikan Nila
Sebanyak 1 kg ikan nila segar dibersihkan dan dipisahkan dagingnya dari kulit
dan duri. Selanjutnya daging ikan nila yang telah terpisah dari duri dan kulitnya di
haluskan dengan menggunakan blender dan dibagi menjadi 5 bagian kedalam
aluminium foil. Masing – masing sebanyak 100 g disimpan selama 5 hari pada
suhu ± 5oC dengan penambahan ekstrak etanol daun keji beling dengan variasi
konsentrasi (20, 40, 60, dan 80 ppm), dan daging ikan nila tanpa tambahan ekstrak
etanol daun keji beling.
3.3.8.2Ekstraksi Minyak Daging Ikan Nila
Daging ikan nila yang telah disimpan selama 5 hari pada suhu ± 5oC, ditambahkan
dengan 400 ml heksana : isopropanol (3:2). Campuran diblender selama 2
menit.Kemudian suspensi disaring hingga residu menjadi kering. Residu
ditambahkan dengan 180 ml heksana : isopropanol (3:2) dan diblender kembali,
disaring dan residu yang diperoleh ditambahkan lagi dengan 150 ml heksana :
isopropanol (3:2), kemudian diblender dan disaring.
Filtrat hasil ekstraksi dikumpulkan dan dimasukkan kedalam corong pisah.
Kemudian ditambahkan dengan 80 ml larutan Na2SO46,67% dan dihomogenkan
selama 1 menit, didiamkan hingga membentuk lapisan. Lapisan atas ditambahkan
dengan 5 gramNa2SO4 anhidrous, disaringdan filtrat dipekatkan dengan rotari
vacum evaporator.
Sebanyak 0,5 g minyak ikan yang diperoleh dari ekstraksi daging ikan nila
dimasukkan ke dalam labu Erlenmeyer 250 ml. Kemudian ditambahkan 30 ml
campuran larutan asam asetat glasial : kloroform dengan perbandingan (3:2).
Selanjutnya, ditambahkan 0,5 ml larutan KI, ditutup dan dikocok selama ± 2
menit. Kemudian ditambahkan 30 ml akuades dan dititrasi dengan larutan
Na2S2O3 0,0036 N hingga larutan berwarna kuning pucat, kemudian ditambahkan
1 ml indikator amilum 1% yang kemudian dititrasi kembali dengan Na2S2O3
0,0036 N sampai warna yang terbentuk hilang, dihitung dan dicatat volume
Na2S2O3 0,0036 N yang terpakai.
Daun Keji Beling
Serbuk Daun Keji Beling
Ekstrak Etanol Keji Beling
Filtrat Etanol dari Daun Keji Beling
Golongan
3.4.1 Ekstraksi Daun Keji Beling (Strobilanthes crispus BI)
Dicuci
Dikering anginkan
Dihaluskan
Dimasukkan kedalam labu Erlenmeyer
Direndam dengan etanol 96% selama 48 jam ( ± 2 hari )
Dipekatkan dengan Rotary Vacum Evaporator
Dipanaskan dengan penangas uap
3.4.2 Skrining Fitokimia Ekstrak Etanol Daun Keji Beling
Dimasukkan ke dalam tabung reaksi secukupnya
3.4.2 Uji Aktivitas Antimikroba
Ditambah-3.4.2.1Pembuatan Media Muller Hinton Agar (MHA)
Dilarutkan dengan 250 ml aquades kedalam LabuErlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121 0C selama 15 menit
3.4.2.2Pembuatan Media Potato Dextrose Agar (PDA) dan Stok Kultur Jamur
Dilarutkan dengan 250 ml aquades kedalam Labu Erlenmeyer
Dipanaskan sambal diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121 0C selama 15 menit
Dituangkan kedalam tabung reaksi sebanyak 3 ml
Dibiarkan pada temperatur kamar sampai memadat pada posisi miring
Diambil jamur Candida albicans dari strain utama dengan jarum ose lalu digoreskan ke dalam media PDA yang telah memadat
Diinkubasi pada suhu 220 C selama 48 jam
Dilakukan perlakuan yang sama untuk jamur Microsporum gypseum
3.4.2.3Pembuatan Media Nutrien Agar (NA) dan Stok Kultur Bakteri
9,5gram media MHA (Muller HintonAgar)
Media MHA (Muller Hinton Agar) steril
9,75gram media PDA (Potato Dextrose Agar)
Media PDA (Potato Dextrose Agar) steril
Dilarutkan dengan 250 ml aquades kedalam Labu Erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 121 0C selama 15 menit
Dituangkan ke dalam tabung reaksi sebanyak 3 ml
Dibiarkan pada temperatur kamar sampai memadat pada posisi miring
Diambil bakteri Bacillus cereus dari strain utama dan digoreskan secara aseptik dengan jarum ose ke dalam media NA yang telah memadat
Diinkubasi selama 24 jam pada suhu 35 0C
Dilakukan perlakuan yang sama untuk bakteri Shigella dysentriae
3.4.2.4Pembuatan Inokulum Bakteri
7gram media NA (Nutrien Agar)
Media NA (Nutrien Agar) steril
Dilarutkan dengan 100 ml aquades kedalam labu Erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 1210 C selama 15 menit
Dituangkan kedalam tabung reaksi sebanyak 5 ml
Diambil koloni bakteri Bacillus cereus dari stok kultur bakteri dengan jarum ose
Disuspensikan kedalam media NaCl
Diinkubasi selama 1-2 jam pada suhu 350 C
Diukur kekeruhan larutan pada panjang gelombang 560-600 nm sampai diperoleh transmitan 25-28
Dilakukan perlakuan yang sama untuk bakteri Shigella dysentriae
3.4.2.5Pembuatan Inokulum Jamur
2,25 gram NaCl
Media NaCl 0,9 % steril
Dilarutkan dengan 100 ml aquades kedalam labu Erlenmeyer
Dipanaskan sambil diaduk hingga larut dan mendidih
Disterilkan dalam autoklaf pada suhu 1210 C selama 15 menit
Dituangkan kedalam tabung reaksi sebanyak 5 ml
Diambil koloni jamur Candida albicans dari stok kultur jamur dengan jarum ose
Disuspensikan kedalam media NaCl
Diinkubasi selama 1-2 jam pada suhu 220 C
Diukur kekeruhan larutan pada panjang gelombang 580-600 nm sampai diperoleh transmitan 25-28
Dilakukan perlakuan yang sama untuk jamur Microsporum gypseum
3.4.2.6Uji Aktivitas Antibakteri Ekstrak Etanol Daun Keji Beling
2,25 gram NaCl
Media NaCl 0,9 % steril
Hasil
Hasil
Dimasukkan kedalam cawan petri
Ditambahkan 15 ml media MHA dengan suhu 450-500 C
Dihomogenkan sampai media dan bakteri tercampur rata
Dibiarkan sampai media memadat
Dimasukkan kertas cakram yang telah direndam dengan ekstrak etanol daun Keji Beling dengan berbagai konsentrasi kedalam cawan petri
Diinkubasi selama 24 jam pada suhu 350 C
Diukur diameter zona bening disekitar cakram dengan jangka sorong
Dilakukan perlakuan yang sama untuk bakteri Shigella dysentriae
3.4.2.7Uji Aktivitas Antijamur Ekstrak Etanol Daun Keji Beling
Dimasukkan kedalam cawan petri
Ditambahkan 15 ml media PDA dengan suhu 450-500 C
Dihomogenkan sampai media dan jamur tercampur rata
Dibiarkan sampai media memadat
Dimasukkan kertas cakram yang telah direndam dengan ekstrak etanol daun Keji Beling dengan berbagai konsentrasi kedalam cawan petri
Diinkubasi selama 48 jam pada suhu 220 C
Diukur diameter zona bening disekitar cakram dengan jangka sorong
Dilakukan perlakuan yang sama untuk jamur Microsporum gypseum 0,1 ml inokulum bakteri Bacillus cereus
0,025 g Estrak Etanol Daun Keji Beling
20 ppm
25 ml Larutan Induk 1000 ppm
25 ml Larutan Induk 100 ppm
40 ppm 60 ppm 80 ppm
3.4.3 Uji Antioksidan Ekstrak Etanol Daun Keji Beling dengan Metode DPPH
Dimasukkan dalam labu takar 25 ml Ditambahkan etanol p.a hingga garis batas
Dihomogenkan
Dipipet 2,5 ml Larutan Induk 1000 ppm
Dimasukkan dalam labu takar 25 ml Ditambahkan etanol p.a hingga garis batas
Dihomogenkan
Dibuat variasi 20, 40, 60 dan 80 ppm
Dimasukkan 2,5 ml masing – masing variasi ekstrak kedalam tabung reaksi yang berisi 1 mllarutan DPPH 0,3 mM
Dihomogenkan
Dibiarkan selama 30 menit dalam ruangan gelap
1 kg Daging ikan nila
3.4.4 Aplikasi Antioksidan Terhadap Daging Ikan Nila
3.4.4.1Preparasi Daging Ikan Nila
Dibersihkan
Dipotong kecil-kecil
Diblender
Dibagi menjadi 5 bagian
3.4.4.2Ekstraksi Minyak Daging Ikan Nila
Ditambah 400ml n-heksan : isopropanol (3:2) dan diblender selama 2 menit
Disaring dengan corong Buchner
Ditambah 180ml n-heksan : isopropanol (3:2) dan diblender
Disaring
Ditambah 150ml n–heksan : isopropanol (3:2) dan diblender
Disaring
Dimasukkan ke dalam corong pisah Dimasukkan 80 ml larutan Na2SO4 6,67%
Dihomogen selama 1 menit Didiamkan
Dipisahkan
Dimasukkan ke labu Erlenmeyer
Ditambahkan 5 g Na2SO4 Anhidrous
Disaring
Dipekatkan dengan rotary vacum evaporator
Dengan prosedur yang sama lakukan untuk sampel 2, 3, 4, dan 5
3.4.4.3 Penentuan Bilangan Peroksida
Dimasukkan ke dalam labu Erlenmeyer
Ditambahkan 30ml asam asetat glasial : kloform (3:2)
Ditambahkan 0,5 ml KI jenuh
Ditutup
Dikocok selama 2 menit
Ditambahkan 30ml akuades
Dititrasi dengan larutan Na2S2O3 0,0036 N
Ditambahkan 1 ml indikator amilum 1%
Dititrasi kembali dengan larutan Na2S2O3 0,0036 N
Dicatat volume larutan Na2S2O3 0,0036 N yang terpakai
Dihitung bilangan peroksidanya
Dengan prosedur yang sama dilakukan untuk sampel 2, 3, 4, dan 5.
0,5 g Minyak Sampel 1
Larutan Kuning Pucat
Larutan Bening
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Skrining Fitokimia Ekstrak Etanol Daun Keji Beling
Ekstrak etanol daun keji beling diperoleh dengan metode maserasi menggunakan
pelarut etanol 96 %, diskrining fitokimia untuk mengetahui senyawa metabolit
sekunder golongan alkaloid, fenolik, saponin dan terpen yang ditunjukkan pada
tabel 4.1 sebagai berikut :
Table 4.1 Hasil skrining Fitokimia Ekstrak Etanol Daun Keji Beling
Golongan Pereaksi Hasil Skrining
Fitokimia
Saponin Akuades -
Terpen CeSO4 1% dalam H2SO4
10% -
Fenolik FeCl3 1% +
Alkaloid
Bouchardat +
Wagner +
Meyer -
Dragendorf +
Keterangan :
- : tidak terjadi perubahan warna/endapan
+ : terjadi perubahan warna/endapan
Perubahan warna/endapan menunjukkan adanya kandungan senyawa metabolit
4.1.2 Hasil Uji Aktivitas Antimikroba Ekstrak Etanol Daun Keji Beling
Aktivitas antimikroba ditentukan beradasarkan metode difusi agar.Kemampuan
ekstrak etanol daun keji beling dalam menghambat pertumbuhan mikroba
ditentukan berdasarkan diameter zona bening yang terbentuk disekitar kertas
cakram dan ditentukan dengan menggunakan jangka sorong. Ekstrak etanol daun
keji beling menunjukkan zona bening pada pertumbuhan jamur Candida albicans
dan tidak menunjukkan zona bening yang efektif pada pertumbuhan jamur
Microsporum gypseum, serta bakteri Shigella dysentriae dan Bacillus cereus
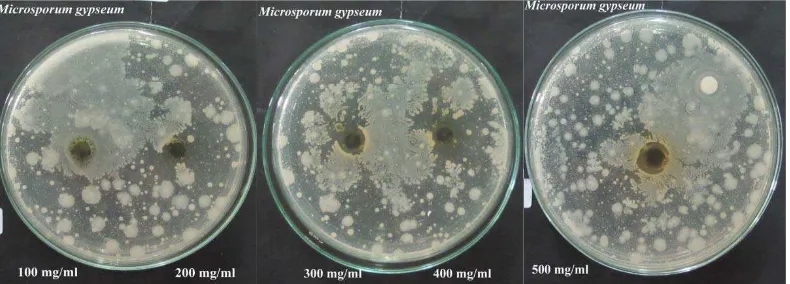
seperti yang ditunjukkan pada gambar berikut ini :
Gambar 4.1 Zona Hambat Jamur Candida albicans
Gambar 4.3 Zona Hambat Bakteri Bacillus cereus
Gambar 4.4 Zona Hambat Bakteri Shigella dysentriae
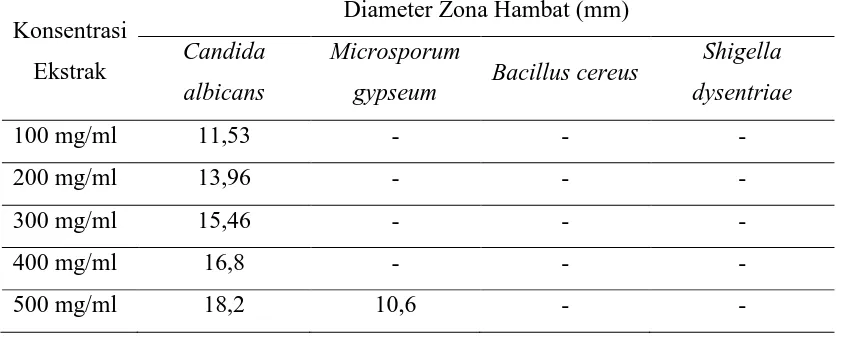
Adapun hasil pengukuran diameter zona bening dari mikroba tersebut yang
ditunjukkan pada tabel 4.2 berikut ini :
Tabel 4.2 Hasil Pengukuran Diameter Zona Hambat Mikroba
Konsentrasi
Ekstrak
Diameter Zona Hambat (mm)
Candida
albicans
Microsporum
gypseum Bacillus cereus
Shigella
dysentriae
100 mg/ml 11,53 - - -
200 mg/ml 13,96 - - -
300 mg/ml 15,46 - - -
400 mg/ml 16,8 - - -
500 mg/ml 18,2 10,6 - -
Keterangan :
4.1.3 Hasil Uji Aktivitas Antioksidan Ekstrak Etanol Daun Keji Beling
Uji aktivitas antioksidan ekstrak etanol daun keji beling dilakukan dengan metode
radikal bebas DPPH menggunakan spektrofotometer UV-Visible pada panjang
gelombang 517 nm untuk memperoleh nilai IC50, dengan mengamati perubahan
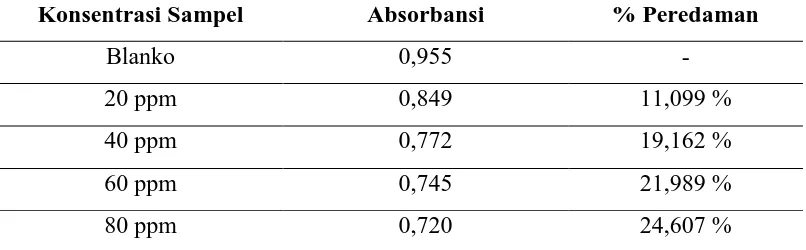
absorbansi pada larutan DPPH yang ditunjukkan pada tabel 4.3 sebagai berikut :
Tabel 4.3 Hasil Pengukuran Absorbansi Ekstrak Etanol Daun Keji Beling
Konsentrasi Sampel Absorbansi % Peredaman
Blanko 0,955 -
20 ppm 0,849 11,099 %
40 ppm 0,772 19,162 %
60 ppm 0,745 21,989 %
80 ppm 0,720 24,607 %
dari persamaan garis linier diperoleh IC50 sebesar 155,2 ppm
4.1.4 Hasil Aplikasi Antioksidan Ekstrak Etanol Daun Keji Beling Terhadap Daging Ikan Nila
Ekstraksi minyak dari daging ikan nila dilakukan dengan menggunakan pelarut
n-heksana : isopropanol. Dimana sebanyak 100 g daging ikan nila ditambahkan
dengan 1 ml ekstrak etanol daun keji beling 20, 40, 60, dan 80 ppm dan disimpan
selama 5 hari pada suhu ± 50 C.
Minyak yang diperoleh dari hasil ekstraksi daging ikan nila yang telah
ditambahkan ekstrak etanol daun keji beling dan tanpa penambahan ekstrak diuji
bilangan peroksida dengan metode titrasi iodometri. Hasil bilangan peroksida
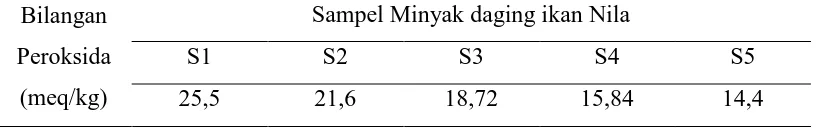
Tabel 4.4 Hasil Penentuan Bilangan Peroksida dari Minyak Daging Ikan Nila
Bilangan
Peroksida
(meq/kg)
Sampel Minyak daging ikan Nila
S1 S2 S3 S4 S5
25,5 21,6 18,72 15,84 14,4
Keterangan :
S1 = Daging ikan nila penyimpanan 5 hari
S2 = Daging ikan nila + ekstrak 20 ppm penyimpanan 5 hari
S3 = Daging ikan nila + ekstrak 40 ppm penyimpanan 5 hari
S4 = Daging ikan nila + ekstrak 60 ppm penyimpanan 5 hari
S5 = Daging ikan nila + ekstrak 80 ppm penyimpanan 5 hari
4.2 Pembahasan
4.2.1 Skrining Fitokimia Kandungan Senyawa Metabolit Sekunder Ekstrak Etanol Daun Keji Beling
Berdasarkan hasil skrining fitokimia, diperoleh bahwa ekstrak etanol daun keji
beling pada golongan saponin dengan penambahan akuades, tidak menunjukkan
adanya pembentukan busa yang stabil saat dikocok.Pada golongan terpen dengan
pereaksi CeSO4 1 % dalam H2SO4 10 %, tidak membentuk endapan berwarna
coklat kemerahan.Pada golongan fenolik dengan pereaksi FeCl3 1 % terbentuk
endapan kehitaman.Pada golongan alkaloid dengan pereaksi Wagner, Bouchardat,
dan Dragendorf terjadi perubahan warna dan pembentukan endapan, sedangkan
dengan pereaksi Meyer tidak terjadi pembentukan endapan putih
kekuningan.Sehingga, ini menunjukkan bahwa ekstrak etanol daun keji beling
mengandung senyawa metabolit sekunder golongan alkaloid dan fenolik.Isnawati,
A dkk (2004) juga telah melakukan penelitian tentang karakterisasi simplisia dan
ekstrak daun Strobilanthus crispus.Hasilnya menunjukkan bahwa ekstrak etanol
daun Strobilanthus crispus positif mengandung senyawa alkaloid dan fenolik.
Aktivitas antimikroba ekstrak etanol daun keji beling terhadap empat jenis
mikroba yaitu Candida albicans, Microspoprum gypseum, Bacillus cereus dan
Shigella dysentriae memberikan hasil zona hambat yang berbeda.Mikroba uji
yang paling sensitif terhadap ekstrak etanol daun keji beling adalah candida
albicans.Mikroba uji Microsporum gypseum, Bacillus cereus dan Shigella
dysentriae tidak dapat dihambat dengan baik oleh ekstrak etanol daun keji beling.
Davis dan Stout dalam Kesuma (2010) mengemukakan bahwa kekuatan
daya antibakteri adalah daerah hambatan 20 mm atau lebih termasuk sangat kuat,
daerah hambatan 10-20 mm kategori kuat, daerah hambatan 5-10 mm kategori
sedang, dan daerah hambatan 5 mm atau kurang termasuk kategori lemah. Adanya
perbedaan diameter zona hambat pada keempat mikroba menunjukkan bahwa
terdapat perbedaan sensitivitas ekstrak pada mikroba uji tersebut. Senyawa yang
bersifat sebagai antimikroba dapat menyebabkan kerusakan pada dinding sel serta
kerusakan pada membran sel berupa denaturasi protein dan lemak yang menyusun
membran sel.
Hasil penelitian menunjukkan bahwa zona hambat terjadi pada jamur
Candida abicans dimulai pada konsentrasi 100 mg/ml dan terus meningkat hingga
konsentrasi 500 mg/ml. Sedangkan pada jamur Microsporum gypseum, zona
hambat terbentuk dimulai pada konsentrasi 500 mg/ml. Hal ini disebabkan karena
jamur Microsporum gypseum merupakan jamur berfilamen yang multiseluler,
sedangkan jamur Candida albicans merupakan jamur uniseluler. Namun, pada
bakteri Bacillus cereus dan Shigella dysentriae tidak mampu dihambat
pertumbuhannya oleh ekstrak etanol daun keji beling.
Hal ini diperkirakan karena berdasarkan hasil skrining fitokimia ekstrak
penelitian ini diduga alkaloid yang lebih berperan terhadap aktivitas antijamur
pada jamur Candida albicans. Alkaloid merupakan suatu senyawa yang bersifat
basa, yang mengandung atom nitrogen. Rahayu et al (2009), mengatakan bahwa
alkaloid memiliki sifat basa pH>7 dan pahit. Sifat basa ini kemungkinan akan
menekan pertumbuhan jamur Candida albicans, karena jamur tersebut tumbuh
pada pH 3,8-5,6.
Pada penelitian ini juga dilakukan pembanding dengan menggunakan
antibiotik Chloramphenicol terhadap bakteri Bacillus cereus dan Shigella
dysentriae serta antibiotik Nystatin terhadap jamur Candida albicans dan
Microsporum gypseum. Antibiotik Chloramphenicol 50 mg/ml menghasilkan
zona hambat sebasar 36,15 mm pada bakteri Bacillus cereus dan 30,63 mm pada
bakteri Shigella dysentriae. Dapat dilihat bahwa, ekstrak etanol daun keji beling
tidak menunjukkan aktivitas sebagai antibakteri jika dibandingkan dengan
antibiotik tersebut.
Berbeda halnya dengan antibiotik Nystatin. 10000 unit Nystatin
menghasilakn zona hambat sebesar 16,37 mm pada jamur Candida albicans dan
12,56 mm pada jamur Microsporum gypseum. Bardasarkan hasil penelitian
menunjukkan bahwa ekstrak etanol daun keji beling pada konsentrasi 400 mg/ml
menunjukkan aktivitas yang sebanding dengan 10000 unit antibiotik Nystatin
pada jamur Candida albicans. Sedangkan pada konsentrasi 500 mg/ml tidak
menunjukkan aktivitas yang sebanding dengan 10000 unit Nystatin pada jamur
Microsporum gypseum.
Adapun zona hambat yang dibentuk oleh antibiotik terhadap pertumbuhan
(a) (b)
(c) (d)
Gambar 4.5 Antibiotik Pembanding Chloramphenicol terhadap bakteri (a) Bacillus cereus (b) Shigella dysentriae
Antibiotik Pembanding Nystatin terhadap jamur (c)
Candida albicans (d) Microsporum gypseum
Ekstrak etanol daun keji beling dilakukan uji aktivitas antioksidan demgan
menggunakan DPPH sebagai radikal sintetik yang stabil dan diukur absorbansinya
dengan menggunakan alat spektrofotometer UV-Visble pada panjang gelombang
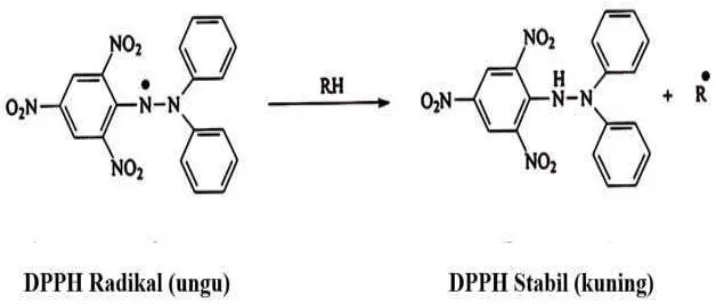
517 nm. Mekanisme umum peredaman radikal bebas DPPH oleh antioksidan
dapat dilihat pada gambar 4.6 sebagai berikut :
Gambar 4.6 Mekanisme Peredaman Radikal DPPH (Yuhernita dan Juniarti. 2011)
Prinsip dari metode DPPH ini adalah inetraksi antara senyawa yang
bersifat sebagai antioksidan dengan DPPH, baik secara transfer elektron ataupun
hidrogen pada DPPH maka akan menetralkan sifat radikal bebas dari DPPH.
Setelah semua elektron pada radikal bebas DPPH berpasangan, maka larutan akan
berubah warna dari ungu tua menjadi kuning terang dan diikuti dengan penurunan
absorbansi pada panjang gelombang 517 nm (Green, R.J. 2004)
Pada tabel 4.3 menunjukkan telah terjadi peredaman radikal bebas DPPH
setelah penambahan ekstrak etanol daun keji beling.Dimana semakin tinggi
konsentrasi ekstrak maka % peredaman semakin tinggi yang disertai dengan
penurunan absorbansi dari larutan radikal bebas DPPH tersebut.
Aktivitas antioksidan dapat dinyatakan dengan Inhibition Concentration 50 %
sebanyak 50 %.Nilai IC50 diperoleh dari persamaan garis regresi setelah
mengganti y dengan 50 (Bendra, A. 2012). Sehingga diperoleh nilai IC50 untuk
ekstrak etanol daun keji beling sebesar 155,2 ppm.
Berdasarkan hasil skrining fitokimia, ekstrak etanol daun keji beling
mengandung senyawa metabolit sekunder golongan alkaloid dan fenolik. Senyawa
fenolik mempunyai gugus –OH yang terikat pada karbon cincin aromatik.
Aktivitas peredaman radikal bebas senyawa fenolik diyakini dipengaruhi oleh
jumlah dan posisi hidrogen fenolik dalam molekulnya. Dengan demikian aktivitas
antioksidan yang lebih tinggi akan dihasilkan pada senyawa fenolik yang
mempunyai jumlah gugus hidroksil yang lebih banyak. Senyawa fenolik ini
mempunyai kemampuan untuk menyumbangkan hidrogen. Produk radikal bebas
yang terbentuk pada senyawa fenolik akan terstabilkan oleh resonansi, sehingga
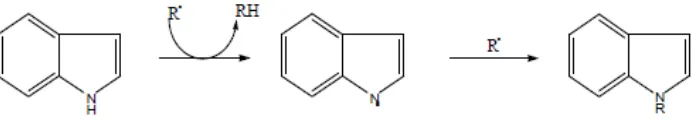
dapat berfungsi sebagai antioksidan yang efektif. Senyawa alkaloid, terutama
indol, memiliki kemampuanuntuk menghentikan reaksi rantai radikal bebas secara
efisien. Mekanisme alkaloid sebagai antioksidan adalah dengan cara mendonorkan
atom hidrogen pada radikal bebas. Beberapa senyawa alkaloid lain yang bersifat
antioksidan adalah quinolon, kafein yang dapat bertindak sebagai peredam radikal
hidroksil dan melatonin yang berperan penting menjaga sel dari pengaruh radiasi
dan toksisitas obat-obatan (Yuhernita dan Juniarti. 2011).
Mekanisme peredaman radikal bebas oleh senyawa fenolik dan alkaloid dapat
dilihat pada gambar 4.7 sebagai berikut :
O O O O
OH + DPPH O + DPPH-H
Gambar 4.8 Mekanisme peredaman radikal bebas oleh senyawa alkaloid (Yuhernita dan Juniarti. 2011)
Berdasarkan penelitian yang dilakukan oleh Yuhernita dan Juniarti (2011),
IC50 untuk vitamin C sebagai kontrol positif antioksidan adalah sebesar 9,23
mg/L. Jika dibandingkan dengan IC50 ekstrak etanol daun keji beling, maka
aktivitas antioksidan nya masih kecil dibandingkan dengan aktivitas antioksidan
dari vitamin C.
4.2.4 Aplikasi Antioksidan Ekstrak Etanol Daun Keji beling Terhadap Daging Ikan Nila
Aktivitas antioksidan ekstrak etanol daun keji beling dengan metode DPPH
menghasilkan nilai IC50 sebesar 155,2 ppm. Sehingga untuk mengetahui pengaruh
sifat antioksidannya, maka ekstrak etanol daun keji beling diaplikasikan terhadap
daging ikan nila yang disimpan selama 5 hari pada suhu ± 50 C. Sifat antioksidan
nya ditentukan dengan bilangan peroksida. Bilangan peroksida adalah bilangan
yang menentukan derajat kerusakan suatu minyak. Asam lemak tak jenuh dalam
minyak diketahui dapat mengikat oksigen pada ikatan rangkapnya sehingga
Pada tabel 4.4 menunjukkan bahwa bilangan peroksida dari minyak dari
daging ikan nila semakin menurun dengan bertambahnya konsentrasi ekstrak
eatnol daun keji beling dan lebih rendah jika dibandingkan dengan kontrol yaitu
minyak dari daging ikan nila tanpa penambahan ekstrak.Hal ini memperlihatkan
bahwa adanya penambahan ekstrak etanol daun keji beling, memberikan pengaruh
untuk menghambat oksidasi yang terjadi.Berdasarkan hasil skrining fitokimia,
ekstrak etanol daun keji beling mengandung senyawa metabolit sekunder
golongan fenolik dan alkaloid yang mampu bersifat sebagai antiokisidan.
Antioksidan mampu menghambat terbentukanya radikal bebas dan
menghambat kelanjutan reaksi autooksidasi.Hal ini desebabkan karena
antioksidan memiliki energi aktivasi yang rendah untuk melepaskan satu atom
hidrogen kepada radikal lemak, sehingga tahap oksidasi lebih lanjut dapat dicegah
(Khamidinal, dkk. 2007).Mekanisme antioksidan dalam menghambat oksidasi
atau menghentikan reaksi berantai pada radikal bebas dari lemak yang teroksidasi,
dapat disebabkan oleh bebrapa macam mekanisme reaksi yaitu, pelepasan
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Ekstrak etanol daun keji beling mengandung senyawa metabolit sekunder
golongan alkaloid dan fenolik.
2. Ekstrak etanol daun keji beling (Strobilanthes crispus BI) memiliki aktivitas
sebagai antimikroba yang efektif terhadap jamur Candida albicans dan tidak
efektif pada jamur Microsporum gypseum, Bakteri Bacillus cereus dan
Shigella dysentriae.
3. Aktivitas antioksidan ekstrak etanol daun keji beling dengan metode DPPH
memiliki nilai IC50 sebesar 155,2ppm. Sifat antioksidan terhadap daging
ikan nila menunjukkan bilangan peroksida yang semakin kecil seiring
dengan penambahan konsentrasi ekstrak etanol daun keji beling yang
semakin besar.
5.2 Saran
Diharapkan dari hasil penelitian yang telah dilakukan, peneliti selanjutnya untuk
menguji aktivitas antimikroba dengan metode dilusi untuk mengetahui konsentrasi
minimum ekstrak yang dapat membunuh mikroba, serta menguji sifat antijamur
BAB 2
TINJAUAN PUSTAKA
2.1 Uraian tumbuhan Keji Beling (Strobilanthes crispus BI)
2.1.1 Deskripsi Tumbuhan
Tumbuhan Keji beling tumbuh liar dihutan, tepi sungai, tebing-tebing dan sering
ditanam sebagai tanaman pagar di pekarangan. Tanaman ini terdapat dari
madagaskar sampai Indonesia, tumbuh pada ketinggian 50 m sampai 1.200 m dpl.
Tumbuhan semak ini memiliki tinggi 0,5-1 m. Batang beruas, bulat, bercabang,
berambut kasar, dan berwarna hijau. Daun tunggal, bertangkai pendek, dengan
letak berhadapan. Helaian daun memanjang atau hampir jorong, tepi bergerigi,
ujung meruncing, pangkal runcing, kedua permukaan kasar, pertulangan menyirip,
panjang 9-18 cm, lebar 3-8 cm, dan berwarna hijau. Perbungaan majemuk,
berkumpul dalam bulir padat. Mahkota bunga berbentuk corong, terbagi 5,
panjang 1,5-2 cm, berambut, dan berwarna kuning. Buah berbentuk gelendong,
berisi 2-4 biji. Biji bulat, pipih, kecil-kecil, berwarna coklat (Dalimartha, 2006).
Tumbuhan keji beling ditunjukkan pada gambar 2.1 sebagai berikut :
2.1.2 Kandungan Senyawa Kimia Tumbuhan
Daun keji beling (Strobilanthes crispus) mengandung alkaloid, tanin dan
flavonoid (Isnawati, A dkk. 2004) . Daun keji beling juga mengandung beberapa
mineral seperti kalium dengan kadar tinggi, asam silikat, natrium dan kalsium
(Dalimartha, 2006).
2.1.3 Sistematika Tumbuhan
Sistematika tumbuhan Keji Beling (Strobilanthes crispus BI)adalah sebagai
berikut :
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dycotiledoneae
Ordo : Scrophulariales
Famili : Achanthaceae
Genus : Strobilanthes
Spesies : Strobilanthes crispus BI
Nama Lokal : Keji Beling (Herbarium Medanense, 2014)
2.1.4 Khasiat Tumbuhan
Daun keji beling memiliki kegunaan sebagai obat disentri, diare (mencret) dan
obat batu ginjal serta dapat juga sebagai penurun kolesterol. Daun keji beling juga
kerap digunakan untuk mengatasi tubuh yang gatal kena ulat atau semut hitam,
caranya dengan cara mengoleskan langsung daun keji beling pada bagian yang
gatal tersebut. Untuk mengatasi diare, disentri, seluruh bagian dari tanaman ini
Sama juga prosesnya untuk mengobati batu ginjal. Daun keji beling juga
dapat mengatasi kencing manis dengan cara dimakan sebagai lalapan secara
teratur setiap hari. Daun tanaman ini selain direbus untuk diminum airnya, juga
dapat dimakan sebagai lalapan setiap hari dan dilakukan secara teratur untuk
mengobati penyakit lever (sakit kuning), ambien (wasir) dan maag dengan cara
dimakan secara teratur (Nursiyah, 2013).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga
terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Sampel yang
diekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak
dapat larut seperti serat, protein dan lain-lain. Senyawa aktif yang terdapat dalam
berbagai sampel dapat digolongkan ke dalam golongan minyak atsiri, alkaloid,
flavonoid dan lain-lain.
Prosedur ekstraksi yang digunakan bertujuan untuk mendapatkan senyawa
yang diinginkan dan untuk menghilangkan komponen yang tidak diinginkan dari
tanaman menggunakan pelarut yang selektif. Tanaman yang diekstrak
mengandung campuran kompleks dari metabolit seperti alkaloida, glikosida,
terpenoid, flavonoid.
Metode ekstraksi dengan maserasi adalah proses pengekstrakkan sampel
dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan
pada temperatur ruangan. Maserasi kinetik berarti dilakukan pengadukan yang
kontinu (terus-menerus). Remaserasi berarti dilakukan pengulangan penambahan
pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya (Depkes.
2.3 Senyawa Metabolit Sekunder
Senyawa metabolit pada makhluk hidup dapat dikelompokkan menjadi dua yaitu,
senyawa metabolit primer dan senyawa metabolit sekunder. Senyawa Metabolit
primer didefinisikan sebagai produk akhir dalam proses metabolisme makhluk
hidup yang fungsinya sangat esensial bagi kelangsungan hidup organisme
tersebut, serta terbentuk secara intraseluler. Contohnya, protein, lemak,
karbohidrat dan DNA. Sedangkan senyawa metabolit sekunder dapat didefinisikan
sebagai suatu produk metabolik yang dihasilkan oleh proses metabolisme
sekunder makhluk hidup, dimana produk tersebut bukan merupakan kebutuhan
pokok untuk hidup dan tumbuh, serta terbentuk secara ekstraseluler. Metabolit
sekunder banyak bermanfaat bagi manusia, dan makhluk hidup lain karena banyak
diantaranya bersifat sebagai obat, vitamin, pigmen (Pratiwi, S.T. 2008)
Skrining fitokimia merupakan uji kualitatif kandungan kimia dalam suatu
tumbuhan untuk mengetahui golongan senyawa metabolit sekunder yang
terkandung didalam tumbuhan tersebut. Senyawa metabolit sekunder yang
memiliki khasiat untuk kesehatan diantaranya alkaloid, flavonoid, terpenoid,
tannin, dan saponin.
2.3.1 Flavonoid
Flavonoid adalah senyawa yang terdiri dari 15 atom karbon. Flavonoid umumnya
terdapat pada tumbuhan sebagai glikosida. Gugusan gula bersenyawa pada satu
atau lebih gugus hidroksil fenolik. Flavonoid terdapat pada seluruh bagian
tumbuhan termasuk pada buah, tepung sari dan akar. Flavonoid dapat bekerja
sebagai diuretik dan sebagai antioksidan pada lemak (Sirait, 2000). Sejumlah
flavonoid mempunyai rasa pahit hingga dapat menolak sejenis ulat tertentu
(Sastrohamidjojo, 1996). Pemeriksaan senyawa flavonoid dapat dilakukan dengan
menambahkan larutan besi (III) klorida 1% dalam air atau etanol yang
menimbulkan warna hijau, merah ungu, ataupun hitam kuat (Mailandari, 2012)
Alkaloid adalah metabolit basa yang mengandung satu atau lebih atom nitrogen
yang biasanya dalam gabungan berbentuk siklik. Alkaloid umumnya memiliki
sifat padatan kristal, sedikit alkaloid berbentuk amorf, dan sebagian ada yang cair,
bersifat basa, berasa pahit, kebanyakan alkaloid tidak berwarna tetapi bebrapa
senyawa yang kompleks spesies aromatik berwarna. Pada umumnya basa bebas
alkaloid hanya larut dalam pelarut organik, tetapi ada bebrapa yang dapat larut
dalam air (Sastrohamidjojo, 1996). Alkaloid dapat dideteksi dengan menggunakan
pereaksi Dragendorf, Mayer, dan Bouchardat (Mailandari, 2012)
2.3.3 Terpen
Terpen adalah suatu senyawa yang tersusun atas isoprene dan kerangka karbonnya
dibangun oleh penyambungan dua atau lebih satuan C5. Terpenoid terdiri atas
beberapa macam senyawa seperti monoterpene dan seskuiterpen yang mudah
menguap, diterpen yang sukar menguap dan yang tidak menguap triterpene dan
sterol. Secara umum senyawa ini larut dalam lemak dan terdapat dalam sitoplasma
sel tumbuhan. Biasanya senyawa ini diidentifikasi dengan pereaksi
Liberman-Buchard (anhidrat asetat-asam sulfat) yang memberikan warna hijau kehitaman
sampai biru (Mailandari, 2012)
2.3.4 Saponin
Pembentukan busa sewaktu mengekstraksi tumbuhan atau pada saat memekatkan
ekstrak tumbuhan merupakan bukti akan adanya saponin. Uji saponin yang
sederhana adalah mengocok ekstrak alkohol-air dari tumbuhan dalam tabung
reaksi dan diperhatikan apakah ada terbentuk busa tahan lama pada permukaan
cairan. Saponin juga dapat diperiksa dalam ekstrak kasar berdasarkan
kemampuannya menghemolisis sel darah (Harborne, 1996).
Tanin terdapat luas dalam tumbuhan berpembuluh, dalam angiospermae terdapat
khusus dalam jaringan kayu. Tanin dapat bereaksi dengan protein membentuk
kopolimer mantap yang tidak larut dalam air. Didalam tumbuhan letak tannin
terpisah dari protein dan enzim sitoplasma. Sebagian besar tumbuhan yang banyak
bertanin dihindari oleh hewan pemakan tumbuhan karena rasanya yang sepat.
Secara kimiawi tannin merupakan senyawa kompleks yang biasanya merupakan
campuran polifenol (Harborne, 1996). Tannin dapat diidentifikasi dengan
menggunakan larutan larutan besi (III) klorida 1% dan timbal (II) asetat 25%
(Mailandari, 2012)
2.4 Antimikroba
Antimikroba adalah obat pembasmi mikroba, khususnya mikroba yang merugikan
manusia. Berdasarkan jenis mikroorganisme yang dimatikan atau dihambat
pertumbuhannya, antimikroba terbagi menjadi antibakteri, antijamur, antivirus,
dan anti-protozoa. Zat antijamur merupakan bahan yangdapat membasmi jamur
pada umumnya, khususnya yang bersifat patogen bagi manusia. antijamur bekerja
menurut salah satu dari berbagai cara, antara lain menyebabkan kerusakan dinding
sel, perubahan permeabilitas sel, perubahan molekul protein dan asam nukleat,
penghambatan kerja enzim, atau penghambatan sintesis asam nukleat dan protein.
Antibakteri adalah zat yang dapat mengganggu pertumbuhan bahkan dapat
mematikan bakteri dengan cara mengganggu metabolisme bakteri yang
merugikan. Mekanisme kerja antibakteri dapat terjadi melalui bebrapa cara yaitu,
merusak dan menghambat sintesis dinding sel, mengubah permeabilitas sel, dan
menghambat sintesis protein dan asam nukleat (Pelczar, M.J. 1988)
Bakteri adalah mikroorganisme bersel tunggal yang tidak terlihat oleh mata, tetapi
dapat terlihat dengan bantuan mikroskop. Ukuran bakteri berkisar antara panjang
0,5 sampai 10 μ dan lebar 0,5 sampai 2,5 μ (μ = 1 mikron = 0,001 mm) tergantung dari jenisnya. Bakteri terdapat secara luas di lingkungan alam yang berhubungan
dengan hewan, udara, air dan tanah. Bakteri berkembang biak secara aseksual
yaitu dengan proses pembelahan diri menjadi dua (Buckle. 2007).
Sebagian besar mikroorganisme tidak berwarna, sehingga untuk dapat
melakukan pengamatan dibawah mikroskop cahaya diperlukan pewarnaan
mikroorganisme dengan menggunakan pewarna. Pewarnaan diferensial
menggunakan lebih dari satu pewarnadan memiliki reaksi yang berbeda untuk
setiap bakteri, sehinnga digunakan untuk membedakan bakteri.
Pewarnaan diferensial yang sering digunakan adalah pewarnaan gram,
yang diciptakan oleh Hans Christian Gram pada tahun 1884, sehingga dapat
dibedakan menjadi dua kelompok besar bakteri, yaitu bakteri Gram positif dan
Gram negatif. Perbedaan warna antara bakteri Gram positif dan bakteri Gram
negatif disebabkan oleh adanya perbedaan struktur dinding sel (Pratiwi, S.T.
2008)
2.4.2 Bakteri Gram Positif
Bakteri gram positif adalah bakteri yang mempertahankan zat warna crystal
violet-iodin,sewaktu proses pncucian dengan alkohol. Sehingga bakteri jenis ini
akan berwarna ungu dibawah mikroskop. Kompleks warna crystal violet-iodin
yang masuk kedalam sel bakteri Gram positif tidak dapat tercuci oleh alkohol
karena adanya lapisan peptidoglikan yang kokoh pada dinding sel. Bakteri Gram
positif banyak mengandung peptidoglikan (Pratiwi, S.T. 2008)
Bacillus cereus merupakan bakteri gram-positif, aerob fakultatif, dan dapat
membentuk spora.Keracunan makanan karena Bacillus cereus mempunyai dua
bentuk yang berbeda yaitu, jenis muntah yang berkaitan dengan nasi yang
tercemar dan jenis diare yang berkaitan dengan daging dan saus. B. cereus adalah
mikroorganisme tanah yang sering mengkontaminasi nasi. Bila sejumlah nasi
dimasak dan dibiarkan dingin perlahan-lahan, spora B. cereusbertunas dan sel
vegetatif menghasilkan toksin (Jawetz, et al. 2001). Bentuk dan kalsifikasi dari
bakteri B. cereus ditunjukkan pada gambar 2.2 berikut ( Kotiranta A, et al. 2000).
Klasifikasi Bacillus cereus:
Kingdom : Bacteria
Filum : Firmicutes
Kelas : Bacilli
Ordo : Bacillales
Famili : Bacillaceae
Genus : Bacillus
Spesies : Bacillus cereus
Gambar 2.2 Bakteri Bacillus cereus ( Kotiranta A, et al. 2000)
Bakteri Gram negatif adalah bakteri yang tidak dapat mempertahankan zat warna
crystal violet-iodin sewaktu pencucian dengan alkohol. Sehingga bakteri akan
berwarna merah setelah diberi pewarna safranin. Pada bakteri Gram negatif,
alkohol dapat merusak lapisan lipopolisakarida dan menyebabkan sel bakteri
transparan yang kemudian diberi pewarna merah. Dinding sel bakteri Gram
negatif banyak mengandung lipopolisakarida (Pratiwi, S.T. 2008)
2.4.3.1Shigella dysenteriae
Habitat alami Shigella terbatas pada sistem saluran intestinal manusia, dan
binatang menyusui, dimana mereka menghasilkan disentri basillus. Shigella
merupakan batang gram negatif yang tipis, berbentuk coccobacilli terjadi pada
pembenihan muda. Shigella merupakan fakultatif anaerob, tetapi tumbuh baik
secara aerob. Koloni shigella cembung, bundar, transparan dengan diameter
sampai kira-kira 2 mm dalam 24 jam. Shigella dapat menular. Dosis menular
adalah 103 organisme. Semua Shigella mengeluarkan toksin liposakaridanya yang
berpengaruh pada iritasi dinding usus (jawetz, et al. 2001). Bentuk dan kalsifikasi
dari bakteri Shigella ditunjukkan pada gambar 2.3 berikut (Hale, T.L and Keusch,
G.T. 1996).
Klasifikasi Shigella :
Kingdom : Bakteria
Filum : Proteobakteria
Kelas : Gamma Proteobakteria
Ordo : Enterobakteriales
Famili : Enterobakteriaceae
Genus : Shigella
Spesies : Shigella boydii
Shigella dysentriae
Shigella flexneri
Gambar 2.3 Bakteri Shigella dysentriae (Hale, T.L and Keusch, G.T. 1996)
2.4.4 Jamur
Jamur (fungi) merupakan organisme kemoheterotrof yang memerlukan senyawa
organik untuk nutrisinya (sumber karbon dan energi). Beberapa fungi dapat
bersifat menguntungkan yaitu sebagai elemen daur ulang dan dapat bersifat
merugikan karena menimbulkan penyakit bagi manusia, hewan dan tumbuhan.
Fungi bereporoduksi baik secara aseksual maupun seksual. Fungi tumbuh dalam
kisaran temperatur yang luas, dengan temperatur optimal berkisar antara 22-300 .
Spesies fungi patogenik mempunyai temperatur pertumbuhan optimal lebih tinggi
yaitu berkisar antatra 30-370 C. Fungi tumbuh baik pada pH ± 5 (Pratiwi, S.T.
2008)
2.4.4.1Candida albicans
Candida merupakan flora normal dan banyak tersebar di dalam tubuh terutama di
membran mukosa saluran pencernaan (24 %) dan mukosa vagina (5-11 %). Jamur
ini bersifat oportunistik dan beberapa spesies Candida dapat menyebabkan infeksi
seperti C. tropicalis, C. glablata dan terutama C. albicans sebagai spesies yang
paling sering menyebabkan infeksi. Pada pemeriksaan mikroskopis dengan
pewarnaan Gram-positif dapat ditemukan Candida albicans dalam bentuk yeast,
C. albicans sering juga ditemukan dalam bentuk mycelium. C. albicans
dapat tumbuh baik pada media agar Saboroud, tetapi dapatjuga tumbuh pada
media kultur biasa. Setelah proses inkubasi, pada media agar terlihat koloni C.
albicans berbentuk bulat, berwarna putih dengan permukaan koloni yang terlihat
agak kasar (Riskillah, A.G. 2010). Bentuk dan klasifikasi dari jamur C.albicans
ditunjukkan pada gambar 2.4 berikut (McClary and Otho. 1952)
Klasifikasi Candida albicans:
Kingdom : Fungi
Divisi : Ascomycota
Kelas : Saccharomycetes
Ordo : Saccharomycetales
Famili : Saccharomycetaceae
Genus : Candida
Spesies : Candida albicans
Gambar 2.4 Jamur Candida albicans (McClary and Otho. 1952)
2.4.4.2Microsporum gypseum
Koloni dari Microsporum gypseum tumbuh dengan cepat, menyebar dengan
permukaan yang mendatar.Microsporum gypseum merupakan penyebab penyakit
kulit, pemakan zat tandukatau keratin, serta merusak kuku dan rambut.Jamur
microsporum gypseum dapatditularkan secara langsung. Penularan langsung dapat
secara fomitis, epitel, rambut-rambut yang mengandung jamur baik dari manusia,
Bentuk dan kalsifikasi dari jamur Microsporum gypseum ditunjukkan pada
gambar 2.5 sebagai berikut (Currah, R. 1985).
Klasifikasi Microsporum gypseum:
Kingdom : Fungi
Divisi : Ascomycota
Kelas : Eurotiomycetes
Ordo : Onygenales
Famili : Arthrodermataceae
Genus : Microsporum
Spesies : Microsporum gypseum
Gambar 2.5 Jamur Microsporum gypseum(Currah, R. 1985)
2.4.5 Metode Pengukutan Aktivitas Antimikroba
Penentuan kepekaan bakteri patogen terhadap antimikroba dapat dilakukan
dengan salah satu dari dua metode pokok yaitu metode dilusi atau difusi.
1. Metode dilusi mengggunakan antimikroba dengan kadar yang menurun
secara bertahap, baik dengan media cair atau padat. Kemudian media
diinokulasi bakteri uji dan diinkubasi. Tahap akhir antimikroba yang
Uji kepekaan dengan cara dilusi agar memakan waktu dan penggunaannya
dibatasi. Uji kepekaan cara dilusi cair yang menggunakan tabung reaksi,
tidak praktis dan jarang dipakai. Keuntungan dari metode ini adalah uji ini
memberi hasil kuantitatif yang menunjukkan jumlah antimikroba yang
dibutuhkan untuk mematikan bakteri.
2. Metode difusi yang paling sering digunakan adalah metode difusi agar.
Cakram kertas yang berisi sejumlah antimikroba ditempatkan pada media
padat yang sebelumnya telah diinokulasi bakteri uji pada permukaannya.
Setelah inkubasi, diameter zona hambatan sekitar cakram dipergunakan
untuk mengukur kekuatan hambatan senyawa antimikroba terhadp
mikroba uji (Jawetz, et al. 2001)
2.5Antioksidan
2.5.1 Pengertian Antioksidan
Dalam pengertian secara kimia, antioksidan adalah senyawa pemberi elektron
(electron donors). Sedangkan secara biologis, antioksidan didefinisikan sebagai
senyawa yang mampu menangkal atau meredam dampak negatif oksidan dalam
tubuh. Antioksidan bekerja dengan cara mendonorkan satu elektronnya kepada
senyawa yang bersifat oksidan sehingga aktivitas senyawa oksidan tersebut dapat
dihambat (Winarsi, 2007).
Antioksidan merupakan senyawa yang mampu membersihkan,
menghilangkan dan menahan pembentukan oksigen reaktif atau radikal bebas
dalam tubuh. Radikal bebas adalah atom atau molekul yang tidak stabil karena
memiliki elektron yang tidak berpasangan dalam orbital luarnya, sehingga sangat
reaktif untuk mendapatkan pasangan elektron dengan mengikat sel-sel tubuh.
Proses pengambilan elektron dari sel-sel tubuh menyebabkan kerusakan sel.
Antioksidan inilah yang mampu mengubah sel-sel tubuh menjadi pengaman untuk
Berdasarkan sumbernya, antioksidan dapat dikelompokkan menjadi dua
kelompok, yaitu antioksidan sintetik dan antioksidan alami. Antioksidan sintetik
adalah antioksidan yang diperoleh dari hasil sintesa reaksi kimia, contohnya Butil
Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT) dan lain-lain. Sedangkan
antioksidan alami adalah antioksidan yang diperoleh dari hasil ekstraksi bahan
alami tumbuhan yang umumnya adalah senyawa fenolik atau polifenolik yang
dapat berupa golongan flavonoid, kumarin, dan tokoferol (Windono. 2001).
Secara umum, berdasarkan mekanisme kerjanya antioksidan digolongkan
menjadi 3 kelompok, yaitu :
1. Antioksidan primer
Antioksidan primer meliputi enzim superoksida dismutase (SOD),
katalase, glutation peroksidase (GSH-Px). Suatu senyawa dikatakan antioksidan
primer, apabila senyawa tersebut dapat memberikan atom hydrogen secara cepat
kepada senyawa radikal, kemudian radikal antioksidan yang terbentuk segera
berubah menjadi senyawa yang lebih stabil. Antioksidan primer bekerja dengan
cara mencegah pembentukan senyawa radikal bebas baru, atau mengubah radikal
bebas yang telah terbentuk menjadi molekul yang kurang reaktif (Winarsi, 2007).
2. Antioksidan sekunder
Antioksidan sekunder bekerja dengan cara memotong reaksi oksidasi
berantai dari radikal bebas atau dengan cara menangkapnya sehingga radikal
bebas tidak akan bereaksi dengan komponen seluler. Antioksidan sekunder ini
meliputi vitamin E, vitamin C, -karoten, flavonoid, asam urat, bilirubin, dan
albumin. Vitamin C, karotenoid dan lainnya banyak terdapat dalam sayur dan
buah-buahan (Winarsi, 2007). Oleh sebab itu untuk memperoleh antioksidan
tersebut diperlukan asupan sayur-sayuran, buah-buahan dalam jumlah yang tinggi.
3. Antioksidan tersier
Kelompok antioksidan tersier ini meliputi system enzim DNA-repair dan
metionin sulfoksida reductase. Enzim-enzim ini atau antioksidan tersier ini
berfungsi dalam perbaikan biomolekuler yang rusak akibat reaktivitas radikal
2.5.2 Metode Pengukuran Aktivitas Antioksidan dengan Metode DPPH
Pengukuran aktivitas antioksidan dapat dilakukan dengan berbagai metode. Salah
satunya adalah dengan metode DPPH (2,2-diphenyl-1-picryl-hydrazil). Metode
menggunakan DPPH yang bertindak sebagai radikal bebas merupakan metode
yang paling sering digunakan untuk pengukuran aktivitas antioksidan dari
berbagai tanaman obat.
Interaksi antioksidan dengan DPPH baik secara transfer elektron atau
radikal hidrogen pada DPPH akan menetralkan karakter radikal bebas dari DPPH.
Prinsip dari metode DPPH adalah penghilangan warna untuk mengukur aktivitas
antioksidan yang langsung menjangkau radikal DPPH dengan pemantauan
absorbansi pada panjang gelombang 517 nm menggunakan spektrofotometer.
Aktivitas antioksidan tersebut dinyatakan sebagai konsentrasi inhibisi
(Inhibition Concentration) atau IC50. IC 50 adalah nilai yang menunjukkan
kemampuan penghambatan proses oksidasi sebesar 50% suatu konsentrasi sampel
(ppm). Nilai IC50 yang semakin kecil menunjukkan semakin tingginya aktivitas
antioksidan. Suatu senyawa dapat dikatakan memiliki aktivitas antioksidan yang
sangat kuat apabila nilai IC50 kurang dari 50 ppm, antioksidan kuat jika IC50
bernilai 50-100 ppm, antioksidan sedang jika IC50 bernilai 100-150 ppm, dan
antioksidan dikatakan lemah jika IC50 bernilai 151-200 ppm (Blois, 1958).
2.5.3 Aplikasi Sifat Antioksidan terhadap Daging Ikan Nila
Ikan nila merupakan jenis ikan konsumsi air tawar dengan bentuk tubuh
memanjang dan pipih kesamping dan warna putih kehitaman. Ikan nila berasal
dari Sungal Nil dan danau-dana sekitarnya. Sekarang ikan ini telah tersebar ke
Klasifikasi ikan nila adalah sebagai berikut:
Kelas : Osteichthyes
Sub-kelas : Acanthoptherigii
Ordo : Percomorphi
Sub-ordo : Percoidea
Famili : Cichlidae
Genus : Oreochromis
Spesies : Oreochromis niloticus.
Terdapat 3 jenis nila yang dikenal, yaitu: nila biasa, nila merah (nirah) dan nila
Albino (Deputi Menegristek).
Ikan banyak mengandung asam lemak tak jenuh seperti misalnya asam
lemak omega-3, omega-6. Asam-asam lemak tak jenuh sangat mudah mengalami
proses oksidasi. Penyimpanan ikan yang kurang baik, dapat menyebabkan
perubahan fisik maupun komposisi kimianya. Asam-asam lemak tak jenuh pada
ikan yang rentan teroksidasi menghasilkan hidroperoksida dan hasil uraian lain
seperti aldehid dan keton yang dapat meyebabkan mutu ikan segar menurun
(Khamidinal, dkk. 2007)
Kerusakan lemak atau minyak yang utama adalah karena peristiwa
oksidasi dan hidrolitik. Secara umum yang membedakan antara ketengikan
hidrolitikdan oksidatif selain kadar air adalah kondisi suhu dimana
produkmakanan tersebut disimpan. Biasanya ketengikan hidrolitik tidak terjadi
pada penyimpanan suhu rendah, sedangkan ketengikan oksidatif masih bisa
berlangsung pada suhu rendah sekalipun.
Bilangan peroksida merupakan nilai terpenting untuk menentukan derajat
kerusakan pada minyak atau lemak. Asam lemak tak jenuh dapat mengikat
oksigen pada ikatan rangkapnya sehingga membentuk peroksida.peroksida ini
dapat ditentukan dengan metode iodometri. Cara yang paling sering dilakukan
untuk mentukan bilangan peroksida adalah berdasarkan pada reaksi antara alkali
iodida dalam larutan asam dengan ikatan peroksida. Iod yang dibebaskan pada
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan salah satu negara di dunia yang kaya akan sumber daya
alam tumbuh-tumbuhan. Jumlah spesies tumbuhan yang tersebar di seluruh
Nusantara Indonesia diperkirakan sekitar 40.000 jenis dan lebih kurang 1000
spesies telah terpakai sebagai obat tradisional (Hargono. 2012). Akhir-akhir ini
penggunaan tumbuhan herbal mulai dikembangkan kembali dalam upaya upaya
penggalian potensi alam untuk mencari bahan baku obat dengan memanfaatkan
tumbuhan yang umumnya telah diketahui manfaatnya oleh masyarakat. Salah satu
tumbuhan yang telah digunakan sebagai obat tradisional oleh masyarakat adalah
tumbuhan Keji Beling.
Keji beling merupakan salah satu tumbuhan yang dapat dimanfaatkan
sebagai obat-obatan.Tumbuhan keji beling adalah jenis tumbuhan yang biasa
ditanam masyarakat sebagai tumbuhan pagar dan dapat tumbuh hampir diseluruh
wilayah Indonesia. Tumbuuhan keji beling juga merupakan tumbuhan herbal liar
yang hidup menahun dan memiliki banyak manfaat bagi kesehatan dalam
penyembuhan beberapa penyakit (Gunawan. 2011)
Dari berbagai penelitian diketahui tanaman Keji Beling mengandung
zat-zat kimia antara lain : kalium, natrium, kalsium, asam silikat, alkaloida, saponin,
flavonoida, dan polifenol, terutama pada bagian daunnya. Bagian daun yang
diolah menjadi simplisia atau sebagai daun segar, digunakan sebagai bahan
racikan jamu atau obat-obatan. Ramuan keji beling untuk mengobati beberapa
jenis penyakit antara lain batu ginjal, infeksi ginjal, tumor, diabetes melitus,
prostat ambeien, gangguan fungsi lever, kolesterol tinggi, maag, diare, serta