ELIMINASI
Onion yellow dwarf virus
DAN
Garlic common latent virus
PADA BAWANG PUTIH MELALUI ELEKTROTERAPI DAN
TERMOTERAPI SECARA
IN VITRO
SITI SHOFIYA NASUTION
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Eliminasi Onion yellow dwarf virus dan Garlic common latent virus pada Bawang Putih melalui Elektroterapi dan Termoterapi secara In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dan dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017
Siti Shofiya Nasution
RINGKASAN
SITI SHOFIYA NASUTION. Eliminasi Onion yellow dwarf virus dan Garlic common latent virus pada Bawang Putih melalui Elektroterapi dan Termoterapi secara In Vitro. Dibimbing oleh SRI HENDRASTUTI HIDAYAT dan DINY DINARTI.
Bawang putih (Allium sativum) merupakan salah satu komoditas hortikultura yang digunakan sebagai bumbu di sebagian besar masakan Indonesia. Bawang putih diperbanyak secara vegetatif sehingga diduga tidak ada klon atau benih yang bebas dari penyakit. Beberapa jenis patogen diketahui dapat menular antar tanaman melalui perbanyakan vegetatif termasuk virus. Tanaman bawang putih dapat terinfeksi oleh virus dari 5 kelompok genus yaitu Allexivirus (Garlic virus-A, GarV-A; Garlic virus-B, GarV-B; Garlic virus-C, GarV-C; Garlic virus-D, GarV-D; Garlic virus-E, GarV-E; Garlic virus-X, GarV-X; Shallot virus X, ShVX; dan
Garlic mite-borne filamentous virus, GarMbFV), Potyvirus (Onion yellow dwarf virus, OYDV; dan Leek yellow stripe virus, LYSV), Carlavirus (Garlic common latent virus, GarCLV atau GCLV; dan Shallot latent virus, SLV), Tospovirus (Irish yellow spot virus, IYSV), dan Fijivirus (Garlic dwarf virus, GDV). Beberapa jenis virus yang menginfeksi bawang putih tersebut dilaporkan dapat menyebabkan kehilangan hasil. Oleh karena itu, perlu upaya preventif untuk mengurangi insidensi penyakit virus melalui penggunaan benih bebas virus.
Tujuan penelitian adalah untuk mendapatkan metode eliminasi OYDV dan GarCLV pada bahan perbanyakan bibit bawang putih melalui aplikasi kombinasi elektroterapi dan termoterapi secara in vitro. Penelitian dilaksanakan mulai Desember 2015 sampai September 2016 di Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman dan Laboratorium Kultur Jaringan 3 Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Sampel benih bawang putih lokal diperoleh dari penangkar umbi bawang putih; terdiri atas 4 kultivar yaitu cv. Lumbu Kuning dan cv. Lumbu Hijau dari Jawa Timur, cv. Tawangmangu Baru dari Jawa Tengah, dan cv. Sangga Sembalun dari Nusa Tenggara Barat, sedangkan bawang putih konsumsi impor diperoleh dari supermarket.
terbentuk siap diaklimatisasi menggunakan media arang sekam steril selama 2 minggu di laboratorium. Deteksi virus dilakukan pada tanaman bawang putih hasil aklimatisasi menggunakan metode reverse transcription polymerase chain reaction
(RT-PCR).
Deteksi virus dari sampel bawang putih lokal menunjukkan hasil yang beragam antar sampel bawang putih. Total insidensi virus sangat tinggi, yaitu 100% pada cv. Sangga Sembalun, 98% pada cv. Lumbu Hijau, 96% pada cv. Tawangmangu Baru, dan 92% pada cv. Lumbu Kuning, sedangkan pada bawang putih konsumsi impor insidensi virus 100%. Lebih dari satu jenis virus ditemukan pada satu tanaman bawang putih. Jenis virus yang paling banyak menginfeksi bawang putih lokal adalah OYDV, baik secara tunggal (43.5%) maupun bersama dengan GarCLV (43.5%), SLV (1%), GarCLV dan SLV (1.5%). Infeksi tunggal GarCLV dan SLV dideteksi dari sampel bawang putih, yaitu berturut-turut sebanyak 5.5% dan 1.5%, tetapi infeksi campuran keduanya tidak ditemukan, sedangkan pada bawang putih konsumsi impor terinfeksi OYDV, GarCLV, dan SLV sebesar 100%.
Pengamatan tanaman setelah perlakuan suhu menunjukkan bahwa suhu berpengaruh nyata terhadap persentase hidup eksplan, sedangkan elektroterapi tidak berpengaruh nyata. Eksplan hidup mencapai 100%, kecuali pada perlakuan suhu 38 °C menyebabkan eksplan mati. Suhu tinggi dapat memberikan pengaruh yang kurang baik terhadap jaringan tanaman. Jumlah daun dan tinggi tanaman pada kedua kultivar dipengaruhi oleh termoterapi. Peningkatan suhu menyebabkan penurunan pertumbuhan tanaman pada kedua kultivar. Pada cv. Lumbu Hijau, elektroterapi memberikan pengaruh nyata terhadap jumlah daun, sedangkan interaksi antara kedua faktor tidak memberikan pengaruh nyata terhadap kedua parameter tersebut. Kondisi yang berbeda terjadi pada cv. Sangga Sembalun, elektroterapi tidak memberikan pengaruh nyata terhadap jumlah daun, tetapi interaksi kedua perlakuan memberikan pengaruh nyata terhadap jumlah daun dan tinggi tanaman.
Perlakuan suhu memberikan pengaruh nyata terhadap persentase tanaman bebas OYDV, sedangkan perlakuan elektroterapi dan interaksi kedua perlakuan tidak memberikan pengaruh nyata terhadap persentase tanaman bebas OYDV. Hasil penelitian menunjukkan bahwa termoterapi 33 oC merupakan perlakuan terbaik dalam mengeliminasi OYDV pada umbi bawang putih meskipun tingkat efisiensi berbeda pada setiap kultivar. Efisiensi eliminasi OYDV mencapai 60% pada cv. Lumbu Hijau, sedangkan cv. Sangga Sembalun 40%. Sementara itu, semua perlakuan dapat mengeliminasi GarCLV sebesar 100% pada kedua kultivar. Berdasarkan hasil tersebut dapat disimpulkan bahwa kultur ujung tunas2 mm dapat menekan insidensi GarCLV. Penelitian lanjutan dibutuhkan dalam meningkatkan dan mengoptimasi metode termoterapi untuk mendapatkan bahan tanaman bebas virus tanpa menurunkan pertumbuhan planlet.
SUMMARY
SITI SHOFIYA NASUTION. In Vitro Elimination of Onion yellow dwarf virus and
Garlic common latent virus Infecting Garlic using Electrotherapy and Thermoterapy. Supervised by SRI HENDRASTUTI HIDAYAT and DINY DINARTI.
Garlic (Allium sativum) is an important commodity in Indonesian as it always become spices in food. Garlics are propagated via vegetative materials, therefore it is difficult to find clones or disease-free bulbs. Many pathogens can be transmitted through vegetative propagation including viruses. Garlic plants can be infected by viruses belonging to five different genera, i.e. Allexivirus (Garlic virus-A, GarV-A;
Garlic virus-B, GarV-B; Garlic virus-C, GarV-C; Garlic virus-D, GarV-D; Garlic virus-E, GarV-E; Garlic virus-X, GarV-X; Shallot virus X, ShVX; and Garlic mite-borne filamentous virus, GarMbFV), Potyvirus (Onion yellow dwarf virus, OYDV; and Leek yellow stripe virus, LYSV), Carlavirus (Garlic common latent virus,
GarCLV or GCLV; and Shallot latent virus, SLV), Tospovirus (Irish yellow spot virus, IYSV), and Fijivirus (Garlic dwarf virus, GDV). Virus infection in garlic can seriously reduce crop yields and cloves quality. Therefore, planting virus-free bulbs might help reduce disease incidence in the field.
This research was aimed to develop method for elimination of viruses from garlic bulbs using combination of electrotherapy and thermotherapy in in vitro
propagation approach. Research was conducted since December 2015 to September 2016, in Laboratory of Plant Virology, Departement of Plant Protection, and Laboratory of Tissue Culture 3 Faculty of Agriculture, Bogor Agricultural University (IPB). Four garlic cultivars from seed breeder, i.e. cv. Lumbu Kuning, cv. Lumbu Hijau from East Java, cv. Sangga Sembalun from East Lombok, and cv. Tawangmangu Baru from Central Java were used as seed bulbs. Garlic used for consumption was collected from the market only for virus detection.
Virus detection was first proceeded using dot immunobinding assay (DIBA) method with spesific antibodies for OYDV, GarCLV, and SLV. From each cultivar, 50 bulbs were taken randomly as seed bulbs and grown for three weeks in the laboratory. Leaves was collected for virus detection. Two cultivars with high incidence of viruses were selected as plant material for virus elimination treatment. The adventitious shoots were given electrotherapy treatment, i.e. 0 mA, 5 mA, 10 mA, 15 mA, and 20 mA, each for 10 min. After the treatment, the adventitious shoots were excised from basal plates and were cut to about 2 mm as explant. These explants were then planted in MS (Murashige-skoog) medium and given thermotherapy treatment with 4 treatments level, i.e. 23 oC, 28 oC, 33 oC, and 38 oC with 4 weeks incubation period. Afterward, the shoots were planted into root-initiating media for 2 weeks in the laboratory. Plantlets were planted in sterile husk charcoal media for 2 weeks in laboratory. Virus detection using reverse transcription polymerase chain reaction (RT-PCR) was carried out after acclimatization phase.
was dominant, both in single infection (43.5%), and mixed infection with GarCLV (43%), SLV (1%), GarCLV and SLV (1.5%). Single infection of GarCLV (5.5%) and SLV (1.5%) were detected from garlic sample but the combined infection from both was not found. This was in contrast to garlic consumption samples, i.e. mix infection of OYDV, SLV, and GarCLV was found 100 %.
Thermotherapy gave significant effect to life percentage of explant, meanwhile electrotherapy was not significant. A higher number of developed explants (100%) were obtained, except from thermotherapy at 38 oC. High temperature may adversely affect the plant tissues. The average number of leaves and height of plants were affected by thermotherapy in both cultivars. Increasing the temperature can inhibit plant growth on both cultivars. On cv. Lumbu Hijau, electrotherapy gave significant effect on average number of leaves, meanwhile interaction of thermotherapy and electrotherapy was no significant. On cv. Sangga Sembalun, electrotherapy gave no significant effect on number of leaves, but interaction of both treatments showed significant effect on number of leaves and height of plants.
Thermotherapy treatment showed significant effect on the percentage of OYDV-free plant, while electrotherapy and interaction of both treatments did not significantly affect the percentage of OYDV-free plant. The best temperature to obtain OYDV-free plant was 33 oC although the efficiency to obtain virus-free plant depends on garlic cultivar used. The efficiency of OYDV elimination reached up to 60% and 40% for cv. Lumbu Hijau and cv. Sangga Sembalun, respectively. Meanwhile, all treatments were able to suppress incidence of GarCLV up to 100% on both cultivars. This result indicated that 2 mm-shoot tip culture could suppress GarCLV. Further studies are needed for improvement and optimization of thermotherapy techniques to obtain virus-free material without decreasing multiplication rate of the plantlets.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
SITI SHOFIYA NASUTION
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
ELIMINASI
Onion yellow dwarf virus
DAN
Garlic common latent virus
PADA BAWANG PUTIH MELALUI ELEKTROTERAPI DAN
TERMOTERAPI SECARA
IN VITRO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Ucapan syukur penulis sampaikan kepada Allah SWT atas rahmat dan karunia-Nya sehingga tesis dengan judul “Eliminasi Onion yellow dwarf virus dan
Garlic common latent virus pada Bawang Putih melalui Elektroterapi dan Termoterapi secara In Vitro” ini dapat diselesaikan.
Penulis menyadari banyak pihak yang terlibat dalam penyelesaian tesis ini. Terima kasih penulis ucapkan kepada Prof Dr Ir Sri Hendrastuti Hidayat, MSc dan Dr Ir Diny Dinarti, MSi selaku komisi pembimbing yang memberi arahan, koreksi, saran membangun dan bimbingan, serta dukungan sejak penentuan topik, pelaksanaan penelitian, sampai penyelesaian tesis ini. Penulis juga mengucapkan terima kasih kepada Dr Ir Kikin Hamzah Mutaqin, MSi sebagai dosen penguji. Penulis mengucapkan terima kasih atas dukungan biaya penelitian melalui proyek ACIAR: Increasing Productivity of Allium and Solanaceous Vegetable Crops in Indonesia and Sub-Tropical Australia.
Penulis menyampaikan terima kasih kepada kedua orang tua, Rustam Efendi Nasution dan Lisdawati, kakak Firda Wahyuni Nasution, adik Ahmad Fakhri Nasution, dan Fathin Annisa Nasution yang memberi dukungan penuh kepada penulis sehingga dapat menyelesaikan pendidikan magister. Terima kasih kepada Sari Nurulita SP, MSi yang telah membantu dan membimbing dalam penelitian. Terima kasih kepada Ibu Siti Kholifah sebagai pranata Laboratorium Kultur Jaringan 3. Terima kasih kepada rekan-rekan Fitopatologi 2014, rekan-rekan Laboratorium Virologi Tumbuhan, Laboratorium Kultur Jaringan 3 dan semua pihak yang tidak dapat disebutkan satu persatu atas dukungan dan kebersamaannya selama menjalani studi di PS Fitopatologi IPB. Terima kasih penulis sampaikan kepada seluruh dosen dan tenaga kependidikan di PS Fitopatologi, Departemen Proteksi Tanaman IPB, Fakultas Pertanian IPB.
Semoga tesis ini bermanfaat.
Bogor, Februari 2017
DAFTAR ISI
Onion yellow dwarf virus (OYDV) 4
Garlic common latentvirus (GarCLV) 5
Shallot latent virus (SLV) 5
Metode Deteksi Virus pada Bawang Putih 5
Dot Immunobinding Assay (DIBA) 6
Reverse Transcription Polymerase Chain Reaction (RT-PCR) 6
Elektroterapi 7
Termoterapi 7
3 BAHAN DAN METODE 9
Waktu dan Tempat 9
Metode 9
Pengumpulan Sampel Umbi Bawang Putih 9
Deteksi Virus pada Sampel Bawang Putih 9
Metode DIBA 10
Metode RT-PCR 10
Eliminasi Virus dari Umbi Bawang Putih 11
Perlakuan Elektroterapi 11
Kultur Jaringan dan Perlakuan Termoterapi 12
Rancangan Percobaan dan Peubah Pengamatan 13
4 HASIL 14
Gejala Penyakit 14
Deteksi Virus pada Tanaman Bawang Putih 15
Pengaruh Elektroterapi dan Termoterapi terhadap Persentase Hidup
Eksplan, Jumlah Daun dan Tinggi Tanaman 17
Pengaruh Termoterapi dan Elektroterapi terhadap Eliminasi OYDV
dan GarCLVpada Tanaman Bawang Putih 20
DAFTAR TABEL
1 Primer yang digunakan untuk amplifikasi OYDV dan GarCLV 11 2 Insidensi beberapa jenis virus pada beberapa kultivar bawang
putih menggunakan metode dot immunobinding assay (DIBA)
15 3 Pengaruh elektroterapi dan termoterapi terhadap persentase hidup
eksplan
17 4 Pengaruh elektroterapi dan termoterapi terhadap rata-rata jumlah
daun pada 4 MST
18 5 Pengaruh elektroterapi dan termoterapi terhadap persentase
tanaman bebas OYDV dan GarCLV
21
DAFTAR GAMBAR
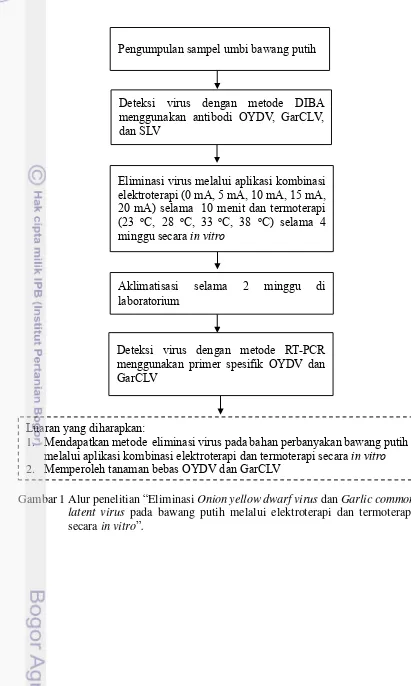
1 Alur penelitian eliminasi Onion yellow dwarf virus dan Garlic common latent virus pada bawang putih melalui elektroterapi dan termoterapi secara in vitro.
3
2 Organisasi genom Onion yellow dwarf virus (OYDV) 4
3 Organisasi genom Carlavirus 5
4 Umbi bawang putih 9
5 Perlakuan elektroterapi pada tunas adventif bawang putih 12
6 Ukuran ujung tunas2 mm 12
7 Gejala pada sampel tanaman bawang putih 14
8 Hasil deteksi sampel daun umbi bawang putih dengan metode DIBA
16 9 Pengaruh termoterapi terhadap eksplan hidup pada 4 MST 18 10 Pengaruh elektroterapi dan termoterapi terhadap tinggi tanaman
bawang putih pada 4 MST secara in vitro
19 11 Gejala pada tanaman bawang putih 2 minggu setelah aklimatisasi 20 12 Hasil amplifikasi RT-PCR tanaman bawang putih setelah
perlakuan elektroterapi dan termoterapi
22
DAFTAR LAMPIRAN
1 PENDAHULUAN
Latar Belakang
Bawang putih (Allium sativum) merupakan salah satu komoditas hortikultura yang digunakan sebagai bumbu di sebagian besar masakan Indonesia serta digunakan untuk kesehatan dan beberapa hal lainnya. Menurut BPS (2015), impor bawang putih pada tahun 2014 mencapai 498 228 ton, sedangkan produksi bawang putih pada tahun 2014 di Indonesia hanya 16 902 ton. Penyebab rendahnya produksi bawang putih lokal diantaranya adalah luas, produktivitas dan kualitas benih bawang putih yang rendah, teknik penyimpanan benih bawang putih kurang memadai, lingkungan tumbuh yang kurang optimum, dan faktor biotik disebabkan oleh organisme pengganggu tanaman (OPT) terutama cendawan dan virus (Wibowo 2006).
Bawang putih selalu diperbanyak secara vegetatif, dimana metode perbanyakan ini dapat menyebabkan penularan patogen sehingga diduga tidak ada klon atau benih yang bebas dari penyakit (Conci et al. 2005). Beberapa jenis patogen diketahui dapat menular antar tanaman melalui perbanyakan vegetatif termasuk virus. Sebanyak 14 virus yang termasuk dalam 5 kelompok genus diketahui dapat menginfeksi bawang putih yaitu kelompok Allexivirus (Garlic virus-A, GarV-A; Garlic virus-B, GarV-B; Garlic virus-C, GarV-C; Garlic
virus-D, GarV-D; Garlic virus-E, GarV-E; Garlic virus-X, GarV-X; Shallot virus X, ShVX; dan Garlic mite-borne filamentous virus, GarMbFV), kelompok Potyvirus
(Onion yellow dwarf virus, OYDV; dan Leek yellow stripevirus, LYSV), kelompok
Carlavirus (Garlic common latent virus, GarCLV atau GCLV; dan Shallot latent virus, SLV), kelompok Tospovirus (Irish yellow spot virus, IYSV), dan kelompok
Fijivirus (Garlic dwarf virus, GDV) (Conci et al. 1992; Van Dijk 1993; Sumi et al.
1993; Barg et al. 1994; Nagakubo et al. 1994; Tsuneyoshi et al. 1998; Chen et al. 2002). Beberapa jenis virus yang menginfeksi bawang putih tersebut dilaporkan dapat menyebabkan kehilangan hasil. Infeksi virus campuran menghasilkan gejala pada daun seperti mosaik, klorotik memanjang, umbi mengecil, dan berkurangnya hasil panen sampai 78% (Walkey & Antil 1989; Lot et al. 1998; Conci et al. 2005; Lunello et al. 2007). Data dan pengetahuan mengenai jenis virus yang menginfeksi tanaman bawang putih di Indonesia masih sangat terbatas.
2
37 °C selama 35 hari dan tidak menyebabkan gangguan pertumbuhan planlet. Soliman et al. (2012) berhasil mengeliminasi OYDV dengan perlakuan tunggal termoterapi pada suhu 38 °C pada umbi bawang putih selama 3 minggu. Efisiensi elektroterapi dan termoterapi sangat bergantung pada jenis tanaman dan virus target. Oleh karena itu perlu dilakukan penelitian dasar untuk mengevaluasi efisiensi kedua perlakuan tersebut terhadap upaya eliminasi virus dari umbi bawang putih.
Perumusan Masalah
Salah satu penyebab rendahnya produktivitas bawang putih secara nasional adalah karena sulitnya mendapatkan umbi yang berkualitas di pasaran. Kualitas umbi ditentukan oleh umur simpan benih, ukuran benih, umbi benih berwarna cerah dan mengkilat, umbi benih sehat, padat, tidak keropos, dan tidak lunak, umbi tidak terserang hama dan penyakit, termasuk yang disebabkan oleh virus. Virus yang menginfeksi umbi bawang putih bersifat sistemik, apabila sudah berada dalam umbi sulit untuk dikendalikan serta dapat membawa masalah baru pada pertanaman berikutnya. Perlakuan elektroterapi dan termoterapi telah digunakan untuk menekan infeksi beberapa jenis virus pada berbagai jenis eksplan. Aplikasi elektroterapi dan termoterapi diharapkan dapat meningkatkan efisiensi eliminasi virus pada tanaman bawang putih sehingga dapat menekan insidensi penyakit akibat infeksi virus pada pertanaman bawang putih di Indonesia.
Tujuan Penelitian
Penelitian dilakukan untuk mendapatkan metode eliminasi virus pada bahan perbanyakan bawang putih melalui aplikasi kombinasi elektroterapi (0 mA, 5 mA, 10 mA, 15 mA, dan 20 mA) dan termoterapi (23 oC, 28 oC, 33 oC, dan 38 oC) secara
in vitro.
Hipotesis
1. Kombinasi perlakuan elektroterapi dan termoterapi pada eksplan bawang putih dapat menurunkan insidensi virus pada bawang putih.
2. Perlakuan elektroterapi dan termoterapi tidak menghambat pertumbuhan eksplan bawang putih.
Manfaat Penelitian
3
Gambar 1 Alur penelitian “Eliminasi Onion yellow dwarf virus dan Garlic common latent virus pada bawang putih melalui elektroterapi dan termoterapi secara in vitro”.
Eliminasi virus melalui aplikasi kombinasi elektroterapi (0 mA, 5 mA, 10 mA, 15 mA, 20 mA) selama 10 menit dan termoterapi (23 oC, 28 oC, 33 oC, 38 oC) selama 4
minggu secara in vitro
Pengumpulan sampel umbi bawang putih
Deteksi virus dengan metode DIBA menggunakan antibodi OYDV, GarCLV, dan SLV
Aklimatisasi selama 2 minggu di laboratorium
Deteksi virus dengan metode RT-PCR menggunakan primer spesifik OYDV dan GarCLV
Luaran yang diharapkan:
1. Mendapatkan metode eliminasi virus pada bahan perbanyakan bawang putih
2 TINJAUAN PUSTAKA
Virus pada Bawang Putih
Tanaman bawang putih diketahui diinfeksi oleh banyak jenis virus dan beberapa jenis virus tersebut menurunkan kualitas dan meningkatkan kehilangan hasil. Kehilangan hasil akibat infeksi virus pada tanaman bawang putih telah dilaporkan sekitar 25-50% (Dovas et al. 2001). Sebanyak 14 virus yang termasuk dalam 5 kelompok genus diketahui dapat menginfeksi bawang putih yaitu kelompok Allexivirus (Garlic virus-A, GarV-A; Garlic virus-B, GarV-B; Garlic virus-C, GarV-C; Garlic virus-D, GarV-D; Garlic virus-E, GarV-E; Garlic
virus-X, GarV-X; Shallot virus X, ShVX; dan Garlic mite-borne filamentous virus, GarMbFV), kelompok Potyvirus (Onion yellow dwarf virus, OYDV; dan Leek yellow stripe virus, LYSV), kelompok Carlavirus (Garlic common latent virus,
GarCLV atau GCLV; dan Shallot latent virus, SLV), kelompok Tospovirus (Irish yellow spot virus, IYSV), dan kelompok Fijivirus (Garlic dwarf virus, GDV) (Conci et al. 1992; van Dijk 1993, Sumi et al. 1993; Barg et al. 1994; Nagakubo et al. 1994; Tsuneyoshi et al. 1998; Chen et al. 2002).
Onion yellow dwarf virus (OYDV)
Onion yellow dwarf virus (OYDV) merupakan virus yang tergolong dalam genus Potyvirus famili Potyviridae yang merupakan famili terbesar dalam virus tanaman dan tergolong positive sense single-stranded RNA (ssRNA(+)). OYDV memiliki partikel virus berbentuk benang, memanjang (filamentous), lentur (flexuous), panjang partikel 772-823 nm dengan berat protein selubung 34 kDa (Takaichi et al. 2001). Virus ini menyerang berbagai jenis bawang, termasuk bawang putih. Infeksi OYDV pada bawang putih dapat mengganggu kualitas dan hasil panen mencapai 60% (Lot et al. 1998). Virus ini memiliki titik panas inaktivasi (TIP) yaitu 60 – 65 oC, batas akhir pengenceran (DEP) yaitu 10-2– 10-4, dan lama penyimpanan in vitro (LIV) 2 – 3 hari (Sutic et al. 1999).
Gambar 2 Organisasi genom Onion yellow dwarf virus (OYDV). VPg: Viral genome-linked protein; P1-Pro: Protein; HC-Pro: Helper component proteinase; P3: Protein; 6K1: Peptida 1; CI: Cylindrical inclusion protein; 6K2: Peptida 2; VPg: Viral genome-linked protein; NIa:
Nuclear inclusion a (proteinase); NIb: Nuclear inclusion b (viral replicase);CP: Coat protein (King et al. 2011).
OYDV ditularkan oleh Myzus persicae dan beberapa famili dari Aphididae
5
melalui bahan perbanyakan vegetatif dari bawang yang terinfeksi, seperti umbi (Diekman 1997).
Gejala infeki OYDV pada tanaman bawang putih menunjukkan garis kuning pada seluruh permukaan daun, klorotik bergaris panjang dengan sedikit warna kuning (van Dijk 1993), daun melengkung ke bawah, memipih, dan mengeriting. Gejala yang ditimbulkan juga akan semakin parah jika infeksi dari virus ini disertai dengan virus lainnya (Diekmann 1997). Menurut Elnagar et al. (2009), infeksi OYDV pada tanaman bawang putih di lapangan dapat menurunkan tinggi pseudo batang, jumlah daun, berat tanaman, berat umbi, jumlah siung, dan berat siung masing-masing sebesar 47.6%, 27.75%, 14%, 56.24%, 58.78%, 47.37% dan 71.92%.
Garlic common latent virus (GarCLV)
Garlic common latent virus (GarCLV atau GCLV) termasuk ke dalam genus
Carlavirus dan termasuk ke dalam famili Betafleviridae yang tergolong positive sense single-stranded RNA (SSRNA(+)). GarCLV memiliki partikel memanjang (filamentous) dan lentur (flexious) sekitar 650 nm (Takaichi et al. 2001; Adams et al. 2004). GarCLV tidak memperlihatkan gejala ketika menginfeksi tunggal tetapi dapat menghasilkan keparahan berat ketika infeksi campuran dengan virus bawang putih lainnya, contohnya Potyvirus. GarCLV ditularkan oleh kutudaun dan melalui perbanyakan vegetatif. Virus ini merupakan virus yang umum menginfeksi bawang putih (Van Dijk 1993). Takaichi et al. (2001) melaporkan bahwa Carlavirus (SLV dan GarCLV) tidak memperlihatkan gejala ketika menginfeksi tanaman bawang putih, tetapi menghasilkan gejala menguning dan mosaik ketika infeksi campuran dengan Potyvirus.
Gambar 3 Organisasi genom Carlavirus. RdRp: RNA dependent RNA polymerase; TGB: Triple gene block; CP: Coat protein; NB: Nucleic acid binding protein (King et al. 2011).
Shallot latent virus (SLV)
Shallot latent virus (SLV) pertama kali dilaporkan di Belanda pada Allium cepa var. ascalonicum (Bos 1982). Virus ini termasuk genus Carlavirus dan tergolong positive sense single-stranded RNA (SSRNA(+)), partikel virus berbentuk filamen sedikit lentur (flexuous) dengan panjang 650 nm. Virus ini dapat ditularkan melalui kutudaun secara nonpersisten, mekanis, dan melalui perbanyakan vegetatif khususnya pada bawang putih dan bawang merah (Diekmann 1997).
Metode Deteksi Virus pada Bawang Putih
6
merupakan langkah awal dalam diagnosis penyebab penyakit oleh virus. Namun, pengamatan gejala saja tidak cukup akurat untuk menentukan virus penyebab suatu penyakit karena gejala yang diduga disebabkan oleh virus bisa saja disebabkan oleh patogen lain, toksisitas serangga, maupun pengaruh faktor abiotik misalnya kekurangan dan kelebihan unsur hara, stres lingkungan dan sebagainya (Agrios 2005).
Metode deteksi yang tepat sangat diperlukan dalam mendeteksi dan mengidentifikasi virus pada suatu tanaman. Deteksi dan identifikasi virus dapat dilakukan berdasarkan karakter biologi dan molekuler. Deteksi virus berdasarkan karakter biologi dapat dilakukan menggunakan tanaman indikator, penularan virus, dan bentuk partikel. Deteksi dan identifikasi menggunakan karakter molekuler dapat dilakukan dengan dua cara yaitu berdasarkan sifat protein melalui uji serologi dan sifat asam nukleat (Foster & Taylor 1998; Hull 2002). Beberapa cara yang digunakan untuk deteksi serologi antara lain presipitasi dalam tabung, gel double-diffusion test, dot immunobinding assay (DIBA), immunoblotting atau western blotting, dan enzyme linked immunosorbent assay (ELISA) (Harlow & Lane 1999).
Dot Immunobinding Assay (DIBA)
DIBA merupakan uji serologi menggunakan membran Nitropure nitrocellulose (NPN) yang sangat efektif mendeteksi dan mendiagnosa virus tanaman. Teknik ini menggunakan gerusan tanaman segar dan diteteskan pada kertas membran (Lin et al. 1990). Metode ini mempunyai tingkat sensitivitas yang tinggi, prosedur yang digunakan sangat sederhana dan dapat digunakan untuk deteksi rutin dengan jumlah sampel yang banyak (Dijkstra & De Jager 1998).
DIBA memiliki prinsip kerja yang hampir sama dengan ELISA, perbedaannya terletak pada antigen atau antibodi yang digunakan, yang nantinya akan berikatan dengan membran nitrocellulose dan menghasilkan suatu reaksi enzim dalam bentuk tak terlarut (Hibi & Saito 1985). Prinsip kerja ELISA adalah antigen (patogen) pada sampel pengujian akan terperangkap secara khusus dan terkunci oleh fase padat dari spesifik antibodi. Antibodi spesifik kemudian akan bereaksi dengan antigen yang telah terkunci, sedangkan antibodi yang tidak bereaksi selanjutnya akan dibersihkan atau dikeluarkan. Antibodi yang telah berikatan kemudian diuji dengan pemberian substrat yang sesuai dan akan memberikan warna yang menunjukkan ada atau tidaknya antigen pada sampel yang diujikan sebagai bentuk pengujian secara kualitatif (Clark 1981).
Metode DIBA telah digunakan untuk mendeteksi virus dengan antibodi spesifik untuk virus OYDV, SLV dan GarCLV pada sampel umbi dan daun tanaman bawang yang diperoleh dari uji pertumbuhan (growing on test) (Wulandari
et al. 2015). Kadwati dan Hidayat (2013) menyatakan bahwa tingkat sensitivitas DIBA dalam mendeteksi Potyvirus cukup sensitif, mampu mendeteksi pengenceran antigen virus mencapai 10-2 dan pengenceran antibodi hingga 10-1 dan 10-2. Mahmood et al. (1997) juga menambahkan metode ini juga cukup sensitif untuk diaplikasikan dan memiliki kesamaan sensitivitas dengan ELISA, akan tetapi lebih sulit dilakukan kuantifikasi.
Reverse Transcription Polymerase Chain Reaction (RT-PCR)
7
dahulu dilakukan proses transkripsi balik (reverse transcription) terhadap molekul RNA sehingga diperoleh molekul cDNA (complementary DNA). Molekul cDNA tersebut kemudian digunakan sebagai cetakan dalam proses PCR. Teknik RT-PCR ini sangat berguna untuk mendeteksi ekspresi gen, untuk amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun untuk diagnosis agensia infektif maupun penyakit genetik (Yuwono 2006).
RT-PCR merupakan teknik yang digunakan untuk mendeteksi virus yang memiliki genom RNA seperti sebagian besar virus tumbuhan sehingga diperlukan modifikasi teknik PCR karena molekul sasarannya adalah RNA. RT-PCR merupakan teknik PCR yang dapat menggandakan RNA menjadi DNA. Teknik RT-PCR terdiri atas dua reaksi yaitu reaksi transkripsi balik (reverse transcription) yang menggunakan genom RNA virus sebagai cetakan dan menghasilkan cDNA primer (untai tunggal) serta reaksi penggandaan PCR. Primer yang digunakan sesuai dengan virus yang akan dideteksi (Akin 2006).
Teknik RT-PCR mempunyai sensitivitas yang lebih tinggi dalam mendeteksi virus tanaman dibandingkan dengan teknik serologi. Hasil deteksi terhadap empat jenis virus tanaman apel menunjukkan bahwa RT-PCR mendeteksi 8.6% lebih banyak sampel yang positif dibandingkan pengujian melalui serologi menggunakan ELISA (Calayani et al. 2006). Takaichi et al. (2001) mengembangkan metode spesifik dan sangat efisien untuk mendeteksi virus utama pada bawang putih seperti Carlavirus, Potyvirus, dan Mite-borne mosaic virus menggunakan metode RT-PCR. Spesifik primer disintesis untuk amplifikasi gen coat protein virus. Identifikasi molekuler dengan teknik RT-PCR juga telah digunakan untuk mengkarakterisasi Garlic latent virus (GarLV), Onion yellow dwarf virus (OYDV) dan Leek yellow stripe virus (LYSV) pada tanaman bawang putih, Shallot yellow stripe virus (SYSV) pada tanaman Allium fistulosum var. caespitosum (Chen et al. 2002).
Elektroterapi
Elektroterapi adalah metode eliminasi virus dengan menggunakan arus listrik. Teknik elektroterapi diterapkan untuk mengganggu atau menurunkan nukleoprotein virus dan menghilangkan aktivitas virulensi virus (Hormozi et al. 2010). Jaringan tanaman yang diberikan perlakuan elektroterapi akan meningkatkan suhu dalam sel. Sebagian protein partikel virus akan terdenaturasi dengan meningkatkan suhu dalam sel (Conzalez et al. 2006). Menurut Lozoya (1996), batang tanaman kentang yang diberi perlakuan elektroterapi dapat meningkatkan suhu batang tanaman kentang sekitar 4 oC sampai 10 oC, suhu ini mungkin menekan aktivitas virus tetapi tidak menghambat metabolisme tumbuhan.
Partikel virus mengalami denaturasi ketika bergerak melewati plasmodesmata (Hull 2002). Inaktivasi struktur nukleoprotein spesifik mencegah penetrasi partikel virus ke bagian sel yang sehat (Conzalez 2006). Menurut Retivin dan Opritov (1992), perlakuan elektroterapi dapat merubah pH dalam cairan batang setelah perlakuan arus listrik yang dapat menghambat replikasi virus.
Termoterapi
8
singkat, tetapi kekurangan dari perlakuan ini tinggi kontaminasi cendawan dan bakteri yang membahayakan berkembangnya eksplan. Perlakuan termoterapi menggunakan udara panas merupakan perlakuan efisien yang dapat digunakan untuk menghasilkan tanaman bebas virus (Torres 2000).
Banyak virus yang dapat dieliminasi dari tanaman inangnya melalui termoterapi. Awalnya perlakuan panas diperlakukan pada keseluruhan tanaman pada suhu konstan yang berkisar dari 35-40 °C. Meskipun banyak tanaman yang mati setelah mendapatkan perlakuan ini, beberapa tanaman yang bertahan dapat menjadi tanaman yang bebas virus. Metode tersebut dapat mengurangi jumlah virus pada suhu yang tinggi. Suhu yang lebih tinggi dari suhu optimal yang digunakan untuk pertumbuhan tanaman dapat menekan multiplikasi patogen dan meningkatkan degradasi RNA virus (Wang & Valkonen 2008).
Perlakuan termoterapi dapat menghambat replikasi virus di dalam tanaman, translokasi virus. Perlakuan panas dengan suhu di atas 37 °C mampu menghambat multiplikasi banyak virus, merusak movement protein yang sangat berperan dalam transportasi virus dalam tanaman, serta merusak coat protein virus yang juga berperan dalam translokasi sistemik virus dalam tanaman (Hadidi et al. 1998). Perlakuan panas tidak hanya berpengaruh terhadap virus di dalam tanaman, tetapi juga menghambat proses fotosintesis, meningkatkan respirasi gelap, mereduksi translokasi karbohidrat, mempengaruhi sintesis protein, mempengaruhi pembelahan sel, pertumbuhan sel dan hormon tumbuhan. Perubahan proses dalam tumbuhan juga dapat mempengaruhi virus dalam tumbuhan tersebut (Hadidi et al.
1998).
Perlakuan termoterapi memberikan pengaruh dalam perubahan partikel virus pada perlakuan suhu di atas 35 oC, pecahnya ikatan hidrogen dan disulfida protein penyelubung virus, diikuti dengan ikatan kovalen fosfodiester asam nukleat mengakibatkan kemunduran infektivitas virus termasuk penghambatan replikasi virus, perubahan pH, peningkatan enzim litik, kompetisi antara RNA virus dan
3 BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Desember 2015 sampai September 2016 di Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman dan Laboratorium Kultur Jaringan 3 Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Metode
Pengumpulan Sampel Umbi Bawang Putih
Sampel umbi bawang putih lokal diperoleh dari penangkar umbi bawang putih, terdiri atas 4 kultivar dari 3 lokasi berbeda, yaitu cv. Lumbu Kuning dan Lumbu Hijau dari Jawa Timur, cv. Tawangmangu Baru dari Jawa Tengah, cv. Sangga Sembalun dari Lombok Timur, sedangkan bawang putih konsumsi impor diperoleh dari supermarket (Gambar 4). Sebanyak 50 umbi untuk masing-masing kultivar bawang putih lokal diambil secara acak dari 2 kg sampel untuk digunakan dalam deteksi awal virus, sedangkan bawang putih impor dipilih 10 umbi dari 1 kg sampel.
Gambar 4 Umbi bawang putih; Bawang putih konsumsi impor (A); Benih bawang
putih lokal: Cv Sangga Sembalun (B); Cv Lumbu Hijau (C); Cv Lumbu Kuning (D); dan Cv Tawangmangu Baru (E)
Deteksi Virus pada Sampel Bawang Putih
Deteksi virus dari sampel bawang putih menggunakan dua metode, yaitu metode dot immunobinding assay (DIBA) untuk deteksi awal pada umbi bawang putih, dan metode reverse transcription polymerase chain reaction (RT-PCR) untuk deteksi pada planlet bawang putih.
A B C
10
Metode DIBA
Umbi yang sudah dipilih dipecah menjadi siung tunggal. Siung diletakkan pada styrofoam yang telah dilubangi sesuai dengan diameter siung. Styrofoam
kemudian diletakkan pada nampan yang telah diberi air. Gejala pada tanaman diamati hingga 3 minggu setelah tanam (MST). Daun dikoleksi dan dijadikan sampel untuk deteksi virus.
Metode DIBA dilakukan berdasarkan metode Asniwita et al. (2012) menggunakan antibodi GarCLV, SLV, dan OYDV. Masing-masing sampel digerus dalam tris buffer saline (TBS : Tris-HCl 0.02 M dan NaCl 0.15 M, pH 7.5 Tris-HCl 0.02 M dan NaCl 0.15 M, pH 7.5) dengan perbandingan 1:10 (b:v). Suspensi tanaman selanjutnya diteteskan ke atas membran nitroselulosa sebanyak 2 μL. Setelah tetesan sampel kering, membran direndam di dalam 10 mL larutan blocking skim milk 2% dalam TBS yang mengandung Triton X-100 dengan konsentrasi akhir 2%. Membran kemudian diinkubasi pada suhu ruang sambil digoyang dengan kecepatan 50 rpm selama 1 jam lalu dicuci 5 kali dengan dH2O, tiap pencucian berlangsung 5 menit sambil digoyang dengan kecepatan 100 rpm. Membran selanjutnya direndam dalam 2.5 mL TBS yang mengandung antibodi 2.5 μL ditambah skim milk dengan konsentrasi akhir 2%, kemudian membran diinkubasi semalam pada suhu 4 oC. Membran kemudian dicuci sebanyak 5 kali dengan Tween 0.05% dalam TBS (TBST), tiap pencucian berlangsung 5 menit. Membran selanjutnya direndam dalam 2.5 mL TBS yang mengandung konjugat 2.5 μL (antibodi kedua) ditambah skim milk dengan konsentrasi akhir 2%, kemudian membran diinkubasi selama 60 menit sambil digoyang dengan kecepatan 50 rpm. Membran selanjutnya dicuci kembali dengan TBST dan direndam selama 5 menit dalam 10 mL bufer AP (Tris-HCl 0.1 M, NaCl 0.1 M, MgCl2 5 mM, dan air) yang mengandung 1 tablet nitro blue tetrazolium (NBT) dan bromo chloro indolil phosphate (BCIP). Reaksi positif ditandai oleh perubahan warna putih menjadi ungu pada membran nitroselulosa yang telah ditetesi cairan tanaman dan reaksi dihentikan dengan merendam membran dalam dH2O. Penghitungan persentase infeksi virus dilakukan menggunakan rumus berikut:
Jumlah sampel terinfeksi
Persentase infeksi virus = x 100% Jumlah sampel yang diuji Metode RT-PCR
Deteksi virus menggunakan metode RT-PCR dilakukan pada tanaman setelah aklimatisasi. Metode RT-PCR terdiri atas empat tahap, yaitu ekstraksi RNA total, sintesis cDNA, amplifikasi cDNA, dan visualisasi dengan elektroforesis.
11
disentrifugasi selama 15 menit pada kecepatan 11 000 rpm. Supernatan yang terbentuk dipindah ke tabung baru, kemudian ditambahkan isopropanol (2/3 volume supernatan). Campuran disentrifugasi kembali dengan kecepatan 11 000 rpm selama 15 menit. Supernatan dibuang, dan pelet yang terbentuk ditambahkan dengan etanol 70% sebanyak 500 µL lalu disentrifugasi selama 5 menit pada kecepatan 8 000 rpm. Supernatan dibuang, pelet yang terbentuk dikeringkan selama 15 menit kemudian ditambahkan bufer TE (pH 8) sebanyak 50 µL.
Sintesis cDNA. RNA total hasil ekstraksi selanjutnya digunakan untuk proses transkripsi balik (reverse transcription-RT) menjadi cDNA (complementary DNA) menggunakan enzim reverse transcriptase. Pereaksi untuk transkripsi balik terdiri atas 3 µL RNA total, 2 µL 5x bufer RT, 2 µL DTT (dithiothreitol) 50 mM, 1 µL dNTP 10 mM, 0.35 µL M-MuLV (200 U/µL), 0.5 µL RNAase inhibitor (40U/µL), 1 µL primer Poty 1 dan air bebas nuklease sampai volume total 10 µL. Reaksi RT dilakukan dalam mesin Automated Thermal Cycler (Gene Amp PCR System 9700; PE Applied Biosystem, USA) yang diprogram untuk satu siklus pada suhu 65 oC selama 5 menit, 42 oC selama 60 menit, dan 70 oC selama 10 menit untuk inaktivasi enzim M-MuLV. Siapan cDNA hasil amplifikasi ini digunakan sebagai DNA cetakan dalam reaksi amplifikasi.
Amplifikasi cDNA. Reaksi amplifikasi terdiri atas 12.5 µL Go Taq Green (Thermoscientific), 0.5 µL MgCl, 1 µL untuk setiap primer (forward dan reverse) (Tabel 1), 1 µL cDNA, dan ditambahkan air bebas nuklease sampai 25 µL. Amplifikasi cDNA menggunakan mesin GeneAmp PCR System 9700 sebanyak tiga tahap. Tahap pertama adalah pradenaturasi selama 3 menit pada suhu 94 oC. Tahap kedua berlangsung sebanyak 35 siklus, terdiri atas denaturasi selama 30 detik pada suhu 94 oC, penempelan primer selama 1 menit pada suhu 52 oC (primer OYDV), 56 oC (primer GarCLV), dan elongasi selama 1 menit pada suhu 72 oC. Tahap ketiga terdiri atas satu siklus elongasi pada 72 oC selama 7 menit.
Tabel 1 Primer yang digunakan untuk amplifikasi OYDV dan GarCLV Kode
OYDV, Onion yellow dwarf virus; GCLV, Garlic common latent virus;R, Primer reverse; F, Primer
forward
Visualisasi dengan Elektroforesis. Amplikon yang diperoleh selanjutnya dielektroforesis pada tegangan 50 volt selama 50 menit menggunakan 1% gel agarosa yang dilarutkan dengan bufer 0.5 x TBE. Gel agarosa selanjutnya direndam dalam 0.1% etidium bromida selama 15 menit dan dicuci dengan H2O, lalu divisualisasi dibawah UVtransilluminator.
Eliminasi Virus dari Umbi Bawang Putih
Perlakuan Elektroterapi
12
tunas adventif digunakan sebagai bahan perlakuan. Tunas adventif direndam dalam kotak elektroforesis yang berisi TBE 0.5x. Tunas tersebut diberi perlakuan arus elektroterapi selama 10 menit pada masing-masing taraf perlakuan, yaitu 0 mA, 5 mA, 10 mA, 15 mA, dan 20 mA (Gambar 5). Setelah perlakuan elektroterapi, tunas adventif digunakan sebagai bahan tanaman untuk kultur jaringan.
Gambar 5 Perlakuan elektroterapi pada tunas adventif bawang putih. Pencatu daya (Power supply) (A); Kotak elektroforesis (B)
Kultur Jaringan dan Perlakuan Termoterapi
Sterilisasi dilakukan secara bertahap terhadap tunas adventif yang telah diberi perlakuan elektroterapi. Pertama-tama tunas adventif direndam dalam NaOCl (1%) selama 10 menit, kemudian dipindah ke dalam NaOCl (0.5%) selama 5 menit, setelah itu dibilas air steril. Ujung tunas dipotong sekitar 2 mm yang digunakan sebagai eksplan untuk dikulturkan pada media MS (Murashige-skoog) yang mengandung 2ip (2 mg L-1) dan GA3 (0.3 mg L-1) (Gambar 6). Sebanyak 1 eksplan ditumbuhkan pada setiap botol kultur. Eksplan diinkubasi pada ruang kultur dan diberikan termoterapi berdasarkan masing-masing suhu selama 4 minggu. Perlakuan termoterapi menggunakan empat taraf perlakuan suhu, yaitu 23 °C, 28 °C, 33 °C, dan 38 °C. Setelah 4 minggu, tunas dipindahkan ke media inisiasi akar yang mengandung NAA (1 mg L-1) dalam medium ½ MS selama 2 minggu. Planlet yang terbentuk siap diaklimatisasi.
Gambar 6 Ukuran ujung tunas2 mm (A) dan kultur ujung tunas 2 mm pada media
Murashige-skoog (B)
A B
13
Sebelum dipindahkan ke media aklimatisasi, plantlet dikeluarkan dari media agar, kemudian direndam dalam larutan fungisida dan bakterisida 2 g L-1 selama 5 menit, kemudian planlet ditiriskan di atas tisu steril. Planlet ditanam pada media arang sekam steril selama 2 minggu di laboratorium. Deteksi virus dilakukan pada tanaman bawang putih hasil aklimatisasi menggunakan metode RT-PCR.
Rancangan Percobaan dan Peubah Pengamatan
4 HASIL
Gejala Penyakit
Sampel umbi bawang putih menunjukkan ciri-ciri benih yang baik yaitu umbi yang penuh berisi, siung tampak licin, tunas segar, dan berbentuk normal (Wibowo 2006). Masa simpan benih berkisar antara 6 sampai 8 bulan setelah panen. Gejala yang beragam pada berbagai kultivar ditemukan pada tanaman bawang putih yang ditumbuhkan di laboratorium. Gejala infeksi virus pada tanaman bawang putih yang diamati pada 3 MST dapat dibedakan menjadi lima jenis gejala yaitu keriting, mosaik hijau, permukaan daun mengerut, daun atas berlekuk dan mosaik kuning (Gambar 7). Gejala lain tidak ditemukan kemungkinan karena penanaman dilakukan di dalam ruangan laboratorium dengan kondisi lingkungan yang terjaga. Menurut Moreno et al. (2014), tanaman bawang putih yang terinfeksi virus di lapangan secara umum menimbulkan gejala daun keriting, mosaik, deformasi daun, daun menguning, melepuh, bergaris, dan kerdil. Infeksi tunggal atau campuran dapat menyebabkan gejala yang sama pada tanaman bawang putih. Demikian pula, gejala yang sama pada tanaman bawang putih dapat disebabkan oleh infeksi jenis virus yang berbeda.
Gambar 7 Gejala pada sampel tanaman bawang putih; Keriting (A), Mosaik hijau (B), Permukaan daun mengerut (C), Daun atas berlekuk (D), dan Mosaik kuning (E)
A B C
15
Pengamatan gejala merupakan langkah awal dalam diagnosis penyebab penyakit oleh virus. Namun, pengamatan gejala saja tidak cukup akurat untuk menentukan virus penyebab suatu penyakit karena gejala yang diduga disebabkan oleh virus bisa saja disebabkan oleh patogen lain, toksisitas serangga, maupun pengaruh faktor abiotik misalnya kekurangan dan kelebihan unsur hara, cekaman lingkungan dan sebagainya (Agrios 2005). Oleh karena itu itu, perlu dilakukan deteksi lebih lanjut untuk memastikan adanya infeksi virus pada tanaman yang menunjukkan gejala.
Deteksi Virus pada Tanaman Bawang Putih
Deteksi virus dilakukan dengan menumbuhkan umbi terlebih dahulu. Menurut Wulandari et al. (2015), infeksi virus lebih banyak terdeteksi dari sampel daun muda dibandingkan dengan sampel dari umbi. Hal ini menunjukkan bahwa untuk deteksi virus terbawa benih, sebaiknya umbi bawang perlu ditumbuhkan terlebih dahulu agar konsentrasi virus yang terdapat di dalam jaringan umbi (yang umumnya dalam konsentrasi rendah) dapat meningkat (Kurniawan & Suastika 2013). Infeksi virus pada tanaman bawang-bawangan akan terakumulasi dari satu generasi ke generasi selanjutnya melalui organ perbanyakan vegetatif (umbi). Virus terbawa umbi dapat menyebabkan pertumbuhan tanaman terhambat, karena virus berkembang bersama dengan pertumbuhan tanaman (Van Dijk 1993).
Tabel 2 Insidensi beberapa jenis virus pada beberapa kultivar bawang putih menggunakan metode dot immunobinding assay (DIBA)
Kultivar Benih bawang putih lokal (50 sampel uji)
Lumbu
Bawang putih konsumsi (10 sampel uji)
Impor 0 0 0 0 0 0 100 100
GarCLV, Garlic common latent virus; OYDV, Onion yellow dwarf virus; SLV, Shallot latent virus
16
Gambar 8 Hasil deteksi sampel daun umbi bawang putih dengan metode DIBA menggunakan antibodi: (A) GarCLV, (B) OYDV, (C) SLV. a1: bufer, a2: kontrol negatif, a3: kontrol positif, b-k: sampel uji
impor. Dua kultivar bawang putih lokal dengan insidensi virus tertinggi, yaitu cv. Sangga Sembalun dan Lumbu Hijau dipilih untuk digunakan sebagai bahan tanaman dalam perlakuan eliminasi virus.
Jenis virus yang paling banyak menginfeksi bawang putih lokal adalah OYDV, baik secara tunggal (43.5%) maupun bersama dengan GarCLV (43.5%), SLV (1%), GarCLV dan SLV (1.5%). Infeksi tunggal GarCLV dan SLV dideteksi dari sampel bawang putih, yaitu berturut-turut sebanyak 5.5% dan 1.5%, tetapi infeksi campuran keduanya tidak ditemukan, sedangkan pada bawang putih impor terinfeksi OYDV, GarCLV dan SLV (100%). Infeksi virus pada bawang putih lokal lebih rendah dibandingkan bawang putih impor. Pada bawang putih lokal, infeksi OYDV dan GarCLV mencapai 100% sehingga perlu dilakukan eliminasi kedua virus pada umbi bawang putih.
Infeksi lebih dari satu jenis virus pada satu tanaman bawang putih dapat menyebabkan variasi gejala yang beragam. Hal yang serupa dilaporkan oleh Kadwati dan Hidayat (2015), bahwa benih bawang putih terinfeksi GarCLV, SLV, dan Potyvirus. Menurut Diekmann (1997), kelompok virus yang umum menginfeksi tanaman bawang putih berasal dari genus Carlavirus (SLV dan GarCLV), Potyvirus (OYDV, Shallot yellow stripe virus/SYSV, Leek yellow stripe virus/LYSV), dan Allexivirus (Garlic Mite-born filamentous virus/GarMbFV). Virus utama pada tanaman bawang putih yang menyebabkan kerugian ekonomis diantaranya SLV, GarCLV, OYDV, SYSV, LYSV (Dovas et al. 2001; Chen et al.
2004; Arya et al. 2006; Shahraeen et al. 2008)
Tingginya infeksi OYDV dan GarCLV mencapai 100% baik infeksi tunggal maupun infeksi campuran kedua jenis virus, dimana infeksi OYDV lebih dominan dibandingkan GarCLV. Menurut Dovas et al. (2001), perbedaan tingkat infeksi GarCLV berkaitan dengan lokasi pertanaman di Yunani. Perbedaan distribusi geografi dari infeksi GarCLV telah dilakukan di daerah selatan Yunani dimana
17
tingkat infeksi GarCLV mencapai 23%, sedangkan di daerah utara mencapai 98% (Dovas & Vovlas 2003). Tingginya infeksi OYDV mencapai 100% juga ditemukan di negara Yunani dan Iran (Dovas et al. 2001). Oleh karena itu, perlunya dilakukan mendapatkan metode eliminasi yang tepat terhadap kedua jenis virus OYDV dan GarCLV dalam upaya mendapatkan tanaman bebas virus untuk meningkatkan produksi bawang putih di Indonesia.
Pengaruh Elektroterapi dan Termoterapi terhadap Persentase Hidup Eksplan, Jumlah Daun dan Tinggi Planlet
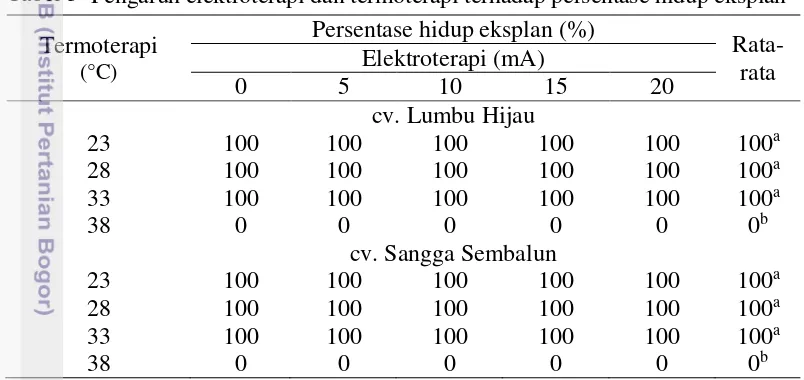
Pertumbuhan eksplan mulai terlihat sejak 1 MST pada media pertumbuhan. Eksplan yang hidup sampai dengan 4 MST pada cv. Lumbu Hijau dan Sangga Sembalun mencapai 100%, kecuali pada perlakuan suhu 38 °C (Tabel 3). Analisis varian menunjukkan bahwa termoterapi berpengaruh sangat nyata terhadap persentase hidup eksplan bawang putih, sedangkan elektroterapi dan interaksi kedua perlakuan tidak berbeda nyata terhadap persentase hidup eksplan bawang putih.
Tabel 3 Pengaruh elektroterapi dan termoterapi terhadap persentase hidup eksplan Termoterapi
Angka-angka pada kolom dan kultivar yang sama diikuti huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
Hasil pengamatan menunjukkan bahwa semakin tinggi suhu yang digunakan maka eksplan menjadi sangat terganggu setelah mendapat perlakuan termoterapi. Eksplan hidup ditandai dengan munculnya daun (Gambar 9). Perlakuan suhu yang terlalu tinggi yaitu 38 oC, menyebabkan penghambatan terhadap pertumbuhan eksplan. Hasil yang sama diperoleh pada penelitian-penelitian sebelumnya. Conci
18
Gambar 9 Pengaruh termoterapi terhadap eksplan hidup pada 4 MST; 23 oC (A), 28 oC (B), 33 oC (C), 38 oC (D)
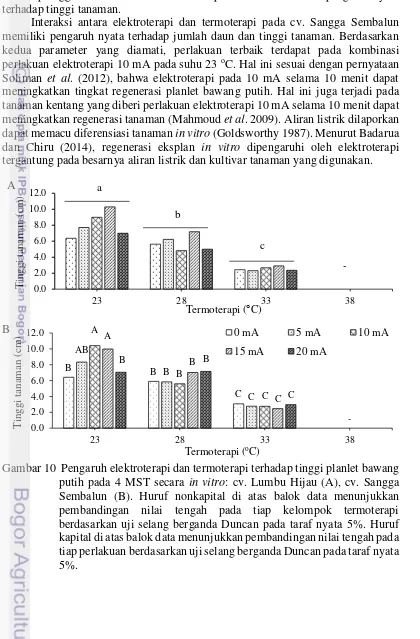
Jumlah daun pada kedua kultivar juga sangat dipengaruhi oleh perlakuan suhu (Tabel 4). Peningkatan suhu menyebabkan penurunan jumlah daun secara nyata pada kedua kultivar. Pada cv. Lumbu Hijau, elektroterapi memberikan pengaruh nyata terhadap jumlah daun, sedangkan interaksi antara kedua faktor tidak memberikan pengaruh nyata terhadap jumlah daun. Kondisi yang berbeda pada cv. Sangga Sembalun, elektroterapi tidak memberikan pengaruh nyata terhadap jumlah daun, tetapi interaksi kedua perlakuan memberikan pengaruh nyata terhadap jumlah daun.
Tabel 4 Pengaruh elektroterapi dan termoterapi terhadap rata-rata jumlah daun pada 4 MST
19
Perlakuan suhu menyebabkan pengaruh nyata terhadap tinggi tanaman pada kedua kultivar (Gambar 10). Semakin tinggi suhu yang digunakan nyata menurunkan tinggi tanaman. Pada cv. Lumbu Hijau, elektroterapi dan interaksi antara kedua perlakuan tidak memberikan pengaruh nyata terhadap tinggi tanaman, tetapi pada cv. Sangga Sembalun, elektroterapi memberikan pengaruh nyata terhadap tinggi tanaman dan interaksi kedua perlakuan memberikan pengaruh nyata terhadap tinggi tanaman.
Interaksi antara elektroterapi dan termoterapi pada cv. Sangga Sembalun memiliki pengaruh nyata terhadap jumlah daun dan tinggi tanaman. Berdasarkan kedua parameter yang diamati, perlakuan terbaik terdapat pada kombinasi perlakuan elektroterapi 10 mA pada suhu 23 oC. Hal ini sesuai dengan pernyataan Soliman et al. (2012), bahwa elektroterapi pada 10 mA selama 10 menit dapat meningkatkan tingkat regenerasi planlet bawang putih. Hal ini juga terjadi pada tanaman kentang yang diberi perlakuan elektroterapi 10 mA selama 10 menit dapat meningkatkan regenerasi tanaman (Mahmoud et al. 2009). Aliran listrik dilaporkan dapat memacu diferensiasi tanaman in vitro (Goldsworthy 1987). Menurut Badarua dan Chiru (2014), regenerasi eksplan in vitro dipengaruhi oleh elektroterapi tergantung pada besarnya aliran listrik dan kultivar tanaman yang digunakan.
20
Pengaruh Termoterapi dan Elektroterapi terhadap Eliminasi OYDV dan GarCLVpada Tanaman Bawang Putih
Tanaman hasil kultur in vitro yang telah diberi perlakuan termoterapi dan elektroterapi dipindahkan ke media inisiasi akar, kemudian dilakukan aklimatisasi selama 2 minggu di laboratorium. Tanaman yang diberi perlakuan termoterapi 33 oC baik yang diberi elektroterapi maupun yang tidak diberi elektroterapi tidak menghasilkan akar sehingga aklimatisasi tidak dapat dilakukan. Tanaman hasil kultur in vitro tumbuh dengan baik ketika diaklimatisasi dan memperlihatkan gejala tanaman terinfeksi virus, seperti mosaik kuning, mosaik hijau, dan permukaan daun mengerut (Gambar 11).
Gambar 11 Gejala pada tanaman bawang putih 2 minggu setelah aklimatisasi;
Daun mengerut (A), Mosaik hijau (B), dan Mosaik kuning (C) Gejala infeksi virus terlihat pada tanaman saat aklimatisasi. Hal ini menandakan bahwa konsentrasi virus meningkat pada saat aklimatisasi seiring dengan pertumbuhan tanaman. Menurut Conci dan Nome (1991), tanaman yang diperoleh dari kultur in vitro memiliki konsentrasi virus yang rendah. Konsentrasi virus yang rendah diduga menyebabkan gejala tidak tampak pada kultur in vitro. Oleh karena itu, deteksi virus pada tanaman in vitro sebaiknya dilakukan setelah aklimatisasi.
Deteksi virus setelah perlakuan eliminasi dilakukan secara komposit, yaitu 4 botol kultur dalam satu ulangan menggunakan metode RT-PCR. Deteksi virus terhadap tanaman hasil kultur in vitro dilakukan menggunakan metode RT-PCR dikarenakan metode ini memiliki sensitivitas yang tinggi. Hasil visualisasi RT-PCR pada planlet yang terinfeksi virus OYDV dan GarCLV ditunjukkan oleh amplifikasi pita dengan panjang OYDV 601 bp dan GarCLV 960 bp (Gambar 12).
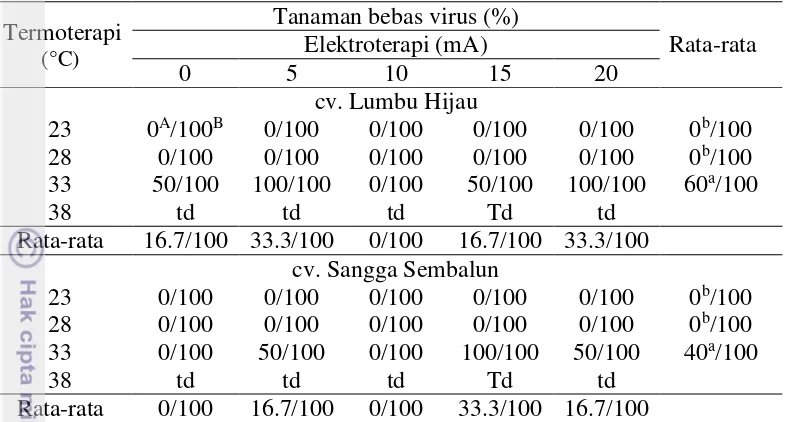
Hasil deteksi virus diketahui bahwa tanaman bebas GarCLV lebih tinggi dibandingkan OYDV sampai 100% pada semua perlakuan baik dengan perlakuan eliminasi maupun tidak diberi perlakuan eliminasi. Hal ini mungkin dikarenakan kultur ujung tunas 2 mm mampu mengeliminasi GarCLV. Menurut Panattoni et al. (2013), ukuran eksplan seperti ujung tunas (5.0-10.0 mm) atau bagian meristem (0.2-0.7 mm) dapat digunakan dalam eliminasi virus dikarenakan semakin kecil ukuran tanaman maka semakin rendah konsentrasi virus dalam tanaman tersebut.
21
Tabel 5 Pengaruh elektroterapi dan termoterapi terhadap persentase tanaman bebas OYDV dan GarCLV
Termoterapi
(°C)
Tanaman bebas virus (%)
Rata-rata Elektroterapi (mA)
0 5 10 15 20
cv. Lumbu Hijau
23 0A/100B 0/100 0/100 0/100 0/100 0b/100 28 0/100 0/100 0/100 0/100 0/100 0b/100 33 50/100 100/100 0/100 50/100 100/100 60a/100
38 td td td Td td
Rata-rata 16.7/100 33.3/100 0/100 16.7/100 33.3/100 cv. Sangga Sembalun
23 0/100 0/100 0/100 0/100 0/100 0b/100 28 0/100 0/100 0/100 0/100 0/100 0b/100 33 0/100 50/100 0/100 100/100 50/100 40a/100
38 td td td Td td
Rata-rata 0/100 16.7/100 0/100 33.3/100 16.7/100 A Tanaman bebas OYDV, B Tanaman bebas GarCLV,
a,bAngka-angka pada kolom dan kultivar yang sama yang diikuti huruf yang sama tidak berbeda
nyata pada taraf uji 5% (uji selang berganda Duncan). td, tidak diuji karena tidak ada planlet yang tumbuh.
Berdasarkan hasil analisis statistik, perlakuan suhu memberikan pengaruh nyata terhadap persentase tanaman bebas OYDV (Tabel 5), sedangkan perlakuan elektroterapi dan interaksi kedua perlakuan tidak memberikan pengaruh yang nyata terhadap persentase tanaman bebas OYDV. Pengaruh termoterapi dan elektroterapi terhadap persentase tanaman bebas OYDV ditentukan oleh jenis kultivar yang digunakan. Menurut Conci et al. (2005), efisiensi untuk mendapatkan tanaman bebas virus bergantung dari jenis virus target dan kultivar bawang putih yang digunakan.
22
Gambar 12 Hasil amplifikasi RT-PCR tanaman bawang putih setelah perlakuan
elektroterapi dan termoterapi menggunakan primer spesifik (A) OYDV dan (B) GarCLV. M: Marker 1 kb; 1: Kontrol positif; 2:
Kontrol negatif; (3-7) Suhu 23 oC: 0 mA, 5 mA, 10 mA, 15 mA, dan 20 mA; (8-12) Suhu 28 oC: 0 mA, 5 mA, 10 mA, 15 mA, dan 20 mA, dan (13-17) Suhu 33 oC: 0 mA, 5 mA, 10 mA, 15 mA, dan 20 mA A
.
B . 601 bp
960 bp
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
5 PEMBAHASAN
Pada umumnya, bawang putih di Indonesia dibudidayakan melalui perbanyakan vegetatif menggunakan umbi. Berbagai kultivar bawang putih yang saat ini banyak dibudidayakan seperti Tawangmangu Baru, Lumbu Hijau, Lumbu Kuning, dan Sangga Sembalun ditemukan telah terinfeksi OYDV, GarCLV, dan SLV dengan tingkat infeksi virus mencapai 100%. Hal tersebut terjadi karena umbi benih berasal dari umbi musim tanam sebelumnya. Dengan demikian patogen tular umbi, termasuk virus, memiliki resiko tinggi untuk menyebar di lapangan. Infeksi virus yang terjadi pada siklus penanaman bawang putih dapat menyebabkan penurunan hasil dan kualitas umbi. Perbanyakan vegetatif merupakan metode efektif untuk virus bertahan dan menyebar (Hull 2002). Cara utama penularan virus melalui perbanyakan tanaman secara vegetatif mendorong penyebaran dan akumulasi virus di dalam umbi (Chen et al. 2004). Kebiasaan petani menanam umbi bibit bawang putih yang terinfeksi virus menyebabkan virus terakumulasi, tersebar luas, dan bertahan dari generasi ke generasi selama bertahun-tahun. Selain itu, insidensi penyakit di lapangan dapat semakin meningkat dengan keberadaan serangga vektor. Serangga vektor berperan penting terhadap penyebaran virus sehingga menyebabkan tingginya insidensi penyakit. Belum banyak informasi tentang keberadaan serangga pada tanaman bawang putih di Indonesia.
Perlakuan eliminasi virus, misalnya melalui termoterapi dan elektroterapi secara in vitro pada umbi bawang putih telah dilaporkan dapat menurunkan insidensi penyakit virus pada bawang putih. Penelitian yang dilakukan menunjukkan bahwa termoterapi pada suhu 33 oC mampu menekan insidensi OYDV hingga 60%, tetapi sayangnya perlakuan tersebut dapat mengganggu pertumbuhan tanaman. Pada perlakuan termoterapi, kisaran suhu merupakan faktor penting yang memengaruhi persentase hidup tanaman. Beberapa peneliti melaporkan bahwa suhu udara di dalam botol lebih tinggi 1-2 oC dibandingkan suhu udara di ruangan (Deogratias et al. 1989; Stein et al. 1991). Lama perlakuan suhu merupakan faktor lain yang memengaruhi efisiensi eliminasi virus (Tan et al. 2010). Pada penelitian ini, suhu 38 oC memiliki pengaruh negatif, hal ini menunjukkan bahwa tanaman bawang putih in vitro sensitif apabila diberikan perlakuan suhu tinggi yang ekstrim.
24
mengeliminasi Prunus necrotic ringspot virus (PNRSV) dan Apple chlorotic leaf spot virus (ACLSV) pada Prunus sp. hingga 75% melalui perlakuan suhu 36 oC selama 4 minggu. Hu et al. (2015) berhasil mengeliminasi ACLCV, Apple stem pitting virus (ASPV), dan Apple stem grooving virus (ASGV) pada tanaman apel dengan nilai efisiensi mencapai 60% melalui termoterapi pada suhu 36 oC selama 20 hari. Szittya et al. (2003) melaporkan bahwa interaksi virus tumbuhan sangat dipengaruhi oleh suhu, yaitu suhu yang tinggi sering diasosiasikan dengan konsentrasi virus rendah pada tanaman terinfeksi. Tanaman yang diberi perlakuan panas dapat menurunkan sintesis movement protein (MP), coat protein (CP) virus dengan menghambat sintesis RNA virus (Bhojwani & Dantu 2013).
Percobaan eliminasi menggunakan metode elektroterapi pada berbagai tingkat arus listrik memperlihatkan bahwa perlakuan elektroterapi tidak berpengaruh nyata terhadap persentase tanaman bebas virus. Hal tersebut mungkin dikarenakan oleh konsentrasi virus yang tinggi. Lassois et al. (2013) menyatakan bahwa ketersediaan tanaman bebas virus sangatlah bergantung pada teknik yang dikembangkan dalam mengeliminasi virus, dan beberapa hal yang perlu diperhatikan dalam memilih teknik eliminasi adalah karakteristik virus, tipe jaringan yang diberikan perlakuan, dan jenis tanaman yang digunakan. Dewi dan Slack (1994) menambahkan bahwa efisiensi protokol yang digunakan untuk mengeliminasi virus akan menurun jika eksplan yang digunakan mengandung konsentrasi virus yang tinggi atau telah terinfeksi oleh berbagai jenis virus. Penelitian sebelumnya melaporkan bahwa tanaman yang diberi arus listrik meningkatkan suhu di dalam sel tanaman. Denaturasi sebagian protein partikel virus mungkin terjadi seiring meningkatnya suhu dalam sel (Conzalez et al. 2006). Menurut Lozoya (1996), batang tanaman kentang yang diberi perlakuan elektroterapi dapat meningkatkan suhu batang tanaman kentang meningkat sekitar 4 oC sampai 10 oC, suhu ini mungkin menekan aktivitas virus tapi tidak menghambat metabolisme tumbuhan.
Perlakuan elektroterapi telah banyak digunakan pada berbagai jenis tanaman untuk mengeliminasi berbagai jenis virus. Almaari et al. (2012) berhasil mengeliminasi Potat virus Y melalui perlakuan elektroterapi menggunakan larutan NaCl (1N) dengan arus listrik 15 mA selama 10 menit yang dikombinasikan dengan kultur meristem 200 µm dan mampu menghasilkan tanaman bebas virus sebanyak 87%. Meybodi et al. (2011) berhasil mengeliminasi Potato virus Y menggunakan elektroterapi 35 mA selama 20 menit. Efisiensi elektroterapi dipengaruhi oleh tingkat arus listrik, lama elektroterapi, dan genotipe tanaman.
6 SIMPULAN DAN SARAN
Simpulan
Perlakuan suhu mampu mengeliminasi OYDV, sedangkan perlakuan elektroterapi tidak dapat mengeliminasi OYDV. Eliminasi OYDV berhasil dilakukan dengan termoterapi pada suhu 33 oC yang dapat menekan insidensi OYDV, tetapi dapat menghambat pertumbuhan tanaman. Eliminasi OYDV pada cv Lumbu Hijau mencapai 60%, sedangkan pada cv Sangga Sembalun mencapai 40%. Sementara itu, semua perlakuan dapat mengeliminasi GarCLV sebesar 100% pada kedua kultivar. Hal ini mungkin dikarenakan kultur ujung tunas 2 mm mampu mengeliminasi GarCLV.
Saran
7 DAFTAR PUSTAKA
Adams MJ, Antoniw JF, Bar-Joseph M, Brunt AA, Candresse T, Foster GD, Martelli GP, Milne RG, Zavriev SK, Fauquet CM. 2004. Virology division news: The new plant virus family Flexiviridae and assessment of molecular criteria for species demarcation. Archives of Virology. 149(5):1045-1060. Agrios GN. 2005. Plant Pathology. Ed ke-5. United States of America (US):
Elsevier Academic Press.
Akin HM. 2006. Virologi Tumbuhan. Yogyakarta (ID): Kanisius.
Almaarri K, Massa R, Albinski F. 2012. Evaluation of some therapies and meristem culture to eliminate Potato Y Potyvirus from infected potato plants. Plant Biotech. 29:237-243. doi:10.5511/plantbiotechnology.12.0215a.
Arya M, Baranwal VK, Ahlawat YS, Singh L. 2006. RT-PCR detection and molecular characterization of Onion yellow dwarf virus associated with garlic and onion. Curr. Sci. 91(9):1230-1234.
Asniwita, Hidayat SH, Suastika G, Sujiprihati S, Sausanto S, Hayati I. 2012. Eksplorasi isolat lemah Chili veinal mottle Potyvirus pada pertanaman cabai di Jambi, Sumatera Barat, dan Jawa Barat. J Hort. 22(2):181-186.
Badarua CL, Chiru N. 2014. Effect of some therapies on potato plantlets infected with Potato Virus X (PVX). In: Proceeding of Bioatlas 2014 Conference;
2014 May 15-17; Brasov (RO): BIOATLAS Conference. page 11-17. Barg E, Lesemann DE, Vetten HJ, Green SJ. 1994. Identification partial
characterization and distribution of viruses infecting Allium crops in South and Southeast Asia. Acta Horticultura. 358:251-258.
Bhojwani SS, Dantu PK. 2013. Production of virus-free plants. In: Bhojwani SS, Dantu PK, editor. Plant Tissue Culture: an Introduction Text. New Delhi (ID). Springer India. p 227-243. doi 10.1007/978-81-322-1026-9_16.
Bos L. 1982. Viruses and virus disease of Allium species. Acta Hort. 127: 11-29. [BPS] Badan Pusat Statistik. 2015. Produksi bawang putih tahun 2014 [Internet].
[diunduh pada 2015 Apr 29]. Tersedia pada http://www.bps.go.id/site /resultTab.
Calayani K, Sercei CU, Gazel M, Jelkman W. 2006. Detection of four apple viruses by ELISA and RT-PCR assays in Turkey. Turk J Agric For. 30: 241-246. Chen J, Chen JP, Adam MJ. 2002. Characterization of some Carla and Potyvirus
from bulb in China. Arch. Virol. 147:419-428.
Chen J, Zheng HY, Antoniw JF, Adams MJ, Chen JP, Lin L. 2004. Detection and classification of allexiviruses from garlic in China. Arch. Virol. 149:435-445. doi:10.1007/s00705-003-0234-2.
Cilienska M. 2007. Application of thermo and chemotherapy in vitro for eliminating some viruses infecting Prunus sp. fruit trees. Journal of Fruit and Ornamental Plant Research. 15:117-124.
Clark MF. 1981. Immunosorbent assays in plant pathology. Ann Rev Phytopathol.
19:83-106.
Conci VC, Nome SF, Milne RG. 1992. Filamentous viruses of garlic in Argentina.
Plant Disease. 76:594-596.