KEEFEKTIFAN FORMULA INOKULAN RHIZOBAKTERIA
UNTUK MENINGKATKAN PRODUKSI KEDELAI
DI LAHAN PERTANIAN
SAIFUL BAHRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Keefektifan Formula Inokulan Rhizobakteria untuk Meningkatkan Produksi Kedelai di Lahan Pertanian adalah benar hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agusuts 2014
Saiful Bahri NIM G351100231
RINGKASAN
SAIFUL BAHRI. Keefektifan Formula Inokulan Rhizobakteria untuk Meningkatkan Produksi Kedelai di Lahan Pertanian. Dibawah bimbingan: ARIS TRI WAHYUDI dan HAPPY WIDIASTUTI.
Salah satu cara untuk meningkatkan produksi kedelai adalah melalui pendekatan teknologi pertanian, seperti pupuk hayati. Pupuk hayati mengandung rhizobakteria yang dapat memacu pertumbuhan tanaman dan dapat digunakan untuk mengurangi penggunaan pupuk kimia. Rhizobakteria pemacu pertumbuhan tanaman (PGPR) sebagai pupuk hayati dapat menjadi jawaban untuk meningkatkan produksi kedelai. Berdasarkan penelitian sebelumnya, ko-inokulasi Pseudomonas sp., Bacillus sp., dan BJ11 Bradyrhizobium japonicum diketahui mampu meningkatkan pertumbuhan kedelai dan mengendalikan jamur patogen. Tujuan penelitian ini adalah untuk mempelajari pengaruh formulasi pupuk hayati dalam bentuk serbuk, granul, dan tepung untuk meningkatkan produksi kedelai. Penelitian ini menggunakan rancangan percobaan berupa rancangan acak kelompok dengan 12 perlakuan dan 3 blok. Viabilitas bakteri dalam pupuk hayati diamati selama 6 bulan pada suhu ruang dan suhu 4 °C masa penyimpanan. Rata-rata produktivitas paket inokulan bentuk serbuk, granul, dan tepung dengan kombinasi pupuk NPK dosis penuh masing-masing mampu mencapai 2.76 ton ha -1
, 2.79 ton ha-1, dan 2.07 ton ha-1. Produksi ini meningkat sebesar 20%, 16,2%, dan 15% dibandingkan dengan perlakuan kontrol NPK dosis penuh yang hanya 2.30 ton ha-1, 2.40 ton ha-1, dan 1.80 ton ha-1. Sementara paket rata-rata inokulan dalam bentuk serbuk, granul, dan tepung dengan dosis NPK setengah mampu mencapai 2.46 ton ha-1, 2.61 ton ha-1, dan 1.81 ton ha-1, produksi ini meningkat 29.5%, 45.8%, dan 10% dibandingkan dengan perlakuan kontrol pupuk NPK dosis setengah yang hanya 1.90 ton ha-1, 1.79 ton ha-1, dan 1.64 ton ha-1. Berdasarkan uji viabilitas bakteri, kisaran rata-rata jumlah sel bakteri yang terkandung dalam bahan pembawa bentuk serbuk, granul, dan tepung dalam masa simpan 6 bulan masih sesuai standar pupuk hayati yang dipersyaratkan, karena jumlah populasi tiga isolat pada setiap formula mencapai 55.5% pada penyimpanan dengan suhu ruang dan 66,6% pada suhu 4 °C dengan jumlah sel rata-rata sebesar 107 sel g-1.
SUMMARY
SAIFUL BAHRI. Effectiveness of Inoculants Rhizobacteria Formula to Increase Production of Soybean in Agricultural Field. Supervised by ARIS TRI WAHYUDI and HAPPY WIDIASTUTI.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
KEEFEKTIFAN FORMULA INOKULAN RHIZOBAKTERIA
UNTUK MENINGKATKAN PRODUKSI KEDELAI
DI LAHAN PERTANIAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Keefektifan Formula Inokulan Rhizobakteria untuk Meningkatkan Produksi Kedelai di Lahan Pertanian Nama : Saiful Bahri
NIM : G351100231
Disetujui oleh Komisi Pembimbing
Prof DrAris Tri Wahyudi, MSi Ketua
Dr Ir Happy Widiastuti, MSi Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bukan September 2011 sampai Maret 2012 ini ialah Rhizobakteria, dengan judul Keefektifan Formula Inokulan Rhizobakteria untuk Meningkatkan Produksi Kedelai di Lahan Pertanian.
Penulis mengucapkan terima kasih kepada Prof. Dr. Aris Tri Wahyudi, M.Si dan Dr. Ir. Happy Widiastuti, M.Si selaku Komisi Pembimbing, serta Dr. Edi Husen, M.Sc yang telah memberikan banyak saran dan bimbingan kepada penulis sampai penyelesaian penulisan tesis ini. Penelitian ini dapat berjalan dengan lancar berkat pendanaan dari program penelitian RISTEK 2010-2011. Oleh karena itu penulis mengucapkan terima kasih kepada program ini dan pihak-pihak yang terkait. Di samping itu, ucapan terima kasih juga ditujukan untuk Ibu Henny, Pak Jaka selaku laboran Mikrobiologi, Bapak Koko pekerja di lapang. Ucapan terima kasih juga kepada teman-teman seperjuangan Bapak Sipriyadi, Bapak Seagams, Wahyu Eka Sari atas support dan segala bantuan yang telah diberikan, serta teman-teman Pasca Mikrobiologi angkatan 2010 dan mahasiswa penghuni Kostan Baristar atas perhatian dan kerjasamanya. Secara khusus penulis menyampaikan ucapan terima kasih untuk Evi Indahwati sang motivator dan nya’, babeh, serta seluruh keluarga, atas doa dan dukungannya selama ini.
Demikian tesis ini penulis buat. Semoga tidak hanya bermanfaat bagi penulis, tetapi juga dapat bermanfaat bagi pembaca.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
2 TINJAUAN PUSTAKA 2
Tanaman Kedelai 2
BakteriPseudomonas sp. 3
BakteriBacillus sp. 3
BakteriBradyrhizobium japonicum 4
Bahan Pembawa 4
3 METODE 5
Tempat dan Waktu Penelitian 5
Bahan Penelitian 6
Peremajaan Bakteri 6
Pembuatan Paket Pupuk Hayati 6
Bentuk Serbuk 7
Bentuk Granul 7
Bentuk Tepung 7
Uji Viabilitas Inokulan Bakteri 7
Analisis Kimia Tanah 8
Total Plate Count (TPC) Bakteri 8
Total Plate Count (TPC) Bakteri Penambat Nitrogen 8
Rancangan Percobaan 8
4 HASIL 10
Formulasi Pupuk Hayati 10
Viabilitas Inokulan Bakteri Selama Masa Penyimpanan 11 Keefektifan Inokulan Terhadap Pertumbuhan Tanaman Kedelai 11
5 PEMBAHASAN 19
6 SIMPULAN 21
DAFTAR PUSTAKA 22
DAFTAR TABEL
1 Perlakuan, kode isolat, dan dosis pupuk NPK yang digunakan pada tiap
plot percobaan 9
2 Kepadatan sel bakteri yang diinokulasikan ke dalam bahan pembawa 11 3 Pengaruh pemberian paket inokulan pada kemasan Serbuk, Granul, dan
Tepung yang dikombinasikan dengan pupuk NPK terhadap Jumlah Bintil (per rumpun) pada tanaman Kedelai berumur 45 hari setelah tanam 14 4 Pengaruh pemberian paket inokulan pada kemasan Serbuk, Granul, dan
2 Pengaruh pemberian paket inokulan kemasan Serbuk dan NPK terhadap Berat Basah Tajuk (BBT), Berat Kering Tajuk (BKT), Berat Basah Akar (BBA), dan Berat Kering Akar (BKA) per rumpun pada tanaman Kedelai
berumur 45 hari setelah tanam 12
3 Pengaruh pemberian paket inokulan kemasan Granul dan NPK terhadap Berat Basah Tajuk (BBT), Berat Kering Tajuk (BKT), Berat Basah Akar (BBA), dan Berat Kering Akar (BKA) per rumpun pada tanaman Kedelai
berumur 45 hari setelah tanam 12
4 Pengaruh pemberian paket inokulan kemasan Tepung dan NPK terhadap Berat Basah Tajuk (BBT), Berat Kering Tajuk (BKT), Berat Basah Akar (BBA), dan Berat Kering Akar (BKA) per rumpun pada tanaman Kedelai
berumur 45 hari setelah tanam 13
5 Pengaruh pemberian paket inokulan kemasan Serbuk dan NPK Terhadap Berat Polong, Berat Biji, dan Berat 100 Biji (per rumpun) dengan masa
tanam 3 bulan 15
6 Pengaruh pemberian paket inokulan kemasan Granul dan NPK terhadap Berat Polong, Berat Biji, dan Berat 100 Biji (per rumpun) dengan masa
tanam 3 bulan 15
7 Pengaruh pemberian paket inokulan kemasan Tepung dan NPK terhadap Berat Polong, Berat Biji, dan Berat 100 Biji (per rumpun) dengan masa
tanam 3 bulan 16
DAFTAR LAMPIRAN
1 Komposisi media Nutrient Agar, King’s B Agar, Yeast Manitol Agar, dan Susu Skim + Molase yang digunakan dalam 100 ml aquades 27 2 Viabilitas sel bakteri pada paket dalam bentuk kemasan selama masa
penyimpanan pada suhu ruang 28
3 Viabilitas sel bakteri pada paket dalam bentuk kemasan selama masa
1
PENDAHULUAN
Latar Belakang
Di Indonesia kedelai (Glycine max (L.) Merr.)) merupakan salah satu komoditas tanaman pangan yang sangat penting. Kebutuhan kedelai di Indonesia ± 2.4 juta ton per tahun sedangkan produksi kedelai pada tahun 2013 (ARAM I) hanya mencapai 847.16 ribu ton biji kering. Produksi kedelai nasional belum mencukupi akan kebutuhan masyarakat. Demi mencukupi permintaan dan konsumsi dalam negeri, pada tahun 2013 pemerintah mengambil kebijakan impor kedelai hingga mencapai 70% (BPS 2013). Oleh karena itu produksi kedelai harus ditingkatkan demi tercapainya swasembada kedelai yang dicanangkan oleh pemerintah. Upaya peningkatan produksi kedelai dihadapkan pada semakin tingginya harga pupuk kimia dan residu di dalam tanah.
Penggunaan pupuk kimia saat ini sudah banyak dikurangi. Salah satu cara mengurangi penggunaan pupuk kimia adalah dengan penggunaan pupuk hayati. Penggunaan pupuk hayati merupakan salah satu cara untuk meningkatkan produksi kedelai melalui pengembangan teknologi pertanian, seperti penggunaan pupuk hayati rhizobakteria. Menurut Vessey (2003), pupuk hayati adalah pupuk yang mengandung mikroorganisme sehingga dapat memacu pertumbuhan tanaman ketika diaplikasikan ke tanaman dengan mekanisme meningkatkan ketersediaan unsur hara tanaman. Oleh karena itu mikroorganisme yang diharapkan adalah kelompok rhizobakteria pemacu pertumbuhan tanaman atau disebut Plant Growth Promoting Rhizobacteria (PGPR). Dengan konsep PGPR, rhizobakteria setidaknya memiliki dua kriteria yaitu kemampuan dalam mengkolonisasi permukaan akar tanaman sehingga mampu memacu pertumbuhan tanaman dan memiliki sifat sebagai biokontrol (Haas dan Defago 2005).
Kelompok bakteri rizosfer pemacu pertumbuhan tanaman (PGPR) telah banyak dilaporkan dapat meningkatkan pertumbuhan tanaman (Ashrafuzzaman et al. 2009). Hal ini terkait dengan penelitian Wahyudi dan Mubarik (2008), yang melaporkan bahwa isolat Bacillus sp. dan Pseudomonas sp. memiliki kemampuan dalam memproduksi hormon pertumbuhan, seperti Indole Acetic Acid (IAA) dan kemampuannya dalam melarutkan unsur-unsur mineral seperti fosfat. Tahar (2009) melaporkan terdapat beberapa isolat dari kelompok Pseudomonas sp. dan Bacillus sp. toleran masam yang berpengaruh nyata terhadap pertumbuhan tanaman kedelai yang diinokulasi secara bersama-sama.
Aplikasi bakteri PGPR untuk tujuan pemupukan tanaman membutuhkan suatu bahan pembawa. Bahan pembawa inokulum yang lazim disebut sebagai carrier pada dasarnya merupakan suatu bahan yang dapat digunakan sebagai tempat hidup inokulum pupuk hayati sebelum diaplikasikan, sehingga harus dapat mengaktifkan kegiatan mikroba agar mampu tumbuh dan berkembang pada saat digunakan. Bahan carrier yang baik adalah bersifat tidak meracuni mikroba, kemampuan absorpsi tinggi, mudah disterilkan dan dihaluskan, mudah menempel pada bahan tanaman (biji misalnya) dan tersedia secara melimpah (Burton 1979).
2
melarutkan fosfat, menghasilkan hormon pertumbuhan IAA, meningkatkan pertumbuhan tanaman kedelai dan mampu mengendalikan cendawan patogen akar tanaman kedelai (Siregar 2011).
Tujuan Penelitian
Penelitian ini bertujuan memformulasi kombinasi bakteri PGPR (Pseudomonas sp. dan Bacillus sp.) dengan bakteri penambat nitrogen B. japonicum (Bj11) dengan bahan pembawa gambut dan talek dalam bentuk kemasan serbuk, granul dan tepung sebagai pupuk hayati, serta mengaplikasikannya pada tanamana kedelai untuk meningkatkan produksinya di lahan pertanian.
2
TINJAUAN PUSTAKA
Tanaman Kedelai
Kedelai dikelompokkan pada divisi Spermatophyta, kelas Dicotyledoneae, ordo Rosales, famili Leguminoseae, sub famili Papilionaceae, genus Glycine, spesies Glycine max (L.) Merill. Kedelai memiliki jumlah kromosom somatik 2n = 40. Tanaman kedelai merupakan tanaman semusim, tanaman tegak dengan tinggi 40-90 cm, bercabang, dan umur tanaman antara 72-90 hari. Sistem perakaran kedelai terdiri atas dua macam, yaitu akar tunggang dan akar sekunder (serabut) yang tumbuh dari akar tunggang (Adie dan Krisnawati 2007).
Tanaman kedelai umumnya tumbuh tegak, berbentuk semak, dan merupakan tanaman semusim. Morfologi tanaman kedelai didukung oleh komponen utamanya, yaitu akar, daun, batang, polong, dan biji sehingga pertumbuhannya bisa optimal (Hidayat 1985). Kedelai merupakan tanaman menyerbuk sendiri, yakni pada kepala putik diserbuki oleh tepung sari dari bunga yang sama. Bunga kedelai biasanya membuka pada pagi hari pada kondisi suhu relatif rendah dengan kelembaban yang cukup. Biasanya bunga kedelai telah terserbuki sebelum bunga membuka. Kemungkinan untuk terjadi penyerbukan silang sangat kecil yaitu kurang dari 1%. Keadaan ini mengakibatkan kedelai menjadi homozigot dan kemurnian varietas dapat dipertahankan selama beberapa generasi, sehingga biji-biji dalam satu polong adalah identik (Poelhman 1996).
3 ditingkatkan dengan pupuk nitrogen, sebab penambatan N2 menurun sejalan dengan penambahan jumlah pupuk nitrogen yang diserap. Untuk pupuk nitrat, penurunan ini akibat dari penghambatan penempelan rhizobium ke bulu akar, pengguguran benang infeksi, penurunan laju pertumbuhan bintil, penghambatan penambatan di dalam bintil yang telah terbentuk dan kematian bintil akar yang lebih cepat bila NO3- atau NH4+ ditambahkan (Robertson dan Farnden 1990).
Kedelai tumbuh baik pada tanah yang sedikit masam sampai mendekati netral, pada pH 5.5-7.0 dan pH optimal 6.0-6.5. Pada kisaran pH tersebut hara makro dan mikro tersedia bagi tanaman kedelai. Pada tanah yang bereaksi masam (pH < 5.5), hara fosfor (P), kalsium (Ca), magnesium (Mg), kalium (K), dan sulfur (S) tidak mudah tersedia bagi tanaman kedelai (Khan et al. 2001). Pada tanah masam, unsur Mn, Al, dan Fe tersedia secara berlebihan, sehingga dapat bersifat racun bagi tanaman. Pada tanah masam yang mengandung Al tinggi yaitu lebih dari 20% akan menyebabkan terjadinya keracunan pada akar kedelai, sehingga akar tidak berkembang (pendek dan tebal), tanaman tumbuh kerdil, daun berwarna kuning kecoklatan, dan tidak mampu membentuk polong (Sumarno dan Manshuri 2007).
Bakteri Pseudomonas sp.
Pseudomonas sp. merupakan bakteri Gram negatif yang memiliki ciri-ciri berbentuk batang lurus atau lengkung, ukuran tiap sel bakteri 0.5–0.11 x 1.5–4.0 µm, motil dengan satu atau beberapa flagel, aerob dan tidak membentuk endospora (Madigan et al. 2000). Bakteri Pseudomonas sp. ini mampu mendominasi daerah rizosfer dan berkembang secara cepat (Pelzar dan Chan 1986). Bakteri Pseudomonas sp. ditemukan secara luas di dalam ekosistem tanah dan air, mendegradasi sejumlah besar senyawa organik, berinteraksi dengan tanaman dan berasosiasi dalam rizosfer yang bersifat menguntungkan di bidang pertanian dan sebagian lainnya dapat sebagai agen biokontrol (Palleroni dan Moore 2004). Chen et al. (2006) menyatakan bakteri ini memiliki kemampuan dalam melarutkan fosfat. Wahyudi dan Rachmania (2008) melaporkan bahwa isolat Pseudomonas sp. memiliki kemampuan dalam memproduksi hormon pertumbuhan, seperti IAA dan kemampuannya dalam melarutkan unsur-unsur mineral seperti fosfat.
Berdasarkan kemampuannya dalam berfluoresensi, bakteri Pseudomonas dikelompokkan menjadi bakteri Pseudomonas berfluoresens dan non fluoresens (Ballows et al. 1992). Beberapa bakteri bersifat patogen seperti P. fluoresens, P. putida, dan P. syringaepada tanaman. Hal yang menarik dari bakteri patogen ini adalah kemampuannya dalam menghasilkan hormon IAA yang tinggi (Fett et al. 1987).
Bakteri Bacillus sp.
4
al.2000). Endospora Bacillus berada di dalam sel vegetatif induk dan memilik morfologi ultrastruktur yang kompleks. Endospora tahan terhadap panas, kekeringan, radiasi dan kondisi lingkungan yang tak menguntungkan (Estiken et al. 2002).
Bacillus sp. merupakan salah satu bakteri dari kelompok bakteri tanah yang seringkali dijumpai di dalam rizosfer tanaman. Bacillus yang terdapat di dalam rizosfer tanah secara tidak langsung berpengaruh terhadap pertumbuhan tanaman yaitu sebagai pengendali hayati, seperti berperan sebagai pengendali penyakit layu pada tanaman (Nasrun dan Nuryani 2007).
Bakteri Bradyrhizobium japonicum
Bradyrhizobium japonicum merupakan bakteri berbentuk batang yang memiliki ukuran 0.5–0.9 x 1.3–3.0 µm, motil, Gram negatif, memiliki flagel polar atau subpolar, pertumbuhannya lambat dan membentuk bintil akar pada tanaman leguminose (Madigan et al. 2000). B. japonicum termasuk dalam grup II Rhizobiayang spesifik menodulasi kedelai. Grup II Rhizobiatumbuh lambat dan menghasilkan basa. Anggota dari kelompok ini memerlukan waktu pertumbuhan 3–5 hari pada medium cair dan rata-rata waktu pembelahan 6–7 jam. Kebanyakan galur dalam kelompok ini tumbuh dengan baik dengan menggunakan pentose sebagai sumber karbon (Somasegaran dan Hoben 1994).
Rhizobia sebagian besar bersifat kemoorganotrof aerobik dan mudah dikultur, tumbuh baik dengan keberadaan oksigen, menggunakan karbohidrat dan asam amino sederhana. Beberapa galur Rhizobium memerlukan vitamin untuk pertumbuhannya. Pertumbuhan optimum sebagian besar galur pada suhu 25 sampai 30°C dengan pH 6 sampai 7. Meskipun metabolismenya secara aerobik, beberapa galur dapat tumbuh dengan baik pada keberadaaan oksigen yang minim (mikroaerofilik) (Somasoegaran dan Hoben 1994).
Simbiosis Rhizobium-Legum dipengaruhi oleh penurunan pH tanah. Penurunan pH tanah dapat menimbulkan peningkatan konsentrasi proton, kelarutan logam seperti aluminium yang bersifat toksik terhadap bakteri bintil akar. Respon bakteri bintil akar terhadap tanah asam tergantung pada interaksi sejumlah faktor seperti konsentrasi H+, aktivitas Al3+, dan kemampuan kompetisi dan persistensi dari galur Rhizobium (Tiwari et al. 1992).
Mekanisme Bradyrhizobium dalam meningkatkan pertumbuhan tanaman inang secara langsung melalui produksi IAA dan pengambilan nutrisi fosfat dan mineral lainnya. Mekanisme secara tidak langsung dengan melindungi akar dari serangan patogen melalui produksi metabolit sekunder seperti siderofor dan rizobitoksin (Deshwal et al. 2002).
Bahan Pembawa
5 disebut sebagai carrier pada dasarnya merupakan suatu bahan yang dapat digunakan sebagai tempat hidup inokulum pupuk hayati sebelum diaplikasikan, sehingga harus dapat mengaktifkan kegiatan mikroba agar mampu tumbuh dan berkembang pada saat digunakan. Produksi dan mutu inokulan Rhizobium di beberapa negara berkembang dibatasi oleh ketersediaan bahan pembawa yang sesuai dan keterbatasan teknologi (Khavasia et al. 2007). Nakkeeran et al. (2004) menyatakan beberapa bahan pembawa yang dapat digunakan untuk formulasi pupuk hayati baik organik seperti gambut dan anorganik seperti talek, zeolit, kaolinit, monmorilonit, piropilit, dan vermikulit.
Gambut terbentuk dari timbunan sisa-sisa tanaman yang telah mati, baik yang sudah lapuk maupun belum. Timbunan terus bertambah karena proses dekomposisi terhambat oleh kondisi anaerob atau kondisi lingkungan lainnya yang menyebabkan rendahnya tingkat perkembangan biota pengurai. Pembentukan tanah gambut merupakan proses geogenik yaitu pembentukan tanah yang disebabkan oleh proses deposisi dan transportasi, berbeda dengan proses pembentukan tanah mineral yang pada umumnya merupakan proses pedogenik (Hardjowigeno 1986). Pembentukan gambut diduga terjadi antara 10.000-5.000 tahun yang lalu (pada periode Holosin) dan gambut di Indonesia terjadi antara 6.800-4.200 tahun yang lalu (Andriesse 2003). Gambut merupakan bahan carrier yang selama ini dianggap memenuhi persyaratan tersebut, namun demikian perlu dicari alternatif bahan pembawa yang lain baik sebagai bahan utama atau sebagai bahan substitusi (Burton 1979). Selanjutnya talek merupakan mineral yang sangat lunak dengan rumus kimia (Mg3Si4O10(OH)2) dan mempunyai luas permukaan < 20 µm dan berada di dalam pasir, lumpur, dan liat yang mempunyai ikatan sangat kuat. Umumnya terjadi sebagai mineral sekunder hasil hidrasi batuan pembawa magnesium, seperti peridotit, gabro, dan dolomite. Talek juga merupakan jenis tanah mineral yang dominan berasosiasi dengan kaolinit dan gibsit, dimana stabilitasnya relatif berbeda dengan mineral lain, karena komponen talek mempunyai kandungan tanah liat yang sangat kuat (Dixon 1989).
Bahan pembawa yang baik adalah bersifat tidak meracuni mikroba, kemampuan absorpsi tinggi, mudah disterilkan, mudah dihaluskan, dan mudah menempel pada bahan tanaman serta tersedia secara melimpah. Berdasarkan penelitian di rumah kaca sebelumnya, menurut Siregar (2011) kedua bahan pembawa talek dan gambut memiliki pengaruh yang berbeda dalam meningkatkan pertumbuhan tanaman dan sebagai tempat hidup sementara bakteri inokulan. Oleh karena itu, dalam penelitian lanjutan ini, kedua bahan pembawa akan diuji kembali untuk diaplikasikan di tanah lapang.
3
METODE
Tempat dan Waktu Penelitian
6
Cimanggu-Bogor dan lahan pertanian di Kelurahan Ranca Bungur Kecamatan Semplak, Bogor sebagai lokasi untuk pengujian formula inokulan.
Bahan Penelitian
Bahan yang digunakan adalah : benih kedelai tahan asam (Anjasmoro); bahan pembawa (talek dan gambut); rhizobakteria yang digunakan terdiri dari 6 isolat yaitu galur Bacillus sp. Cr 24, Cr 55, Cr 76 dan Pseudomonas sp. Crb 17, Crb 64, Crb 86 (Siregar 2011), dan bakteri penambat nitrogen yang bersimbiosis dengan tanaman kedelai Bradyrhizobium japonicum Bj 11 (Wahyudi et al. 1998). Media yang digunakan adalah; King’S B agar untuk Pseudomonas sp., Nutrient Agar (NA) untuk Bacillus sp., dan Yeast Manitol Agar (YMA) untuk B. japonicum (Bj 11) dan media susu skim molase dan Yeast Manitol Broth (YMB) untuk formulasi kultur inokulum (Lampiran 1).
Peremajaan Bakteri
Peremajaan isolat bakteri yang digunakan dilakukan dengan menggoreskan bakteri pada media padat yang sesuai yaitu King’s B agar, NA, dan YMA masing -masing untuk Pseudomonas sp., Bacillus sp., dan Bradyrhizobium japonicum. Pada media YMA untuk BJ 11 ditambahkan antibiotik rifampisin (50 µg/ml).
Pembuatan Paket Pupuk Hayati
Bakteri PGPR Pseudomonas sp. dan Bacillus sp. ditumbuhkan ke dalam media alternatif berupa susu skim molase, sedangkan bakteri B. japonicum Bj11 ditumbuhkan dalam media Yeast Manitol Broth (YMB). Waktu pemanenan bakteri mengacu pada penelitian Siregar (2011), yaitu isolat Bj 11 selama 5 hari inkubasi, isolat Pseudomonas sp (kode: CRB 17 dan CRB 64) dan Bacillus sp (kode: CR 24 dan CR 55) dipanen setelah 2 hari masa inkubasi. Sedangkan isolat Pseudomonas sp (kode: CRB 86) dan Bacillus sp (kode: CR 76) dipanen hanya 1 hari masa inkubasi. Bakteri yang telah mencapai kepekatan ± 108 sel/ml kemudian dicampurkan dengan perbandingan 1:1:1 untuk selanjutnya dicampurkan pada bahan pembawa gambut dan talek untuk menjadi bentuk serbuk, granul, dan tepung. Pemilihan komposisi bakteri penyusun paket inokulan disesuaikan dengan hasil penelitian sebelumnya, dimana ketiga komposisi isolat tersebut paling efektif dalam memacu pertumbuhan tanaman kedelai pada percobaan rumah kaca (Siregar 2011).
7 dan granul, persiapan bahan pembawa pupuk bentuk tepung mengikuti prosedur Nandakumar et al. (2001), yaitu bahan talek ditambah kaptan sebanyak 1% dari total berat campuran dan dikemas sebanyak 300 g setiap kemasan. Kedua jenis bahan pembawa dimasukkan ke dalam plastik tahan panas untuk selanjutnya disterillisasi terlebih dahulu menggunakan autoklaf pada suhu 121 °C dan tekanan 1 atm selama 2 x 15 menit.
Bentuk Serbuk
Untuk kemasan bentuk serbuk disiapkan 50 g bahan pembawa gambut yang sudah bercampur dengan kapur pertanian, dan fosfat alam steril yang telah dingin, kemudian disuntikkan dengan campuran ketiga isolat sebanyak 15 ml secara aseptis. Setelah diinokulasikan, ketiga inokulan disebar kesemua bagian permukaan gambut secara merata dan kemasan bentuk serbuk siap untuk digunakan dan disimpan pada suhu ruang.
Bentuk Granul
Gambut sebanyak 250 g yang sudah disterilisasi sebelumnya dikeringkan untuk mencapai kadar air < 20%. Pemberian inokulan dilakukan dengan memasukkan ketiga inokulan campuran kedalam botol semprot steril, yaitu sebanyak 110 ml inokulan campuran ke dalam 250 g bahan pembawa gambut, kemudian dilakukan penyemprotan pada gambut pada saat proses granulasi dengan menggunakan mesin granulator khusus pembuatan pupuk hayati. Granul yang terbentuk dikering-anginkan dalam ruang bersih dan siap dikemas serta disimpan untuk selanjutnya digunakan.
Bentuk Tepung
Sebanyak 300 g talek yang sudah disterillisasi dan sudah didinginkan selama satu malam dilakukan inokulasi ketiga biakan kultur cair, masing-masing inokulan 35 ml dicampurkan secara aseptik hingga merata dan siap dicampurkan pada talek. Campuran tersebut dikering-anginkan dalam ruang teduh dan bersih untuk mencapai kadar air < 20%.
Uji Viabilitas Inokulan Bakteri
8
populasi Pseudomonas sp. dengan penambahan antibiotik Ampicillin, media NA untuk Bacillus sp. dengan penambahan antibiotik Chloramphenicol, dan media YMA untuk populasi inokulan B. japonicum (Bj11) dengan penambahan antibiotik Rifampisin.
Analisis Kimia Tanah
Analisis kimia tanah dilakukan untuk sampel tanah meliputi pH tanah, kadar nitrogen tersedia, fosfor, dan kalium tersedia dengan metode standar.
Total Plate Count (TPC) Bakteri
Sebanyak 10 gram sampel tanah, kemudian disuspensikan dalam 90 ml larutan garam fisiologis steril, untuk kemudian dilakukan pengenceran serial dengan menggunakan 9 ml garam fisiologis steril hingga 10-7. Suspensi tersebut lalu diinokulasikan 100 µl ke dalam medium Standard Method Agar (SMA) dan disebar secara merata dengan batang penyebar, kemudian diinkubasi selama 24-48 jam dan diamati pertumbuhannya serta dihitung total populasinya berdasarkan metode TPC.
Total Plate Count(TPC) Bakteri Penambat Nitrogen
Sebanyak10 gram sampel tanah disuspensikan dalam 90 ml larutan garam fisiologis steril, untuk kemudian dilakukan pengenceran serial dengan menggunakan 9 ml garam fisiologis steril hingga 10-7. Suspensi tersebut lalu diinokulasikan ke dalam medium seleksi Yeast Manitol Agar (YMA) yang ditambah Congo Red 0,25% dan disebar secara merata menggunakan batang penyebar, kemudian diinkubasi selama 3-5 hari dan diamati pertumbuhannya serta dihitung total populasinya berdasarkan metode TPC.
Rancangan Percobaan
Pengujian paket formula inokulan dilakukan dengan mengkombinasikan dengan pupuk Urea untuk hara N, SP36 untuk hara P dan KCl untuk hara K. Dosis yang digunakan berdasarkan petunjuk teknis pengelolaan tanaman kedelai, yaitu 50 kg Urea/ha, 75 kg SP36/ha, dan 100 kg KCl/ha (BPTP 2010). Percobaan disusun dalam rancangan acak kelompok lengkap dengan 12 perlakuan yang masing-masing diulang 3 kali pada ketiga bentuk pupuk hayati yang digunakan (serbuk, granul dan tepung) ditampilkan pada Tabel 1.
9 mikroorganisme. Inokulasi pupuk hayati dilakukan bersamaan dengan penanaman benih kedelai. Benih kedelai Anjasmoro dibasahi dengan air dan kemudian dicampur dengan paket inokulan bakteri dalam bentuk serbuk maupun tepung dari masing-masing paket sesaat sebelum benih ditanam dengan dosis 50 g paket inokulan untuk 1 kg biji kedelai. Selanjutnya untuk paket bentuk granul diberikan bersamaan dengan waktu penanaman, yaitu dalam 1 lubang terdiri dari 1 butir granul formula kemudian lubang ditutup. Kedelai ditanam dengan jarak tanam 40 cm x 15 cm pada plot tanaman sebesar 3.5 x 4 m dengan 2 biji kedelai per lubang tanam. Lubang tanam pada plot percobaan sebanyak 230 lubang. Pemeliharaan tanaman dilakukan dengan membersihkan gulma seminggu sekali. Pengamatan pertumbuhan dilakukan terhadap berat basah tajuk, berat kering tajuk, berat basah akar, berat kering akar, dan jumlah bintil akar pada 45 HST. Pengamatan produksi dilakukan terhadap berat polong per rumpun, berat biji per rumpun, berat 100 biji, serta produktivitasnya dalam ton ha-1 yang diamati ketika tanaman dipanen setelah mencapai 3 bulan. Data dianalisis dengan analisis ragam dan dilakukan uji lanjutan dengan Duncan Multiple Range Test (DMRT) pada α = 5%.
Tabel 1 Perlakuan, kode isolat, dan dosis pupuk NPK yang digunakan pada tiap plot percobaan
Keterangan : M_RS adalah paket formula pupuk hayati dan biokontrol fungi patogen Rhizoctonia solani, M_FO adalah paket formula pupuk hayati dan biokontrol fungi patogen Fusarium oxysporum, dan M_SR adalah paket formula pupuk hayati dan biokontrol fungi patogen Sclerotium rolfsii.
Perlakuan Kode Isolat dalam Formula Dosis N:P:K (g plot-1) M_RS+NPK 1 Bacillus Cr 76 + Pseudomonas Crb 86
+ B. japonicum Bj 11 69:138:83 M_RS+NPK 0.5 Bacillus Cr 76 + Pseudomonas Crb 86
+ B. japonicum Bj 11 34.5:69:41.5 M_RS Bacillus Cr 76 + Pseudomonas Crb 86
+ B. japonicum Bj 11 0
M_FO+NPK 1 Bacillus Cr 24 + Pseudomonas Crb 17
+ B. japonicum Bj 11 69:138:83 M_FO+NPK 0.5 Bacillus Cr 24 + Pseudomonas Crb 17
+ B. japonicum Bj 11 34.5:69:41.5 M_FO Bacillus Cr 24 + Pseudomonas Crb 17
+ B. japonicum Bj 11 0
M_SR+NPK 1 Bacillus Cr 55 + Pseudomonas Crb 64
+ B. japonicum Bj 11 69:138:83 M_SR+NPK 0.5 Bacillus Cr 55 + Pseudomonas Crb 64
+ B. japonicum Bj 11 34.5:69:41.5 M_SR Bacillus Cr 55 + Pseudomonas Crb 64
+ B. japonicum Bj 11 0
NPK 1 - 69:138:83
NPK 0.5 - 34.5:69:41.5
10
4
HASIL
Formulasi Pupuk Hayati
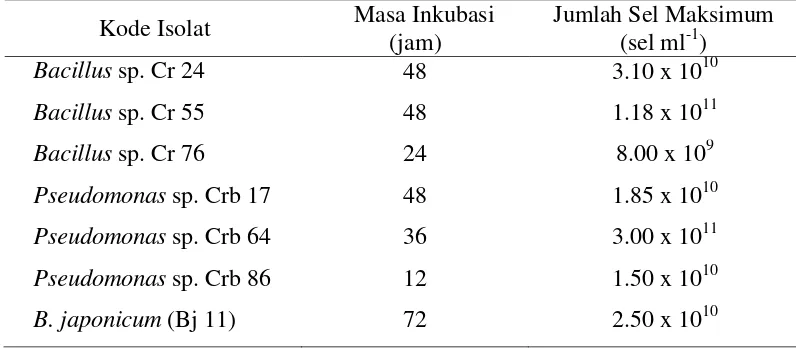
Bakteri PGPR yang digunakan ditumbuhkan dalam media alternatif susu skim molase cair yang mengacu pada penelitian sebelumnya. Dalam perbanyakan sel, ketiga jenis bakteri yang digunakan jumlahnya mencapai maksimum. Pada media susu skim molase cair, tiga isolat Bacillus sp. berkisar antara 8.00 x 109 sel ml-1 sampai 1.18 x 1011 sel ml-1, dan tiga isolat Pseudomonas sp. berkisar antara 1.5 x 1010 sel ml-1 sampai 3.00 x 1011 sel ml-1. Adapun waktu inkubasi ketiga isolat Bacillus sp. berkisar antara 24 sampai 48 jam, dan untuk ketiga isolat Pseudomonas sp. berkisar antara 12 sampai 48 jam. Selanjutnya pada isolat B. japonicum (BJ 11) untuk mencapai jumlah sel maksimum dibutuhkan waktu inkubasi selama 72 jam, yaitu dengan mencapai populasi sel 2.5 x 1010 sel ml-1 (Tabel 2). Berdasarkan kegiatan pembuatan formulasi pupuk hayati diperoleh tiga paket formulasi yang selanjutnya diberi kode M_RS, M_FO, dan M_SR dengan tiga bentuk kemasan. Paket inokulan tersebut dikemas dalam serbuk, granul, dan tepung yang dibungkus plastik dan diberi label (Gambar 1).
Gambar 1 Penampilan kemasan pupuk hayati bentuk Serbuk (a), Granul (b), dan Tepung (c)
a b
11 Tabel 2 Kepadatan sel bakteri yang diinokulasikan ke dalam bahan pembawa
Kode Isolat Masa Inkubasi (jam)
Jumlah Sel Maksimum (sel ml-1)
Bacillus sp. Cr 24 48 3.10 x 1010
Bacillus sp. Cr 55 48 1.18 x 1011
Bacillus sp. Cr 76 24 8.00 x 109
Pseudomonas sp. Crb 17 48 1.85 x 1010
Pseudomonas sp. Crb 64 36 3.00 x 1011
Pseudomonas sp. Crb 86 12 1.50 x 1010
B. japonicum (Bj 11) 72 2.50 x 1010
Pemilihan komposisi bakteri penyusun paket inokulan disesuaikan dengan hasil penelitian Siregar (2011), dimana ketiga komposisi tersebut efektif dalam memacu pertumbuhan tanaman kedelai pada percobaan rumah kaca. Ketiga bentuk paket formulasi pupuk memiliki kandungan air yang berdeda, pada paket bentuk serbuk dengan bahan dasar gambut memiliki kadar air berkisar 44 sampai 46%, bentuk granul memiliki kadar air berkisar 5 sampai 10%, sedangkan bentuk tepung dengan bahan dasar talek memiliki kadar air berkisar 2 sampai 6% (Siregar 2011).
Viabilitas Inokulan Bakteri Selama Masa Penyimpanan
Viabilitas sel bakteri pada pupuk dihitung dengan metode cawan sebar pada penyimpanan suhu ruang dan suhu 4 °C dengan lama penyimpanan selama 6 bulan disajikan dalam Lampiran 2 dan 3. Jumlah konsentrasi bakteri per gram bahan pembawa dalam bentuk serbuk, gambut, dan tepung mengalami penurunan jumlah konsentrasi pada pengujian 0 bulan hingga bulan ke-6, karena sebagian bakteri mengalami kematian sel. Berdasarkan hasil penghitungan jumlah sel bakteri selama masa penyimpanan 6 bulan dalam suhu ruang berkisar 1.55 x 107 hingga 3.84 x 108 sel g-1 paket formulasi untuk isolat Cr, selanjutnya 2.50 x 107 hingga 1.27 x 108 sel g-1 paket formulasi untuk isolat Crb, dan untuk isolat Bj 11 jumlah sel antara 1.15 x 106 hingga 1.67 x 108 sel g-1 paket formulasi. Selanjutnya untuk penghitungan jumlah sel bakteri pada suhu 4 °C berkisar 1.35 x 107 hingga 1.84 x 108 sel g-1 paket formulasi untuk isolat Cr, selanjutnya 2.00 x 107 hingga 1.15 x 108 sel g-1 paket formulasi, dan untuk isolat Bj 11 berkisar antara 1.66 x 106 hingga 1.82 x 108 sel g-1 paket formulasi.
Keefektifan Inokulan Terhadap Pertumbuhan Tanaman Kedelai
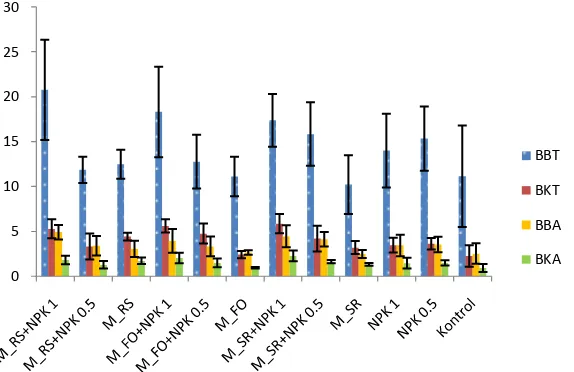
12 menggunakan cawan sebar YMA dengan masa inkubasi mencapi 5 sampai 7 hari. Sementara itu jumlah bahan organik N serta mineral P dan K pada sampel tanah kering sebelum penanaman diketahui berturut-turut sebesar 0.08%, 8.4 ppm, dan 622 ppm. Selanjutnya untuk mengetahui efektivitas dari inokulan perlu adanya uji efektivitas bakteri PGPR dalam meningkatkan pertumbuhan tanaman yang dilakukan di tanah lapang. Hasil uji efektivitas paket formulasi kemasan serbuk, granul, dan tepung terhadap beberapa parameter pertumbuhan tanaman kedelai disajikan dalam Gambar 2, 3, dan 4. Respon tanaman kedelai terhadap pemberian inokulan berbeda-beda untuk setiap perlakuan yang diamati pada 45 hari setelah tanam.
Gambar 2 Pengaruh pemberian paket inokulan kemasan Serbuk dan NPK terhadap Berat Basah Tajuk (BBT), Berat Kering Tajuk (BKT), Berat Basah Akar (BBA), dan Berat Kering Akar (BKA) per rumpun pada tanaman Kedelai berumur 45 hari setelah tanam
13 terhadap Berat Basah Tajuk (BBT), Berat Kering Tajuk (BKT), Berat Basah Akar (BBA), dan Berat Kering Akar (BKA) per rumpun pada tanaman Kedelai berumur 45 hari setelah tanam
Respon pertumbuhan yang lebih baik ditunjukkan oleh perlakuan inokulan yang dikombinasikan dengan pupuk NPK terutama dengan dosis penuh. Seperti halnya pada perlakuan kemasan serbuk dari ketiga paket inokulan dengan dosis pupuk NPK penuh mampu meningkatkan berat basah tajuk, berat kering tajuk, berat basah akar, dan berat kering akar. Perlakuan ini bahkan memberikan hasil yang lebih baik dibandingkan dengan perlakuan pemberian NPK penuh. Akan tetapi, pemberian inokulan dengan pupuk NPK dosis setengah, hanya perlakuan paket M_SR yang belum mampu meningkatkan berat basah tajuk yang lebih baik dibandingkan dengan perlakuan pemberian NPK dosis penuh. Untuk respon pertumbuhan yang ditunjukkan oleh kemasan granul, perlakuan paket inokulan dengan kombinasi pupuk NPK dosis penuh dan dosis setengah, mampu meningkatkan berat basah tajuk, berat kering tajuk, berat basah akar, dan berat kering akar. Perlakuan kemasan granul ini memberikan hasil yang lebih baik dibandingkan dengan perlakuan pemberian NPK dengan dosis penuh. Selanjutnya pada perlakuan kemasan tepung dari ketiga paket inokulan dengan dosis pupuk NPK penuh mampu meningkatkan berat basah tajuk, berat kering tajuk, berat basah akar, dan berat kering akar. Perlakuan ini bahkan memberikan hasil yang lebih baik dibandingkan dengan perlakuan kontrol pemberian NPK dosis penuh. Akan tetapi, pemberian inokulan dengan pupuk NPK dosis setengah, hanya perlakuan paket M_SR yang mampu meningkatkan berat basah tajuk dan akar serta berat kering tajuk dan akar yang lebih baik dibandingkan dengan perlakuan pemberian NPK dosis penuh dan setengah.
14
mampu meningkatkan jumlah bintil akar dibandingkan dengan perlakuan dengan pupuk NPK baik dosis penuh maupun dosis setengah.
Tabel 3 Pengaruh pemberian paket inokulan pada kemasan Serbuk, Granul, dan Tepung yang dikombinasikan dengan pupuk NPK terhadap jumlah bintil (per rumpun) pada tanaman Kedelai berumur 45 hari setelah tanam Perlakuan M_RS+NPK 1 21.76±8.66cd 11.29±7.31bc 20.53±14.62e M_RS+NPK 0.5 26.14±18.91d 16.85±8.69c 14.04±5.43bcde
M_RS 31.25±16.27d 10.91±4.45bc 18.30±1.15de
M_FO+NPK 1 21.27±11.69bcd 10.04±5.30bc 16.43±6.28cde M_FO+NPK 0.5 31.53±12.64d 6.06±5.61ab 6.27±1.64ab M_FO 17.65±5.60abcd 7.49±3.39ab 7.16±1.36abc M_SR+NPK 1 28.23±7.29d 9.08±4.77bc 11.50±1.88bcde M_SR+NPK 0.5 22.64±4.58cd 5.82±3.15ab 11.65±3.24bcde
M_SR 28.02±3.25d 7.77±2.00ab 9.16±0.42abcd
NPK 1 5.94±7.46abc 0.21±0.36a 0.19±0.21a NPK 0.5 0.33±0.27a 0.09±0.15a 0.02±0.03a Kontrol 3.00±2.45ab 0.03±0.05a 0.07±0.13a *Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (Uji Selang Berganda Duncan). Data adalah nilai rata-rata ± standar deviasi (n =3).
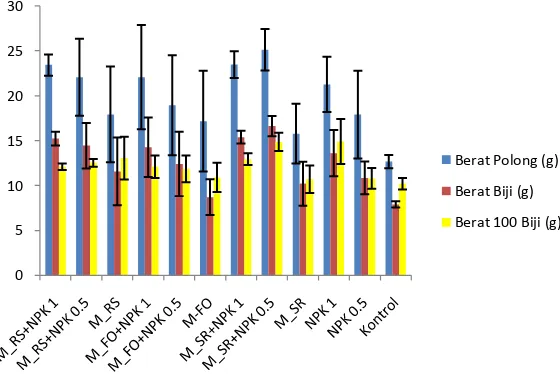
Respon paket inokulan ketiga bentuk kemasan terhadap produksi biji kedelai dengan masa tanam selama 3 bulan, diketahui dapat meningkatkan berat polong, berat biji per rumpun, berat 100 biji (Gambar 5, 6, dan 7), dan produksi dalam ton ha-1 biji tanaman kedelai (Tabel 4). Respon terhadap produksi biji kedelai yang lebih baik ditunjukkan oleh perlakuan inokulan yang dikombinasikan dengan pupuk NPK terutama dengan dosis penuh. Seperti pada perlakuan kemasan serbuk, granul, dan tepung dari ketiga paket inokulan dengan dosis pupuk NPK penuh dan dosis setengah mampu meningkatkan berat polong per rumpun dan berat biji per rumpun. Perlakuan ini memberikan hasil yang lebih baik dibandingkan dengan perlakuan pemberian NPK dengan dosis penuh dan dosis setengah. Akan tetapi tidak untuk perlakuan kemasan serbuk paket M_SR dosis NPK setengah dan kemasan tepung paket M_FO dosis NPK penuh dan setengah, ketiga paket tersebut belum mampu meningkatkan berat biji per rumpun yang lebih baik dibandingkan dengan perlakuan pemberian NPK dengan dosis penuh dan kemasan granul paket M_FO dosis NPK setengah belum mampu meningkatkan berat polong per rumpun dan berat biji per rumpun yang lebih baik dibandingkan dengan perlakuan pemberian NPK dengan dosis penuh.
15
0 5 10 15 20 25 30 35 40
Berat Polong (g)
Berat Biji (g)
Berat 100 Biji (g)
0 5 10 15 20 25 30
Berat Polong (g)
Berat Biji (g)
Berat 100 Biji (g)
perlakuan kemasan granul paket inokulan dengan pemberian NPK dosis penuh maupun dosis setengah belum memberikan hasil yang lebih baik dibandingkan dengan perlakuan pemberian NPK dosis penuh. Akan tetapi paket inokulan dengan pemberian NPK dosis setengah mampu meningkatkan berat 100 biji dibandingkan dengan perlakuan pemberian NPK dosis setengah. Sedangkan untuk respon berat 100 biji pada kemasan tepung ketiga paket inokulan dengan pemberian NPK dosis penuh dan dosis setengah mampu memberikan hasil yang lebih baik dibandingkan dengan perlakuan pemberian NPK dosis penuh dan dosis setengah, tetapi tidak pada paket inokulan M_FO dengan pemberian NPK dosis setengah belum mampu meningkatkan berat 100 biji dibandingkan dengan perlakuan kontrol pemberian NPK dosis setengah.
Gambar 5 Pengaruh pemberian paket inokulan kemasan Serbuk dan NPK terhadap Berat Polong, Berat Biji, dan Berat 100 Biji (per rumpun) dengan masa tanam 3 bulan
16
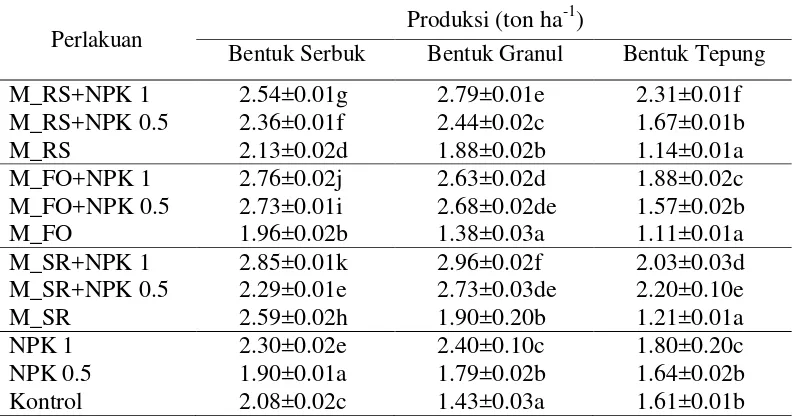
Bentuk Serbuk Bentuk Granul Bentuk Tepung
M_RS+NPK 1 2.54±0.01g 2.79±0.01e 2.31±0.01f
M_RS+NPK 0.5 2.36±0.01f 2.44±0.02c 1.67±0.01b
M_RS 2.13±0.02d 1.88±0.02b 1.14±0.01a
M_FO+NPK 1 2.76±0.02j 2.63±0.02d 1.88±0.02c
M_FO+NPK 0.5 2.73±0.01i 2.68±0.02de 1.57±0.02b
M_FO 1.96±0.02b 1.38±0.03a 1.11±0.01a
M_SR+NPK 1 2.85±0.01k 2.96±0.02f 2.03±0.03d
M_SR+NPK 0.5 2.29±0.01e 2.73±0.03de 2.20±0.10e
M_SR 2.59±0.02h 1.90±0.20b 1.21±0.01a
NPK 1 2.30±0.02e 2.40±0.10c 1.80±0.20c
NPK 0.5 1.90±0.01a 1.79±0.02b 1.64±0.02b
Kontrol 2.08±0.02c 1.43±0.03a 1.61±0.01b
*Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (Uji Selang Berganda Duncan). Data adalah nilai rata-rata ± standar deviasi (n =3).
17 paket inokulan dengan dosis penuh rata-rata mencapai 2.79 ton ha-1 dan dosis setengah rata-rata 2.62 ton ha-1, hasil ini lebih tinggi dan memiliki nilai yang signifikan terhadap perlakuan tanaman dengan pemberian NPK dengan dosis penuh sebesar 2.40 ton ha-1 dan dosis setengah sebesar 1.79 ton ha-1. Selanjutnya perlakuan kemasan tepung dari ketiga paket inokulan dengan dosis penuh rata-rata mencapai 2.07 ton ha-1 dan dosis setengah 1.81 ton ha-1, hasil ini lebih tinggi dan memiliki nilai yang signifikan dibandingkan dengan hasil perlakuan tanaman dengan pemberian NPK dengan dosis penuh sebesar 1.80 ton ha-1 dan dosis setengah sebesar 1.64 ton ha-1.
5
PEMBAHASAN
Jumlah sel bakteri yang terdapat dalam bahan pembawa dihitung secara berkala untuk mengetahui viabilitas bakteri selama masa penyimpanan. Tinggi rendahnya viabilitas bakteri di dalam bahan pembawa selama masa penyimpanan menunjukkan kualitas inokulan bakteri yang diproduksi. Berdasarkan hasil penghitungan jumlah sel bakteri selama masa penyimpanan 6 bulan dalam suhu
Dengan mempertimbangkan kisaran rata-rata jumlah sel bakteri yang terkandung dalam talek dan gambut selama masa simpan 6 bulan kualitas inokulan bakteri yang dihasilkan masih tergolong baik, karena jumlah populasi bakteri dari ketiga isolat pada setiap formula dengan penyimpanan pada suhu ruang rata-rata sebesar 55.5% dan suhu 4 °C rata-rata sebesar 66.6% kepadatan sel mencapai 107 sel g-1 berat kering, hasil rata-rata uji viabilitas dalam penelitian ini masih berada pada ambang baku mutu yang disyaratkan (Simanungkalit et al. 2007). Menurut Husein et al. (2007) bahwa standar kepadatan sel yang terdapat pada produk pupuk hayati adalah sebesar ≥107
cfu g-1 bahan pembawa. Ketentuan berdasarkan Kementan (2011) pupuk hayati harus memenuhi syarat mutu dan efektivitasnya, bahwa standar mutu untuk pupuk hayati majemuk menurut jenis bahan pembawa dalam bentuk serbuk, tepung dan granul harus memiliki total sel hidup ≥107
cfu g-1 berat kering. Bahkan menurut Bashan (1998), inokulan yang menggunakan bahan pembawa berupa gambut dapat bertahan selama satu tahun dalam kondisi gambut tidak steril dan mencapai dua tahun dalam kondisi steril jika disimpan pada suhu 5 °C.
18
dipengaruhi oleh media yang digunakan, jenis bahan pembawa dan daya tahan bakteri tersebut. Bahan pembawa seperti gambut bisa menjadi sumber bahan organik bagi bakteri untuk mempertahankan populasinya selama masa penyimpanan. Sedangkan penyebab lain kemungkinan dapat terkait dengan daya tahan bakteri terhadap kompetisi dengan bakteri lain. Menurut Madigan et al. (2000) terjadinya penurunan dan penaikkan jumlah sel bakteri dalam gambut diduga karena perbedaan kemampuan beradaptasi dengan kondisi gambut seperti pH dan kelembapan. Peningkatan jumlah sel bakteri dalam gambut menunjukkan bahwa selama masa penyimpanan memungkinkan terjadi pertumbuhan sel yang dipengaruhi suhu dan kandungan nutrisi di dalamnya. Gambut merupakan bagian dari jaringan tanaman yang terkarbonasi sebagian dan terbentuk pada kondisi basah melalui dekomposisi berbagai tanaman dan lumut-lumutan (Andriesse 2003). Senyawa organik yang terkadung secara tidak langsung dapat mempengaruhi pertumbuhan tanaman dan bakteri yang tumbuh dalam paket inokulan tersebut. Dibandingkan dengan bentuk serbuk dan granul, bentuk tepung hanya terdiri dari talek yang berupa mineral dengan komposisi kimia yaitu Mg3SiO10(OH)2 (Dixon 1989).
Pada pengujian masa simpan 0 bulan hingga masa 6 bulan pada suhu ruang dan suhu 4 °C hampir semua paket inokulan mengalami penurunan jumlah rata-rata konsentrasi bakteri akibat kematian sejumlah bakteri pada bahan pembawa gambut dan talek. Bakteri yang mati ±103sel g-1dari konsentrasi bakteri pada saat awal diinokulasi dalam bahan pembawa yaitu berkisar antara 8.00 x 109 hingga 3.00 x 1011sel g-1dari ketiga isolat yang digunakan. Jumlah bakteri yang dimasukkan dalam bahan pembawa tersebut sudah memenuhi jumlah sel rhizobakteria yang disarankan untuk diinokulasikan kedalam bahan pembawa menurut Somasegaran dan Hoben (1994). Kemampuan bertahan isolat bakteri selama masa penyimpanan berbeda-beda antar spesies bakteri. Kemampuan tersebut yang akan menentukan viabilitas sel selama penyimpanan. Bakteri dari golongan Bacillus sp. mempunyai struktur bertahan dengan menghasilkan endospora pada saat tidak diperolehnya sumber makanan atau dalam keadaan ekstrim, bahkan endospora Bacillus sp. dapat bertahan bila dipanaskan sampai mendidih (Bai et al. 2003). Strategi bertahan bakteri Pseudomonas sp. salah satunya yaitu dengan mangakumulasi β-polihidroksi butirat (PHB) dalam sel yang berfungsi sebagai sumber karbon dan energi cadangan pada saat kondisi nutriso non karbon dan oksigen terbatas dan diproduksi pada fase stasioner. Peran PHB mirip dengan polimer karbohidrat seperti glikogen pada manusia (Aneja dan Charles 1999).
19 Berdasarkan uji lapang, penggunaan inokulum bakteri pada ketiga bentuk kemasan tanpa kombinasi NPK dapat dilihat belum mampu memberikan hasil seperti yang diharapkan. Aplikasi ketiga paket inokulan dalam bentuk kemasan serbuk, granul, dan tepung yang dikombinasikan dengan pupuk NPK dosis penuh dan dosis setengah, mampu meningkatkan pertumbuhan tanaman kedelai melebihi perlakuan NPK dosis penuh dan setengah, terutama perlakuan kontrol tanpa kombinasi NPK dan paket inokulan. Hasil yang lebih baik ditunjukkan oleh inokulan yang dikombinasikan dengan NPK terutama kombinasi dengan dosis penuh. Inokulan dengan kombinasi NPK dosis penuh mampu meningkatkan berat basah tajuk, berat kering tajuk, berat basah akar, dan berat kering akar dibandingkan pemberian NPK dosis penuh. Respon terhadap berat kering tajuk maupun akar mengalami peningkatan diduga akibat kemampuan bakteri yang dapat menghasilkan hormon pertumbuhan indole acetic acid (IAA) (Patten dan Glick 2002). Hormon IAA dapat meningkatkan pemanjangan akar lateral sehingga dapat meningkatkan penyerapan unsur hara di dalam tanah. Untuk respon berat basah akar pada inokulan yang dikombinasikan NPK dosis penuh meningkatan pertumbuhan akar jika dibandingkan dengan perlakuan kontrol, terutama kontrol tanpa kombinasi NPK dan paket inokulan. Peningkatan pertumbuhan akar mengindikasikan akar dapat berkembang dengan baik, sehingga meningkatkan penyerapan unsur hara dan air di dalam tanah. Isolat-isolat bakteri yang digunakan juga dapat melarutkan fosfat sehingga akar tanaman lebih mudah menyerap fosfat karena bakteri tersebut dapat menghasilkan asam-asam organik (Khan et al. 2009).
Produksi asam organik oleh bakteri menyebabkan menurunnya pH media. Asam organik tersebut selanjutnya mengkelat kation pengikat fosfat membentuk kompleks yang pembentukannya tergantung pada jumlah dan posisi grup fungsional karboksilik dan fenolik dari asam organik tersebut (Barroso et al. 2006). Asam organik seperti asam oksalat, asam sitrat, asam glukonat, asam suksinat, asam fumarat, dan asam asetat dilaporkan terlibat dalam pelarutan fosfat (Alam et al. 2002). Jumlah dan jenis asam organik yang diproduksi oleh mikroorganisme dipengaruhi oleh bahan genetik yang terlibat dalam menghasilkan asam organik (Chen et al. 2006).
20
dipengaruhi juga oleh auksin (Grunewald et al. 2009; Indrasumunar et al. 2012b). Jumlah bintil akar kedelai akan meningkat pada tanaman kedelai yang diberi Rhizobium dan IAA (Ningsih dan Anas 2004).
Auksin endogen dan eksogen akan meningkatkan respon akar terhadap rhizobia dengan cara meningkatkan pembelahan dan differensiasi sel akar saat proses pembentukan bintil akar (Grunewald et al. 2009). Hasil penelitian ini sejalan dengan penelitian Pii et al. (2007) dengan menginokulasi galur Sinorhizobium meliloti penghasil IAA pada Medicago truncatula yang dapat meningkatkan jumlah bintil akar. Selain itu, kompetisi antara B. japonicum BJ 11 dengan bradyrhizobia indigenus menentukan juga jumlah bintil akar yang terbentuk (Appunu dan Dhar 2006).
Asosiasi yang terjadi antara akar tanaman kedelai dengan rhizobakteria dalam penelitian ini berperan dalam proses penyediaan hara nitrogen untuk tanaman. Penyediaan hara N tidak hanya melibatkan peran Bradyrhizobium japonicum semata, tetapi diduga dipengaruhi oleh ko-inokulasi bakteri tersebut dengan bakteri Bacillus Cr dan Pseudomonas Crb. Han et al. (2006) menyatakan genus Bradyrhizobium sp. memiliki hubungan kekerabatan yang lebih dekat dengan Bacillus dibandingkan dengan kelompok rhizobia lain. Oleh karena itu, Bacillus diduga memiliki kapasitas untuk menambat nitrogen dari alam. Sedangkan Kumar dan Chandra (2008) melaporkan bahwa bakteri pelarut fosfat dan PGPR dapat meningkatkan kemampuan kompetisi dan efektivitas Rhizobium sp. yang diinokulasikan ke tanaman Lens culinaris sehingga meningkatkan serapan nitrogen pada tanaman.
Aplikasi inokulan bakteri terhadap produksi kedelai diketahui dapat meningkatkan berat polong per rumpun dan berat biji per rumpun, meski tidak secara nyata taraf α=0.05. Perlakuan inokulan dengan dosis penuh maupun dosis setengah mampu meningkatkan berat polong dan berat biji per rumpun dibandingkan perlakuan NPK dosis penuh dan dosis setengah. Peningkatan berat polong per rumpun dan berat biji per rumpun dapat dipengaruhi oleh adanya peran aktif bakteri bintil akar seperti Bradyrhizobium japonicum dalam pembentukan polong pada tanaman kedelai. Polong yang telah terbentuk selanjutnya akan diisi oleh fotosintat sehingga terbentuklah biji. Jumlah biji sangat ditentukan oleh jumlah dan ukuran polong, sehingga semakin banyak polong maka jumlah biji yang ada semakin banyak pula (Harun dan Ammar 2001).
21 Berdasarkan hasil produktivitas kedelai yang dihasilkan, produksi ton ha-1 dari perlakuan inokulan yang dikombinasikan NPK dosis penuh dan dosis setengah mampu mencapai nilai yang lebih tinggi dan signifikan berbeda nyata (α=0.05) dibandingkan dengan produksi yang dihasilkan pada perlakuan kontrol dengan pemberian NPK dosis penuh, setengah, dan bahkan dibandingkan dengan kontrol tanpa kombinasi NPK dan paket inokulan.
Peningkatan pertumbuhan tanaman dan produksi kedelai melalui aplikasi paket inokulan kemungkinan disebabkan oleh pengaruh langsung dari rhizobakteria Bacillus sp. dan Pseudomonas sp. dalam memacu pertumbuhan tanaman kedelai. Berdasarkan penelitian sebelumnya, rhizobakteria Bacillus sp. dan Pseudomonas sp. yang digunakan dalam penelitian ini mampu menghasilkan hormon pertumbuhan IAA dan senyawa lain seperti siderofor (Wahyudi et al.2011a, Wahyudi et al. 2011b) sehingga dapat membantu meningkatkan pelarutan P oleh bakteri. Hormon IAA berperan sebagai hormon pertumbuhan tanaman sedangkan kemampuan melarutkan fosfat dapat menyebabkan meningkatnya ketersediaan fosfat dalam tanah yang dapat dimanfaatkan oleh tanaman sebagai nutrisi.
Dalam hal ini, Jilani et al. (2007) menyatakan bahwa inokulan bakteri berpeluang dimanfaatkan menjadi pupuk hayati, apabila mampu memberikan hasil lebih baik atau sama dengan perlakuan pupuk kimia dosis penuh ketika diaplikasikan bersama pupuk kimia dalam dosis yang lebih rendah. Dengan melihat pengaruhnya terhadap beberapa parameter pertumbuhan tanaman kedelai dapat dinyatakan bahwa penggunaan pupuk hayati pada penelitian ini belum dapat menggantikan peran pupuk kimia tetapi penggunaan kombinasi antara keduanya dapat memberikan hasil yang lebih baik dalam meningkatkan pertumbuhan tanaman.
Ketidakefektivan penggunaan inokulum bakteri dalam memacu pertumbuhan tanaman kedelai dapat juga dipengaruhi oleh keberadaan mikroorganisme lain yang jumlahnya mencapai 5.6 x 107 sel g-1 sampel tanah yang digunakan. Dari jumlah tersebut, tidak seluruhnya bersinergi dengan bakteri-bakteri yang digunakan dalam penelitian, menurut Meliah (2012) kondisi ini memungkinkan terjadinya persaingan diantara mikroorganisme yang mengkolonisasi tanaman sehingga justru menghambat pertumbuhan tanaman kedelai. Kombinasi yang saling kompatibel lebih efektif dalam mengendalikan dan menekan patogen dalam tanah lapang. Interaksi antara rhizobakteria yang diaplikasikan dengan mikroorganisme tanah yang saling kompatibel menjadi kunci penting dalam keberhasilan aplikasi pupuk hayati di lapangan (Nawangsih 2006).
6
SIMPULAN
22
dan dosis setengah diketahui dapat meningkatkan pertumbuhan tanaman kedelai serta meningkatkan produktivitas tanaman kedelai, terutama paket inokulan dengan dosis penuh yaitu 20%, 16.2% dan 15% peningkatan produksi dibandingkan dengan perlakuan kontrol NPK dosis penuh, sedangkan paket inokulan dengan dosis setengah mampu meningkatkan 29.5%, 45.8% dan 10% dibandingkan dengan perlakuan kontrol NPK dengan dosis setengah. Aplikasi inokulan masih memerlukan pupuk NPK untuk dapat memberikan hasil yang terbaik. Dalam hal ini, ketiga paket formulasi dalam bentuk serbuk, granul, dan tepung dapat direkomendasikan untuk digunakan sebagai pupuk hayati karena diketahui dapat meningkatkan pertumbuhan dan produksi tanaman kedelai.
DAFTAR PUSTAKA
Adie MM, Krisnawati A. 2007. Biologi tanaman kedelai. Di dalam: Sumarno, Suyamto, Widjono A, Kasim H, editor. Kedelai:Teknik Produksi dan Pengembangan. Bogor (ID): Badan Penelitian dan Pengembangan Pertanian. hlm 45-73.
Alam S, Khalil S, Ayub N, Rashid M. 2002. In vitro solubilization of inorganic phosphate by phosphate solubilizing microorganisms (PSM) from maize rhizosphere. Int J Agric Biol 4: 454-458.
Andriesse JP. 2003. Ekologi dan Pengelolaan Tanah Gambut Tropika. Bogor: Fakultas Pertanian. Institut Pertanian Bogor.
Aneja P, Charles TC.1999. Poly-3-hidroxybutirate degradation in Rhizobium (Sinorhizobium) meliloti: Isolation and characterization of gene encoding 3-hidroxybutirate dehidrogenase. J Bacteriol 181:849-857.
Appunu C, Dhar B. 2006. Symbiotic effectiveness of acidtolerant Bradyrhizobium strains with soybean in low pH soil. Afr J Biotechnol. 5:842-845.
Ashrafuzzaman M, et al.. 2009. Efficiency of plant growth promoting
[BPTP] Balai Pengkajian Teknologi Pertanian. 2010. Petunjuk Teknis Pengelolaan Tanaman Terpadu (PTT) Kedelai. Nusa Tenggara Barat (ID): Kementan.
Baharsjah JS. 1983. Legum Pangan. Bogor : Fakultas Pertanian. Institut Pertanian Bogor.
Bai Y, Zhou X, Smith DL. 2003. Enchaced soybean plant growth resulting from co inoculation of Bacillus strains with Bradyrhizobium japonicum.Crop Sci. 43: 1774-1781.
23 Barroso CB, Pereira GT, Nahas E. 2006. Solubilization of CaHPO4 and AlPO4 by Aspergillus niger in culture media with different carbon and nitrogen sources. Braz J Microbiol 37: 434-438.
Bashan Y. 1998. Inoculants of plant growth-promoting bacteria for use in agriculture. Biotechnol Adv 16 : 729-770.
Burton J.C. 1979. New Development In Inoculating Legumes. Recent Advances In Biological Nitrogen Fixation (Ed). NS Subba Rao, Oxford And IBH Publishing Co. New Delhi-India.
Chen YP, et al. 2006. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities. Appl Soil Ecol34: 33-41. Deshwal VK, Dubey RC, and Maheshwari DK. 2002. Isolation of plant growth
promoting strains of Bradyrhizobium (arachis) sp. with biocontrol potential againts macrophomia phaseolina causin charcoal rot of peanut. Curr Sci 84 : 443-448.
Dixon JB. 1989. Kaolinit and Serpentine Group Mineral. Di dalam: Dixon JB, Weed SB, editor: Mineral in Soil Environment. Ed ke-2. USA: Wisconsin. Hal 357-398.
Estiken A, Kardilag H, Erusli S, Turan M, and Sahin F. 2002. The effect of spraying a growth bacterium in yield, growth and nutrient element composition of leaves of Apricot (Prunus americanal.cv. Hacihaliloglu). J Aust Agri Research 54 : 377-380.
Fett WF., Osman SF., Dunn MF.1987. Auxin production by plant-pathogenic Pseudomonas dan Xanthomonas. Appl Environ Microbiol 53: 1839-1845. Grunewald W, Noorden GV, Isterdael GV, Beeckman T, Gheysen G, Mathesius
U. 2009. Manipulation of auxin transport in plant roots during Rhizobium symbiosis and nematode parasitism. Plant Cell 21:2553-2562.
Haas D, Defago G. 2005. Biological Control of Soil-borne Pathogens by Fluorescent Pseudomonads. Nat Rev Microbiol 3: 307-319.
Han HS, Supanjani, Lee KD. 2006. Effect of co-inoculation with phosphate and potassium solubilizing bacteria on mineral uptake and growth of pepper and cucumber. Plant Soil Environ 52: 130-136.
Hardjowigeno S. 1986. Sumber daya fisik wilayah dan tata guna lahan: Histosol. Fakultas Pertanian Institut Pertanian Bogor. Hal. 86-94.
Harun MU, Ammar M. 2001. Respon kedelai (Glycine max) terhadap Bradyrhizobium japonicum strain Hup+ pada tanah masam. J. Pert Indones 3:111-115.
Hidayat OD. 1985. Morfologi Tanaman Kedelai. Hal 73-86. Dalam S. Somaatmadja et al. (Eds.). Puslitbangtan. Bogor.
Husen E, Simanungkalit RDM, Saraswati R, Irawan. 2007. Characterization and Quality Assessment of Indonesian Comersial Biofertilizers. Indones J Agric Sci 8: 31-36.
Indrasumunar A, Menzies NW, Dart PJ. 2012a. Calcium affects the competitiveness of acid-sensitive and acid-tolerant strains of Bradyrhizobium japonicum in nodulating and fixing nitrogen with two soybean cultivars in acid soil. Soil Biol Biochem. 46:115-122.
24
Jilani G, Akram A, Ali RM, Hafeez FY, Shamsi IH, Chaudhry AN, Chaudhry AG. 2007. Enhancing crop growth, nutrients availability, economics and beneficial rhizosphere microflora through organic and biofertilizers. Ann Microbiol 57(2): 177-183.
[Kementan] Kementerian Pertanian. 2011. Peraturan Menteri Pertanian No. 70/Permentan/SR.140/10/2011tentang Pupuk Organik, Pupuk Hayati, dan Pembenah Tanah. Jakarta (ID): Kementan.
Khan AA, McNeilly T, Azhar FM. 2001. Review: Stress Tolerance in Crop Plants. Int J Agri Biol. 3(2):250-256
Khan AA, Jilani G, Akhtar MS, Naqvi SMS, Rasheed M. 2009. Phosporus solubilizing bacteria: Occurred, mechanism and their role in crop production. J Agric Biol Sci 1: 48-58.
Khavasia K, Rejalia F, Seguinb P, Mirappsaric M. 2007. Effect of carrier, sterilization method, and incubation on survival of Bradyrhizobium japonicum in soybean (Glycine Max L) inoculants. Enzyme Microb Tech 41 : 780-784. Kumar R, Chandra R. 2008. Influence of PGPR and PSB on Rhizobium
legumminosarum Bv. viciae strain competition and symbiotic performance in lentil. World J Agric Sci 4: 297-301.
Madigan MT, Martinko JM, Parker J. 2000. Brock Biology of Microorganisms. New Jersey: Prentice-Hall. International Edition.
Meliah S. 2012. Formulasi Rhizobakteria Pelarut Fosfat Sebagai Pupuk Hayati dan Aplikasinya pada Tanaman Kedelai [tesis]. Bogor : Sekolah Pascasarjana IPB.
Mubarik NR, Wahyudi AT, Imas T. 2009. Potensi Bradyrhizobium japonicum toleran asam-aluminium sebagai inokulan pada tanaman kedelai. Prosiding Seminar Penelitian Hasil-hasil Penelitian IPB; 2009 Des 23; Bogor, Indonesia. Bogor (ID). Institut Pertanian Bogor. hlm 655-665.
Nakkeeran S, Kavitha K, Mathiyashagan S, Fernando WGD, Chandrasekar G, Renukadevi P. 2004. Induced systemic resistance and plant growth promotion by Pseudomonas chlororaphis strain PA-23 and Bacillus subtilis strain CBE4 againts rhizome rot of turmeric (Curcuma longa). Can J Plant Pathol 26 : 417-418.
Nandakumar R, Babu S, Viswanathan R, Sheela J, Raguchander T, Samiyappan R. 2001. A new bio-formulation containing plant growth promoting rhizobacterial mixture for the management of sheath blight and enchanced grain yield in rice. Biocontrol 46: 493-510.
Nasrun, Nuryani. 2007. Penyakit layu bakteri pada nilam dan strategi pengendaliannya. J Litbang Pert 26 : 1-15.
Nawangsih AA. 2006. Seleksi dan karakterisasi bakteri biokontrol untuk mengendalikan penyakit layu bakteri (Ralstonia solanacearum) pada tomat [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Ningsih RD, Anas I. 2004. Tanggap tanaman kedelai terhadap inokulasi Rhizobium dan asam indol asetat (IAA) pada Ultisol Darmaga. Bul Agron. 32:25-32.
25 Patten CL, Glick BR. 2002. Role of Pseudomonas putida indoleacetic acid in development of the host plant root system. Appl Environ Microbiol 68(8): 3795-3801.
Pelczar MJ, Chan ESC. 1986. Dasar-dasar Mikrobiologi I. Hadieotomo HS., Imas T., Angka SL. Terjemahan dari Element of Microbiology. Jakarta UI Press. Pii Y, Crimi M, Cremonese G, Spena A, Pandolfini T. 2007. Auxin and nitric
oxide control indeterminate nodule formation. BMC Plant Biol. 7:21.
Poelhman JM. 1996. Breeding Field Corps. New York (US): Henry Hall and Company Inc. p427.
Purwantari ND. 2008. Penambatan nitrogen secara biologis perspektif dan keterbatasannya. Wartazoa 18 (1): 1-3.
Robertson JG and Farnden KJF. 1990. Ultra-structure and metabolism of the developing legume root nodule. The Biochemistry of Plant, Vol 5. New York. Academic Press.
Saraswati R. 1999. Ulas balik teknologi pupuk mikrob multiguna menunjang keberlanjutan sistem produksi kedelai. J Mikrobiol Indones 4 : 1-9.
Simanungkalit RDM, Husen E, Saraswati R. 2007. Buku Mutu Pupuk Hayati dan Sistem Pengawasannya [Internet]. Bogor (ID). [diunduh 2011 Maret 3]. Tersedia pada: http://www.balittanah.litbang.deptan.go.id.
Siregar BA. 2011. Teknologi Formulasi Pupuk Hayati Rhizobakteria dan Aplikasinya sebagai Pemacu Pertumbuhan Tanaman Kedelai dan Biofungisida pada Tanah Masam [tesis]. Bogor (ID): Institut Pertanian Bogor.
Somasegaran P, Hobben HJ. 1994. Handbook for Rhizobia. Method in Legume-Rhizobium Technology. New York (US): Springer Verlag.
Sulistyani N. 2009. Koinokulasi galur Pseudomonas sp. dan Bacillus sp. dengan Bradyrhizobium japonicum dalam pemacuan pertumbuhan dan pengendalian cendawan patogen akar tanaman kedelai [tesis]. Bogor (ID): Institut Pertanian Bogor.
Sumarno, Manshuri AG. 2007. Persyaratan tumbuh dan wilayah produksi kedelai di Indonesia. Di dalam: Sumarno, Suyamto, Widjono A, Kasim H, editor. Kedelai: Teknik Produksi dan Pengembangan. Bogor (ID): Badan Penelitian dan Pengembangan Pertanian. hlm 74-103
Suprapto, H. 1998. Bertanam kedelai. Penebar Swadaya. Jakarta.
Tahar. 2009. RhizobakteriaPseudomonas sp. dan Bacillus sp. toleran asam aluminium sebagai pemacu pertumbuhan tanaman dan pengendali fungi patogen akar tanaman kedelai. [tesis]. Bogor : Sekolah Pascasarjana IPB. Tiwari RP, Reeve WG, Glenn AR. 1992. Mutation conferring acid sensitivity in
the acid toleran strain Rhizobium meliloti WSM419 and Rhizobium leguminosarum biovar viciae WSM710. Feder Europ Microbial Soc 100: 107-112.
Triadiati, MubarikNR, RamasitaY. 2013. Respon Pertumbunan Tanaman Kedelai terhadap Bradyrhizobium japonicum Toleran Masam dan Pemberian Pupuk di Tanah Masam. J Agron Indonesia 41 (1): 24 – 31.
Vessey JK. 2003. Plant growth promoting rhizobacteria as biofertilizer. Plant Soil 255: 571-586.
26
Marker Genes and Competition in Planta. Aspac J Mol Biol Biotechnol 6: 13-20.
WahyudiAT, Mubarik NR. 2008. Kajian Bakteri Rizosfer Pemacu Pertumbuhan Tanaman Kedelai (Glycine max): Isolasi, Karakterisasi, dan Peningkatan Pemacu Pertumbuhan. IPB Bogor: Laporan Akhir Insentif Riset Dasar.
Wahyudi AT, Astuti RI, Giyanto. 2011a. Screening of Pseudomonas sp. isolated from rhizosphere of soybean plant growth promoter and biocontrol agent. Am J Agric Biol Sci 6: 134-141.
Wahyudi AT, Astuti RP, Widyawati A, Meryandini A, Nawangsih AA. 2011b. Characterization of Bacillus sp. strains isolated from rhizosphere of soybean plants for their use as potential plant growth for promoting rhizobacteria. J Microbiol Antimicrob 3: 34-40.
27 Lampiran 1 Komposisi media Nutrient Agar, King’s B Agar, Yeast Manitol Agar,
dan Susu Skim + Molase yang digunakan dalam 100 ml aquades 1. Media Nutrient Agar (NA)
Nutrient Broth : 0.8 g Agar Bacto : 1.5 g
Aquades : 100 ml
pH : 6.8
2. Media King’s B Agar
Agar Bacto : 1.5 g Pepton : 2 g
K2HPO4 : 0.15 g
MgSO4 : 0.15 g
Gliserol : 1.5 g
Aquades : 100 ml
pH : 7.2 ± 0.2
3. Media Yeast Manitol Agar (YMA) Agar Bacto : 2 g Mannitol : 1 g Yeast Ekstrak : 0.1 g
K2HPO4 : 0.05 g
MgSO4 : 0.02 g
NaCl : 0.02 g
Aquades : 100 ml
pH : 6.8 ± 0.2
4. Media Susu Skim + Molase Susu Skim : 2 g
K2HPO4 : 0.15 g
MgSO4 : 0.15 g
Molase : 1.5 ml
Aquades : 100 ml
28
Lampiran 2 Viabilitas sel bakteri pada paket dalam bentuk kemasan selama masa penyimpanan pada suhu ruang
Paket (Bentuk Kemasan)
Kode Isolat
Populasi Bakteri (Sel/g) pada suhu ruang bulan ke-
0 1.5 3 6
M_RS (Serbuk) Cr 76 1.00 x 109 7.00 x 108 2.60 x 108 4.75 x 107 Crb 86 6.50 x 109 9.00 x 108 4.00 x 106 6.65 x 107
BJ 11 5.00 x 108 1.45 x 108 6.00 x 108 1.66 x 106
M_RS (Granul) Cr 76 2.20 x 109 3.00 x 108 2.00 x 108 6.60 x 107 Crb 86 3.00 x 108 7.00 x 108 3.00 x 108 2.90 x 107
BJ 11 1.20 x 108` 1.50 x 108 1.30 x 105 2.14 x 106
M_RS (Tepung) Cr 76 2.20 x 109 3.50 x 108 5.00 x 108 4.91 x 107 Crb 86 8.15 x 109 3.00 x 108 3.00 x 107 6.50 x 107
BJ 11 1.50 x 108 1.00 x 107 3.50 x 105 1.15 x 106
M_SR (Serbuk) Cr 55 1.60 x 1010 1.40 x 108 1.70 x 107 3.84 x 108 Crb 64 3.00 x 109 4.00 x 108 2.90 x 107 3.50 x 107
BJ 11 6.70 x 109 6.50 x 108 1.60 x 108 5.25 x 106
M_SR (Granul) Cr 55 2.50 x 109 4.50 x 108 6.00 x 107 9.00 x 107 Crb 64 3.50 x 108 2.00 x 107 1.00 x 107 2.50 x 107
BJ 11 1.00 x 108 1.00 x 107 1.70 x 106 1.72 x 107
M_SR (Tepung) Cr 55 7.75 x 109 1.80 x 107 1.00 x 107 3.24 x 108 Crb 64 1.00 x 109 1.00 x 106 2.60 x 107 3.20 x 107
BJ 11 2.00 x 108 - 3.00 x 105 4.60 x 106
M_FO (Serbuk) Cr 24 1.55 x 109 3.40 x 108 3.00 x 108 1.33 x 108 Crb 17 8.50 x 107 6.00 x 108 2.00 x 108 1.06 x 108 BJ 11 2.50 x 109 1.50 x 108 7.00 x 108 4.40 x 107 M_FO (Granul) Cr 24 2.50 x 109 3.50 x 108 1.30 x 108 1.55 x 107 Crb 17 3.00 x 109 1.00 x 108 1.00 x 108 5.40 x 107
BJ 11 4.75 x 109 1.50 x 108 4.00 x 108 2.14 x 107
M_FO (Tepung) Cr 24 5.00 x 109 7.00 x 108 3.00 x 108 1.85 x 108 Crb 17 2.25 x 108 2.00 x 108 3.00 x 108 1.27 x 108
BJ 11 1.35 x 106 1.00 x 108 1.00 x 108 1.67 x 108
Keterangan: