PENGKLONAN GEN PENYANDI PEPTIDA SINYAL Pln A DAN
EKSPRESI Pln E DAN Pln F EKSTRASELULER
PADA
Lactococcus lactis
NZ3900
HIDAYAH MURTIYANINGSIH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pengklonan Gen Penyandi Peptida Sinyal Pln A dan Ekspresi Pln E dan Pln F Ekstraseluler pada Lactococcus lactis NZ3900 adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Lembaga Ilmu Pengetahuan Indonesia.
Bogor, Oktober 2015 Hidayah Murtiyaningsih
RINGKASAN
HIDAYAH MURTIYANINGSIH. Pengklonan Gen Penyandi Peptida Sinyal Pln A dan Ekspresi Pln E dan Pln F Ekstraseluler pada Lactococcus lactis NZ3900. Dibimbing oleh SUHARSONO dan APON ZAENAL MUSTOPA.
Lactobacillus plantarum S34 dan S31 yang diisolasi dari Bekasam (fermentasi daging sapi) mampu menghasilkan bakteriosin jenis plantarisin. Plantarisin tersebut memiliki aktivitas penghambatan terhadap beberapa bakteri patogen. Plantarisin disandikan oleh gen pln dan tersebar pada beberapa operon yang masing-masing memiliki fungsi tersendiri dalam sistem biosintesis plantarisin. Terdapat lima operon yang terdiri dari plnABCD, plnEFI, plnJKLR, plnMNOP dan plnGHSTUVW. Operon plnABCD, plnEFI, plnJKLR menyandikan protein yang berperan sebagai regulator dan senyawa antimikroba. Plantarisin EF adalah bakteriosin dua peptida yang termasuk dalam kelas IIa dan kebanyakan diaplikasikan pada pengawetan pangan. Sedangkan pln A merupakan peptida feromon yang memiliki peran sebagai induser dalam sintesis plantarisin. Penelitian ini bertujuan untuk mengklon gen penyandi peptida sinyal pln A (SPplnA) dan mengkonstruksi vektor ekspresi untuk fusi gen pln E dan pln F secara ekstraseluler. Selain itu penelitian ini juga bertujuan untuk mengekspresikan gen penyandi pln E dan pln F secara eksraseluler pada inang L. lactis NZ3900.
Penelitian ini dimulai dari amplifikasi gen pln A dari DNA kromosom L. plantarum S31, kemudian mengklonnya ke dalam vektor kloning pGEM-T Easy. Selanjutnya plasmid rekobinan pGEM-T plnA digunakan sebagai sumber untuk memperoleh sekuen peptida sinyal pln A (SPplnA). Sementara itu gen plnEF didapatkan dari sumber pGEM-T plnEF S34 (penelitian terdahulu). Fusi keduanya dilakukan dengan teknik PCR overlapping sehingga menghasilkan fusi gen dan dikloning ke dalam vektor ekspresi pNZ8148. Vektor ekspresi yang telah membawa fusi gen pln E dan pln F diintroduksikan ke L. lactis NZ3900 menggunakan teknik elektroporasi. Analisis ekspresi Pln E dan pln F dilihat dari level transkripsi maupun translasi dibawah pengaruh konsentrasi nisin dalam menginduksi L. lactis. Aktivitas dari pln E dan pln F dapat dilihat dari ada tidaknya daya penghambatan terhadap bakteri patogen.
Hasil penelitian menunjukkan bahwa fragmen DNA pln A berukuran 300 pb berhasil teramplifikasi dari DNA kromosom L. plantarum S31. Karakterisasi dari sekuen pln A (300 pb) tersebut mengandung 66 pb SPplnA (22 asam amino). Peptida sinyal yang terdapat pada bagian N-terminal memiliki dua bagian pemotongan oleh peptidase yaitu pada glisin21 dan glisin22. Gen yang akan difusikan masing-masing berukuran 66 pb untuk peptida sinyal, 102 pb untuk pln E dan 105 pb untuk pln F. Hasil fusi didapatkan ukuran 168 pb (pln E) dan 171 pb (pln F). Fusi gen kemudian disisipkan pada vektor pNZ8148 diantara Nco1-Pst1 (untuk pln F) dan Nco1-HindIII (untuk pln E) sehingga terbentuk plasmid pNZ8148 rekombinan. Hasil konfirmasi PCR menggunakan primer F/R (promotor /terminator) pada L. lactis rekombinan terlihat bahwa L. lactis rekombinan memiliki ukuran yang lebih tinggi apabila dibandingkan dengan kontrol (450 pb).
mRNA dari pln E dan pln F dilakukan transkripsi balik kemudian diamplifikasi sehingga menghasilkan pita pada ukuran 168 pb dan 171 pb. Selanjutnya analisis SDS-PAGE dari supernatan pln E dan pln F menunjukkan adanya pita protein pada ukuran 3.7 dan 3.85 kDa pada sampel induksi 0.5 ng/ml, 1 ng/ml dan 5 ng/ml nisin. Hal tersebut menunjukkan bahwa pln EF telah disekresikan ke luar sel. Plantarisin E dan plantarisin F sama-sama memiliki aktivitas antimikroba pada patogen E. coli ATCC 8739, S. aureus ATCC 6539, L. monocytogen BTCC B693. Pada kedua plantarisin E dan F zona penghambatan terbesar pada ketiga strain indikator terdapat pada sampel dengan induksi 5 ng/ml.
SUMMARY
HIDAYAH MURTIYANINGSIH. Cloning of Gene Encoding PlnA Signal Peptide and Extracelluler Expression of Plantaricin E and Plantaricin F in Lactococcus lactis NZ3900. Supervised by SUHARSONO dan APON ZAENAL MUSTOPA.
Lactobacillus plantarum S34 and S31, isolated from Bekasam (fermented beef), are able to produces plantaricin, a type of bacteriocins. Plantaricin has inhibitory activity against several bacterial pathogens. Plantaricin is encoded by pln genes and it extend among several operons, plnABCD, plnEFI, plnJKLR, plnMNOP and plnGHSTUVW. Each operon has its own function on the biosynthesis of plantaricin. PlnABCD, plnEFI, and plnJKLR operons encode a proteins which has a role as a regulator and an antimicrobial compounds. Plantaricin EF is a two peptide bacteriocins and it was classified as a class IIa bacteriocin and mostly applied on food preservation. Pln A is a pheromone peptide, and it has a role as an inducer in the synthesis of plantaricin. The aim of this study was to clone a pln A signal peptide gene and to construct an extracelullar expression vector of pln E and pln F in Lactococcus lactis.
The study start from the amplification of pln A gene from chromosomal DNA of L. plantarum S31, then the gene was cloned into the cloning vector pGEM-T Easy. The cloning vector pGEM-T pln A was a source to obtain the signal peptide pln A (SPplnA) and plnEF genes were obtained from pGEM-T pln EF on previous study. The fusion of pln A and pln EF was perform using an overlapping PCR techniques. Then the fused genes was cloned into the expression vector pNZ8148 and then introduced into L. Lactis NZ3900. The introduction was perform using electroporation techniques. The expression of pln EF was analyzed on transcription and translation level. The functional properties of pln EF were verified from the absence of inhibition zone of pathogenic bacteria.
The results showed that a 300 bp DNA fragment containing the SPplnA gene and mature plnA were successfully amplified from chromosomal DNA of L. plantarum S31. It contains 66 bp which encode of SPplnA proteins. The pln A sequence analysis showed that it contains 22 amino acid of signal peptide followed by mature pln A from the 23 rd amino acid residue. The signal peptide located at the N-terminal has two peptidase cutting section, the glisin21 and glisin22. The fused genes were a 66 bp signal peptide, a 102 bp plnE and a 105 bp plnF. The results are a 168 bp pln E fusion gene and a 171 bp pln F fusion gene. Furthermore, a fused gene was inserted into pNZ8148 vector to generate a pNZ8148 SPplnA-plnE/F expression vector. PCR confirmation (using primers F/R; promotor/terminator) results showed that the recombinant L.lactis has a higher size than the control (450 bp).
antimicrobial activity on indicator strain E.coli ATCC 8739, S.aureus ATCC 6539, L. monocytogenes BTCC B693. The biggest inhibition zone on both plantaricin were visible on 5 ng/ml induced samples.
© Hak Cipta Milik IPB dan LIPI, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan LIPI.
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
PENGKLONAN GEN PENYANDI PEPTIDA SINYAL Pln A
DAN EKSPRESI Pln E DAN Pln F EKSTRASELULER
PADA
Lactococcus lactis
NZ3900
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah “Pengklonan Gen Penyandi Peptida Sinyal Pln A dan Ekspresi Pln E dan Pln F Ekstraseluler pada Lactococcus lactis NZ3900”.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Ir Suharsono, DEA dan Bapak Dr Apon Zaenal Mustopa, MSi selaku komisi pembimbing, yang telah memberikan kritik dan saran yang bersifat membangun untuk menyempurnakan tesis ini. Terima kasih juga kepada Dr Ir Iman Rusmana, MSi selaku penguji luar komisi dan kepada DIKTI melalui program BPPDN 2013 yang telah memberikan dana selama penulis melaksanakan perkuliahan di IPB. Di samping itu, penghargaan penulis sampaikan kepada Bapak Dr Ir Bambang Sunarko selaku Kepala Pusat Penelitian Bioteknologi LIPI yang telah mengizinkan penulis untuk melakukan penelitian di Laboratorium Rekayasa Genetika Terapan dan Disain Protein, Puslit Bioteknologi LIPI Cibinong.
Terima kasih kepada Lembaga Ilmu Pengetahuan Indonesia atas bantuan Program Riset KKP3N 2014-2015 yang telah membantu membiayai penelitian ini atas nama Dr Apon Zaenal Mustopa, MSi. Ungkapan terima kasih juga disampaikan kepada keluarga terutama kedua orang tua saya Bpk. Mulyani dan Almarhumah Ibu Endang S, adik saya Ach. Musthofa, kakak sepupu saya Emi Fadillah W, para rekan se-laboratorium Bioteknologi LIPI, Prof Dr Bambang Sugiharto, teman kuliah Bioteknologi 2013, teman alumni UNEJ di Bogor dan seluruh pihak yang membantu atas segala doa, kasih sayang dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL V
DAFTAR GAMBAR V
DAFTAR LAMPIRAN V
1 PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
2 TINJAUAN PUSTAKA 3
Lactobacillus plantarum 3
Bakteriosin 4
Peptida sinyal 6
Ekspresi protein heterolog di L. lactis 6
3 METODE 8
Bahan 8
Tempat dan Waktu Penelitian 8
Prosedur Kerja 9
4 HASIL DAN PEMBAHASAN 13
Penyisipan Gen plnA dari L. plantarum S31 ke pGEM-T Easy 13 Konstruksi Vektor Ekspresi dari Gen PlnE dan PlnF Ekstraseluler 14
Ekspresi plantarisin E dan plantarisin F 17
5 SIMPULAN DAN SARAN 21
Simpulan 21
Saran 21
DAFTAR PUSTAKA 22
LAMPIRAN 26
DAFTAR TABEL
1 Plasmid dan strain bakteri 8
2 Primer yang digunakan untuk amplifikasi fusi gen 9
3 Kondisi reaksi PCR 10
4 Aktivitas antimikroba dari plantarisin E dan F 20
DAFTAR GAMBAR
1 Lokus-lokus plantarisin pada beberapa strain L. plantarum 5 2 Peta vektor kloning pGEM-Teasy dan vektor ekspresi pNZ8148 8 3 Hasil amplifikasi PCR gen plantarisin A (300bp) 13 4 Analisis sekuen gen pln A pada vektor rekombinan 14 5 Skema prosedur konstruksi pNZ8148 SPplnA-plnF 15 6 Hasil amplifikasi fusi pln F dan konfirmasi transformasi pada
Lactococcus lactis NZ3900
16 7 Analisis sekuen fusi gen plnF pada vektor pNZ8148 16 8 Hasil amplifikasi fusi pln E dan konfirmasi transformasi pada
Lactococcus lactis NZ3900
17 9 Analisis sekuen fusi gen plnE pada vektor pNZ8148 17 10 Hasil amplifikasi fusi gen E dan F dari cetakan cDNA L. lactis 18 11 Profil SDS-PAGE dari ekspresi pln F di L. lactis 19 12 Profil SDS-PAGE dari ekspresi pln E di L. lactis 19 13 Contoh aktivitas antimikroba pln F terhadap E. coli ATCC 8739 dari
supernatan L.lactis rekombinan
20
DAFTAR LAMPIRAN
1 Komposisi media pertumbuhan de Man, Rogosa, Sharpe (MRS) 26 2 Komposisi media pertumbuhan Luria-Bertani (LB) 26
3 Komposisi media pertumbuhan M17 26
4 Komposisi Buffer TBE 26
5 Komposisi larutan dalam SDS-PAGE 27
6 Komposisi Bufer Elektroforesis SDS-PAGE 28
1
PENDAHULUAN
Latar Belakang
Mikroorganisme mampu memproduksi berbagai macam senyawa yang memiliki kemampuan sebagai antibakteri. Salah satu grup dari senyawa tersebut adalah bakteriosin yang merupakan peptida atau protein berukuran kecil (20 – 70 asam amino) yang disintesis di ribosom dan dikeluarkan secara ekstraseluler oleh bakteri Gram positif maupun Gram negatif. Bakteriosin dapat menghambat atau mematikan sel dengan cara menurunkan stabilitas dari membran sel (Sabo & Vitolo 2014).
Beberapa jenis mikroba mampu menghasilkan bakteriosin seperti bakteri asam laktat (BAL). Lactobacillus plantarum merupakan salah satu jenis BAL yang menghasilkan bakteriosin dengan nama plantarisin. Pada penelitian sebelumnya telah berhasil diisolasi L. plantarum S34 dan S31 dari bekasam (fermentasi daging sapi) sebagai sumber penghasil plantarisin (Mustopa et al. 2010, Mustopa & Fatimah 2014). Isolat tersebut diketahui memiliki aktivitas penghambatan terhadap beberapa patogen dan telah dikarakterisasi mengenai mekanisme aksinya (Mustopa 2013), selain itu juga memiliki aktivitas protease (Budiarto et al. 2015). Mustopa et al. (2014) dan Kusdianawati et al. (2015) juga telah melakukan kloning dan ekspresi Plantarisin E dan F ke dalam inang E. coli. Bakteriosin yang dihasilkan oleh L. plantarum, khususnya pada kelas II seperti plantarisin EF kebanyakan diaplikasikan pada pengawetan bahan pangan. Plantarisin EF adalah bakteriosin dua peptida yang diproduksi oleh bakteri asam laktat L. plantarum C11. Kedua peptida ini merupakan bakteriosin yang biasa disebut Plantarisin E (PlnE) dan Plantarisin F (PlnF) (Pal & Sheela 2013). Bakteriosin memiliki potensi yang besar untuk digunakan dalam keamanan pangan, probiotik dan terapeutik karena bersifat alami, nontoksik, tidak hanya menghambat spesies berkerabat dekat namun juga pada patogen lain dan mudah didegradasi oleh protease pada saluran pencernaan manusia. Beberapa bakteriosin seperti nisin, pediosin dan enterosin yang dihasilkan oleh L. lactis dan Enterococcus sp. merupakan beberapa contoh bakteriosin yang telah diproduksi secara komersial untuk bahan pengawet (Martin et al. 2007; Borrero et al. 2011).
2
Sel inang yang aman dan telah memiliki status GRAS (Generally Recognized as Safe) yang sering digunakan dalam mengekspresikan protein rekombinan adalah Lactococcus lactis (Mierau et al. 2005). Selain aman, penggunaan L. lactis juga dikarenakan inang tersebut mudah ditangani, telah dikarakterisasi sebagai mikroorganisme yang baik untuk industri dan mampu mensekresikan protein rekombinan pada media pertumbuhannya sehingga produk yang dihasilkan bebas dari endotoksin. Terdapat banyak penelitian yang telah dikembangkan dengan menggunakan inang L. lactis misalnya produksi protease, amilase dan bakteriosin sendiri (Martin et al. 2007; Liang et al. 2010; Jorgensen et al. 2013; Wu et al. 2013 dan Lages et al. 2015). Selain dengan menggunakan inang yang aman, untuk meningkatkan sekresi protein rekombinan pada media pertumbuhanya dapat digunakan gen penyandi peptida sinyal dan difusikan pada gen target.
Sebagian besar bakteriosin yang dihasilkan oleh BAL disintesis dalam bentuk prekursor atau prepeptida yang mengandung penambahan pada N-terminalnya, seperti pada enterosin dan hirasin (Borero et al. 2010). Penambahan tersebut sering disebut dengan leader sequence (tipe double glycine) yang akan mengenali ATP-binding cassette transporter (ABC transporter) kemudian secara bersamaan akan terpotong apabila peptida telah melewati membran sitoplasma. Seperti bakteriosin lainnya, plantarisin A yang dihasilkan oleh L. plantarum S31 diduga memiliki leader sequence. Hal tersebut karena plantarisin A merupakan peptida feromon, dapat menginduksi produksi bakteriosin pada strain tertentu dan memiliki efek antimikroba (Hauge et al. 1998; Sand et al. 2010; Sand et al. 2013). Asseldonk et al. (1993) menyatakan bahwa gen penyandi leader sequence atau peptida sinyal dari L. lactis mampu difusikan dengan gen lain, misalnya difusikan dengan amilase atau jenis enterosin lainnya (Martin et al. 2007; Borrero et al. 2011).
Dari penjelasan di atas dapat dirumuskan bahwa pln EF dari L. plantarum S34 telah berhasil diekspresikan di inang E. coli namun belum diekspresikan ke dalam inang yang aman seperti L. lactis. Maka dalam penelitian ini selain mengganti inang dari E. coli ke L. lactis juga dilakukan pengklonan peptida sinyal pln A dari L. plantarum S31, penggantian peptida sinyal dari pln E dan pln F dengan peptida sinyal pln A. Hal tersebut bertujuan agar ekspresi ekstraseluler dari pln E dan pln F oleh inang L. lactis lebih meningkat.
Tujuan Penelitian
3
2
TINJAUAN PUSTAKA
Lactobacillus plantarum
Kelompok bakteri asam laktat (BAL) yang terkait dengan makanan berfermentasi meliputi 11 genus, antara lain Carnobacterium, Enterococcus, Lactococcus, Lactobacillus, Lactosphaera, Leuconostoc, Oenococcus, Pediococcus, Streptococcus, Vagococcus, dan Weissella (Vries et al. 2006). Mikroorganisme ini termasuk dalam Gram positif (+), tidak bersporulasi, katalasenya negatif, tahan terhadap asam, pH optimum untuk tumbuh antara 4,0 - 4,5, anaerobik aerotoleran, suhu optimum untuk tumbuh adalah 30 °C (mesofilik) atau 42 °C (termofilik) dan memiliki berbagai bentuk, seperti batang (bacil) dan bola (coccus) (Todorov et al. 2010).
Di antara beberapa BAL, kelompok terbesar adalah genus Lactobacillus, yang terdiri lebih dari 150 spesies yang berbeda (Siezen et al. 2010). Lactobacillus plantarum merupakan spesies yang penyebarannya paling luas sehingga dapat ditemukan di berbagai makanan berfermentasi (Kleerebezem et al. 2003). Bakteri ini dapat ditemukan pada fermentasi dengan bahan bertepung/sereal, daging, produk susu, sayuran, buah-buahan dan minuman (Brinques et al. 2010; Ricciardi et al. 2012). Menurut Todorov et al. (2010) strain yang berbeda telah diisolasi dari berbagai relung, seperti fermentasi susu, keju, mentimun, zaitun, nanas, jus jeruk, sorgum bir dan molase. Selain itu di Indonesia, Mustopa dan Fatimah (2014) juga telah mengisolasi berbagai strain L. plantarum dari tempoyak, bekasam dan tape. L. plantarum strain S31 dan S34 merupakan contoh strain yang di isolasi dari bekasam (fermentasi daging sapi), dan telah dideteksi mampu menghasilkan plantarisin (Mustopa et al. 2014; Kusdianawati et al. 2015).
L. plantarum adalah bakteri asam laktat yang memiliki sifat fakultatif heterofermentatif, umumnya memfermentasi karbohidrat dengan jalur phosphoketolase (PKP). Fermentasi pentosa (xylosa, ribosa) mengarah pada pembentukan piruvat dan asetil-P dan selanjutnya dikonversi menjadi laktat dan asetat. Kemudian heksosa (glukosa, fruktosa, manosa) dapat dikonversi menjadi laktat, CO2, dan etanol. Selain itu, genom pada bakteri ini mengkodekan semua enzim yang dibutuhkan untuk jalur glikolisis dan phosphoketolase (Todorov et al. 2010).
Sebagai spesies heterogenus, L. plantarum diketahui memiliki tingkat kekerabatan yang cukup dekat dengan Lactobacillus pentosus, Lactobacillus paraplantarum dan Lactobacillus fabifermentans melalui homologi sekuen 16s rDNA. DNA genom dari beberapa strain L. plantarum juga telah berhasil disekuensing sehingga dapat diketahui karakteristik genetik yang dimilikinya (Parente et al. 2010; Siezen & Van 2011). L. plantarum merupakan bakteri yang sangat adaptif, dapat ditemukan di berbagai macam kondisi ekologis lingkungan, bahkan pada saluran pencernaan hewan dan manusia. Kemampuan hidup di berbagai tipe habitat ini dikarenakan L. plantarum mampu memanfaatkan karbon dari berbagai sumber (Prins et al. 2010).
4
sebagai produk probiotik, salah satu strain yang telah dikomersialkan adalah L. plantarum 299v (Siezen & Van 2011). Konsorsium bakteri ini dapat meningkatkan nilai organoleptik pangan fermentasi dengan cara mensekresikan enzim-enzim glikolitik, lipolitik dan proteolitik yang akan mempengaruhi struktur, aroma dan cita rasa produk tersebut (Todorov et al. 2012).
L. plantarum juga digunakan secara alami pada makanan fermentasi sehubungan dengan timbulnya cita rasa asam (asidifikasi) akibat dari produksi asam laktat dan asetat. Efek asam tersebut diakibatkan adanya konversi karbohidrat selama fermentasi. Hal tersebut merupakan karakteristik penting guna memperpanjang masa simpan dan keamanan produk. Perlindungan makanan dari kebusukan dan mikroorganisme patogen oleh bakteri asam laktat (BAL) adalah melalui produksi asam organik, hidrogen peroksida, diasetil, komponen anti jamur seperti asam laktat atau asam fenulaktik dan bakteriosin (Sabo & Vitolo 2014).
Bakteriosin
Bakteriosin adalah peptida atau protein antimikroba yang disintesis di ribosom dan dikeluarkan ke ekstraseluler oleh mikroorganisme Gram positif (+) dan Gram negative (-). Sejarah dari bakeriosin sebagai antimikroba diawali dengan adanya penelitian pada tahun 1925 mengenai zat antibakteri. André Gratia menerbitkan sebuah artikel mengenai kapasitas penghambatan E. coli pada strain lain dari spesies yang sama. Senyawa yang dihasilkan memiliki efek penghambatan dan disebut colicin. Nama tersebut mengacu pada mikroorganisme yang menghasilkannya (Collins et al. 2010). Pada tahun 1928, dilaporkan mengenai kemampuan strain Lactococci untuk menghambat strain LAB lainnya. Kemudian pada tahun 1947, Mattick dan Hirsh melaporkan mengenai zat penghambat yang diisolasi dari strain Lactococcus lactis subsp. lactis, disebut nisin (Cotter et al. 2005). Bakteriosin jenis nisin ini kemudian dimurnikan dan dipasarkan pada tahun 1953 di Inggris. Pada tahun 1969, nisin dianggap aman untuk digunakan dalam produk makanan oleh Joint Food and Agriculture Organization (Organisasi Kesehatan Dunia/Ahli Food Additives). Pada tahun yang sama istilah bakteriosin diusulkan sebagai peptida antimikroba yang dihasilkan oleh mikroorganisme.
Bakteriosin dapat dikelompokkan menjadi 4 kelas berdasarkan struktur primer, berat molekul, stabilitas terhadap panas dan modifikasi dari molekul lain. Kelas I (lantibiotik): terdiri dari peptida linear (tipe A) dan globuler (tipe B), dengan berat molekul rendah (<5 kDa, sekitar 19-38 asam amino). Memiliki modifikasi pada pasca-translasi yang mengandung lantionin dan turunannya (Todorov et al. 2010). Nisin adalah lantibiotik pertama dan paling terkenal (Ghrairi et al. 2012).
6
(disandikan oleh plnB) yang akan memicu reaksi berantai melalui fosforilasi, sehingga mengaktifkan protein respon regulator (disandikan oleh plnC dan plnD) di dalam sel. Protein respon regulator yang telah terfosforilasi akan berikatan pada daerah promoter dan mengaktifkan transkripsi gen target. Bakteriosin jenis plantarisin (Plantarisin EF dan JK) memiliki leader sekuen double glisin pada bagian N-terminal peptida. Sekuen ini memiliki kosensus motif Leu-Ser-xx-Glu-Leu-xxx-Gly-Gly („x‟ merupakan jenis asam amino lainnya) dimana double glisin bersifat sangat terkonservasi. Leader sekuen akan menekan aktivitas peptida selama masih berada di dalam sel, sekaligus mengenali motif pada ABC transporter dan mentranslokasikan peptida tersebut keluar sel (Havarstein et al. 1995).
Peptida Sinyal
Peptida sinyal (biasanya disebut sebagai sinyal target, peptida transit, leader sequence dan leader peptide) merupakan peptida pendek (5-30 asam amino) yang terdapat pada bagian N-terminal dari mayoritas protein yang baru disintesis dan dikeluarkan menuju jalur sekretori. Peptida sinyal ini berperan penting dalam translokasi protein, misalnya dalam organel tertentu (retikulum endoplasma, golgi atau mitokondria), dikeluarkan dari sel atau dimasukkan ke dalam sebagian membran sel. Dengan bermacam-macam tujuan translokasi dari peptida sinyal, menyebabkan struktur dari peptida ini bervariasi secara luas sesuai dengan lokasi yang dituju. Spesifisitas dari peptida sinyal biasanya akan tercapai melalui interaksi dengan reseptor di membran sasaran (Cintas et al. 1997).
Karakteristik struktural dari peptida sinyal yang berasal dari prokariot bersifat conserve. Jenis yang paling umum dari peptida sinyal terdiri dari bagian N-terminus bermuatan positif, inti hidrofobik di bagian tengah dan daerah pemotongan di ujung C-terminal. Sementara itu struktur antara peptida sinyal bakteri memiliki sifat conserve, hanya saja urutan dan panjangnya berbeda. Beberapa penelitian menyebutkan bahwa terdapat perbedaan peptida sinyal dari Gram positif dan Gram negatif. Hal tersebut terkait dengan panjang residu, Gram positif memiliki residu lebih panjang (rata-rata 29-31 residu) daripada Gram negatif (24 residu). Namun masih belum terdapat bukti yang menyebutkan bahwa peptida sinyal lebih pendek tidak mampu mengarahkan sekresi pada organisme Gram positif (Asseldonk et al. 1993).
7 Ekspresi Protein Heterolog di Lactococcus lactis
Lactococcus lactis merupakan BAL Gram positif, bersifat homofermentatif dan banyak digunakan dalam fermentasi makanan, seperti pada produksi keju dan mentega. Fungsi utama dari L. lactis adalah memproduksi asam laktat dari substrat laktosa. Dalam dua dekade terakhir, fisiologi dan genetik dari bakteri ini telah banyak dipelajari. Karakteristik fungsional yang telah dipelajari secara ekstensif di L. lactis meliputi metabolisme karbon, sistem proteolitik ekstraseluler dan intraseluler, produksi zat antibiotik, dan interaksi ketahanan terhadap bakteriofage (Teuber 1995). Saat ini informasi genom dari sebagian besar strain L. lactis telah tersedia untuk umum. Karena mudahnya aksesibilitas genetik dan penanganannya, L. lactis telah banyak dikembangkan dan digunakan untuk menjadi inang dalam ekspresi gen heterolog pada Gram positif (Mierau et al. 2005).
Pengetahuan dan pengalaman mengenai ekspresi protein heterolog di inang yang aman telah menyebabkan meningkatnya penggunaan L. lactis di beberapa bidang bioteknologi, misalnya ekspresi antigen bakteri dan virus untuk vaksinasi yang aman melalui imunisasi mukosa, produksi sitokin manusia dan agen terapi lainnya (Mierau et al. 2005). Selain itu masih terdapat banyak ekspresi gen menggunakan inang L. lactis misalnya amilase (Martin et al. 2007), protease (Liang et al. 2010; Wu et al. 2013), Aminopeptidase (Jorgensen et al. 2013) dan bakteriosin enterosin P (Borero et al. 2011) serta plantarisin W (Lages et al. 2015).
Beberapa faktor yang mendukung ekspresi protein heterolog di L. lactis diantaranya: (i) pertumbuhan bakteri yang relatif cepat menghasilkan densitas sel yang cukup tinggi; (ii) transformasi bakteri yang efisien; (iii) memiliki promoter yang bersifat kuat; (iv) ukuran genom yang relatif kecil, sehingga dapat mereduksi protein-protein kontaminan yang ikut terekspresi selama pertumbuhan; (v) protein yang diekspresikan tidak membentuk badan inklusi; (vi) struktur membran yang dimiliki L. lactis memudahkan dalam memproduksi protein membran; dan (vii) status GRAS (generally recognized as safe) yang membuat L. lactis bersifat aman dalam memproduksi protein untuk tujuan pangan maupun biomedis (Kunji et al. 2003).
9
Situs restriksi pada urutan nukleotida ditandai dengan garis bawah Prosedur Kerja
Penyisipan Gen plnA dari L. plantarum S31 ke pGEM-T Easy
Genom L. plantarum S31 diisolasi menggunakan metode Mustopa dan Fatimah (2014). Sebanyak 5 mL kultur stasioner L. plantarum dalam media de Man, Rogosa, Sharpe (MRS) (Lampiran 1) dipanen dengan sentrifugasi pada kecepatan 11000 x g selama 10 menit. Pelet sel diresuspensi dalam 540 µL bufer Tris-EDTA yang mengandung 60 mg/mL lisozim, kemudian diinkubasi selama 1 jam pada suhu 37 °C. Proses lisis sel dilanjutkan dengan menambahkan 200 µL 10% (SDS) sodium dedosil sulfate, 100 µL 5M NaCl, dan 80 µL 10% CTAB untuk kemudian diinkubasi selama 30 menit pada suhu 68 °C. Campuran tersebut ditambahkan kloroform dengan rasio 1:1, lalu disentrifugasi selama 10 menit pada kecepatan 23000 x g. Sentrifugasi menghasilkan tiga fase larutan, fase atas merupakan cairan bening nukleotida untuk kemudian dipresipitasi dengan isopropanol. DNA yang terendapkan disentrifugasi, dicuci dengan etanol 70% dan dikering-anginkan untuk menghilangkan sisa senyawa alkohol. DNA dilarutkan dengan nuclease-free water yang telah mengandung 0.1 mg/mL RNAse untuk menghilangkan kontaminan RNA. DNA disimpan pada suhu -20 °C.
DNA genom dari isolat S31 digunakan sebagai cetakan dalam amplifikasi Polymerase Chain Reaction (PCR) dengan pasangan primer F/R: 5‟ -ATTTCATGGTGATTCACGTTTAAATT-3‟/ 5-„CTTACGCCATCTATACG-3‟ (Mustopa 2013) dengan produk amplifikasi 300 pb. Kondisi PCR untuk amplifikasi gen Pln A disajikan pada Tabel 3. Gen pln A yang didapatkan kemudian dimurnikan menggunakan QIAquick® Gel Extraction Kit (QIAGEN). Hasil pemurnian DNA dapat dilihat secara kualitatif dengan elektroforesis gel agarosa 2%. DNA yang telah murni kemudian diligasikan dengan vektor pGEM-T® Easy (Promega). Gen pln A yang telah terligasi dengan vektor pGEM-T kemudian diintroduksikan ke dalam E.coli TOP 10 (Sambrook et al. 2002). Konstruksi Vektor Ekspresi dari Gen PlnE dan PlnF Ekstraseluler
10
dilakukan sebanyak tiga tahap, tahap pertama yaitu amplifikasi peptida sinyal pln A (produk1) dari template pGEM-T plnA. Tahap kedua amplifikasi plantarisin E dan F (produk2) dari template pGEM-T plnEF. Tahap ketiga amplifikasi fusi peptida signal dan pln E/F menggunakan template produk 1 dan produk 2. Kondisi PCR dari masing-masing tahap disajikan pada Tabel 3. Gen yang didapatkan kemudian dimurnikan dengan QIAquick® Gel Extraction Kit. Gen yang telah murni kemudian dipotong menggunakan enzim restriksi Nco1-Pst1(untuk fusi pln F)/ Nco1-HindIII(untuk fusi pln E), selain itu plasmid pNZ8148 yang digunakan sebagai vektor juga dipotong menggunakan enzim yang sama. Gen maupun plasmid yang telah terpotong kemudian dimurnikan kembali sebelum dilakukan ligasi. Ligasi antara insert dan vektor dilakukan dengan menggunakan T4 DNA ligase (NEB), diinkubasi pada suhu 4 ºC selama semalam. Tabel 3 Kondisi reaksi PCR
Introduksi Hasil Ligasi ke dalam E.coli dan L.lactis
11 FirstBASE Laboratories (1st BASE Company, Malaysia). Analisis sekuen DNA dan translasi dilakukan dengan DNAMAN versi 4.0 (Lynnon BioSoft).
Vektor pNZ8148 yang telah membawa fusi gen signal peptida dan plantarisin diintroduksikan ke inang L. lactis. Preparasi sel elektrokompeten L. lactis strain NZ3900 dimulai dengan inokulasi kultur stasioner L. lactis NZ3900 (25% vol/vol) ke dalam 100 mL media M17 (Lampiran 3) yang mengandung 0.5 M sukrosa, 2.5% (wt/vol) glisin dan 0.5% (wt/vol) glukosa. Kultur bakteri diinkubasi tanpa agitasi pada suhu 30 °C hingga mencapai OD600 ~ 0.3. Kultur bakteri disentrifugasi 6000 x g selama 10 menit pada suhu 4 °C. Pelet diresuspensi dengan buffer pencuci (0.5 M sukrosa dan 10% (vol/vol) gliserol), kemudian disentrifugasi kembali selama 10 menit pada kondisi yang sama. Pelet diresuspensi dengan buffer inkubasi (0.5 M sukrosa, 10% (vol/vol) gliserol dan 0.05 M EDTA), diamkan di dalam es selama 15 menit, kemudian sentrifugasi kembali pada kondisi yang sama. Pelet dicuci dengan buffer pencuci, kemudian diresuspensi sebanyak 1 mL dengan buffer yang sama. Vektor rekombinan dengan jumlah tertentu (0.5, 0.7 dan 1 µg) dicampurkan ke dalam 100 µL sel elektrokompeten, kemudian dimasukkan ke dalam kuvet elektroda. Elektroporasi dilakukan dengan kondisi tegangan 2 kV, kapasitas 25 µF dan hambatan 200 Ω. Sel bakteri yang telah terelektroporasi ditambahkan 400 µL media M17 yang mengandung 20 mM MgCl2 dan 2 mM CaCl2, kemudian diinkubasi tanpa agitasi selama 3 jam pada suhu 30 °C. Proses transformasi dilakukan dengan menggunakan Gene Pulser BIORAD (MoBiTec). Selanjutnya, 100 µL hasil elektroporasi yang telah diinkubasi disebar pada media M17 agar yang mengandung 10 µg/mL klorampenikol. Koloni PCR dilakukan terhadap transforman yang mampu tumbuh pada media seleksi untuk mengkonfirmasi gen plantarisin yang berhasil diintroduksikan. Isolasi vektor rekombinan dari L. lactis dilakukan dengan tujuan untuk mengkonfirmasi adanya sisipan gen pada vector, dengan menggunakan metode Duan et al. (1999).
Ekspresi plantarisin E dan F
Uji Ekspresi Pada Tingkat Transkripsi
12
selama 1 menit, sampel dicuci dengan 2x500 uL solution 2/3 dan disentrifugasi kembali selama 1 menit (menghilangkan wash solution dari filter). RNA dielusi dengan menambahkan 25-50 uL ddH2O ke filter. Penambahan DNase dilakukan dengan menambahkan 10xbuffer DNase dan 2 uL DNase, diinkubasi selama 30 menit pada 37 ºC.
RNA yang telah murni kemudian diuji secara kualitatif denga elektroforesis gel agarosa 2% pada buffer TBE + DEPC. Konsentrasi RNA ditentukan dengan spektrofotometri pada abs 260 nm. RNA yang didapatkan kemudian dilakukan transkripsi balik membentuk cDNA (thermo kit). Program transkripsi balik yang digunakan adalah 45 ºC, 30 menit. Selanjutnya cDNA diamplifikasi dengan primer fusi signal peptida dan plantarisin E/F. Untuk amplifikasi gen dilakukan dengan kondisi 94 ºC 3 menit, 94 ºC 1 menit, 57 ºC 1 menit, 72 ºC 30 det, 72 ºC 5 menit, sebanyak 35 siklus. Hasil PCR divisualisasi dengan 2% gel agarosa.
Uji Ekspresi Pada Tingkat Translasi
Uji ekspresi pada tingkat translasi dilakukan dengan menumbuhkan 10% L.lactis pada 100 ml media GM17B + klorampenikol dan dilakukan penambahan 0.5-5 ng/ml nisin untuk induksi. Dilakukan sentrifugasi dengan kecepatan 12.000×g pada suhu 4 ºC selama 10 menit (Borero et al. 2010). Supernatan yang didapatkan kemudian dianalisis pita protein dengan SDS-PAGE menggunakan gel pemisah 16% (Lampiran 4) dan gel penahan 4% untuk melihat bobot molekul plantarisin EF dengan cara membandingkannya dengan pita protein standar. Campuran fraksi protein dan buffer loading dye (50 mM Tris HCl pH 6.8, 2% SDS, 10% gliserol, 1% β-merkaptoetanol, 12.5 M EDTA, 0.02% Bromophenol biru, H2O) dipanaskan pada suhu 95 °C selama 15 menit, kemudian dimigrasikan ke dalam gel elektroforesis SDS-PAGE. Proses elektroforesis berlangsung pada kondisi tegangan 100 V dan arus listrik 20 mA. Setelah elektroforesis, gel diwarnai menggunakan Silver Staining Kit (Fermentas, EU).
Gel hasil elektroforesis dicuci dengan akuades steril selama 5 menit (2x), kemudian dilakukan fiksasi menggunakan fixing solution 1 selama 60 menit dilanjutkan dengan gel fixing 2 dan dicuci menggunakan aquades steril selama 20 detik (2x). Gel disensitifkan dengan larutan sensitizer selama 1 menit dan dicuci dengan aquadest steril 20 detik (2x). Etanol:asam asetat:air (3:1:6) selama 15 menit (2x). Pewarnaan dilakukan dengan merendam gel pada larutan stain selama 20 menit, kemudiaan dicuci selama 20 detik dengan akuades steril (2x). Pita pada gel akan muncul dengan cara merendam gel pada larutan developer selama 5-10 menit atau hingga pita muncul. Setelah muncul pita protein, reaksi dihentikan dengan menambahkan larutan stop selama 10 menit.
Analisis Aktivitas Antimikroba
13
4
HASIL DAN PEMBAHASAN
Penyisipan Gen plnA dari L. plantarum S31 ke pGEM-T Easy
Plantarisin A merupakan peptida feromon, bersifat kationik dan dapat menginduksi produksi bakteriosin pada strain tertentu (Sand et al. 2010). Sifat pln A yang dapat menginduksi tersebut diduga bahwa peptida ini disekresikan ke luar sel. Adanya ekspresi di luar sel tersebut membuktikan bahwa terdapat leader sequence atau peptida sinyal pada gen pln A, seperti pada lokus pln yang lain yaitu pln EF, pln JK yang juga memiliki peptida sinyal. Pada penelitian ini, DNA genom dari isolat L. plantarum S31 (Mustopa dan Fatimah 2014) digunakan sebagai sumber dalam mendapatkan gen pln A. Hasil amplifikasi menggunakan primer F/R (seperti yang tertera pada metode) menunjukkan bahwa ukuran amplikon adalah sebesar 300 pb (Gambar 3a). Gen pln A tersebut telah berhasil diligasikan dengan plasmid pGEM-T Easy dan diintroduksikan ke E.coli TOP10, sehingga menghasilkan koloni E.coli TOP10 rekombinan. Plasmid dari koloni tersebut berhasil diisolasi dan dikonfirmasi dengan PCR (Gambar 3b) menghasilkan pita pada ukuran 300 pb. Hal ini menunjukkan bahwa gen pln A telah berhasil tersisipkan pada vektor kloning pGEM-T Easy. Hasil analisis sekuensing menunjukkan kesamaan 100% apabila dibandingkan dengan sekuen referensi L. plantarum WCFS1 (asal saliva manusia, no aksesi AL935263.2). Hasil kloning ini dapat digunakan sebagai sumber untuk mendapatkan sekuen peptida sinyal pln A, karena tidak mengalami mutasi.
Gambar 3 Hasil amplifikasi PCR pada gen pln A (300 pb). (a) dari cetakan DNA genom L. plantarum S31, (b) 1: dari cetakan pGEM- T Easy pln A. (M) 100 pb Kappa universal DNA ladder
Secara rinci urutan sekuen DNA dari pln A terdapat pada Gambar 4. Analisis sekuen pln A menunjukkan bahwa pln A mengandung 22 asam amino peptida sinyal, sedangkan mature pln A dimulai dari residu asam amino 23. Peptida sinyal yang terdapat pada bagian N-terminal memiliki dua bagian pemotongan oleh peptidase yaitu pada glisin21 dan glisin22. Adanya dua situs pemotongan yang berdekatan ini memiliki keuntungan bagi aktivitas protein yang difusikan dengan peptida sinyal tersebut. Apabila dibandingkan dengan peptida
14
sinyal Usp45 yang memiliki 3 situs pemotongan yang berjauhan yaitu Ala19,20 dan Ala27, menunjukkan tidak aktifnya amilase apabila peptidase memotong pada situs Ala19,20, sebaliknya enzim amilase akan aktif pada pemotongan Ala27 (Asseldonk et al. 1993).
Gambar 4 Analisis sekuen gen pln A pada vektor rekombinan yang mengandung bagian N-terminal pln A, tranlasi dan sekuen upstream. Bagian promotor (-35 dan -10) dan awal dari translasi ditandai dengan garis bawah. Prediksi area pemotongan oleh signal peptidase ditandai dengan panah vertikal
Konstruksi Vektor Ekspresi dari Gen PlnE dan PlnF Ekstraseluler
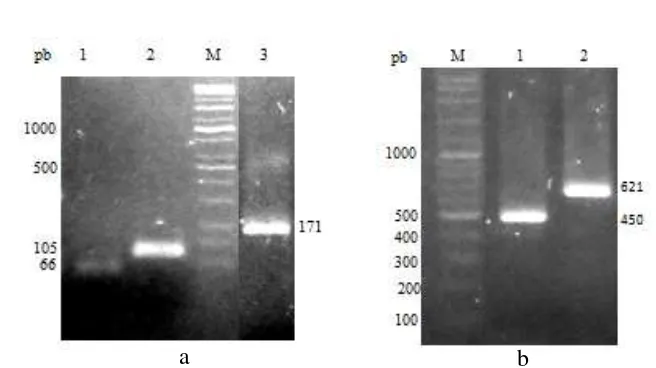
Konstruksi vektor pada penelitian ini dilakukan dengan menggunakan PCR overlapping dari fragmen yang mengandung peptida sinyal dan gen penyandi plantarisin, seperti pada penelitian Martín et al. (2007) dan Borero et al. (2010). Skema fusi antara peptida sinyal pln A dengan gen plnE dan plnF disajikan pada Gambar 5. Hasil amplifikasi dari masing-masing gen tersebut berukuran 66 pb untuk peptida sinyal, 102 pb untuk pln E dan 105 pb untuk pln F. Sedangkan untuk fusi didapatkan ukuran 168 pb (pln E) dan 171 pb (pln F) (Gambar 6a dan 8a).
Fusi keduanya kemudian disisipkan pada vektor pNZ8148 diantara Nco1-HindIII (untuk pln E) dan Nco1-Pst1 (untuk pln F) sehingga terbentuk plasmid pNZ8148 rekombinan. Hasil dari plasmid rekombinan yang terbentuk berukuran 3335 pb untuk fusi pln E, sedangkan fusi pln F sebesar 3338 pb. Gen yang disisipkan ke vektor tersebut terlebih dahulu diadaptasikan dengan penambahan dua basa nukleotida CC setelah fusi translasi dengan situs restriksi Nco1 (CCATGG), seperti pada penelitian Wu et al. (2013). Hal ini dikarenakan pada situs Nco1 telah mengandung ATG atau titik awal translasi, sehingga translasi tidak dimulai dari gen, melainkan dari situs NcoI.
16
Gambar 6 Hasil amplifikasi fusi pln F dan konfirmasi transformasi pada L. lactis NZ3900. (M) 100 pb Kappa universal DNA ladder. (a) 1: hasil amplifikasi signal peptida pln A (66 pb), 2: pln F(105 pb) dan 3: fusi (171 pb), (b): hasil PCR plasmid rekombinan L. lactis, 1: kontrol negatif (L. lactis pNZ8148), 2: L. lactis rekombinan fusi pln F
Gambar 7 Analisis sekuen fusi plnF pada pNZ8148, RBS: daerah pengikatan ribosom, *: kodon stop, 1: titik awal transkripsi, Terminator: titik akhir transkripsi. Motif GxxxG ada pada asam amino 30-34.
17
Gambar 8 Hasil amplifikasi fusi pln E dan konfirmasi transformasi pada L. lactis NZ3900. (M) 100 pb Kappa universal DNA ladder. (a) 1: hasil amplifikasi signal peptida pln A (66 pb), 2: pln E(102 pb) dan 3: fusi (168 pb), (b): hasil PCR plasmid rekombinan L. lactis, 1: L. lactis rekombinan fusi pln E, 2: kontrol (L. lactis pNZ8148)
Gambar 9 Analisis sekuen fusi gen plnE pada vektor pNZ8148, RBS: daerah pengikatan ribosom, *: kodon stop, 1: titik awal transkripsi Terminator: titik akhir transkripsi. Motif GxxxG ada pada asam amino 5-9 dan 20-24.
Ekspresi Plantarisin E dan F di L.lactis serta uji Aktivitas Antimikroba
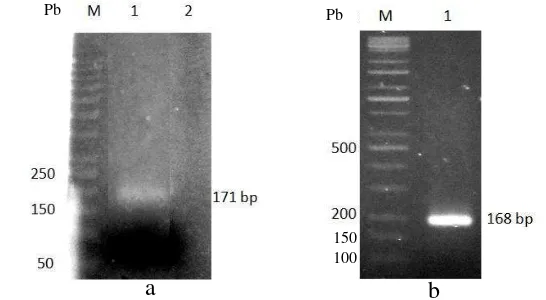
Fusi pln E dan F telah berhasil diekspresikan dalam tahap transkripsi maupun translasi dengan sistim induksi nisin pada L. lactis. Hasil mRNA dari pln E dan F dilakukan transkripsi balik membentuk cDNA, kemudian cDNA tersebut diamplifikasi hingga 35 siklus dan menghasilkan pita pada ukuran 168 pb dan 171 pb (Gambar 10). Selain itu pada kontrol (inang L. lactis) tidak menunjukkan
18
adanya pita DNA. Hal ini menunjukkan bahwa plasmid rekombinan telah terintroduksi ke L. lactis dan mampu diekspresikan membentuk mRNA.
Gambar 10 Hasil amplifikasi fusi gen E dan F dari cetakan cDNA L. lactis induksi nisin 5 ng/ml (a) 1: fusi gen F, 2: kontrol L. lactis (inang). (b) 1: fusi gen E. (M) 100 pb Kappa universal DNA ladder
Fusi gen plnE dan plnF diekspresikan dalam sistem ekspresi NICE vektor pNZ8148 melalui mekanisme auto-regulasi. Pemberian induser nisin dari luar akan menstimulasi dimulainya transkripsi pada promoter nisA melalui regulon nisK dan nisR yang terintegrasi pada DNA kromosom L. lactis (de Ruyter et al. 1996). Hal ini memungkinkan tingkat ekspresi dapat dikendalikan melalui besarnya konsentrasi nisin dari luar yang diberikan. Gen nisK yang menyandikan histidin kinase bertindak sebagai reseptor nisin dan meneruskan responnya ke nisR (Mierau et al. 2005). Hasil dari respon ini akan membentuk faktor transkripsi yang akan mengaktifkan promoter nisA sehingga proses transkripsi oleh RNA polimerase dapat berjalan (Sorvig et al. 2003). Konsentrasi nisin yang dibutuhkan untuk induksi sangatlah rendah yaitu antara 0.5-5 ng/ml, tingginya konsentrasi nisin >10 ng/ml yang digunakan akan berpengaruh negatif pada inang karena bisa menekan pertumbuhan inang L. lactis (Zhang et al. 2015). Untuk lebih mengoptimalkan hasil ekspresi (pada tahap translasi protein) bisa dilakukan fusi dengan RBS kuat pada konstruksi plasmid rekombinan (Borrero et al. 2011).
Selanjutnya analisis SDS-PAGE dari sampel supernatan L. lactis rekombinan menunjukkan adanya pita protein pada ukuran 3.85 kDa pada sampel yang diinduksi dengan nisin 0.5 ng/ml, 1 ng/ml dan 5 ng/ml (Gambar 11a). Hal tersebut menunjukkan bahwa plantarisin F telah disekresikan ke luar sel, apabila dibandingkan dengan pelet tidak menunjukkan adanya pita protein (Gambar 11b). Hal yang sama yaitu pada pln E juga berhasil terekspresi, hal ini ditunjukkan pada analisis SDS-PAGE gambar 12. Pada gambar tersebut menunjukkan adanya pita protein berukuran 3.7 kDa yang lebih tebal pada sampel induksi apabila dibandingkan dengan kontrol (inang dan noninduksi). Keberhasilan sekresi protein ke luar sel (ke media tumbuh) dikarenakan peptida sinyal pln A mampu mengenali SRP (signal recognition particle). Kemudian SRP akan membawa prepeptida (pln E dan F) ke reseptor SRP yang ada di membran dan nantinya akan membawa kompleks tersebut ke PTC (protein translocation channel). Peptida sinyal akan membuka PTC, selanjutnya peptida (pln E dan F) matang dikeluarkan dan peptida sinyal pln A akan dipotong oleh peptidase.
a b
19
Gambar 11 Profil SDS-PAGE (pewarnaan silver stain) dari ekspresi pln F di L. lactis. (a) supernatan L. lactis, 1: inang L. lactis, 2: non induksi, 3, 4 dan 5: pita protein pln F (3.85 kDa) pada L. lactis rekombinan dengan induksi nisin 0.5, 1 dan 5 ng/ml. (b) pellet L. lactis. M: Marker protein (Thermo).
Gambar 12 Profil SDS-PAGE (silver stain) dari pln E di L. lactis. 1: inang L. lactis; 2: noninduksi; 3, 4 dan 5: pita protein pln E (3.7 kDa) pada L. lactis rekombinan dengan induksi nisin 1; 5 dan 0.5 ng/ml
Penggunaan vektor ekspresi yang kompatibel dengan sel inang dalam hal ekspresi gen heterolog sangatlah penting. Pada penelitian Borero et al. (2011) telah digunakan beberapa vekor ekspresi pMG36c, pMSP dan pNZ8048 untuk inang L. lactis. Namun dari semua vektor tersebut, ekspresi tertinggi terjadi pada pNZ8048, dengan ditunjukkannya zona hambat yang luas. Pada penelitian ini penggunaan pNZ8148 didasarkan pada acuan di atas, bahwa pNZ8148 merupakan turunan dari pNZ8048.
Bakteri L. lactis NZ3900 merupakan turunan dari L. lactis MG1363 yang diketahui tidak memiliki gen penghasil nisin (Kunji et al. 2003). Adapun terdapatnya pita protein target pada sampel non-induksi, diduga karena adanya aktivitas basal yang menyebabkan gen plnEF terekspresi meskipun tanpa adanya induksi nisin. Hal ini telah dibuktikan pada penelitian Sorvig et al. (2003) bahwa sistem ekspresi NICE seringkali menunjukkan aktivitas ekspresi basal (tanpa adanya induksi) ketika diekspresikan pada Lactobacillus.
Gen pln E dan F mature menyandikan protein pln E dan F matang tanpa peptida sinyal. Protein mature pln EF ini memiliki urutan asam amino dengan motif GxxxG yang nantinya menentukan aktifitas antibakteri (Fimland et al. 2008). Motif GxxxG tersebut ada pada asam amino GFIHG (pln F) dan GYNFG serta GSVAG (pln E). Kedua plantarisin baik E dan F sama-sama memiliki aktivitas antibakteri pada bakteri patogen E. coli ATCC 8739, S. aureus ATCC 6539, L. monocytogenes BTCC B693. Contoh zona penghambatan pada strain indikator (E. coli ATCC 8739) ditunjukkan pada Gambar 13. Hal ini
a
b
20
menunjukkan bahwa inang L. lactis mampu mengekspresikan gen penyandi plantarisin E dan F, dan tidak terbentuk badan inklusi. Hasil ini berbeda dengan penelitian sebelumnya, yang mengekspresikan pln F pada inang E. coli namun tidak terdeteksi adanya aktifitas penghambatan pada bakteri patogen (Kusdianawati et al. 2015). Selain itu Pall dan Sheela (2014) juga mengekspresikan pln F, namun perlu adanya penambahan EDTA (etilendiamin tetraasetat) untuk memperoleh aktifitas antibakteri pada Gram negatif. EDTA yang ditambahkan bertujuan untuk merusak sel dengan cara mengikat ion magnesium, sehingga integritas sel rusak. Pada penelitian ini plantarisin E dan F yang didapatkan tidak perlu ditambahkan dengan EDTA sudah mampu menghambat bakteri patogen Gram positif dan negatif.
Gambar 13 Contoh aktivitas antimikroba pln F pada E. coli ATCC 8739 dengan uji difusi agar. Supernatan dari 1: L. lactis NZ3900; 2: noninduksi; 3, 4 dan 5: L. lactis rekombinan dengan induksi nisin 0.5, 1 dan 5 ng/ml.
Pada kedua plantarisin E dan F zona penghambatan terbesar terdapat pada sampel dengan induksi 5 ng/ml (Tabel 4). Hal ini menunjukkan bahwa induksi optimal untuk ekspresi adalah 5 ng/ml nisin. Selain itu dari ketiga strain indikator, E. coli memiliki zona hambat paling tinggi. Hal ini berbeda dengan teori yang menyebutkan bahwa plantarisin seharusnya mampu meghambat dengan baik hanya pada bakteri kerabat dekat yaitu pada Gram positif (S. aureus dan L. monocytogenes), sedangkan E. coli merupakan Gram negatif. Tingginya aktifitas pada E. coli tersebut belum diketahui secara pasti karena mekanisme aksi spesifik dari pln E dan pln F belum banyak dilaporkan.
Tabel 4. Aktivitas antimikroba dari plantarisin E dan F
Strain Indikator Gram (+/-)
Pln E Pln F
Konsentrasi nisin (ng/ml) Konsentrasi nisin (ng/ml)
0.5 1 5 0.5 1 5
E. coli ATCC 8739 - 10 mm 9.5 mm 11 mm 10 mm 10 mm 11 mm
S. aureus ATCC 6539
+ 8.5mm 9.5 mm 10 mm 8 mm 8 mm 9 mm
L. monocytogenes
BTCC B693
+ 8 mm 8.5 mm 8.5 mm 7 mm 7 mm 9.5 mm
21
5
SIMPULAN DAN SARAN
Simpulan
Sekuen peptida sinyal plnA dari L. plantarum S31 telah berhasil dikloning pada pGEMT-Easy dengan ukuran 66 pb. Peptida sinyal plnA telah berhasil difusikan dengan pln E dan pln F, masing-masing berukuran 168 pb dan 171 pb. Vektor ekspresi pNZ8148 yang mengandung fusi pln E dan pln F telah berhasil dikonstruksi dan diekspresikan pada inang L.lactis sebagai mRNA dan protein. Protein pln E dan pln F dapat diekspresikan secara ekstraseluler dengan bobot molekul 3.7 dan 3.85 kDa. Kedua plantarisin tersebut memiliki aktivitas antibakteri pada E. coli ATCC 8739, S. aureus ATCC 6539, L. monocytogenes BTCC B693.
Saran
22
DAFTAR PUSTAKA
Arief I, Jakaria, Suryati, Wulandari Z, Andreas E. 2013. Isolation and characerization of plantaricin produced by L. plantarum strains (IIA-1A5, IIA-1B1, IIA-2B2). Med Peternakan. 3(2):91-100.
Asseldonk MV, Vos WMd, Simons G. 1993. Functional analysis of the Lactococcus lactis usp45 secretion signal in the secretion of a homologous proteinase and a heterologous a-amylase. Mol Gen Genet. 240:428-434. Balciunas EM, Martinez FAC, Todorov SD, Franco BDGM, Converti A, Oliveira
RPS. 2013. Novel biotechnological applications of bacteriocins: a review. Food Control 32(1): 134-142.
Borrero J, Jiménez JJ, Gútiez L, Herranz C, Cintas LM, Hernández PE. 2011. Protein expression vector and secretion signal peptide optimization to drive the production, secretion, and functional expression of the bacteriocin enterocin A in lactic acid bacteria. J Biotechnol. 156:76-86.
Brinques GB, Peralba MC dan Ayub MAZ. 2010. Optimization of probiotic and lactic acid production by Lactobacillus plantarum in submerged bioreactor systems. J Industrial Microbiol and Biotechnol. 37:205–212.
Budiarto BR, Mustopa AZ, Indarmawan T. 2015. Characterization of partial extracellular protease from bekasam-isolated L. plantarum S31 and its application to hydrolize skimmed-milk with antibacerial property. IFRJ in press.
Cintas LM, Casaus P, Håvarstein LS, Hernández PE, Nes IF. 1997. Biochemical and genetic characterization of enterocin P, a novel sec-dependent bacteriocin from Enterococcus faecium P13 with a broad antimicrobial spectrum. Appl Environ Microbiol. 63:4321–4330.
Cleveland J, Montville TJ, Nes IF, Chikindas ML. 2001. Bacteriocins: Safe, natural antimicrobials for food preservation. Inter J Food Microb. 71:1–20. Collins B, Cotter PD, Hill C, Ross R. 2010. Applications of lactic acid bacteria
produced bacteriocins. In F. Mozzi, R. R. Raya, & G. M. Vignolo (Eds.), Biotechnology of lactic acid bacteria: Novel applications (pp. 89–109). Iowa, USA: Wiley Blackwell.
Cotter PD, Hill C, Ross RP. 2005. Bacteriocins: Developing innate immunity for food. Nat Rev Microbiol. 3:777–788.
De Ruyter PG, Kuipers OP, de Vos WM. 1996. Controlled gene expression system for Lactococcus lactis with the food-grade inducer nisin. Appl Environ Microbiol. 62: 3662-3667.
Dicks LMT, Mellett FD, Hoffman LC. 2004. Use of bacteriocin-producing starter cultures of Lactobacillus plantarum and Lactobacillus curvatus in production of ostrich meat salami. Meat Science. 66:703–708.
Diep DB, Havarstein LS, Nes IF. 1996. Characterization of the locus responsible for the bacteriocin production in Lactobacillus plantarum C11. J Bacteriol. 178: 4472-4483.
23 Fimland PR, Gunnar F, Jon N, Per E. 2008. Three-dimensional structure of the two peptides that constitute the two-peptide bacteriocin plantaricin EF.
Biochimica et Biophysica Acta. 1784:1711-1719.
Ghrairi T, Chaftar N, Hani K. 2012. Bacteriocins: Recent advances and opportunities. Progress in Food and Preserv. 1:485–511.
Hauge HH, Mantzilas D, Moll GN, Konings WN, Driessen AJ, Eijsink VG. 1998. Plantaricin A is an amphiphilic alpha-helical bacteriocin-like pheromone which exerts antimicrobial and pheromone activities through different mechanisms. Biochemistry. 37(160):26–32.
Havarstein LS, Diep DB, Nes IF. 1995. A family of bacteriocin ABC transporter carry out proteolytic processing of their substrates concomitant with export. Mol Microbiol. 16: 229-240.
Jørgensen CM, Madsen SM, Vrang A, Hansen OC, Johnsen MG. 2013. Recombinant expression of Laceyella sacchari thermitase in Lactococcus lactis. Prot Expression and Purification. 92:148–155.
Kleerebezem M, Boekhorst J, Kranenburg R, Van Molenaar D, Kiupers OP, Leer R. 2003. Complete genome sequence of Lactobacillus plantarum WCFS1. Proceedings of the National Academy of Sciences. 100:1990–1995.
Kumar M, Srivastava S. 2010. Antilisterial activity of a broad-spectrum bacteriocin, enterocin LR/6 from Enterococcus faecium LR/6. Appl Biochem Biotechnol. 162:698-706.
Kunji ERS, Slotboom D, Poolman B. 2003. Lactococcus lactis as host for overproduction of functional membrane proteins. Biochem Biophys Acta. 1610: 97-108.
Kusdianawati, Mustopa AZ, Suharsono, Budiarto BR, Fatimah, Danuri H. 2015. Construcion, Expression and Purification of Recombinant Pre-Mature Peptide of Plantaricin F from Lactobacillus plantarum S34 in E. coli. IJAS 16 (10):31-38.
LagesAC, Mustopa AZ, Sukmarini L, Suharsono. 2015. Cloning and Expression of Plantaricin W Produced by Lactobacillus plantarum U10 Isolate from „Tempoyak‟ Indonesian Fermented Food as Immunity Protein in Lactococcus lactis. Appl Biochem Biotechnol. DOI 10.1007/s12010-015-1786-9.
Liang X, Sun Z, Zhong J, Zhang Q, Huan L. 2010. Adverse effect of nisin resistance protein on nisin-induced expression system in Lactococcus lactis. Microbiol Research. 165;458-465.
Margareta H, Mustopa AZ, Widiyastuti U, Budiarto BR. 2015. Characterization of chaperone-like activity of small heat shock protein (sHSP) isolated from Indonesian Traditional Food (Tempoyak) Lactobacillus plantarum U10. J Microbiol Indonesia. 8 (4):184-191.
Martín M, Gutiérrez J, Criado R, Herranz C, Cintas LM, Hernández PE. 2007. Cloning, production and expression of the bacteriocin enterocin A produced by Enterococcus faecium PLBC21 in Lactococcus lactis. Appl Microbiol Biotechnol. 76:667–675.
24
Mierau I, Olieman K , Mond J dan Smid EJ. 2005. Optimization of the Lactococcus lactis nisin-controlled gene expression system NICE for industrial applications. Microbial Cell Factories. 4:16.
Mustopa AZ. 2013. Isolation and characterization of Lactobacillus plantarum S34 from Indonesian traditional food. PhD thesis, Dankook University, Seoul, KR.
Mustopa AZ dan Fatimah. 2014. Diversity of lactic acid bacteria isolated from Indonesian traditional fermented foods. Microbiol Indones. 8(2): 48-57. Mustopa AZ, Kusdianawati, Fatimah, Umami RN, Budiarto BR dan Danuri H .
2014. Cloning and expression of Plantaricin E and F genes of Lactobacillus plantarum S34 isolated from Indonesia traditional-fermented meat (Bekasam). IFRJ 615. Inpress.
Mustopa AZ, Balia R, Putranto WS, Ridwan M dan Solehudin M. 2010. Penapisan bakteri asam laktat yang diisolasi dari bekasam daging sapi dalam menghasilkan bakteriosin untuk menghambat bakteri patogen. Prosiding Seminar Nasional Fakultas Peternakan Universitas Padjajaran ke-2: 679-685.
Pal G dan Sheela S. 2013. Cloning and heterologous expression of plnE, -F, -J and –K genes derived from soil metagenome and purification of active plantaricin peptides. Appl Microbiol Biotechnol. DOI 10.1007/s00253-013-5097-1.
Pal G dan Sheela S. 2014. Inhibitory effect of plantaricin peptides (Pln E/F and J/K) against Escherichia coli. World J Microbiol Biotechnol. 30:2829–2837. Pal G dan Sheela S. 2015. In vitro activity of recombinant ABC transporter protein in the processing of plnE pre-peptide. Arch microbiol. DOI 10.1007/s00203-015-1120-5.
Parente E, Ciocia F, Ricciardi A, Zotta T, Felis GE, Torriani S. 2010. Diversity of stress tolerance in Lactobacillus plantarum, Lactobacillus pentosus and Lactobacillus paraplantarum: a multivariate screening study. Int J Food Microbiol. 144: 270-279.
Pinto D, Marzani B, Minervini F, Calasso M, Giuliani G, Gobbetti M, Angelis MD. 2011. Plantaricin A synthesized by L.plantarum induces in vitro proliferation and migration of human keratinocytes and increases the expression of TGF β1, FGF7, VEGF-A and IL-8 genes. Peptides. 32;1815– 1824.
Prins WA, Botha M, Botes M, Kwaadsteniet M, Endo A, Dicks LMT. 2010. Lactobacillus plantarum 24, isolated from the marula fruit (Sclerocarya birrea), has probiotic properties and harbors genes encoding the production of three bacteriocins. Curr Microbiol. 61: 584-589.
Ricciardi A, Parente E, Guidone A, Ianniello RG, Zotta T, Sayem SMA, et al. 2012. Genotypic diversity of stress response in Lactobacillus plantarum, Lactobacillus plantarum and Lactobacillus pentosus. Inter J Food Microbiol.157:278–285.
Sabo S dan Vitolo M. 2014. Overview of Lactobacillus plantarum as a promising bacteriocin producer among lactic acid bacteria. Food research inter. 64;527-536.
25 Sánchez J, Diep DB, Herranz C, Nes IF, Cintas LM, Hernández PE. 2007. Amino acid and nucleotide sequence, adjacent genes, and heterologous expression of hiracin JM79, a Sec-dependent bacteriocin produced by Enterococcus hirae DCH5, isolated from Mallard ducks (Anas platyrhynchos). FEMS Microbiol Lett. 270:227–236.
Sand SL, Oppegård C, Ohara S, Iijima T, Naderi S, Blomhoff HK, Meyer JN, Sand O. 2010. Plantaricin A, a peptide pheromone produced by Lactobacillus plantarum, permeabilizes the cell membrane of both normal and cancerous lymphocytes and neuronal cells. Peptides. 31: 1237–1244. Sand SL, Meyer JN, Sand O, Haug TM. 2013. Plantaricin A, a cationic peptide
produced by L. plantarum, permeabilizes eukaryotic cell membranes by a mechanism dependent on negative surface charge linked to glycosylated membrane proteins. Biochimica et Biophysica Acta. 1828;249–259.
Siezen RJ, Tzeneva VA, Castioni A, Wels M, Phan HTK, Rademaker JLW. 2010. Phenotypic and genomic diversity of Lactobacillus plantarum strain isolated from various environmental niches. Env Microbiol.12(3):758–773.
Siezen RJ, Van Hylckama VJET. 2011. Genomic diversity and versatility of L. plantarum, a natural metabolic engineer. Microb Cell Fact. 10(1): 1-13. Sorvig E, Gronqvist S, Naterstad K, Mathiesen G, Eijsink VGH, Axelsson L.
2003. Construction of vectors for inducible gene expression in Lactobacillus sakei and L. plantarum. FEMS Microbiol Lett. 229: 119-126.
Teuber M. 1995. The Genus Lactococcus: In The Genera of Lactic Acid Bacteria Volume 2. Edited by: Wood BJB and Holzapfel WH. Glasgow and others, Blackie Academic & Professional, London.
Todorov SD, Ho P, Vaz-Velho M dan Dicks LMT. 2010. Characterization of bacteriocins produced by two strains os Lactobacillus plantarum isolated from Beloura ou Chouriço, traditional pork products from Portugal. Meat Science. 84:334–343.
Todorov SD, LeBlanc JG, Franco BDGM. 2012. Evaluation of the probiotic potencial and effect of encapsulation on survival for Lactobacillus plantarum ST16Pa isolated from papaya. World J Microb Biot. 28: 973-984. Tsapieva A, Duplik N, Suvorov A. 2011. Structure of plantaricin locus of
Lactobacillus plantarum 8P-A3. Benef Microbes. 2: 255-261.
Van RCA, Van ZWH, Dicks MT. 2006. Expression of the immunity protein of plantaricin 423, produced by Lactobacillus plantarum 423, and analysis of the plasmid encoding the bacteriocin. Appl Environ Microbiol.72(12): 7644-7651
Vries MC, Vaughan EE, Kleerebezem M dan Vos WM. 2006. Lactobacillus plantarum Survival, functional and potential probiotic properties in the human intestinal tract. Inter Dairy Journal. 16:1018–1028.
Wu C, Juan ZJ, Du G, Chen J. 2013. Heterologous expression of L. casei RecO improved the multiple stress tolerance and lactic acid production in L. lactis NZ9000 during salt stress. Bioresource Technol. 143:238–241.
26
LAMPIRAN
Lampiran 1 Komposisi media pertumbuhan de Man, Rogosa, Sharpe (MRS)
Pepton 10 g/L
Bubuk „Lab-Lemco‟ 8 g/L Ekstrak khamir 4 g/L Sorbitan mono-oleat 1 mL Di-potassium hidrogen fosfat 2 g/L Sodium asetat 5 g/L Tri-ammonium sitrat 2 g/L Magnesium sulfat 0.2 g/L Mangan sulfat 0.05 g/L
Lampiran 2 Komposisi media pertumbuhan Luria-Bertani (LB)
Tripton 10 g/L
Ekstrak khamir 5 g/L Sodium klorida 10 g/L
Lampiran 3 Komposisi media pertumbuhan M17
Tripton 5 g/L
Pepton soya 5 g/L
Meat digest 5 g/L Ekstrak khamir 2.5 g/L
Asam askorbat 5 g/L
Magnesium sulfat 0.25 g/L Di-sodium gliserol fosfat 19 g/L
Lampiran 4 Komposisi Buffer TBE 500 mL Tris aminometan 5.4 g
27
Lampiran 5 Komposisi larutan dalam SDS-PAGE
Medium dan larutan-larutan Bahan-bahan
Larutan gel separating 16% H2O 1 ml 1,5 M Tris-Cl pH 8,8
containing 0.4% SDS 1.875 ml 30% Akrilamid 4 ml 10% Amonium Persulfat 0.05 ml
TEMED 0.01 ml
Larutan gel stacking 3.9% H2O 3.05 ml 0,5 M Tris-Cl pH 6,8
containing 0.4% SDS 1.25 ml 30% Akrilamid 0.65 ml 10% Amonium Persulfat 0.025 ml
TEMED 0.005 ml
Buffer sampel SDS 2X (Loading Dye)
4x Tris Cl/SDS pH 6,8 25 ml Gliserol 20 ml SDS 4 g β- mercaptoethanol 2 ml Bromphenol blue 1 mg H2O 53 ml Commasie Blue G-250
Staining Solution (500 ml)
45% H2O 225 ml
45% Metanol 225 ml 10% Asam asetat glacial 50 ml 0,05%Commasie brilliant
blue 250 mg Commasie Blue G-250
Destaining Solution (1000 ml)
50% H2O 500 ml
28
Lampiran 6 Komposisi Bufer Elektroforesis SDS-PAGE
Larutan Komposisi Stok Konsentrasi Akhir
Bufer separating
Tris pH 8.8 SDS Akuades
91 g 2g 500 mL
1.5 M 0.4 % 500 mL
sBufer stacking
Tris pH 6.8 SDS Akuades
6.09 g 0.4 g
100
0.5 M 0.4 % 100 mL
Bufer running
(5x)
Tris Glisin SDS Akuades
7.5 g 36 g 2.5 g 500 mL
29 Lampiran 7 Komposisi Larutan Silver Staining
Larutan Komposisi Stok Konsentrasi Akhir
30
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Jember, Provinsi Jawa Timur, 01 September 1990 dari Ayah Mulyani dan Ibu Endang S (Alm). Penulis merupakan anak pertama dari dua bersaudara. Penulis menyelesaikan pendidikan menengah atas di SMA Negeri 2 Tanggul pada tahun 2008. Penulis melanjutkan kuliah S1 di Program Studi Biologi FMIPA Universitas Jember (UNEJ) pada tahun 2008 dan mendapatkan gelar sarjana sains (SSi) pada tahun 2013. Selama masa kuliah S1 penulis aktif dalam berorganisasi diantaranya sebagai pengurus Himpunan Mahasiswa Biologi FMIPA (HIMABIO), selain itu penulis juga menjadi asisten praktikum Biologi Molekuler dan Rekayasa genetika. Penulis juga beberapa kali menerima beasiswa Pengembangan Potensi Akademik (PPA) dari UNEJ.