DETEKSI VIRUS PADA PERTANAMAN MENTIMUN
(Cucumis sativus L.) DI KABUPATEN BOGOR, KARAWANG,
DAN SUBANG, JAWA BARAT
NUR UNSYAH LAILI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul “Deteksi Virus pada Pertanaman Mentimun (Cucumis sativus L.) di Kabupaten Bogor, Karawang, dan Subang, Jawa Barat” adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2015
Nur Unsyah Laili
ABSTRAK
NUR UNSYAH LAILI. Deteksi Virus pada Pertanaman Mentimun (Cucumis sativus L.) di Tiga Kabupaten Bogor, Karawang, dan Subang, Jawa Barat. Dibimbing oleh TRI ASMIRA DAMAYANTI.
Penyakit virus banyak ditemukan pada pertanaman mentimun di Jawa Barat. Namun sulit membedakan spesies virus penyebab penyakit berdasarkan pengamatan gejala. Penelitian ini bertujuan untuk memperbaharui informasi data virus yang menginfeksi tanaman mentimun di Kabupaten Bogor, Karawang, dan Subang, provinsi Jawa Barat. Sampel daun mentimun diambil dari tanaman bergejala sebanyak 50 sampel tiap lokasi. Insidensi penyakit virus ditentukan secara serologi dengan metode dot blot immunobinding assay (DIBA) menggunakan antiserum Cucurbit aphid yellow borne virus (CABYV), Cucumber green mottle mosaic virus (CGMMV), Cucumber mosaic virus (CMV), Papaya ringspot virus (PRSV), Squash mosaic virus (SqMV), Watermelon mosaic virus
(WMV), dan Zucchini yellow mosaic virus (ZYMV). Deteksi asam nukleat dengan reverse transcription polymerase chain reaction (RT-PCR/PCR) dilakukan terhadap virus baru yang dominan ditemukan dan yang tidak terdeteksi serologi. Gejala yang ditemukan pada daun mentimun berupa mosaik, klorosis, keriting, dan penebalan tulang daun. Hasil deteksi menunjukkan insidensi penyakit oleh CABYV, CGMMV, CMV, PRSV, SqMV, WMV, dan ZYMV di Bogor berturut-turut adalah 100%, 86%, 98%, 0%, 8%, 32%, dan 6%, di Karawang 100%, 98%, 100%, 14%, 72%, 68%, dan 64%, dan di Subang 100%, 88%, 86%, 2%, 8%, 60%, dan 46%. CABYV, CGMMV, dan CMV merupakan virus yang dominan terdeteksi di tiga kabupaten dan PRSV hanya terdeteksi pada sampel asal Karawang dan Subang. RT-PCR menggunakan primer spesifik PRSV, primer universal Polerovirus dan Begomovirus berhasil mengamplifikasi gen protein selubung PRSV asal Karawang berukuran ~ 470 pb dan Polerovirus
asal Subang berukuran ~ 450 pb, dan Begomovirus berukuran ~ 900 pb. WMV dan CGMMV perlu deteksi lebih lanjut menggunakan primer spesifik untuk konfirmasi hasil deteksi serologi. Polerovirus dan CGMMV merupakan virus yang baru ditemukan pada mentimun di Jawa Barat.
ABSTRACT
NUR UNSYAH LAILI. Detection of Viruses on Cucumber (Cucumis sativus L.) Cultivation in Bogor, Karawang, and Subang Regencies, West Java. Under supervision of TRI ASMIRA DAMAYANTI.
The virus diseases were found in cucumber cultivations in West Java. However, it was difficult to differentiate the causal virus species based on visual symptoms. The aim of the research was to updating the viruses infecting cucumber in Bogor, Karawang, and Subang regencies. From each location, 50 leaf samples were collected from the symptomatic cucumber plants. The disease incidence was determined by dot blot immunobinding assay (DIBA) method using
Cucurbit aphid borne yellow virus (CABYV), Cucumber green mottle mosaic virus (CGMMV), Cucumber mosaic virus (CMV), Papaya ringspot virus (PRSV),
Squash mosaic virus (SqMV), Watermelon mosaic virus (WMV), and Zucchini yellow mosaic virus (ZYMV) antisera. Detection of nucleic acids of the newly predominant and serologically undetectable virus was conducted by reverse transcription polymerase chain reaction (RT-PCR/PCR). The symptom were found in cucumber leaves such as mosaic, chlorosis, curling, and vein banding. The result showed that the disease incidence of CABYV, CGMMV, CMV, PRSV, SqMV, WMV, and ZYMV in Bogor were 100%,86%, 98%, 0%, 8%, 32%, and 6%, in Karawang were 100%, 98%, 100%, 14%, 72%, 68%, and 64%, and in Subang were 100%, 88%, 86%, 2%, 8%, 60%, and 46%. CABYV, CGMMV, and CMV were the most common viruses detected in three regencies and PRSV only detected on samples from Karawang and Subang. RT-PCR/PCR using spesific primer of PRSV, universal primer Polerovirus, and Begomovirus successfully amplified the coat protein gen of PRSV from Karawang with size ~ 470 bp,
Polerovirus from Subang with size ~ 450 bp, and Begomovirus with size ~ 900 bp. Since WMV and CGMMV unable to detect by using universal primer, it is necessary to further detection using specific primer. Polerovirus and CGMMV are considerated as new viruses on cucumber in West Java.
©
Hak Cipta milik IPB, tahun 2015 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu maslah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
DETEKSI VIRUS PADA PERTANAMAN MENTIMUN
(Cucumis sativus L.) DI KABUPATEN BOGOR, KARAWANG,
DAN SUBANG, JAWA BARAT
NUR UNSYAH LAILI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Deteksi Virus pada Pertanaman Mentimun (Cucumis sativus
L.) di Kabupaten Bogor, Karawang, dan Subang, Jawa Barat Judul Skripsi :
Nama Mahasiswa: Nur Unsyah Laili NIM : A34110019
Disetujui oleh
Dr. Ir. Tri Asmira Damayanti, MAgr. Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, MSi. Ketua Departemen Proteksi Tanaman
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT yang telah memberikan karunia dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Deteksi Virus pada Pertanaman Mentimun (Cucumis sativus L.) di Kabupaten Bogor, Karawang, dan Subang, Jawa Barat” sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada program studi Proteksi Tanaman, Fakultas Pertanian Institut Pertanian Bogor. Penelitian dilakukan di Laboratorium Virologi, Departemen Proteksi Tanaman, Fakultas Pertanian. Penelitian dilaksanakan pada bulan Februari 2015 sampai Juni 2015.
Terima kasih untuk bapak, mamak, kakak, abang, dan adik yang selalu memberikan doa, semangat, dan kasih sayang. Penulis mengucapkan terima kasih kepada ibu Dr.Ir. Tri Asmira Damayanti, MAgr selaku pembimbing atas arahan dan bimbingan yang diberikan dalam pelaksanaan dan penyusunan skripsi ini. Terima kasih kepada Prof.Dr.Ir. Aunu Rauf, Msc selaku pembimbing akademik dan penguji tamu atas bimbingan yang diberikan. Terima kasih kepada teman-teman kosan puteri white house atas dukungan dan semangat yang telah diberikan. Terima kasih kepada PTN 48 atas persahabatan selama di IPB, terima kasih kepada teman-teman anggota Laboratorium Virologi Tumbuhan IPB atas bantuan dan dukungannya dalam melaksanakan penelitian.
Semoga penelitian ini bermanfaat.
Bogor, Oktober 2015
DAFTAR ISI
DAFTAR ISI iii
DAFTAR TABEL iv
DAFTAR GAMBAR iv
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
BAHAN DAN METODE 4
Waktu dan Tempat Penelitian 4 Pengambilan Sampel Tanaman Mentimun 4
Metode Penelitian 4
Perhitungan Insidensi Penyakit 4 Deteksi dengan Dot blot immunobinding assay 4 Deteksi dengan Reverse-transcription polymerase chain reaction 5
HASIL 8
Gejala Infeksi Virus pada Tanaman Mentimun di Lapangan 8
Insidensi Penyakit 9
Infeksi Campuran 9
Amplifikasi DNA 10
PEMBAHASAN 11
SIMPULAN DAN SARAN 14
DAFTAR PUSTAKA 15
DAFTAR TABEL
1 Sekuen primer untuk deteksi virus pada mentimun 6 2 Komposisi reaktan Polymerase chain reaction (PCR) untuk satu kali
reaksi amplifikasi DNA genom virus 6 3 Program PCR untuk mendeteksi virus pada mentimun 7 4 Variasi gejala infeksi pada tanaman mentimun di Jawa Barat 9 5 Insidensi penyakit oleh beberapa virus berdasarkan uji serologi 9 6 Infeksi tunggal dan infeksi campuran virus 10
DAFTAR GAMBAR
1 Gejala dominan infeksi virus pada tanaman mentimun di Kabupaten Bogor (b-c), Karawang (d-f), dan Subang (g-i). a. Klorosis disertai penebalan tulang daun, b-c. Malformasi daun disertai keriting, d. Klorosis disertai penebalan tulang daun, e. Klorosis, f-g. Mosaik, h. Klorosis, malformasi disertai penebalan tulang daun, dan i. mosaik
kuning 8
2 Amplifikasi DNA PRSV (a), Polerovirus (b), dan Begomovirus (c). Ukuran DNA ditunjukkan dengan panah. L = penanda DNA 100 pb (a dan b), 1 kb (c) (Thermo Scientific), K+ = kontrol positif, KKA = PRSV asal Karawang, SMA = Polerovirus asal Subang, SPU = Begomovirus
asal Subang, SMA = Begomovirus asal Subang, KJA = Begomovirus asal
Karawang 10
LAMPIRAN
PENDAHULUAN
Latar Belakang
Mentimun (Cucumis sativus L.) merupakan komoditas sayuran dari famili labu-labuan (Cucurbitaceae) yang dapat ditanam didataran tinggi maupun dataran rendah. Tanaman ini berasal dari Benua Asia, yakni India dan dibudidayakan hampir di seluruh dunia (Rukmana 1994). Mentimun merupakan sayuran yang digemari di Indonesia karena kandungan nutrisi dan rasanya. Namun budidaya mentimun masih dianggap usaha sampingan sehingga rata-rata produksi mentimun secara nasional masih rendah antara 3.5 sampai 4.8 ton/ha. Badan Pusat Statistik (2013) mencatat produksi mentimun di Indonesia tahun 2013 mencapai 256 006 ton. Produksi mentimun ini menurun dibandingkan dengan tahun sebelumnya yang mencapai 511 525 ton. Penurunan produksi tersebut salah satunya disebabkan oleh penyakit yang disebabkan oleh virus.
Sekitar 32 virus dapat menginfeksi tanaman Cucurbitaceae diantaranya
Cucurbit aphid borne yellow mosaic virus (CABYV), Cucumber green mottle mosaic virus (CGMMV), Cucumber mosaic virus (CMV), Papaya ringspot virus
(PRSV), Squash mosaic virus (SqMV), Watermelon mosaic virus (WMV), dan
Zucchini yellow mosaic virus (ZYMV) (Coutts dan Jones 2005; Ali et al. 2012).
Begomovirus dilaporkan menyebabkan penyakit yang cukup penting pada mentimun (Shtayeh et al. 2010). Begomovirus menyebabkan gejala berupa keriting pada daun hingga kerdil (Cohen et al. 1983). Begomovirus dapat ditularkan secara efektif melalui penyambungan dan vektor yakni kutu kebul (Bemisia tabaci) (Hunter et al. 1998).
CMV (Bromoviridae; Cucumovirus) merupakan salah satu virus penting di dunia yang menginfeksi lebih dari 1000 spesies tanaman khususnya cabai dan tomat (Duriat et al. 1992; Roossinck dan Russell 2002). CMV menimbulkan gejala berupa mosaik, belang, malformasi pada daun, kerdil, dan keriting (Palukaitis et al. 1992). Taufik et al. (2005) melaporkan CMV ditemukan pada hampir semua pertanaman cabai di Indonesia. CMV juga ditemukan pada tanaman sayuran di Kroasia, Mesir, Yunani, Israel, Italia, Jepang, Polandia, Portugal, dan negara bagian Amerika Utara (Hadidi et al. 1998). Penurunan produksi yang disebabkan oleh CMV sebesar 30 sampai 60% pada tanaman cabai. Penularan dan penyebaran CMV terjadi melalui serangga vektor dan benih.
Myzus persicae dan Aphis gossypii merupakan serangga vektor penting yang menyebarkan CMV. Penularan CMV melalui benih dilaporkan terjadi pada lebih dari 20 spesies tanaman dengan efisiensi penularan 1% sampai 50% (Palukaitis et al. 1992).
2
craccivora, M. persicae, dan Lipaphis erysimi. ZYMV juga dapat disebarkan melalui benih zuchini dan labu, namun belum dilaporkan dapat tersebar melalui benih mentimun.
SqMV (Comoviridae; Comovirus) banyak ditemukan di daerah produksi tanaman Cucurbitaceae termasuk mentimun, namun jarang menginfeksi semangka. Virus ini menginfeksi tanaman mentimun di Australia, Israel, Japan, dan China. SqMV termasuk dalam organisme pengganggu tanaman karantina (OPTK) kategori A2 menurut revisi Peraturan Menteri Pertanian Nomor 93/Permentan/OT.140/12/2011. Aulia (2004) melaporkan SqMV ditemukan pada pertanaman melon di Bogor. Gejala SqMV umumnya berupa mosaik hijau kuning dengan hijau tua lebih banyak berada di sekitar tulang daun, daun menjadi kaku dan berkerut serta mengalami penyempitan ukuran daun, dan tanaman menjadi kerdil (Lestari dan Nurhayati 2014). SqMV ditularkan secara non persisten oleh
Ephilacna Sp.dan Aulacophora similis (Campbell 1971).
PRSV (Potyviridae; Potyvirus) merupakan virus yang masuk dalam organisme pengganggu tanaman karantina (OPTK) kategori A2 berdasarkan revisi Peraturan Menteri Pertanian Nomor 93/Permentan/OT.140/12/2011. Tanaman Cucurbitaceae yang terinfeksi PRSV menunjukkan gejala seperti kerdil, mosaik, dan malformasi pada buah (Babadoost 2012). PRSV dapat ditularkan secara mekanis dan melalui kutu daun secara non persisten (Tripathi et al. 2008). Hidayat et al. (2012) melaporkan infeksi PRSV pada pepaya di daerah Aceh dan menguatkan keberadaan PRSV di wilayah negara Indonesia.
WMV (Potyviridae; Potyvirus) merupakan virus yang menyebabkan infeksi berupa mosaik, klorosis, belang, dan distorsi pada daun. Virus ini pertama kali dilaporkan tahun 1963 di Israel. WMV pernah dilaporkan di Sulawesi Selatan dan daerah lainnya di Indonesia (Wakman et al. 2002). Virus ini dapat menginfeksi lebih dari 170 spesies dari famili monokotiledon atau dikotiledon (Lecoq et al. 2011). Penyebaran WMV difasilitasi kutu daun secara non persisten, seperti M. persicae, A. gossypii, dan A. fabae dan dapat disebarkan melalui benih (Lecoq dan Desbiez 2008).
CABYV (Luteoviridae; Polerovirus) merupakan virus yang menyebabkan daun mentimun menjadi kekuningan. CABYV pertama kali dilaporkan di Prancis tahun 1992, namun di Indonesia CABYV belum pernah dilaporkan menginfeksi tanaman Cucurbitaceae. Gejala yang disebabkan oleh infeksi CABYV yakni bintik-bintik seperti klorosis pada daun, daun menebal, dan menjadi rapuh (Lecoq
et al. 1992). Penurunan produksi yang disebabkan oleh CABYV sebesar 50% pada mentimun dan 40% pada melon. Penyebaran CABYV terjadi secara persisten melalui A. gossypii dan M. persicae (Lecoq et al. 1992), sedangkan penyebaran secara mekanik belum dilaporkan.
CGMMV (Virgaviridae; Tobamovirus) menyebabkan gejala berupa klorosis pada daun, nekrosis pada pedikel, dan kerusakan pada buah (Boubourakas et al. 2004). CGMMV menyebabkan kehilangan hasil produksi sebesar 15% pada
Cucurbitacea (Shang et al. 2011). CGMMV dilaporkan menginfeksi
3
Peningkatan infeksi dan munculnya virus baru pada tanaman mentimun di Indonesia kemungkinan disebabkan oleh adanya importasi benih Cucurbitaceae dari negara lain. Untuk memantau infeksi virus yang telah ada ataupun virus baru yang mungkin ada, maka perlu dilakukan pemutakhiran data tentang penyakit virus secara berkala agar terpantau identitas, sebaran, dan insidensinya di lapangan.
Tujuan Penelitian
Penelitian ini bertujuan mendeteksi virus-virus yang menginfeksi mentimun di Kabupaten Bogor, Karawang, dan Subang, Jawa Barat.
Manfaat Penelitian
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Survei penyakit dan pengambilan sampel tanaman mentimun yang bergejala dilakukan pada pertanaman mentimun di Kabupaten Bogor di Desa Bojong (BBO), Sindang Barang (SBO), dan Petir (SPE), Subang di Desa Marjim (SMA), Tanjung Baru (STB), dan Pungangan (SPU), dan Karawang di Desa Kaceot (KKA), Jatimulya (KJA), dan Kutakarya (KKA), Jawa Barat. Deteksi virus dilakukan di Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini berlangsung mulai bulan Februari 2015 hingga Juni 2015.
Pengambilan Sampel Tanaman Mentimun
Sampel tanaman mentimun yakni daun yang bergejala diambil sebanyak 50 sampel dari tiap lokasi. Deskripsi gejala dan dokumentasi menggunakan kamera digital dilakukan pada masing-masing sampel. Sampel dari semua lokasi dibawa ke Laboratorium dan disimpan pada suhu -80 °C.
Metode Penelitian
Insidensi penyakit ditentukan dengan deteksi serologi menggunakan metode
Dot blot immunobanding assay (DIBA) dengan antiserum CABYV,CGMMV, CMV, PRSV, SqMV, WMV, dan ZYMV. Sedangkan amplifikasi DNA dilakukan dengan PCR atau RT-PCR menggunakan primer universal atau primer target virus.
N = Jumlah seluruh tanaman yang diamati
Deteksi dengan Dot Blot Immunobinding Assay (DIBA)
Metode DIBA dilakukan sesuai metode yang digunakan oleh Asniwita et al. (2013). Deteksi dengan DIBA terdiri dari beberapa tahapan, yaitu blotting,
blocking, reaksi antibodi 1, reaksi antibodi 2, dan pewarnaan.
Blotting. Jaringan daun digerus dalam Tris buffer saline (TBS) [TBS: Tris
–HCl 0.3152 g dan NaCl 0.8766 g, dalam 100 ml akuabides, pH 7.5]. dengan perbandingan 1:10 (b/v). Sap tersebut selanjutnya diteteskan pada membran nitro selulosa sebanyak 2 µl.
5
dengan konsentrasi final 2%. Membran kemudian diinkubasi pada shaker dengan kecepatan 50 rpm selama 2 jam. Membran kemudian dicuci sebanyak 5 kali dengan dH2O selama 5 menit dalam shaker dengan kecepatan 100 rpm.
Antibodi 1. Membran selanjutnya direndam dalam 5 ml TBS yang
mengandung antiserum pertama 1 µl (1:5000 v/v) ditambah non fat milk dengan konsentrasi final 2%, kemudian membran diinkubasi diatas shaker dengan kecepatan 50 rpm selama dua jam pada suhu ruang. Membran kemudian dicuci sebanyak 5 kali dengan Tween 0.05% dalam TBS (TBST).
Antibodi 2. Membran nitroselulosa selanjutnya direndam dalam 5 ml TBS
yang mengandung antiserum ke dua sebanyak 1 µl (goat anti rabbit-IgG, Sigma) (1:5000 v/v) ditambah non fat milk dengan konsentrasi final 2% dan kemudian membran diinkubasi selama 60 menit diatas shaker dengan kecepatan 50 rpm. Membran kemudian dicuci kembali dengan TBST.
Pewarnaan. Membran lalu direndam selama 5 menit dalam Alkalin
Phosphatase buffer pH 9.5 (Tris-HCl 6.05 g, NaCl 2.92 g, dan MgCl.6H2O 0.51 g
dalam 500 ml akuabides steril) yang mengandung nitro blue tetrazolium (NBT) 75 mg/ml dan bromo chloro indolyl phosphate (BCIP) 50 mg/ml (dalam 10 ml AP bufer ditambahkan 45 µl NBT dan 35µl BCIP). Jika reaksi positif akan terjadi perubahan warna putih menjadi ungu pada membran nitroselulosa yang telah ditetesi cairan sap dan reaksi dapat dihentikan dengan merendam membran dengan dH2O.
Deteksi dengan Reverse-Transcription Polymerase Chain Reaction (RT-PCR)
Metode deteksi virus dengan RT-PCR terdiri dari beberapa tahapan, yaitu ekstraksi RNA total, sintesis complementary DNA (cDNA), amplifikasi DNA target, dan visualisasi hasil amplifikasi.
Ekstraksi RNA total. Ekstraksi RNA secara manual dilakukan dengan mengikuti metode CTAB (Doyle dan Doyle 1990). Sampel tanaman bergejala sebanyak 0.1 g digerus menggunakan nitrogen cair dan ditambahkan 500 μl bufer ekstraksi yang mengandung (1% 2-β-merkaptoetanol). Hasil gerusan kemudian dimasukkan kedalam tabung mikro 2 ml dan diinkubasi dalam penangas air pada
suhu 65 ˚C selama 30 menit. Setiap 10 menit sekali tabung dibolak-balik untuk membantu proses lisis. Setelah 30 menit tabung yang berisi ekstraksi tanaman diangkat dari penangas air kemudian didiamkan selama 2 menit pada suhu ruang, Lalu ditambahkan 500 μl campuran Chloroform:Isoamilalcohol (24:1). Agar tercampur dengan baik tabung divortek dengan kecepatan tinggi selama 5 menit, kemudian disentrifugasi dengan kecepatan 12 000 rpm selama 15 menit. Supernatan kemudian dipindahkan ke tabung baru, lalu ditambahkan Isopropanol (volume sebanding dengan supernatan yang diperoleh). Tabung mikro dibolak-balik sehingga terlihat benang-benang RNA, kemudian disentrifugasi dengan kecepatan 12 000 rpm selama 7 menit. Setelah disentrifugasi akan terlihat pelet RNA, campuran supernatan dan Isopropanol dipindahkan sehingga menyisakan pelet RNA. Pelet RNA yang diperoleh dicuci dengan etanol 70% sebanyak 500 μl. Pelet RNA yang telah ditambahkan etanol disentrifugasi selama 7 menit dengan kecepatan 12 000 rpm, etanol dibuang lalu tabung diletakkan secara terbalik diatas tisu selama 15 menit agar pelet kering. Pelet yang diperoleh dilarutkan dalam 50
6
Sintesis cDNA. Produk ekstraksi RNA total digunakan sebagai template untuk sintesis cDNA. Sintesis cDNA terjadi melalui transkripsi balik RNA menggunakan enzim transkriptase MmuLV (Moloney Murine Leukimia Virus). Molekul cDNA tersebut digunakan untuk cetakan pada proses PCR. Komposisi bahan reaksi transkripsi balik terdiri dari: bufer RT 2 µl, dNTP 10 mM 0.50 µl, DTT 50 mM 0.35 µl, RNAse inhibitor (Thermo scientific) 0.35 µl, MmuLV (Thermo scientific) 0.35 µl, dH2O 3.7 µl, oligo d(T) 0.75 µl , dan RNA 2 µl.
Untuk sintesis cDNA dari genus Polerovirus menggunakan primer reverse
Polerovirus. Reagen seperti dH2O 3.7 µl , dNTP 10 mM 0.50 µl, oligo d(T) 0.75
µl, dan RNA 2 µl direaksikan pada suhu 65 °C selama 5 menit dan segera didinginkan didalam es. Selanjutnya reagen tersebut direaksikan kembali dengan menambah 5× bufer RT 2 µl, DTT 50 mM 0.35 µl, RNAse inhibitor (Thermo scientific) 0.35 µl, dan MmuLV (Thermo scientific) 0.35 µl yang dicampur rata dan diinkubasi pada suhu 42 °C selama 60 menit dan 70 °C selama 10 menit untuk menginaktivasi enzim. Produk cDNA kemudian digunakan sebagai templat pada amplifikasi PCR.
RT-PCR/PCR. Amplifikasi DNA virus dilakukan dengan menggunakan
pasangan primer untuk mengamplifikasi dan mendeteksi CABYV, CGMMV, PRSV, WMV, dan Begomovirus (Tabel 1). Komposisi reaktan PCR tercantum pada tabel 2.
Tabel 1 Sekuen primer untuk deteksi virus pada mentimun
Primer1 Runutan
Produk PCR
(pb)
Referensi
Tob-Uni 1-cpR 5’-ATTTAAGTGGASGGAAAAVCACT-3’ ~ 830 Letschert et al. 2002 CGMMV-cpF 5’-GATTCCTTATCCGAGAAAGTT-3’
SPG1-R 5’-CCCKGTGCGWRAATCCAT-3’ ~ 912 Li et al. 2004
SPG2-F 5’-ATCCVAAYWTYCAGGGAGCTAA-3’
Polerovirus-cpR 5’-GTCTACCTATTTBGGRTTNTGGAA-3’ ~ 600 Correa et al. 2005 Polerovirus-cpF 5’-TGCGACAAATAGTTAATGAATACGGT-3’
PRSV-P-cpR 5’-TCGTGCCACTCAATCACAAT-3’ ~ 470 Mohammed et al. 2012
PRSV-P-cpF 5’-GTTACTGACATGCCGTCCA-3’
Potyvirus-cpR 5’-ATGGTHTGGTGTGYATHGARAAYGG-3’ ~ 320 Jeanne et al. 2008 Potyvirus-cpF 5’-TGCTGCKGCYTTCATYTG-3’
Go Taq green 2x (Thermo scientific) 12.5
Primer forward 10 µM 1.0
Primer reverse 10 µM 1.0
Air bebas nuklease 9.5
cDNA 1.0
7
PCR dilakukan dengan program PCR diatur pada waktu dan suhu tertentu sesuai dengan virus target (Tabel 3).
Tabel 3 Program PCR untuk mendeteksi virus pada mentimun
Target Kondisi PCR ∑Siklus
Predenaturasi Denaturasi Annealing Elongasi Ekstensi akhir CABYV 95ºC/5 min 95ºC/1 min 45ºC/1 min 72ºC/1 min 72ºC/10 min 40 CGMMV 94ºC/5 min 94ºC/1 min 60ºC/45 det 72ºC/1 min 72ºC/5 min 35 PRSV 94ºC/5 min 94ºC/30 det 50ºC/1 min 72ºC/1 min 72ºC/7 min 35 WMV 94ºC/5 min 94ºC/4 min 53ºC/1 min 72ºC/1 min 72ºC/5 min 35 Begomovirus 94ºC/5 min 94ºC/1 min 50ºC/1 min 72ºC/1 min 72ºC/7 min 35
Visualisasi DNA. Visualisasi DNA hasil amplikasi dilakukan pada
HASIL
Gejala Infeksi Virus pada Tanaman Mentimun di Lapangan
Gejala infeksi virus dari lokasi pengambilan sampel bervariasi berupa mosaik pada daun, kuning, malformasi daun, penebalan tulang daun, dan keriting pada daun (Gambar 1 dan Tabel 1). Gejala dominan pada pertanaman mentimun di Bogor yaitu klorosis disertai penebalan tulang daun dan mosaik disertai ujung-ujung daun mengeriting. Gejala dominan pada pertanaman mentimun di Karawang yaitu klorosis disertai penebalan daun, klorosis, dan mosaik, sedangkan gejala dominan pada pertanaman mentimun di Subang yaitu mosaik, klorosis, malformasi disertai penebalan daun, dan mosaik kuning.
Gambar 1 Gejala dominan infeksi virus pada tanaman mentimun di Kabupaten Bogor (a-c), Karawang (d-f), dan Subang (g-i). a. klorosis disertai penebalan tulang daun, b-c. malformasi daun disertai keriting, d. klorosis disertai penebalan daun, e. klorosis, f-g. mosaik, h. klorosis, malformasi, dan penebalan tulang daun, dan i. mosaik kuning
a b c
d e f
9
Tabel 4 Variasi gejala infeksi virus pada tanaman mentimun di Jawa Barat
Lokasi Tipe gejala
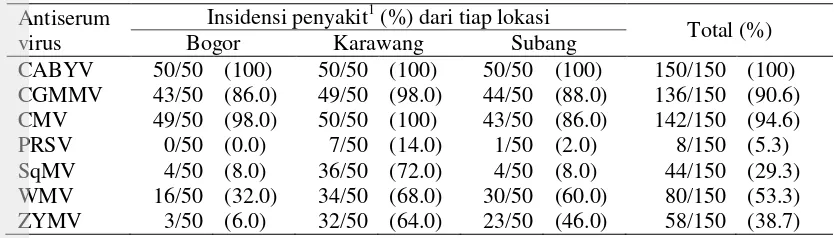
Berdasarkan uji serologi dari 150 sampel yang diuji menunjukkan tanaman terinfeksi CABYV, CGMMV, CMV, PRSV, SqMV, WMV, dan ZYMV. Insidensi penyakit CABYV di Kabupaten Bogor paling tinggi dibandingkan CGMMV, CMV, PRSV, SqMV, WMV, dan ZYMV. Persentase insidensi penyakit masing-masing sebesar 100%, 86%, 98%, 0%, 8%, 32%, dan 6%. Insidensi CABYV juga dominan ditemukan di Kabupaten Karawang dan Subang. Insidensi penyakit CABYV, CGMMV, CMV, PRSV, SqMV, WMV, dan ZYMV di Kabupaten Karawang berturut-turut adalah 100%, 98%, 100%, 14%, 72%, 68%, dan 64%, dan di Kabupaten Subang berturut-turut adalah 100%, 88%, 86%, 2%, 8%, 60%, dan 46%. Insidensi PRSV merupakan yang terendah dengan persentase insidensi penyakit pada Kabupaten Karawang dan Subang masing-masing adalah 14% dan 2% dan hanya terdeteksi pada sampel di Kabupaten Subang dan Karawang, Jawa Barat (Tabel 5).
Tabel 5 Insidensi penyakit oleh beberapa virus berdasarkan uji serologi
Antiserum virus
Insidensi penyakit1 (%) dari tiap lokasi
Total (%)
Insidensi penyakit = n/N x 100%; n = jumlah tanaman positif terdeteksi virus, N = total tanaman yang diuji.
Infeksi Campuran
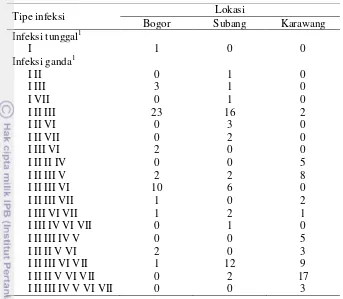
Berdasarkan hasil deteksi serologi, terdeteksi adanya infeksi campuran pada beberapa tanaman mentimun. Infeksi campuran CABYV, CGMMV, dan CMV merupakan yang paling dominan dideteksi di Kabupaten Bogor dan Subang. Infeksi campuran lainnya terdeteksi pada 22 sampel tanaman (15%) dari Kabupaten Bogor, 27 sampel tanaman (18%) dari Kabupaten Subang, dan 53 sampel tanaman (35%) dari Kabupaten Karawang (Tabel 6, Lampiran 1-3).
10
Tabel 6 Infeksi tunggal dan infeksi campuran virus
Tipe infeksi Lokasi (Gambar 2a). DNA Polerovirus asal Subang berukuran ~ 450 pb (Gambar 2b) dan amplifikasi DNA Begomovirus asal Subang dan Karawang berukuran ~ 900 pb (Gambar 2c). WMV dan CGMMV belum berhasil teramplifikasi dengan primer universal (data tidak ditampilkan), sehingga perlu dideteksi lebih lanjut dengan primer spesifik virus untuk mengkonfirmasi hasil deteksi serologi.
PEMBAHASAN
Gejala penyakit yang ditemukan di lapangan berupa mosaik pada daun, klorosis, malformasi daun, penebalan tulang daun, keriting, dan kuning. Gejala mosaik yang dominan ditemukan bercampur dengan permukaan daun yang tidak rata, malformasi disertai klorosis. Selain menyebabkan mosaik pada daun, infeksi virus juga menyebabkan penurunan kuantitas dan kualitas buah. Identifikasi berdasarkan gejala saja tidak dapat menentukan virus penyebab, karena gejala dapat disebabkan oleh infeksi tunggal atau campuran.
Infeksi campuran pada beberapa tanaman mentimun terdeteksi merupakan interaksi virus kemungkinan berupa interaksi sinergis dan antagonis antara dua atau lebih virus. Interaksi sinergis adalah infeksi campuran antara dua atau lebih virus yang meningkatkan replikasi dari satu atau kedua virus dan meningkatkan gejala dibandingkan infeksi tunggal. Interaksi tersebut juga meningkatkan kerusakan pada tanaman terutama pada kultivar rentan sehingga meningkatkan kehilangan hasil panen (Syller 2012). Kehilangan hasil panen pada mentimun dilaporkan terjadi akibat infeksi tunggal maupun campuran antara PRSV, WMV, dan ZYMV (Arteaga et al. 1998). Menurut Poolpol dan Inouye (1986) interaksi antara ZYMV dengan CMV pada mentimun merupakan interaksi sinergis. Interaksi antagonis adalah interaksi yang menyebabkan hanya satu virus yang memperoleh keuntungan dan menurunkan aktivitas virus lainnya (Syller 2012). Infeksi campuran pada satu tanaman mentimun kemungkinan terjadi karena penyebaran virus oleh kutu daun dan secara mekanis melalui alat pertanian. Infeksi campuran menyebabkan variasi gejala yang berbeda dari infeksi tunggal masing-masing virus.
Gejala tunggal yang disebabkan oleh CMV berupa mosaik, belang, kerdil, dan keriting (Palukaitis et al. 1992). Gejala yang disebabkan oleh ZYMV berupa mosaik kuning, malformasi buah dan daun, pelepuhan, pengurangan ukuran lamina daun, nekrosis, dan kerdil, dan gejala yang disebabkan oleh SqMV berupa mosaik hijau kuning, penyempitan ukuran daun dan kerdil (Zitter et al. 1996; Desbiez dan Lecoq 1997; Lestari dan Nurhayati 2014). Gejala yang disebabkan oleh infeksi tunggal PRSV berupa mosaik, kerdil, dan warna buah yang tidak sempurna (Gonsalves 1998). Gejala yang disebabkan oleh CABYV berupa, bintik-bintik seperti klorosis pada daun, daun menebal, dan menjadi rapuh (Lecoq
et al. 2011). Gejala yang disebabkan oleh CGMMV berupa klorosis pada daun, nekrosis pada pedikel, dan kerusakan pada buah (Boubourakas et al. 2004). Gejala infeksi tunggal CABYV yang ditemukan di Kabupaten Bogor sesuai dengan gejala CABYV yang dilaporkan oleh Lecoq et al. (2011). Gejala infeksi CGMMV, CMV, PRSV, SqMV, WMV, dan ZYMV yang ditemukan dalam penelitian ini berbeda dengan gejala tunggal yang telah dilaporkan. Gejala campuran yang disebabkan oleh infeksi ganda antara CGMMV dan WMV berupa pemucatan tulang daun, belang kuning hijau, dan mosaik (Moradi dan Jafarpour 2010).
12
menginfeksi tanaman dari famili Cucurbitaceae (Gonsalves 1998), sedangkan strain PRSV-P menginfeksi famili Caricaeae dan Cucurbitaceae. Oleh karena PRSV dapat teramplifikasi dengan primer PRSV-P hal ini menunjukkan PRSV pada tanaman tersebut kemungkinan adalah PRSV-W atau PRSV-P, namun perlu dikonfirmasi dengan perunutan DNA. Tanaman Cucurbitaceae yang terinfeksi oleh PRSV menunjukkan gejala berupa mosaik, kerdil, dan warna buah yang tidak sempurna. Menurut Rosales et al. (2000) gejala khas PRSV hanya ditemukan pada tanaman pepaya, sedangkan pada Cucurbitaceae menunjukkan gejala ringan. Tanaman muda yang terinfeksi PRSV tidak dapat berkembang, sedangkan tanaman tua yang terinfeksi akan menghasilkan buah namun mengalami malformasi dan perubahan warna. Menurut Harmiyati (2015) infeksi PRSV juga memengaruhi bobot kering tanaman Cucurbitaceae. Tanaman dari famili Cucurbitaceae, kecuali kabocha tidak menunjukkan penurunan bobot, melainkan kenaikan bobot. Faktor yang memengaruhi penambahan bobot tanaman adalah tanaman mengeluarkan senyawa tertentu sehingga dapat mengeliminasi atau mengurangi infeksi virus dan keberadaan virus tidak mengganggu metabolisme tanaman (Harmiyati 2015).
Sampel asal Subang yang terdeteksi serologi dengan antiserum CABYV juga teramplifikasi dengan ukuran ~ 450 pb menggunakan primer universal gen protein selubung genus Polerovirus. Ukuran DNA ini lebih pendek dibandingkan dengan DNA kontrol positif PeVYV (Pepper vein yellow virus) yang dilaporkan oleh Apindiati et al. (2015) yang berukuran 650 pb (Gambar 2b). Polerovirus
menyebabkan gejala kuning pada tanaman mentimun (Knierim et al. 2010). Gejala kuning banyak ditemukan pada pertanaman mentimun di lokasi pengambilan sampel. Gejala tersebut ikuti oleh penebalan tulang daun seperti yang ditemukan di Kabupaten Bogor, Subang, dan Karawang. Spesies dari genus
Polerovirus yang menginfeksi mentimun yaitu CABYV, MABYV (Melon aphid borne yellows virus), dan SABYV (Suakwa aphid borne yellow virus) (Lecoq et al. 1992; Knierim et al. 2010). Oleh karena ukuran DNA virus yang teramplifikasi lebih pendek dibandingkan kontrol positif, perlu dilakukan konfirmasi dengan perunutan DNA untuk mengetahui spesies virus yang terdeteksi dari sampel dalam penelitian ini.
Gejala kuning yang teramati di tiga lokasi diikuti oleh beberapa gejala lain seperti mosaik, kerdil, dan keriting. Gejala yang terlihat pada tanaman mentimun diduga diinfeksi oleh Begomovirus. Pita DNA Begomovirus teramplifikasi dengan ukuran DNA yang sama dengan kontrol positif ToLCNDV (Tomato leaf curl new delhi virus) (Gambar 2c). Septariani et al. (2014) melaporkan ToLCNDV ditemukan di Tegal, Sleman, Sukoharjo, dan Bogor. Gejala yang terlihat berupa mosaik kuning, melepuh, menguning, dan mosaik hijau muda. Gejala kuning pada mentimun juga dilaporkan oleh Adnyani (2015), namun disebabkan oleh SLCCV (Squash leaf curl china virus). SLCCV menginfeksi tanaman mentimun di Bali dan menyebabkan produksi mentimun menurun meskipun tidak terjadi penurunan secara drastis.
13
14
SIMPULAN DAN SARAN
DAFTAR PUSTAKA
Adlerz WC. 1987. Cucurbit potyvirus transmision by alate aphids (Homoptera: Aphididae) trapped alive. Journal of Economic Entomology 80:87-92. Adnyani NNP. 2015. Kloning gen Squash leaf curl china virus (SLCCNV)
penyebab penyakit daun kuning pada tanaman mentimun [Tesis]. Bali (ID): Universitas Udayana.
Ali A, Mohammad O, Khattab A. 2012. Distribution of viruses infecting cucurbit crops and isolation of potential new virus like sequences from weeds in Oklahoma. Plant Disease 96(2): 243-248.
Al-Shahwan IM, Abdalla OA, Al-Saleh MA. 1995. Response of greenhouse-grown cucumber cultivars to an isolate of Zucchini yellow mosaic virus
(ZYMV). Plant Disease 79(9): 898-901.
Apindiati RK, Suastika G, Mutaqin KH. 2015. Identifikasi Polerovirus penyebab klorosis pada cabai asal Bali, Indonesia. Jurnal Fitopatologi Indonesia
11(2):43-50.
Arteaga ML, Alvarez JM, Prados JLA, Bernal JJ, Arenal FG, Lavina A, Batlle A, Moriones E. 1998. Occurrence, distribution, and relative incidence of mosaic virus infecting field grow melon in Spain. Plant Disease 82:979-982.
Asniwita, Hidayat SH, Suastika G, Sujiprihati S. 2013. Penggunaan galur lemah
Chili veinal mottle virus untuk proteksi silang. Jurnal Fitopatologi Indonesia 5(9):145-152.
Aulia R. 2004. Inventarisasi dan deteksi virus penyebab mosaik pada famili Cucurbitaceae di Kotamadya Bogor, Pasir Muncang, dan Cibodas [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Babadoost M. 2012. Viral Disease of Cucurbits. Report on Plant Disease. University of Illionis.
[BPS] Badan Pusat Statistik. 2013. Produksi sayuran di Indonesia, 1997-2013 [Internet]. Jakarta (ID): Badan Pusat Statistik; [diunduh 2014 April 17]. Tersedia pada: http://www.bps.go.Id/tab_sub/view.Php?kat=3&tabel=1 &daftar=1&id_subyek=55& notab=70.
Boubourakas IN, Hatziloukas E, Antignus Y, Katis NI. 2004. Etiology of leaf chlorosis and deterioration of the fruit interior of watermelon plants. Journal of Phytopathology 152(10): 580-588.
Campbell RN. 1971. Description of Plant Viruses. University of Idaho.
Cohen S, Duffus JE, Larsen RC, Liu HY, Flock RA. 1983. Purification, serology, and vector relationships of squash leaf curl virus, a whitefly-transmitted
Geminivirus. The American Phytopathological Society 73(12): 1669-1673. Coutts BA, Jones RAC. 2005. Incidence and distribution of viruses infecting
cucurbit crop in the Northem Territory and Western Australia. Australian Journal of Agricultural Research 56(8):847-858.
Correa RL, Silva TF, Araujo S, Barroso PAV, Vidal MS, Vaslin FS. 2005. Molecular characterization of a virus from the family Luteoviridae
16 Evaluasi penggunaan vaksin CARNA-5 pada tanaman cabai. Jurnal Hortikultura 22(4):41-50.
Gonsalves D. 1998. Control of Papaya ringspot virus in papaya. Phytopathology
36:15-37.
Grisoni M, Moles M, Farreyrol K, Rassaby L, Davis R, Pearson M. 2006. Identification of Potyvirus infecting vanilla by direct sequencing of a short RT-PCR amplicon. Plant Pathology 55:523-529.
Hadidi A, Khetarpal RK, Koganzewa H. 1998. Plant Virus Diseases Control. St Paul (US): The American phytopathological Sociaty.
Harmiyati T. 2015. Kisaran inang dan penularan Papaya ringspot virus [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Hidayat SH, Nurulita S, Wiyono S. 2012. Infeksi papaya ringspot virus pada tanaman pepaya di provinsi Nanggro Aceh Darussalam. Jurnal Fitopatologi Indonesia 6(8):184-187.
Hunter WB, Hiebert E, Webb SE, Tsai JH, Polston JE. 1998. Location of
Geminivirus in the whitefly Bemisia tabaci (Homoptera: Aleyrodidae).
Plant Disease 82: 1147-1151.
Jeanne MV, Loos R, Peyre J, Alliot B, Signoret P. 2000. Differentiation of Poaceae Potyviruses by reverse transcription polymerase chain reaction and restriction analysis. Phytopathology 148(3):141-151. doi:10.1046/j.1439-0434.2000.00473.x
[Kementan] Kementerian Pertanian. 2011. Peraturan Menteri Pertanian Nomor 93 tahun 2011 tentang Jenis Organisme Pengganggu Tumbuhan Karantina. Jakarta (ID): RI.
Knierim D, Deng TC, Tsai WS, Green KS, Kenyon L. 2010. Molecular identification of three distinct Polerovirus species and a recombinant
Cucurbit aphid-borne yellows virus strain infecting cucurbit crops in Taiwan. Plant Pathology 59:991-1002.
Lecoq H, Bourdin D, Wipf S, Bon C, Lot, Lemaire O, Herrbach E. 1992. A new yellowing disease of cucurbits caused by a luteovirus, Cucurbit aphid-borne yellows virus. Plant Pathology 41(6):749-761.
Lecoq H, Desbiez C. 2008. Watermelon mosaic virus and Zucchini yellow mosaic virus. Di dalam: Smith HG, Barker H, editor. Encyclopedia of Virology. Ed ke-3. Oxford (GB): Elsevier. hlm 433-440.
Lecoq H, Fabre F, Joannon B, Schiebel WC, Chandeysson C, Schoeny A, Desbiez C. 2011. Search for factor involved in the rapid shift in Watermelon mosaic virus (WMV) populations in South-Eastern France. Virus Research
159(2):115-123.
Lestari SM, Nurhayati E. 2014. Efisiensi tular benih Squash mosaic virus pada Cucurbitaceae. Jurnal FitopatologiIndonesia 10(3):81-86.
17
economical importance by RT-PCR and RT-PCR-RFLP. Virological Method 106:1-10.
Li R, Salih S, Hurtt S. 2004. Detection of Geminivirus in sweetpotato by polymerase chain reaction. Plant Disease 88:1347-1351.
Mohammed H, Manglli A, Zicca S, Mohammed M, Tomassoli L. 2012. First report of Papaya ringspot virus in pumpkin in Sudan [Internet]. London (UK): New Disease Report; [diunduh 2015 September 24]. Tersedia pada: http://www.ndrs.org.uk/article.php?id=026026.
Moradi Z, Jafarpour B. 2010. Mixed infections of Watermelon mosaic potyvirus
and Cucumber green mottle mosaic Tobamovirus in cucurbit hosts. Plant Protection Journal 2(4):353-365.
Padmalatha K, Prasad MNV. 2006. Optimation of DNA isolation and PCR protocol for RAPD analysis of selected medicinal and aromatic plants of conservation on concern from penisular India. African Journal of Biotechnology 5(3):230-234.
Palukaitis P, Roossinck MJ, Dietzgen, Francki RIB. 1992. Description of plant viruses: Cucumber mosaic virus [Internet]. Cambridge (GB): Association of Applied Biologists; [diunduh 2014 April 16]. Tersedia pada: Tersedia pada:http://www.dpvweb.net/dpv/showdpv.php?dpvno=400.
Poolpol P, Inouye T. 1986. Enhancement of cucumber mosaic virus multiplication by Zucchini yellow mosaic virus in doubly infected cucumber plants. Phytopathological Society of Japan 52:22-30.
Roossinck MJ, Russell DW. 2002. Evolutionary of Cucumber mosaic virus
deduced by phylogenetic analyses. Virology 76(7):3882-3887.
Rosales LS, Leor NB, Castro SR, Ortiz DT, Carrazana JCN. 2000. Coat protein sequence comparisons of three Mexican isolates of Papaya ringspot virus
with other geographical isolates reveal a close relationship to American and Australian isolates. Archives of Virology 145:835-843.
Rukmana. 1994. Budidaya Mentimun. Yogyakarta (ID): Kanisius.
Septariani DN, Hidayat SH, Nurhayati E. 2014. Identifikasi penyebab penyakit daun keriting kuning pada tanaman mentimun. Jurnal Hama Penyakit Tanaman Tropika 14(1):80-86. Palestinan Authority. American Phytopathological Society 94(5): 640. Syller J. 2012. Facilitative and antagonistic interaction between plant viruses in
mix infection. Molecular Plant Pathology 13(2):204-216.
Taufik M, Hidayat SH, Suastika G, Sumaraw S, Sujiprihati S. 2005. Kajian plant growth promoting rhizobacteria sebagai agens proteksi Cucumber mosaic virus dan Chili veinal mottle virus pada cabai. Hayati 12(4):139-144.
18
Wakman W, Kontong MS, Paersley DM. 2002. Watermelon mosaic virus of pumpkin (Cucurbita maxima) from Sulawesi: identification, transmission, and host range. Indonesian Journal of Agricultural Science 3(1):33-36. Zitter TA, Hopkins DL, Thomas CE. 1996. Compendium of Cucurbits Disease. St
RIWAYAT HIDUP
Penulis dilahirkan di Jaharun B, Kecamatan Galang, Kabupaten Deli Serdang, Sumatera Utara pada tanggal 4 Juni 1993 dari pasangan Sutimin dan Sutiani dan merupakan anak kedua dari empat bersaudara.
Penulis menyelesaikan pendidikan menengah Atas di SMA Negeri 1 Tembilahan Hulu pada tahun 2011. Pada tahun 2011 penulis diterima sebagai mahasiswa program studi mayor Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
Selama mengikuti perkuliahan, penulis aktif sebagai anggota divisi keprofesian dalam Himpunan Profesi Proteksi Tanaman (Himpro). Penulis juga aktif sebagai panitia di beberapa kegiatan kampus seperti Masa Pengenalan Fakultas (MPF), IPB Social and Health care (I-Share), dan National Plant Protection Event (NPV).
Selama masa studi penulis merupakan asisten praktikum mata kuliah Pengantar Virologi tahun 2012 dan 2013, Ilmu Penyakit Tumbuhan Dasar tahun 2014 dan 2015 dan Dasar-dasar Proteksi Tanaman tahun 2015 dan 2016. Tahun 2015 penulis mengikuti Program Kreativitas Mahasiswa (PKM) dengan judul
“Ekstrak Tanaman Kendalikan Virus” yang danai oleh Diretorat Pendidikan
21
Lampiran 1 Hasil Dot blot immunobinding assay Kabupaten Bogor
Nomer
22
Lampiran 2 Hasil Dot blot immunobinding assay Kabupaten Karawang
Nomer
23
Lampiran 3 Hasil Dot blot immunobinding assay Kabupaten Subang
Nomer