KETAHANAN KLON KENTANG LIAR (
Solanum chacoense)
TERHADAP PENYAKIT LAYU BAKTERI
(
Ralstonia solanacearum
) SECARA
IN VITRO
DAN DI LAPANGAN
AI ELY YULIATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRACT
AI ELY YULIATI. In vitro and field resistances of wild potato Solanum chacoense clones to the bacterial wilt disease (Ralstonia solanacearum). Under direction of G.A. Wattimena, M. Machmud, and Nurhajati A. Mattjik.
Potato is one of the world most important crops after rice, wheat, and maize. One of the major constraints to potato production is yield losses due to bacterial wilt (Ralstonia solanacearum). Planting resistant potato cultivars is an effective measure to control the disease, but resistant potato cultivars are lacking. Genetic resistance to bacterial wilt were found in wild potato species, such as Solanum chacoense.
A research was carried out from January to September 2007 with objectives: (1) to find clones of wild potato Solanum chacoense that are resistant to the bacterial wilt, both in vitro and in the field; (2) to obtain an effective inoculation in vitro technique for evaluation of resistance to the disease, and (3) to identify an in vitro technique that give comparable results to that from the field trial.
The research activities consisted of an in vitro trial and a field trial. Nineteen S. chacoense clones were evaluated for their resistance to bacterial wilt, and one susceptible potato cultivar Atlantic was used as a susceptible check. In the in vitro trial, two inoculation techniques were evaluated, i. e., the flooding and the leaf clipping techniques. The trial was arranged in a Factorial Experiment using a Completely Randomized Design with three replications. In the field trial, which was carried out in Pasir Sarongge, Cianjur, West Java (+1100 m above sea level), a Randomized Block Design with five replications was used to evaluate resistances of the potato clones. The trial was carried out in a homogenous heavily infested soil.
Results of the trials showed that resistances of the 19 S. chacoense clones varied. These were indicated by the incubation period and incidence of the disease of each clones. Two of the clones (Pi230580 no. 01 and 03) were resistant to the disease both in vitro and in the field. Another clone (Pi230580 no. 04) was found resistant to the disease in the evaluation using the flooding technique. Among the clones in the field trial, four clones were moderately resistant, 6 clones were moderately susceptible, and 7 clones were susceptible. Both the flooding and leaf clipping techniques were effective for in vitro evaluation of the potato clones for resistance to the bacterial wilt, and the results was comparable to that from the field trial. The leaf clipping technique is preferably chosen for the in vitro evaluation of potato clones for resistance to bacterial wilt, since it showed results comparable to that of the field trial. Besides, comparing to the flooding technique, the leaf clipping technique was more effective in inoculum spreading and more efficient in time and number of inoculum used.
RINGKASAN
AI ELY YULIATI. Ketahanan Klon Kentang Liar (Solanum chacoense) terhadap Penyakit Layu Bakteri (Ralstonia solanacearum) secara In Vitro dan di Lapangan. Dibimbing oleh G.A. Wattimena, M. Machmud, dan Nurhajati A. Mattjik.
Kentang merupakan tanaman pangan utama dunia setelah padi, terigu, dan jagung. Luas pertanaman kentang di Indonesia pada tahun 2005 adalah 55.110 ha dengan produktivitas rata-rata 16,39 ton/ha. Produktivitas ini masih tergolong rendah dibandingkan dengan potensinya yang dapat mencapai 30 ton/ha. Rendahnya produktivitas ini antara lain disebabkan oleh sulitnya memperoleh bibit kentang bermutu, keterbatasan lokasi tanam yang sesuai serta gangguan hama dan penyakit. Diantara penyakit yang banyak ditemukan pada pertanaman kentang di Indonesia adalah penyakit layu bakteri yang disebabkan oleh Ralstonia solanacearum merupakan salah satu penyakit utama tanaman kentang. Penyakit ini dapat menurunkan hasil kentang hingga 80%. Sejak dilaporkan pertama kali oleh Smithpada tahun 1896, penyakit layu bakteri masih menjadi kendala utama produksi kentang di dunia.
Salah satu komponen pengendalian terpadu penyakit layu bakteri yang efektif adalah menanam varietas kentang yang tahan serta berproduksi dan berkualitas sesuai dengan kebutuhan konsumen. Namun, sampai saat ini di Indonesia belum tersedia klon kentang yang mempunyai ketahanan tinggi terhadap penyakit layu bakteri. Oleh karena itu, upaya menemukan klon yang tahan terhadap penyakit layu bakteri perlu mendapatkan prioritas dalam pengembangan budidaya kentang.
Beberapa spesies kentang liar dilaporkan tahan terhadap penyakit layu bakteri dan telah digunakan sebagai sumber gen ketahanan, di antaranya adalah Solanum chacoense. Klon S. chacoense telah diperbanyak secara klonal dari eksplan kecambah biji secara in vitro dan dikoleksi di Laboratorium Biomolekuler dan Seluler, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Institut Pertanian Bogor, Bogor. Klon-klon ini belum dan perlu dikonfirmasi ketahanannya terhadap penyakit layu bakteri. Klon yang tahan diharapkan dapat dijadikan kultivar baru atau sebagai sumber gen ketahanan dalam pemuliaan tanaman kentang. Sementara itu kultivar Atlantic, yang diperbanyak dengan umbi, dikenal sebagai kultivar yang rentan terhadap penyakit layu bakteri tetapi banyak dibudidayakan oleh petani. Pengujian ketahanan terhadap penyakit layu bakteri yang telah dilakukan kebanyakan dilaksanakan di lapangan, sehingga memerlukan waktu yang lama, biaya yang cukup besar dan hasil yang seringkali beragam. Akhir-akhir ini metode evaluasi ketahanan terhadap penyakit layu bakteri mulai dilakukan secara in vitro, karena memiliki beberapa kelebihan, di antaranya biaya relatif murah, jumlah materi yang diuji dapat banyak, waktu lebih cepat.
klon kentang liar S. chacoense diuji ketahanannya terhadap penyakit layu bakteri. Kultivar kentang Atlantic yang rentan terhadap penyakit layu bakteri digunakan sebagai pembanding rentan.
Pada percobaan in vitro, 120 botol kultur yang berisi media Murashige-Skoog digunakan sebagai media tumbuh; pada setiap botol ditumbuhkan 10 tanaman (planlet). Inokulum R. solanacearum disiapkan berbentuk suspensi bakteri dalam air steril yang dibuat dari kultur bakteri berumur 48 jam pada medium Sukrose Peptone Agar dan kerapatan inokulum ditetapkan 9x108 sel/ml berdasarkan larutan McFarland no. 3. Pada percobaan ini digunakan dua metode inokulasi, yaitu metode gunting pucuk dan metode siram. Inokulasi dilakukan pada tanaman umur 30 hari. Pada metode gunting pucuk, inokulasi dilakukan dengan cara mencelupkan gunting inokulasi ke dalam suspensi inokulum bakteri setiap kali akan menggunting pucuk tanaman. Sedangkan pada metode inokulasi siram, digunakan 1,0 ml inokulum per botol kultur, kemudian disiramkan pada perakaran tanaman. Percobaan faktorial dalam penelitian ini menggunakan Rancangan Acak Lengkap dengan tiga ulangan. Faktor pertama adalah 19 klon kentang liar S. chacoense yang terdiri atas 11 nomor (Pi175415) dan 8 nomor (Pi230580), serta satu kultivar Atlantic sebagai pembanding rentan. Faktor kedua adalah metode inokulasi yang terdiri atas dua metode yaitu metode gunting pucuk dan metode siram. Peubah yang diamati adalah periode inkubasi (hari) dan kejadian penyakit (%). Periode inkubasi diamati mulai dari 1 hari setelah inokulasi sampai timbul gejala awal layu bakteri. Kejadian penyakit diamati dengan menghitung persentase jumlah tanaman yang bergejala penyakit dilakukan setiap hari mulai saat tanaman berumur satu hari sampai 21 hari setelah inokulasi..
Percobaan lapangan dilakukan di Kebun Percobaan IPB, Pasir Sarongge, Cianjur, pada lahan yang terdiri dari lima blok yang telah diinfestasikan bakteri R. solanacearum secara merata dengan populasi 8.5 x 105 sel/ml. Selanjutnya, lahan percobaan ditanami dengan 19 klon kentang yang diuji dan satu kultivar Atlantic sebagai pembanding rentan. Pada setiap blok dibuat 20 petakan, masing-masing berukuran 3 m x 0.5 m. Pada setiap petakan dibuat 10 lubang tanam dengan jarak antar lubang adalah 30 cm. Jarak antar lubang dari petakan yang berbeda adalah 50 cm. Setiap petakan diberi 3 kg pupuk kandang. Percobaan ini menggunakan 1000 tanaman uji. Penempatan tanaman dari klon yang berbeda pada masing-masing petakan dalam satu blok dilakukan secara acak. Setiap petakan ditanami 10 tanaman dari klon yang sama. Dengan demikian pada setiap blok terdapat 19 klon dan satu kultivar yang berbeda.
Hasil percobaan in vitro menunjukkan bahwa reaksi ketahanan klon-klon S. chacoense terhadap penyakit layu bakteri, baik yang diinokulasi dengan menggunakan metode gunting pucuk maupun dengan metode siram, beragam mulai dari rentan hingga tahan. Pada pengujian dengan metode gunting pucuk diperoleh dua klon yang tahan (Pi230580 no. 03 dan 01), sedangkan pada pengujian dengan metode siram diperoleh tiga klon tahan (Pi230580 no. 03, 01, dan 04). Periode inkubasi dan kejadian penyakit layu bakteri pada klon-klon yang diinokulasi dengan metode gunting pucuk dan metode siram juga beragam. Untuk metode inokulasi gunting pucuk periode inkubasi mulai dari 2.3 – 9.0 hari setelah inokulasi, dengan kejadian penyakit antara 17 – 100%. Sementara itu, pada metode inokulasi siram periode inkubasi mulai dari 6.0 – 11.7 hari setelah inokulasi, dengan kejadian penyakit antara 10 – 90%.
metode gunting pucuk adalah 59,1%, sedangkan rata-rata kejadian penyakit pada klon-klon yang diinokulasi dengan metode siram adalah 49.1% atau 10% lebih rendah. Pada metode siram, tanaman tidak dilukai seperti pada metode gunting pucuk, sehingga patogen memerlukan waktu lebih lama untuk masuk ke dalam tanaman, karena bakteri hanya dapat masuk melalui luka atau lubang alami seperti stomata dan lentisel. Pada tanaman yang diinokulasi dengan metode siram, gejala awal penyakit diawali dengan tumbuhnya koloni bakteri di sekitar pangkal tanaman, sehingga warnanya berubah menjadi kecoklatan. Selanjutnya, pada klon yang rentan, infeksi bakteri mengakibatkan daun pada bagian bawah tanaman menguning, tanaman menjadi layu, dan akhirnya mati. Pada tanaman yang diinokulasi dengan metode gunting pucuk, gejala penyakit diawali dengan munculnya warna coklat kehitaman pada bagian daun yang digunting. Pada klon yang rentan, gajala ini juga terus berkembang, sehingga seluruh daun dan batang tanaman menjadi layu, batang membusuk, dan tanaman mati.
Pada pengujian di lapangan, ketahanan klon-klon S. chacoense yang diuji juga menunjukkan reaksi ketahanan yang beragam mulai dari rentan hingga tahan. Dua klon (Pi230580 nomor 03 dan 01) bereaksi tahan, sama dengan jumlah dan nomor klon tahan pada hasil pengujian in vitro dengan metode gunting pucuk. Gejala awal penyakit layu bakteri di lapangan dimulai dari pucuk daun yang mengalami kelayuan dan berwarna hijau keabu-abuan. Selanjutnya, pada tanaman yang rentan, daun-daun tanaman yang terinfeksi berubah warna menjadi kuning sampai kecoklatan, layu, mengering, dan akhirnya tanaman mati. Kejadian penyakit layu bakteri pada klon-klon kentang yang diuji juga beragam antara 18 - 98%. Kejadian penyakit ini berpengaruh terhadap jumlah dan bobot umbi kentang yang dihasilkan, semakin tinggi kejadian penyakit, semakin rendah jumlah dan bobot umbi per petak, serta semakin tinggi persentase umbi yang terinfeksi R. solanacearum. Umbi yang terinfeksi dapat menunjukkan gejala busuk atau tidak bergejala (infeksi laten).
Perbandingan hasil uji ketahanan klon kentang secara in vitro baik menggunakan metode inokulasi gunting pucuk maupun dengan metode siram dengan uji ketahanan di lapangan menunjukkan korelasi positif yang kuat. Hal ini menunjukkan bahwa hasil uji dengan menggunakan kedua metode inokulasi tersebut mendekati kesetaraan (setara) dengan hasil uji di lapangan. Dengan kata lain, pengujian ketahanan klon kentang secara in vitro dengan menggunakan metode inokulasi gunting pucuk dan metode siram dapat mewakili pengujian ketahanan di lapangan. Namun demikian, hasil uji menggunakan metode gunting pucuk menunjukkan koefisien korelasi (r) = 0.9114 yang relatif lebih tinggi daripada hasil pada metode siram dengan koefisien korelasi (r) = 0.8979. Hal ini menunjukkan bahwa hasil uji dengan metode gunting pucuk lebih mendekati kesetaraan dengan hasil uji di lapangan. Metode uji ketahanan in vitro dengan metode gunting pucuk lebih disukai, karena metode ini lebih efektif dan efisien, efektif dalam hal hasil inokulasi dan efisien dalam hal waktu dan jumlah inokulum yang dibutuhkan.
KETAHANAN KLON KENTANG LIAR
(Solanum chacoense)
TERHADAP PENYAKIT LAYU BAKTERI
(
Ralstonia solanacearum
) SECARA
IN VITRO
DAN DI LAPANGAN
AI ELY YULIATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Ketahanan Klon Kentang Liar (Solanum chacoense) Terhadap Penyakit Layu Bakteri (Ralstonia solanacearum) Secara In Vitro dan di Lapangan
Nama : Ai Ely Yuliati NIM : A151060121
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. G.A. Wattimena, M.Sc. Ketua
Dr. Ir. M. Machmud, M.Sc., APU Prof. Dr. Ir. Nurhajati A. Mattjik, M.S. Anggota Anggota
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Munif Ghulamahdi, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Tesis ini, berjudul “Ketahanan Klon Kentang Liar (Solanum chacoense)
Terhadap Penyakit Layu Bakteri (Ralstonia solanacearum) Secara In vitro dan di
Lapangan” merupakan salah satu syarat untuk memperoleh gelar Magister Sains
pada Program Studi Agronomi, Sekolah Pascasarjana, Institut Pertanian Bogor.
Kegiatan penelitian dilaksanakan di Laboratorium Biomolekuler dan Seluler,
Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Institut Pertanian Bogor,
di Laboratorium Fitopatologi, Balai Besar Penelitian Bioteknologi dan
Sumberdaya Genetik Pertanian, Bogor dan di Kebun Percobaan IPB, Pasir
Sarongge, Kabupaten Cianjur, Jawa Barat.
Pada kesempatan ini penulis mengucapkan terima kasih kepada: Prof. Dr.
Ir. G.A.Wattimena, M.Sc., selaku Ketua Komisi Pembimbing, Dr. Ir. Muhammad
Machmud, M.Sc., APU, dan Prof. Dr. Ir. Nurhajati A. Mattjik, MS.,
masing-masing sebagai Anggota Komisi Pembimbing, atas segala bimbingan, nasehat
serta saran, sehingga penulis dapat menyelesaikan tesis ini. Penulis juga
mengucapkan terima kasih kepada semua pihak yang telah membantu penulis
dalam melakukan penelitian, baik di laboratorium maupun di lapangan, serta
teman sejawat yang telah banyak memberikan saran dalam penyelesaian tesis
ini. Dukungan dan pengertian dari suami dan anak-anak tercinta merupakan
modal utama dalam membangun semangat belajar selama penyelesaian studi
pascasarjana ini.
Semoga karya kecil ini bermanfaat dalam menunjang usaha peningkatan
penyediaan pangan bagi umat manusia.
Bogor, Desember 2007
RIWAYAT HIDUP
Penulis dilahirkan di Cianjur pada tanggal 18 Februari 1969 dari ayah T.M.
Sumantri dan ibu Djuarsih. Penulis merupakan putri kedua dari empat
bersaudara.
Tahun 1988, penulis lulus dari Sekolah Pembangunan Pertanian, Cianjur.
Pada tahun 1989 penulis melanjutkan pendidikan pada Jurusan Budidaya
Pertanian, Fakultas Pertanian, Universitas Djuanda, Bogor. Penulis memperoleh
gelar Sarjana Pertanian pada tahun 1994.
Pada tahun 1994 penulis menikah dan dikarunia dua orang putri Nyayu
Azliani dan Nyayu Azlisani.
Pada tahun 2006 penulis mulai mengikuti pendidikan Pascasarjana pada
Program Studi Agronomi, Institut Pertanian Bogor, dengan biaya sendiri. Penulis
mendapatkan gelar Magister Sains dalam bidang Agronomi dari Institut Pertanian
DAFTAR TABEL
Halaman
1 Ciri-ciri isolat R. solanacearum dalam Biovar berdasarkan kemampuannya menggunakan senyawa karbohidrat (He et al., 1983) ……….………..
7
2 Kesamaan dan perbedaan ketahanan terhadap hama dan penyakit antara klon S. chacoense Pi230580 dan S. chacoense Pi175415 ………….………...………....……….
10
3 Jumlah sel bakteri menurut skala Mc Farland (Klement et al., 1990) ……….……
17
4 Tingkat ketahanan klon kentang terhadap R. solanacearum (Valdez, 1985) ………..…..………..…..
19
5 Periode inkubasi penyakit layu bakteri dari 19 klon S. chacoense dan kultivar Atlantic pada percobaan in vitro dengan menggunakan metode inokulasi gunting dan siram ………..……..
26
6 Kejadian penyakit layu bakteri pada 19 klon S. chacoense dan kultivar Atlantic pada percobaan in vitro dengan menggunakan metode inokulasi gunting dan siram ………
28
7 Periode inkubasi penyakit layu bakteri dari 19 klon S. chacoense dan kultivar Atlantic pada percobaan di lapangan.. ………..……….
31
8 Kejadian penyakit layu bakteri dari 19 klon S. chacoense dan kultivar Atlantic pada percobaan di lapangan.………
33
9 Jumlah, bobot, dan umbi terinfeksi per petak pada berbagai tingkat ketahanan dari 19 klon S. chacoense dan kultivar Atlantic pada pengujian di lapangan ………...……….………
DAFTAR GAMBAR
Halaman
1 Tanaman kentang mati dan potongan batang kentang di dalam tabung reaksi yang diambil dari Kebun Percobaan IPB, Pasir Sarongge, Cianjur ..………..……….
14
2 Sel bakteri R. solanacearum berbentuk batang dengan ukuran bervariasi ………..………..
15
3 Koloni bakteri R. solanacearum virulen yang ditumbuhkan pada media TZC (Triphenyltetrazolium Chloride) ……….
15
4 Koloni bakteri R. solanacearum avirulen yang ditumbuhkan pada media TZC (Triphenyltetrazolium Chloride) ………
16
5 Eksplan yang ditumbuhkan pada media MS dan diregenerasi menjadi planlet ...
20
6 Planlet yang ditumbuhkan pada media arang sekam ... 21
7 Stek mini berumur satu minggu di rumah kasa Kebun Percobaan IPB, Pasir Sarongge, Cianjur ………..
22
8 Stek mini berumur tiga minggu yang siap dipindahkan ke lapangan di Kebun Percobaan IPB, Pasir Sarongge, Cianjur ...
22
9 Contoh tanaman uji berumur 14 hari setelah inokulasi pada percobaan in vitro .……….………..…..…..
27
10 Hubungan antara periode inkubasi dan kejadian penyakit layu bakteri dari 19 klon S. chacoense dan kultivar Atlantic dengan metode inokulasi gunting ……….
29
11 Hubungan antara periode inkubasi dan kejadian penyakit layu bakteri dari 19 klon S. chacoense dan kultivar Atlantic dengan metode inokulasi siram ….………..………..…..
30
12 Contoh tanaman uji yang bergejala penyakit layu bakteri berumur 10 minggu di lapangan .……….………..
31
13 Contoh potongan batang tanaman kentang yang sakit di dalam tabung reaksi yang mengeluarkan aliran massa bakteri seperti asap ……….
32
14 Hubungan antara periode inkubasi dan kejadian penyakit layu bakteri dari 19 klon S. chacoense dan kultivar Atlantic pada percobaan di lapangan ………….………
34
15 Hubungan antara kejadian penyakit dari 19 klon S. chacoense dan kultivar Atlantic secara in vitro dengan metode gunting dan di lapangan ...
35
dankultivar Atlantic secara in vitro dengan metode siram dan di lapangan ………...
17 Tanaman S. chacoense berumur 8 minggu dengan daun berbentuk eliptik dan tepi tak bergelombang, di Kebun Percobaan IPB, Pasir Sarongge, Cianjur ………..
37
18 Tanaman S. chacoense berumur 8 minggu dengan bunga berwarna putih dan anther berwarna kuning, di Kebun Percobaan IPB, Pasir Sarongge, Cianjur ………..
38
19 Hubungan antara kejadian penyakit layu bakteri dan jumlah umbi per petak dari 19 klon S. chacoense pada percobaan di lapangan ..……….…..…
40
20 Hubungan antara kejadian penyakit layu bakteri dan bobot umbi per petak dari 19 klon S. chacoense pada percobaan di lapangan ……….………
40
21 Hubungan antara kejadian penyakit layu bakteri dan umbi terinfeksi dari 19 klon S. chacoense pada percobaan di lapangan ………..……….……….
41
22 Contoh umbi klon S. chacoense yang ukurannya lebih kecil dari umbi kultivar Atlantic ………..
42
23 Contoh umbi klon S. chacoense yang terinfeksi penyakit layu bakteri dan umbi sehat …..…………..……….…..
DAFTAR LAMPIRAN
Halaman
1 Komposisi Media Murashige dan Skoog …………..………… 56
2 Komposisi Media Sukrose Pepton Agar (SPA) ……… 56
3 Komposisi Media Triphenyltetrazolium Chloride (TZC)…….. 56
4 Denah lahan percobaan di Kebun Percobaan IPB Pasir Sarongge. ……….
57
5 Daftar sidik ragam periode inkubasi dari 19 klon S. chacoense dankultivar Atlantic pada percobaan in vitro……
58
6 Daftar sidik ragam kejadian penyakit dari 19 klon S. chacoense dankultivar Atlantic pada percobaan in vitro …..
58
7 Daftar sidik ragam periode inkubasi dari 19 klon S. chacoense dan kultivar Atlantic pada percobaan di lapangan ……….
58
8 Daftar sidik ragam kejadian penyakit dari 19 klon S. chacoense dan kultivar Atlantic pada percobaan di lapangan ……….
58
9 Morfologi Tanaman Kentang Koln S. chacoense dan kultivar Atlantic ...
PENDAHULUAN
Latar Belakang
Kentang merupakan tanaman pangan utama dunia setelah padi, gandum,
dan jagung. Kentang mampu memenuhi kebutuhan pangan dan kecukupan gizi
masyarakat karena umbi kentang mengandung protein, vitamin B dan vitamin C,
serta mineral, fosfor, magnesium dan kalium (International Potato Center, 1984).
Kentang merupakan salah satu komoditi sayuran yang cukup penting dan
mendapat prioritas untuk dikembangkan selain beberapa tanaman seperti
bawang merah, bawang putih, kacang panjang, tomat dan cabai (Asian
Vegetable Research and Development Centre, 1991). Wattimena (1992)
menyatakan bahwa kentang adalah komoditi penting bagi Indonesia karena
merupakan: (1) tanaman yang menjadi sumber uang bagi petani (cash crop), (2)
komoditas ekspor non migas yang menghasilkan devisa bagi negara, (3) salah
satu makanan siap saji (fast food) yang banyak digemari masyarakat perkotaan
dan (4) makanan bernilai gizi tinggi dan lengkap yang dapat digunakan sebagai
pangan alternatif disamping beras.
Kebutuhan akan kentang dari tahun ke tahun cenderung meningkat sejalan
dengan bertambahnya jumlah penduduk dan perubahan pola konsumsi
masyarakat. Kahar (1996) menyatakan bahwa pesatnya peningkatan kebutuhan
kentang dipicu oleh semakin meningkatnya industri-industri makanan kecil,
misalnya keripik kentang (potato chips).
Salah satu kendala yang dihadapi Indonesia adalah produktivitas
kentangnya masih rendah dibandingkan dengan negara penghasil kentang
lainnya, yaitu rata-rata 16,39 ton/ha, meskipun menurut hasil penelitian potensi
produksinya bisa mencapai 30 ton/ha (Badan Pusat Statistik, 2005). Sementara
negara lain seperti Amerika Serikat produktivitas kentangnya sekitar 38 ton/ha,
Selandia Baru 35 ton/ha, Jepang 33 ton/ha dan Belanda 37 ton/ha.
Rendahnya produktivitas ini antara lain disebabkan oleh sulitnya
memperoleh bibit kentang bermutu, keterbatasan lokasi pertanaman yang sesuai
serta gangguan hama dan penyakit. Salah satu penyakit yang banyak
ditemukan pada pertanaman kentang di Indonesia adalah penyakit layu bakteri
dilaporkan pertama kali oleh Smithpada tahun 1896, penyakit layu bakteri masih
menjadi kendala utama produksi kentang di dunia (Sequeira 1992).
Di Indonesia penyakit layu bakteri terutama dijumpai di seluruh sentra
produksi kentang di Pulau Jawa, dapat menyebabkan kematian tanaman
kentang 10 - 30%, bahkan dapat menurunkan hasil lebih dari 50% (Hutagalung,
1985). Menurut Wattimena, (1994) penyakit ini dapat menurunkan hasil kentang
hingga 80%. Kematian awal dan penurunan hasil panen kentang yang
disebabkan oleh R. solanacearum, dipandang dari segi ekonomi sangat
merugikan dan dapat menyebabkan penurunan pendapatan petani.
Salah satu komponen pengendalian terpadu penyakit layu bakteri yang
efektif adalah menanam varietas kentang yang tahan serta berproduksi dan
berkualitas sesuai dengan kebutuhan konsumen. Namun, sampai saat ini di
Indonesia belum tersedia klon kentang yang mempunyai ketahanan tinggi
terhadap penyakit layu bakteri (Sahat & Sulaeman, 1990). Dalam
pengembangan budidaya kentang, upaya menemukan klon yang tahan terhadap
penyakit layu bakteri perlu mendapatkan prioritas.
Beberapa spesies kentang liar dilaporkan tahan terhadap penyakit layu
bakteri dan telah digunakan sebagai sumber gen ketahanan, di antaranya adalah
Solanum chacoense (International Potato Center, 1984). Berdasarkan tingkat
ploidinya klon S. chacoense ini termasuk spesies diploid (2n=2x=24). Klon S.
chacoense telah dikembangkan dan dikoleksi secara in vitro dalam bentuk biji di
Laboratorium Biomolekuler dan Seluler, Pusat Penelitian Bioteknologi Institut
Pertanian Bogor (IPB), Bogor. Klon-klon ini belum dan perlu dikonfirmasi
ketahanannya terhadap penyakit layu bakteri. Klon yang tahan diharapkan dapat
dijadikan kultivar baru atau sebagai sumber gen ketahanan dalam pemuliaan
kentang.
Pengujian ketahanan penyakit layu bakteri yang telah dilakukan
kebanyakan dilaksanakan di lapangan, sehingga memerlukan waktu lama, biaya
yang cukup besar dan hasil yang seringkali beragam. Akhir-akhir ini metode
evaluasi ketahanan penyakit mulai dilakukan secara in vitro, karena memiliki
beberapa kelebihan, di antaranya biaya relatif murah, jumlah materi yang diuji
Tujuan Penelitian
Penelitian ini bertujuan untuk :
(1) Mendapatkan metode inokulasi yang efektif dan efisien secara in vitro
(2) Mendapatkan klon kentang yang tahan terhadap penyakit layu bakteri dari
19 klon kentang liar S. chacoense
(3) Mencari metode percobaan ketahanan klon kentang terhadap penyakit layu
bakteri secara in vitro yang hasilnya setara dengan hasil pada percobaan di
lapangan
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah :
(1) Metode inokulasi gunting lebih efektif dan efisien daripada metode inokulasi
siram dalam menginfeksi tanaman kentang pada percobaan in vitro
(2) Dari 19 klon kentang S. chacoense yang diseleksi akan ditemukan satu
atau beberapa klon yang tahan terhadap penyakit layu bakteri (R.
solanacearum)
(3) Hasil pengujian ketahanan klon kentang terhadap penyakit layu bakteri
TINJAUAN PUSTAKA
Botani Tanaman Kentang
Kentang berasal dari dataran tinggi Andean, Amerika Selatan. Pada tahun
1794 kentang telah dibudidayakan di sekitar Cisarua, Bandung. Baru pada tahun
1811, kentang tersebar luas di Indonesia, terutama di daerah-daerah
pegunungan di Aceh, Tanah Karo, Padang, Bengkulu, Sumatera Selatan,
Minahasa, Bali dan Flores. Di Jawa, kentang banyak terdapat di daerah
Pengalengan, Lembang dan Pacet (Jawa Barat), Wonosobo dan Tawangmangu
(Jawa Tengah), Batu, Dieng dan Tengger (Jawa Timur). Kentang yang
dibudidayakan terdiri dari beberapa spesies yang meliputi kurang lebih 150
spesies yang berumbi. Tanaman tersebut termasuk famili Solanaceae, genus
Solanum, subgenus Pachystemonum, seksi Tuberarium, subseksi
Hyperbasarthrum (Hooker, 1990; Permadi, 1989).
Kentang merupakan tanaman herba semusim dengan tipe biji berkeping
dua. Tinggi tanaman dapat mencapai 0.3 - 1 meter, batangnya agak lunak,
berbulu dan bercabang, akarnya merupakan akar adventif. Pada awal
pertumbuhannya batang tanaman kentang tegak, kemudian menyebar dan rebah
di atas tanah. Bentuk batang bulat sampai persegi tiga atau empat dengan warna
hijau kemerah-merahan atau keungu-unguan. Sedangkan daun berwarna hijau,
berbentuk delta sampai lonjong, berpasangan di sebelah kiri dan kanan tangkai
membentuk rangkaian yang berakhir dengan daun tunggal pada ujungnya
(Ashari, 1995).
Bunga kentang mempunyai dua jenis kelamin (bunga sempurna).
Mahkotanya berwarna putih, merah, ungu atau biru tergantung varietasnya dan
berbentuk terompet yang ujungnya seperti bintang (Smith, 1977). Terdapat lima
benang sari yang berwarna kuning melingkari tangkai putiknya, bersifat protogeni
yakni putiknya lebih cepat masak daripada tepung sarinya, hal ini menyebabkan
terjadinya penyerbukan silang dan tidak memiliki kelenjar madu.
Buah kentang berwarna hijau tua sampai keunguan, berbentuk bulat dan
berongga dua, dengan biji berwarna krem dan berukuran kecil (0.5 mm). Pada
bagian batang yang terletak di bawah permukaan tanah terdapat daun-daun kecil
seperti sisik. Pada ketiak daun ini terdapat tunas ketiak yang tumbuh menjulur
sebagai pembesaran bagian ujung stolon dan berfungsi sebagai tempat
cadangan makanan. Umbi tersebut memiliki banyak mata tunas. Bentuk umbi
bulat, lonjong dan berkulit tipis. Warna umbi putih, merah agak ungu dan kuning
sesuai varietasnya dan umumnya umbi dipakai sebagai bahan perbanyakan
tanaman (Soewito, 1991).
Penyakit Layu Bakteri
Penyakit layu bakteri yang disebabkan oleh Ralstonia solanacearum,
dilaporkan pertama kali oleh E.F. Smith pada tahun 1896 (Kelman et al., 1994).
Bakteri ini sebelumnya dikenal dengan nama Bacillus solanacearum E.F. Smith,
Bacterium solanacearum Chester, Bacillus nicotianae Uyeda, Bacillus musae
Rorer, Bacillus musarum Zeman, Phytomonas solanacearum E.F. Smith, Erwinia
nicotiana Uyeda atau Xanthomonas solanacearum E.F. Smith dan Pseudomonas
solanacearum E.F. Smith (Kelman, 1953; Mehan et al., 1994). Yabuuchi et al.,
(1995) kemudian merevisi nama bakteri tersebut menjadi Ralstonia
solanacearum.
Layu bakteri merupakan penyakit penting pada famili Solanaceae terutama
pada tanaman kentang, tomat, terung, lada, jahe, cabai, kacang tanah, pisang
dan tembakau. Bakteri ini merupakan penyebab penyakit yang mempunyai
sebaran yang luas di daerah tropis dan sub-tropis (Asandhi, 1996).
Ciri-ciri R. solanacearum
Bakteri R. solanacearum mempunyai ciri-ciri berbentuk batang, bersifat
gram negatif, dan tidak membentuk spora. Ukuran sel bakteri ini bervariasi
sekitar (0.5 - 1.0) x (1.5 - 4.0) m, tergantung pada kondisi pertumbuhan.
Bentuk koloni bakteri bervariasi dari tidak tembus cahaya sampai bintik-bintik
kecil. Dalam media padat, koloni bakteri berwarna coklat keruh, tidak beraturan,
halus, bercahaya, kebasah-basahan dan berdiameter 3 - 5 m (Kelman, 1953).
Pada media biakan, R. solanacearum cenderung membentuk koloni tidak
virulen atau tingkat virulensinya rendah. Koloni yang virulen dan tidak virulen
dapat dideteksi dengan menumbuhkan isolat bakteri pada medium
Triphenyltetrazolium Chloride (TZC). Koloni bakteri virulen berwarna putih
sedangkan yang tidak virulen koloni bakterinya berbentuk bulat kecil dengan
pusat berwarna merah tua. Pada media cair, bakteri virulen biasanya tidak
bergerak, sedangkan bakteri yang tidak virulen aktif bergerak (Hooker, 1983;
1990).
Klasifikasi R. solanacearum dibagi dalam dua sistem, yaitu sistem Ras dan
sistem Biovar. Sistem pengelompokan Ras didasarkan pada perbedaan kisaran
tanaman inang dari patogen pada kondisi di lapangan (Hayward, 1964 dan 1986;
He et al., 1983; Martin dan French, 1996). Berdasarkan sistem Ras, R.
solanacearum dikelompokkan menjadi lima Ras, yaitu: Ras 1, mempunyai
kisaran tanaman inang yang sangat luas, menyerang kentang, tomat, cabai,
tembakau, kacang tanah dan gulma, terjadi terutama di daerah dataran rendah
tropis dan sub tropis dan termasuk Biovar 1, 3 dan 4; Ras 2, menyerang
tanaman famili Musaceae, contoh pisang dan Heliconia spp., yang pada awalnya
terbatas ditemukan di daerah tropis Amerika, namun saat ini telah menyebar ke
Asia, dan termasuk Biovar 1 dan 3; Ras 3, terutama menyerang tanaman
kentang dan tomat di daerah dataran tinggi, dan termasuk Biovar 2; Ras 4,
menyerang tanaman jahe, ditemukan terutama di Filipina dan termasuk Biovar 3
dan 4; dan Ras 5, menyerang murbei di Cina dan termasuk Biovar 5.
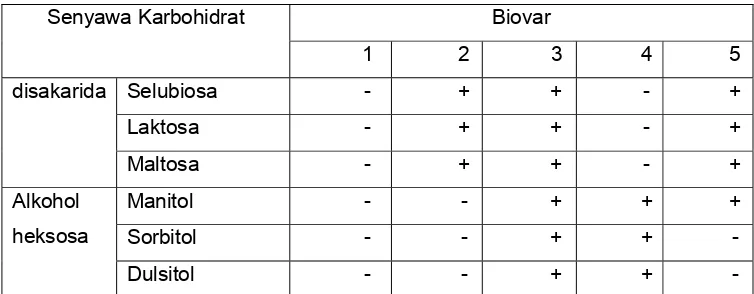
Sistem Biovar didasarkan pada karakteristik biokimia, yaitu kemampuan
bakteri menggunakan atau menghidrolisis tiga disakarida (selobiosa, laktosa dan
maltosa) dan tiga alkohol heksosa (dulsitol, mannitol dan sorbitol). Sistem ini
membedakan isolat R. Solanacearum menjadi lima Biovar (Hayward, 1964 dan
1986; He et al., 1983) (Tabel 1). Isolat Biovar 1 tidak menggunakan semua
senyawa karbohidrat. Isolat Biovar 2 menghidrolisis tiga disakarida, tetapi tidak
menghidrolisis alkhol heksosa. Isolat Biovar 3 dapat menghidrolisis semua
senyawa karbohidrat. Isolat Biovar 4 hanya menggunakan alkohol heksosa,
tetapi tidak menghidrolisis disakarida. Isolat Biovar 5 dapat menghidrolisis
semua senyawa disakarida dan alkohol heksosa manitol, tetapi tidak
menggunakan sorbitol dan dulsitol.
Hayward (1991) menyatakan bahwa biovar 1 dominan ditemukan di
Amerika Serikat, sedangkan Biovar 3 ditemukan di Asia. Biovar 2, 3 dan 4
ditemukan di Australia, Cina (bersama-sama ras 5), India, Indonesia, Papua New
Guinea dan Srilanka. Sedangkan di Filipina ditemukan Biovar 1 sampai 4.
Hubungan antara Ras dan Biovar belum banyak diketahui, namun
Dari hasil penelitian yang dilakukan oleh Machmud (1986) diketahui bahwa R.
solanacearum yang ditemukan di Indonesia adalah Ras 1 dan Ras 3, atau
berdasarkan sistem biotipe tergolong Biovar 2, 3 dan 4.
Tabel 1. Ciri-ciri Biovar R. Solanacearum yang dikelompokan berdasarkan kemampuannya menggunakan senyawa karbohidrat (Hayward, 1964 dan 1986; He et al., 1983 ; Martin dan French, 1996).
Senyawa Karbohidrat Biovar
1 2 3 4 5
disakarida Selubiosa - + + - +
Laktosa - + + - +
Maltosa - + + - +
Alkohol
heksosa
Manitol - - + + +
Sorbitol - - + + -
Dulsitol - - + + -
Keterangan : + (reaksi positif/tumbuh); - (reaksi negatif/tidak tumbuh)
Gejala Serangan
Gejala serangan penyakit layu bakteri yang disebabkan oleh R.
solanacearum dapat terlihat pada semua fase pertumbuhan tanaman kentang
(Martin dan French, 1996). Pada kebanyakan tanaman, biasanya gejala yang
ditimbulkan penyakit layu pertama kali terlihat pada tanaman yang berumur 30
hari, daun-daun menjadi layu pada salah satu atau beberapa daun saja atau
kelayuan mendadak pada seluruh tanaman. Dalam satu rumpun batang
biasanya layu semua. Daun-daun layu berwarna suram sampai pucat, dan
akhirnya berubah menjadi coklat tanpa diikuti oleh penggulungan daun.
Kelayuan yang hebat disertai robohnya batang lebih sering terjadi pada tanaman
muda dan dari varietas-varietas yang rentan.
Penyebaran Patogen
Sumber utama penyebaran bakteri R. solanacearum di lapangan adalah
umbi bibit yang terinfeksi secara laten, dan melalui tanah yang terinfestasi
akar yang satu dengan akar lainnya, alat-alat yang digunakan saat penanaman,
dan air irigasi ataupun percikan air hujan. Sedangkan penyebaran jarak jauh
dapat melalui umbi, serangga dan bahan perbanyakan vegetatif yang terinfeksi
secara laten. Hal ini dapat berlangsung dalam waktu yang relatif lama, bahkan
sampai beberapa tahun (Semangun, 1989).
Bakteri R. solanacearum umumnya masuk ke dalam tanaman melalui luka
yang terjadi pada waktu bercocok tanam atau melalui pertumbuhan akar
sekunder. Akar-akar tanaman yang luka, oleh nematoda atau luka mekanik
selama bercocok tanam atau lubang-lubang alamiah merupakan tempat
masuknya patogen ke jaringan tanaman sehingga cocok untuk kolonisasi bakteri
(Kelman, 1953).
Perkembangan penyakit layu bakteri dapat dipengaruhi oleh berbagai
faktor, diantaranya faktor lingkungan, tanaman, dan mikroorganisme tanah.
Faktor yang sangat penting peranannya dalam perkembangan bakteri adalah
suhu. Kelman (1953) mengemukakan bahwa suhu memegang peranan penting
dalam distribusi patogen. Suhu optimum untuk perkembangan bakteri layu
adalah 27 - 37oC, sedangkan pada suhu 15oC penyakit ini tidak berkembang dan kondisi tanah yang kering sangat tidak sesuai untuk perkembangan penyakit.
French (1986) melaporkan bahwa strain R. solanacearum Ras 3 Biovar 2
menyebabkan kerusakan yang berat pada tanaman kentang yang ditanam di
daerah yang suhunya lebih rendah.
Kelembaban dan suhu tanah juga dapat mempengaruhi kemampuan
bertahannya hidup bakteri. Penelitian yang dilakukan oleh Akiew (1985)
menunjukkan bahwa populasi R. solanacearum menurun tajam pada suhu tanah
yang tinggi serta kelembaban tanah yang rendah. Sebaliknya pada kelembaban
tanah yang tinggi dan suhu tanah yang rendah, bakteri tersebut menunjukkan
kemampuan bertahan hidup untuk waktu yang relatif lama di dalam tanah.
Ketahanan Tanaman Kentang Terhadap R. solanacearum
Pemuliaan ketahanan kentang terhadap layu bakteri baru dimulai sekitar
tahun 1967 di Wisconsin, USA (Schmiediche, 1984). Tahun 1972, Rowe dan
Sequeira mulai mengadakan persilangan antara beberapa klon tahan yang
berasal dari spesies diploid S. phureja dengan S. tuberosum. Pada tahun 1976
kemudian dikirimkan ke beberapa negara, diantaranya ke Peru, Fiji dan
Indonesia. Di Peru, dua klon telah menjadi varietas unggul, yaitu Caxmarca
(BR.63.74) dan Molinera (Br. 63.69), sedangkan di Fiji adalah Amapola yaitu klon
BR 69.84 (Herrera, 1977).
Pemuliaan tanaman kentang dapat dilakukan dengan cara persilangan baik
persilangan antar varietas (Atlantic X Granola) maupun persilangan antar
spesies (S. tuberosum X S. phureja). Persilangan-persilangan tersebut terutama
ditujukan untuk mencari turunan yang berproduksi dan berkualitas, serta tahan
terhadap hama dan penyakit. Juga dengan cara mendatangkan bahan-bahan
pemuliaan dari luar negeri (introduksi) berupa varietas-varietas unggul, klon-klon
hasil silangan atau berupa biji-biji hasil silangan.
Pemuliaan tanaman kentang bertujuan untuk mendapatkan varietas
unggul, yang berproduksi dan tahan terhadap penyakit. Menurut Sahat (1984),
varietas dikatakan unggul jika mempunyai daya hasil tinggi, tahan terhadap
penyakit, kualitas hasil baik, berpenampilan baik (warna, bentuk, kedalaman dan
jumlah mata) serta mempunyai daya adaptasi lingkungan yang luas.
Tanaman pada dasarnya akan memberikan reaksi tertentu terhadap setiap
faktor luar, termasuk infeksi oleh patogen. Ketahanan tanaman terhadap
patogen dapat dibedakan sebagai ketahanan horizontal dan ketahanan vertikal.
Ketahanan horizontal adalah ketahanan yang dikendalikan oleh banyak gen atau
disebut ketahanan poligenik, bersifat lemah tetapi efektif mengatasi semua ras
dari satu spesies patogen. Gen-gen yang tercakup dalam ketahanan horizontal
ini memberi pengaruh terhadap patogen dengan cara memperlambat
perkembangan infeksi patogen dan menurunkan penyebaran penyakit dan
perkembangan epidemik di lapangan.
Ketahanan vertikal adalah ketahanan yang dikendalikan oleh satu atau
beberapa gen saja atau disebut ketahanan monogenik, bersifat kuat tetapi hanya
terbatas pada ras tertentu saja. Gen-gen yang terlibat pada ketahanan vertikal
dapat menyebabkan interaksi inang dan patogen tidak cocok, sehingga patogen
tidak dapat bertahan dan memperbanyak diri dalam tanaman inang. Dapat
menghambat penyerangan awal patogen dan menghambat perkembangan
epidemik dengan membatasi jumlah inokulum awal.
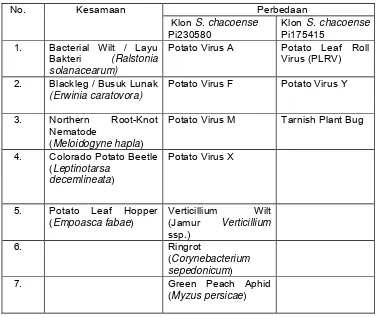
Diantara klon kentang liar, S. chacoense dilaporkan tahan terhadap
beberapa penyakit, antara lain layu bakteri (Ralstonia solanacearum), blackleg
1994). Menurut Bamberg et al. (1994), saat ini telah diketahui beberapa
kesamaan dan perbedaan ketahanan terhadap hama dan penyakit antara klon
kentang S. chacoense Pi230580 dan S. chacoense Pi175415 (Tabel 2).
Tabel 2. Kesamaan dan perbedaan ketahanan terhadap hama dan penyakit antara klon S. chacoense Pi230580 dan S. chacoense Pi175415 (Bamberg et al. 1994)
Potato Virus F Potato Virus Y
3. Northern Root-Knot
Nematode
(Meloidogyne hapla)
Potato Virus M Tarnish Plant Bug
4. Colorado Potato Beetle (Leptinotarsa
Pengujian Ketahanan secara In vitro
Pengujian ketahananan tanaman kentang terhadap penyakit layu bakteri
secara in vitro merupakan metode pengujian yang mudah dilakukan. Kelebihan
dari cara pengujian ini antara lain tidak memerlukan lahan yang luas, waktu
yang diperlukan lebih singkat dan hasil seleksi dapat diulangi di rumah kaca atau
di rumah plastik sementara patogen yang digunakan menyebar terbatas di
laboratorium. Metode ini mudah dikerjakan dan telah dipelajari pada beberapa
tanaman dalam program pemuliaan tanaman untuk mendapatkan sifat
Fock et al. (2000) melakukan seleksi secara in vitro terhadap klon-klon
kentang hasil fusi protoplas antara BF15 (2x) dengan S. Phureja (2x) untuk
mendapatkan klon yang tahan terhadap penyakit layu bakteri. Metode inokulasi
yang digunakan yaitu dengan memasukkan akar tanaman ke dalam inokulum.
Hasil penelitian menunjukan metode inokulasi yang digunakan belum efektif dan
periode inkubasinya relatif lama. Oleh karena itu, melakukan pengujian
ketahanan klon kentang terhadap penyakit layu bakteri secara in vitro masih
perlu dicoba dengan metode-metode inokulasi yang lain, sehingga didapatkan
METODE PENELITIAN
Tempat dan Waktu
Penelitian dilakukan di Laboratorium Biomolekuler dan Seluler, Pusat
Penelitian Sumberdaya Hayati dan Bioteknologi, Institut Pertanian Bogor, di
Laboratorium Fitopatologi, Balai Besar Penelitian Bioteknologi dan Sumberdaya
Genetik Pertanian, Bogor, dan di Kebun Percobaan IPB, Pasir Sarongge,
Kabupaten Cianjur, Jawa Barat. Pelaksanaan penelitian dilakukan mulai bulan
Januari sampai dengan bulan September 2007.
Bahan dan Alat
Bahan uji yang digunakan dalam penelitian ini adalah 19 klon kentang S.
chacoense dan satu kultivar Atlantic sebagai pembanding rentan. Bahan
tanaman tersebut merupakan koleksi dari Laboratorium Biomolekuler dan
Seluler, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Institut Pertanian
Bogor, yang diperbanyak secara klonal dari eksplan kecambah biji. Klon-klon
tersebut berasal dari dua nomor koleksi yaitu Pi175415 dan Pi230580, yang
masing-masing terdiri atas 11 klon dan 8 klon. Selain itu juga digunakan media
MS (Murashige & Skoog, 1962) (Tabel Lampiran 1), Betadine, alkohol 70%,
akuades, spirtus, isolat R. solanacearum Ras 3 Biovar 2 yang berasal dari
tanaman kentang kultivar Atlantic yang bergejala layu bakteri, yang diambil dari
Kebun Percobaan IPB, Pasir Sarongge, Kabupaten Cianjur, Jawa Barat., arang
sekam, tanah, pupuk kandang, pupuk daun Vitabloom-D, Urea, TSP, KCl,
Furadan 3G, fungisida Antracol 50 WP dan insektisida Curacron, serta tanah
yang terinfestasi R. solanacearum, yang diperoleh dengan cara menanam
terlebih dulu kentang kultivar Atlantic.
Peralatan yang digunakan untuk perbanyakan tanaman adalah laminar,
almunium foil, pinset, gunting, sarung tangan, kertas lakmus, botol, labu
erlenmeyer 1000 ml, cawan petri, pipet, dan otoclaf. Peralatan yang digunakan
untuk isolasi R. Solanacearum adalah tabung reaksi, ose, pipet 1 ml, erlenmeyer
1000 ml, cawan petri, ruang isolasi (clean bench), timbangan dan pengocok
adalah toples, bak plastik berukuran 31 cm x 23 cm x 6 cm, cangkul, gunting,
koret, gembor, ajir, alat ukur dan semprotan.
Pengujian secara In Vitro
Rancangan Percobaan
Percobaan ini dilakukan dengan menggunakan Rancangan Acak Lengkap
yang terdiri atas dua faktor dan tiga ulangan. Faktor pertama adalah 19 klon
kentang liar S. chacoense yang terdiri atas 11 klon Pi175415 dan 8 klon
Pi230580, serta satu kultivar Atlantic sebagai pembanding rentan. Faktor kedua
adalah metode inokulasi, terdiri atas dua metode, yaitu metode siram dan
metode gunting pucuk. Kombinasi dari kedua faktor tersebut menjadi 40
perlakuan. Satuan perlakuan terdiri atas satu botol kultur yang ditanami dengan
10 tanaman dari klon yang sama.
Model linier dari percobaan ini adalah: Yij = μ + τi + βj + τβij + εijk
dimana :
Yij : nilai pengamatan dari respon yang diamati
μ : nilai tengah umum respon yang diamati
τi : pengaruh klon ke-i terhadap respon yang diamati
βj : pengaruh cara inokulasi ke-j terhadap respon yang diamati
τβij : pengaruh interaksi klon dan cara inokulasi ke-ij terhadap respon
yang diamati
εijk : galat percobaan pada klon ke-i, cara inokulasi ke-j,dan ulangan ke-k
Isolasi dan Perbanyakan Bakteri R. solanacearum
Isolat R. solanacearum dengan nomor EY07(01), yang digunakan sebagai
sumber inokulum, diperoleh dari contoh tanaman kentang kultivar Atlantic yang
ditanam di Kebun Percobaan Pasir Sarongge (± 1100 m dpl), Kabupaten Cianjur,
Jawa Barat (Gambar 1, kiri). Menurut Machmud (1998)isolat R. solanacearum dari tanaman kentang yang ditanam di dataran tinggi Indonesia kebanyakan
termasuk Ras 3 Biovar 2. Batang tanaman kentang yang sakit dipotong-potong
sepanjang lebih kurang 0.5 cm dan direndam dalam larutan Na-hipoklorit selama
5 menit untuk membersihkan bagian permukaan. Kemudian potongan batang
kentang dibilas dengan akuades. Selanjutnya, potongan batang kentang
(Gambar 1, kanan). Setelah itu potongan batang kentang didiamkan selama 5 -
15 menit di dalam tabung reaksi sampai keluar eksudat bakteri. Untuk
menumbuhkan bakteri, satu lup suspensi bakteri diambil dari tabung reaksi
tersebut dengan menggunakan ose dan digores-goreskan pada 5 cawan petri
yang berisi masing-masing 15 ml media agar TZC (Triphenyltetrazolium
Chloride). Setelah cawan petri ditutup, isolat tersebut diinkubasi di dalam lemari
kultur dengan suhu 30oC selama 48 jam (Machmud, 1986). Bakteri R. solanacearum, berbentuk batang bersifat gram negatif, dan tidak membentuk
spora, dengan ukuran bervariasi sekitar (0.5 - 1.0) x (1.5 - 4.0) m (Gambar 2).
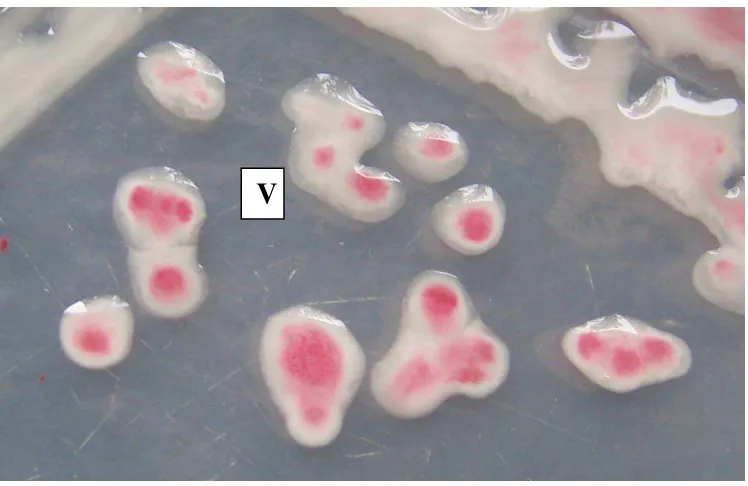
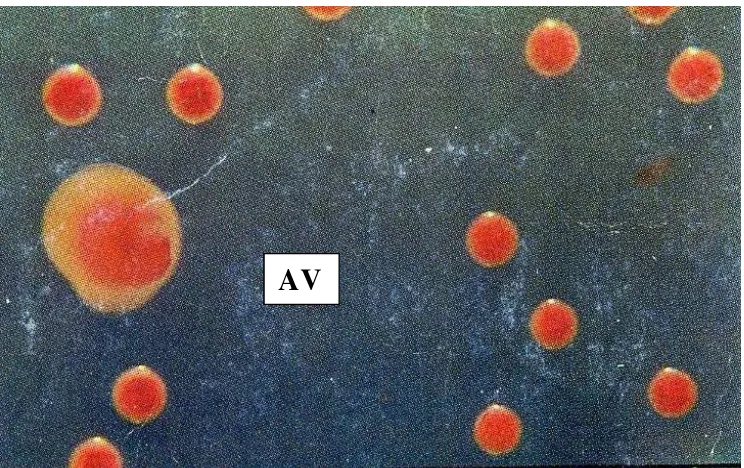
Bakteri tersebut jika ditumbuhkan pada media TZC dapat dibedakan berdasarkan
virulensinya. Bagian tengah dari koloni bakteri yang virulen berwarna merah
muda dengan tepi lingkaran tidak beraturan (Gambar 3). Sedangkan koloni
bakteri yang tidak virulen lebih kecil dengan bagian tengahnya berwarna merah
tua (Gambar 4).
Gambar 2. Sel bakteri R. solanacearum berbentuk batang dengan ukuran (0.5 - 1.0) x (1.5 - 4.0) μm
V
V
Gambar 3. Koloni bakteri R. Solanacearum virulen yang ditumbuhkan pada media TZC (Triphenyltetrazolium Chloride)
Gambar 4. Koloni bakteri R. Solanacearum tidak virulen yang ditumbuhkan pada media TZC (Triphenyltetrazolium Chloride)
Penumbuhan isolat bakteri ini dilakukan berulang-ulang sampai
membentuk koloni tunggal. Kemudian isolat yang virulen dimurnikan dengan cara
memindahkan koloni bakteri ke tabung reaksi yang berisi media SPA (Sukrosa
Pepton Agar) miring dan ditutup rapat dengan kapas, selanjutnya diinkubasi
pada suhu 30oC selama 48 jam. Isolat bakteri murni ini dipindahkan ke dalam tabung reaksi yang berisi 10 ml air steril, kemudian dikocok merata dan
dipindahkan lagi ke dalam labu yang selanjutnya ditambah air steril sampai
volumenya menjadi 1000 ml. Setelah itu labu digoyang dengan menggunakan
pengocok (shaker) dengan kecepatan 150 rpm selama 48 jam, agar isolat bakteri
tersebut tercampur merata. Selanjutnya dilakukan pengenceran sampai di dapat
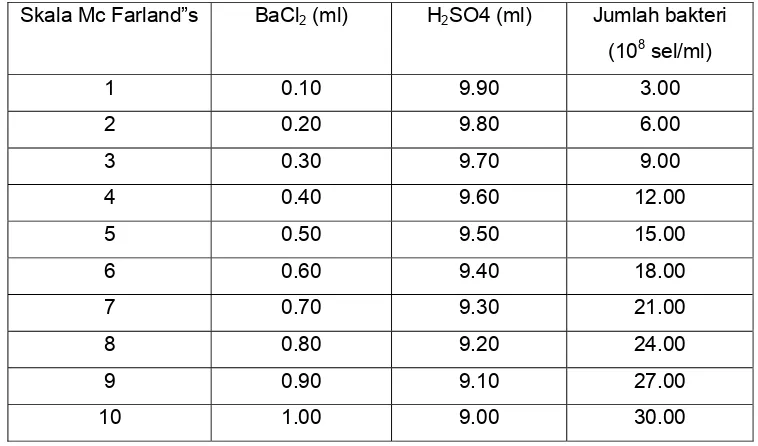
konsentrasi yang digunakan yaitu 9x108 sel/ml berdasarkan larutan McFarland skala no. 3 (Klement et al. 1990) (Tabel 3). Inokulum tersebut siap untuk
diinokulasikan ke tanaman.
Persiapan Tanaman Percobaan
Untuk pembuatan media perbanyakan tanaman digunakan larutan baku yang dibuat dengan komposisi medium Murashige & Skoog. Campuran larutan
baku yang telah dibuat ditambahkan akuades hingga volumenya 1000 ml,
kemudian ditambahkan sukrosa sebanyak 30 g dan diaduk hingga rata.
Keasaman larutan diatur sampai pH 6.0, dengan cara meneteskan larutan
NaOH 0.1 N untuk menaikan pH atau HCl 0.1 N untuk menurunkan pH yang
diukur dengan menggunakan kertas lakmus. Sebagai bahan pemadat
ditambahkan 7 g agar, dan dimasak sampai mendidih. Larutan media yang
sudah siap dimasukkan ke dalam botol kultur sebanyak 15 - 20 ml per botol,
kemudian ditutup rapat-rapat dengan menggunakan kertas almunium foil. Media
dimasukkan kedalam otoclaf untuk disterilisasi selama 30 menit pada suhu
120oC. Kemudian media yang sudah steril disimpan pada rak-rak kultur yang telah disediakan selama 3 hari sebelum penanaman eksplan.
Tabel 3. Jumlah sel bakteri menurut skala Mc Farland (Klement et al., 1990)
Skala Mc Farland”s BaCl2 (ml) H2SO4 (ml) Jumlah bakteri
(108 sel/ml)
1 0.10 9.90 3.00
2 0.20 9.80 6.00
3 0.30 9.70 9.00
4 0.40 9.60 12.00
5 0.50 9.50 15.00
6 0.60 9.40 18.00
7 0.70 9.30 21.00
8 0.80 9.20 24.00
9 0.90 9.10 27.00
10 1.00 9.00 30.00
Untuk penanaman eksplan digunakan eksplan yang berasal dari koleksi
tanaman kentang yang diperbanyak di Laboratorium Biomolekuler dan Seluler,
Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Institut Pertanian Bogor.
Perbanyakan dilakukan dengan menanam stek pada media MS dengan panjang
satu buku. Sebelum ditanam pada botol media, stek direndam dalam larutan
betadine selama dua menit untuk menghindari kontaminasi. Setiap botol diisi
sepuluh buku batang eksplan yang diregenerasi menjadi plantlet. Kemudian botol
ditutup dengan menggunakan kertas almunium foil, dan disimpan pada rak-rak
kultur di dalam ruangan berpendingin (Air Conditioner) yang dilengkapi lampu
regenerasi menjadi planlet, berakar dan bertunas mikro, selanjutnya tanaman
siap diinokulasi dengan inokulum R. solanacearum.
Pelaksanaan Percobaan
Dalam percobaan ini digunakan 120 tanaman uji yang berumur empat
minggu yang ditempatkan dalam botol kultur. Tanaman uji ini teridiri atas 19
klon S. chacoense dan satu kultivar Atlantic, masing-masing tersedia 6 tanaman.
Enam tanaman dari masing-masing klon dan kultivar ini diacak untuk
menetapkan tiga tanaman uji yang akan diinokulasi dengan metode inokulasi
gunting dan tiga lainnya diinokulasi dengan inokulasi siram.
Pada metode inokulasi gunting dilakukan dengan mencelupkan gunting ke
dalam inokulum bakteri setiap kali akan menggunting pucuk tanaman. Pada
metode inokulasi siram digunakan inokulum sebanyak satu ml per botol kultur,
kemudian disiramkan ke perakaran tanaman.
Pengamatan
Peubah yang diamati dalam penelitian ini meliputi:
(1) Periode Inkubasi (hari setelah inokulasi; hsi). Periode inkubasi merupakan
periode waktu yang dibutuhkan oleh patogen sejak penetrasi hingga
timbulnya infeksi melalui gejala yang dapat dilihat pada tanaman atau
bagian tanaman. Pengamatan terhadap periode inkubasi dilakukan setiap
hari dan dimulai satu hari setelah inokulasi sampai timbul gejala awal.
(2) Kejadian Penyakit (%). Kejadian penyakit layu bakteri diamati dengan
menghitung persentase jumlah tanaman yang bergejala penyakit. Suatu
tanaman dinyatakan terserang penyakit layu bakteri apabila paling tidak satu
daun menunjukkan gejala layu. Pengumpulan data persentase kejadian
penyakit dilakukan setiap hari dimulai saat tanaman berumur satu hari
setelah inokulasi sampai tanaman berumur 21 hari dengan menggunakan
rumus sebagai berikut :
Untuk mengetahui tingkat ketahanan masing-masing klon kentang yang
diuji, nilai persentase kejadian penyakit diklasifikasikan menggunakan kriteria
ketahanan menurut Valdez (1985) yang tercantum pada Tabel 4.
, dimana: KP = Kejadian Penyakit (% layu) n = Jumlah tanaman layu
Tabel 4. Kriteria Tingkat Ketahanan Klon Kentang terhadap R. solanacearum (Valdez, 1985)
Kejadian Penyakit (%) Tingkat Ketahanan
0 - 20 Tahan
21 - 40 Agak Tahan
41 - 60 Agak Rentan
> 60 Rentan
Pengujian di Lapangan
Rancangan Percobaan
Percobaan di lapangan menggunakan Rancangan Acak Kelompok dengan
20 perlakuan dan 5 kelompok sebagai ulangan. Perlakuan adalah 19 klon
kentang liar S. chacoense yang terdiri atas 11 klon (Pi175415) dan 8 klon
(Pi230580) serta satu kultivar Atlantic sebagai kontrol rentan. Satuan percobaan
adalah petakan yang ditanami dengan 10 tanaman dari klon yang sama.
Model linier dari percobaan ini adalah sbb Yij = μ + τi + βj + εij dimana :
Yij : nilai pengamatan dari respon yang diamati μ : nilai tengah umum respon yang diamati
τi : pengaruh klon ke-i terhadap respon yang diamati
βj : pengaruh blok ke-j terhadap respon yang diamati
εijk : galat percobaan klon ke-i yang ditanam pada blok ke-j
Pembuatan media perbanyakan tanaman
Larutan baku dibuat dengan komposisi medium MS. Campuran larutan
baku yang telah dibuat ditambah akuades hingga volumenya 1000 ml, kemudian
ditambah sukrosa sebanyak 30 g dan diaduk hingga rata. Keasaman larutan
diatur sampai pH 6.0, dengan cara meneteskan larutan NaOH 0.1 N untuk
menaikan pH atau HCl 0.1 N untuk menurunkan pH yang diukur dengan
menggunakan kertas lakmus. Sebagai bahan pemadat ditambahkan 7 g agar,
dan dimasak sampai mendidih. Larutan media yang sudah siap dimasukkan ke
dalam botol kultur sebanyak 15 - 20 ml per botol, kemudian ditutup rapat-rapat
untuk disterilisasi selama 30 menit pada suhu 120oC. Kemudian media yang sudah steril disimpan pada rak-rak kultur yang telah disediakan selama 3 hari
sebelum penanaman eksplan.
Penanaman Eksplan
Eksplan yang digunakan adalah 19 klon kentang S. chacoense dan satu
kultivar Atlantic sebagai kontrol rentan. Bahan tanaman tersebut merupakan
koleksi yang diperbanyak dari Laboratorium Biomolekuler dan Seluler, Pusat
Penelitian Sumberdaya Hayati dan Bioteknologi, Institut Pertanian Bogor.
Perbanyakan dilakukan dengan menanam stek dengan panjang satu buku pada
botol yang berisi media MS (Gambar 5, kiri). Sebelum ditanam pada botol
media, stek direndam dalam larutan betadine selama dua menit untuk
menghindari kontaminasi. Setiap botol diisi 10 buku eksplan, sebanyak 240 botol
kultur yang diregenerasi menjadi plantlet. Kemudian botol ditutup dengan
menggunakan kertas almunium foil, dan disimpan pada rak-rak kultur didalam
ruangan yang dilengkapi lampu sebagai sumber cahaya. Setelah berumur 6
minggu eksplan mengalami regenerasi menjadi planlet, berakar dan bertunas
mikro, dan siap untuk diaklimatisasi (Gambar 5, kanan).
Aklimatisasi
Plantlet berumur 6 minggu dikeluarkan dari botol, dan akar-akarnya
dibersihkan dari agar yang masih menempel. Kemudian plantlet di tanam pada
media arang sekam dalam wadah stoples (diameter 14 cm, tinggi 7 cm)
sebanyak 20 stoples yang berisi 100 plantlet per stoples, dan ditutup kembali.
Selanjutnya plantlet-plantlet tersebut disimpan di laboratorium pada rak-rak
kultur, yang dilengkapi dengan lampu sebagai sumber cahaya selama empat
hari. Selanjutnya plantlet-plantlet tersebut (masih dalam media yang sama)
dipindahkan pada kondisi lapangan (dalam rumah kasa), selama satu minggu
(Gambar 6).
Setelah satu minggu diaklimatisasi, tanaman siap untuk distek. Stek pucuk
diambil dan di tanam pada bak plastik berukuran 31 cm x 23 cm x 6 cm yang
berisi media tanam tanah, pupuk kandang dan arang sekam dengan
perbandingan 1 : 1 : 1 berdasarkan volume (gambar 7). Setiap bak plastik
ditanami 60 stek pucuk dari klon yang sama, sebanyak 20 bak plastik. Pada saat
berumur dua hari tanaman diberi pupuk daun Vitabloom-D dengan dosis 2 g/l,
sebanyak 5 liter untuk 20 bak plastik yang diberikan 3 kali seminggu. Setelah
berumur tiga minggu, tanaman siap dipindahkan ke lapangan (Gambar 8).
Selama aklimatisasi di laboratorium dan di rumah kasa, plantlet diberi air
seperlunya.
Gambar 7. Stek mini berumur satu minggu di rumah kasa Kebun Percobaan IPB Pasir Sarongge, Cipanas Cianjur.
Gambar 8. Stek mini berumur tiga minggu yang siap dipindahkan ke lapangan di Kebun Percobaan IPB Pasir Sarongge, Cipanas Cianjur.
Sebelum penanaman tanaman uji, lahan tersebut diinokulasi secara alami
dengan cara menanam terlebih dahulu kultivar Atlantic. Dalam mempersiapkan
penanaman kultivar Atlantic, tanah digemburkan, diberi 300 kg pupuk kandang,
dan Furadan 3G sebanyak 1.5 kg untuk 1000 lubang tanam. Kemudian lahan
tersebut ditanami 1000 tanaman kentang kultivar Atlantic. Pada saat
penanaman disekitar tanaman diberi pupuk buatan sebanyak 5 g Urea, 10 g
TSP dan 5 g KCl per tanaman. Tanaman tersebut dipelihara selama 40 hari.
Berdasarkan pengamatan ternyata 87.6% tanaman kentang kultivar Atlantic di
lahan percobaan ini bergejala penyakit layu bakteri. Seluruh tanaman
dihancurkan dan diratakan dengan tanah. Selanjutnya lahan tersebut diolah
kembali untuk menyebarkan dan meratakan inokulumR. solanacearum. Contoh
tanah diambil dari 5 tempat secara diagonal masing-masing sebanyak 100 g
untuk mengetahui jumlah bakteri per gram tanah. Tanah tersebut dibawa dan
dianalisis di Laboratorium Fitopatologi, Balai Besar Penelitian Bioteknologi dan
Sumberdaya Genetik Pertanian, Bogor ternyata mengandung 8.5 x 105 sel bakteri per gram tanah. Machmud (1998) mengatakan bahwa tanah yang
mengandung 8.5 x 105 sel bakteri per gram tanah, merupakan konsentrasi yang cukup tinggi untuk di lapangan.
Pelaksanaan Percobaan
Lahan yang digunakan untuk percobaan lapangan berukuran 10 m x 17 m
(Lampiran 4) dan dibagi menjadi 5 blok, masing-masing berukuran 10 m x 3 m.
Diantara blok-blok tersebut dibuat parit selebar 0,5 m (Gambar 9). Pada setiap
blok dibuat 20 petakan, masing-masing berukuran 3 m x 0.5 m. Pada setiap
petakan dibuat 10 lubang tanam dengan jarak antar lubang adalah 30 cm. Jarak
antar lubang dari petakan yang berbeda adalah 50 cm. Setiap petakan diberi 3
kg pupuk kandang. Percobaan ini menggunakan 1000 tanaman uji. Setiap
lubang dalam satu petakan ditanami satu tanaman kentang yang berasal dari
klon yang sama. Penempatan tanaman dari klon yang berbeda pada
masing-masing petakan dalam satu blok dilakukan secara acak. Setiap petakan
ditanami 10 tanaman dari klon yang sama. Dengan demikian pada setiap blok
terdapat 19 klon dan satu kultivar yang berbeda. Pada saat penanaman diberi
pupuk buatan sebanyak 5 g Urea, 10 g TSP dan 5 g KCl untuk setiap tanaman
uji.
Selama masa pemeliharaan tanaman, penyiangan dilakukan seperlunya,
sesuai dengan pertumbuhan dan perkembangan gulma. Pada umur satu minggu
setelah tanam sampai akhir percobaan dilakukan penyemprotan menggunakan
fungisida Antracol 50 WP dan insektisida Curacron dengan dosis 2 g/l setiap 2
minggu sekali. Setelah tanaman berumur 6 minggu lahan percobaan diberi
pupuk lagi dengan dosis yang sama seperti pada awal penanaman. Tanaman
dibiarkan tumbuh sampai berumbi, tanaman yang mati karena penyakit layu
bakteri dicabut, tanpa penyulaman.
Pengamatan
Peubah yang diamati dalam penelitian ini meliputi:
(1) Periode inkubasi (hari setelah tanam; hst). Pengamatan terhadap periode
inkubasi dilakukan setiap hari dan dimulai satu hari setelah tanam sampai
timbul gejala awal penyakit layu bakteri.
(2) Kejadian penyakit (%). Kejadian penyakit layu bakteri diamati dengan
menghitung persentase jumlah tanaman yang bergejala layu pada setiap
petakan. Suatu tanaman dinyatakan terserang penyakit layu bakteri
apabila paling tidak satu daun menunjukkan gejala layu. Pengumpulan
data persentase kejadian penyakit dilakukan dengan interval waktu satu
minggu dimulai saat tanaman berumur satu minggu setelah tanam sampai
tanaman berumur 10 minggu setelah tanam, dengan menggunakan rumus
seperti pada percobaan in vitro. Untuk mengetahui tingkat ketahanan
masing-masing klon kentang yang diuji, nilai persentase kejadian penyakit
diklasifikasikan menggunakan kriteria tingkat ketahanan menurut Valdez
(1985) yang tercantum pada Tabel 3.
(3) Pengamatan morfologi tanaman kentang klon S. chacoense dan kultivar
Atlantic mencakup tinggi tanaman, jumlah buku, jumlah daun, jumlah
cabang, bentuk dan warna bunga, serta ukuran stolon. Pengamatan
tersebut dimulai satu minggu setelah tanam dengan interval waktu satu
minggu sampai tanaman berumur 10 minggu setelah tanam.
(4) Pengamatan jumlah umbi, bobot umbi dan umbi terinfeksi yang dilakukan
saat panen, yaitu pada saat tanaman kentang berumur 10 minggu setelah
tanam. Data jumlah umbi dihitung berdasarkan jumlah total umbi per petak.
Data bobot umbi diperoleh dengan menimbang bobot total umbi per petak.
dan tanda yang nampak pada bagian luar dan dalam umbi hasil panen dari
setiap petak.
Untuk mengetahui perbedaan respon klon yang diamati, dilakukan analisis
ragam data hasil pengamatan. Jika hasil analisis ragam ini menunjukkan adanya
perbedan respon yang bermakna akibat perbedaan klon, pengujian akan
dilanjutkan dengan Uji Beda Nyata Jujur (BNJ) untuk melihat klon-klon mana saja
yang menyebabkan perbedaan respon tersebut.
Pengujian Ketahanan secara In Vitro
Periode Inkubasi
Hasil analisis ragam periode inkubasi atau saat timbulnya gejala penyakit
(Lampiran 5) menunjukkan bahwa baik perbedaan klon maupun perbedaan
metode inokulasi berpengaruh nyata terhadap periode inkubasi. Untuk melihat
pengaruh dari klon yang berbeda terhadap periode inkubasi baik pada metode
gunting maupun pada metode siram dilakukan uji lanjut menggunakan Uji Beda
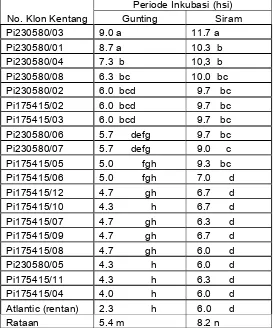
Nyata Jujur (BNJ) (Sokal dan Rolf, 1995). Hasil uji lanjut disajikan pada Tabel 5.
Tabel 5. Periode inkubasi penyakit layu bakteri dari 19 klon S. chacoense dan kultivar Atlantic pada percobaan in vitro dengan menggunakan metode inokulasi gunting dan siram
Gejala awal penyakit layu bakteri pada metode inokulasi siram ditunjukkan
dengan tumbuhnya bakteri pada media yang mengakibatkan media berubah
warna menjadi kecoklatan, diikuti dengan daun pada bagian bawah tanaman
menguning dan selanjutnya tanaman menjadi layu dan mati. Pada metode
inokulasi gunting, awal timbulnya gejala penyakit terlihat pada daun dan batang
sekitar pucuk daun yang digunting berwarna coklat kehitaman yang terus
berkembang sampai daun layu serta batang membusuk dan lunak, akhirnya
tanaman mati (Gambar 9).
Gambar 9. Contoh tanaman uji yang bergejala penyakit layu bakteri setelah diinokulasi dengan metode inokulasi siram dan metode inokulasi gunting pada percobaan in vitro.
Kejadian Penyakit dan Ketahanan Tanaman
Seperti pada analisis ragam periode inkubasi, hasil analisis ragam kejadian
penyakit (Lampiran 6) menunjukkan hal yang sama, baik perbedaan klon
maupun perbedaan metode inokulasi berpengaruh nyata terhadap kejadian
penyakit. Untuk melihat pengaruh dari klon yang berbeda terhadap kejadian
penyakit baik pada metode gunting maupun pada metode siram dilakukan juga
uji lanjut menggunakan Uji BNJ (Sokal dan Rolf, 1995). Hasil uji lanjut ini
ditampilkan pada Tabel 6. Tingkat ketahanan yang ditampilkan pada Tabel 6 ini
ditetapkan berdasarkan kriteria Valdez (1985) yang tercantum pada Tabel 4,
Bab Metode.
Tabel 6. Kejadian penyakit dan tingkat ketahanan terhadap penyakit layu bakteri dari 19 klon S. chacoense dan kultivar Atlantic pada percobaan in vitro dengan menggunakan metode inokulasi gunting dan siram
No. Klon Kentang
Kejadian Penyakit (%)* Tingkat Ketahanan
Gunting Siram Gunting Siram
Pi230580/03 17 a 10 a T T
Keterangan: Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama menunjukkan bahwa antar klon tidak berbeda nyata pada uji BNJ taraf 5%. *) Data dihitung dari 10 tanaman dan ditransformasi dengan arcsin Vx;. hsi = hari setelah inokulasi; T=tahan; AT=agak tahan; AR=agak rentan; R=rentan.
Dari Tabel 6 terlihat pula bahwa dengan metode inokulasi gunting
diperoleh dua klon S. chacoense (Pi230580 no. 03 dan 01) yang tahan, tiga klon
yang agak tahan, lima klon yang agak rentan dan 9 klon yang rentan terhadap
penyakit layu bakteri, sedangkan dengan metode inokulasi siram diperoleh tiga
tahan, dua klon yang agak rentan, dan 8 klon yang rentan terhadap penyakit layu
bakteri.
Untuk memperjelas adanya hubungan antara periode inkubasi dengan
kejadian penyakit pada pengujian secara in vitro baik dengan menggunakan
metode inokulasi gunting maupun metode inokulasi siram dilakukan analisis
regresi yang hasilnya disajikan pada Gambar 10 dan Gambar 11.
Besarnya kejadian penyakit terkait erat dengan periode inkubasi. Makin
panjang periode inkubasi, makin kecil kejadian penyakitnya. Pada metode
inokulasi gunting, penurunan kejadian penyakit karena peningkatan periode
inkubasi lebih cepat dibandingkan dengan penurunan kejadian penyakit pada
metode inokulasi siram dengan penurunan kejadian penyakit karena peningkatan
periode inkubasi lebih lambat.
Pada metode inokulasi gunting, periode inkubasi terpendek sekitar 2.3 hsi
dengan rata-rata kejadian penyakit tertinggi mencapai 100% untuk kultivar
Atlantic sebagai pembanding rentan. Sementara untuk klon-klon S. chacoense
yang rentan rata-rata kejadian penyakit 90% ketika tanaman berumur 4 hsi.
Sedangkan pada metode inokulasi siram, periode inkubasi terpendek sekitar 6
hsi dengan kejadian penyakit tertinggi untuk kultivar Atlantic sebagai pembanding
rentan 90%, dan untuk klon-klon S. chacoense yang rentan rata-rata kejadian
penyakit sekitar 80% ketika tanaman berumur antara 6 – 6.7 hsi.
Gambar 11. Hubungan antara periode inkubasi dengan kejadian penyakit layu bakteri pada 19 klon S. chacoense dan kultivar Atlantic dengan metode inokulasi siram
Pengujian Ketahanan di Lapangan
Periode Inkubasi
Hasil analisis ragam periode inkubasi (Lampiran 7) menunjukkan bahwa
terdapat perbedaan periode inkubasi yang sangat nyata antara klon-klon yang
diuji. Untuk melihat pengaruh dari klon yang berbeda terhadap periode inkubasi
dilakukan uji lanjut menggunakan Uji Beda Nyata Jujur (Sokal dan Rolf, 1995).
Hasil uji lanjut ini disajikan pada Tabel 7.
Pengamatan di lapangan menunjukkan bahwa gejala awal penyakit layu
bakteri mulai nampak pada minggu kedua setelah tanam, berupa kelayuan pada
pucuk daun (Gambar 12, kiri). Daun-daun berubah warna menjadi kuning
sampai kecoklatan yang akhirnya mati. Apabila semua daun sudah layu, maka
dalam waktu satu sampai dua minggu tanaman kering berwarna coklat
kehitaman dan selanjutnya tanaman tersebut mati (Gambar 12, kanan).
Kelayuan yang disertai robohnya batang terjadi pada tanaman kentang dari
klon-klon yang rentan, sehingga tanaman menjadi rebah (Gambar 12, tengah).