TEKNIK EKSTRAKSI TERBAIK UNTUK ISOLASI
KAEMPFEROL DAN KUERSETIN DARI DAUN JAMBU BIJI
(Psidium guajava)
NURUL SRI WULANDARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Teknik Ekstraksi Terbaik untuk Isolasi Kaempferol dan Kuersetin dari Daun Jambu Biji (Psidium guajava) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
NURUL SRI WULANDARI. Teknik Ekstraksi Terbaik untuk Isolasi Kaempferol dan Kuersetin dari Daun Jambu Biji (Psidium guajava). Dibimbing oleh IRMANIDA BATUBARA dan IRMA HERAWATI SUPARTO.
Daun jambu biji mengandung beragam senyawa yang memiliki aktivitas hayati, diantaranya kaempferol dan kuersetin sebagai antikanker. Dalam upaya mengisolasi kaempferol dan kuersetin, dilakukan 12 macam ekstraksi guna mencari teknik ekstraksi terbaik untuk mengisolasi kaempferol dan kuersetin dari daun jambu biji. Ekstrak yang dihasilkan diuji toksisitasnya terhadap larva Artemia salina. Semua ekstrak bersifat toksik karena memiliki nilai LC50 kurang dari 1000 ppm kecuali ekstrak soxhletasi langsung daun jambu, dan ekstrak sonikasi dan soxhletasi residu n-heksana. Ekstrak dengan kandungan total fenolik dan total flavonoid yang tinggi, kandungan tanin yang rendah, warna noda kromatografi lapis tipis yang pekat dipilih untuk analisis kromatorafi cair kinerja tinggi guna mengetahui kadar kaempferol dan kuersetinnya. Maserasi langsung daun dengan bantuan sonikasi dipilih sebagai teknik ekstraksi terbaik untuk mengisolasi dengan kandungan kaempferol 0.03% dan kuersetin 2.15%. Selain kandungan kaempferol dan kuersetin yang tinggi, teknik ekstraksi maserasi dengan bantuan sonikasi langsung daun jambu dipilih karena waktu ekstraksinya yang singkat, jumlah senyawa pengotornya yang lebih sedikit, dan memiliki toksisitas yang tinggi. Kata kunci: daun jambu biji, kaempferol, kromatografi cair kinerja tinggi, kuersetin
ABSTRACT
NURUL SRI WULANDARI. The Best Extraction Technique for Kaempferol and Quercetin Isolation from Guava Leaves (Psidium guajava). Supervised by IRMANIDA BATUBARA and IRMA HERAWATI SUPARTO.
Guava leaves contain various compounds that have biological activity such as kaempferol and quercetin as anticancer. Twelve extraction techniques were performed to obtain the best extraction technique to isolate kaempferol and quercetin from the guava leaves. Toxicity of extracts was tested against Artemia salina larvae. All extracts were toxic (LC50 value less than 1000 ppm) except extract of direct soxhletation on guava leaves, and extract of sonication and soxhletation using n-hexane. The extract with high content of total phenols and total flavonoids, low content of tannins, intense color of spot on thin layer chromatogram was selected for high performance liquid chromatography analysis. Direct sonication of guava leaves was chosen as the best extraction technique with kampferol and quercetin content of 0.02% and 2.15%, respectively. In addition to high content of kaempferol and quercetin, direct sonication was chosen due to the shortest extraction time, lesser impurities and high toxicity.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
TEKNIK EKSTRAKSI TERBAIK UNTUK ISOLASI
KAEMPFEROL DAN KUERSETIN DARI DAUN JAMBU BIJI
(Psidium guajava)
NURUL SRI WULANDARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Teknik Ekstraksi Terbaik untuk Isolasi Kaempferol dan Kuersetin dari Daun Jambu Biji (Psidium guajava)
Nama : Nurul Sri Wulandari NIM : G44124021
Disetujui oleh
Dr Irmanida Batubara, MSi
Pembimbing I Dr dr Irma Herawati Suparto, MS Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Segala puji dan rasa syukur Penulis panjatkan atas segala karunia kesehatan dan kemudahan yang dilimpahkan oleh Allah SWT selama proses penyusunan karya ilmiah dengan judul “Teknik Ekstraksi Terbaik untuk Isolasi Kaempferol dan Kuersetin dari Daun Jambu Biji (Psidium guajava)“. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Desember 2013 hingga Agustus 2014 di Laboratorium Kimia Analitik dan Laboratorium Bersama, Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor, dan Pusat Studi Biofarmaka IPB, Bogor.
Penulis mengucapkan terima kasih kepada Dr Irmanida Batubara, MSi. dan Dr dr Irma Herawati Suparto, MS. selaku pembimbing yang telah memberikan arahan, bimbingan, motivasi, dan doa selama penelitian. Penulis juga mengucapkan terima kasih kepada Pusat Studi Biofarmaka dan pemberi bantuan dan kegiatan BOPTN PSB tahun 2014 Program Penguatan dan Upaya Menjaga Kesinambungan Program LITBANG RAP Pusat Unggulan.
Ucapan terima kasih juga penulis sampaikan kepada Ayah, Ibu, dan adik yang telah memberikan doa, semangat, kasih sayang, dan dukungan selama masa studi hingga proses penyusunan karya ilmiah ini. Tak lupa juga terima kasih kepada Wenny Nurwendari dan staf Kependidikan Laboratorium Kimia Analitik, yaitu Bapak Eman Suherman dan Ibu Nunung yang turut membantu dan memberikan semangat selama penelitian berlangsung. Semoga Allah SWT memberikan balasan atas segala amal yang diperbuat dan senantiasa menyertai hamba-Nya dengan kasih dan sayang-Nya.
Semoga karya ilmiah ini dapat memberikan manfaat.
10
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Prosedur Penelitian 2
HASIL DAN PEMBAHASAN 5
Kondisi Sampel dan Ekstraksi 5
Kadar Fenol dan Tanin 6
Kadar Flavonoid 7
Toksisitas BSLT 8
Profil KLT 9
Kadar Kaempferol dan Kuersetin Ekstrak Terpilih 11
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
11
DAFTAR TABEL
1 Rendemen ekstrak 6
2 Kadar fenol dan tanin total 7
3 Kadar flavonoid 8
4 LC50 terhadap larva A. Salina dari tiap ekstrak 8 5 Penentuan konsentrasi kaempferol dan kuersetin dengan KCKT 11
DAFTAR GAMBAR
1 Kromatogram penentuan eluen terbaik fase diam silika gel dengan
n-heksana:etil asetat (a) 2:98, (b) 5:95, (c) 7:93, (d) 1:9, (e) 2:8, dan (f) 0:100 9 2 Kromatogram pemisahan ekstrak dan standar kaempferol diamati pada
UV 254 nm 9
3 Kromatogram pemisahan ekstrak dan standar keamferol diamati pada
UV 366 nm 10
4 Struktur senyawa (a) mirisetin, (b) kuersetin, dan (C) kaempferol 12
DAFTAR LAMPIRAN
1 Diagram alir penelitian 15
2 Hasil determinasi daun jambu biji 17
3 Perhitungan kadar air 18
4 Perhitungan % rendemen 18
1
PENDAHULUAN
Latar Belakang
Jambu biji (Psidium guajava) merupakan buah daerah tropis yang memiliki nama lain jambu klutuk atau jambu batu. Jambu biji berupa tanaman semak atau perdu yang memiliki daging buah berwarna merah atau putih. Daunnya memiliki bentuk menyirip dengan tepi daun yang rata. Daun jambu biji sering digunakan masyarakat sebagai obat tradisional untuk mengobati luka, diare, batuk, sariawan, dan demam berdarah (Syaefudin 2008). Ekstrak daun jambu biji dilaporkan memiliki aktivitas sebagai antioksidan (Chen dan Yen 2007), penghambat reaksi nonenzimatik gula pereduksi pada penderita hiperglikemia (Wu et al. 2009), antiinflamasi (Jang et al. 2013), dan antikoagulan (Hsieh et al. 2007). Beberapa penelitian menunjukkan ekstrak daun jambu biji mengandung senyawa fenolik seperti asam ferulat, dan flavonoid seperti katekin, kuersetin, kaempferol, dan asam galat (Wu et al. 2009).
Penelitian mengenai kaempferol dan kuersetin pada jambu biji belum banyak dilakukan, padahal kaempferol diketahui memiliki banyak aktivitas farmakologi seperti antioksidan, antimikrob (Teffo et al. 2010), antidiabetik (Zang et al. 2011), antiinflamasi, dan analgesik (Parveen et al. 2007), sedangkan kuersetin diketahui memiliki aktivitas sebagai antioksidan (Duenas et al. 2009), antibakteri (Arima dan Danno 2002), dan antivirus (Agustinus 2009). Aktivitas kaempferol dan kuersetin dapat diuji menggunakan bioassay Brine Shrimp Lethality Test (BSLT). Uji ini biasa digunakan sebagai uji pendahuluan untuk mengetahui potensi aktivitas farmakologi suatu senyawa bahan alam karena dianggap sebagai metode alternatif yang murah untuk uji sitotoksisitas. Senyawa yang diduga memiliki aktivitas farmakologi biasanya diujikan terlebih dahulu menggunakan larva udang Artemia salina sebagai bioindikator (Krishnaraju et al. 2005). Metode ini merupakan penapisan awal yang dapat disempurnakan oleh uji hayati lainnya yang lebih spesifik setelah senyawa aktif dari suatu bahan uji dapat diisolasi.
2
Tujuan
Penelitian ini bertujuan menentukan teknik ekstraksi terbaik untuk isolasi kaempferol dan kuersetin pada daun jambu biji serta menentukan aktivitasnya dengan metode BSLT.
Waktu dan Tempat Pelaksanaan
Penelitian ini dilaksanakan dari bulan Desember 2013 sampai Agustus 2014 di Laboratorium Kimia Analitik dan Laboratorium Bersama, Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor, dan Pusat Studi Biofarmaka, Bogor.
METODE
Alat dan Bahan
Alat-alat yang digunakan adalah peralatan gelas, oven, neraca analitik, penguap putar, sumur uji, bejana kromatografi, lampu UV, sonikator, instrumen kromatografi cair kinerja tinggi (KCKT) Shimadzu Prominence 20A, dan spektrofotometer UV Hitachi U-2000. Bahan-bahan yang digunakan adalah daun jambu biji (Psidium guajava) yang diambil dari kebun biofarmaka Cikabayan, etanol, metanol 70%, n-heksana, etil asetat, HCl 4 M, asetonitril tingkat KCKT, buffer KH2PO4 0.025 M pH 2.5, pelat kromatografi lapis tipis (KLT) silika gel 60 F254, standar kaempferol dan kuersetin, telur Artemia salina, air laut, dan akuades.
Lingkup kerja
Metode penelitian yang dilakukan mengikuti diagram alir (Lampiran 1) yang meliputi penentuan kadar air dengan metode AOAC 2006, ekstraksi, uji toksisitas dengan metode BSLT, dan isolasi kaempferol.
Ekstraksi Daun Jambu Biji
3 Rendemen % = b(1-Ka)a × 100%
Keterangan:
a: bobot ekstrak (g)
b: bobot sampel kering (g) Ka: kadar air
Teknik ekstraksi 1: Maserasi (Erosa-Rejon et al. 2010)
Sampel daun diekstraksi dengan etanol pada suhu ruang selama 1 minggu. Ekstraksi dilakukan sebanyak 3 kali. Ekstrak selanjutnya dipekatkan dengan penguap putar.
Teknik ekstraksi 2: Maserasi dengan sonikasi (Tang et al. 2001)
Sampel daun diekstraksi dengan metanol-air (85:15) dengan bantuan sonikasi selama 3 jam. Ekstraksi diulang sebanyak 3 kali. Ekstrak kemudian dipekatkan dengan penguap putar hingga bebas pelarut.
Teknik ekstraksi 3: Refluks (Zang et al. 2011)
Sampel daun ditambahkan dengan metanol 70% kemudian direfluks pada suhu 60-70ºC selama 3 jam. Ekstrak yang didapatkan selanjutnya dipekatkan dengan penguap putar.
Teknik ekstraksi 4: Soxhlet (Loizzo et al. 2007)
Sampel daun ditambahkan dengan metanol 70%. Sampel daun selanjutnya disoxhlet. Ekstrak kemudian dipekatkan dengan penguap putar.
Penentuan kadar fenol total (Murtijaya dan Lim 2007)
Standar fenol yang digunakan ialah asam galat. Larutan induk asam galat dibuat dengan cara melarutkan 25 mg asam galat dengan 0.25 mL etanol lalu dipindahkan ke dalam labu takar 50 mL dan ditera dengan akuades. Larutan induk diencerkan dan dihasilkan deret standar asama galat dengan konsentrasi 10, 20, 30, 40, 50, dan 60 ppm. Masing-masing ekstrak ditimbang sebanyak 25 mg lalu dilarutkan dengan metanol:air (1:1) dan disaring ke dalam labu takar 25 ml. Larutan standar dan ekstrak dipipet sebanyak 0.9 mL ke dalam tabung reaksi terpisah kemudian ditambahkan 4.5 mL pereaksi Folin-Ciocalteau, dikocok dengan vorteks dan didiamkan selama 3 menit. Masing-masing larutan selanjutnya ditambahkan 3.6 mL Na2CO3 7.5%, dikocok dan diinkubasi kembali selama 1 jam. Absorbans dari larutan standar dan sampel diukur dengan spektrofotometer UV-Vis pada panjang gelombang 765 nm. Kadar fenol total sampel ditentukan menggunakan persamaan regresi dari standar asam galat.
Penentuan kadar tanin (Sulastri 2009)
4 dari biru menjadi kuning emas. Titrasi dilakukan triplo. Penetapan blangko dilakukan dengan cara 5 mL akuades ditambahkan 5 mL larutan indigokarmin lalu dititrasi. Kadar tanin ditentukan dengan rumus berikut:
% Tanin= 10 A-B × N × 0.00416bobot ekstrak (g) × 100% Keterangan:
A: volume KMnO4 untuk titrasi sampel (mL) B: volume KMnO4 untuk titrasi blangko (mL) N: konsentrasi KMnO4 setelah standardisasi 1 mL KMnO4 setara dengan 0.00416 g tanin.
Penentuan kadar flavonoid total (BPOM 2004)
Ekstrak daun jambu biji ditimbang sebanyak 200 mg, lalu ditambah 1 mL larutan heksametilentetramina (HMT) 0.5%, 20 mL aseton, dan 2 mL larutan HCl, kemudian campuran dihidrolisis dengan cara direfluks selama 30 menit. Campuran disaring kemudian filtrat dimasukkan ke dalam labu ukur 100 mL. Campuran filtrat ditambah dengan aseton sampai volume 100 mL. Filtrat diambil sebanyak 20 mL dan dimasukkan ke dalam corong pisah, kemudian ditambah 20 mL air dan 15 mL etil asetat, lalu dikocok. Fraksi etil asetat dikumpulkan dalam labu ukur 50 mL. Ekstraksi diulangi dengan menambahkan 10 mL etil asetat. Fraksi etil asetat ditera dengan etil asetat sampai volume mencapai 50 mL. Selanjutnya 10 ml dari campuran tersebut dimasukkan ke dalam labu ukur 25 ml dan ditambahkan dengan 1 mL AlCl3 2% dan ditera dengan asam asetat glasial 5% dalam metanol. Campuran dihomogenkan dan didiamkan 15-30 menit. Nilai absorbansnya pada panjang gelombang 425 nm dengan spektrofotometer UV-VIS. Kadar flavonoid total ditentukan dengan rumus berikut:
Uji toksisitas dengan BSLT (Krishnaraju et al. 2005)
Pengujian dilakukan dengan cara 10 ekor larva dimasukkan ke dalam sumur uji hingga 1 mL, kemudian ditambahkan larutan ekstrak sebanyak 1 mL. Larutan ekstrak yang digunakan dibuat dengan variasi konsentrasi dari 200-14000 μg/ml. Pengujian dilakukan pada suhu ruang. Setiap konsentrasi dilakukan pengulangan sebanyak 3 kali dan digunakan 1 kontrol tanpa penambahan ekstrak. Pengamatan dilakukan setelah 1 hari (24 jam) dengan cara menghitung jumlah larva udang yang mati kemudian dihitung nilai LC50 dengan rumus berikut:
5 Nilai % kematian diubah ke dalam nilai probit. Persamaan regresi y=a+bx dibuat antara log konsentrasi ekstrak (x) dan nilai probit (y) lalu ditentukan nilai LC50 dengan cara dimasukkan nilai y=5.
Penentuan ekstrak terbaik
Eluen terbaik untuk pemisahan ekstrak ditentukan. Eluen yang digunakan ialah n-heksana:etil asetat dengan berbagai perbandingan. Masing-masing ekstrak selanjutnya dianalisis dengan KLT terhadap standar kaempferol menggunakan eluen terbaik. Noda yang dihasilkan diamati pada lampu UV 254 dan 366 nm. Ekstrak yang mengandung flouresens dan nilai Rf yang sama dengan standar kaempferol dan kuersetin akan dianalisis lebih lanjut.
Penentuan kadar kaempferol (Wang dan Helliwell 2001) Preparasi standar dan sampel
Larutan stok standar kaempferol dan kuersetin 5 ppm dibuat dengan cara melarutkan standar dalam metanol. Masing-masing ekstrak terpilih sebanyak 30 mg ditambahkan 2 mL HCl 4 M, dikocok dan dipanaskan selama 30 menit. Larutan ditambahkan 2 mL etil asetat lalu dikocok kembali. Fraksi etil asetat dipisahkan. Larutan dibilas dengan 1 mL etil asetat sebanyak 2 kali. Fraksi etil asetat yang terkumpul diuapkan hingga kering lalu dilarutkan dengan metanol dan ditepatkan dalam labu 10 mL. Larutan standar dan sampel kemudian disaring dengan membran mikro 0.45 µm dan diinjeksikan sebanyak 20 µl pada KCKT untuk dianalisis. Kadar kaempferol dan kuersetin dalam sampel ditentukan dengan rumus:
Konsentrasi dalam sampel= luas puncak standarluas puncak sampel × konsentrasi standar
Kondisi KCKT
Kondisi KCKT yang digunakan (Wang dan Helliwel 2001)ialah kolom C18, detektor UV dengan λ 370 nm, suhu oven 30ºC, fase gerak asetonitril 30% dalam buffer KH2PO4 0.025 M pH 2.5 dengan elusi isokratik, laju alir 1 ml/mnt, dan volume injeksi 20 µL. Kandungan kaempferol dan kuersetin dibandingkan dengan standar.
HASIL DAN PEMBAHASAN
Kondisi Sampel dan Ekstraksi
6 kualitasnya akibat jamur atau bakteri. Berdasarkan syarat tersebut maka kadar air sampel dapat dikatakan sudah memenuhi standar karena di bawah 10%.
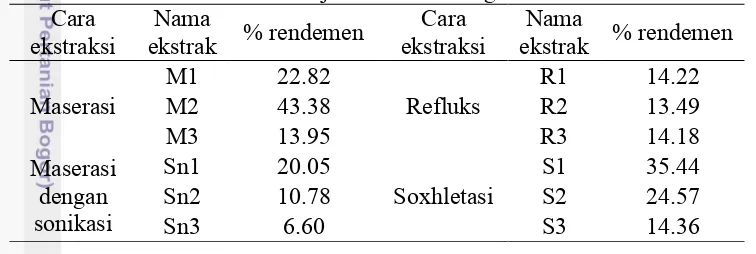
Sampel daun jambu biji diekstraksi dengan 4 macam teknik, yakni maserasi, maserasi dengan sonikasi, refluks, dan soxhletasi. Total ekstrak yang dihasilkan sebanyak 12 ekstrak, yakni ekstraksi langsung daun jambu biji dengan 4 macam teknik (ekstrak M1, Sn1, R1, dan S1), ekstrak dari residu n-heksana (M2, Sn2, R2, dan S2), dan ekstrak dari residu etil asetat (M3, Sn3, R3, dan S3). Perbedaan perlakuan ini bertujuan untuk mengetahui pengaruh teknik ekstraksi terhadap kandungan kaempferol dan kuersetin terbanyak. Soxhletasi dengan n-heksana bertujuan untuk menghilangkan lemak yang terikat pada jaringan daun sehingga diharapkan lebih mudah untuk mengekstraksi kaempferol yang bersifat polar. Soxhletasi dengan etil asetat bertujuan menghilangkan komponen-komponen yang bersifat semipolar sehingga ketika diekstraksi dengan metanol atau etanol hanya komponen polar yang terekstraksi. Tabel 1 memperlihatkan bahwa semakin panjang tahap ekstraksi, semakin kecil nilai % rendemen yang dihasilkan. Berdasarkan hasil ekstraksi didapatkan ekstrak dengan % rendemen tertinggi adalah ekstrak M2 sebesar 43.38%. Perhitungan % rendemen dapat dilihat pada Lampiran 4.
Tabel 1 Rendemen ekstrak daun jambu dari berbagai macam teknik ekstraksi Cara
ekstraksi ekstrak % rendemen Nama ekstraksi Cara ekstrak % rendemen Nama Maserasi M1 M2 22.82 43.38 Refluks R1 R2 14.22 13.49
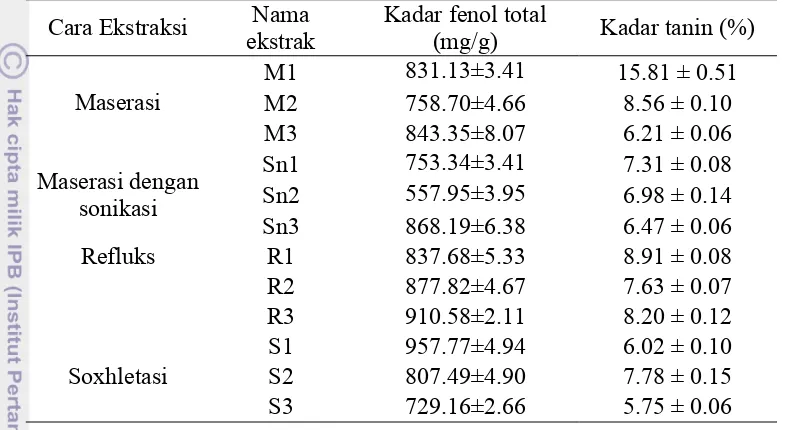
Senyawa fenol meliputi seluruh senyawa metabolit sekunder yang memiliki cincin aromatik yang mengandung satu atau lebih gugus hidroksil. Kadar fenol total menyatakan banyaknya senyawa fenol yang terkandung dalam suatu sampel. Analisis kadar fenol total menggunakan asam galat sebagai standar. Tanin merupakan golongan senyawa fenol yang banyak terdapat dalam kulit batang, daun dan beberapa jenis buah yang belum matang. Tanin dalam jambu biji merupakan tanin terkondensasi karena jambu biji merupakan tanaman angiospermae (Harborne 2006). Penentuan kadar tanin menggunakan titrasi permanganometri, yakni titrasi menggunakan KMnO4 yang merupakan oksidator kuat sebagai titran. Senyawa tanin dalam titrat akan dioksidasi oleh KMnO4. Kelebihan KMnO4 dalam titrat akan mengoksidasi indigokarmin sehingga terjadi perubahan warna dari biru menjadi kuning emas. Tanin yang akan dioksidasi oleh KMnO4 ialah tanin secara total (Hamidah 2006).
7 tanin tertinggi dari semua ekstrak sebesar 15.81%. Tingginya senyawa fenol pada ekstrak S1 menunjukkan bahwa senyawa fenol dapat diesktraksi secara optimal dengan soxhletasi langsung daun jambu biji. Tahap soxhletasi langsung daun jambu juga terbukti paling efektif karena jika tahapan soxhletasi terlalu banyak diduga dapat merusak senyawa fenol akibat pemanasan yang berulang-ulang.
Tabel 2 Kadar fenol dan tanin total ekstrak daun jambu
Cara Ekstraksi ekstrak Nama Kadar fenol total (mg/g) Kadar tanin (%)
Maserasi M1 M2 831.13±3.41 758.70±4.66 15.81 ± 0.51 8.56 ± 0.10
Menurut Guimarães-Beelen et al. (2006) tanin dapat terekstraksi secara optimal
dengan maserasi menggunakan pelarut etil asetat dan air. Ekstrak M1 merupakan hasil ekstraksi menggunakan metanol:air sehingga kadar tanin yang dihasilkan paling tinggi. Ekstrak lainnya memiliki kadar tanin yang rendah karena telah mengalami tahap ekstraksi yang panjang dan berasal dari residu etil asetat.
Kadar Flavonoid
Flavonoid merupakan golongan senyawa fenol yang dapat diekstraksi menggunakan senyawa organik polar seperti metanol dan etanol (Loizzo et al. 2007). Senyawa flavonoid yang banyak terkandung dalam ekstrak daun jambu biji ialah kuersetin, keampferol, asam galat, dan katekin yang biasanya terikat dengan glikosidanya (Wu et al. 2009). Kadar flavonoid total daun jambu biji ditentukan menggunakan standar kuersetin.
8 Tabel 3 Kadar flavonoid total ekstrak daun jambu
Cara
Ekstraksi ekstrak Nama
Kadar flavonoid total (mg/g)
Cara
Ekstraksi ekstrak Nama
Kadar
Brine Shrimp Lethality Test (BSLT) adalah suatu metode penelusuran untuk menentukan bioaktivitas suatu ekstrak ataupun senyawa terhadap larva udang Artemia salina. Sifat sitotoksik senyawa aktif dapat diketahui berdasarkan jumlah kematian larva udang pada konsentrasi tertentu dan biasanya dinyatakan dalam nilai LC50 (Lethal Concentration 50%), yaitu suatu nilai yang menunjukkan konsentrasi zat toksik yang dapat menyebabkan kematian hewan uji sampai 50% (Meyer et al. 1982). Data % kematian larva yang diperoleh kemudian diolah dengan analisis probit dengan memasukkan nilai probit 5 untuk menentukan nilai LC50. Analisis probit merupakan salah satu analisis regresi untuk mengetahui hubungan konsentrasi-respon (persentase kematian sel) agar diperoleh persamaan garis lurus sehingga dapat digunakan untuk menentukan harga LC50 dengan lebih akurat (Nurrochmad 2001).
Senyawa kimia berpotensi bioaktif jika mempunyai nilai LC50 kurang dari 1000 ppm (Meyer et al. 1982). Berdasarkan nilai LC50 yang ditunjukkan pada Tabel 4, hampir ekstrak dikatakan toksik kecuali ekstrak Sn2, S1, dan S2 yang memiliki nilai LC50 lebih besar dari 1000 ppm. Pengamatan terhadap kadar fenol, kadar tanin, dan kadar flavonoid total terhadap ketiga ekstrak ini menunjukkan bahwa ketiganya memiliki tanin dan flavonoid total yang tidak terlalu tinggi dari tiap jenis ekstraksi sehingga dapat diduga bahwa adanya senyawa fenol lain dalam daun jambu selain tanin dan flavonoid, seperti asam protokatekuat (Kim et al. 2011), tidak terlalu berpengaruh pada toksisitas ekstrak.
Tabel 4 LC50 terhadap larva A. salina dari tiap ekstrak Teknik
Soxhletasi S1 1340.81 ± 156.47
Sn2 3862.62 ± 104.80 S2 1095.52 ± 85.80
Sn3 745.54 ± 206.76 S3 132.13 ± 26.53
9 Profil KLT
Penentuan eluen terbaik menggunakan n-heksana dan etil asetat dengan berbagai perbandingan. Profil kromatogram pada Gambar 1 menunjukkan bahwa n-heksana:etil asestat (2:98) merupakan eluen terbaik karena noda yang dihasilkan banyak dengan keterpisahan yang baik.
Gambar 1 Kromatogram penentuan eluen terbaik fase diam silika gel dengan n-heksana:etil asetat (a) 2:98, (b) 5:95, (c) 7:93, (d) 1:9, (e) 2:8, dan (f) 0:100.
Analisis selanjutnya ialah KLT dari masing-masing ekstrak dengan standar kaempferol menggunakan eluen terbaik. Kromatogram pemisahan ekstrak dan pada Gambar 2 menunjukkan bahwa semua ekstrak menghasilkan noda yang hampir sama. Pemisahan standar kaempferol menghasilkan nilai Rf sebesar 0.87 sedangkan standar kuersetin sebesar 0.83. Perbandingan noda dari masing-masing ekstrak terhadap nilai Rf standar memperlihatkan bahwa semua ekstrak memiliki nilai Rf yang sama seperti standar.
Gambar 2 Kromatogram pemisahan ekstrak dan standar diamati pada UV 254 nm; berurutan dari 1-14: standar kuersetin, standar kaempferol, M1, M2, M3, Sn1, Sn2, Sn3, R1, R2, R3, S1, S2, dan S3.
a b c d e f
10 Penampakan dengan UV 366 nm pada Gambar 3 menunjukkan bahwa baik standar kaempferol maupun standar kuersetin memiliki flouresens hijau. Penampakan noda pada ekstrak bila dibandingkan dengan standar kaempferol terlihat adanya flouresens biru. Tidak adanya warna flouresens hijau pada Rf yang sama dapat diasumsikan bahwa senyawa kaempferol dalam ekstrak terhalang oleh senyawa flouresens biru karena memiliki sifat kepolaran yang mirip sehingga terelusi bersama dengan kaempferol. Hal lain terlihat dari penampakan noda sampel terhadap standar kuersetin, yakni sama-sama memiliki penampakan flouresens hijau, hanya berbeda intensits.
Gambar 3 Kromatogram pemisahan ekstrak dan standar diamati pada UV 366 nm; berurutan dari 1-14: standar kuersetin, standar kaempferol, M1, M2, M3, Sn1, Sn2, Sn3, R1, R2, R3, S1, S2, dan S3.
Pemisahan sampel (Gambar 3) menunjukkan bahwa ekstrak yang berasal dari ekstraksi maserasi dan maserasi dengan sonikasi langsung sampel daun dan residu n-heksana (M1, M2, Sn1, Sn2) merupakan ekstrak yang memiliki noda terbanyak. Noda ini berasal dari senyawa selain kaempferol dan kuersetin. Ekstrak yang berasal dari refluks dan soxhletasi langsung sampel daun dan residu n-heksana (R1, R2, S1, S2) memperlihatkan berkurangnya noda sampel, sedangkan semua ekstrak yang berasal dari residu etil asetat (M3, Sn3, R3, S3) memperlihatkan noda yang paling sedikit. Makin sedikitnya noda ini dapat disebabkan oleh telah hilangnya senyawa-senyawa lain akibat tahapan ekstraksi yang semakin panjang.
Kadar Kaempferol dan Kuersetin pada Ekstrak Terpilih
Pemilihan ekstrak untuk analisis dengan KCKT berdasarkan pada intensitas flouresens pada KLT, kadar fenol total, kadar tanin total, dan kadar flavonoid total. Ekstrak yang dipilih untuk analisis lanjutan ialah Sn1, Sn2, S1, dan S3. Ekstrak yang dipilih memiliki intensitas flouresens yang tinggi, kadar tanin total yang rendah, dan kadar fenol dan flavonoid total yang tinggi. Tanin sama seperti flavonoid, yakni termasuk ke dalam golongan senyawa fenol. Keberadaan tanin yang tinggi dalam ekstrak dikhawatirkan dapat memengaruhi hasil analisis sehingga dipilih ekstrak yang memiliki kadar tanin yang rendah.
Noda standar
11 Analisis dengan KCKT dari keempat ekstrak terpilih menggunakan sistem fase terbalik dengan fase diam kolom C-18 dan fase gerak yang berssifat polar sehingga senyawa yang terelusi lebih dulu bersifat lebih polar dibandingkan yang lainnya. Tabel 5 menunjukkan bahwa pada pemisahan standar kuersetin terelusi lebih dulu dengan waktu retensi sekitar 5.6 menit dari pada kaempferol dengan waktu retensi sekitar 9.2 menit. Pemisahan keempat ekstrak juga menunjukkan puncak-puncak dengan hasil yang serupa sehingga dapat dikatakan bahwa keempat ekstrak mengandung kaempferol dan kuersetin. Perhitungan konsentrasi kaempferol dan kuersetin pada sampel dapat dilihat pada Lampiran 5.
Tabel 5 Penentuan konsentrasi kaempferol dan kuersetin pada sampel dengan KCKT
Ekstrak
Waktu retensi
(menit) Luas puncak Konsentrasi (%)
Kaem-Ekstrak yang mengandung kaempferol terbanyak ialah ekstrak S1 yakni 0.03% (mg kaempferol/mg ekstrak), sedangkan ekstrak dengan kandungan kuersetin terbanyak ialah ekstrak Sn1 yakni 2.15% (mg kuersetin/mg ekstrak). Kandungan kaempferol pada ekstrak Sn1 tidak jauh berbeda dengan S1, tetapi memiliki nilai LC50 yang jauh berbeda. Ekstrak Sn1 memiliki nilai LC50 sebesar 41.21 ± 9.84 ppm, sedangkan ekstrak S1 memiliki nilai LC50 sebesar 1340.81 ± 156.47 ppm. Perbedaan yang besar antara kedua nilai LC50 tersebut menunjukkan bahwa ekstrak Sn1 lebih toksik dari pada ekstrak S1 sehingga pemilihan ekstrak Sn1 dianggap lebih baik karena memiliki nilai LC50 yang jauh lebih kecil dari pada ekstrak S1 dengan perbedaan kadar kaempferol yang tidak jauh berbeda. Hasil tersebut memperlihatkan bahwa maserasi langsung daun jambu biji dengan bantuan sonikasi menggunakan pelarut metanol-air (85:15) merupakan teknik ekstraksi terbaik untuk isolasi kaempferol dan kuersetin pada daun jambu biji.
12
Gambar 4 Struktur senyawa (a) mirisetin, (b) kuersetin, dan (C) kaempferol Penelitian sebelumnya, Koo dan Mohamed (2011) menyatakan bahwa dalam buah jambu biji terkandung mirisetin sebanyak 549.5 mg/kg sampel kering, dan penelitian Wang et al. (2010) menyatakan bahwa daun jambu biji mengandung senyawa flavonoid seperti kaempferol, guaijaverin, mirisetin, dan apigenin. Hasil penelitian tersebut menunjukkan bahwa puncak yang pertama terelusi pada keempat ekstrak diduga merupakan senyawa mirisetin.
SIMPULAN DAN SARAN
Simpulan
Teknik ekstraksi terbaik untuk mengisolasi kaempferol dan kuersetin dari daun jambu biji adalah maserasi dengan bantuan sonikasi menggunakan pelarut metanol-air (85:15) dengan kandungan kaempferol sebesar 0.02% dan kuersetin sebesar 2.15%.
Saran
Perlu dilakukan fraksionasi terhadap ekstrak terbaik agar diperoleh senyawa kaempferol dan kuersetin murni dan dilakukan pengukuran kadar kaempferol hasil fraksionasi dengan KCKT sehingga diketahui kadar kaempferol sebelum dan sesudah fraksionasi.
DAFTAR PUSTAKA
[AOAC] The Association of Official Analytical Chemist. 2006. Official Methods of Analysis. Ed ke-18. Washington DC (US): Association of Official Analytical Chemist.
[BPOM] Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta (ID): BPOM RI.
[KEPMENKES] Keputusan Menteri Kesehatan. 1994. Persyaratan Obat Tradisional. Kementrian Kesehatan Republik Indonesia.
13 Arima H, Danno G (2002). Isolation of antimicrobial compounds from guava (Psidium guajava L.) and their structural elucidation. Biosci Biotechnol Biochem. 66(8):1727-1730.
Agustinus. 2009. Studi hematologis potensi metabolik jambu biji merah (Psidium guajava L.) pada penderita demam berdarah dengue [skripsi]. Bogor(ID): Institut Pertanian Bogor.
Chen HY, Yen GC. 2007. Antioxidant activity and free radical-scavenging capacity of extract from guava (Psidium guajava L.) leaves. Food Chem. 101:689-694. Duenas M, Manzano SO, Paramas AG, Buelga SC. 2009, Antioxidant evaluation of O-methylated metabolites of catechins, epicatechin, and quersetin. J Pharm Biomed Anal. 51:443-449.
Erosa-Rejon G, Pena-Rodriguez LM, Sterner O. 2010. Isolation of kaempferol-3-rutinoside from the leaf extract of Sideroxylon foetidissimum Subsp. Gaumeri. Rev Latinoamer Quim. 38(1):8-11.
Guimarães-Beelen PM, Berchielli TT, Beelen R, Filho JA, de Oliveira SG. 2006. Characterization of condensed tannins from native legumes of the brazilian northeastern semi-arid. Sci Agric. 6(36):522-528.
Hamidah S. 2006. Rendemen dan kadar tanin kulit kayu bakau (Rhizophora mucronata Lamck) dari daerah Takisung. JHT.18:15-23.
Harborne JB. 2006. Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, Soediro I, penerjemah. Bandung(ID): ITB Pr. Terjemahan dari: Phytochem Methods.
Hsieh CL, Lin YC, Yen GC, Chen HY. 2007. Preventive effects of guava (Psidium guajava L.) leaves and its active compounds against α-dicarbonyl compounds-induced blood coagulation. Food Chem. 103:528-535.
Jang M, Jeong SW, Cho SK, Ahn KS, Kim BK, Kim JC. 2013. Anti-inflammatory effects of 4 medicinal plant extracts in lipopolysaccharide-induced RAW 264.7 cells. Food Sci Biotechnol. 22(5):213-220.
Kim SH, Cho SK, Hyun SH, Park HE, Kim YS. 2011. Metabolic profiling and predicting the free radical scavenging activity of guava (Psidium guajava L.) leaves according to harvest time by 1H-nuclear magnetic resonance spectroscopy. Biosci Biotechnol Biochem. 75:1090-1097.
Krishnaraju AV, Rao TVN, Sundararaju D, Vanisree M, Tsay HS, Subbaraju GV. 2005. Assessment of bioactivity of Indian medicinal plants using brine shrimp (Artemia salina) lethality assay. Int J Appl Sci Eng. 3(2):125-134.
Koo HM, Mohamed S. 2001. Flavonoid (myricetin, quercetin, kaempferol, luteolin, and apigenin) content of edible tropical plants. J Agric Food Chem. 49(6): 3106–3112.
Loizzo MR, Said A, Tundis R, Rashed K, Statti GA, Hufner A, Menichini F. 2007. Inhibition of Angiotensin Converting Enzyme (ACE) by flavonoids isolated from Ailanthus excelsa (Roxb) (Simaroubaceae). Phytother Res. 21:32-36. Meyer BN, Ferrigni NR, Putnam JE, Jacobson LB, Nichols DE, McLaughlin JL.
1982. Brine shrimp: a convenient general bioassay for active plant constituents. Planta Med. 45:31-34.
Murtijaya J, Lim YY. 2007. Antioxidant properties of Phylanthus amarus extracts as affected by different drying methods. Food Sci Technol. 40:1664-1669. Nurrochmad A. 2001. Sintesis Kurkumin, Bisdemetoksi kurkumin,
14 sel myeloma, dan sel mononuklear normal secara in vitro [tesis]. Yogyakarta
(ID): Universitas Gajah Mada.
Parveen Z, Deng Y, Saeed MK, Dai R, Ahamad W, Yu YH. 2007. Antiinflammatory and analgesic activities of Thesium chinense turez extracts and its major flavonoids, kaempferol and kaempferol-3-O-glucoside. Yakugaku Zasshi. 127(8):1275-1279.
Rao YK, Geethangili M, Chan HS, Wu WS, Tzeng YM. 2009. High-performance liquid chromatographic determination of kaempferol glucosides in Cinnamomum osmophloeum leaves. Intr J Appl Sci Eng. 7(1):1-9.
Sulastri T. 2009. Analisis kadar tanin ekstrak air dan ekstrak etanol pada biji
pinang sirih (Areca Catechu. L). J Chem. 10(1):59-63
Syaefudin. 2008. Aktivitas antioksidan formula ekstrak jati belanda (Guazuma ulmifolia Lamk.), jambu biji (Psidium guajava Linn.), dan salam (Eugenia polyantha Wight.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Tang Y, Lou F, Wang J, Li Y, dan Zhuang S. 2001. Coumaryl flavonol glycosides from the leaves of Ginko biloba. Phytochemistry. 58:1251-1256.
Teffo LS, Aderogba MA, Eloff JN. 2010. Antibacterial and antioxidant activities of four kaempferol methyl ethers isolated from Dodonaea viscosa Jacq. Var. angustifolia leaf extracts. S Afr J Bot. 76:25-29.
Wang H, Du YJ, Song HC. 2010. α-Glucosidase and α-amylase inhibitory activities of guava leaves. Food Chem. 123:6-13.
Wang H, Helliwel K. 2001. Determination of flavonols in green and black tea leaves and green tea infusions by high-performance liquid chromatography. Food Res Int. 34:223-227.
Wu JW, Hsieh CL, Wang HY, Chen HY. 2009. Inhibitory effects of guava (Psidium guajava L.) leaf extracts and its active compounds on the glycation process of protein. Food Chem. 113:78-84.
Yen CT, Hsieh PW, Hwang TL, Lan YH, Chang FR, Wu YC. 2009. Flavonol glycosides from Muehlenbeckia platyclada and their anti-inflammatory activity. Chem Pharm Bull. 57(3):280-282.
Yu SF, Sun CT, Chen TM, Chen YH. 2006. 3-O-β-D-Glucosyl-(1→6)-β-D- Glucosyl-kaempferol isolated from Sauropus androgenus reduces body weight gain in wistar rats. Bio Pharm Bull. 29(12):2510-2513.
15
Lampiran 1 Diagram alir penelitian
LA
16 Lanjutan Diagram alir penelitian
Silika gel (n-heksana-etil asetat 2:98)
KCKT (asetonitril 30% dalam buffer KH2PO4 0.025 M pH 2.5)
Ekstrak
Uji BSLT
Ekstrak terpilih Kadar fenol
total Kadar tanin total flavonoid total Kadar
KLT
18 Lampiran 3 Perhitungan data kadar air daun jambu biji
Ulangan Bobot daun awal (g) Bobot daun akhir (g) Kadar air (%)
Lampiran 4 Perhitungan % rendemen Cara
Keterangan: banyaknya (+) menunjukkan intensitas noda kaempferol dan kuersetin pada KLT
Contoh perhitungan (ekstrak M1) % rendemen
Bobot sampel daun: 100.0069 g Bobot ekstrak: 21.6113 g
19
Rendemen % = 100.0069 1-0.053121.6113 × 100%= 22.82%
Lampiran 5 Perhitungan konsentrasi kaempferol dan kuersetin pada sampel Contoh perhitungan (ekstrak Sn1)
Konsentrasi kaempferol = luas puncak sampelluas puncak standar×konsentrasi standar Konsentrasi kaempferol = 31789742612 ×5 ppm
Konsentrasi kaempferol = 0. 03 ppm Konsentrasi kaempferol (%)
= konsentrasi (ppm)×volume×10bobot estrak (mg) -3L/mL×100% =0. 03 mg/L ×10 mL×1030.2 mg -3L/mL×100% =0.02%
Contoh perhitungan (ekstrak Sn1)
Konsentrasi kuersetin=luas puncak sampelluas puncak standar×konsentrasi standar Konsentrasi kuersetin=5074195390065 ×5 ppm
Konsentrasi kuersetin= 65.0429 ppm Konsentrasi kuersetin (%)
20
RIWAYAT HIDUP
Penulis dilahirkan di Klaten pada tanggal 27 November 1991 sebagai putri pertama dari Bapak Supardiyono dan Ibu Nunuk Parmini. Penulis lulus dari SMA Negeri 1 Pamulang pada tahun 2009 dan pada tahun yang sama diterima di Analisis Kimia Program Diploma Institut Pertanian Bogor (IPB). Penulis lulus dari Diploma IPB dengan predikat Sangat Memuaskan pada tahun 2012 dan melanjutkan pendidikan S1 melalui Program Alih Jenis Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB pada tahun 2012.