PENGARUH LANJUT BIOAKUMULASI INSEKTISIDA
ENDOSULFAN TERHADAP PERTUMBUHAN DAN
KONDISI HEMATOLOGIS IKAN MAS
(Cyprinus carpio)
IMAM TAUFIK
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
IMAM TAUFIK.
Pengaruh Lanjut Bioakumulasi Insektisida Endosulfan Terhadap
Pertumbuhan dan Kondisi Hematologis Ikan Mas
(Cyprinus carpio)
. Dibawah bimbingan
Dr. Ir. Eddy Supriyono, MSc.; Dr. Ir. Kukuh Nirmala, MSc.; dan Dr. Santosa
Koesoemadinata, MSc.
Penelitian bertujuan untuk mengetahui pengaruh lanjut dari bioakumulasi
insektisida endosulfan (C
6H
6Cl
6O
3S) terhadap laju pertumbuhan dan kondisi hematologis
ikan mas. Penelitian dilakukan dalam enam taha p, yaitu: Uji stabilitas bahan aktif; Uji
penentuan kisaran konsentrasi lehal; Uji definitif; Uji biokonsentrasi; Uji bioeliminasi; dan
Uji subletal. Penelitian disusun dalam Rancangan Acak Lengkap dengan menggunakan
wadah berupa akuarium kaca.
Bahan uji yang digunakan adalah formulasi insektisida dengan bahan aktif
endosulfan yang berbentuk cairan berwarna kuning bening yang dapat larut dalam aseton.
Hewan uji berupa ikan mas
(Cyprinus carpio)
stadia juvenil dengan ukuran bobot 0,81
±
0,098 g/ekor yang diperoleh dari hasil pemijahan secara terkontrol. Sebelum digunakan
hewan uji diadaptasikan selama 12 hari dalam kondisi laboratorium dan diberi pakan pellet
dengan kandungan protein
±
43,96%.
Pada uji stabilitas diaplikasikan endosulfan dengan konsentrasi 2,42 µg/l dalam air,
kemudian diambil sample air pada jam ke 0, 24, 48, 72, dan 96 jam. Sample yang diperoleh
selanjutnya di ekstraksi dan diidentifikasi menggunakan gas kromatografi (GC). Pada uji
penentuan kisaran konsentrasi letal diaplikasikan 4 deret konsentrasi uji, yaitu: 0 (kontrol);
0,1; 1,0; 10,0 µg/l. Ikan uji sebanyak 10 ekor/wadah dengan pengamatan mortalitas pada
jam ke: 0, 24, dan 48 jam setelah aplikasi. Pada uji definitif diaplikasikan 7 deret
konsentrasi, yaitu: 0 (kontrol); 1,4; 1,9; 2,7; 3,7; 5,2; dan 7,2 µg/l. Ikan uji sebanyak 10
ekor per wadah dengan waktu pengamatan pada jam ke: 2, 4, 6, 8, 12, 24, 48, 72 dan 96
jam setelah aplikasi.
Pada uji bioakumulasi diaplikasikan 3 konsentrasi endosulfan sebesar 10, 30, dan
50% dari nilai LC
50-96 jam dengan nilai konsentrasi, yaitu: 0 (kontrol); 0,24; 0,72; dan 1,20
µg/l dalam air. Ikan mas dipelihara dengan kepadatan 0,5 ekor/liter air atau 20 ekor dalam
40 liter air. Selama pemaparan ikan uji diberi pakan secara
at satiation
serta dilakukan
pergantian air setiap 24 jam dengan konsentrasi bahan uji yang sama. Parameter yang
diukur adalah: laju pertumbuhan, efisiensi pakan dan kondisi hematologis. Untuk
kebutuhan analisa residu, sample ikan dan air diambil pada jam ke: 0, 4, 12, 24, 48, 96,
144, 192, 264 pemaparan. Sample selanjutnya diekstraksi dan dipekatkan dalam 10 ml
aceton p.a untuk selanjutnya diidentifikasi menggunakan GC.
air bersih tanpa bahan uji
(clean water)
. Pengambilan ikan uji dilakukan pada hari ke 0, 5,
10 dan 15 pemeliharaan untuk selanjutnya diekstraksi dan diidentifikasi menggunakan GC
dengan prosedur yang standar. Pada semua tahapan penelitian dilakukan pengukuran sifat
fisika-kimia air yang meliputi: suhu, pH, O
2terlarut, CO
2dan amonia, untuk mengetahui
kelayakannya sebagai media uji.
Data uji stabilitas dianalisis secara regresi dan deskriptif, data uji penentuan kisaran
konsentrasi letal dianalisis secara deskriptif, sedangkan data uji definitif dianalisis dengan
bantuan program “probit analysis”. Residu endosulfan dalam ikan dan air dianalisis
menurut petunjuk Komisi Pestisida (1977), laju penyerapan dan eliminasi ditentukan
menurut petunjuk Specie dan Hamelink (1995), biokonsentrasi faktor dihitung menurut
persamaan Montanes dan Hattum (1995). Untuk menghitung pertumbuhan digunakan
persamaan Ricker (1975), sedangkan penentuan efisiensi pakan dihitung berdasarkan
persamaan NRC (1983). Data yang diperoleh dari uji subletal dianalisis ragam dengan
bantuan program statistik RPSS 10.0 for Window.
Hasil penelitian menunjukkan bahwa rata-rata laju peluruhan endosulfan dalam air
adalah sebesar 0,81% per jam. Kisaran konsentrasi endosulfan terhadap ikan mas antara 1
µg/l (ambang bawah) dan 10 µg/l (ambang atas) dengan nilai LC
50-96 jam sebesar 2,42
(2,206 – 2,652)
µg/l pada limit kepercayaan 95%. Bioakumulasi endosulfan dalam tubuh
ikan mas yang dipaparkan pada konsentrasi 0,24; 0,72; dan 1,20 µg/l secara berurutan
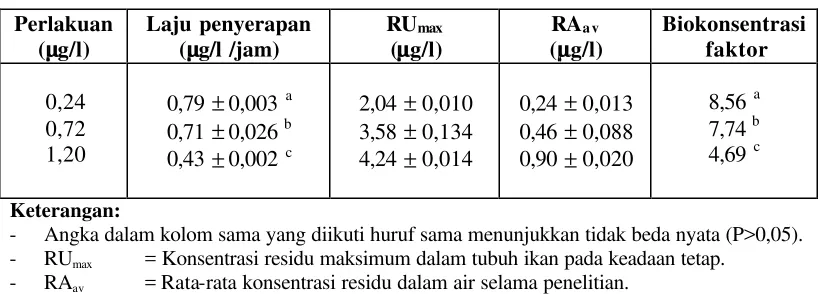
sebesar 2,04; 3,58 dan 4,24 µg/kg dengan laju penyerapan sebesar 0,79; 0,71; dan 0,43 µg/l
per jam, serta nilai biokonsentrasi faktor (BCF) sebesar 8,56; 7,74 dan 4,69. Melalui
analisis statistik terhadap data tersebut diketahui bahwa bioakumulasi endosulfan secara
nyata berpengaruh terhadap laju penyerapan dan nilai BCF dalam tubuh ikan mas.
Bioakumulasi endosulfan dalam tubuh ikan mas sebesar 2,04 µg/kg secara nyata
menurunkan jumlah eritrosit; bioakumulasi sebesar 3,58 µg/kg mengurangi jumlah leukosit
dan mereduksi pertumbuhan; dan pada konsentrasi bioakumulasi 4,24 µg/kg secara nyata
meningkatkan kadar hematokrit dan hemoglobin dalam darah ikan mas.
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis dengan judul :
PENGARUH LANJUT BIOAKUMULASI INSEKTISIDA ENDOSULFAN
TERHADAP PERTUMBUHAN DAN KONDISI HEMATOLOGIS
IKAN MAS
(Cyprinus carpio)
adalah benar merupakan hasil karya sendiri dan belum pernah dipublikasikan.
Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas
dan dapat diperiksa kebenarannya.
Bogor, Desember 2005
PENGARUH LANJUT BIOAKUMULASI INSEKTISIDA
ENDOSULFAN TERHADAP PERTUMBUHAN DAN
KONDISI HEMATOLOGIS IKAN MAS
(Cyprinus carpio)
IMAM TAUFIK
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Ilmu Perairan
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pengaruh Lanjut Bioakumulasi Insektisida Endosulfan Terhadap Pertumbuhan dan Kondisi Hematologis Ikan Mas
(Cyprinus carpio).
Nama : Imam Taufik
NRP : C 051020101
Program Studi : Ilmu Perairan (AIR)
Menyetujui,
1. Komisi Pembimbing
Dr. Ir. Eddy Supriyono, M.Sc. Ketua
Dr. Ir. Kukuh Nirmala, M.Sc. Dr. Santosa Koesoemadinata, M.Sc.
Anggota Anggota
Mengetahui,
2. Ketua Program Studi Ilmu Perairan 3. Dekan Sekolah Pascasarjana
Dr. Chairul Muluk, M.Sc. Prof. Dr. Ir. Sjafrida Manuwoto, M.Sc.
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 9 Juli 1967 sebagai putera ke lima dari
pasanga n H. Ali Muchtar (Alm) dan Yuhana (Almh). Jenjang pendidikan sampai
dengan tingkat menengah atas, berturut -turut diselesaikan pada SD Negeri 1 Kotabatu,
SMP Negeri 2, dan SMA Negeri 1 di Bogor. Pendidikan Strata 1 (S1) ditempuh pada
Jurusan Perikanan, Fakultas Peternakan Universitas Hasanuddin – Ujung Pandang dan
lulus pada tahun 1992.
Tahun 1994 sampai 1997 penulis bekerja sebagai Staf Peneliti pada Loka
Penelitian Perikanan Pantai, Pusat Penelitian Perikanan Budidaya, di Gondol – Bali dan
tergabung dalam kelompok peneliti Penyakit Ikan. Tahun 1997 sampai sekarang,
penulis bekerja sebagai Staf Peneliti pada Balai Riset Perikanan Budidaya Air Tawar,
Pusat Riset Perikanan Budidaya, di Bogor dan tergabung dalam kelompok peneliti
Lingkungan Budidaya & Toksikologi. Pada tahun 2002, penulis melanjutkan studi S2
pada Program Studi Ilmu Perairan (AIR), Program Pascasarjana Institut Pertanian
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT, yang selalu melimpahkan
berkah dan hidayah-Nya sehingga penulis masih diberi kekuatan untuk melakukan
segala aktivitas yang Insya Allah senantiasa ditujukan untuk mencari Ridho-Nya.
Tesis dengan judul “Pengaruh Lanjut Bioakumulasi Insektisida Endosulfan
terhadap Pertumbuhan dan Kondisi Hematologis Ikan Mas (Cyprinus carpio)”
merupakan hasil penelitian yang disusun sebagai salah satu syarat yang dibebankan
kepada penulis untuk memperoleh gelar Magister Sains pada Program Pascasarjana
Institut Pertanian Bogor. Penulis berharap hasil penelitian ini dapat memberi kontribusi
dan sumbangsih bagi kepentingan pengelolaan lingkungan, khususnya yang berkaitan
dengan pencemaran pestisida pada sumberdaya perikanan.
Selama menjalani masa perkuliahan, pelaksanaan penelitian hingga selesainya
penulisan tesis ini, penulis telah mendapat dukungan dan bantuan dari berbagai pihak,
untuk itu penulis menghaturkan terima kasih. Secara khusus ungkapan terima kasih
yang sebesar-besarnya dan penghargaan yang setinggi-tingginya penulis haturkan
kepada:
1. Istriku tercinta Fetty Fatimah serta kedua putri-permata hatiku Iffi Rizkiya dan
Fitta Fairuz Rahmani, atas segenap cinta dan ketulusan hati nan ikhlas yang
telah dengan setia mendampingi penulis selama melaksanakan kuliah hingga
selesai dan Insya Allah untuk selamanya.
2. Yang mulia: Apih (alm), Bapak dan Ummi yang telah memberikan do’a tulus
sehingga penulis mendapat kekuatan lahir dan keteguhan bathin selama
menjalani proses perkuliahan.
3. Bapak Dr. Ir. Eddy Supriyono, M.Sc. sebagai ketua Komisi Pembimbing, Bapak
Dr. Ir. Kukuh Nirmala, M.Sc. dan Bapak Dr. Santosa Koesoemadinata, M.Sc.
sebagai Anggota Komisi Pembimbing, yang telah meluangkan waktu, tenaga,
pemikiran bahkan materi untuk membantu, mengarahkan dan membimbing
4. Bapak Dr. Chairul Muluk, M.Sc. sebagai Ketua Program Studi Ilmu Perairan
beserta seluruh Staf Dosen PPs-IPB yang telah memberikan arahan, materi
kuliah serta bantuan administrasi selama penulis mengikuti perkuliahan.
5. Bapak Dr. S. Djokosetyanto, M.Sc. selaku Penguji Luar Komisi Pembimbing
yang telah memberi pengarahan, masukan dan saran guna perbaikan tesis ini.
6. Bapak Drs. Sutrisno yang tak henti-hentinya memberi dukungan moril serta
bantuan materil yang sangat besar sehingga penulis dapat melaksanakan dan
menyelesaikan kuliah.
7. Bapak Dr. Asep Nugraha Ardiwinata, M.Si, Bapak Eman Sulaeman dan Bapak
Aji M. Tohir yang telah membantu menganalisis sample penelitian di
Laboratorium Toksikologi Balai Penelitian Bioteknologi dan Sumberdaya
Genetika Pertanian, Bogor.
8. Teman-teman Program Studi Ilmu Perairan PPs-IPB: Ahmad Jauhari, Amrulla,
Wahidah, Desi, Esti, Ricky serta yang lainnya, atas kerjasama, spirit dan
kekompakannya.
9. Berbagai pihak yang belum disebutkan di atas dan telah membantu.
Akhir kata, Wabillahi Taufik Wal Hidayah Wassalamualaikum Warohmatullahi
Wabarokaatuh.
Bogor, Desember 2005
DAFTAR ISI
halaman.
HALAMAN PENGESAHAN ……… i.
RIWAYAT HIDUP ……… ii.
PRAKATA ……… iii.
DAFTAR ISI ……… v.
DAFTAR TABEL ………. vii.
DAFTAR GAMBAR ………. viii.
DAFTAR LAMPIRAN ………. ix.
PENDAHULUAN Latar Belakang ……… 1.
Pendekatan Masalah ……… 4.
Hipotesis ……… 5.
Tujuan Penelitian ……… 5.
Manfaat Penelitian ……… 5.
TINJAUAN PUSTAKA Pestisida ……… 6.
Keberadaan Pestisida di Lingkungan Perairan ……… 7.
Insektisida Organoklorin ……… 12.
Endosulfan ……… 12.
Penyerapan dan Eliminasi ……… 15.
Pertumbuhan ……… 16.
Darah Ikan ……… 17.
Hematokrit ……… 17.
Hemoglobin ……… 18.
Sel darah merah (eritrosit) ……… 19.
Sel darah putih (leukosit) ……… 19.
Kualitas Air ……… 20.
METODE PENELITIAN Waktu dan Tempat ……… 22.
Bahan dan Alat ……… 22.
Persiapan Penelitian Wadah dan media …….……….. 23.
Ikan uji ……… 23.
Media uji ……… 24.
Pelaksanaan Penelitian Uji stabilitas endosulfan dalam a ir ……… 24.
halaman.
Uji toksisitas letal ……… 25.
Uji bioakumulasi ……… 26.
Uji bioeliminasi ……… 27.
Bioakumulasi terhadap pertumbuhan ……… 28.
Bioa kumulasi terhadap kondisi hematologis ……… 29.
Kadar hematokrit (Ht) ……… 29.
Kadar hemoglobin (Hb) ……… 30.
Jumlah sel darah merah (eritrosit) ……… 30.
Jumlah sel darah putih (leukosit) ……… 31.
Analisis Data ……… 31.
HASIL DAN PEMBAHASAN Hasil Penelitian Uji stabilitas endosulfan dalam air ………. 34.
Toksisitas letal: Nilai LC50 ………. 35.
Uji bioakumulasi endosulfan ………. 37.
Uji bioeliminas i endosulfan ………. 39.
Pertumbuhan ikan ………. 40.
Efisiensi pakan ………. 42.
Kondisi hematologis ………. 43.
Kualitas air ………. 45.
Pembahasan ………. 46.
KESIMPULAN DAN SARAN Kesimpulan ……..……….. 59.
Saran ……..……….. 59.
DAFTAR PUSTAKA ………...……… 60.
DAFTAR TABEL
halaman.
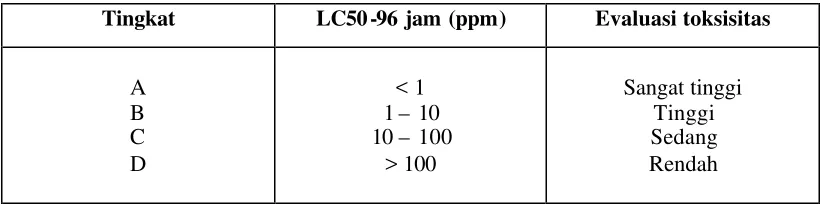
Tabel 1. Klasifikasi pestisida berdasarkan toksisitasnya terhadap ikan ………. 9.
Tabel 2. Nilai LC50 insektisida endosulfan terhadap ikan mas
pada setiap waktu pemaparan ……… 36.
Tabel 3. Model persamaan laju penyerapan insektisida endosulfan ke dalam tubuh ikan mas pada masing-masing
konsentrasi perlakuan ……….. 38.
Tabel 4. Nilai laju penyerapan dan biokonsentrasi faktor insektisida
endosulfan terhadap ikan mas pada masing-masing perlakuan ……….. 39.
Tabel 5. Pertumbuhan ikan mas pada berbagai konsentrasi bioakumulasi
endosulfan setelah 12 minggu pemaparan ……… 41.
Tabel 6. Rata-rata nilai efisiensi pakan (%) ikan mas pada masing-masing perlakuan selama 12 minggu pemaparan ……… 43.
Tabel 7. Rata-rata kadar hematokrit, hemoglobin, eritrosit dan leukosit ikan mas dengan bioakumulasi insektisida endosulfan
yang berbeda setelah 12 minggu pemaparan ……….. 43.
Tabel 8. Kisaran sifat fisika-kimia air pada uji toksisitas letal
DAFTAR GAMBAR
halaman.
Gambar 1. Dinamika pestisida dalam lingkungan ……… 10.
Gambar 2. Konsekwensi penggunaan herbisida terhadap ekologi perairan. …. 11.
Gambar 3. Struktur kimia endosulfan ………. 14.
Gamba r 4. Prosentase peluruhan konsentrasi endosulfan dalam air
pada setiap waktu pemaparan ……….. 34.
Gambar 5. Nilai LC50 insektisida endosulfan terhadap ikan mas
untuk setiap waktu pemaparan ……….. 36.
Gambar 6. Penyerapan endosulfan ke dalam tubuh ikan mas yang dipaparkan dalam larutan endosulfan sebesar 10% x LC50-96 jam dengan konsentrasi aktual
rata-rata dalam air sebesar 0,24 (± 0,013) µg/l ……… 37.
Gambar 7. Penyerapan endosulfan ke dalam tubuh ikan mas yang dipaparkan dalam larutan endosulfan sebesar 30% x LC50-96 jam dengan konsentrasi aktual
rata-rata dalam air sebesar 0,46 (± 0,088) µg/l ……….. 37.
Gambar 8. Penyerapan endosulfan ke dalam tubuh ikan mas yang dipaparkan dalam larutan endosulfan sebesar 50% x LC50-96 jam dengan konsentrasi aktual
rata-rata dalam air sebesar 0,91 (± 0,020) µg/l ………..……… 38.
Gambar 9. Eliminasi endosulfan dari tubuh ikan mas yang telah dipaparkan dalam larutan insektisida endosulfan sebesar 30% x LC50-96 jam dengan konsentrasi rata-rata
bioakumulasi sebesar 3,58 µg/kg ………. 40.
Gambar 10. Pertambahan bobot rata-rata individu ikan mas
DAFTAR LAMPIRAN
halaman.
Lampiran 1. Prosedur analisis residu insektisida endosulfan
pada sample air ………... ……….. 66.
Lampiran 2. Prosedur analisis residu insektisida endosulfan
pada sample daging ikan ………. 67.
Lampiran 3. Mortalitas ikan mas (ekor) pada uji pendahuluan
setelah waktu pemaparan (jam) ……… 68.
Lampiran 4. Motalitas ikan mas (ekor) pada uji lanjutan (definitife test) untuk setiap konsentrasi perlakuan (µg/l)
setelah waktu pemaparan (jam) ……….. 69.
Lampiran 5. Analisis probit (Wallace, 1982) untuk menentukan nilai
LC50-24 jam insektisida endosulfan terhadap ikan mas ………….. 70.
Lampiran 6. Analisis probit (Wallace, 1982) untuk menentukan nilai
LC50-48 jam insektisida endosulfan terhadap ikan mas ………….. 70.
Lampiran 7. Analisis probit (Wallace, 1982) untuk menentukan nilai
LC50-72 jam insektisida endosulfan terhadap ikan mas ………….. 71.
Lampiran 8. Analisis probit (Wallace, 1982) untuk menentukan nilai
LC50-96 jam insektisida endosulfan terhadap ikan mas ………….. 71.
Lampiran 9. Analisis statistik terhadap laju penyerapan (Ku) dan biokonsentrasi faktor (BCF) insektisida endosulfan
ke dalam tubuh ikan mas ………. 72.
Lampiran 10. Bobot biomas ikan mas (g) yang dipaparkan dengan berbagai konsentrasi bioakumulasi insektisida endosulfan
selama 12 minggu ………. 73.
Lampiran 11. Bobot biomas ikan mas (g) yang dipaparkan dengan berbagai konsentrasi bioakumulasi insektisida endosulfan
selama 12 minggu (transformasi logaritma natural) ……..……….. 74.
Lampiran 12. Bobot ikan mas (g/ekor) yang dipaparkan dengan berbagai konsentrasi bioakumulasi insektisida endosulfan
selama 12 minggu ……….………… 75.
Lampiran 13. Bobot ikan mas (g/ekor) yang dipaparkan dengan berbagai konsentrasi bioakumulasi insektisida endosulfan
halaman.
Lampiran 14. Laju pertumbuhan individu harian (%) ikan mas yang dipaparkan dengan berbagai konsentrasi bioakumulasi insektisida endosulfan pada setiap
periode pemaparan (bulan) ………… ………... 77.
Lampiran 15. Data efisiensi pakan harian (FE) ikan mas yang dipaparkan dengan berbagai konsentrasi bioakumulasi insektisida
endosulfan selama 12 minggu pemaparan ……….. 78.
Lampiran 16. Analisis statistik terhadap laju pertumbuhan individu (SGR) dan efisiensi pakan (FE) ikan mas setelah pemaparan
12 minggu ………. 79.
Lampiran 17. Kadar hematokrit (Ht), hemoglobin (Hb), eritrosit dan leukosit ikan mas yang dipaparkan dengan berbagai konsentrasi bioakumulasi insektisida endosulfan
selama 12 minggu pemaparan ……… 80.
Lampiran 18. Analisis statistik terhadap data hematologis (hematokrit, hemoglobin, eritrosit, leukosit) ikan mas
setelah pemaparan 12 minggu ……… 81.
PENDAHULUAN
Latar Belakang
Pestisida dewasa ini mempunyai peranan yang penting khususnya dalam bidang
pertanian untuk memberantas jasad-jasad yang merusak tanaman dan hasil pertanian
yang disimpan. Usaha meningkatkan produksi pertanian, baik kuantitatif maupun
kualitatif, telah dipermudah dengan penggunaan pestisida (Soekardi et al., 1977).
Walaupun konsep “pest management” atau “integrated pest control” dilakukan,
dimana pestisida hendaknya digunakan sesedikit mungkin dan apabila diperlukan saja,
namun pada umumnya usaha proteksi tanaman dilakukan dengan pertimbangan bahwa
hama dan penyakit tanaman hanya dapat diberantas dengan mudah dan cepat dengan
menggunakan pestisida yang efektif, sekalipun keadaan ini hanya dicapai untuk
sementara. Oleh karena itu pemberantasan hama dan penyakit tanaman hampir
senantiasa diartikan sebagai penggunaan pestisida, sehingga bermacam-macam pestisida
banyak digunakan yang juga menimbulkan berbagai dampak negatif (Mulyani, 1973).
Meningkatnya penggunaan pestisida telah menimbulkan kekhawatiran karena
terjadinya hal-hal yang tidak diinginkan. Menurunnya kualitas lingkungan karena
kontaminasi oleh pestisida telah mengakibatkan timbulnya masalah-masalah baru yang
harus segera diatasi. Kematian ikan di sawah, kolam atau sungai, makin jarangnya
dijumpai jenis burung-burung tertentu, terjadinya resistensi hama maupun timbulnya
eksplosi hama sekunder antara lain diduga sebagai akibat penggunaan pestisida yang
Sifat penting yang dimilki suatu bahan aktif pestisida adalah daya racun atau
toksisitas. Meskipun bahan kimia tersebut hanya dimaksudkan untuk mematikan suatu
jenis hama tertentu tetapi pada hakekatnya bersifat racun untuk semua mahluk hidup.
Hampir semua jenis pestisida tidak bersifat selektif dan mempunyai spektrum yang luas
sebagai racun sehingga merupakan salah satu sumber pencemaran yang potensial
khususnya bagi sumberdaya dan lingkungan perairan perikanan.
Pestisida yang paling ideal adalah yang bersifat khusus dan dapat digunakan
secara selektif terhadap hama sasaran saja, namun di seluruh dunia belum dijumpai
pestisida yang demikian. Kebanyakan pestisida yang ada sebetulnya tidak bersifat
selektif karena pestisida digunakan pada suatu ekosistim yang rumit dan kompleks
sehingga setiap pemakaian pestisida juga dapat membunuh organisme bukan sasaran
atau paling tidak mengganggu kehidupannya (Kadarsan, 1977).
Endosulfan merupakan senyawa kimia dari golongan organoklorin yang banyak
dipergunakan di Indonesia sebagai bahan aktif dalam berbagai formulasi insektisida
yang diperdagangkan dengan beberapa nama dagang, antara lain: Thiodan, Fanodan,
Akodan, dan Termisidan (Komisi Pestisida, 1990). Penggunaan endosulfan di Indonesia
sebenarnya sudah dilarang sejak tahun 1996 melaui Surat Keputusan Menteri Pertanian
No. 473/KPTS/TP207/6/96, namun pada kenyataannya sampai saat ini masih banyak
digunakan oleh petani karena insektisida endosulfan cukup efektif mengendalikan hama
sasaran, harganya relatif murah dan mudah didapatkan (Sulaksono, 2001).
Seperti pestisida organoklorin pada umumnya, endosulfan bersifat toksik
terhadap organisme perairan termasuk ikan dan sangat persisten sehingga akan
Ekaputri (2001) membuktika n bahwa perairan sungai Ciliwung-Jawa Barat yang
mengalir melewati daerah Bogor, Depok dan Jakarta mengandung residu insektisida
endosulfan dengan konsentrasi berkisar antara 0,7-4,0 µg/l. Sedangkan Taufik et al.,
(2003) melaporkan bahwa perairan tambak serta saluran irigasi di Kabupaten
Brebes-Jawa Tengah telah tercemar oleh endosulfan yang berasal dari limbah pertanian dan
perkebunan dengan konsentrasi secara berturut-turut sebesar 2,7 mg/l dan 3,2 µg/l.
Ikan yang terpapar dalam air yang tercemar oleh endosulfan dalam konsentrasi
subletal akan menyerap bahan aktif tersebut melalui permukaan tubuh, membran insang
dan difusi kutikular. Penyerapan akan berlangsung secara terus menerus sampai tercapai
keadaan steady state yaitu kondisi dimana jumlah bahan uji yang diserap dan didepurasi
per satuan waktu seimbang pada suatu konsentrasi bahan dalam air (Nagel dan Loskill,
1991). Residu endosulfan dalam air yang terserap oleh ikan akan terakumulasi di dalam
jaringan tubuh melalui proses bioakumulasi, hal ini dis ebabkan karena endosulfan
termasuk insektisida golongan organoklorin yang memiliki sifat lipofilitas tinggi, yakni
mudah terikat dalam jaringan lemak.
Ikan mas (Cyprinus carpio) merupakan komoditas perikanan air tawar yang
paling banyak dibudidayakan di Indonesia, khususnya di daerah Jawa Barat. Ikan ini
berpotensi untuk terkontaminasi oleh insektisida endosulfan karena pada umumnya
dipelihara dalam kolam budidaya atau Karamba Jaring Apung (KJA) di waduk, dimana
sumber airnya berasal dari aliran sungai yang berhubungan langsung dengan berbagai
aktivitas pertanian yang banyak menggunakan pestisida.. Selain itu, ikan mas juga
mempunyai kandungan lemak cukup tinggi sehingga akan lebih mudah mengakumulasi
Pendekat an Masalah
Peningkatan penggunaan pestisida terutama dalam bidang pertanian telah
menyebabkan pencemaran pada berbagai perairan. Hal ini terjadi karena pada umumnya
aktivitas pertanian seperti tanaman padi di sawah akan menggunakan lingkungan
perairan sebagai tempat pembuangan limbah cair (run off) yang masih mengandung
residu pestisida. Akibat aktivitas tersebut maka lingkungan perairan tawar yang
merupakan sumber air untuk berbagai kegiatan budidaya perikanan dapat tercemar oleh
berbagai bahan aktif yang terkandung dalam formulasi pestisida.
Endosulfan merupakan senyawa organoklorin yang banyak digunakan sebagai
bahan aktif dalam formulasi insektisida pertanian. Penggunaan senyawa ini akan
meninggalkan residu dalam lingkungan biotik maupun abiotik karena degradasi
endosulfan sangat lambat di alam. Lebih lanjut, residu endosulfan mempunyai sifat
yang mudah larut dalam lemak (lipofilik) sehingga dapat terserap dan terakumulasi
dalam tubuh organisme (bioakumulasi) sehingga merupakan masalah dalam budidaya
perikanan air tawar.
Salah satu komoditi perikanan yang potensial tercemar oleh endosulfan adalah
ikan mas karena pada umumnya ikan jenis ini dibudidayakan dalam kolam dan KJA
dengan sumber air berasal dari sungai yang merupakan tempat pembuangan limbah cair
pertanian. Oleh karena itu perlu diketahui bahaya yang dapat timbul pada ikan mas
akibat terpapar dalam air yang tercemar endosulfan, baik pada konsentrasi letal maupun
subletal.
Estimasi toksisitas dan potensi bioakumulasi endosulfan serta pengaruh yang
hayati (bioassay), uji akumulasi, uji eliminasi dan uji subletal. Dalam kondisi subletal
pengaruh lanjut dari bioakumulasi insektisida endosulfan dapat berdampak pada
perubahan kondisi hematologis sehingga dalam jangka waktu tertentu akan berpengaruh
terhadap pertumbuhan ikan mas.
Hipotesis
Hipotesis yang digunakan dalam penelitian ini adalah sebagai berikut:
a). Insektisida endosulfan mempunyai toksisitas yang tinggi dan dapat terakumulasi di
dalam tubuh ikan mas.
b). Pengaruh lanjut dari bioakumulasi insektisida endosulfan pada konsentrasi tertentu
dapat menghambat pertumbuhan ikan mas.
c). Pengaruh lanjut bioakumulasi insektisida endosulfan dapat menyebabkan perubahan
pada kondisi hematologis ikan mas.
Tujuan Penelitian
Penelitian bertujuan untuk mengetahui pengaruh lanjut bioakumulasi insektisida
endosulfan terhadap laju pertumbuhan dan kondisi hematologis ikan mas.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat bermanfaat untuk menentukan konsentrasi
bioakumulasi insektisida endosulfan yang masih dapat ditolerir oleh ikan mas.
Informasi tersebut dapat digunakan sebagai acuan bagi penetapan batas maksimum
TINJAUAN PUSTAKA
Pestisida
Pestisida merupakan serangkaian senyawa alamiah dan sintetis berbagai unsur
kimia yang memiliki kemampuan untuk membunuh organisme pengganggu, terutama
ditujukan kepada jenis -jenis hama tertentu (Kusno, 1995). Menurut Lodang (1994)
penggunaan pestisida disamping dapat memberikan keuntungan juga dapat
menimbulkan kerugian (efek negatif). Keuntungan yang didapat antara lain: 1) dapat
meningkatkan produksi pertanian dan hasil penen yang cepat; 2) aplikasi di lapangan
relatif mudah; 3) dapat digunakan pada areal yang luas dalam waktu yang relatif
singkat; 4) dapat diaplikasikan setiap waktu, dengan memperhatikan cuaca; 5) dapat
diperoleh dengan mudah; 6) harga relatif murah dan memberikan keuntungan ekonomi.
Efek negatif yang ditimbulkan dari penggunaan pestisida adalah: 1) mempertinggi
resistensi hama sehingga memerlukan penggunaan pestisida yang lebih banyak dan
lebih kuat; 2) membunuh mahluk lain yang bukan sasaran, termasuk predator ala mi
yang berguna; 3) gangguan toksik pada manusia yang bertambah sehubungan dengan
bertambahnya volume dan intensitas penggunaan insektisida; 4) produk pertanian akan
mengandung residu pestisida yang dapat mengancam kesehatan para konsumen,
terutama petani dan keluarganya; 4) kontaminasi global akibat mobilitas yang tinggi,
terutama oleh pestisida persisten; 6) mengganggu keseimbangan dalam rantai makanan
sehingga akan mengganggu ekosistem secara keseluruhan; 7) bertambahnya resiko efek
sinergik interaksi antara bermacam-macam pestisida; 8) kemungkinan akan terjadi efek
Chau et al. (1982) menyatakan, pestisida dapat digolongkan menurut organisme
sasarannya, bahan asal pestisida, cara kerja serta formulasi bahan aktifnya. Berdasarkan
formulasi bahan aktifnya pestisida dapat dikelompokkan menjadi 6 golongan, yaitu:
organoklorin, organofosfat, karbamat, turunan asam fenoksi alkoloid, triazin dan
substansi urea. Berdasarkan kegunaannya pestisida da pat dibedakan menjadi:
insektisida, herbisida, fungisida, rodentisida, akarisida, bakterisida, ovisida, algasida,
nematosida dan molusisida (Ekha, 1993). Menurut struktur dan golongan zat kimianya
pestisida dibagi menjadi pestisida alamiah dan pestisida sintetik.
Dampak lingkungan penggunaan pestisida berkaitan erat dengan sifat dasar yang
penting terhadap efektifitasnya sebagai pestisida. Pertama, pestisida cukup beracun
untuk mempengaruhi seluruh kelompok taksonomi biota, termasuk mahluk bukan
sasaran, sampai batas tertentu tergantung pada faktor fisiologis dan ekologis. Kedua,
banyak jenis pestisida yang dapat bertahan terhadap degradasi lingkungan akibatnya
dapat bertahan dalam suatu daerah yang diberi perlakuan, sehingga keefektifannya
dapat diperkuat. Sifat ini juga memberikan pengaruh jangka panjang dalam ekosistim
alamiah (Connel dan Miller, 1995).
Keberadaan Pestisida Di Lingkungan Perairan
Perairan bertindak sebagai suatu tempat penampungan utama bagi residu
pestisida yang persisten. Masuknya pestisida ke dalam perairan melalui berbagai jalur,
antara lain: pemakaian langsung untuk membasmi hama tanaman, buangan limbah
perkotaan dan industri, limpasan dari areal persawahan, pencucian melalui tanah,
fase udara-air (Connel dan Miller, 1995). Penyebaran pencemaran pestisida dalam
lingkungan perairan sangat dipengaruhi oleh sejumlah proses pengangkutan interaktif,
seperti penguapan, presipitasi dari udara, pencucian da n pengaliran.
Aliran pembuangan pestisida beragam menurut laju arus air permukaan dan jenis
tanah, sedangkan pencucian mula -mula tergantung pada adsorpsi/desorpsi antara
konstituen tanah dan pergolakan air yang melaluinya (Robinson, 1973). Kelarutan suatu
bahan aktif pestisida di dalam air merupakan faktor penting yang akan menentukan
persistensinya di lingkungan perairan.
Residu pestisida tidak hanya terdifusi ke dalam tanah tetapi juga ke dalam air,
udara dan akhirnya akan mengkontaminasi rantai makanan kehidupan. Masalah ini
perlu mendapat perhatian serius karena residu pestisida (insektisida) ada yang bersifat
karsinogenik yang dapat mempengaruhi kesehatan manusia (Ardiwinata et al., 1999).
Pestisida yang masuk ke dalam perairan, terutama dari golongan klor-organik
akan diserap oleh sedimen dasar perairan, plankton, algae, invertebrata perairan,
tumbuhan air dan ikan. Insektisida klor-organik tidak larut dalam air dan residunya di
dalam perairan ditemukan dalam bentuk partikulat tersuspensi yang lebih ba nyak
terdapat dalam lumpur dan sedimen dasar perairan. Karena tidak larut dalam air maka
persistensinya di lingkungan perairan dapat berlangsung dalam waktu yang relatif lama.
Residu pestisida klor-organik yang diserap oleh hewan air dapat terakumulasi di dalam
jaringan tubuh karena pestisida tersebut memiliki sifat lipofitas yang tinggi sehingga
mudah terikat dalam jaringan lemak dan akumulasi residu pestisida klor-organik pada
ikan dipengaruhi oleh kandungan lemak (Edward, 1976). Ikan yang memiliki
Penyerapan residu pestisida yang terdapat dalam perairan oleh hewan air dapat
terjadi melalui berbagai cara, seperti mengkonsumsi makanan yang telah
terkontaminasi, pengambilan dari air melalui membran insang, difusi kutikular serta
penyerapan langsung dari sedimen (Livingstone, 1977). Kusno (1995) mengemukakan
bahwa penyerapan residu pestisida tergantung dari besarnya residu, sifat fisika -kimia,
sifat bioakumulatif dan toksisitasnya, maka keracunan yang ditimbulkannyapun dapat
bersifat akut maupun kronik. Menurut Edward (1976), rata -rata kenaikan residu
pestisida dalam hewan akuatik mempunyai korelasi dengan aktivitas metabolisme,
bobot badan, luas permukaan tubuh dan rantai makanannya.
Berkenaan dengan bahaya yang ditimbulkan oleh pestisida terhadap ikan, para
ahli telah mengklasifikasikan pestisida berdasarkan pada nilai LC5 0-96 jam :
Tabel 1. Klasifikasi pestisida berdasarkan toksisitasnya terhadap ikan
Tingkat LC50 -96 jam (ppm) Evaluasi toksisitas
A B C D
< 1 1 – 10 10 – 100
> 100
Sangat tinggi Tinggi Sedang Rendah
Tanah/sedimen: - Fotolisa
- Degradasi
Depsorpsi Leaching Run off
Tanaman:
- Toksik
- Residu
- Terurai
Herbivora
Omnivora
Karnivora
M A N U S I A
penguapan penguapan
Atmosfier: - Fotolisa
- Reaksi
Perairan : - Hidrolisa - Fotolisa
- Oksidasi
- Degradasi
mikroba
deposiosi basah & kering
Mikroplankton
Zooplankton
Ikan kecil
Ikan besar
pengendapan
Hama
Predator
Organisme
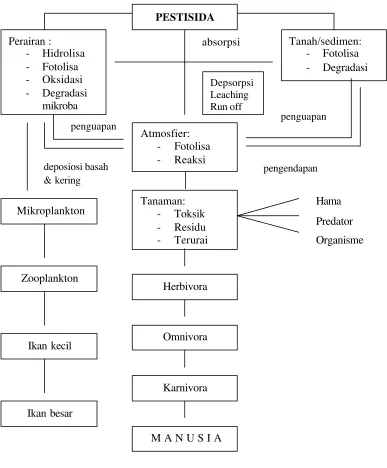
Gambar 1. Dinamika pestisida dalam lingkungan.
(Mustamin dan Ma’ruf, 1990 dalam Kusno, 1995).
absorpsi
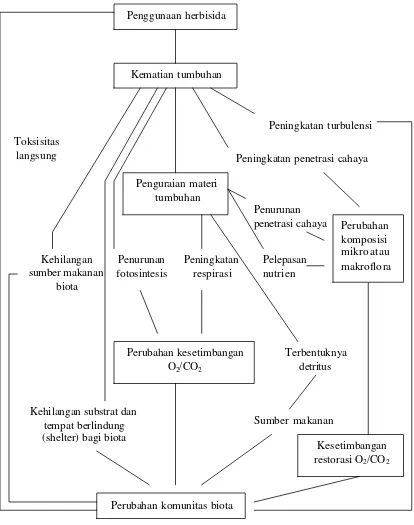
Pengaruh penggunaan pestisida (herbisida) terhadap ekologi perairan dapat
digambarkan secara skematik seperti di bawah ini.
Penggunaan herbisida
Kematian tumbuhan
Peningkatan turbulensi
Peningkatan penetrasi cahaya
Penguraian materi tumbuhan
Peningkatan respirasi
Perubahan kesetimbangan O2/CO2
Penurunan penetrasi cahaya
Pelepasan nutrien
Terbentuknya detritus
Sumber makanan
Kesetimbangan restorasi O2/CO2
Perubahan komunitas biota Kehilangan substrat dan
tempat berlindung (shelter) bagi biota
Penurunan fotosintesis Kehilangan
sumber makanan biota Toksisitas
langsung
Perubahan komposisi mikro atau makroflora
Insektisida Organoklorin
Insektisida organoklorin adalah suatu senyawa insektisida yang mengandung
atom karbon, klor, hidrogen dan kadang-kadang oksigen (Sastroutomo, 1992).
Golongan organoklorin dibagi menjadi tiga sub golongan utama yaitu
diklorodifenitrikloro etana (DDT), benzena heksaklorida (BHC) dan siklodiena.
Insektisida organoklorin merupakan kelompok pestisida paling persisten yang
pada dasarnya tidak mengalami perubahan di lingkungan dalam jangka waktu yang
lama (ADB, 1987). Insektisida organoklorin mempunyai kelarutan yang rendah di
dalam air dibanding dengan pelarut organik dengan ciri-ciri umum adalah:
- Mengandung atom-atom karbon, oksigen dan ikatan C-Cl
- Mempunyai karbon rantai siklik, termasuk cincin benzena
- Secara intermolekuler tidak memiliki tempat-tempat aktif
- Bersifat nonpolar dan lipofilik.
Senyawa organoklorin berdampak negatif di alam karena kemampuannya untuk
dapat bertahan lama di alam (persisten), bersifat racun karsinogen (dapat menyebabkan
kangker), juga mengganggu saluran pernafasan bila terjadi kontak fisik langsung
dengan kulit atau masuk melalui mulut dan berpengaruh terhadap sistim syaraf (Connel
dan Miller, 1995). Organoklorin sangat sulit larut di dalam air (daya larut dibawah 1
mg/l), hanya lindane yang daya larutnya mencapai 7 mg/l (Edwards, 1976).
Endosulfan
Endosulfan merupakan salah satu insektisida organoklorin golongan siklodien.
kegiatan pertanian dan kehutanan, diantaranya pertanian cabai, jagung, kopi, lada, tebu,
teh dan tembakau. Endosulfan diperdagangkan dengan beberapa nama dagang seperti:
Thiodan, Fanodan, Akodan, Termisidan dan lain-lain (Komisi Pestisida, 1990).
Endosulfan ini berbentuk pekatan berwarna coklat yang dapat diemulsikan dalam air.
Endosulfan mempunyai kelarutan yang rendah dalam air, tetapi larut dalam pelarut
organik. Endosulfan merupakan campuran dua isomer yaitu isomer alfa dan isomer
beta. Waktu paruh endosulfan dalam air lebih kurang 4 hari, tetapi kondisi pH yang
rendah akan memperpanjang waktu paruhnya. Dalam air endosulfan dapat didegradasi
membentuk endosulfan alkohol yang dapat mematikan ikan. Di dalam tanah isomer alfa
lebih cepat hilang dibanding isomer beta dan membentuk hasil degradasi berupa
senyawa endosulfan sulfat (WHO, 1992 dalam Arianti, 2002).
Pada ikan endosulfan didapatka n dalam bentuk alfa dan beta isomer serta
endosulfan sulfat (Toledo dan Johnson, 1992). Endosulfan sulfat terdeteksi pada otak,
insang, usus, ginjal, hati dan gonad. Kebanyakan biotransformasi dari alfa dan beta
endosulfan terjadi di hati, dimana residu te rtinggi didapatkan (Nowak dan Akhmad,
1989).
Struktur molekul senyawa endosulfan mempunyai bentuk heterosiklik yang
secara sintesis dapat diperoleh melalui reaksi kondensasi Diels-Alder dari
heksaklopentadiena dan cis-2-buten-1.4-diol yang dilanjutkan tahap kedua yaitu
pengubahan dari senyawa sulfit melalui persamaan reaksi dengan tionil klorida.
Tahapan kondensasi Diels -Alder berlangsung pada perbedaan temperatur lebih dari
75oC, yaitu antara 125-250oC. Reaksi berlangsung dengan baik pada temperatur refluks
Menurut Schoettger (1970) insektisida endosulfan termasuk senyawa kimia yang
relatif persisten dalam lingkungan, seperti halnya insektisida toxaphene, aldrin, dieldrin
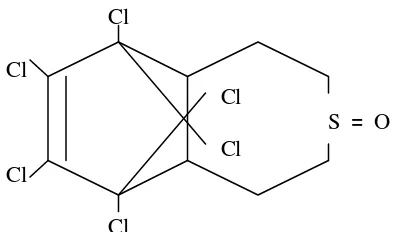
dan endrin yang juga merupakan golongan klor-organik. Nama kimia endosulfan adalah
6,7,8,9,10,10-heksaklor-1,5,5a,6,9,9a
-heksahidro-6,9,metano,2,4,3-benzo-dioksthiepin-3-oksida, dan mempunyai rumus empiris C9H6Cl6O3S dengan struktur kimia sebagai
berikut:
Cl
Cl
Cl
S = O Cl
Cl
Cl
Gambar 3. Struktur kimia endosulfan (Schoettger, 1970)
Endosulfan dapat diserap melalui pencernaan, pernafasan dan kontak dengan
kulit. Penambahan melalui oral atau parenteral akan cepat dikeluarkan melalui feces dan
urine. Tanda-tanda hewan keracunan endosulfan dalan konsentrasi akut adalah
neorogikal, hiperaktif dan kejang otot sampai akhirnya mati (UNEP, ILO, WHO, 1992).
Keracunan endosulfan dapat menyebabkan terjadinya penghambatan (Na+ = K+)
ATP -ase terutama pada mitokondria akson sinaptik dan sedikit pada endoplasmik
retikulum. Penghambatan ATP -ase berkaitan dengan Ca++ yang menyebabkan
peningkatan pelepasan neurotransmiter (Tarumingkeng, 1992). Selanjutnya ADB
(1987) menyatakan bahwa endosulfan dapat menimbulkan rangsangan pada sistim
syaraf pusat dan menyebabkan terjadinya kejang. Karena sangat berbahaya bagi ikan,
penggunaan insektisida endosulfan sudah dilarang sejak tahun 1996 melalui Surat
Keputusan Menteri Pertanian No. 473/KPTS/TP270/6/96, tetapi pada kenyataannya
masih banyak digunakan oleh petani karena insektisida ini efektif mengendalikan hama
sasaran, harganya murah dan mudah didapatkan (Sulaksono, 2001).
Penyerapan dan Eliminasi
Masalah kompleks dari toksisitas pestisida adalah akumulasi dalam berbagai
organisme akuatik karena ketika pestisida masuk ke dalam air maka secara cepat
diabsorpsi oleh sedimen, plankton, alga, avertebra ta, vegetasi dan ikan. Laju penyerapan
oleh invertebrata air dapat dihubungkan dengan aktivitas metabolisme, bobot tubuh,
luas permukaan atau melalui tingkat trofik dalam rantai makanan (Edwards, 1976).
Bioakumulasi adalah proses pengambilan bahan kimia dari lingkungan melalui
beberapa atau semua jalur yang memungkinkan (melalui respirasi, pakan, kulit) dari
beberapa sumber dalam lingkungan akuatik (air, suspensi, koloid atau partikulat organik
karbon, sedimen, organisme lain) dimana bahan kimia tersebut berada. Sedangkan
eliminasi merupakan proses pengurangan atau kehilangan suatu bahan aktif dari suatu
organisme melalui mekanisme perpindahan aktif atau pasif termasuk difusi dan
transformasi metabolik (Specie et al., 1997 dalam Pong-Masak, 2003).
Respon farmakodinamik oleh organisme dapat menyerap suatu zat asing
merupakan suatu fungsi konsentrasi steady-state dari bahan aktif secara biologi pada
jaringan sasaran yang diperkirakan dalam keseimbangan dengan sirkulasi secara teratur.
Perubahan konsentrasi secara teratur ditetapkan melalui laju absorpsi relatif dan
Biokonsentrasi merupakan suatu bagian dari akumulasi dimana bahan terlarut
secara selektif diambil dari air dan dikonsentrasikan ke dalam jaringan. Secara khusus
biokonsentrasi diaplikasikan pada konsentrasi suatu mineral dari air ke dalam ikan
(Manahan, 1992). Rasio antara konsentrasi dalam jaringan organisme dengan
konsentrasi dalam air dikenal dengan bioconcentration factor (BCF) yang merupakan
suatu istilah untuk menggambarkan kadar suatu bahan kimia yang dapat terkonsentrasi
dalam suatu jaringan organisme pada suatu lingkungan perairan sebagai hasil
pemaparan bahan kimia tersebut dalam air. Nilai BCF pada kondisi steady state selama
fase penyerapan adalah tingkat konsentrasi dalam satu atau beberapa jaringan organisme
perairan yang terpapar dibagi dengan rata -rata konsentrasi bahan kimia dalam air
selama pengujian (Rand dan Petrocelli, 1985). Sedangkan keadaan staedy state adalah
suatu kondisi dimana jumlah bahan uji yang diserap dan didepurasi persatuan waktu
seimbang pada suatu konsentrasi bahan yang diberikan dalam air (Negel dan Loskill,
1991).
Pertumbuhan
Pertumbuhan ikan merupakan suatu pola kejadian yang kompleks dan
melibatkan banyak faktor yang berbeda (Aziz, 1989). Proses pertumbuhan ikan pada
mulanya berlangsung lambat, kemudian cepat dan akhirnya lambat kembali.
Pertumbuhan yang demikian disebut pertumbuhan autocatalytic. Dengan demikian ikan
muda akan mengalami pertumbuhan yang lebih cepat dibanding dengan ikan tua. Ikan
tua tetap mengalami pertumbuhan, walaupun pertumbuhannya berlangsung secara
Pertumbuhan ikan dipengaruhi oleh faktor internal dan eksternal. Faktor internal
merupakan faktor yang sukar dikontrol, antara lain meliputi: faktor keturunan (genetik),
seks, umur, serta daya tahan terhadap penyakit dan parasit. Faktor eksternal adalah
faktor luar yang meliputi: kompetisi pada populasi, makanan, tingkatan trofik, energi
matahari, dan keadaan fisika kimia lingkungan (Effendi, 1979). Tekanan lingkungan
yang disebabkan oleh pengaruh pestisida yang bersifat subletal juga merupakan faktor
eksternal yang akan menyebabkan direduksinya pertumbuhan ikan (Schmittou, 1991).
Darah Ikan
Darah ikan terdiri dari cairan plasma dan sel-sel darah yang terdiri dari sel darah
merah (eritrosit), sel darah putih (leukosit) dan keping darah (trombosit). Darah pada
ikan berfungsi untuk mengedarkan zat makanan hasil pencernaan dan O2 ke sel-sel
tubuh serta membawa hormon dan enzim ke organ yang memerlukannya (Lagler et al.,
1977). Menurut Bond (1979), darah pada ikan berfungsi membawa ion-ion anorganik
(Na+, Mg2+, Cl-) dan senyawa organik seperti hormon, vitamin dan beberapa protein
plasma.
Beberapa parameter yang dapat memperlihatkan perubahan pada darah adalah
kadar hematokrit (Ht), kadar hemoglobin (Hb), jumlah sel darah putih (leukosit) dan
jumlah sel darah merah (eritrosit) (Lagler et al., 1977)
Hematokrit (Ht)
Parameter yang berpengaruh terhadap pengukuran volume eritrosit adalah
perbandingan antara volume sel darah merah dengan plasma darah (Bond, 1979). Kadar
hematokrit dalam darah ikan dapat digunakan untuk me ndeteksi terjadinya anemia pada
ikan. Apabila ikan terserang penyakit atau kehilangan nafsu makan karena sebab-sebab
yang tidak jelas, kadar hematokrit akan menurun (Snieszko et al., 1974).
Kadar hematokrit tidak selalu tetap nilainya (Randall, 1970). Pada ikan kadar
hematokrit berkisar antara 5-60% (Snieszko et al., 1960) dan bila berada di bawah 30%
menunjukkan defisiensi eritrosit (Bond, 1979). Sedangkan menurut Peter dan Cech
(1990) dalam Affandi dan Tang (2002) kadar hematokrit dalam darah ikan mas pada
kondisi normal adalah sebanyak 27,1%.
Hemoglobin (Hb)
Sel darah merah mengandung hemoglobin. Molekul hemoglobin merupakan
suatu protein dalam eritrosit yang terdiri atas protoporfirin, globin dan besi (Fe)
bervalensi dua. Menurut Lagler et.al. (1977) , hemoglobin berperan dalam proses
pengangkutan oksigen dalam darah dan kadar hemoglobin dalam darah ikan berkaitan
dengan jumlah eritrosit.
Menurut Lucky (1977) kadar hemoglobin dalam darah ikan teleostei berkisar
antara 37% hingga 70% dan 100% Hb setara dengan 14 gram dalam 100 ml darah.
Dalam keadaan sakit akut kadar Hb pada ikan akan turun hingga 27%. Angka (1990)
memperoleh kadar hemoglobin (gram) per 100 cc volume darah pada ikan mas dewasa
adalah 8,61/0,43 sampai 10,86/0,43 (gram per 100 cc volume darah), sedangkan Peter
dan Cech (1990) dalam Affandi dan Tang (2002) menyatakan bahwa kadar Hb dalam
Sel darah merah (Eritrosit)
Sel darah merah ikan mempunyai inti, berfungsi untuk mengikat oksigen.
Eritrosit berwarna merah kekuningan, bentuknya lonjong, kecil dan berukuran sekitar
7-36 mikron (Lagler et al., 1977). Eritrosit yang matang berbentuk oval hingga bundar,
inti yang kecil dengan sitoplasma dalam jumlah yang besar (Chinabut et al., 1991).
Darah ikan sebagian besar terdiri dari sel-sel darah merah yang jumlahnya diperkirakan
mencapai 4 juta sel/mm3. Sel darah merah ikan memiliki inti sel yang ukurannya
bervariasi antar spesies. Sel darah merah tersebut banyak mengandung hemoglobin dan
berfungsi membawa oksigen dari insang ke berbagai jaringan (Moyle dan Cech, 1988).
Eritrosit yang sudah matang adalah sel berbentuk ellips berukuran panjang 13-16
mikron dan lebar 7 – 10 mikron. Pada ulasan pewarnaan Leischman-Giemsa, eritrosit
ini mempunyai sitoplasma yang homogen. Inti terletak di tengah-tengah, juga
membentuk ellips, berwarna merah keunguan dan mempunyai kromatin yang kompak
(Affandi dan Tang, 2002).
Volume sel darah merah dalam 100 cc volume darah pada ikan mas dewasa
berkisar antara 30,92 K 0,43% dan 37,4 K 1,67 % dan jumlah sel darah merah per 1 cc
darah ikan mas (1,61 K 0,06) x 106 sel sampai (2,04 K 0,09) x 106 sel (Angka, 1990).
Menurut Peter dan Cech (1990) dalam Affandi dan Tang (2002), eritrosit yang terdapat
dalam darah ikan mas dalam kondisi normal jumlahnya adalah 1,43 sel x 106/mm3
Sel darah putih (Leukosit)
Sel darah putih pada ikan tidak berwarna dengan jumlah berkisar antara 20.000
Agranulosit digolongkan menjadi limfosit, monosit dan trombosit, sedangkan granulosit
dibagi menjadi basofil, eoseonofil dan neutrofil (Affandi dan Tang, 2002).
Limfosit banyak terlihat apabila ada reaksi immunitas dengan perantaraan sel,
monosit bersama -sama dengan makrofage jaringan setempat menghancurkan sisa-sisa
jaringan yang mati dan penyebab penyakit sedangkan trombosit dapat menghasilkan
tromboplastin yaitu sejenis enzim yang membuat polimer dan fibrinogen yang berperan
dalam pembekuan darah. Neutrofil dapat meninggalkan pembuluh darah, mengandung
vakuola yang berisi enzim yang digunakan oleh sel tersebut untuk menghancurkan
organisme yang dimakannya (Robert, 1978). Sel-sel neutrofil nampaknya mempunyai
fungsi fagositik atau sebagai sel fagosit, namun beberapa laporan menunjukkan bahwa
fagositosis mungkin bukan merupakan fungsi utama (Affandi dan Tang, 2002).
Kualitas air
Suhu sangat penting karena tidak hanya mempengaruhi aktivitas metabolik dan
tingkah laku organisme dan pemaparan polutan (bahan pencemar) tetapi juga dapat
mengubah keadaan fisik dan kimia dari polutan. Secara umum toksisitas dari polutan
akan meningkat dengan peningkatan suhu (Mason, 1992). Suhu berpengaruh secara
langsung maupun tidak langsung terhadap faktor -faktor seperti aktivitas enzim, tingkat
metabolisme maupun kadar oksigen. Tingkat penyerapan racun dapat lebih tinggi
dengan adanya kenaikan suhu (Macek et al., 1969 dalam Arianti, 2002).
Bahan polutan cenderung lebih beracun pada air dengan tingkat kesadahan
rendah (soft) dengan nilai pH yang stabil, sedangkan kesadahan yang tinggi cenderung
Toksisitas pestisida dalam air terhadap ikan akan meningkat dengan
berkurangnya konsentrasi oksigen. Hal ini disebabkan oleh peningkatan tingkat respirasi
sehingga racun yang terekspos terhadap tubuh ikan akan semakin besar (Mason, 1992).
Penurunan konsentrasi oksigen dan peningkatan konsentrasi CO2 dapat menyebabkan
stress pada ikan sehingga ketahanan ikan terhadap insektisida akan turun, dengan
demikian akan mempengaruhi toksisitas insektisida terhadap ikan (Arianti, 2002).
Keberadaan amonia akan dapat mereduksi masukan oksigen ke dalam tubuh
ikan yang disebabkan oleh rusaknya insang (Boyd, 1990). Selanjutnya menurut Arianti
(2002), rendahnya oksigen terlarut dalam tubuh ikan akan meningkatkan toksisitas
METODE PENELITIAN
Waktu dan Tempat
Penelitian dilaksanakan selama enam bulan, dimulai dari bulan April hingga
September 2004, bertempat di Instalasi Riset Lingkungan Perikanan Budidaya &
Toksikologi, Balai Riset Perikanan Budidaya Air Tawar – Bogor; Laboratorium
Kesehatan Ikan Fakultas Perikanan dan Ilmu Kelautan, IPB (analisis darah); dan Balai
Penelitian Bioteknologi Tanaman Pangan (analisis residu pestisida)
Bahan dan Alat
Bahan yang dipergunakan selama penelitian adalah sebagai berikut:
a. Benih ikan mas yang berasal dari hasil pemijahan secara terkontrol dengan ukuran
panjang total 3,65 ± 0,247 cm dengan bobot tubuh 0,81 ± 0,098 g/ekor.
b. Insektisida Akodan 35 EC dengan kandungan bahan aktif endosulfan 350 g/liter.
c. Pakan ikan, berupa pellet komersil dengan kandungan protein 43,96%.
d. Aceton p.a sebagai pelarut dan KMnO4 (PK) 20 mg/l sebagai desinfektan pada
wadah pengujian sebelum penelitian dilaksanakan.
e. Bahan kimia untuk analisis residu pestisida, darah dan kualitas air.
Peralatan yang digunakan dalam penelitian ini, meliputi:
a. Wadah pengujian berupa akuarium kaca yang terdiri dari: 28 unit berukuran 40 x 20
x 20 cm dan 16 unit berukuran 70 x 50 x 60 cm yang masing-masing dilengkapi
dengan wadah/tandon pergantian air.
c. Peralatan untuk pembuatan berbagai konsentrasi perlakuan: gelas ukur, pipet, labu
takar dan bulp.
d. Peralatan untuk perhitungan dan pengamatan parameter darah: jarum suntik, tabung
dan sentrifius mikrohematokrit, skala hematokrit, hemometer, hemositometer, pipet,
gelas objek dan penutup, mikroskop.
f. Timbangan digital dengan ketelitian 0,01 gram.
g. Peralatan pengukur parameter kualitas air: termometer, pH meter, DO meter.
Persiapan Penelitian
Wadah dan media
Sebelum penelitian berlangsung, wadah uji didesinfeksi dengan cara direndam
dalam larutan PK pada konsentrasi 20 mg/l selama 24 jam (Angka, 1990). Wadah uji
disusun secara paralel dalam rak-rak dan dilengkapi dengan penampungan air.
Selama penelitian berlangsung media uji diberi airasi sehingga kadar oksigen
terlarut tidak pernah di bawah nilai 60-70 persen saturasi. Karakteristik fisika -kimia
media uji selama penelitian harus berada pada ambang kondisi yang baik bagi ikan uji
dengan beberapa ketentuan sebagai berikut: fluktuasi suhu air tidak lebih dari 2oC,
kadar CO2 bebas ≤ 10 mg/l, ammonia ≤ 1 mg/l, kesadahan total ≥ 15 mg/l (CaCO3) dan
alkalinitas berkisar antara 50-200 mg/l.
Ikan uji.
Ikan uji berasal dari induk yang sama atau satu pendederan, berukuran seragam
terkecil. Sebelum digunakan dalam penelitian, ikan uji terlebih dahulu diaklimatisasi
selama 12 hari dalam kondisi laboratorium dan mortalitas ikan uji selama aklimatisasi
harus ≤ 10% dari jumlah populasi.
Media uji
Media uji yang digunakan adalah formulasi insektisida endosulfan, yaitu
Akodan 35 EC, dengan konsentrasi tertentu di dalam air. Untuk mencapai konsentrasi
perlakuan dilakukan pengenceran secara bertahap.
Pelaksanaan Penelitian
Uji stabilitas endosulfan dalam air
Pengujian bertujuan untuk mengetahui tingkat kestabilan konsentrasi insektisida
endosulfan dalam air. Pe nurunan tingkat konsentrasi endosulfan akan dijadikan acuan
untuk menentukan presentase dan interval waktu pergantian air bagi kestabilan
konsentrasi perlakuan pada tahap pengujian selanjutnya. Insektisida endosulfan
dianggap stabil sampai laju penurunan tingkat konsentrasi bahan kimia tersebut
mencapai ≤ 20% dari konsentrasi awal (Koesoemadinata, 2003).
Pengujian dilakukan dengan mengaplikasikan tingkat konsentrasi sebesar nilai
LC50-96 jam dengan dua kali ulangan. Penentuan konsentrasi larutan uji dite ntukan
dengan mengacu pada rumus pengenceran sebagai berikut:
V1. N1 = V2.N2 ……… (1)
keterangan :
N1 = konsentrasi endosulfan dalam larutan stok
V1 = volume larutan stok yang akan diambil
V2 = volume media air penelitian yang diinginkan
Larutan endosulfan disebar merata pada permukaan air kemudian diaduk merata
menggunakan pengaduk kaca. Selama uji stabilitas tidak dilakukan pergantian air dan
pengambilan sampel (150 ml) dilakukan pada jam ke: 0 (sesaat setelah aplikasi), 24, 48,
72 dan 96 setelah aplikasi. Sampel dibawa ke laboratorium dalam kondisi dingin
menggunakan cool box untuk kemudian diekstraksi sesuai dengan prosedur (Lampiran
1). Hasil akstraksi dipekatkan da lam 10 ml aceton p.a. dilanjutkan dengan identifikasi
menggunakan gas kromatografi (GC) dan perhitungan konsentrasi (persamaan 4).
Bioakumulasi endosulfan
Untuk mengetahui potensi akumulasi insektisida endosulfan dalam tubuh ikan
mas ditentukan melalui be berapa tahap pengujian sebagai berikut:
Uji toksisitas letal
Penelitian toksisitas letal meliputi percobaan untuk mencari nilai LC50 dari
insektisida endosulfan terhadap ikan mas yang ditentukan dengan metode uji hayati
(bioassay) melalui dua tahap (Busvine, 1971): Pertama, uji pendahuluan untuk
menentukan ambang daya racun letal insektisida terhadap ikan mas dengan cara
“Critical Range” yaitu menentukan konsentrasi ambang atas (LC100-24 jam) dan
ambang bawah (LC0-48 jam); Kedua: uji lanjutan yaitu untuk menentukan Median
Lethal Concentration (LC50) yang besarnya berada antara nilai ambang atas dan ambang
log (N/n) = k log (a/n) ……… (2)
a/n = b/a = c/b = d/c = e/d = f/e = g/f = N/g ………… (3)
keterangan :
N = konsentrasi ambang atas n = konsentrasi ambang bawah K = jumlah konsentrasi yang diuji (7)
a, b, c, d, e, f, dan g adalah konsentrasi yang diuji dengan nilai a sebagai konsentrasi terkecil
Konsentrasi-konsentrasi bahan uji tidak diverifikasi secara analisis kimia dan
nilai-nilai LC5 0 ditentukan berdasarkan konsentrasi nominal insektisida endosulfan
dalam wadah-wadah penelitian.
Wadah yang digunakan dalam uji toksisitas letal berupa 28 unit akuarium kaca
yang berukura n 40 x 20 x 20 cm. Masing-masing akuarium dilengkapi saluran
pemasukan dan pengeluaran serta penampungan air pengganti. Banyaknya ikan uji pada
setiap wadah penelitian berjumlah 10 ekor dengan waktu pemaparan selama 24, 48, 72
dan 96 jam dengan fariabel ya ng diukur adalah mortalitas ikan. Pada setiap konsentrasi
pengujian dilakukan pengukuran terhadap sifat fisika-kimia media uji, yaitu pada awal
pengujian (0 jam), pertengahan (48 jam) dan akhir pengujian (96 jam). Pengujian
diulang apabila tingkat mortalitas ikan uji dalam kontrol > 10% (Komisi Pestisida,
1983)
Uji bioakumulasi
Pengujian menggunakan wadah berupa 16 unit akuarium kaca berukuran 70 x 50
x 60 cm (p x l x t) yang masing-masing dilengkapi airasi dan diisi media uji sebanyak
wadah/tandon untuk membuat larutan uji sehingga lebih menjamin homogenitas larutan
dan mempermudah saat pergantian air. Ikan uji ditebar sebanyak 20 ekor untuk setiap
wadah (kepadatan: 1 ekor/2 liter) dan diberi pakan sampai kenyang (at-satiation).
Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan cara
mengaplikasikan 4 deret konsentrasi insektisida endosulfan dalam media uji sebagai
perlakuan, yaitu 0% (kontrol), 10, 30, da n 50% dari nilai LC5 0-96 jam yang
masing-masing diulang sebanyak 3 kali.
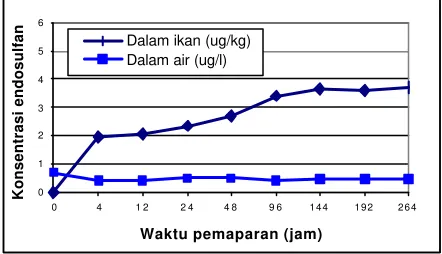
Pengambilan sample ikan sebanyak 30 g dan air (100 ml) untuk keperluan
analisis residu dilakukan pada jam ke: 0 (awal), 4, 12, 24, 48, 96, 144, 192 dan 264
setelah pemaparan. Sample ikan ditempatkan dalam kantung plastik sedangkan sample
air dimasukkan dalam botol, kemudian diekstraksi dan diidentifikasi di laboratorium
dengan menggunakan GC. Kandungan residu endosulfan dalam sample ikan dan air
yang teridentifikasi kemudian dihitung menggunakan persamaan 4. Setelah konsentrasi
endosulfan dalam tubuh ikan mencapai kondisi stabil (steady state) untuk setiap
perlakuan, maka konsentrasi tersebut digunakan sebagai dasar perlakuan berikutnya,
dan pada saat itu pula dihitung nilai biokonse ntrasi faktor (persamaan 5 sampai 7).
Uji bioeliminasi
Uji bioeliminasi dilakukan setelah penyerapan endosulfan dalam tubuh ikan uji
mencapai konsentrasi stabil yang diketahui dari hasil uji bioakumulasi. Sebanyak 20
ekor ikan uji dipindahkan ke dalam akuarium berisi 40 liter air tanpa bahan uji (clean
setelah pemeliharaan sebanyak 30 gr dan dianalisis seperti prosedur pada uji
bioakumulasi sampai identifikasi (persamaan 4).
Selama pemaparan ikan uji diberi makan secara at-satiation dan dilakukan
pergantian air sebanyak 100% setiap 24 jam. Pengamatan sifat fisika -kimia air (suhu,
pH, O2 terlarut, CO2 bebas dan amonia) dilakuan setiap kali pengambilan sample.
Bioakumulasi terhadap pertumbuhan
Pengujian dilakukan dengan metode uji hayati penggantian media uji (renewal
test) yaitu melakukan pergantian air pemeliharaan setiap 24 jam dengan konsentrasi
endosulfan yang sama untuk masing-masing perlakuan. Cara seperti ini menurut Yudha
(1999) dan Koesoemadinata (2000) dapat dilakukan agar konsentrasi insektisida
endosulfan dalam wadah pengujian relatif konstan.
Sebagai perlakuan digunakan 4 konsentrasi bioakumulasi insektisida endosulfan
dalam tubuh ikan mas yang besarnya diketa hui berdasarkan hasil uji bioakumulasi, yaitu
sebesar 0,00 (kontrol); 2,04; 3,58; dan 4,24 µg/kg. Setiap perlakuan diulang sebanyak 3
kali dan masing-masing perlakuan mempunyai satu wadah cadangan. Jumlah ikan uji
ditebar dengan kepadatan 20 ekor setiap wadah (40 liter air) dengan waktu pemaparan
selama 84 hari (12 minggu). Parameter pertumbuhan yang diukur adalah bobot biomas
ikan uji yang dilakukan seminggu sekali. Pengaruh lanjut bioakumulasi endosulfan
terhadap pertumbuhan ikan mas diukur melalui pende katan laju pertumbuhan individu
harian selama 84 hari (persamaan 8). Parameter lain yang diukur adalah efisiensi pakan
Selama penelitian hewan uji diberi makanan secara at satiation menggunakan
pakan berupa pelet dengan kadar protein 43,96%. Pengukuran parameter fisika -kimia
air dilakukan setiap minggu sebelum pengukuran bobot dilakukan yang meliputi: suhu
air, pH, O2 terlarut, CO2 bebas dan amonia.
Bioakumulasi terhadap kondisi hematologis.
Ikan mas yang telah dipaparkan dalam setiap perlakuan pada uji bioakumulasi
terhadap pertumbuhan, masing-masing diambil darahnya untuk dilakukan pengamatan
dan pengukuran terhadap parameter hematologis.
Pengambilan darah dilakukan dengan menggunakan jarum suntik steril pada
bagian vena caudalis. Sebelum digunakan, jarum suntik dibasahi dengan Na -sitrat 3,8%
yang berfungsi sebagai anti koagulan. Terhadap darah ikan yang diperoleh dari
masing-masing perlakuan dilakukan pengukuran parameter hematologis, meliputi kadar
hematokrit, hemoglobin, serta jumlah sel darah merah dan sel darah putih.
Kadar hematokrit (Ht)
Darah ikan dihisap dengan menggunakan tabung mikrohematokrit yang berlapis
heparin yang dapat mencegah pembekuan darah dalam tabung, sampa i volume darah
mencapai ¾ bagian tabung kemudian salah satu ujung tabung disumbat dengan critosea
untuk selanjutnya disentrifus dengan kecepatan 8000 rpm selama 5 menit. Pengukuran
kadar hematokrit dilakukan dengan membandingkan volume benda darah terhada p
volume seluruh darah dengan menggunakan skala hematokrit dan dinyatakan dalam
Kadar hemoglobin (Hb)
Pengukuran kadar hemoglobin pada prinsipnya adalah mengkonversikan
hemoglobin dalam darah ke dalam bentuk asam hematin oleh asam klorida. Mula-mula
darah dihisap menggunakan pipet sahli hingga mencapai skala 20 mm3, kemudian
dipindahkan ke dalam tabung Hb yang berisi HCl 0,1 N sampai skala 10 (kuning).
Didiamkan selama 3-5 menit agar Hb bereaksi dengan HCl membentuk asam hematin,
kemudian diaduk dan ditambah akuades (sedikit demi sedikit) hingga warnanya sama
dengan standar. Pembacaan skala dilakukan dengan melihat tinggi permukaan larutan
yang dikocok dengan skala lajur g% yang menunjukkan banyaknya Hb dalam gram
setiap 100 ml darah dan dinyatakan dalam persentase (% Hb) (Hesser, 1960 dalam
Yudha, 1999).
Jumlah sel darah merah (eritrosit)
Sample darah diencerkan dengan larutan Hayem untuk menghancurkan sel darah
putih agar jumlah sel darah merah dapat dihitung. Pengenceran dilakukan dengan
menggunakan pipet pencampur berskala maksimum 11 yang dilengkapi pengaduk.
Darah dihisap dengan pipet hingga skala 1, kemudian dihisap larutan Hayem
hingga skala 11 menggunakan pipet yang sama. Pipet digoyang selama 15 menit agar
darah tercampur secara merata, sedangkan larutan pada ujung pipet yang tidak
tercampur segera dibuang. Darah yang teraduk diteteskan ke dalam hemositometer yang
dilengkapi gelas penutup hingga memenuhi seluruh permukaan yang berskala,
Jumlah sel darah putih (leukosit)
Sample darah diencerkan dengan larutan Turks untuk menghancurkan sel darah
merah agar jumlah sel darah putih dapat dihitung. Untuk mengencerkan leukosit
digunakan pipet berskala maksimal 11 yang dilengkapi pengaduk. Mula-mula darah
dihisap hingga skala 1, kemudian dilanjutkan dengan menghisap larutan Turks hingga
skala 11. Pencampuran dilakukan dengan mengaduk pipet selama 15 menit hingga
benar-benar homogen.
Setelah pencampuran selesai, setetes campuran dimasukkan ke dalam
permukaan hitung pada hemositometer kemudian ditutup dengan gelas penutup dan
dilakukan penghitungan leukosit secara mikroskopis.
Analisis Data
Data komulatif mortalitas ikan mas pada uji definitif dianalisis menggunakan
analisis probit (Wallace, 1982) dengan bantuan program “probit analysis” untuk
menentukan nilai LC50 pada waktu pemaparan 24, 48, 72 dan 96 jam. Data uji
biokonsentrasi dan bioeliminasi dianalisis dengan mengacu pada petunjuk Spacie dan
Hamelink dalam Ra nd dan Petrocelli (1985), sedangkan data sifat fisika-kimia air
dianalisis secara deskriptif untuk mengetahui kelayakannya sebagai media uji.
Kandungan konsentrasi endosulfan dalam sample (air dan daging ikan) dihitung
berdasarkan petunjuk Komisi Pestisida (1990) sebagai berikut:
C D F
keterangan:
A = konsentrasi larutan standar (µg/ml)
B = luas puncak standar (mm)
C = lebar puncak sample (mm)
D = volume larutan standar yang diinjeksi (µl) E = volume larutan sample yang diinjeksi (µl)
F = volume pengenceran (ml)
G = bobot awal sample analitik (g)
Nilai biokonsentrasi faktor (BCF) dihitung berdasarkan laju bioakumulasi dan
bioeliminasi pada kondisi stabil (steady state) dengan rumus persamaan Montanes dan
Hattum (1995) sebagai berikut:
Ku = KdCf/Cw ………. (5)
Kd = ln Cf1 – ln Cf2/t1 – t2 …..……….. (6)
BCF = Ku/Kd ……….. (7)
keterangan:
Ku = laju penyerapan (µg/l/jam)
Kd = laju eliminasi (µg/l/jam)
Cf1 = konsentrasi endosulfan dalam tubuh ikan pada awal
pengamatan (µg/kg)
Cf2 = konsentrasi endosulfan dalam tubuh ikan pada waktu t
pengamatan (µg/kg)
Cw = konsentrasi rataan endosulfan dalam air selama penyerapan
(µg/l)
t = waktu pengamatan (jam)
BCF = Biokonsentrasi Faktor
Pertumbuhan individu ikan mas selama waktu pemaparan dalam uji
bioakumulasi dihitung berdasarkan model laju pertumbuhan harian individu dengan
rumus menurut Ricker (1975):
G = (ln Wt – ln W0)/∆∆t x 100% ………… (8)
keterangan:
G = laju pertumbuhan harian individu (%)
W0 = bobot rata-rata individu pada awal pengamatan (g)
∆t = waktu pemaparan (hari)
Efisiensi pakan ikan dari masing-masing perlakuan dihitung berdasarkan rumus
NRC (1983) sebagai berikut:
(Wt + D) – W0
FE = x 100% …….……… (9)
F
keterangan:
FE = efisiensi pakan (%)
W0 = rata-rata berat biomas ikan pada awal penelitian (g)
Wt = rata-rata berat biomas ikan pada akhir penelitian (g)
D = jumlah bobot ikan yang mati (g) F = jumlah pakan yang dikonsumsi (g)
Terhadap data laju pertumbuhan harian individu dan pertumbuhan populasi serta
konsums i pakan harian dilakukan analisis statistik untuk mengetahui pengaruh
perlakuan terhadap masing-masing parameter. Selanjutnya untuk mengetahui perbedaan
antar perlakuan digunakan analisis varian (anova) rancangan acak lengkap terhadap
koefisiensi pertumbuhan dan konsumsi pakan (Steel dan Torrie, 1989).
Untuk mengetahui pengaruh perlakuan terhadap setiap parameter hematologis
dilakukan analisis ragam terhadap data Ht (%), jumlah Hb (g/100 ml), jumlah eritrosit
(sel/ml) dan jumlah leukosit (sel/ml). Jika hasil Anova menunjukkan beda nyata maka
HASIL DAN PEMBAHASAN
Hasil Penelitian
Uji stabilitas endosulfan dalam air
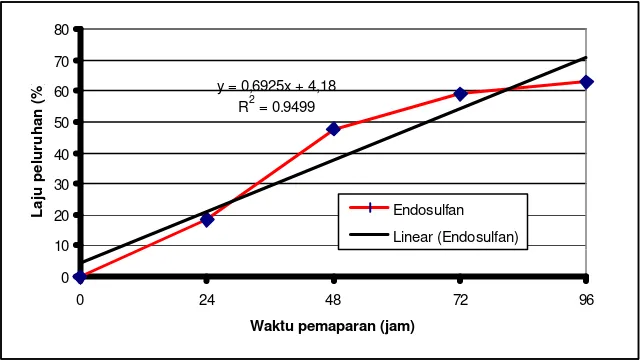
Dari hasil pengukuran residu endosulfan dalam air yang diberikan perlakuan
konsentrasi 2,42 µg/l (LC50-96 jam) menunjukkan bahwa laju peluruhan endosulfan
dalam air relatif lambat, dimana dalam waktu pemaparan 96 jam prosentase peluruhan
baru mencapai 62,8% (Gambar 4).
y = 0,6925x + 4,18 R2 = 0.9499
0 10 20 30 40 50 60 70 80
0 24 48 72 96
Waktu pemaparan (jam)
Laju peluruhan (%) Endosulfan
Linear (Endosulfan)
Gambar 4. Prosentase peluruhan konsentrasi endosulfan dalam air pada setiap waktu pemaparan.
Dapat diketahui bahwa rata -rata peluruhan endosulfan dalam air setelah 24 jam
adalah sebesar 19,44% dan setelah 72 jam mencapai 58,32%. Sedangkan nilai rata-rata
laju peluruhan endosulfan dalam air adalah 0,81% per jam, dengan laju peluruhan
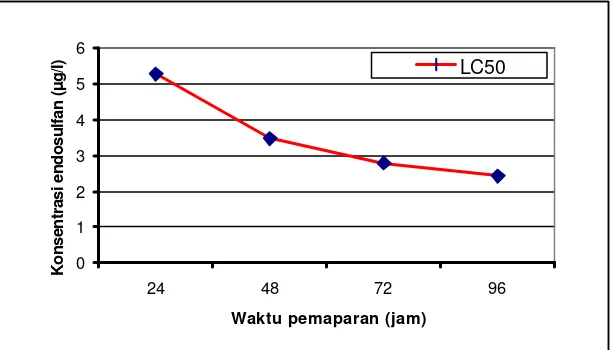
[image:49.612.163.485.323.503.2]Toksisitas letal: Nilai LC50
Respon ikan mas terhadap deret konsentrasi endosulfan menunjukkan kepekaan
mortalitas yang cukup tinggi. Berdasarkan percobaan pendahuluan diketahui nilai
ambang bawah (LC0-48 jam) adalah 1 µg/l, yaitu konsentrasi tertinggi insektisida
endosulfan yang tidak mematikan ikan mas dalam waktu 48 jam. Sedangkan nilai
ambang atas (LC100-24 jam) adalah 10 µg/l, yaitu konsentrasi terendah insektisida
endosulfan yang dapat mematikan 100% ikan mas dalam waktu 24 jam (Lampiran 3).
Dari nilai kisaran tersebut dan melalui perhitungan dengan menggunakan
persamaan (1), maka uji definitif dilakukan pada konsentrasi insektisida endosulfan
sebesar: 1,4; 1,9; 2,7; 3,7; 5,2; dan 7,2 µg/l serta kontrol yaitu ikan mas yang dipelihara
tanpa insektisida endosulfan sebagai pembanding. Pengamatan gejala klinis yang timbul <