KARAKTERISASI DAN UJI KEPEKAAN
TERHADAP ANTIBIOTIK ISOLAT BAKTERI Staphylococcus
aureus DIISOLASI DARI SAPI MASTITIS SUBKLINIS
EVI NUR QOLBAINI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
HALAMAN PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakam bahwa tesis berjudul Karakterisasi dan Uji Kepekaan terhadap Antibiotik Isolat Bakteri Staphylococcus aureus diisolasi dari Sapi Mastitis Subklinis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
RINGKASAN
EVI NUR QOLBAINI. Karakterisasi dan Uji Kepekaan terhadap Antibiotik Isolat Bakteri Staphylococcus aureus diisolasi dari Sapi Mastitis Subklinis. Dibimbing oleh I MADE ARTIKA dan DODI SAFARI.
Mastitis subklinis merupakan infeksi pada ambing yang tidak disertai dengan gejala klinis. Staphylococcus aureus merupakan salah satu bakteri penyebab mastitis. Identifikasi bakteri Staphylococcus aureus penyebab mastitis subklinis biasanya dilakukan secara fenotipik. Namun, belum mampu mengidentifikasi S.aureus hingga tingkat spesies. Bakteri S.aureus memiliki gen nuc mengkodekan produksi Tnase (Thermonuclease) yang memiliki sekuen spesifik dan amplifikasi gen nuc memiliki potensi yang cepat untuk mendeteksi infeksi S.aureus menggunakan metode PCR, sehingga bakteri S.aureus dapat teridentifikasi hingga tingkat spesies dibandingkan dengan identifikasi secara fenotipik. Identifikasi secara tepat pada S.aureus berhubungan dengan terapi antibiotik yang diberikan pada sapi mastitis subklinis. Namun penggunaan antibiotik β-laktam terkendala oleh resistansi antibiotik β-laktam yang dikenal dengan MRSA (Methicillin Resistant of Staphylococcus aureus) dan regulasinya dikendalikan oleh gen mecA. Penelitian ini dilakukan untuk mengidentifikasi secara fenotipik dan genotipik terhadap bakteri penyebab infeksi mastitis subklinis, melakukan uji kepekaan antibiotik terhadap bakteri S.aureus penyebab mastitis subklinis, serta mendeteksi adanya gen mecA yang menyandikan MRSA sebagai indikator penyebab resistansi antibiotik β-laktam.
Sampel susu sapi mastitis subklinis diambil di kawasan usaha peternak (KUNAK) Cibungbulang Bogor, sebanyak 102 sampel susu sapi. Uji CMT (California Mastitis Test) dilakukan sebagai identifikasi dini adanya penyakit mastitis subklinis. Sampel susu yang diambil, dikultur dalam media agar darah dan diidentifikasi secara fenotipik melalui pewarnaan Gram, uji katalase, dan uji oksidase. Identifikasi secara genotipik dilakukan dengan PCR sebagai konfirmasi adanya gen nuc. Isolat yang positif ditemukan gen nuc dinyatakan sebagai bakteri S.aureus dan selanjutnya dilakukan uji kepekaan antibiotik. Antibiotik yang digunakan diantaranya tetrasiklin, oksasilin, gentamisin, eritromisin, kloramfenikol, sefoksitin, trimetrtoprim-sulfametoksazol. Isolat yang resistan terhadap antibiotik oksasilin dan sefoksitin dilakukan konfirmasi dengan PCR untuk mengetahui adanya gen mecA.
Hasil identifikasi secara fenotipik melalui pewarnaan Gram dan uji biokimia, didapatkan 72% yang memiliki karakteristik Gram positif, koloni menyerupai anggur, berbentuk bulat, tidak berspora, katalase positif, dan oksidase negatif. Kemudian dilanjutkan dengan identifikasi secara genotipik melalui gen nuc didapatkan 48% yang dinyatakan positif bakteri S.aureus. Semua isolat bakteri S.aureus penyebab mastitis subklinis sensitif terhadap antibiotik tetrasiklin, gentamisin, kloramfenikol, eritromisin, dan trimetoprim-sulfametoksazol, sedangkan 22.5% dinyatakan resistan terhadap β-laktam (sefoksitin dan oksasilin) dan ditemukan adanya gen mecA.
SUMMARY
EVI NUR QOLBAINI. Characterization and Antimicrobial Succeptibility Testing of Staphylococcus aureus isolated from Bovine Subclinical Mastitis. Supervised by I MADE ARTIKA dan DODI SAFARI.
Subclinical mastitis is an infection of udder devoid of clinical symptoms, and Staphylococcus aureus is one of bacteria that causes this disease. Phenotypic identification of Staphylococcus aureus that causing subclinical mastitis was not able to identify S. aureus to species level. S.aureus has nuc gene that encodes production of Tnase (Thermonuclease) which have specific DNA sequences and the amplification of nuc gene has a potential for the rapid detection of S. aureus infections. PCR method can identify the presence of nuc gene, so S. aureus can be identified quickly, accurately, and sensitive to species level compared with the phenotypic identification. Identification of S. aureus associated with antibiotic therapy that given to cows with subclinical mastitis infection. However, the used of β-lactam antibiotics was constrained by β-lactam antibiotic resistance that known as MRSA (Methicillin Resistant of Staphylococcus aureus) which was controlled by the mecA gene. The aims of this study are to identify the phenotypic and genotypic of bacteria causing subclinical mastitis infections, antibiotic sensitivity test of S.aureus bacteria causing subclinical mastitis, as well as detect the presence of the mecA gene that encode β-lactam antibiotic resistance.
In the present study we investigated subclinical mastitis in Cibungbulang, Bogor, West Java dairy cows using the California Mastitis Test (CMT). We randomly collected 102 milk samples from dairy farms in different stalls. Samples of milk were cultured on Blood agar (BA) and phenotypically identified by Gram stain, catalase test and oxidase test. Moleculer identification was performed by PCR to confirm the presence of thermonuclease gene (nuc). Isolates that expressed nuc gene were positive S.aureus, then antibiotic succeptibility testing was performed. The antibiotics that was used include tetracycline, oxaciline, gentamicin, erythromicyn, chloramphenicol, cefoxitin, trimethoprim-sulfamethoxazole. Isolates were resistant to antibiotics cefoxitin and oxacilin will be confirmed by PCR for the presence of the mecA gene.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
KARAKTERISASI DAN UJI KEPEKAAN
TERHADAP ANTIBIOTIK ISOLAT BAKTERI Staphylococcus
aureus DIISOLASI DARI SAPI MASTITIS SUBKLINIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Karakterisasi dan Uji Kepekaan terhadap Antibiotik Isolat Bakteri Staphylococcus aureus diisolasi dari Sapi Mastitis Subklinis Nama : Evi Nur Qolbaini
NIM : G851120061
Disetujui oleh Komisi Pembimbing
Dr. Ir. I Made Artika, M.App.Sc Ketua
Dodi Safari, Ph.D Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof. Dr. Maria Bintang, M.S
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2013 sampai April 2014 ini adalah Karakterisasi dan Uji Kepekaan terhadap Antibiotik Isolat Bakteri Staphylococcus aureus diisolasi dari Sapi Mastitis Subklinis.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. I Made Artika, M.App.Sc dan Bapak Dodi Safari, Ph.D selaku pembimbing yang telah memberikan arahan dan saran, ibu Decy selaku kepala lab EOCRU atas saran yang telah diberikan selama penelitian, Ibu Lia dan Pak Majid selaku asisten di laboratorium Mikrobiologi Eijkman yang telah membantu selama penelitian. Ungkapan terimakasih juga disampaikan kepada suami, ibu, kakak, kakak ipar, dan adik yang telah memberikan semangat, doa, dan kasih sayangnya.
Semoga karya ilmiah yang telah tersusun ini bermanfaat bagi semua.
DAFTAR ISI
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
METODE
Waktu dan Tempat Penelitian 3
Bahan 3
Alat 4
Prosedur Penelitian 4
HASIL DAN PEMBAHASAN
Kuantifikasi Mastitis Subklinis KUNAK Bogor 6
Karakteristik Koloni Bakteri dan Uji Biokimia 8
Hasil Amplifikasi Gen nuc S.aureus 10
Kepekaan S.aureus terhadap Antibiotik 11
Hasil Amplifikasi Gen mecA 13
SIMPULAN DAN SARAN
Simpulan 14
Saran 15
DAFTAR PUSTAKA 16
LAMPIRAN 22
DAFTAR TABEL
Tabel 1 Kasus mastitis subklinis di kawasan usaha peternak
(KUNAK) sapi perah Cibungbulang, Bogor 7
Tabel 2 Uji kepekaan antibiotik terhadap bakteri S.aureus 12
DAFTAR GAMBAR
Gambar 1 Zona Bening yang terbentuk di sekitar koloni S.aureus
pada media agar darah 8
Gambar 2 Hasil pewarnaan Gram pada bakteri Staphylococci dengan
perbesaran mikroskop 400× 9
Gambar 3 Uji katalase pada bakteri 9
Gambar 4 Hasil amplifikasi gen nuc dari S.aureus dengan panjang
255 bp 10
Gambar 5 Hasil uji antibiotik terhadap bakteri S.aureus 11 Gambar 6 Hasil amplifikasi gen mecA penyandi MRSA (Methicilin
Resistant of Staphylococcus aureus) dengan panjang 527
bp. 14
DAFTAR LAMPIRAN
Lampiran 1 Hasil pemeriksaan mastitis subklinis dengan reagen
CMT 22
Lampiran 2 Hasil pewarnaan Gram, uji katalase, dan uji oksidase 24 Lampiran 3 Standar diameter zona bening pada uji kepekaan
antibiotik terhadap bakteri S.aureus 26
Lampiran 4 Diameter zona hambatan beberapa antibiotik terhadap
bakteri Staphylococcus aureus 27
Lampiran 5 Gambar pengamatan lokasi penelitian 28
PENDAHULUAN
Latar Belakang
Mastitis merupakan peradangan pada kelenjar susu sebagai respon dari adanya luka dengan tujuan untuk merusak agen penginfeksi sehingga dapat kembali ke fungsi normal. Pada daerah peternakan sapi, mastitis banyak disebabkan oleh mikroorganisme yang menyerang ambing, kemudian berkembang biak dan menghasilkan toksin yang sangat berbahaya bagi kelenjar susu (Jones 2009; Schroeder 2012). Akibat peradangan pada ambing, Schroeder (2012) dan Seegers et al. (2003) menjelaskan bahwa hal tersebut berdampak pada penurunan produksi susu dan juga penurunan kualitas susu. Penurunan kualitas tersebut dapat dilihat dari penurunan kadar laktosa, lemak, mineral potasium. Mastitis subklinis berbeda dengan mastitis klinis yang disertai dengan gejala klinis yang timbul pada ambing. Namun, mastitis subklinis merupakan penyakit utama yang menyerang peternakan sapi (Oliver et al. 2004). Salah satu bakteri penyebab infeksi pada ambing adalah Staphylococcus aureus (S.aureus) yang paling banyak ditemukan pada kasus mastitis pada sapi (Østeras et al. 2006; Ferguson et al. 2007). S.aureus dapat mencapai kelenjar susu baik secara langsung dari ambing atau kontaminasi sekunder (Scherrer et al. 2004). Kontaminasi sekunder tersebut kemungkinan terjadi dari transfer S.aureus antara manusia dan sapi (Matos et al. 1991; Roberson et al. 1994; Zadoks et al. 2002).
S.aureus termasuk bakteri yang berbahaya, karena patogenitas organisme ini memiliki proses yang komplek dan melibatkan berbagai faktor virulensi yang berlangsung ketika proses infeksi terjadi pada jaringan (Cotar et al. 2010). Faktor virulen tersebut meliputi berbagai macam eksoprotein dan protein dinding sel (Arvidson dan Tegmark 2001). Hampir seluruh strain S.aureus mengeluarkan eksoprotein, seperti eksotoksin dan enzim, termasuk koagulase, nuklease, protease, lipase, hialuronidase dan kolagenase. Staphylocoagulase (SC) merupakan salah satu faktor virulensi menyebabkan koagulasi plasma dan digunakan sebagai penanda untuk membedakan S.aureus dan Staphylococci lain yang kurang patogenik, yaitu Staphylococci koagulase negatif (Bronner et al. 2004). Selain S.aureus, terdapat beberapa spesies lain yang termasuk dalam Staphylococci koagulase positif (Devriese et al. 2005; Freney et al. 1999). Sehingga perlu identifikasi secara tepat untuk mengetahui adanya infeksi bakteri S.aureus pada mastitis subklinis.
2
Amplifikasi gen nuc yang menyandikan enzim Thermonuclease memiliki potensi yang cepat dan murah untuk mendeteksi adanya infeksi bakteri S.aureus (Costa et al. 2005). Metode PCR secara tepat dapat mengidentifikasi adanya gen tersebut, sehingga bakteri S.aureus dapat teridentifikasi secara cepat, akurat, dan sensitif hingga tingkat spesies dibandingkan dengan identifikasi secara fenotipik (Neelesh et al. 2008).
Identifikasi secara tepat pada bakteri penyebab mastitis berhubungan dengan terapi antibiotik yang diberikan dan penentuan resistansinya. Uji kepekaan antibiotik telah dilakukan pada beberapa penelitian di Indonesia, khususnya terhadap bakteri S.aureus. (Suryanto et al. 2007; Purnomo et al. 2006; Anjarwati dan Dharmawan 2010). Beberapa golongan antibiotik yang direkomendasikan penggunaannya dalam peternakan diantaranya golongan β-laktam, golongan tetrasiklin, dan golongan makrolida. Diantara golongan antibiotik tersebut, golongan β-laktam paling sering digunakan dalam pengobatan mastitis (Sawant 2005). Salah satu permasalahan yang dihadapi pada terapi antibiotik adalah resistansi antibiotik. Pemilihan antibiotik β-laktam, seperti penisilin atau sefoksitin dalam mengatasi infeksi mastitis menimbulkan permasalahan resistan antibiotik jenis β-laktam, yang dikenal dengan MRSA (Methicillin Resistant of Staphylococcus aureus) (Gindonis et al. 2013). MRSA banyak ditemukan pada manusia, kemudian terdeteksi pula pada hewan (Lee et al. 2004). Dalam beberapa tahun terakhir, terdapat peningkatan jumlah strain Staphylococci yang menunjukkan resistansi antibiotik jenis β-laktam telah menjadi masalah klinis dan epidemiologi. Resistansi antibiotik β-laktam pada Staphylococci karena adanya penicillin-binding protein 2α(PBP2α), yang dikodekan oleh gen mecA (Velasco et al. 2005). Selain itu, S. aureus telah mengalami multiresistan terhadap variasi antibiotik yang disebarkan antar ternak (Waage et al. 2002).
Perumusan Masalah
S.aureus merupakan salah satu bakteri penyebab mastitis subklinis. Identifikasi secara tepat untuk mengtahui adanya infeksi bakteri S.aureus dapat dilakukan secara genotipik. Namun identifikasi secara fenotipik secara mikrobiologi dan biokimia perlu dilakukan terlebih dahulu untuk membantu proses seleksi bakteri. Identifikasi selanjutnya dapat dilakukan secara genotipik melalui gen nuc yang merupakan gen spesifik yang terdapat pada S.aureus dan dapat diketahui melalui metode PCR. Identifikasi S.aureus secara tepat berhubungan dengan terapi antibiotik yang akan diberikan sebagai terapi mastitis subklinis.
3 Tujuan Penelitian
Penelitian ini dilakukan untuk mengidentifikasi secara fenotipik dan genotipik bakteri S.aureus penyebab infeksi mastitis subklinis, melakukan uji kepekaan terhadap antibiotik pada bakteri S.aureus, serta mendeteksi adanya gen mecA yang menyandikan MRSA sebagai indikator penyebab resistansi antibiotik β-laktam.
Manfaat Penelitian
Identifikasi secara molekuler untuk mengetahui adanya infeksi S.aureus mampu mendeteksi secara tepat dan cepat adanya bakteri tersebut sebagai penyebab penyakit mastitis subklinis pada sapi. Pengujian beberapa antibiotik dapat membantu menentukan jenis antibiotik yang tepat digunakan sebagai terapi antibiotik pada sapi yang terinfeksi mastitis subklinis.
METODE
Waktu dan Tempat Penelitian
Penelitian dilakasanakan di Laboratorium Mikrobiologi Lembaga Biologi Molekuler Eijkman Jakarta. Sampel susu diambil di kawasan usaha peternak (KUNAK) Cibungbulang Bogor, sebanyak 102 sampel susu sapi.
Waktu penelitian dilakukan selama 7 bulan dimulai dari bulan oktober 2013 sampai April 2014. Tahapan penelitian meliputi pemeriksaan dan pengambilan sampel susu, isolasi dan identifikasi bakteri secara fenotipik, ekstraksi DNA, identifikasi bakteri secara genotipik, uji antibiotik, dan identifikasi gen penyandi MRSA.
Bahan
4
Alat
Peralatan yang digunakan diantaranya adalah vortex (Thermolyne), sentrifugator (Thermo Scientific Heraeus Pico 21), dry bath (Thermo Scientific), water bath (Barnstead Lab-Line), inkubator (Thermo-Scientific Heraeus), biosafety cabinet (Nuaire), laminar air flow (ESCO), mikroskop (Nikon Eclipse E200), aparatus elektroforesis (Bio-Rad), jangka sorong, neraca analitik (Sartorius), pipet mikro (Eppendorf), tabung mikro 1.5 ml (Axygen), tabung mikro 0.25 ml (Axygen), spin down (Green liv), piring kaca steril diameter 8 cm (Labserv), Cryotube 1.8 ml (Nunc), magnetic stirer (Cimarec), pengukur pH (Thermo Orion 2 Star), kaca mikroskop (Saill Brand 7105), tabung falkon 50 ml (Corning), Pedel, Gel doc 1000 (Bio-Rad), analytical paper (Schleicher and Schuell), PCR cabinet (Scle-Pias).
Prosedur Penelitian
Identifikasi Kasus Mastitis
Sampel susu berasal dari 102 ekor sapi yang berada pada 8 kandang berbeda. Uji CMT pada susu dilakukan terlebih dahulu sebagai Identifikasi dini adanya penyakit mastitis subklinis (Blowey dan Edmondson 2010). Pengambilan sampel susu dilakukan secara steril dengan cara membersihkan daerah puting menggunakan alkohol 70%, kemudian susu diperah menggunakan sarung tangan. Hasil pemerahan kedua atau ketiga ditampung pada pedel, dan ditambahkan reagen CMT dengan perbandingan 1:1. Pedel diputar selama 10-15 detik. Hasil positif mastitis ditunjukkan melalui terbentuknya gel berwarna putih abu-abu dalam larutan berwarna ungu pada dasar pedel (Surjowardojo et al. 2008). Skor mastitis ditentukan dengan angka 0, +1, +2, dan +3. Setiap angka memiliki tingkat yang berbeda untuk mendeteksi mastitis subklinis menggunakan CMT. Angka 0 menunjukkan bahwa tidak terdapat infeksi mastitis subklinis pada sapi dan tidak terbentuk gel pada campuran susu dengan reagen CMT. Angka +1 apabila terjadi pembentukan gel pada campuran susu dan reagen CMT, namun hanya berlangsung 2-3 detik dan jika pedel diputar terus, maka gel tersebut akan menghilang. Angka +2, apabila terbentuk penebalan secara langsung dari kedua campuran tersebut, namun gel yang terbentuk hanya sedikit. Berbeda dengan +3, yang ditunjukkan dengan terbentuknya gel yang sangat tebal pada pedel (Barnum dan Newbould 1961). Sapi dengan hasil positif mastitis kemudian diambil sampel susunya dalam tabung steril. Susu disimpan pada suhu 40C dan pemeriksaan sampel tidak melebihi 72 jam (Virdis et al. 2010).
Isolasi dan Identifikasi Bakteri Penyebab Mastitis Subklinis
5 karakteristik morfologi dan hemolitiknya. Koloni bakteri yang terpilih diidentifikasi lebih lanjut dengan pewarnaan Gram, uji katalase, dan uji oksidase (Harley dan Prescott 2002). Tahap pewarnaan Gram adalah mengambil isolat yang terpilih dan dibuat apusan di atas kaca objek kemudian difiksasi panas. Apusan ditetesi kristal violet dan dibiarkan selama 1 menit kemudian dibilas dengan air mengalir. Apusan kemudian ditetesi dengan lugol dan dibiarkan selama 1 menit, setelah itu dibilas lagi dengan air mengalir. Alkohol 95% diteteskan di atas apusan dan dibiarkan selama 30 detik, kemudian dicuci dengan air mengalir. Tahap terakhir adalah apusan ditetesi safranin dan dibiarkan selama 30 detik sebelum dibilas dengan air mengalir kemudian dikeringkan dengan kertas penyerap. Hasil apusan tersebut diamati di bawah mikroskop (Claus 1992). Uji katalase dilakukan dengan cara meneteskan larutan Hidrogen Peroksida (H2O2) 5% pada isolat bakteri (Harley dan Prescott 2002). Uji oksidase dilakukan dengan menggunakan reagen uji oksidase (N,N,N-tetramethyl-p-phenylediamine) (Harley dan Prescott 2002). Bakteri yang terpilih dimurnikan kembali pada media BA dan diinkubasi pada suhu 370C selama 24 jam. Bakteri yang telah dimurnikan, kemudian disimpan dalam medium STGG (skim milk, tryptone, glucose, and glycerin) dan disimpan pada suhu -700C sampai -800C (O'Brien et al. 2001). Ekstraksi DNA Bakteri Penyebab Mastitis Subklinis
Bakteri yang telah disimpan disubkultur pada medium agar darah dan diinkubasi selama 24 jam pada suhu 370C. Koloni bakteri yang tumbuh kemudian diekstraksi dengan menggunakan metode boiling atau pemanasan seperti yang dideskripsikan oleh Zhang et al. (2004), dengan modifikasi. Satu ose penuh koloni bakteri ditransfer kedalam 400 µ l buffer TE, kemudian divortex. Suspensi sel bakteri tersebut dipanaskan pada suhu 1000C selama 10 menit, selanjutnya diinkubasi pada suhu -200C selama 10 menit. Hasil inkubasi kemudian disentrifugasi dengan kecepatan 13000 rpm selama 10 menit. Lapisan supernatan hasil sentrifugasi dipindahkan pada tabung steril untuk dilakukan PCR.
Identifikasi gen nuc Melalui PCR
Identifikasi secara biomolekuler dilakukan sebagai konfirmasi adanya gen nuc yang merupakan gen spesifik pada S.aureus. Identifikasi dilakukan melalui polymerase chain reaction (PCR) menggunakan primer nuc-R (5’ -AGCCAAGCCTTGACGAACTAAAGC-3’) dan nuc-F (5’ -GCGATTGAT-GGTGATACGGTT-3’) seperti yang dideskripsikan oleh Brakstad et al. (1992). Komposisi campuran PCR meliputi 10 µl Go Taq Green, 0.5 µl masing-masing primer, 2 µl DNA, dan 10 µ l ddH2O, dengan volume total 23 µl. Kondisi amplifikasi PCR diantaranya 940C selama 5 menit, diikuti dengan 35 siklus dari 940C selama 30 detik, annealing 550C selama 1 menit, extension 720C selama 1 menit, kemudian diikuti dengan final extension selama 10 menit pada suhu 720C. Hasil PCR diamati dengan elektroforesis agaros 1%. Amplikon dengan panjang 255 bp dinyatakan sebagai gen nuc (Poulsen 2003).
Uji Kepekaan Antibiotik
6
disuspensikan ke dalam larutan NaCl 2% hingga mencapai kekeruhan sesuai standar Mc. Farland 0.5 atau konsentrasi bakteri 1.5x108 CFU/ml (CFU=colony forming unit). Kapas lidi steril dicelupkan ke dalam suspensi bakteri dan dipastikan tidak terlalu basah, kemudian dioleskan di atas permukaan media Mueller Hinton agar. Cakram antibiotik diletakkan di atas media, kemudian diinkubasi pada suhu 370C selama 24 jam. Jenis antibiotik yang digunakan berdasarkan pedoman CLSI, diantaranya tetrasiklin 30 µg, oksasilin 1 µg, gentamisin 10 µg, eritromisin 15 µg, kloramfenikol 30 µg, sefoksitin 30 µg, trimetoprim-sulfametoxazole 1.25/23.75 µg. Isolat bakteri yang resistan terhadap oksasilin dan sefoksitin dideteksi gen resistannya melalui PCR.
Identifikasi Gen mecA Melalui PCR
Isolat bakteri yang resistan terhadap antibiotik sefoksitin atau oksasilin, atau resistan terhadap keduanya diidentifikasi secara molekuler adanya gen mecA melalui PCR menggunakan primer mecA-F (5’ -GGGATCATAGCGTCATTA-TTC-3’), primer mecA-R (5’-AACGATTGTGACACGATAGCC-3’). Komposisi master mix PCR meliputi 10 µ l Go Taq Green, 0.5 µl masing-masing primer, 2 µl DNA, dan 10 µ l ddH2O, dengan volume total 23 µ l. Kondisi amplifikasi PCR dimulai dengan pemanasan 940C selama 4 menit, kemudian diikuti dengan 30 siklus dari denaturasi 940C selama 45 detik, annealing 500C selama 45 detik, dan extension 720C selama 1 menit, dilanjutkan dengan final extension 720C selama 3 menit (Anand et al. 2009). Hasil amplifikasi PCR diamati dengan elektroforesis (California Mastitis Test). Keuntungan menggunakan CMT adalah mudah, murah, sederhana, membutuhkan sedikit peralatan, dan mudah dibersihkan. CMT merupakan reagen yang mengandung arylsulfonate. Reagen tersebut akan membentuk gelatin apabila bereaksi dengan leukosit dan sel somatik yang terdapat dalam susu. Tingkat kekentalan yang terbentuk menunjukkan jumlah leukosit dan sel somatik dalam susu. Jumlah leukosit dan sel somatik yang berlebihan ditemukan apabila terjadi infeksi, misalnya infeksi mastitis pada ambing (Akers 2002). Sebanyak 102 sampel sapi pada 8 kelompok kandang yang berbeda di KUNAK Cibungbulang diperiksa sampel susunya menggunakan reagen CMT untuk mengetahui adanya mastitis subklinis.
7 Tabel 1 Kasus mastitis subklinis di kawasan usaha peternak
(KUNAK) sapi perah Cibungbulang, Bogor
Karakterisasi Jumlah Persentase (%)
Jumlah sampel 102 diperoleh angka +1 sebanyak 22% yang menunjukkan infeksi yang ringan, angka +2 sebanyak 45% yang menunjukkan positif mastitis subklinis, sedangkan angka +3 sebanyak 33% yang menunjukkan infeksi mastitis subklinis yang terjadi sudah parah (Barnum dan Newbould 1961). Sehingga sebagian kecil dari sapi di KUNAK Cibungbulang terindikasi infeksi mastitis subklinis, namun masih termasuk ringan, dan sebagian besar termasuk dalam kategori positif mastitis subklinis kategori sedang. Kasus mastitis subklinis yang parah juga terjadi di KUNAK Cibungbulang dan memerlukan tindakan secepatnya, misalnya dengan terapi antibiotik. Namun, tindakan yang lain juga diperlukan pada tingkat mastitis yang lain agar tidak menjadi semakin parah. misalnya perbaikan dalam manajemen pemerahan. Manajemen pemerahan yang baik meliputi pre dipping dan post dipping (Bewley dan Arnold. 2012). Pre dipping adalah melakukan sanitasi terhadap puting sebelum dilakukan pemerahan, hal tersebut untuk mencegah masuknya bakteri yang berasal dari lingkungan. Hal yang sama juga dilakukan pada akhir pemerahan (post dipping), kedua cara tersebut dapat dilakukan dengan mencelupkan puting pada larutan detergen kemudian dikeringkan.
8
Karakteristik Koloni Bakteri dan Uji Biokimia
Berdasarkan hasil uji CMT, susu sapi yang positif mastitis dilakukan uji lebih lanjut untuk mengetahui apakah terdapat bakteri S.aureus yang menyebabkan infeksi mastitis subklinis. Sampel susu yang telah diambil kemudian dikulturkan di atas media agar darah untuk mendapatkan isolat S.aureus. Identifikasi secara konvensional dilakukan sebagai identifikasi awal, yaitu dengan pengamatan karakteristik koloni, pewarnaan Gram, uji katalase, dan uji oksidase.
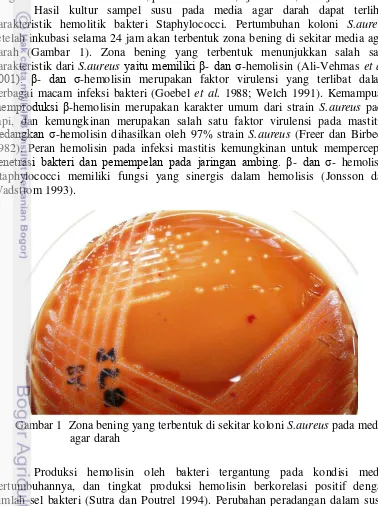
Hasil kultur sampel susu pada media agar darah dapat terlihat karakteristik hemolitik bakteri Staphylococci. Pertumbuhan koloni S.aureus setelah inkubasi selama 24 jam akan terbentuk zona bening di sekitar media agar darah (Gambar 1). Zona bening yang terbentuk menunjukkan salah satu karakteristik dari S.aureus yaitu memiliki β- dan σ-hemolisin (Ali-Vehmas et al. 2001). β- dan σ-hemolisin merupakan faktor virulensi yang terlibat dalam berbagai macam infeksi bakteri (Goebel et al. 1988; Welch 1991). Kemampuan memproduksi β-hemolisin merupakan karakter umum dari strain S.aureus pada sapi, dan kemungkinan merupakan salah satu faktor virulensi pada mastitis. Sedangkan σ-hemolisin dihasilkan oleh 97% strain S.aureus (Freer dan Birbeck 1982). Peran hemolisin pada infeksi mastitis kemungkinan untuk mempercepat penetrasi bakteri dan pemempelan pada jaringan ambing. β- dan σ- hemolisin Staphylococci memiliki fungsi yang sinergis dalam hemolisis (Jonsson dan Wadstrom 1993).
Gambar 1 Zona bening yang terbentuk di sekitar koloni S.aureus pada media agar darah
9 berasal dari susu normal (Mattila dan Sandholm 1984). hal tersebut menunjukkan bahwa proses inflamasi pada ambing menyebabkan perubahan dalam susu yang mendukung pertumbuhan bakteri.
Genus Staphylococci merupakan bakteri Gram positif, tidak bergerak, dan berdiameter 1 µm (Gambar 2), mampu membentuk koloni, mampu tumbuh dengan baik dengan oksigen maupun tanpa oksigen (anaerob fakultatif), tidak mampu menghasilkan spora, akan tetapi mampu memfermentasi glukosa dan manitol (Pagels et al. 2010; Watanakunakorn dan Bakie 1973). Genus Staphylococci memiliki ciri katalase positif (Gambar 3). Enzim katalase (kat) berfungsi sebagai katalis dalam reaksi penguraian hidrogen peroksida (H2O2) menjadi H2O dan O2 (Harley dan Prescott 2002). Namun, pada kasus S. aureus strain negatif untuk uji katalase telah diidentifikasi bahwa telah terjadi mutasi missense atau penghapusan pada untaian gen katA (Piau et al. 2008). Genus Staphylococci menunjukkan oksidase negatif (Wilkinson 1997).
Gambar 2 Hasil pewarnaan Gram pada bakteri Staphylococci dengan perbesaran mikroskop 400×
Gambar 3 Uji katalase pada bakteri. (a) Kontrol Uji Katalase (b) Uji katalase pada genus Staphylococci yang menunjukkan katalase positif
10
Hasil Amplifikasi Gen nucS.aureus
Berdasarkan hasil identifikasi secara fenotipik, isolat yang telah terpilih dilanjutkan dengan identifikasi secara genotipik, karena identifikasi secara konvensional belum dapat mengidentifikasi bakteri Staphylococcus sp hingga tingkat spesies. Identifikasi secara genotipik menggunakan gen target dari S.aureus, yaitu gen nuc, yang memiliki panjang 255 bp dan dapat mengidentifikasi secara tepat adanya infeksi S.aureus (Poulsen 2003).
Terdapat 72% sampel hasil identifikasi fenotipik yang diidentifikasi lebih lanjut menggunakan gen nuc dengan metode PCR. Hasil amplifikasi PCR didapatkan 48% sampel ditemukan adanya gen nuc dengan panjang 255 bp (Lampiran 6). Hal tersebut menunjukkan bahwa terdapat 49 sampel/48% susu sapi yang terinfeksi bakteri S.aureus.
.
Gambar 4 Hasil amplifikasi gen nuc dari S.aureus dengan panjang 255 bp. Baris ke-1 adalah marker DNA 100-1500 bp, baris ke-2 kontrol positif bakteri S.aureus, baris ke-3 sampai ke-7 sampel yang diuji, baris ke-8 kontrol negatif
Gen nuc yang spesifik dimiliki oleh S.aureus mengkodekan produksi Tnase (Thermonuclease) dan memiliki sekuen DNA spesifik, hasil amplifikasi gen nuc memiliki potensi yang cepat untuk mendeteksi infeksi S.aureus (Costa et al. 2005). Enzin Thermonuclase merupakan faktor virulensi yang dimiliki oleh S.aureus (Olson et al. 2013). Peran gen nuc hampir sama dengan DNases yang diproduksi oleh bakteri gram positif lainnya, yaitu menghindari perangkap ekstraseluler dari neutrofil ketika terjadi infeksi (Berend et al. 2010). Karakter spesifik yang dimiliki oleh S.aureus menunjukkan bahwa identifikasi secara genotipik dapat dilakukan untuk mengetahui infeksi S.aureus. Identifikasi secara fenotipik saja sangat sulit untuk membedakan antar spesies Staphylococcus koagulase positif karena kurangnya ciri khusus untuk identifikasi hingga tingkat spesies (Freney et al. 1999; Sasaki et al. 2007).
11 dalam tabung (Rotter dan Kelly 1966). Prosedur tambahan telah ditingkatkan untuk mengidentifikasi hingga tingkat spesies untuk membedakan S.aureus dengan staphylococci koagulase-negatif (Staphylococcus epidermidis dan lain-lain) (Gillapsy et al. 1995). Misalnya, tes aglutinasi Pastorex ® Staph-Plus, yang dikembangkan oleh Sanofi Pasteur, yang dapat mengidentifikasi S.aureus dengan ketelitian 98.6%, namun dapat menurun mencapai 95.1% apabila S.aureus resistan terhadap antibiotik β-laktam. Tes tersebut terdiri dari campuran partikel lateks yang dilapisi dengan fibrinogen, imunoglobulin G dan antibodi monoklonal yang berlawanan dengan polisakarida kapsuler S.aureus serotipe 5 dan 8 (Fournier et al. 1993). Tes tersebut merupakan identifikasi S.aureus berdasarkan deteksi faktor penggumpalan, protein A, dan polisakarida kapsuler, sehingga terjadi penggumpalan sebagai hasil positifnya (Compernolle et al. 2007). Sampai saat ini, tujuh spesies koagulase-positif stafilokokus telah teridentifikasi, diantaranya: S.aureus, S.intermedius, S.schleiferisub sp.coagulans, S.hyicus, S.lutrae, S.delphini, dan S. pseudintermedius (Devriese et al. 2005; Freney et al. 1999). Sehingga penentuan spesies S.aureus berdasarkan tes koagulase tidak dapat menentukan secara tepat hingga tingkat spesies.
Identifikasi bakteri penyebab infeksi, khususnya S.aureus perlu dilakukan secara tepat. Hal tersebut berhubungan dengan pemeriksaan kepekaan terhadap antibiotk methicillin (MRS=Methicillin Resistant of Staphylococci) berdasarkan pedoman CLSI (Clinical and Laboratory Standards Institute). Dalam CLSI kosentrasi oxacilin untuk MIC (Minimal Inhibitory Concentration) resistan terhadap methicillin adalah 4 µg/ml, berbeda dengan spesies lain yaitu 0.5-2 µg/ml. Pada penelitian sebelumnya telah dilaporkan MIC oxacillin positif MRS adalah 0.5-2 µg/ml untuk spesies S. pseudintermedius (Descloux et al. 2008; Sasaki et al. 2007). Jika bakteri tersebut tidak teridentifikasi sebagai S. pseudintermedius, tetapi teridentifikasi sebagai S.aureus, maka akan terjadi kesalahan identifikasi MRS. Identifikasi spesies yang tidak tepat akan mempengaruhi pemberian antibiotik untuk infeksi Staphylococci yang resistan terhadap methicillin (Bemis et al. 2006). Identifkasi secara tepat juga berhubungan dengan kesehatan masyarakat terkait kejadian MRSA baik dari hewan ternak maupun dari manusia, karena MRSA juga dikenal dalam dunia kedokteran hewan. (Morgan 2008; Weese dan E.van 2010).
Kepekaan S.aureus terhadap Antibiotik
Berdasarkan hasil identifikasi secara genotipik melalui gen nuc, 49 isolat/48% dinyatakan positif sebagai bakteri S.aureus. Selanjutnya dilakukan uji kepekaan antibiotik menggunakan metode disc diffusion dari Kyrby Bauer dengan tujuan untuk mengetahui tingkat kepekaan bakteri S.aureus terhadap beberapa antibiotik dan dapat digunakan sebagai pilihan untuk mengobati mastitis subklinis yang disebabkan oleh bakteri S.aureus. Beberapa antibiotik yang digunakan dalam uji kepekaan antibiotik adalah golongan aminoglikosida (gentamisin), tetrasiklin, macrolida (eritromisin), sulfonamida (trimetoprim-sulfametoksazol), fenikol (kloramfenikol), dan β-laktam (oksasilin dan sefoksitin).
12
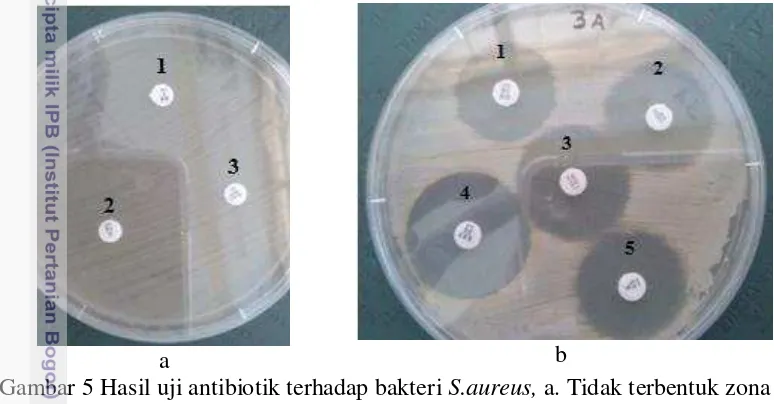
Berdasarkan hasil uji kepekaan antibiotik, mayoritas antibiotik yang digunakan dapat menghambat pertumbuhan bakteri S.aureus. Kepekaan antibiotik terhadap bakteri S.aureus ditentukan dengan terbentuknya zona bening pada media (Gambar 5a). Berdasarkan uji kepekaan terhadap 7 jenis antibiotik (Tabel 3 dan Lampiran 4)), dapat diketahui bahwa sebagian besar isolat S.aureus dari susu sapi mastitis subklinis masih sensitif terhadap gentamisin, tetrasiklin, eritromisin, trimetoprim-sulfametoksazol, dan kloramfenikol. Sebagian dari S.aureus bersifat resistan terhadap antibiotik β-laktam, yaitu oksasilin (9 isolat/22.5%) dan sefoksitin (9 isolat/22.5%), dimana isolat yang resistan terhadap oxacilin juga resistan terhadap cefoxitin.
a b
Gambar 5 Hasil uji antibiotik terhadap bakteri S.aureus, a. Tidak terbentuk zona bening (resistan). a.1. oksasilin, a.2. penisilin, a.3. sefoksitin. b. Terbentuk zona bening (sensitif). b.1 gentamisin, b.2. tetrasiklin, b.3. eritromisin, b.4. trimetoprim-sulfametoksazol, b.5. kloramfenikol Tabel 2 Hasil uji kepekaan antibiotik terhadap bakteri S.aureus
Antibiotik konsentrasi Resistan (jumlah/persentase)
Sensitif (Jumlah/Persentase)
Gentamisin 10 µg 0/0% 49/100%
Tetrasiklin 30 µg 0/0% 49/100% Eritromisin 15 µg 0/0% 49/100%
Trimetoprim-sulfametoksazol 1.25/23.75 µg 0/0% 49/100% Kloramfenikol 30 µg 0/0% 49/100% Oksasilin 1 µg 9/22.5% 40/77.5% Sefoksitin 30 µg 9/22.5% 40/77.5%
13 diantaranya golongan aminoglikosida (gentamisin), tetrasiklin, macrolida (eritromisin), sulfonamida (trimetoprim-sulfametoksazol), fenikol (kloramfenikol). Akan tetapi adanya isolat S.aureus yang telah resistan terhadap antibiotik, mengindikasikan bahwa antibiotik yang diberikan tersebut tidak sesuai dengan prinsip pengobatan antibiotik untuk mengatasi penyakit yang disebabkan oleh bakteri. Apabila diberikan, maka akan terjadi kecenderungan resistan terhadap antibiotik yang diberikan. Kecenderungan resistansi tersebut dapat terjadi seperti kejadian mastitis di daerah Baturaden yang telah resistan terhadap antibiotik β -laktam methicillin (5x.88%) dan juga resistan terhadap antibiotik lain, yaitu gentamisin (5,88%) (Aminah 2013).
Pada dasarnya mekanisme penghambatan masing-masing antibiotik adalah berbeda. Antibiotik jenis tetrasiklin, eritromisin, dan gentamisin bekerja dengan cara menghambat sintesis protein. Antibiotik tetrasiklin bekerja dengan cara menghambat pengikatan aminoacyl-transfer (t-RNA) pada A-site (Harms et al. 2003). Eritromisin mencegah terbentuknya subunit ribosom 50S, penghambatan eritromisin terjadi dalam tahap translasi antara proses inisiasi dan elongasi (Nicola et al. 1998). Gentamisin menghambat subunit 30S sehingga menghambat perpanjangan rantai polipeptida (Lambert 2012). Antibiotik golongan fenikol (kloramfenikol) bekerja dengan mencegah pepanjangan rantai polipeptida dengan menghambat aktivitas enzin peptidil transferase (Lambert 2012). Antibiotik trimetoprim-sulfamatoksazol merupakan perpaduan 2 jenis antibiotik. Trimetoprim bekerja dengan mengikatkan diri pada dihydrofolate reductase dan menghambat reduksi dihydrofolic acid (DHF) mejadi tetrahydrofolic acid (THF). Sulfametoksazol bekerja dengan menghambat dihydropteroate synthetase yang merupakan enzim yang berada di daerah upstream pada proses sintesis yang sama. Kombinasi kedua antibiotik tersebut memiliki fungsi yang sinergis dan dapat mengurangi perkembangan resistansi apabila hanya digunakan satu jenis (Brogden 1982). Antibiotik β-laktam (sefoksitin dan oksasilin) bekerja dengan cara menghambat biosintesis dinding sel. Antibiotik tersebut mengikat enzim transpeptidase dan menghambat sintesis dinding sel. Enzim transpeptidase disebut juga penicilin-binding protein (Walsh 2000).
Hasil Amplifikasi Gen mecA
Antibiotik jenis β-laktam, seperti penicilin, oxacilin, dan cefoxitin, sering digunakan dan sangat efektif dalam pengobatan infeksi yang disebabkan oleh Staphylococci (Sawant 2005). Namun, pengobatan antibiotik tersebut terkendala dengan resistansi antibiotik jenis β-laktam, yang dikenal dengan MRSA (Methicilin Resistant of Staphylococcus aureus). Berdasarkan hasil uji kepekaan antibiotik, terdapat 9 isolat/22.5% bakteri yang berasal dari susu mastitis subklinis resistan terhadap antibiotik jenis β-laktam, yaitu oksasilin dan sefoksitin.
14
bahwa sebanyak 93.75% kasus MRSA ditemukan pada sapi mastitis subklinis di daerah Boyolali, Pacitan, dan Ponorogo, namun gen mecA tidak terdeteksi pada semua isolat S. aureus baik yang resistan maupun sensitif terhadap methicilin dengan menggunakan metode disc diffusion. Beberapa penelitian menyebutkan bahwa amplifikasi gen mecA dengan teknik PCR merupakan konfirmasi yang baik untuk menunjukkan kejadian MRSA dan dapat mendeteksi dengan cepat (Baddour et al. 2007; Mohanasoundaram dan lalitha. 2008). Konfirmasi adanya gen mecA yang mengkodekan MRSA juga dilakukan dalam penelitian dan dihasilkan bahwa bakteri yang terdeteksi MRSA melalui uji antibiotik juga ditemukan adanya gen mecA.
Gambar 6 Hasil amplifikasi gen mecA penyandi MRSA (Methicilin Resistant of Staphylococcus aureus) dengan panjang 527 bp. Baris ke-1 adalah marker DNA 100-1500 bp, baris ke-2 kontrol positif MRSA, baris ke-3 sampai ke-11 sampel yang diuji, baris ke-12 kontrol negatif
MRSA menghasilkan PBP2α (Penicilin binding Protein) yang memberikan resistansi terhadap semua antibiotik jenis β-laktam. PBP2α dikodekan oleh gen mecA (Matsuhashi et al. 1986). Bakteri Gram positif memproduksi dinding sel luar tebal yang terdiri dari peptidoglikan yang berguna untuk memproteksi bakteri dari sistem pertahanan hospes, yaitu sistem komplemen atau pun kerusakan yang disebabkan tekanan osmotik (Hakenbeck et al. 1998). Karakteristik dari struktur cincin antibiotik β-laktam adalah mengikat PBP yang terkait dalam sintesis peptidoglikan dan mencegah sintesis dinding sel. Resistansi terhadap β-laktam merupakan hasil dari degradasi enzimatis dari cincin β-laktam oleh betalaktamase atau rendahnya afinitas (Vavra et al. 2003).
SIMPULAN DAN SARAN
Simpulan
15 bakteri S.aureus penyebab mastitis subklinis sensitif terhadap antibiotik tetrasiklin, gentamisin, kloramfenikol, eritromisin, dan trimetoprim-sulfametoksazol, sedangkan 22.5% bakteri dinyatakan resistan terhadap antibiotik β-laktam (sefoksitin dan oksasilin) dan ditemukan adanya gen mecA melalui konfirmasi secara molekuler.
Saran
Pemeriksaan mastitis subklinis perlu dilakukan secara berkala sehingga dapat menghasilkan produksi susu yang berkualitas.
Identifikasi secara tepat tentang bakteri penyebab mastitis dapat bekerjasama dengan balai penelitian peternakan, sehingga dapat dilakukan penanganan yang tepat, terutama untuk terapi antibiotik.
Uji antibiotik yang digunakan sebagai terapi mastitis subklinis perlu dilakukan secara berkala untuk mengetahui perkembangan resistansi antibiotik dan pemilihan antibiotik secara tepat.
16
DAFTAR PUSTAKA
Akers RM. 2002. Lactation and the Mammary Gland. Ames: Iowa State University Press.
Ali-Vehmas T, Vikerpuur M, Sandholm M. 1994. Lactoperoxidase antagonizes anti-staphylococcal activity of cell-wall destabilizing antibiotics. Prosiding Indigenous antimicrobial agents of milk: recent developments; 31.8-1.9.1994; Uppsala, Sweeden: International Dairy Federation. 164-174. Ali-Vehmas T, Vikerpuur M, Pyorala S, Atroshi F. 2001. Characterization of
hemolytic activity of Staphylococcus aureus strains isolated from bovine mastitis milk. Micribiological Research. 155(4):339-344.
Aminah S. 2013. Eesistensi Staphylococcus aureus asal susu sapi perah di Balai Besar Pembibitan Ternak Unggul (BBPTU) Baturaden terhadap berbagai antibiotic [skripsi]. Universitas Gajah Mada:Yogyakarta.
Anri A, Sugiri YD. 2010. Prevalensi patogen penyebab mastitis subklinis (Staphylococcus aureus dan Streptocuccus agalactiae) dan patogen penyebab mastitis subklinis lainnya pada peternak skala kecil dan menengah di beberapa sentra peternakan sapi perah di pulau Jawa. Rapat Teknis dan Pertemuan Ilmiah Kesehatan Hewan Bogor. 2010 jul 13-14; Jakarta, Indonesia. Jakarta (ID): Animal diseases-Congresses. Hlm 196-206.
Anand KB, Agrawal P, Kumar S, Kapila K. 2009. Comparison of cefoxitin disc diffusion test, oxacillin screen agar, and PCR for mecA gene for detection of MRSA. J. Med. Microbiol. 2(27):27-29.
Anjarwatu DU, Dharmawan AB. 2010. Identifikasi vancomycin resistant Staphylococcus aureus (VRSA) pada membran stetoskop di bawah rumah sakit margono soekarjo Purwokerto. Mandala of Helath. 4(2):87-91.
Arvidson S, Tegmark K. 2001. Regulation of virulence determinants in S. aureus. Int. J. Med. Microbiol. 291(2):159–170.
Baddour MM, Abu El Kheir MM, Fatani AJ. Comparison of mecA polymerase chain reaction with phenotypic methods for the detection of methicillin-resistant Staphylococcus aureus. Curr Microbiol. 55(2):473–479.
Barnum DA and Newbould FHS. 1961. The use of california mastitis test for the detecetion of bovine mastitis. Can. Vet. Jour. 2(3): 83-90.
Bemis DA, Jones RD, Hiatt LE, Ofori ED, Rohrbach BW, Frank LA, Kania SA. 2006. Comparison of tests to detect oxacillin resistance in Staphylococcus intermedius, Staphylococcus schleiferi, and Staphylococcus aureus isolates fromcanine hosts. J.Clin. Microbiol. 44(9): 3374-3376.
Berends ET, Horswill AR, Haste NM, Monestier M, Nizet V, von Köckritz-Blickwede M. 2010. Nuclease expression by Staphylococcus aureus facilitates escape from neutrophil extracellular traps. Journal of innate immunity. 2(6):576-586.
Bewley J, Arnold M. 2012. Recomended Milking Procedures for Maximum Milk Quality. University of Kentucky:USA.
17 Brogden RN, Carmine AA, Heel RC, Speight TM, Avery GS. 1982. Trimethoprim: a review of its antibacterial activity, pharmacokinetics and therapeutic use in urinary tract infections. Drugs. 23(6):405–430.
Bronner S, Monteil H, Prevost G. 2004. Regulation of virulence determinants in Staphylococcus aureus:complexity and applications. FEMS Microbiol Rev. 28(2):1-8.
Clinical Laboratory Standards Institute 2014. Performance Standards for Antimicrobial Susceptibility Testing: Twenty-third Informational Supplement M100-S23. Wayne, PA, USA: CLSI
Compernolle VG, Verschraegen G, Claeys. 2007. Combined use of Pastorex Staph-Plus and either of two new chromogenic agars, MRSA ID and CHROM agar MRSA, for detection of methicillin-resistant Staphylococcus aureus. J. Clin. Microbiol. 4(1):154-158.
Costa AM, Kay I, Palladino S. 2005. Rapid detection of mecA and nuc genes in staphylococci by real-time multiplex polymerase chain reaction. Diag. Microbiol. Infect. Dis. 51(1):13–17.
Cotar AI, Chifiriuc MC, Dinu S, Bucur M, Iordache C, Banu O, Dracea O, Larion C, Lazar V. 2010. Screening of molecular virulence markers in S. aureus and Pseudomonas aeruginosa strains isolated from clinical infections. Int. J. Mol. Sci. 11(12):5273–5291.
Descloux S, Rossano A, Perreten V. 2008. Characterization of new staphylococcal cassette chromosome mec (SCCmec) and topoisomerase genes in fluoroquinolone and methicillin-resistant Staphylococcus pseudintermedius. J. Clin. Microbiol. 46(5):1818-1823.
Devriese LA, Vancanneyt M, Baele M, Vaneechoutte M, De Graef E, Snauwaert C, Cleenwerck I, Dawyndt P, Swings J, Haesebrouck F. 2005. Staphylococcus pseudintermedius sp. nov., a coagulase-positive species from animals. Int. J. Sys. Evol. Microbiol. 55(4):1569-1573.
Ferguson JD, Azzaro G, Gambina M, Licitra G. 2007. Prevalence of mastitis pathogens in Ragusa, Sicily, from 2000 to 2006. J.Dairy Sci. 90(12):5798-5813.
Fournier JM, Bouvet A, Mathieu D, Nato F, Boutonnier A, Gerbal R, Slizewicz B. 1993. New latex reagent using monoclonal antibodies to capsular polysaccharide for reliable identification of both oxacillin-susceptible and oxacillin-resistant Staphylococcus aureus. J. Clin. Microbiol. 31(5):1342-1344.
Freer JH, Birkbeck TH. 1982. Possible conformation of delta-lysin, a membrane-damaging peptide of Staphylococcus aureus. J. Theo. Biol. 94(3):535-540. Freney J, Kloos WE, Hajek V, Webster JA, Bes M, Brun Y, Vernozy-Rozand C.
18
Gilbert FB, Fromageau A, Gélineau L, Poutrel B. 2006. Differentiation of bovine S.aureus isolates by use of polymorphic tandem repeat typing. Vet. Microbiol. 117(2):297-303.
Gillaspy AF, Hickmon SG, Skinner RA, Thomas JR, Nelson CL, Smeltzer MS. 1995. Role of the accessory gene regulator (agr) in pathogenesis of Staphylococcal osteomyelitis. Infection and immunity. 63(9):3373-3380. Goebel W, Chakraborty T, Kreft J. 1988. Bacterial hemolysins as virulence
factors. Antonie van Leeuwenhoek. 54(5):453-463
Hakenbeck R, Coyette J. 1998. Resistant penicillin-binding proteins. Cel. Mol. Life. 54(4):332-340.
Harley JP, Prescott LM. 2002. Laboratory Exercise in Microbiology, fifth edition. USA: The McGraw-Hill Companies.
Harms JM, Bartels H, Schlunzen F, Yonath A. 2003. Antibiotics acting on the translational machinary. J. Cell. Sci. 127 (12): 1391-1393.
Jones GM. 2009. Understanding the Basics of Mastitis. Virginia: Virginia State S, Eo SK. 2004. Evaluation of the methicillin-resistan Staphylococcus aureus (MRSA)-Screen latex agglutination test for detection of MRSA of animal origin. J. Clin. Microbiol. 42 (6) : 2780–2782
Mattila T, Sandholm M. 1986. Milk plasmin, N-Acetyl-β-D-Glucosaminidase, and antitrypsin as determinants of bacterial replication rates in whey. J. Dairy Sci. 69(3):670-675.
Matos JS, White DG, Harmon RJ, Langlois BE. 1991. Isolation of Staphylococcus aureus from sites other than the lactating mammary gland. J. Dairy Science. 74 (5):1544–1549.
Matsuhashi M, Song MD, Ishino F. 1986. Molecular cloning of the gene of a penicillin-binding protein supposed to cause high resistance to β-lactam antibiotics in Staphylococcus aureus. J Bacteriol. 167 (3):975–980.
Mohanasoundaram KM, Lalitha MK. 2008. Comparison of phenotypic versus genotypic methods in the detection of methicillin resistance in Staphylococcus aureus. Indian J. Med. Res. 127(1):78-84.
Morgan M. 2008. Methicillin-resistant Staphylococcus aureus and animals: zoonosis or humanosis. J. Antimicrobial Chemotherapy. 62(6):1181-1187. Neelesh S, Anshu S, Jain VK. 2008. Phenotypic and genotypic characterization
of Staphylococcus aureus isolated from mastitis cases of cows and buffaloes. J. Immunology and Immunopathology. 10 (2):119-123
Nicola FG, McDougal LK, Briddle JW, Tenover FC. 1998. Characterization of erythromycin-resistant isolates of Staphylococcus aureus recovered in the united states from 1958 through 1969. Antimicrob Agents Chemother. 42(11), 3024-3027
19 pneumoniae from nasopharyngeal secretions collected during field studies. Journal of Clinical Microbiology. 39(3):1021-1024.
Oliver SP, Gillespie BE, Headrick SJ, Moorehead A, Lunn P, Dowlen HH, Johnson DL, Lamar KC, Chester ST, Moseley WM. 2004. Efficacy of extended ceftiofur intramammary therapy for treatment of subclinical mastitis in lactating dairy cows. J. Dairy Sci. 87(8):2393-2400.
Olson ME, Nygaard TK, Ackermann L, Watkins RL, Zurek OW, Pallister KB, Voyich JM. 2013. Staphylococcus aureus nuclease is an SaeRS-dependent virulence factor. Infection and immunity. 81(4):1316-1324.
Østeras O, Sølverød L, Reksen O. 2006. Milk culture results in a large Norwegian survey: effects of season, parity, days in milk, resistance, and clustering. J. Dairy Sci. 89(3):1010-1023.
Pagels M, Fuchs S, J Pané-Farré, Kohler C, Menschner L, Hecker M, J. McNamarra P, Bauer MC, Von Wachenfeldt C, Liebeke M, Lalk M, Sander G, Von Eiff C, Proctor RA, Engelmann S. 2010. Redox sensing by a rex‐family repressor is involved in the regulation of anaerobic gene expression in Staphylococcus aureus. Molecular microbiology. 76 (5): 1142-1161.
Piau C, Jehan J, Leclercq R, Daurel C. 2008. Catalase-negative Staphylococcus aureus strain with point mutations in the katA gene. J. Clin. Microbiol. 46(6): 2060-2061.
Pinanditya FXS. 2014. Deteksi Gen MecA Isolat Staphylococcus aureus Resistan dan Sensitif terhadap Metisilin Asal Susu Sapi Perah [Tesis]. Universitas Gajah Mada: Yogyakarta.
Poulsen AB, Skov R, Pallesen LV. 2003. Detection of methicillin resistance in coagulase-negative staphylococci and in staphylococci directly from simulated blood cultures using the EVIGENE MRSA detection kit. Antimicrob Agents Chemother. 51(2):419-421.
Purnomo A, Hartatik, Khusnan, Salasia SIO, Soegitono. 2006. Isolasi dan karakterisasi Staphylococcus aureus asal usus kambing peranakan ettawa. Media Kedokteran Hewan. 22(2):142-147.
Roberson JR, Fox LK, Hancock DD, Gay JM, Besser TE. 1994. Ecology of Staphylococcus aureus isolated from various sites on dairy farms. J. Dairy Sci. 77(11): 3354–3364.
Rotter J, Kelly FC. 1966. Serological reactions associated with the clumping factor of Staphylococcus aureus. J. bacteriology. 91(2):588-594.
Rushdy AA, Salama MS, Othman AS. 2007. Detection of methicillin/oxacillin resistant S. aureus isolated from some clinical hospitals in Cairo using mecA/nuc genes and antibiotic susceptibility profile. Int. J. Agri. Biol. 9(6): 800–806.
Sawant AA. 2005. Descriptive and Molecular Epidemology of Antibiotic Resistant Gram Negative Enteric Bacteria from Dairy Cattle [thesis]. The Pennsylvanis State University:USA.
20
Scherrer D, Corti S, Muehlherr JE, Zweifel C, Stephan R. 2004. Phenotypic and genotypic characteristics of Staphylococcus aureus isolates from raw bulk-tank milk samples of goats and sheep. Vet. Microbiol. 101(2):101–107. Schroeder JW. 2012. Mastitis Control Programs: Bovine Mastitis and Milking
Management. North Dakota: North Dakota State University.
Seegers H, Fourichon C, Beaudeau F. 2003. Production effects related to mastitis economics in dairy cattle herds. Vet Res, forthcoming.
Sperber WZ, Tatini SR. 1975. Interpretation of the tube coagulase test for identification of Staphylococcus aureus. Applied microbiology. 29(4):502-505.
Surjowardojo P, Suyadi, Hakim L, Aulani’am. 2008. Ekspresi produksi susu pada sapi perah mastitis. J. Ternak Tropika. 9(2):1-11.
Suryanto D, Irmayanti, Lubis S. 2007. Karakterisasi dan uji kepekaan antibiotik beberapa isolat Staphyloccus aureus dari Sumatra Utara. Majalah Kedokteran Nusantara. 40(2):104-107.
Sutra L, Poutrel B. 1994. Virulence factors involved in the pathogenesis of bovine intramammary infections due to Staphylococcus aureus. J. Medical microbiol. 40(2): 79-89.
Tirtana LP. 2010. Identifikasi Staphylococcus aureus penyebab mastitis dengan uji fermentasi manitol dan deteksi produksi asetoin pada sapi perah di wilayah kerja koperasi usaha tani ternak Suka Makmur Grati Pasuruan. Veterenaria Medika. 1(1):1-12.
Taverna F, Negri A, Piccinini R, Zecconi A, Nonnis S, Ronchi S, Tedeschi G.
2007. Characterisation of cell wall associated proteins of a S.aureus
isolated from bovine mastitis case by a proteomic approach. Vet. Microbiol.
119(2): 240–247.
Vavra SB, Yin S, Challapalli M, Daum RD. 2003. Transcriptional induction of
the Penicillin-Binding Protein 2 Gene in Staphylococcus aureus by Cell Wall Active Antibiotics Oxacillin and Vancomycin. J. Antimicro. Agents and Chemother. 47(4): 1028–36.
Velasco D, Tomas MM, Cartelle M, Beceiro A, Perez A, Molina F, Moure R, Villanueva R, Bou G. 2005. Evaluation of different methods for detecting methicillin (oxacillin) resistance in Staphylococcus aureus. J. Antimicro. Agents and Chemother. 55 (3):379–382.
Virdis S, Scarano C, Cossu F, Spanu V, Spanu C, Santis. 2010. Antibiotic Resistance in Staphylococcus aureus and Coagulase Negative Staphylococci Isolated from Goats with Subclinical Mastitis. Veterinary Medicine International. doi:10.4061/2010/517060
Waage S, Bjorland J, Caugant D A, Oppegaard H, Tollersrud T, Mørk T, Aarestrup FM. 2002. Spread of Staphylococcus aureus resistant to penicillin and tetracycline within and between dairy herds. Epidemiology and Infection. 129 (1) : 193–202.
Wahyuni AETH, Winarno D, Valenti V, Franky. 2010. The surface of character of Staphylococcus aureus isolated from subclinical mastitis of dairy cow supporting adherence to udder ephithelial cell. J. Indonesian Trop. Anim. Agric. 35(3):2006-2012.
21 Watanakunakorn C, Bakie C. 1973. Coagulase production, mannitol fermentation, penicillinase elaboration, and phage typability of Staphylococcus aureus reverted from L-phase variants. Journal of Infectious Diseases. 127(5): 571-575.
Weese JS, E van Duijkeren E. 2010. Methicillin-resistant Staphylococcus aureus and Staphylococcus pseudintermedius in veterinary medicine. Veterinary microbiology. 140(3):418-429.
Welch RA. 1991. Pore‐forming cytolysins of gram‐negative bacteria. Molecular microbiology. 5(3):521-528
Wilkinson BJ. 1997. Biology In: Crossley KB, Archer GL, eds. The Staphylococci in human diseases. Churchill Livingston, London. pp 1-38. Winarso. 2008. Hubungan kualiitas susu dengan keragaman genetik dan
prevalensi mastits subklinis di daerah jalur susu Malang sampai Pasuruan. J. Sain Vet. 26(2):58-65
Zadoks RN, Van Leeuwen WB, Kreft D, Fox LK, Barkema HW, Schukken YH, Van Belkum A. 2002. Comparison of Staphylococcus aureus isolates from bovine and human skin, milking equipment, and bovine milk by phage typing, pulsed-field gel electrophoresis, and binary typing. J. Cli. Microbiol. 40 (11):3894–3902.
Zhang K, Sparling J, Chow BL, Elsayed S, Hussain Z, Church DL, Gregson DB, Louie T, Conly JM. 2004. New quadriplex PCR assay for detection of methicillin and mupirocin resistance and simultaneous discrimination of S.aureus from coagulase-negative staphylococci. J. Clin. Microbiol. 42(11): 4947-4955.
22
Lampiran 1 Hasil pemeriksaan mastitis subklinis dengan reagen CMT
24
Lampiran 2 Hasil pewarnaan Gram, uji katalase, dan uji oksidase
26
Lampiran 3 Standar diameter zona bening pada uji kepekaan antibiotik terhadap bakteri S.aureus
Antibiotik Resistan Intermediet Sensitif
Gentamisin (10 µg) ≤12 mm 13-14 mm ≥15 mm
Lampiran 4 Diameter zona hambatan beberapa antibiotik terhadap bakteri Staphylococcus aureus
sampel Diameter Zona Hambatan (mm)
27
sampel Diameter Zona Hambatan (mm)
SXT CN C TE OX E FOX
45A 30.8 26.3 22.3 26 23.3 27.4 33.5
47A1 23 27 28.7 31.8 25.3 30.6 30
50B1 22 26.8 29 35 19.8 28 24
51A 26 23.3 25 26 19.7 24 27
52A 36.4 33 31.3 32.8 39 35.4 41
53B 27.7 26.9 25.6 29 16 27.5 26.5
54A1 29 24.6 25.4 28.6 26.4 28 32
55A 28 25 24 28 26 27 30
57A 26.2 26.8 26.1 28.9 24.5 26.9 30.2
59A 29.8 28 27 31 26.5 29 33.2
61B 24.7 21.5 24.9 27.6 0 23 0
63B 28 21.4 18.5 24 20 23 25.2
66A1 24.7 21 19.7 22.8 17.8 23.3 30
70A1 20 34.3 32.3 36 20 33.4 29
73B 33 32 30 36.6 38 35 37
78A 27.9 23.4 29.3 28.9 12.5 25.4 23
86B 26.5 24.2 26.9 28.4 0 25 0
92A1 23 31 24 32 25 35.5 32
95A1 24 24.4 22.6 27.7 0 25.8 0
96A 24 25 23 27 0 26 0
97B 26.5 26 27 28.6 0 28 0
98B 27.4 22 30 26.9 0 24.5 0
28
Lampiran 5 Gambar pengamatan lokasi penelitian
Gambar 1 Kondisi kandang yang lembab dan licin
Gambar 2 Proses pemerahan menggunakan tangan
Gambar 3 Saluran pembuangan kotoran sapi
Gambar 4 Tempat penampungan air yang digunakan untuk membersihkan tempat
susu dan memandikan sapi
29 Lampiran 6 Hasil amplifikasi Gen nuc
Gambar 1 Hasil amplifikasi gen nuc pada tanggal 14 Maret 2014
Gambar 2 Hasil amplifikasi gen nuc pada tanggal 19 Maret 2014
30
Gambar 4 Hasil amplifikasi gen nuc tanggal 10 April 2014
Gambar 5 Hasil amplifikasi gen nuc tanggal 11 April 2014
31
RIWAYAT HIDUP
Penulis dilahirkan di Jombang, Jawa Timur pada tanggal 13 Mei 1990 dari ayah yang bernama Drs. Ahyat dan seorang ibu bernama Rubi’ah S.Pd. Penulis merupakan putri kedua dari tiga bersaudara.