POLA KUMAN DAN UJI KEPEKAAN DARI EMPIEMA DI RSUP. H. ADAM MALIK
MEDAN
TESIS
OLEH
SETIA PUTRA TARIGAN
PROGRAM PENDIDIKAN DOKTER SPESIALIS I DEPARTEMEN ILMU PENYAKIT PARU
FAKULTAS KEDOKTERAN USU/RSUP. H. ADAM MALIK MEDAN
BAB I PENDAHULUAN
1.1 . LATAR BELAKANG
Empiema masih merupakan masalah penting dalam bidang penyakit paru
karena secara signifikan masih menyebabkan kecacatan dan kematian walaupun
sudah ditunjang dengan kemajuan terapi antibiotik dan drainase rongga pleura
maupun dengan tindakan operasi dekortikasi.1 Mense GPL pernah meneliti tingkat keberhasilan dari beberapa prosedur penatalaksanaan empiema dan
mendapatkan hasil bahwa dengan tindakan dekortikasi sekalipun, angka
keberhasilannya tidak mencapai 100 %. Dari penelitian tersebut juga didapatkan
bahwa dengan penggunaan selang dada, angka keberhasilannya hanya 11 %.1 Mengetahui jenis kuman penyebab empiema dan memberikan antibiotik yang
tepat merupakan salah satu hal yang sangat membantu dalam penatalaksanaan
empiema disamping drainase yang baik dari rongga pleura. Untuk mengetahui
jenis kuman tersebut dapat dilakukan dengan cara pewarnaan langsung ataupun
dengan mengkultur cairan empiema tersebut. Untuk mengetahui antibiotik yang
tepat untuk kuman penyebab empiema tersebut, dilakukan pemeriksaan uji
kepekaan. Semua pemeriksaan ini memerlukan waktu yang kadang kadang
cukup lama sementara pemberian antibiotik tidak mungkin ditunda menunggu
hasil pemeriksaan tersebut. Lalu dasar apa yang kita pakai untuk memilih
antibiotik yang kira kira tepat sebelum hasil pemeriksaan kita dapatkan. Disinilah
terhadap antibiotik agar antibiotik yang kita berikan dapat lebih tepat. Disamping
itu dari pola tersebut dapat dibuat suatu hubungan antara penyakit yang
mendasari dan kuman yang didapat. Seperti pada penelitian retrospektif yang
dilakukan Chen dari tahun 1989 sampai 1998 di National Taiwan University
Hospital didapat hasil kuman yang paling banyak didapat dari kultur adalah
bakteri aerob Gram negatif (49,6 %) dengan jenis terbanyak adalah Klebsiella
pneumoniae (24,4 %). Didapati juga hasil bahwa penyakit yang mendasari paling
banyak adalah diabetes mellitus. Peneliti juga menduga adanya hubungan yang
kuat antara diabetes mellitus dan bakteri Klebsiella pneumoniae, sebab dijumpai
44 % Klebsiella pneumoniae dengan penyakit dasar diabetes mellitus dan hanya
15 % non Klebsiella pneumoniae mempunyai diabetes mellitus.1,2
Selain dari penyakit yang mendasari, penyebab dari empiema juga biasanya
mempunyai hubungan dengan kuman yang akan didapatkan di cairan empiema.
Seperti pada penelitian retrospektif yang dilakukan Nunley selama 13 tahun pada
14 pasien yang mendapat empiema setelah menjalani operasi transplantasi
paru, kuman yang didapatkan yaitu bakteri enterik Gram negatif, Staphylococcus
dan Candida. Kuman kuman ini biasanya sering menyebabkan infeksi
nosokomial.3
Dengan kemajuan penemuan antibiotik baru dapat dimungkinkan pola kuman
bisa berubah dari waktu ke waktu. Pola kuman dari cairan empiema sebelum
ditemukannya antibiotik lebih banyak didapati bakteri Streptococcus pneumoniae
atau Streptococcus haemolyticus. Pada tahun 1955 – 1965, kuman yang paling
anaerob lebih banyak didapat. Pada 80 an dan 90 an bakteri aerob kembali lagi
menjadi bakteri yang paling banyak didapat dari cairan empiema.2,4
Pada penelitian retrospektif yang dilakukan Brook pada tahun 1973 s/d1985
di Walter Reed Army Medical Center, Washington DC dan Naval Hospital,
Bethesda, Amerika , dijumpai hasil paling banyak ditemukan bakteri aerob saja
(64 %), kemudian campuran aerob dan aerob (23 %), kemudian bakteri anaerob
saja (13%). Bakteri aerob yang paling banyak adalah Streptococcus
pneumoniae, Staphylococcus aureus dan Escheria coli. Bakteri anaerob yang
paling banyak adalah Bacteroides sp, Prevotella dan anaerob cocci.5
Pada penelitian prospektif yang dilakukan De A di LTM Medical College and
Hospital, Sion, Mumbai, India dijumpai yang paling banyak adalah campuran
aerob dan anaerob (56,2 %), bakteri aerob saja (34,4 %), bakteri anaerob saja
(9,4 %). Bakteri anaerob terbanyak adalah Prevotella melaninogenicus
,Peptostreptococcus asaccharolyticus , Peptostreptococcus sp.6
Pada penelitian retrospektif yang dilakukan Jerng JS dkk pada tahun 1984 s/d
1996 di National Taiwan University Hospital, didapatkan hasil kuman yang
terbanyak adalah bakteri aerob Streptococcus viridans (32 % ). Pada penelitian
ini didapati juga bahwa Streptococcus viridans sering dijumpai bersama kuman
lain seperti bakteri aerob, anaerob dan jamur.7
Dari penelitian retrospektif yang dilakukan Alfageme, selama 6 tahun di
Valme University Hospital, Seville, Spanyol didapatkan hasil kultur positif pada
92 % sampel. Kuman paling banyak yaitu bakteri aerob saja (62%), kemudian
Bakteri aerob yang paling banyak ditemukan yaitu Staphylococcus aureus ,
kemudian Streptococcus pneumoniae dan Streptococcus intermedius. Bakteri
anaerob yang paling banyak ditemukan yaitu Bacteroides fragilis. Dijumpai juga
hasil kultur Mycobacterium tuberculosis pada 3 sampel.8
Dari penelitian retrospektif yang dilakukan Snider GL dkk dari tahun 1952
sampai 1967 di Wood Veterans Center, Wisconsin, Amerika, didapatkan hasil
kuman yang paling banyak didapat yaitu bakteri aerob, diantaranya
Streptococcus spp, Pseudomonas spp , Klebsiella pneumoniae. Bakteri anaerob
yang paling banyak didapat adalah Proteus dan Bacteroides.9
Dari penelitian retrospektif yang dilakukan Cheng dkk dari tahun 1992 sampai
2004 di Rumah Sakit Pendidikan di Los Angeles Amerika, didapatkan hasil
kuman yang paling banyak didapat adalah bakteri aerob Streptococcus viridans
dan Streptococcus pneumoniae.10
Dari banyak penelitian mengenai empiema hanya sedikit yang meneliti
mengenai kepekaan kuman yang didapat terhadap antibiotik, padahal hal
tersebut sebenarnya penting untuk diteliti mengingat keberhasilan pengobatan
sangat tergantung kepada antibiotik yang tepat. Penatalaksanaan empiema
memang tidak hanya dengan pemberian antibiotik saja, namun kadang-kadang
hanya dengan pemberian antibiotik yang tepat atau sesuai hasil uji kepekaan
bisa didapat perbaikan yang signifikan sehingga tindakan lain seperti torakostomi
atau bahkan dekortikasi tidak atau belum diperlukan.
Soeroso melaporkan mengenai seorang pasien dengan loculated empyema.
antibiotik, namun setelah 10 hari tampak perselubungan bertambah luas. Dari
CT scan dijumpai loculated effusion. Kemudian dilakukan punksi percobaan dan
didapat cairan pus kental serta dinding dada yang sudah tebal. Hasil kultur pus
dijumpai Klebsiella spp. Pasien kemudian dianjurkan untuk dilakukan tindakan
operasi (dekortikasi), namun pasien menolak. Akhirnya pasien hanya diberikan
antibiotik yang sesuai dengan uji kepekaan. Setelah 2 minggu, perselubungan
berkurang dan klinis membaik dan setelah 1 bulan, perselubungan hanya
tampak di lapangan bawah dan tampak juga penebalan pleura.11
Di institusi paru ini telah pernah diteliti mengenai pola kuman ini, uji kepekaan
dan juga penatalaksanaannya. Hal ini dilakukan oleh Helmi pada bulan
Desember 1986 s/d September 1988, di RS Pirngadi dan Balai Pengobatan
Penyakit Paru Paru, Medan. Dari 50 pasien empiema yang diteliti, dijumpai
kuman hanya dari 18 pasien. Dari 18 pasien tersebut seluruhnya dijumpai bakteri
aerob (100 %), dengan jenis terbanyak adalah Pseudomonas aeruginosa ,
kemudian Streptococcus viridans, dan Staphylococcus aureus. Pemeriksaan
terhadap bakteri anaerob tidak dilakukan pada penelitian ini.12
Dari data-data yang tertera diatas dapat diambil kesimpulan bahwa sangat
sedikit yang meneliti dan melaporkan uji kepekaan terhadap antibiotika dari
kuman yang dijumpai pada cairan empiema. Disamping itu juga, penelitian
mengenai pola kuman dan uji kepekaan dari cairan empiema, masih sedikit
dilakukan di Indonesia. Hal ini menjadi latar belakang penulis untuk meneliti
kembali mengenai pola kuman dan uji kepekaan dari cairan empiema.
1.2. PERUMUSAN MASALAH
Berdasarkan uraian latar belakang di atas dapat dirumuskan masalah
a. Bagaimana gambaran pola kuman dari empiema di Bagian Paru RSUP H
Adam Malik Medan
b. Bagaimana gambaran hasil uji kepekaan terhadap beberapa jenis
antibiotika dari kuman yang ditemukan.
c. Bagaimana hubungan antara penyakit dasar dengan jenis kuman yang
ditemukan.
1.3. TUJUAN PENELITIAN 1.3.1. Tujuan Umum
a. Mengetahui pola kuman dari empiema di Bagian Paru RSUP H Adam
Malik Medan
b. Mengetahui kepekaan terhadap beberapa jenis antibiotika dari kuman
yang ditemukan.
1.3.2. Tujuan Khusus
Mengetahui hubungan antara penyakit dasar dengan jenis kuman yang
ditemukan
1.4. MANFAAT PENELITIAN
a. Dari hasil penelitian ini dapat diketahui gambaran pola kuman dari
b. Dari hasil penelitian ini dapat diketahui kepekaan kuman terhadap
antibiotika, yang dapat digunakan sebagai pedoman untuk pemberian
antibiotika secara empiris sebelum hasil pemeriksaan yang
sesungguhnya didapatkan.
BAB II
TINJAUAN PUSTAKA
2.1. DEFINISI EMPIEMA
Empiema dapat didefenisikan sebagai pus atau nanah di rongga pleura
dengan karakteristik Bj >1,018, lekosit > 500/mm3 atau protein > 2,5 gr/dl. Pendapat lain mendefenisikan empiema sebagai cairan pleura dengan kultur
bakteri positif atau lekosit > 15000/mm3 dengan protein > 3 gr/dl.4 Mense mendefenisikan empiema sebagai cairan pleura dengan memenuhi salah satu
kriteria dibawah ini yaitu :
1. Didapat organisme/kuman pada kultur cairan pleura atau pada pewarnaan
Gram.
2. Cairan berbentuk pus.
3. Analisa cairan pleura didapat pH < 7,10 dengan LDH > 1000 IU/L atau dengan
glukosa < 40 mg/dl.1
2.2. EPIDEMIOLOGI EMPIEMA
Empiema telah dikenal sejak lebih kurang 500 tahun sebelum Masehi, dan
pada zaman itu Hippocrates merekomendasikan penanganan empiema dengan
open drainage. Pada tahun 1876, Hewitt memperkenalkan closed drainage untuk
penanganan empiema dengan menggunakan selang karet yang dimasukkan ke
rongga dada dengan menggunakan kanul. Selang karet tersebut dihubungkan
Pada tahun 1890, diperkenalkan tindakan torakoplasti dan dekortikasi. Kemudian
pada tahun 1950 diperkenalkan penggunaan Streptokinase dan Streptodornase.
Dan pada dekade terakhir ini penggunaan VATS telah luas digunakan pada
penanganan empiema.4 Suzuki pernah meneliti efikasi dari VATS untuk penanganan empiema yang kronis dan hasilnya menunjukkan bahwa VATS
sebagai tindakan invasif yang minimal sangat baik untuk mengatasi pasien
dengan empiema kronis terutama pada pasien usia tua dan dengan debilitas.13 Prevalensi efusi parapneumonik dan empiema berkisar 40 % dari pasien
pneumonia bakterial yang dirawat inap di rumah sakit di Amerika.4 Ada juga yang mendapatkan angka 57 % dari pneumonia yang dirawat inap14. Sementara Brook mendapati dari 197 pasien empiema yang diteliti, 40 % diantaranya disebabkan
pneumonia. Selain pneumonia, faktor penyebab lain yaitu aspirasi pneumonia
(21 %), abses paru (6,5%), pasca torakotomi (6,5%), esofagus (3,5 %), abses
sub diafragma (4 %), metastasis jauh (4,5 %), metastasis dekat (8 %)5. Jenis kuman penyebab pneumonia juga mempengaruhi terjadinya empiema.
Pneumonia akibat bakteri aerob Gram positif jenis Bacillus anthracis bisa
mengakibatkan empiema pada 90 – 100 % kasus, sedangkan jenis
Streptococcus pyogenes bisa mengakibatkan empiema pada 55 – 95 % kasus.4
2.3. PATOFISIOLOGI EMPIEMA
Terjadinya empiema merupakan sekunder dari suatu proses infeksi di tempat
lain yang meluas ke pleura atau karena masuknya kuman ke rongga pleura.
diantaranya akibat perluasan langsung dari infeksi mulut, retrofaring,
paravertebra, abses kulit, atau akibat masuknya kuman ke rongga pleura oleh
karena trauma atau pembedahan. Tindakan torasintesis atau torakotomi pada
pneumotoraks yang tidak steril, perforasi esofagus, pneumotoraks spontan,
infeksi subdiafragma juga dapat menimbulkan empiema. Snider dan Saleh
pernah meneliti penyebab empiema dari 105 kasus dengan hasil terbanyak
adalah infeksi paru dan pasca operasi (Tabel 1).9
Tabel 1. Patogenesis dari 105 kasus empiema.9
Jumlah Persentase
Infeksi Paru 58 55,2
Pasca operasi 23 21,9
Pasca trauma 4 3,8
Fistula esophagus 4 3,8
Pneumotoraks spontan 4 3,8
Pasca torasintesis 4 3,8
Proses subdiafragma 2 1,9
Etiologi tidak diketahui 6 5,7
Mekanisme penyebaran infeksi sehingga mencapai rongga pleura dapat
dibagi kepada 4 yaitu :
1. Infeksi paru. Infeksi paru seperti pneumonia dapat menyebar secara langsung
ke pleura, penyebaran melalui sistem limfatik atau penyebaran secara
hematogen. Penyebaran juga bisa terjadi akibat adanya nekrosis jaringan
2. Mediastinum. Kuman kuman dapat masuk ke rongga pleura melalui tracheal
fistula, esophageal fistula, adanya abses di kelenjar mediastinum atau
adanya osteomyelitis vertebra.
3. Subdiafragma. Adanya proses di peritoneal atau di visceral dapat juga
menyebar ke rongga pleura.
4. Inokulasi langsung. Inokulasi langsung dapat terjadi akibat trauma, iatrogenik,
pasca operasi. Pasca operasi dapat terjadi infeksi dari hemotoraks atau
adanya leak dari bronkus.9
Proses infeksi di paru seperti pneumonia , abses paru, bronkiektasis, sering
mengakibatkan efusi parapneumonik yang merupakan awal terjadinya empiema.
Ada tiga fase perjalanan efusi parapneumonik. Fase pertama yaitu fase eksudatif
yang ditandai dengan penumpukan cairan pleura yang steril dengan cepat di
rongga pleura. Penumpukan cairan tersebut akibat peninggian permeabilitas
kapiler di pleura visceralis yang disebabkan pneumonitis. Cairan ini mempunyai
karakteristik rendah lekosit, rendah LDH, normal glukosa, dan normal pH. Bila
diberikan antibiotik yang tepat pada fase ini, maka efusi pleura tidak akan
berlanjut.
Bila pemberian antibiotik tidak tepat, bakteri yang berasal dari proses
pneumonitis tersebut akan menginvasi cairan pleura yang akan mengawali
terjadinya fase kedua yaitu fase fibropurulent. Pada fase ini cairan pleura
mempunyai karakteristik PMN lekosit tinggi, dijumpai bakteri dan debris selular,
hanya dengan antibiotik tetapi memerlukan tindakan lain seperti pemasangan
selang dada.
Bila penanganan juga kurang baik, penyakit akan berlanjut memasuki fase
akhir yaitu fase organization. Pada fase ini fibroblas akan berkembang ke
eksudat dari permukaan pleura visceralis dan parietalis dan membentuk
membran yang tidak elastis yang dinamakan pleural peel. Pleural peel akan
menyelubungi paru dan menghalangi paru untuk mengembang. Pada fase ini
eksudat sangat kental dan bila penanganan tetap tidak baik, penyakit dapat
berlanjut menjadi empiema nesesitas akibat cairan pleura mengalir sendiri
menuju ke dinding toraks atau sebaliknya terjadi bronchopleural fistula akibat
cairan pleura mengalir menuju paru. Secara lebih rinci, Light membagi cairan
efusi parapneumonik dan empiema ini menjadi 7 kelas (tingkatan) berdasarkan
radiologis, analisa cairan, pewarnaan Gram maupun kultur cairan (Tabel 2).4
2.4. BAKTERIOLOGI EMPIEMA
Secara garis besar bakteri yang didapat pada manusia dibagi kepada 4
bagian besar (Tabel 3).15 Dari banyak penelitian, bakteri aerob lebih banyak ditemukan pada cairan empiema dibandingkan anaerob. Jenis bakteri aerob
yang paling banyak ditemukan adalah Staphylococcus aureus, Streptococcus
pneumoniae, Streptococcus pyogenes. Bakteri aerob Gram positif ditemukan
lebih banyak dari bakteri aerob Gram negatif. Bakteri aerob Gram negatif yang
paling banyak ditemukan adalah Klebsiella spp, Pseudomonas spp, dan
Tabel 2.Pembagian Kelas (Tingkatan) Efusi Parapneumonik dan Empiema dan skema terapi.4 Kelas 1
Nonsignificant pleural effusion
Kecil.Kurang dari 10 mm pada foto toraks posisi dekubitus.
Tidak diperlukan torasintesis Kelas 2
Typical parapneumonic pleural effusion
Lebih dari 10 mm.Glukosa > 40 mg/dl, pH >7,2,LDH < 3 x batas atas normal,pewarnaan Gram dan kultur negatif.
Antibiotik saja Kelas 3
Borderline complicated pleural effusion
7 < pH <7,2 dan/atau LDH > 3 x batas atas normal,glukosa > 40 mg/dl,pewarnaan Gram dan kultur negatif.
Antibiotik dan torasintesis berulang Kelas 4
Simple complicated pleural effusion
pH < 7 atau glukosa < 40 mg/dl atau pewarnaan Gram positif atau kultur positif,tidak loculated,tidak pus (nanah)
Tube thoracostomy ditambah antibiotic
Kelas 5
Complex complicated pleural effusion
PH < 7 dan/atau glukosa < 40 mg/dl atau pewarnaan Gram positif atau kultur positif, multiloculated
Tube thoracostomy ditambah fibrinolitik
Kelas 6
Simple empyema
Pus (nanah),cairan bebas bergerak
Tube thoracostomy,bisa dilakukan dekortikasi.
Kelas 7
Complex empyema
Pus (nanah),multiloculated
Tube thoracostomy,bisa ditambah fibrinolitik.Sering
diperlukan tindakan torakoskopi dan dekortikasi.
Tabel 3.Prinsip pembagian kelompok bakteri pada manusia.15 Genera
I.Fleksibel,dinding sel tipis,pergerakan dengan gliding
mechanism : Gliding Bacteria
II.Fleksibel,dinding sel tipis,pergerakan dengan axial
filament : Spirochetes
Treponema,Borrelia,Leptospira
III.Kaku,dinding sel tebal,tidak bergerak atau bergerak dengan flagella: Eubacteria
A.Mycelial(actinomycetes)
B.Simple unicellular
1.Obligate intracellular parasites 2.Free –living a.Gram positif (1)Cocci (2)Nonsporulating rods (3)Sporulating rods Obligate aerobes Obligate anaerobes b.Gram negatif (1)Cocci (2)Nonenteric rods Spiral forms
Straight,very small rods
(3)Enteric rods Facultative anaerobes Obligate aerobes Obligate anaerobes Mycobacterium,Actinomyces,Nocardia Streptomyces Rickettsia,Coxiella,Chlamydia Streptococcus,Staphylococcus Corynebacterium,Listeria Bacillus Clostridium Neisseria Spirillum Pasteurella,Brucella,Yersinia, Haemophilus,Bordetella
Escherichia (coliform bacteria) Salmonella,Shigella,Klebsiella,Proteus Vibrio
Pseudomonas
Bacteroides,Fusobacterium IV.Dinding sel tidak ada Mycoplasma
Bakteri anaerob yang paling banyak ditemukan adalah Bacteroides spp dan
Peptostreptococcus. Bakteri anaerob sering dijumpai bersama bakteri lain dan
jarang dijumpai tunggal pada cairan empiema.1,4,6,9,11
Banyaknya bakteri anaerob yang didapat dari kultur sangat tergantung pada
cara mengkultur bakteri tersebut yang sangat berbeda dengan cara mengkultur
bakteri aerob. Cara pengambilan dan transport spesimen juga harus dilakukan
dengan benar bebas oksigen disamping media yang digunakan juga berbeda
dengan yang biasa dipakai untuk bakteri aerob. Perlu juga dilihat populasi pasien
yang diteliti. Pada populasi dengan banyaknya pasien usia tua , aspirasi sering
terjadi dan menjadi penyebab dari pneumonia. Bakteri yang paling banyak
dijumpai pada aspirasi adalah bakteri anaerob karena bakteri anaerob banyak
terdapat di rongga mulut. Pada pasien usia muda biasanya banyak dijumpai
Streptococcus pneumoniae dan pada anak umumnya dijumpai Haemophylus
influenzae.4
Streptococcus pneumoniae atau Diplococcus pneumoniae atau
Pneumococcus merupakan penyebab terbanyak dari pneumonia.4 Bakteri ini termasuk golongan Streptococcus Non Beta Hemolyticus.16 Pneumonia akibat bakteri ini bisa mengakibatkan efusi pleura pada 40-60 % kasus tetapi hanya
didapatkan hasil kultur yang positif pada 1-5 % kasus.4 Dari pneumonia dapat terjadi komplikasi berupa empiema, septikemia, endokarditis, perikarditis,
meningitis, dan artritis. Selain pneumonia, bakteri ini dapat menimbulkan
sinusitis, otitis media, osteomielitis, artritis, peritonitis, ulserasi kornea dan
merupakan carrier bakteri ini.16 Bakteri ini menjadi patogen bila terjadi abnormalitas saluran nafas seperti pada infeksi virus, obstruksi bronkus, atau
penumpukan mukus. Juga bisa terjadi akibat ketergantungan obat atau alkohol,
dan malnutrisi.16 Pada pemeriksaan mikroskopik dari sediaan yang diwarnai dengan Gram, bakteri ini tampak berbentuk lanset, Gram positif dan berkapsul.
Bakteri ini sukar tumbuh dalam medium sederhana mudah melarut dalam larutan
garam empedu dan sensitif terhadap optochin (ethyl-hydrocuprein).17 Gejala klinis pneumonia akibat bakteri ini sifatnya akut dengan demam, menggigil, nyeri
dada, sputum bloody atau rusty.16 Pemilihan antibiotika yang tepat bakteri ini adalah penicillin.16
Berbeda dengan Streptococcus pneumoniae, Streptococcus pyogenes lebih
jarang menjadi penyebab pneumonia, tetapi lebih tinggi persentasenya dijumpai
di cairan pleura yaitu sekitar 30-40 %.4 Bakteri ini termasuk golongan
Streptococcus Beta Hemolyticus Group A.16
Streptococcus viridans yang termasuk kelompok Streptococcus Non Beta
Hemolyticus, juga sering ditemukan pada cairan pleura atau empiema. Pada
pemeriksaan mikroskopik dari sediaan usap yang diwarnai dengan Gram terlihat
bakteri ini berbentuk bola, Gram positif, tersusun seperti rantai panjang, tidak
ada spora . Koloninya di agar darah biasanya tidak berpigmen. Hemolisanya
tidak sempurna dimana tampak warna kehijau - hijauan disekeliling koloni (green
hemolysis). Koloni Streptococcus pneumoniae di lempeng agar darah sukar
dibedakan dengan Streptococcus viridans, karena keduanya memberikan
yang tepat dari Streptococcus adalah Penicillin dengan alternatif lain yaitu
Eythromycin atau Cephalosporin .16
Tabel 4.Perbedaan antara S pneumoniae dan S viridans.17 Perbedaan S pneumoniae S viridans
1. Morfologi Koloni Haemolytic, draughtman coloni Haemolytic,koloni convex
2.Morfologi Mikroskopis Oval, lanset dua dua rantai pendek
Spheris, ovoid berantai panjang
3. Optochin disc Peka Tidak peka
4. Bile solubility Larut Tidak larut 5. Kapsul Bisa berkapsul Tidak ada kapsul
6. Virulensi terhadap Manusia
Tinggi Sangat rendah
Staphylococcus aureus juga merupakan bakteri Gram positif yang sering
menyebabkan pneumonia.4 Staphylococcus aureus merupakan persistent carrier
pada 20 % individu sehat.18
Bakteri ini adalah bakteri Gram positif dengan sifatnya yang dapat
menghemolisa darah dan mengkoagulasi plasma. Bakteri ini tumbuh pada
keadaan aerob atau microaerophilic. Koloninya pada media padat berbentuk
bulat, licin, dan membentuk pigmen yang berwarna kuning keemasan. Bakteri ini
dapat memproduksi Eksotoksin yang dapat menghemolisis eritrosit, kemudian
Leukocidin yang dapat membunuh leukosit. Bakteri ini juga memproduksi
Enterotoksin dan Koagulase.16,17 Persentase terjadinya efusi pleura juga tinggi akibat infeksi bakteri ini yaitu sekitar 40 % pada dewasa dan 70 % pada anak
% kasus pada dewasa.4 S. aureus dibagi 2 strain yaitu strain MSSA (Methcillin Susceptible Staphylococcus Aureus) dan MRSA (Methcillin Resistence
Staphylococcus Aureus ). Antibiotik yang direkomendasikan untuk pengobatan
pneumonia karena S. aureus strain MSSA yaitu Nafcillin dengan alternatif lain
yaitu Vancomycin dan Clindamycin. Untuk strain MRSA direkomendasikan
penggunaan Vancomycin dan Linezolid.18
Pseudomonas aeruginosa merupakan salah satu bakteri aerob Gram negatif
yang juga sering mengakibatkan pneumonia.4 P. aeruginosa masuk kelompok
bakteri enterik Gram negatif dari famili Pseudomonadaceae. P. aeruginosa
sering muncul sebagai flora normal di saluran intestinal dalam jumlah yang
sedikit. P. aeruginosa menjadi patogen hanya bila pertahanan tubuh menurun
atau bila ada infeksi yang disebabkan kuman lain. P aeruginosa dapat
memproduksi endotoksin dan eksotoksin. Endotoksin akan mengakibatkan
demam, leukopenia, hipoglikemia, hipotensi, shock, mengganggu perfusi ke
jaringan, intravascular coagulation dan kematian. Eksotoksin dapat menginhibisi
sintesis protein dan menyebabkan nekrosis jaringan. Koloni bakteri ini pada
media berbentuk bulat, licin, mengeluarkan pigmen berwarna kehijauan dan
berbau sweetish (harum).19 Sekitar 25-50 % pneumonia ini berkembang menjadi efusi pleura dan sekitar 40-50 % kasus bisa didapatkan kultur yang positif dari
cairan pleura.4 Infeksi Pseudomonas sering merupakan infeksi nosokomial dan juga sering pada pasien pasien dengan daya tahan tubuh yang lemah seperti
pasien yang mendapat antibiotik atau steroid atau yang sedang terinfeksi oleh
Pseudomonas yang didapat selama perawatan. Kondisi pasien pada awal
perawatan membaik tetapi setelah 15 hari perawatan kondisi pasien memburuk
kembali dan akhirnya mengakibatkan pasien meninggal setelah 30 hari
perawatan. Dari hasil uji kepekaan dari aspirasi trakea, dahak dan cairan pleura
yang dilakukan sebanyak 7 kali didapatkan bahwa pola kepekaan antibiotik
terhadap Pseudomonas berubah dari awal pemeriksaan sampai akhir
pemeriksaan. Pada awalnya chloramphenicol, tetracycline, kanamycin masih
sensitif, tetapi menjelang pasien meninggal ketiga antibiotik tersebut sudah
resisten terhadap pseudomonas.20 Pemilihan antiobiotik yang tepat pada
Pseudomonas adalah Gentamicin ditambah Carbenicillin dengan alternatif
Polymyxin atau Amikacin.21
Klebsiella pneumoniae juga merupakan salah satu bakteri aerob Gram negatif
yang sering didapat.4 Sepuluh persen dari pneumonia karena K.pneumoniae, bisa disertai dengan efusi pleura, dan sekitar 20% dari efusi tersebut bisa
dijumpai hasil yang positif dari kultur.4 K.pneumoniae masuk famili escherichiae
yang biasanya bukan flora normal pada manusia. K. pneumoniae merupakan
bakteri nonmotile, tidak membentuk spora, berkapsul, batang Gram negatif dan
memproduksi mukus. Koloni bakteri ini pada media berbentuk sangat kental,
mucoid growth, nonmotile.19,22 Bakteri ini bisa mengakibatkan konsolidasi dan nekrosis yang luas pada paru. Lobus atas paru merupakan bagian yang sering
terlibat akibat bakteri ini. Bila penyembuhan atau resolusi pneumonia memakan
jangka waktu yang lama dapat dipikirkan bahwa hal itu mungkin disebabkan oleh
dapat mirip dengan gambaran foto toraks TB Paru karena gambaran lesi pada
kedua penyakit sering berada pada lobus atas paru, kemudian kedua penyakit ini
juga bisa menyebabkan kavitas, penebalan pleura, fibrosis, kontraksi dan distorsi
dari fisura. Bisa juga dijumpai kedua kuman tersebut bersamaan. Untuk
membedakannya harus dipastikan dengan pemeriksaan sputum BTA DS (Basil
Tahan Asam Direct Smear) 3 x, kultur sputum dan Mantoux Test.22 Walaupun
K.pneumoniae bukan flora normal, tetapi pada 2 – 25 % populasi bisa
merupakan carrier. Biasanya pasien yang carrier ini menderita penyakit lain
seperti otitis media kronis, sinusitis kronis, tonsilitis berulang, penyakit gigi dan
gusi. Tidak ada drug of choice terhadap bakteri ini, tetapi pada satu penelitian
didapati nilai kepekaan K.pneumoniae paling tinggi pada Streptomycin dan
Chloramphenicol.22 Ada juga yang menyatakan Cephalosporin atau Gentamycin sebagai drug of choice.21
Haemophylus influenzae adalah bakteri aerob Gram negatif yang sering
ditemukan pada anak. Tujuh puluh lima persen dari pneumonia karena bakteri ini
bisa dijumpai efusi pleura dan 80 % dari efusi pleura ini bisa dijumpai kultur yang
positif.4
Mycobacterium tuberculosis juga dapat pada cairan pleura. Bakteri ini bisa
didapat pada kurang lebih 40 % kasus efusi pleura akibat bakteri ini (tuberculous
pleuritis).23 Bakteri ini masuk famili Mycobacteriaceae, berbentuk batang, lurus, tidak membentuk spora. Bakteri ini tidak bisa diwarnai dengan pewarnaan biasa
karena dinding selnya mengandung lemak sampai hampir 60 %, sehingga
zat warna. Ada beberapa pengecatan tahan asam untuk mewarnai bakteri ini,
yang lazim digunakan adalah pengecatan Ziehl Nielsen. Cara lain adalah
pengecatan Kinyoun Gabett atau pengecatan Than Thiam Hok. Pada
pengecatan tersebut kuman tampak berwarna merah dengan latar belakang biru.
Pada pewarnaan fluorochrom, kuman berfluoresensi dengan warna kuning
oranye. Kuman ini tumbuh secara obligat aerob. Kandungan lemak pada dinding
sel yang tinggi menyebabkan kuman ini sangat tahan terhadap asam dan basa
dan juga tahan terhadap kerja bakterisidal antibiotika. Ada beberapa medium
yang bisa digunakan untuk mengisolasi kuman ini, tetapi yang sering digunakan
adalah media Lowenstein Jensen.24,25 Tuberculous empyema biasanya muncul
pada jaringan paru yang fibrotik. Gejala klinis biasanya subakut dengan demam
subfebril, lemah dan penurunan berat badan. Empiema yang terjadi bisa juga
akibat terjadinya bronchopleural fistula dengan masuknya kuman yang lain dari
bronkus menuju pleura sehingga terjadi superinfection.23 Dapat dijumpai kuman
M. tuberculosis dari pewarnaan langsung (direct smear) atau dari kultur, tetapi
bisa juga tidak dijumpai. Seperti pada penelitian yang dilakukan Goyal, dari 53
pasien tuberculous empyema,15 pasien tidak dijumpai kuman M tuberculosis,
baik dari pewarnaan langsung atau dari kultur. Pada penelitian ini juga dijumpai
kuman kuman lain selain kuman M tuberculosis pada 41 pasien. Pengobatan
sangat sulit akibat selain pemberian OAT (Obat Anti Tuberkulosis) juga harus
diberikan antibiotik untuk kuman yang lain. Disamping itu, dinding pleura yang
dijumpai juga pada 19 pasien harus dilakukan tindakan dekortikasi, torakoplasti,
dan pleuropneumonektomi.26
Pada penelitian De A, bakteri anaerob lebih banyak didapat pada cairan
empiema dibandingkan bakteri aerob walaupun bakteri anaerob yang dijumpai
tersebut bersamaan dengan bakteri aerob. Bakteri anaerob yang paling banyak
didapat adalah Prevotella melaninogenicus, Peptostreptococcus
asaccharolyticus, Peptostreptococcus spp.6 Pada penelitian Bartlett dijumpai hasil dari 193 pasien dengan infeksi anaerob pada paru dan pleura, bakteri
anaerob yang paling banyak ditemukan yaitu Peptostreptococcus, Bacteroides,
Fusobacterium.27 Peptostreptococcus merupakan strain dari Streptococcus yang
hanya tumbuh pada kondisi anaerob atau microaerophilic. Bacteroides dan
Fusobacterium merupakan flora normal pada mulut dan saluran pernafasan atas.
Media yang biasa dipakai untuk pembiakan bakteri anaerob adalah Agar
Brucella.16 Dapat dijumpai efusi pleura pada 35 % kasus pneumonia yang disebabkan bakteri anaerob. Persentase kultur yang positif pada cairan pleura
tersebut juga tinggi yaitu sekitar 90 %.4
Untuk membedakan bakteri aerob dan anaerob secara cepat bisa digunakan
tehnik direct gas-liquid chromatography, seperti yang dilakukan Thadepalli
terhadap 52 pasien empiema. Thadepalli mendapatkan 14 pasien dengan bakteri
anaerob, 22 pasien dengan bakteri aerob dan 16 pasien tidak didapatkan
kuman.28
Jamur juga bisa dijumpai pada cairan empiema. Pada penelitian retrospektif
Hospital, didapatkan 73 sampel dengan kultur positif jamur. Spesies terbanyak
adalah Candida (47 %), dengan strain terbanyak adalah Candida albicans (28
%). Dari penelitian itu didapatkan penyebab terbanyak terjadinya empiema
adalah penyakit abdominal (30 %), infeksi bronkopulmonal (22 %), torakostomi
(18 %), torasintesis berulang (7 %).29 Pemilihan antibiotik yang tepat adalah
Amphotericin B yang dapat diberikan sistemik atau intra pleura.21
Kuman kuman lain yang pernah dilaporkan didapat di cairan empiema antara
lain Trichomonas 30, Actinomycoses naeslund i31, Histoplasma capsulatum 32,
Cryptococcus neoformans 33, Clostridium perfringens 34, Legionella pneumophila.35
2.5. DIAGNOSIS EMPIEMA
Diagnosis empiema ditegakkan dari gejala klinis, fisis diagnosis, foto toraks,
darah rutin dan pungsi percobaan. Gejala klinis pasien empiema yang
disebabkan kuman aerob biasanya bersifat akut dengan keluhan demam, sesak
nafas, nyeri dada, produksi sputum dan lekositosis, sementara yang disebabkan
kuman anaerob biasanya menunjukkan gejala yang subakut. Pada satu
penelitian dengan empiema anaerob didapatkan rata - rata pasien sudah
mengalami gejala lebih kurang 15 hari sebelum masuk rumah sakit. Gejala lain
dijumpai juga seperti penurunan berat badan.4,27
Pada fisis diagnosis dijumpai hemitoraks bulging, sela iga melebar pada sisi
efusi bila tekanan pleura meningkat. Bila pada sisi efusi tekanan pleura menurun
mengecil, sela iga menyempit. Pada palpasi dijumpai stem fremitus yang
melemah pada sisi efusi. Pada perkusi dijumpai suara beda pada sisi efusi. Pada
auskultasi dijumpai suara pernafasan melemah atau menghilang pada sisi
efusi.36
Dari foto toraks lateral dapat dilihat bayangan cairan di rongga pleura. Bila
bayangan tersebut dikaburkan dengan bayangan infiltrat, sebaiknya dilakukan
foto lateral dekubitus untuk membedakannya. Bila ada cairan di rongga pleura,
maka cairan akan bergerak menuju tempat yang terendah, dan jumlah cairan
tersebut dapat diperkirakan dengan mengukur jarak dinding dada bagian dalam
dengan bagian bawah paru. Bila jarak tersebut < 1 cm, efusi tersebut tidak
signifikan dan tindakan torasintesis tidak dianjurkan. Bila jarak tersebut > 1 cm
perlu dilakukan torasintesis untuk evakuasi cairan, pemeriksaan cairan dan untuk
membedakan efusi tersebut apakah complicated effusions atau uncomplicated
effusions atau telah masuk kelas yang mana dari klasifikasi Light. Cairan pleura
itu secara makroskopis dilihat warna, kekentalan dan bau. Selanjutnya cairan
pleura dikirim ke laboratorium untuk dilakukan analisa cairan pleura yang
meliputi berat jenis, pH, protein, lekosit, Diff Tell, LDH dan glukosa. Juga
dilakukan pewarnaan Gram, kultur untuk kuman aerob dan anaerob, sitologi, dan
pewarnaan serta kultur untuk jamur dan Basil Tahan Asam (BTA) bila terdapat
indikasi secara klinis.4
Warna cairan pleura pada efusi parapneumonik bervariasi sesuai dengan
kelasnya, mulai dari jernih, kuning sampai kuning kental. Bila cairan pleura
bakteri anaerob. Bila pada cairan dijumpai sisa makanan, mungkin penyebabnya
adalah esophageal pleural fistula.4
2.6. PENATALAKSANAAN EMPIEMA
Penatalaksanaan empiema dibagi kepada 2 hal penting yaitu pemilihan
antibiotik yang tepat dan penatalaksanaan terhadap cairan empiema tersebut.
2.6.1. Antibiotik
Antibiotik yang pertama kali ditemukan yaitu Quinine untuk malaria dan
Emetine untuk amebiasis yang ditemukan pada abad ke 17. Kemudian pada
tahun 1929 ditemukan Penicillin, tahun 1935 ditemukan Sulfonamides, kemudian
diikuti penemuan streptomycin, tetracycline, chloramphenicol, dan banyak lagi
antibiotik yang baru. Mekanisme kerja antibiotik dibagi kepada 4 jenis, yaitu :
1. Menginhibisi pembentukan dinding sel. Yang termasuk jenis ini yaitu
Bacitracin, Cephalosporins, Cycloserine, Penicillins, Ristocetin,
Vancomycin.
2. Menginhibisi fungsi membran sel. Yang termasuk jenis ini yaitu :
Amphotericin B, Colistin, Nystatin, Polymyxins.
3. Menginhibisi sintesis protein. Yang termasuk jenis ini yaitu :
Chloramphenicol, Erythromycins, Lincomycins, Tetracyclines, golongan
Aminoglycosides seperti Amikacin, Gentamicin, Kanamycin, Neomycin,
4. Menginhibisi sintesis dari asam nukleat. Yang termasuk jenis ini yaitu :
Nalidixic Acid, Novobiocin, Pyrimethamine, Sulfonamides, Trimethoprim,
Rifampin.
Resistensi terhadap antimikroba/antibiotik dapat terjadi melalui 5 mekanisme
yaitu :
1. Mikroorganisme memproduksi enzim yang dapat menghancurkan zat aktif
dari obat tersebut. Contohnya adalah Staphylococcus yang resisten
terhadap Penicillin karena memproduksi betalaktamase. Kemudian bakteri
Gram negatif yang resisten terhadap aminoglikosida karena memproduksi
acetylating enzym, bakteri Gram negatif yang resisten terhadap
chloramphenicol acetyltransferase.
2. Mikroorganisme merubah permeabilitasnya terhadap obat. Contohnya
adalah bakteri yang resisten terhadap aminoglikosida karena terganggunya
transport aktif melewati membran sel.
3. Mikroorganisme merubah struktur target dari antibiotik. Contohnya adalah
bakteri yang resisten terhadap aminoglikosida karena bakteri merubah 30s
sub unit dari ribosom bakteri yang menjadi tempat melekat antibiotik.
4, Mikroorganisme merubah jalur metabolisme sehingga melewati reaksi yang
diinhibisi oleh antibiotik. Contohnya adalah bakteri yang resisten terhadap
Sulfonamide tidak memerlukan ekstra selular PABA, tetapi dapat
5. Mikroorganisme merubah pembentukan enzim tetapi masih bisa berfungsi
dalam metabolisme.
Resistensi mikroorganisme ini terhadap antibiotik bisa didapat secara genetik
atau non genetik.21
Pemilihan antibiotik yang tepat baru bisa dilakukan setelah hasil pemeriksaan
tes kepekaan didapatkan. Sebelum hasil itu didapat, pedoman untuk
memberikan antibiotik yang tepat bisa berdasarkan penyebab dari empiema
tersebut. Bila empiema disebabkan oleh pneumonia komuniti yang kuman
penyebabnya biasanya bakteri Gram positif, dianjurkan pemberian antibiotik jenis
fluoroquinolone saja seperti levofloxacin, sparfloxacin, atau grepafloxacin. Bila
keadaan lebih berat dapat dikombinasi dengan cefotaxime atau ceftriaxone atau
dengan betalaktam dan betalaktamase inhibitor seperti ampicillin/sulbactam,
ticarcillin/clavulanate, piperacillin/tazobactam. Pilihan lain dapat diberikan
betalaktam dan betalaktamase inhibitor saja atau bila keadaan lebih berat dapat
dikombinasi dengan macrolide seperti erythromycin, azithromycin, atau
clarithromycin selain dengan fluoroquinolone. Bila diduga kuman penyebabnya
adalah bakteri anaerob, dianjurkan pemberian fluoroquinolone kombinasi dengan
clindamycin atau metronidazole atau betalaktam dan betalaktamase inhibitor.4
Bila empiema disebabkan pneumonia nosokomial yang didapat di rumah
sakit, kuman penyebabnya biasanya bakteri enterik Gram negatif seperti
Pseudomonas aeruginosa atau oleh bakteri Gram positif seperti Staphylococcus
aureus.4 Bila diduga penyebabnya adalah S.aureus, dianjurkan pemberian
dianjurkan pemberian cephalosporine generasi ke 3 saja atau betalaktam
-betalaktamase inhibitor dikombinasi dengan aminoglikosida.18
BTS mempunyai guidelines untuk pemberian antibiotik pada infeksi pleura
dengan hasil kultur yang negatif (Tabel 5).14
Tabel 5. Regimen pemberian antibiotik pada infeksi pleura dengan kultur
negatif.14
Sumber infeksi Pengobatan antibiotik intravena Pengobatan antibiotik oral
Komuniti ♦Cefuroxime1,5 gr, 3x/hari,iv +
Metronidazole 400 mg, 3x/hari,
oral atau 500 mg, 3x/hari,iv
♦Benzyl penicillin 1,2 gr, 4x/hari, iv
+ Ciprofloxacin 400 mg,
2x/hari, iv
♦Meropenem 1 gr,3x/hari,iv +
Metronidazole 400 mg, 3x/hari,
oral atau 500mg, 3x/hari,iv
♦Amoxycillin 1 gr,3x/hari +
Clavulanic acid 125 mg,
3x/hari
♦Amoxycillin 1 gr, 3x/hari +
Metronidazole 400 mg,
3x/hari
♦Clindamycin 300 mg,
4x/hari
Rumah sakit ♦Piperacillin + Tazobactam 4,5 gr
,4x/hari,iv
♦Ceftazidime 2 gr,3x/hari,iv
♦Meropenem 1 gr,3x/hari,iv +
Metronidazole 400 mg, 3x/hari,
oral atau 500 mg,3x/hari,iv
Penetrasi antibiotik ke rongga pleura berbeda beda dari tiap antibiotik. Pada
penelitian Teixeira terhadap kelinci yang diberikan injeksi bakteri Pasteurella
multocida ke rongga pleura, akhirnya terjadi empiema yang dipastikan dengan
torasintesis. Kemudian diberikan antibiotik yang berbeda - beda pada tiap kelinci
secara intravena. Setelah itu diukur dan dibandingkan kadar antibiotik pada
serum dengan cairan pleura. Hasilnya Penicillin berpenetrasi sangat mudah ke
rongga pleura, diikuti oleh metronidazole, ceftriaxone, clindamycin, vancomycin
dan gentamicin.37
Pemberian antibiotik ke rongga pleura pertama sekali hanya dilakukan
terhadap pasien empiema yang disebabkan oleh infeksi paska operasi
pneumonektomi.Tetapi sekarang ini pemberian antibiotik ke rongga pleura telah
dilakukan pada empiema yang disebabkan oleh pneumonia juga.3
2.6.2. Penatalaksanaan Cairan Empiema
Penatalaksanaan terhadap cairan efusi parapneumonik atau yang sudah
berkembang menjadi empiema bergantung kepada kelas dari cairan efusi
tersebut. Pada cairan efusi kelas 1 atau nonsignificant pleural effusion yang
didapat hanya dari foto toraks posisi dekubitus, tidak diindikasikan untuk
dilakukan torasintesis. Tetapi pada kelas 3 atau borderline complicated pleural
effusion, diindikasikan untuk dilakukan torasintesis secara serial. Pada kelas 4
thoracostomy sedangkan pada kelas 7, selain thoracostomy kadang - kadang
diperlukan fibrinolitik atau torakoskopi dan bahkan dekortikasi.3
2.7. UJI KEPEKAAN
Uji kepekaan (tes resistensi) dilakukan untuk mengetahui apakah bakteri
penyebab infeksi peka (sensitif) atau tidak peka (resisten) terhadap antimikroba
sehingga dapat dipilih antimikroba yang tepat untuk mengatasi infeksi tersebut.
Pada uji kepekaan dapat pula ditentukan KHM (Kadar Hambatan Minimum) dan
KBM (Kadar Bakterisidal Minimum) untuk mengetahui apakah suatu antimikroba
itu menghambat pertumbuhan bakteri tersebut (bacteriostatic) atau
mematikannya (bacteriocidal).
Tergantung dari maksud dan tujuannya itu dipilih cara uji kepekaan yang
cocok, karena ada beberapa cara uji kepekaan yang dapat di lakukan.
Disamping cara pemeriksaan yang rutin, masih terdapat cara cara uji kepekaan
lainnya yang khusus seperti uji kepekaan menggunakan alat - alat yang serba
otomatis (radiometry, micro calorimetry bioluminescence, electrical impedance
seperti Autobac System cara deteksi betalaktamase, rapid acidommetric, rapid
iodometri, rapid chromogenic cephalosporin methode).
Cara Cara Uji Kepekaan
1. Cara Pengenceran (dilution methode) :
a. Memakai media cair (broth)
b. Memakai media padat
a. Memakai kertas cakram
b. Memakai tablet
2.7.1. Uji Kepekaan Cara Difusi
Dibandingkan dengan cara pengenceran maka cara difusi pelaksanaannya
jauh lebih mudah dan murah. Karena itu secara rutin dipakai cara ini. Kalau cara
pengenceran merupakan cara kuantitatif, cara difusi merupakan cara kualitatif.
Hasil pemeriksaan dinyatakan dengan peka, kurang peka atau hampir resisten
dan tidak peka (resisten). Walaupun cara ini mudah dan murah akan tetapi untuk
mendapatkan hasil yang akurat, pelaksanaannya harus menurut prosedur yang
telah ditetapkan yaitu ketebalan medianya, jumlah bakteri yang disemai, jarak
antara cakram antimikroba dan hal lain yang patut diperhatikan pada uji
kepekaan pada umumnya.
Daerah di sekitar cakram yang tidak ditumbuhi bakteri terlihat bersih (daerah
inhibisi). Daerah inhibisi ini diukur dengan alat kaliper (jangka sorong atau
dengan millimeter). Untuk menentukan peka, kurang peka atau tidak peka
(resisten) ditetapkan berdasarkan luas daerah inhibisi menurut Metode Kirby
Tabel 6.Ukuran Inhibisi Metode Kirby Bauer(dalam mm)38
ANTIMIKROBA STRAIN T. PEKA K. PEKA PEKA
AMPICILLIN (10 ug) Enterobacteriac <=11 12-13 =>14 eae ,
Staphyl.sp. dan
bakteri yang
peka dengan
PNC
<=10 21-28 =>29
PENICILLIN (10 ug) Staphylococcus <=20 21-28 =>29
sp.
Bakteri lainnya
<=11 12-21 =>22
METHICILLIN (5ug) <=9 10-13 =>14
KANAMYCIN (30ug) <=13 14-17 =>18
STREPTOMYCIN (10ug) <=11 12-14 =>15
GENTAMYCIN (10ug) <=12 - =>13
CEPHALOTHIN (30ug) <=14 15-17 =>18
ERYTHROMYCIN (15ug) <=13 14-17 =>18
LYNCOMYCIN (2ug) <=9 10-14 =>15
TETRACYCLIN (30ug) <=14 15-18 =>19
CHLORAMPHENICOL (30ug) <=12 13-17 =>18
NALIDIXIC ACID (30ug) <=13 13-18 =>19
NITROFURANTOIN (300ug) <=14 15-16 =>17
SULPHONAMIDE (300ug) <=12 13-16 =>17
ANTIMIKROBA STRAIN T PEKA K PEKA PEKA
Amikacin (AN-30), 30ug <14 15-16 >17
Staphylo <19 >20
Amoxillin / Clav. Acid (AMC-30)
Lain lain <13 14-17 >18
Enterobact <13 14-16 >17
Staphylo <28 >29
Ampicillin (AM-1), 10ug
Enterococ <16 >17
Bacitracin (B-10), 10 units
Cefotaxime (CTX-30), 30 ug < 14 15-22 >23
Cefotiam (CTM) 30 ug
Ceftazidime (CAZ-30), 30ug <14 15-17 >18
Cefuroxime (CXM-30), 30ug <14 15-22 >23
Cephalexin (CI), 30 ug <14 15-17 >18
Cephalothin (KF), 30 ug <14 15-17 >18
Chloramphenicol ©, 30 ug <12 13-17 >18
Ciprofloxacin (CIP-5), 5ug <15 16-20 >21
Doxicycline (D-30), 30 ug <12 13-15 >16
Erythromycin (E-15), 15 ug <13 14-22 >23
Fosfomycin (FOS) 50 ug <13 14-19 >20
Fusidic Acid
Gentamycin (GM-10), 10 ug
Kecuali high
resistant
enterococcus
<12 13-14 >15
Imipenem (IPM-10), 10ug <13 14-15 >16
Methicillin (met), 5ug Staphylo <9 10-13 >14
Nalidixic Acid (NA-30), 30ug <13 14-18 >19
Nitrofurantoin (F/M), 300 ug <14 15-16 >17
Norfloxacin (NOR), 10ug <12 13-15 >16
S aureus <10 11-12 >13
Oxacillin (OX-1), 1 ug Staph coag negative
<17 >18
Staphylococcu s
<28 >29
Penicillin (P-10), 10 units
Enterococcus <14 >15
Pseudomonas <17 >18
Piperacillin (PIP), 100ug and Tazobactam +Piperacillin (TZP)
100 ug
Other
Gram (-)
<17 15-19 >20
Rifampin <16 17-19 >20
Tetracyline (TE-30), 30 ug <14 15-18 >19
Timentin
Trimetthoprim (TMP-5) 5 ug <10 11-15 >16
[image:35.612.87.528.67.544.2]Vancomycin (Va-30), 30 ug
Tabel 7.Ukuran Inhibisi menurut Metode Modifikasi Kirby Bauer (dalam mm)38
BAB III
BAHAN DAN METODE
3.1. TEMPAT DAN WAKTU PENELITIAN
Penelitian ini dilakukan di Departemen Ilmu Penyakit Paru RSUP H.Adam
Malik Medan. Penelitian dilakukan selama 6 bulan ( Januari 2007 - Juni 2007 ).
3.2. RANCANGAN PENELITIAN Penelitian ini bersifat deskriptif
3.2.1. Populasi
Semua penderita empiema yang datang berobat ke Departemen Ilmu
Penyakit Paru di RSUP H.Adam Malik Medan selama 6 bulan (Januari 2007 -
Juni 2007)
3.2.2. Sampel
Sampel adalah bagian dari populasi yang memenuhi kriteria pasien diterima
dan tidak terdapat kriteria pasien ditolak yang didapat selama penelitian ini
3.2.2.1. Kriteria Pasien Diterima
1. Pasien empiema dengan cairan pleura memenuhi salah satu kriteria
dibawah ini yaitu :
a. Didapat organisme/kuman pada pewarnaan langsung atau pada
kultur cairan pleura
c. Analisa cairan pleura didapat pH < 7,10 dengan LDH > 1000 IU/L atau
dengan Glukosa < 40 mg/dl.1
2. Pasien empiema yang baru pertama kali berobat atau yang mendapat
Empiema setelah dirawat di bangsal Departemen Ilmu Penyakit Paru di
RSUP H.Adam Malik Medan dan BP4 Medan
3. Umur pasien di atas 15 tahun
4. Pasien koperatif dan bersedia untuk mengikuti penelitian dengan benar .
3.2.2.2. Kriteria Pasien Ditolak
1. Pasien Empiema yang disebabkan oleh karena trauma
3.2.3. Jumlah Sampel
Jumlah sampel dihitung berdasarkan estimasi populasi :
Z α2 P ( 1 – p ) 3,84 . 0,21 n = =
d2 0,01
n = 28 sampel
Keterangan :
n = besar sampel
Z α = batas kepercayaan
P = prevalensi empiema sebesar 92 %
1- p = ( 1 – prevalensi )
3.3. KERANGKA KONSEP
EMPIEMA POLA KUMAN
UJI KEPEKAAN
3.4. DEFINISI OPERASIONAL:
1. Empiema adalah cairan pleura berbentuk pus (nanah) atau didapat
organisme(kuman) pada pewarnaan langsung atau pada kultur cairan
pleura atau dari analisa cairan pleura didapat pH < 7,10 dengan LDH >
1000 IU/L atau dengan Glukosa < 40 mg/dl.1
2. Pola kuman adalah gambaran dari kuman kuman yang didapat di cairan
empiema yang didapat dari pewarnaan Gram, pewarnaan Ziehl Nielsen,
pewarnaan jamur, kultur bakteri aerob, kultur bakteri anaerob, kultur
jamur.
3. Pewarnaan Gram adalah pewarnaan cairan pleura dengan zat warna ungu
kristal untuk melihat bakteri Gram negatif atau bakteri Gram positif.
Dijumpai bakteri Gram positif bila dengan mikroskop dijumpai bakteri
bakteri yang berwarna ungu. Dijumpai bakteri Gram negatif bila dengan
mikroskop dijumpai bakteri bakteri yang berwarna merah.39
4. Pewarnaan Ziehl Nielsen adalah pewarnaan cairan pleura dengan zat
warna Carbol-Fuchsin untuk melihat Basil Tahan Asam (BTA). Dijumpai
batang tipis, ada granule, lurus atau agak bengkok, susunan tidak
teratur.39
5. Pewarnaan jamur adalah pewarnaan cairan pleura dengan tehnik Wet
Mount. Sediaan kering bisa di warnai dengan pewarnaan Gram atau bisa
juga dengan simple staining dengan Methylene blue.40
6. Kultur Bakteri Aerob adalah penanaman cairan pleura pada media
pembiakan Blood Agar untuk melihat pertumbuhan bakteri aerob.
Dikatakan kultur positif bila dijumpai koloni kuman pada media pembiakan
setelah 24 jam di eramkan di inkubator. Identifikasi kuman berdasarkan
identifikasi bentuk koloni yang pedomannya telah ditetapkan
sebelumnya.41
7. Kultur Bakteri Anaerob adalah penanaman cairan pleura pada media
pembiakan Agar Brucella diperkaya dengan darah domba defibrinated 55,
Vitamin K, Hemin , untuk melihat pertumbuhan bakteri anaerob. Media
pembiakan diletakkan di bejana anaerob terlebih dahulu baru kemudian
dieramkan di inkubator. Dikatakan kultur positif bila dijumpai koloni kuman
pada media pembiakan setelah 24 jam. Identifikasi kuman berdasarkan
identifikasi bentuk koloni yang pedomannya telah ditetapkan
sebelumnya.42
8. Kultur Jamur adalah penanaman cairan pleura pada media pembiakan
Saborauds glukose agar untuk melihat pertumbuhan jamur. Dikatakan
jam. Identifikasi kuman berdasarkan identifikasi bentuk koloni yang
pedomannya telah ditetapkan sebelumnya.40
9. Uji kepekaan adalah suatu pemeriksaan yang dilakukan untuk mengetahui
apakah bakteri penyebab infeksi, peka (sensitif) atau tidak peka (resisten)
terhadap antimikroba. Hal ini dilakukan dengan metode Kirby Bauer.38
3.5. PELAKSANAAN PENELITIAN
Semua pasien yang memenuhi kriteria pasien diterima dan tidak terdapat
kriteria pasien ditolak diambil data dasarnya. Data dasar berupa nama, umur,
jenis kelamin, gejala klinis, BTA sputum, kultur sputum bakteri, jamur & uji
kepekaan, darah rutin, kadar gula darah, penyebab empiema.
Pasien yang memenuhi kriteria kemudian dilakukan pewarnaan Gram,
pewarnaan Ziehl Nielsen, pewarnaan Jamur dan kultur cairan pleura.
Pengambilan cairan pleura dilakukan dengan steril dengan menggunakan 2 buah
disposible syringe 10 cc. Disposible syringe yang pertama untuk pemeriksaan
analisa cairan pleura dan disposible syringe yang kedua untuk pewarnaan Gram
dan kultur. Pemeriksaan analisa cairan pleura dilakukan di Laboratorium Patologi
Klinik RS HAM , sedangkan pewarnaan Gram dan kultur dilakukan di
Laboratorium Mikrobiologi FK USU. Kedua spesimen harus segera dikirim ke
3.5.1. Pewarnaan Gram
Secara tehnis pewarnaan Gram di Laboratorium Mikrobiologi FK USU
dilakukan dengan cara :
1. Fiksasi
2. Tuang zat warna ungu kristal menggenangi sediaan : 1 menit
3. Cuci dengan air kran ... 5-10 detik
4. Genangi dengan larutan lugol ... 1 menit
5. Cuci dengan air kran ... 5-10 detik
6. Celup dan digoyang goyang dalam bak berisi alkohol
96% selama ... 30 detik
7. Segera cuci dengan air kran
8. Genangi dengan Fuchsin-air (atau Safranin)
selama ………. 1-2 menit
9. Cuci kembali dengan air kran, lalu keringkan. Siap untuk diperiksa.39
3.5.2. Pewarnaan Ziehl Nielsen.
Secara tehnis pewarnaan Ziehl Nielsen dilakukan dengan cara :
1. Buatlah sediaan bakteri, lakukan fiksasi.
2. Genangi dengan larutan Carbol-Fuchsin.
3. Panaskan di atas nyala api sampai menguap (jangan mendidih atau
kering) ….. 5 menit (atau dengan beberapa tetes tergitol ditambahkan
kepada Carbol-Fuchsin).
5. Lunturkan dengan H2SO4 20% atau asam alkohol sehingga tak ada lagi zat warna yang luntur.
6. Cuci dengan air kran……….. 5 detik
7. Genangi dengan Methylene blue………. ……….. 30 detik
(atau dengan Malachit green)
8. Cuci dengan air kran dan keringkan
Preparat siap untuk diperiksa di bawah mikroskop.39
3.5.3. Pewarnaan Jamur
Pewarnaan untuk melihat jamur secara tehnis dilakukan dengan tehnik Wet
Mount. Sediaan basah yaitu mengenai spesimen dengan cairan seperti KOH
atau NaOH 10-20%, larutan Ecosin, Larutan Lactophenol cotton blue, aquadest
bisa juga digunakan. Sediaan kering bisa di warnai dengan pewarnaan Gram
atau bisa juga dengan simple staining dengan Methylene Blue.40
3.5.4. Kultur Cairan Pleura
Kultur cairan pleura secara tehnis dilakukan dengan cara sebagai berikut
1. Cairan empiema di disposible syringe diteteskan ke media pembiakan
blood agar
2. Ose atau kapas lidi dipakai untuk menyemai bakteri dalam cairan
empiema tersebut pada permukaan medium padat dengan goresan
Disamping tehnik goresan diatas ada lagi dikenal goresan radian dan
goresan sinambung.
3. Penyentuhan tersebut dilakukan berulang ulang sedemikian sehingga
dapat diperoleh koloni yang terpisah pada proses penyentuhan terakhir
yaitu :
a. Pada proses penyentuhan pertama kali bakteri disemai masih
rapat satu sama lainnya.
b. Pada penyentuhan ke-2 bakteri semai semakin renggang
c. Pada penyentuhan ke-3 bakteri yang disemai semakin renggang
d. Dan pada penyentuhan terakhir penyemaian bakteri sudah demikian
renggang sehingga di harapkan bakteri dapat tumbuh dengan
membentuk koloni terpisah (isolated colony).41
Untuk kuman aerob digunakan media blood agar dan setelah disemai
langsung dimasukkan ke inkubator. Untuk kuman anaerob digunakan media
Agar Brucella diperkaya dengan Darah domba defibrinated 55, Vitamin K,
Hemin. Sebelum dimasukkan ke inkubator, terhadap media yang telah disemai
dilakukan isolasi terlebih dahulu dengan memasukkan media tersebut ke bejana
anaerob yang menggunakan gas-pak sebagai generator H2 dan CO2 dan palladium sebagai katalisator. Pembacaan koloni dilakukan 24 jam kemudian
dan bila pertumbuhan kurang baik pengeraman ulang dilakukan untuk 24 jam
3.5.5. Kultur Jamur
Untuk mengkultur jamur dilakukan dengan tehnik Slide Culture yaitu dengan
cara :
1. Letakkan kertas filter steril menutupi seluruh dasar suatu petri yang steril.
2. Sterilkan sebuah gelas objek dengan cara mencelupkannya ke dalam
alkohol lalu membakarnya sehingga seluruh alkohol menguap. Lalu gelas
objek ini di letakkan di atas kertas filter tersebut secara aseptis lalu biarkan
dingin.
3. Dengan pipet steril, secara aseptis tuangkan selapis tipis Sabaroud’s
Glucose Agar panas di atas permukaan gelas objek tadi dan biarkan dingin
menjadi padat.
4. Iris salah satu segmen Agar itu dengan sengkelit steril, sehingga diperoleh
suatu pinggir yang rata.
5. Dengan sengkelit tanamlah permukaan yang rata itu jamur yang akan
diperiksa.
6. Tutuplah dengan dek gelas steril.
7. Rekatlah 3 sisi dek glass itu dengan parafin atau vaselin, sedangkan
permukaan yang rata tidak di tutup.
8. Tutup piring petri dan eramkan dalam inkubator 250C beberapa hari. 9. Tiap hari aquadest ditambah agar kertas saring selalu basah.
Amati pertumbuhan koloni pada slide culture tersebut. Dengan cara itu
struktur jamur yang tumbuh dapat di amati tanpa harus mengganggu
3.5.6. Uji Kepekaan
Secara tehnis uji kepekaan dilakukan dengan cara
1. Lempeng Agar
Tebal lempeng Agar kira kira 4 mm bisa disimpan pada suhu 40C, bila permukaannya basah, keringkan dulu dengan memasukkannya ke dalam
inkubator pada suhu 370C selama setengah jam. 2. Bakteri yang diuji
Dengan Ose (sengkelit) diambil bakteri dari koloninya dan masukkan ke
dalam tabung reaksi yang berisi medium cair dan eramkan selama 2-5 jam
pada suhu 360-370C. 3. Cara penyemaian bakteri
Kapas lidi steril dicelupkan ke dalam medium cair berisi bakteri yang telah
di eramkan secukupnya (kapas lidi itu di tekan pada dinding tabung reaksi)
lalu disemaikan pada permukaan medium hingga rata (dioleskan 3 arah).
Bisa juga permukaan medium Agar digenangi dengan medium cair berisi
bakteri di atas lalu medium cair yang berlebihan diisap dengan pipet steril,
lempeng itu dibiarkan mengering selama 3-5 menit (jangan lebih dari 15
menit).
4. Cakram Antimikroba
Cakram Antimikroba diletakkan di atas permukaan lempeng agar dengan
bantuan pinset steril atau dengan alat / dispenser khusus untuk itu. Cakram
yang sudah di letakkan itu di tekan sedikit agar melekat cukup baik pada
5. Mengatur daerah inhibisi
Daerah di sekitar cakram yang tidak ditumbuhi bakteri terlihat bersih itu di
ukur dengan alat kaliper (jangka sorong atau dengan millimeter). Untuk
menentukan peka kurang peka atau resisten, diukur lebar daerah inhibisi
disekitar cakram dan disesuaikan dengan Tabel Ukuran Inhibisi Metode
Kirby Bauer.38
3.6. ANALISIS DATA
Analisis data untuk menentukan distribusi frekuensi
BAB IV
HASIL DAN PEMBAHASAN
4.1. HASIL PENELITIAN
Pada penelitian ini jumlah penderita empiema yang masuk dalam penelitian
sebanyak 28 orang. Seluruh pasien / subjek penelitian setelah menandatangani
surat persetujuan sebagai subjek penelitian, diambil data dasarnya. Data dasar
berupa nama, umur, jenis kelamin, gejala klinis, BTA sputum, kultur sputum,
Lekosit, LED, KGD, penyakit dasar.
Kemudian diambil cairan pus dari rongga pleura dengan menggunakan
dispossible syringe 10 cc. Cairan kemudian diperiksa di laboratorium
Mikrobiologi FK USU. Pemeriksaan meliputi pemeriksaan kultur cairan pus.
Bila ditemukan kuman baik dari pemeriksaan langsung maupun dari kultur cairan
pus , maka akan dilakukan kemudian pemeriksaan uji kepekaan dengan metode
cakram antibiotika.
4.1.1. Karakteristik Demografi dan Data Dasar
Dari 28 orang subjek penelitian, laki laki berjumlah 22 orang (78,6%),
perempuan berjumlah 6 orang (21,4 %), dengan umur < 20 tahun berjumlah 1
orang (3,6 %), 21- 30 tahun 5 orang (17,9 %), 31- 40 tahun 7 orang (25 %),
41-50 tahun 6 orang (21,4 %), 51-60 tahun 4 orang (14,3 %), 61-70 tahun 3 orang
(10,7 %), 71-80 tahun 2 orang (7,1 %).
Tabel 4.1.Karakteristik Demografi
n %
Jenis Kelamin
Laki laki 22 78,6
Perempuan 6 21,4
Umur
< 20 1 3,6
21-30 5 17,9
31-40 7 25
41-50 6 21,4
51-60 4 14,3
61-70 3 10,7
> 70 2 7,1
Total 28 100
Data hasil pemeriksaan BTA Direct Smear sputum yang didapat menunjukkan
bahwa yang paling banyak adalah BTA negatif (21 pasien), sedangkan BTA
positif hanya pada 7 pasien.
Dari data kultur sputum yang didapat menunjukkan bahwa kultur positif pada
15 pasien. Yang paling banyak adalah bakteri aerob Gram negatif Pseudomonas
aeruginosa (14,3 %), kemudian bakteri aerob Gram negatif Klebsiella
pneumoniae (7,1 %), bakteri aerob Gram positif Staphylococcus aureus (7,1 %),
bakteri aerob Gram positif Streptococcus haemolyticus (7,1 %), jamur Candida
aerob Gram positif Streptococcus pneumoniae (3,6 %), bakteri aerob Gram
negatif Klebsiella oxytoca (3,6 %), dan gabungan 2 jenis kuman yaitu
Pseudomonas aeruginosa dengan Candida albicans (3,6 %). Tidak dijumpai
bakteri anaerob dari kultur sputum tersebut. Kultur negatif / tidak ada
pertumbuhan kuman (TAPB) pada 13 pasien. Dijumpai juga 5 pasien dengan
BTA sputum positif disertai kultur sputum positif.
Tabel 4.2. Karakteristik BTA DS Sputum
n %
Negatif 21 75
Positif 7 25
Total 28 100
Tabel 4.3. Karakteristik Kultur Sputum
n %
TAPB 13 46,4
Klebsiella pneumoniae 2 7,1
Pseudomonas aeruginosa 4 14,3
Staphylococcus aureus 2 7,1
Streptococcus pneumoniae 1 3,6
Streptococcus haemolyticus 2 7,1
Klebsiella oxytoca 1 3,6
Candida albicans 1 3,6
Pseudomonas aeruginosa & Candida
albicans
1 3,6
Total 28 100
Dari hasil pemeriksaan darah rutin didapat hasil nilai rata rata leukosit 15.495,
nilai rata-rata laju endap darah 39. Dari hasil pemeriksaan kadar gula darah, nilai
rata-rata 136.
Penyakit dasar penyebab empiema yang terbanyak adalah pneumonia (n =
14 ), kemudian TB paru (n = 11 ), tumor paru (n = 2 ) dan gabungan antara tumor
paru dengan TB paru (n = 1).
Tabel 4.4. Karakteristik Penyakit Dasar
n %
TB paru 11 39,3
Pneumonia 14 50
Tumor paru 2 7,1
TB paru & tumor paru 1 3,6
4.1.2. Kultur dan BTA Direct Smear Empiema
Dari penelitian ini didapatkan hasil kultur empiema yang positif pada 16
pasien (57,1 %), kultur positif dengan BTA DS (Direct Smear) positif pada 7
pasien (25 %), kultur negatif / Tidak ada pertumbuhan kuman (TAPB) dengan
BTA DS positif pada 1 pasien (3,6 %), TAPB dengan BTA DS negatif pada 11
pasien (39,3 %).
Kuman yang terbanyak didapat dari kultur adalah bakteri anaerob Clostridium
perfringens (10,7 %), kemudian jamur Candida albicans (10,7 %), bakteri aerob
Gram positif Staphylococcus aureus (7,1 %), bakteri aerob Gram negatif
Escheria coli (7,1 %), bakteri aerob Gram negatif Klebsiella oxytoca (3,6 %),
bakteri aerob Gram negatif Klebsiella pneumoniae (3,6 %), bakteri aerob Gram
negatif Proteus mirabilis (3,6 %), bakteri aerob Gram negatif Pseudomonas
aeruginosa (3,6 %), bakteri anaerob Actinomyces (3,6 %), dan gabungan 2 jenis
kuman yang berbeda yaitu gabungan bakteri aerob Klebsiella oxytoca dengan
bakteri anaerob Clostridium perfringens (3,6 %).
Pada kelompok bakteri aerob, bakteri yang banyak didapat adalah
Staphylococcus aureus (22,2 %), kemudian Escheria coli (22,2 %), kemudian
Klebsiella oxytoca (22,2 %). Pada kelompok bakteri anaerob, bakteri yang
banyak didapat adalah Clostridium perfringens (80 %). Pada kelompok jamur
hanya dijumpai Candida albicans (100 %). Gabungan BTA positif dengan kultur
positif ,terbanyak terdapat pada gabungan BTA positif dengan Candida albicans
(7,1 %).
Tabel 4.5. Kultur Empiema
Golongan n %
TAPB 12 42,9
Clostridium perfringens Anaerob 3 10,7
Candida albicans Jamur 3 10,7
Staphylococcus aureus Aerob Gram positif 2 7,1
Escheria coli Aerob Gram negatif 2 7,1
Klebsiella oxytoca Aerob Gram negatif 1 3,6
Klebsiella pneumoniae Aerob Gram negatif 1 3,6
Proteus mirabilis Aerob Gram negatif 1 3,6
Pseudomonas aeruginosa Aerob Gram negatif 1 3,6
Actinomyces Anaerob 1 3,6
Clostridium perfringens &
Klebsiella oxytoca
Anaerob & Aerob Gram
negatif
1 3,6
Total 28 100
Tabel 4.6. Bakteri Aerob
n %
Staphylococcus aureus 2 22,2
Escheria coli 2 22,2
Klebsiella oxytoca 2 22,2
Klebsiella pneumoniae 1 11,1
Pseudomonas
aeruginosa
1 11,1
[image:53.612.86.529.70.159.2]Total 9 100
Tabel 4.7. Bakteri Anaerob
n %
Clostridium perfringens 4 80
Actinomyces 1 20
Total 5 100
Tabel 4.8. Jamur
n %
Candida albicans 3 100
[image:53.612.81.530.217.593.2]Total 3 100
Tabel 4.9. BTA Direct Smear Empiema
n % BTA Positif & Klebsiella oxytoca 1 3,6
BTA Positif & Actinomyces 1 3,6
BTS Positif & Klebsiella pneumoniae 1 3,6
BTA Positif & Pseudomonas aeruginosa 1 3,6
BTA Positif & Clostridium perfringens 1 3,6
BTA Positif & Kultur Negatif 1 3,6
BTA Negatif 20 71,4
Total 28 100
4.1.3. Uji Kepekaan
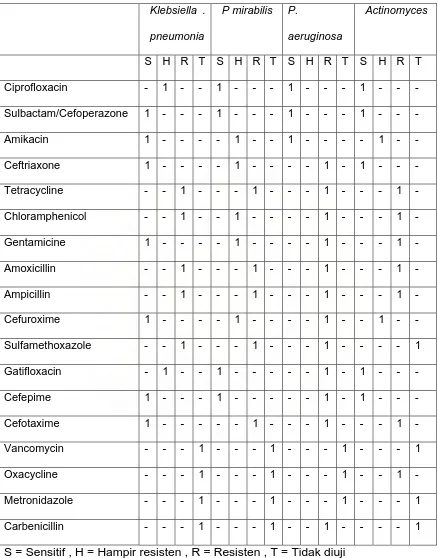
Dari hasil uji kepekaan terhadap antibiotika diperoleh hasil,
Sulbactam/Cefoperazone merupakan antibiotik yang peka (sensitif) untuk
seluruh bakteri yang didapat dari hasil kultur (100 %). Ciprofloxacin didapati peka
terhadap 92,9 % bakteri, Cefepime pe