BI OKI M I A
M .T. SI M AN JUN TAK J. SI LALAH I
Fa k u lt a s M a t e m a t ik a da n I lm u Pe n ge t a h u a n Ala m Ju r u sa n Fa r m a si
U n i v e r si t a s Su m a t e r a U t a r a
1 . En z i m
Enzim dikatakan sebagai suatu kelompok protein yang berperan penting di dalam aktifitas biologi. Enzim berfungsi sebagai katalisator di dalam sel dan sifatnya sangat khas. Didalam jumlah sangat kecil, enzim dapat mengatur reaksi tertentu sehingga di dalam keadaan normal tidak terjadi penyimpangan-penyimpangan hasil akhir reaksinya. Di dalam sel terdapat banyak jenis enzim yang berlainan kekhasannya. Artinya suatu enzim hanya mampu menjadi katalisator untuk reaksi tertentu saja . Ada enzim yang dapat mengkatalisa suatu kelompok substrat , adapula yang hanya satu substrat saja , dan ada pula yang bersifat stereospesifik. Karena enzim mengkataliser reaksi-reaksi di dalam sistim biologis, maka enzim juga disebut sebagai Biokat alisat or.
Beberapa enzim mempunyai aktifitas diantaranya spesifik untuk D dan L isomer optik . Enzim L- asam amino oksidase hanya pada L- asam amino oksidase tidak bereaksi terhadap isomer D- asam amino . Beberapa enzim memerlukan suatu ko-faktor yang bukan protein dan biasanya agak longgar berikatan dengan enzim. Ko-faktor itu disebut gugus prost et ik. Banyak juga enzim yang memerlukan ko-faktor logam seperti Mn++, Fe ++,Mg++, dll. Di dalam proses isolasi kadang-kadang ko-faktor yang berikatan longgar pada enzim terlepas sehingga menyebabkan aktifitas enzim menurun atau bahkan hilang. Bagian protein dari enzim disebut apo- enzim , sedangkan enzim keseluruhannya disebut holoenzim .
Bagian protein ( tak aktif ) + non – protein = holoenzim ( akktif ) (apoenzim ) (gugus protestik )
A. Kla sifik a si e n z im
Penamaan enzim secara trivial , yaitu secara non –sistematik misalnya pepsin , tripsin , katalase tidak menerangkan sifat dan macam reaksi yang terjadi . Penamaan dan klasifikasi enzim secara sistematik telah ditentukan oleh suatu badan internasional bernama : Commission on Enzim of the international union of Biochemistry (CEIUB). Dalam sistim yang baru ini enzim dibagi menjadi sub bagian. Dalam beberapa hal tertentu , penanaman trivial masih dipakai , yaitu bila nama sistematiknya terlalu panjang.
Klasifikasi enzim CEIUB meliputi nama golongan , nomor kode dan cara reaksi yang dikatalisernya dan tiap golongan utama terbagi menjadi kelompok – kelompok enzim berdasarkan gugus substrat yang diserangnya . Sistim CEIUB atau International Enzym Commision (IEC ) adalah sebagai berikut.
1 . Ok sido- r e du k t a se
Berperan didalam reaksi reaksi oksidasi - reduksi . Oksido –reduktase berada antara bentuk- bentuk oksidasi dan reduksinya jika molekul-molekul subtrat secara berturut-turut dioksidasi. Sifat aseptor elektron menentukan nama dari dua jenis oksido – reduktase yang kita tinjau dehidrogenase atau oksidase.
Dehidrogenase adalah enzim redoks yang tidak menggunakan oksigen sebagai suatu elektron aseptor elektron .Oksidasi biologik biasanya melibatkan pengambilan dua elektron dari substrat oleh suatu proses yang disebut dehirogenase .
CH3 – CHOH – COO- + enzim ----> CH3 -CO-COO- + 2H+ + 2e + enzim
Substrat hasil oksidasi ( tereduksi )
Oksidase adalah enzim redoks yang oksigen bertindak sebagai electron aseptor. Contoh :
NH3+ NH2+
R – CH - COO- + Enzim ---> R – C – COO - + Enzim Asam L – amino asam imino ( tereduksi )
Jenis lain dari oksido-reduktase meliputi Oksigenase yang menyatukan diri dengan oksigen secara langsung kedalam molekul substrat ,dan peroksidase yang menggunakan H2O2 sebagai suatu aseptor elektron
2 . Tr a n sfe r a se
Berperan di dalam reaksi pemindahan gugus tertentu . Digolongkan berdasarkan sifat gugus yang di pindahkan.
Contoh :
Enzim t ransam inase (amino transferase ) yang mengkatalis pemindahan
reversible dari suatu asam amino kesuatu asam keto .
X– CO – CO2- + Z - CHNH3+ - CO2- X - CHNH3+ - CO2- + Z – CO - CO2
-α-asam keto α-asam amino
Kinase merupakan enzim tranferase yang penting di dalam pemindahan energi dari suatu sistim ke sistim yang lain dalam bentuk “ikatan fosfat berenergi tinggi”.Molekul Adenosin Trifosfat (ATP) bekerja sebagai suatu “medium pertukaran’’ untuk energi ikatan fosfat dalam sistim hidup.
3 . H idr ola se
Berperan dalam reaksi hidrolis. Biasanya digolongkan atas dasar ikatan yang dihidrolisis.
R – CO - OR, + H
2 O esterase R – COO - + R, OH R – CO – NH – R, + H2O peptidase R-COO- + H3 – N+ - R, O
R – O – P – O - + H2 O
Fosfotase
R – OH + HPO4 = O
-4 . Lia se
Mengkatalisis reaksi addisi atau pemecahan ikatan rangkap dan suatu contoh dari liase adalah hidrasi dari ikatan asam fumarat oleh enzim fumarase.
CO2- H
H2O + C ==C Fumarase CO2- - CH2 – CHOH – CO2
H CO2- asam malat
Dekarboksilase asam piruvat merupakan liase.
5 . I som e r a si
Mengkatalisis reaksi isomerisasi. Contoh dari suatu isomerisasi adalah reaksi yang dikataliser oleh alanin rasem ase, enzim yang ditemukan dalam bakteri :
Alanin rasemase
L – alanin D – Alanin
6 . Liga se
Mengkataliser reaksi pembentukan ikatan dengan bantuan pemecahan ikatan dalam ATP. Enzim ini mengkatalisir reaksi yang membentuk ikatan kimia, sehingga sering disebut sintase. Misalnya , pembentukan suatu ikatan peptida adalah suatu proses yang memerlukan energi. Daya pendorong untuk reaksi – reaksi yang dikataliser ligase pada umumnya adalah pengambilan eksergenik ( pelepasan energi ) gugus fosforil atau pirofosforil dari ATP.
PEN GARUH KAD AR EN ZI M D AN SUBSTRAT
Kecepatan reaksi tergantung pada konsentrasi enzim yang berperan sebagai katalisator di dalam suatu reaksi. Hubungan antara konsentrasi enzim dengan kecepatan reaksi jika konsentrasi substrat berlebihan lihat gambar 1.
Gambar 1 Pengaruh (enzim) terhadap kecepatan reaksi
KI N ET I KA EN Z I M
Reaksi-reaksi kimia dalam tubuh secara tidak langsung dipengaruhi oleh enzim. Katalis-katalis ini, adalah spesifik untuk reaksi-reaksi tertentu. Akan tetapi, katalis-katalis ini sering berubah-ubah (tidak tetap), pada beberapa ribu enzim yang sekarang dikenal dapat berperan dalam beberapa reaksi seperti hidrolisis, polimerisasi, pemindahan gugus fungsi, oksidasi reduksi, dehidrasi dan isomerisasi, untuk menjelaskan hanya beberapa kelompok umum dari reaksi yang dipengaruhi enzim. Enzim-enzim bukanlah merupakan permukaan pasif pada mana reaksi berlangsung tetapi merupakan mesin molekul kompleks yang terus bekerja melalui rasikan mekanisme reaksi yang berbeda beda. Sebagai contoh, beberapa enzim hanya bekerja pada molekul-molekul substrat tunggal; lainnya bekerja pada dua atau lebih molekul-molekul substrat yang berbeda yang akan mengatur terjadi atau tidaknya suatu ikatan. Beberapa enzim membentuk ikatan kovalen yang menjadi perantara untuk membentuk kompleks dengan substrat-substratnya, tetapi ada juga yang tidak.
Pengukuran kinet ik dari reaksi- reaksi kat alis enzim at ik m erupakan t eknik- t eknik yang sangat pent ing unt uk m enerangkan m ekanism e kat alis enzim .
penentuan mekanisme-mekanisme enzimatik. Sebagai pendahuluan akan diuraikan tentang teori dasar dari kinetika enzim.
A. Pe r sa m a a n M ich a e lis – M e n t e n
Studi tentang kinetika enzim dimulai pada tahun 1902 ketika Adrian Brown melaporkan sebuah penelitian kecepatan hidrolisis sucrosa ( yang dikatalisis oleh enzim ragi invertase (sekarang dikenal sebagai β-fructofuranosidase) :
Sukrosa + H2O ! glukosa + fruktosa
Brown menerangkan bahwa bila konsentrasi sukrosa lebih tinggi daripada enzim, kecepatan reaksi menjadi tidak tergantung pada konsentrasi sukrosa; jadi, kecepatannya mengikuti orde nol terhadap sukrosa. Oleh sebab itu Brown mengusulkan bahwa keseluruhan reaksi disusun oleh dua reaksi dasar dimana mula mula substrat membentuk sebuah kompleks dengan enzim yang kemudian terurai menjadi produk dan enzim.
E + S
1 1
k
k
−
ES P + E
E, S, ES dan P masing-masing melambangkan enzim, substrat, kompleks enzim – substrat dan produk (untuk penyusun enzim yang merupakan perkalian sub-sub unit yang identik, E menyatakan sisi aktif molekul enzim dan bukan molekul enzim). Berdasarkan model ini, bila konsent rasi subst rat m enj adi t inggi sehingga cukup secara keseluruhan unt uk m engubah enzim ke bent uk ES, m aka t ahap kedua dari reaksi m enj adi m em puny ai bat as kecepat an dan seluruh t ingkat reaksi m enj adi t idak sensit if t erhadap peningkat an konsent rasi subst rat y ang lebih besar.
Persamaan umum untuk kecepatan dari reaksi ini adalah :
V =
k
[
ES
]
dt
=
2[P]
d
[1.1]
Kecepatan pembentukan [ES] adalah perbedaan antara kecepatan reaksi dasar yang mengarahkan kepada penampakan dan hasil dalam ketidaknampakannya.
]
ES
[
k
]
ES
[
k
]
S
[
]
E
[
k
1−
1−
2=
−dt
[ES]
d
[1.2]
Persamaan ini tidak dapat dengan jelas diintegrasikan, tanpa penyederhanaan asumsi . Ada dua kemungkinan yaitu :
1 . Asu m si Ke se t im ba n ga n
Pada tahun 1913, Leonor Michaelis dan Maude Menten bekerja berdasarkan hasil kerja Victor Henry yang lebih dulu mengasumsikan bahwa k-1 >> k2, untuk itu tahap I dari reaksi menghasilkan kesetimbangan.
]
ES
[
]
S
[
]
E
[
K
s=
=
1 1
-k
k
[1.3]Ks melambangkan konstanta disosiasi tahap I reaksi enzimatik. Dengan asumsi ini, Persamaan [13.17] dapat diintegrasikan. Meskipun asumsi ini tidak sepenuhnya benar. Ikatan nonkovalen antara enzim – kompleks substrat ES dikenal dengan Kom ple k s M ich a e lis.
2 . Asu m si Ke a da a n St e a dy St a t e
Gambar 2 mengilustrasikan kurva peningkatan variasi partisipasi-partisipasi dalam melangsungkan model reaksi di bawah kondisi psikologi umum bahwa substrat berada dalam keadaan berlebihan terhadap enzim. Dengan pengecualian tingkat awal reaksi yang disebut fase translent, dimana biasanya
dalam beberapa mili second dari pencampuran enzim dan substrat, [ES] menunjukkan hasil yang lebih kurang konstan sampai substrat tersebut hampir habis. Dengan demikian kecepatan sintesa ES harus sama dengan kecepatan yang dibutuhkan selama reaksi berlangsung yaitu, [ES] tetap pada keadaan st e a dy st a t e.
Ga m ba r 2 . Ku r v a k om pon e n - k om pon e n da r i r e a k si se de r h a n a M ich a e lis M e n t e n . Pe r h a t ik a n ba h w a de n ga n pe n ge cu a lia n fa se t r a n sie n t da r i r e a k si y a n g m a n a m u n cu l se be lu m a r sir a n k ot a k , slope - slope da r i k u r va [ E] da n [ ES] se ca r a e se n sia l n ol se la m a [ S] > > [ E]T ( dia n t a r a a r sir a n k ot a k t e r se bu t )
Untuk itu dapat diasumsikan dengan derajat akurasi yang berdasar bahwa ES adalah konstan, sehingga
0
=
dt
[ES]
d
[1.4]
Ini dinamakan asumsi steady state yang pertama kali diusulkan oleh G.E. Briggs dan James B.S. Haldane pada tahun 1925.
Untuk penggunaannya, persamaan kinetika untuk seluruh reaksi harus dirancang dalam rangka untuk pengukuran kuantitatip. Jumlah [ES] dan [E] umumnya tidak dapat ditentukan secara langsung tetapi konsentrasi total enzim, biasanya langsung dapat ditentukan.
[E]T = [E] + [ES] [1.5]
Persamaan kecepatan reaksi enzimatis dapat diterangkan seperti dibawah ini. Dengan menggabungkan persamaan [1.2] dengan asumsi keadaan steady state, persamaan [1.4], dan kondisikan konservasi, persamaan [1.5] akan menghasilkan :
k1([E]T – [ES])[S] = (k-1 + k2)[ES] persamaan di atas diubah jadi
[ES](k-1 + k2 + k1[S] = k1[E]T[S]
]
S
[
K
]
S
[
]
E
[
M T+
=
[ES]
dimana KM dikenal dengan konstanta Michaelis yang didefinisikan
1 2 1 M
K
k
k
+
=
K
[1.6]Keterangan mengenai pentingnya konstanta ini akan didiskusikan di bawah ini.
Permulaan kecepatan reaksi dari persamaan [1.1] dapat dinyatakan sebagai hasil pengukuran kuantitas [E]T dan [S] secara experimental
]
S
[
K
]
S
[
]
E
[
k
]
Es
[
k
dt
]
P
[
d
M T 2 2 0 to
=
=
+
=
=V
[1.7]Kegunaan dari kecepatan awal (secara operasional sebagai kecepatan yang diukur sebelum lebih dari -10% substrat diubah jadi produk) lebih daripada meminimalkan kecepatan seperti faktor-faktor komplikasi sebagai efek reaksi reversibel, inhibisi enzim oleh produk, dan inaktivasi progresif dari enzim.
Kecepatan maksimal reaksi, Vmax, terjadi pada konsentrasi substrat yang tinggi ketika enzim telah tersaturasi, yaitu ketika secara keseluruhan telah berubah jadi bentuk ES.
Vmax = k2[E]T [1.8]
Jadi dengan mengkombinasikan persamaan [1.7] dan [1.8] diperoleh
]
S
[
K
]
S
[
V
V
M maxo
=
+
[1.9]Rumus ini, adalah persamaan Michaelis – Menten yang merupakan persamaan dasar dari kinetika enzim. Ini menggambarkan hyperbola rectangular seperti
yang di plot pada gambar 3 (meskipun kurva ini dirotasi pada 45o dan
ditranslasikan ke bentuk asli dengan rujukan contoh hiperbola yang terlihat pada kebanyakan teks aljabar dasar).
Fungsi saturasi untuk pengikatan O2 ke myoglobin, memiliki bentuk fungsional yang sama.
Sign ifik a n da r i Kon st a n t a M ich a e lis – M e n t e n
Konstanta Michaelis, KM memiliki definisi operasional yang sederhana. Pada konsentrasi substrat dimana [S] = KM,
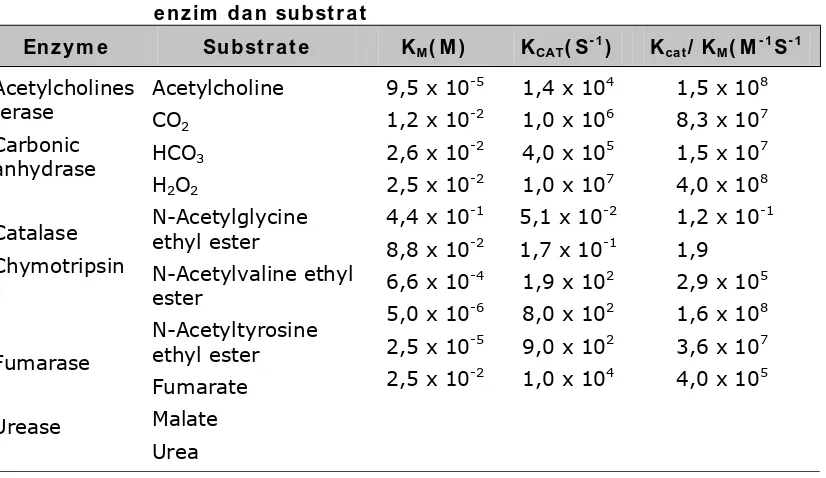
Ta be l 1 - 1 . H a r ga - h a r ga da r i KM, kCAT, da n kCAT,/ KM u n t u k be be r a pa e n z im da n su bst r a t
En z y m e Su bst r a t e KM( M ) KCAT( S- 1) Kca t/ KM( M- 1S- 1
Acetylcholines terase Carbonic anhydrase Catalase Chymotripsin Fumarase Urease Acetylcholine CO2 HCO3 H2O2
N-Acetylglycine ethyl ester N-Acetylvaline ethyl ester N-Acetyltyrosine ethyl ester Fumarate Malate Urea
9,5 x 10-5 1,2 x 10-2 2,6 x 10-2 2,5 x 10-2 4,4 x 10-1 8,8 x 10-2 6,6 x 10-4 5,0 x 10-6 2,5 x 10-5 2,5 x 10-2
1,4 x 104 1,0 x 106 4,0 x 105 1,0 x 107 5,1 x 10-2 1,7 x 10-1 1,9 x 102 8,0 x 102 9,0 x 102 1,0 x 104
1,5 x 108 8,3 x 107 1,5 x 107 4,0 x 108 1,2 x 10-1 1,9
2,9 x 105 1,6 x 108 3,6 x 107 4,0 x 105
Persamaan [1.9] menghasilkan Vo = Vmax/2 sehingga KM adalah konsent rasi
subst rat dim ana kecepat an reaksi adalah ½ dari m aks im al. Untuk itu apabila suatu enzim memiliki nilai KM kecil maka akan mencapai efisiensi katalitik yang maksimal pada konsentrasi substrat yang rendah.
Magnitudo KM bervariasi secara luas dengan identitas enzim dan sifat alamiah substrat (Tabel 1-1). Ini juga merupakan fungsi temperatur dan pH (lihat bagian 1-4). Konstanta Michaelis (persamaan 1.6) dapat dinyatakan sebagai : 1 2 s 1 2 1 1 M
k
k
K
k
k
k
k
K
=
−+
=
+
[1.10]karena Ks adalah konstanta disosiasi kompleks Michaelis, jika Ks menurun, afinitas enzim untuk substrat meningkat. KM untuk itu juga merupakan ukuran
afinitas enzim terhadap substrat dengan
1 2
k
k
lebih kecil dibandingkan dengan Ks,
B. An a lisis D a t a Kin e t ik
Ada beberapa metode untuk menentukan nilai-nilai dari parameter-parameter persamaan Michaelis Menten.
Ga m ba r 4 . Su a t u Plot r e sipr ok ga n da ( Lin e w e a v e r – Bu r k ) de n ga n ga r is- ga r is k e sa la h a n ± 0 ,0 5 Vm a x. Tit ik - t it ik t e r se bu t sa m a de n ga n Ga m ba r 3 . pe r h a t ik a n ba h w a pe n ga r u h ya n g be sa r da r i k e sa la h a n k e cil pa da [ S] k e cil ( 1 / [ S] be sa r ) da n k u m pu la n pa da t t it ik - t it ik [ S] be sa r .
Pada harga [S] yang besar, kecepatan awal Vo secara asimtot mendekati Vmax. Dalam prakteknya, namun, sangat sukar untuk memperoleh Vmax secara akurat dari plot-plot Vo versus [S] secara langsung seperti pada Gambar 4. Bahkan pada
konsentrasi substrat yang tinggi seperti [S] = 10.KM, persamaan [1.9]
mengindikasikan bahwa Vo hanya 91% dari Vmax sehingga nilai terekstrapolasi dan asimtot tersebut akan hampir tidak dapat diestimasi secara pasti. Metode yang lebih baik untuk menentukan nilai-nilai Vmax dan KM yang disusun oleh Hans Lineweaver dan Dean Burk, menggunakan resiprokal persamaan [1.9].
max max
M
o
V
I
]
S
[
I
V
K
V
I
+
+
[1.11]
Ini merupakan persamaan linear dalam
o
V
I
dan
]
S
[
I
. Apabila kuantitas-kuantitas
ini di plotkan, yang disebut dengan plot resiprok ganda atau Lineweaver – Burk, slop dari garis tersebut adalah KM / Vmax, Interep I/Vo adalah I/Vmax dan intersep
ekstrapolasi 1/[S] adalah
M
K
1
−
(Gambar 4). Kerugian dari plot ini adalah
dengan kegunaannya dalam analisa data kinetik dari enzim yang memerlukan lebih dari satu substrat.
KCAT / KM a da la h u k u r a n e fisie n si k a t a lit ik
Suatu parameter kinetika enzim merupakan suatu ukuran dari efisiensi katalitiknya. Konstanta katalitik dari suatu enzim dapat didefenisikan sebagai:
T max CAT
]
E
[
v
K
=
[1.12]Jumlah (kuantitas) ini dikenal juga dengan angka turn over dari suatu enzim karena merupakan nilai proses reaksi (turn over) dimana tiap daerah aktif dapat mengkatalisis persatuan waktu. Angka turn over ini untuk enzim-enzim tertentu diberikan pada Tabel 1-1. Perhatikan bahwa kuantitas-kuantitas ini bervariasi hampir pada delapan bagian dari magnitudo tergantung pada identitas enzim dan juga substratnya. Persamaan ini [1.8] mengindikasikan bahwa untuk model Michaelis Menten, kCAT = k2. Untuk enzim-enzim dengan mekanisme yang lebih rumit, kCAT dapat berupa fungsi dari beberapa tingkat reaksi.
Bila [S] << KM, sangat sedikit [ES] dibentuk. Akibatnya [E] ≈ [E]T sehingga persamaan [13.22] berubah membentuk persamaan tingkat reaksi orde dua.
Vo≈
[
E
]
[
S
]
K
k
]
S
[
]
E
[
K
k
M CAT T M 2
[1.13]KCAT / KM adalah konstanta tingkat reaksi orde dua dari reaksi enzimatis, tingkat reaksi bervariasi secara langsung terhadap seberapa sering enzim dan substrat bergabung satu sama lain dalam larutan. Kuantitas kCAT / KM untuk itu merupakan ukuran efisiensi katalistik enzim.
Be be r a pa En z im M e m ilik i Ke se m pu r n a a n Ke r j a Ka t a lit ik
Apakah ada batas teratas dari efisiensi katalitik enzim ? Dari persamaan [1.6] ditemukan 2 1 2 1 M 2 M CAT
k
k
k
k
K
k
K
k
+
=
=
[1.14]Ratio (perbandingan) ini adalah maksimal bila k2 >> k-1; yaitu, ketika pembentukan produk dari Michaelis kompleks [ES] adalah lebih cepat daripada dekomposisi kembali menjadi substrat dan enzim. Maka kCAT/KM = k1, konstanta kecepatan orde kedua untuk pembentukan ES. K1 tentunya tidak boleh lebih besar daripada frekuensi dimana enzim dan substrat bertubrukan satu sama lain dalam larutan. Batas kontrol difusi ini berkisar dari 108 sampai 109M-1s-1. Sehingga enzim-enzim dengan nilai-nilai seperti itu dari kCAT/KM harus mengkatalisa suatu reaksi yang hampir setiap waktu enzim tersebut bergabung dengan molekul substrat.Tabel 1-1 mengindikasikan beberapa enzim seperti katalase, asetil kolinesterase, fumarase dan kemungkinan karbonik anhidrase telah mencapai kesempurnaan tingkat katalitik. Oleh karena daerah aktif suatu enzim secara umum hanya mengikat suatu fraksi kecil dari total permukaan daerah, bagaimana suatu enzim mengkatalisa suatu reaksi tiap waktu bila bergabung dengan molekul substrat?.
Walaupun jawaban ini belum jelas, bukti struktural dan teoritical telah dikumpulkan untuk menduga bahwa pengaturan grup-grup bermuatan pada permukaan enzim berhubungan dengan petunjuk substrat polar secara elektrostatistik terhadap daerah-daerah aktif enzim..
C. R e a k si Ba l i k
ini dapat dilihat batasan Michaelis – Menten tanpa reaksi balik dan dengan demikian, akan menemukan beberapa hal yang menarik dan prinsip kinetik yang penting.
M o d e l Sa t u P e r a n t a r a
Modifikasi dari model Michaelis – Menten adalah memadukan hasil reaksi kembali seperti pada skema reaksi.
E + S ES
(Disini ES adalah disebut EP karena model ini tidak menspesifikasikan sifat dari kompleks perantara). Persamaan yang menjelaskan perilaku kinetik dari model ini, dinyatakan sebagai :
P M s M P M r max s M f max
K
]
P
[
K
]
S
[
1
K
]
P
[
V
K
]
S
[
V
v
+
+
−
=
[ 1 . 1 5 ]dimana :
T 2 f
max
k
[
E
]
V
=
V
maxr=
k
−1[
E
]
T2 2 1 P M
k
k
k
K
− −+
=
dan[E]T = [E] + [ES]
Ini merupakan persamaan Michaelis Menten yang sangat penting yang bekerja secara bolak balik. Dalam hal ini, pada [P] = 0, maka bila V = Vo, persamaan ini menjadi persamaan Michaelis Menten.
H u b u n g a n H a l d a n e
Pada kesetimbangan, V = 0 sehingga persamaan [1.15] dapat diuraikan sehingga menghasilkan :
s M r max P M f max eq
K
V
K
V
]
S
[
]
P
[
K
=
=
[ 1 . 1 6 ]yang dikenal sebagai hubungan Haldane. Hubungan ini menunjukkan bahwa
p ar am et er k in et ik a d ar i r eak si b olak b alik y an g d ik at alisasik an secar a en zim at ik ad alah b u k an t id ak t er g an t u n g p ad a sat u sam a lain . Leb ih d ar i it u , in i salin g d ih u b u n g k an oleh k on st an t a k eset im b an g an u n t u k k eselu r u h an r eak si y an g t en t u saj a ad alah b er sif at in d ep en d en p ad a k eb er ad aan en zy m.
D a t a Ki n e t i k T i d a k D a p a t M e n e n t u k a n M e k a n i sm e R e a k si
Enzim yang membentuk senyawa reversibel dengan substratnya haruslah dalam hal ini, mempunyai mekanisme seperti :
E + S ES
Persamaan yang menjelaskan perilaku kinetik dari kedua model perantara ini, yang turunannya adalah analog terhadap apa yang diuraikan dalam Lampiran A untuk satu model perantara, yaitu memiliki bentuk yang identik dengan persamaan [1.15]. Namun, parameternya
V
maxf,
V
maxr,
K
Ms,
danK
MPk
1k-
1K
2k-
2P + E
k
1k-
1K
2k-
2EP
k
3k-
3didefinisikan dalam pengertian enam konstanta kinetika dari model dua perantara dari pada empat dari model satu perantara. Dalam kenyataan, persamaan kecepatan kondisi tunak untuk reaksi reversibel dengan tiga perantara atau lebih juga memiliki bentuk yang sama tetapi dengan definisi yang berbeda dari empat parameter.
Nilai
V
maxf,
V
maxr,
K
sM,
danK
PM dalam pers [1.15] dapat ditentukan dengan manipulasi yang sesuai dari substrat awal dan konsentrasi produk di bawah kondisi tunak. Ini, tentu saja tidak menghasilkan nilai konstanta untuk model dua perantara karena terdapat enam konstanta dan hanya empat persamaan yang menjelaskan hubungannya. Lebih lanjut pengukuran kinetik kondisi tunak tidak mampu untuk membedakan jumlah perantara dalam reaksi enzimatik reversibel karena bentuk pers [1.15] tidak berubah dengan jumlah perantara.Identitas fungsional dari persamaan ini menjelaskan skema reaksi yang mungkin dapat dipahami dalam pengertian analogi antara model reaksi reversibel n-perantara dan kotak hitam yang mengandung sistem pipa air dengan satu inlet dan satu drain :
Pada kondisi tunak, yaitu setelah pipa terisi dengan air, seseorang dapat mengukur hubungan antara tekanan input dan aliran output. Namun, berbagai pemeriksaan tidak menghasilkan informasi menyangkut konstruksi yang lebih rinci dari plumbing yang menghubungkan inlet dengan drain. Ini memerlukan informasi tambahan seperti pembukaan kotak hitam dan penelusuran pipa.
Dem ikian j uga pengukuran kinet ika kondisi t unak dapat m em berikan uraian fenom enologi dari perilaku enzim , t et api sifat alam iah dari perant ara ini m asih t et ap t idak dapat dit ent ukan. Lebih dari it u, int erm ediasi at au perant araan ini haruslah t erdet eksi dan dikarakt erisasi dengan cara independen sepert i analisis spekt roskopik.
Pembahasan ini terus menyoroti prinsip utama dari analisis kinetika : Analisis kinetika kondisi tunak dari reaksi, tidak dapat menentukan dengan jelas mekanismenya. Ini karena permasalahan tidak sederhana, elegan atau rasional dari mekanisme salah satu postulat yang dihitung dari data kinetika, juga adanya jumlah tak terbatas dari mekanisme alternatif, yang barangkali rumit, janggal, dan terlihat irasional, yang dapat dihitung untuk data kinetika yang ada. Biasanya ini lebih sederhana dan mekanisme elegan yang akan menghasilkan kebenaran, tetapi ini tidak selalu menjadi kasus. Jika dat a kinet ika t idak sesuai dengan m ekanism e yang dihasilkan, m aka m ekanism e harus dit olak. Oleh karena itu, meskipun kinetika tidak dapat digunakan untuk mekanisme yang tidak jelas tanpa data yng sesuai, seperti percobaan fisika dari eksistensi perantara, analisis kinetika kondisi tunak mempunyai arti yang besar besar karena dapat digunakan untuk menghilangkan mekanisme yang diajukan.
3 . I N H I BI SI
“turn-over”-nya. Bahan bahan yang mereduksi aktivitas suatu enzim dengan cara ini dikenal sebagai in h ibit or.
Banyak inhibitor berupa bahan –bahan yang secara struktural menyerupai substrat enzimnya tetapi salah satunya tidak bereaksi atau bereaksi dengan sangat lambat dibandingkan dengan substrat. Inhibitor-inhibitor seperti ini pada umumnya digunakan untuk menyelidiki sifat kimia dan sifat konformasi alami dari suatu daerah (site) ikatan substrat sebagai bagian dari suatu usaha untuk mengelusidasi mekanisme katalisis enzim tersebut. Sebagai tambahan, banyak inhibitor enzim efektif sebagai bahan kemoterapi karena suatu analog substrat “tidak alami” dapat menghalangi aksi dari suatu enzim spesifik. Sebagai contohnya, ‘methotrexate’ (juga disebut amethopterin) secara kimiawi menyerupai dihidrofolat. Methotrexate berikatan kuat dengan enzim dihydrofolate reduktase, sehingga dengan demikian mencegahnya dari fungsi normalnya, reduksi dari dehidrofolat menjadi tetrahidrofolat, suatu kofaktor esensial dalam biosintesis dari prekursor DNA a sa m t h ym idylic .
Dihydrofolate reductase
C – NHCHCH
2CH
2COO
-O
COO
-CH
2– NH
H
H
N
H
N
HN
O
Pembelahan sel-sel yang cepat seperti sel kanker, yang mana secara aktif berkaitan dengan sintesis DNA adalah jauh lebih rentan terhadap methotrexate daripada pertumbuhan sel-sel yang lambat seperti halnya kebanyakan jaringan sel normal mamalia. Untuk itu, methotrexate, bila diatur dalam dosis yang sesuai, akan membunuh sel-sel kanker tanpa secara fatal meracuni tubuh pemiliknya.
Ada berbagai mekanisme dimana inhibitor enzim dapat bekerja. Dalam bahagian ini, akan dibicarakan beberapa mekanisme serupa yang paling sederhana dan efeknya pada perilaku kinetik enzim yang mengikuti model Michaelis – Menten.
Inhibisi Kompetitif
Suatu bahan yang berkompetisi secara langsung dengan suatu substrat normal untuk suatu daerah (site) ikatan enzim dikenal dengan suatu in h ibit or k om pe t it if. Inhibitor seperti ini biasanya menyerupai substrat dimana secara spesifik mengikat daerah aktif tetapi bila berbeda darinya sehingga menjadi tidak reaktif. Untuk itu, methotrexate merupakan suatu inhibitor kompetitif dari dihidrofolat reduktase. Sama seperti suksinat dehidrogenase, suatu enzim siklus asam sitrat, yang berfungsi untuk mengubah suksinat menjadi fumarat, secara kompetitif di inhibisi oleh malonat, dimana secara strukturnya menyerupai suksinat tetapi tidak dapat terdehidrogenasi.
COO
-CH2
CH2
COO-
Su ccin a t e Fu m a r a t e
COO
-CH2 NO REACTION
COO
-Efektivitas malonat dalam menginhibisi kompetitif suksinat dehidrogenase secara kuat menyatakan bahwa daerah (site) ikatan substrat enzim diatur untuk mengikat kedua grup substrat karboksilat, barang kali melalui pengaruh kira kira tempat dua muatan positif residu. Model umum untuk inhibisi kompetitif diberikan pada skema reaksi di bawah ini :
E + S ES +
I
EI + S NO REACTION
Diasumsikan bahwa I, inhibitor akan berikatan secara reversibel kepada enzim dan dicapai kesetimbangan dengan cepat sehingga :
succinate dehydrogenase
C
C
H
COO
-H
-OOC
succinate dehydrogenase
k
1k-
1K
2
]
EI
[
]
I
[
]
E
[
K
I=
[1.17]dan EI, kompleks enzim inhibitor, secara katalitik tidak aktif. Suat u inhibit or kom pet it if unt uk it u bekerj a dengan m ereduksi konsent rasi enzim bebas yang t ersedia unt uk m engikat subst rat .
Tujuan sebelumnya adalah untuk mengekspresikan Vo dalam ukuran
kuantitas; dalam hal [E]T, [S] dan [I]. Dimulai dalam kondisi konservatif dari turunan persamaan Michaelis Menten, yang mana sekarang harus dihitung dengan adanya EI.
[E]T = [E] + [EI] + [ES] [1.18]
Konsentrasi enzim dapat dinyatakan sebagai [ES] dengan mengatur kembali persamaan [1.2] di bawah kondisi tunak (steady-state).
]
S
[
]
ES
[
K
]
E
[
=
M[1.19]
Kompleks enzim – inhibitor diperoleh dengan mengatur kembali persamaan [1.17] dan mensubstitusi persamaan [1.19] ke dalamnya.
I M
I
[
S
]
K
]
I
[
]
ES
[
K
K
]
I
[
]
E
[
]
EI
[
=
=
[1.20]Dengan mensubstitusi kedua hasil sebelumnya dalam persamaan [1.18] diperoleh :
+
+
=
1
K
]
I
[
1
]
S
[
K
]
Es
[
]
E
[
I M Tdimana dapat diperoleh [ES] dengan mengatur kembali persamaan tersebut
]
S
[
K
]
I
[
1
K
]
S
[
]
E
[
]
ES
[
I M T+
+
=
maka, menurut persamaan [1.7], kecepatan awal dinyatakan dengan :
]
S
[
K
]
I
[
1
K
]
S
[
]
E
[
k
]
ES
[
k
V
I M T 2 2 o+
+
=
=
[1.19]Lalu mengingat bahwa :
+
=
IK
]
I
[
1
α
[1.20]dan Vmax = k2[E]T seperti persamaan [13.23]
]
S
[
K
]
S
[
V
V
M maxo
=
+
Ga m ba r 5 . Su a t u plot k e ce pa t a n Vo da r i r e a k si M ich a e lis M e n t e n se de r h a n a v e r su s k on se n t r a si su bst r a t [ S] de n ga n a da n ya pe r be da a n k on se n t r a si da r i in h ibit or k om pe t it if.
Ini adalah persamaan Michaelis – Menten dengan KM dimodulasikan dengan α, suatu fungsi konsentrasi inhibitor (yang menurut persamaan [1.20], harus bernilai ≥ 1. Nilai dari [S] pada Vo = Vmax/2 adalah αKM.
Gambar 5 menunjukkan plot hiperbola persamaan [1.21] untuk variasi nilai α. Perhatikan bahwa pada [S] !∞ , Vo! Vmax untuk setiap nilai α Semakin besar nilai α, semakin besar pula [S] harus mencapai nilai Vmax. Untuk itu, inhibitor tidak mempengaruhi nilai “turn-over” dari enzim. Hal ini lebih kepada keberadaan I memiliki pengaruh mengakibatkan [S] menjadi lebih encer daripada kenyataannya, atau secara alternatif membuat KM menjadi lebih besar daripada kenyataannya. Sebaliknya peningkatan [S] mengubah kesetimbangan ikatan substrat terhadap ES. Dengan demikian, terdapat kompetisi sebenarnya antara I dan S untuk daerah (site) ikatan enzim substrat; ikatannya adalah mutually exclusive.
Dengan merujuk pada persamaan [1.21] dalam bentuk resiprok ganda diperoleh persamaan :
max max
M
o
V
1
]
S
[
1
V
K
V
I
+
= α
[1.22]Suatu plot dari persamaan ini linier dan memiliki slope αKM / Vmax, intersep dari 1/[S] adalah -1/αKM, dan intersep dari 1/Vo adalah 1/Vmax (Gambar 6). Plot
resiprok ganda unt uk inhibit or kom pet it if pada v ariasi konsent rasi I berpot ongan pada 1/ Vm ax dalam aksis 1/ Vo; ini diagnose unt uk inhibisi kom pet it if unt uk
m em bandingkan dengan t ipe- t ipe inhibisi lain.
Dengan m enent ukan nilai- nilai α pada berbagai konsent rasi inhibit or y ang berbeda- beda, nilai Ki dapat dibentuk dari persamaan [1.20]. Dengan cara ini,
Apabila inhibitor mengikat enzim secara irreversibel, inhibitor tersebut digolongkan sebagai suatu in a k t iv a t or seperti bahan apapun yang pada dasarnya mengnon-aktifkan enzim. Inaktivator benar benar mereduksi level efektif [E]T pada semua nilai [S].
Ga m ba r 6 . Su a t u plot Lin e w e a v e r – Bu r k da r i in h ibisi M ich a e lis – M e n t e n se ca r a k om pe t it if e n z im da la m Ga m ba r 5 . Pe r h a t ik a n se m u a ga r is be r pot on ga n pa da I / Vo a k sis pa da I / Vm a x
I n h ibisi N on - Kom pe t it if
Dalam inhibisi non-kompetitif, inhibitor mengikat secara langsung ke kompleks enzim-substrat tetapi tidak ke enzim bebas.
Tingkat peningkatan inhibitor, yang mana memiliki konstanta disosiasi
, [ES] [I]
KI = [1.23] [ESI]
Ga m ba r 7 . Su a t u plot Lin e w e a v e r – Bu r k da r i su a t u e n z im M ich a e lis – M e n t e n se de r h a n a de n ga n k e h a dir a n in h ibit or n on -k om pe t it if. Pe r h a t i-k a n ba h w a se m u a ga r is m e m ili-k i slope ide n t ik KM / Vm a x.
Persamaan Michaelis – Menten untuk inhibisi non-kompetitif yang diturunkan, adalah :
]
S
[
K
]
S
[
V
V
'M max o
α
α
+
=
[1.24]dimana,
' I '
K
]
I
[
1
+
=
α
[1.25]Penyelidikan terhadap persamaan ini menunjukkan bahwa p ad a n ilai [ S] y an g t in g g i, Vo ad alah m en d ek at i Vm a x/α’ secar a asim p t om at ik seh in g g a b er b ed a
d en g an in h ib it or k om p et it if , ef ek d ar i in h ib isi y an g t id ak k om p et it if p ad a Vm a x
ad alah t id ak d ap at b alik oleh p en in g k at an k on sen t r asi su b st r at . Namun, pada konsentrasi substrat yang rendah, dalam hal ini, bila [S] << KM, maka pengaruh inhibisi yang tidak kompetitif menjadi dapat diabaikan, juga perilaku (sifat) yang berlawanan dari inhibisi kompetitif.
Bila dibentuk dalam persamaan resiprok ganda, persamaan [1.24] menjadi :
max '
max M
o
[
S
]
V
I
V
K
V
I
+
α
=
[ 1 . 2 6 ]Plot Lineweaver-Burk untuk inhibisi (hambatan) yang tidak kompetitif adalah liner dengan kemiringan atau slope KM/Vmax seperti di
dalam reaksi yang tidak terhambat, dan dengan yang memotong 1/Vo dan
1/[S] berupa α’/Vmax dan -α’/KM. Serangkaian plotLineweaver-Burk pada berbagai konsentrasi inhibitor yang tidak kompetitif terdiri dari serangkaian garis parallel (gbr.7). Ini adalah dignosa untuk inhibisi yang tidak kompetitif.
seperti proton atau ion logam. Sebagaimana diketahui bahwa, inhibisi yang tidak kompetitif adalah sangat penting bagi enzim dengan multisubstrat.
C. I n h i b i si Ca m p u r a n
Jika baik enzim dan senyawa substrat-enzim mengikat inhibitor, maka model berikut ini akan dihasilkan :
E+S == ES ! P + E
+ +
I I
K1 K1
EI ESI ! Tanpa reaksi
Kedua langkah pengikatan – inhibitor ini dianggap terjadi pada kesetimbangan tetapi dengan konstanta disosiasi yang berbeda :
]
ESI
[
]
I
[
]
ES
[
K
dan
]
EI
[
]
I
[
]
E
[
K
I=
'I=
[ 1 . 2 7 ]Fenomena ini adalah dikenal sebagai inhibisi campuran (mixed inhibition )atau inhibisi yang tidak kompetitif (non competitive inhibition). Kemungkinan, inhibisi campuran berikatan dengan bahagian (site) enzim yang ikut serta baik dalam pengikatan substrat dan katalisator.
Persamaan Michaelis – Menten untuk inhibisi campuran adalah :
]
S
[
a
K
]
S
[
V
V
'M max o
+
=
α
[ 1 . 2 8 ]Dimana α dan α’ telah didefinisikan dalam pers [1.20] dan [1.25].
Juga dapat dilihat dari persamaan [1.28] bahwa nama dari inhibisi campuran muncul dari fakta bahwa denominator merupakan faktor α yang dikalikan KM seperti dalam inhibisi kompetitif, (persamaan [1.21]) dan faktor α’ dikali dengan [S] seperti dalam inhibisi tidak kompetitif (persamaan [1.24]). Inhibisi campuran ini akan efektif, baik dalam konsentrasi substrat yang tinggi dan rendah.
max '
max M
o
[
S
]
V
I
V
K
V
I
α
α
+
=
[ 1 . 2 9 ]Plot dari persamaan ini terdiri dari garis yang memiliki kemiringan (slope)
αKM/Vm dengan perpotongan terhadap 1/Vo,adalah α’/Vmax dan perpotongan terhadap 1/[S] adalah -α’/αKm. Manipulasi aljabar dari persamaan [1.29] untuk nilai yang berbeda dari [I] menunjukkan bahwa persamaan ini
menjelaskan kumpulan garis yang memotong sisi kiri dari sumbu 1/Vo
(Gambar 8 ); untuk kasus khusus dimana K1 = K1’ (α=α’), perpotonganya adalah pada aksis 1/[S].
Tabel 2 memberikan ringkasan dari hasil awal yang melibatkan inhibisi Michaelis - Menten sederhana. Persamaan KM dan Vmax adalah nilai yang terlihat dari KM dan Vmax yang secara actual diamati dengan adanya inhibitor untuk persamaan Michaelis – Menten yang menjelaskan enzim yang dihambat.
4 . Ef e k p H
Enzim, berupa protein, memiliki sifat yang sensitive terhadap pH. Sebagian protein adalah hanya aktif di dalam trayek pH sempit, umumnya 5 hingga 9. Ini adalah merupakan hasil pengaruh dari pH atas kombinasi faktor (1) ikatan dari substrat ke enzim (2), aktivitas katalitik dari enzim, (3) ionisasi substrat dan (4) variasi struktur protein ( biasanya signifikan hanya pada pH yang cukup tinggi).
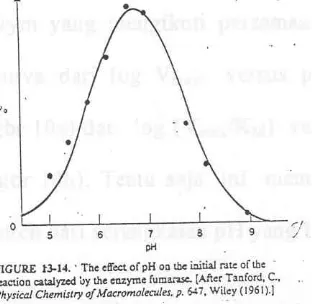
Ke t e r g a n t u n g a n p H d a r i e n z y m M i ch a e l i s – M e n t e n Se d e r h a n a
Kecepatan awal untuk reaksi enzimatik memperlihatkan kurva berbentuk lonceng sebagai fungsi pH (gbr. 9). Kurva ini memperlihatkan ionisasi dari berbagai residu asam amino yang harus ada di dalam kondisi ionisasi spesifik untuk kegiatan enzim. Model berikut ini dapat dipakai untuk berbagai pengaruh pH.
Dalam pengembangan mekanisme reaksi satu substrat sederhana – tanpa balik, akan dianggap bahwa hanya EH dan ESH yang aktif mengkatalisa.
Persamaan Michaelis – Menten untuk model ini adalah :
Vmax [S]
Vo = [1.30]
Kmax + [S]
Vmax = Vmax / f2 dan KM = KM ( f1/f2 ) Dimana :
[ H+] K E 2 f1 = + 1 + KE 1 [H+] [H+] KES 2 f2 = + 1 +
KES 1 [H+]
dan Vmax dan KM merujuk pada bentuk aktif dari enzim, EH dan ESH. Sebagai catatan bahwa pada pH tertentu, persamaan [1.30] merupakan persamaan sederhana dari Michaelis – Menten, tetapi karena ketergantungan pH dari f1 dan f2, Vo bervariasi dengan pH dalam bentuk lonceng.
Ev a l u a si Ko n st a n t a I o n i sa si
Konstanta ionisasi dari enzym yang mengikuti persamaan [1.30]
dapat dievaluasi dengan analisis kurva dari log Vmax versus pH, yang
memberikan nilai KES1 dan KES2 (gbr 10a) dan log (Vmax/KM) versus pH yang menghasilkan KE1 dan KE2. (gbr 10b). Tentu saja ini menunjukkan penentuan parameter Michaelis Menten dari serangkaian pH yang berbeda.
U k u r a n p Ks i n i s e r i n g m e n j a d i p e t u n j u k b e r h a r g a u n t u k m e n g i d e n t i f i k a s i r e s i d u e s e n s i a l d a r i a s a m a m i n o k a r e n a a k t i v i t a s e n z i m a t i k . M i s a l n y a , u k u r a n p K ~ 4 m e n y a t a k a n b a h w a r e s i d u A s p a t a u G l u a d a l a h e n s e n s i a l b a g i e n z i m . S a m a j u g a , u n t u k p K s ~ 6 a t a u ~ 1 0 m e n y a t a k a n p a r t i s i p a s i d a r i r e s i d u H i s a t a u L y s s e c a r a b e r t u r u t a n .
2 . M e t a b o l i sm e
permulaan sampai ke suatu hasil akhir disebut jalur metabolisme. (pat hw ay). Senyawa yang terbentuk selama jalur metabolisme berlangsung disebut senyawa antara (int erm ediat e). Metabolisme meliputi proses sintesis (anabolisme) dan proses penguraian (katabolisme) senyawa atau komponen di dalam sel hidup. Melalui jalur anabolisme terbentuk senyawa.
Diperlukan sejumlah energi supaya proses anabolisme terjadi. Reaksi kimia yang terjadi meliputi sintesis dari ikatan –C-C- (sintesa asam lemak), ikatan –CO-N- (sintesa protein), ikatan C-N- (sintesis urea), dan ikatan –C-O- (sintesa trigliserida) memerlukan energi. Unsur kimia dan senyawa digunakan untuk membentuk senyawa baru yang lebih besar. Sebaliknya melaui jalur katabolisme akan terjadi penguraian senyawa menjadi komponen yang lebih kecil. Misalnya, katabolisme glukosa akan terurai menjadi karbon dioksida (CO2) dan air (H2O). Di dalam proses katabolisme sejumlah energi dilepaskan; sebagian dipakai oleh sel dan sisanya hilang sebagai panas. Produksi energi untuk keperluan sel terjadi dalam tiga tahap; (1) molekul-molekul besar komponen makanan seperti protein, pati, lemak dipecah selama proses pencernaan dan penyerapan menjadi molekul-molekul yang lebih kecil seperti asam amino, monosakarida dan asam lemak, (2) sebagian besar molekul-molekul yang lebih sederhana ini selanjutnya diuraikan menjadi senyawa antara (intermediate) yang terdiri dari dua atom karbon yakni asam asetat (CH3COOH dan (3) asam asetat dipecah menjadi air dan karbon dioksida. Elektron dan ion hidrogen yang dilepaskan selama proses metabolisme ini disumbangkan ke atom oksigen membentuk air. Sebahagian energi yang dihasilkan di dalam proses katabolisme ini memicu sintesa adenosin tripospat (ATP). ATP adalah energi di dalam suatu bentuk yang digunakan sel. Ketiga tahapan katabolisme ini dapat dilihat seperti di dalam Gambar 11 berikut.
Karbohidrat Lemak Protein
glukosa asam lemak asam amino alkohol
CO2 CO2
Ga m ba r . 9. Ikhtisar umum dari katabolisme(Wardlaw & Kessel, 2002)
H
2O ½O
2e
Rantai transportasi elektron
siklus sitrat
D . En e r gi u n t u k se l
Energi yang digunakan oleh manusia bersasal dari ikatan kimia yang terdapat diantara atom di dalam karbohidrat, protein, lemak dan alkohol. Energi tersebut terbentuk selama proses fotosintesa pada saat tanaman menggunakan energi matahari untuk membentuk glukosa dan senyawa organik lainnya. Reaksi-reaksi kimia di dalam fotosintesa membentuk senyawa yang mengandung lebih banyak energi daripada di dalam karbon dioksida dan air. Badan manusia akan mengubah energi ikatan kimia yang terjerat di dalam karbohidrat, lemak, protein menjadi energi dalam bentuk lain yakni:
(1) Energi kimia yang membantu senyawa baru seperti glikogen dari molekul-molekul monosakarida
(2) Energi mekanik yang menggerakkan otot
(3) Energi osmotik yang mempertahankan kesetimbangan ion di dalam sel-sel.
Hasil samping dari transformasi energi ini adalah CO2, H2O dan panas. Bentuk energi yang digunakan sel untuk proses kimia, listrik, mekanik dan osmotik umumnya adalah ATP. Untuk melepaskan energi dari ATP, sel memecahkannya menjdi adenosin dipospat (ADP) plus Pi, gugus pospat anorganik yang bebas. ADP dapat juga dipecah menjadi adenosin monopospat (AMP) plus Pi untuk menghasilkan energi di dalam otot yang berekasi agar mampu bekerja selama latihan yang intensif pada saat ATP terbatas
(ADP + ADP ATP + AMP).
Jalur metabolisme terdapat di dalam setiap sel yang dapat menggabungkan ADP dan Pi membentuk ATP. Suatu enzim kemudian memecahkan ikatan ATP untuk melepaskan energi untuk reaksi metabolisme. ATP sendiri sangat stabil, sehingga diperlukan suatu enzim untuk membuka energi yang tersimpan di dalam molekulnya. Selama metabolisme, suatu sel secara kontiniu memecahkan ATP di dalam suatu organel sementara pembentukan di dalam organel yang lain. Di dalam suatu sel otot yang kelelahan memiliki ADP pada konsentrasi yang tinggi sedangkan ATP dengan konsentrasi yang rendah. Jika ini terjadi, aktivitas sel otot seperti kontraksi otot dapat menurun atau berhenti. Dengan konsentrasi ATP yang rendah kemudian akan merangsang proses metabolisme yang akan menghasilkan ATP. Hanya dengan re-sintesa ATP yang dibutuhkan dapat mengaktifkan otot siap untuk melakukan fungsi selanjutnya.
Re a k si ok sida si- r e du k si di da la m m e t a bolism e
Reksi oksidasi-reduksi membentuk suatu hubungan yang vital diantara nutrient penghasil energi dengan pembentukan ATP. Pengertian dasar dari oksidasi dan reduksi dapat diterangkan sebagai berikut. Suatu zat dioksidasi jika zat tersebut kehilangan satu elektron atau lebih. Suatu zat direduksi jika zat tersebut memperoleh satu elektron atau lebih. Aliran elektron menentukan proses reduksi-oksidasi. Jika suatu zat kehilangan elektron (teroksidasi), zat lain harus memperoleh elektron (tereduksi). Kedua proses berlangsung serentak; satu dengan yang lain saling terkait. Tidak mungkin satu proses terjadi tanpa yang lainnya. Contoh proses reduksi-oksidasi sebagai berikut.
Zn + Cu 2++ Zn 2++ + Cu
Disini, Zn telah kehilangan dua elektron (telah teroksidasi), Cu telah mendapatkan dua elektron (tereduksi). Contoh lain adalah besi di dalam hemoglobin, yang dapat teroksidasi dari Fe 2+ menjadi Fe3+ dan reduksi dari Fe3+ menjadi Fe2+. Hal ini terjadi selama transportasi oksigen ke sel-sel badan.
oksidasi
CH3-CH3 CH3-CH2-OH reduksi
reduksi
CH3-CO-CO-OH CH3-COH-CO-OH Asam piruvat oksidasi asam laktat
Metode ini menentukan oksidasi–reduksi adalah dengan menentukan perobahan kandungan atau pertukaran oksigen dan hidrogen yang digunakan di dalam ilmu gizi. Reaksi reduksi-oksidasi di dalam tubuh dikendalikan oleh enzim-enzim. Satu kelompok yang penting dari enzim ini ialah disebut sebagai dehy drogenase, mampu mengusir/mengeluarkan hidrogen dari zat gizi penghasil energi atau hasil peruraiannya dan menyumbangkan hidrogen ke aseptor terakhir oksigen membentuk air. Di dalam proses ini, sejumlah besar energi dipindahkan ke ADP plus Pi membentuk ATP. Dua vitamin B, niacin dan riboflavin, membantu enzim hidrogenase, secara bergantian, berperan di dalam pemindahan hidrogen dari glukosa ke oksigen di dalam jalur metabolisme dari sel. Niacin berfungsi sebagai co-enzim nicot inam ide adenin dinucleot ide (NAD). Ini adalah bentuk teroksidasi yang dapat menerima dua ion hidrogen dan dua elektron membentuk NADH + H+ (kelebihan ion hidrogen tetap bebas di dalam sel). Dengan kata lain, bentuk oksidasi dari niacin, NAD, direduksi membentuk NADH+ H+. Perlu diketahui
bahwa NAD sebenarnya NAD+, menunjukkan kekurangan satu elektron
dibandingkan dengan bentuk konfigurasi keseluruhan. Dengan menerima dua
elektron dan dua ion hidrogen, NAD+ menjadi NADH + H+, tanpa muatan.
(Muatan NAD+ diabaikan untuk mempermudah pembahasan). NAD + + 2H+ + 2 e- NADH + H+
Riboflavin berfungsi dengan peranan yang sama. Di dalam bentuk oksidasi, dikenal sebagai flav in adenine dinucleot ide (FAD). Jika tereduksi (menerima dua hidrogen, ekivalen dengan dua ion hidrogen dan dua elektron), maka dikenal sebagai FADH2. Reduksi oksigen (O) menjadi air (H2O) menghasilkan daya dorong untuk kehidupan, karena sangat penting untuk sel mensintesa ATP (lihat Gambar 12). Maka reaksi reduksi-oksidasi merupakan satu kunci di dalam kehidupan.
Ga m ba r 1 2. Struktur dari adenosin trifospat dan zat-zat yang berkaitan. Bentuk ionik yang ditunjukkan merupakan bentuk berlimpah pada pH 7. ATP bekerja untuk memberi gugus fosforil kepada suatu penerima gugus fosforil. Di dalam sel
2 .1 . M e t a bolism e Ka r boh idr a t
Glik olisis
Glikolisis secara harafiah berari pemecahan glukosa. Jalur glikolisis di temukan di dalam sitosol dari sel, mempunyai dua peran; pemecahan monosakarida untuk menghasilkan energi dan menyediakan satuan pembentuk untuk sintesa senyawa yang diperlukan sel seperti gliserol untuk sintesa trigliserida atau lemak. Sebelum glikolisis dapat berlangsung, sebuah sel harus memperoleh glukosa. Hanya beberapa jenis sel seperti sel-sel hati dan buah pinggang (kidney) yang dapat menghasilkan glukosa dari asam amino, dan hanya hati dan sel-sel jaringan menyimpan glukosa dalam jumlah besar.
Glukosa ini disimpan sebagai glikogen. Hati dan jaringan memecahkan glikogen menjadi glukosa (atau bentuk monosakarida lain). Sel-sel badan lainnya harus memperoleh glukosa dari sirkulasi darah, sehingga badan perlu mempertahankan suatu konsentrasi yang relatif tetap dari glukosa darah supaya dapat hidup.
Hasil glikolisis adalah dua unit senyawa yang mengandung tiga atom karbon yaitu asam piruvat. Sebahagian sel-sel mengubah asam piruvat menjadi asam laktat. Glikolisis dimulai dengan penambahan satu gugus fospat ke glukosa, sehingga menjadi lebih reaktif. Satu gugus fospat yang lainnya di tambahkan ke senyawa glukosa-fospat yang baru terbentuk yang kemudian dipecah menjadi senyawa karbon yang mengandung tiga atom karbon. Senyawaan ini diubah melalui serangkaian tahapan menjadi dua molekul piruvat. Maka dalam glikolisis sebuah sel memulai dengan satu molekul glukosa dan menghasilkan dua molekul yang mengandung tiga atom karbon yakni piruvat. Di dalam proses ini empat hidrogen(mengandung total empat elektron) dikeluarkan dan empat ATP terbentuk. Elektron dan hidrogen ditangkap oleh pembawa (carrier) dalam hal ini NAD. Setiap NAD (bentuk teroksidasi) menerima dua elektorn dan satu ion hidrogen, menghasilkan NADH + H+ (bentuk tereduksi). Maka salah satu hasil akhir dari glikolisis adalah juga sintesa dari dua NADH + H+, dengan pelepasan dua ion hidrogen.
Di dalam glikolisis, reaksi pertama melibatkan satu ATP menyumbangkan satu gugus fospat ke glukosa. Pada tahap ketiga, satu lagi ATP digunakan menambah satu gugus fospat kedua. Maka untuk memulai jalur ini, satu sel memakai dua ATP. Pada saat molekul yang mengandung tiga atom karbon diubah menjadi piruvat, masing-masing menghasilkan dua ATP, sehingga total ada 4 ATP. Energi bersih yang dihasilkan sejauh ini dari glikolisis adalah dua ATP, karena dua ATP digunakan didalam proses dan empat ATP di hasilkan. Masih ada ATP yang akan terbentuk; ini hanya menyatakan sebanyak 5% dari total produksi ATP yang mungkin dari satu molekul glukosa.
Energi kimia yang disimpan di dalam ikatan NADH akhirnya dapat
ditransfer ke ATP. Pada umumnya setiap NADH + H+ menyumbangkan energi
yang cukup untuk menghasilkan 2,5 ATP. Maka NADH + H+ adalah satu bentuk dari energi potensial untuk sel. Pada akhirnya sel memakai energi di dalam NADH + H+ membentuk ATP.
Pr odu k si la k t a t a da la h t it ik a k h ir da r i glik olisis a n a e r obik
Sebagian sel kekurangan jalur yang membutuhkan oksigen (aerobik)
diperlukan untuk memakai NADH + H+ untuk sintesa ATP, dan pada saatnya sel-sel ini kurang mampu memakai proses ini untuk me-recycle NADH + H+ kembali menjadi NAD. Misalnya sel darah merah. Maka, pada saat sel darah merah mengubah glukosa menjadi piruvat, NADH + H+ meningkat di dalam sel. Akhirnya konsentrasi NAD menurun terlampu rendah sehingga glikolisis berlanjut, karena kebanyakan NAD ada di dalam bentuk NADH + H+. Untuk mengimbanginya, satu
sel darah merah mereaksikan piruvat dengan satu NADH + H+ dan satu ion
hidrogen bebas membentuk laktat, lihat Gambar 11. Di dalam proses itu, NADH +
H+ berobah menjadi NAD. Proses ini memungkinkan sel darah merah untuk
mengandung m it ochondria. Otot yang sedang latihan juga menghasilkan laktat jika kekurangan NAD. Bertambahnya laktat kemudian akan menyebabkan otot menjadi lelah (fatigue).
Produksi laktat oleh suatu sel memungkinkan glikolisis anaerobik berlanjut karena disini tetap ada suatu pasokan dari NAD. Lagi pula, jalur ini menghasilkan hanya sekitar 5% dari potensial ATP per molekul glukosa. Tetapi untuk sebagian sel-sel seperti sel darah
Ga m ba r 1 3 . Tahapan reaksi glikolisis: glukosa menjadi piruvat (Wardlaw & Kessel, 2002)
merah, glikolisis anaerobik adalah satu-satunya metode untuk menghasilkan ATP. Asam laktat dilepaskan ke peredaran darah, ditangkap terutama oleh hati dan disintesa menjadi glukosa.
Fe r m e n t a si a lk oh ol
Dalam beberapa jasad renik seperti ragi, glukosa dioksidasi menghasilkan etanol dan CO2 dalam proses yang disebut fermentasi alkohol. Jalur metabolisme proses ini sama dengan glikolisis sampai dengan terbentuknya piruvat. Dua tahap reaksi enzim berikutnya adalah reaksi perubahan asam piruvat menjadi asetaldehide, reaksi reduksi asetaldehide menjadi alkohol. Dalam reaksi yang pertama piruvat didekarboksilasi diubah menjadi asetaldehide dan CO2 oleh
piruv at dekarboksilase, suatu enzim yang tidak terdapat dalam hewan. Reaksi dekarboksilasi ini merupakan reaksi yang tidak reversible, membutuhkan ion
Mg++ dan koenzim tiamin piropospat. Dalam reaksi terakhir, asetaldehide
jumlah energi yang dihasilkannya sama dengan glikolisis anaerob, yaitu 2 ATP (lihat Gambar 14).
Ga m ba r 1 4 . Metabolisme karbohidrat: fermentasi alkohol (Wirahadikusumah, 1985)
Sik lu s Asa m Sit r a t
Dua molekul piruvat atau laktat yang terbentuk pada akhir dari glikolisis masih mengandung banyak energi yang tersimpan. Piruvat lewat dari sitosol sel ke mitokondria. Kemudian sebuah sel memakai jalur-jalur yang ada untuk mengeluarkan energi yang masih sisa dari piruvat untuk membentuk ATP. Satu jalur kunci yang disebut siklus asam sitrat.
Sebelum siklus asam sitrat dapat berlangsung, piruvat harus melepaskan satu gugus karbon dioksida dan akhirnya membentuk asetil-CoA. Reaksi ini bersifat irreversible dan memiliki konsequensi metabolik yang penting. Pada saat asam piruvat diobah menjadi asetil-CoA, satu lagi NADH + H+ akan terbentuk, sehingga akan dihasilkan lagi molekul ATP. Perobahan piruvat menjadi asetil-CoA membutuhkan vitamin B tiamin, riboflavin, niacin, dan asam pantotenat. Maka, metabolisme karbohidrat tergantung pada adanya vitamin-vitamin ini.
Siklus asam sitrat (Siklus Krebs atau Siklus TCA) adalah suatu urutan reaksi-reaksi kimia yang rapi dan bagus, digunakan oleh sel untuk mengubah karbon dari asetat menjadi karbon dioksida dan untuk menghasilkan energi. Asetil-CoA memasuki siklus, dan akhirnya reaksi-reaksi menghasilkan dua molekul karbon dioksida. Di dalam proses ini, sel menghasilkan NADH + H+ dan molekul-molekul lain yang terkait yang akhirnya digunakan membentuk banyak ATP.
Ga m ba r 1 5. Hubungan antara berbagai tahap pada oksidasi piruvat (Page, 1989)
Dengan cara ini sebagian energi di dalam bentuk ikatan kimia di dalam glukosa ditransfer ke ATP. Maka, sebagian energi didalam makanan menghasilkan satu bentuk energi yang dapat dimanfaatkan oleh sel, daripada hanya diubah menjadi panas, sebagaimana terjadi jika makanan dibakar dengan api. Dengan istilah teknik, sel memanfaatkan sebanyak 40% energi kimia dari glukosa ditransfer ke dalam bentuk ATP. Inilah tujuan utama dari metabolisme energi. Sisa energi sebanyak 60% terlepas sebagai panas melalui semua reaksi-reaksi
yang terjadi dimana ATP, GTP, NADH + H+, atau FADH2 tidak terbentuk.
Perbandingan yang sama (40:60) ini juga berlaku pada energi metabolisme lemak dan asam amino. Hal ini sudah cukup effisien dibandingkan dengan mesin mobil yang hanya mampu memanfaatkan 10% dari energi di dalam bensin.
Ra n t a i t r a n spor t e le k t r on da la m sin t e sa ATP
Selama metabolisme protein, karbohidrat, lemak, dan alkohol, sel menghasilkan NADH + H+ dan FADH2. Kebanyakan sel dapat memakai senyawa ini untuk sintesa ATP. Jalur yang melaksanakan pertukaran ini disebut rantai transport elektron. Proses ini terjadi di bagian dalam membrane mitokondria disebut posporilasi oksidatif (oxidat ive phosphorylat ion). Mineral besi dan tembaga diperlukan untuk proses ini.
Di dalam rantai transport elektron, NADH memberikan energi kimianya ke senyawa yang berkaitan dengan FAD yang disebut flav in m ononucleot ide (FMN). FMN ini diikuti pada suatu sambungan oleh Coenzim Q, yang memisahkan pasangan elektron sehingga mereka dapat meneruskan satu elektron setiap kali melalui tahapan selanjutnya dari rantai transport elektron. Kemudian hidrogen akan menempuh jalur lain.
Struktur selanjutnya yang digunakan di dalam rantai transport elektron adalah suatu gugus dari molekul yang mengandung besi cyt ochrom e. Pada akhir dari rantai cytochrome adalah cytochrome khusus (disebut cytochrome a3) yang berfungsi untuk menyumbangkan semua elektron-elektron yang telah bergerak turun ke bagian bawah akhir rantai ke oksigan. Pada tahap akhir ini, ion hidrogen bergabung kembali dengan elektron menjadi hidrogen, yang kemudian bergabung dengan oksigen menjadi air. Jadi walaupun NADH + H+ dan FADH2 mentransfer hidrogennya ke rantai transport elektorn, harus diingat bahwa ion hidrogen (H+) tidak ditransfer bersamaan dengan elektron. Sesudah NADH + H+ dan FADH2 memindahkan hidrogen ke rantai transport elektron kemudian menjadi NAD dan FAD dan akan siap untuk mentransfer hidrogen dari hasil siklus sitrat ke rantai transport elektron. Di dalam proses ini oksigen sangat essensial, rantai transport elektron adalah bagian dari metabolisme aerobik. NADH + H+ dan FADH2 yang dihasilkan dari siklus asam sitrat dapat berubah menjadi NAD dan FAD hanya jika telah mentransfer elektron dan ion hidrogennya ke oksigen. Itulah sebabnya oksigen sangat mendasar bagi kehidupan; suatu penerima elektron dan ion hidrogen terakhir yang dihasilkan dari pemecahan zat gizi pemberi energi. Tanpa oksigen, kebanyakan sel tubuh kita tidak mampu mengambil energi yang cukup dari bahan bakar untuk mempertahankan kehidupan.
2 .2 . M e t a bolism e Le m a k
Lipolisis
Lipolisis adalah bagian dari katabolisme trigliserida menjadi asam lemak bebas dan gliserol. Peruraian selanjutnya dari asam lemak untuk menjadi energi disebut oksidasi asam lemak, karena pelepasan electron dari asam lemak ke oksigen adalah rekasi keseluruhan di dalam proses produksi energi. Proses ini terjadi di dalam mitokhondria dan memenfaatkan energi menjadi ATP.
Asam lemak dibebaskan dari jaringan cadangan lemak sel-sel adipose oleh enzim sejenis lipase yakni horm on- sensit iv e lipase. Aktivitas enzim ini meningkat oleh hormon glukagon, hormon pertumbuhan, epineprin dan yang lainnya; dan ditekan oleh hormon insulin. Asam lemak diambil dari sirkulasi darah oleh sel-sel dan dipindahkan dari sitosol ke dalam mitokhondria dengan bantuan suatu carrier yang disebut carnit ine. Pada orang sehat, sel-sel memproduksi carnitine yang diperlukan untuk proses ini. Selama penayakit akut pada pasien-pasien rawat inap di rumah sakit, sintesis carnitine mungkin terganggu sehingga tidak mencapai jumlah yang dibutuhakan. Oleh karena itu mungkin diperlukan pemberian makanan tambahan melalui intravena (penyuntikan via pembuluh darah balik).
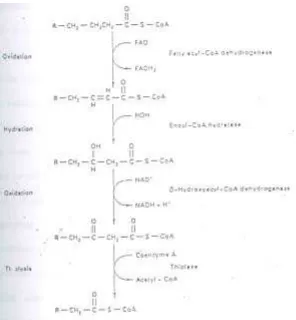
Pada umumnya, asam lemak terdiri dari rantai karbon yang genap antara 2-26. Tahap pertama di dalam pengambilan energi dari asam lemak menjadi ATP (oksidasi asam
lemak) adalah memecahkan rangkaian atom karbon sebanyak dua setiap kali, dan mengubahnya menjadi fragmen asetil-CoA. Proses pengubahan asam lemak menjadi banyak molekul asetil-CoA lebih dikenal sebagai bet a- oksidasi (lihat Gambar 18), karena atom karbon kedua pada asam lemak (dihitung dari gugus karboksilat) disebut karbon bet a. Selama beta-oksidasi berlangsung, NADH + H+ dan FADH2 dihasilkan sebagaimana oleh glukosa, asam lemak akhirnya dipecah menjadi senyawa yang mengandung dua atom karbon yakni asetat dalam bentuk asetil-CoA. Sebahagian energi kimia ditransfer ke NADH + H+ dan FADH2, asetil-CoA memasuki siklus asam sitrat dan dua karbon dioksida dihasilkan, sebagaimana dari glukosa. Maka, hasil pemecahan baik dari glukosa dan asam lemak, asetil-CoA, menjalani jalur yang sama yakni siklus asam sitrat. Salah satu perbedaan yang mendasar ialah bahwa asam lemak yang mempunyai 16 atom karbon akan menghasilkan 108 ATP, sementara glukosa yang terdiri dari 6 atom karbon menghasilkan 30-32 ATP. Hal ini memberikan perbandingan 7 ATP per atom karbon pada asam lemak dan kira-kira 5 ATP per atom karbon pada glukosa. Perbedaan ini adalah karena ikatan C-H yang lebih banyak pada asam lemak dibandingkan dengan pada glukosa. Proses okasidasi pada ikatan kimia dari suatu senyawa akan menghasilkan energi untuk mensintesa ATP. Perlu diketahui bahwa pada atom karbon di dalam glukosa juga terikat dengan gugus hidroksil (-OH), dibandingkan hanya dengan atom hidrogen di dalam molekul asam lemak. Oleh karena itu, secara keseluruhan, karbon pada glukosa terdapat sebagai karbon yang lebih teroksidasi (memiliki bilangan oksidasi yang lebih tinggi). Hal ini lah yang menyebabkan lebih banyak energi yang dikandung oleh asam lemak (lebih tereduksi) dari pada karbohidrat. Berapa pun jumlah atom karbon dari asam lemak selalu diuraikan menjadi asetil-CoA. Kadang-kadang, suatu asam lemak yang terdiri dari atom karbon yang ganjil, sel akan membentuk banyak asetil-CoA, plus satu senyawa yang mengandung tiga atom karbon yakni propionil-CoA yang kemudian langsung memasuki siklus asam sitrat.
[image:30.595.148.444.418.738.2]Ke t oge n e sis
Ketone bodies (senyawa keton dalam tubuh) adalah hasil oksidasi asam lemak yang tidak sempurna. Ketidakseimbangan hormonal terutama produksi insulin yang tidak cukup untuk mengimbangi aktivitas glukagon di dalam tubuh memungkinkan kondisi metabolisme yang cendrung mengarah ke produksi yang relatif banyak ketone bodies yang disebut ket osis.
1. Asam lemak yang tersimpan di dalam sel-sel adipose dengan cepat dilepas ke aliran darah. Alasan utama terjadinya hal ini adalah jika insulin sangat rendah di dalam darah, karena insulin akan menghambat lipolisis, sebaliknya akan menyimpan lemak. Pertambahan yang berlimpah dari asam lemak di dalam darah akan diambil oleh hati.
2. Oksidasi asam lemak menjadi asetil-CoA mendominasi/melebihi sintesis asam lemak di dalam hati.
3. Karena hati mengambil asam lemak dan memecahkannya menjadi asetil-CoA, kapasitas siklus asam sitrat untuk memproses molekul-molekul asetil-CoA yang dihasilkan menurun. Terutama hal ini karena metabolisme asam lemak menjadi asetil-CoA menghasilkan banyak ATP, dan jumlah ATP yang tinggi akan memperlambat aktivitas siklus asam sitrat di dalam sel-sel hati. Pada dasarnya, tidak perlu memakai siklus asam sitrat (yang peranan utamanya mentransfer energi dari bahan bakar untuk diguanakan dalam sintesis ATP) jika sel-sel sudah memiliki banyak ATP.
Perobahan-perobahan metabolisme ini akan memicu sel-sel hati membentuk asetil-CoA dan kemudian menyatukan dua molekul asetil-CoA menjadi senyawa yang mengandung empat atom karbon. Senyawa ini kemudian dimetaboliser dan akhirnya disekresikan ke dalam aliran darah sebagai ketone bodies seperti asam asetoasetat dan senyawa sejenisnya asam beta-hidroksibutirat dan aseton. Kebanyakan ketone bodies akhirnya akan diubah menjadi kembali ke asetil-CoA di dalam sel lain yang memakai ketone bodies sebagai bahan bakar. Kemudian ketone bodies di tolakkan melalui siklus asam sitrat. Salah satu ketone bodies yang terbentuk (aseton) meninggalkan badan melalui paru-paru menyebabkan pernapasan seseorang sebagai karakteristik kondisi ketosis, napas berbau seperti buah. Kunci tahapan di dalam ketosis lihat Gambar 19 berikut.
Pasokan karbohidrat rendah, produksi insulin yang rendah
Asam lemak yang berlimpah dalam hati
Banyak sedikit
Ketone bodies seperti CO2 + H2O Asam asetoasetat
E. Ke t osis pa da k e a da a n la pa r a t a u m a sa pu a sa
Jika seseorang dalam keadaan puasa, ketersediaan karbohidrat sangat rendah sehingga produksi insulin juga sedikit. Karena rendahnya kadar insulin akan menyebabkan asam lemak banyak terdapat di dalam darah dan akhirnya membentuk ketone bodies. Jantung, otot, dan bagian tertentu dari buah pinggang menggunakan ketone bodies sebagai bahan bakar. Sesudah beberapa hari dalam keadaan ketosis, otak juga mulai memetaboliser ketone bodies untuk energi. Ini adalah suatu respon penyesuaian (adaptive response) yang penting terhadap puasa. Karena semakin banyak sel-sel tubuh mulai menggunakan ketone bodies untuk sumber energi, kebutuhan akan glukosa sebagai sumber energi makin berkurang. Hal ini kemudian mengurangi kebutuhan bagi buah pinggang dan hati untuk menghasilkan glukosa dari asam amino, akan menghemat protein yang dimanfaatkan sebagai sumber energi. Penghematan jumlah protein dengan cara seperti ini merupakan kunci utama kemampuan utntuk melewati masa puasa atau keadaan lapar. Kematian dapat terjadi bila kira-kira separoh dari protein tubuh berkurang, biasanya sesudah kira-kira 50-70 hari puasa total. Jalur ketogenesis lihat Gambar 20.
Ga m ba r 2 0 . Jalur ketogenesis dalam hati (FFA=asam lemak bebas; hidroksi-3-metilglutaril) (Murray et al., 1997).
Lipoge n e sis
trigliserida dan kemudian disimpan. Biasanya karbohidrat disimpan sebagai glikogen, tetapi jumlah total tidak lebih dari 350 g. Sebagian protein berada sebagai asam amino di dalam tubuh, tetapi jumlahnya hanya sedikit. Maka, jika banyak glukosa dan asam amino berada di dalam tubuh sesudah makan yang banyak, sebagian atom karbonnya dapat digunakan untuk mensintesa asam lemak. Proses ini membutuhkan ATP dan vitamin B, biotin, niacin dan asam pantotenat. Karena ATP digunakan, lipogenesis adalah suatu pengurangan energi untuk sel hati.
Di dalam lipogenesis, hati memulainya dengan karbon dari glukosa dan karbon dari asam amino yang dikataboliser menjadi asetil-CoA. Sel-sel di dalam hati menyatukan bagian asetat dari molekul asetl-CoA (sebenarnya dalam bentuk malonil-CoA) bersama-sama di dalam suatu rangkaian tahapan membentuk satu asam lemak palmitat (C 16:0). Insulin meningkatkan aktivitas dari enzim yang berperan yakni fatty acid synthase. Asam lemak palmitat (C 16: 0) ini kemudian dapat diperpanjang menjadi asam lemak yang mengandung 18 atau 20 atom karbon, yang terjadi di dalam sitosol atau mitokhondria. Selanjutnya asam lemak disatukan dengan gliserol (yang dihasilkan selama glikolisis dari gliseraldehide 3-pospat) menjadi trigliserida. Kemudian trigliserida dilepas ke sirkulasi darah sebagai very low density lipoprotein (VLDL). Sel-sel yang mengambil lemak mungkin memakainya untuk produksi ATP atau mungkin disimpan di dalam sel-sel lemak, bersama-sama dengan lemak dari makanan.
2 .3 . M e t a bolism e Pr ot e in
Metabolisme protein mulai setelah protein dipecah menjadi asam amino. Untuk memanfaatkan asam amino sebagai bahan bakar, pertama-tama sel harus mengeluarkan gugus amino (-NH2).
Jalur-jalur ini sering membutuhkan vitamin B-6 supaya dapat berfungsi. Pengeluaran gugus amino akan menghasilkan rantai karbon yang biasanya kemudian akan memasuki siklus asam sitrat. Sebagian rantai karbon juga menghasilkan asetil-CoA dan piruvat.
Metabolisme asam amino pada umumnya terjadi di dalam hati. Hanya sam amino berantai cabang, leusine, isoleusine dan valine dimetaboliser di tempat lain terutama di dalam otot. Asam amino bercabang dimasukkan kedalam makanan supplement pengganti cairan untuk pasien rawat inap. Beberapa formula pengganti cairan diperdagangkan untuk para atlet juga mengandung asam amino berantai cabang.
Perlu diketahui bahwa sebagian rantai karbon memasuki siklus asam sitrat sebagai asetil-CoA, sedangkan yang lainnya membentuk senyawa antara (intermediate) dari siklus asam sitrat atau glikolisis. Setiap bagian dari rantai karbon yang memasuki siklus asam sitrat secara langsung atau membentuk piruvat akhirnya dapat menjadi bagian dari glukosa melalui glukoneogenesis. Hal ini terjadi dari asam amino alanine, methionine, arginine, histidine, asam aspartat, dan lain-lain.
Glu k on e oge n e sis
Proses glukoneogenesis secara keseluruhan hanya terjadi di dalam sel-sel hati dan di dalam sel-sel tertentu buah pinggang. Bahan baku untuk glukoneogenesis adalah oksaloasetat, yang berasal dari terutama rantai karbon beberapa asam amino, utamanya alanine. Piruvat dapat juga diubah menjadi oksaloasetat.
Salah satu contoh perobahan asam amino menjadi glukosa adalah asam glutamat. Mula-mula asam glutamat mengalami deaminasi menjadi rantai karbon seperti reaksi berikut ini.
HO-CO-CH2-CH2-CH-COOH