LEHER UNTUK DIAGNOSIS METASTASIS KARSINOMA
NASOFARING
TESIS
POLTAK POIDA BERLIANA GURNING
NIM. 087108014
DEPARTEMEN PATOLOGI ANATOMI
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
TAMPILAN LATENT MEMBRANE PROTEIN-1 (LMP1) PADA SEDIAAN SITOLOGI KELENJAR GETAH BENING LEHER UNTUK DIAGNOSIS
METASTASIS KARSINOMA NASOFARING
TESIS
Untuk Memperoleh Gelar Spesialis Patologi Anatomi
Dalam Program Pendidikan Dokter Spesialis I
Pada Fakultas Kedokteran Universitas Sumatera Utara
POLTAK POIDA BERLIANA GURNING
NIM. 087108014
PROGRAM PENDIDIKAN DOKTER SPESIALIS I
DEPARTEMEN PATOLOGI ANATOMI
FAKULTAS KEDOKTERAN UNIVERSITAS SUMATERA UTARA
MEDAN
Judul Penelitian : Tampilan Latent Membrane Protein-1 (LMP1) Pada Sediaan
Sitologi Kelenjar Getah Bening Leher Untuk Diagnosis
Metastasis Karsinoma Nasofaring
Nama : Poltak Poida Berliana Gurning
NIM : 087108014
Program Studi : Program Pendidikan Dokter Spesialis
Konsentrasi : Patologi Anatomi
TESIS INI TELAH DIPERIKSA DAN DISETUJUI OLEH :
Pembimbing I
Prof. Dr. HM. Nadjib D. Lubis, Sp.PA(K) NIP. 130 318 033
Pembimbing II
dr. H. Delyuzar, M.Ked(PA), Sp.PA(K)
NIP. 19630219 199003 1 001
Ketua Program Studi
Patologi Anatomi FK USU
Ketua Departemen
Patologi Anatomi FK USU
dr. H. Delyuzar, M.Ked(PA), Sp.PA(K)
NIP. 19630219 199003 1 001
dr. T.Ibnu Alferraly, M.Ked(PA), Sp.PA, D.Bioet
NIP. 19620212 198911 1 001
LEMBAR PANITIA UJIAN
Judul Penelitian : Tampilan Latent Membrane Protein-1 (LMP1) pada Sediaan Sitologi Kelenjar Getah Bening Leher Untuk
Diagnosis Metastasis Karsinoma Nasofaring
Nama : Poltak Poida Berliana Gurning
NIM : 087108014
Program Studi : Program Pendidikan Dokter Spesialis Departemen
Patologi Anatomi Fakultas Kedokteran Universitas
Sumatera Utara
Diuji pada
Hari/Tanggal : Selasa/12 November 2013
Pembimbing : 1. Prof. Dr. HM. Nadjib D. Lubis, Sp.PA(K)
2. dr. H. Delyuzar, M. Ked.(PA), Sp.PA(K)
Penguji : 1. dr. H. Soekimin, Sp.PA(K)
PERNYATAAN
TAMPILAN LATENT MEMBRANE PROTEIN-1 (LMP1) PADA
SEDIAAN SITOLOGI KELENJAR GETAH BENING LEHER
UNTUK DIAGNOSIS METASTASIS KARSINOMA
NASOFARING
TESIS
Dengan ini saya menyatakan bahwa dalam tesis ini tidak terdapat karya yang
pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi,
dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang
pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu
dalam naskah ini dan disebutkan dalam daftar pustaka.
Medan, 12 November 2013 Peneliti
UCAPAN TERIMA KASIH
Puji syukur saya panjatkan kehadirat Allah yang Maha Kuasa atas berkat
dan rahmatNya kepada penulis sehingga dapat menyelesaikan penelitian dengan
judul “Tampilan Latent Membrane Protein-1 (LMP1) pada Sediaan Sitologi Kelenjar Getah Bening Leher untuk Diagnosis Metastasis Karsinoma Nasofaring”. Tesis ini adalah salah satu syarat yang harus dilaksanakan penulis dalam rangka memenuhi persyaratan untuk meraih gelar meraih gelar keahlian
dalam Program Pendidikan Dokter Spesialis Patologi Anatomi pada Fakultas
Kedokteran Universits Sumatera Utara.
Dengan selesainya tesis ini, ijinkan penulis mengucapkan terimakasih
yang sebesar-besarnya kepada :
Rektor Universitas Sumatera Utara, Prof.Dr.dr.Syahril Pasaribu, DTM&H,
M.Sc(CTM), Sp.A(K) dan seluruh jajarannya yang telah memberikan kesempatan
pada penulis untuk mengikuti pendidikan pada Program Pendidikan Dokter
Spesialis Patologi Anatomi pada Fakultas Kedokteran Universits Sumatera Utara.
Dekan Fakultas Kedokteran Universitas Sumatera Utara, Prof. dr. Gontar A.
Siregar, Sp.PD (KGEH), atas kesempatan dan fasilitas yang diberikan kepada
penulis untuk mengikuti dan menyelesaikan Program Pendidikan Dokter Spesialis
Patologi Anatomi pada Fakultas Kedokteran Universits Sumatera Utara.
Terima kasih sebesar-besarnya penulis sampaikan kepada Prof. Dr. HM. Nadjib
D. Lubis, Sp.PA(K) (Pembimbing I) dan dr. H. Delyuzar, M. Ked.(PA), Sp.PA(K)
(Pembimbing II) yang juga merupakan Ketua Program Studi Patologi Anatomi
Fakultas Kedokteran Universitas Sumatera Utara, yang penuh perhatian dan
kesabaran telah mengorbankan waktu untuk memberikan dorongan, bimbingan,
bantuan serta saran-saran yang bermanfaat kepada penulis mulai dari persiapan
Terima kasih kepada dr. H. Soekimin, Sp.PA(K) dan dr. H. Joko S. Lukito,
Sp.PA(K), yang telah bersedia menguji, mengoreksi dan memberikan saran-saran
pada tesis penelitian saya ini.
Terima kasih kepada dr.T. Ibnu Alferraly, M.Ked(PA), Sp.PA, D.Bioet selaku
Ketua Departemen Patologi Anatomi Fakultas Kedokteran Universitas Sumatera
Utara atas segala bantuannya selama penulis menjalankan pendidikan Program
Pendidikan Dokter Spesialis di Departemen Patologi Anatomi Fakultas
Kedokteran Universitas Sumatera Utara.
Terima kasih kepada dr. Jessy Chrestella, M.Ked(PA), Sp.PA sebagai dosen
pembimbing akademik atas segala bantuan, bimbingan dan arahan kepada penulis
dalam menjalankan pendidikan Program Pendidikan Dokter Spesialis di
Departemen Patologi Anatomi Fakultas Kedokteran Universitas Sumatera Utara.
Rasa hormat dan terima kasih penulis sampaikan kepada dewan guru lainnya
yakni Prof. Dr. Gani W Tambunan, Sp.PA(K), dr. Betty, M.Ked.(PA),Sp.PA, dr.
Lidya Imelda Laksmi, M.Ked.(PA), Sp.PA, dr.Hj.Kemala Intan, M.Pd, dr.
Sumondang M Pardede, Sp.PA, dr.Jamaluddin Pane, Sp.PA, yang telah
membimbing penulis selama menjalankan Pendidikan Dokter Spesialis Patologi
Anatomi pada Fakultas Kedokteran Universits Sumatera Utara dan di RSUP H.
Adam Malik Medan, dan tidak lupa penulis mengucapkan terima kasih kepada
dr.Stephan Udjung, Sp.PA, dr.Lely Hartati, M.Ked.(PA),Sp.PA dan dr. Sutoyo
Eliandy, M.Ked.(PA), Sp.PA, serta seluruh staf di Departemen Patologi Anatomi
FK USU dan RSUP H. Adam Malik Medan yang telah membantu penulis
menyelesaikan tesis ini.
Terima kasih yang sebesar-besarnya penulis sampaikan kepada dr. Juliandi,
M.Kes dan dr. Yuki, M.Kes, atas bimbingan dan saran-saran yang bermanfaat
kepada penulis dalam penelitian sampai pada penyelesaian tesis ini.
Persembahan terima kasih tulus tak terhingga, rasa hormat dan sembah sujud
kepada kedua orang tua, Ibunda tercinta R. boru Manurung dan Ayahanda tercinta
namun penuh kasih sayang tulus dan doa. Juga tak terlupakan yang selalu turut
memberikan dorongan dan doa Adinda Salama br. Gurning, SP, Adinda Richard
Siagian, S.Komp., Ibu mertua M. br. Ginting, Ibu D. boru Manurung, dan Adinda
Oscar Siagian, ST.
Kepada suami tercinta Herpendi Purba, SSI dan anak-anak terkasih Pricilla Philia
br. Purba, Felicia br. Purba dan Vania br. Purba, tiada kata setara yang dapat
diucapkan untuk mengutarakan rasa terima kasih dan penghargaan yang
setinggi-tingginya atas cinta, kasih sayang, pengertian, pengorbanan kesabaran, serta doa
yang tulus yang diberikan kepada penulis. Dan kepada seluruh keluarga besarku
yang tidak dapat disebutkan satu-persatu, saya ucapkan terima kasih atas
dorongan moral, materi, dan doa yang selalu menyemangati penulis untuk dapat
menjalani pendidikan dengan baik.
Penulis juga mengucapkan terima kasih kepada para sahabat dr. Veronika
Brahmana, dr. Renatha Nainggolan dan dr. Erlinta Sembiring, yang selalu
memberi dukungan, semangat dan doa bagi penulis selama mengikuti pendidikan.
Penulis juga tak lupa mengucapkan terima kasih buat semua teman-teman PPDS
di Departemen Patologi Anatomi atas doa, semangat dan persahabatan dalam
menjalani pendidikan selama ini.
Akhirnya penulis menyadari bahwa isi hasil penelitian ini masih perlu mendapat
koreksi dan masukan untuk kesempurnaan. Oleh karena itu penulis berharap
adanya kritik dan saran untuk penyempurnaan tulisan ini. Semoga penelitian ini
bermanfaat bagi kita semua. Amin.
Penulis,
2.1.11. Stadium Klinik……….…………. 3.2. Tempat dan Waktu Penelitian... 33
3.2.1. Tempat Penelitian... 33
3.2.2. Waktu Penelitian... 33
3.4. Kriteria Inklusi dan Eksklusi... 35
3.5.1 Kriteria Inklusi………….………. 35 3.9. Alat dan Bahan Penelitian... 3.9.1. Alat Penelitian... 3.9.2. Bahan Penelitian... 3.10.Instrumen Penelitian... 3.11.Analisa Data...
BAB IV HASIL PENELITIAN DAN PEMBAHASAN... 4.1. Hasil Penelitian...
Lampiran 1. Tabel Data Sampel
DAFTAR TABEL
Perubahan klasifikasi karsinoma nasofaring sejak tahun 1978
sampai sekarang……….. Waktu pelaksanaan penelitian………. Data karakteristik sampel penelitian………...
Skor imunoreaktivitas LMP1 pada 34 sampel penelitian………
Hubungan skor imunoreaktivitas LMP1 terhadap lateralisasi
KGB……….
Hubungan skor imunoreaktivitas LMP1 terhadap ukuran (diameter) KGB………... Hubungan skor imunoreaktivitas LMP1 terhadap klasifikasi histopatologik KNF (berdasarkan klasifikasi WHO)………….. Hubungan skor imunoreaktivitas LMP1 terhadap jumlah KGB
DAFTAR GAMBAR
Halaman
Gambar 2.1. Pemotongan sagital kepala menunjukkan nasofaring,
rongga hidung dan sinus paranasal ……... 5 Gambar 2.2. Submukosa nasofaring dengan agregat limfoid... Gambar 2.3. Tahapan evolusi kanker nasofaring... Gambar 2.4. Nasopharyngeal keratinizing squamous cell carcinoma… Gambar 2.5. Gambaran sitologi karsinoma sel skuamous...……... Gambar 2.6. Nasopharyngeal nonkeratinizing carcinoma,
differentiated type……… Gambar 2.7. Gambaran sitologi undifferentiated carcinoma…………. Gambar 2.8. Nasopharyngeal nonkeratinizing carcinoma,
undifferentiated subtype……….………... Gambar 2.9. Undifferentiated Carcinoma “Regaud type”……….. Gambar 2.10. Undifferentiated carcinoma“Schmincke type”………... Gambar 2.11. Basaloid squamous cell carcinomapada nasofaring……..
6
Gambar 2.12. Ringkasan insidensi metastasis karsinoma nasofaring pada kelenjar getah bening leher………. Gambar 2.13. Metastatis karsinoma nasofaring pada kelenjar getah bening……….. Gambar 2.14. Pewarnaan imunohistokimia pada nonkeratinizing carcinoma undifferentiated subtype……… Gambar 2.15. Sekilas jalur sinyal dalam patogenesis karsinoma
DAFTAR SINGKATAN
AE1-AE3 = Cytokeratin cocktail AE1 & AE3 AJCC = Americant Joint Committe on Cancer AP-1 = Activated Protein 1
Bcl-2 = Proto-onkogen B cell lymphoma-2 CTAR = C-terminal activating regions CT-scan = Computed tommography scanning
CD = Cluster designation atau cluster of differentiation CHM = Chinese herbal medicine
DNA = Deoxyribonucleic acid
EA = Early antigen of Epstein-Barr Virus EBER = Epstein-Barr Virus encoded Early RNA EBNA = Epstein-Barr Virus Nuclear Antigen EBV = Epstein-Barr Virus
EGFR = Epidermal Growth Factor Receptor ERK = Extracellular signal-related kinase FNAC = Fine needle aspiration cytology
IgA = Immunoglobulin A
IgG = Immunoglobulin G
HLA = Human Leucocyte Antigen
JAK/STAT = Janus kinase/signal transducers and activators of transcription
JNK = c-Jun N-terminal kinase
LFA-1 = Leucocyte Functioning antigen-1 LMP1 = Latent Membrane Protein-1 LOH = Lost of Heterozygocity
MAPK = Mitogen-activated protein kinase MMP-9 = Matrix metalloproteinase-9 MRI = Magnetic Resonance Imaging NDMA = Nitrosodimethyamine
NF-κB = Nuclear factor kappa-light-chain-enhancer of activated B cells NPIP = N-nitrospiperidine
NPYR = N-nitrospyrrolidene RNA = Ribonucleic acid
TNFR = Tumor necrosis factor reseptor UICC = Union Internationale Centre Cancer VCA = Viral Capsid antigen
TAMPILAN LATENT MEMBRANE PROTEIN-1 (LMP1) PADA SEDIAAN SITOLOGI KELENJAR GETAH BENING LEHER UNTUK DIAGNOSIS
METASTASIS KARSINOMA NASOFARING P. Poida Berliana Gurning, M. Nadjib D. Lubis, Delyuzar
Departemen Patologi Anatomi Fakultas Kedokteran Universitas Sumatera Utara
ABSTRAK
Latar belakang. Karsinoma nasofaring (KNF) merupakan keganasan nasofaring
yang paling sering dan mempunyai hubungan yang erat dengan Epstein-Barr virus (EBV). Latent Membrane Protein 1 (LMP1) yang merupakan salah satu protein EBV yang diketahui mempunyai peranan dalam pertumbuhan karsinoma bahkan dalam metastasis KNF. Pembesaran kelenjar getah bening (KGB) leher sering merupakan gejala utama keganasan pada pasien. Penggunaan sitologi biopsi aspirasi jarum halus tidak hanya mengkonfirmasi adanya metastasis, tapi juga dapat memberikan petunjuk asal tumor primer.
Tujuan. Melihat tampilan LMP1 pada sediaan sitologi KGB leher pada penderita KNF yang mengalami metastasis di leher.
Metode. Penelitian ini merupakan penelitian deskriptif analitik terhadap 34 slaid sitologi yang sudah didiagnosis sebagai metastasis KNF, kemudian dilakukan pemeriksaan imunositokimia LMP1 dengan menggunakan anti-EBV Latent Membrane Protein 1 antibody, ab7502 dengan metode Labelled Streptavidin Biotin Immunoperoxidase Complex. Penelitian ini dilakukan di Departemen Patologi Anatomi Fakultas Kedokteran Universitas Sumatera Utara.
Hasil. Pada penelitian ini 28 sampel (82,4%) menunjukkan tampilan positif terhadap LMP1 dan 6 sampel (17,6%) menunjukkan tampilan negatif. Hasil uji perbandingan dengan Fisher’s exact test menunjukkan terdapat perbedaan tampilan LMP1 pada keratinizing squamous cell carcinoma dibanding nonkeratinizing carcinoma dengan nilai p=0,003.
Kesimpulan. Pewarnaan imunositokimia LMP1 pada sediaan sitologi biopsi aspirasi KGB leher hanya dapat dipergunakan untuk diagnosis metastasis KNF jenis nonkeratinizing carcinoma.
THE EXPRESSION OF LATENT MEMBRANE PROTEIN-1 (LMP1) IN CYTOLOGY SPECIMEN OF THE NECK LYMPH NODES TO DIAGNOSIS
OF METASTATIC NASOPHARYNGEAL CARCINOMA P.Poida Berliana Gurning, M. Nadjib D. Lubis, Delyuzar
Departemen of Pathology, Faculty of Medicine University of North Sumatra
ABSTRACT
Background. Nasopharyngeal carcinoma (NPC) is the most common
nasopharyngeal malignancies and mostly associated with Epstein-Barr virus (EBV). Latent Membrane Protein 1 (LMP1), which is one of the EBV proteins are known to have a role in the growth of metastatic NPC. Enlargement of the neck lymph node is often a major symptom of NPC patients. The use of fine needle aspiration cytology (FNAC) not only to confirm the presence of metastasis, but can also provide the origin of the primary tumor.
Aim and objective. To view the expression of LMP1 in FNAC cervical lymph nodes in patients with metastatic NPC in the neck.
Methods. This study is a descriptive analytic assessment of 34 cytology slides that have been diagnosed as metastatic NPC. LMP1 immunocytochemistry staining examined by anti-LMP1 EBV Latent Membrane Protein 1 antibody, ab7502 with Labelled Streptavidin Biotin Immunoperoxidase Complex method was performed to these slides. This study is conducted in the Department of Pathologic Anatomy Faculty of Medicine University of North Sumatra.
Results. In this study, 28 samples (82.4%) showed positive expression of LMP1 and 6 samples (17.6%) showed negative expression. Comparison with Fisher's exact test showed the differentiation of LMP1 expression between keratinizing squamous cell carcinoma and nonkeratinizing carcinoma with p value 0.003.
Conclusion. LMP1 can only be used in cytology preparations of neck lymph nodes for the diagnosis of metastatic nasopharyngeal nonkeratinizing carcinoma.
TAMPILAN LATENT MEMBRANE PROTEIN-1 (LMP1) PADA SEDIAAN SITOLOGI KELENJAR GETAH BENING LEHER UNTUK DIAGNOSIS
METASTASIS KARSINOMA NASOFARING P. Poida Berliana Gurning, M. Nadjib D. Lubis, Delyuzar
Departemen Patologi Anatomi Fakultas Kedokteran Universitas Sumatera Utara
ABSTRAK
Latar belakang. Karsinoma nasofaring (KNF) merupakan keganasan nasofaring
yang paling sering dan mempunyai hubungan yang erat dengan Epstein-Barr virus (EBV). Latent Membrane Protein 1 (LMP1) yang merupakan salah satu protein EBV yang diketahui mempunyai peranan dalam pertumbuhan karsinoma bahkan dalam metastasis KNF. Pembesaran kelenjar getah bening (KGB) leher sering merupakan gejala utama keganasan pada pasien. Penggunaan sitologi biopsi aspirasi jarum halus tidak hanya mengkonfirmasi adanya metastasis, tapi juga dapat memberikan petunjuk asal tumor primer.
Tujuan. Melihat tampilan LMP1 pada sediaan sitologi KGB leher pada penderita KNF yang mengalami metastasis di leher.
Metode. Penelitian ini merupakan penelitian deskriptif analitik terhadap 34 slaid sitologi yang sudah didiagnosis sebagai metastasis KNF, kemudian dilakukan pemeriksaan imunositokimia LMP1 dengan menggunakan anti-EBV Latent Membrane Protein 1 antibody, ab7502 dengan metode Labelled Streptavidin Biotin Immunoperoxidase Complex. Penelitian ini dilakukan di Departemen Patologi Anatomi Fakultas Kedokteran Universitas Sumatera Utara.
Hasil. Pada penelitian ini 28 sampel (82,4%) menunjukkan tampilan positif terhadap LMP1 dan 6 sampel (17,6%) menunjukkan tampilan negatif. Hasil uji perbandingan dengan Fisher’s exact test menunjukkan terdapat perbedaan tampilan LMP1 pada keratinizing squamous cell carcinoma dibanding nonkeratinizing carcinoma dengan nilai p=0,003.
Kesimpulan. Pewarnaan imunositokimia LMP1 pada sediaan sitologi biopsi aspirasi KGB leher hanya dapat dipergunakan untuk diagnosis metastasis KNF jenis nonkeratinizing carcinoma.
THE EXPRESSION OF LATENT MEMBRANE PROTEIN-1 (LMP1) IN CYTOLOGY SPECIMEN OF THE NECK LYMPH NODES TO DIAGNOSIS
OF METASTATIC NASOPHARYNGEAL CARCINOMA P.Poida Berliana Gurning, M. Nadjib D. Lubis, Delyuzar
Departemen of Pathology, Faculty of Medicine University of North Sumatra
ABSTRACT
Background. Nasopharyngeal carcinoma (NPC) is the most common
nasopharyngeal malignancies and mostly associated with Epstein-Barr virus (EBV). Latent Membrane Protein 1 (LMP1), which is one of the EBV proteins are known to have a role in the growth of metastatic NPC. Enlargement of the neck lymph node is often a major symptom of NPC patients. The use of fine needle aspiration cytology (FNAC) not only to confirm the presence of metastasis, but can also provide the origin of the primary tumor.
Aim and objective. To view the expression of LMP1 in FNAC cervical lymph nodes in patients with metastatic NPC in the neck.
Methods. This study is a descriptive analytic assessment of 34 cytology slides that have been diagnosed as metastatic NPC. LMP1 immunocytochemistry staining examined by anti-LMP1 EBV Latent Membrane Protein 1 antibody, ab7502 with Labelled Streptavidin Biotin Immunoperoxidase Complex method was performed to these slides. This study is conducted in the Department of Pathologic Anatomy Faculty of Medicine University of North Sumatra.
Results. In this study, 28 samples (82.4%) showed positive expression of LMP1 and 6 samples (17.6%) showed negative expression. Comparison with Fisher's exact test showed the differentiation of LMP1 expression between keratinizing squamous cell carcinoma and nonkeratinizing carcinoma with p value 0.003.
Conclusion. LMP1 can only be used in cytology preparations of neck lymph nodes for the diagnosis of metastatic nasopharyngeal nonkeratinizing carcinoma.
BAB I PENDAHULUAN
1.1. Latar Belakang
Karsinoma nasofaring (KNF) memperlihatkan distribusi yang unik secara
rasial dan geografis, dan memiliki etiologi yang multifaktor.1 Karsinoma
nasofaring berdasarkan World Health Organization (WHO) adalah kanker yang berasal dari mukosa nasofaring yang terbukti dengan mikroskop cahaya ataupun
secara ultrastruktural sebagai diferensiasi skuamous. KNF terdiri dari keratinizing squamous cell carcinoma, nonkeratinizing carcinoma (berdiferensiasi atau tidak berdiferensiasi/undifferentiated) dan basaloid squamous cell carcinoma. Adenokarsinoma dan karsinoma kelenjar salivarius tidak termasuk di dalamnya.1,2
Angka kejadian KNF di Indonesia cukup tinggi, yakni 4,7 kasus baru per
tahun per 100.000 penduduk. Catatan dari berbagai rumah sakit menunjukkan
bahwa KNF menduduki urutan keempat setelah kanker leher rahim, kanker
payudara dan kanker kulit, tetapi seluruh bagian THT (telinga hidung dan
tenggorokan) di Indonesia sepakat mendudukkan KNF pada peringkat pertama
penyakit kanker pada area ini.3
Karsinoma nasofaring merupakan tumor nasofaring yang paling sering.
dan mempunyai hubungan yang erat dengan Epstein-Barr virus (EBV).1 Pada 1966, seorang peneliti menjumpai peningkatan titer antibodi terhadap EBV pada
KNF. Kenaikan titer ini sejalan pula dengan tingginya stadium penyakit. Berbeda
halnya dengan jenis kanker kepala dan leher lain, KNF tidak pernah dihubungkan
Kanker nasofaring sulit untuk didiagnosis dini, kemungkinan karena
nasofaring sulit diperiksa karena letaknya sangat tersembunyi dan gejalanya mirip
dengan penyakit lain yang lebih umum sehingga pasien tidak datang berobat.
Biasanya pasien baru datang berobat bila gejala telah mengganggu dan tumor
tersebut telah mengadakan infiltrasi serta bermetastasis ke kelenjar getah bening
(KGB) leher. Hal ini merupakan keadaan lanjut dan biasanya dengan prognosis
yang jelek.4-7
Massa di leher orang dewasa yang timbul lebih dari 1 minggu merupakan
keadaan patologik sampai diagnosis diperoleh. Penggunaan sitologi biopsi aspirasi
jarum halus (sibajah) atau Fine Needle Aspiration Cytology (FNAC) untuk diagnosis metastasis keganasan pada KGB merupakan metode yang telah diakui.
Limfadenopati sering merupakan gejala utama keganasan pada pasien. Sibajah
tidak hanya mengkonfirmasi adanya metastasis, tapi juga dapat memberikan
petunjuk tumor primer. False-positive rate dari sibajah pada KGB untuk mendeteksi metastasis masih cukup rendah (sekitar 0.9-1.7%). Menghindari
diagnosis false-positive sangat penting karena terapi seringkali hanya berdasarkan hasil pemeriksaan sitologi. Prosedur sibajah lebih murah biayanya, lebih
sederhana, dan lebih minimal komplikasinya, lebih diterima karena dapat
dilakukan pada pasien berobat jalan dan dapat diulang.7
Infeksi EBV terutama ditunjukkan oleh ekspresi gen laten yang dihasilkan
antara lain EBV-encoded Nu clear Antigen (EBNA), Latent Membrane Protein (LMP), dan EBV-encoded Ribonucleic acid (EBER). Protein-protein ini memiliki aksi yang menyerupai beberapa faktor pertumbuhan, faktor transkripsi, dan faktor
yang merupakan salah satu protein EBV diketahui mempunyai peranan dalam
pertumbuhan karsinoma bahkan dalam metastasis KNF.8,9
Berdasarkan uraian di atas, peneliti tertarik untuk mengetahui bagaimana
tampilan LMP1 pada sitologi biopsi aspirasi jarum halus kelenjar getah bening
leher pada penderita KNF yang mengalami metastasis di KGB leher yang
diperiksa di Laboratorium Patologi Anatomi Fakultas Kedokteran Universitas
Sumatera Utara Medan.
1.2. Perumusan Masalah
Bagaimana tampilan Latent Membrane Protein 1 (LMP1) pada sitologi biopsi aspirasi jarum halus kelenjar getah bening leher pada penderita karsinoma
nasofaring yang mengalami metastasis di kelenjar getah bening leher yang
diperiksa di Laboratorium Patologi Anatomi Fakultas Kedokteran Universitas
Sumatera Utara Medan.
1.3. Hipotesis
EBV berhubungan dengan sebagian besar KNF jenis nonkeratinizing carcinoma, sehingga KNF yang bermetastasis ke KGB leher yang akan menampilkan LMP1 adalah KNF jenis nonkeratinizing carcinoma, dengan demikian hipotesis awal pada penelitian ini adalah ada perbedaan tampilan LMP1
1.4. Tujuan Penelitian
1.4.1. Tujuan Umum
Melihat tampilan Latent Membrane Protein 1 (LMP1) pada sitologi biopsi aspirasi jarum halus kelenjar getah bening leher pada penderita karsinoma
nasofaring yang mengalami metastasis di kelenjar getah bening leher.
1.4.2. Tujuan Khusus
1. Melihat pola tampilan LMP1 pada masing-masing tipe histologik
karsinoma nasofaring.
2. Melihat hubungan tampilan LMP1 dengan ukuran KGB yang terlibat
dalam metastasis karsinoma nasofaring pada penderita karsinoma
nasofaring.
1.5. Manfaat Penelitian
1. Tampilan LMP1 diharapkan dapat dipakai untuk konfirmasi diagnosis
suatu metastasis karsinoma nasofaring di kelenjar getah bening leher.
2. Tampilan LMP1 juga diharapkan dapat membantu dalam menentukan
prognosis penderita karsinoma nasofaring.
3. Tampilan LMP1 juga diharapkan dapat membantu dalam menentukan
terapi pada penderita karsinoma nasofaring.
4. Penelitian ini juga diharapkan dapat menjadi bahan acuan untuk penelitian
BAB II
TINJAUAN PUSTAKA
2.1. Karsinoma Nasofaring
2.1.1. Anatomi dan Histologi Nasofaring
Secara fungsional dan struktural faring terbagi atas tiga bagian, nasofaring,
orofaring, dan hipofaring.10,11 Nasofaring adalah lubang berbentuk pipa dengan
ujung menyempit, terletak di belakang rongga hidung. Bagian atap dan dinding
belakang dibentuk oleh basi sfenoid, basi oksiput dan ruas pertama vertebra.
Bagian depan berhubungan dengan rongga hidung melalui koana. Orifisium dari
tuba Eustachian terletak pada dinding lateral, di bagian depan dan belakang
terdapat ruangan berbentuk koma yang disebut dengan torus tubarius. Bagian atas
dan samping dari torus tubarius merupakan ceruk dari nasofaring yang disebut
dengan fossa Rosenmuller. Nasofaring berhubungan dengan orofaring pada bagian
palatum mole. Nasofaring merupakan bagian dari Waldeyer ring.1,2,10,12,13
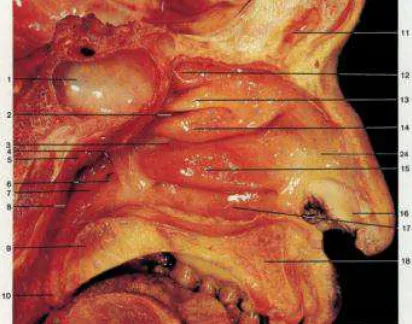
Gambar 2.1. Pemotongan sagital kepala menunjukkan nasofaring, rongga hidung dan sinus paranasal. 1. Sinus sfenoidalis; 2. Meatus superior; 3. Meatus media; 4.Tubal
elevation; 5. Tonsil faringeal; 6. Pharyngeal orifice of Eustachian tube;
7. Salpingopharyngeal fold; 8. Pharyngeal recess; 9. Palatum mole; 10. Uvula; 11. Sinus frontalis; 12. Sphenoethmoidal recess; 13. Superior nasal concha; 14. Middle nasal concha; 15. Inferior nasal concha; 16. Vestibulum; 17. Meatus inferior; 18. Palatum
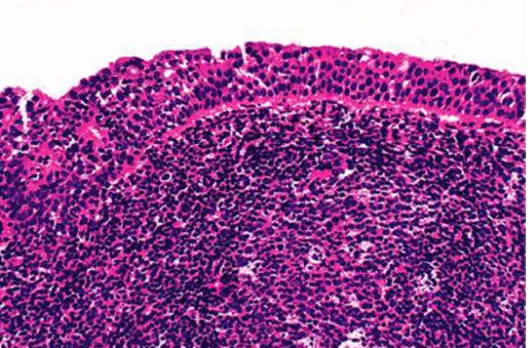
Mukosa nasofaring dewasa mempunyai luas permukaan sekitar 50 cm2.
Sebagian besar dilapisi oleh epitel skuamous berlapis dan sekitar 40% dilapisi
oleh epitel kolumnar tipe respiratorius. Epitel skuamous terutama melapisi dinding
anterior dan posterior bagian bawah, juga bagian anterior dinding lateral. Epitel
kolumnar bersilia terutama melapisi regio posterior nares (choanae) dan atap dari dinding posterior. Sambungan antara skuamous dan kolumnar dapat secara
langsung atau berupa zona intermediet atau transisional, yang terdiri atas sel-sel
basaloid dengan sitoplasma minimal dan biasanya berbentuk bulat atau kuboid.
Kadang-kadang pada saat biopsi zona ini diduga sebagai daerah displasia atau
karsinoma in situ. Mukosa mengalami invaginasi membentuk kripta yang
menjorok ke dalam stroma. Stroma kaya akan jaringan limfoid yang sering dengan
folikel limfoid yang reaktif. Permukaan mukosa dan kripta biasanya diinfiltrasi
oleh sel-sel limfoid yang banyak, yang meluas dan mengubah epitel sehingga
menghasilkan pola retikular. Beberapa kelenjar seromusinus dapat dijumpai, tetapi
tidak sebanyak yang terdapat di mukosa hidung.1,2,10,14
2.1.2. Epidemiologi
Secara global ditemukan sekitar 65.000 kasus baru KNF dengan 38.000
kematian pada tahun 2000. Sementara pada sebagian besar tempat di dunia jarang
dijumpai (dengan angka kejadian sekitar 1 dari 105 atau 0,6% dari seluruh
kanker),1,2 pada populasi tertentu insidensinya lebih tinggi pada ras China, Asia
Tenggara (seperti Thailand, Philippina, dan Vietnam), Afrika Utara (seperti
Algeria dan Maroko), demikian juga wilayah Arctic (seperti Canada dan Alaska).
Insidensi tertinggi dari karsinoma nasofaring telah lama diamati di Hongkong, di
mana 1 dari 40 laki-laki menderita karsinoma nasofaring sebelum usia 75 tahun.1
Bukti epidemiologik lain adalah angka kejadian kanker ini di Singapura.
Persentase terbesar yang dikenai adalah masyarakat keturunan Tionghoa (18,5 per
100.000 penduduk), disusul oleh keturunan Melayu (6,5 per 100.000) dan terakhir
adalah keturunan Hindustan (0,5 per 100.000).3
Prevalensi penderita KNF 4,7 orang per 100.000 penduduk pertahun yang
diambil dari data resmi Departemen Kesehatan tahun 1980. Penelitian Fachiroh di
Yogyakarta menyatakan insiden penderita KNF 3,9 orang per 100.000 penduduk.
Di Bagian THT FK-UI RSCM selama periode 1988-1992 didapati 511 penderita
baru KNF. Di RSUP H. Adam Malik Medan pada tahun 1998-2000 ditemukan
130 penderita KNF dari 1370 pasien baru onkologi kepala dan leher. Dari
beberapa penyelidikan di Indonesia dan di luar negeri, kasus dini hanya ditemukan
antara 3,8%-13,9%, dibandingkan dengan kasus lanjut (stadium III dan IV) sekitar
88,1%-96,2%.7 Di RSUP HAM periode Juli 2005-Juni 2006 dari 79 penderita
KNF seluruhnya berada pada stadium lanjut, tidak dijumpai penderita dengan
2.1.3. Etiologi
Etiologi KNF dinyatakan berhubungan dengan interaksi yang kompleks
dari faktor lingkungan dan faktor genetik serta infeksi Epstein-Barr virus.16-21
2.1.3.1. Faktor Genetik
KNF merupakan keganasan yang jarang di sebagian besar tempat di dunia,
namun KNF merupakan salah satu kanker tersering di Asia Tenggara dengan
insidensi berkisar 10-53 kasus per 100.000 penduduk. Insidensinya juga tinggi di
Alaska, Greenland dan Tunisia dengan kisaran 15-20 per 100.000 penduduk.
Terdapat risiko familial yang tinggi pada populasi Kanton dan pada orang-orang
dengan riwayat KNF pada keluarga. Banyak penelitian yang membuktikan adanya
kelainan pada kromosom antara lain translokasi, amplifikasi, dan delesi 3p, 5p dan
3q juga pada kromosom lain yang bervariasi pada masing-masing kasus.
Inaktivasi gen supresor tumor pada 9p, 11q, 14q, dan 16q serta perubahan
onkogen pada kromosom 8 dan 12 juga ditemukan pada KNF. Beberapa studi
menunjukkan bahwa delesi kromosom 3p merupakan kelainan genetik yang paling
sering ditemukan pada KNF. Beberapa studi lain juga menunjukkan adanya
polimorfik dalam gen yang memetabolisme karsinogen yang berhubungan dengan
KNF. Cytochrome P450 2E1 (CYP2E1) dan Cytochrome P450 2A6 (CYP2A6) merupakan grup cytochrome P450 yang respon terhadap aktivasi metabolik nitrosamin dan karsinogen lain. Gen-gen ini diduga berperan dalam timbulnya
KNF.22
Salah satu studi di Cina pada keluarga penderita KNF dijumpai adanya
HLA A*0207 atau B*4601 tetapi tidak pada A*0201 memiliki resiko yang
meningkat untuk terkena karsinoma nasofaring.12,23 Studi oleh Goldsmith et al
menyatakan adanya hubungan pada risiko KNF dengan HLA-A2, HLA-B14, dan
HLA-B46.2
2.1.3.2. Faktor Lingkungan
Adanya hubungan antara faktor kebiasaan makan dengan terjadinya KNF
dipelajari oleh Ho dkk. Ditemukan kasus KNF dalam jumlah yang tinggi pada
mereka yang gemar mengkonsumsi ikan asin yang dimasak dengan gaya Kanton
(Cantonese-style salted fish). Risiko terjadinya KNF sangat berkaitan dengan lamanya mereka mengkonsumsi makanan ini. Banyak studi case-control pada berbagai populasi (Kanton, Cina Selatan lainnya, Cina Utara dan Thailand)
menunjukkan bahwa makanan gaya Kanton mengandung nitrosodimethyamine (NDMA), N-nitrospyrrolidene (NPYR), dan N-nitrospiperidine (NPIP) dalam jumlah besar yang dapat menjadi faktor karsinogenik terhadap KNF.3,20 Paparan
ikan asin sejak usia muda merupakan resiko tinggi KNF pada populasi Cina
Selatan. Di beberapa bagian negeri Cina makanan ini mulai digunakan sebagai
pengganti air susu ibu pada saat menyapih. Peneliti lainnya mencoba
menghubungkannya dengan makanan yang diawetkan menggunakan garam
lainnya seperti udang asin, telur asin. Pada penelitian terhadap hewan percobaan
diketahui bahwa tumor nasal dan nasofaringeal dapat diinduksi pada tikus dengan
memberi ikan asin dalam makanan mereka. Pajanan di tempat kerja seperti asap,
paparan formaldehyde dan debu kayu juga telah diketahui merupakan faktor risiko bagi timbulnya KNF. Belakangan ini penelitian dilakukan terhadap pengobatan
hubungan yang erat antara terjadinya KNF, infeksi EBV dan penggunaan
CHM.3,20
2.1.3.3. Epstein–Barr Virus
Hubungan dekat yang konstan antara EBV dan KNF, terlepas dari latar
belakang etnis, menunjukkan kemungkinan peran onkogenik virus dalam
pembentukan tumor ini. Bukti-bukti mencakup: (1) meningkatnya titer antibodi,
khususnya IgA, terhadap EBV (yang tersering viral capsid antigen dan early antigen) pada kebanyakan penderita KNF dibandingkan kontrol normal dan penderita kanker lainnya; (2) tingginya titer IgA antibodi terhadap EBV pada
penderita dengan tumor yang besar; (3) adanya DNA atau RNA EBV dalam
hampir semua sel KNF; (4) adanya EBV dalam bentuk episomal klonal,
menunjukkan bahwa virus telah berada di dalam sel tumor sebelum ekspansi
klonal; (5) adanya EBV dalam lesi prekursor KNF, tetapi tidak pada epitel
nasofaring normal. Bukti dianggap cukup untuk menyatakan bahwa EBV adalah
karsinogenik oleh the International Agency for Research on Cancer (IARC) pada tahun 1997.1
Hubungan antara EBV dan KNF pertama kali ditemukan oleh Old et al
pada tahun 1966 dengan menggunakan metode in situ hybridization dan the anticomplement immunofluorescent (ACIF). Studi lainnya menunjukkan ekspresi gen laten EBV yaitu Epstein–Barr virus nuclear antigen (EBNA), latent membrane protein-1 (LMP-1), LMP-2, dan EBV encoded small RNAs (EBER) dalam sel-sel KNF untuk mengkonfirmasi adanya infeksi EBV dalam sel-sel
menemukan bahwa KNF dengan EBV tumbuh lebih cepat dan lebih cenderung
untuk bermetastasis dibanding yang tidak mengandung EBV.20-30
EBV-Encoded Latent Membrane Proteins LMP1 merupakan protein membran integral dengan potensi onkogenik, dikode oleh gen BNLF-1 (juga
dikenal sebagai gen LMP1) dari EBV, dapat mentransformasi sel hewan pengerat
dan mengubah fenotipe baik sel limfoid maupun sel sepitel. LMP1 terekspresi
dalam kebanyakan KNF, dan diduga kuat memiliki peranan penting dalam
patogenesis dan perkembangan KNF dan ekspresinya berhubungan dengan
prognosis yang buruk.17,27
Infeksi EBV dalam KNF merupakan tampilan dari pola latensi tipe II dari
virus, yang mengekspresikan EBV nuclear antigen-1 (EBNA-1) dan latent membrane protein 1 (LMP1), tetapi tidak mengekspresikan EBNA2-6. EBV encoded early RNAs (EBERs) juga diekspresikan secara kuat pada tumor ini. LMP1, protein virus dengan perangkat transformasi, dapat menginduksi
hiperplasia epidermal, menghambat diferensiasi skuamous, melakukan upregulasi
adhesion molecule ICAM-1 dan CD40, mengaktivasi nuclear factor-κB (NF-κ -B), dan menginduksi ekspresi epidermal growth factor receptor.1
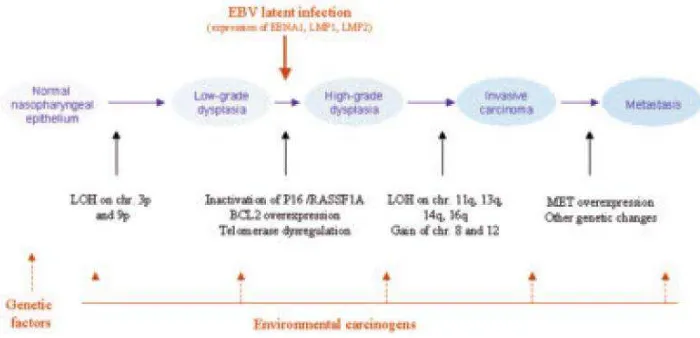
2.1.4. Patogenesis
KNF terbentuk melalui beberapa tahap karsinogenesis, namun sirkuit yang
sangat terintegrasi dan kompleks molekul sinyal dalam patogenesis KNF masih
sebagian yang dipahami. Adanya disregulasi dan ekspresi protein abnormal
molekul dalam jalur sinyal tertentu yang terlibat dalam fungsi selular termasuk
proliferasi, adhesi, kelangsungan hidup, dan apoptosis telah dibuktikan dalam sel
Gambar 2.3. Tahapan evolusi kanker nasofaring1
2.1.5. Gambaran klinis
Karena lokasi anatomisnya maka rongga nasofaring sulit untuk dilihat dan
tumor yang tumbuh sering tidak diketahui dan sedikit yang memberikan gejala
pada fase awal. Gejala sering hanya sedikit memberikan gejala pada waktu yang
lama dengan pola mirip dengan kelainan umum di hidung dan nasofaring.
Kadang-kadang mukosa nasofaring terlihat normal walaupun telah terjadi
penyebaran tumor ke KGB regional atau bahkan sudah menjalar ke
intrakranial.6,15 Penemuan penderita pada stadium I dan II (kasus dini), dimana
belum terjadi metastasis regional sangat sulit dicapai baik di Indonesia maupun di
luar negeri.5
Gejala KNF dapat dibedakan antara gejala dini dan gejala lanjut. Gejala
dini merupakan gejala yang timbul sewaktu tumor masih tumbuh dalam batas
nasofaring (gejala setempat disebabkan oleh tumor primer), berupa gejala-gejala
hidung dan gejala-gejala telinga). Gejala lanjut merupakan gejala yang timbul
karena tumor telah tumbuh keluar dari nasofaring, baik infiltrasi tumor ke jaringan
Gejala telinga timbul akibat penyumbatan tuba Eustachius oleh massa
tumor antara lain tinnitus, rasa tidak nyaman di telinga, rasa tersumbat,
berkurangnya pendengaran dan sering otitis media. Jika seseorang dengan
suku/ras Cina datang dengan kemungkinan otitis media serosa maka ahli THT
harus mempertimbangkan kemungkinan dia menderita KNF.6,24 Gejala hidung
yang biasanya muncul adalah epistaksis ringan dan obstruksi hidung. Perdarahan
hidung dapat terjadi berulang-ulang, sedikit-sedikit dan bercampur dengan ingus.
Gejala obtruksi hidung biasanya menetap dan bertambah berat akibat massa tumor
yang menutupi koana.6,31
Pada keadaan lanjut tumor tumbuh ekspansif ke depan mengisi nasofaring
menutup koana sehingga timbul gejala hidung tersumbat secara unilateral atau
bilateral. Bila tumor tumbuh ke bawah maka palatum mole akan terdesak sehingga
timbul gangguan menelan atau sesak. Bila tumor tumbuh ke atas, menjalar melalui
formen laserum dan foramen ovale masuk ke intrakranial dan mengenai dura
maka akan timbul sakit kepala hebat. Selanjutnya akan mengenai saraf kranial.
Keluhan saraf yang tersering adalah adalah paresis saraf abdusen (N VI) dengan
keluhan diplopia dan strabismus, dan paresis saraf trigeminus (N V) dengan
keluhan baal di pipi dan wajah atau timbul gejala neuralgia Trigeminal (nyeri
hebat pada daerah wajah, sekitar mata, hidung, rahang atas, rahang bawah dan
lidah), biasanya secara unilateral.6,31 Bila mengenai N III dan IV akan timbul
ptosis dan oftalmoplegia. Lebih lanjut lagi akan mengenai N IX, X, XI dan XII.31
Pembesaran KGB leher yang merupakan gejala lanjut KNF, merupakan
keluhan yang paling sering yang menyebabkan penderita datang berobat.
kas KGB leher yang membesar adalah daerah yang terletak di bawah angulus
mandibula di dalam otot strenokleidomastoideus, di mana kelenjar teraba keras,
tidak nyeri bila ditekan, tidak mudah digerakkan karena biasanya juga telah
mengenai jaringan otot di bawahnya.6,31 Metastasis jauh terjadi secara hematogen
maupun limfogen, biasanya ke tulang, paru, ginjal, limpa dan hati dengan gejala
sesuai dengan organ yang terkena.3,6,12,13,15,31
Sebagai pedoman adanya KNF bila dijumpai kumpulan gejala yang
disebut sebagai TRIAS yaitu :
I. Pembesaran KGB leher, gejala telinga, gejala hidung.
II. Pembesaran KGB leher, gejala intrakranial (saraf dan mata), gejala
hidung dan telinga.
III. Gejala intrakranial, gejala hidung dan telinga.31
2.1.6. Pemeriksaan
Pada kasus yang dicurigai suatu KNF, maka perlu dilakukan pemeriksaan
menyeluruh daerah kepala dan leher terutama nasofaring, termasuk memeriksa
adanya pembesaran KGB di leher.6,11,19 Pemeriksaan dengan menggunakan
nasofaringoskop kaku (rigid nasopharyngoscopy) atau lentur (flexible nasopharyngoscopy) sehingga tumor kecil dapat tampak lebih jelas. Dengan nasofaringoskopi biopsi nasofaring dapat langsung dilakukan di bawah anestesi
lokal atau biopsi di bawah anestesi umum.6 Biopsi jaringan nasofaring mutlak
dilakukan untuk konfirmasi diagnosis dan menentukan subtipe histologi.
Pemeriksaan ini merupakan baku emas diagnosis KNF. 6,12
Pemeriksaan radiologik untuk mendeteksi tumor di nasofaring, juga dapat
tumor. CT-scan nasofaring merupakan pemeriksaan yang mempunyai nilai diagnostik tinggi, di mana tumor dini pada fossa Rosenmuller dapat terlihat. CT-scan dengan kontras dapat menentukan batas tumor dan dapat menilai kelenjar limfe dan pembuluh darah. MRI (Magnetic resonance imaging) merupakan pemeriksaan pilihan untuk melihat perluasan regional karena sensitivitasnya untuk
mendeteksi metastasis ke retrofaring. MRI lebih baik dibanding CT-scan dalam membedakan jaringan tumor dari jaringan lunak di sekitarnya. KGB leher
profunda dan keterlibatan sumsum tulang secara dini.1,6,32,33
Pemeriksaan patologik KNF dapat dilakukan dengan pemeriksaan
sitologik. Sediaan sitologik dari nasofaring diperoleh dengan beberapa cara antara
lain kerokan (scrapping), sikatan (brushing), usapan (swab) atau dengan biopsi aspirasi jarum halus dengan penuntun. Akan tetapi hasilnya sering meragukan
sehingga kurang dipergunakan dalam diagnosis KNF.6 Sebagian besar KNF
ditemukan dengan pembesaran KGB di leher. Metastasis karsinoma ke KGB leher
bukan hanya berasal dari nasofaring tetapi juga dari beberapa jaringan lain di
sekitar kepala dan leher, bahkan dengan gambaran yang hampir sama, oleh karena
itu perlu dibuktikan bahwa pembesaran KGB leher benar-benar merupakan
metastasis KNF.6,12 Pemeriksaan untuk menentukan diagnosis ini adalah biopsi
aspirasi jarum halus. Karena teknik ini mudah diagnosis dapat dibuat dalam waktu
singkat dengan akurasi yang cukup tinggi, maka di banyak sentra biopsi aspirasi
sering digunakan sebagai pilihan pertama pada penatalaksanaan metastasis
KNF.12,13
Pemeriksaan serologik dilakukan untuk mendeteksi adanya infeksi EBV
EBV seperti IgA (Antibodi terhadap VCA-viral capsid antigen, maupun EA-early antigen), antigen EBV rekombinan seperti EBV nuclear antigens (EBNA)yang paling sering dipergunakan. Hasil pemeriksaan serologi positif untuk EBV
ditemukan pada hampir 100% nonkeratinizing carcinoma, sedangkan keratinizing squamous cell carcinoma cenderung kurang membawa EBV dibanding nonkeratinizing carcinoma.1
2.1.7. Klasifikasi
Klasifikasi karsinoma nasofaring berdasarkan WHO: (1). Keratinizing squamous cell carcinoma ICDO 8071/3. Tipe KNF ini menunjukkan diferensiasi skuamous dengan adanya intercellular bridges, dan keratin dalam gambaran histologinya; (2). Nonkeratinizing carcinoma (ICDO 8072/3) yang mencakup tipe berdiferensiasi dan tipe tidak berdiferensiasi (undifferentiated). Tumor ini umumnya lebih radiosensitif dan mempunyai hubungan yang kuat dengan EBV.
(2.1). Differentiated nonkeratinizing carcinoma. Sel-sel tumor menunjukkan diferensiasi dengan maturasi sel skuamous. (2.2.). Undifferentiated carcinoma. Sel-sel tumor dengan bentuk inti oval atau bulat vesikular dengan anak inti
menonjol. Batas antar sel tidak jelas dan dengan hubungan antar sel yang sinsitial;
Tabel 2.1. Perubahan klasifikasi karsinoma nasofaring sejak tahun 1978 sampai sekarang2
World Health Organization (1978) 1. Squamous cell carcinoma 2. Nonkeratinizing carcinoma 3. Undifferentiated carcinoma
World Health Organization (1991) 1. Squamous cell carcinoma 2. Nonkeratinizing carcinoma
a. Differentiated nonkeratinizing carcinoma b. Undifferentiated carcinoma
World Health Organization (2005) 1. Squamous cell carcinoma 2. Nonkeratinizing carcinoma
a. Differentiated nonkeratinizing carcinoma b. Undifferentiated carcinoma
3. Basaloid squamous carcinoma
2.1.8. Gambaran sitologi dan histopatologi karsinoma nasofaring
2.1.8.1. Keratinizing Squamous Cell Carcinoma
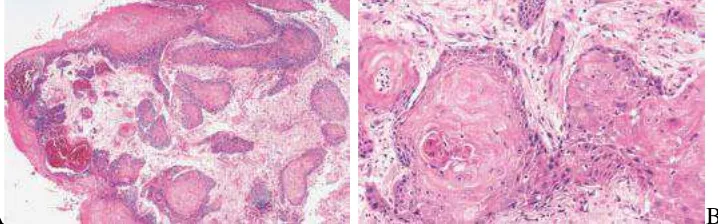
Pada pemeriksaan histopatologi keratinizing squamous cell carcinoma memiliki kesamaan bentuk dengan yang terdapat pada lokasi lainnya. Dijumpai
adanya diferensiasi dari sel skuamous dengan intercellular bridge atau keratinisasi.12,14,29,34 Tumor tumbuh dalam bentuk pulau-pulau yang dihubungkan
dengan stroma yang desmoplastik dengan infiltrasi sel-sel radang limfosit, sel
plasma, neutrofil dan eosinofil yang bervariasi. Sel-sel tumor berbentuk poligonal
dan berlapis. Sel-sel pada bagian tengah pulau menunjukkan sitoplasma
eosinofilik yang banyak mengindikasikan keratinisasi. Dijumpai adanya keratin
A B
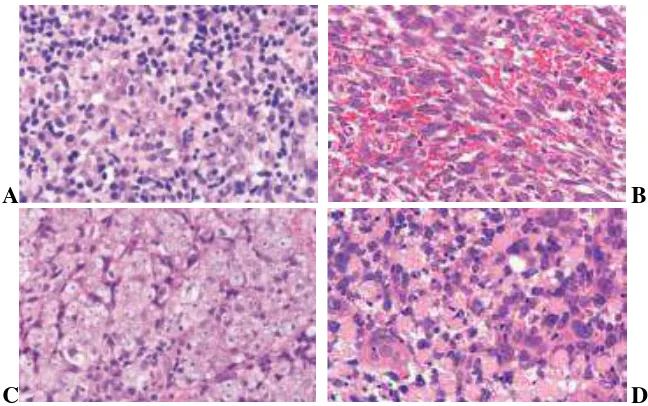
Gambar 2.4. Nasopharyngeal keratinizing squamous cell carcinoma. A. Tumor menunjukkan invasi ke stroma. B. Pulau-pulau sel tumor yang invasif berbentuk ireguler
dengan stroma desmoplastik. Sel-sel tumor menunjukkan diferensiasi skuamous yang jelas disertai keratinisasi1
Pada sediaan sitologik inti karsinoma sel skuamous berbentuk lebih
"spindel" dengan kromatin yang padat dan tersebar tidak merata. Pleomorfisme
inti lebih jelas terlihat. Nukleoli bervariasi dalam besar dan jumlah, sitoplasma
lebih padat, berwarna biru dan batas sel lebih mudah dikenali. Keratinisasi
merupakan indikasi yang paling dapat dipercaya sebagai tanda adanya diferensiasi
ke arah sel skuamous. Bila keratinisasi tidak terlihat maka dijumpainya halo pada
sitoplasma di sekitar inti dan kondensasi sitoplasma pada bagian pinggir sel
merupakan penuntun yang sangat menolong untuk mengenal lesi tersebut sebagai
karsinoma sel skuamous.12,36-38
2.1.8.2. Nonkeratinizing Carcinoma
Secara histopatologi tumor terdiri dari lembaran padat, pulau-pulau yang
tidak teratur, lembaran yang diskohesif dan trabekula bercampur dengan limfosit
dan sel plasma yang bervariasi jumlahnya. Subklasifikasi menjadi subtipe
undifferentiated dan differentiated adalah pilihan, perbedaan daerah biopsi dalam satu tumor atau biopsi yang diambil pada interval waktu yang berbeda dari pasien
yang sama mungkin menunjukkan gambaran subtipe yang berbeda. Ketika kedua
subtipe terlihat dalam spesimen, tumor dapat diklasifikasikan sesuai dengan
subtipe yang menonjol, atau sebagai nonkeratinizing carcinoma dengan gambaran dari kedua subtipe.1
2.1.8.2.1. Differentiated Subtype
Pada pemeriksaan histopatologi nonkeratinizing carcinoma differentiated subtype memperlihatkan gambaran stratified dan membentuk pulau-pulau.12,14,35 Gambaran stratifikasi sering dengan pertumbuhan plexiformis, mirip dengan
karsinoma sel transisional kandung kemih.1 Sel-sel menunjukkan batas antar sel
yang jelas dan terkadang dijumpai intercellular bridge yang samar-samar. Dibandingkan dengan undifferentiated carcinoma ukuran sel lebih kecil, rasio inti sitoplasma lebih kecil, inti lebih hiperkromatik dan anak inti tidak menonjol.1,12
A B
Gambar 2.6. Nasopharyngeal nonkeratinizing carcinoma, differentiated type. A. Karsinoma invasif menunjukkan degenerasi kistik dengan nekrosis. B. Pada pembesaran kuat sel-sel tumor menunjukkan pleomorfisitas dan hiperkromatik yang jelas dengan rasio
2.1.8.2.2. Undifferentiated Subtype
Gambaran sitologi yang dapat dijumpai pada nonkeratinizing carcinoma undifferentiated subtype (undifferentiated carcinoma) berupa kelompokan sel-sel berukuran besar yang tidak berdiferensiasi, inti yang membesar dan khromatin
pucat, terdapat anak inti yang besar, sitoplasma rapuh, dijumpai latar belakang
sel-sel radang limfosit diantara sel-sel-sel-sel epitel.1,12,36,37 Sebaran sel-sel tumor yang besar
di sekitar sel-sel limfoid dapat menyerupai Hodgkin lymphoma.1
A B
Gambar 2.7. Gambaran sitologi undifferentiated carcinoma. Kelompokan sel-sel epitel undifferentiated, dengan inti vesikuler, nukleoli menonjol dan sitoplasma pucat dan rapuh, dengan latar belakang limfosit.(A. diwarnai dengan MGG, B. diwarnai dengan
H&E.)37
Pada pemeriksaan histopatologi undifferentiated carcinoma ditandai dengan sel-sel tumor yang besar tersusun sinsitial dengan batas sel yang tidak
jelas, inti vesikuler bentuk bulat sampai oval, dan nukleoli yang jelas di tengah.
Sel-sel sering terlihat padat atau bahkan tumpang tindih. Kadang-kadang, inti
dapat kaya akan kromatin dibanding vesikular. Sitoplasma sedikit yang amfofilik
atau eosinofilik.1,34 Beberapa sel tumor dapat berbentuk spindel. Dijumpai infiltrat
sel radang dalam jumlah banyak, khususnya limfosit, sehingga dikenal juga
Terdapat dua pola pertumbuhan undifferentiated subtype yaitu tipe Regauds, yang terdiri dari kumpulan sel-sel epiteloid dengan batas yang jelas yang dikelilingi oleh jaringan ikat fibrous dan sel-sel limfosit. Tipe kedua yaitu tipe
Schmincke, sel-sel epitelial neoplastik tumbuh difus dan bercampur dengan sel-sel radang. Tipe ini sering dikacaukan dengan large cell malignant lymphoma.12,14,35 Pemeriksaan yang teliti dari inti sel tumor dapat membedakan antara karsinoma
nasofaring dan large cell malignant lymphoma, dimana inti dari karsinoma nasofaring memiliki gambaran vesikular, dengan pinggir inti yang rata dan
berjumlah satu, dengan anak inti yang jelas berwarna eosinophil. Inti dari limfoma
biasanya dengan pinggir lebih iregular, kromatin kasar dan anak inti lebih kecil
dan berwarna basofilik atau amfofilik.12,14,35
A B
C D
Gambar 2.8. Nasopharyngeal nonkeratinizing carcinoma, undifferentiated subtype. A. Disebut sebagai lymphoepithelial carcinoma, dengan karakteristik sel-sel limfoid
sebagian bercampur dengan sel-sel tumor membentuk agregat kecil sehingga sulit menentukan asal sel dari epitel. B. Tampak sel-sel berbentuk spindel dengan inti hiperkromatik dan nukleoli tidak menonjol. C. Sel-sel karsinoma dengan inti vesikular.
2.1.8.3. Basaloid Squamous Cell Carcinoma
Bentuk mikroskopis lain yang jarang dijumpai adalah basaloid squamous cell carcinoma.1,12,35 Tipe ini memiliki dua komponen yaitu sel-sel basaloid dan sel-sel skuamous. Sel-sel basaloid berukuran kecil dengan inti hiperkromatik dan
tidak dijumpai anak inti dan sitoplasma sedikit. Tumbuh dalam pola solid dengan
konfigurasi lobular dan pada beberapa kasus dijumpai adanya peripheral palisading. Komponen sel-sel squamous dapat in situ atau invasif. Batas antara komponen basaloid dan skuamous jelas.1,12
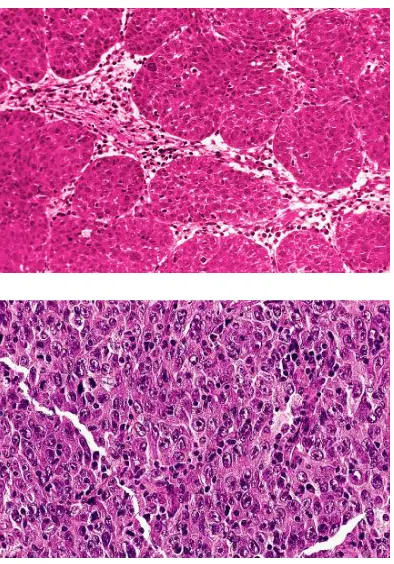
Gambar 2.9.Undifferentiated carcinoma “Regaud type”,terdiri dari
sel-sel yang membentuk sarang-sarang padat35
Gambar 2.10. Undifferentiated carcinoma“Schmincke type”, terdiri
sel-sel yang tumbuh membentuk gambaran sinsisial yang difus35
Gambar 2.11.Basaloid squamous cell carcinoma pada nasofaring. Sel-sel basaloid menunjukkan pola
pertumbuhan festooning, sel-sel basaloid berselang-seling dengan
2.1.9. Metastasis Karsinoma Nasofaring Pada Kelenjar Getah Bening Leher
Pembesaran KGB leher bagian atas merupakan gejala tersering dari KNF.1
Lebih dari 90% dari metastasis KGB yang didiagnosis dengan aspirasi awal. Salah
satu bantuan yang sangat penting dalam penanganan tumor di leher, dan bagi
onkologi kepala dan leher secara umum adalah melihat tingkat KGB leher yang
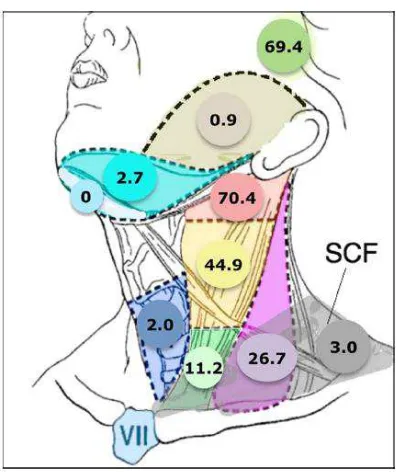
terlibat.7 Insidensi lokasi metastasis KNF pada KGB leher diteliti oleh Ho et al
dapat dilihat pada gambar 2.12. Hasil meta-analisis dari 13 uji klinis
menggunakan MRI untuk diagnosis dan penentuan stadium untuk KNF
mengungkapkan bahwa KGB leher yang paling sering terlibat meliputi KGB
retrofaringeal lateral dan KGB tingkat II dengan kemungkinan metastasis
masing-masing 69,4% & 70,4%. Selanjutnya kelompok KGB diikuti oleh tingkat III, VA,
dan IV, dengan kemungkinan masing-masing sebesar 44,9%, 26,7%, 11,2%.
Beberapa kelompok KGB leher, termasuk tingkat I, tingkat VI, parotis dan
kelenjar supraklavikula memiliki risiko yang sangat rendah untuk metastasis KNF.
Sebuah temuan penting adalah bahwa penyebaran limfatik di KGB leher
berlangsung berantai secara teratur dari KNF primer. Terdapat risiko yang sangat
rendah sekitar 0,5% untuk skip metastasis.33
Pemeriksaan sitologi biopsi aspirasi jarum halus pada KGB leher yang
membesar merupakan pemeriksaan yang sangat bernilai untuk mendiagnosis
metastasis KNF, juga sebagai diagnosis awal dan untuk menentukan stadium.
Gambar 2.12. Ringkasan insidensi metastasis karsinoma nasofaring pada kelenjar getah bening leher33
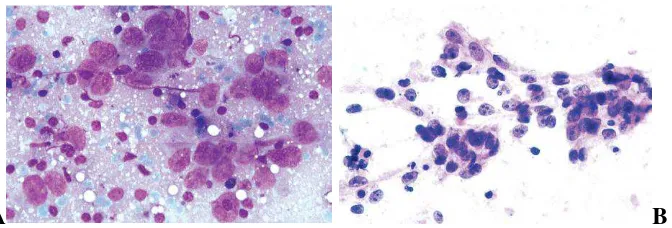
A B
C
Gambar 2.13. Metastatis karsinoma nasofaring pada kelenjar getah bening. A. Gambaran sitologi biopsi aspirasi KGB menunjukkan kelompokan sel-sel tumor di antara sel-sel limfosit matur. B. Secara histologi dengan pembesaran sedang menunjukkan area dengan
pertumbuhan sel-sel tumor dengan kohesi antar sel yang kuat. C. Sel-sel tumor dengan pewarnaan imunohistokimia dengan sitokeratin.1
2.1.10. Pewarnaan Imunohistokimia
Secara praktis semua sel tumor menunjukkan hasil positif kuat terhadap
yang terwarnai secara fokal. Juga terwarnai positif kuat dengan high molecular weight cytokeratins (seperti CK 5/6, 34ßE12). Dengan epithelial membrane antigen biasanya memberi reaksi secara fokal saja, pada kebanyakan kasus menunjukkan reaksi positif kuat pada inti sel tumor.1
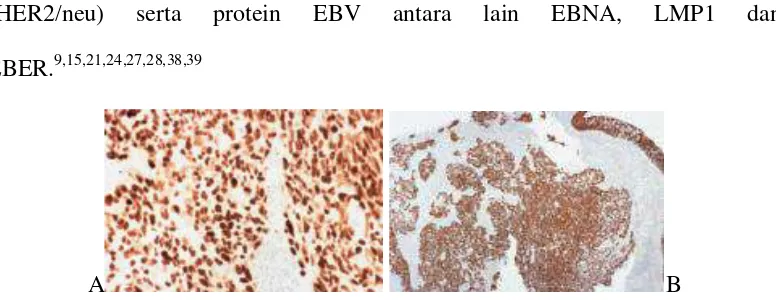
Beberapa marker lain untuk KNF antara lain p53, epidermal growth factor receptor (EGFR), vascular endothelial growth factor (VEGF), Ki-67 dan c-erbB2 (HER2/neu) serta protein EBV antara lain EBNA, LMP1 dan
EBER.9,15,21,24,27,28,38,39
A B
Gambar 2.14. Pewarnaan imunohistokimia pada nonkeratinizing carcinoma undifferentiated subtype. A. In-situ hybridization for EBER menunjukkan reaksi positif pada semua inti sel tumor (nuclear labeling). B. Imunohistokimia dengan pan sitokeratin menunjukkan reaksi positif pada epitel permukaan dan pada kelompokan ireguler sel-sel
tumor di dalam stroma.1
2.1.11. Stadium Klinik
Penentuan stadium dilakukan berdasarkan atas kesepakatan antara UICC
(Union Internationale Centre Cancer ) dan AJCC (Americant Joint Committe on Cancer). Untuk karsinoma nasofaring pembagian TNM adalah sebagai berikut : T menggambarkan keadaan tumor primer, besar dan perluasannya
T1 : Tumor terbatas pada nasofaring
T2 : Tumor meluas ke orofaring dan/atau fossa nasal
T2a : Tanpa perluasan ke parafaring
T2b : Dengan perluasan ke parafaring
T4 : Tumor meluas ke intrakranial dan atau mengenai saraf otak, fossa
infratemporal, hipofaring atau orbita
N menggambarkan keadaaan kelenjar limfe regional
N0 : Tidak ada pembesaran kelenjar
N1 : Terdapat pembesaran kelenjar ipsilateral < 6 cm
N2 : Terdapat pembesaran kelenjar bilateral < 6 cm
N3 : Terdapat pembesaran kelenjar > 6 cm atau ekstensi ke supraklavikula
M menggambarkan metastasis jauh
M0 : Tidak ada metastasis jauh
M1 : Terdapat metastasis jauh
Berdasarkan TNM tersebut di atas, stadium penyakit dapat ditentukan :
Satdium 0 : Tis, N0, M0
Stadium I : T1, N0, M0
Stadium IIA : T2a, N0, M0
Stadium IIB : T1, N1, M0; atau T2a, N1, M0; atau T2B, N0,N1, M0
Stadium III : T1, N2, M0; atau T2a, T2b, N2 M0; atau T3, N0, N1, N2, M0
Stadium IVA : T4, N0, N1, N2, M0
Stadium IVB : Tiap T, N3, M0
2.1.12. Penatalaksanaan
Terapi baku dengan menggunakan radioterapi, dengan angka ketahan
hidup sekitar 50-70%, tetapi beberapa penulis menganjurkan untuk
mengkombinasikan dengan kemoterapi.34 Undifferentiated Cacinoma lebih radiosensitif sedangkan keratinizing squamous cell carcinoma merupakan yang paling tidak radiosensitif.10
KNF mempunyai sensitivitas yang tinggi terhadap radiasi dibanding
kanker pada kepala dan leher lain. Radioterapi pada KNF stadium dini (I dan II)
merupakan terapi pilihan, sedangkan pada stadium lanjut (III dan IV)
dikombinasikan dengan kemoterapi.6,13
Kemoterapi diberikan pada KNF dengan indikasi metastasis ke KGB leher,
metastasis jauh dan kasus residif. Pemberian kemoterapi dikombinasikan dengan
radioterapi. Kemoterapi dapat diberikan sebelum radioterapi (neoadjuvant), selama radioterapi (concurrent/concomitant) atau setelah radioterapi (adjuvant).6
Terapi bedah kurang dipakai dalam penalaksanaan KNF, terbatas pada
diseksi leher untuk mengontrol KGB yang radioresisten dan metastasis leher
setelah radioterapi. Terapi bedah juga dilakukan pada kasus relaps di nasofaring
atau di KGB tanpa metastasis jauh.6
2.1.13. Prognosis
Angka ketahanan hidup dipengaruhi oleh usia (lebih baik pada pasien usia
muda), staging klinik dan lokasi dari metatasis regional (lebih baik pada yang
homolateral dibandingkan pada metastasis kontralateral dan metastasis yang
terbatas pada leher atas dibandingkan pada leher bawah).10 Studi terakhir dengan
stadium I 98%, stadium II A-B 95%, stadium III 86%, dan stadium IV A-B
73%.10,34 Berdasarkan tipe histologik, prognosis lebih buruk pada keratinizing squamous cellcarcinoma dibandingkan dengan yang lainnya.10,35
Diagnosa dini sangat menentukan prognosis penderita. Hal ini sukar
dicapai karena nasofaring tersembunyi di belakang tabir langit-langit dan terletak
di bawah dasar tengkorak serta berhubungan dengan banyak daerah penting di
dalam tengkorak maupun leher. Diagnosis dini yaitu menemukan kasus KNF pada
stadium I dan IIA, dimana belum terjadi metastasis regional. Keadaan ini sangat
sulit dicapai baik di Indonesia maupun di luar negeri.13
2.2. LMP1
EBV-Encoded Latent Membrane Proteins 1 (LMP1) merupakan protein membran integral dengan potensi onkogenik, dikode oleh gen BNLF-1 (juga
dikenal sebagai gen LMP1) dari EBV, dapat mentransformasi sel hewan pengerat
dan mengubah fenotipe baik sel limfoid maupun sel sepitel. LMP1 terekspresi
dalam kebanyakan KNF, dan diduga kuat memiliki peranan penting dalam
patogenesis dan perkembangan KNF dan ekspresinya berhubungan dengan
prognosis yang buruk.9,17,21,28,40
Studi oleh Zheng et al menyatakan LMP1 merupakan protein membran
diferensiasi sel B. Dua domain fungsional, yaitu C-terminal activation regions 1 (CTAR-1) dan CTAR-2, dalam cytoplasmic carboxy terminus dari LMP1, dapat mengaktivasi faktor transkripsi NF-kB, yang dapat menyebabkan upregulasi produk gen antiapoptotik. LMP1 berperan penting dalam imortalitas sel B
manusia melalui aktivasi sejumlah jalur sinyal seluler, termasuk NF-kB, JNK,
JAK/STAT, p38/MAP, dan Ras/MAPK. Dalam sel epitel manusia LMP1 mengubah beberapa materi fungsional yang terlibat dalam progresi dan invasi
tumor. Temuan dalan studi ini menunjukkan bahwa LMP1 meningkatkan
transkripsi dan ekspresi MMP-9 melalui NF-kB dan AP-1 yang menjadi salah satu
mekanisme LMP1 dalam memediasi invasi dan metastasis sel-sel KNF. Selain itu
LMP1 juga meningkatkan transkripsi dan ekspresi VEGF dalam lini sel-sel KNF
melalui jalur JAK3/STAT3. LMP2 tidak terlibat dalam transformasi sel B secara
in vitro, namun ekspresinya menunjukkan peranan penting dalam
mempertahankan virus dalam tubuh. Pada studi ini dinyatakan bahwa LMP1
merupakan molekul utama dalam patogenesis KNF, sehingga mengganggu sinyal
LMP1 menjadi strategi yang menjanjikan untuk terapi target pada KNF.28
Gullo et al dalam studinya menyatakan secara in vitro ekspresi LMP1
dalam sel epitel dapat menyebabkan upregulasi ekspresi intercellular adhesion molecule 1 (ICAM-1), CD40, dan sitokin-sitokin seperti interleukin 6 (IL-6) dan IL-8. LMP1 juga dapat menginduksi ekspresi CD70, anggota dari keluarga TNF
pada sel epitel secara in vitro. LMP1 dapat menginduksi matrix metalloproteinase (MMP-9), melalui CTAR-1 dan CTAR-2. LMP1 mengaktifkan beberapa jalur
Tulalamba dan Janvilisri dalam artikelnya menguraikan peranan LMP1
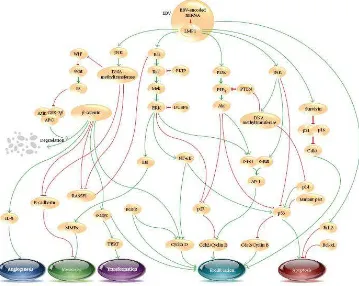
dalam berbagai tahapan siklus sel dalam patogenesis KNF (gambar 2.15).21 Pada
studi ini dijelaskan peranan LMP1 pada jalur MAPK seperti JNK dan ERK yang
menyebabkan aktivasi faktor-faktor transkripsi NF-kB dan AP-1, menghasilkan
output di hilir berupa proliferasi dan pertumbuhan sel. LMP1 juga berperanan
dalam upregulasi survivin yang merupakan anggota dari inhibitor apoptosis.
Overekspresi survivin berhubungan dengan prognosis yang buruk, sedangkan
inhibisinya akan mengurangi viabilitas sel-sel KNF dan meningkatkan sensitifitas
terhadap radioterapi.21
Gambar 2.15. Sekilas jalur sinyal dalam patogenesis karsinoma nasofaring yang diperankan oleh LMP1. Inisiasi sinyal protein di hulu (upstream) dimulai dengan LMP1.
Kegiatan selanjutnya menginduksi protein di hilir (downstream) dalam beberapa jalur
seperti β-catenin, NF-kB, dan AP-1 menyebabkan gangguan regulasi proliferasi sel (CDK/cyclin protein), transformasi sel (TERT), peningkatan angiogenesis (IL-8) dan
Hariwiyanto et al dalam studinya menyatakan bahwa terdapat perbedaan yang
signifikan pada tampilan LMP1 dan LMP2 dalam kaitannya dengan hasil terapi,
telah membuktikan bahwa LMP1 dan LMP2 memainkan peran utama dalam hasil
terapi, hal ini sesuai dengan teori yang menduga LMP1 sebagai agen antiapoptotik
dan mempengaruhi resistensi tumor terhadap obat antitumor, sedangkan LMP2a
mungkin berperan dalam gangguan transduksi sinyal sel B, memungkinkan infeksi
laten EBV, dan menghambat apoptosis yang mengurangi hasil terapi.41
Studi oleh Shao et al dengan melakukan evaluasi hasil immunostainning
antibodi terhadap LMP1, Bcl-2, Bax, Fas (CD95), Fas-Ligand, CD3, CD4, CD8,
CD25, CD68, MMP-9, Caspase-3, p53, dan Ki-67, menunjukkan tingginya akumulasi p53 pada kebanyakan biopsi KNF bersama dengan Ki-67 yang
berkorelasi dengan ekspresi LMP1 dan pengurangan apoptosis. Protein Bcl-2 dan
Bax ternyata ditemukan pada sel-sel KNF (masing-masing 69% dan 65%) maupun
pada sel-sel limfosit dan folikel limfoid. memodulasi jalur yang dipicu sitokrom
C. Pemeriksaan biopsi dengan derajat proliferasi lebih tinggi (Ki-67) pada
kenyataannya juga dengan Bcl-2 yang lebih kuat. Upregulasi MMP-9 telah
terbukti berkorelasi dengan peningkatan invasi dan metastasis sel tumor. LMP1
menginduksi ekspresi MMP-9 oleh aktivasi NF-kB dan AP-1 dan LMP1
kemudian dapat mempromosikan invasi.42
A B
Studi oleh Thompson dan Kurzrock menyatakan setidaknya terdapat empat
jalur sinyaling dalam siklus sel, yaitu NF-kB, JNK, p38/MAPK, dan JAK/STAT
yang dipengaruhi oleh LMP1. Kaskade aktivasi yang berhubungan dengan LMP1
meyebabkan peningkatan ekspresi molekul adhesi sel B (LFA-1, CD54, dan
CD58), ekspresi marker aktivitas sel B (CD23, CD39, CD40, CD44, dan HLA
kelas II), dan perubahan morfologi sel seperti penggumpalan seluler. Interaksi
LMP1 juga menyebabkan overekspresi protein BCL-2 dan A20, yang melindungi
sel terinfeksi dari apoptosis yang dimediasi p53.43
Hampir semua studi ini menyatakan bahwa ekspresi LMP1 mempunyai
nilai yang signifikan dalam menentukan perilaku sel-sel tumor yang lebih invasif,
lebih cenderung bermetastasis dini, lebih resisten terhadap obat-obat anti tumor
sehingga menyebabkan prognosis yang lebih buruk dibanding sel-sel tumor yang
tidak mengekspresikan LMP1. 9,17,21,28,40-43
2.3. Kerangka Konsepsional
NASOFARING
Lingkungan
Epstein-Barr virus
Genetik
BAB III
METODOLOGI PENELITIAN
3.1. Jenis Penelitian
Penelitian ini merupakan studi deskriptif-analitik dengan pendekatan cross sectional.
3.2. Tempat dan Waktu Penelitian
3.2.1. Tempat Penelitian
Penelitian dilakukan di Laboratorium Patologi Anatomi Fakultas
Kedokteran Universitas Sumatera Utara Medan.
3.2.2. Waktu Penelitian
Penelitian ini dilakukan mulai bulan Januari sampai November 2013 yang
meliputi studi kepustakaan, pengajuan judul, pengumpulan data/sampel,
pengolahan data dan laporan hasil penelitian.
Tabel 3.1. Waktu pelaksanaan penelitian