EVALUASI TEPUNG BUNGKIL BIJI KARET
Hevea
brasiliensis
DIFERMENTASI CAIRAN RUMEN DOMBA
SEBAGAI SUMBER PROTEIN PAKAN IKAN NILA
Oreochromis niloticus
SAHRUL ALIM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Evaluasi Tepung Bungkil Biji Karet (Hevea brasiliensis) difermentasi Cairan Rumen Domba sebagai Sumber Protein Pakan Ikan Nila (Oreochromis niloticus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
RINGKASAN
SAHRUL ALIM. Evaluasi Tepung Bungkil Biji Karet (Hevea brasiliensis) difermentasi Cairan Rumen Domba sebagai Sumber Protein Pakan Ikan Nila (Oreochromis niloticus). Dibimbing oleh MUHAMMAD AGUS SUPRAYUDI dan MIA SETIAWATI.
Penelitian ini dilakukan untuk mengevaluasi penggunaan tepung bungkil biji karet (TBBK) difermentasi cairan rumen domba sebagai sumber protein nabati utama dalam pakan ikan nila. Ikan uji yang digunakan adalah ikan nila dari strain nirwana yang berukuran 8.14 ± 0.08 g. Ikan dipelihara dalam akuarium berukuran 100x50x50 cm3 dengan sistem resirkulasi. Lima macam pakan yang digunakan dalam penelitian ini memiliki kadar protein dan energi yang serupa yakni 31% dan 433,5 kcal GE g-1. Kelima perlakuan pakan memiliki perbedaan dalam hal sumbangan TBBK yang menggantikan tepung bungkil kedelai yaitu pakan A (0% TBBK), pakan B (25% TBBK), pakan C (50% TBBK), pakan D (75% TBBK) dan pakan E (100% TBBK). Penelitian terbagi menjadi dua tahap yaitu untuk uji kecernaan pakan dan uji performa pertumbuhan. Uji kecernaan dilakukan selama 14 hari, sedangkan uji performa pertumbuhan dilakukan selama 50 hari. Ikan diberi pakan tiga kali dalam sehari, yaitu pukul 07.00, 12.00 dan 17.00 WIB.
Parameter uji yang diamati yaitu jumlah konsumsi pakan, kecernaan pakan, protein darah, total kolesterol, trigliserida, LDL (low density lipoprotein), HDL (high density lipoprotein), retensi protein, retensi lemak, efisiensi pakan, laju pertumbuhan harian, kelangsungan hidup, hepatosomatik indeks (HSI), glikogen (hati dan otot), dan lemak (hati dan otot). Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap dengan lima perlakuan dan empat ulangan. Data dianalisis secara statistik dengan one-way analysis of variance (ANOVA) menggunakan program Minitab (versi 16.0) pada selang kepercayaan 95% (p<0.05). Substitusi tepung bungkil kedelai dengan TBBK sebanyak 50% menunjukkan hasil yang baik ditinjau dari kecernaan protein (92.95%) dan kecernaan total (70,30%). Namun, peningkatan hingga 100% menurunkan kecernaan protein (86.79%) dan kecernaan total pakan (54.58%).
Substitusi tepung kedelai dengan TBBK sebanyak 75% dan 100% memberikan nilai protein darah yang rendah yaitu 3.57% dan 2.58%. Ditinjau dari parameter profil darah, substitusi tepung kedelai dengan TBBK 75% hingga 100% mampu meningkatkan kolesterol, trigliserida, LDL dan menurunkan HDL dalam darah. Efisensi pakan dengan perlakuan substitusi tepung bungkil kedelai dengan TBBK hingga 50% memberikan nilai sebesar 67.04%. Namun hal sebaliknya terjadi dengan substitusi 75% dan 100% TBBK menurunkan efisensi pakan sebesar 46.90% dan 33.82%. Laju pertumbuhan harian pada perlakuan 25% TBBK sebesar 3.43% dan 50% TBBK sebesar 3.42% tidak berbeda nyata dengan perlakuan pakan tanpa TBBK sebesar 3.41%, sehingga TBBK hasil fermentasi dengan cairan rumen domba mampu menggantikan peranan tepung bungkil kedelai hingga 50% sebagai sumber protein nabati utama pada pakan ikan nila. Kata kunci : Protein alternatif, Oreochromis niloticus, bungkil biji karet, LDL
SUMMARY
SAHRUL ALIM. Evaluation of Rubber Seeds (Hevea brasilliensis) Fermented Meal using Rumen Liquour as a Protein Source in Diet of Nile Tilapia (Oreochromis niloticus). Supervised by MUHAMMAD AGUS SUPRAYUDI and MIA SETIAWATI.
This research is aimed to investigate the effect of replacing soybean meal with rubber seed meal (RSM) as protein sources for feed of Nile tilapia (Orecochromis niloticus) strain Nirwana. The fish (8.14 ± 0.08 g) were cultured in rearing aquaria (100x50x50 cm3) connected to a recirculating aquaculture system, and fed three times daily with 5 different concentrations of RSM feeds: A (0% RSM), B (25% RSM), C (50% RSM), D (75% RSM) and E (100% RSM), with the same protein content and gross energy: 31% and 433.5 kcal GE g-1 respectively. The study consisted of two phase. Phase one aims to determine the digestibility of feed (14 days) and phase two study aimed to growth performance (50 days).
During the feeding period, some parameters were measured including feeding rate, feed efficiency, protein retention, fat retention, daily growth rate, cholesterol, triglycerides, feed digestibility, LDL (low density lipoprotein), HDL (high density lipoprotein), hepatosomatic indeks (HSI), glycogen in heart and muscle, and lipid in hearth and muscle. Experimental design was set according to completely randomized design with 5 treatments and 4 repetitions of each. Data were statiscally analysed with one-way analysis of variance (ANOVA) using software Minitab version 16.0, with 95% (p<0.05) confidence interval. The results showed that the replacement of soybean meal with the rubber seed meal at 50% gave the highest protein digestibility (92.95%) and total feed digestibility (70.30%). On the contrary, increasing rate of the replacement up to 100% decreased both protein digestibility and total feed digestibility to 86.79% and 54.58%. Substitution up to 75% and 100% showed low blood protein to 3.57% and 2.58%.
Other results revealed that the use of 75% and 100% lead to the increasing of cholesterol, triglyceride and LDL (low density lipoprotein), but decreased HDL (high density lipoprotein). Overall, the replacement of soybean meal with fermented rubber seed meal as protein sources showed no significant different in fish growth rate; 3.43% (25% RSM), 3.42% (50% RSM) and 3.41% (control). This research result may suggest that rubber seed meal which was previously fermented with rumen liquid can be used to replace soybean meal as protein sources and can be used up to 50% in diet of nile tilapia.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EVALUASI TEPUNG BUNGKIL BIJI KARET
Hevea
brasiliensis
DIFERMENTASI CAIRAN RUMEN DOMBA
SEBAGAI SUMBER PROTEIN PAKAN IKAN NILA
Oreochromis niloticus
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Evaluasi Tepung Bungkil Biji Karet (Hevea brasiliensis) difermentasi Cairan Rumen Domba sebagai Sumber Protein Pakan Ikan Nila (Orechromis niloticus)
Nama : Sahrul Alim NIM : C151110281
Disetujui oleh Komisi Pembimbing
Dr Ir Muhammad Agus Suprayudi, MSi Ketua
Dr Ir Mia Setiawati, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 ini ialah bahan pakan alternatif, dengan judul Evaluasi Tepung Bungkil Biji Karet (Hevea brasilliensis) difermentasi Cairan Rumen Domba sebagai Sumber Protein Pakan Ikan Nila (Oreochromis niloticus).
Terima kasih penulis ucapkan kepada Bapak Dr Ir Muhammad Agus Suprayudi, MSi dan Ibu Dr Ir Mia Setiawati, MSi selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada rekan-rekan yang banyak membantu selama penelitian. Ungkapan terima kasih juga disampaikan kepada istri dan anakku, orang tua, serta seluruh keluarga dan sahabat, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
3 METODE 7
Waktu dan Tempat 7
Prosedur Analisis Data 14
4 HASIL DAN PEMBAHASAN 15
Hasil 15
Pembahasan 17
5 SIMPULAN 21
DAFTAR PUSTAKA 21
DAFTAR TABEL
1 Kebutuhan protein ikan nila (Oreochromis sp.) 3 2 Komposisi proksimat cangkang dan daging biji karet 5 3 Komposisi proksimat (% bobot kering) bungkil biji karet hasil
fermentasi menggunakan cairan rumen domba 7 4 Komposisi proksimat pakan uji (% bobot kering) 8 5 Unsur asam amino esensial dalam pakan perlakuan 8 6 Kecernaan protein dan total pada pakan perlakuan dengan
sumbangan tepung bungkil biji karet hasil fermentasi yang
berbeda 15
7 Kadar protein darah, kolesterol, trigliserida, LDL dan HDL ikan
uji 15
8 Jumlah konsumsi pakan (JKP), retensi protein (RP), retensi lemak (RL), efisiensi pakan (EP), laju pertumbuhan harian (LPH), dan
tingkat kelangsungan hidup 16
9 Kadar air, lemak dan glikogen pada hati ikan nila beserta HSI
pada berbagai perlakuan pakan yang berbeda 16 10 Kadar air, lemak dan glikogen pada otot ikan nila pada berbagai
perlakuan pakan yang berbeda 17
11 Sel darah merah (SDM), sel darah putih (SDP), hemoglobin (Hb),
hematocrit (Ht) dan aktifitas fagosit (AF) 17
DAFTAR LAMPIRAN
1 Prosedur analisis proksimat bahan pakan dan tubuh ikan 27
2 Prosedur analisis asam sianida pada pakan 29
1
PENDAHULUAN
Latar Belakang
Budidaya ikan air tawar menempatkan biaya pakan sebagai biaya produksi tertinggi dalam kegiatan budidaya yaitu 70-89% dari total biaya produksi (Suprayudi 2010). Produksi ikan nila di tahun 2009 menunjukkan volume 323389 ton dan di tahun 2011 meningkat menjadi 481440 ton (Data Statistik Kelautan dan Perikanan 2012). Peningkatan produksi ikan nila akan berdampak pada meningkatnya kebutuhan pakan yang digunakan. Bahan pakan yang umum digunakan sebagai sumber protein yaitu tepung bungkil kedelai dan tepung ikan. Khususnya di Indonesia, sebagian besar bahan baku pakan berasal dari luar negeri, yaitu 70-80% (Hadadi et al. 2010). Pada tahun 2007 Indonesia mengimpor 1.88 juta ton bungkil kedelai dan 10000 ton tepung ikan (Ditjennak 2009b dalam Sinurat 2010). Ketergantungan terhadap bahan pakan impor akan berdampak pada ketersediaan pakan. Bahan baku lokal seperti biji karet diharapkan mampu menggantikan peranan tepung bungkil kedelai sebagai sumber protein nabati utama dalam pakan ikan nila.
Indonesia memiliki luas areal perkebunan karet sebesar 3.48 juta ha dan 85% diantaranya merupakan perkebunan rakyat (Deptan 2012). Secara umum produktivitas biji karet cukup baik yaitu 1 ha kebun karet dapat menghasilkan 0.8-1.2 ton/tahun biji karet sehingga produksi biji karet setiap tahunnya sebesar 2.7-4.1 juta ton/tahun (Dirjen Perkebunan 2004). Biji karet memiliki kandungan protein sebesar 21.9%, karbohidrat sebesar 61.5%, lemak 15.8%, dan kadar abu 2.3% (Oyewusi et al. 2007). Aritama (2012) menambahkan bahwa bungkil biji karet yang difermentasi memiliki kandungan protein sebesar 34.32%, lemak 6.96%, abu 7.36%, serat kasar 7.96%, dan BETN 43.40%.
Penelitian-penelitian yang telah dilakukan menunjukkan tepung biji karet mampu berperan sebagai sumber protein nabati dalam pakan. Eyo dan Ezechie (2004), melaporkan bahwa tepung biji karet dapat menggantikan protein tepung jagung sekitar 10-20% untuk memacu pertumbuhan ikan lele hibrid. Syamsunarno (2011) menyatakan bahwa TBK yang diolah mampu menyumbang hingga 50% dari total protein pakan benih ikan lele Clarias sp.. Selanjutnya Inara (2011) menyatakan bahwa TBK mampu menyumbangkan 25% dari total protein pakan benih ikan mas (Cyprinus carpio Linn). Sedangkan Suprayudi et al. (2011) melapor bahwa penggunaan crude enzim cairan rumen pada bahan baku berbasis protein nabati sebanyak 200 ml kg-1 memberikan hasil yang terbaik terhadap kinerja pertumbuhan ikan nila.
2
serat kasar, sehingga kemampuan ikan dalam memanfaatkan nutrien yang ada pada tepung bungkil biji karet meningkat.
Zat anti nutrisi yang terkandung dalam biji karet yaitu asam sianida (HCN) (Rachmawan 2001). Menurut Siahaan (2009) biji karet mengandung 330 mg HCN per 100 g biji karet. Kandungan zat anti nutrisi pada bahan baku dapat dikurangi secara biologis dan fisik. Sun dan Jiang (2010) menyatakan bahwa pengurangan zat anti nutrisi pada biji karet dapat dilakukan dengan pemanasan (steam physical activity), karbonisasi ataupun keduanya. Abdullah (2012) menambahkan bahwa kandungan sianida pada minyak biji karet dapat dieliminasi menggunakan metode ekstraksi kimia menggunakan larutan N-Hexane. Tujuan dari penelitian ini adalah untuk mengevaluasi penggunaan tepung bungkil biji karet hasil fermentasi dengan cairan rumen domba sebagai sumber protein nabati utama dalam pakan ikan nila.
Perumusan Masalah
Serat kasar yang cukup tinggi dan adanya kandungan zat anti nutrisi seperti HCN pada biji karet merupakan kendala yang cukup signifikan terhadap pembuatan pakan. Serat kasar yang cukup tinggi menjadi kendala bagi kecernaan pakan untuk ikan. Untuk mengurangi serat kasar pada biji karet digunakan metode fermentasi dengan cairan rumen domba. Cairan Rumen domba kaya akan mikroba pengahasil enzim selulotik yang mampu mendegradasi partikel-partikel kompleks menjadi lebih sederhana sehingga lebih mudah untuk diserap dalam saluran pencernaan ikan. Kemudian kandungan HCN dalam bungkil biji karet menjadi salah satu faktor yang dapat mengganggu sirkulasi darah. Dimana HCN dalam darah akan berikatan dengan hemoglobin, dan membentuk cyanohemoglobin sehingga hemoglobin tidak dapat membawa oksigen yang menyebabkan darah akan kekurangan oksigen dan dipenuhi oleh racun asam sianida. Untuk mengurangi kandungan HCN tersebut digunakan metode pemanasan dan penekanan menggunakan hydrolic press. Menurunnya kandungan serat kasar dan zat anti nutrisi (HCN) dalam biji karet diharapkan mampu meningkatkan kualitas nutrisi biji karet, sehingga biji karet dapat digunakan secara maksimal untuk menggantikan peranan tepung bungkil biji kedelai sebagai sumber protein nabati dalam pakan ikan nila.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengevaluasi penggunaan olahan tepung bungkil biji karet difermentasi cairan rumen domba sebagai sumber protein nabati utama dalam pakan ikan nila.
Manfaat Penelitian
3
2
TINJAUAN PUSTAKA
Kebutuhan nutrisi ikan
Kebutuhan nutrisi tiap spesies ikan tentunya akan berbeda. Hal ini dipengaruhi oleh beberapa faktor yakni spesies ikan, ukuran ikan, umur ikan, temperatur air, kandungan energi pakan, kecernaan terhadap nutrien dan kualitas atau komposisi dari nutrien (NRC 1983). Nilai nutrien pakan umumnya dilihat dari komposisi protein, lemak, karbohidrat, mineral dan vitamin serta kandungan energinya. Sedangkan daya cerna ditentukan oleh jenis bahan dan proses pembuatannya.
Halver dan Hardy (2002) menyebutkan bahwa protein merupakan komponen organik terbesar pada jaringan tubuh ikan, karena sekitar 65-75% dari total bobot tubuh ikan terdiri dari protein. Kandungan protein yang optimal untuk ikan dipengaruhi oleh keseimbangan protein dan energi, komposisi asam amino, kecernaan protein dan sumber energi dalam pakan. Menurut Webster dan Lim (2002) kadar protein yang optimal dalam menunjang pakan ikan nila berkisar antara 28-50%. Ketika energi berkurang maka protein akan dirombak oleh tubuh untuk dijadikan sebagai sumber energi sehingga pertumbuhan ikan akan terhambat mengingat fungsi utama protein untuk ikan yakni pembentukan sel baru. Jika kebutuhan ikan akan protein tidak mencukupi maka pertumbuhan akan berhenti dan terjadi penurunan bobot tubuh karena protein pada jaringan tubuh akan dipecah kembali untuk mempertahankan fungsi jaringan tubuh yang lebih penting (NRC 1993). Kebutuhan protein ikan nila untuk beberapa ukuran dapat dilihat pada Tabel 1.
Tabel 1 Kebutuhan protein ikan nila (Oreochromis sp)
Ukuran Ikan (gram) Kadar Protein (%)
Larva 45-50 berasal dari protein tetapi dari nutrien non protein seperti lemak dan karbohidrat. Lemak merupakan sumber energi yang tinggi dalam pakan ikan. Lemak juga berfungsi sebagai pelarut vitamin A, D, E, dan K dan sumber asam lemak esensial, yaitu asam lemak linoleat dan asam lemak linolenat. Lemak terutama dalam bentuk fosfolipid dapat berperan dalam struktur sel dan memelihara permeabilitas membran. Menurut Chou dan Shiau (1996), kadar lemak 5% dalam pakan sudah mencukupi kebutuhan nila, namun kadar lemak pakan sebesar 12% akan menghasilkan perkembangan maksimal.
4
energi termurah dan dapat menggantikan protein yang mahal untuk suplai energi dalam pakan ikan sehingga dapat mereduksi harga pakan. Karbohidrat dalam pakan dapat berupa bahan ekstrak tanpa nitrogen (BETN) dan serat kasar. Ikan-ikan karnivora dapat memanfaatkan karbohidrat optimum pada tingkat 10-20% dalam pakannya sedangkan ikan-ikan omnivora mampu memanfaatkan karbohidrat optimun sebesar 30-40% dalam pakan (Furuichi 1988).
Komponen lain yang dibutuhkan dalam pakan ikan yaitu vitamin dan mineral. Jumlah yang dibutuhkan dari vitamin dan mineral dalam pembuatan pakan sangatlah kecil namun kehadirannya dalam pakan sangat penting karena dibutuhkan tubuh ikan untuk tumbuh dan menjalani beberapa fungsi tubuh. Vitamin merupakan senyawa organik kompleks yang diperlukan untuk tumbuh secara normal, reproduksi, kesehatan, dan metabolisme secara umum. Mineral merupakan senyawa penting yang digunakan untuk proses respirasi, osmoregulasi, dan pembentukan kerangka tulang. Takeuchi et al. (2002) menyatakan bahwa pembuatan pelet dengan suhu tinggi dapat menyebabkan kerusakan pada struktur vitamin dan mineral, sehingga seringkali terjadi penambahan vitamin dan mineral menjadi 2-5 kali dari kebutuhan dasar.
Sumber protein nabati
Keseimbangan protein dan energi sangat penting dalam menunjang pertumbuhan ikan. Pakan yang memiliki kadar protein tinggi bukan saja berasal dari sumber protein hewani, tetapi bisa didapatkan pada sumber protein nabati. Dewasa ini pertumbuhan penduduk yang tidak terkontrol menjadi kendala yang cukup berpengaruh terhadap produksi pakan ikan. Hal ini terjadi karena terdapat persaingan penggunaan sumber protein antara manusia dengan sumber protein pakan ikan. Persaingan tersebut mengakibatkan meningkatnya harga bahan baku pakan, seperti contoh tepung ikan yang merupakan sumber protein utama dalam ransum pakan ikan. Meningkatnya harga bahan baku pakan akan berujung pada tingginya harga pakan. Harga pakan inilah yang berdampak besar terhadap kelangsungan usaha budidaya ikan.
Sumber protein nabati yang biasa digunakan sebagai imbangan dari tepung ikan adalah tepung bungkil kedelai. Tepung bungkil kedelai adalah hasil yang diperoleh setelah minyak kedelainya diekstraksi, baik melalui proses penekanan maupun dengan pelarutan zat-zat tertentu. Kedelai termasuk biji-bijian yang memiliki kadar protein dan lemak yang tinggi. TBK memiliki pola asam amino yang dapat memenuhi kebutuhan asam amino ikan bila dibandingkan dengan sumber bahan baku nabati lainnya (Muray 2004). Suprayudi et al. (1999) menyatakan bahwa tepung kedelai memiliki keterbatasan nutrisi yang terkait dengan rendahnya kecernaan dan energi, defisiensi mineral, kandungan oligosakarida yang tidak tercerna dan faktor anti-nutrisi yang menyebabkan penurunan pertumbuhan.
5
Tabel 2 Komposisi proksimat cangkang dan daging biji karet
Parameter (%) Biji Segar (%) Biji Kering (%) Cangkang (%)
Keterangan : * tidak dianalisis (Siahaan 2009).
Bungkil biji karet merupakan limbah industri minyak biji karet dengan presentase 55-56% dari daging biji karet, namun penggilingan biji karet sederhana menghasilkan 60% bungkil biji karet (Mulyati 2003). Pengekstraksian biji karet akan menghasilkan 55-60% bungkil biji karet yang mengandung total energi sebesar 4374 kkal/kg dan energi metabolisme sebesar 2500 kkal/kg.
Cairan rumen
Perut hewan ruminansia terdiri atas rumen, retikulum, omasum dan abomasum. Volume rumen pada ternak sapi dapat mencapai 100 liter atau lebih, dan untuk domba berkisar 10 liter. Rumen diakui sebagai sumber enzim pendegradasi polisakarida. Polisakarida dihidrolisis dalam rumen disebabkan pengaruh sinergis dan interaksi dari komplek mikroorganisme, terutama selulase dan xilanase (Trinci et al. 1994). Mikroorganisme terdapat pada cairan rumen (liquid phase) dan yang menempel pada digesta rumen. Enzim yang aktif mendegradasi struktural polisakarida hijauan kebanyakan aktif pada mikroorganisme yang menempel pada partikel pakan. Di dalam retikulo rumen terdapat mikrobia rumen yang terdiri atas protozoa dan bakteri yang berfungsi melaksanakan fermentasi untuk mensintesis asam amino, vitamin B-komplek dan vitamin K.
beta-D-6
xylosidase, acethyl esterase dan alfa-L-arabinofuranosidase. Kemudian terdapat enzim-enzim pektinolitik terdiri atas polygalakturonase, pectate lyase dan pectin lyase, dan enzim-enzim lain yang terdiri atas amilase, endo-arabilase, beta-D-gluanase (laminarinase), beta-D-glucanase (Lichenase), beta-D-glucanase (Pechimanase) dan protease.
Zat anti nutrisi pada TBBK
Pada umumnya terdapat kekurangan dalam sumber protein nabati, yaitu adanya kandungan zat anti nutrisi. Khususnya pada biji karet terdapat asam Tingkat toksisitas sianida dipengaruhi oleh beberapa faktor yaitu ukuran dan jenis hewan, kecepatan mengunyah makanan, jenis sianogen dalam makanan, keaktifan enzim dalam degradasi makanan dan detoksifikasi sianida. HCN dalam tubuh dapat diukur pada plasma, sel darah merah atau urin. Jumlah distribusi sianida berubah-ubah sesuai dengan kadar zat kimia lainnya di dalam darah. Bila sianida masuk melalui sistem pencernaan maka kadar tertinggi adalah di hati. Sianida menjadi toksik bila berikatan dengan Fe3+. HCN merupakan racun yang tergolong kuat dan sangat cepat cara bekerjanya (Murni et al. 2008).
Kolesterol
Kolesterol adalah zat menyerupai lemak yang secara alami terdapat di seluruh tubuh. Kolesterol terdapat pada dinding dan membran setiap sel, termasuk sel otak, saraf, otot, kulit, hati, usus dan jantung. Tubuh tidak dapat berfungsi dengan baik tanpa kolesterol (Laurencio 2002). Kolesterol merupakan sterol utama dalam lipida hewan dan dapat menghasilkan sejumlah produk oksidasi di bawah kondisi tertentu. Dalam berbagai proses metabolisme tubuh, kolesterol juga mengambil peran penting diantaranya, sebagai zat dalam pembentukan sel-sel dalam tubuh dan kandungan lemak dalam kolesterol berperan sebagai pembentuk dinding-dinding sel. Kolesterol juga dibutuhkan sebagai bahan dasar pembentukan hormon-hormon steroid, membuat asam empedu untuk proses emulsi lemak dan dibutuhkan untuk membuat vitamin D dan juga berperan sebagai bahan untuk membuat hormon - hormon reproduksi.
Lipoprotein
7 juga kecepatan tubuh membentuk dan membuang LDL dari dalam tubuh (Santos et al. 2003). High density lipoprotein (HDL) memiliki kandungan protein paling tinggi dari lipoprotein (55% protein dan 45% lipida). HDL sering disebut sebagai kolesterol baik karena aktivitasnya yang mengeluarkan kolesterol dari dalam tubuh.
3
METODE
Waktu dan lokasi penelitian
Penelitian ini dilaksanakan pada bulan Maret hingga Juli 2013 yang bertempat di Laboratorium Basah Nutrisi Ikan, Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor. Analisis proksimat dilakukan di Laboratorium Nutrisi Ikan, analisis gambaran darah dilakukan di Laboratorium Kesehatan Ikan dan analisis kualitas air dilakukan di Laboratorium Lingkungan, Departemen Budidaya Perairan. Kemudian Analisis asam amino dilakukan di Laboratorium Kimia Terpadu, Institut Pertanian Bogor dan analisis kimia darah dilakukan di Laboratorium Fisiologi, Fakultas Kedoketeran Hewan, Institut Pertanian Bogor.
Persiapan biji karet
Bahan baku yang digunakan adalah biji karet sebanyak 300 kg biji yang berasal dari perkebunan karet rakyat di Padang Sidempuan, Sumatera Utara. Analisis proksimat bahan uji biji karet dengan fermentasi menggunakan cairan rumen domba disajikan pada Tabel 3.
Tabel 3 Komposisi proksimat (% bobot kering) bungkil biji karet hasil fermentasi menggunakan cairan rumen domba
BETN = bahan ekstrak tanpa nitrogen
GE = gross energy (Watanabe 1988) 1 gr protein : 5.6 kkal GE, 1 gr lemak : 9.4 kkal GE 1 gr karbohidrat/BETN : 4.2 kkal GE.
8
Pakan uji
Penelitian ini terbagi menjadi dua tahap yaitu uji kecernaan pakan dan uji performa pertumbuhan. Pakan untuk uji kecernaan dan uji pertumbuhan menggunakan formula yang sama, namun pada uji kecernaan pakan ditambahkan kromium (Cr2O3) sebagai indikator. Komposisi proksimat dan profil asam amino
pakan disajikan pada Tabel 4 dan Tabel 5.
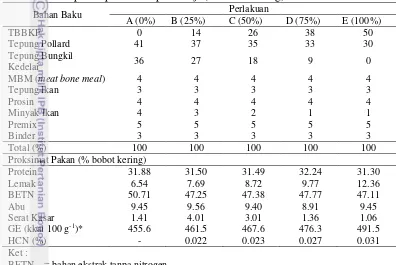
Tabel 4 Komposisi proksimat pakan uji (% bobot kering)
Bahan Baku Perlakuan
BETN = bahan ekstrak tanpa nitrogen
GE = gross energy (Watanabe 1988) 1 gr protein : 5.6 kkal GE, 1 gr lemak : 9.4 kkal GE 1 gr karbohidrat/BETN : 4.2 kkal GE.
Tabel 5 Unsur asam amino esensial dalam pakan perlakuan
Asam
Fenilalanin 1.48 1.46 1.37 1.30 1.28 1.16
Threonin 1.22 1.20 1.16 1.13 1.11 1.16
Valin 1.42 1.57 1.63 1.72 1.81 0.87
9
Rancangan penelitian
Penelitian tahap pertama berupa uji kecernaan menggunakan 5 perlakuan pakan dengan level sumbangan TBBK hasil fermentasi yang berbeda dan pakan kontrol. Penelitian tahap kedua berupa uji kinerja pertumbuhan menggunakan 5 perlakuan dan 4 ulangan dengan Rancangan Acak Lengkap, sebagai berikut: Perlakuan P1: Tidak mendapat sumbangan protein dari TBBK hasil fermentasi.
Perlakuan P2: 25% protein dari TBBK hasil fermentasi.
Perlakuan P3: 50% protein dari TBBK hasil fermentasi.
Perlakuan P4: 75% protein dari TBBK hasil fermentasi.
Perlakuan P5: 100% protein dari TBBK hasil fermentasi.
Pemeliharaan ikan
Pemeliharaan ikan pada uji kecernaan menggunakan 20 buah akuarium berukuran 100x50x40 cm dengan volume air sebanyak 160 L/akuarium dan padat penebaran sebanyak 20 ekor/akuarium. Pakan diberikan secara at satiation dengan frekuensi sebanyak 3 kali sehari, yaitu pada pukul 07.00, 12.00 dan 17.00 WIB selama 14 hari masa pemeliharaan. Pada hari ke-3, feses ikan diambil 30-60 menit setelah pemberian pakan. Feses tersebut disipon dari bagian dasar akuarium, kemudian feses tersebut ditampung dalam botol film yang selanjutnya dilakukan analisis kandungan Cr2O3 dan proteinnya.
Pemeliharaan ikan pada uji kinerja pertumbuhan menggunakan 20 buah akuarium berukuran 100x50x40 cm dengan volume air sebanyak 160 L/akuarium dan padat penebaran sebanyak 15 ekor/akuarium dengan pergantian air sebanyak 30% setiap 4 hari sekali. Pakan diberikan secara at satiation dengan frekuensi sebanyak 3 kali sehari, yaitu pada pukul 07.00, 12.00 dan 17.00 WIB selama 50 hari masa pemeliharaan. Pada awal dan akhir pemeliharaan, dilakukan analisis proksimat tubuh ikan uji. Selama masa pemeliharaan, nilai kualitas air yang digunakan meliputi suhu air berkisar 27.5-31.5ºC, pH 6.88-8.62 dan DO 7.36 mg/L). Pada akhir masa pemeliharaan, ikan dipuasakan selama 1 hari kemudian ditimbang bobotnya, kemudian diambil beberapa ekor ikan dari setiap perlakuan untuk menguji parameter-parameter yang diperlukan.
Parameter yang dievaluasi
10
Tingkat kelangsungan hidup (SR) dihitung berdasarkan persamaan yang dikemukakan oleh Huisman (1987), yaitu:
Ket : Nt = jumlah ikan pada akhir pemeliharaan (ekor), No = jumlah ikan pada awal pemeliharaan (ekor)
Laju pertumbuhan harian ikan dihitung berdasarkan persamaan yang dikemukakan oleh Huisman (1987), yaitu:
Ket :
LPH : Laju pertumbuhan harian (%) t : Periode pengamatan (hari)
Wt : Bobot rata-rata ikan pada akhir pemeliharaan (g) Wo : Bobot rata-rata ikan pada awal pemeliharaan (g).
Retensi protein dihitung berdasarkan persamaan yang dikemukakan oleh Takeuchi (1988), yaitu:
Ket :
F : Jumlah protein tubuh pada akhir pemeliharaan (g) I : Jumlah protein tubuh pada awal pemeliharaan (g) P : Jumlah protein yang dikonsumsiikan (g).
Retensi lemak dihitung berdasarkan persamaan yang dikemukakan oleh Takeuchi (1988), yaitu:
Ket :
F : Jumlah lemak tubuh pada akhir pemeliharaan (g) I : Jumlah lemak tubuh pada awal pemeliharaan (g) L : Jumlah lemak yang dikonsumsi (g).
11 Ket :
EP : Efisiensi pakan (%)
Wt : Bobot total ikan pada akhir pemeliharaan (g) Wo : Bobot ikan pada awal pemeliharaan (g)
Wd : Bobot total ikan yang mati selama pemeliharaan (g) F : Jumlah pakan yang diberikan selama percobaan (g).
Kimia darah
Total kolesterol
Darah ikan diambil sebanyak 0.5 ml, kemudian di sentrifugasi pada 2500 rpm selama 15 menit. Plasma darah yang didapat kemudian dimasukkan ke dalam tabung Effendorf. Setelah itu, pengukuran kolesterol dilakukan menggunakan metode CHOD-PAP (enzymatic colorimetric test for cholesterol with lipid clearing factor) dengan kit CHOLESTEROL liquicolor, merk HUMAN. Larutan blanko disiapkan sebanyak 1 ml R-Chol. Setalah itu disiapkan kembali larutan blanko yang dicampur dengan 10 μl larutan standar (200 mg/dl). Kemudian sampel
sebanyak 10 μl dicampurkan dengan 1 ml R-Chol. Selanjutnya larutan standar dan larutan sampel divortex beberapa menit kemudian diinkubasi selama 10 menit pada suhu kamar dan dibaca absorbannya menggunakan spektrophotometer pada panjang gelombang 500 nm (HITACHI – U – 2001). Rumus perhitungan total kolesterol yaitu:
Triglyserida
Darah ikan diambil sebanyak 0.5 ml, kemudian di sentrifugasi pada 2500 rpm selama 15 menit. Plasma darah yang didapat kemudian dimasukkan ke dalam tabung Effendorf. Setelah itu, pengukuran triglyserida dilakukan menggunakan metode CHOD-PAP (enzymatic colorimetric test for triglyserida with lipid clearing factor) dengan kit TRIGLYSERIDA liquicolor mono, merk HUMAN. Larutan blanko disiapkan sebanyak 1 ml R-TG. Setalah itu disiapkan kembali
larutan blanko yang dicampur dengan 10 μl larutan standar (200 mg
/dl). Kemudian
sampel sebanyak 10 μl dicampurkan dengan 1 ml R-TG. Selanjutnya larutan standar dan larutan sampel divortex beberapa menit kemudian di inkubasi selama 10 menit pada suhu kamar dan dibaca absorbannya menggunakan spektrophotometer pada panjang gelombang 500 nm (HITACHI – U – 2001). Rumus perhitungan total kolesterol yaitu:
Kadar kolesterol HDL darah ikan nila
12
larutan precipitation dicampur dengan 200 μl sampel, setelah itu larutan disentrifugasi pada 2500 rpm selama 10 menit dan diambil supernatannya.
Sebanyak 100 μl supernatan dicampur dengan 1 ml R-Chol dan divortex beberapa menit lalu diinkubasi selama 10 menit pada suhu kamar. Setelah itu, dibaca absorbannya menggunakan spektrofotometer pada panjang gelombang 500 nm (HITACHI – U – 2001). Rumus perhitungan total HDL kolesterol yaitu:
Kadar kolesterol LDL darah ikan nila
Kadar kolesterol LDL darah tidak dianalisis secara enzimatis menggunakan Test Kit. Menurut Friedwald et al. (1972), kadar kolesterol LDL dapat dihitung dengan persamaan berikut:
Keterangan :
LDL = kolesterol LDL ; HDL = kolesterol HDL ; TG = trigliserida ; TK = Total kolesterol
Analisis kadar air, lemak, glikogen pada hati dan otot serta nilai hepatosomatik indeks (HSI) (Garling dan Wilson 1997)
Analisis ini dilakukan untuk membandingkan keadaan organ hati ikan yang diberi pakan tanpa sumbangan TBBK dengan ikan yang diberi pakan dengan bahan baku TBBK, yang meliputi kadar air, lemak, glikogen hati serta nilai HSI.
Ket : * dalam bobot basah
Gambaran darah
Pengambilan sampel darah
Alat suntik dan tabung Effendorf dibilas dengan antikoagulan Na-sitrat 3.8 %. Darah ikan diambil dengan menggunakan syringe yang ditusukkan sampai tulang vertebrae dimana terdapat vena caudalis. Darah didiamkan mengalir secara kapiler lalu dihisap dengan ditarik secara perlahan. Darah yang telah diambil, dimasukkan ke dalam tabung Effendorf untuk segera diamati gambaran darahnya.
Penghitungan sel darah merah (Eritrosit)
13 penghitungan, larutan pada bagian ujung pipet yang tidak teraduk dibuang. Darah yang teraduk diteteskan kedalam hemasitometer yang telah ditutupi gelas penutup melalui bagiannya yang berlekuk hingga memenuhi seluruh bagian yang berskala. Penghitungan dilakukan di bawah mikroskop dengan perbesaran 400 kali pada 10
kotak kecil hemasitometer. Rumus penghitungan jumlah sel darah merah (Σ
SDM) :
Penghitungan sel darah putih (Leukosit)
Penghitungan dilakukan dengan mengencerkan darah dengan larutanTurk’s di dalam pipet pencampur berskala maksimum 11. Didalam pipet initerdapat bulir berwarna putih yang berfungsi sebagai pengaduk. Darah dihisap dengan pipet pencampur hingga skala 0.5, lalu dengan pipet yang sama dihisap larutan Turk’s hingga skala 11. Pipet kemudian digoyang membentuk angka delapan 3-5 menit agar darah tercampur secara merata. Sebelum dilakukan penghitungan, larutan pada bagian ujung pipet yang tidak teraduk dibuang. Darah yang telah teraduk kemudian diteteskan ke dalam hemasitometer yang telah ditutupi gelas penutup melalui bagiannya yang berlekuk hingga memenuhi seluruh bagian yang berskala. Penghitungan dilakukan di bawah mikroskop dengan perbesaran 400 kali pada 64 kotak besar hemasitometer.Rumus penghitungan jumlah sel darah putih (Σ SDP) :
Pengukuran hemoglobin menurut Wedemeyer dan Yasutake (1977) dalam Alifuddin (1999)
Pengukuran kadar hemoglobin dilakukan dengan metode Sahli. Prinsip metode ini adalah mengkonversikan hemoglobin dalam darah ke dalam bentuk asam hematin oleh asam klorida. Darah dihisap menggunakan pipet Sahli sampai skala 20 mm3, ujung pipet yang telah digunakan dibersihkan dengan tissue. Darah kemudian dipindahkan ke dalam tabung hemoglobin yang berisi HCl 0.1 N sampai skala 10 (warna kuning), lalu didiamkan 3-5 menit agar hemoglobin bereaksi dengan HCl membentuk asam hematin. Darah kemudian diaduk dan ditambahkan akuades tetes demi tetet hingga warnanya sama dengan warna standar. Pembacaan skala dilakukan dengan melihat tinggi permukaan larutan
14
yang dicocokkan dengan skala lajur G% yang berarti banyaknya hemoglobin dalam gram per 100 ml darah.
Pengukuran hematokrit menurut Anderson dan Siwicki (1993) dalam Alifuddin (1999)
Darah dihisap menggunakan tabung mikrohematokrit berlapis heparin dengan sistem kapiler. Fungsi heparin adalah untuk mencegah pembekuan darah di dalam tabung (Amlacher, 1970). Setelah darah mencapai ¾ bagian tabung, kemudian salah satu ujung tabung disumbat dengan cristoseal. Tabung kapiler yang telah berisi darah kemudian disentrifugasi pada 6000 rpm selama 5 menit. Pengukuran dilakukan dengan membandingkan volume benda darah terhadap volume seluruh darah menggunakan skalahematokrit.
Analisis kimia
Kadar air diukur dengan metode pemanasan dalam oven (105-110°C) selama 4 jam. Protein dianalisis dengan metode Kjehdal, lemak dengan metode ekstraksi menggunakan alat Soxlet, abu dengan pemanasan dalam tanur (400-600°C), serat kasar diukur dengan pelarutan dalam asam dan basa kuat serta pemanasan. Lemak tubuh dan hati dianalisis dengan menggunakan metode Folch (Takeuchi, 1988). Pengukuran Cr2O3 dan asam amino (HPLC) sesuai prosedur
AOAC (1984). Pengukuran zat anti nutrisi (HCN) dilakukan menggunakan metode titrasi (Lampiran 2).
Analisis statistik
Data dianalisis menggunakan program minitab 16.0 dengan Analysis of Variance (Anova) dan dilanjutkan dengan Uji Tuckey dengan selang kepercayaan
15
4
HASIL DAN PEMBAHASAN
Hasil
Hasil penelitian meliputi kecernaan pakan, protein darah, total kolesterol, trigliserida, LDL, HDL, jumlah konsumsi pakan, retensi protein, retensi lemak, efisiensi pakan, laju pertumbuhan harian, kelangsungan hidup, HSI, glikogen (hati dan otot), lemak (hati dan otot) dan status kesehatan ikan. Nilai kecernaan pakan berbasis sumber protein nabati yang berasal dari tepung bungkil biji karet hasil fermentasi pada ikan nila tersaji pada Tabel 6.
Tabel 6 Kecernaan protein dan total pada pakan perlakuan dengan sumbangan tepung bungkil biji karet hasil fermentasi yang berbeda
Parameter Perlakuan nyata (p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Nilai kecernaan protein dan kecernaan total yang memberikan pengaruh berbeda nyata pada perlakuan substitusi D (75% TBBK) dan E (100% TBBK) (p<0.05). Hal ini menunjukkan nilai kecernaan protein dan total yang lebih rendah dibandingkan perlakuan substitusi A (0% TBBK), B (25% TBBK) dan C (50% TBBK). Kemudian hasil analisis yang dilakukan pada profil darah ikan nila meliputi protein darah, total kolesterol darah, trigliserida, HDL dan LDL tersaji pada Tabel 7.
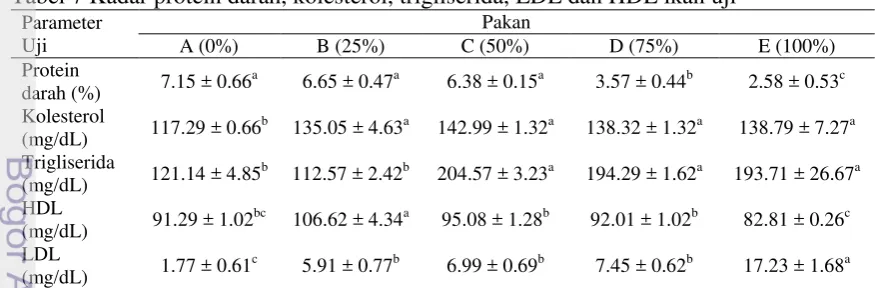
Tabel 7 Kadar protein darah, kolesterol, trigliserida, LDL dan HDL ikan uji
Parameter nyata (p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
16
TBBK berbeda nyata dan lebih tinggi dibandingkan dengan perlakuan 0%, 50%, 75% dan 100% TBBK. Sedangkan kadar LDL pada perlakuan 100% TBBK berbeda nyata dan lebih tinggi dibandingkan dengan perlakuan 0-75% TBBK. Hasil pengamatan yang dilakukan pada performa pertumbuhan ikan nila disajikan pada Tabel 8.
Tabel 8 Jumlah konsumsi pakan (JKP), retensi protein (RP), retensi lemak (RL), efisiensi pakan (EP), laju pertumbuhan harian (LPH), dan tingkat nyata (p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Jumlah konsumsi pakan tidak berbeda nyata antar perlakuan (p>0.05). Kemudian nilai retensi protein perlakuan substitusi 0-50% TBBK berbeda nyata dan lebih tinggi dibandingkan dengan substitusi 75-100% TBBK (p<0.05). Selanjutnya nilai retensi lemak perlakuan substitusi 50% TBBK berbeda nyata dan lebih tinggi dibandingkan dengan perlakuan substitusi lainnya.
Nilai efisiensi pakan dan laju pertumbuhan harian memiliki pola yang sama dimana perlakuan substitusi 0-50% berbeda nyata dan lebih tinggi dibandingkan dengan substitusi 75-100% (p<0.05). Tingkat kelangsungan hidup ikan tidak berbeda antara perlakuan substitusi 0-100% TBBK. Selanjutnya hasil pengamatan yang dilakukan pada kadar air, lemak dan glikogen hati beserta indek nyata (p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
17 berbeda nyata dengan substitusi 0-50% TBBK. Selanjutnya pengamatan yang dilakukan pada kadar air, lemak dan glikogen otot disajikan pada Tabel 10.
Tabel 10 Kadar air, lemak dan glikogen pada otot ikan nila pada berbagai nyata (p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
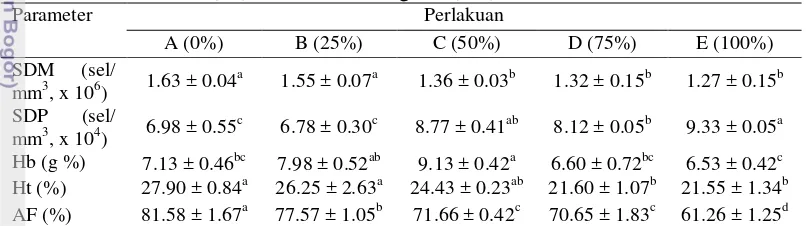
Hasil analisis kadar air otot perlakuan substitusi 100% TBBK berbeda nyata dengan perlakuan substitusi lainnya (p<0.05). Kemudian hasil analisis kadar lemak otot perlakuan substitusi 75-100% TBBK berbeda nyata dan lebih tinggi dibandingkan dengan substitusi 0-50% TBBK (p<0.05). Selanjutnya kadar glikogen otot perlakuan substitusi 100% TBBK berbeda nyata dan lebih tinggi dibandingkan dengan perlakuan lainnya (p<0.05). Selanjutnya hasil pengamatan yang dilakukan pada jumlah sel darah merah (SDM), sel darah putih (SDP), hemoglobin (Hb), hematokrit (Ht) dan aktifitas fagosit (AF) tersaji pada Tabel 11. Tabel 11 Sel darah merah (SDM), sel darah putih (SDP), hemoglobin (Hb), nyata (p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Hasil analisis SDM perlakuan substitusi 0-25% TBBK berbeda nyata dengan perlakuan 50-100% TBBK (p<0.05). Sedangkan SDP perlakuan substitusi 100% TBBK berbeda nyata dengan perlakuan lainnya (p<0.05). Kemudian kadar Hb perlakuan substitusi 50% TBBK berbeda nyata dengan perlakuan lainnya (p<0.05). Selanjutnya kadar Ht perlakuan substitusi 0-25% TBBK berbeda nyata dengan substitusi 50-100% TBBK. Aktifitas fagosit dari perlakuan yang tidak diberikan TBBK (0%) berbeda nyata dengan semua perlakuan substitusi TBBK yang ada (p<0.05).
Pembahasan
18
menurunkan kecernaan protein (86.80%) dan kecernaan total pakan (54.58%) pada ikan nila. Menurunnya kecernaan protein dan kecernaan total diduga karena adanya kandungan zat anti nutrisi yang semakin meningkat dengan bertambahnya sumbangan tepung bungkil biji karet pada pakan. Zat anti nutrisi yang terdapat pada biji karet adalah “sianogenik glikosida” yang biasa disebut “linnamarin” (Butler 1965: Lieberei et al. 1986 dalam Abdullah et al. 2012). Linamarin
mengurai bersama dengan enzim linamarase (β-glukosidase) dan hidroksinitrilliase menjadi sianida (HCN). HCN merupakan racun yang sangat kuat dan sangat cepat cara bekerjanya. Tubuh yang mempunyai lebih dari 40% sistem enzim menjadi inaktif oleh sianida (Yoserinta 1999 dalam Syamsunarno 2011). Diduga bahwa enzim pencernaan pada ikan terganggu akibat adanya paparan asam sianida tersebut. Dari hasil yang didapat, ikan nila mampu beradaptasi dengan kandungan HCN sebesar 0.023 % dalam pakan (Tabel 4).
Proses pencernaan merupakan serangkaian kegiatan mulai pakan dimakan kemudian dicerna dan diserap oleh ikan dan masuk ke dalam jaringan tubuh. Meningkatnya kecernaan pakan pada perlakuan substitusi 50% TBBK sejalan dengan tingginya kadar protein dalam plasma darah ikan. Namun, hal sebaliknya terjadi pada substitusi TBBK sebesar 75-100% yang menunjukkan rendahnya kandungan protein darah pada ikan nila. Kadar protein darah terkait dengan kemampuan ikan untuk menyerap protein dalam pakan yang digunakan sebagai bahan bakar penghasil energi untuk pertumbuhan. Protein di dalam darah tidak dapat disirkulasikan tanpa pembawa (carrier) yang sering disebut dengan lipoprotein (Colpo 2005). Pada umumnya lipoprotein terbagi menjadi dua yaitu, HDL dan LDL. Penggunaan TBBK hingga 50% dalam menggantikan tepung bungkil kedelai memberikan nilai HDL yang tidak berbeda nyata dengan perlakuan pakan kontrol. Namun hal sebaliknya terjadi pada penggunaan TBBK untuk menggantikan tepung bungkil kedelai sebesar 75% hingga 100% menunjukkan rendahnya HDL dan meningkatnya LDL. Meningkatnya LDL dalam darah diduga karena adanya perombakan protein (protein breakdown) yang memicu pembentukan lemak jenuh yang diikuti meningkatnya kadar kolesterol dan trigliserida dalam darah (Tabel 7).
19 Nilai retensi lemak yang dihasilkan menunjukkan adanya perbedaan dan cenderung turun dengan semakin bertambahnya penggunaan TBBK dalam pakan (Tabel 8). Nilai retensi lemak pada perlakuan substitusi 50% TBBK lebih tinggi daripada perlakuan substitusi 75-100% TBBK. Nilai retensi lemak yang semakin menurun menunjukkan bahwa lemak yang dimanfaatkan oleh ikan semakin tinggi, sehingga lemak yang disimpan dalam tubuh sedikit. Di dalam tubuh ikan, lemak disimpan di dalam otot dan rongga perut (Setiawati 2007). Sehingga dengan semakin menurunnya nilai retensi lemak, diduga lemak yang disimpan dalam otot dan rongga perut semakin sedikit dengan semakin bertambahnya persentase TBBK pada pakan. Hal lain yang diduga menjadi penyebab rendahnya retensi lemak karena adanya proses perombakan protein. Proses tersebut akan menghasilkan buangan metabolit. Proses penguraian sisa metabolit tersebut membutuhkan energi yang cukup besar, sehingga diduga energi yang digunakan untuk merombak tersebut berasal dari lemak. Millamema et al. (2002) mengatakan bahwa sumber energi bukan hanya berasal dari protein tetapi dari nutrien non protein seperti lemak dan karbohidrat.
Salah satu organ tubuh yang berfungsi menyimpan lemak adalah hati. Hasil pengukuran HSI menunjukkan penimbunan lemak dan glikogen pada hati ikan disetiap perlakuan pakan. Meningkatnya TBBK di dalam pakan berpengaruh terhadap meningkatnya persentase bobot hati ikan (Tabel 9). Kadar lemak hati meningkat 15.92% pada perlakuan substitusi 100% TBBK. Hal yang sama juga terjadi pada kadar glikogen hati, yaitu substitusi sebesar 100% TBBK menunjukkan kadar glikogen yang paling tinggi sebesar 0.21% dibandingkan dengan perlakuan substitusi lainnya. Semakin bertambahnya persentase lemak dan glikogen hati sejalan dengan bertambahnya bobot hati atau nilai hepatosomatik indeks. Menurut Ali dan Al-Asgah (2001), bahwa nilai HSI pada ikan nila dipengaruhi oleh karbohidrat dan lemak pakan masing-masing pada kandungan 16.84% dan 5.19% dan.
Karbohidrat juga dapat disimpan dalam tubuh ikan, khususnya pada otot dalam bentuk glikogen atau dikonversi menjadi lemak. Kadar lemak otot meningkat seiring meningkatnya persentase substitusi TBK dengan TBBK (Tabel 10). Kadar lemak otot tertinggi terdapat pada perlakuan substitusi 100% TBBK sebesar 1.46% dan terendah pada perlakuan kontrol (0% TBBK) sebesar 1.22%. Kadar glikogen tertinggi juga terdapat pada perlakuan substitusi 100% TBBK sebesar 0.91% sedangkan yang terendah terdapat pada perlakuan kontrol (0% TBBK) sebesar 0.13%. Ikan nila cenderung menyimpan sisa energi dalam bentuk glikogen, sedangkan ikan patin cenderung mengkonversi glukosa menjadi lemak (Furuichi dan Yone 1981).
Nilai efisensi pakan dengan substitusi TBK dengan TBBK hingga 50% memberikan nilai efisiensi pakan yang lebih baik dibandingkan dengan perlakuan substitusi 75-100% (Tabel 8). Penggunaan bahan baku nabati sebagai sumber protein dihadapkan pada permasalahan adanya zat anti nutrisi dan keberadaan selulosa serta hemiselulosa yang sukar dicerna oleh ikan sehingga ketersediaan energi dan nutrien pakan menjadi rendah (Lee et al. 2002). Menurunnya efisiensi pakan dengan bertambahnya proporsi TBBK dalam pakan berpengaruh terhadap nilai laju pertumbuhan harian.
20
pertumbuhan diduga akibat adanya zat anti nutrisi (HCN) pada bahan baku biji karet. HCN ini bersifat toksik yang menimbulkan gangguan fisiologik. Pada sebagian besar spesies hewan, dosis letal minimum untuk HCN yang diberikan melalui pakan berkisar antara 2.0-2.3 mg/kg. Kandungan 1.4 μg/g HCN pada hati dapat dilihat sebagai indikasi keracunan sianida (Inara 2011). Shwetha dan Hosetti (2009) melaporkan bahwa konsentrasi HCN pada lingkungan perairan sebesar 343
μg/l mengurangi aktifitas renang, hilangnya keseimbangan, pernafasan cepat dan gangguan pada sistem osmoregulasi sedangkan pada konsentrasi 350 μg/l menyebabkan kematian.
TBBK mengandung zat anti nutrisi seperti asam sianida, sehingga diperlukan pengamatan status kesehatan ikan. Svobodova dan Vyukusova (1991) menjelaskan bahwa pemeriksaan darah dapat membantu untuk memantapkan tujuan diagnostik, beberapa diantara tujuan tersebut adalah untuk mengevaluasi kondisi ikan, menguji efek zat beracun pada ikan, untuk menguji pantas tidaknya pakan untuk ikan dan mengevaluasi efek tekanan situasi. Pengamatan dari jumlah sel darah merah (SDM) ikan pada penelitian ini, menunjukkan adanya penurunan SDM dengan penambahan TBBK pada pakan perlakuan (Tabel 11). SDM tertinggi terdapat pada perlakuan kontrol (0% TBBK) sebesar 1.63x106 sel/mm3 dan terendah pada perlakuan substitusi 100% TBBK sebesar 1.27x106 sel/mm3. Pada ikan yang normal, jumlah sel darah merah berkisar antara 1.05 - 3.00 x106 sel/mm3 (Robert 1978). Kadar hemoglobin menentukan tingkat ketahanan tubuh ikan karena erat hubungannya dengan daya ikat oksigen oleh darah (Siakpere et al. 2005). Kadar Hb tertinggi terdapat pada perlakuan kontrol (0% TBBK) sebesar 7,13% dan terendah pada perlakuan substitusi 100% TBBK sebesar 6,53%. Wells et al. (2005) mengatakan bahwa 1 gram hemoglobin dapat mengikat kira-kira 1.34 ml oksigen.
Sel darah putih (SDP) merupakan sel darah yang berperan dalam sistem kekebalan tubuh. Pengamatan yang dilakukan pada jumlah sel darah putih dalam penelitian ini menunjukkan adanya peningkatan sel darah putih dengan bertambahnya TBBK dalam pakan perlakuan (Tabel 11). Jumlah sel darah putih tertinggi terdapat pada perlakuan substitusi 100% TBBK sebesar 9.33 x104 sel/mm3 dan terendah pada perlakuan substitusi 25% TBBK sebesar 6.78 x106 sel/mm3. Jumlah sel darah putih pada ikan berkisar antara 20.000-150.000 sel/mm3 darah (Rastogi 1977). Pada ikan sehat, jumlah dan proporsi masing-masing komponen darah relatif konstan.
Hematokrit merupakan perbandingan antara sel darah merah dengan plasma darah, serta berpengaruh terhadap pengaturan sel darah merah. Kadar Ht tertinggi terdapat perlakuan kontrol (0% TBBK) sebesar 27.90% dan terendah terdapat pada perlakuan substitusi 100% TBBK sebesar 21.55%. Peningkatan kadar hematokrit ini dipengaruhi oleh dua faktor yaitu perubahan parameter lingkungan terutama suhu perairan serta keadaan fisiologi ikan terkait dengan energi yang dibutuhkan (Jawad et al. 2004).
21 penelanan dan tahap pencernaan. Pada penelitian kali ini dilakukan pengamatan aktivitas fagositik dalam darah pada tiap perlakuan. Aktivitas fagositik tertinggi terdapat pada perlakuan kontrol (0% TBBK) sebesar 81.58% sedangkan yang terendah terdapat pada perlakuan substitusi 100% TBBK sebesar 61.26%. Hal ini diduga memberikan pengaruh terhadap pemberian TBBK pada tiap perlakuan pakan sehingga terjadinya penurunan aktivitas fagositik.
5
SIMPULAN
Simpulan
Tepung bungkil biji karet hasil fermentasi dengan cairan rumen domba mampu menggantikan peranan tepung bungkil kedelai hingga 50% sebagai sumber protein nabati utama pada pakan ikan nila.
DAFTAR PUSTAKA
Abdullah BM, Salimon J, Yousif E, Salih N. 2012. Occurrences of cyanogenic glycoside and cyanide in the Malaysian rubber seed oil. Journal of The Association of Arab Universities fo Basic and Applied Sciences.
Alifuddin, M. 1999. Peran imunostimulan (lipopolisakarida, Saccaromyces cerevisiae & levamisol) pada gambaran respon imunitas ikan jambal siam Pangasius hypophthalmus Fowler. [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Ali A, Al-Asgah NA. 2001. Effect of feeding different carbohydrate to lipid rations on the growth performance and body compositition of Nile tilapia (Oreochromis niloticus) fingerlings. Journal Animal Res. 50: 91-100. Amlacher E. 1970. Textbook of Fish Disease. DA Conroy, RL Herman
(Penerjemah). TFH Publ. Neptune. New York. 1: 1-14
Anderson P.S. 1995. Patofisiologi Konsep Klinis Proses-Proses Penyakit. Alih bahasa: Peter Anugerah. Jakarta: EGC. Penerbit Buku Kedokteran.
[AOAC] Association of Official Analytical Chemist. 1984. Official Methods ofAnalysis, 14th ed. AOAC. Airlington, V. A. 1141 pp.
Aritama P. 2012. Evaluasi kecernaan bungkil biji karet, kulit buah kakao, dan bonggol jagung yang difermentasi dengan cairan rumen domba pada ikan nila [skripsi]. Bogor: Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Boyer R.F. 2002. Concepts In Biochemistry. 2nd Edition. Thomson Learning, Inc., New York.
22
Colpo A. 2005. LDL cholesterol: bad cholesterol or science cholesterol. Journal of American physicians and surgeons. 10: 83-89.
Data Statistik Kelautan dan Perikanan. 2012. Statistik Perikanan Tangkap, Perikanan Budidaya dan Ekspor – Impor Setiap Provinsi Seluruh Indonesia.
Departemen Pertanian. 2012. Produksi, luas areal dan produktivitas perkebunan di Indonesia. www.deptan.go.id. [17 Oktober 2013].
Dirjen Perkebunan. 2004. Statistik Perkebunan Karet Indonesia 2002-2004. Direktorat Jendral Perkebunan. Jakarta.
El-Sayed. 2006. Tilapia Culture. CABI Publishing. Wallingford. Pp 293.
Eyo JE, Ezechie CU. 2004. The effect of rubber seed (Hevea Brasiliensis) meal based diets on diet acceptability and growth oerformance of Heterobanchius bidorsalir and Clarias gariepenus Hybrid. Journal of Sustainable Tropical Agriculture Research, 10: 20-25.
Fitzsimmons K. 1997. Introduction to tilapia nutrition in tilapian aquaculture. Proceeding from the fourth international symposium on tilapia aquaculture. Orlando (Florida). 1 : 9-2.
Friedwald WT, Levy RI dan Fredrickson DS. 1972. Estimation of the concentration of low-density lipoprotein cholesterol in plasma without the use of preparative ultracentrifuge. Clin.Chem. 18: 499-502.
Furuichi M. 1988. Dietary Requirements, p.8-78. In Watanabe, T, ed. Fish Nutrition and Marinculture. Departement of Aquatic Bioscience. Tokyo University of Fisheries. JICA.
Furuichi M, Yone Y. 1981. Change of blood sugar and plasma insulin levels of fishes in glucose tolerance test. Bull. Jpn. Soc. Sci. Fish. 47: 761-764. Garling DR Jr, Wilson RP. 1977. Effects of dietary carbohydrate to lipid ratio
on growth and body composition of fingerling channel catfish. Prog. Fish Cult. 39: 43-47.
Gunawan R. 1993. Potensi Ekstraksi Daging Biji Karet (Havea brasiliensis, Muell. Arg.) Dalam Pengangkutan Ikan Bandeng (Chanos chanos) [skripsi]. Bogor: Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Hadadi A, Herry, Setyorini E, Ridwan. 2007. Pemanfaatan limbah sawit untuk bahan baku pakan ikan. Jurnal Budidaya Air Tawar. 4: 11-12.
Halver JE, Hardy RW. 2002. Fish Nutrition. Third Edition. Academic Press Inc. California USA. 822pp. Temalosailisha. Journal Animal Biodiversity an Concervation. 27: 47-52 Jobling M, Gomez D, Diaz J. 2002. Feeds Types Manufacturer and Ingredient. In
Houlihan D, Boujard T, Jobling M, eds. Food intake fish. Blackwell Science Ltd. Osney Mead. Oxford, p: 31-39.
23 Laurencio BA. 2002. Cholesterol, part one: a patient guide.
http://www.heartinfo.org [4 Juni 2013].
Law AT, Cheah SH, Ang KJ. 1985. An Evaluation of The Apparent Digestibility of Some Locally Available Plants and Pelleted Feed in Three Finfish in Malaysia. In Cho CY, Cowey CB, Watanabe T. Eds. Finfish Nutrition in Asia: Methodological Approaches to Research and Development . IDRC, Ottawa, p: 90-95.
Lee SS, Kim CH, Ha JK, Moon YH, Choi NJ and Cheng KJ. 2002. Distribution and activities of hydrolytic enzymes in the rumen compartements of hereford bulls fed alfalfa based diet. Journal Anim. Sci. 15: 1725-1731. Huisman EA, 1987. The Principles of Fish Culture Production. Departement of.
Aquaculture. Wegeningen University, Netherland.
Millamema, Oseni M, Relicado M. Coloso and Felicitas P. Pascual. 2002. Nutrition in Tropical Aquaculture. Southeast Asian Fisheries Development Center. Tigbauan, Iloilo, Philippines.
Mulyati. 2003. Pengaruh penggunaan bungkil biji karet yang difermentasi dengan ragi tempe dan oncom dalam ransum terhadap kualitas daging ayam broiler [tesis]. Semarang: Program Pascasarjana, Universitas Diponogoro. Muray DD. 2004. Canola protein concentrate as a feed ingredient for salmonid
fish. In: Cruz Suarez, L. E., Ricque Marie, D,.Nieto Lopez, M. G., Villarreal, D,. Scolzs, U. Y Gonzales, M. 2004. Avances an nutricion acuicola VII. Memories del VII symposium Internacionale de Nutriticion acuicola, 2004. Hermosillo, Sonora. Mexico.
Murni R, Suparjo, Akmal, B. L. Ginting. 2008. Buku ajar teknologi pemanfaatan limbah untuk pakan. Fakultas Peternakan. Universitas Jambi. Jambi. NRC. 1983. Nutrient Requirement of Warmwater Fishes dan Shellfishes (Rev.
Randal DJ. 1970. The circulatory system. P: 133-172. Di dalam: WS Hoar and D J Randal (eds.). Fish Physiology. Vol 4. Academic Publs. London.
Rastogi SC. 1977. Essential of Animal Physiology. Wiley Eastern Limited. New Delhi, Belangmore, Calcutta. P : 204-233.
Randall DJ. 1970. The Circulatory System. Didalam : Hoar WS, Randall DJ (Eds). Fish Physiology. Vol IV. Academic Publs. London. P: 133-172.
Robert RJ. 1978. The Pathophysiology and Systematic Pathology of Theleost. Dalam: Roberts RJ (editor). Fish Pathology. Balliere Tindall. London. Santos RD., Hueb W, Oliveira AA, Ramires JAF dan Manhao RC. 2003. Plasma
kinetics of cholesterol-rich emulsion in subjects with or without coronary artery disease. Journal Lipid Res. 44: 464-469.
Setiawati M, Nuraeni C, Jusadi D. Penggunaan lemak patin dalam pakan ikan nila (Oreochromis niloticus). Jurnal Akuakultur Indonesia. 6(1): 89-95.
24
Siahaan S. 2009. Potensi pemanfaatan limbah biji karet (Hevea bransiliensis) sebagai sumber energi alternative biokerosin untuk keperluan rumah tangga. [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Siakpere OK, Ake JEG, Idoge E. 2005. Haematological characteristics of african snakehead Parachanna obscura. Africa J. Biotechnology. 4: 527-530. Sinurat AP. 2010. Teknologi pemanfaatan hasil samping industri sawit untuk
meningkatkan ketersediaan bahan pakan unggas nasional. Orasi Ilmiah. Bogor, 31 Maret 2010. Balai Penelitian Ternak, Ciawi Bogor – Jawa Barat. Sun K, Jiang JC. 2010. Preparation and characterization of actived carbon from
rubber-seed shell by physical activation with steam. Journal Biomass and Bioenergy. 34: 539-544.
Suprayudi MA, Dimahesa W, Jusadi D, Setiawati M, Ekasari J. 2011. Suplementasi crude enzim rumen domba pada pakan berbasis sumber protein nabati dalam memacu pertumbuhan ikan nila (Oreochromis niloticus). Jurnal Ikhtiologi Indonesia. 11(2): 177-183.
Suprayudi MA. 2010. Pengembangan penggunaan bahan baku lokal untuk pakan ikan atau udang: Status Terkini dan Prospeknya. Makalah disajikan pada Semi Loka Nutrisi dan teknologi pakan ikan atau udang. Bogor, 26 Oktober 2010. Badan Litbang Kelautan dan Perikanan, KKP bekerja. Suprayudi MA, Bintang M, Takeuchi T, Mokoginta I, and Sutardi T. 1999.
Defatted soybean meal as an alternatif source to subtitute fish meal in the feed of giant gouramy (Osphronemus gouramy Lac.). Sanzoshoku. 47(5): 807-811.
Suprayudi MA, Takeuchi T, Mokoginta I, and T Kartikasari. 2000. The effect of additional arginine in the high deffated soybean meal diet on the growth giant gouramy (Osphronemus gouramy Lac.). Fisheries Sciece. 66(4): 551-557.
Syamsunarno MB. 2011. Evaluasi tepung biji karet Hevea brasiliensis sebagai bahan baku pakan ikan lele Clarias sp. [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Svobodova Z, Vyukusova B. 1991. Diagnostic, prevention and therapy of fish disease and intoxication. Research institute of fish culture and hydro-biology vodnany. Czechoslovakia.
Takeuchi T, Satoh S, Kiron V. 2002. Common Carp Nutrition and Requirements. New York: CABI Publishing.
Watanabe T. 1988. Fish Nutrition and Mariculture. Departement of Aquatic Bioscience. Tokyo University of Fisheries. JICA.
26
27 Lampiran 1 Prosedur analisis proksimat bahan pakan dan tubuh ikan
A. Kadar Protein Tahap Oksidasi
1. Sampel ditimbang sebanyak 0.5 gram dan dimasukkan ke dalam labu Kjeldahl. 2. Katalis (K2SO4+CuSo4.5H2O) dengan rasio 9:1 ditimbang sebanyak 3 gram
dan dimasukkan ke dalam labu Kjeldahl.
3. 10 ml H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan kemudian labu
tersebut dipanaskan dalam rak oksidasi/digestion pada suhu 400oC selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening. 4. Larutan didinginkan lalu ditambahkan air destilasi 100 ml. Kemudian larutan
dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 ml. Larutan sampel siap didestilasi.
Tahap Destilasi
1. Beberapa tetes H2SO4 dimsukkan ke dalam labu, sebelumnya labu diisi
setengahnya dengan akuades untuk menghindari kontaminasi oleh ammonia lingkungan. Kemudian didihkan selama 10 menit.
2. Erlenmeyer diisi 10 ml H2SO4 0.05 N dan ditambahkan 2 tetes indicator methyl
red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
3. 5 ml larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan akuades dan ditambahkan 10 ml NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup.
4. Campuran alkaline dalam labu destilasi disuling menjadi uap air selama 10 menit terjadi pengembunan pada kondensor.
5. Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu, diatas permukaan larutan. Kondensor dibilas dengan akuades selama 1-2 menit.
Tahap Titrasi
1. Larutan hasil destilasi ditritasi dengan larutan NaOH 0.05 N. 2. Volume hasil titrasi dicatat.
3. Prosedur yang sama juga dilakukan pada blanko.
Kadar Protein (%) = 0.0007 * x (Vb – Vs) x 6.25 ** x 20 x 100%
S
28
2. Sampel ditimbang sebanyak 3-5 gram (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya.
3. N-hexan 100-150 ml dimasukkan ke dalam soxhlet sampai selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4. Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath sampai cairan yang merendam sampel dalam soxhlet berwarna bening.
5. Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap.
6. Labu dan lemak yang tersisa dipanakan dalam oven selama 15-60 menit, kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2)
Metode Folch
1. Labu silinder dioven terlebih dahulu pada suhu 110oC selama 1 jam, didinginkan dalam desikaotr selama 30 menit kemudian ditimbang (X1).
2. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam gelas homogenize dan ditambahkan larutan kloroform / methanol (20xA) , sebagian disisakan untuk membilas pada saat penyaringan.
3. Sampel dihomogenizer selama 5 menit setelah itu disraing dengan vacuum pump.
4. Sampel yang telah disaring tersebut dimasukkan dalamlabu pemisah yang telah diberi larutan MgCl2 0.03 N(0.2xC), kemudian dikocok dengan kuat
minimal selama 1 menit kemudian ditutup dengan aluminium foil dan didiamkan selama 1 malam.
5. Lapisan bawa yang terdapat dalam labu pemisah disaring ke dalam labu silinder kemudian dievaporator sampai kering. Sisa kloroform / methanol yang terdpat dalam labu ditiup dengan menggunakan vacuum setelah itu ditimbang (X2)
Kadar Lemak (%) = X2–X1 x 100%
A
C. Kadar Air
1. Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam dessikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipansakan dalam oven pada suhu 110oC selama 4 jam kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
Kadar Air (%) = (X1+A)-X2 x 100%
A
D. Kadar Abu
1. Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
29 Kadar Abu (%) = X2–X1 x 100%
A
E. Kadar Serat Kasar
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110oC setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1)
2. Sampel ditimbang sebnayak 0.5 gram (A) dimasukkan kedalam Erlenmeyer 250 ml
3. H2SO4 0.3 N sebanyak 50 ml ditambahkan ke dalam Erlenmeyer kemudian
dipanaskan di atas pembakar Bunsen selama 30 menit. Setelah itu NaOH 1.5 N sebanyak 25 ml ditambahkan ke dalam Erlenmeyer dan dipanskan kembali selama 30 menit.
4. Larutan dan bahan yang telah dipanaskan kemudian disraing dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5. Larutan dan bahan yang ada pada corong Buchner kemudaian dibilas secara
berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0.3 N, 50 ml air panas, dan
25 ml acetone.
6. Kertas saring dan isinya dimasukkan dalam cawan porselin, lalu dipanaskan dalam oven 105-110oC selama 1 jam kemudian didinginkan dalam desikator 5-15 menit dan ditimbang (X2).
7. Setelah itu dipanaskan dalam tanur 600oC hingga berwarna putih atau menjadi abu (± 4 jam). Kemudian dimasukkan dalam oven 105-110oC selama 15 menit, didinginkan dalam desikator selama 5-15 menit dan ditimbang (X3).
Kadar Serat Kasar (%) = (X2– X1– X3) x 100%
A Lampiran 2. Prosedur analisis asam sianida pada pakan.
Reagen/Pereaksi :
1. Buffer CN ( 138 gram NaH2PO4.H2O dilarutkan menjadi 1 liter aquadest)
2. Chloramin T 1% ( 1 gram dilarutkan menjadi 100 ml aquadest) 3. Asam Barbiturat – Pyridin ( 3 gram asam barbiturat ditambah 15 ml
pyridin dan 3 ml HCl 37%, ditambahkan aquadest hingga volumenya 50 ml)
Metode Kerja :
1. Sampel sebanyak ± 1 gram , dilarutkan dengan aquadest sebanyak 10 ml, ditutup dan didiamkan semalam.
2. Sampel disentrifuge dengan kecepatan 5000 rpm.
3. Supernatan sampel dipipet sebanyak 0.1 ml, lalu dimasukkan kedalam tabung reaksi dan ditambahkan aquadest sebanyak 1.9 ml.
4. Dimasukkan kedalamnya 2 ml larutan buffer CN dan 0.5 ml Chloramin T 1%.
5. Divortex/dihomogenkan dan didiamkan selama 2 menit. Setelah itu ditambahkan 0.5 ml larutan asam barbiturat-pyridin, kemudian dihomogenkan kembali.
30
7. Lalu larutan sampel dan standar siap diukur pada spektrofotometer dengan panjang gelombang 578 nm.
Lampiran 3. Analisis proksimat bahan pakan (% bobot basah).
Bahn Baku Air Protein Lemak Abu Serat
Kasar BETN Bungkil Biji Karet 10.85 35.28 12.44 4.41 8.83 28.72 Pollard 11.14 14.44 3.395 6.31 13.05 51.65 Bungkil Kedelai 10.44 43.64 2.14 6.28 4.58 32.94 Tepung Ikan 10.88 51.84 2.96 22.825 6.32 5.17 MBM 8.39 53.28 11.74 17.16 0.4 9.03
Prosin 8 44 6.1 12 2.4 27.5
Minyak 2 0 98 0 0 0
Premix 0 3 1 50 30 16
31
RIWAYAT HIDUP
Penulis dilahirkan di Mataram 20 Januari 1989 dari Ayah H. Muhammad Ichsan dan Ibu Hj. Siti Zuardiah. Penulis merupakan anak kelima dari lima bersaudara. Penulis menyelesaikan pendidikan dasar di SD Negeri 26 Mataram pada tahun 2000. Tahun 2003 penulis berhasil menyelesaikan pendidikan lanjutan pertama di SLTP Negeri 2 Mataram. Pada tahun 2006 penulis berhasil menyelesaikan pendidikan di SMU Negeri 5 Mataram. Pada tahun yang sama, penulis lulus seleksi masuk IPB jalur Beasiswa Utusan Daerah dan memilih mayor Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Kemudian tahun 2010 penulis berhasil menyelesaikan pendidikan sarjana (S1).