SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI
EKSTRAK DAUN DARI TUMBUHAN PACAR AIR (Impatiens
balsamina L.) TERHADAP BAKTERI Staphylococcus aureus,
Staphylococcus epidermidis DAN Pseudomonas aeruginosa
SKRIPSI
OLEH: PUSPA UTARI NIM 091524066
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK DAUN DARI TUMBUHAN PACAR AIR (Impatiens balsamina L.) TERHADAP
BAKTERI Staphylococcus aureus, Staphylococcus epidermidis DAN Pseudomonas aeruginosa
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: PUSPA UTARI NIM 091524066
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN SKRIPSI
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK DAUN DARI TUMBUHAN PACAR AIR (Impatiens balsamina L.) TERHADAP
BAKTERI Staphylococcus aureus, Staphylococcus epidermidis DAN Pseudomonas aeruginosa
OLEH: PUSPA UTARI NIM 091524066
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : Juni 2011
Pembimbing I, Panitia Penguji,
Drs. Suryadi Achmad, M.Sc., Apt. Dra. Masfria, M.Si., Apt.
NIP 195109081985031002 NIP 195707231986012001
Pembimbing II, Drs. Suryadi Achmad, M.Sc., Apt.
NIP 195109081985031002
Drs. Awaluddin Saragih, M.Si., Apt.
NIP 195008221974121002 Dra. Suwarti Aris, M.Si., Apt.
KATA PENGANTAR
Alhamdulillah, penulis ucapkan atas ke hadirat Allah SWT Yang Maha
Agung yang telah melimpahkan rahmat, hidayah dan kemudahan kepada penulis
sehingga dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul
“Skrining Fitokimia dan Uji Aktivitas Antibakteri Eksrak Daun Dari Tumbuhan
Pacar Air (Impatiens balsamina L.) Terhadap Bakteri Staphylococcus aureus,
Staphylococcus Epidermidis dan Pseudomonas aeruginosa” sebagai salah satu syarat
untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera
Utara.
Dengan kerendahan hati penulis mengucapkan terma kasih yang tulus kepada
kedua orangtua tercinta Tasrif Saka dan Rahayu, untuk kakak dan adikku tersayang
Wewet Witarsa, Nuriman Jaya Tarsa, Indera Permana Tarsa, Nugraha Adya Putra
Tarsa, Yuda priyatna Tarsa dan Aditya Tarsa atas dukungan doa, semanagat dan
pengorbanan baik moril maupun materil. Semoga Allah SWT selalu melindungi.
Pada kesempatan ini penulis menyampaikan terima kasih yang
sebesar-besarnya kepada Bapak Drs. Suryadi Achmad,M.Sc., Apt. dan Bapak Drs. Awalludin
Saragih,M.Si., Apt. yang telah membimbing dengan penuh kesabaran dan ikhlas,
sehingga penelitian dan penulisan skripsi ini dapat diselesaikan.
Penulis juga menyampaikan ucapan terima kasih kepada :
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt. Selaku Dekan Fakultas Farmasi
Universitas Sumatera Utara yang telah memberikan bantuan dan fasilitas selama
2. Ibu Dra. Saleha Salbi,M.Si,. Apt. selaku pembimbing akademik yang telah
membimbing dan member semangat kepada penulis selama menjalani pendidikan.
3. Ibu Dra. Masfria,M.Si,. Apt., Ibu Dra. Suwarti Aris,M.Si,. Apt., dan Ibu Aswita
Hafni Lubis,M.Si,. Apt. selaku dosen penguji yang telah memberikan saran
hingga selesainya skripsi ini.
4. Bapak Kepala Laboratorium Obat Tradisional Fakultas Farmasi dan Laboratorium
Kesehatan Medan yang telah memberikan fasilitas kepada penulis dalam
menyelesaikan penelitian.
5. Bapak dan Ibu staf pengajar Fakultas Farmasi USU yang telah membina dan
mendidik penulis selama menjalani pendidikan.
6. Teman-teman mahasiswa/i Farmasi khususnya Ekstensi angkatan 2008 dan 2009
yang telah membantu dan memberikan semangat seingga penelitian dan penulisan
skripsi ini dapat diselesaikan.
7. Fadliyata yang telah memberikan semua doa, kasih saying dan semangat yang
luar biasa dalam menyelesaikan skripsi ini.
8. Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu
penulis dalam menyelesaikan penelitian dan penulisan skripsi ini.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan, oleh karena
itu penulis bersedia menerima saran dan kritik yang membangun dari pembaca.
Semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang Farmasi.
Medan, Juni 2011
Penulis
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK DAUN DARI TUMBUHAN PACAR AIR (Impatiens balsamina L.) TERHADAP
BAKTERI Staphylococcus aureus, Staphylococcus epidermidis DAN Pseudomonas aeruginosa
Abstrak
Daun tumbuhan pacar air (Impatiens balsamina L.) merupakan salah satu
bagian tumbuhan yang perlu dikembangkan manfaatnya, secara tradisional digunakan
sebagai obat pencuci luka, nyeri haid, keputihan dan infeksi pada kulit. Selama ini
masyarakat hanya mengenal tumbuhan ini sebagai tumbuhan hias, dan ternyata
selain itu tumbuhan ini dapat dimanfaatkan sebagai tumbuhan obat. Oleh karena itu
perlu dilakukan penelitian terhadap daun pacar air.
Pada penelitian ini dilakukan pemeriksaan karakterisasi, skrining fitokimia
dan uji aktivitas antibakteri ekstrak daun pacar air terhadap bakteri Staphylococcus
aureus, Staphylococcus epidermidis dan Pseudomonas aeruginosa yang dilakukan
secara invitro dengan metode difusi agar menggunakan kertas cakram.
Hasil skrining fitokimia dari simplisia dan ekstrak daun pacar air
menunjukkan adanya senyawa flavonoida, steroida dan saponin. Ekstrak daun pacar
air mempunyai aktivitas antibakteri. Aktivitas antibakteri dari ekstrak daun pacar air
menunjukkan konsentrasi hambat minimum (KHM) pada bakteri Staphylococcus
aureus sebesar 12 mg/ml, pada bakteri Staphylococcus epidermidis sebesar 24 mg/ml
dan pada bakteri Pseudomonas aeruginosa sebesar 24 mg/ml. Sedangkan batas
daerah hambat yang efektif dengan diameter 14,5 mm pada konsentrasi 60 mg/ml
untuk bakteri Staphylococcus aureus, diameter 14,2 mm pada konsentrasi 60 mg/ml
untuk bakteri Staphylococcus epidermidis dan diameter 14,4 mm pada konsentrasi
60 mg/ml untuk bakteri Pseudomonas aeruginosa.
Kata kunci : Skrining, Ekstrak Daun Pacar Air, Antibakteri, Staphylococcus
PHYTOCHEMICAL SCREENING AND ANTIBACTERIAL ACTIVITY TEST OF EXTRACT HENNA WATER LEAVES (Impatiens balsamina L.) WITH RESPECT TO Staphylococcus aureus, Staphylococcus epidermidis AND
Pseudomonas aeruginosa
Abstract
The leaf of henna water (Impatiens balsamina L.) is one of the plants that
need to be developed benefits, traditionally used as a drug wash wounds, menstrual
pain, vaginal discharge and infection of the skin. As long as this society are only
familiar with this plant as an ornamental plant, and in fact other than that this plant
can be used as a medicinal plant. Therefore it needs to do research on henna water
leaf.
In this research was conducted at the characteristic, phytochemical screening
and examination antibacterial activity of extract the henna leaves water against
Staphylococcus aureus, Staphylococcus epidermidis and Pseudomonas aeruginosa
that was conducted as invitro agar diffusion method by using the disc paper.
The result of phytochemical screening of crude drugs and extracts of henna
leaves indicate water flavonoida compounds, steroid and saponin. Henna leaf water
extract has antibacterial activity. Antibacterial activity of water extract of henna
leaves showed a minimum inhibitory concentration (MIC) of the Staphylococcus
aureus bacterium at 12 mg/ml, the Staphylococcus epidermidis bacterium at 24
mg/ml and the Pseudomonas aeruginosa bacterium at 24 mg/ml. While the limit of
effective inhibition area with a diameter of 14,5 mm at a concentration of 60 mg/ml
for Staphylococcus aureus, 14,2 mm diameter at a concentration of 60 mg/ml for
Staphylococcus epidermidis and a diameter of 14,4 mm at a concentration of 60
mg/ml to Pseudomonas aeruginosa.
Keyword : Screening, Extract Henna Water Leaf, Antibacterial, Staphylococcus
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Uraian Tumbuhan ... 4
2.1.1 Morfologi Tumbuhan ... 4
2.1.2 Sistematika Tumbuhan ... 4
2.1.3 Nama Daerah ... 5
2.1.4 Kandungan Kimia ... 5
2.1.5 Khasiat Tumbuhan ... 5
2.2.1 Flavonoida ... 5
2.2.2 Saponin ... 6
2.2.3 Steroida ... 7
2.2.4 Glikosida ... 7
2.3 Ekstrak ... 8
2.3.1 Pengertian... 8
2.3.2 Metode Ekstraksi ... 9
2.4 Uraian Bakteri ... 10
2.4.1 Pertumbuhan Bakteri ... 11
2.4.2 Media Pertumbuhan Bakteri ... 12
2.4.3 Fase Pertumbuhan Bakteri ... 14
2.4.4 Bakteri Staphylococcus aureus ... 15
2.4.5 Bakteri Staphylococcus epidermidis... 16
2.4.6 Bakteri Pseudomonas aeruginosa ... 17
2.6.7 Pengukuran Aktivitas Antibakteri ... 17
BAB III METODE PENELITIAN ... 19
3.1 Lokasi dan Waktu Penelitian ... 19
3.2 Metode Penelitian ... 19
3.3 Alat dan Bahan ... 19
3.3.1 Alat ... 19
3.3.2 Bahan ... 20
3.4 Pembuatan Larutan Pereaksi ... 20
3.4.1 Larutan Pereaksi Mayer ... 20
3.4.3 Larutan Pereaksi Bouchardat ... 20
3.4.4 Larutan Pereaksi Lieberman-Bourchard ... 21
3.4.5 Larutan Pereaksi Molish ... 21
3.4.6 Larutan Pereaksi Timbal (III) Asetat 0,4 M ... 21
3.4.7 Larutan Pereaksi Besi (III) Klorida 1 % ... 21
3.4.8 Larutan Pereaksi Asam Sulfat 2 N ... 21
3.4.9 Larutan Pereaksi Asam Klorida 2 N ... 21
3.4.10 Larutan Pereaksi Kloralhidrat ... 21
3.5 Penyiapan Bahan Tumbuhan ... 22
3.5.1 Identifikasi Tumbuhan ... 22
3.5.2 Pengumpulan Tumbuhan ... 22
3.5.3 Pembuatan Simplisia ... 22
3.6 Pemeriksaan Karakteristik Simplisia ... 23
3.6.1 Pemeriksaan Makroskopik ... 23
3.6.2 Pemeriksaan Mikroskopik ... 23
3.6.3 Penetapan Kadar Air ... 23
3.6.4 Penetapan Kadar Sari yang Larut dalam Air .... 24
3.6.5 Penetapan Kadar Sari yang Larut dalam Etanol.. 24
3.6.6 Penetapan Kadar Abu Total ... 25
3.6.7 Penetapan Kadar Abu yang Tidak Larut Asam ... 25
3.7 Skrining Fitokimia ... 25
3.7.1 Pemeriksaan Glikosida ... 25
3.7.2 Pemeriksaan Alkaloida ... 26
3.7.4 Pemeriksaan Flavonoida ... 27
3.7.5 Pemeriksaan Tanin ... 27
3.7.6 Pemeriksaan Saponin ... 27
3.8 Pembuatan Ekstrak ... 27
3.9 Sterilisasi Alat ... 28
3.10 Pembuatan Media ... 28
3.10.1 Nutrient Agar (NA)... 28
3.10.2 Mueller Hinton Agar (MHA) ... 29
3.10.3 Larutan NaCL 0,9 % ... 29
3.10.4 Pembuatan Suspensi Standard Mc. Farland .... 30
3.10.5 Pembuatan Media Miring ... 30
3.11 Pembuatan Stok Kultur Bakteri ... 30
3.12 Pembuatan Inokulum Bakteri ... 30
3.13 Pembuatan Pengenceran Ekstrak ... 31
3.14 Uji Aktivitas Antibakteri ... 31
BAB IV HASIL DAN PEMBAHASAN ... 33
BAB V KESIMPULAN DAN SARAN ... 39
5.1 Kesimpulan ... 39
5.2 Saran ... 39
DAFTAR PUSTAKA ... 40
DAFTAR TABEL
Tabel Halaman
4.1. Hasil pemeriksaan karakteristik serbuk simplisia ... 33
4.2. Hasil skrining fitokimia dari daun pacar air ... 35
4.3. Hasil uji aktivitas antibakteri ekstrak daun pacar air terhadap bakteri Staphylococcus aureus, Staphylococcus
DAFTAR LAMPIRAN
Lampiran Halaman
1. Identifikasi Tumbuhan ... 42
2. Gambar Tumbuhan Pacar Air dan Daun Pacar Air ... 43
3. Gambar Simplisia Daun Pacar Air dan Serbuk Simplisia ... 44
4. Gambar Mikroskopik Penampang Melintang Daun Segar Pacar Air ... 45
5. Gambar Mikroskopik Serbuk Simplisia ... 46
6. Kerangka Percobaan ... 47
7. Hasil uji aktivitas antibakteri ... 51
8. Gambar Hasil Uji Aktivitas Antibakteri ekstrak daun pacar air terhadap bakteri Staphylococcus aureus …... 52
9. Gambar Hasil Uji Aktivitas Antibakteri ekstrak daun pacar air terhadap bakteri Staphylococcus epidermidis ... 54
10. Gambar Hasil Uji Aktivitas Antibakteri ekstrak daun pacar air terhadap bakteri Staphylococcus pseudomonas... 55
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK DAUN DARI TUMBUHAN PACAR AIR (Impatiens balsamina L.) TERHADAP
BAKTERI Staphylococcus aureus, Staphylococcus epidermidis DAN Pseudomonas aeruginosa
Abstrak
Daun tumbuhan pacar air (Impatiens balsamina L.) merupakan salah satu
bagian tumbuhan yang perlu dikembangkan manfaatnya, secara tradisional digunakan
sebagai obat pencuci luka, nyeri haid, keputihan dan infeksi pada kulit. Selama ini
masyarakat hanya mengenal tumbuhan ini sebagai tumbuhan hias, dan ternyata
selain itu tumbuhan ini dapat dimanfaatkan sebagai tumbuhan obat. Oleh karena itu
perlu dilakukan penelitian terhadap daun pacar air.
Pada penelitian ini dilakukan pemeriksaan karakterisasi, skrining fitokimia
dan uji aktivitas antibakteri ekstrak daun pacar air terhadap bakteri Staphylococcus
aureus, Staphylococcus epidermidis dan Pseudomonas aeruginosa yang dilakukan
secara invitro dengan metode difusi agar menggunakan kertas cakram.
Hasil skrining fitokimia dari simplisia dan ekstrak daun pacar air
menunjukkan adanya senyawa flavonoida, steroida dan saponin. Ekstrak daun pacar
air mempunyai aktivitas antibakteri. Aktivitas antibakteri dari ekstrak daun pacar air
menunjukkan konsentrasi hambat minimum (KHM) pada bakteri Staphylococcus
aureus sebesar 12 mg/ml, pada bakteri Staphylococcus epidermidis sebesar 24 mg/ml
dan pada bakteri Pseudomonas aeruginosa sebesar 24 mg/ml. Sedangkan batas
daerah hambat yang efektif dengan diameter 14,5 mm pada konsentrasi 60 mg/ml
untuk bakteri Staphylococcus aureus, diameter 14,2 mm pada konsentrasi 60 mg/ml
untuk bakteri Staphylococcus epidermidis dan diameter 14,4 mm pada konsentrasi
60 mg/ml untuk bakteri Pseudomonas aeruginosa.
Kata kunci : Skrining, Ekstrak Daun Pacar Air, Antibakteri, Staphylococcus
PHYTOCHEMICAL SCREENING AND ANTIBACTERIAL ACTIVITY TEST OF EXTRACT HENNA WATER LEAVES (Impatiens balsamina L.) WITH RESPECT TO Staphylococcus aureus, Staphylococcus epidermidis AND
Pseudomonas aeruginosa
Abstract
The leaf of henna water (Impatiens balsamina L.) is one of the plants that
need to be developed benefits, traditionally used as a drug wash wounds, menstrual
pain, vaginal discharge and infection of the skin. As long as this society are only
familiar with this plant as an ornamental plant, and in fact other than that this plant
can be used as a medicinal plant. Therefore it needs to do research on henna water
leaf.
In this research was conducted at the characteristic, phytochemical screening
and examination antibacterial activity of extract the henna leaves water against
Staphylococcus aureus, Staphylococcus epidermidis and Pseudomonas aeruginosa
that was conducted as invitro agar diffusion method by using the disc paper.
The result of phytochemical screening of crude drugs and extracts of henna
leaves indicate water flavonoida compounds, steroid and saponin. Henna leaf water
extract has antibacterial activity. Antibacterial activity of water extract of henna
leaves showed a minimum inhibitory concentration (MIC) of the Staphylococcus
aureus bacterium at 12 mg/ml, the Staphylococcus epidermidis bacterium at 24
mg/ml and the Pseudomonas aeruginosa bacterium at 24 mg/ml. While the limit of
effective inhibition area with a diameter of 14,5 mm at a concentration of 60 mg/ml
for Staphylococcus aureus, 14,2 mm diameter at a concentration of 60 mg/ml for
Staphylococcus epidermidis and a diameter of 14,4 mm at a concentration of 60
mg/ml to Pseudomonas aeruginosa.
Keyword : Screening, Extract Henna Water Leaf, Antibacterial, Staphylococcus
BAB I
PENDAHULUAN
1.1Latar Belakang
Obat tradisional merupakan warisan nenek moyang yang telah dikembangkan
sejak dahulu kala. Sumber obat tradisional terutama berasal dari bahan alam baik
tumbuhan ataupun bahan-bahan mineral. Saat ini Indonesia merupakan salah satu
negara penghasil tanaman obat yang potensial, dimana hasil alam yang paling banyak
digunakan sebagai bahan obat adalah tumbuhan, yang telah digunakan dalam kurun
waktu cukup lama (Djauhariyah, 2004). Masyarakat Indonesia memanfaatkan
tumbuhan obat secara tradisional karena efek samping lebih kecil dari obat yang
dibuat secara sintesis. Mahalnya obat sintesis membuat masyarakat beralih ke
tumbuhan obat. Hal ini menandai adanya peningkatan kesadaran masyarakat untuk
kembali ke alam dalam rangka mencapai kesehatan optimal dan untuk mengatasi
berbagai penyakit secara alami (Mursito, 2001).
Sesuai Keputusan Menteri Kesehatan No.131/Menkes/SK/II/2004 tentang
Sistem Kesehatan Nasional (SKN) yang menyatakan bahwa pengembangan dan
peningkatan obat tradisional harus terus dilakukan agar diperoleh obat yang bermutu
tinggi, aman, memiliki khasiat yang nyata yang teruji secara ilmiah dimanfaatkan
secara luas baik untuk pengobatan sendiri oleh masyarakat maupun digunakan dalam
pelayanan kesehatan formal (Depkes RI, 2006).
Salah satu tumbuhan obat adalah pacar air (Impatiens balsamina L.) dari suku
Balsaminaceae. Tumbuhan pacar air mempunyai bunga dengan beberapa warna yaitu
merah, putih, kuning, jingga dan ungu. Kandungan kimia dari bunga diantaranya
akarnya mengandung sianidin dan monoglikosida (Dalimartha, 2003), serta bagian
daunnya mengandung flavonoida, saponin, steroida dan glikosida (Adfa, 2007).
Tumbuhan ini memiliki banyak manfaat dari bagiannya yang dapat digunakan
sebagai obat diantaranya biji, daun, bunga dan akarnya. Biji digunakan untuk
mengatasi terlambat haid, sulit melahirkan, rasa tersumbat ditenggorokan, bengkak
akibat terbentur dan tumor perut. Bunga digunakan untuk mengatasi terlambat haid,
dan bengkak karena gumpalan bekuan darah. Daun digunakan untuk mengatasi
radang kulit bernanah, bisul dan radang pinggir kuku (cantengan). Akar digunakan
untuk mengatasi rematik, leher kaku dan sakit pinggang (Dalimartha, 2003).
Masyarakat Bengkulu telah memanfaatkan daun pacar air segar sebagai obat
luka tersayat, bengkak-bengkak, koreng, obat panas dalam dan susah buang air kecil
bagi anak-anak (Adfa, 2007). Dalam kehidupan sehari-hari masyarakat kota Medan
menggunakan tumbuhan ini dengan melumatkan daun pacar air segar, lalu
ditempelkan pada bagian tubuh yang luka atau dengan cara merebus daun pacar air
segar secukupnya lalu digunakan air rebusan untuk mencuci luka.
Berdasarkan uraian di atas, maka perlu dilakukan pemeriksaan karakterisasi,
skrining fitokimia terhadap simplisia dan ekstrak daun pacar air serta menguji
aktivitas antibakteri dari ekstrak daun pacar air terhadap bakteri penyebab penyakit
kulit. Adapun mikroba yang digunakan adalah Staphylococcus aureus,
Staphylococcus epidermidis dan Pseudomonas aeruginosa. Staphylococcus aureus
dan Staphylococcus epidermidis merupakan bakteri gram positif sedangkan
Pseudomonas aeruginosa merupakan bakteri gram negatif. Ketiga bakteri ini dapat
1.2Perumusan Masalah
Berdasarkan latar belakang, perumusan masalah penelitian yaitu:
a. Apakah karakteristik simplisia daun pacar air dapat diidentifikasi
b. Apakah golongan senyawa kimia yang terdapat pada simplisia dan ekstrak
daun pacar air.
c. Apakah ekstrak daun pacar air mempunyai aktivitas antibakteri terhadap
bakteri Staphylococcus aureus, Staphylococcus epidermidis dan Pseudomonas
aeruginosa.
1.3Hipotesis
Berdasarkan perumusan masalah, maka hipotesis penelitian adalah:
a. Simplisia daun pacar air dapat diidentifikasi dengan karakteristik tertentu.
b. Golongan senyawa kimia yang terdapat pada simplisia dan ekstrak memiliki
kandungan yang sama yaitu flavonoida, saponin, steroida dan glikosida.
c. Ekstrak daun pacar air mempunyai aktivitas antibakteri terhadap bakteri
Staphylococcus aureus, Staphylococcus epidermidis dan Pseudomonas aeruginosa.
1.5 Tujuan
Tujuan penelitian ini adalah :
a. Untuk mengetahui karakteristik simplisia daun pacar air.
b. Untuk mengetahui golongan senyawa kimia yang terdapat pada simplisia dan
ekstrak daun pacar air.
c. Untuk mengetahui aktivitas antibakteri dari ekstrak daun pacar air terhadap
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi, morfologi tumbuhan, sistematik tumbuhan, nama
daerah, kandungan kimia dan khasiat tumbuhan.
2.1.1 Morfologi tumbuhan
Pacar air merupakan tanaman terna semusim, berakar serabut, berbatang
basah, bulat, licin, tegak, tinggi 30-80 cm, bercabang, warnanya hijau kekuningan.
Biasa ditanam di halaman sebagai tanaman hias atau tumbuhan liar ditempat yang
cukup mendapat air dan sinar matahari. Daun tunggal, bertangkai, bentuk lanset
memanjang, panjang 6-15 cm, lebar 2-3 cm, tepi bergerigi tajam, ujung dan pangkal
meruncing, pertulangan menyirip, warna hijau muda. Bunga tungal, keluar dari ketiak
daun, berkumpul 1-3, warnanya cerah (ada yang merah, orange, ungu, dan putih).
Buahnya buah kendaga, berbentuk telur, elips, berambut, warna hijau, bila masak
akan pecah membuka menjadi 5 bagian yang terpilin. Bijinya bulat, kecil, hitam.
2.1.2 Sistematika Tumbuhan
Sistematika tumbuhan pacar air adalah sebagai berikut :
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Geraniales
Suku : Balsaminaceae
Genus : Impatiens
2.1.3 Nama Daerah
Nama daerah dari tumbuhan pacar air adalah lahine (Nias), paruinai (Jawa)
atau pacar banyu, kimbong (Jakarta), bunga taho (Sulawesi), inai anyar (Maluku),
pacar foya (Nusa tenggara) (Hariana, 2008).
2.1.4 Kandungan Kimia
Pada bunga diantaranya antosianin dan kamperol, pada biji mengandung
saponin dan fixel oil dan pada akarnya mengandung sianidin dan monoglikosida
(Dalimartha, 2003), serta bagian daunnya mengandung flavonoida, saponin, steroida
dan glikosida (Adfa, 2007).
2.1.5 Khasiat Tumbuhan
Biji digunakan untuk mengatasi terlambat haid, sulit melahirkan, rasa
tersumbat ditenggorokan, bengkak akibat terbentur dan tumor perut. Bunga
digunakan untuk mengatasi terlambat haid, dan bengkak karena gumpalan bekuan
darah. Daun digunakan untuk mengatasi radang kulit bernanah, bisul dan radang
pinggir kuku (cantengan). Akar digunakan untuk mengatasi rematik, leher kaku dan
sakit pinggang (Dalimartha, 2003).
2.2Kandungan Senyawa Kimia
Senyawa kimia yang terkandung pada tumbuhan Impatiens balsamina L.
adalah Flavonoida, Saponin, Steroida dan Glikosida (Adfa, 2001).
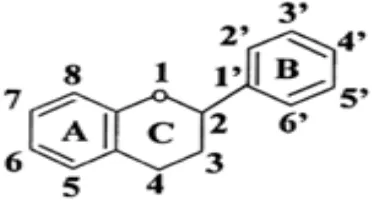
2.2.1 Flavonoida
Flavonoida merupakan salah satu golongan fenol alam yang tersebar luas pada
tumbuhan hijau dan mengandung 15 atom karbon dalam inti dasarnya, yang tersusun
dalam konfigurasi C6-C3-C6 Yaitu dua cincin aromatik yang dihubungkan oleh satuan
Gambar 1. Struktur Flavonoida
Umumnya senyawa flavonoida dalam tumbuhan terikat dengan gula disebut
sebagai glikosida dan aglikon flavonoida yang berbeda-beda mungkin saja terdapat
pada satu tumbuhan dalam beberapa bentuk kombinasi glikosida. Oleh karena itu
dalam menganalisis flavonoida biasanya lebih baik memeriksa aglikon yang telah
dihidrolisis dibandingkan dalam bentuk glukosida dengan kerumitan strukturnya.
Flavonoida berkhasiat sebagai antioksidan, antibakteri dan inflamasi (Harbone,
1987).
2.2.2Saponin
Senyawa golongan ini banyak terdapat pada tumbuhan tinggi. Keberadaan
saponin sangat mudah ditandai dengan pembentukan larutan koloidal dengan air yang
apabila dikocok menimbulkan buih yang stabil. Sapponin merupakan senyawa berasa
pahit menusuk, menyebabkan bersin dan sering mengakibatkan iritasi terhadap
selaput lender (Gunawan & Mulyani, 1995)
Saponin merupakan senyawa aktif permukaan, bersifat seperti sabun dan
dapat dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisis, sel
darah. Pembentukan busa yang mantap sewaktu mengekstraksi tumbuhan atau pada
waktu memekatkan ekstrak tumbuhan merupakan bukti terpercaya akan adanya
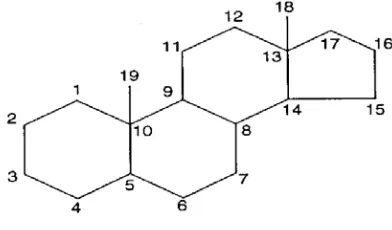
2.2.3 Steroida
Steroid adalah triterpenoid yang kerangka dasarnya system cincin
siklopentana perhidrofenantren. Uji yang biasa digunakan adalah reaksi Lieberman
Bourchard yang dengan kebanyakan triterpen dan steroid memberikan warna hijau
biru (Harbone, 1987).
Gambar 2. Sruktur Steroida
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu
skualena. Senyawa ini berstruktur siklik yang rumit, kebanyakan berupa alcohol,
aldehid atau asam karboksilat. Berupa senyawa warna. Berbentuk Kristal. Sering kali
bertitik leleh tinggi dan aktif optic (Harbone, 1987).
2.2.4 Glikosida
Glikosida adalah suatu senyawa yang jika dihidrolisis akan menghasilkan
bagian gula yang disebut glikon dan bagian bukan gula disebut aglikon. Gula yang
dihasilkan biasanya adalah glukosa, ramnosa, dan lain sebagainya. Jika bagian
gulanya adalah glukosa maka disebut glukosida, sedangkan jika bagian gulanya selain
Menurut fransworth (1996), Pembagian glikosida berdasarkan atom yang
menghubungkan bagian gula dan bagian bukan gula adalah sebagai berikut :
1. O-glikosida : Jika bagian gula dan bukan gula dihubungkan oleh atom O
2. S-glikosida : Jika bagian gula dan bukan gula dihubungkan oleh atom S
3. N-glikosida : Jika bagian gula dan bukan gula dihubungkan oleh atom N
4. C-glikosida : Jika bagian gula dan bukan gula dihubungkan oleh atom C
2.3 Ekstrak
2.3.1 Pengertian
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif
dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang
tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan
(Depkes RI, 1995).
Sebagian besar ekstrak dibuat dengan mengekstraksi bahan baku obat secara
perkolasi. Seluruh perkolat biasanya dipekatkan dengan cara destilasi dengan
pengurangan tekanan, agar bahan utama obat sesedikit mungkin terkena panas
(Depkes RI, 1995).
Ekstraksi adalah suatu proses yang dilakukan untuk memperoleh kandungan
senyawa kimia dari jaringan tumbuhan maupun hewan. Ekstrak adalah sediaan
kering, kental atau cair dibuat dengan menyari simplisia nabati atau hewani menurut
cara yang cocok, di luar pengaruh cahaya matahari langsung, ekstrak kering harus
mudah digerus menjadi serbuk. Cairan penyari yang digunakan air, etanol dan
2.3.2 Metode Ekstraksi
Menurut Depkes RI (2000), beberapa metode ekstraksi:
1. Cara dingin
i. Maserasi, adalah proses pengekstrakan simplisia dengan menggunakan pelarut
dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan
(kamar).
ii. Perkolasi, adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna
(exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan.
2. Cara panas
i. Refluks, adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik.
ii. Soxhlet, adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
iii. Digesti, adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40-50oC.
iv. Infus, adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur
96-98oC) selama waktu tertentu (15-20 menit).
v. Dekok, adalah infus pada waktu yang lebih lama dan temperatur sampai titik
2.4 Uraian bakteri
Nama bakteri berasal dari kata “bakterion” (bahasa yunani) yang berarti
tongkat atau batang. Sekarang nama itu dipakai untuk menyebut sekelompok
mikroorganisme yang bersel satu, tidak berklorofil, berbiak dengan pembelahan diri,
serta demikian kecilnya sehingga hanya dapat dilihat dengan menggunakan
mikroskop (Dwijoseputro, 1982).
Ukuran bakteri bervariasi baik penampang maupun panjangnya, tetapi pada
umumnya penampang bakteri adalah sekitar 0,7-1,5 µm dan panjangnya sekitar 1-6
µ m (Tim mikrobiologi FK Unibraw, 2003).
Tubuh bakteri yang terdiri dari satu sel mempunyai bentuk yang
beranekaragam. Ada yang berbentuk peluru atau bola (kokus), berbentuk batang
(basil), berbentuk koma dan spiral (Tjitrosoepomo, 1994).
Berdasarkan perbedaannya didalam menyerap zat warna gram bakteri dibagi
atas dua golongan yaitu bakteri gram positif dan bakteri gram negatif. Bakteri gram
positif menyerap zat warna pertama yaitu Kristal violet yang menyebabkan berwarna
ungu, sedangkan bakteri gram negatif menyerap zat warna kedua yaitu safranin dan
menyebabkannya berwarna merah (Dwijoseputro, 1982).
Bakteri gram positif memiliki kandungan peptidoglikan yang tinggi (dapat
mencapai 50 %) dibandingkan bakteri gram negatif (sekitar 10 %). Sebaliknya
kandungan lipida dinding sel bakteri gram positif rendah sedangkan pada dinding sel
2.4.1 Pertumbuhan Bakteri
Pertumbuhan dan perkembangan bakteri dipengaruhi oleh:
1. Zat makanan (nutrisi)
Sumber zat makanan bagi bakteri diperoleh dari senyawa karbon, nitrogen,
sulfur, fosfor, unsur logam (natrium, kalsium, magnesium, mangan, besi,
tembaga dan kobalt), vitamin dan air untuk fungsi-fungsi metabolik dan
pertumbuhannya.
2. Keasaman dan kebasaan (pH)
Kebanyakan bakteri mempunyai pH optimum pertumbuhan antara 6,5-7,5,
namun beberapa spesies dapat tumbuh dalam keadaan sangat asam atau sangat
alkali.
3. Temperatur
Proses pertumbuhan bakteri tergantung pada reaksi kimiawi dan laju reaksi
kimia yang dipengaruhi oleh temperatur. Berdasarkan ini maka bakteri dapat
diklasifikasikan sebagai berikut:
a. Bakteri psikofil, yaitu bakteri yang dapat hidup pada temperatur
0-30oC, temperatur optimum adalah 10-20oC.
b. Bakteri mesofil, yaitu bakteri yang dapat hidup pada temperatur
5-60oC, temperatur optimum adalah 25-40oC.
c. Bakteri termofil, yaitu bakteri yang dapat hidup pada temperatur
4. Oksigen
Beberapa spesies bakteri dapat hidup dengan adanya oksigen dan sebaliknya
spesies lain akan mati. Berdasarkan kebutuhan akan oksigen, bakteri dapat
dikelompokkan sebagai berikut:
a. Aerobik yaitu bakteri yang membutuhkan oksigen untuk
pertumbuhannya.
b. Anaerobik yaitu bakteri yang dapat tumbuh tanpa oksigen.
c. Anaerobik fakultatif yaitu bakteri yang dapat tumbuh dengan oksigen
ataupun tanpa oksigen.
d. Mikroaerofilik yaitu bakteri yang dapat tumbuh baik dengan adanya
sedikit oksigen.
5. Tekanan osmosa
Medium yang baik bagi pertumbuhan bakteri adalah medium isotonis
terhadap isi sel bakteri.
6. Kelembaban
Secara umum bakteri tumbuh dan berkembang biak dengan baik pada
lingkungan yang lembab. Kebutuhan akan air tergantung dari jenis bakterinya
(Pelczar, 1986).
2.4.2 Media Pertumbuhan Bakteri
Pembiakan bakteri dalam laboratorium memerlukan media yang berisi zat
hara serta lingkungan pertumbuhan yang sesuai bagi bakteri. Zat hara diperlukan
untuk pertumbuhan, sintesis sel, keperluan energi dalam metabolisme dan
pergerakan. Lazimnya, media biakan mengandung air, sumber energi, zat hara
dasar media dapat pula ditambahkan faktor pertumbuhan berupa asam amino dan
vitamin. Media biakan dikelompokkan dalam beberapa kategori, yaitu:
1. Bedasarkan asalnya, media dibagi atas:
a. Media sintetik yaitu media yang kandungan dan isi bahan yang ditambahkan
diketahui secara terperinci. Contoh: glukosa, kalium fosfat, magnesium fosfat.
b. Media non-sintetik yaitu media yang kandungan dan isinya tidak diketahui
secara terperinci dan menggunakan bahan yang terdapat di alam. Contohnya:
ekstrak daging, pepton (Lay, 1994).
2. Berdasarkan kegunaannya, dapat dibedakan menjadi:
a. Media selektif
Media selektif adalah media biakan yang mengandung paling sedikit satu
bahan yang dapat menghambat perkembang biakan mikroorganisme yang
tidak diinginkan dan membolehkan perkembang biakan mikroorganisme
tertentu yang ingin diisolasi.
b. Media diferensial
Media ini digunakan untuk menyeleksi suatu mikroorganisme dari berbagai
jenis dalam suatu lempengan agar.
c. Media diperkaya
Media ini digunakan untuk menumbuhkan mikroorganisme yang diperoleh
dari lingkungan alami karena jumlah mikroorganisme yang ada terdapat
dalam jumlah sedikit
3. Berdasarkan konsistensinya, dibagi atas :
a. Media padat/ solid
c. Media semi padat
Media padat diperoleh dengan menambahkan agar. Agar berasal dari
ganggang merah. Agar digunakan sebagai bahan pemadat karena tidak
diuraikan oleh mikroorganisme dan membeku pada suhu diatas 450C.
Kandungan agar sebagai bahan pemadat dalam media 1,5-2 %.
2.4.3 Fase Pertumbuhan Bakteri
Bakteri mengalami pertumbuhan melalui beberapa fase, yaitu:
1) Fase lag
Pada saat dipindahkan ke media yang baru, bakteri tidak langsung tumbuh dan
membelah, meskipun kondisi media sangat mendukung untuk pertumbuhan.
Bakteri biasanya akan mengalami masa penyesuaian untuk menyeimbangkan
pertumbuhan.
2) Fase log
Selama fase ini, populasi meningkat dua kali pada interval waktu yang teratur.
Jumlah koloni bakteri akan terus bertambah seiring lajunya aktivitas
metabolisme sel.
3) Fase tetap
Pada fase ini terjadi kompetisi antara bakteri untuk memperoleh nutrisi dari
media untuk tetap hidup. Sebagian bakteri mati sedangkan yang lain tumbuh
dan membelah sehingga jumlah sel bakteri yang hidup menjadi tetap.
4) Fase kematian
Pada fase ini, sel bakteri akan mati lebih cepat daripada terbentuknya sel baru.
Gambar 3. Grafik pertumbuhan bakteri
Keterangan :
a : Lag phase b : Log phase c : Stationary phase d : Death phase
2.4.4 Bakteri Staphylococcus aureus
Sistematika bakteri (Tjitrosoepomo, 1994) :
Divisio : Schizophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococcaceae
Marga : Staphylococcus
Jenis : Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif yang bersifat aerob
atau anaerob fakultatif, tes katalase positif dan tahan hidup dalam lingkungan yang
mengandung garam dengan konsentrasi tinggi (halofilik), misalnya NaCl 10%. Hasil
pewarnaan yang berasal dari pembenihan padat akn memperlihatkan susunan bakteri
yang bergerombol seperti buah anggur. Untuk membiakkan bakteri Staphylococcus
aureus diperlukan suhu optimal sekitar 350C dan pH optimal untuk pertumbuhan
Bakteri ini terdapat pada kulit, selaput lendir, bisul dan luka. Dapat
menimbulkan penyakit melalui kemampuannya berkembang biak dan menyebar luas
dalam jaringan dan melalui pembentukan berbagai zat ekstraseluler seperti enzim dan
toksin (Jawetz, dkk, 2001).
2.4.5 Bakteri Staphylococcus Epidermidis
Sistematika bakteri (Tjitrosoepomo, 1994) :
Divisio : Eukariota
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococcaceae
Marga : Staphylococcus
Jenis : Staphylococcus epidermidis
Staphylococcus epidermidis merupakan bakteri gram positif, aerob atau
anaerob fakultatif berbentuk bola atau kokus berkelompok tidak teratur, diameter
0,8-1,0 µm tidak membentuk spora dan tidak bergerak, koloni berwarna putih bakteri ini
tumbuh cepat pada suhu 370C. Koloni pada pembenihan padat berbentuk bulat halus,
menonjol, berkilau, tidak meghasilkan pigmen, berwarna putih porselin sehingga
staphylococcus epidemidis disebut staphylococcus albus, koagulasi-negatif dan tidak meragi manitol (Jawetz et al, 2001).
Staphylococcus epidermidis terdapat pada kulit, selaput lender, bisul dan luka.
Dapat menimbulkan penyakit melalui kemampuannya berkembang biak menyebar
luas dalam jaringan (Jawetz et al, 2001).
2.4.6 Bakteri Pseudomonas aeruginosa
Sistematika bakteri (Buchanan dan Gibbons, 1974) :
Divisio : Protophyta
Kelas : Schizomycetes
Bangsa : Pseudomonadales
Suku : Pseudomonadaceae
Marga : Pseudomonas
Jenis : Pseudomonas aeruginosa
Pseudomonas aeruginosa merupakan bakteri gram negative aerob obligat,
berbentuk batang, bergerak, berukuran sekitar 0,5-8 x 1,5-3,0 µm, terlihat sebagai
bakteri tunggal, berpasangan dan kadang-kadang membentuk rantai yang pendek.
Pseudomonas aeruginosa membentuk koloni halus bulat dengan warna floresensi
kehijauan. Bakteri ini menghasilkan piosianin, suatu pigmen kebiru-biruan yang tak
berfloresensi, yang berdifusi ke dalam agar. Floresensi dapat dihasilkan bila biakan
diinkubasi pada suhu 20-300C dari pada yang dibiakkan pada suhu 35-370C.
Pseudomonas aeruginosa tersebar luas di alm dan biasanya terdapat di
lingkungan yang lembab. Bakteri ini menyebabkan penyakit bila pertahanan tubuh
inang abnormal. Dalam jumlah kecil, bakteri ini sering terdapat dalam flora usus
normal dan pada kulit manusia serta merupakan pathogen utama dari kelompok
Pseudomonas. Bakteri ini menimbulkan infeksi pada luka, meningitis, infeksi saluran
kemih, dan infeksi mata (Jawetz et al, 2001).
2.3.7 Pengukuran Aktivitas Antibakteri
Pengukuran aktivitas antibakteri dapat dilakukan dengan metode dilusi
a. Metode Dilusi
Metode ini menggunakan antimikroba dengan kadar yang menurun secara
bertahap, baik dengan media cair atau padat. Kemudian media diinokulasi bakteri uji
dan dieramkan. Tahap akhir dilarutkan antimikroba dengan kadar yang menghambat
atau mematikan. Uji kepekaan cara dilusi agar memakan waktu dan penggunaannya
dibatasi pada keadaan tertentu saja (Jawetz et al, 2001).
b. Metode Difusi
Metode yang paling sering digunakan adalah metode difusi agar. Cakram
kertas saring berisi sejumlah tertentu obat ditempatkan pada permukaan medium
padat yang sebelumnya telah diinokulasi bakteri uji pada permukaannya. Setelah
inkubasi, diameter zona hambatan sekitar cakram dipergunakan mengukur kekuatan
hambatan obat terhadap organisme uji. Metode ini dipengaruhi oleh beberapa faktor
fisik dan kimia, selain faktor antara obat dan organisme (misalnya sifat medium dan
kemampuan difusi, ukuran molekular dan stabilitas obat). Meskipun demikian,
standarisasi faktor-faktor tersebut memungkinkan melakukan uji kepekaan dengan
BAB III
METODOLOGI PENELITIAN
3.1 Lokasi dan waktu penelitian
Penelitian ini dilaksanakan pada bulan Januari-Maret 2011 di Laboratorium
Obat Tradisional Fakultas Farmasi Universitas Sumatera Utara dan Laboratorium
Kesehatan Medan.
3.2 Metode Penelitian
Penelitian dilakukan dengan metode eksperimental dengan tahapan meliputi
pengumpulan sampel dan pembuatan simplisia, pemeriksaan karakteristik simplisia,
skrining fitokimia, pembuatan ekstrak, dan uji aktivitas antibakteri dari ekstrak daun
pacar air terhadap bakteri Staphylococcus aureus, Staphylococcus epidermidis dan
Pseudomonas aeruginosa. Penentuan aktivitas antibakteri ekstrak daun pacar air
dilakukan dengan metode difusi agar. Prinsip metode ini adalah menggunakan media
padat dan cakram kertas, kemudian daya hambat (zona jernih) bakteri ditentukan
dengan mengukur diameter daerah hambat pertumbuhan.
3.3 Alat dan Bahan
3.3.1 Alat
Alat- alat yang digunakan adalah seperangkat alat perkolator, Alat-alat gelas,
blender (National), oven listrik (Fisher scientific), Neraca kasar (Ohaus), Neraca
listrik (Mettler Toledo), rotary evaporator (Haake D), freeze dryer (Modulio),
seperangkat alat destilasi, cawan porselin berdasar rata, desikator, aluminium foil,
cawan porselin, mikroskop (Olympus), tanur (Ney M 525 Series II), krus porselin,
spatula, lemari pendingin (Toshiba), jarum ose, pinset, kertas cakram, lampu bunsen,
lemari pengering, kertas Perkamen, cawan Petri, jangka sorong.
3.3.2 Bahan
Bahan-bahan yang digunakan adalah daun pacar air, bahan-bahan kimia pro
analisa, kecuali dinyatakn lain: air suling, asam klorida encer, asam klorida pekat,
besi (III) klorida, alfa naftol, bismuth (III) nitrat, timbal (II) asetat, Merkuri (II)
klorida, asam sulfat pekat, n-heksan, kalium iodida, iodium, isopropanol, metanol,
barium klorida, asam asetat anhidrat, larutan fisiologi NaCl 0,9 %, Serbuk
magnesium, amil alkohol, kloralhidrat, toluen, kloroform, Muller Hinton Agar
(MHA), Nutrient Agar (NA), Suspensi standar Mc.Farland, biakan bakteri
Staphylococcus aureus ATCC 25923, Staphylococcus epidermidis ATCC 12228 dan Pseudomonas aeruginosa ATCC 27853.
3.4 Pembuatan Larutan Pereaksi
3.4.1 Larutan pereaksi Mayer
Campurkan 60 ml larutan Raksa (II) Klorida dan 10 ml larutan Kalium Iodida,
tambahkan air secukupnya hingga 100 ml (Depkes RI, 1995).
3.4.2 Larutan pereaksi Dragendorff
Campur 20 ml larutan Bismuth (III) Nitrat dalam Asam Nitrat lalu tambahkan
dengan 50 ml larutan Kalium Iodida diamkan sampai memisah sempurna. Ambil
larutan jernih dan encerkan dengan air secukupnya hingga 100 ml (Depkes RI, 1995).
3.4.3 Larutan pereaksi Bouchardat
Sebanyak 4 g Kalium Iodida dilarutkan dalam 20 ml air suling kemudian
ditambah 2 g Iodium sambil diaduk sampai larut, lalu cukupkan dengan air suling
3.4.4 Larutan pereaksi Lieberman-Bourchard
Campurkan 5 bagian volume Asam Sulfat dengan 50 bagian volume etanol.
Tambahkan hati-hati 5 bagian volume Asetat Anhidrat ke dalam campuran tersebut,
dinginkan (Depkes RI, 1995).
3.4.5 Larutan pereaksi Molish
Ditimbang sebanyak 3 g Alfa Naftol dilarutkan dalam Asam Nitrat 0,5 N
secukupnya hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.6 Larutan pereaksi Timbal (II) Asetat 0,4 M
Ditimbang sebanyak 15,17 g Timbal (II) Asetat dilarutkan dalam air hingga
100 ml (Depkes RI, 1995).
3.4.7 Larutan peraksi Besi (III) Klorida 1 %
Ditimbang sebanyak 1 g Besi (III) Klorida dilarutkan dalam air suling hingga
diperoleh larutan 100 ml kemudian disaring (Depkes RI, 1995).
3.4.8 Larutan pereaksi Asam Sulfat 2 N
Sebanyak 5,5 ml Asam Sulfat pekat diencerkan dengan air suling hingga
100 ml (Depkes RI, 1995).
3.4.9 Larutan Pereaksi Asam Klorida 2 N
Sebanyak 17 ml Asam Klorida pekat diencerkan dengan air suling hingga
100 ml (Depkes RI, 1995).
3.4.10 Larutan pereaksi Kloralhidrat
3.5 Penyiapan Bahan Tumbuhan
3.5.1 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense Bidang Botani
Pusat Penelitian Biologi-LIPI. Hasil identifikasi tumbuhan dapat dilihat pada
lampiran 1 halaman 42.
3.5.2 Pengumpulan Tumbuhan
Pengumpulan sampel dilakukan secara purposif yaitu tanpa membandingkan
dengan tumbuhan yang sama dari daerah lain. Bahan yang digunakan untuk
penelitian adalah daun pacar air yang bunganya berwarna ungu, bagian daun yang
diambil daun yang tidak terlalu muda dan tidak terlalu tua yaitu daun keempat dari
atas dan daun kedua dari bawah. Daun pacar air diambil dari lahan kebun di daerah
Pales Raya VII, Medan. Gambar tumbuhan pacar air dan daun pacar air segar dapat
dilihat pada lampiran 2 halaman 43.
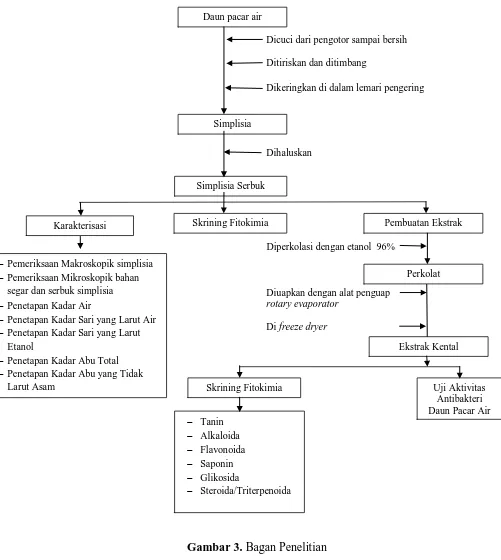
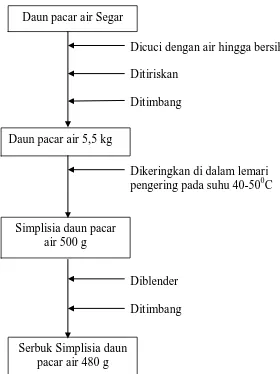
3.5.3 Pembuatan Simplisia
Pembuatan daun pacar air dilakukan dengan cara daun pacar air yang masih
segar dibersihkan dari kotoran yang melekat kemudian dicuci dengan air bersih,
ditiriskan dan ditimbang berat basahnya 5,5 kg. Daun pacar air selanjutnya
dikeringkan dalam lemari pengering pada suhu 40-600C sampai simplisia rapuh
(sekitar satu minggu). Kemudian ditimbang berat kering simplisia yaitu 0,500 kg.
Selanjutnya simplisia diserbuk menggunakan blender dan ditimbang beratnya 0,480
kg. Kemudian disimpan dalam wadah plastik yang tertutup rapat. Gambar simplisia
3.6 Pemeriksaan Karakterisasi Simplisia
Pemeriksaan karakteristik simplisia yang meliputi pemeriksaan makroskopik,
mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air,
penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total dan
penetapan kadar abu yang tidak larut dalam asam (Depkes RI, 1989).
3.6.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan terhadap daun pacar air segar dan
simplisia daun dengan cara mempehatikan bentuk, bau, warna dan rasa. Hasil
pemeriksaan makroskopik dapat dilihat pada lampiran 2 halaman 43 dan 44.
3.6.2 Pemeriksaan Mikroskopik
Pemeriksaan ini dilakukan terhadap irisan melintang dari daun pacar air segar
dan serbuk simplisia. Pemeriksaan mikroskopik untuk irisan melintang tumbuhan
segar dilakukan sebagai berikut: dibuat irisan melintang daun pacar air. Hasil irisan
tipis diletakkan di atas objek gelas lalu ditetesi larutan kloralhidrat, dipanaskan
dengan lampu spiritus, ditutup dengan kaca penutup dan dilihat di bawah mikroskop
pada berbagai perbesaran. Hasil pemeriksaan dilihat pada lampiran 3 halaman 45.
Pemeriksaan mikroskopik untuk serbuk simplisia dilakukan sebagai berikut:
sejumlah serbuk simplisia diletakkan merata di atas objek gelas yang telah ditetesi
larutan kloralhidrat, ditutup dengan kaca penutup dan dilihat di bawah mikroskop
pada berbagai perbesaran. Hasil pemeriksaan dilihat pada lampiran 3 halaman 46.
3.6.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (Destilasi Toluen).
Kedalam labu alas bulat di masukkan 200 ml toluena dan 2 ml air suling, destilasi
penampung dibaca. Selanjutnya ke dalam labu dimasukkan 5 gram serbuk simplisia
lalu dipanaskan hati-hati selama 15 menit. Setelah toluena mendidih, kecepatan
tetesan diatur yaitu 2 tetesan per detik sampai sebagian air terdestilasi, kemudian
kecepatan destilasi dinaikkan sampai 4 tetes per detik. Setelah semua air terdestilasi,
bagian dalam pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit,
kemudian tabung penampung dibiarkan dingin sampai sama dengan suhu kamar.
Setelah air dan toluena memisah sempurna, dibaca volume air dengan ketelitian 0,05
ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air di dalam
bahan yang diperiksa (WHO, 1992).
3.6.4 Penetapan Kadar Sari yang Larut dalam Air
Sebanyak 5 gram serbuk simplisia yang telah dikeringkan di udara dimaserasi
selama 24 jam dalam 100 ml campuran air dan kloroform (2,5 ml kloroform dalam air
sampai 1000 ml) dalam labu bersumbat sambil sesekali dikocok selama 6 jam
pertama, kemudian dibiarkan selama 18 jam. Disaring, sejumlah 20 ml filtrat
diuapkan sampai kering dalam cawan dangkal berdasar rata dan telah ditara, sisanya
dipanaskan pada suhu 105oC sampai bobot tetap. Kadar sari larut dalam air dihitung
terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1989).
3.6.5 Penetapan Kadar Sari yang Larut dalam Etanol
Sebanyak 5 gram serbuk simplisia yang telah dikeringkan di udara dimaserasi
selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok
sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian
disaring, 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata
sari larut dalam etanol dihitung terhadap bahan yang telah dikeringkan di udara
(Depkes RI, 1989).
3.6.6 Penetapan Kadar Abu Total
Sebanyak 2 gram serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan.
Krus dipijar pada suhu 600oC sampai arang habis. Selanjutnya didinginkan dan
ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang
telah dikeringkan di udara (WHO, 1992).
3.6.7 Penetapan Kadar Abu yang Tidak Larut dalam Asam
Abu yang telah diperoleh dalam penetapan kadar abu total dididihkan dalam
25 ml asam klorida 2 N selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu dan dicuci dengan air panas.
Residu dan kertas saring dipijar pada suhu 600oC sampai bobot tetap, kemudian
didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap
bahan yang telah dikeringkan (WHO, 1992).
3.7 Skrining fitokimia
Skrining fitokimia serbuk simplisia dan ekstrak daun pacar air meliputi
pemeriksaan senyawa golongan glikosida, alkaloida, steroida/triterpenoida,
flavonoida, tanin dan saponin.
3.7.1 Pemeriksaan Glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml
campuran 7 ml bagian etanol 96 % dan 3 bagian volum air suling ditambah dengan
10 ml HCL 2 N. Direfluks selama 30 menit, didinginkan dan disaring. Diambil 20 ml
didiamkan selama 5 menit dan disaring. Filtrat disari dengan 20 ml campuran 3
bagian kloroform dan 2 isopropanol dilakukan berulang sebanyak tiga kali.
Kumpulan sari air diuapkan pada temperatur tidak lebih dari 500C. Sisanya dilarutkan
dalam 2 ml metanol. Kemudian diambil 0,1 ml larutan percobaan dimasukkan
kedalam tabung reaksi, diuapkan di penangas air. Pada sisa ditambahkan 2 ml air dan
5 tetes pereaksi Molish. Kemudian secara perlahan ditambahkan 2 ml asam sulfat
pekat melalui dinding tabung, jika terbentuk cincin ungu pada batas kedua cairan
menunjukkan adanya glikosida (Depkes RI, 1989).
3.7.2 Pemeriksaan Alkaloida
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam
klorida dan 9 ml air suling, dipanaskan air selama 2 menit, didinginkan lalu disaring.
Filtrat dipakai untuk percobaan berikut :
a. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer.
b. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bourchardat.
c. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendroff.
Alkaloida dianggap positif jika terjadi endapan atau paling sedikit dua atau
tiga dari percobaan diatas (Depkes RI, 1989).
3.7.3 Pemeriksaan Steroida/Triterpenoida
Sebanyak 1 g sampel di maserasi dengan 20 ml n-heksan selama 2 jam, lalu
disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 2 tetes asam
asetat anhidrida dan 1 tetes asam sulfat pekat. Timbul warna ungu merah
menunjukkan adanya triterpenoida atau warna hijau biru menunjukkan adanya
3.7.4 Pemeriksaan Flavonoida
Sebanyak 10 g sebuk simplisia kemudian ditambahkan 100 ml air panas,
dididihkan selama 5 menit dan disaring dalam keadaan panas, filtrat yang diperoleh
kemudian diambil 5 ml lalu di tambahkan 0,1 g serbuk Mg dan 1 ml HCl pekat dan 2
ml amil alkohol, dikocok, dan dibiarkan memisah. Flavonoida positif jika terjadi
warna merah, kuning, jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.7.5 Pemeriksaan Tanin
Sebanyak 0,5 g sampel disari dengan 10 ml air suling, disaring lalu filtratnya
diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml larutan lalu
ditambahkan 1 sampai 2 ttes pereaksi besi (III) klorida. Terjadi warna biru atau hijau
kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.7.6 Pemeriksaan Saponin
Sebanyak 0,5 g sampel dimasukkan dalam tabung reaksi dan di tambahkan 10
ml air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, timbul
busa yang mantap tidak kurang dari 10 menit setinggi 1-10 cm. Ditambahkan 1 tetes
larutan asam klorida 2 N, bila buih tidak hilang menunjukkan adanya saponin
(Depkes RI, 1989).
3.8 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan dengan cara perkolasi. Prosedur pembuatan
ekstrak : sebanyak 300 gram serbuk simplisia dibasahi dengan etanol 96 % dan
dibiarkan selama 3 jam. Kemudian dimasukkan ke dalam perkolator. Lalu dituang
cairan penyari etanol sampai semua simplisia terendam, mulut tabung perkolator
ditutup dengan aluminium foil dan biarkan selama 24 jam, kemudian kran dibuka dan
ditambahkan berulang-ulang cairan penyari secukupnya hingga selalu terdapat selapis
cairan penyari diatas simplisia. Perkolasi dihentikan hingga bila 500 mg perkolat
yang keluar terakhir diuapkan tidak meninggalkan sisa. Perkolat yang diperoleh
dipekatkan dengan alat penguap rotary evaporator pada tekanan rendah dengan suhu
tidak lebih dari 500C setelah itu dipekatkan menggunakan freeze dryer hingga
diperoleh ekstrak kental (Ditjen POM, 1979). Bagan pembuat ekstrak dapat dilihat
pada lampiran 4 halaman 49.
3.9 Sterilisasi Alat
Sterilisasi untuk alat-alat yang digunakan antara lain:
1. Alat–alat yang terbuat dari gelas dibungkus dengan kertas perkamen,
disterilkan menggunakan oven pada suhu 1700C selama 1 jam.
2. Alat-alat jenis lainnya seperti kertas cakram, media disterilkan di autoklaf
pada suhu 1210C selama 15 menit.
3. Jarum ose dan pinset disterilkan dengan cara dibakar pada lampu bunsen.
4. Sebelum mulai daerah sekitar pengerjaan disemprot dengan etanol 70% dan
dibiarkan selama 15 menit sebelum digunakan.
5. Meja dibersihkan dari debu dan dilap menggunakan desinfektan (Lay, 1994).
3.10 Pembuatan media
3.10.1 Nutrient Agar
Komposisi : Beef extract 3,0 g
Peptone 5,0 g
Agar 15,0 g
Cara pembuatan: Ditimbang sebanyak 23 g serbuk nutrient agar kemudian
sedikit hingga 1000 ml, dipanaskan hingga mendidih sambil sekali-kali diaduk
sampai bahan larut sempurna dan jernih. Tutup erlenmeyer dengan kapas yang
dilapisi dengan aluminium foil. Disterilkan di dalam autoklaf pada suhu 121oC
tekanan 2 atm selama 15 menit.
3.10.2 Muller Hinton Agar (MHA)
Komposisi : Beef infusion from 300 g
Casein hydrolysate 17,5 g
Starch 1,50
Bacto – Agar 17,0 g
pH = 7,4
Cara pembuatan: Ditimbang sebanyak 38 g serbuk MHA kemudian disuspensikan
dalam erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml, dipanaskan hingga mendidih sambil sekali-kali diaduk sampai bahan larut
sempurna dan jernih. Tutup erlenmeyer dengan kapas yang dilapisi dengan
aluminium foil. Disterilkan di dalam autoklaf pada suhu 121oC tekanan 2 atm selama
15 menit.
3.10.3 Pembuatan Larutan NaCl 0,9%
Komposisi: Natrium Klorida 0,9 g
Air suling steril ad 100 ml
Cara pembuatan: Ditimbang sebanyak 0,9 g Natrium klorida lalu dilarutkan dalam air
suling steril sedikit demi sedikit dalam labu takar 100 ml sampai larut sempurna.
Ditambahkan air suling steril sampai garis tanda, dimasukkan dalam erlenmeyer steril
yang bertutup lalu disterilkan pada autoklaf suhu 121oC tekanan 2 atm selama 15
3.10.4 Pembuatan Suspensi standar Mc.Farland
Suspensi standar yang menunjukkan konsentrasi kekeruhan suspensi bakteri
sama dengan 108 CFU/ml.
Komposisi: Larutan asam sulfat 1% 9,5 ml
Larutan barium klorida 1,175% b/v 0,5 ml
Cara pembuatan:
Kedua larutan dicampurkan dalam tabung reaksi steril, dikocok sampai
homogen dan ditutup. Apabila kekeruhan hasil suspensi bakteri sama dengan
kekeruhan suspensi standar berarti konsentrasi bakteri 108 CFU/ml
3.10.5 Pembuatan Media Agar Miring
10 ml media agar yang telah dimasak dimasukkan kedalam tabung reaksi,
ditutup dan di bungkus lalu disterilkan di dalam autoklaf selama 15 menit pada suhu
1210C Kemudian tabung yang berisi agar diletakkan pada kemiringan 30-450C.
Diperhatikan bahwa agar tidak menyentuh tutup tabung. Agar dibiarkan menjadi
dingin dan keras (Lay, 1994).
3.11 Pembuatan stok kultur bakteri
Masing- masing sebanyak satu ose dari biakan murni bakteri Staphylococcus
aureus ATCC 25923, Staphylococcus epidermidis ATCC 12228 dan Pseudomonas aeruginosa ATCC 27853 digoreskan dengan metode sinambung pada permukaan
Nutrien Agar miring, ditutup mulut tabung reaksi dengan kapas. Diinkubasi selama
18-24 jam pada suhu 37oC.
3.12 Pembuatan inokulum bakteri
Bakteri hasil inkubasi dengan menggunakan jarum ose steril lalu
dihomogenkan dengan vorteks hingga diperoleh kekeruhan suspensi bakteri yang
sama dengan kekeruhan standart Mc. Farland, ini berarti konsentrasi suspensi bakteri
adalah 108 CFU/ml. Setelah itu dilakukan pengenceran dengan memipet 0,1 ml
biakan bakteri (108 CFU/ml), dimasukkan kedalam tabung steril yang berisi larutan
NaCl 0,9% sebanyak 9,9 ml dan dikocok homogen, maka diperoleh suspensi bakteri
dengan konsentrasi 106 CFU/ml.
3.13 Pembuatan pengenceran ekstrak
Sebanyak 5 gram ekstrak kental ditimbang seksama dengan neraca analitik,
dilarutkan dalam 5 ml etanol 96% dan dimasukkan ke dalam labu takar 10 ml.
Tambahkan etanol 96% hingga garis tanda dan diperoleh konsentrasi ekstrak 500
mg/ml. Selanjutnya larutan tersebut diencerkan kembali dengan etanol 96% hingga
didapat ekstrak dengan konsentrasi 400 mg/ml, 300 mg/ml, 200 mg/ml, 100 mg/ml,
90 mg/ml, 80 mg/ml, 70 mg/ml, 60 mg/ml, 50 mg/ml, 40 mg/ml, 30 mg/ml, 28
mg/ml, 26 mg/ml, 24 mg/ml, 22 mg/ml, 20 mg/ml, 18 mg/ml, 16 mg/ml, 14 mg/ml,
12 mg/ml, 10 mg/ml dan 5 mg/ml.
3.14. Uji Aktivitas Antibakteri
Sebanyak 0,1 ml suspensi bakteri konsentrasi 106 CFU/ml dimasukkan ke
dalam cawan petri, kemudian ditambahkan 15 ml media MHA cair (45-500C), lalu
dihomogenkan dan didiamkan hingga media memadat. Selanjutnya di atas permukaan
media diletakkan kertas cakram dengan menggunakan pinset. Sebanyak 0,1 ml
larutan ekstrak konsentrasi 500 mg/ml sampai 5 mg/ml masing-masing diteteskan
pada kertas cakram. Sebagai kontrol diteteskan 0,1 ml larutan etanol 96%. Ditutup
cawan petri dan dibungkus. Didiamkan selama 10-15 menit kemudian diinkubasi
bakteri pada daerah bening di sekitar kertas cakram dengan menggunakan jangka
sorong. Bagan uji aktivitas antibakteri ekstrak daun pacar air dapat dilihat pada
lampiran 4 halaman 50.
Hasil uji aktivitas antibakteri ekstrak daun pacar air dapat dilihat pada
lampiran 5 halaman 51, dan gambar hasil uji aktivitas antibakteri ekstrak daun pacar
BAB IV
HASIL DAN PEMBAHASAN
Berdasarkan Identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense
Bidang Botani Pusat Penelitian biologi-LIPI, identitas sampel tumbuhan adalah
Impatiens balsamina L., suku Balsaminaceae.
Hasil pemeriksaan makroskopik terhadap daun segar yaitu berwarna hijau,
bentuk memanjang, berurat jelas dengan tepi yang bergerigi pada bagian tepinya,
panjang 10-18 cm dan lebar 2-4 cm. Berdaun tipis, berbau langu, tidak berasa dan
cepat layu, panjang tangkai daun berkisar 6-15 cm, bulat dan berwarna hijau
kemerahan. Pemeriksaan pada simplisia daun pacar air yaitu daun menggulung,
berwana hijau kecoklatan, tidak berbau dan tidak berasa.
Hasil pemeriksaan mikroskopik terhadap daun segar menunjukkan adanya
epidermis atas, rambut penutup, palisade, berkas pembuluh, jaringan bunga karang,
kristal kalsium oksalat bentuk sapu, kolenkim, stomata dan epidermis bawah.
Pemeriksaan serbuk simplisia menunjukkan adanya stomata tipe anomositik, rambut
penutup, kalsium oksalat bentuk sapu, dan berkas pembuluh xilem berbentuk spiral.
Hasil pemeriksaan karakteristik serbuk simplisia daun pacar air dapat dilihat
pada tabel 4.1 dibawah ini.
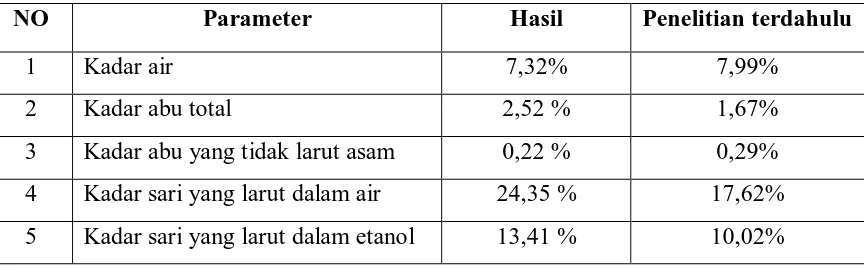
Tabel 4.1. Hasil Pemeriksaan Karakteristik Serbuk Simplisia
NO Parameter Hasil Penelitian terdahulu
1 Kadar air 7,32% 7,99%
2 Kadar abu total 2,52 % 1,67%
3 Kadar abu yang tidak larut asam 0,22 % 0,29%
4 Kadar sari yang larut dalam air 24,35 % 17,62%
Dari hasil yang diperoleh pada pemeriksaan karakteristik serbuk simplisia
daun pacar air dan dibandingkan dengan penelitian terdahulu. Hasilnya tidak terlalu
jauh. Hal ini dapat terjadi karena lingkungan tempat tumbuh berbeda sehingga
mengakibatkan perbedaan kadar kandungan senyawa aktif yang dipengaruhi oleh
keadaan tanah, cuaca dan tinggi tanah (Depkes RI, 2000). Hasil ini dibandingkan
karena Monografi dari serbuk simplisia dari daun pacar air tidak ditemukan di buku
Materia Medika Indonesia.
Penetapan kadar air dilakukan untuk mengetahui apakah simplisia memenuhi
persyaratan, karena air merupakan media yang baik untuk tumbuhnya kapang. hasil
yang diperoleh pada penetapan kadar air 7,32% berarti standarisasi simplisia
memenuhi persyaratan Materia Medika Indonesia yakni tidak lebih 10%. Apabila
kadar air simplisia lebih besar dari 10 % maka simplisia tersebut akan mudah
ditumbuhi kapang pada saat penyimpanan sehingga mutu simplisia akan menurun
(Gunawan dan Mulyani, 1995). Penetapan kadar sari larut air dilakukan untuk
mengetahui kadar senyawa yang bersifat polar, sedangkan kadar sari larut dalam
etanol untuk mengetahui senyawa yang terlarut dalam etanol baik polar maupun non
polar. Penetapan kadar abu total dilakukan untuk mengetahui kadar senyawa
anorganik dalam simplisia, misalnya Mg, Ca, Na, Pb, sedangkan penetapan kadar abu
tidak larut dalam asam untuk mengetahui kadar senyawa yang tidak larut dalam asam,
Hasil skrining fitokimia dari serbuk simplisia dan ekstrak daun pacar air dapat
dilihat pada tabel 4.2 dibawah ini.
Tabel 4.2. Hasil skrining fitokimia dari daun pacar air
No Parameter
Berdasarkan hasil pemeriksaan skrining fitokimia dari simplisia dan ekstrak daun
pacar air menunjukkan hasil yang sama bahwa mengandung senyawa kimia golongan
flavonoida, saponin, steroida dan glikosida.
Menurut Robinson, (1995) seyawa flavonoida, saponin dan triterpenoida
merupakan senyawa kimia yang memiliki potensi sebagai antibakteri dan antivirus.
Hasil penyarian 300 g serbuk simplisia daun pacar air dengan menggunakan
pelarut etanol, perkolat diuapkan dengan rotary evaporator, kemudian dikeringkan
dengan freeze dryer dan ditimbang. Ekstrak kental diperoleh sebanyak 67,33 g.
Ekstrak ini kemudian digunakan untuk uji aktivitas antibakteri terhadap bakteri
Staphylococcus aureus, Staphylococcus epidermidis dan Pseudomonas aeruginosa.
Hasil uji aktivitas antibakteri ekstrak etanol daun pacar air terhadap bakteri
Staphylococcus aureus, Staphylococcus epidermidis dan Pseudomonas aeruginosa
Tabel 4.3. Hasil uji aktivitas antibakteri ekstrak daun pacar air terhadap bakteri
Staphylococcus aureus, Staphylococcus epidermidis dan Pseudomonas aeruginosa.
Diameter hambat pertumbuhan mikroba (mm)* Staphylococcus
Metode yang digunakan pada penelitian ini adalah metode difusi agar dengan
menentukan diameter zona hambat, diameter zona hambat yang semakin meningkat
pada kenaikan konsentrasi. Hal ini membuktikan bahwa peningkatan konsentrasi
diameter zona hambat pertumbuhan bakteri Staphylococcus aureus, Staphylococcus
epidermidis dan Pseudomonas aeruginosa. Kepekaan ketiga jenis bakteri tersebut
terhadap ekstrak daun pacar air berbeda-beda. Konsentrasi 500 mg/ml menunjukkan
diameter yang lebih besar dibanding konsentrasi yang lebih rendah. Semakin tinggi
konsentrasi ekstrak etanol akan menghasilkan diameter daerah hambat yang semakin
besar pula (Dwidjoseputro, 1982).
Berdasarkan data diatas menunjukkan bahwa ekstrak daun pacar air dapat
menghambat pertumbuhan bakteri Staphylococcus aureus, Staphylococcus
epidermidis dan Pseudomonas aeruginosa. Hasil uji aktivitas dari ekstrak tersebut
diperoleh konsentrasi hambat minimum (KHM) bakteri Pseudomonas aeruginosa dan
Staphylococcus epidermidis sebesar 24 mg/ml sedangkan konsentrasi hambat
minimum (KHM) pada bakteri Staphylococcus aureus sebesar 12 mg/ml. Dengan
demikian ekstrak daun pacar air lebih kuat dalam menghambat pertumbuhan bakteri
Staphylococcus aureus dibandingkan Pseudomonas aeruginosa dan Staphylococcus epidermidis. Bakteri Pseudomonas aeruginosa merupakan bakteri gram negatif
sedangkan bakteri Staphylococcus aureus dan Staphylococcus epidermidis
merupakan bakteri gram positif.
Hasil penelitian terlihat bahwa ekstrak daun pacar air memberikan nilai
daerah hambat yang efektif sama besar terhadap bakteri gram positif dan gram
negatif. Walaupun, bakteri gram positif dan gram negatif memiliki komponen dan
struktur dinding sel yang berbeda yaitu dinding sel bakteri gram negatif mengandung
komponen lipid lebih banyak (11% -22 %) dari pada struktur dinding bakteri gram
positif mengandung komponen lipid lebih sedikit (1% - 4%) (Pelczar, 1986). Tetapi,