PENGARUH EKSTRAK TANAMAN CEREMAI, DELIMA PUTIH,
KECOMBRANG, KEMUNING, DAN JATI BELANDA TERHADAP
PENGHAMBATAN HEMOLISIS SEL ERITROSIT MANUSIA
SECARA IN VITRO
Oleh :
Ianre Meiko Renaldo Siagian
F24103103
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
PENGHAMBATAN HEMOLISIS SEL ERITROSIT MANUSIA
SECARA IN VITRO
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
IANRE MEIKO RENALDO SIAGIAN
F24103103
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
PENGARUH EKSTRAK TANAMAN CEREMAI, DELIMA PUTIH,
KECOMBRANG, KEMUNING, DAN JATI BELANDA TERHADAP
PENGHAMBATAN HEMOLISIS SEL ERITROSIT MANUSIA
SECARA IN VITRO
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
IANRE MEIKO RENALDO SIAGIAN
F24103103
Dilahirkan di Tarutung, 23 Mei 1985
Tanggal lulus : 20 Agustus 2007
Menyetujui :
Bogor, Agustus 2007
Dosen Pembimbing
Prof.Dr.Ir.Fransisca Zakaria R.,M.Sc
NIP.131.476.603
Mengetahui,
Dr.Ir.Dahrul Syah
Ianre Meiko R. F24103103. PENGARUH EKSTRAK TANAMAN CEREMAI, DELIMA PUTIH, KECOMBRANG, KEMUNING, DAN JATI BELANDA TERHADAP PENGHAMBATAN HEMOLISIS SEL ERITROSIT MANUSIA SECARA IN VITRO. Di bawah bimbingan Fransisca Zakaria Rungkat.
RINGKASAN
Peroksidasi terus menerus terhadap komponen membran merupakan salah satu penyebab timbulnya penyakit degeneratif. Umumnya peroksidasi terjadi pada lapisan lipid dan protein dari membran seluler. Eritrosit sangat mudah mengalami lipid peroksidasi dikarenakan kandungan lemak tidak jenuh ganda yang sangat tinggi, kandungan oksigen yang tinggi, dan keberadaan logam transisi.
Penelitian ini bertujuan mengetahui aktivitas antioksidan (aktivitas penghambatan hemolisis) ekstrak daun ceremai, daun delima putih, daun jati belanda, daun kemuning, dan bunga kecombrang secara in vitro terhadap sel eritrosit. Tujuan lain penelitian ini adalah mengembangkan potensi tanaman indigenus Indonesia dan memperoleh data-data yang dapat dijadikan salah satu acuan dalam pengembangan pangan fungsional.
Penelitian ini dibagi menjadi beberapa tahap. Tahap pertama merupakan proses ekstraksi dari sampel segar yang akan diuji. Tahap kedua merupakan analisa kimia dari sampel segar dan hasil ekstraksi yang meliputi analisis kadar air, analisis kadar protein, analisis total fenol, dan analisis kapasitas antioksidan. Tahap ketiga merupakan isolasi sel eritrosit dan pengujian respons perlindungan eritrosit terhadap hemolisis oleh masing-masing hasil ekstrak.
Tahap ekstraksi sampel segar dilakukan terhadap daun ceremai, delima putih, jati belanda, kemuning, dan bunga kecombrang. Ekstraksi dilakukan dengan menggunakan pelarut akuades dan etanol 96% dengan menggunakan perbandingan sampel dan pelarut yang biasa digunakan pada konsumsi normal masyarakat.
Hasil ekstraksi merupakan hasil perbandingan sampel bahan segar dan pelarut sebesar dua kali konsentrasi konsumsi normal masyarakat. Bobot hasil ekstraksi dengan volume 10 ml menggunakan akuades pada daun ceremai adalah 10.50 gram, daun kemuning sebesar 11.70 gram, bunga kecombrang sebesar 10.90 gram, daun delima putih sebesar 11.43 gram, dan daun jati belanda adalah 8.89 gram. Bobot hasil ekstraksi dengan volume 10 ml menggunakan etanol 96 % pada daun ceremai adalah 9.42 gram, daun kemuning sebesar 9.36 gram, bunga kecombrang sebesar 9.31 gram, daun delima putih sebesar 8.94 gram, dan daun jati belanda adalah 8.80 gram.
Analisis kimia dilakukan terhadap sampel segar dan hasil ekstraksi. Analisis kimia yang dilakukan terhadap sampel segar antara lain analisis kadar air dan kadar protein. Kadar air dan kadar protein berpengaruh terhadap kondisi bahan segar dan komponen aktif yang terdapat di dalamnya. Protein dapat berikatan dengan komponen fenolik pada sampel segar dan kandungan nutrisinya.
delima putih sebesar 5.88 %, bunga kecombrang sebesar 1.38 %, daun kemuning sebesar 4.65 %, dan daun jati belanda sebesar 6.05 %.
Analisis kimia yang dilakukan terhadap hasil ekstraksi antara lain analisis total kandungan fenol dan kapasitas antioksidan dengan menggunakan DPPH. Analisis total kandungan fenol akan memberikan data mengenai kuantitas komponen fenolik pada hasil ekstraksi. Sedangkan analisis kapasitas antioksidan akan memberikan data mengenai aktivitas pereduksi radikal bebas oleh komponen aktif pada hasil ekstraksi, diantaranya merupakan komponen fenolik.
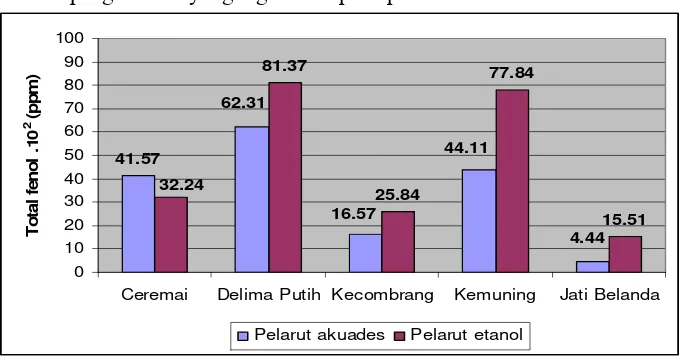
Analisis total kandungan fenol dilakukan terhadap hasil ekstrak masing-masing pelarut. Berdasarkan pengujian, kandungan fenol hasil ekstraksi pelarut akuades pada daun ceremai sebesar 41.57x102 ppm, daun delima putih sebesar 62.31x102 ppm, bunga kecombrang sebesar 16.57x102 ppm, daun kemuning sebesar 44.11x102 ppm, dan daun jati belanda sebesar 4.44x102 ppm. Sedangkan kandungan fenol hasil ekstraksi pelarut etanol pada daun ceremai sebesar 32.24x102 ppm, daun delima putih sebesar 81.37x102 ppm , bunga kecombrang sebesar 25.84x102 ppm, daun kemuning sebesar 77.84x102 ppm, dan daun jati belanda sebesar 15.51x102 ppm.
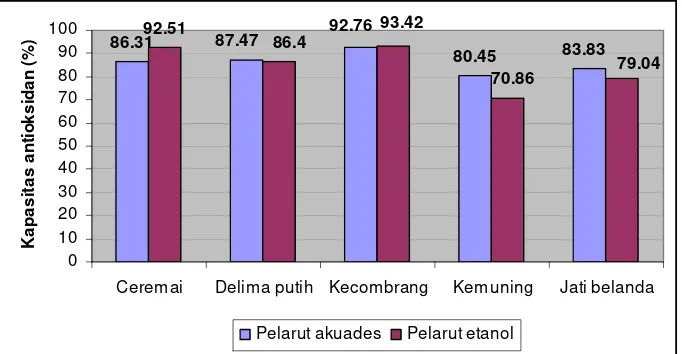
Analisis kapasitas antioksidan dengan menggunakan DPPH dilakukan terhadap hasil ekstrak masing-masing pelarut. Berdasarkan pengujian, kapasitas antioksidan hasil ekstraksi pelarut akuades pada daun ceremai sebesar 86.31 %, daun delima putih sebesar 87.47 %, bunga kecombrang 92.76 %, daun kemuning sebesar 80.45 %, dan daun jati belanda sebesar 83.83 %. Sedangkan kapasitas antioksidan hasil ekstraksi pelarut etanol pada daun ceremai sebesar 92.51 %, daun delima putih sebesar 86.40 %, bunga kecombrang sebesar 93.42 %, daun kemuning sebesar 70.86 %, dan daun jati belanda sebesar 79.04 %.
Sel eritrosit yang telah diisolasi akan diinkubasi dengan menggunakan media Phosphat Buffered Saline. Ke dalam suspensi eritrosit ini ditambahkan larutan pengoksidasi yaitu hidrogen peroksida (H2O2) 0.5 % dan formaldehid 5 %. Uji respons perlindungan eritrosit dilakukan dengan penambahan hasil ekstrak kepada masing-masing suspensi dan pembacaan nilai absorbansi pada
Spectrophotometer Microplate Reader selama 120 menit pada selang waktu 20 menit.
Hasil ekstraksi yang ditambahkan memiliki 3 konsentrasi, yaitu C1 (perbandingan sampel segar dua kali lebih banyak dari konsumsi normal pada pelarut), C2 (perbandingan sampel segar sama dengan konsumsi normal pada pelarut), dan C3 (perbandingan sampel segar setengah dari konsumsi normal pada pelarut).
Berdasarkan pengamatan diperoleh data aktivitas penghambatan hemolisis dengan menggunakan larutan penguji H2O2 0.5 %, tertinggi dicapai ekstrak C2 ceremai akuades sebesar 98.06 %. Aktivitas penghambatan hemolisis terkecil dicapai ekstrak C3 delima etanol sebesar 12.01 %. Aktivitas penghambatan hemolisis awal (menit ke-0) tertinggi dicapai ekstrak C1 ceremai etanol sebesar 90.84 % dan terendah diperoleh ekstrak C3 kecombrang akuades sebesar 30 %. Aktivitas penghambatan hemolisis akhir (menit ke-120) tertinggi dicapai ekstrak C2 ceremai akuades sebesar 98.06 %, dan terendah diperoleh ekstrak C1 kemuning akuades sebesar 28.74 %.
Aktivitas penghambatan hemolisis terkecil dicapai ekstrak C1 kecombrang akuades sebesar 25.11 %. Aktivitas penghambatan hemolisis awal (menit ke-0) tertinggi dicapai ekstrak C1 kemuning etanol sebesar 99.53 % dan terendah diperoleh ekstrak C1 kemuning akuades sebesar 43.08 %. Aktivitas penghambatan hemolisis akhir (menit ke-120) tertinggi dicapai ekstrak C1 kemuning etanol sebesar 95.86 %, dan terendah diperoleh ekstrak C1 kecombrang akuades sebesar 25.11 %.
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan Yesus Kristus sehingga penulis dapat melaksanakan dan menyelesaikan penelitian serta penyusunan skripsi ini dengan baik. Pada kesempatan ini penulis menyampaikan rasa terima kasih sebesar-besarnya serta permohonan maaf atas semua hal yang kurang berkenan selama ini kepada ;
1. Prof. Dr. Ir. Fransisca Zakaria Rungkat, MSc selaku dosen pembimbing yang telah memberikan bimbingan dan arahan dalam studi dan penyelesaian skripsi ini.
2. Dr. Ir. Sukarno yang telah berkenan menguji dan memberi masukan dalam penyusunan skripsi ini.
3. Dias Indrasti, STP selaku dosen penguji atas kesediaan menguji dan saran-saran yang diberikan kepada penulis.
4. H.M.Siagian dan R.Sinaga, kakakku : Linggom, Donni, Susi, dan Asido atas perhatian, kesabaran, dukungan, kasih sayang, dan pengorbanannya yang selalu diberikan kepada penulis.
5. Buat Agnes, yang selalu menemani, memberi kasih sayang, pengorbanan, pemikiran dan dukungan, serta semua tingkah laku dan perbuatan yang pernah dilakukannya secara sadar atau tidak (SuarakuwAbzJDNygNd. Panahnyanah???), I Always Love U.
6. Temanku satu bimbingan Novi, atas perhatian, dukungan, masukan dan semangatnya.
7. Anak malam dan gamers TPG’40 (Teddy, Ryal, Aca, Steph, Widhi, Iin, Dini, Hendi, Agus) untuk waktu dan masukan-masukannya.
8. Teman-temanku sekost (Kaninta, Martin, Steph, Hengky) yang telah menemani penulis melewati hari-harinya, khusus Babeh atas pengorbanan komputernya.
10.Sahabat-sahabat sejatiku dalam kelompok praktikum (Noor, Wati, dan Nat-nat), serta anak-anak golongan C atas bantuan dan kebersamaannya selama ini.
11.Rekan-rekan futsalku yang terlalu banyak untuk disebutkan atas kebersamaan, semangat, kerjasama, dan dukungannya baik di lapangan atau luar lapangan.
12.Seluruh teman-teman TPG’40 yang belum disebutkan atas segala kebersamaan dan waktu yang menyenangkan selama ini.
13.Seluruh jajaran staf dan karyawan Departemen ITP-IPB yang telah banyak membantu dan kerjasamanya selama penulis menempuh pendidikan di IPB 14.Pak Gatot, Bu Rubiyah, Pak Wahid, Pak Sobirin, Pak Yahya, Pak Koko,
Pak Rojak. Terima kasih atas bantuannya.
15.Semua pihak yang tidak dapat disebutkan satu persatu, atas semua bantuan, masukan, kritik, simpati, empati kepada penulis.
Akhir kata, masih banyak ketidaksempurnaan pada karya ini. Walaupun demikian, semoga sebuah karya kecil ini dapat memberikan manfaat dan berguna bagi kita semua.
Bogor, Agustus 2007
DAFTAR ISI
Halaman
RINGKASAN ... i
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... xi
I. PENDAHULUAN ... 1
A. LATAR BELAKANG... 1
B. TUJUAN ... 2
II. TINJAUAN PUSTAKA ... 3
A. CEREMAI (Phyllanthus acidus [L.] Skeels) ... 3
B. DELIMA PUTIH (Punica granatum Linn) ... 4
C. KECOMBRANG (Nicolaia speciosa Horan) ... 6
D. KEMUNING (Murraya paniculata [L.] Jack) ... 7
E. JATI BELANDA (Guazoma ulmifolia Lamk) ... 8
F. ERITROSIT ... 9
G. HEMOLISIS ERITROSIT ... 10
H. ANTIOKSIDAN ... 13
I. KOMPONEN FENOLIK ... 16
J. PENGGUNAAN SEL ERITROSIT UNTUK UJI IN VITRO ... 17
III. BAHAN DAN METODE ... 20
A. BAHAN DAN ALAT ... 20
B. METODE PENELITIAN ... 21
1. Ekstraksi ... 21
1.1. Ekstraksi dengan pelarut akuades ... 22
1.2. Ekstraksi dengan pelarut etanol ... 22
1.3. Persiapan hasil ekstraksi untuk inkubasi sel eritrosit ... 23
2. Analisis Kimia ... 23
2.1. Analisis kadar air metode oven ... 23
2.3. Analisis total fenol ... 25
2.4. Analisis kapasitas antioksidan ... 25
3. Isolasi Sel Eritrosit ... 25
4. Pengujian Respons Perlindungan Eritrosit Terhadap Hemolisis .... 27
IV. HASIL DAN PEMBAHASAN ... 29
1. Ekstraksi ... 29
2. Analisa Kimia... 31
2.1. Kadar Air ... 31
2.2. Kadar Protein ... 32
2.3. Total Fenol ... 34
2.4. Kapasitas Antioksidan ... 36
3. Pengujian Respons Perlindungan Eritrosit Terhadap Hemolisis ... 38
3.1. Uji respons penghambatan hemolisis oleh H2O2 ... 40
3.2. Uji respons penghambatan hemolisis oleh formaldehid ... 48
3.3. Pengujian aktivitas penghambatan hemolisis sel eritrosit dengan trifan biru ... 57
V. KESIMPULAN DAN SARAN ... 59
A. KESIMPULAN ... 59
B. SARAN ... 60
DAFTAR PUSTAKA ... 61
LAMPIRAN ... 65
PENGARUH EKSTRAK TANAMAN CEREMAI, DELIMA PUTIH,
KECOMBRANG, KEMUNING, DAN JATI BELANDA TERHADAP
PENGHAMBATAN HEMOLISIS SEL ERITROSIT MANUSIA
SECARA IN VITRO
Oleh :
Ianre Meiko Renaldo Siagian
F24103103
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
PENGHAMBATAN HEMOLISIS SEL ERITROSIT MANUSIA
SECARA IN VITRO
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
IANRE MEIKO RENALDO SIAGIAN
F24103103
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
PENGARUH EKSTRAK TANAMAN CEREMAI, DELIMA PUTIH,
KECOMBRANG, KEMUNING, DAN JATI BELANDA TERHADAP
PENGHAMBATAN HEMOLISIS SEL ERITROSIT MANUSIA
SECARA IN VITRO
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh :
IANRE MEIKO RENALDO SIAGIAN
F24103103
Dilahirkan di Tarutung, 23 Mei 1985
Tanggal lulus : 20 Agustus 2007
Menyetujui :
Bogor, Agustus 2007
Dosen Pembimbing
Prof.Dr.Ir.Fransisca Zakaria R.,M.Sc
NIP.131.476.603
Mengetahui,
Dr.Ir.Dahrul Syah
Ianre Meiko R. F24103103. PENGARUH EKSTRAK TANAMAN CEREMAI, DELIMA PUTIH, KECOMBRANG, KEMUNING, DAN JATI BELANDA TERHADAP PENGHAMBATAN HEMOLISIS SEL ERITROSIT MANUSIA SECARA IN VITRO. Di bawah bimbingan Fransisca Zakaria Rungkat.
RINGKASAN
Peroksidasi terus menerus terhadap komponen membran merupakan salah satu penyebab timbulnya penyakit degeneratif. Umumnya peroksidasi terjadi pada lapisan lipid dan protein dari membran seluler. Eritrosit sangat mudah mengalami lipid peroksidasi dikarenakan kandungan lemak tidak jenuh ganda yang sangat tinggi, kandungan oksigen yang tinggi, dan keberadaan logam transisi.
Penelitian ini bertujuan mengetahui aktivitas antioksidan (aktivitas penghambatan hemolisis) ekstrak daun ceremai, daun delima putih, daun jati belanda, daun kemuning, dan bunga kecombrang secara in vitro terhadap sel eritrosit. Tujuan lain penelitian ini adalah mengembangkan potensi tanaman indigenus Indonesia dan memperoleh data-data yang dapat dijadikan salah satu acuan dalam pengembangan pangan fungsional.
Penelitian ini dibagi menjadi beberapa tahap. Tahap pertama merupakan proses ekstraksi dari sampel segar yang akan diuji. Tahap kedua merupakan analisa kimia dari sampel segar dan hasil ekstraksi yang meliputi analisis kadar air, analisis kadar protein, analisis total fenol, dan analisis kapasitas antioksidan. Tahap ketiga merupakan isolasi sel eritrosit dan pengujian respons perlindungan eritrosit terhadap hemolisis oleh masing-masing hasil ekstrak.
Tahap ekstraksi sampel segar dilakukan terhadap daun ceremai, delima putih, jati belanda, kemuning, dan bunga kecombrang. Ekstraksi dilakukan dengan menggunakan pelarut akuades dan etanol 96% dengan menggunakan perbandingan sampel dan pelarut yang biasa digunakan pada konsumsi normal masyarakat.
Hasil ekstraksi merupakan hasil perbandingan sampel bahan segar dan pelarut sebesar dua kali konsentrasi konsumsi normal masyarakat. Bobot hasil ekstraksi dengan volume 10 ml menggunakan akuades pada daun ceremai adalah 10.50 gram, daun kemuning sebesar 11.70 gram, bunga kecombrang sebesar 10.90 gram, daun delima putih sebesar 11.43 gram, dan daun jati belanda adalah 8.89 gram. Bobot hasil ekstraksi dengan volume 10 ml menggunakan etanol 96 % pada daun ceremai adalah 9.42 gram, daun kemuning sebesar 9.36 gram, bunga kecombrang sebesar 9.31 gram, daun delima putih sebesar 8.94 gram, dan daun jati belanda adalah 8.80 gram.
Analisis kimia dilakukan terhadap sampel segar dan hasil ekstraksi. Analisis kimia yang dilakukan terhadap sampel segar antara lain analisis kadar air dan kadar protein. Kadar air dan kadar protein berpengaruh terhadap kondisi bahan segar dan komponen aktif yang terdapat di dalamnya. Protein dapat berikatan dengan komponen fenolik pada sampel segar dan kandungan nutrisinya.
delima putih sebesar 5.88 %, bunga kecombrang sebesar 1.38 %, daun kemuning sebesar 4.65 %, dan daun jati belanda sebesar 6.05 %.
Analisis kimia yang dilakukan terhadap hasil ekstraksi antara lain analisis total kandungan fenol dan kapasitas antioksidan dengan menggunakan DPPH. Analisis total kandungan fenol akan memberikan data mengenai kuantitas komponen fenolik pada hasil ekstraksi. Sedangkan analisis kapasitas antioksidan akan memberikan data mengenai aktivitas pereduksi radikal bebas oleh komponen aktif pada hasil ekstraksi, diantaranya merupakan komponen fenolik.
Analisis total kandungan fenol dilakukan terhadap hasil ekstrak masing-masing pelarut. Berdasarkan pengujian, kandungan fenol hasil ekstraksi pelarut akuades pada daun ceremai sebesar 41.57x102 ppm, daun delima putih sebesar 62.31x102 ppm, bunga kecombrang sebesar 16.57x102 ppm, daun kemuning sebesar 44.11x102 ppm, dan daun jati belanda sebesar 4.44x102 ppm. Sedangkan kandungan fenol hasil ekstraksi pelarut etanol pada daun ceremai sebesar 32.24x102 ppm, daun delima putih sebesar 81.37x102 ppm , bunga kecombrang sebesar 25.84x102 ppm, daun kemuning sebesar 77.84x102 ppm, dan daun jati belanda sebesar 15.51x102 ppm.
Analisis kapasitas antioksidan dengan menggunakan DPPH dilakukan terhadap hasil ekstrak masing-masing pelarut. Berdasarkan pengujian, kapasitas antioksidan hasil ekstraksi pelarut akuades pada daun ceremai sebesar 86.31 %, daun delima putih sebesar 87.47 %, bunga kecombrang 92.76 %, daun kemuning sebesar 80.45 %, dan daun jati belanda sebesar 83.83 %. Sedangkan kapasitas antioksidan hasil ekstraksi pelarut etanol pada daun ceremai sebesar 92.51 %, daun delima putih sebesar 86.40 %, bunga kecombrang sebesar 93.42 %, daun kemuning sebesar 70.86 %, dan daun jati belanda sebesar 79.04 %.
Sel eritrosit yang telah diisolasi akan diinkubasi dengan menggunakan media Phosphat Buffered Saline. Ke dalam suspensi eritrosit ini ditambahkan larutan pengoksidasi yaitu hidrogen peroksida (H2O2) 0.5 % dan formaldehid 5 %. Uji respons perlindungan eritrosit dilakukan dengan penambahan hasil ekstrak kepada masing-masing suspensi dan pembacaan nilai absorbansi pada
Spectrophotometer Microplate Reader selama 120 menit pada selang waktu 20 menit.
Hasil ekstraksi yang ditambahkan memiliki 3 konsentrasi, yaitu C1 (perbandingan sampel segar dua kali lebih banyak dari konsumsi normal pada pelarut), C2 (perbandingan sampel segar sama dengan konsumsi normal pada pelarut), dan C3 (perbandingan sampel segar setengah dari konsumsi normal pada pelarut).
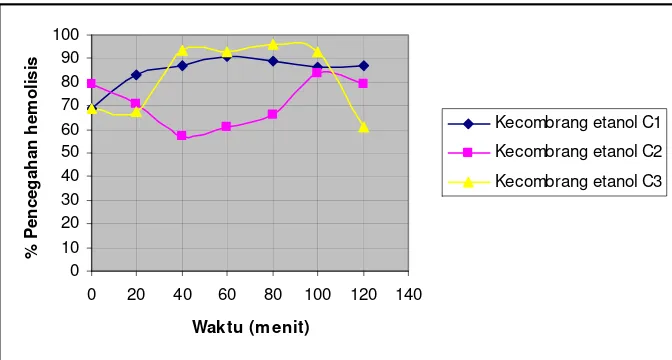
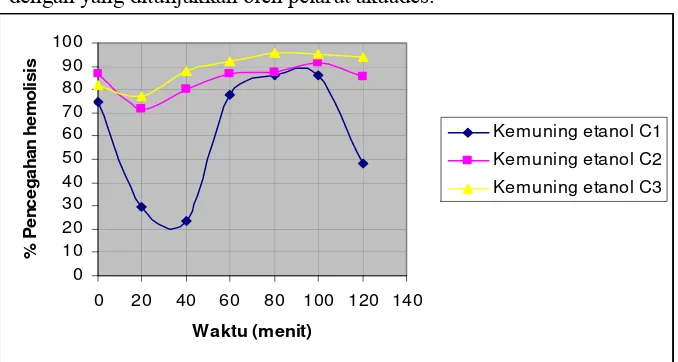
Berdasarkan pengamatan diperoleh data aktivitas penghambatan hemolisis dengan menggunakan larutan penguji H2O2 0.5 %, tertinggi dicapai ekstrak C2 ceremai akuades sebesar 98.06 %. Aktivitas penghambatan hemolisis terkecil dicapai ekstrak C3 delima etanol sebesar 12.01 %. Aktivitas penghambatan hemolisis awal (menit ke-0) tertinggi dicapai ekstrak C1 ceremai etanol sebesar 90.84 % dan terendah diperoleh ekstrak C3 kecombrang akuades sebesar 30 %. Aktivitas penghambatan hemolisis akhir (menit ke-120) tertinggi dicapai ekstrak C2 ceremai akuades sebesar 98.06 %, dan terendah diperoleh ekstrak C1 kemuning akuades sebesar 28.74 %.
Aktivitas penghambatan hemolisis terkecil dicapai ekstrak C1 kecombrang akuades sebesar 25.11 %. Aktivitas penghambatan hemolisis awal (menit ke-0) tertinggi dicapai ekstrak C1 kemuning etanol sebesar 99.53 % dan terendah diperoleh ekstrak C1 kemuning akuades sebesar 43.08 %. Aktivitas penghambatan hemolisis akhir (menit ke-120) tertinggi dicapai ekstrak C1 kemuning etanol sebesar 95.86 %, dan terendah diperoleh ekstrak C1 kecombrang akuades sebesar 25.11 %.
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan Yesus Kristus sehingga penulis dapat melaksanakan dan menyelesaikan penelitian serta penyusunan skripsi ini dengan baik. Pada kesempatan ini penulis menyampaikan rasa terima kasih sebesar-besarnya serta permohonan maaf atas semua hal yang kurang berkenan selama ini kepada ;
1. Prof. Dr. Ir. Fransisca Zakaria Rungkat, MSc selaku dosen pembimbing yang telah memberikan bimbingan dan arahan dalam studi dan penyelesaian skripsi ini.
2. Dr. Ir. Sukarno yang telah berkenan menguji dan memberi masukan dalam penyusunan skripsi ini.
3. Dias Indrasti, STP selaku dosen penguji atas kesediaan menguji dan saran-saran yang diberikan kepada penulis.
4. H.M.Siagian dan R.Sinaga, kakakku : Linggom, Donni, Susi, dan Asido atas perhatian, kesabaran, dukungan, kasih sayang, dan pengorbanannya yang selalu diberikan kepada penulis.
5. Buat Agnes, yang selalu menemani, memberi kasih sayang, pengorbanan, pemikiran dan dukungan, serta semua tingkah laku dan perbuatan yang pernah dilakukannya secara sadar atau tidak (SuarakuwAbzJDNygNd. Panahnyanah???), I Always Love U.
6. Temanku satu bimbingan Novi, atas perhatian, dukungan, masukan dan semangatnya.
7. Anak malam dan gamers TPG’40 (Teddy, Ryal, Aca, Steph, Widhi, Iin, Dini, Hendi, Agus) untuk waktu dan masukan-masukannya.
8. Teman-temanku sekost (Kaninta, Martin, Steph, Hengky) yang telah menemani penulis melewati hari-harinya, khusus Babeh atas pengorbanan komputernya.
10.Sahabat-sahabat sejatiku dalam kelompok praktikum (Noor, Wati, dan Nat-nat), serta anak-anak golongan C atas bantuan dan kebersamaannya selama ini.
11.Rekan-rekan futsalku yang terlalu banyak untuk disebutkan atas kebersamaan, semangat, kerjasama, dan dukungannya baik di lapangan atau luar lapangan.
12.Seluruh teman-teman TPG’40 yang belum disebutkan atas segala kebersamaan dan waktu yang menyenangkan selama ini.
13.Seluruh jajaran staf dan karyawan Departemen ITP-IPB yang telah banyak membantu dan kerjasamanya selama penulis menempuh pendidikan di IPB 14.Pak Gatot, Bu Rubiyah, Pak Wahid, Pak Sobirin, Pak Yahya, Pak Koko,
Pak Rojak. Terima kasih atas bantuannya.
15.Semua pihak yang tidak dapat disebutkan satu persatu, atas semua bantuan, masukan, kritik, simpati, empati kepada penulis.
Akhir kata, masih banyak ketidaksempurnaan pada karya ini. Walaupun demikian, semoga sebuah karya kecil ini dapat memberikan manfaat dan berguna bagi kita semua.
Bogor, Agustus 2007
DAFTAR ISI
Halaman
RINGKASAN ... i
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... xi
I. PENDAHULUAN ... 1
A. LATAR BELAKANG... 1
B. TUJUAN ... 2
II. TINJAUAN PUSTAKA ... 3
A. CEREMAI (Phyllanthus acidus [L.] Skeels) ... 3
B. DELIMA PUTIH (Punica granatum Linn) ... 4
C. KECOMBRANG (Nicolaia speciosa Horan) ... 6
D. KEMUNING (Murraya paniculata [L.] Jack) ... 7
E. JATI BELANDA (Guazoma ulmifolia Lamk) ... 8
F. ERITROSIT ... 9
G. HEMOLISIS ERITROSIT ... 10
H. ANTIOKSIDAN ... 13
I. KOMPONEN FENOLIK ... 16
J. PENGGUNAAN SEL ERITROSIT UNTUK UJI IN VITRO ... 17
III. BAHAN DAN METODE ... 20
A. BAHAN DAN ALAT ... 20
B. METODE PENELITIAN ... 21
1. Ekstraksi ... 21
1.1. Ekstraksi dengan pelarut akuades ... 22
1.2. Ekstraksi dengan pelarut etanol ... 22
1.3. Persiapan hasil ekstraksi untuk inkubasi sel eritrosit ... 23
2. Analisis Kimia ... 23
2.1. Analisis kadar air metode oven ... 23
2.3. Analisis total fenol ... 25
2.4. Analisis kapasitas antioksidan ... 25
3. Isolasi Sel Eritrosit ... 25
4. Pengujian Respons Perlindungan Eritrosit Terhadap Hemolisis .... 27
IV. HASIL DAN PEMBAHASAN ... 29
1. Ekstraksi ... 29
2. Analisa Kimia... 31
2.1. Kadar Air ... 31
2.2. Kadar Protein ... 32
2.3. Total Fenol ... 34
2.4. Kapasitas Antioksidan ... 36
3. Pengujian Respons Perlindungan Eritrosit Terhadap Hemolisis ... 38
3.1. Uji respons penghambatan hemolisis oleh H2O2 ... 40
3.2. Uji respons penghambatan hemolisis oleh formaldehid ... 48
3.3. Pengujian aktivitas penghambatan hemolisis sel eritrosit dengan trifan biru ... 57
V. KESIMPULAN DAN SARAN ... 59
A. KESIMPULAN ... 59
B. SARAN ... 60
DAFTAR PUSTAKA ... 61
LAMPIRAN ... 65
DAFTAR TABEL
Halaman
Tabel 1. Konsumsi normal masyarakat terhadap kelima tanaman ... 21
Tabel 2. Perbandingan sampel dan pelarut ... 22
Tabel 3. Bobot hasil ekstraksi sampel tanaman pada volume 10 ml ... 30
Tabel 4. Kadar air sampel bahan segar ... 32
Tabel 5. Kadar protein sampel bahan segar ... 33
Tabel 6. Absorbansi kurva standar asam tanat ... 34
Tabel 7. Perluasan taraf konsentrasi masing-masing hasil ekstraksi ... 65
Tabel 8. Data absorbansi kurva standar asam askorbat... 74
DAFTAR GAMBAR
Halaman Gambar 1. Ceremai ... 4 Gambar 2. Delima putih ... 5 Gambar 3. Kecombrang ... 6 Gambar 4. Kemuning ... 8 Gambar 5. Jati belanda ... 9 Gambar 6. Sel eritrosit ... 10 Gambar 7. Perbandingan eritrosit, trombosit, dan leukosit... 10 Gambar 8. Mekanisme reaksi antioksidan pada DPPH ... 15 Gambar 9. Hasil pemisahan sel eritrosit menggunakan Hystopaque .... 27 Gambar 10. Total kandungan fenol hasil ekstraksi ... 34 Gambar 11. Kapasitas antioksidan ekstrak dengan metode DPPH ... 36 Gambar 12. Persentase pencegahan hemolisis tiap waktu pengamatan
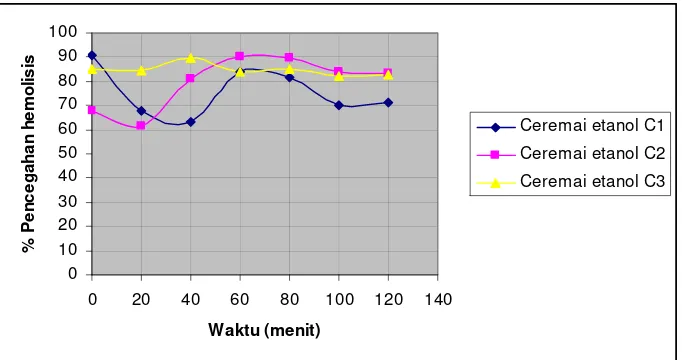
ekstrak ceremai akuades ... 41 Gambar 13. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak ceremai etanol ... 41 Gambar 14. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak delima akuades ... 43 Gambar 15. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak delima etanol... 43 Gambar 16. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak kecombran akuades ... 44 Gambar 17. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak kecombrang etanol ... 45 Gambar 18. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak kemuning akuades ... 45 Gambar 19. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak kemuning etanol ... 46 Gambar 20. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak jati belanda akuades ... 47 Gambar 21. Persentase pencegahan hemolisis tiap waktu pengamatan
Gambar 22. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak ceremai akuades ... 49 Gambar 23. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak ceremai etanol ... 49 Gambar 24. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak delima akuades ... 50 Gambar 25. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak delima etanol... 51 Gambar 26. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak kecombrang akuades... 52 Gambar 27. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak kecombrang etanol ... 53 Gambar 28. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak kemuning akuades ... 54 Gambar 29. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak kemuning etanol ... 54 Gambar 30. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak jati belanda akuades ... 55 Gambar 31. Persentase pencegahan hemolisis tiap waktu pengamatan
ekstrak jati belanda etanol ... 56 Gambar 32. Perbandingan jumlah sel eritrosit hidup dengan
menggunakan H2O2 ... 57 Gambar 33. Perbandingan jumlah sel eritrosit hidup dengan
menggunakan formaldehid ... 58 Gambar 34. Sel eritrosit (perbesaran 400x); a) kontrol (menit ke-0), b)
penambahan H2O2 (menit ke-120), c) penambahan formaldehid (menit ke-120), d) penambahan hasil ekstraksi pada uji dengan menggunakan H2O2 (menit
DAFTAR LAMPIRAN
I. PENDAHULUAN
A. LATAR BELAKANG
Berbagai jenis tanaman telah dipercaya berkhasiat untuk meningkatkan atau menjaga kesehatan seseorang. Indonesia memiliki banyak sekali jenis tanaman obat yang belum sepenuhnya diteliti kandungan dan khasiatnya. Seperti diketahui, penduduk Indonesia telah sejak lama menggunakan berbagai tanaman tersebut secara tradisional dalam bentuk ramuan untuk pengobatan atau bahan olahan pangan sehari-hari.
Terdapat lima tanaman yang memiliki potensi untuk dikembangkan menjadi salah satu komponen pangan fungsional. Tanaman tersebut antara lain adalah Ceremai (Phyllanthus acidus [L.] Skeels.), Delima Putih (Punica
granatum Linn), Kecombrang (Nicolaia speciosa Horan), Kemuning
(Murraya paniculata [L..] Jack.) dan Jati Belanda (Guazuma ulmifolia Lamk).
Kelima tanaman ini mengandung komponen aktif yang dipercaya memiliki aktivitas antioksidan yang cukup tinggi seperti komponen fenolik.
Pengembangan suatu produk pangan memerlukan beberapa langkah-langkah tertentu agar dapat diterima sebagai salah satu produk yang dipercaya bersifat fungsional. Metode uji untuk memastikan fungsionalitas dari bahan pangan atau pangan olahan sangat penting untuk menentukan dosis keamanan, klaim dan pelabelan. Uji bioavailabilitas dan fungsi metabolik juga bersifat esensial karena hasil analisa kimia mengenai kadar suatu senyawa belum tentu merefleksikan fungsionalitasnya karena adanya faktor-faktor pencernaan, metabolisme, dan matriks bahan pangan yang mempengaruhi ketersediaan zat tersebut (Zakaria et.al., 2001).
Metode uji fungsionalitas antioksidan dapat dibedakan menjadi beberapa cara, antara lain ; a. Sistem kimia dengan substrat asam lemak tidak jenuh, b. Sistem semi biologis dengan LDL / lipoprotein, c. Sistem biologis dengan sel hidup yang dapat berupa sel-sel primer dari organ hewan atau darah manusia, atau alur-alur turunan sel, d. Sistem in vivo dengan pemberian makan pada hewan percobaan atau subjek manusia (Zakaria et.al., 2001).
Data-data yang diperoleh nantinya diharapkan dapat menjadi salah satu acuan yang diperlukan untuk mengembangkan produk pangan fungsional. Uji aktivitas antioksidan yang dilakukan pada penelitian ini adalah aktivitas penghambatan hemolisis dari sel eritrosit yang diinduksi oleh senyawa-senyawa oksidator seperti hidrogen peroksida atau senyawa-senyawa aldehid seperti formaldehid. Data tersebut diharapkan dapat memberitahukan konsentrasi optimal atau interaksi dari komponen-komponen aktif tersebut pada sel tubuh manusia terutama sel eritrosit.
B. TUJUAN
II. TINJAUAN PUSTAKA
A. Ceremai (Phyllanthus acidus [L.] Skeels.)
Ceremai merupakan tanaman yang berasal dari India yang termasuk ke dalam famili Euphorbiaccae. Ceremai dapat tumbuh hingga ketinggian 1000 meter dpl dan bertahan hidup pada tanah dengan kondisi kekurangan air (IPTEKa, 2005 ). Ceremai sendiri diketahui tumbuh hampir di seluruh bagian kepulauan Indonesia terutama di Sumatera, Jawa, Sulewesi, kepulauan Nusa Tenggara, dan Maluku.
Daun ceremai tunggal, bertangkai pendek, tersusun dalam tangkai membentuk rangkaian seperti daun majemuk. Helai daun ceremai bundar telur sampai jorong, ujung runcing, pangkal tumpul sampai bundar, tepi rata, pertulangan menyirip, permukaan licin tidak berambut, panjang 2-7 cm, lebar 1,5-4 cm, dan warna hijau muda. Daun muda ceremai dapat digunakan sebagai sayuran dan apabila digunakan bersamaan dengan buahnya dapat menyedapkan masakan karena memberi rasa asam (IPTEKa, 2005).
Gambar 1. Ceremai (Phyllanthus acidus [L.] Skeels.)
Sumber : IPTEK (2005a)
B. Delima Putih (Punica granatum Linn)
Delima merupakan tanaman yang berasal dari Timur Tengah, tersebar dari daerah subtropik hingga tropik dan dapat tumbuh hingga ketinggian 1000 m dpl. Tumbuhan ini biasa ditanam pada tanah gembur yang tidak terendam air, dengan air tanah yang tidak terlalu dalam. Delima sendiri sering ditanam sebagai tanaman hias dan tanaman obat karena buahnya yang dapat dimakan (IPTEKb, 2005).
Bagian tanaman yang digunakan sebagai obat adalah kulit kayu, kulit akar, kulit buah, daun, biji, dan bunganya. Kandungan kimia bagian tanaman ini adalah kulit buah mengandung alkaloid pelletierene, granatin, betulic acid, ursolic acid, isoquercitrin, elligatanin, resin, triterpenoid, kalsium oksalat, dan pati. Kulit akar dan kulit kayu mengandung sekitar 20% elligatanin dan 0,5-1% senyawa alkaloid, antara lain alkaloid pelletierine (C8H14), pseudopelletierine (C9H15), metilpelletierine (C8H14.CH3),
isopelletierine (C8H15), dan metilisopellettierine (C9H1). Daun mengandung
alkaloid, tanin, kalsium oksalat, lemak, sulfur, peroksidase. Alkaloid yang terdapat pada tanaman ini dipercaya dapat menyebabkan kelumpuhan cacing pita, cacing gelang, dan cacing keremi (IPTEKb, 2005).
Setiap bagian tanaman ini secara tradisional digunakan untuk menyembuhkan beberapa penyakit, yaitu kulit buah biasa digunakan untuk sakit perut karena cacing, buang air besar mengandung darah dan lendir (disentri amuba), diare kronis, perdarahan seperti wasir berdarah, muntah darah, batuk darah, perdarahan rahim, perdarahan rektum, prolaps rektum, radang tenggorok, radang telinga, keputihan (leukorea), dan nyeri lambung. Bunga delima biasa digunakan unutk radang gusi, perdarahan, dan bronkhitis. Daging buah dapat digunakan untuk cacingan, sariawan, tenggorokan, suara parau, hipertensi, rematik, dan perut kembung. Bagian daun delima dan daging buah biasa digunakan untuk menurunkan berat badan. Penggunaan daun delima pada konsumsi masyarakat adalah 5 – 10 gram dalam 200 ml pelarut (IPTEKb, 2005).
Gambar 2. Delima Putih (Punica granatum Linn)
C. Kecombrang (Nicolaia speciosa Horan)
Kecombrang termasuk dalam famili Zingiberaceae. Umumnya tanaman ini terdapat di Sumatera, Jawa, Sulawesi, dan Maluku. Deskripsi tanaman ini sendiri adalah tanaman tahunan berbentuk semak dengan ketinggian 1-3 m dengan batang semu yang tegak dan berpelepah serta bentuknya menyerupai rimpang. Biasa dikonsumsi sebanyak 20 – 50 gram dalam 200 ml pelarut.
Daun kecombrang sendiri merupakan daun tunggal dengan bagian ujung dan pangkal runcing. Panjang daun kecombrang sekitar 20-30 cm, dengan lebar 5-15 cm. Daunnya berwarna hijau dengan pertulangan daun menyirip. Sedangkan bunga kecombrang, yang dipakai dalam penelitian ini, merupakan bunga majemuk berbentuk bongkol dengan panjang tangkainya sekitar 40-80 cm. Bunga kecombrang berwarna merah jambu, berbulu jarang dan didalamnya terdapat benang sari berwarna kuning dan putik berwarna putih (warintek.ristek, 2005).
[image:30.612.239.399.466.668.2]Bunga kecombrang banyak digunakan sebagai obat penghilang bau badan, memperbanyak air susu ibu, pembersih darah, dan memiliki aktivitas antimikroba. Kandungan kimia yang terdapat di daun, batang , bunga, dan rimpang kecombrang adalah saponin dan flavonoid. Selain itu, kecombrang juga mengandung polifenol dan minyak atsiri (warintek.ristek, 2005).
D. Kemuning (Murraya paniculata [L..] Jack.)
Kemuning merupakan tanaman famili Rutaceac, biasa tumbuh di di semak belukar, tepi hutan, atau ditanam sebagai tanaman hias dan tanaman pagar dan memiliki variasi morfologi yang besar sekali. Tanaman ini dapat ditemukan sampai ketinggian ± 400 m dpl. (IPTEKc, 2005).
Kemuning merupakan tanaman jenis semak atau pohon kecil, bercabang banyak, tinggi 3-8 m, batangnya keras, beralur, dan tidak berduri. Daunnya majemuk, bersirip ganjil dengan anak daun 3-9, letak berseling. Helaian anak daunnya bertangkai, bentuk bulat telur sungsang atau jorong, ujung dan pangkal runcing, tepi rata atau agak beringgit, panjang 2-7 cm, lebar 1-3 cm, permukaan licin, mengilap, wamanya hijau, bila diremas tidak berbau. Sedangkan bunga kemuning merupakan bunga majemuk berbentuk tandan, warnanya putih dan wangi, serta keluar dari ketiak daun atau ujung ranting. (IPTEKc, 2005).
Daun kemuning mengandung cadinene, methyl-anthranilate, bisabolene, P-earyophyllene, geraniol, carene-3, eugenol, citronellol,
methyl-salicylate, s-guaiazulene, osthole, paniculatin, tanin, dan coumurrayin.
Sedangkan kulit batang mengandung mexotioin, 5-7-dimethoxy-8-
(2,3-dihydroxyisopentyl) coumarin, sedangkan bunga kemuning mengandung
scopeletin, dan buahnya mengandung semi-ec-carotenone (IPTEKc, 2005).
Gambar 4. Kemuning (Murraya paniculata [L..] Jack.) Sumber : IPTEK (2005)
E. Jati belanda (Guazuma ulmifolia Lamk)
Jati belanda merupakan tanaman famili Sterculiaceae. Bentuknya pohon dengan tinggi lebih kurang 10 meter. Batang keras, bulat, permukaan kasar, banyak alur, berkayu, bercabang, warna hijau keputih-putihan. Daun tunggal, bulat telur, permukaan kasar, tepi bergerigi, ujung runcing, pangkal berlekuk, pertulangan menyirip, panjang 10-16 cm, lebar 3-6 cm, berwarna hijau. Bunganya tunggal, bulat di ketiak daun, warna hijau muda, buahnya kotak, bulat, keras, permukaan berduri, dan berwarna hitam (IPTEKd, 2005).
Bagian pohon yang biasa digunakan adalah daun, biji, dan buah. Daun jati Belanda dapat digunakan untuk mengurangi kegemukan, buahnya digunakan untuk menyembuhkan penyakit bronkhitis, sedangkan bijinya digunakan untuk mengurangi kegemukan dan menyembuhkan sakit perut (IPTEKd, 2005). Senyawa kimia yang terkandung pada daun jati belanda yaitu saponin, tanin, alkaloida, dan flavonoida. Penggunaan daun jati belanda adalah sebanyak 5 – 10 gram dalam 150 ml pelarut (warintek.ristek, 2005).
permukaan usus halus sehingga dapat mengurangi penyerapan makanan dan proses obesitas (kegemukan) dapat dihambat (IPTEKd, 2005).
Gambar 5. Jati Belanda (Guazuma ulmifolia Lamk) Sumber : IPTEK (2005)
F. Eritrosit
Eritrosit adalah sel darah merah dan terdapat sekitar 4 – 6 juta/mm3. diameternya 6.6 – 7.5 um, namun ada pula yang diameternya lebih dari 9 um (macrocytes) atau kurang dari 6 um (microcytes). Sel darah merah kaya hemoglobin, suatu protein yang dapat mengikat oksigen. Dengan begitu, sel darah merah bertanggungjawab untuk menyediakan oksigen bagi jaringan dan membuang sebagian karbondioksida. Namun, kebanyakan CO2 dibawa oleh plasma dalam bentuk karbonat terlarut.
Eritrosit merupakan sel yang sangat terdiferensiasi, berupa kantung-kantung dikelilingi oleh membran plasma yang mengandung hemoglobin. Sebesar 33% berat sel eritrosit merupakan hemoglobin. Eritrosit yang telah dewasa, selain tidak mengandung nukleus, ribosom, dan mitokondria, juga telah kehilangan kemampuan untuk mensintesis protein dan metabolisme aerobik. Selain itu, eritrosit yang telah dewasa juga telah kehilangan kemampuannya untuk mensintesis membran yang baru (Weiss et.al., 1977).
difusi oksigen lebih mudah pada sel darah merah. Dengan mikroskop elektron, eritrosit dapat memiliki berbagai macam bentuk, yaitu normal (discocyte).,
crenated, echinocyte, codocyte, oat, bulan sabit, helmet, pinched, pointed,
berlekuk, poikilocyte, dan sebagainya. Paruh hidup eritrosit sendiri adalah sekitar 120 hari.
Eritrosit sendiri memiliki beberapa sistem membran yang dapat melindungi dirinya dari kerusakan oksidatif dan hemolisis, antara lain superoksida dismutase (SOD), glutation peroksidase, dan katalase. Juga terdapat asam askorbat dan asam urat yang berfungsi sebagai penangkap radikal bebas larut air (berada di plasma) dan α-tokoferol yang berfungsi sebagai penangkap radikal bebas larut lemak yang terdapat di membran eritrosit (Qin Yan Zhu et.al., 2002).
Gambar 6. Sel eritrosit Sumber : Buhler (2000)
G. Hemolisis eritrosit
Hemolisis yang terjadi pada eritrosit disebabkan oleh kehadiran tiba-tiba larutan merah cerah yang berasal dari hemoglobin keluar dari eritrosit, dan sering digunakan untuk mengukur kecepatan penetrasi suatu komponen masuk ke dalam eritrosit (Girrese, 1979). Parameter-parameter yang penting dan dapat digunakan untuk mendeteksi kerusakan akibat toksik pada membran eritrosit antara lain adalah hemolisis, kehilangan ion potasium, autooksidasi membran lipid, perubahan fluiditas eritrosit, perubahan bentuk membran, pengendapan protein
Gambar 7. Perbandingan eritrosit (1), trombosit (2), dan leukosit (3) Sumber :Buhler (2000)
1
2
[image:34.612.149.290.306.476.2]membran, dan perubahan rasio volume terhadap luas permukaan membran sel (Luke et.al., 1987).
Eritrosit sangat mudah mengalami lipid peroksidasi dikarenakan kandungan lemak tidak jenuh ganda yang sangat tinggi, kandungan oksigen yang tinggi, dan keberadaan logam transisi. PUFA, fosfolipid, dan kolesterol bebas adalah dasar dan konstituen permanen bagi membran seluler. Membran-membran seluler ini terbentuk dalam lapisan bilayer dimana senyawa makromolekul protein seperti reseptor, pembawa spesifik, dan enzim dimasukkan. Pada sistem biologis, PUFA merupakan komponen esensial dari biomembran, yang bersifat sangat rentan terhadap peroksidasi (Bermond, 1990).
Oleh sebab itu, eritrosit merupakan media yang tepat untuk menganalisa kapasitas antioksidan ataupun daya toksik suatu zat tertentu secara in vitro, terutama terhadap stabilitas biomembrannya. Reactive oxygen species (ROS) yang terbentuk pada fase air atau lipid dapat menyerang membran eritrosit yang mengakibatkan oksidasi lipid dan protein, memicu kerusakan membran yang berakibat pada terjadinya hemolisis (Qin Yan Zhu et.al.,, 2002).
Pada fungsi fisiologis normal, mayoritas ROS diproduksi pada rantai transport elektron di dalam mitokondria, karena sebanyak 90% konsumsi oksigen oleh tubuh direduksi menjadi air terjadi di mitokondria. Walaupun begitu, ROS juga dihasilkan di jalur biokimia lain pada tubuh. Contohnya, proses penghancuran oleh neutrofil terhadap bakteri, virus, dan senyawa xenobiotik, β -oksidasi dari lemak, aktivasi sitokrom P450 dan lainnya (Ji, 1999)
Oksigen merupakan elektron penerima yang sifatnya universal berfungsi menghasilkan energi bagi organisme aerobik dari dalam bahan pangan seperti karbohidrat, lemak, dan protein. Proses katabolisme dapat menghasilkan radikal bebas oksigen dan reactive oxygen species (ROS) seperti superoksida (°O2-),
radikal hidroksil (OH°), dan hidrogen peroksida (H2O2) (Ji, 1999).
H2O2 dapat dihasilkan dari proses pengubahan °O2- (superoksida) yang
dihasilkan dari hasil kerja enzim superoksida dismutase (SOD) yang terdapat pada membran eritrosit. H2O2 yang terbentuk nantinya akan diubah menjadi air (H2O)
logam transisi seperti besi, yang diubah dari bentuk ferric menjadi ferrous oleh °O2-, dapat bereaksi dengan H2O2 untuk menghasilkan radikal hidroksil (°OH)
yang sangat reaktif (Yoshikawa et.al., 1997). Reaksi H2O2 dan Fe2+ digambarkan
sebagai berikut ; H2O2 + Fe2+→ Fe3+ + OHº + OH-.
Kekurangan pada sistem antioksidan, terjadinya proses oksidasi yang tinggi, atau terjadinya beberapa kelainan pada darah seperti β-thalasemia, sickle
cell anemia, dan defisiensi glukosa-6-fosfat dehidrogenase dapat meningkatkan
kecenderungan eritrosit terhadap peroksidasi (Qin Yan Zhu et.al., 2002). Penggunaan eritrosit sebagai media uji kapasitas antioksidan alami dapat menentukan kekuatan aktivitas antioksidan tersebut, interaksinya dengan sel hidup, dan kemungkinan sinergisme dengan keberadaan komponen lain dalam sistem seluler.
Pengujian aktivitas anti hemolisis pada sel darah merah banyak dilakukan dengan penambahan larutan pengoksidasi seperti H2O2 atau senyawa-senyawa
aldehid (asetaldehid, formaldehid, dan glutaraldehid). Senyawa-senyawa aldehid dapat bereaksi mengakibatkan hemolisis dengan banyak cara. Formaldehid bereaksi dengan protein dan asam nukleat, yang dapat mengakibatkan kerusakan membran. Dalam sistem tubuh manusia, terdapat beberapa enzim yang dapat mengkatalisis oksidasi formaldehid menjadi asam format. Salah satu enzim terpenting adalah NAD-dependent formaldehyde-dehydrogenase, yang membutuhkan GSH (reduced glutathione) sebagai kofaktor (Andel et.al., 2002).
Sedikitnya ada 7 enzim berfungsi sebagai katalisator oksidasi formaldehid pada jaringan mahluk hidup, antara lain ; aldehid dehidrogenase, xantinoksidase, katalase, peroksidase, gliserinaldehid-3-fosfat dehidrogenase, aldehid oksidase,
dan DPN-dependent formaldehyde dehydrogenase. Proses oksidasi tersebut terjadi
sebagian besar di hati, tetapi juga terjadi di eritrosit, otak, ginjal, dan otot (Andel
et.al., 2002).
suspensi eritrosit yang telah didiamkan selama 3 jam dan diagitasi pada selang waktu 15 menit agar sel eritrosit tetap tersuspensi pada larutan balanced salt.
Hasil penelitian yang dilakukan oleh Qin Yan Zhu (2002), terhadap aktivitas penghambatan hemolisis eritrosit menggunakan ekstrak kokoa yang diinduksi dengan AAPH (2,2’-azo-bis (2-amidinopropane) dihidroklorid). Ekstrak kokoa dihilangkan kandungan lemaknya dengan menggunakan aseton dan dibandingkan dengan aktivitas penghambatan hemolisis dari asam askorbat pada konsentrasi 2, 4, 6, dan 8 mg/ml. Ekstrak kokoa memberikan nilai aktivitas penghambatan hemolisis lebih tinggi dibandingkan dengan asam askorbat pada masing-masing konsentrasi. Nilai aktivitas penghambatan hemolisis dengan ekstrak kokoa mencapai 60 %, dan asam askorbat mencapai 40 % pada konsentrasi 8 mg/ml.
Penelitian yang dilakukan oleh Lanping (2000), menunjukkan aktivitas penghambatan hemolisis menggunakan komponen polifenol ekstrak teh hijau (epikatekin, epikatekin galat, epigalokatekin, dan epigalokatekin galat). Pada penelitian ini, hemolisis eritrosit diinduksi secara in vitro dengan menggunakan berbagai konsentrasi AAPH (2,2’-azo-bis (2-amidinopropane). Hasil penelitian ini dinyatakan sebagai persentase hemolisis sel eritrosit pada rentang waktu pengamatan 60 hingga 240 menit. Persentase hemolisis terendah terdapat pada sel eritrosit yang ditambahkan epigalokatekin galat 30.0 mmol/L (konsentrasi tertinggi) yaitu 20 %. Pada penelitian ini juga dilakukan perbandingan interaksi komponen polifenol (30.0 mmol/L) secara langsung terhadap sel eritrosit yang diinduksi oleh AAPH. Penambahan epikatekin menyebabkan hemolisis sel eritrosit hingga 80 %, lebih tinggi bila dibandingkan kontrol sel eritrosit tanpa penambahan komponen polifenol yaitu 65 %.
H. Antioksidan
Menurut Kochar dan Rossell (1990), antioksidan pangan biasa diterapkan untuk zat yang menghambat reaksi rantai radikal bebas yang terdapat di dalam oksida lipida, tetapi istilah tersebut digunakan tidak hanya untuk pengertian sempit di atas karena kompleksitas dalam sistem pangan. Antioksidan dapat menghambat dan mencegah proses oksidasi walaupun terdapat dalam jumlah yang sedikit dan tubuh juga memiliki sistem antioksidan alami yang dapat di produksi sendiri.
Komponen antioksidan alami dalam pangan dapat berupa :
1) Komponen endogenous dalam satu atau lebih komponen makanan tersebut 2) Merupakan komponen yang terbentuk dari berbagai reaksi selama proses 3) Zat tambahan pangan yang diisolasi dari sumber alami
Antioksidan dapat digolongkan menjadi antioksidan primer dan sekunder berdasarkan mekanisme kerjanya, yaitu ; antioksidan primer atau antioksidan pemecah rantai (chain breaking antioxidant) dapat bereaksi dengan radikal lemak dan mengubahnya menjadi produk yang stabil dengan melepas hidrogen, seperti tokoferol lesitin, asam askorbat. Antioksidan sekunder mencegah prooksidator sehingga dapat digolongkan sebagai sinergis, seperti asam sitrat dan EDTA (Bender, 1982).
Menurut Kochar dan Russell (1990), antioksidan diklasifikasikan menjadi lima jenis yaitu :
1) Antioksidan primer, utamanya senyawa fenolik yang dapat menghentikan rantai radikal bebas oksidasi lemak. Yang termasuk kelompok ini antara lain tokoferol, alkil galat, BHA, BHT dan TBHQ.
2) Perangkap oksigen , seperti asam askorbat (vitamin C), askorbil palmitat, asam eritrobat dan garam natriumnya, yang bereaksi dengan oksigen dan dapat menghilangkan dalam sistem tertutup.
3) Antioksidan sekunder, seperti dilauril tiodipropionat yang bekerja dengan memecah hidroperoksida lemak menjadi produk akhir yang stabil.
5) Chelating agent atau sekustran, seperti asam sitrat, asam amino, EDTA, yang mengkelat ion logam seperti tembaga (Cu) dan besi (Fe) yang mengkatalisis oksidasi lemak.
Sedangkan menurut Ranney (1979), antioksidan dapat digolongkan menjadi tiga berdasarkan prinsip kerja dalam mencegah oksidasi, yaitu :
1) Antioksidan gugus fenol dan amin aromatik yang akan bereaksi dengan radikal bebas dari sistem membentuk produk substrat non-radikal dan radikal antioksidan
2) Antioksidan yang dapat menghilangkan molekul-molekul hidroperoksida dari substrat tetapi tanpa melibatkan radikal bebas
3) Antioksidan menginaktifkan logam yang digunakan untuk mempercepat reaksi oksidasi.
Komponen antioksidan yang ada pada alam mempunyai struktur kimia yang berbeda-beda. Pada umumnya senyawa tersebut adalah asam amino, asam askorbat, karotenoid, asam sinamat, flavanoid, melanoidin, asam organik tertentu, zat pereduksi, peptida, fosfatida, polifenol, tanin, dan tokoferol (Dugan, 1985)
Pengujian aktivitas antioksidan dapat dilakukan dengan beberapa cara.. DPPH (2,2-diphenyl-1-picrylhydrazil atau 1,1-diphenyl-2-picrylhydrazil) merupakan senyawa radikal bebas yang stabil dalam larutan metanol dan berwarna ungu tua. Pada metode DPPH, pencegahan radikal DPPH biasanya diikuti dengan pengamatan terhadap penurunan nilai absorbansi pada 515 nm yang terjadi akibat reaksi antara antioksidan (AH) atau reaksi dengan radikal.
DPPH° + AH → DPPH-H +A° DPPH° + R → DPPH-R
Gambar 8. Mekanisme reaksi antioksidan pada DPPH
NO2 NO2
NO2 N
NH
+ AOH NO2 NO2
NO2 N
Reaksi yang cepat dari radikal DPPH terjadi dengan beberapa polifenol, termasuk tokoferol, tetapi reaksi sekunder yang lambat dapat menyebabkan penurunan yang progresif pada nilai absorbansi, oleh sebab itu keadaan tetap
(steady state) mungkin tidak tercapai pada beberapa saat lamanya. Beberapa
laporan mengatakan bahwa aktivitas pencegahan terjadi setelah 15 hingga 30 menit. (Gordon, 1992)
I. Komponen fenolik
Senyawa fenolik merupakan senyawa kimia yang memiliki satu buah cincin aromatik yang mengandung satu atau lebih gugus hidroksi, termasuk turunan fungsionalnya (ester, metil ester, glikosida, dan lainnya). Kebanyakan polifenol memiliki 2 atau lebih grup hidroksil dan merupakan komponen bioaktif yang terdapat secara luas pada pangan nabati (Tang, 1992).
Senyawa ini merupakan hasil metabolit sekunder dari tanaman. Kebanyakan komponen fenolik pada tanaman terdapat pada vakuola dari tanaman tersebut, oleh sebab itu, kebanyakan dari polifenol yang telah dikenal luas memiliki potensi untuk bereaksi dengan protein atau komponen sitoplasma lainnya (Tang, 1992).
Senyawa polifenol tanaman banyak terdapat pada kulit kayu, batang, daun, buah, akar, bunga, biji, dan serbuk sari (Pratt, 1992). Pada tanaman, komponen fenolik digunakan sebagai respons perlindungan terhadap serangan patogen. Komponen fenolik dapat terdiri dari fenol-fenol sederhana, asam fenolik, turunanan asam hidroksinamat, dan flavanoids (Tang, 1992).
Fungsi senyawa fenolik dalam kapasitasnya sebagai antioksidan telah banyak diteliti. Zat perangkap radikal (radical scavenger) umumnya memberikan satu elektron kepada elektron yang tidak berpasangan dari radikal bebas sehingga menetralkannya. Polifenol diketahui sangat aktif dalam hal ini, begitu pula dengan propilgalat, ellagic acid, flavonoids, asam askorbat, dan tokoferol. ( Bors et.al., 1992).
Radikal fenol yang terbentuk relatif stabil karena delokalisasi resonansi elektron yang tidak berpasangan dan tidak adanya tempat yang cocok pada molekul radikal fenol tersebut untuk diserang oleh molekul oksigen (Shahidi
et.al., 1995). Aktivitas antioksidan dari senyawa fenol dipengaruhi beberapa
faktor, yaitu adanya agen pengkelat, pH lingkungan sekitar, kelarutan, ketersediaan senyawa fenol dalam suatu bahan, dan stabilitas senyawa fenol. Kekuatan dari efek antioksidan polifenol tergantung dari tipe grup polifenol dan jumlahnya dalam setiap molekul (Okuda, 1992).
Pengujian kapasitas fenol umumnya dilakukan dengan menggunakan uji fenol-ciocalteau. Metode ini digunakan untuk menentukan total fenolik pada sampel. Reagen folin-ciocalteau adalah metode yang tidak spesifik dan dapat mendeteksi seluruh fenol yang terdapat pada sampel. Kekurangan dari metode ini adalah adanya kemungkinan gangguan dari komponen pereduksi lainnya seperti asam askorbat (Shahidi et.al, 1995).
J. Penggunaan sel eritrosit untuk uji in vitro
Penggunaan sel eritrosit pada pengujian secara in vitro kurang tepat bila dikatakan sebagai kultur sel. Hal ini diakibatkan karena sel eritrosit yang tidak dapat tumbuh dan berkembang biak seperti halnya sel hidup lain (misal ; sel limfosit). Sel eritrosit tidak memiliki nukleus, mitokondria dan organel-organel sel lainnya yang diperlukan untuk pertumbuhan dan perkembangbiakan. Akan tetapi, inkubasi sel eritrosit selama pengujian memerlukan lingkungan yang sesuai agar dapat tetap hidup dan mendekati keadaan sebenarnya seperti di dalam tubuh. Oleh sebab itu, perlakuan pada pengujian dengan menggunakan kultur sel dapat diterapkan pada inkubasi sel eritrosit.
mengevaluasi dampak yang ditimbulkan dari kondisi abnormal atau dari keberadaan senyawa berbahaya pada sel (Novikoff dan Erick, 1970). Untuk melakukan kultur sel secara in vitro dibutuhkan kondisi pertumbuhan yang mirip dengan kondisi in vivo seperti pengaturan temperatur, konsentrasi O2 dan CO2,
pH, tekanan osmosis, dan kandungan nutrisi (Davis, 1994).
Keuntungan penggunaan kultur sel adalah lingkungan tempat hidup sel dapat dikontrol, seperti pH, tekanan osmosis, tekanan CO2 dan O2, sehingga
kondisi fisiologis dari kultur relatif konstan (Malole, 1990). Menurut Davis (1994), kondisi optimal kultur untuk sel mamalia umumnya adalah memiliki pH 7.2 – 7.5, osmolalitas 280 – 320 mOsmol/kg, kandungan CO2 2 – 5 %, serta
temperatur 35 – 37°C.
Menurut Malole (1990), faktor yang mendukung pertumbuhan sel dalam kultur adalah media pertumbuhan. Fungsi media kultur sel adalah mempertahankan pH, menyediakan lingkungan yang baik dimana sel dapat bertahan hidup, dan juga menyediakan substansi-substansi yang tidak dapat disintesis oleh sel itu sendiri. Menurut Davis (1994), media kultur harus menyediakan semua nutrien esensial, vitamin dan kofaktor, susbtansi metabolik, asam amino, ion inorganik, elemen kasar, dan faktor pertumbuhan yang diperlukan untuk mendukung fungsi seluler dan sintesis sel baru.
Media yang digunakan pada inkubasi sel eritrosit adalah balanced salt
solution .Balanced salt solution adalah larutan kombinasi dari garam-garam
inorganik yang dapat mempertahankan pH fisiologis dan tekanan osmotik. Ion-ion organik yang ada juga digunakan untuk mempertahankan membran potensial, kofaktor pada reaksi enzim, dan pelekatan sel. Ion-ion organik yang ada antara lain adalah Na+, K+, Mg2+, Ca2+, Cl-, SO42-, PO43-, dan HCO3-. Umumnya
balanced salt solution tidak mengandung nutrien-nutrien yang diperlukan untuk
pemeliharaan sel jangka panjang (Davis, 1994). Oleh sebab itu, balanced salt
solution digunakan sebagai media dalam uji kultur sel eritrosit yang tidak
memerlukan waktu pemeliharaan lama.
maka pertumbuhan sel akan terhambat. Kapasitas buffer dari medium dapat ditingkatkan dengan keberadaan fosfat pada balanced salt solution.
Suhu dipertahankan 370C dengan konsentrasi CO2 5%dan O2 95% untuk
menyamakan dengan kondisi di dalam tubuh. Selain memberikan pengaruh langsung terhadap sel, temperatur juga mempengaruhi pH melalui peningkatan kelarutan CO2 dan melalui perubahan ionisasi dan dari pH buffer
III. BAHAN DAN METODE
A. BAHAN DAN ALAT
1. Bahan
Bahan-bahan yang digunakan adalah daun ceremai, daun delima putih, daun jati belanda, daun kemuning, dan bunga kecombrang diperoleh dari Balitro, Bogor. Bahan kimia yang dipakai untuk ekstraksi adalah akuades, etanol 96%, dan kertas saring Whatman No.42 diperoleh dari Setia Guna, Bogor. Bahan-bahan yang digunakan untuk isolasi sel eritrosit dan kultur sel adalah darah dari donor yang sehat, aquades, akuabides, etanol 70%, fycoll-histopaque (Sigma, USA), biru tripan, dan PBS
(Phospat Buffer Saline). Bahan kimia yang digunakan untuk pengujian sel
darah merah adalah PBS (Phospat Buffer Saline), H2O2 0.5 %, dan
formaldehid 5 %. Bahan kimia yang dipakai untuk analisis kimia K2SO4,
HgO, H2SO4 pekat, NaOH-Na2S2O3, asam borat, HCl 0.02 N, indikator
metil merah dan metil biru, dan aquades. Bahan kimia yang digunakan untuk analisis antioksidan adalah larutan DPPH (
2,2-diphenyl-1-picrylhydrazil atau 1,1-diphenyl-2-picrylhydrazil) 3 mM segar, metanol,
HPO3, asam askorbat, dan larutan buffer asetat (campuran Na-asetat dan
asam asetat). Bahan kimia yang digunakan untuk analisis total fenol adalah etanol, air deion, pereaksi Folin Ciocalteau 50%, Na2CO3 5%, dan asam
tanat. Bahan kimia lain yang digunakan adalah KmnO4.
2. Alat
inkubator VWR Scientific (CO2 5 %, 37oC), dan Spectrophotometer
Microplate Reader (Bio-rad model 550). Alat-alat yang digunakan untuk
analisis kimia adalah oven kering, oven vakum, gegep, neraca analitik, erlenmeyer 100 ml, cawan alumunium, labu kjedahl, pipet 5 ml, 3 ml, dan 10 ml, alat dekstruksi, alat destilasi, buret, gelas piala, sudip, dan gelas pengaduk. Alat-alat yang digunakan untuk analisis antioksidan dan total fenol adalah spektrofotometer, kuvet, tabung reaksi, gelas piala, botol gelap, mikropipet, pipet 5 ml, dan vorteks.
B. METODE PENELITIAN
Penelitian ini terdiri atas beberapa tahap, yaitu :
1. Ekstraksi
Ekstraksi dilakukan dengan menggunakan dua pelarut, yaitu aquades dan etanol 96 %. Bagian tanaman yang diekstrak adalah daun (ceremai, delima putih, kemuning, jati belanda) dan bunga (kecombrang). Hasil ekstraksi kemudian dianalisis kapasitas antioksidan dan total fenolnya. Proses ekstraksi menggunakan perbandingan bahan segar dan pelarut sebanyak dua kali konsentrasi normal, atau disebut C1. Perbandingan bahan segar dan pelarut pada konsentrasi normal dapat dilihat pada Tabel 1.
Tabel 1. Konsumsi normal masyarakat terhadap kelima tanaman
Tanaman Konsumsi Normal
Bahan segar (g) Pelarut (ml)
Daun ceremaia 3 – 25 200 Daun delima putihb 5 – 10 200 Bunga kecombrangc 20 – 50 200 Daun kemuningd 20 – 60 200 Daun jati belandae 5 – 10 150
a
) IPTEKa, 2005
b
) IPTEKb, 2005
c)Warintek.Ristek., 2005 d
) IPTEKc, 2005
Total volume akhir ekstrak ditepatkan menjadi 10 ml. Penepatan dilakukan dengan proses pemanasan pada pelarut akuades (80°C, 10 menit), dan evaporasi berputar pada pelarut etanol (55°C). Hasil ekstraksi digunakan dalam pengujian kadar total fenol, kapasitas antioksidan (DPPH), dan aktivitas penghambatan hemolisis pada sel darah merah in
vitro.
Tabel 2. Perbandingan Sampel dan Pelarut
Sampel Jumlah
Bahan segar (gr) Pelarut (ml)
Daun Ceremai Daun Delima putih Bunga Kecombrang Daun Kemuning Daun Jati belanda
40 20 40 40 15
200 200 200 200 150
Ekstraksi dengan pelarut aquades (Pandoyo, 2000)
Bahan yang telah mengalami proses pembersihan kemudian langsung diblender dengan pelarut aqudes. Perbandingan antara bahan dan pelarut disesuaikan dengan dua kali konsumsi masyarakat sehari-hari (Tabel 2). Setelah diblender, larutan tersebut kemudian dipanaskan 80°C, 10 menit. Kemudian sampel diangkat dan disaring menggunakan kain saring. Hasil saringan disentrifus pada 2000 rpm selama 10 menit untuk memisahkan padatan yang masih tersisa. Supernatan yang diperoleh kemudian dipanaskan kembali sampai diperoleh volume ekstrak akhir 10 ml untuk menyamakan volume masing-masing hasil ekstraksi.
1.2. Ekstraksi dengan pelarut etanol (Marliyati et.al., 2005)
dimaserasi pada suhu ruang dengan kecepatan 35 rpm. Proses maserasi berlangsung 24 jam pada suhu ruang, kemudian larutan tersebut disaring menggunakan pompa vakum yang diberi kertas saring Whatman No. 1. Hasil saringan yang diperoleh kemudian dipekatkan menggunakan rotary vacuum evaporator pada suhu 55oC sehingga diperoleh ekstrak pekat dengan volume 10 ml.
1.3. Persiapan hasil ekstraksi untuk inkubasi sel eritrosit
Sebelum digunakan pada kultur sel, hasil ekstraksi disterilisasi terlebih dahulu dengan menggunakan membran 0.22 μm. Hasil penyaringan kemudian diencerkan dengan media PBS (Phosphat
Buffered Saline) sebagai media pelarut. Melalui pengenceran diperoleh
tiga taraf konsentrasi yaitu C1, C2, dan C3. C1 merupakan dua kali konsentrasi normal masyarakat, C2 merupakan konsentrasi normal masyarakat, dan C3 merupakan setengah konsentrasi normal masyarakat. Hasil ektraksi ini nantinya akan ditambahkan pada suspensi eritrosit yang akan diinkubasi dan diuji responnya dalam menghambat hemolisis.
2. Analisis Kimia
Analisis kimia yang dilakukan mencakup analisis kadar air, kadar protein, kadar total fenol, dan kapasitas antioksidan. Pengujian kadar air dan kadar protein dilakukan terhadap sampel segar tanaman, sedangkan kadar total fenol dan kapasitas antioksidan dilakukan terhadap hasil ekstraksi tanaman.
Analisis kadar air metode oven (AOAC,1984)
diulang proses pengeringan dalam oven sampai diperoleh berat yang tetap.
Kadar air diperoleh dengan perhitungan sebagai berikut :
Keterangan : a = berat cawan dan sampel akhir (g)
b = barat cawan (g)
c = berat sampel awal (g)
2.2. Analisis kadar protein (AOAC,1984)
Ditimbang 0.1-0.15 gram contoh. Contoh dimasukkan ke dalam labu Kjeldahl dan ditambahkan 1.9±0.1 g K2SO4, 40±10 mg
HgO, dan 2.0±0.1 ml H2SO4. Contoh kemudian dididihkan sampai
cairan menjadi jernih (1 jam). Larutan jernih ini kemudian dipindahkan ke alat destilasi. Labu Kjeldahl dicuci dengan air (1-2 ml). Air cucian dimasukkan ke dalam alat destilasi dan ditambahkan 10 ml larutan NaOH-Na2S2O3. Digunakan asam standar, yaitu asam
borat yang telah ditambahkan indikator campuran merah metil dan metil biru. Destilasi dihentikan saat terjadi perubahan warna asam standar dari biru violet menjadi hijau. Cairan hasil destilasi (dalam erlenmeyer) kemudian dititrasi oleh HCl 0.02 N. Titik akhir titrasi ketika warna titrat berubah dari hijau menjadi biru keunguan/abu-abu.
Kadar protein diperoleh dengan perhitungan sebagai berikut : Kadar air (bb) = c – (a-b) x 100 %
c
Kadar air (bk) = c – (a-b) x 100 % (a-b)
%N = ( ml HCL sampel – ml HCL blanko ) x N HCL x 14.007 mg contoh
Kadar Protein (KP) % = Faktor Konversi x %N
2.3. Analisis Total Fenol
Analisis terhadap total fenol sampel dilakukan menurut metode Chandler dan Dodds yang dimodifikasi (Shetty et.al , 1995). Sebanyak 1 ml sampel dimasukkan ke dalam tabung reaksi yang telah berisi 1 ml etanol 95 % dan 5 ml air bebas ion. Pereaksi Folin-Ciocalteau (50%, 0,5 ml) ditambahkan pada masing-masing sampel. Campuran tersebut kemudian divorteks dan didiamkan selama 5 menit. Setelah 5 menit, ditambahkan 1 ml Na2CO3 5 %, kemudian
divorteks dan disimpan selama 60 menit dalam ruang gelap. Sampel dihomogenisasi kembali, dan absorbansinya diukur pada panjang gelombang 725 nm. Standar yang digunakan adalah asam tanat. Dengan konsentrasi 0, 5, 10, 15, 20, dan 25 ppm.
2.4. Analisis Kapasitas Antioksidan (Hatano et.al., 1988)
Analisis kapasitas antioksidan dilakukan dengan menggunakan metode DPPH. Sebanyak 2 ml buffer asetat dicampur
dengan 3.75 ml metanol dan 200 μl larutan DPPH. Campuran
kemudian divorteks. Setelah itu ditambahkan 50 μl sampel / larutan standar. Larutan kemudian divorteks dan didiamkan selama 20 menit di ruang gelap. Absorbansi larutan diukur pada panjang gelombang 517 nm. Kontrol negatif yang digunakan adalah metanol, sedangkan kontrol positif yang digunakan adalah asam askorbat (50, 100, 200, 500, dan 1000 ppm). Kapasitas antioksidan diperoleh dengan perhitungan sebagai berikut :
Kapasitas antioksidan (%) = [ A kontrol (-) – A sampel ] A kontrol (-)
3. Isolasi Sel Eritrosit (Qin Yan Zhu, 2002)
Darah donor diambil secara aseptis dan disimpan dalam tabung
vacuntee steril yang sudah terdapat EDTA 0.1 %. Darah yang diambil
sebanyak kira-kira 30 ml, dan EDTA 0.1 % berfungsi sebagai antikoagulan darah. Pengambilan dilakukan di klinik Farfa, Dramaga, Bogor oleh seorang suster.
Darah tersebut kemudian dipindahkan ke dalam tabung sentrifus steril dan pengerjaannya dilakukan di dalam laminar hood. Darah pada penelitian ini akan digunakan dalam pengujian aktivitas proliferasi dan aktivitas anti hemolisis. Pemisahan sel eritrosit pada penelitian ini didahului oleh pemisahan sel limfosit untuk digunakan pada pengujian aktivitas proliferasi.
Sampel darah disentrifus selama 10 menit pada 2000 rpm. Sel eritrosit akan berada di bagian paling bawah dan plasma akan berada di bagian atas. Di antara lapisan sel darah merah dan plasma terdapat lapisan
buffycoat yang sebagian besar merupakan sel limfosit. Lapisan sel eritrosit
yang terdapat pada lapisan terbawah tabung sentrifus dapat digunakan untuk pengujian penghambatan hemolisis. Akan tetapi, pada penelitian ini yang digunakan adalah sel eritrosit yang telah dipisahkan melalui pemisahan sel limfosit dengan menggunakan Hystopaque.
Lapisan buffycoat diambil dengan menggunakan mikropipet. Lapisan buffycoat yang diambil ini masih mengandung sel eritrosit dan plasma. Kemudian pemisahan sel limfosit dilakukan dengan menggunakan
Histopaque (buffycoat : Histoaque = 1:1). Pemisahan dengan Histopaque,
yang setelah disentrifus 2500 rpm selama 30 menit, akan mengakibatkan pemisahan secara utuh antara sel limfosit dan eritrosit. Sel eritrosit akan mengendap di dasar tabung bersama sel lainnya yang mempunyai densitas cukup tinggi seperti granulosit.
Sel eritrosit yang telah mengendap di dasar tabung kemudian ditambahkan kembali dengan larutan PBS. Suspensi eritrosit kemudian diencerkan agar jumlah sel dapat dihitung. Pengenceran dilakukan sebanyak 300 kali dan jumlah sel dihitung, sel yang hidup harus lebih dari 95% agar dapat dipergunakan untuk pengujian hemolisis sel eritrosit. Perhitungan jumlah sel hidup di atas 95% dilakukan dengan hemasitometer dan larutan pewarna trifan biru.
Gambar 9. Hasil pemisahan sel eritrosit menggunakan Hystopaque
4. Pengujian Respons Perlindungan Eritrosit Terhadap Hemolisis (Qin
Yan Zhu, 2002)
Suspensi sel eritrosit yang hidup di atas 95% disiapkan. Suspensi sel tersebut kemudian ditambahkan ke dalam sumur sebanyak 60 μl. Kemudian, ke dalam tiap – tiap sumur tersebut ditambahkan ekstrak sebanyak 20 μl yang telah disiapkan. Ekstrak yang telah disiapkan tersebut terdiri dari tiga taraf, yaitu C1, C2, dan C3. Well yang telah berisi suspensi eritrosit dan ekstrak tersebut kemudian didiamkan selama 10 menit pada inkubator bersuhu 37°C agar ekstrak dapat bercampur seluruhnya dengan suspensi eritrosit.
Suspensi eritrosit dan ekstrak tersebut kemudian ditambah dengan larutan H2O2 0.5% atau formaldehida 5% sebanyak 20 μl untuk memicu
terjadinya hemolisis. Kontrol negatif yang digunakan adalah suspensi eritrosit yang hanya ditambahkan larutan oksidator. Larutan Phosphat
Buffered Saline digunakan untuk menyamakan volume dari
masing-masing suspensi dalam sumur. Volume dari masing-masing-masing-masing suspensi dalam sumur adalah 100 μl. Dilakukan 3 ulangan pada masing-masing suspensi yang hendak diukur absorbansinya.
Inkubasi dilakukan dalam inkubator bersuhu 37°C selama 2 jam. Pengukuran dilakukan setiap 20 menit sekali dengan menggunakan
Spectrophotometer Micropalate Reader pada panjang gelombang 450 nm.
% Pencegahan Hemolisis = (Abs. Kontrol Negatif – Abs. Sampel) Abs. Kontrol Negatif
Keterangan :
Abs. Kontrol Negatif : Absorbansi suspensi eritrosit + oksidator
Abs. Sampel : [(Absorbansi suspensi eritrosit + hasil ekstraksi + oksidator)-(Absorbansi hasil ekstraksi)]
IV. HASIL DAN PEMBAHASAN
1. Ekstraksi
Tahap ekstraksi dilakukan dengan menggunakan dua pelarut, yaitu akuades dan etanol 96 %. Ekstraksi dilakukan pada daun ceremai, delima putih, jati belanda, dan kemuning, sedangkan pada kecombrang, ekstraksi dilakukan pada bunganya. Bagian tanaman tersebut merupakan bagian tanaman yang umum untuk dikonsumsi oleh masyarakat secara tradisional.
Proses ekstraksi harus dilakukan dengan menggunakan pelarut yang sesuai. Pelarut polar digunakan untuk mengekstrak komponen polar pula, dan sebaliknya. Selain itu, rasio pelarut dan sampel yang hendak diekstrak, suhu yang digunakan selama proses ekstraksi, serta lamanya proses ekstraksi juga turut menentukan hasil yang didapatkan selama proses ekstraksi.
Akuades digunakan sebagai pelarut karena umum digunakan dalam proses ekstraksi pada kehidupan sehari-hari. Sedangkan pelarut etanol digunakan karena memiliki polaritas lebih tinggi daripada aquades sehingga diharapkan lebih banyak melarutkan komponen polar. Umumnya, komponen terlarut yang dapat diperoleh dengan menggunakan pelarut akuades atau etanol adalah komponen fenolik (Shahidi et.al., 1995).
Menurut Shahidi (1995), pelarut yang sering digunakan untuk proses ekstraksi polifenol meliputi metanol, etanol, aseton, air, etil asetat, propanol, dimetilformamide, dan kombinasi antara pe

![Gambar 4. Kemuning (Murraya paniculata [L..] Jack.) Sumber : IPTEK (2005)](https://thumb-ap.123doks.com/thumbv2/123dok/532312.335680/32.612.207.438.78.273/gambar-kemuning-murraya-paniculata-l-jack-sumber-iptek.webp)