KARAKTERISASI
α
-AMILASE DAN GLUKOAMILASE
DARI BAKTERI PROTEOLITIK ASAL PENCERNAAN
IKAN NILA GIFT
MUHAMMAD NOVIANTO BAYU SAPUTRO
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MUHAMMAD NOVIANTO BAYU SAPUTRO. Karakterisasi
α
-Amilase dan
Glukoamilase dari Bakteri Proteolitik Asal Pencernaan Ikan Nila GIFT.
Dibimbing oleh NISA RACHAMANIA MUBARIK dan ANJA MERYANDINI.
Penggunaan teknologi probiotik telah menjadi salah satu alternatif dalam
usaha meningkatkan produktivitas perikanan. Penelitian ini bertujuan untuk
menapis isolat amilolitik yang memiliki aktivitas
α
-amilase dan glukoamilase dari
sejumlah bakteri proteolitik yang berasal dari saluran pencernaan ikan nila GIFT
(Genetic Improvement of Farmed Tilapias). Dari 31 isolat bakteri proteolitik,
berhasil ditapis sebanyak 18 isolat amilolitik. Tiga isolat diantaranya
menunjukkan indeks amilolitik (IA) terbesar yaitu NU-1, NU-2, dan NL-15.
Pengukuran aktivitas
α
-amilase menggunakan metode Bernfeld dan aktivitas
glukoamilase dengan metode Somogyi-Nelson. Kadar protein diukur dengan
metode Bradford. Isolat bakteri NU-2, yang merupakan genus Bacillus, mampu
menghasilkan enzim
α
-amilase dan glukoamilase. Aktivitas maksimum
α
-amilase
dan glukoamilase terjadi pada jam ke-15 setelah inkubasi. Hasil karakterisasi
menunjukkan bahwa aktivitas
α
-amilase optimum pada suhu 37-40
oC, pH 6.0
yang diproduksi pada media pati tapioka, dan pH 6.0-7.0 pada media tepung ikan.
Aktivitas glukoamilase optimum pada suhu 40
oC, pH 6.0 yang diproduksi pada
media pati tapioka, dan pH 5.0-6.0 pada media tepung ikan. Penggunaan media
kaldu nutrien (NB) dengan menggunakan 0.5% (b/v) tepung ikan ternyata
meningkatkan produksi enzim
α
-amilase dan glukoamilase dari isolat NU-2.
ABSTRACT
MUHAMMAD NOVIANTO BAYU SAPUTRO. Characterization of
α
-Amylase
and Glucoamylase Production from Tilapia Digestive Tract Proteolytic Bacteria.
Supervised by NISA RACHMANIA MUBARIK and ANJA MERYANDINI.
KARAKTERISASI
α
-AMILASE DAN GLUKOAMILASE
DARI BAKTERI PROTEOLITIK ASAL PENCERNAAN
IKAN NILA GIFT
MUHAMMAD NOVIANTO BAYU SAPUTRO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Karakterisasi
α
-Amilase dan Glukoamilase dari Bakteri
Proteolitik Asal Pencernaan Ikan Nila GIFT
Nama
: Muhammad Novianto Bayu Saputro
NIM
: G34103042
Menyetujui:
Pembimbing I, Pembimbing II,
(Dr. Nisa Rachmania Mubarik, M.Si)
(
Dr. Anja Meryandini, M.S)
NIP 132045531
NIP 131663016
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
(Dr. Drh. Hasim, DEA)
NIP 131578806
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT berkat rahmat serta
rizki-Nya, penulis dapat menyelesaikan karya tulis ini. Shalawat serta salam
penulis panjatkan kepada Nabi Muhammad SAW, sang pembawa kebenaran
hakiki.
Penulis ucapkan terima kasih kepada Ibu Nisa Rachmania Mubarik dan
Ibu Anja Meryandini atas saran serta bimbingan dalam penelitian ini. Ucapan
terima kasih kepada Ibu Rita Megia, sebagai Wakil Komisi Pendidikan atas saran
dan diskusi yang diberikan. Rasa terima kasih disampaikan kepada kedua orang
tua dan adikku tersayang atas segala doa, pengorbanan dan kasih sayangnya.
Terima kasih kepada sahabatku Ari dan Taufiq yang telah setia menemani dan
menjadi tempat berbagi cerita dan berkeluh kesah, kepada Mba Heni, Bapak Jaka
dan Bapak Endang atas bantuannya di laboratorium, kepada Oci, Fajri, Eko, Iip,
atas persahabatan dan kebersamaannya, kepada Dendi, Muley, Cicit, Sagita,
Mbem, dan Dian atas motivasi dan dukungannya, kepada teman-teman
laboratorium mikrobiologi, Andri, Irni, Sarah, Mute, Tri, Besty, Wahyu, Ima, Ika,
Ryo, Ai, Mba Rina, Mba Ari, Mba Rika, Mba Dini atas kekompakannya, dan
kepada teman-teman Biologi 40 atas kebersamaannya.
Semoga karya tulis ini dapat bermanfaat di kemudian hari.
Bogor, Januari 2008
RIWAYAT HIDUP
Penulis dilahirkan di Malang pada tanggal 8 November 1985 dari
pasangan Bapak Rahardjo Dwi Prihanggono dan Ibu Sri Widyastati. Penulis
adalah anak pertama dari dua bersaudara.
Setamat dari SMUN 3 Sidoarjo pada tahun 2003, penulis diterima di
Departemen Biologi, FMIPA, Institut Pertanian Bogor (IPB) melalui jalur
Undangan Seleksi Masuk IPB (USMI) di Biologi. Selama mengikuti perkuliahan,
penulis pernah menjadi asisten praktikum mata kuliah Mikrobiologi Dasar dan
Fisiologi Prokariot untuk S1 Biologi. Penulis juga pernah menjabat sebagai
anggota seksi Dana Sosial Paguyuban Mahasiswa Biologi (Pamabi) Fakultas
Matematika dan Ilmu Pengetahuan Alam (FMIPA) IPB.
DAFTAR ISI
Halaman
DAFTAR GAMBAR………
DAFTAR TABEL……….
DAFTAR LAMPIRAN……….
PENDAHULUAN……….
Waktu dan Tempat………....
BAHAN DAN METODE………...
Bahan………
Peremajaan Isolat Bakteri……….
Penapisan Isolat Bakteri Amilolitik……….…….
Produksi Enzim……….………
Pengukuran Aktivitas
α
-Amilase……….……….
Pengukuran Aktivitas Glukoamilase……….………
Pengukuran Kadar Protein………
Pembuatan Kurva Pertumbuhan Sel dan Aktivitas Enzim………...
Uji Modifikasi Substrat……….………
Karakterisasi Suhu dan pH Enzim………
HASIL……….………...
PEMBAHASAN……….………...
SIMPULAN……….………..
SARAN……….……….
DAFTAR PUSTAKA………
viii
viii
ix
DAFTAR GAMBAR
Halaman
1
2
3
4
5
6
7
8
9
Isolat bakteri amilolitik pada agar-agar nutrien yang mengandung 0.5%
(b/v) pati tapioka setelah 24 jam inkubasi ………...……....
Sel isolat NU-2 hasil pewarnaan Gram (perbesaran mikroskop 1000X)....
Uji patogenitas terhadap isolat bakteri NU- 2 (a) dan supernatannya (b)….
Kurva pertumbuhan dan aktivitas amilase isolat NU-2 pada media NB
dengan substrat 5% (b/v) pati tapioka. pH media yaitu 7 dengan suhu
produksi 37
oC……….…..
Aktivitas
α
-amilase
dan glukoamilase isolat NU-2 yang diproduksi
dengan menggunakan substrat pati tapioka dan tepung ikan (a) dalam
satuan aktivitas unit/ml, (b) dalam satuan aktivitas unit/ml
protein………...
Aktivitas
α
-amilase isolat NU-2 yang diproduksi pada tepung ikan dan
pati tapioka pada berbagai suhu. Pengukuran aktivitas pada pH
7.0……….
Aktivitas
α
-amilase isolat NU-2 yang diproduksi pada tepung ikan dan
pati tapioka pada berbagai pH. Pengukuran aktivitas pada suhu optimum
37
oC………..
Aktivitas glukoamilase isolat NU-2 yang diproduksi pada tepung ikan dan
pati tapioka pada berbagai suhu. Pengukuran aktivitas pada pH 7.0……....
Aktivitas glukoamilase isolat NU-2 yang diproduksi pada tepung ikan dan
pati tapioka pada berbagai pH. Pengukuran aktivitas pada suhu optimum
40
oC…...
3
3
3
4
4
4
5
5
5
DAFTAR TABEL
Halaman
1
2
3
4
Hasil uji aktivitas
α
-amilase dan glukoamilase dari tiga isolat bakteri
terpilih………...
Kadar protein dan karbohidrat pada tepung ikan dan pati tapioka
(Alamsyah 2005)...
Kadar kalsium dan fosfor pada tepung ikan dan pati tapioka (Alamsyah
2005)...
Ciri-ciri
α
-amilase dan glukoamilase dari sejumlah bakteri……..………..
3
6
DAFTAR LAMPIRAN
Halaman
1
2
3
4
5
6
7
8
Skema metode Bernfeld (1955)...
Skema metode Somogyi-Nelson (Nelson 1944 dalam Breuil & Saddler
1985)...
Skema metode Bradford (1976)...
Hasil penapisan isolat bakteri amilolitik...
Aktivitas amilase dari isolat bakteri NU-2 yang diproduksi pada media
NB dengan substrat 0.5% (b/v) pati tapioka dan tepung ikan. Suhu
inkubasi enzim yang digunakan yaitu 37
oC dengan pH 7.0…………
Karakterisasi
α
-amilase dari isolat bakteri NU-2 pada berbagai suhu
dan pH……….………..
Karakterisasi glukoamilase dari isolat bakteri NU-2 pada berbagai suhu
dan pH……….………..
Kandungan nutrisi tepung ikan dan pati tapioka (Alamsyah 2005)…….
11
12
13
14
15
15
PENDAHULUAN
Permintaan dan kebutuhan ikan dunia terus meningkat dari tahun ke tahun, sebagai akibat pertambahan penduduk. Oleh sebab itu, diperlukan adanya peningkatan produktivitas perikanan untuk mengimbangi jumlah permintaan yang terus meningkat (DKPRI 2005).
Penggunaan teknologi probiotik telah menjadi salah satu alternatif dalam usaha meningkatkan produktivitas perikanan. Probiotik di dalam bidang akuakultur didefinisikan sebagai suplemen mikrob hidup yang memberikan efek menguntungkan terhadap inangnya dengan cara mengubah struktur komunitas mikrob, meningkatkan fungsi pemanfaatan pakan atau peningkatan nilai gizi pakan, meningkatkan ketahanan inang terhadap penyakit, serta meningkatkan kualitas lingkungan di sekitar inang (Verschuere et al. 2000).
Salah satu prinsip dasar kerja probiotik ialah memanfaatkan kemampuan mikroorganisme dalam memecah atau menguraikan rantai panjang karbohidrat, protein, dan lemak yang menyusun pakan yang diberikan. Kemampuan ini diperoleh karena adanya enzim-enzim khusus yang dimiliki mikrob untuk memecah ikatan tersebut (Feliatra et al. 2004). Penelitian Suyanandana et al. (1998) menunjukkan bahwa penggunaan bakteri asam laktat galur E7, E26, dan F10 sebagai suplemen makanan pada budidaya Tilapia nilotica ternyata mampu meningkatkan bobot ikan dan menunjukkan resisten terhadap serangan bakteri patogen Aeromonas hydrophila.
Enzim α-amilase dan glukoamilase
merupakan enzim yang memiliki peranan dalam proses perombakan karbohidrat atau
pati. Enzim α-amilase (EC 3.2.1.1)
mengatalisis pemutusan ikatan glikosidik α -1.4 dari dalam molekul pati, sedangkan glukoamilase atau amiloglukosidase (EC 3.2.1.3) menghidrolisis ikatan glikosidik α-1,4 dan α-1,6 dari bagian ujung gula nonpereduksi secara berurutan (Fogarty 1983).
Berbagai penelitian telah dilakukan untuk mencari kandidat probiotik unggul untuk budidaya perikanan. Feliatra et al. (2004) telah berhasil mengisolasi dan mengidentifikasi bakteri probiotik dari ikan kerapu macan (Ephinephelus fuscogatus) dalam upaya efisiensi pakan ikan. Demikian pula Mubarik et al. (2006) melaporkan telah berhasil mengisolasi tiga puluh satu isolat bakteri proteolitik dari pencernaan ikan nila
GIFT (Genetic Improvement of Farmed
Tilapias) dan beberapa isolat terpilih (NU-5 dan NU-8) dari penelitian tersebut telah dikarakterisasi aktivitas proteasenya. Enterobacter sp. galur NU-5 menghasilkan metaloprotease yang optimum pada suhu 50 oC, pH 7.0, dan aktivitasnya meningkat dengan penambahan Co2+. Aeromonas sp. galur NU-8 juga menghasilkan metaloprotease dengan aktivitas optimum pada suhu 70 oC, pH 7.0, dan aktivitasnya meningkat dengan penambahan K+.
Sehubungan dengan upaya menggali kemampuan isolat-isolat proteolitik yang memiliki potensi menghasilkan enzim amilase ekstraseluler, maka penelitian ini bertujuan untuk menapis isolat-isolat proteolitik tersebut yang memiliki aktivitas enzim α -amilase dan gluko-amilase serta melakukan karakterisasi kedua enzim amilase tersebut berdasarkan pH dan suhu yang diproduksi dengan menggunakan substrat yang berbeda. Dari hasil penelitian ini diharapkan diperoleh isolat-isolat yang dapat diaplikasikan sebagai agen probiotik dalam budidaya perikanan air tawar.
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Februari sampai Nopember 2007 di Laboratorium Bagian Mikrobiologi FMIPA, IPB.
BAHAN DAN METODE
Bahan
Bahan-bahan yang digunakan ialah 31 isolat bakteri proteolitik asal ikan nila koleksi Bagian Mikrobiologi, Departemen Biologi, FMIPA, IPB, media agar-agar nutrien (NA), media kaldu nutrien (NB), pati tapioka (tepung tapioka), tepung ikan, pereaksi-pereaksi: Bernfeld (1955), Somogyi-Nelson (Nelson 1944 dalam Breuil & Saddler 1985), dan Bradford (1976). Peralatan yang digunakan ialah peralatan yang umum digunakan di laboratorium mikrobiologi.
Peremajaan Isolat Bakteri
Tiga puluh satu isolat proteolitik asal pencernaan ikan nila yang telah diperoleh dari penelitian sebelumnya (Mubarik et al. 2006) diremajakan pada kaldu nutrien (NB) yang mengandung 0.5% pati tapioka (b/v). Kultur diinkubasi pada suhu ruang (25-27 oC) selama ±24 jam dan digoyang dengan kecepatan 140 rpm.
Penapisan Isolat Bakteri Amilolitik
agar-agar nutrien (NA) yang mengandung 0.5% pati tapioka. Isolat bakteri diinkubasi selama 24 jam pada suhu ruang, lalu diamati zona bening yang terbentuk. Isolat bakteri lalu dipilih berdasarkan indeks amilolitiknya (IA), yaitu nisbah antara selisih diameter zona bening dengan diameter koloninya. Tiga isolat bakteri dengan indeks amilolitik terbesar diuji aktivitas α-amilase dan glukoamilasenya. Satu isolat bakteri penghasil aktivitas α-amilase dan glukoamilase terbesar dipilih untuk dilakukan identifikasi dengan pewarnaan Gram dan ditentukan kondisi optimum pertumbuhannya.
Isolat bakteri terpilih diuji patogenitasnya dengan digores pada media agar-agar darah. Hal yang sama juga dilakukan pada supernatannya, yaitu dengan meneteskan 15
μl supernatan di atas filtrate paper pada media agar-agar darah. Biakan diinkubasi selama 24 jam lalu diamati ada tidaknya zona bening yang terbentuk.
Produksi Enzim
Tiga isolat bakteri penghasil IA terbesar ditumbuhkan pada media kaldu nutrien (NB) yang mengandung 0.5% pati tapioka (b/v) lalu diinkubasi selama 24 jam pada suhu 25 oC dan digoyang dengan kecepatan 140 rpm. Enzim amilase ekstrak kasar ekstraseluler diperoleh dengan cara mensentrifugasi kultur pada 8400 g selama 15 menit pada suhu 4 oC. Supernatan mengandung enzim amilase lalu dipisahkan dari endapan dan diukur aktivitasnya.
Pengukuran Aktivitas α-Amilase
Metode yang digunakan ialah metode Bernfeld (1955). Sebanyak 1 ml larutan pati 1% (dalam 0.05M bufer Tris-HCl pH 7) direaksikan dengan 1 ml enzim ekstrak kasar, lalu diinkubasi pada suhu 37 dan 50 oC selama 20 menit. Campuran direaksikan dengan 2 ml pereaksi dinitrosalisilat (DNS) dan didihkan selama 5 menit. Absorbansi diukur dengan spektrofotometer pada panjang gelombang 550 nm. Satu unit (U) aktivitas α-amilase didefinisikan sebagai jumlah enzim yang menghasilkan produk setara 1 µmol maltosa per menit pada kondisi pengukuran. Sebagai standar, digunakan larutan maltosa pada konsentrasi 100-500 ppm dengan selang konsentrasi 100 ppm (Lampiran 1). Pengujian aktivitas α-amilase pada sampel, kontrol, dan blanko diulang sebanyak dua kali.
Pengukuran Aktivitas Glukoamilase
Aktivitas enzim glukoamilase diukur dengan metode Somogyi-Nelson (Nelson dalam Breuil & Saddler 1985). Sebanyak 0.5
ml larutan pati 0.5%, 0.4 ml bufer Tris-HCl 0.05 M pH 7 dan 0.1 ml larutan enzim direaksikan di dalam tabung reaksi dan diinkubasi selama 30 menit pada suhu 37 dan 50 oC. Pada akhir inkubasi ditambahkan 1 ml pereaksi A. Sebanyak 1 ml campuran tersebut diambil dan direaksikan dengan pereaksi D dalam tabung reaksi yang lain lalu didihkan selama 20 menit. Campuran didinginkan pada air mengalir selama 5 menit, direaksikan dengan pereaksi C kemudian dikocok kuat sampai tidak ada gelembung Setelah itu, campuran diencerkan dengan akuades hingga volume akhir 25 ml. Absorbansi diukur pada panjang gelombang 520 nm. Satu unit (U) aktivitas glukoamilase setara dengan 1 µmol glukosa yang dihasilkan per menit pada kondisi pengukuran. Sebagai standar digunakan glukosa pada konsentrasi 100-500 ppm dengan selang konsentrasi 100 ppm (Lampiran 2). Pengujian aktivitas glukoamilase pada sampel, kontrol, dan blanko diulang sebanyak dua kali.
Pengukuran Kadar Protein
Kadar protein diukur dengan metode Bradford (1976). Sebanyak 0.1 ml enzim ekstrak kasar direaksikan dengan 5 ml pereaksi Bradford lalu diinkubasi selama 5 menit. Absorbansi diukur pada panjang gelombang 595 nm. Sebagai standar digunakan larutan bovine serum albumin (BSA) berkonsentrasi 100-500 ppm dengan selang konsentrasi 100 ppm (Lampiran 3). Pengujian kadar protein pada sampel dan blanko diulang sebanyak dua kali.
Pembuatan Kurva Pertumbuhan Sel dan Aktivitas Enzim
Sebanyak ±108 sel/ml isolat terpilih ditumbuhkan pada media NB yang mengandung 0.5% pati tapioka. Kultur diinkubasi dan digoyang dengan kecepatan 92 rpm selama 36 jam pada suhu 37 oC. Setelah itu, diukur pertumbuhan sel, aktivitas α -amilase, dan glukoamilase setiap 3 jam selama 36 jam. Pengujian aktivitas α-amilase, glukoamilase, dan jumlah sel diulang sebanyak dua kali.
Uji Modifikasi Substrat
8400 g 15 menit dan diukur aktivitas
α-amilase dan glukoamilasenya. Uji aktivitas kedua enzim pada masing-masing perlakuan diulang sebanyak dua kali.
Karakterisasi Suhu dan pH Enzim
Karakterisasi aktivitas enzim dilakukan untuk mengetahui kondisi optimum kedua enzim pada berbagai suhu dan pH. Rentang suhu yang digunakan yaitu 30, 37, 40, 50, dan 60 oC. Rentang pH yang digunakan yaitu 4.0 hingga 9.0. Bufer yang digunakan yaitu bufer sitrat (pH 4.0, 5.0, dan 6.0), bufer tris-HCl (pH 7.0 dan 8.0), dan bufer glisin-NaOH (pH 9.0) masing-masing dengan konsentrasi 0.05 M.
HASIL
Sebanyak 18 isolat bakteri proteolitik yang diujikan mampu membentuk zona bening di sekitar koloni pada media NA yang mengandung 0.5% pati tapioka pada suhu ruang setelah disiram dengan larutan Iodin (Lampiran 4 & Gambar 1).
Gambar 1 Isolat bakteri amilolitik pada agar- agar nutrien yang mengandung 0.5% (b/v) pati tapioka setelah 24 jam inkubasi.
Ada tiga isolat dari 18 isolat amilolitik yang memiliki nilai IA paling besar dari rata-rata dua ulangan yaitu isolat bakteri NU-1 (1.22), NU-2 (0.94), dan NL-15 (0.76) (Lampiran 4). Hasil pengukuran aktivitas
enzim α-amilase dan glukoamilase
menunjukkan bahwa isolat bakteri NU-1 memiliki aktivitas spesifik glukoamilase pada suhu inkubasi enzim 50 oC, yaitu sebesar 0.143 unit/mg protein. Isolat bakteri NL-15 memiliki aktivitas spesifik α-amilase pada suhu inkubasi enzim 37 oC, yaitu sebesar 0.363 unit/mg protein. Di antara ketiga isolat penghasil IA terbesar hanya isolat bakteri NU-2 yang memiliki aktivitas α-amilase pada suhu 50 oC dan glukoamilase pada suhu 37 oC. Nilai aktivitas α-amilase spesifik sebesar 0.085 unit/mg protein dan glukoamilase spesifik sebesar 0.865 unit/mg protein (Tabel 1).
Tabel 1 Hasil uji aktivitas α-amilase dan glukoamilase dari tiga isolat bakteri terpilih Aktivitas spesifik α-amilase (Unit/mg protein) Aktivitas spesifik glukoamilase (Unit/mg protein) Suhu inkubasi enzim Suhu inkubasi enzim Kode isolat
37 oC 50 oC 37 oC 50 oC
NU-1 NU-2 NL-15 - - 0.363 - 0.085 - - 0.865 - 0.143 - -
Hasil identifikasi menunjukkan bahwa isolat bakteri NU-2 tergolong ke dalam genus Bacillus yang memiliki ciri-ciri yaitu bentuk sel batang berantai, bersifat Gram positif, dan memiliki endospora pada bagian sentral sel (Gambar 2).
Gambar 2 Sel isolat NU-2 hasil pewarnaan Gram (perbesaran mikroskop 1000X).
Sebagai analisis tambahan dari penelitian ini dilakukan uji patogenitas. Bakteri NU-2 mampu membentuk zona bening pada media agar-agar darah, sebaliknya uji supernatan yang bebas sel tidak menunjukkan adanya zona bening (Gambar 3).
Gambar 3 Uji patogenitas terhadap isolat bakteri NU-2 (a) dan supernatannya (b).
Pengukuran turbiditas sel yang dilakukan setiap tiga jam selama 36 jam menunjukkan bahwa bakteri NU-2 mengalami fase lag pada jam ke-0 hingga jam ke-9, fase eksponensial pada jam ke-9 hingga jam ke-12, dan
endospora
a
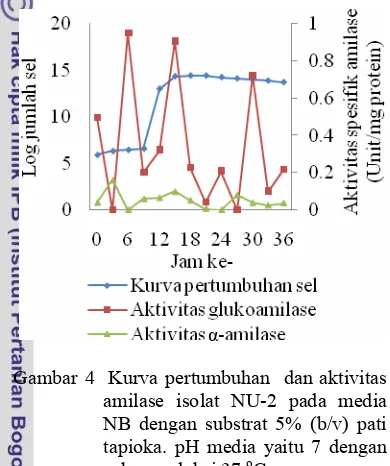
memasuki fase stasioner pada jam ke-15 setelah inkubasi (Gambar 4).
Hasil pengukuran aktivitas enzim α -amilase isolat bakteri NU-2 menunjukkan bahwa aktivitas spesifik maksimum α-amilase terjadi pada jam ke-3 (0.163 unit/mg protein) dan ke-15 (0.1 unit/mg protein). Aktivitas spesifik glukoamilase maksimum terjadi pada jam 6 (0.947 unit/mg protein) dan jam ke-15 (0.903 unit/mg protein) (Gambar 4).
Gambar 4 Kurva pertumbuhan dan aktivitas amilase isolat NU-2 pada media NB dengan substrat 5% (b/v) pati tapioka. pH media yaitu 7 dengan suhu produksi 37 oC.
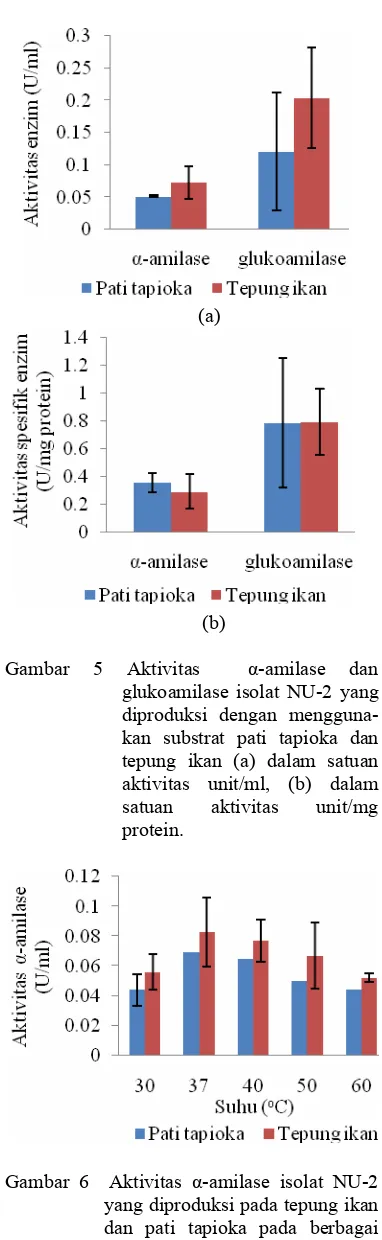
Pertumbuhan sel untuk produksi amilase pada substrat yang dimodifikasi menunjukkan bahwa aktivitas kedua enzim ternyata relatif lebih tinggi pada media NB yang mengandung 0.5% tepung ikan dengan nilai aktivitas α -amilase yaitu 0.051 unit/ml dan gluko-amilase yaitu 0.204 unit/ml (Lampiran 5 & Gambar 5a). Meskipun demikian, aktivitas spesifik ternyata menunjukkan perbedaan hasil, yaitu nilai aktivitas α-amilase ternyata lebih tinggi pada media pati tapioka, sedangkan aktivitas spesifik glukoamilasenya tidak jauh berbeda antara media pati tapioka dan media tepung ikan (Lampiran 5 & Gambar 5b). Hasil pengukuran kadar protein media kontrol tanpa inokulasi menunjukkan kadar protein pada media tepung ikan memang lebih tinggi yaitu 0.546 mg/ml, sedangkan pati tapioka yaitu 0.441 mg/ml.
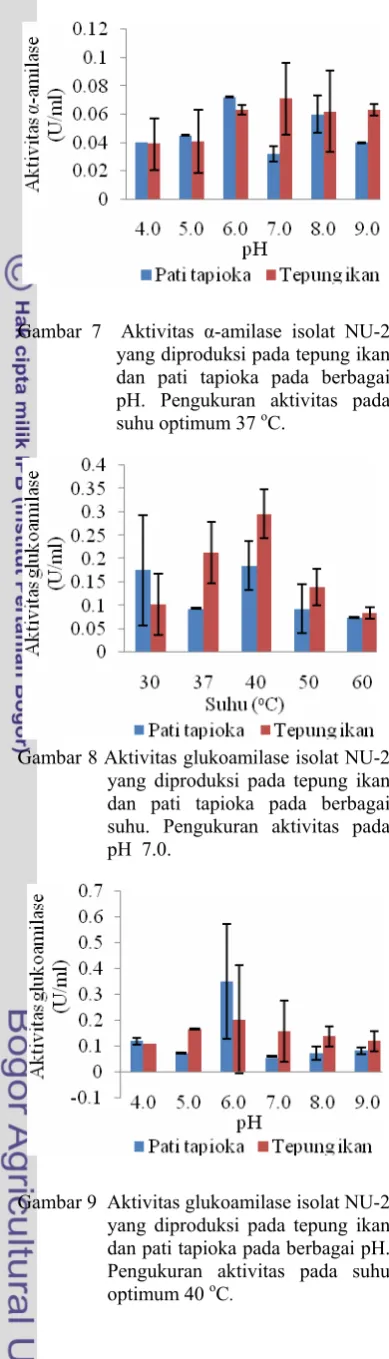
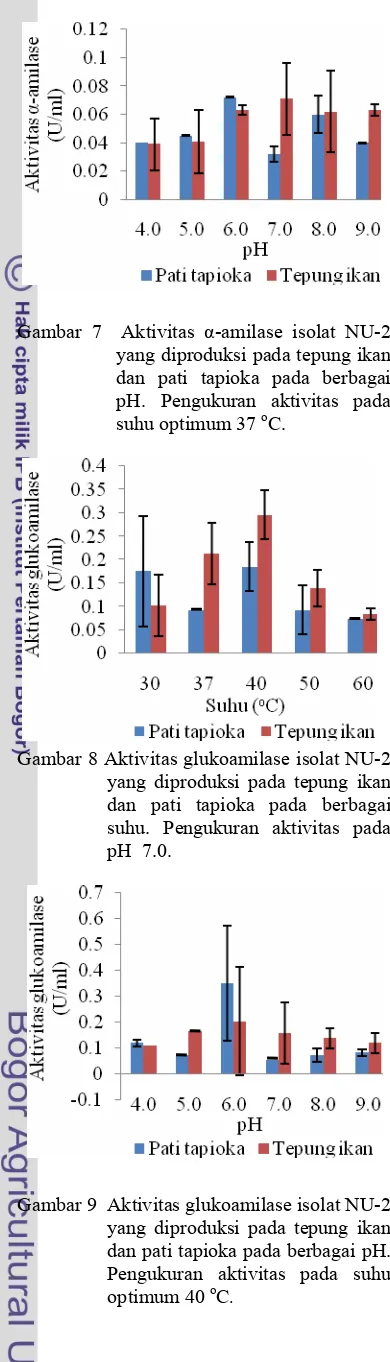
Hasil karakterisasi menunjukkan bahwa aktivitas α-amilase isolat NU-2 optimum pada suhu 37-40 oC dan pH 6.0 untuk yang diproduksi pada media pati tapioka dan 6.0-7.0 pada media tepung ikan (Lampiran 6, Gambar 6 & 7). Aktivitas optimum glukoamilase terjadi pada suhu 40 oC dan pH
6.0 untuk yang diproduksi pada media pati tapioka dan pH 5.0-6.0 pada media tepung ikan (Lampiran 7, Gambar 8 & 9).
(a)
(b)
Gambar 5 Aktivitas α-amilase dan
glukoamilase isolat NU-2 yang diproduksi dengan mengguna- kan substrat pati tapioka dan tepung ikan (a) dalam satuan aktivitas unit/ml, (b) dalam satuan aktivitas unit/mg protein.
Gambar 6 Aktivitas α-amilase isolat NU-2 yang diproduksi pada tepung ikan dan pati tapioka pada berbagai suhu. Pengukuran aktivitas pada pH 7.0.
Gambar 7 Aktivitas α-amilase isolat NU-2 yang diproduksi pada tepung ikan dan pati tapioka pada berbagai pH. Pengukuran aktivitas pada suhu optimum 37 oC.
Gambar 8 Aktivitas glukoamilase isolat NU-2 yang diproduksi pada tepung ikan dan pati tapioka pada berbagai suhu. Pengukuran aktivitas pada pH 7.0.
Gambar 9 Aktivitas glukoamilase isolat NU-2 yang diproduksi pada tepung ikan dan pati tapioka pada berbagai pH. Pengukuran aktivitas pada suhu optimum 40 oC.
PEMBAHASAN
Ikan nila galur GIFT (Genetic
Improvement of Farmed Tilapias) atau Oreochromis niloticus (Linnaeus) Trewavas merupakan ikan nila unggul hasil seleksi dan persilangan dari delapan galur ikan nila yang dikumpulkan dari delapan negara yaitu Mesir, Ghana, Senegal, Kenya, Israel, Singapura, Thailand, dan Taiwan. Ikan nila GIFT memiliki beberapa keunggulan dibandingkan varietas lokalnya, diantaranya yaitu tingkat pertumbuhan yang cepat, fekunditas (kesuburan) yang tinggi, serta ketahanannya terhadap penyakit (Usni 2000). Penelitian Rachmadi (2008) juga menunjukkan bahwa beberapa bakteri proteolitik yang diisolasi dari saluran pencernaan ikan nila GIFT ternyata mampu mengambat pertumbuhan Microcystis aeruginosa yang bersifat toksik bagi ikan lain. Oleh sebab itu, potensi diperolehnya kandidat isolat-isolat probiotik dari saluran pencernaan ikan nila GIFT cukup besar.
Terkait dengan fungsinya dalam meningkatkan efisiensi pakan, isolat-isolat probiotik diharapkan mampu menghasilkan enzim-enzim yang bersifat digestif. Enzim-enzim ini dapat memecah makromolekul (protein, karbohidrat, lemak) yang terdapat di dalam pakan ikan sehingga membuat penyerapan makanan menjadi lebih efektif dan efisien. Hasil penelitian Mubarik et al. (2006) menunjukkan bahwa isolat NU-2 merupakan bakteri proteolitik dengan nilai Indeks Proteolitik (IP) sebesar 1.89. Meskipun protease ekstraseluler dari isolat NU-2 belum dikarakterisasi, akan tetapi isolat bakteri ini berpotensi untuk dijadikan probiotik karena mampu menghasilkan baik protease, α -amilase, dan glukoamilase ekstraseluler.
saluran pencernaan dan 50 oC, yang merupakan suhu rata-rata aktivitas optimum amilase (Fogarty 1983).
Berdasarkan pengamatan morfologi sel dengan teknik pewarnaan Gram, isolat bakteri NU2 termasuk ke dalam genus Bacillus yang memiliki morfologi berbentuk batang berantai, bersifat Gram positif, dan memiliki endospora pada bagian sentral sel (Gambar 2). Selain itu, berdasarkan kebutuhannya terhadap oksigen, bakteri NU-2 tergolong sebagai bakteri aerob atau anaerobik fakultatif yang merupakan salah satu ciri fisiologi bakteri genus Bacillus (Holt et al. 1994). Bacillus merupakan genus bakteri penghasil enzim amilase ekstraseluler terbesar. Beberapa spesies genus ini, seperti B. subtilis, B. stearothermophilus, B. licheniformis, B. amiloquefaciens seringkali digunakan untuk memproduksi enzim amilase secara komersial untuk berbagai keperluan (Sivaramakrishnan et al. 2006).
Hasil pengukuran kurva aktivitas menunjukkan bahwa aktivitas maksimum α -amilase terjadi pada jam ke-3 ketika sel berada pada fase lag dan jam ke-15 ketika sel berada pada fase stasioner. Untuk glukoamilase aktivitas maksimumnya terjadi pada saat jam ke-6 (fase lag) dan jam ke-15 (fase stasioner) setelah inkubasi. Hasil ini memang sedikit berbeda dari hasil penelitian lainnya yang melaporkan bahwa enzim amilase diproduksi pada saat fase log atau pada saat sel mengalami fase stasioner. Ashger et al. (2007) melaporkan bahwa aktivitas α-amilase B. subtilis JS-2004 terjadi pada jam ke-48 setelah inkubasi atau pada saat sel mengalami fase stasioner. Oleh sebab itu, tingginya aktivitas α-amilase pada jam ke-3 dan glukoamilase pada jam ke-6 setelah inkubasi diduga disebabkan oleh pengaruh inokulum. Ray et al. (2007) menyatakan bahwa kondisi inokulum seperti keadaan sel dan jumlah optimum sel di dalam inokulum berpengaruh terhadap proses fermentasi.
Di dalam memenuhi kebutuhan akan nutrisinya, beberapa bakteri mampu memproduksi enzim-enzim ekstraseluler. Enzim-enzim ekstraseluler seperti amilase dan protease, dihasilkan dengan tujuan untuk merombak molekul kompleks di luar sel menjadi lebih sederhana, sehingga molekul-molekul yang sederhana tersebut mampu masuk ke dalam sel. Enzim-enzim ekstraseluler ini bersifat induktif dan dipengaruhi oleh substrat yang tersedia di lingkungan (Whitaker 1994).
Menurut Murtidjo (2001), tepung ikan merupakan bahan makanan pokok ikan yang
digunakan sebagai sumber protein hewani dan mineral. Sebagai komponen utama penyusun pakan ikan, tepung ikan memiliki kadar protein yang jauh lebih tinggi dibandingkan dengan pati tapioka. Sebaliknya, pati tapioka memiliki kandungan karbohidrat yang jauh lebih tinggi jika dibandingkan dengan tepung ikan (Tabel 2). Hasil pengukuran kadar protein dari media kontrol tanpa inokulasi menunjukkan nilai yang lebih tinggi pada media tepung ikan sebesar 0.546 mg/ml, dibandingkan pati tapioka sebesar 0.441 mg/ml. Hal ini menunjukkan bahwa isolat bakteri NU-2 tumbuh lebih optimum dengan menggunakan protein sebagai sumber energi untuk pertumbuhan selnya.
Tabel 2 Kadar protein dan karbohidrat pada tepung ikan dan pati tapioka (Alamsyah 2005)
Jenis tepung Kadar protein (%) Kadar karbohidrat (%) Tepung ikan Pati tapioka 55.7 2.6 2.9 65.84
Selain mengandung kadar protein tinggi, tepung ikan juga mengandung kadar mineral yang cukup tinggi, terutama kalsium (Ca) dan fosfor (P) (Tabel 3 dan Lampiran 8).
Tabel 3 Kadar kalsium dan fosfor pada tepung ikan dan pati tapioka (Alamsyah 2005)
Jenis tepung Kadar
kalsium (%) Kadar fosfor (%) Tepung ikan Pati tapioka 4.75 0.17 2.45 0.19
Di antara berbagai ion logam lainnya, ion kalsium seringkali dilaporkan mampu meningkatkan baik produksi maupun aktivitas amilase (Srivastava & Baruah 1986; Sivaramakrishnan et al. 2006). Namun demikian, perlu dilakukan pengujian lebih lanjut mengenai pengaruh kation terutama kalsium dalam meningkatkan produksi dan aktivitas amilase dari isolat bakteri NU-2.
Tabel 4 Ciri-ciri α-amilase dan glukoamilase dari sejumlah bakteri enzim asam (pH optimum < 6.0).
Masing-masing dengan suhu optimum untuk α -amilase yaitu 37-40 oC dan 40 oC untuk glukoamilase. Sivaramakrishnan et al. (2006) melaporkan bahwa suhu optimum produksi enzim amilase yang dihasilkan oleh suatu organisme memiliki keterkaitan dengan suhu optimum pertumbuhan selnya. Pada umumnya bakteri mesofilik memiliki aktivitas enzim amilase pada kisaran 40-60 oC. Meskipun demikian, beberapa spesies Bacillus, seperti B. subtilis, B. stearothermophilus, B. licheniformis, B. amiloliquefaciens dilaporkan mampu memproduksi amilase dengan kisaran suhu yang lebih luas yaitu 37-60 oC (Sivaramakrishnan et al. 2006). Sementara itu, Fogarty (1983) menyatakan bahwa suhu optimum untuk aktivitas glukoamilase berada pada kisaran 40-60 oC, sedangkan pH optimumnya pada kisaran 4.5-5.0. Hasil perbandingan dengan referensi menunjukkan bahwa karakter setiap enzim tidaklah selalu sama (Tabel 4). Perbedaan karakter suhu dan pH yang dimiliki oleh enzim menunjukkan bahwa enzim bersifat khusus, tergantung spesies yang menghasilkannya.
Jika enzim akan diaplikasikan untuk pemakaian industri atau aplikasi praktis sudah selayaknya dilakukan pengujian keamanan apakah mengandung bahan yang toksik yang tidak diharapkan ada di dalam enzim tersebut. Analisis yang dilakukan dalam penelitian ini sehubungan dengan hal tersebut yaitu menguji kemampuan melisis darah. Bakteri penghasil hemolisin akan mampu melisis sel darah merah. Beberapa anggota dalam genus
Bacillus diketahui bersifat patogen dan memiliki kemampuan dalam menghidrolisis darah, salah satunya yaitu B. cereus. B. cereus diketahui mampu memproduksi beberapa enterotoksin, antara lain protease, fosfolipase, dan hemolisin (Drobniewski 1993). Meskipun demikian, penggunaan B. cereus sebagai agen probiotik telah dilaporkan oleh Duc et al. (2004). Duc et al. (2004) menyatakan bahwa bakteri tidak selalu memproduksi entero- toksin. Faktor-faktor lingkungan mikro, seperti faktor adhesi dan kompetisi terhadap bakteri komensal lainnya, perolehan nutrisi, dan pH di dalam saluran gastrointestinal berpengaruh terhadap produksi enterotoksin. Bakteri NU-2 ternyata dapat melisis sel darah merah, namun ekstrak kasar enzim amilase yang dihasilkannya tidak dapat melisis sel darah merah. Dengan demikian apabila enzim akan diaplikasikan harus terbebas dari sel bakteri penghasilnya.
SIMPULAN
Isolat bakteri NU-2, yang merupakan genus Bacillus, mampu menghasilkan baik enzim α-amilase dan glukoamilase. Produksi optimum α-amilase dan glukoamilase terjadi pada saat jam ke-15 setelah inkubasi. Penggunaan media NB yang menggunakan 0.5% tepung ikan mampu meningkatkan produksi kedua enzim. Aktivitas α-amilase optimum pada suhu 37-40 oC, pH 6.0 yang diproduksi pada media pati tapioka, dan pH 6.0-7.0 pada media tepung ikan. Aktivitas
Enzim Bakteri Suhu
Optimum (oC)
pH
Optimum Referensi
α-amilase B. acidocaldaricus 75 3.5 Buonocore et al.
(1976)
α-amilase Clostridium acetobutylicum
ATCC 824 45 5.6
Paquet et al. (1991)
α-amilase Streptomyces rimosus 35-50 6.0-6.7 Yang & Wang
(1999)
α-amilase B. subtilis JS-2004 70 8.0 Ashger et al.
(2007)
α-amilase Bacillus sp. TS-23 70 9.0 Lin et al. (1998)
α-amilase Bacillus sp. IMD370 40 10.0 Mc Tigue et al.
(1995)
Glukoamilase C. thermohydrosulfuricum 75 4.0-6.0 Hyun & Zeikus
(1985)
Glukoamilase Bacillus sp. Termofil 70 5.0 Gill & Kaur
(2004)
Glukoamilase Streptomyces rimosus 35-50 6.0-6.7 Yang & Wang
(1999)
glukoamilase optimum pada suhu 40 oC, pH 6.0 yang diproduksi pada media pati tapioka, dan pH 5.0-6.0 pada media tepung ikan. Sel bakteri NU-2 mampu menghasilkan hemolisin, akan tetapi supernatan yang mengandung enzim amilase ekstrak kasar tidak.
SARAN
Perlu dikaji lebih lanjut mengenai pengaruh inokulum dan komposisi media berdasarkan rasio C/N dalam produksi α -amilase dan gluko-amilase.
DAFTAR PUSTAKA
Alamsyah R. 2005. Pengolahan Pakan Ayam dan Ikan Secara Modern. Depok: Penebar Swadaya.
Ashger M, Asad MJ, Rahman SU, Legge RL. 2007. A thermostable α-amylase from moderately thremophilic Bacillus subtilis strain for starch processing. J Food Eng 79:950-955.
Bernfeld P. 1955. Amylases α and β: Methods in Enzymol I. New York: Academic Pr. Bradford MM. 1976. A rapid and sensitive
method for the quantitation of micrograms quantitaties of protein in utilizing the principle of protein-dye binding. Anal Biochem 72:248-254. Breuil C, Saddler JN. 1985. Comparison of
the 3.5-dinitrosalicylic acid and Nelson-Somogyi methods of assaying for reducing sugars and determining cellulose activity. Enzyme Microbiol Technol 7:331.
Buonocore V, Caporale C, Rosa MD, Gambacorta A. 1976. Stable, inducible thermophilic α-amylase from Bacillus acidocaldaricus. J Bacteriol 128: 515-521.
[DKPRI]. 2005. Pemberdayaan Industri Perikanan Nasional Melalui Pengemba- ngan Budidaya Laut dan Pantai [terhubung berkala]. http: www.dkp.go.id [25 Nov 2006].
Drobniewski FA. 1993. Bacillus cereus and related species. J Clin Microbiol Rev 6(4):324-338.
Duc et al. 2004. Characterization of Bacillus probiotic available for human use. Appl Environ Microbiol 70(4):2161-2171. Feliatra, Efendi I, Suryadi E. 2004. Isolasi dan
identifikasi bakteri probiotik dari ikan kerapu macan (Ephinephelus fuscogatus) dalam upaya efisiensi pakan ikan. J Natur Indones 6:75-80.
Fogarty WM. 1983. Microbial amylases. Di dalam: Fogarty WM, editor. Microbial Enzymes and Biotechnology. London: Applied Science. hlm 1-92.
Gill RK, Kaur J. 2004. A thermostable glucoamylase from a thermophilic Bacillus sp.: characterization and thermostability. J Industrial Microbiol Biotechnol 31:1 [terhubung berkala]. http://www.springerlink.com [20 Desem-ber 2007).
Holt et al. 1994. Determinative Bacteriology. Ed ke-9. NSA: Lippincot William & Wilkins.
Hyun HH, Zeikus JG. 1985. General biochemical characterization of thermo- stable pullulanase and glucoamylase from Clostridium thermohydrosulfuricum. Appl Environ Microbiol 49:1168-1173.
Kim et al. 2004. Properties of a novel thermostable glucoamylase from the hyperthermophilic archaeon Sulfolobus solfataricus. Appl Environ Microbiol 70:3933-3940.
Lin LL, Chyau CC, Hsu WH. 1998. Production and properties of a raw-starch-degrading amylase from the thermophilic and alkaliphilic Bacillus sp. TS-23. Biotechnol Appl Biochem 28:61-68.
Mc Tigue MA, Kelly CT, Doyle EM, Fogarty WM. 1995. The alkaline amylase of the alkalophilic Bacillus sp. IMD 370. Enzymes Microbiol Technol 17:570-573. Mubarik NR, Fatimah I, Wahjuningrum D.
2006. Isolation of proteolytic bacteria from digestive tract of tilapias strain GIFT (Oreochromis niloticus (Linnaeus) Trewavas) and characterization of its extracellular protease. Di dalam: Enzymes: Industrial and Medical Prospects. Proceeding of ASEAN Biochemistry Seminar; Surabaya, 6-7 Feb 2006. Surabaya: Universitas Airlangga. hlm 1-6.
Murtidjo BA. 2001. Pedoman Meramu Pakan Ikan. Yogjakarta: Kanisius.
Paquet V, Croux C, Goma G, Soucaille P. 1991. Purification and characterization of
the extracellular α-amylase from
Clostridium acetobutylicum ATCC 824. Appl Environ Microbiol 57:212-218. Rachmadi AT. 2008. Peranan bakteri asal
Ray AK, Bairagi A, Ghosh KS, Sen SK. 2007. Optimization of fermentation condition for cellulase production by Bacillus subtilis CY5 and Bacillus circulans TP3 isolated from fish gut. Acta Ichthyol Piscat 37(1):47-53.
Sivaramakrishnan et al. 2006. α-Amylase from microbial sources-an overview on recent developments. Food Technol Biotechnol 44:173-184.
Srivastava RAK, Baruah JN. 1986. Culture conditions for production of thermostable amylase by Bacillus stearothermophilus. Appl Environ Microbiol 52:179-184. Suyanandana et al. 1998. New probiotic
lactobacilli and enterococci from fish intestine and their effect on fish production. Di dalam: ASIAN Network on Microbial Researches. Proceeding of International Researches, Yogjakarta, 23-25 Feb 1998.
Usni A. 2000. Pembenihan dan Pembesaran Ikan Nila GIFT. Jakarta: Penebar Swadaya. hlm. 1-10.
Verschuere L, Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotic bacteria as biological control agents in aquaqulture. Microbiol Mol Biol Rev 64:655-671. Whitaker JR. 1994. Principles of Enzymology
for the Food Sciences. Ed ke-2. New York: Marcel Dekker.
Lampiran 1 Skema metode Bernfeld (1955)
1 ml enzim + 1 ml larutan pati 1% (dalam bufer)
Diinkubasi
(suhu optimum, 15 menit)
+ 2 ml DNS
Dididihkan 5 menit
Didinginkan 5 menit
Absorbansi diukur pada λ 550 nm
Blanko: enzim diganti dengan akuades steril.
Kontrol: penambahan enzim dilakukan setelah ditambah DNS, sebelum
dididihkan.
Standar: larutan standar maltosa 100-500 ppm, dengan selang konsentrasi 100
ppm.
Perasamaan aktivitas
α
-amilase (Unit/ml): [maltosa] x Fp
BM maltosa x V x t
Persamaan aktivitas spesifik
α
-amilase (Unit/mg protein):
aktivitas
α
-amilase (Unit/ml)
kadar protein (mg/ml)
Keterangan:
[maltosa]: konsentrasi maltosa (ppm)
Fp: faktor pengenceran
Lampiran 2 Skema metode Somogyi-Nelson (Nelson 1944 dalam Breuil &
Saddler 1985)
0.1
ml enzim + 0.5 ml larutan pati + 0.4 ml bufer
Diinkubasi (suhu optimum, 30 menit)
+ 1 ml Pereaksi A*
Diambil 1 ml + 1 ml Pereaksi D*
Dididihkan 20 menit
Didinginkan 5 menit
+ 1 ml Pereaksi C*,
Dikocok hingga tidak ada gelembung
Diencerkan hingga 25 ml
Absorbansi diukur pada λ 520 nm
Blanko: enzim diganti dengan akuades steril.
Kontrol: penambahan enzim dilakukan setelah ditambah pereaksi A, sebelum
dididihkan.
Standar: larutan standar glukosa 100-500 ppm, dengan selang konsentrasi 100
ppm.
Persamaan aktivitas spesifik glukoamilase (Unit/mg protein):
aktivitas glukoamilase (Unit/ml)
kadar protein (mg/ml)
Keterangan:
[glukosa]: konsentrasi glukosa (ppm)
Fp: faktor pengenceran
BM: bobot molekul maltosa (180.16 dalton)
V: volume enzim yang digunakan (1 ml)
t: waktu inkubasi (20 menit)
*) Cara membuat:
•
Pereaksi A: 2.5 g Na
2CO
3+ 2.5 g NaKtartrat + 2 g NaHCO
3+ 20 g, keempat
bahan dicampur dalam 50 ml akuades steril, lalu diencerkan hingga
100 ml.
•
Pereaksi B: 30 g CuSO
4.5H
2O
dilarutkan dalam 200 ml akuades steril yang
mengandung 4 tetes asam sulfat pekat.
•
Pereaksi C: 5 g amonium molibdat dilarutkan dalam 50 ml akuades yang
mengandung 4.2 ml H
2SO
4. Campuran lain disiapkan dengan
melarutkan 0.6 g Na
2HAsO
4.7H
2O dalam 5 ml akuades. Kedua
campuran disatukan lalu diencerkan hingga 100 ml. Inkubasi
semalam pada suhu 37-40
oC, dimasukkan ke dalam botol gelap
dan disimpan pada suhu rendah.
•
Pereaksi D: 25 ml pereaksi A + 1 ml pereaksi B
Lampiran 3 Skema metode Bradford (1976)
0.1 ml sampel + 5 ml pereaksi Bradford (Coomasie)*
Diinkubasi (±5 menit, < 1 jam)
Absorbansi diukur pada λ 595 nm
Standar: bovin serum albumin 0.1 – 0.5 mg/ml
Blanko: akuades steril pengganti sampel
•
0.01 g Coomasie Brilian Blue (CBB) G-250 dilarutkan dalam 5 ml etanol
95% (v/v), lalu ditambahkan 10 ml asam fosfor 85% (v/v).
•
Campuran dihomogenkan (dikocok kuat) lalu disaring dengan kertas
saring dan disimpan dalam botol gelap dan suhu rendah.
•
Stok pereaksi Bradford harus diencerkan lima kali sebelum digunakan.
Lampiran 4 Hasil penapisan isolat bakteri amilolitik
Hasil (24 jam, T = 37oC)Ulangan 1 (mm) Ulangan 2 (mm) Kode
isolat
Ф koloni Ф zona IA Ф koloni Ф zona IA
Rata-rata
NL 1 10 15.5 0.55 8.5 12 0.41 0.48 NL 2 14.5 21 0.45 12.5 21 0.68 0.57 NL 3 15 21.5 0.43 16.5 22 0.33 0.38 NL 4 5 9 0.8 5.5 8.5 0.54 0.67
NL 6 - - -
-NL 7 - - -
-NL 8 19 25 0.32 24 31 0.29 0.31 NL 9 13 0.65 0.65 13 21 0.62 0.64
NL 10 - - -
-NL 11 - - -
-NL 12 - - -
-NL 13 13 14.5 0.12 11.5 14 0.22 0.17 NL 14 22 23.5 0.07 13.5 17 0.26 0.16 NL 15 13 19 0.46 8 16.5 1.06 0.76
NL 16 7 11 0.57 6 9 0.5 0.54
NL 17 - - -
-NL 18 - - -
-NU 1 10.5 18.5 0.76 8.5 18 1.12 0.94
NU 2 5 14 1.8 11 18 0.64 1.22
NU 3 13 21.5 0.65 13.5 22.5 0.67 0.66
NU 4 - - -
-NU 5 6.5 6.5 0 7 7 0 0
NU 6 - - -
-NU 7 17 22 0.29 12 19 0.58 0.44
NU 8 - - -
-NU 9 15.5 26 0.68 15 26.5 0.77 0.73
NU 10 - - -
-NU 11 - - -
Lampiran 5 Aktivitas amilase dari isolat bakteri NU-2 yang diproduksi pada
media NB dengan substrat 0.5% (b/v) pati tapioka dan tepung ikan.
Suhu inkubasi enzim yang digunakan yaitu 37
oC dengan pH 7.0
Aktivitas (Unit/ml) Aktivitas spesifik (Unit/mg protein) Jenis
Substrat α-amilase glukoamilase α-amilase glukoamilase
Pati tapioka 0.051 0.121 0.358 0.785 Stdev ±0.0014 ±0.0916 ±0.0679 ±0.4667 Tepung ikan 0.073 0.204 0.293 0.795
Stdev ±0.0252 ±0.0785 ±0.1266 ±0.2376 Keterangan: Stdev = standar deviasi dari rata-rata dua ulangan.
Lampiran 6 Karakterisasi
α
-amilase dari isolat bakteri NU-2 pada berbagai suhu
dan pH
•
Aktivitas
α
-amilase isolat NU-2 yang diproduksi pada tepung ikan dan tepung
pati pada berbagai suhu. Pengukuran aktivitas pada pH 7.0
Aktivitas α-amilase (Unit/ml) pada suhu (oC) Jenis Substrat
30 37 40 50 60
Pati tapioka 0.044 0.069 0.065 0.05 0.044 Stdev ±0.0105 ±0.00001 ±0.00001 ±0.00003 ±0.000009 Tepung ikan 0.056 0.083 0.077 0.067 0.052
Stdev ±0.0119 ±0.0231 ±0.014 ±0.0224 ±0.0028 Keterangan: Stdev = standar deviasi dari rata-rata dua ulangan.
•
Aktivitas
α
-amilase isolat NU-2 yang diproduksi pada tepung ikan dan pati
tapioka pada berbagai pH. Pengukuran aktivitas pada suhu optimum 37
oC
Aktivitas α-amilase (Unit/ml) pada pH Jenis
Substrat 4.0 5.0 6.0 7.0 8.0 9.0
Pati tapioka 0.04 0.045 0.072 0.032 0.06 0.04 Stdev ±0.0002 ±0.0003 ±0.0003 ±0.0056 ±0.0133 ±0.0003 Tepung ikan 0.039 0.041 0.063 0.071 0.062 0.063
Lampiran 7 Karakterisasi glukoamilase dari isolat bakteri NU-2 pada berbagai
suhu dan pH
•
Aktivitas glukoamilase isolat NU-2 yang diproduksi pada tepung ikan dan pati
tapioka pada berbagai suhu. Pengukuran aktivitas pada pH 7.0
Aktivitas glukoamilase (Unit/ml) pada suhu (oC) Jenis Substrat
30 37 40 50 60
Pati tapioka 0.176 0.093 0.185 0.093 0.074 Stdev ±0.1178 ±0.00001 ±0.0523 ±0.0523 ±0.000009 Tepung ikan 0.102 0.213 0.296 0.139 0.084
Stdev ±0.0654 ±0.0654 ±0.0523 ±0.0393 ±0.0131 Keterangan: Stdev = standar deviasi dari rata-rata dua ulangan.
•
Aktivitas glukoamilase isolat NU-2 yang diproduksi pada tepung ikan dan pati
tapioka pada berbagai pH. Pengukuran aktivitas pada suhu optimum 40
oC
Aktivitas glukoamilase (Unit/ml) pada pH Jenis Substrat
4.0 5.0 6.0 7.0 8.0 9.0 Pati tapioka 0.121 0.074 0.352 0.056 0.075 0.084
Stdev ±0.0131 ±0 ±0.2237 ±0 ±0.0262 ±0.0131 Tepung ikan 0.111 0.167 0.204 0.158 0.139 0.121
Stdev ±0 ±0 ±0.2093 ±0.1178 ±0.0393 ±0.0393 Keterangan: Stdev = standar deviasi dari rata-rata dua ulangan.
Lampiran 8 Kandungan nutrisi tepung ikan dan pati tapioka (Alamsyah 2005)
Jenis tepung
Kadar protein
(%)
Kadar karbohidrat
(%)
Kadar lemak (%)
Serat kasar (%)
Kadar abu (%)
Kadar kalsium
(%)
Kadar fosfor (%)
Energi metabolisme
(ME) (kkal/kg)
Tepung ikan Pati tapioka
55.7 2.6
2.9 65.84
8.1 0.7
1.5 5.67
20.3 4.69
4.75 0.17
2.45 0.19
KARAKTERISASI
α
-AMILASE DAN GLUKOAMILASE
DARI BAKTERI PROTEOLITIK ASAL PENCERNAAN
IKAN NILA GIFT
MUHAMMAD NOVIANTO BAYU SAPUTRO
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MUHAMMAD NOVIANTO BAYU SAPUTRO. Karakterisasi
Į
-Amilase dan
Glukoamilase dari Bakteri Proteolitik Asal Pencernaan Ikan Nila GIFT.
Dibimbing oleh NISA RACHAMANIA MUBARIK dan ANJA MERYANDINI.
Penggunaan teknologi probiotik telah menjadi salah satu alternatif dalam
usaha meningkatkan produktivitas perikanan. Penelitian ini bertujuan untuk
menapis isolat amilolitik yang memiliki aktivitas
Į
-amilase dan glukoamilase dari
sejumlah bakteri proteolitik yang berasal dari saluran pencernaan ikan nila GIFT
(
Genetic Improvement of Farmed Tilapias
). Dari 31 isolat bakteri proteolitik,
berhasil ditapis sebanyak 18 isolat amilolitik. Tiga isolat diantaranya
menunjukkan indeks amilolitik (IA) terbesar yaitu NU-1, NU-2, dan NL-15.
Pengukuran aktivitas
Į
-amilase menggunakan metode Bernfeld dan aktivitas
glukoamilase dengan metode Somogyi-Nelson. Kadar protein diukur dengan
metode Bradford. Isolat bakteri NU-2, yang merupakan genus
Bacillus
, mampu
menghasilkan enzim
Į
-amilase dan glukoamilase. Aktivitas maksimum
Į
-amilase
dan glukoamilase terjadi pada jam ke-15 setelah inkubasi. Hasil karakterisasi
menunjukkan bahwa aktivitas
Į
-amilase optimum pada suhu 37-40
oC, pH 6.0
yang diproduksi pada media pati tapioka, dan pH 6.0-7.0 pada media tepung ikan.
Aktivitas glukoamilase optimum pada suhu 40
oC, pH 6.0 yang diproduksi pada
media pati tapioka, dan pH 5.0-6.0 pada media tepung ikan. Penggunaan media
kaldu nutrien (NB) dengan menggunakan 0.5% (b/v) tepung ikan ternyata
meningkatkan produksi enzim
Į
-amilase dan glukoamilase dari isolat NU-2.
ABSTRACT
MUHAMMAD NOVIANTO BAYU SAPUTRO. Characterization of
Į
-Amylase
and Glucoamylase Production from Tilapia Digestive Tract Proteolytic Bacteria.
Supervised by NISA RACHMANIA MUBARIK and ANJA MERYANDINI.
PENDAHULUAN
Permintaan dan kebutuhan ikan dunia terus meningkat dari tahun ke tahun, sebagai akibat pertambahan penduduk. Oleh sebab itu, diperlukan adanya peningkatan produktivitas perikanan untuk mengimbangi jumlah permintaan yang terus meningkat (DKPRI 2005).
Penggunaan teknologi probiotik telah menjadi salah satu alternatif dalam usaha meningkatkan produktivitas perikanan. Probiotik di dalam bidang akuakultur didefinisikan sebagai suplemen mikrob hidup yang memberikan efek menguntungkan terhadap inangnya dengan cara mengubah struktur komunitas mikrob, meningkatkan fungsi pemanfaatan pakan atau peningkatan nilai gizi pakan, meningkatkan ketahanan inang terhadap penyakit, serta meningkatkan kualitas lingkungan di sekitar inang (Verschuere et al. 2000).
Salah satu prinsip dasar kerja probiotik ialah memanfaatkan kemampuan mikroorganisme dalam memecah atau menguraikan rantai panjang karbohidrat, protein, dan lemak yang menyusun pakan yang diberikan. Kemampuan ini diperoleh karena adanya enzim-enzim khusus yang dimiliki mikrob untuk memecah ikatan tersebut (Feliatra et al. 2004). Penelitian Suyanandana et al. (1998) menunjukkan bahwa penggunaan bakteri asam laktat galur E7, E26, dan F10 sebagai suplemen makanan pada budidaya Tilapia nilotica ternyata mampu meningkatkan bobot ikan dan menunjukkan resisten terhadap serangan bakteri patogen Aeromonas hydrophila.
Enzim α-amilase dan glukoamilase
merupakan enzim yang memiliki peranan dalam proses perombakan karbohidrat atau
pati. Enzim α-amilase (EC 3.2.1.1)
mengatalisis pemutusan ikatan glikosidik α -1.4 dari dalam molekul pati, sedangkan glukoamilase atau amiloglukosidase (EC 3.2.1.3) menghidrolisis ikatan glikosidik α-1,4 dan α-1,6 dari bagian ujung gula nonpereduksi secara berurutan (Fogarty 1983).
Berbagai penelitian telah dilakukan untuk mencari kandidat probiotik unggul untuk budidaya perikanan. Feliatra et al. (2004) telah berhasil mengisolasi dan mengidentifikasi bakteri probiotik dari ikan kerapu macan (Ephinephelus fuscogatus) dalam upaya efisiensi pakan ikan. Demikian pula Mubarik et al. (2006) melaporkan telah berhasil mengisolasi tiga puluh satu isolat bakteri proteolitik dari pencernaan ikan nila
GIFT (Genetic Improvement of Farmed
Tilapias) dan beberapa isolat terpilih (NU-5 dan NU-8) dari penelitian tersebut telah dikarakterisasi aktivitas proteasenya. Enterobacter sp. galur NU-5 menghasilkan metaloprotease yang optimum pada suhu 50 oC, pH 7.0, dan aktivitasnya meningkat dengan penambahan Co2+. Aeromonas sp. galur NU-8 juga menghasilkan metaloprotease dengan aktivitas optimum pada suhu 70 oC, pH 7.0, dan aktivitasnya meningkat dengan penambahan K+.
Sehubungan dengan upaya menggali kemampuan isolat-isolat proteolitik yang memiliki potensi menghasilkan enzim amilase ekstraseluler, maka penelitian ini bertujuan untuk menapis isolat-isolat proteolitik tersebut yang memiliki aktivitas enzim α -amilase dan gluko-amilase serta melakukan karakterisasi kedua enzim amilase tersebut berdasarkan pH dan suhu yang diproduksi dengan menggunakan substrat yang berbeda. Dari hasil penelitian ini diharapkan diperoleh isolat-isolat yang dapat diaplikasikan sebagai agen probiotik dalam budidaya perikanan air tawar.
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Februari sampai Nopember 2007 di Laboratorium Bagian Mikrobiologi FMIPA, IPB.
BAHAN DAN METODE
Bahan
Bahan-bahan yang digunakan ialah 31 isolat bakteri proteolitik asal ikan nila koleksi Bagian Mikrobiologi, Departemen Biologi, FMIPA, IPB, media agar-agar nutrien (NA), media kaldu nutrien (NB), pati tapioka (tepung tapioka), tepung ikan, pereaksi-pereaksi: Bernfeld (1955), Somogyi-Nelson (Nelson 1944 dalam Breuil & Saddler 1985), dan Bradford (1976). Peralatan yang digunakan ialah peralatan yang umum digunakan di laboratorium mikrobiologi.
Peremajaan Isolat Bakteri
Tiga puluh satu isolat proteolitik asal pencernaan ikan nila yang telah diperoleh dari penelitian sebelumnya (Mubarik et al. 2006) diremajakan pada kaldu nutrien (NB) yang mengandung 0.5% pati tapioka (b/v). Kultur diinkubasi pada suhu ruang (25-27 oC) selama ±24 jam dan digoyang dengan kecepatan 140 rpm.
Penapisan Isolat Bakteri Amilolitik
PENDAHULUAN
Permintaan dan kebutuhan ikan dunia terus meningkat dari tahun ke tahun, sebagai akibat pertambahan penduduk. Oleh sebab itu, diperlukan adanya peningkatan produktivitas perikanan untuk mengimbangi jumlah permintaan yang terus meningkat (DKPRI 2005).
Penggunaan teknologi probiotik telah menjadi salah satu alternatif dalam usaha meningkatkan produktivitas perikanan. Probiotik di dalam bidang akuakultur didefinisikan sebagai suplemen mikrob hidup yang memberikan efek menguntungkan terhadap inangnya dengan cara mengubah struktur komunitas mikrob, meningkatkan fungsi pemanfaatan pakan atau peningkatan nilai gizi pakan, meningkatkan ketahanan inang terhadap penyakit, serta meningkatkan kualitas lingkungan di sekitar inang (Verschuere et al. 2000).
Salah satu prinsip dasar kerja probiotik ialah memanfaatkan kemampuan mikroorganisme dalam memecah atau menguraikan rantai panjang karbohidrat, protein, dan lemak yang menyusun pakan yang diberikan. Kemampuan ini diperoleh karena adanya enzim-enzim khusus yang dimiliki mikrob untuk memecah ikatan tersebut (Feliatra et al. 2004). Penelitian Suyanandana et al. (1998) menunjukkan bahwa penggunaan bakteri asam laktat galur E7, E26, dan F10 sebagai suplemen makanan pada budidaya Tilapia nilotica ternyata mampu meningkatkan bobot ikan dan menunjukkan resisten terhadap serangan bakteri patogen Aeromonas hydrophila.
Enzim α-amilase dan glukoamilase
merupakan enzim yang memiliki peranan dalam proses perombakan karbohidrat atau
pati. Enzim α-amilase (EC 3.2.1.1)
mengatalisis pemutusan ikatan glikosidik α -1.4 dari dalam molekul pati, sedangkan glukoamilase atau amiloglukosidase (EC 3.2.1.3) menghidrolisis ikatan glikosidik α-1,4 dan α-1,6 dari bagian ujung gula nonpereduksi secara berurutan (Fogarty 1983).
Berbagai penelitian telah dilakukan untuk mencari kandidat probiotik unggul untuk budidaya perikanan. Feliatra et al. (2004) telah berhasil mengisolasi dan mengidentifikasi bakteri probiotik dari ikan kerapu macan (Ephinephelus fuscogatus) dalam upaya efisiensi pakan ikan. Demikian pula Mubarik et al. (2006) melaporkan telah berhasil mengisolasi tiga puluh satu isolat bakteri proteolitik dari pencernaan ikan nila
GIFT (Genetic Improvement of Farmed
Tilapias) dan beberapa isolat terpilih (NU-5 dan NU-8) dari penelitian tersebut telah dikarakterisasi aktivitas proteasenya. Enterobacter sp. galur NU-5 menghasilkan metaloprotease yang optimum pada suhu 50 oC, pH 7.0, dan aktivitasnya meningkat dengan penambahan Co2+. Aeromonas sp. galur NU-8 juga menghasilkan metaloprotease dengan aktivitas optimum pada suhu 70 oC, pH 7.0, dan aktivitasnya meningkat dengan penambahan K+.
Sehubungan dengan upaya menggali kemampuan isolat-isolat proteolitik yang memiliki potensi menghasilkan enzim amilase ekstraseluler, maka penelitian ini bertujuan untuk menapis isolat-isolat proteolitik tersebut yang memiliki aktivitas enzim α -amilase dan gluko-amilase serta melakukan karakterisasi kedua enzim amilase tersebut berdasarkan pH dan suhu yang diproduksi dengan menggunakan substrat yang berbeda. Dari hasil penelitian ini diharapkan diperoleh isolat-isolat yang dapat diaplikasikan sebagai agen probiotik dalam budidaya perikanan air tawar.
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Februari sampai Nopember 2007 di Laboratorium Bagian Mikrobiologi FMIPA, IPB.
BAHAN DAN METODE
Bahan
Bahan-bahan yang digunakan ialah 31 isolat bakteri proteolitik asal ikan nila koleksi Bagian Mikrobiologi, Departemen Biologi, FMIPA, IPB, media agar-agar nutrien (NA), media kaldu nutrien (NB), pati tapioka (tepung tapioka), tepung ikan, pereaksi-pereaksi: Bernfeld (1955), Somogyi-Nelson (Nelson 1944 dalam Breuil & Saddler 1985), dan Bradford (1976). Peralatan yang digunakan ialah peralatan yang umum digunakan di laboratorium mikrobiologi.
Peremajaan Isolat Bakteri
Tiga puluh satu isolat proteolitik asal pencernaan ikan nila yang telah diperoleh dari penelitian sebelumnya (Mubarik et al. 2006) diremajakan pada kaldu nutrien (NB) yang mengandung 0.5% pati tapioka (b/v). Kultur diinkubasi pada suhu ruang (25-27 oC) selama ±24 jam dan digoyang dengan kecepatan 140 rpm.
Penapisan Isolat Bakteri Amilolitik
agar-agar nutrien (NA) yang mengandung 0.5% pati tapioka. Isolat bakteri diinkubasi selama 24 jam pada suhu ruang, lalu diamati zona bening yang terbentuk. Isolat bakteri lalu dipilih berdasarkan indeks amilolitiknya (IA), yaitu nisbah antara selisih diameter zona bening dengan diameter koloninya. Tiga isolat bakteri dengan indeks amilolitik terbesar diuji aktivitas α-amilase dan glukoamilasenya. Satu isolat bakteri penghasil aktivitas α-amilase dan glukoamilase terbesar dipilih untuk dilakukan identifikasi dengan pewarnaan Gram dan ditentukan kondisi optimum pertumbuhannya.
Isolat bakteri terpilih diuji patogenitasnya dengan digores pada media agar-agar darah. Hal yang sama juga dilakukan pada supernatannya, yaitu dengan meneteskan 15
μl supernatan di atas filtrate paper pada media agar-agar darah. Biakan diinkubasi selama 24 jam lalu diamati ada tidaknya zona bening yang terbentuk.
Produksi Enzim
Tiga isolat bakteri penghasil IA terbesar ditumbuhkan pada media kaldu nutrien (NB) yang mengandung 0.5% pati tapioka (b/v) lalu diinkubasi selama 24 jam pada suhu 25 oC dan digoyang dengan kecepatan 140 rpm. Enzim amilase ekstrak kasar ekstraseluler diperoleh dengan cara mensentrifugasi kultur pada 8400 g selama 15 menit pada suhu 4 oC. Supernatan mengandung enzim amilase lalu dipisahkan dari endapan dan diukur aktivitasnya.
Pengukuran Aktivitas α-Amilase
Metode yang digunakan ialah metode Bernfeld (1955). Sebanyak 1 ml larutan pati 1% (dalam 0.05M bufer Tris-HCl pH 7) direaksikan dengan 1 ml enzim ekstrak kasar, lalu diinkubasi pada suhu 37 dan 50 oC selama 20 menit. Campuran direaksikan dengan 2 ml pereaksi dinitrosalisilat (DNS) dan didihkan selama 5 menit. Absorbansi diukur dengan spektrofotometer pada panjang gelombang 550 nm. Satu unit (U) aktivitas α-amilase didefinisikan sebagai jumlah enzim yang menghasilkan produk setara 1 µmol maltosa per menit pada kondisi pengukuran. Sebagai standar, digunakan larutan maltosa pada konsentrasi 100-500 ppm dengan selang konsentrasi 100 ppm (Lampiran 1). Pengujian aktivitas α-amilase pada sampel, kontrol, dan blanko diulang sebanyak dua kali.
Pengukuran Aktivitas Glukoamilase
Aktivitas enzim glukoamilase diukur dengan metode Somogyi-Nelson (Nelson dalam Breuil & Saddler 1985). Sebanyak 0.5
ml larutan pati 0.5%, 0.4 ml bufer Tris-HCl 0.05 M pH 7 dan 0.1 ml larutan enzim direaksikan di dalam tabung reaksi dan diinkubasi selama 30 menit pada suhu 37 dan 50 oC. Pada akhir inkubasi ditambahkan 1 ml pereaksi A. Sebanyak 1 ml campuran tersebut diambil dan direaksikan dengan pereaksi D dalam tabung reaksi yang lain lalu didihkan selama 20 menit. Campuran didinginkan pada air mengalir selama 5 menit, direaksikan dengan pereaksi C kemudian dikocok kuat sampai tidak ada gelembung Setelah itu, campuran diencerkan dengan akuades hingga volume akhir 25 ml. Absorbansi diukur pada panjang gelombang 520 nm. Satu unit (U) aktivitas glukoamilase setara dengan 1 µmol glukosa yang dihasilkan per menit pada kondisi pengukuran. Sebagai standar digunakan glukosa pada konsentrasi 100-500 ppm dengan selang konsentrasi 100 ppm (Lampiran 2). Pengujian aktivitas glukoamilase pada sampel, kontrol, dan blanko diulang sebanyak dua kali.
Pengukuran Kadar Protein
Kadar protein diukur dengan metode Bradford (1976). Sebanyak 0.1 ml enzim ekstrak kasar direaksikan dengan 5 ml pereaksi Bradford lalu diinkubasi selama 5 menit. Absorbansi diukur pada panjang gelombang 595 nm. Sebagai standar digunakan larutan bovine serum albumin (BSA) berkonsentrasi 100-500 ppm dengan selang konsentrasi 100 ppm (Lampiran 3). Pengujian kadar protein pada sampel dan blanko diulang sebanyak dua kali.
Pembuatan Kurva Pertumbuhan Sel dan Aktivitas Enzim
Sebanyak ±108 sel/ml isolat terpilih ditumbuhkan pada media NB yang mengandung 0.5% pati tapioka. Kultur diinkubasi dan digoyang dengan kecepatan 92 rpm selama 36 jam pada suhu 37 oC. Setelah itu, diukur pertumbuhan sel, aktivitas α -amilase, dan glukoamilase setiap 3 jam selama 36 jam. Pengujian aktivitas α-amilase, glukoamilase, dan jumlah sel diulang sebanyak dua kali.
Uji Modifikasi Substrat
8400 g 15 menit dan diukur aktivitas
α-amilase dan glukoamilasenya. Uji aktivitas kedua enzim pada masing-masing perlakuan diulang sebanyak dua kali.
Karakterisasi Suhu dan pH Enzim
Karakterisasi aktivitas enzim dilakukan untuk mengetahui kondisi optimum kedua enzim pada berbagai suhu dan pH. Rentang suhu yang digunakan yaitu 30, 37, 40, 50, dan 60 oC. Rentang pH yang digunakan yaitu 4.0 hingga 9.0. Bufer yang digunakan yaitu bufer sitrat (pH 4.0, 5.0, dan 6.0), bufer tris-HCl (pH 7.0 dan 8.0), dan bufer glisin-NaOH (pH 9.0) masing-masing dengan konsentrasi 0.05 M.
HASIL
Sebanyak 18 isolat bakteri proteolitik yang diujikan mampu membentuk zona bening di sekitar koloni pada media NA yang mengandung 0.5% pati tapioka pada suhu ruang setelah disiram dengan larutan Iodin (Lampiran 4 & Gambar 1).
[image:31.595.323.510.83.251.2]
Gambar 1 Isolat bakteri amilolitik pada agar- agar nutrien yang mengandung 0.5% (b/v) pati tapioka setelah 24 jam inkubasi.
Ada tiga isolat dari 18 isolat amilolitik yang memiliki nilai IA paling besar dari rata-rata dua ulangan yaitu isolat bakteri NU-1 (1.22), NU-2 (0.94), dan NL-15 (0.76) (Lampiran 4). Hasil pengukuran aktivitas
enzim α-amilase dan glukoamilase
menunjukkan bahwa isolat bakteri NU-1 memiliki aktivitas spesifik glukoamilase pada suhu inkubasi enzim 50 oC, yaitu sebesar 0.143 unit/mg protein. Isolat bakteri NL-15 memiliki aktivitas spesifik α-amilase pada suhu inkubasi enzim 37 oC, yaitu sebesar 0.363 unit/mg protein. Di antara ketiga isolat penghasil IA terbesar hanya isolat bakteri NU-2 yang memiliki aktivitas α-amilase pada suhu 50 oC dan glukoamilase pada suhu 37 oC. Nilai aktivitas α-amilase spesifik sebesar 0.085 unit/mg protein dan glukoamilase spesifik sebesar 0.865 unit/mg protein (Tabel 1).
Tabel 1 Hasil uji aktivitas α-amilase dan glukoamilase dari tiga isolat bakteri terpilih Aktivitas spesifik α-amilase (Unit/mg protein) Aktivitas spesifik glukoamilase (Unit/mg protein) Suhu inkubasi enzim Suhu inkubasi enzim Kode isolat
37 oC 50 oC 37 oC 50 oC
NU-1 NU-2 NL-15 - - 0.363 - 0.085 - - 0.865 - 0.143 - -
[image:31.595.362.472.340.425.2] [image:31.595.322.515.562.689.2]Hasil identifikasi menunjukkan bahwa isolat bakteri NU-2 tergolong ke dalam genus Bacillus yang memiliki ciri-ciri yaitu bentuk sel batang berantai, bersifat Gram positif, dan memiliki endospora pada bagian sentral sel (Gambar 2).
Gambar 2 Sel isolat NU-2 hasil pewarnaan Gram (perbesaran mikroskop 1000X).
Sebagai analisis tambahan dari penelitian ini dilakukan uji patogenitas. Bakteri NU-2 mampu membentuk zona bening pada media agar-agar darah, sebaliknya uji supernatan yang bebas sel tidak menunjukkan adanya zona bening (Gambar 3).
Gambar 3 Uji patogenitas terhadap isolat bakteri NU-2 (a) dan supernatannya (b).
Pengukuran turbiditas sel yang dilakukan setiap tiga jam selama 36 jam menunjukkan bahwa bakteri NU-2 mengalami fase lag pada jam ke-0 hingga jam ke-9, fase eksponensial pada jam ke-9 hingga jam ke-12, dan
endospora
a
8400 g 15 menit dan diukur aktivitas
α-amilase dan glukoamilasenya. Uji aktivitas kedua enzim pada masing-masing perlakuan diulang sebanyak dua kali.
Karakterisasi Suhu dan pH Enzim
Karakterisasi aktivitas enzim dilakukan untuk mengetahui kondisi optimum kedua enzim pada berbagai suhu dan pH. Rentang suhu yang digunakan yaitu 30, 37, 40, 50, dan 60 oC. Rentang pH yang digunakan yaitu 4.0 hingga 9.0. Bufer yang digunakan yaitu bufer sitrat (pH 4.0, 5.0, dan 6.0), bufer tris-HCl (pH 7.0 dan 8.0), dan bufer glisin-NaOH (pH 9.0) masing-masing dengan konsentrasi 0.05 M.
HASIL
Sebanyak 18 isolat bakteri proteolitik yang diujikan mampu membentuk zona bening di sekitar koloni pada media NA yang mengandung 0.5% pati tapioka pada suhu ruang setelah disiram dengan larutan Iodin (Lampiran 4 & Gambar 1).
[image:32.595.323.510.83.251.2]
Gambar 1 Isolat bakteri amilolitik pada agar- agar nutrien yang mengandung 0.5% (b/v) pati tapioka setelah 24 jam inkubasi.
Ada tiga isolat dari 18 isolat amilolitik yang memiliki nilai IA paling besar dari rata-rata dua ulangan yaitu isolat bakteri NU-1 (1.22), NU-2 (0.94), dan NL-15 (0.76) (Lampiran 4). Hasil pengukuran aktivitas
enzim α-amilase dan glukoamilase
menunjukkan bahwa isolat bakteri NU-1 memiliki aktivitas spesifik glukoamilase pada suhu inkubasi enzim 50 oC, yaitu sebesar 0.143 unit/mg protein. Isolat bakteri NL-15 memiliki aktivitas spesifik α-amilase pada suhu inkubasi enzim 37 oC, yaitu sebesar 0.363 unit/mg protein. Di antara ketiga isolat penghasil IA terbesar hanya isolat bakteri NU-2 yang memiliki aktivitas α-amilase pada suhu 50 oC dan glukoamilase pada suhu 37 oC. Nilai aktivitas α-amilase spesifik sebesar 0.085 unit/mg protein dan glukoamilase spesifik sebesar 0.865 unit/mg protein (Tabel 1).
Tabel 1 Hasil uji aktivitas α-amilase dan glukoamilase dari tiga isolat bakteri terpilih Aktivitas spesifik α-amilase (Unit/mg protein) Aktivitas spesifik glukoamilase (Unit/mg protein) Suhu inkubasi enzim Suhu inkubasi enzim Kode isolat
37 oC 50 oC 37 oC 50 oC
NU-1 NU-2 NL-15 - - 0.363 - 0.085 - - 0.865 - 0.143 - -
[image:32.595.362.472.340.425.2] [image:32.595.322.515.562.689.2]Hasil identifikasi menunjukkan bahwa isolat bakteri NU-2 tergolong ke dalam genus Bacillus yang memiliki ciri-ciri yaitu bentuk sel batang berantai, bersifat Gram positif, dan memiliki endospora pada bagian sentral sel (Gambar 2).
Gambar 2 Sel isolat NU-2 hasil pewarnaan Gram (perbesaran mikroskop 1000X).
Sebagai analisis tambahan dari penelitian ini dilakukan uji patogenitas. Bakteri NU-2 mampu membentuk zona bening pada media agar-agar darah, sebaliknya uji supernatan yang bebas sel tidak menunjukkan adanya zona bening (Gambar 3).
Gambar 3 Uji patogenitas terhadap isolat bakteri NU-2 (a) dan supernatannya (b).
Pengukuran turbiditas sel yang dilakukan setiap tiga jam selama 36 jam menunjukkan bahwa bakteri NU-2 mengalami fase lag pada jam ke-0 hingga jam ke-9, fase eksponensial pada jam ke-9 hingga jam ke-12, dan
endospora
a
memasuki fase stasioner pada jam ke-15 setelah inkubasi (Gambar 4).
[image:33.595.321.512.121.741.2]Hasil pengukuran aktivitas enzim α -amilase isolat bakteri NU-2 menunjukkan bahwa aktivitas spesifik maksimum α-amilase terjadi pada jam ke-3 (0.163 unit/mg protein) dan ke-15 (0.1 unit/mg protein). Aktivitas spesifik glukoamilase maksimum terjadi pada jam 6 (0.947 unit/mg protein) dan jam ke-15 (0.903 unit/mg protein) (Gambar 4).
Gambar 4 Kurva pertumbuhan dan aktivitas amilase isolat NU-2 pada media NB dengan substrat 5% (b/v) pati tapioka. pH media yaitu 7 dengan suhu produksi 37 oC.
Pertumbuhan sel untuk produksi amilase pada substrat yang dimodifikasi menunjukkan bahwa aktivitas kedua enzim ternyata relatif lebih tinggi pada media NB yang mengandung 0.5% tepung ikan dengan nilai aktivitas α -amilase yaitu 0.051 unit/ml dan gluko-amilase yaitu 0.204 unit/ml (Lampiran 5 & Gambar 5a). Meskipun demikian, aktivitas spesifik ternyata menunjukkan perbedaan hasil, yaitu nilai aktivitas α-amilase ternyata lebih tinggi pada media pati tapioka, sedangkan aktivitas spesifik glukoamilasenya tidak jauh berbeda antara media pati tapioka dan media tepung ikan (Lampiran 5 & Gambar 5b). Hasil pengukuran kadar protein media kontrol tanpa inokulasi menunjukkan kadar protein pada media tepung ikan memang lebih tinggi yaitu 0.546 mg/ml, sedangkan pati tapioka yaitu 0.441 mg/ml.
Hasil karakterisasi menunjukkan bahwa aktivitas α-amilase isolat NU-2 optimum pada suhu 37-40 oC dan pH 6.0 untuk yang diproduksi pada media pati tapioka dan 6.0-7.0 pada media tepung ikan (Lampiran 6, Gambar 6 & 7). Aktivitas optimum glukoamilase terjadi pada suhu 40 oC dan pH
6.0 untuk yang diproduksi pada media pati tapioka dan pH 5.0-6.0 pada media tepung ikan (Lampiran 7, Gambar 8 & 9).
(a)
(b)
Gambar 5 Aktivitas α-amilase dan
glukoamilase isolat NU-2 yang diproduksi dengan mengguna- kan substrat pati tapioka dan tepung ikan (a) dalam satuan aktivitas unit/ml, (b) dalam satuan aktivitas unit/mg protein.
Gambar 6 Aktivitas α-amilase isolat NU-2 yang diproduksi pada tepung ikan dan pati tapioka pada berbagai suhu. Pengukuran aktivitas pada pH 7.0.
[image:33.595.107.302.211.444.2]Gambar 7 Aktivitas α-amilase isolat NU-2 yang diproduksi pada tepung ikan dan pati tapioka pada berbagai pH. Pengukuran aktivitas pada suhu optimum 37 oC.
Gambar 8 Aktivitas glukoamilase isolat NU-2 yang diproduksi pada tepung ikan dan pati tapioka pada berbagai suhu. Pengukuran aktivitas pada pH 7.0.
Gambar 9 Aktivitas glukoamilase isolat NU-2 yang diproduksi pada tepung ikan dan pati tapioka pada berbagai pH. Pengukuran aktivitas pada suhu optimum 40 oC.
PEMBAHASAN
Ikan nila galur GIFT (Genetic
Improvement of Farmed Tilapias) atau Oreochromis niloticus (Linnaeus) Trewavas merupakan ikan nila unggul hasil seleksi dan persilangan dari delapan galur ikan nila yang dikumpulkan dari delapan negara yaitu Mesir, Ghana, Senegal, Kenya, Israel, Singapura, Thailand, dan Taiwan. Ikan nila GIFT memiliki beberapa keunggulan dibandingkan varietas lokalnya, diantaranya yaitu tingkat pertumbuhan yang cepat, fekunditas (kesuburan) yang tinggi, serta ketahanannya terhadap penyakit (Usni 2000). Penelitian Rachmadi (2008) juga menunjukkan bahwa beberapa bakteri proteolitik yang diisolasi dari saluran pencernaan ikan nila GIFT ternyata mampu mengambat pertumbuhan Microcystis aeruginosa yang bersifat toksik bagi ikan lain. Oleh sebab itu, potensi diperolehnya kandidat isolat-isolat probiotik dari saluran pencernaan ikan nila GIFT cukup besar.
Terkait dengan fungsinya dalam meningkatkan efisiensi pakan, isolat-isolat probiotik diharapkan mampu menghasilkan enzim-enzim yang bersifat digestif. Enzim-enzim ini dapat memecah makromolekul (protein, karbohidrat, lemak) yang terdapat di dalam pakan ikan sehingga membuat penyerapan makanan menjadi lebih efektif dan efisien. Hasil penelitian Mubarik et al. (2006) menunjukkan bahwa isolat NU-2 merupakan bakteri proteolitik dengan nilai Indeks Proteolitik (IP) sebesar 1.89. Meskipun protease ekstraseluler dari isolat NU-2 belum dikarakterisasi, akan tetapi isolat bakteri ini berpotensi untuk dijadikan prob