i
MEMPERBAIKI PERTUMBUHAN JUVENIL
ABALON (
Haliotis asinina
Linn. 1758)
FATURRAHMAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
iii Dengan ini saya menyatakan bahwa disertasi Potensi Bakteri Agarolitik
sebagai Penyedia Enzim Agarase Eksogen untuk Memperbaiki Pertumbuhan
Juvenil Abalon (Haliotis asinina Linn. 1758) adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber
informasi yang berasal dari karya yang diterbitkan maupun tidak diterbitkan dari
penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di
bagian akhir disertasi ini.
Bogor, Juni 2012
v FATURRAHMAN.
The Potency of Agarolytic Bacteria As Producer of
Exogenous Agarase Enzyme to Improve Growth of Abalone Juvenile
(Haliotis asinina
Linn. 1758). Under supervision of
ANJA MERYANDINI, M. ZAIRIN JUNIOR, IMAN RUSMANAThere is a great potential of using probiotics in aquaculture to increase growth rates and improve nutritional status of cultured animals. The aims of this research were to isolate and select agarolytic bacteria, to identify isolates based on physiological, biochemical and molecular properties, to analyze agarase activity of the isolates, to evaluate colonization ability of agarolytic isolates in the gastrointestinal tract of abalone. Growth performance of gnotobiotic and normal abalone were evaluated and compared with abalone fed cake-Gracilaria supplemented with probiotic strains. The result of isolation can be achieved 14 agarolytic bacteria. Seven of them showed antibiotic resistance. Based on their growth rate, degree of agar liquefaction and qualitative agarolytic activity were carried out three isolate that potential as exogenous agarase producers, i.e. Alg4.2, Alg3.1 and Abn1.2 isolates. These isolates were identified as Vibrio. The ability of Alg3.1 strain to degrade agar was higher than the others, whereas the highest starch degradation was achieved by Abn1.2 strain. All isolates showed high capacity to degrade casein. Generally, the degree of carbohydrate and protein hydrolysis were increased up to 48 h of incubation. In vitro agarase activity of mix culture Alg3.1-Abn1.2 (0.593 nkat/mL) was higher than that of single culture of Alg3.1 (0.489 nkat/mL), Alg4.2 (0.423 nkat/mL) and Abn1.2 (0.411 nkat/mL). So the mix culture was chosen as candidate of probiotic. Abalone fed diet supplemented with mix culture of Alg3.1-Abn1.2 strains exhibited higher growth rate compared to that of abalone fed standard diet under laboratory conditions. The increasing of biomass of gnotobiotic and normal abalone supplemented with Alg3.1-Abn1.2 strains were higher 32.22 and 11.09% respectively than that of gnotobiotic and normal abalone fed standard diet. The improving of gaining daily shell length of gnotobiotic and normal abalone supplemented with probiotics were higher 24.17 and 21.88% than that of abalone fed unsupplemented diet. The efficiency and the feed conversion of abalone which supplemented with Alg3.1-Abn1.2 strains was better than that of control abalone. Application of Alg3.1-Abn1.2 strains as diet increased the activity of agarase and amylase exogen in the abalone digestive tract. The number of culturable cell reisolated from abalone fed probiotic-supplemented cake for 14 days was 106 -107cfu/g.
vii Eksogen untuk Memperbaiki Pertumbuhan Juvenil Abalon (Haliotis asinina Linn. 1758)
. Dibimbing oleh
ANJA MERYANDINI, M. ZAIRIN JUNIOR, IMAN RUSMANAAbalon atau siput mata tujuh (Haliotis asinina) merupakan salah satu komoditi ekspor perairan laut andalan NTB. Minat masyarakat untuk mengembangkan budidaya abalon sangat tinggi karena didorong oleh tingginya permintaan dunia akan abalon hidup. Salah satu kendala yang dihadapi pembudidaya abalon adalah laju pertumbuhan abalon yang lambat, dibutuhkan waktu lebih dari 18 bulan untuk mencapai ukuran layak ekspor. Peningkatan laju pertumbuhan abalon dapat dilakukan melalui pemberian probiotik. Probiotik akuakultur selain dapat menekan kehadiran bakteri patogen perairan juga menghasilkan sejumlah metabolit yang dapat memicu sistem imunitas inang, membantu sistem pencernaan inang melalui penyediaan nutrisi esensial maupun enzim-enzim pencernaan eksogen serta membantu memperbaiki kualitas perairan. Tujuan penelitian ini adalah untuk menyeleksi dan mengembangkan galur bakteri probiotik yang dapat meningkatkan laju pertumbuhan abalon. Isolat bakteri yang berpotensi sebagai probiotik dipilih. Pemilihan ini didasarkan atas kemampuannya dalam memecah komplek agar-agar penyusun dinding sel alga, kerentanan isolat terhadap antibiotik, laju pertumbuhan, derajat agarolitik isolat tunggal dan kombinasi terbaik, patogenisitas terhadap inang, ketahanan terhadap pH asam, viabilitas pada air laut, kemampuan penempelan pada lempeng baja stainless, derajat hidrofobisitas, dan koagregasi isolat. Isolat yang terseleksi sebagai kandidat probiotik selanjutnya diidentifikasi secara biokimia, fisiologi dan molekuler berdasarkan sekuen 16S rDNA. Isolat yang terpilih diuji kemampuannya dalam mendegradasi substrat pati, agar-agar dan kasein serta aktivitas enzim agarase secara in vitro. Sebelum diaplikasikan, isolat kandidat diuji kemampuannya untuk berkolonisasi pada saluran pencernaan abalon. Selanjutnya adalah uji coba aplikasi isolat bakteri kandidat pada skala laboratorium untuk melihat kemampuannya dalam meningkatkan pertumbuhan abalon. Untuk melihat kontribusi isolat dalam menyediakan enzim eksogen maka dilakukan uji aktivitas enzim agarase secara in situ. Informasi tentang aspek mikrobiologi, aktivitas dan kemampuannya sebagai probiotik dari isolat bakteri ini diharapkan dapat mendukung pengembangan paket teknologi probiotik untuk budidaya siput mata tujuh secara luas.
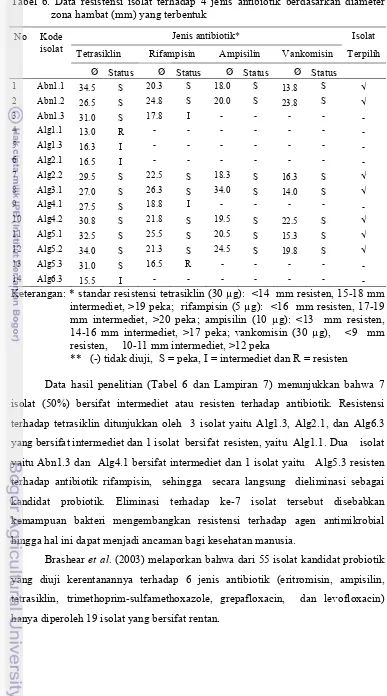
viii resisten terhadap antibiotik rifampisin, yaitu, Abn1.3, Alg4.1 dan Alg5.3 sehingga ketujuh isolat secara langsung dieliminasi sebagai kandidat probiotik. Isolat-isolat yang sensitif diukur laju pertumbuhannya. Empat isolat yaitu Abn1.2, Alg3.1, Alg4.2 dan Alg5.1 memperlihatkan laju pertumbuhan yang lebih tinggi dibanding Abn1.3, Alg2.2 dan Alg5.2.
Hasil uji kemampuan isolat dalam menghidrolisis agar-agar dalam bentuk kultur tunggal maupun kombinasinya menunjukkan bahwa kombinasi antara isolat Abn1.2 dengan Alg3.1 dan Abn1.2 dengan Alg4.2 memberikan hasil terbaik dengan ukuran zona bening berturut-turut 32.50 dan 32.83 mm. Selanjutnya uji patogenisitas terhadap isolat Alg3.1, Abn1.2 dan Alg4.2. memperlihatkan bahwa ke-3 isolat tidak bersifat patogen terhadap spat. Uji viabilitas menunjukkan bahwa populasi bakteri cenderung menurun setiap periode pengamatan. Terlihat bahwa setelah 48 jam inkubasi, jumlah sel bakteri pada air laut berkurang hingga lebih dari setengahnya. Hal ini terjadi karena air laut sangat miskin nutrisi esensial. Pemberian sumber karbon berupa agar-agar tanpa disertai dengan faktor tumbuh seperti asam amino, lemak, dan vitamin tidak dapat menunjang pertumbuhan bakteri dengan baik.
Kemampuan isolat untuk bertahan dalam media pada pH asam sangat rendah, dimana ketiga isolat mengalami penurunan jumlah sel yang besar pada media pH 2.5 selama 8 dan 24 jam inkubasi. Media pH 4.5 sedikit memberikan pengaruh terhadap ketahanan isolat bakteri agarolitik yang ditandai dengan kecilnya selisih jumlah populasi bakteri kontrol dengan perlakuan. Ketiga isolat menunjukkan pertumbuhan yang lebih baik pada media pH basa (pH 7.5) dibandingkan kontrol. Hal ini dapat terjadi karena isolat sudah beradaptasi dengan air laut yang bersifat alkalis dengan pH berkisar 7-8. Hasil uji hidrofobisitas memperlihatkan bahwa persentase hidrofobisitas paling tinggi dicapai oleh isolat Abn1.2 yaitu sebesar 23.91, diikuti oleh Alg4.2 sebesar 22.98 persen dan Alg3.1 11.84 persen. Isolat Alg4.2 dan Abn1.2 dengan nilai lebih dari 20% tergolong hidrofobik moderat. Persentase koagregasi tertinggi dicapai oleh pasangan Abn1.2 dengan Alg3.1 sebesar 8.79 persen dan yang terendah adalah pasangan Abn1.2 dengan Alg4.2 sebesar 6.85 persen. Pertumbuhan sel planktonik ketiga isolat berlangsung cepat pada 24 jam inkubasi dan mulai melambat pada 48 jam inkubasi. Sebaliknya laju penempelan meningkat pesat setelah 48 jam inkubasi.
Identifikasi berdasarkan reaksi Gram, morfologi, fisiologi, dan biokimia menggunakan metode ‘profile matching’ dan disertai dengan analisis molekuler 16S rRNA menunjukkan bahwa isolat Abn1.2, Alg3.1, Alg4.2 tergolong Vibrio spp.
ix mencapai aktivitas maksimum pada 36 jam setelah inokulasi (0.489 nkat/ml) pada Alg3.1, 28 jam setelah inokulasi (0.439 nkat/ml) pada Alg4.2 dan 24 jam setelah inokulasi (0.411 nkat/ml) pada Abn1.2. Aktivitas maksimum paling tinggi dicapai oleh kultur campuran Alg3.1-Abn1.2, yaitu 0.593 nkat/mL pada jam ke 32. Dengan demikian, kedua isolat ini dipilih sebagai kandidat probiotik penyedia enzim agarase eksogen untuk abalon.
Kemampuan kolonisasi isolat tunggal maupun kombinasinya terus berkurang seiring bertambah lamanya waktu pengamatan. Meskipun demikian persentase isolat campuran tetap lebih tinggi dibanding isolat tunggal sepanjang waktu pengamatan. Pemberian probiotik pada pakan menunjukkan pertumbuhan biomassa, pertumbuhan relatif dan pertambahan panjang cangkang abalon yang lebih tinggi bila dibandingkan dengan kontrol. Peningkatan pertumbuhan biomassa abalon gnotobiotik dan abalon normal yang diberi bakteri agarolitik berturut-turut adalah 32.22 dan 11.09% bila dibandingkan kontrol abalon gnotobiotik dan abalon normal tanpa probiotik. Peningkatan pertambahan panjang cangkang sebagai kontribusi bakteri agarolitik pada abalone gnotobiotik dan abalon normal berturut-turut adalah 24.17 dan 21.88%. Efisiensi dan konversi pakan abalon yang disuplementasi dengan probiotik galur Alg3.1-Abn1.2 lebih baik dibandingkan abalon kontrol yang hanya mengkonsumsi cake standar. Abalon gnotobiotik dan abalon normal yang mendapatkan probiotik menunjukkan efisiensi pakan 35% dan 5% lebih baik dibanding abalon tanpa probiotik. Data hasil analisis kadar agar-agar pada pakan dan feses abalon menunjukkan bahwa persentase agar-agar yang dicerna oleh abalon yang disuplementasi bakteri agarolitik Alg3.1-RfR dan Abn1.2-RfR lebih tinggi bila dibandingkan dengan abalon yang hanya mengkonsumsi cake Gracilariastandar.
Pemberian Alg3.1-RfR- Abn1.2-RfRbaik pada abalon gnotobiotik maupun abalon normal meningkatkan aktivitas enzim agarase dan amilase eksogen pada saluran pencernaan abalon. Aktivitas enzim agarase abalon gnotobiotik plus probiotik lebih tinggi 47% dibandingkan gnotobiotik, sedangkan aktivitas enzim agarase abalon normal plus probiotik lebih tinggi 34% dibandingkan abalon normal. Sementara itu, aktivitas enzim amilase abalon gnotobiotik dan abalon normal yang diberi probiotik lebih tinggi 11 dan 15% bila dibandingkan dengan kontrol gnotobiotik dan abalon normal tanpa probiotik.
xiii
MEMPERBAIKI PERTUMBUHAN JUVENIL
ABALON (
Haliotis asinina
Linn. 1758)
FATURRAHMAN
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
xv Juvenil Abalon (Haliotis asininaLinn. 1758)
Nama Mahasiswa : Faturrahman
NIM : G361080021
Disetujui :
Komisi Pembimbing
Prof. Dr. Dra. Anja Meryandini, M.S Ketua
Prof. Dr. Ir. M. Zairin Junior, M.Sc Dr. Ir. Iman Rusmana, M.Si
Anggota Anggota
Diketahui
Ketua Program Studi Mikrobiologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Gayuh Rahayu Dr. Ir. Dahrul Syah, M.Sc. Agr
xvii Alhamdulilhah, puji syukur penulis panjatkan kehadirat Allah Yang Maha Pencipta lagi Maha Pengasih, atas karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan dari bulan September 2010 sampai dengan Desember 2011 ini ialah bakteri agarolitik.
Indonesia memiliki beragam biota laut yang memiliki nilai ekonomi yang sangat tinggi, salah satunya adalah abalon atau siput mata tujuh (Haliotis asinina) yang terdapat di pulau Lombok, Sumbawa, Sulawesi, Maluku dan Papua. Tingginya permintaan dunia akan abalon, menarik minat banyak pengusaha untuk mengembangkan usaha budidaya abalon. Loka Budidaya Laut Lombok telah berhasil melakukan rekayasa teknologi pembenihan di hatchery sehingga dapat memenuhi kebutuhan benih abalon. Meskipun demikian, kendala utama yang dihadapi pembudidaya abalon adalah laju pertumbuhan abalon yang lambat. Dalam kontek inilah penulis mencoba memberikan alternatif solusi dengan mengangkat tema penelitian ”Potensi Bakteri Agarolitik sebagai Penyedia Enzim Agarase Eksogen untuk Memperbaiki Pertumbuhan Juvenil Abalon (Haliotis asinina Linn. 1758)”.
Penulis menyampaikan terima kasih yang setulus-tulusnya kepada Ibu Prof. Dr. Anja Meryandini, M.Si, Bapak Prof. Dr. M. Zairin Junior, M.Sc dan Bapak Dr. Iman Rusmana, M.Si. yang telah membimbing, memberi saran dan kritik yang konstruktif sehingga penelitian dan pembuatan karya ilmiah ini menjadi lebih baik. Terima kasih yang tak terhingga saya sampaikan kepada Direktur PT. Alaska Dwipa Perdana, Bapak Yusuf Triyanto, yang telah memberikan keleluasaan kepada penulis untuk mengelola Laboratorium Mikrobiologi Terapan PT. Alaska DP. Disamping itu, penghargaan penulis sampaikan kepada Bapak Ir. H. Saripin, MM beserta staf Loka Budidaya Laut Lombok atas izin dan bantuannya selama penelitian ini berlangsung. Kepada mbak Heny, pak Jaka, bu Dewi, mbak Rika dan mas Heri BBL penulis sampaikan terima kasih yang tak terhingga atas segenap bantuannya. Tak lupa ungkapan terima kasih kepada ayah, ibu, istri, anak-anakku serta seluruh keluarga atas segala doa, cinta dan kasih sayangnya. Permohonan maaf yang setulus-tulusnya kepada istri dan anak-anakku jika selama ini telah melalaikan kewajiban dan tidak memenuhi hak-hak kalian.
Semoga penelitian ini dapat memberikan kontribusi yang nyata baik dalam memperkaya khasanah ilmu pengetahuan maupun dalam pengembangan industri budidaya perikanan laut khususnya abalon di Indonesia.
Bogor, Juni 2012
xix Penulis dilahirkan di Sumbawa pada tanggal 3 Juli 1975 sebagai anak kedua dari pasangan Mustafa dan Mustarah. Pendidikan sarjana ditempuh di Jurusan Produksi Ternak, Fakultas Peternakan Universitas Mataram, lulus pada tahun 1999. Pada tahun yang sama, penulis diterima di Program Studi Bioteknologi Program Pascasarjana IPB dan menamatkannya pada tahun 2002. Kesempatan untuk melanjutkan ke program doktor pada Program Studi Mikrobiologi pada perguruan tinggi yang sama diperoleh tahun 2008. Beasiswa pendidikan pascasarjana (BPPS) diperoleh dari Direktorat Pendidikan Tinggi Kementerian Pendidikan Nasional Republik Indonesia.
Penulis bekerja sebagai staf pengajar pada Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Mataram sejak tahun 2003. Bidang studi yang menjadi tanggungjawab penulis adalah bioteknologi dan teknologi mikrobial.
Selama mengikuti program S3, penulis menjadi anggota Perhimpunan Biologi Indonesia dan anggota Masyarakat Biodiversitas Indonesia. Karya ilmiah berjudul ’The Application of Probiotic Effective Microorganism-4 on Abalone (Haliotis asinina Linn 1758) Larval Rearing’ disajikan pada ’The 3nd International Seminar on Science Education’ di Bandung pada bulan Oktober 2009; karya ilmiah yang berjudul ’The Potential of Marine Agarolytic Bacteria for Production Bioethanol from Agarophytes’ telah disajikan pada ‘1st International Conference on Biodiversity’ di Solo pada bulan Juli 2011. Sebuah artikel telah diterbitkan dengan judul “Isolation and Identification of An Agar-Liquefying Marine Bacterium and Some Properties of Its Extracellular Agarases” pada jurnal Biodiversitas Volume12 No. 4 Oktober 2011 halaman 192-197.
xiii
DAFTAR TABEL ... xxi
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xxv
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA Probiotik Akuakultur ... 5
Probiotik Sebagai Pemacu Pertumbuhan ... 6
Penelitian Probiotik untuk Moluska ... 8
Nutrisi untuk Pertumbuhan Abalon ... 10
Sistem Pencernaan pada Abalon ... 12
Bakteri Pendegradasi Agar-agar dan Enzim Agarase ... 16
Interaksi Biologi Bakteri di Alam ... 17
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 21
Tahapan Penelitian ... 21
Isolasi dan Seleksi Bakteri Agarolitik ... 21
Identifikasi Isolat Kandidat Probiotik ... 28
Degradasi Substrat dan Aktivitas Agarase In Vitro ... 30
Kemampuan Kolonisasi ... 32
Bioassai Isolat Kandidat Probiotik pada Abalon ... 33
Aktivitas Agarase dan Amilase In Situ ... 36
Interpretasi dan Analisis Data ... 37
HASIL DAN PEMBAHASAN Isolasi dan Seleksi Bakteri Agarolitik ... 39
xiv
Aplikasi Isolat Agarobiotik pada Pakan Abalon ... 74
Aktivitas Agarase In Situ dan Total Bakteri ... 80 Pembahasan Umum ... 85
SIMPULAN DAN SARAN ... 87
DAFTAR PUSTAKA ... 89
xv Halaman
1. Penelitian probiotik pada moluska laut ... 9
2. Studi enzim-enzim pencernaan pada abalon... 15
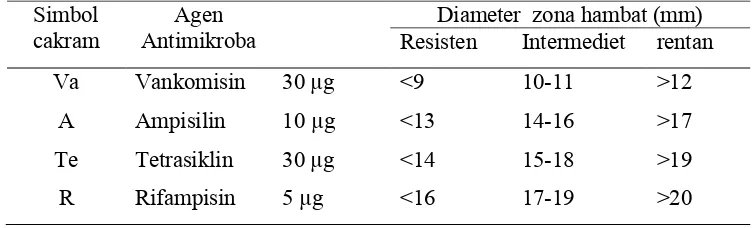
3. Interpretasi zona hambat dari kultur uji ... 36
4. Data lokasi, bahan sumber isolat, jumlah sampel, jumlah isolat dan kode isolat bakteri agarolitik ... 39
5. Aktivitas agarolitik berdasarkan ukuran diameter zona bening yang terbentuk pada media agar ... 41
6. Data resistensi isolat terhadap 4 jenis antibiotik berdasarkan diameter zona hambat ... 43
7. Waktu generasi dan laju pertumbuhan spesifik isolat bakteri agarolitik yang ditumbuhkan pada medium MB ... 46
8. Kekuatan likuifikasi agar isolat bakteri agarolitik pada media agar-agar SWM selama 7 dan diinkubasi hari pada 29 oC ... 47
9. Rataan mortalitas spat abalon (ukuran 0.5-0.7 cm) yang diberi isolat bakteri agarolitik pada konsentrasi berbeda ... 49
10. Patogenisitas isolat terhadap Gracilariasp selama 6 hari pengamatan ... 49
11. Viabilitas sel pada air laut steril yang diberi substrat agar ... 50
12. Selisih log (cfu/mL) antara jumlah isolat dalam media pH 2.5,
pH 4.5, pH 6.5 dan pH 7.5 dengan kontrol (pH 7.0) ... 52
13. Persentase koagregasi isolat bakteri agarolitik yang dipasangkan... 55
14. Karakteristik fenotipik isolat... 59
15. Takson dalam pusat data GenBank dengan sekuen gen 16S rRNA
yang paling mirip dengan sekuen parsial isolat ... 60
16. Pertumbuhan dan aktivitas enzim kualitatif isolat Alg3.1 pada medium yang berbeda selama 24 jam inkubasi ... 62
17. Aktivitas agarase kualitatif antara tipe liar dan mutan isolat Alg3.1 dan Abn1.2 ... 71
18. Total bakteri Alg3.1-RfR, Abn1.2-RfR, kombinasi dan kontrol (log10 cfu/ml) pada saluran pencernaan abalon selama 24-72 jam
xvi
20. Rata-rata efisiensi pakan dan konversi pakan abalon selama 60 hari pemeliharaan ... 76
xvii 1. Kurva pertumbuhan abalon Lombok yang dipelihara secara
Indoor dan diberi pakan Gracilariasp. ... 11 2. Abalon Haliotis asinina dan representasi saluran pencernaan ... 13 3. Posisi pemotongan agarosa oleh enzim agarase ... 16
4. Bagan alur kerja penelitian ... 21
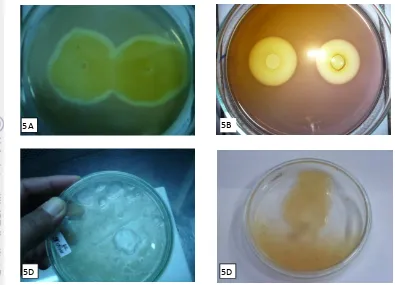
5. Koloni bakteri agarolitik menyebar tipis pada permukaan medium B dengan 1.8% agar, zona bening yang terbentuk dari supernatan yang diproduksi pada kultur cair MB umur 24 jam, pembentukan kawah atau pendangkalan agar setelah 3-5 hari inkubasi ... 41
6. Kurva pertumbuhan isolat bakteri agarolitik berdasarkan jumlah koloni (log10 cfu/mL) selama periode inkubasi 24 jam pada 29 oC dan 120 rpm ... 45
7. Aktivitas agarolitik kultur campuran berdasarkan diameter zona bening ekstrak enzim kasar 36 jam yang diinkubasi pada 29 oC selama 4 jam... 49
8. Selisih log (cfu/mL) antara jumlah isolat dalam media pH 2.5, pH 4.5, pH 6.5 dan pH 7.5 dengan kontrol (pH 7.0) pada periode 8 dan 24 jam inkubasi... 54
9. Persentase hidrofobisitas isolat bakteri agarolitik ... 55
10. Jumlah sel bakteri agarolitik yang menempel pada lempeng baja stainless (log cfu/cm2) dan yang melayang (planktonik) pada fase cair (log cfu/ml) selama 24 dan 48 jam pada 28 oC ... 57
11. Pohon filogenetik berdasarkan sekuen 16S rDNA yang menunjukkan hubungan genetik antara Abn1.2, Alg3.1 dan Alg4.2 dengan bakteri agarolitik yang lain ... 61
xviii
14. Pertumbuhan sel dan aktivitas enzim agarase isolat bakteri
agarolitik yang ditumbuhkan pada media BSM plus selama 52 jam pada 29 oC ... 68
15. Kromatografi lapis tipis produk hasil hidrolisis agarosa oleh ekstrak kasar enzim agarase... 70
16. Perbandingan kurva pertumbuhan isolat bakteri Alg3.1 dan Abn1.2 tipe liar dengan mutan rifampisin ... 71
17. Kemampuan kolonisasi isolat bakteri Alg3.1RfR, Abn1.2RfR, campuran dan kontrol dalam saluran pencernaan abalon selama 72 jam ... 73
18. Aktivitas agarase dan amilase pada saluran pencernaan abalon yang mengkonsumsi cake Gracilariastandar dan yang
disuplementasi probiotik ... 80
xix 1. Komposisi media dan reagen yang digunakan ... 95
2. Prosedur uji degradasi substrat oleh bakteri ... 97
3. Pengukuran aktivitas enzim agarase dan kadar protein ... 100
4. Prosedur analisis proksimat (kadar air, kadar abu, kadar serat kasar, kadar lemak kasar, dan kadar prtein kasar) ... 101
5. Proses ekstraksi agar menurut SNI (SNI 01-4497-1998) ... 104
6. Isolat bakteri agarolitik yang diisolasi dari air laut, alga dan abalon. 105
7. Hubungan Optical density(OD620) dan Log10 cfu/mL isolat bakteri
agarolitik yang ditumbuhkan pada media MB... 105
8. Aktivitas kualitatif (diameter zona bening, mm) dari supernatan isolat bakteri agarolitik yang ditumbuhkan pada medium SWM selama 24 jam ... 106
9. Data hasil uji hidrofobisitas pada OD600... 106
10. Data hasil pengukuran koagregasi isolat selama 1 dan 4 jam pengamatan pada panjang gelombang 620nm ... 107
11. Hasil uji penempelan isolat bakteri agarolitik pada lempeng baja stainless selama 24 dan 48 jam pada 28 oC dan diagitasi 120 rpm... 107
12. Derajat hidrolisis substrat oleh bakteri agarolitik kandidat
probiotik ... 108
13. Derajat hidrolisis karbohidrat Gracilariaoleh bakteri agarolitik kandidat probiotik ... 108
14. Hubungan pertumbuhan sel (OD620) dengan aktivitas enzim agarase
selama 52 jam pengamatan ... 108
15. Nilai optical density(OD620nm) tipe liar dan mutan yang
ditumbuhkan pd media MB selama 24 jam ... 109
16. Rataan berat awal dan akhir, panjang cangkang awal dan akhir abalon ... 110
17. Konsumsi pakan total, konsumsi per ekor , konversi dan
efisiensi pakan ... 110
18. Jumlah total bakteri dan bakteri agarolitik pada saluran pencernaan abalon selama 60 hari pemeliharaan ... 111
xx
Latar Belakang
Abalon atau siput mata tujuh (Haliotis asinina Linn. 1758) merupakan salah satu komoditas perikanan tangkap yang telah memberikan peranan penting
bagi perekonomian masyarakat pesisir di Nusa Tenggara Barat (NTB), tidak
hanya dijual di pasar nasional, tetapi juga diekspor ke beberapa negara Asia
seperti Jepang, Hongkong dan Taiwan. Menurut data ACIAR (2007), ekspor
abalon NTB ke Hongkong pada tahun 2006 ialah sebesar 5.2 ton dan 3.6 ton tahun
2007. Permintaan dunia terutama dari negara-negara Asia terus meningkat dari
20000 ton pada tahun 1970-an menjadi lebih dari 40000 ton pada tahun 2007,
sementara itu produksi abalon dunia dari hasil tangkapan ternyata terus menurun
dari 20000 ton pada tahun 1975 menjadi kurang dari 9000 ton tahun 2008
(Gordon dan Cook 2010).
Mahalnya harga jual abalon mendorong masyarakat pesisir melakukan
eksploitasi secara intensif dan tidak selektif sehingga mengakibatkan stok alam
yang terus menurun, berkurangnya hasil tangkapan dan terancamnya kelestarian
abalon (Setyono 2009). Pada saat yang sama, daya tarik atau minat untuk
mengembangkan budidaya abalon di dunia termasuk Indonesia terus meningkat
seiring dengan tingginya permintaan dunia akan abalon hidup. Indonesia kaya
akan sumberdaya pantai, sehingga Indonesia memiliki potensi yang sangat besar
untuk mengembangkan budidaya abalon.
Salah satu kendala yang dihadapi pembudidaya abalon adalah laju
pertumbuhannya yang lambat. Haliotis asinina dapat tumbuh mencapai ukuran layak jual di pasaran nasional (cocktail abalone, 50-60 mm) dalam waktu 12-18 bulan (Setyono 2008). Ukuran pasar (market size) internasional abalon adalah 80 mm (Doeschate dan Coyne 2008), sehingga dibutuhkan waktu pemeliharaan
yang lebih panjang lagi untuk dapat menembus pasar ekspor.
Abalon yang mengkonsumsi rumput laut sebagai pakan tunggal
menunjukkan laju pertumbuhan yang rendah karena defisiensi sejumlah nutrisi
esensial (Doeschate dan Coyne 2008) seperti protein. Menurut Setyono (2008),
Laurencia, Hypnea dan Amphiroa, sedangkan pada abalon budidaya diberikan pakan tunggal berupa Gracilaria sp.. Gracilaria memiliki kandungan protein yang rendah yaitu sekitar 3-7%, akan tetapi kaya akan agar-agar, hingga 47.34%
(Soegiarto dan Sulistijo 1985).
Herbivora laut termasuk abalon umumnya memiliki enzim-enzim
pendegradasi dinding sel komponen pakan di dalam saluran pencernaannya
(Gomez-Pinchetti dan Garcia-Reina 1993) dan memiliki kemampuan untuk
menggunakan agar-agar, alginat, karagenan sebagai sumber energi (Erasmus et al. 1997). Disamping itu, dalam saluran pencernaan abalon juga ditemukan
enzim-enzim polisakarase eksogen yang disumbangkan oleh bakteri enterik. Kelompok
bakteri enterik memainkan peranan penting bagi penyediaan nutrisi abalon
dengan menghidrolisis komplek polisakarida menjadi molekul sederhana yang
dapat diserap oleh abalon. Sebanyak 70-90% aktivitas bakteri polisakarolitik
menghasilkan enzim-enzim polisakarase ekstraseluler yang disekresikan ke dalam
saluran pencernaan abalon (Erasmus et al. 1997). Katabolisme monosakarida oleh bakteri enterik menghasilkan sejumlah besar asam asetat dan format yang
dapat digunakan sebagai sumber energi atau prekursor sintesis asam amino oleh
abalon (Thompson et al. 2004; Prado et al. 2010). Michel et al. (2006) dalam ulasannya menyebutkan bahwa beberapa kelompok bakteri laut menghasilkan
enzim agarase ekstraseluler yang dapat mendegradasi agar-agar menjadi
agarooligosakarida dan galaktosa. Dengan demikian, pendekatan yang dapat
dilakukan untuk mempercepat laju pertumbuhan abalon H. asininaadalah dengan meningkatkan kecernaan agar-agar melalui introduksi bakteri probiotik yang
dapat memproduksi enzim agarase.
Kajian mengenai aplikasi bakteri probiotik penyedia enzim polisakarase
pada budidaya abalon sudah pernah dilaporkan. Doeschate dan Coyne (2008)
menggunakan bakteri alginolitik Pseudoalteromonas sp. galur C4 pada pemeliharaan H. midaeyang diberi pakan alami ternyata secara signifikan dapat meningkatkan laju pertumbuhan dan aktivitas enzim alginat lyase secara in situ pada saluran cerna abalon dibandingkan kontrol. Sementara aplikasi bakteri dan
(Macey dan Coyne 2005). Penelitian lain yang dilakukan di Jepang menunjukkan
bahwa Vibrio halioticoli, bakteri penghuni dominan perut H. discus hannai, diketahui dapat memecah alginat, komplek polisakarida utama dari alga coklat
yang dimakan oleh abalon tersebut (Sawabe et al. 1998, 2003).
Penelitian mengenai bakteri agarolitik dan potensinya sebagai probiotik
untuk pertumbuhan abalon H. asinina belum ada, dan suplementasi bakteri agarolitik dipandang sebagai strategi yang tepat dalam memperbaiki pertumbuhan
H. asinina, yaitu melalui penyediaan enzim agarase eksogen yang dapat membantu sistem pencernaan abalon dalam mendegradasi agar-agar menjadi
senyawa sederhana siap serap.
Tujuan penelitian
Penelitian ini bertujuan untuk (1) melakukan isolasi, seleksi dan
karakterisasi bakteri agarolitik, (2) menganalisis kemampuan isolat kandidat
probiotik dalam mendegradasi substrat dan menguji aktivitas enzim agarase dalam
memecah agar-agar menjadi galaktosa, (3) mengidentifikasi isolat probiotik
secara fisiologi, biokimia dan molekuler, (4) menguji kemampuan kolonisasi
isolat baik dalam bentuk kultur tunggal maupun kultur campuran dalam saluran
pencernaan abalon, (5) mempelajari potensi isolat agarolitik terpilih dalam
meningkatkan laju pertumbuhan abalon, dan (6) mengevaluasi kontribusi isolat
agarolitik untuk menyediakan enzim agarase eksogen dalam saluran pencernaan
abalon.
Manfaat penelitian
Studi mengenai bakteri agarolitik dan enzim agarase serta aplikasinya
pada H. asinina merupakan sesuatu yang baru, sehingga informasi yang diperoleh dari penelitian ini dapat menjadi sumbangsih penulis dalam
memperkaya khazanah ilmu pengetahuan, khususnya ke-enzim-an dan probiotik
akuakultur di Indonesia. Selain itu, perolehan isolat bakteri agarolitik yang
berpotensi sebagai kandidat probiotik bagi abalon, diharapkan dapat mendorong
Probiotik Akuakultur
Probiotik secara umum didefinisikan sebagai suplemen makanan dalam
bentuk mikroba hidup yang dapat menguntungkan inang dengan menjaga
keseimbangan mikrobiota saluran pencernaan. Definisi ini ditujukan untuk hewan
terestrial dan manusia. Menurut Verschuere et al. (2000), definisi probiotik tersebut membutuhkan beberapa pertimbangan apabila ditujukan untuk akuakultur
karena adanya perbedaan karakter lingkungan perairan dengan terestrial. Berbeda
dengan manusia dan hewan terestrial, keberadaan mikroorganisme pada saluran
pencernaan organisme akuatik tidak berada sebagai suatu entitas tersendiri, akan
tetapi secara konstan berhubungan dengan mikroorganisme pada lingkungannya.
Oleh karena itu kehadiran bakteri pada lingkungan akuatik berpengaruh terhadap
komposisi mikrobiota pada saluran pencernaan dan begitu pula sebaliknya.
Pada hewan teresterial awal kolonisasi bakteri pada anak bersumber dari
kontak dengan induknya, sementara spesies akuatik telur diletakkan di air
sehingga kolonisasi primer pada telur dan larva berasal dari mikroba lingkungan.
Lebih dari itu, larva atau hewan akuatik yang baru lahir sistem percernaannya
belum berkembang dan belum memiliki komunitas mikroba baik pada saluran
pencernaan, insang maupun pada kulitnya. Oleh karena itu, tahap awal
perkembangan larva akuatik bergantung mikrobiota primer yang bersumber dari
perairan lingkungan budidaya (Verschuere et al. 2000).
Karakteristik mikroba probiotik adalah kemampuannya untuk
mengkolonisasi saluran pencernaan inang, akan tetapi mikrobiota saluran
intestinal pada hewan akuatik berubah dengan cepat karena secara konstan
berhubungan dengan aliran mikroba yang berasal dari air dan makanan (Abidi
2003). Berdasarkan pernyataan di atas bahwa interaksi antara mikrobiota,
termasuk probiotik, dan inang tidak hanya dibatasi pada saluran pencernaan.
Bakteri probiotik seharusnya dapat aktif pada insang atau kulit inangnya, tetapi
juga aktif pada lingkungan perairan.
Dengan demikian, probiotik untuk lingkungan akuatik didefinisikan
hubungan komunitas mikroba yang berasosiasi dengan inang atau lingkungannya,
meningkatkan penggunaan pakan atau nilai nutrisi, memacu respon inang
terhadap penyakit, atau dengan meningkatkan kualitas lingkungan perairan
(Verschuere et al. 2000).
Berdasarkan definisi di atas, probiotik mikroba memiliki peran yang
sangat penting pada akuakultur, khususnya menyangkut pengaruhnya terhadap
produktivitas, sumber nutrisi hewan akuatik, kualitas air, pengendalian penyakit
dan perbaikan lingkungan (Wanget al. 2008; Verschuere et al. 2000).
Secara umum prosedur seleksi dan pengembangan probiotik untuk
akuakultur terdiri atas 6 tahapan (Gomez-Gil et al. 2000), yakni (1) pengumpulan informasi dari literatur serta di lapangan, seperti informasi operasional tambak
atau tanki pembenihan (hatchery), manajemen produksi dan pengendalian penyakit, (2) pengumpulan atau isolasi kandidat probiotik potensial dari poolatau sumber terbaiknya (indigenous/putative probiotics), yaitu dari inang, pakan alami maupun dari lingkungan budidaya, (3) seleksi dan evaluasi kemampuan calon
probiotik potensial, (4) penilaian patogenisitas probiotik potensial, (5) pengujian
skala laboratorium termasuk melihat pengaruh kandidat probiotik secara in vivo terhadap variabel imunologi, sintasan dan keragaan inang, dan (6) analisis
ekonomi (cost/benefit analysis).
Probiotik dapat diberikan pada inang atau ditambahkan ke lingkungan
akuatik lewat beberapa cara, yaitu pemberian melalui pakan hidup (Gomez-Gilet al. 1998), perendaman (Gram et al. 1999), pemberian pada air budidaya (Moriarty 1998), dan penambahan pada pakan buatan (Rengpipat et al. 2000).
Probiotik sebagai Pemacu Pertumbuhan
Sebelum melakukan seleksi mikroba probiotik, pemahaman mengenai
mekanisme kerja probiotik adalah sangat penting karena merupakan dasar untuk
menentukan kriteria seleksi yang diinginkan.
Salah satu mekanisme aksi (mode of action) dari suatu probiotik akuakultur untuk menghasilkan efek yang menguntungkan bagi inang adalah
menyediakan nutrisi esensial dan membantu sistem pencernaan inang melalui
2006, 2008; Kesarcodi-Watsonet al. 2008; Qiet al. 2009). Kontribusi enzimatik dari bakteri probiotik bagi inang adalah berupa peningkatan aktivitas enzim-enzim
pencernaan seperti amilase, protease dan lipase (Ziaei-Nejad et al. 2006; Wang 2007; Suzer et al. 2008) dan produksi enzim pemecah komplek polisakarida penyusun dinding sel pakan, seperti selulase, agarase, karaginase, alginat lyase
(Erasmus et al. 1997; Foster et al. 1999).
Zhou et al. (2009) mempelajari pengaruh pemberian Bacillus coagulans SC8168 terhadap aktivitas enzim pencernaan pada berbagai fase perkembangan
larva udang Penaeus vannamae. Hasilnya menunjukkan bahwa pemberian probiotik tidak memberikan pengaruh terhadap aktivitas enzim protease, amilase
dan lipase pada fase awal larva (Z3 dan M3), akan tetapi pengaruhnya menjadi
sangat berbeda nyata dengan kontrol setelah fase postlarva (PL1-2). Pakan utama
udang pada fase awal larva adalah bentik diatom dan plankton yang kaya akan
enzim-enzim protease, amilase dan lipase, sehingga pemberian probiotik pada fase
ini tidak menunjukkan pengaruh terhadap peningkatan aktivitas enzimatis pada
saluran pencernaan larva.
Wang et al. (2008) menggunakan probiotik Enterococcus faecum dengan konsentrasi 1 x 107cfu/ml pada tilapia selama 40 hari pemeliharaan. Tilapia yang
diberi probiotik menunjukkan berat badan akhir dan pertambahan berat harian
secara nyata lebih baik bila dibandingkan kontrol.
Ziaei-Nejad et al. (2006) menggunakan variabel rasio konversi pakan (Feed conversion ratio, FCR) dan laju pertumbuhan spesifik (specific growth rate, SGR) untuk menilai pengaruh pemberian probiotik Bacillus spp. terhadap performa pertumbuhan udang putih India. Pemberian probiotik baik pada tahap
pembenihan maupun pada pembesaran menunjukkan rasio konversi pakan, laju
pertumbuhan spesifik dan berat akhir yang lebih tinggi dibandingkan kontrol yang
tidak mendapatkan probiotik.
Rengpipat et al. (2000) melaporkan bahwa pemberian beragam bentuk probiotikBacillusS11 – dalam bentuk sel segar, sel segar dalam larutan fisiologis, dan sel liofilisasi - tidak memberikan pengaruh yang berbeda nyata terhadap
pertumbuhan udang galah, akan tetapi pemberian probiotik dapat meningkatkan
Penelitian Probiotik untuk Moluska
Laporan hasil penelitian mengenai probiotik untuk moluska tidak
sebanyak pada ikan dan udang. Meskipun demikian, laporan tersebut
mengisyaratkan bahwa pemberian probiotik menunjukkan pengaruh yang
menguntungkan bagi moluska. Pengaruh tersebut dapat berupa peningkatan
survival rate dan kebugaran, reduksi mortalitas larva serta peningkatan pertumbuhan (Tabel 1). Prado et al. (2010) menyebutkan bahwa bakteri Alteromonas galur CA2 yang diberikan bersama algae, mampu meningkatkan keragaan sebesar 16-21% dan sintasan sebesar 21-22% pada larva tiram pasifik
(Crassostrea gigas). Sementara itu Gibson et al. (1998) menggunakan galur A. media A199 sebagai probiotik untuk larva tiram Pasifik dalam usaha mengendalikan infeksi Vibrio tubiashii, terbukti mampu menurunkan mortalitas secara signifikan bila dibandingkan kontrol.
Erasmus et al. (1997) melaporkan bahwa bakteri penghuni saluran pencernaan H. midae mampu memecah komplek polisakarida dari Ecklonia maxima dan Gracilaria gracilis, alga utama yang dikomsumsi abalon tersebut. Menurutnya, kelompok bakteri enterik memainkan peranan penting bagi
penyediaan nutrisi abalon dengan menghidrolisis komplek polisakarida menjadi
molekul sederhana yang dapat diserap oleh abalon. Lebih lanjut Erasmus et al. (1997) menyebutkan bahwa bakteri-bakteri tersebut memproduksi enzim yang
dapat mendegradasi agar-agar, karagenan dan alginat. Macey dan Coyne (2005)
telah menyeleksi bakteri dan khamir dari perut H. midaedan setelah diaplikasikan pada budidaya abalon dapat meningkatkan pertumbuhan hingga 34% bila
dibandingkan dengan abalon kontrol.
Galur V. halioticoli diketahui merupakan mikroflora utama yang menghuni perut dari beberapa spesies siputHaliotis(Sawabeet al. 1998; Tanaka et al. 2002), yaitu berkisar antara 40 -64 % dari total komunitas bakteri heterotrof yang dapat dikulturkan (culturable) dengan jumlah sel antara 103 hingga 107 CFU/g perut siput Haliotis (Sawabe et al. 2003; Thompson et al. 2004). Vibrio halioticoli dapat memproduksi asam asetat dan asam format dalam jumlah besar, yang diduga digunakan sebagai sumber energi atau prekursor sintesis protein oleh
hubungan mutual antara V. halioticoli dengan abalon. Selain itu Tanaka et al. (2002) melaporkan bahwa V. halioticoli menghasilkan enzim poliguluronat lyase, suatu enzim yang mengkatalisis degradasi komponen dinding sel rumput laut
coklat yang merupakan makanan utama siputHaliotis. Tabel 1. Penelitian probiotik pada moluska laut
Spesies abalon Probiotik Pengaruh Referensi
Pecten ziczac Flavobacteriumsp.
P14
Aktivitas antibakteri Lodeiros et al. (1989)*
C. gigas Alteromonassp. CA2 Peningkatan sintasan larva Douillet & Langdon
(1993)*
C. gigas Alteromonassp. CA2 Peeningkatan laju pertumbuhan Douillet and Langdon
1994* Argopecten
purpuratus
Alt. haloplanktis Proteksi dari infeksi Riquelme et al.(1996)*
A. purpuratus INH Aktivitas antibakteri (Vibrio
anguillarum- like)
A. purpuratus Vibriosp. C33 Peningkatan sintasan larva
H. midae Microbial gut Aktivitas enzim Erasmus et al. 1997
C. gigas Aeromonas media
A199
Peningkatan sintasan larva Gibson et al. 1998
Aktivitas antibakteri (Vibrio
tubiashii)
A. purpuratus Vibriosp. C33 Antibacterial activity
(Vibrio anguillarum- like)
Avendano & Riquelme (1999)*
C. gigas S21 Enhancement of survival rate Nakamura et al. (1999)*
Aktivitas antibakteri (Vibrio
alginolyticus)
Pecten maximus Roseobacter
gallaeciensis
Peningkatan sintasan larva Ruiz-Ponte et al.
(1999)*
BS107 Aktivitas antibakteri
A. purpuratus Vibriosp. C33 Peningkatan sintasan larva Riquelme et al.2001
Pseudomonassp. 11
Bacillussp. B2
P. maximus Pseudoalteromonassp. Peningkatan sintasan larva Longeon et al. 2004
Ostrea edulis Phaeobacter
gallaeciensis
Peningkatan sintasan larva Prado (2006)*
H. midae Vibrio midae Perbaikan komposisi mikroba
usus
Peningkatan sintasan larva Doeschate & Coyne
2008
H. gigantea Lactobacillus sp. a3 Kemampuan kolonisasi Iehata et al. 2009
H. gigantea Pediococcus sp.Ab1 Aktivitas enzim dan produksi
asam lemak rantai pendek
Iehata et al.2010
*dikutip dari Prado et al. 2010
Baru-baru ini dilaporkan bahwa Pseudoalteromonas sp. galur C4 yang diisolasi dari saluran pencernaan H. midae telah digunakan sebagai probiotik untuk meningkatkan laju pertumbuhan abalon tersebut. Hasilnya menunjukkan
cerna pakan alami dan meningkatkan laju pertumbuhan juvenil H. midae (Doeschate dan Coyne 2008).
Suplementasi bakteri probiotik (dalam hal ini bakteri agarolitik) dipandang
sebagai strategi yang tepat dalam memperbaiki pertumbuhan H. asinina, yaitu dengan membantu sistem pencernaan inang dalam mendegradasi agar-agar
menjadi senyawa sederhana yang dapat diserap oleh abalon.
Nutrisi untuk Pertumbuhan Abalon
Kebutuhan pakan dan nutrisi abalon berbeda mengikuti tahapan
perkembangan atau siklus hidupnya. Sebelum fase penempelan (settling) pada substrat, larva bersifat lecithotrophic, yaitu mengabsorbsi yolk sack dan menyerap bahan organik terlarut dari lingkungannya (Takami 2002). Setelah yolk sackhabis (hari ke-4 sampai ke-5), larva akan mencari tempat yang cocok untuk menempel pada substrat, bermetamorfose menjadi juvenil dan memulai siklus
hidupnya sebagai biota bentik dengan memakan bentik diatom, bakteri dan
mikroalga yang menempel pada permukaan substrat (Setyono 2009). Juvenil
abalon H. asinina akan tumbuh dan mencapai ukuran panjang cangkang sekitar 10 mm dalam waktu 3-5 bulan dan sudah dapat memakan makroalga (Setyono,
2008).
Capinpin dan Corre (1996) melaporkan bahwa laju pertumbuhan juvenil
abalon H. asinina di Filipina yang diberi pakan buatan dan alga merah G. heteroclada lebih cepat bila dibandingkan dengan Kappaphycus alvarezii selama 120 hari pengamatan, akan tetapi pada periode pengamatan yang lebih lama (360 hari) menunjukkan bahwa G. heterocladadapat memicu pertumbuhan abalon lebih baik, sehingga dipertimbangkan sebagai pakan terbaik untuk
budidaya abalon di Filipina.
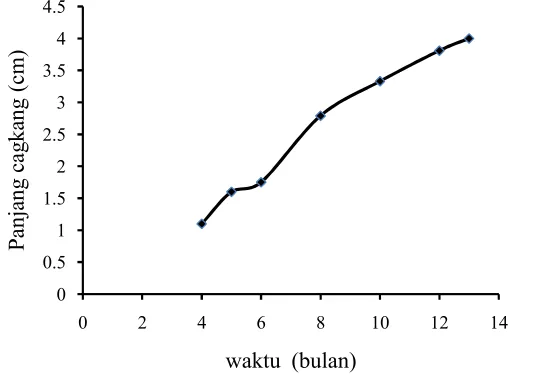
Pertumbuhan abalon Lombok yang dipelihara secara indoor pada Balai Budidaya Laut Lombok yang diberi pakan tunggal Gracilaria sp. lambat dan dibutuhkan waktu pemeliharaan 13 bulan untuk mencapai ukuran 40 cm (Gambar
1). Kandungan nutrisi Gracilaria sp. yang rendah diduga sebagai penyebab lambatnya pertumbuhan abalon. Menurut Soegiarto dan Sulistijo (1985)
karbohidrat 42.59% (termasuk di dalamnya agar-agar), lemak 9.54%, serat kasar
10.51%, dan abu 14.18%.
Gambar 1. Kurva pertumbuhan abalon Lombok yang dipelihara secara indoordan diberi pakan Gracilariasp.selama 13 bulan pengamatan. Pertumbuhan diukur berdasarkan panjang cangkang (Sofyan et al. 2005)
Kebutuhan energi metabolisme abalon utamanya diperoleh dari
karbohidrat (Picos-Garcia et al. 2000) dan ini dapat dipenuhi abalon dengan mengkonsumsi pakan alamiah yang mengandung karbohidrat sebanyak 30-60%
(Olin dan McBridge 2000). Komponen utama karbohidrat yang ditemukan pada
Gracilaria adalah agar-agar yang berkisar antara 17,0-47,34 % (Soegiarto dan Sulistijo 1985). Kandungan agar-agar pada Gracilaria blodgetti dari pulau Lombok adalah 30% (Angka dan Suhartono 2000). Karbohidrat pada pakan
buatan untuk abalon adalah dekstrin sebesar 49.3% (Britz 1996) atau campuran
21% dekstrin dan 23% pati (Knaeur et al. 1996). Fallu (1991) menyatakan bahwa jika karbohidrat tidak tersedia dalam jumlah cukup dalam pakan, maka abalon
akan mengalihkan beberapa building block seperti asam amino dan asam lemak tidak jenuh untuk dibakar menjadi energi. Mencegah penggunaan protein sebagai
sumber energi melalui penambahan karbohidrat dalam jumlah yang tepat disebut
protein sparing.
Tingkat konsumsi nitrogen tercerna secara nyata berpengaruh pada laju
pertumbuhan abalon, dan ini berarti nitrogen merupakan nutrien pembatas bagi
membandingkan berbagai sumber protein hewani dan tanaman terhadap
pertumbuhan juvenil H. asinina. Sumber protein yang digunakan meliputi tepung ikan, tepung udang, tepung kedelai tanpa lemak dan spirulina. Mereka
menyimpulkan bahwa laju pertumbuhan terbaik dicapai pada pemberian pakan
dengan kombinasi protein hewani dan tanaman.
Kebutuhan nutrisi untuk pertumbuhan abalon secara umum sama dengan
hewan laut lainnya, yaitu karbohidrat, protein dan lemak. Akan tetapi, menurut
Olin dan McBridge (2000), abalon membutuhkan nutrisi spesifik untuk mencapai
pertumbuhan yang optimal. Komposisi nutrisi pakan abalon terdiri atas 30%
protein dalam bentuk tepung kedelai bebas lemak, kasein ataupun tepung ikan.
Bautista-Teruel el al. (2003) menyatakan bahwa kebutuhan protein pada pakan harus cocok, mudah dicerna dan memiliki komposisi asam amino yang seimbang.
Komposisi asam amino esensial dalam pakan dirancang sesuai dengan profil asam
amino esensial pada tubuh abalon (% total AAE) yaitu arginin 15.9; histidin 3.7;
ileusin 8.2; leusin 14.0; lisin 12.5; metionin+sistin 9.1; fenilalanin+tirosin 15.5;
threonin 10.1; triptofan 1.7; dan valin 9.3 (Knaeur et al. 1996).
Lemak memegang peranan penting dalam nutrisi abalon sebagai penyedia
asam lemak esensial (EFA), khususnya asam lemak tak jenuh (high unsaturated fatty acid, HUPA) seperti asam lemak eikosapentanoat (20: 5n-3) dan dokosaheksanoat (22:6n-3) (Uki et al. 1986). Kebutuhan lemak pada pakan berkisar antara 3-5% yang biasanya bersumber dari minyak ikan atau minyak
sayur (Olin dan McBridge 2000). Kandungan lemak dari alga sebagai pakan
alami abalon umumnya rendah, tetapi kaya cadangan karbohidrat. Meskipun
demikian, abalon memiliki kemampuan untuk mensintesis asam lemak dari
sumber karbohidrat (Mai et al. 1995).
Sistem Pencernaan pada Abalon
Organ pencernaan pada abalon terdiri atas mulut, radula, oesophagus,
tembolok, lambung, usus, dan anus serta kelenjar pencernaan berupa
hepatopankreas (Gambar 2) (Fallu 1991). Mulut dan radula berfungsi untuk
memotong, mengerat dan menelan rumput laut. Tembolok atau disebut juga
sebagai tempat pertamakali berlangsungnya penc
tembolok dihasilkan enzim
yaitu protease dan karbohidrase
merupakan tempat utama
Gambar 2. Abalon Haliotis 1991)
secara mikrobial, oleh bakteri saluran pencernaan (Foster
Enzim merupakan m
hidup dan terlibat dalam
metabolisme makanan, mekanisme
ke pewarisan sifat keturunan
disintesis di dalam sel dan
melalui proses eksositosis.
pencernaan di luar sel (di
digestion, sedangkan enzim
gai tempat pertamakali berlangsungnya pencernaan secara kimiawi.
hasilkan enzim-enzim yang sama seperti yang terdapat pada lambung,
karbohidrase (Macey dan Coyne 2005). Lambung
utama terjadinya pencernaan secara kimiawi. Hepatopankreas
berdifusi di antara sel-sel hati) merupakan organ penting
bahan (enzim) yang berperan dalam proses pencernaan (Affandi
enzim yang diproduksi oleh hepatopankreas terdiri
selulase, alginat lyase, laminarinase, agarase dan karagenase (E
Haliotis asinina dan representasi saluran pencernaan
umum herbivora laut membutuhkan mekanisme untuk
polisakarida struktural dan simpanan pada alga. Ada 3 mekanisme
dilakukan, yaitu 1) secara mekanik menggunakan bagian radula
ra biokimia, menggunakan sistem enzimatik dari saluran pencernaa
dasi secara ekstraseluler bahan-bahan yang telah ditelan,
mikrobial, oleh bakteri saluran pencernaan (Foster et al. 1999) rupakan molekul polimer yang beragam yang dihasilkan ole
terlibat dalam setiap reaksi biokimia, mulai dari konversi
makanan, mekanisme pertahanan sel, komunikasi antar sel,
keturunan (Suhartono 1989). Enzim adalah protein
dalam sel dan ada yang dikeluarkan dari dalam sel penghasilnya
eksositosis. Enzim yang disekresikan ke luar digunakan
luar sel (di dalam rongga pencernaan) atau disebut extracellular sedangkan enzim yang dipertahankan di dalam sel digunakan
pencernaan di dalam sel itu sendiri atau disebut intracellular digestion(Affandi et al. 2005).
Enzim pencernaan yang disekresikan dalam rongga pencernaan berasal
dari sel-sel mukosa tembolok-lambung, hepatopankreas, dan mukosa usus,
Enzim-enzim tersebut berperan dalam hidrolisis protein, lemak dan karbohidrat.
Sel-sel mukosa lambung menghasilkan enzim protease dengan aktivitas
proteolitik optimal pada pH rendah. Cairan pankreas kaya akan tripsin, yaitu suatu
protease yang aktivitasnya optimal pada kondisi alkalis, disamping itu juga
menghasilkan amilase, maltase, dan lipase. Usus terutama menghasilkan
enzim-enzim penghidrolisis protein, lemak dan karbohidrat yang aktif pada pH netral dan
sedikit alkalis. Menurut Erasmus et al. (1997) bahwa komposisi enzim dalam cairan pencernaan berhubungan dengan makanan yang dimakan oleh abalon.
Aktivitas enzim pencernaan adalah suatu indikator yang baik untuk
menentukan kapasitas pencernaan. Aktivitas yang tinggi secara fisiologis
mengindikasikan bahwa larva siap untuk memproses pakan dari luar. Aktivitas
enzim pencernaan meningkat dengan bertambahnya umur larva. Peningkatan ini
disebabkan oleh semakin sempurnanya organ penghasil enzim (Gawlicka et al. 2000).
Degradasi alga secara enzimatik pada moluska sangat penting karena
mereka memiliki enzim-enzim karbohidrase dengan spesifitas substrat yang luas
dan efisiensi katalitik yang lebih tinggi dibandingkan krustasea, ekinodermata dan
annelida (Foster et al. 1999). Moluska memiliki kemampuan untuk mencerna selobiosa, amilosa, glikogen, laminarin, CM selulase, kitin (Foster et al. 1999), agar-agar, alginat, karagenan (Erasmus et al. 1997; Gomez-Pinchetti dan Garcia-Reina 1993). Penelitian aktivitas enzim-enzim karbohidrase pada abalon telah
banyak dilaporkan (Tabel 2).
Sejumlah laporan menyebutkan bahwa abalon H. midae dan H. discus hannae memiliki beragam enzim polisakarida hidrolase dalam saluran pencernaannya yang dapat menghidrolisis komplek polisakarida dari rumput laut
(Fleming et al. 1996). Menariknya enzim-enzim pendegradasi komponen alga tersebut aktivitasnya secara dominan berada pada lokasi yang berbeda. Alginat
ditemukan dominan pada usus abalon (Erasmus et al. 1997). Pada abalon tropis yang umumnya mengkonsumsi alga merah yang kaya agar-agar dan karagenan
seperti Gracilaria dan Euchema kemungkinan distribusi enzim-enzim penecernaan berbeda lokasi dominansinya dengan dengan abalon temprate yang
mengkonsumsi alga coklat yang kaya alginat.
Tabel 2. Enzim-enzim pencernaan pada abalon
Aktivitas Spesies abalon Referensi
Amilase, emulsin, glikogensase, laktase, lipase, maltase, pepsin, sukrase, urease
Tidak spesifik Albrecht (1921)*
Amilase, lipase, protease H. rufescens McLean (1970)*
Protease H. discus hannai Cho et al.(1983)*
Agarase, alginase, selulase H. coccinea conariensis
Gomez-Pinchetti & Garcia-Reina (1993)
Kimotripsin, tripsin H. rufescens Groppe & Morse (1993)* Amilase, lipase, protease H. midae Knaeur et al. (1996) Agarase, alginase, karagenase,
laminarinase
H. midae Erasmus et al. (1997)
Kimotripsin, tripsin, protease H. fulgens Serviere-Zaragosa et al. (1997)*
Kimotripsin, tripsin, protease, karboksipeptidase
H. fulgens Hernandes-Santoyo etal. (1997)*
Kimotripsin, tripsin, protease, fosfatase
H. fulgens Picos-Garcia et al. (2000)
Kimotripsin, tripsin, proteinase asam, aminopeptidase
H. fulgens Garcia-Carreno et al. (2003)
Protease H. midae Macey & Coyne (2005)
Selulase, lisozim, tripsin, protease asam, aminopeptidase, lipase, fosfohidrolase
H. rufescens Garcia-Esquifel & Felback (2006)
Protease, tripsin, amilase, lipase H. fulgens Viana et al. (2007)
Alginat lyase H. midae Doeschate & Coyne (2008)
Alginat lyase H. gigantea Iehata et al. (2010) *dikutip dari Picos-Garcia et al. (2000).
Menurut Erasmuset al. (1997), bakteri pada saluran pencernaan H. midae berperan dalam fungsi fisiologis saluran pencernaan, yakni dapat memproduksi
beragam enzim yang dapat memecah agar-agar, alginat, karaginan dan pati
menjadi molekul yang lebih sederhana, sehingga bakteri ini diduga membantu
Bakteri Pendegradasi
Agar-Polisakarida alga merupakan
laut yang mensekresi enzim agarolitik
tersebut, Gammaproteobacteria pemain kunci dalam siklus karbon
sel alga melalui sekresi enzim
alga merah melibatkan bakteri
karagenase (Michel et al. 2006) Bakteri yang memproduksi
(GH) yang menghidrolisis agaro
pada tahun 1902. Sejak saat
terutama dari lingkungan laut,
berasosiasi dengan alga merah
bakteri tersebut masuk kedalam
Cytophaga, Microbulbifer, Microscilla, (Eckborg et al. 2006; Michel et al
Berdasarkan mekanisme
mendegradasi agarosa diklasifikasikan kedalam dua kelompok yaitu α
yang memotong ikatan α-1,3 dari ag 1,4 dari agarosa (Sugano et al. 1993)
Gambar 3. Posisi pemotongan (Eckborg 2005)
β-agarase menghidrolisis ikatan β serangkaian oligosakarida yang
-Agar dan Enzim Agarase
merupakan sumber karbon krusial bagi sejumlah bakteri
enzim agarolitik (Flament et al. 2007). Di antara bakteri Gammaproteobacteria, Bacterioidetes, dan Planctomycetes adalah
siklus karbon global di lautan, mereka mendegradasi dinding
m glikosida hidrolase spesifik. Daur ulang biomassa
bakteri yang dapat memproduksi enzim agarase
. 2006).
memproduksi enzim agarase, suatu enzim glikosida hidrolase
agarosa, pertama kali diisolasi dari air laut oleh Gran
Sejak saat itu sejumlah bakteri agarolitik berhasil diisolasi
lingkungan laut, baik itu dari badan air, sedimen maupun yang
merah (Michel et al. 2006). Sebagian besar dari bakteri kedalam genus Agarivorans, Alterococcus, Alteromonas, Microbulbifer, Microscilla, Pseudoalteromonas, dan Pseudomonas
et al. 2006).
mekanisme aksinya terhadap agarosa, enzim hidrolitik yang
diklasifikasikan kedalam dua kelompok yaitu α-agarase 1,3 dari agarosadan β-agarase yang memotong ikatan β
. 1993) (Gambar 3).
pemotongan agarosa oleh enzim α-agarase dan β-agarase
menghidrolisis ikatan β-(14) agarosa dan menghasilkan yang berhubungan dengan neoagarobiosa (O
anhidro-α-L-galaktopiranosil-(13)-D-galaktosa) (Allouch et al.2003; Michel et al. 2006).
Berdasarkan sekuen gen glikosida hidrolase, ada tiga family β-agarase yaitu GH-16, GH-50 dan GH-86. Family GH-16 ditemukan sangat melimpah
dengan β-agarase yang berasal dari Streptomyces coelicolor A3, Aeromonas sp., Pseudomonas sp. ND137, Pseudoalteromonas CY24, Pseudoalteromonas atlantica ATCC 19262, dan dari Zobellia galactanivorans Dsij. Family GH-50
mengandung dua β-agarase dari Vibrio sp. JT0107, sedangkan family GH-86
mengandung β-agarase dari P. alantica(Allouch et at.2003).
Tahapan reaksi degradasi agarosa oleh β-agarase terkarakterisasi dengan baik pada Pseudoalteromonas atlantica ATCC 19262. Pada bakteri ini terdapat
dua jenis β-agarase yang bekerja secara sekuensial. Enzim ekstraseluler endo-β -agarase I memiliki aktivitas mendepolimerisasi agarosa menjadi neoagarotetrosa
sebagai produk akhir. Neoagarotetrosa kemudian akan dihidrolisis lebih lanjut
oleh 2 enzim periplasmik, β-agarase II (lebih dikenal dengan sebutan neoagarotetrosa hidrolase) dan neoagarobiose hidrolase, yang menghasilkan
produk akhir berupa 3,6-anhidro-L-galaktosa dan D-galaktosa (Vera et al. 1998; Michel et al. 2006).
Berbeda halnya dengan β-agarase yang dihasilkan oleh banyak kelompok bakteri, enzim α-agarase diketahui hanya dihasilkan oleh Alteromonas agaroliticus GJIB. Sistem agarolitik pada bakteri ini terdiri atas 2 enzim yaitu suatuα-agarase yang memecah ikatan α-(1,3) dari agarosa menjadi oligosakarida dalam bentuk agarobiosa dan enzim β-galaktosidase spesifik untuk kehadiran 3,6-anhidro-L-galaktosa sebagai produk akhir (Vera et al. 1998).
Interaksi Biologi Bakteri di Alam
Banyak interaksi mikroorganisme-invertebrata diketahui sangat penting di
lingkungan akuatik. Interaksi mikroorganisme-invertebrata bisa dipastikan adalah
sebagai ‘pemangsa-dimangsa’, yang mana invertebrata memanfaatkan secara
langsung mikrobiota sebagai sumber makanan. Dapat juga terjadi sinergisme,
yang mana invertebrata memudahkan kolonisasi bakteri melalui pemecahan
feses, sementara mikrobiota memprakondisikan bahan makanan sebelum ditelan
atau dicerna oleh invertebrata. Aktivitas invertebrata, seperti produksi substansi
bakteriosidal mungkin dapat menghambat atau memicu pertumbuhan
mikroorganisme, sedangkan mikroba dilaporkan dapat menghambat aktivitas
invertebrata seperti sebagai parasit atau patogen aktif (Harris 1993).
Istilah simbiosis digunakan untuk menunjukkan hubungan yang khusus
diantara dua organisme. Dalam arti luas, simbiosis dipandang sebagai hal yang
menguntungkan karena mereka menjaga keseimbangan ekologi. Terdapat
beragam bentuk interaksi di antara dua populasi mikroorganisme di alam, yaitu
netralisme, komensalisme, sinergisme atau protokooperasi, mutualisme
(simbiosis), kompetisi, predasi dan parasitisme (Atlas dan Bartha 1998).
Interaksi simbiotik bakteri juga banyak ditemukan dalam saluran
pencernaan hewan seperti rayap, ruminansia, dan gastropoda. Menurut Madigan
et al. (2009), beberapa bakteri rumen dapat menghidrolisis selulosa menjadi monosakarida yang selanjutnya diubah menjadi asam lemak rantai pendek.
Bakteri selulolitik anaerob yang populasinya melimpah di rumen adalah
Fibrobacter succinogenes dan Ruminococcus albus. Produk fermentasi dari bakteri polisakarolitik pada rumen digunakan sebagai sumber energi oleh
kelompok bakteri lain. Suksinat diubah menjadi propionat dan CO2 oleh
Schwatzia, dan asam laktat difermentasi menjadi asam asetat oleh Selenomonas dan Megasphaera.
Pengembangan industri budidaya perairan dewasa ini dihadapkan pada
sejumlah isu penting seperti peningkatan laju resistensi antibiotik, budidaya ramah
lingkungan dan alasan kesehatan. Oleh karena itu, pendekatan atau metode yang
ramah lingkungan dalam pencegahan dan penanggulangan penyakit pada industri
budidaya perairan mutlak diperlukan (Marques et al. 2006). Sejumlah teknik yang telah diaplikasikan pada akuakultur antara lain probiotik, imunostimulan,
bakteriosin, dan analisis quorum sensing (Vershuere et al. 2000; Balcazar et al. 2006).
Menurut Marques et al. (2006), aplikasi dari semua teknik di atas harus didasarkan pada pemahaman baik tentang mekanisme yang terlibat serta
untuk memahami hal tersebut adalah dengan mempelajari ‘interaksi
inang-mikrobial’. Strategi kunci untuk mempelajari interaksi tersebut adalah dengan
hewan coba yang bebas dari semua mikroba (gnotobiotic condition) dan kemudian mengevaluasi pengaruh penambahan kultur tunggal atau campuran mikroba
Tempat dan Waktu Penelitian
Kegiatan penelitian untuk isolasi bakteri agarolitik dilakukan di
Laboratorium Mikrobiologi Terapan PT Alaska Dwipa Perdana Cabang Mataram.
Sebagian proses seleksi, karakterisasi dan pengujian aktivitas enzim dilakukan di
Laboratorium Bioteknologi Hewan dan Biomedis PPSHB-PAU IPB. Uji
pengaruh isolat terhadap pertumbuhan abalon dilakukan di Balai Budidaya Laut
(BBL) Lombok, stasiun Sekotong, Kabupaten Lombok Barat, Nusa Tenggara
Barat. Waktu pelaksanaan penelitian mulai dari bulan September 2010 sampai
Desember 2011.
Tahapan Penelitian
Penelitian ini dilakukan dalam enam tahap, yaitu tahap I isolasi dan
seleksi bakteri agarolitik kandidat probiotik; tahap II dilakukan identifikasi isolat
bakteri terseleksi; tahap III uji kemampuan degradasi substrat dan aktivitas
enzim agarasein vitro; tahap IV uji kemampuan kolonisasi isolat terpilih; tahap V dilakukan uji pengaruh pemberian bakteri probiotik terhadap pertumbuhan
juvenil abalon; dan penelitian tahap VI pengujian kontribusi kandidat probiotik
dalam menyediakan enzim agarase eksogen pada saluran pencernaan abalon.
Bagan alir penelitian dapat dilihat pada Gambar 4.
Tahap I Isolasi dan Seleksi Bakteri Agarolitik Kandidat Probiotik
Isolasi Bakteri Agarolitik
Bakteri agarolitik diperoleh dari abalon dan alga merah dari perairan
pantai Kuta, pantai Gerupuk dan Tanjung An Lombok Tengah; kultur pengkayaan
dan isolasi bakteri agarolitik dilakukan menurut prosedur Agbo and Moss
(1979). Indikasi isolat bakteri agarolitik adalah terjadinya pencairan atau
pendangkalan agar-agar dan terbentuknya zona bening di sekitar koloni setelah
ditetesi indikator Lugol’s iodine.
Pengambilan Sampel. Sampel abalon (20 ekor) yang sehat diperoleh dari
hasil tangkapan nelayan di perairan pantai Gerupuk dan pantai Kuta Lombok
dari pantai Kuta (9 sampel), Tanjung An (6 sampel) dan pantai Gerupuk (3
sampel) lalu dimasukkan ke dalam kantong plastik. Semua sampel dimasukkan
dalam ice box dan segera dibawa ke laboratorium untuk dikulturkan.
Gambar 4. Bagan alur kerja penelitian TAHAP I
Identifikasi isolat
Degradasi substrat & Aktivitas enzim agarase
Kemampuan kolonisasi
Efek terhadap pertumbuhan abalon
Kontribusi enzimatik
Kandidat Probiotik TAHAP II
TAHAP III
TAHAP IV
TAHAP V
TAHAP VI
Pengayaan bakteri agarolitik Pengambilan sampel
Isolasi selektif bakteri agarolitik
Isolat terseleksi Uji
patogenisitas
Resistensi antibiotik
Kecepatan tumbuh Viabilitas
sel
Ketahanan pH rendah Uji
penempelan
Uji koagregasi Uji
hidrofobisitas
Kultur Pengayaan Bakteri Agarolitik. Abalon dibagi kedalam 3
kelompok berdasarkan ukurannya: >5 cm (4 ekor), 3.5-5 cm (7 ekor) dan < 3.5 cm
(9 ekor). Selanjutnya cangkang abalon dicuci dan didesinfeksi dengan etanol 95%
(Schulzeet al. 2006). Isi rongga perut (viscera) dibedah secara steril di atas es, lalu dihomogenisasi dalam 10 ml bufer kalium fosfat 100mM pH 7.5. Rumput
laut (Gracilaria spp.) dibilas 2-3 kali dengan air laut steril lalu diblender secara aseptis. Pengayaan bakteri dilakukan dengan memasukkan 100 ml air laut steril
ke dalam labu erlenmeyer 250 ml dan diberi agar-agar 0.2% (w/v, oxoid) sebagai
sumber karbon. Kedalam tiap-tiap erlenmeyer diinokulasikan masing-masing 10
ml suspensi rumput laut, dan 5 g isi perut abalon untuk tiap-tiap kelompok.
Erlenmeyer kemudian diinkubasi selama 4-7 hari pada 29 oC sambil digoyang
(Agbo and Moss, 1979 yang dimodifikasi).
Isolasi Bakteri Agarolitik. Sebanyak 0.1 ml kultur sampel disebar pada
medium agar-agar A (Vera et al. 1998) dan medium marine agar (MA), lalu diinkubasi pada 29oC. Isolasi selektif Vibrionaceae dilakukan dengan menanam
suspensi pada medium Thiosulphate Citrate Bile Salt Sucrose (TCBS), kemudian diinkubasi pada 29 oC. Setelah 24 jam, koloni yang tumbuh diambil, dibuat
replikanya dan dimurnikan dengan metode cawan gores. Selanjutnya cawan
dituangi dengan Lugol’s iodin dan penampakan warna kuning-pucat di sekitar
koloni pada latar cawan berwarna merah-violet menunjukkan adanya aktivitas
degradasi agar-agar. Verifikasi adanya aktivitas agarolitik dilakukan setiap hari
selama 7 hari dengan melihat ada tidaknya pencairan agar-agar (liquification) atau terjadi pendangkalan agar-agar di sekitar koloni (Agbo dan Moss, 1979). Selain
itu, verifikasi juga dilakukan dengan menumbuhkan isolat pada medium marine broth(MB) selama 24 jam pada 29 oC. Selanjutnya sel dan supernatannya dipisah dengan cara disentrifugasi pada 3000 rpm selama 10 menit. Sebanyak 100 µL
supernatan yang mengandung ekstrak kasar enzim yang dimasukkan ke dalam
sumur pada media agar-agar (1.2% agar Merck), diinkubasi selama 4 jam dan
diamati ada tidaknya zona bening setelah dituangi Lugol’s iodin.
Isolat bakteri agarolitik dipelihara dalam larutan Dubos’ yang