ABSTRAK
DERY SUPRAYOGI. Adsorpsi dan Desorpsi Kromium(VI) pada Zeolit Alam
asal Lampung Termodifikasi Heksadesiltrimetilamonium Bromida. Dibimbing
oleh ETI ROHAETI dan BETTY MARITA SOEBRATA.
ABSTRACT
DERY SUPRAYOGI. Adsorption and Desorption Chromium(VI) on Modified
Lampung’s Zeolite Hexadeciltrimetilamonium Bromide. Supervised by ETI
ROHAETI and BETTY MARITA SOEBRATA.
berdampak pada kehidupan manusia, baik yang positif maupun negatif. Dampak negatifnya adalah dihasilkannya cemaran yang mengganggu lingkungan. Cemaran yang sering menjadi perhatian adalah ion-ion logam berat. Hal ini disebabkan ion-ion tersebut bersifat toksik meskipun pada konsentrasi yang rendah dan umumnya sebagai cemaran utama bagi lingkungan (Suardana 2008). Salah satu logam berat yang merupakan sumber cemaran dan perlu dihilangkan dari perairan adalah logam kromium (Cr). Kromium banyak digunakan pada industri elektroplating, penyamakan kulit, pendingin air, pulp, cat, fotografi, serta proses pemurnian bijih dan petroleum.
Unsur kromium di alam terutama terdapat dalam tiga bentuk stabil, yaitu kromium logam, kromium(III), dan kromium(VI). Kromium(III) umumnya merupakan bentuk yang umum dijumpai di alam dan dalam material biologis. Kromium(III) memiliki sifat racun yang rendah dibandingkan dengan kromium(VI). Kromium(VI) merupakan salah satu material anorganik pengoksida tinggi. Kromium(VI) dapat menyebabkan kerusakan hati, ginjal, saluran pernapasan, dan kanker paru-paru (Kusnoputranto 1996).
Kromium(VI) umumnya terdapat dalam bentuk anion, yaitu sebagai kromat (CrO42-)
dan dikromat (Cr2O72-). Kromium(VI)
merupakan bentuk kromium yang paling toksik daripada bentuk valensi lainnya. Oleh karena itu, sangat penting untuk menurunkan kadarnya di lingkungan. World Health
Organization (WHO) merekomendasikan
batas maksimum kandungan kromium (VI) dalam air minum sebesar 0.050 mg L-1 dan
National Institute for Occupational Safety and Health (NIOSH) mengusulkan bahwa tingkat kandungan kromium harus dikurangi sampai 10-3 mg L-1 (Alias et al. 2008).
Salah satu metode untuk menurunkan kandungan logam kromium dalam air limbah adalah perlakuan sorpsi. Metode sorpsi melibatkan interaksi antara analit dengan permukaan zat padat (adsorben) (Diantariani
et al. 2008). Adsorben yang sekarang ini banyak digunakan dalam penanganan limbah kromium adalah zeolit alam (Suardana 2008). Zeolit ada 2 macam, yaitu zeolit alam dan sintetik. Zeolit alam pada umumnya memiliki kristalinitas yang tidak terlalu tinggi, ukuran porinya sangat tidak seragam, aktivitas katalitiknya rendah, dan mengandung banyak
(Setyawan & Handoko 2003).
Struktur zeolit yang bermuatan negatif berfungsi sebagai penukar kation dan sedikit sebagai penukar anion. Oleh karena itu, untuk meningkatkan fungsi zeolit agar dapat menukar anion maka zeolit dapat dimodifikasi dengan bahan-bahan organik seperti heksadesiltrimetilamonium (HDTMA), vinil piridin, dan kitosan (Husaini 2003). Zeolit yang telah dimodifikasi dengan suatu zat aktif permukaan mempunyai kapasitas penukaran anion yang lebih baik. Kation yang berada pada kerangka zeolit umumnya alkali dan alkali tanah, dapat dipertukarkan dengan kation HDTMA sehingga permukaan zeolit memiliki daya tarik untuk oksianion.
Penelitian ini bertujuan memodifikasi zeolit alami dengan aktivasi secara pemgasaman dan heksadesiltrimetilamonium bromida (HDTMABr) kemudian menguji kapasitas adsorpsinya pada kromium(VI) dengan menentukan kondisi optimum adsorpsi yang meliputi waktu adsorpsi, pH, konsentrasi awal larutan kromium(VI), menentukan isoterm adsorpsi kromium(VI) oleh zeolit alami dan zeolit termodifikasi serta menentukan proses desorpsinya. Zeolit alam asal Lampung yang termodifikasi HDTMABr dengan aktivasi secara pengasaman ini diharapkan dapat meningkatkan nilai kapasitas adsorpsinya terhadap kromium(VI) yang lebih baik dibandingkan zeolit tanpa modifikasi.
TINJAUAN PUSTAKA
Zeolit
Zeolit pertama kali diperkenalkan pada tahun 1756 oleh Freiherr Axel Cronsted, seorang ahli geologi kebangsaan Swedia yang menamakannya dari bahasa Yunani yaitu zein
(mendidih) dan lithos (batu) yang berarti batu mendidih. Zeolit didefinisikan sebagai suatu aluminosilikat terhidrat yang terdiri atas satuan-satuan tetrahedral SiO4 dan AlO4
dengan kerangka struktur berongga yang ditempati oleh molekul-molekul air dan kation. Kation pada rongga zeolit dapat bergerak bebas sehingga memungkinkan pertukaran ion tanpa merusak struktur zeolit (Ming dan Mumpton 1989). Satuan-satuan SiO4 dan AlO4 (Gambar 1) saling
berdampak pada kehidupan manusia, baik yang positif maupun negatif. Dampak negatifnya adalah dihasilkannya cemaran yang mengganggu lingkungan. Cemaran yang sering menjadi perhatian adalah ion-ion logam berat. Hal ini disebabkan ion-ion tersebut bersifat toksik meskipun pada konsentrasi yang rendah dan umumnya sebagai cemaran utama bagi lingkungan (Suardana 2008). Salah satu logam berat yang merupakan sumber cemaran dan perlu dihilangkan dari perairan adalah logam kromium (Cr). Kromium banyak digunakan pada industri elektroplating, penyamakan kulit, pendingin air, pulp, cat, fotografi, serta proses pemurnian bijih dan petroleum.
Unsur kromium di alam terutama terdapat dalam tiga bentuk stabil, yaitu kromium logam, kromium(III), dan kromium(VI). Kromium(III) umumnya merupakan bentuk yang umum dijumpai di alam dan dalam material biologis. Kromium(III) memiliki sifat racun yang rendah dibandingkan dengan kromium(VI). Kromium(VI) merupakan salah satu material anorganik pengoksida tinggi. Kromium(VI) dapat menyebabkan kerusakan hati, ginjal, saluran pernapasan, dan kanker paru-paru (Kusnoputranto 1996).
Kromium(VI) umumnya terdapat dalam bentuk anion, yaitu sebagai kromat (CrO42-)
dan dikromat (Cr2O72-). Kromium(VI)
merupakan bentuk kromium yang paling toksik daripada bentuk valensi lainnya. Oleh karena itu, sangat penting untuk menurunkan kadarnya di lingkungan. World Health
Organization (WHO) merekomendasikan
batas maksimum kandungan kromium (VI) dalam air minum sebesar 0.050 mg L-1 dan
National Institute for Occupational Safety and Health (NIOSH) mengusulkan bahwa tingkat kandungan kromium harus dikurangi sampai 10-3 mg L-1 (Alias et al. 2008).
Salah satu metode untuk menurunkan kandungan logam kromium dalam air limbah adalah perlakuan sorpsi. Metode sorpsi melibatkan interaksi antara analit dengan permukaan zat padat (adsorben) (Diantariani
et al. 2008). Adsorben yang sekarang ini banyak digunakan dalam penanganan limbah kromium adalah zeolit alam (Suardana 2008). Zeolit ada 2 macam, yaitu zeolit alam dan sintetik. Zeolit alam pada umumnya memiliki kristalinitas yang tidak terlalu tinggi, ukuran porinya sangat tidak seragam, aktivitas katalitiknya rendah, dan mengandung banyak
(Setyawan & Handoko 2003).
Struktur zeolit yang bermuatan negatif berfungsi sebagai penukar kation dan sedikit sebagai penukar anion. Oleh karena itu, untuk meningkatkan fungsi zeolit agar dapat menukar anion maka zeolit dapat dimodifikasi dengan bahan-bahan organik seperti heksadesiltrimetilamonium (HDTMA), vinil piridin, dan kitosan (Husaini 2003). Zeolit yang telah dimodifikasi dengan suatu zat aktif permukaan mempunyai kapasitas penukaran anion yang lebih baik. Kation yang berada pada kerangka zeolit umumnya alkali dan alkali tanah, dapat dipertukarkan dengan kation HDTMA sehingga permukaan zeolit memiliki daya tarik untuk oksianion.
Penelitian ini bertujuan memodifikasi zeolit alami dengan aktivasi secara pemgasaman dan heksadesiltrimetilamonium bromida (HDTMABr) kemudian menguji kapasitas adsorpsinya pada kromium(VI) dengan menentukan kondisi optimum adsorpsi yang meliputi waktu adsorpsi, pH, konsentrasi awal larutan kromium(VI), menentukan isoterm adsorpsi kromium(VI) oleh zeolit alami dan zeolit termodifikasi serta menentukan proses desorpsinya. Zeolit alam asal Lampung yang termodifikasi HDTMABr dengan aktivasi secara pengasaman ini diharapkan dapat meningkatkan nilai kapasitas adsorpsinya terhadap kromium(VI) yang lebih baik dibandingkan zeolit tanpa modifikasi.
TINJAUAN PUSTAKA
Zeolit
Zeolit pertama kali diperkenalkan pada tahun 1756 oleh Freiherr Axel Cronsted, seorang ahli geologi kebangsaan Swedia yang menamakannya dari bahasa Yunani yaitu zein
(mendidih) dan lithos (batu) yang berarti batu mendidih. Zeolit didefinisikan sebagai suatu aluminosilikat terhidrat yang terdiri atas satuan-satuan tetrahedral SiO4 dan AlO4
dengan kerangka struktur berongga yang ditempati oleh molekul-molekul air dan kation. Kation pada rongga zeolit dapat bergerak bebas sehingga memungkinkan pertukaran ion tanpa merusak struktur zeolit (Ming dan Mumpton 1989). Satuan-satuan SiO4 dan AlO4 (Gambar 1) saling
penghubung antara atom Si dan atom Al membentuk rongga-rongga intrakristalin dan saluran-saluran yang teratur (Tominaga 1987).
Gambar 1 Struktur dasar zeolit. Berdasarkan asalnya, zeolit dibedakan menjadi dua, yaitu zeolit alam dan zeolit sintetik. Zeolit alam terbentuk selama ribuan tahun dalam bentuk sedimen yang terjadi karena pencampuran debu-debu vulkanis dengan air hujan, air tanah, atau air laut. Sementara zeolit sintetik dibuat di laboratorium. Berbagai jenis zeolit alam telah ditemukan dan dianalisis rumus kimia unit selnya. Pada saat ini dikenal sekitar 40 jenis zeolit alam, meskipun yang mempunyai nilai komersial hanya sekitar 12 jenis, di antaranya klinoptilolit, mordenit, dan faujasit(Tabel 1). Tabel 1 Jenis mineral zeolit yang terdapat
dalam batuan zeolit
Nama Rumus Kima Unit Sel Faujasit Na58(Al58Si134O384).18H2O
Ferrierit (Na2Mg2)(Al6Si30O72).18H2O
Hulandit Ca4(Al8Si28O72).24H2O
Klinoptilolit (Na4K4)(Al8Si40O96).24H2O
Mordenit Na8(Al8Si40O96).24H2O
Natrolit Na4(Al4Si6O20).4H2O
Scolecit Ca2(Al4Si6O20).6H2O
Thomsonit (Na4K4)(Al8Si40O96).24H2O
Wairakit Ca(Al2Si4O12).2H2O
Yugawaralit Ca(Al4Si6O20).6H2O
Kabasit Ca2[Al4Si8O24].13H2O
Laumontit Ca(Al2Si4O12).4H2O
Sumber: Hay (1966)
Zeolit sintetik dihasilkan dari beberapa perusahaan seperti Union Carbide, ICI, dan Mobil Oil, serta lebih dari 100 jenis telah dikenal strukturnya antara lain zeolit A, X, Y, dan L seperti tertera pada Tabel 2 (Thamzil 2005).
Tabel 2 Jenis-jenis zeolit sintetik Nama Rumus Molekul
A Na12[(AlO2)12(SiO2)12].27H2O
X Na86[(AlO2)86(SiO2)106].264H2O
Y Na56[(AlO2)56(SiO2)136].250H2O
L K9[(AlO2)9(SiO2)27].22H2O
Sumber: Hay (1966)
Zeolit merupakan material berpori yang penggunanya sangat luas. Penggunaan zeolit didasarkan atas kemampuannya melakukan pertukaran ion, adsorpsi, dan katalisator. Zeolit memiliki bentuk kristal yang sangat teratur dengan rongga yang saling berhubungan ke segala arah yang menyebabkan luas permukaan zeolit sangat besar sehingga sangat baik digunakan sebagai adsorben (Sutarti & Rachmawati 1994).
Pada struktur zeolit terdapat atom Si yang bermuatan +4, tetapi dengan adanya atom Al yang bermuatan +3, yang menggantikan atom Si, menyebabkan kerangka zeolit kekurangan muatan positif atau kelebihan muatan negatif. Selain itu semua atom Al dalam bentuk tetrahedral sehingga atom Al akan bermuatan negatif karena berkoordinasi dengan 4 atom oksigen dan selalu dinetralkan oleh kation alkali atau alkali tanah seperti K+, Na+, Mg2+ , dan Ca2+ untuk mencapai senyawa yang stabil. Kation-kation ini dalam struktur rongga zeolit tidak terikat pada posisi yang tetap, tetapi dapat bergerak bebas dalam rongga zeolit dan bertindak sebagai penukar ion yang dapat dipertukarkan dengan kation lainnya. Sifat tersebut memungkinkan zeolit berfungsi sebagai penukar ion (Thamzil 2005).
Menurut Suwardi (1998), zeolit asal Lampung memiliki kandungan mordenit dengan montmorilonit sebagai mineral pengotor, kandungan zeolit sebesar 68%, dan nilai kapasitas tukar kation (KTK) sebesar 127 mek/100g. Aningrum (2006) melaporkan zeolit asal Lampung memiliki nilai KTK sebesar 89.62 mek/100g, luas permukaan 37.7768 m2/g, nisbah Si/Al 5.24, dan kapasitas adsorpsi pada ion kromium(III) sebesar 3.02 mg Cr/g zeolit. Suwardi (1998) melaporkan hasil analisis kimia dari contoh zeolit di daerah Lampung adalah SiO2:
65.00%, Al2O3: 13.28%, Fe2O3: 0.96%, CaO:
2.29%, MnO: 0.01%, MgO: 0.40%, Na2O:
0.94%, K2O: 3.41%, TiO2: 0.29%, kadar air:
6.34%, dan hilang pijar atau loss of ignition
(LOI): 9.08%.
Struktur dasar zeolit mempunyai rumus sebagai berikut (Mx
+
,My
2+
)(Al(x+2y)Si n-(x+2y)O2n).mH2O. M
+
Kerangka aluminasilikat zeolit terdiri atas unit bangun primer, sekunder, dan polihedral sebagaimana terlihat pada Gambar 2-4.
Gambar 2 Tetrahedral alumina dan silika (TO4) pada struktur zeolit.
Gambar 3 Unit bangun sekunder struktur zeolit: Single-4-Ring (S4R),
Double-4-Ring (D4R), dan
Complex 4-1 (T5O10).
Gambar 4 Unit bangun polihedral struktur zeolit.
Struktur kristal zeolit dengan semua atom Si dan Al dalam bentuk tetrahedral (TO4)
disebut unit bangun primer. Unit bangun sekunder terdiri atas unit tetrahedral SiO4 dan
AlO4 yang saling berhubungan dengan
pemakaian bersama atom oksigen membentuk cincin, seperti cincin tunggal jenis lingkar 4, 6, 8, bentuk kubus, cincin ganda lingkar 4, prisma heksagonal, dan dua cincin lingkar 6. Zeolit hanya dapat diidentifikasi berdasarkan unit bangun sekunder (UBS). Unit bangun polihedral terdiri atas unit bangun sekunder (Thamzil 2005).
Aktivasi Zeolit
Aktivasi zeolit adalah proses persiapan sebelum zeolit digunakan. Aktivasi bertujuan menghilangkan pengotor yang berupa oksida logam dari alam yang menutupi rongga, sehingga kapasitas tukar ion dan kapasitas adsorpsi menjadi optimal. Peningkatan daya guna zeolit sebagai adsorben dapat dilakukan melalui aktivasi secara fisis maupun kimia (Priatna et al. 1985).
Proses aktivasi secara fisis dilakukan dengan pemanasan (kalsinasi) pada suhu 300-375 °C selama 3-4 jam (Suwardi 2000). Pemanasan ini bertujuan menguapkan air yang terperangkap dalam pori-pori kristal zeolit sehingga jumlah pori dan luas permukaan spesifiknya bertambah. Aktivasi secara kimia dapat dilakukan dengan penambahan asam dan basa. Penambahan asam yaitu menggunakan larutan asam klorida atau asam sulfat yang bertujuan membersihkan permukaan pori, membuang senyawa pengotor, dan menata kembali letak atom yang dapat dipertukarkan. Penambahan basa menggunakan larutan natrium hidroksida (Suyartono & Husaini 1991).
Adsorpsi
Salah satu metode yang digunakan untuk menghilangkan zat pencemar dari air limbah adalah adsorpsi (Diantariani et al. 2008). Adsorpsi merupakan terjerapnya suatu zat (molekul atau ion) pada permukaan adsorben. Zat yang diadsorpsi disebut fase teradsorpsi (adsorbat) dan zat yang mengadsorpsi disebut adsorben. Adsorben pada umumnya adalah zat padat yang berongga, contohnya zeolit. Pada umumnya untuk dapat mengadsorpsi, zeolit harus didehidrasi terlebih dahulu dengan aktivasi, baik secara fisis maupun kimia.
Terdapat 2 metode adsorpsi, yaitu tumpak (batch) dan lapik tetap (fixed bed). Pada metode tumpak, larutan contoh dicampur dan dikocok bersama-sama dengan adsorben sampai tercapainya kesetimbangan. Adsorpsi pada fase padat-cair ini mencapai kesetimbangan saat adsorben telah jenuh oleh adsorbat. Zat yang tidak teradsorpsi dipisahkan dari adsorben dengan cara penyaringan. Ketika kesetimbangan sudah tercapai, kemudian dilakukan pengukuran konsentrasi sisa larutan.
jumlah adsorbat tiap gram adsorben (McCabe 2001).
Isoterm Adsorpsi
Isoterm adsorpsi menunjukkan hubungan kesetimbang antara konsentrasi zat terlarut yang teradsorpsi pada permukaan padatan dan jumlah adsorben pada suhu tetap. Kesetimbangan terjadi pada saat laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya (Muhammad et al.
1998).
Terdapat beberapa isoterm yang dikembangkan untuk menggambarkan interaksi antara adsorben dan adsorbat. Tipe isoterm adsorpsi yang umum digunakan untuk menggambarkan fenomena adsorpsi padat-cair adalah tipe isoterm Langmuir dan Freundlich (Alberty & Silbey 1992).
Isoterm Adsorpsi Langmuir
Isoterm adsorpsi Langmuir didasarkan atas beberapa asumsi, yaitu (a) adsorpsi hanya terjadi pada lapisan tunggal (monolayer), (b) panas adsorpsi tidak tergantung pada penutupan permukaan, (c) semua bagian dan permukaannya bersifat homogen, dan (d) sejumlah tertentu tapak aktif adsorben yang membentuk ikatan kovalen atau ion (Oscik 1982). Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoritis dengan menganggap terjadinya kesetimbangan antara molekul-molekul zat yang diadsorpsi pada permukaan adsorben dengan molekul-molekul zat yang tidak teradsorpsi. Persamaan isoterm adsorpsi Langmuir dapat dituliskan sebagai berikut:
C merupakan konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm), x/m adalah massa adsorbat yang teradsorpsi per gram adsorben, α,β adalah konstanta yang berhubungan dengan afinitas adsorpsi (Atkins 1999).
Isoterm Adsorpsi Freundlich
Persamaan isoterm adsorpsi Freundlich didasarkan atas beberapa asumsi, yaitu (a) terbentuknya beberapa lapisan (multilayer) dari molekul-molekul adsorbat pada permukaan adsorben, (b) bagian tapak aktif pada permukaan adsorben bersifat heterogen, dan (c) hanya melibatkan gaya Van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lain dari adsorben. Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut:
Log (
m x
) = log k +
n
1 log C
C merupakan konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm), x/m adalah massa adsorbat yang teradsorpsi per gram adsorben, k,n adalah konstanta yang berhubungan dengan afinitas adsorpsi (Atkins 1999).
Isoterm Freundlich menganggap bahwa pada semua tapak permukaan adsorben akan terjadi proses adsorpsi di bawah kondisi yang diberikan. Isoterm Freundlich tidak mampu memperkirakan adanya tapak-tapak pada permukaan yang mampu mencegah adsorpsi pada saat kesetimbangan tercapai, dan hanya ada beberapa tapak aktif saja yang mampu mengadsorpsi molekul terlarut (Jason 2004).
Kromium
Kromium merupakan salah satu logam berat unsur transisi golongan VIB dengan sifat-sifat antara lain mempunyai nomor atom 24, massa atom 51.996 sma, massa jenis 7.9 g/cm3, titik didih 2658 °C, dan titik leleh 1875 °C. Kromium dapat membentuk 3 macam senyawa yang berasal dari proses oksidasi kromium oksida (CrO), yaitu kromium divalen (+2), trivalen (+3), dan heksavalen (+6). Bentuk kromium heksavalen adalah CrO42- dan Cr2O72-, sedangkan dalam bentuk
kromium trivalen adalah Cr3+, [Cr(OH)]2+, [Cr(OH)2]+, dan [Cr(OH)4]+ (Cotton &
Wilkinson 1989). Kromium mempunyai konfigurasi elektron [Ar] 3d54s1. Jika dalam keadaan murni melarut dengan lambat sekali dalam asam encer membentuk garam kromium(II) (Vogel 1990).
Kromium sebagai logam berat, termasuk logam yang mempunyai daya racun tinggi. Daya racun yang dimiliki oleh kromium ditentukan oleh valensi ionnya. Kromium(VI) merupakan bentuk yang paling banyak dipelajari sifat racunnya, dikarenakan kromium(VI) merupakan unsur toksik yang sangat kuat dan dapat mengakibatkan terjadinya keracunan akut dan keracunan kronis (Soemirat 2002). Pemasukan kromium(VI) ke dalam tubuh, walaupun dalam jumlah yang sangat kecil dapat menyebabkan iritasi pada saluran pernapasan. Akumulasi kromium(VI) dalam tubuh dapat menyebabkan kanker hati dan ginjal (Jugade & Joshi 2006).
Metode umum yang digunakan untuk pengukuran kadar kromium total dan heksavalen adalah spektrofotometri sinar
C α αβ x/m
C 1 1
Cr 2O7
2-tampak. Metode ini didasarkan pada pengukuran absorban larutan berwarna ungu kemerahan yang menunjukkan terjadinya kompleks antara 1,5-difenilkarbazida [(C6H5NHNH)2CO) (DPC)] dengan
kromium(VI) (Gambar 5). Reaksi kromium dengan DPC sangat sensitif, absorpsivitas molar kira-kira 40.000 L mol-1 cm-1 pada 530 atau 540 nm (Clesceri et al. 2005).
+
Gambar 5 Reaksi antara DPC dan kromium (VI) (Clesceri et al. 2005).
Kapasitas Tukar Kation
Kemampuan pertukaran ion zeolit merupakan parameter utama dalam menentukan kualitas zeolit. Kemampuan ini dinyatakan sebagai nilai kapasitas tukar kation (KTK). KTK adalah jumlah milligram ekuivalen (mek) kation yang dapat dipertukarkan maksimum oleh 100 g bahan penukar ion dalam kondisi kesetimbangan. Nilai KTK zeolit bergantung pada derajat substitusi jumlah atom Al3+ atau Fe3+ terhadap Si4+ yang menghasilkan muatan negatif pada kerangka zeolit. Semakin besar derajat substitusi menunjukkan semakin banyak kation alkali atau alkali tanah yang diperlukan untuk menetralkan muatan negatif pada kerangka sehingga nilai KTK makin besar (Ming dan Mumpton 1989). Selain itu, nilai KTK juga bergantung pada suhu, konsentrasi dari kation dalam larutan, jenis anion yang tergabung dengan kation, pelarut, ukuran kation baik dalam bentuk hidrat dan anhidrat, serta muatan kation (Nizam 2007).
Zeolit mempunyai KTK yang sangat tinggi, sekitar 80-200 mek/100g. Zeolit yang mempunyai KTK kurang dari 80 mek/100g menunjukkan kandungan zeolit murninya sangat rendah, sehingga mutunya juga sangat rendah (Suwardi 2000). Nilai KTK yang rendah disebabkan oleh rendahnya kandungan zeolit pada contoh dan pengaruh mineral
pengotor. Mineral pengotor kuarsa dan feldspar menyebabkan KTK rendah, sedangkan mineral montmorilonit menyebabkan KTK tinggi. Terdapat hubungan yang erat antara KTK dan kandungan zeolit, semakin tinggi kandungan zeolit, memiliki nilai KTK semakin tinggi. Oleh karena itu, besarnya nilai KTK pada contoh zeolit dapat digunakan untuk menduga kandungan mineral zeolit dan kualitas zeolit (Suwardi 1998).
Heksadesiltrimetilamonium
Heksadesiltrimetilamonium (HDTMA) adalah suatu tetra-substitusi kation amonium dengan pengikatan nitrogen bervalesi lima secara permanen dan rantai lurus panjang alkil (C16) yang memberikan tingkat hidrofobisitas. HDTMA biasanya berada dalam bentuk garamnya seperti HDTMA bromida dan HDTMA klorida. HDTMABr memiliki rumus molekul, yaitu C19H42NBr
dengan rumus bangun tertera pada Gambar 6 (Husaini 2003).
Gambar 6 Struktur HDTMA bromida. Menurut Li (1998) HDTMA merupakan kation organik yang dapat dipertukarkan dengan kation anorganik yang berada dalam kerangka zeolit. Pertukaran kation anorganik dengan kation organik pada kerangka zeolit dapat meningkatkan daya adsorpsi zeolit terhadap anion. Menurut Nizam (2007) HDTMA merupakan garam amonium kuartener yang kationnya dapat dipertukarkan dengan kation lain yang berada pada struktur zeolit, yang memungkinkan peningkatan adsorpsi zeolit pada ion dikromat.
Permukaan
daya jerap zeolit yang secara alamiah memang tinggi (Husaini 2003).
HDTMA terdiri atas gugus amina yang merupakan gugus kepala hidrofilik dan hidrokarbon yang merupakan gugus ekor hidrofobik. Interaksi antar ekor hidrokarbon pada HDTMA membentuk 2 lapisan (bilayer). Lapisan pertama gugus amina yang bermuatan positif melekat pada permukaan eksternal dari zeolit yang bermuatan negatif sehingga berperan sebagai penukar kation dalam kerangka zeolit. Lapisan kedua, dengan ikatan hasil interaksi antara gugus hidrofobik, muatan positif dari gugus amina yang mengarah keluar untuk mengadsorpsi ion bermuatan negatif sehingga berperan sebagai penukar anion. Pembentukan dua lapisan
(bilayer) HDTMA pada permukaan zeolit
dapat disajikan seperti pada Gambar 7 (Nizam NA 2007).
Gambar 7 Pembentukan dua lapisan (bilayer) HDTMA pada zeolit.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah Zeolit alam asal Lampung.
Alat-alat yang digunakan antara lain perangkat spektrofotometer UV-Vis Shimadzu.
Metode
Penelitian ini terdiri atas 3 tahap. Tahap pertama mencakup preparasi zeolit, aktivasi zeolit alam dengan pengasaman, penentuan KTK dan pembuatan zeolit modifikasi HDTMABr. Penentuan nilai KTK dilakukan di Laboratorium Mineralogi, Departemen Manajemen Sumber Daya Lahan, Institut Pertanian Bogor. Tahap kedua adalah penentuan kondisi optimum adsorpsi kromium(VI) oleh zeolit meliputi waktu adsorpsi, pH, dan konsentrasi awal larutan kromium(VI). Tahap ketiga adalah penentuan isoterm adsorpsi zeolit tanpa modifikasi dan
zeolit termodifikasi, serta desorpsi kromium(VI) dari zeolit (Lampiran 1).
Preparasi Zeolit
Zeolit dicuci dengan akuades, digiling dengan mortar, lalu diayak sehingga diperoleh zeolit dengan ukuran butir lolos ayakan 60 mesh. Kemudian dilakukan pemanasan dalam oven bersuhu 300 °C selama 3 jam.
Aktivasi zeolit
Aktivasi zeolit dilakukan secara kimia, yaitu dengan cara pengasaman. Sebanyak 100 gram zeolit siap pakai, dilarutkan ke dalam 250 mL HCl 4.0 M. Campuran diaduk dengan pengaduk magnet selama 60 menit. Kemudian dibilas dengan akuades sampai pH netral dan dikeringkan dalam oven pada suhu 300 °C selama 3 jam.
Pembuatan Zeolit Modifikasi HDTMABr
Sebanyak 100 g zeolit dikocok dalam 180 mL larutan HDTMABr dosis 50, 100, dan 200% dari nilai KTK. Selanjutnya dikocok selama 8 jam, didekantasi, disaring, dibilas dengan akuades sampai pH netral, dan residu dikeringudarakan (Li 1998; Husaini 2003).
Penentuan Kapasitas Tukar Kation
Sebanyak 2.5 g zeolit dimasukkan ke dalam tabung perkolasi yang telah dilapisi berturut-turut dengan filter pulp dan pasir terlebih dahulu dengan susunan (1) bagian bawah adalah filter pulp untuk menutup lubang pada dasar tabung dan diatasnya 2.5 g pasir, (2) bagian tengah diisi 2.5 g zeolit, dan (3) bagian atas ditutup dengan 2.5 g pasir. Ketebalan setiap lapisan pada sekeliling tabung diupayakan sama. Selanjutnya diperkolasi dengan amonium asetat pH 7 sebanyak 2 × 25 mL dengan selang waktu 30 menit. Setelah itu tabung perkolasi yang masih berisi contoh diperkolasi dengan 100 mL etanol 96% untuk menghilangkan kelebihan amonium dan perkolat ini dibuang. Sisa etanol dalam tabung perkolasi dibuang dengan pompa isap dari bawah tabung perkolasi atau pompa tekan dari atas tabung perkolasi. Selanjutnya zeolit diperkolasi dengan NaCl 10% sebanyak 50 mL, filtrat ditampung dalam labu takar 50 mL dan diimpitkan dengan larutan NaCl 10%.
Setelah itu, filtrat dipindahkan secara kuantitatif ke dalam labu didih. Akuades digunakan untuk membilas labu takar. Selanjutnya ditambahkan sedikit batu didih
Permukaan
daya jerap zeolit yang secara alamiah memang tinggi (Husaini 2003).
HDTMA terdiri atas gugus amina yang merupakan gugus kepala hidrofilik dan hidrokarbon yang merupakan gugus ekor hidrofobik. Interaksi antar ekor hidrokarbon pada HDTMA membentuk 2 lapisan (bilayer). Lapisan pertama gugus amina yang bermuatan positif melekat pada permukaan eksternal dari zeolit yang bermuatan negatif sehingga berperan sebagai penukar kation dalam kerangka zeolit. Lapisan kedua, dengan ikatan hasil interaksi antara gugus hidrofobik, muatan positif dari gugus amina yang mengarah keluar untuk mengadsorpsi ion bermuatan negatif sehingga berperan sebagai penukar anion. Pembentukan dua lapisan
(bilayer) HDTMA pada permukaan zeolit
dapat disajikan seperti pada Gambar 7 (Nizam NA 2007).
Gambar 7 Pembentukan dua lapisan (bilayer) HDTMA pada zeolit.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah Zeolit alam asal Lampung.
Alat-alat yang digunakan antara lain perangkat spektrofotometer UV-Vis Shimadzu.
Metode
Penelitian ini terdiri atas 3 tahap. Tahap pertama mencakup preparasi zeolit, aktivasi zeolit alam dengan pengasaman, penentuan KTK dan pembuatan zeolit modifikasi HDTMABr. Penentuan nilai KTK dilakukan di Laboratorium Mineralogi, Departemen Manajemen Sumber Daya Lahan, Institut Pertanian Bogor. Tahap kedua adalah penentuan kondisi optimum adsorpsi kromium(VI) oleh zeolit meliputi waktu adsorpsi, pH, dan konsentrasi awal larutan kromium(VI). Tahap ketiga adalah penentuan isoterm adsorpsi zeolit tanpa modifikasi dan
zeolit termodifikasi, serta desorpsi kromium(VI) dari zeolit (Lampiran 1).
Preparasi Zeolit
Zeolit dicuci dengan akuades, digiling dengan mortar, lalu diayak sehingga diperoleh zeolit dengan ukuran butir lolos ayakan 60 mesh. Kemudian dilakukan pemanasan dalam oven bersuhu 300 °C selama 3 jam.
Aktivasi zeolit
Aktivasi zeolit dilakukan secara kimia, yaitu dengan cara pengasaman. Sebanyak 100 gram zeolit siap pakai, dilarutkan ke dalam 250 mL HCl 4.0 M. Campuran diaduk dengan pengaduk magnet selama 60 menit. Kemudian dibilas dengan akuades sampai pH netral dan dikeringkan dalam oven pada suhu 300 °C selama 3 jam.
Pembuatan Zeolit Modifikasi HDTMABr
Sebanyak 100 g zeolit dikocok dalam 180 mL larutan HDTMABr dosis 50, 100, dan 200% dari nilai KTK. Selanjutnya dikocok selama 8 jam, didekantasi, disaring, dibilas dengan akuades sampai pH netral, dan residu dikeringudarakan (Li 1998; Husaini 2003).
Penentuan Kapasitas Tukar Kation
Sebanyak 2.5 g zeolit dimasukkan ke dalam tabung perkolasi yang telah dilapisi berturut-turut dengan filter pulp dan pasir terlebih dahulu dengan susunan (1) bagian bawah adalah filter pulp untuk menutup lubang pada dasar tabung dan diatasnya 2.5 g pasir, (2) bagian tengah diisi 2.5 g zeolit, dan (3) bagian atas ditutup dengan 2.5 g pasir. Ketebalan setiap lapisan pada sekeliling tabung diupayakan sama. Selanjutnya diperkolasi dengan amonium asetat pH 7 sebanyak 2 × 25 mL dengan selang waktu 30 menit. Setelah itu tabung perkolasi yang masih berisi contoh diperkolasi dengan 100 mL etanol 96% untuk menghilangkan kelebihan amonium dan perkolat ini dibuang. Sisa etanol dalam tabung perkolasi dibuang dengan pompa isap dari bawah tabung perkolasi atau pompa tekan dari atas tabung perkolasi. Selanjutnya zeolit diperkolasi dengan NaCl 10% sebanyak 50 mL, filtrat ditampung dalam labu takar 50 mL dan diimpitkan dengan larutan NaCl 10%.
Setelah itu, filtrat dipindahkan secara kuantitatif ke dalam labu didih. Akuades digunakan untuk membilas labu takar. Selanjutnya ditambahkan sedikit batu didih
dan akuades sampai setengah volume labu didih. Sebanyak 10 mL NaOH 40% ditambahkan ke dalam labu didih yang berisi contoh dan secepatnya ditutup. Disiapkan pula penampung untuk NH3 yang dibebaskan, yaitu
Erlenmeyer yang berisi 10 mL H3BO3 1%
yang ditambahkan 3 tetes indikator Conway
(berwarna merah) dan dihubungkan dengan alat destilasi. Destilasi dihentikan jika volume destilat yang ditampung mencapai 75 mL (berwarna hijau). Destilat dititrasi dengan HCl 0,05 N hingga warna merah muda. Dilakukan pula pengujian terhadap blanko. Volume hasil titrasi contoh dan blanko dicatat (Peraturan Menteri Pertanian No.02/Pert/HK.060/ 2/2006, diacu dalam Al-Jabri 2008). KTK zeolit dihitung menggunakan rumus sebagai berikut:
KTK (mek/100 g) =
t gram zeoli
N HCl Vb)
(Vc− ×
× 100
Keterangan:
Vb = volume HCl yang dibutuhkan pada titrasi blanko (mL)
Vc = volume HCl yang dibutuhkan pada titrasi contoh (mL)
N HCl = normalitas HCl
Penentuan Kondisi Optimum Adsorpsi
Sebanyak 2.5 g zeolit tanpa modifikasi dan zeolit modifikasi dimasukkan kedalam 10 mL larutan kromium(VI) dengan ragam konsentrasi awal 150, 250, dan 350 ppm serta pH 2, 3.5, dan 5, kemudian larutan dikocok dengan shaker. Adsorpsi dilakukan dengan variasi waktu adsorpsi 20, 23, dan 26 jam. Setelah itu, campuran disaring, dan filtrat dianalisis kadar kromium(VI)-nya dengan spektrofotometer UV-Vis. Penentuan kondisi optimum adsorpsi dilakukan menggunakan metode response surface dengan rancangan acak lengkap faktorial. Kondisi yang digunakan sebagai faktor adalah waktu adsorpsi, pH, dan konsentrasi awal larutan kromium(VI) sedangkan responnya kapasitas adsorpsi (Q). Kapasitas adsorpsi dihitung dengan cara:
Q =
m
C)
V(C
o−
Keterangan:
Q = kapasitas adsorpsi (mg/g) V = volume larutan (L)
Co = konsentrasi Cr (VI) awal (ppm)
C = konsentrasi Cr (VI) sisa (ppm) m = massa zeolit (g)
Penentuan Isoterm Adsorpsi
Sebanyak 2.5 g zeolit tanpa modifikasi dan zeolit modifikasi dimasukkan ke dalam 10 mL larutan kromium(VI) dengan variasi konsentrasi 150, 200, 250, 300, dan 350 ppm pada kondisi pH optimum dan dikocok dengan shaker selama waktu optimum. Campuran disaring, lalu filtrat dianalisis kadar kromium(VI)-nya dengan spektrofotometer UV-Vis. Kemudian dibuat persamaan regresi linier menggunakan persamaan Langmuir dan Freundlich untuk menentukan tipe isoterm yang sesuai (Atkins 1999).
Analisis Kromium
Analisis kromium dilakukan dengan cara memasukkan sejumlah larutan kromium(VI) yang akan diukur kedalam labu takar 50 mL. Kemudian ditambahkan 5 tetes H2SO4 0.2 N
dan 5 tetes H3PO4 85% (sampai pH 1.2),
diencerkan dengan air bebas ion sampai tanda tera dan dikocok sampai bercampur merata, ditambahkan 1.0 mL larutan difenilkarbazida dan dikocok. Setelah didiamkan selama 5-10 menit larutan diukur dengan spektrofotometer UV-Vispada λ 540 nm (Clesceri et al. 2005).
Pembuatan kurva standar diawali dengan menyiapkan larutan standar kromium(VI) berbagai konsentrasi, yaitu 0.1, 0.2, 0.4, 0.6, 0.8, dan 1.0 ppm, lalu masing-masing dipipet dan dimasukkan kedalam tabung reaksi. Blanko dibuat dengan menggantikan larutan standar oleh air bebas ion dalam jumlah yang sama. Selanjutnya larutan-larutan ini diukur serapannya dan dibuat kurva standar hubungan antara konsentrasi kromium(VI) dan serapan untuk menentukan konsentrasi kromium contoh.
Desorpsi
Sebanyak 2.5 g zeolit tanpa modifikasi dan zeolit modifikasi dimasukkan kedalam 3 buah Erlenmeyer dan direndam dalam 10 mL larutan kromium(VI) dengan konsentrasi dan pH optimum yang diperoleh, dikocok selama waktu adsorpsi optimumnya. Selanjutnya campuran disaring dan filtrat dianalisis kadar kromium(VI)-nya.
Residunya dimasukkan ke dalam Erlenmeyer dan direndam dengan akuades sebanyak 10 mL pada Erlenmeyer pertama, HCl 1 M sebanyak 10 mL pada Erlenmeyer kedua, dan Na2EDTA 0.05 M sebanyak 10
kedua, dan 14 jam untuk Erlenmeyer ketiga. Setelah itu larutan disaring kembali, dan filtrat dianalisis kadar kromium(VI)-nya.
HASIL DAN PEMBAHASAN
Penentuan Kapasitas Tukar Kation
Kapasitas tukar kation (KTK) merupakan salah satu sifat kimia terpenting zeolit dalam hubungannya sebagai bahan adsorpsi. KTK dapat digunakan sebagai parameter kualitas zeolit. KTK merupakan ukuran jumlah kation yang dapat dipertukarkan. Kation-kation yang dapat dipertukarkan dari zeolit adalah kation yang tidak terikat secara kuat di dalam kerangka tetrahedral zeolit sehingga dengan mudah akan dipertukarkan melalui penggantian oleh H+ pada pencucian asam. Pengubahan menjadi bentuk H-zeolit hanya merupakan proses pertukaran ion tanpa mengubah kerangka silika-alumina zeolit. Pencucian oleh asam selain menukarkan kation juga menghilangkan kation pengotor yang menutupi rongga zeolit seperti oksida-oksida logam termasuk silika dan alumina bebas.
Kemampuan pertukaran zeolit merupakan fungsi dari tingkat substitusi Al terhadap Si pada struktur bangun zeolit. Hal ini dikarenakan semakin tinggi tingkat substitusi Al terhadap Si maka muatan negatif yang dihasilkan pada kerangka zeolit semakin banyak. Semakin banyak muatan negatif maka semakin banyak pula jumlah kation NH4+
yang diperlukan untuk menetralkannya. Oleh karena itu, nilai kapasitas tukar kation akan meningkat. Hal ini dapat dilihat nilai KTK zeolit teraktivasi lebih besar nilainya dibandingkan dengan zeolit awal sebelum diaktivasi (Tabel 3). Hasil ini mendukung simpulan Haryati (2007) bahwa aktivasi oleh asam dapat meningkatkan KTK.
Tabel 3 Data kapasitas tukar kation Sampel KTK (mek/
100g) Zeolit awal 56.36 Zeolit teraktivasi 61.62
Zeolit-HDTMABr
50 % KTK 57.14 100 % KTK 57.67 200 % KTK 58.89 Nilai KTK zeolit teraktivasi berada dibawah nilai KTK kriteria zeolit dengan kualitas tinggi (80-200 mek/100g). Hal ini dimungkinkan terjadinya dealuminasi
sebagian Al pada kerangka klinoptilolit akibat pengasaman, sehingga tingkat substitusi Al terhadap Si turun dan rasio Si/Al mengalami peningkatan. Dengan demikian, muatan negatif zeolit menjadi lebih sedikit dan banyaknya kation yang dapat dipertukarkan menjadi berkurang.
Hasil pengujian nilai KTK zeolit termodifikasi pada berbagai komposisi HDTAMBr dengan dosis 50%, 100%, dan 200% nilai KTK berturut-turut sebesar 57.14; 57.67; dan 58.89 mek/100g. Semakin besar dosis HDTMABr yang digunakan untuk memodifikasi zeolit, hanya menurunkan sedikit nilai KTK setelah aktivasi. Hal ini dikarenakan, ukuran molekul HDTMABr lebih besar daripada ukuran pori dari permukaan zeolit. Sehingga pertukaran kation HDTMABr dengan kation yang terdapat pada zeolit hanya sebatas dengan kation pada permukaan luar dari zeolit. Karena besarnya ukuran molekul HDTMABr dibandingkan ukuran pori zeolit, sehingga kation yang berada dalam kerangka zeolit tidak dapat dipertukarkan (Nizam 2007).
Selain itu, dosis HDTMABr yang ditambahkan ke dalam zeolit berpengaruh pada mutu hasil pelapisan HDTMABr pada permukaan zeolit. Dosis HDTMABr yang tinggi dapat menyebabkan jumlah HDTMABr yang ditambahkan jumlahnya berlebihan yang menyebabkan terjadi lapisan ganda (bilayer) pada permukaan zeolit yang dapat menutup seluruh pemukaan luar zeolit, karena permukaan luar zeolit lebih kecil daripada molekul HDTMABr. Menurut Huasini (2003) hal ini justru tidak dikehendaki, karena permukaan zeolit yang terbentuk tidak mampu mengadsorpsi anion.
kedua, dan 14 jam untuk Erlenmeyer ketiga. Setelah itu larutan disaring kembali, dan filtrat dianalisis kadar kromium(VI)-nya.
HASIL DAN PEMBAHASAN
Penentuan Kapasitas Tukar Kation
Kapasitas tukar kation (KTK) merupakan salah satu sifat kimia terpenting zeolit dalam hubungannya sebagai bahan adsorpsi. KTK dapat digunakan sebagai parameter kualitas zeolit. KTK merupakan ukuran jumlah kation yang dapat dipertukarkan. Kation-kation yang dapat dipertukarkan dari zeolit adalah kation yang tidak terikat secara kuat di dalam kerangka tetrahedral zeolit sehingga dengan mudah akan dipertukarkan melalui penggantian oleh H+ pada pencucian asam. Pengubahan menjadi bentuk H-zeolit hanya merupakan proses pertukaran ion tanpa mengubah kerangka silika-alumina zeolit. Pencucian oleh asam selain menukarkan kation juga menghilangkan kation pengotor yang menutupi rongga zeolit seperti oksida-oksida logam termasuk silika dan alumina bebas.
Kemampuan pertukaran zeolit merupakan fungsi dari tingkat substitusi Al terhadap Si pada struktur bangun zeolit. Hal ini dikarenakan semakin tinggi tingkat substitusi Al terhadap Si maka muatan negatif yang dihasilkan pada kerangka zeolit semakin banyak. Semakin banyak muatan negatif maka semakin banyak pula jumlah kation NH4+
yang diperlukan untuk menetralkannya. Oleh karena itu, nilai kapasitas tukar kation akan meningkat. Hal ini dapat dilihat nilai KTK zeolit teraktivasi lebih besar nilainya dibandingkan dengan zeolit awal sebelum diaktivasi (Tabel 3). Hasil ini mendukung simpulan Haryati (2007) bahwa aktivasi oleh asam dapat meningkatkan KTK.
Tabel 3 Data kapasitas tukar kation Sampel KTK (mek/
100g) Zeolit awal 56.36 Zeolit teraktivasi 61.62
Zeolit-HDTMABr
50 % KTK 57.14 100 % KTK 57.67 200 % KTK 58.89 Nilai KTK zeolit teraktivasi berada dibawah nilai KTK kriteria zeolit dengan kualitas tinggi (80-200 mek/100g). Hal ini dimungkinkan terjadinya dealuminasi
sebagian Al pada kerangka klinoptilolit akibat pengasaman, sehingga tingkat substitusi Al terhadap Si turun dan rasio Si/Al mengalami peningkatan. Dengan demikian, muatan negatif zeolit menjadi lebih sedikit dan banyaknya kation yang dapat dipertukarkan menjadi berkurang.
Hasil pengujian nilai KTK zeolit termodifikasi pada berbagai komposisi HDTAMBr dengan dosis 50%, 100%, dan 200% nilai KTK berturut-turut sebesar 57.14; 57.67; dan 58.89 mek/100g. Semakin besar dosis HDTMABr yang digunakan untuk memodifikasi zeolit, hanya menurunkan sedikit nilai KTK setelah aktivasi. Hal ini dikarenakan, ukuran molekul HDTMABr lebih besar daripada ukuran pori dari permukaan zeolit. Sehingga pertukaran kation HDTMABr dengan kation yang terdapat pada zeolit hanya sebatas dengan kation pada permukaan luar dari zeolit. Karena besarnya ukuran molekul HDTMABr dibandingkan ukuran pori zeolit, sehingga kation yang berada dalam kerangka zeolit tidak dapat dipertukarkan (Nizam 2007).
Selain itu, dosis HDTMABr yang ditambahkan ke dalam zeolit berpengaruh pada mutu hasil pelapisan HDTMABr pada permukaan zeolit. Dosis HDTMABr yang tinggi dapat menyebabkan jumlah HDTMABr yang ditambahkan jumlahnya berlebihan yang menyebabkan terjadi lapisan ganda (bilayer) pada permukaan zeolit yang dapat menutup seluruh pemukaan luar zeolit, karena permukaan luar zeolit lebih kecil daripada molekul HDTMABr. Menurut Huasini (2003) hal ini justru tidak dikehendaki, karena permukaan zeolit yang terbentuk tidak mampu mengadsorpsi anion.
Kondisi Optimum Adsorpsi Zeolit Tanpa Modifikasi
Penentuan kondisi optimum adsorpsi zeolit tanpa modifikasi (ZTM) dilakukan dengan mengukur 3 parameter, yaitu waktu adsorpsi, konsentrasi awal, dan pH larutan kromium(VI). Hasil penelitian menunjukan bahwa kondisi optimum adsorpsi kromium(VI) oleh zeolit tanpa modifikasi diperoleh pada waktu adsorpsi 20 jam, konsentrasi awal larutan kromium(VI) 350 ppm pada pH 3.5 (Tabel 4).
Tabel 4 Kondisi optimum adsorpsi zeolit tanpa modifikasi
Parameter Kondisi Optimum
Q
(mg/g) Waktu 20 jam
0.74 Konsentrasi 350 ppm
pH 3.5
Pada kondisi optimum diperoleh nilai kapasitas adsorpsi (Q) sebesar 0.74 mg/g. Artinya, setiap 1 g zeolit mengadsorpsi 0.74 mg kromium(VI). Data selengkapnya dapat dilihat pada Lampiran 3 dan 4.
Waktu optimum adsorpsi yang diperoleh adalah 20 jam. Waktu optimum merupakan waktu terjadi keadaan kesetimbangan antara laju adsorpsi dan desorpsi (Alias et al. 2008). Setelah melewati 20 jam, kapasitas adsorpsi mengalami penurunan (Lampiran 5). Hal ini menunjukkan pada waktu pengocokkan 20 jam, kontak antara zeolit sebagai adsorben dan larutan kromium(VI) sebagai adsorbat telah mengalami kesetimbangan. Akibatnya permukaan zeolit seluruhnya mengadsorpsi ion kromium(VI). Apabila dilanjutkan, kemungkinan akan terjadi proses desorpsi adsorbat yang telah teradsorpsi.
Adsorpsi kromium(VI) oleh zeolit dipengaruhi oleh pH larutan kromium(VI). Kapasitas adsorpsi kromium(VI) pada zeolit tanpa modifikasi optimum berlangsung pada pH larutan kromium(VI) sebesar 3.5. Menurut Alias et al. (2008) bentuk ion kromium (VI) pada kisaran pH 2-6 adalah ion HCrO4- dan
dikromat (Cr2O72-). Oleh karena itu, anion
kromium(VI) yang paling dominan terdapat di dalam larutan pada pH 3.5 dan diadsorpsi zeolit tanpa modifikasi adalah ion HCrO4
-. Secara umum kapasitas adsorpsi mengalami peningkatan dengan turunnya pH dan mengalami penurunan dengan naiknya pH. Peningkatan dan penurunan kapasitas adsorpsi tersebut 0.01-0.03 mg/g (Lampiran
4). Peningkatan kapasitas adsorpsi kromium(VI) pada suasana asam ini diduga karena pada larutan terjadi kesetimbangan kromat-dikromat, pada pH rendah terdapat kromium(VI) dalam bentuk ion dikromat (Cr2O72-) yang lebih mudah masuk dan
teradsorpsi pada zeolit dibandingkan dengan bentuk ion kromat (CrO4
2-). Hal ini disebabkan bentuk molekul dikromat yang lebih sesuai dengan rongga zeolit (Alias et al. 2008). Penurunan kapasitas adsorpsi dengan kenaikan pH hal ini kemungkinan karena terjadi penurunan gaya elektrostatis dari interaksi antara adsorben dan adsorbat (Wang XS et al. 2008).
Zeolit merupakan mineral silikat yang termasuk ke dalam group tektosilikat dengan pola susunan tetrahedron-SiO4 dan AlO4
membentuk pola tenunan, dengan energi ikatan total sebesar 155.500 kg kal/mol (Paton 1978). Pada zeolit terjadi penggantian isomorfis 1 sampai 2 atom Si oleh Al sehingga menjadi bermuatan negatif 1-2. Muatan negatif ini merupakan muatan tetap
(permanent charge) sehingga tidak
terpengaruh oleh perubahan pH lingkungannya ( Ismangil & Hanudin 2005). Oleh karena itu, pengaruh pH larutan kromium(VI) tidak akan memengaruhi muatan negatif kerangka satuan tetrahedron-SiO4 dan AlO4 stuktur zeolit.
Group mineral tektosilikat mempunyai nilai pH abrasi 7-9. Nilai pH abrasi merupakan indikasi ketahanan ikatan antarsatuan dan antarkerangka satuan tetrahedron-SiO4 dan AlO4. Mineral
tektosilikat mempunyai nilai pH abrasi 7-9, artinya ikatan O-Si-O dan O-Al-O dalam rantai tetrahedron akan terdegradasi dalam larutan yang bernilai pH 7-9 (Birkeland 1974). Nilai pH larutan kromium(VI) optimum pada zeolit tanpa modifikasi (3.5) berada di bawah nilai pH abrasi (7-9). Oleh karena itu, pengaruh pH larutan kromium(VI) tidak akan menyebabkan terdegradasinya kerangka satuan tetrahedron-SiO4 dan AlO4 stuktur
zeolit.
Pengaruh konsentrasi pada kapasitas adsorpsi menunjukkan semakin tinggi konsentrasi awal larutan kalium dikromat, semakin meningkatkan nilai kapasitas adsorpsinya (Lampiran 4). Verma et al.
kapasitas adsorpsinya juga meningkat. Konsentrasi awal larutan kromium(VI) yang diperoleh adalah 350 ppm. Nilai ini belum dapat dikatakan sebagai nilai optimum, melainkan nilai terbaik yang diperoleh melalui percobaan karena mungkin saja apabila konsentrasi dinaikkan maka kapasitas adsorpsi akan semakin meningkat (Lampiran 5).
Kondisi Optimum Adsorpsi Zeolit Modifikasi
Penentuan kondisi optimum adsorpsi zeolit modifikasi menggunakan parameter yang sama dengan zeolit tanpa modifikasi. Berdasarkan penelitian, kondisi optimum adsorpsi kromium(VI) oleh zeolit modifikasi (ZM) diperoleh pada waktu adsorpsi 23 jam, konsentrasi awal larutan kromium(VI) 350 ppm pada pH 5 (Tabel 5).
Tabel 5 Kondisi optimum adsorpsi zeolit modifikasi.
Parameter Kondisi Optimum
Q
(mg/g) Waktu 23 jam
1.40 Konsentrasi 350 ppm
pH 5
Pada kondisi optimum tersebut diperoleh kapasitas adsorpsi (Q) sebesar 1.40 mg/g. Artinya, setiap 1 g zeolit mengadsorpsi 1.40 mg kromium(VI). Sama halnya dengan zeolit tanpa modifikasi, nilai ini bukanlah nilai kapasitas adsorpsi maksimum, akan tetapi pada kondisi tersebut memiliki nilai yang paling tinggi. Data selengkapnya dapat dilihat pada Lampiran 6 dan 7.
Waktu optimum adsorpsi yang diperoleh adalah 23 jam. Grafik hubungan antara kapasitas adsorpsi dan waktu adsorpsi dapat dilihat pada Lampiran 8. Setelah melewati 23 jam, proses adsorpsi kromium(VI) mengalami penurunan yang cukup tajam. Waktu adsorpsi yang diperlukan oleh zeolit modifikasi agar terjadi kesetimbangan antara adsorben dan adsorbat, lebih lama dibandingkan dengan zeolit tanpa modifikasi. Hal ini disebabkan permukaan zeolit telah tersalut oleh HDTMABr sehingga ketersediaan tapak aktif untuk mengikat ion kromium(VI) meningkat.
Dengan demikian, tapak aktif dalam jumlah besar membutuhkan waktu kesetimbangan yang lebih lama agar terjadinya interaksi antara tapak aktif pada zeolit modifikasi dan ion kromium(VI). Penurunan kapasitas adsorpsi setelah
mencapai nilai optimum dimungkinkan oleh pelepasan ikatan antara tapak aktif pada zeolit modifikasi dengan ion kromium(VI) akibat semakin lamanya waktu kontak antara adsorben dan adsorbat. Hal ini memperkuat laporan Suardana (2008) menyatakan bahwa waktu kontak antara adsorben dan adsorbat yang melebihi waktu optimum dapat menyebabkan desorpsi.
Berdasarkan Lampiran 8 terlihat bahwa kenaikan konsentrasi berbanding lurus dengan kenaikan kapasitas adsorpsi. Hal ini karena semakin tinggi konsentrasi, jumlah ion kromium(VI) yang terikat dengan adsorben semakin banyak sehingga nilai kapasitas adsorpsi semakin meningkat. Konsentrasi awal larutan kromium(VI) optimum yang diperoleh adalah 350 ppm. Nilai ini belum dapat dikatakan sebagai kondisi optimum, melainkan nilai terbaik yang diperoleh melalui percobaan karena mungkin saja jika konsentrasi dinaikkan lagi maka kapasitas adsorpsi masih akan terus mengalami peningkatan.
Kondisi pH optimum yang diperoleh sebesar 5. Hal ini mengindikasikan bentuk ion kromium(VI) pada larutan kromium(VI) pH 5 dan teradsorpsi pada zeolit modifikasi berada dalam dikromat (Cr2O72-) (Alias et al. 2008).
Kondisi pH optimum tersebut berada di bawah nilai pH abrasi 7-9 ( Ismangil & Hanudin 2005) sehingga tidak akan menyebabkan terdegradasinya kerangka satuan tetrahedron-SiO4 dan AlO4 stuktur
zeolit.
Perbandingan Kapasitas Adsorpsi Kromium(VI)
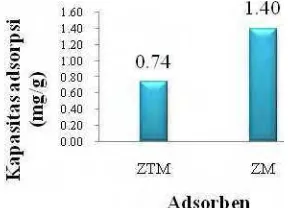
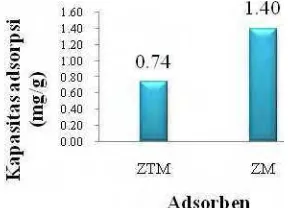
Perbandingan antara kapasitas adsorpsi kromium (VI) dari zeolit tanpa modifikasi (ZTM) dan zeolit modifikasi (ZM) dapat dilihat pada Gambar 8.
Kapasitas adsorpsi kromium(VI) oleh ZM lebih tinggi dibandingkan dengan ZTM berturut-turut sebesar 1.40 dan 0.74 mg/g. Hal ini menunjukkan bahwa pada zeolit yang dimodifikasi telah terjadi penempelan HDTMABr pada permukaan zeolit dan membentuk bilayer. Lapisan bilayer tersebut menyebabkan zeolit yang awalnya bermuatan negatif menjadi bermuatan positif (Li 1997) sehingga adsorpsi zeolit terhadap kromium(VI) semakin meningkat. Hasil ini membuktikan bahwa penempelan HDTMABr pada zeolit dapat meningkatkan daya adsorpsinya terhadap anion dibandingkan zeolit tanpa modifikasi.
Isoterm Adsorpsi
Pola isoterm adsorpsi ZTM dan ZM diuji dengan pola isoterm adsorpsi Freundlich dan Langmuir. Uji pola isoterm adsorpsi Freundlich dilakukan dengan membuat kurva hubungan log (x/m) terhadap log c. Sementara pengujian pola isoterm adsorpsi Langmuir dilakukan dengan dengan cara membuat kurva hubungan c/(x/m) terhadap c. Pola adsorpsi ditentukan dengan cara membandingkan linearitas kurva yang ditunjukkan oleh harga
R2. Harga R2 yang dapat diterima adalah ≥0.95 atau ≥95% (Suardana 2008).
Sebagaimana ditunjukkan pada Gambar 9 dan 10 yang berasal dari pengolahan data pada Lampiran 9, adsorpsi kromium(VI) oleh zeolit tanpa modifikasi menunjukkan pola isoterm Freundlich dengan linearitas sebesar 97.30% (Gambar 9) sedangkan isoterm Langmuir memiliki linearitas sebesar 93.40% (Gambar 10).
Gambar 9 Isoterm Freundlich adsorpsi kromium(VI) oleh zeolit tanpa modifikasi.
Gambar 10 Isoterm Langmuir adsorpsi kromium(VI) oleh zeolit tanpa modifikasi.
Berdasarkan data tersebut dapat disimpulkan bahwa proses adsorpsi kromium(VI) oleh ZTM mengikuti tipe isoterm Freundlich, karena linearitas untuk tipe isoterm ini lebih besar. Pada isoterm Freundlich hanya melibatkan gaya Van der Waals sehingga ikatan antara adsorbat dengan adsorben bersifat lemah. Hal ini memungkinkan adsorbat leluasa bergerak hingga akhirnya berlangsung proses adsorpsi banyak lapisan.
Isoterm adsorpsi kromium(VI) oleh ZM menunjukkan hasil yang sama dengan ZTM. Gambar 11 dan Gambar 12 yang berasal dari pengolahan data pada Lampiran 10 menunjukkan bahwa isoterm Freundlich memiliki linearitas sebesar 95.14%. Nilai ini jauh melampaui isoterm Langmuir yang hanya memiliki linearitas sebesar 29.89%. Hal ini menunjukkan bahwa adsorpsi kromium(VI) oleh zeolit modifikasi mengikuti tipe isoterm Freundlich.
Gambar 12 Isoterm Langmuir adsorpsi kromium(VI) oleh zeolit modifikasi.
Desorpsi
Desorpsi merupakan proses pelepasan kembali ion/molekul yang telah berikatan dengan gugus aktif pada adsorben. Hasil desorpsi dengan menggunakan akuades, HCl 1 M, dan Na2EDTA 0.05 M pada zeolit tanpa
modifikasi dan zeolit modifikasi disajikan pada Tabel 6.
Tabel 6 Hasil desorpsi ion kromium (VI) dari adsorben
Adsorben
Jumlah Cr (VI) terdesorpsi (%)
Akuades HCl 1 M
Na2EDTA 0.05 M
ZTM 30.56 31.28 0.01 ZM 0.33 0.06 0.01 Hasil desorpsi dengan menggunakan akuades, HCl 1M, dan Na2EDTA 0.05 M, jumlah ion
logam kromium(VI) yang terdesorpsi pada ZTM berturut-turut sebesar 30.56, 31.28, dan 0.01%. Sedangkan jumlah ion logam kromium(VI) yang terdesorpsi pada ZM berturut-turut sebesar 0.33, 0.06, dan 0.01%. Data lengkap pada Lampiran 11-12.
Berdasarkan hasil tersebut dapat diketahui bahwa proses desorpsi kromium(VI) dari zeolit tanpa modifikasi cenderung lebih besar daripada zeolit modifikasi. Hal ini menunjukkan bahwa kromium(VI) teradsorpsi lebih kuat di dalam ZM dibandingkan dalam ZTM.
Jumlah ion kromium(VI) cukup banyak terdesorpsi pada ZTM dan ZM adalah dengan menggunakan akuades. Karena dengan waktu pengocokan selama 0.5 jam menggunakan akuades dapat mendesorpsi ion logam kromium (VI) yang terikat pada ZTM dan ZM cukup besar. Meskipun jumlah ion kromium(VI) pada ZTM paling banyak terdesorpsi menggunakan HCl, pelarut ini tidak dipilih sebagai pelarut pendesorpsi. Hal
ini dikarenakan bahaya dari cemaran palarut HCl yang apabila terionisasi melepaskan ion Cl- sebagai agen pengoksidasi yang dapat menyebabkan racun dibandingkan dengan akuades yang bersifat ramah lingkungan.
Ion kromium(VI) yang terdesorpsi cukup banyak pada ZTM dan ZM dengan pelarut akuades. Hal ini mengindikasikan bahwa interaksi yang mendominasi pada proses adsorpsi ion kromium (VI) pada zeolit tanpa modifikasi dan zeolit modifikasi adalah ikatan Van der Waals. Sehingga dapat diasumsikan mekanisme adsorpsi yang terjadi berlangsung secara fisika (fisisorpsi) (Atkins 1999).
.
SIMPULAN DAN SARAN
Simpulan
Kapasitas adsorpsi kromium(VI) oleh zeolit termodifikasi lebih tinggi dibandingkan zeolit tanpa modifikasi berturut-turut sebesar 1.40 dan 0.74 mg/g. Kondisi optimum adsorpsi zeolit tanpa modifikasi pada kromium(VI) diperoleh pada waktu adsorpsi 20 jam dan konsentrasi awal larutan kromium(VI) 350 ppm pada pH 3.5. Sementara kondisi optimum zeolit modifikasi pada kromium(VI) diperoleh pada waktu 23 jam dan konsentrasi awal larutan kromium(VI) 350 ppm pada pH 5. Tipe isoterm yang dianut oleh zeolit tanpa modifikasi dan zeolit modifikasi adalah tipe isoterm Freundlich. Jumlah ion logam kromium(VI) yang terdesorpsi pada zeolit tanpa modifikasi maupun zeolit modifikasi paling banyak terdesorpsi dengan menggunakan akuades berturut-turut sebesar 30.56 dan 0.33 %. Oleh karena itu, diasumsikan mekanisme interaksi yang dominan terjadi pada zeolit tanpa modifikasi dan zeolit modifikasi adalah ikatan Van der Waals.
Saran
Gambar 12 Isoterm Langmuir adsorpsi kromium(VI) oleh zeolit modifikasi.
Desorpsi
Desorpsi merupakan proses pelepasan kembali ion/molekul yang telah berikatan dengan gugus aktif pada adsorben. Hasil desorpsi dengan menggunakan akuades, HCl 1 M, dan Na2EDTA 0.05 M pada zeolit tanpa
modifikasi dan zeolit modifikasi disajikan pada Tabel 6.
Tabel 6 Hasil desorpsi ion kromium (VI) dari adsorben
Adsorben
Jumlah Cr (VI) terdesorpsi (%)
Akuades HCl 1 M
Na2EDTA 0.05 M
ZTM 30.56 31.28 0.01 ZM 0.33 0.06 0.01 Hasil desorpsi dengan menggunakan akuades, HCl 1M, dan Na2EDTA 0.05 M, jumlah ion
logam kromium(VI) yang terdesorpsi pada ZTM berturut-turut sebesar 30.56, 31.28, dan 0.01%. Sedangkan jumlah ion logam kromium(VI) yang terdesorpsi pada ZM berturut-turut sebesar 0.33, 0.06, dan 0.01%. Data lengkap pada Lampiran 11-12.
Berdasarkan hasil tersebut dapat diketahui bahwa proses desorpsi kromium(VI) dari zeolit tanpa modifikasi cenderung lebih besar daripada zeolit modifikasi. Hal ini menunjukkan bahwa kromium(VI) teradsorpsi lebih kuat di dalam ZM dibandingkan dalam ZTM.
Jumlah ion kromium(VI) cukup banyak terdesorpsi pada ZTM dan ZM adalah dengan menggunakan akuades. Karena dengan waktu pengocokan selama 0.5 jam menggunakan akuades dapat mendesorpsi ion logam kromium (VI) yang terikat pada ZTM dan ZM cukup besar. Meskipun jumlah ion kromium(VI) pada ZTM paling banyak terdesorpsi menggunakan HCl, pelarut ini tidak dipilih sebagai pelarut pendesorpsi. Hal
ini dikarenakan bahaya dari cemaran palarut HCl yang apabila terionisasi melepaskan ion Cl- sebagai agen pengoksidasi yang dapat menyebabkan racun dibandingkan dengan akuades yang bersifat ramah lingkungan.
Ion kromium(VI) yang terdesorpsi cukup banyak pada ZTM dan ZM dengan pelarut akuades. Hal ini mengindikasikan bahwa interaksi yang mendominasi pada proses adsorpsi ion kromium (VI) pada zeolit tanpa modifikasi dan zeolit modifikasi adalah ikatan Van der Waals. Sehingga dapat diasumsikan mekanisme adsorpsi yang terjadi berlangsung secara fisika (fisisorpsi) (Atkins 1999).
.
SIMPULAN DAN SARAN
Simpulan
Kapasitas adsorpsi kromium(VI) oleh zeolit termodifikasi lebih tinggi dibandingkan zeolit tanpa modifikasi berturut-turut sebesar 1.40 dan 0.74 mg/g. Kondisi optimum adsorpsi zeolit tanpa modifikasi pada kromium(VI) diperoleh pada waktu adsorpsi 20 jam dan konsentrasi awal larutan kromium(VI) 350 ppm pada pH 3.5. Sementara kondisi optimum zeolit modifikasi pada kromium(VI) diperoleh pada waktu 23 jam dan konsentrasi awal larutan kromium(VI) 350 ppm pada pH 5. Tipe isoterm yang dianut oleh zeolit tanpa modifikasi dan zeolit modifikasi adalah tipe isoterm Freundlich. Jumlah ion logam kromium(VI) yang terdesorpsi pada zeolit tanpa modifikasi maupun zeolit modifikasi paling banyak terdesorpsi dengan menggunakan akuades berturut-turut sebesar 30.56 dan 0.33 %. Oleh karena itu, diasumsikan mekanisme interaksi yang dominan terjadi pada zeolit tanpa modifikasi dan zeolit modifikasi adalah ikatan Van der Waals.
Saran
adanya modifikasi. Selain itu, pencirian zeolit dengan mikroskop elektron payaran (SEM) untuk mengetahui mikrostruktur pada permukaan zeolit setelah proses adsorpsi. Zeolit yang telah dilakukan proses desorpsi dilakukan uji regenerasi untuk mengetahui kemampuan zeolit tersebut dapat digunakan sebagai adsorben ion logam.
DAFTAR PUSTAKA
Alias MY, Nizam NA. 2009. Removal of Cr (VI) and As (V) from aqueous solutions by HDTMA-modified zeolite Y. Journal of
Hazardous Materials 162:1019–1024.
Al-Jabri M. 2008. Kajian metode penetapan kapasitas tukar kation zeolit sebagai pembenah tanah untuk lahan pertanian terdegradasi. Jurnal Standardisasi
10(2):56-59.
Aningrum S. 2006. Optimalisasi jerapan kromium trivalent oleh zeolit lampung dengan metode lapik tetap dan perlakuan kromium limbah penyamakan kulit [skripsi]. Bogor: Fakultas Metematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Atkins PW. 1999. Kimia Fisik. Irma IK, penerjemah. Jakarta: Erlangga. Terjemahan dari: Physical Chemistry.
Birkeland PW. 1974. Pedology, Weathering,
and Geomorphological Research. Toronto:
Oxford Univesity Press.
Clesceri LS, Greenberg AE, Eaton AD. 2005.
Standard Methods for Examination of
Water and Wastewater. Ed ke-21.
Washington DC: American Public Health Association.
Cotton FA, Wilkinson G. 1989. Kimia Anorganik Dasar. Suharto S, penerjemah. Jakarta: UI Pr. Terjemahan dari: Basic Inorganic Chemistry.
Diantariani NP, Sudiarta IW, Elantiani NK. 2008. Proses biosorpsi dan desorpsi ion Cr(VI) pada biosorben rumput laut Eucheuma spinosum. Jurnal Kimia
2(1):45-52.
Gottardi G. 1976. Mineralogy and crystal chemistry of zeolites. hal 31-44. Di dalam buku: Sand LB, Mumpton FA. In Natural
Zeolites: Occurrence, Properties, Use. New York: PergamonPr.
Haryati A. 2007. Perilaku krom heksavalen, krom trivalen dan krom limbah penyamakan kulit dalam interaksinya dengan zeolit [skripsi]. Bogor: Fakultas Metematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Hay RL. 1966. Zeolites and Zeolitic Reactions
in Sedimentary Rocks. California:
Department Geology and Geophysics, University of California, Berkeley.
Husaini, Soenara T. 2003. Modifikasi zeolit alam asal Cikalong Jawa Barat dengan hexadecil trimetil ammonia dan uji daya serapnya terhadap ion sulfat dan kromat. Jurnal Zeolit Indonesia 2:15-23.
Ismangil, Hanudin E. 2005. Degradasi mineral batuan oleh asam-asam organik. Jurnal Ilmu Tanah dan Lingkungan 5(1):1-17.
Jugade R, Joshi AP. 2006. Highly sensitive adsorptive stripping voltammetric method for the ultra-trace determination of chromium (VI). Anal Sci 22:571-574.
Kusnoputranto H. 1996. Toksikologi
Lingkungan Logam Toksik dan B-3.
Jakarta: Fakultas Kesehatan Masyarakat dan Pusat Penelitian Sumber Daya Manusia dan Lingkungan, Universitas Indonesia.
Li Z, Robert SB. 1997. Counterion effects on the sorption of cationic surfactant and chromate on natural clinoptilolite. Journal Environ Sci Technol 31:2407-2412.
Li Z. 1998. Chromate extraction from surfactant-modified zeolit surfaces. Journal Environ Qual 27:240-242.
McCabe WL et al. 2001. Unit Operation of
Chemical Engineering. Ed ke-6. New
York: McGraw Hill.
Ming DW, Mumpton. 1989. Zeolites in Soils. Di dalam: Dixon JB, Weed SB, editor.
Mineral in Soil Environments. Ed ke-2. Madison: Soil Science Society of America.
ADSORPSI DAN DESORPSI KROMIUM(VI) PADA ZEOLIT
ALAM ASAL LAMPUNG TERMODIFIKASI
HEKSADESILTRIMETILAMONIUM BROMIDA
DERY SUPRAYOGI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
adanya modifikasi. Selain itu, pencirian zeolit dengan mikroskop elektron payaran (SEM) untuk mengetahui mikrostruktur pada permukaan zeolit setelah proses adsorpsi. Zeolit yang telah dilakukan proses desorpsi dilakukan uji regenerasi untuk mengetahui kemampuan zeolit tersebut dapat digunakan sebagai adsorben ion logam.
DAFTAR PUSTAKA
Alias MY, Nizam NA. 2009. Removal of Cr (VI) and As (V) from aqueous solutions by HDTMA-modified zeolite Y. Journal of
Hazardous Materials 162:1019–1024.
Al-Jabri M. 2008. Kajian metode penetapan kapasitas tukar kation zeolit sebagai pembenah tanah untuk lahan pertanian terdegradasi. Jurnal Standardisasi
10(2):56-59.
Aningrum S. 2006. Optimalisasi jerapan kromium trivalent oleh zeolit lampung dengan metode lapik tetap dan perlakuan kromium limbah penyamakan kulit [skripsi]. Bogor: Fakultas Metematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Atkins PW. 1999. Kimia Fisik. Irma IK, penerjemah. Jakarta: Erlangga. Terjemahan dari: Physical Chemistry.
Birkeland PW. 1974. Pedology, Weathering,
and Geomorphological Research. Toronto:
Oxford Univesity Press.
Clesceri LS, Greenberg AE, Eaton AD. 2005.
Standard Methods for Examination of
Water and Wastewater. Ed ke-21.
Washington DC: American Public Health Association.
Cotton FA, Wilkinson G. 1989. Kimia Anorganik Dasar. Suharto S, penerjemah. Jakarta: UI Pr. Terjemahan dari: Basic Inorganic Chemistry.
Diantariani NP, Sudiarta IW, Elantiani NK. 2008. Proses biosorpsi dan desorpsi ion Cr(VI) pada biosorben rumput laut Eucheuma spinosum. Jurnal Kimia
2(1):45-52.
Gottardi G. 1976. Mineralogy and crystal chemistry of zeolites. hal 31-44. Di dalam buku: Sand LB, Mumpton FA. In Natural
Zeolites: Occurrence, Properties, Use. New York: PergamonPr.
Haryati A. 2007. Perilaku krom heksavalen, krom trivalen dan krom limbah penyamakan kulit dalam interaksinya dengan zeolit [skripsi]. Bogor: Fakultas Metematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Hay RL. 1966. Zeolites and Zeolitic Reactions
in Sedimentary Rocks. California:
Department Geology and Geophysics, University of California, Berkeley.
Husaini, Soenara T. 2003. Modifikasi zeolit alam asal Cikalong Jawa Barat dengan hexadecil trimetil ammonia dan uji daya serapnya terhadap ion sulfat dan kromat. Jurnal Zeolit Indonesia 2:15-23.
Ismangil, Hanudin E. 2005. Degradasi mineral batuan oleh asam-asam organik. Jurnal Ilmu Tanah dan Lingkungan 5(1):1-17.
Jugade R, Joshi AP. 2006. Highly sensitive adsorptive stripping voltammetric method for the ultra-trace determination of chromium (VI). Anal Sci 22:571-574.
Kusnoputranto H. 1996. Toksikologi
Lingkungan Logam Toksik dan B-3.
Jakarta: Fakultas Kesehatan Masyarakat dan Pusat Penelitian Sumber Daya Manusia dan Lingkungan, Universitas Indonesia.
Li Z, Robert SB. 1997. Counterion effects on the sorption of cationic surfactant and chromate on natural clinoptilolite. Journal Environ Sci Technol 31:2407-2412.
Li Z. 1998. Chromate extraction from surfactant-modified zeolit surfaces. Journal Environ Qual 27:240-242.
McCabe WL et al. 2001. Unit Operation of
Chemical Engineering. Ed ke-6. New
York: McGraw Hill.
Ming DW, Mumpton. 1989. Zeolites in Soils. Di dalam: Dixon JB, Weed SB, editor.
Mineral in Soil Environments. Ed ke-2. Madison: Soil Science Society of America.
WEDC International Conference on Water
Supply and Sanitation. Durban, South
Africa. 346-349.
Nizam NA. 2007. Surfactant Modified Zeolite Y as A Sorbent For Some Chromium And
Arsenic Species In Water. Malaysia:
Faculty of Science, Universiti Teknologi Malaysia.
Oscik J. 1982. Adsorption. New York: Halsted Pr.
Paton TR. 1978. The formation of soil
material. London: George Allen and
Unwin.
Priatna K, Suharto S, Syariffudin A. 1985. Prospek pemakaian zeolit Bayah sebagai penyerap NH4+ dalam air limbah.
Bandung: Laporan Teknik Pengembangan. 69. PPTM.
Setyawan D, Handoko P. 2002. Pengaruh perlakuan asam, hidrotermal dan impregnasi logam kromium pada zeolit alam dalam preparasi katalis. Jurnal Ilmu Dasar 3(2):103-109.
Setyawan D, Handoko P. 2003. Aktivitas katalis Cr/zeolit dalam reaksi konversi katalitik fenol dan metil isobutil keton. Jurnal Ilmu Dasar 4(2):70-76.
Soemirat J. 2002. Kesehatan Lingkungan. Yogyakarta: Gajah Mada University Pr.
Suardana. 2008. Optimalisasi Daya Adsorpsi Zeolit Terhadap Ion Kromium (III) Jurnal Penelitian dan Pengembangan Sain &
Humaniora 2(1):17-33.
Sutarti M, Rachmawati M. 1994. Zeolit:
Tinjauan literatur. Jakarta: Pusat
Dokumentasi dan Informasi Ilmu Pengetahuan Indonesia (LIPI).
Suyartono, Husaini. 1991. Tinjauan terhadap kegiatan penelitian karakterisasi dan
pemanfaatan zeolit Indonesia yang dilakukan PPTM Bandung Periode 1890-1991. Bandung: Buletin PPTM. JPPSH.
Suwardi. 1998. Penetapan Kualitas Mineral
Zeolit dan Prospeknya di Bidang
Pertanian. Bogor: Departemen
Manajemen Sumber Daya Lahan, Fakultas Pertanian, IPB.
Suwardi. 2000. Mineral Zeolit: Sifat-Sifat dan
Pemanfaatan di Bidang Pertanian. Bogor:
Departemen Manajemen Sumber Daya Lahan, Fakultas Pertanian, IPB.
Suwardi. 2000. Prospek Pengolahan Zeolit di
Indonesia. Bogor: Departemen
Manajemen Sumber Daya Lahan, Fakultas Pertanian, IPB.
Thamzil. 2005. Potensi Zeolit untuk Mengolah
Limbah Industri dan Radioaktif.
Tanggerang: Pusat Pengembangan Pengelolaan Limbah Radioaktif Badan Tenaga Nuklir Nasional (P2PLR BATAN), Kawasan Puspiptek Serpong.
Tominaga H. 1987. Chemistry and Application of Zeolites. Japan: Kodansha Scientific.
Verma A, Chakraborty S, Basu JK. 2006. Adsorption study of hexavalent chromium using tamarind hull-based adsorbents.
Separation and Purification Technology
50:336–341.
Vogel. 1990. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Edisi ke-5. Setiono L dan Pudjaatmaka AH, penerjemah. Jakarta: PT Kalman Media Pustaka. Terjemahan dari: Textbook of Macro and Semimicro Qualitatif Inorganic Analysis.
Xue So