SKRIPSI
PENENTUAN AKTIVITAS ANTIOKSIDAN RIMPANG SEGAR DAN RIMPANG BUBUK DENGAN UJI KADAR POLIFENOL DAN
ACTIVE OXYGEN METHOD (AOM)
Oleh :
CHRISTINE WUISAN F24103041
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PANGAN
PENENTUAN AKTIVITAS ANTIOKSIDAN RIMPANG SEGAR DAN RIMPANG BUBUK DENGAN UJI KADAR POLIFENOL DAN
ACTIVE OXYGEN METHOD (AOM)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pangan
Institut Pertanian Bogor
Oleh :
CHRISTINE WUISAN F24103041
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PANGAN
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PANGAN
PENENTUAN AKTIVITAS ANTIOKSIDAN RIMPANG SEGAR DAN RIMPANG BUBUK DENGAN UJI KADAR POLIFENOL DAN
ACTIVE OXYGEN METHOD (AOM)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pangan
Institut Pertanian Bogor
Oleh :
CHRISTINE WUISAN F24103041
Tanggal lulus : 22 Agustus 2007
Menyetujui,
Bogor, 23 Agustus 2007
Prof. Dr. Ir. H. Dedi Fardiaz, MSc Dosen Pembimbing
Mengetahui,
Dr. Ir. Dahrul Syah
RIWAYAT PENULIS
Penulis dilahirkan di Jakarta pada tanggal
17 November 1984 dan merupakan anak tunggal dari pasangan
Charles Wuisan dan Hilda. Pendidikan dasar sampai menengah
atas diselesaikan di sekolah Regina Pacis Bogor.
Penulis melanjutkan pendidikannya di Institut Pertanian
Bogor pada tahun 2003 melalui jalur USMI. Selama kuliah,
penulis aktif berorganisasi di Paduan Suara IPB Agria Swara sebagai staf dan
koordinator Divisi Pengembangan Sumber Daya Manusia, serta aktif mengisi
konser-konser yang diadakan Agria Swara dan beberapa paduan suara lainnya di
luar IPB. Prestasi internasional yang pernah diraih bersama Agria Swara adalah
Golden dan Silver Diplome pada the 4th Johannes-Brahms International Choir Competition and Festival di Wernigerode, Jerman pada tahun 2005.
Penulis juga aktif menjadi asisten praktikum Kimia Dasar I di Departemen
Kimia. Di waktu luangnya, penulis bekerja sebagai guru biola di sekolah Gema
Christine Wuisan. F24103041. Penentuan Aktivitas Antioksidan Rimpang Segar dan Rimpang Bubuk dengan Uji Kadar Polifenol dan Active Oxygen Method (AOM). Dibawah bimbingan: Prof. Dr. Ir. Dedi Fardiaz, MSc.
RINGKASAN
Oksigen sangat dibutuhkan tubuh namun juga merupakan senyawa radikal bebas, yang dapat menyebabkan berbagai penyakit sehingga tubuh memerlukan senyawa antioksidan. Antioksidan dapat melindungi senyawa lainnya dari oksigen dengan mereaksikan dirinya sendiri dengan oksigen. Rempah-rempah diketahui mengandung senyawa fenolik yang memiliki kapasitas antioksidan yang kuat.
Rimpang yang diteliti adalah lengkuas (Alpinia galanga), kencur (Kaemferia galanga L.), kunyit (Curcuma domestica Val), dan jahe (Zingiber officinale Rosc.). Sebagai tambahan perbandingan, diteliti juga bawang putih (Allium sativum L.) dan cengkeh (Syzygium aromaticum L.).
Kadar polifenol tertinggi dimiliki cengkeh, yaitu sebesar 619.94 mg/g solid untuk cengkeh segar dan 790.06 mg/g solid untuk cengkeh bubuk. Cengkeh mengandung kadar polifenol yang sangat tinggi karena cengkeh merupakan rempah utama penghasil eugenol dan senyawa galat. Kadar polifenol terendah dimiliki bawang putih, yaitu sebesar 2.81 mg/g solid untuk bawang putih segar dan 0.30 mg/g solid untuk bawang putih bubuk. Kadar polifenol yang rendah pada bawang putih disebabkan senyawa aktif dalam bawang putih, yaitu allicin bukan termasuk golongan polifenol, melainkan golongan thiosulfonat. Kencur, kunyit, dan bawang putih dalam bentuk segar memiliki kadar polifenol lebih tinggi daripada bentuk bubuknya, namun besarnya penurunan kadar polifenol berbeda-beda tergantung stabilitas masing-masing jenis polifenol. Lengkuas, jahe, dan cengkeh dalam bentuk bubuk memiliki kadar polifenol lebih tinggi dibandingkan bentuk segarnya karena terlepasnya polifenol terikat akibat perlakuan panas dan terbebasnya polifenol akibat kerusakan sel yang terjadi selama proses pengeringan.
Metode AOM dengan menggunakan alat Rancimat adalah metode untuk menentukan stabilitas minyak terhadap oksidasi yang dapat membuat minyak menjadi tengik. Waktu dimana jumlah senyawa volatil hasil oksidasi minyak meningkat dengan cepat disebut periode induksi. Rasio antara periode induksi sampel dan periode induksi standar (BHT) disebut faktor proteksi. Semakin tinggi faktor proteksi, semakin tinggi aktivitas antioksidan. Minyak yang dipilih sebagai media pada metode AOM adalah minyak dengan periode induksi terpendek, yaitu minyak kedelai merk Happy dengan periode induksi 7.67 jam.
meskipun terdapat dalam jumlah yang lebih banyak tetapi tidak meningkatkan aktivitas antioksidan rempah secara keseluruhan.
Hubungan kadar polifenol dan faktor proteksi menunjukkan kecenderungan meningkat. Semakin tinggi kadar polifenol, maka faktor proteksi juga akan semakin tinggi hingga mencapai batas tertentu. Peningkatan kadar polifenol pada kisaran 0-10 mg polifenol kurang berpengaruh terhadap peningkatan faktor proteksi sedangkan pada kisaran 10-20 mg polifenol, peningkatan kadar polifenol walaupun dalam jumlah sedikit dapat menyebabkan faktor proteksi mengalami banyak peningkatan. Peningkatan kadar polifenol pada kisaran 20-50 mg polifenol masih berpengaruh terhadap peningkatan faktor proteksi, meskipun tidak sebesar pengaruh peningkatan kadar polifenol pada kisaran 10-20 mg polifenol. Setelah melebihi 50 mg polifenol, peningkatan kadar polifenol walaupun dalam jumlah banyak tidak menyebabkan faktor proteksi mengalami banyak peningkatan. Hubungan kadar polifenol dan faktor proteksi tersebut dapat disebabkan perbedaan struktur polifenol dan kadar masing-masing jenis polifenol yang berbeda-beda pada setiap jenis rempah.
KATA PENGANTAR
Segala puji dan syukur hanya kepada Tuhan Yesus Kristus, karena berkat
kasih karunia dan perlindunganNya penulis dapat menyelesaikan tugas akhir ini.
Pada kesempatan ini, penulis juga menyampaikan terima kepada semua pihak
yang telah membantu penulis dalam penyusunan tugas akhir ini:
1. Prof. Dr. Ir. Dedi Fardiaz, MSc. selaku dosen pembimbing atas segala
bimbingan dan masukannya yang positif, serta pengorbanan waktunya baik
selama penelitian berlangsung maupun dalam penyelesaian skripsi ini.
2. Dr. Ir. Sukarno, MSi. dan Didah Nur Faridah STP, MSi. selaku dosen
penguji yang bersedia menyediakan waktu untuk menguji dan memberikan
masukan yang berguna bagi perbaikan skripsi ini.
3. Orang tua yang selalu memberikan dukungan moril dan materil.
4. Fany Nely (Nene), teman seperjuanganku. Terima kasih untuk segala ide
dan semangat selama penelitian ini berlangsung.
5. Para pegawai dan laboran ITP : Pak Sobirin, Mbak Yane, Mbak Ririn, pak
Rojak, Bu Rubiah, pak Misdi, pak Muchtadin, dan Mas Syamsu.
6. Kel atas kesediaannya mendengarkan segala keluhan dan memberikan saran.
7. Tia Hewan, my best roomate I’ve ever had, untuk semua pengalaman seru yang kita lewati bersama selama 4 tahun. Tidak lupa juga kepada Dhino,
Puri, mbak Ndung, dan teman-teman lain di Perwira 9.
8. Teman-teman TPG 40, khususnya teman sekos (Tya, Rika, Agnes, Anas), Aji, Andreas, Erick, dan teman-teman golongan B.
9. Teman-teman Agria Swara, khususnya Greth, Putri, dan Inge. Pengalaman
latihan sampai tengah malam, konser, dan ke Jerman tak akan terlupakan.
Penulis menyadari bahwa masih terdapat kekurangan dalam penelitian
maupun penyusunan tugas akhir ini. Oleh karena itu, kritik dan saran yang
membangun sangat penulis harapkan. Penulis berharap agar skripsi ini dapat
bermanfaat bagi semua pihak yang membutuhkan.
Bogor, 22 Agustus 2007
DAFTAR ISI
KATA PENGANTAR ... ...i
DAFTAR ISI ... ...ii
DAFTAR TABEL ... ...iv
DAFTAR GAMBAR ... ...v
DAFTAR LAMPIRAN ... ...vi
I. PENDAHULUAN ... ...1
A. Latar Belakang ... ...1
B. Tujuan Penelitian ... ...2
II. TINJAUAN PUSTAKA ... ...3
A. Rempah sebagai Sumber Antioksidan ... ...3
B. Lengkuas (Alpinia galanga L.) ... ...4
C. Kencur (Kaemferia galanga L.) ... ...5
D. Kunyit (Curcuma domestica Val.) ... ...6
E. Jahe (Zingiber officinale Rosc.) ... ...8
F. Cengkeh (Syzygium aromaticum L.) ... ...9
G. Bawang Putih (Allium sativum L.) ... ...11
H. Pengukuran Aktivitas Antioksidan dengan Uji Kadar Polifenol...12
I. Pengukuran Aktivitas Antioksidan berdasarkan Active Oxygen Method (AOM) ... ...14
III. METODOLOGI PENELITIAN ... ...18
A. Bahan dan Alat. ... ...18
B. Metode Penelitian ... ...18
1. Tahap Persiapan Sampel ... ...18
2. Uji Kadar Air (Park, 1996) ... ...19
3. Uji Kadar Polifenol (Oki et al, 2002)... ...19
4. Metode AOM (Beirao dan Bernardo-Gil, 2005) ... ...20
C. Perhitungan Hasil Pengamatan ... ...22
1. Uji Kadar Air ... ...22
2. Uji Polifenol ... ...22
IV. HASIL DAN PEMBAHASAN ... ...24
A. Kadar Polifenol ... ...24
B. Aktivitas Antioksidan berdasarkan metode AOM ... ...28
C. Hubungan Kadar Polifenol dan Aktivitas Antioksidan berdasarkan metode AOM ... ...32
V. KESIMPULAN DAN SARAN ... ...36
A. Kesimpulan ... ...36
B. Saran ... ...37
DAFTAR PUSTAKA ... ...38
SKRIPSI
PENENTUAN AKTIVITAS ANTIOKSIDAN RIMPANG SEGAR DAN RIMPANG BUBUK DENGAN UJI KADAR POLIFENOL DAN
ACTIVE OXYGEN METHOD (AOM)
Oleh :
CHRISTINE WUISAN F24103041
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PANGAN
PENENTUAN AKTIVITAS ANTIOKSIDAN RIMPANG SEGAR DAN RIMPANG BUBUK DENGAN UJI KADAR POLIFENOL DAN
ACTIVE OXYGEN METHOD (AOM)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pangan
Institut Pertanian Bogor
Oleh :
CHRISTINE WUISAN F24103041
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PANGAN
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PANGAN
PENENTUAN AKTIVITAS ANTIOKSIDAN RIMPANG SEGAR DAN RIMPANG BUBUK DENGAN UJI KADAR POLIFENOL DAN
ACTIVE OXYGEN METHOD (AOM)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pangan
Institut Pertanian Bogor
Oleh :
CHRISTINE WUISAN F24103041
Tanggal lulus : 22 Agustus 2007
Menyetujui,
Bogor, 23 Agustus 2007
Prof. Dr. Ir. H. Dedi Fardiaz, MSc Dosen Pembimbing
Mengetahui,
Dr. Ir. Dahrul Syah
RIWAYAT PENULIS
Penulis dilahirkan di Jakarta pada tanggal
17 November 1984 dan merupakan anak tunggal dari pasangan
Charles Wuisan dan Hilda. Pendidikan dasar sampai menengah
atas diselesaikan di sekolah Regina Pacis Bogor.
Penulis melanjutkan pendidikannya di Institut Pertanian
Bogor pada tahun 2003 melalui jalur USMI. Selama kuliah,
penulis aktif berorganisasi di Paduan Suara IPB Agria Swara sebagai staf dan
koordinator Divisi Pengembangan Sumber Daya Manusia, serta aktif mengisi
konser-konser yang diadakan Agria Swara dan beberapa paduan suara lainnya di
luar IPB. Prestasi internasional yang pernah diraih bersama Agria Swara adalah
Golden dan Silver Diplome pada the 4th Johannes-Brahms International Choir Competition and Festival di Wernigerode, Jerman pada tahun 2005.
Penulis juga aktif menjadi asisten praktikum Kimia Dasar I di Departemen
Kimia. Di waktu luangnya, penulis bekerja sebagai guru biola di sekolah Gema
Christine Wuisan. F24103041. Penentuan Aktivitas Antioksidan Rimpang Segar dan Rimpang Bubuk dengan Uji Kadar Polifenol dan Active Oxygen Method (AOM). Dibawah bimbingan: Prof. Dr. Ir. Dedi Fardiaz, MSc.
RINGKASAN
Oksigen sangat dibutuhkan tubuh namun juga merupakan senyawa radikal bebas, yang dapat menyebabkan berbagai penyakit sehingga tubuh memerlukan senyawa antioksidan. Antioksidan dapat melindungi senyawa lainnya dari oksigen dengan mereaksikan dirinya sendiri dengan oksigen. Rempah-rempah diketahui mengandung senyawa fenolik yang memiliki kapasitas antioksidan yang kuat.
Rimpang yang diteliti adalah lengkuas (Alpinia galanga), kencur (Kaemferia galanga L.), kunyit (Curcuma domestica Val), dan jahe (Zingiber officinale Rosc.). Sebagai tambahan perbandingan, diteliti juga bawang putih (Allium sativum L.) dan cengkeh (Syzygium aromaticum L.).
Kadar polifenol tertinggi dimiliki cengkeh, yaitu sebesar 619.94 mg/g solid untuk cengkeh segar dan 790.06 mg/g solid untuk cengkeh bubuk. Cengkeh mengandung kadar polifenol yang sangat tinggi karena cengkeh merupakan rempah utama penghasil eugenol dan senyawa galat. Kadar polifenol terendah dimiliki bawang putih, yaitu sebesar 2.81 mg/g solid untuk bawang putih segar dan 0.30 mg/g solid untuk bawang putih bubuk. Kadar polifenol yang rendah pada bawang putih disebabkan senyawa aktif dalam bawang putih, yaitu allicin bukan termasuk golongan polifenol, melainkan golongan thiosulfonat. Kencur, kunyit, dan bawang putih dalam bentuk segar memiliki kadar polifenol lebih tinggi daripada bentuk bubuknya, namun besarnya penurunan kadar polifenol berbeda-beda tergantung stabilitas masing-masing jenis polifenol. Lengkuas, jahe, dan cengkeh dalam bentuk bubuk memiliki kadar polifenol lebih tinggi dibandingkan bentuk segarnya karena terlepasnya polifenol terikat akibat perlakuan panas dan terbebasnya polifenol akibat kerusakan sel yang terjadi selama proses pengeringan.
Metode AOM dengan menggunakan alat Rancimat adalah metode untuk menentukan stabilitas minyak terhadap oksidasi yang dapat membuat minyak menjadi tengik. Waktu dimana jumlah senyawa volatil hasil oksidasi minyak meningkat dengan cepat disebut periode induksi. Rasio antara periode induksi sampel dan periode induksi standar (BHT) disebut faktor proteksi. Semakin tinggi faktor proteksi, semakin tinggi aktivitas antioksidan. Minyak yang dipilih sebagai media pada metode AOM adalah minyak dengan periode induksi terpendek, yaitu minyak kedelai merk Happy dengan periode induksi 7.67 jam.
meskipun terdapat dalam jumlah yang lebih banyak tetapi tidak meningkatkan aktivitas antioksidan rempah secara keseluruhan.
Hubungan kadar polifenol dan faktor proteksi menunjukkan kecenderungan meningkat. Semakin tinggi kadar polifenol, maka faktor proteksi juga akan semakin tinggi hingga mencapai batas tertentu. Peningkatan kadar polifenol pada kisaran 0-10 mg polifenol kurang berpengaruh terhadap peningkatan faktor proteksi sedangkan pada kisaran 10-20 mg polifenol, peningkatan kadar polifenol walaupun dalam jumlah sedikit dapat menyebabkan faktor proteksi mengalami banyak peningkatan. Peningkatan kadar polifenol pada kisaran 20-50 mg polifenol masih berpengaruh terhadap peningkatan faktor proteksi, meskipun tidak sebesar pengaruh peningkatan kadar polifenol pada kisaran 10-20 mg polifenol. Setelah melebihi 50 mg polifenol, peningkatan kadar polifenol walaupun dalam jumlah banyak tidak menyebabkan faktor proteksi mengalami banyak peningkatan. Hubungan kadar polifenol dan faktor proteksi tersebut dapat disebabkan perbedaan struktur polifenol dan kadar masing-masing jenis polifenol yang berbeda-beda pada setiap jenis rempah.
KATA PENGANTAR
Segala puji dan syukur hanya kepada Tuhan Yesus Kristus, karena berkat
kasih karunia dan perlindunganNya penulis dapat menyelesaikan tugas akhir ini.
Pada kesempatan ini, penulis juga menyampaikan terima kepada semua pihak
yang telah membantu penulis dalam penyusunan tugas akhir ini:
1. Prof. Dr. Ir. Dedi Fardiaz, MSc. selaku dosen pembimbing atas segala
bimbingan dan masukannya yang positif, serta pengorbanan waktunya baik
selama penelitian berlangsung maupun dalam penyelesaian skripsi ini.
2. Dr. Ir. Sukarno, MSi. dan Didah Nur Faridah STP, MSi. selaku dosen
penguji yang bersedia menyediakan waktu untuk menguji dan memberikan
masukan yang berguna bagi perbaikan skripsi ini.
3. Orang tua yang selalu memberikan dukungan moril dan materil.
4. Fany Nely (Nene), teman seperjuanganku. Terima kasih untuk segala ide
dan semangat selama penelitian ini berlangsung.
5. Para pegawai dan laboran ITP : Pak Sobirin, Mbak Yane, Mbak Ririn, pak
Rojak, Bu Rubiah, pak Misdi, pak Muchtadin, dan Mas Syamsu.
6. Kel atas kesediaannya mendengarkan segala keluhan dan memberikan saran.
7. Tia Hewan, my best roomate I’ve ever had, untuk semua pengalaman seru yang kita lewati bersama selama 4 tahun. Tidak lupa juga kepada Dhino,
Puri, mbak Ndung, dan teman-teman lain di Perwira 9.
8. Teman-teman TPG 40, khususnya teman sekos (Tya, Rika, Agnes, Anas), Aji, Andreas, Erick, dan teman-teman golongan B.
9. Teman-teman Agria Swara, khususnya Greth, Putri, dan Inge. Pengalaman
latihan sampai tengah malam, konser, dan ke Jerman tak akan terlupakan.
Penulis menyadari bahwa masih terdapat kekurangan dalam penelitian
maupun penyusunan tugas akhir ini. Oleh karena itu, kritik dan saran yang
membangun sangat penulis harapkan. Penulis berharap agar skripsi ini dapat
bermanfaat bagi semua pihak yang membutuhkan.
Bogor, 22 Agustus 2007
DAFTAR ISI
KATA PENGANTAR ... ...i
DAFTAR ISI ... ...ii
DAFTAR TABEL ... ...iv
DAFTAR GAMBAR ... ...v
DAFTAR LAMPIRAN ... ...vi
I. PENDAHULUAN ... ...1
A. Latar Belakang ... ...1
B. Tujuan Penelitian ... ...2
II. TINJAUAN PUSTAKA ... ...3
A. Rempah sebagai Sumber Antioksidan ... ...3
B. Lengkuas (Alpinia galanga L.) ... ...4
C. Kencur (Kaemferia galanga L.) ... ...5
D. Kunyit (Curcuma domestica Val.) ... ...6
E. Jahe (Zingiber officinale Rosc.) ... ...8
F. Cengkeh (Syzygium aromaticum L.) ... ...9
G. Bawang Putih (Allium sativum L.) ... ...11
H. Pengukuran Aktivitas Antioksidan dengan Uji Kadar Polifenol...12
I. Pengukuran Aktivitas Antioksidan berdasarkan Active Oxygen Method (AOM) ... ...14
III. METODOLOGI PENELITIAN ... ...18
A. Bahan dan Alat. ... ...18
B. Metode Penelitian ... ...18
1. Tahap Persiapan Sampel ... ...18
2. Uji Kadar Air (Park, 1996) ... ...19
3. Uji Kadar Polifenol (Oki et al, 2002)... ...19
4. Metode AOM (Beirao dan Bernardo-Gil, 2005) ... ...20
C. Perhitungan Hasil Pengamatan ... ...22
1. Uji Kadar Air ... ...22
2. Uji Polifenol ... ...22
IV. HASIL DAN PEMBAHASAN ... ...24
A. Kadar Polifenol ... ...24
B. Aktivitas Antioksidan berdasarkan metode AOM ... ...28
C. Hubungan Kadar Polifenol dan Aktivitas Antioksidan berdasarkan metode AOM ... ...32
V. KESIMPULAN DAN SARAN ... ...36
A. Kesimpulan ... ...36
B. Saran ... ...37
DAFTAR PUSTAKA ... ...38
DAFTAR TABEL
Tabel 1. Senyawa antioksidan yang telah berhasil diisolasi dari rempah-rempah (Pokorny et al., 2001) ... ...4 Tabel 2. Hasil metode AOM untuk seleksi minyak sebagai media pada alat
Rancimat ... ... 29
Tabel 3. Komponen asam lemak pada minyak kedelai, minyak jagung, dan minyak zaitun (Almatsier, 2002) ... ...30
Tabel 4. Komponen minyak kedelai mentah dan minyak kedelai yang dimurnikan (Hui, 1996) ... ...30
Tabel 5. Aktivitas antioksidan berdasarkan metode AOM ...31
DAFTAR GAMBAR
Gambar 1. Lengkuas (Alpinia galanga L.) ... ...5 Gambar 2. Kencur (Kaemferia galanga L.) ... ...6 Gambar 3. Kunyit (Curcuma domestica Val.) ... ...6 Gambar 4. Struktur kimia senyawa curcumin pada kunyit (Tiwari et al., 2006)..7 Gambar 5. Jahe putih besar (Zingiber officinale Rosc.) ... ...8 Gambar 6. Struktur kimia senyawa gingerol pada jahe (Tiwari et al., 2006)...9 Gambar 7. Bunga cengkeh (Syzygium aromaticum L.) ... ...10 Gambar 8. Struktur kimia eugenol pada cengkeh (Porter, 1979) ... ...10
Gambar 9. Bawang putih (Allium sativum L.) ... ...11 Gambar 10. Struktur kimia senyawa allicin pada bawang putih
(Anonim, 2006d) ... ...12
Gambar 11. Asam fosfomolibdat yang tereduksi (The Grape Seed Method Evaluation Committee, 2001) ... ...13
Gambar 12. Alat Rancimat... ...15
Gambar 13. Skema deskripsi alat Rancimat (Löliger, 1983) ... ...16
Gambar 14. Penentuan periode induksi (Löliger, 1983) ... ....17 Gambar 15. Diagram alir analisis aktivitas antioksidan dengan uji polifenol dan metode AOM dengan menggunakan alat Rancimat ... ...21
Gambar 16. Pengukuran periode infleksi pada metode AOM ... ...22
Gambar 17. Asam galat ... ...24
Gambar 18. Kurva standar uji polifenol dengan standar asam galat... ...25
Gambar 19. Grafik perbandingan kadar polifenol rempah segar dan rempah bubuk ... ...26
Gambar 20. Grafik hubungan kadar polifenol dan aktivitas antioksidan
DAFTAR LAMPIRAN
Lampiran 1. Kadar air rempah segar basah dengan metode azeotropik (dry basis) ... ...43 Lampiran 2. Kadar air rempah segar kering dengan metode oven vakum
(dry basis) ... ...44 Lampiran 3. Kadar air rempah bubuk dengan metode oven vakum (dry basis) . ...45 Lampiran 4. Perhitungan uji kadar polifenol ... ...45
A. Kurva standar asam galat ... ...45
B. Rempah segar ... ...46
C. Rempah bubuk ... ...47
Lampiran 5. Perhitungan metode AOM ... ...48
A. Pemilihan minyak sebagai media pada metode AOM ... ...48
B. Faktor proteksi rempah segar ... ...49
C. Faktor proteksi rempah bubuk ... ...50
BAB I. PENDAHULUAN
A. LATAR BELAKANG
Reaksi-reaksi yang terjadi di dalam tubuh manusia memerlukan
oksigen, namun di lain pihak, oksigen juga merupakan senyawa oksidan
yang dapat menimbulkan efek samping berbahaya, yang dapat menyebabkan
kerusakan sel sehingga menimbulkan penyakit kronis (Anonim, 2006d).
Senyawa oksidan yang umumnya dikenal sebagai radikal bebas,
dapat berasal dari dalam maupun luar tubuh. Sumber eksternal tersebut
antara lain paparan sinar matahari dan polusi, minuman beralkohol,
makanan yang tidak sehat, dan rokok. Radikal bebas ini menyerang sel-sel
sehat dalam tubuh, termasuk DNA, protein, dan lemak, sehingga dapat
menyebabkan gangguan fungsi imunitas, mempercepat proses penuaan, serta
menimbulkan berbagai penyakit seperti katarak, kanker, penyakit jantung,
artritis, dan penyakit kronis lainnya (Anonim, 2006d). Radikal bebas
merupakan kunci utama penyebab penyakit infeksi dan non-infeksi serta
berbagai penyakit dalam tubuh. Sebenarnya, secara normal tubuh dapat
mengatasi radikal bebas tersebut, tapi dalam suatu kondisi tertentu tubuh
tidak mampu mengatasinya sehingga memerlukan senyawa antiradikal bebas
(Maslimah, 2004).
Antioksidan adalah suatu senyawa yang melindungi senyawa
lainnya dari oksigen dengan mereaksikan dirinya sendiri dengan oksigen
tersebut (Sizer and Whitney, 2000). Antioksidan juga dapat membantu
memperbaiki kerusakan yang terjadi pada sel-sel tubuh. Beberapa enzim
antioksidan dapat dihasilkan di dalam tubuh seperti superoksida dismutase,
katalase, dan glutathion. Antioksidan lainnya dapat ditemukan di dalam
bahan pangan seperti vitamin A, vitamin C, vitamin E, and beta-karoten
pada sayur-sayuran berwarna. (Anonim, 2006d). Dalam 20 tahun terakhir,
selain buah dan sayuran, rempah-rempah diketahui mengandung senyawa
fenolik yang memiliki kapasitas antioksidan yang kuat (Benkeblia, 2005).
Rempah-rempah yang diteliti pada penelitian ini adalah kunyit, jahe,
merupakan rempah yang sering digunakan masyarakat Indonesia sebagai
bumbu masakan maupun sebagai obat, serta pada banyak penelitian telah
terbukti mengandung senyawa antioksidan.
B. TUJUAN PENELITIAN
Tujuan penelitian ini adalah untuk membandingkan aktivitas
antioksidan rimpang segar dan rimpang bubuk. Rimpang yang
dibandingkan adalah lengkuas (Alpinia galanga), kencur (Kaemferia galanga L.), kunyit (Curcuma domestica Val.), dan jahe (Zingiber officinale Rosc.). Sebagai tambahan perbandingan, diteliti juga bawang putih (Allium sativum L.) dan cengkeh (Syzygium aromaticum L.). Tujuan dari membandingkan rimpang segar dan rimpang bubuk adalah untuk melihat
BAB II. TINJAUAN PUSTAKA
A. REMPAH SEBAGAI SUMBER ANTIOKSIDAN
Istilah rempah-rempah (spices) berasal dari bahasa Latin, yaitu Species aromatacea yang berarti buah-buahan bumi (Farrell, 1990). Definisi rempah-rempah adalah segala komponen tumbuhan atau sayuran yang
bersifat aromatik yang dikeringkan, berbau, aromatik, atau pedas, dalam
bentuk utuh, dihancurkan, atau digiling, yang fungsi utamanya dalam
makanan ialah sebagai bumbu. Rempah-rempah dapat berasal dari membran, kulit kayu, pucuk, umbi, bunga, buah, daun, rimpang (rhizoma), akar, biji, atau keseluruhan tanaman (Farrell, 1990).
Rempah-rempah yang merupakan umbi atau rimpang misalnya
jahe, kunyit, temulawak, kencur, dan sebagainya. Rempah yang berasal dari
biji misalnya pala, kemiri, kapol, dan lain-lain. Kayu manis dan kayu secang
merupakan rempah yang berasal dari kulit pohon. Rempah yang berasal dari
bunga misalnya cengkeh. Rempah yang berasal dari buah misalnya lada
(Muchtadi dan Sugiyono, 1992).
Penelitian-penelitian terhadap sifat antioksidan dari
rempah-rempah yang dilakukan pada tahun 1930-an menunjukkan bahwa beberapa
jenis rempah-rempah dapat memperlambat terbentuknya peroksida pada
minyak kacang dan menghambat ketengikan pada daging. Hak paten untuk
antioksidan yang berasal dari rempah-rempah pertama kali dikeluarkan pada
tahun 1938, dimana minyak cengkeh dapat mencegah terjadinya oksidasi
minyak goreng. Pada banyak penelitian, pala, lada hitam, jahe, kunyit,
oregano, rosemary, dan jenis rempah-rempah lainnya terbukti memiliki aktivitas antioksidan yang kuat.
Berdasarkan pelarut yang digunakan dalam ekstraksi
rempah-rempah, hampir seluruh aktivitas antioksidan yang kuat ditemukan pada
fraksi yang larut dalam etanol. Namun demikian, pelarut etanol memiliki
kelemahan, yaitu tidak dapat mengekstraksi komponen hidrofilik (Farrell,
1985). Pengecualian hanya terjadi untuk cengkeh, dimana fraksi yang larut
yang kuat (Hirasa dan Takemasa, 1998). Ekstraksi rempah dengan pelarut
etanol akan menghasilkan senyawa yang disebut oleoresin. Oleoresin
memiliki sifat kental, kaya akan senyawa aromatik, dan secara alami
mengandung antioksidan (Farrell, 1985).
Senyawa-senyawa antioksidan yang terdapat dalam berbagai jenis
rempah-rempah juga telah dapat diidentifikasi. Contoh-contoh senyawa
antioksidan pada rempah-rempah dapat dilihat pada Tabel 1.
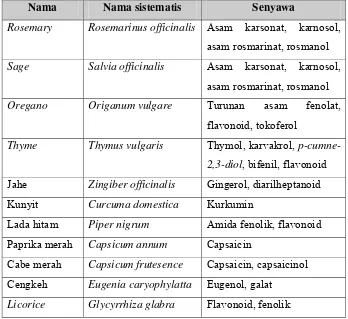
Tabel 1. Senyawa antioksidan yang telah berhasil diisolasi dari rempah- rempah (Pokorny et al., 2001)
Nama Nama sistematis Senyawa
Rosemary Rosemarinus officinalis Asam karsonat, karnosol, asam rosmarinat, rosmanol
Sage Salvia officinalis Asam karsonat, karnosol, asam rosmarinat, rosmanol
Oregano Origanum vulgare Turunan asam fenolat, flavonoid, tokoferol
Thyme Thymus vulgaris Thymol, karvakrol, p-cumne-2,3-diol, bifenil, flavonoid Jahe Zingiber officinalis Gingerol, diarilheptanoid
Kunyit Curcuma domestica Kurkumin
Lada hitam Piper nigrum Amida fenolik, flavonoid Paprika merah Capsicum annum Capsaicin
Cabe merah Capsicum frutesence Capsaicin, capsaicinol Cengkeh Eugenia caryophylatta Eugenol, galat
Licorice Glycyrrhiza glabra Flavonoid, fenolik
B. LENGKUAS (Alpinia galanga L.)
Lengkuas termasuk dalam famili Zingiberaceae. Lengkuas dapat
hidup di daerah dataran rendah sampai dataran tinggi, lebih kurang 1200
meter di atas permukaan laut. Lengkuas termasuk tumbuhan tegak yang
yang terdiri dari susunan pelepah-pelepah daun. Bunganya muncul pada
bagian ujung tumbuhan. Rimpang umbi lengkuas selain berserat kasar juga
mempunyai aroma yang khas (Anonim, 2005b).
Ada 2 jenis lengkuas berdasarkan warna umbinya yaitu lengkuas
putih dan lengkuas merah. Lengkuas putih dipakai sebagai penyedap
masakan, sedangkan lengkuas merah digunakan sebagai obat (Anonim,
2005b). Lengkuas yang dipakai pada penelitian ini adalah lengkuas putih,
seperti yang terlihat pada Gambar 1.
Gambar 1. Lengkuas (Alpinia galanga L.)
Berdasarkan uji DPPH, minyak volatil lengkuas memiliki aktivitas
antioksidan yang kuat dengan persen inhibisi sebesar 86.6-92.5% dengan
komponen utamanya adalah trans-3-acetoxy-1,8 cineole. Namun demikian, ekstrak lengkuas dengan pelarut metanol memiliki aktivitas antioksidan
yang tidak terlalu tinggi. Komponen utama pada ekstrak lengkuas dengan
pelarut metanol adalah p-coumaryl-9-methyl ether (Zaeoung et al., 2005).
C. KENCUR (Kaemferia galanga L.)
Kencur termasuk dalam famili Zingiberaceae. Bentuk kencur dapat dilihat pada Gambar 2. Menurut Tewtrakul et al. (2005), minyak volatil kencur yang diperoleh dari distilasi air mengandung 31.77%
etil-p-metoksisinamat, 23.23% metilsinamat, 11.13% karvon, 9.59% eukaliptol,
dan 6.41% pentadekan. Namun demikian, kandungan minyak kencur dapat
saja berbeda, tergantung kondisi iklim dan geografis tempat asal kencur
Gambar 2.Kencur (Kaemferia galanga L.)
Ekstrak kencur diketahui dapat melawan infeksi bakteri. Secara
tradisional, kencur digunakan untuk mengobati scariasis dan tumor, digunakan secara eksternal untuk mengobati sakit perut, dan secara topikal
untuk mengobati rematik. Komponen terbesar minyak kencur yaitu
etil-p-metoksisinamat telah dilaporkan memiliki banyak aktivitas biologis seperti
antikanker dan anti-monoamin oksidase (Tewtrakul et al., 2005).
D. KUNYIT (Curcuma domestica Val.)
Tanaman kunyit aslinya berasal dari daerah Asia Selatan,
kemudian tersebar ke Jepang, Malaysia, dan Sri Langka. Kunyit merupakan
tanaman tropis yang memiliki sistem reproduksi berupa rimpang (rhizoma). Bentuk kunyit dapat dilihat pada Gambar 3.
Gambar 3.Kunyit (Curcuma domestica Val.)
dilihat pada Gambar 4. Warna kunyit sensitif terhadap pH, dimana warna
kuning yang paling cerah terbentuk pada suasana asam (Farrell, 1990).
Gambar 4. Struktur kimia senyawa curcumin pada kunyit (Tiwari et al., 2006)
Senyawa antioksidan pada kunyit antara lain curcumin atau bis (4 -hidroxy-3-methoxy cinnamoyl) methane, 4-hidroxycinnamoyl (feruloyl) methane, dan bis (4-hidroxycinnamoyl) methane (Hirasa dan Takemasa, 1998). Curcumin akhir-akhir ini populer di banyak majalah dan surat kabar karena terbukti memiliki manfaat kesehatan berdasarkan
penelitian-penelitian laboratorium. Bubuk kunyit murni memiliki konsentrasi curcumin sekitar 3% w/w. Para peneliti telah menemukan bahwa curcumin dapat meningkatkan kinerja TRAIL dua hingga tiga kali lipat. TRAIL (Tumor necrosis factor-Related Apoptosis-Inducing Ligand) adalah molekul yang terdapat secara alami dalam tubuh yang membantu membunuh sel-sel
kanker. Curcumin juga ditemukan dapat menghentikan replikasi sel-sel leukemia, mengurangi kerusakan jaringan jantung dari kekurangan oksigen
dan aliran darah, serta melindungi tubuh dari bahaya asap rokok (Anonim,
2006a).
Kunyit banyak dikonsumsi masyarakat dan saat ini kunyit banyak
diteliti kegunaannya karena kandungan metabolitnya yang besar, dengan
struktur kurkuminoid yang terbukti mampu menangkap radikal bebas DPPH
secara in vitro dua buah radikal aroxyl yang terbentuk setelah curcumin mendonorkan atom hidrogennya kepada radikal DPPH. Mekanisme
antioksidan di dalam lipid tak jenuh (linoleat) terjadi karena gugus fenolik
E. JAHE (Zingiber officinale Rosc.)
Tanaman jahe termasuk dalam famili Zingiberaceae, merupakan
tanaman berumur panjang dengan rimpang di dalam tanah yang
bercabang-cabang dan ke atas mengeluarkan tunas serta batang-batang yang dibalut
oleh pelepah daun, dengan tinggi tanaman yang dapat mencapai 0.4-0.6
meter.
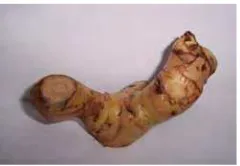
Bagian jahe yang banyak digunakan manusia adalah rhizoma atau rimpangnya. Rimpang jahe merupakan batang yang tumbuh dalam tanah dan
dipanen setelah berumur 9-11 bulan. Rimpang jahe bercabang-cabang tidak
teratur, berserat, dan berbau khas aromatik (Sutarno et al., 1999).
Berdasarkan bentuk, ukuran, dan warna rimpangnya, dikenal tigs
varietas, yaitu jahe putih besar (jahe gajah, jahe badak), jahe putih kecil
(jahe emprit), dan jahe merah (jahe sunti). Diantara ketiga varietas tersebut,
yang banyak digunakan sebagai obat adalah jahe merah karena kandungan
minyak atsirinya lebih banyak (Wijayakusuma, 2002). Jahe yang digunakan
dalam penelitian ini adalah jahe putih besar. Bentuk jahe putih besar dapat
dilihat pada Gambar 5.
Gambar 5. Jahe putih besar (Zingiber officinale Rosc.)
Rimpang jahe berasa pedas karena mengandung minyak atsiri
sebesar 0.25-3.3%, yang kadarnya bervariasi tergantung jenis jahe. Selain
itu, rimpang jahe mengandung oleoresin sebanyak 4.3-6.0% yang terdiri dari
gingerol dan shogaol (hasil dehidrasi gingerol). Oleoresin pada jahe juga
fellandren, dekstrokamfen, bahan sesquiterpen yang dinamakan zingiberen,
zingeron damar, dan pati (Achyad dan Rasyidah, 2000).
Ekstrak jahe dengan pelarut metanol menunjukkan aktivitas
antioksidan yang tinggi, yaitu sekitar 2-4 kali BHT. Aktivitas antioksidan
yang tinggi pada ekstrak jahe disebabkan kandungan gingerol dan shogaol
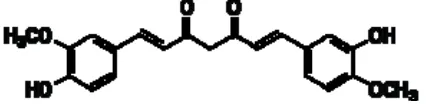
yang memiliki gugus hidroksil (Zaeoung et al., 2005). Struktur kimia senyawa gingerol dapat dilihat pada Gambar 6.
Gambar 6. Struktur kimia senyawa gingerol pada jahe (Tiwari et al., 2006)
Ekstrak jahe mempunyai daya antioksidan yang dapat
dimanfaatkan untuk mengawetkan minyak dan lemak. Jahe memiliki
kandungan senyawa aktif yang mampu berfungsi sebagai antioksidan.
Menurut Vankar et al. (2006), aktivitas antioksidan dengan DPPH pada jahe bubuk sebelum dipanaskan dengan standar BHT adalah sebesar 10.81% dan
setelah dipanaskan 120oC adalah 6.01%, sedangkan dengan standar
pyragallol, aktivitas antioksidan dengan metode DPPH adalah 4.13% dan
setelah dipanaskan 120oC adalah 1.36%.
F. CENGKEH (Syzygium aromaticum L.)
Tanaman cengkeh termasuk ke dalam familii Myrtaceae. Cengkeh merupakan tanaman indigenus dari lima pulau kecil yaitu Pulau Ternate,
Tidore, Mutir, Machian, dan Bachian. Cengkeh dalam bahasa Inggris
disebut clove, yang diturunkan dari bahasa Perancis dan Spanyol yang berarti paku, karena bentuk cengkeh yang mirip paku berkepala bulat
Gambar 7. Bunga cengkeh
Pohon cengkeh dapat mencapai tinggi 20-30 meter dan umurnya
dapat mencapai lebih dari seratus tahun (Hadiwijaya, 1986). Myrtaceae terdiri dari 30000 spesies pohon dan semak dari daerah tropika dan
subtropika. Menurut Purseglove et al. (1981), bunga cengkeh mempunyai aroma yang lebih kuat, lebih tajam, dan lebih getir dan pedas dibandingkan
gagang dan daun cengkeh. Bunga cengkeh terutama digunakan untuk
campuran rokok kretek.
Sifat khas yang dimiliki tanaman cengkeh yaitu semua bagian
tanaman mengandung minyak, mulai dari akar, batang, daun, dan bunga.
Kandungan minyak tertinggi terdapat pada bagian bunga (Bintoro, 1986).
Kandungan minyak cengkeh adalah eugenol (2-metoksi-4-alil
fenol) 90%, eugenol asetat, metil n-heptil alkohol, benzil alkohol, metil
salisilat, metil n-amil karbinol, dan terpene caryophylene (Harris, 1987). Eugenol adalah senyawa utama pada minyak esensial cengkeh (Hirasa dan
Takemasa, 1998). Eugenol inilah yang memberikan aroma khas cengkeh.
Namun demikian, cengkeh yang berasal dari daerah berbeda mempunyai
kadar minyak atsiri dan kadar total eugenol yang berbeda (Kardiman, 2005).
Struktur kimia eugenol dapat dilihat pada Gambar 8.
Minyak cengkeh merupakan hasil sulingan serbuk kuntum cengkeh
kering, yang digunakan untuk penyedap rasa, parfum, dan kebutuhan
industri farmasi. Minyaknya banyak digunakan untuk bahan baku industri
pangan, parfum, obat-obatan, dan bahan peledak dalam industri senjata
(Ketaren, 1985).
Minyak bunga cengkeh merupakan sumber eugenol yang lebih
besar dibandingkan tangkai bunga dan daun. Eugenol dapat menjadi bahan
pembuat vanilin dalam bentuk isoeugenol (Anonim, 1975). Minyak bunga
cengkeh digunakan sebagai bau khas rokok dan obat-obatan seperti
analgesik gigi dan karminatif. Dalam bidang farmasi, eugenol ditambahkan
formaldehid dan garam natrium yang akan membentuk eugeoform yang
berguna sebagai obat kolera, demam, dan tipus. Eugenol juga berguna
sebagai antiseptik, desinfektan, penenang syaraf, dan obat penyakit
paru-paru (Gardner dan Cooke, 1971).
G. BAWANG PUTIH (Allium sativum L.)
Bawang putih aslinya berasal dari padang gurun Kirghiz dan Asia
Barat. Bawang putih dapat tumbuh hampir di seluruh negara beriklim hangat
dan semitropis di seluruh dunia (Farrell, 1985). Bawang putih adalah salah
satu tanaman paling awal yang ditanam manusia karena kemudahannya
dibawa dan disimpan. Bawang putih dapat dikeringkan dan diawetkan untuk
beberapa bulan. Bawang putih termasuk dalam famili Allium. Hingga kini sudah ditemukan lebih dari 500 lebih jenis bawang yang termasuk famili
Allium, yang masing-masing memiliki rasa, bentuk, dan warna yang berbeda-beda namun mirip dalam kandungan biokimia, fitokimia, dan
neutraceutical (Benkeblia, 2005). Bentuk bawang putih dapat dilihat pada Gambar 9.
Senyawa aktif dalam bawang putih disebut allicin (C3H5 -S-S-C3H5). Ketika bawang putih dipotong atau dilukai, allicin akan terpecah menjadi dialil disulfida yang menyebabkan bau khas pada bawang putih
(Farrell, 1985). Struktur kimia senyawa allicin dapat dilihat pada Gambar 10.
Gambar 10. Struktur kimia senyawa allicin pada bawang putih (Anonim, 2006d)
Ekstrak Allium dikenal memiliki aktivitas antibakteri dan antifungal, mengandung antioksidan yang kuat, sulfur, dan banyak senyawa
fenolik, sehingga kini Allium banyak diteliti kegunaannya (Benkeblia, 2005). Bawang putih mengandung alilsulfida yang dapat memperlambat
oksidasi pada daging babi (Hirasa dan Takemasa, 1998).
Perlakuan panas dapat menurunkan aktivitas antioksidan dalam
ekstrak Allium, sehingga pemanasan dalam persiapan makanan dan pemasakan perlu diperhatikan dengan hati-hati untuk melindungi
antioksidan (Benkeblia, 2005). Allicin bersifat tidak stabil jika dikeluarkan dari bawang putih dan proses pengolahan dapat menyebabkan allicin terdegradasi menjadi senyawa yang tidak dapat terdeteksi (Yu dan Wu,
1989).
H. PENGUKURAN AKTIVITAS ANTIOKSIDAN DENGAN UJI
KADAR POLIFENOL
Antioksidan adalah suatu senyawa yang melindungi senyawa
lainnya dari oksigen dengan mereaksikan dirinya sendiri dengan oksigen
tersebut (Sizer dan Whitney, 2000). Antioksidan ada yang berasal secara
alami dari tanaman seperti vitamin C dan E, dan ada pula yang antioksidan
Secara umum, antioksidan adalah senyawa yang mampu untuk
menghambat dan mencegah proses oksidasi, akan tetapi tidak dapat
meningkatkan kualitas dari produk yang sudah teroksidasi. Antioksidan
untuk penggunaan dalam makanan harus memenuhi beberapa persyaratan
antara lain efektif dalam konsentrasi rendah, dapat bergabung dengan
substrat, tidak mempengaruhi sensori produk makanan (off-color, off-odor, off-taste), dan tidak toksik (Schuler, 1990).
Sebelum mengukur kadar antioksidan, sampel harus diekstrak
terlebih dahulu. Pelarut yang digunakan untuk ekstraksi sampel adalah
etanol karena hampir seluruh aktivitas antioksidan yang kuat ditemukan
pada fraksi yang larut dalam etanol (Hirasa dan Takemasa, 1998). Fraksi
polar yang larut dalam etanol memiliki aktivitas antioksidan yang lebih kuat
daripada fraksi yang tidak larut dalam etanol (Pokorny, 2001). Ekstraksi
dilakukan dengan menggunakan refluks pada suhu 50oC.
Uji kadar polifenol didasarkan pada prinsip reaksi oksidasi-reduksi
dengan menggunakan reagen Folin-Ciocalteau. Reagen Folin-Ciocalteau
merupakan campuran asam fosfomolibdat dan asam fosfotungstat.
Antioksidan dapat mereduksi reagen sehingga terbentuk kompleks warna
biru (kromatogen) dengan absorbansi maksimum pada panjang gelombang
745-750 nm (Nollet, 1996). Asam fosfotungstat (P2W18O62-7) tereduksi
menjadi H4P2W18O62-8 dan asam fosfomolibdat (H2P2Mo18O62-6) tereduksi
menjadi H6P2Mo18O62-6 (The Grape Seed Method Evaluation Committee,
2001). Struktur kimia asam fosfomolibdat yang telah tereduksi dapat dilihat
pada Gambar 11.
Uji kadar polifenol memiliki kelebihan, yaitu dapat menghitung
secara kuantitatif semua grup fenolik seperti quercetin, antosianin, dan
fenolik pada teh hijau. Namun demikian, uji kadar polifenol juga memiliki
kelemahan, antara lain tidak mampu membedakan tipe-tipe fenol yang
terkandung (monomer/dimer/trimer). Selain itu, keberadaan protein, asam
nukleat, dan asam askorbat dapat mempengaruhi uji polifenol (Lee dan
Widmer, 1996).
Sebagai garam basa, Na2CO3 berfungsi memberikan suasana basa
karena pembentukan warna biru sangat bergantung pada pH. Nilai pH yang
paling sesuai adalah 10 – 10.5. Namun demikian, reagen Folin-Ciocalteau
tidak stabil pada pH basa sehingga ketepatan waktu dalam setiap tahap
sangat diperlukan. Setelah penambahan pereaksi, selalu dilakukan
pendiaman agar reaksi dapat berjalan sempurna. Reaksi yang tidak berjalan
sempurna dapat menyebabkan kesalahan negatif, yaitu hasil percobaan lebih
rendah dari yang seharusnya (Lee dan Widmer, 1996).
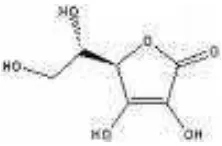
Standar polifenol yang digunakan adalah asam galat (asam
3,4,5-hidroksibenzoat). Asam galat merupakan asam organik yang secara alami
terdapat pada daun teh, kayu oak, dan tanaman lainnya. (Anonim, 2006c).
Hasil uji polifenol diekspresikan sebagai GAE (Gallic Acid Equivalents) (The Grape Seed Method Evaluation Committee, 2001).
Semakin tinggi kadar polifenol yang terkandung dalam suatu
sampel, semakin banyak molekul kromatogen yang terbentuk. Akibatnya,
intensitas warna biru yang dihasilkan semakin tinggi dan nilai absorbansinya
juga semakin tinggi. Oleh karena itu, dapat disimpulkan bahwa kadar
polifenol berbanding lurus dengan nilai absorbansi.
I. PENGUKURAN AKTIVITAS ANTIOKSIDAN BERDASARKAN
ACTIVE OXYGEN METHOD (AOM)
Menurut Almatsier (2002), pada saat lipid bersentuhan dengan
udara untuk jangka waktu yang lama, oksigen akan terikat pada ikatan
rangkap dan membentuk peroksida aktif. Peroksida aktif ini sangat reaktif
dan dapat membentuk hidroperoksida yang bersifat sangat tidak stabil dan
asam-asam lemak, aldehida-aldehida, dan keton yang bersifat volatil (mudah
menguap) dan menimbulkan bau tengik pada minyak.
Metode AOM pada penelitian ini menggunakan alat Rancimat.
Metode ini membutuhkan minyak murni sebagai media. Minyak yang
digunakan adalah minyak yang memiliki kandungan asam lemak tak jenuh
tinggi, karena asam lemak tak jenuh mudah teroksidasi. Hal tersebut
bertujuan agar waktu yang terpakai untuk mencapai waktu infleksi lebih
singkat dan lebih efisien. Beberapa penelitian seperti yang dilakukan Beirao
dan Bernardo-Gil (2005) menggunakan minyak bunga matahari, namun
sayangnya minyak tersebut sulit didapatkan di Indonesia. Minyak kaya asam
lemak tak jenuh yang banyak terdapat di segaran Indonesia antara lain
minyak kedelai, minyak jagung, dan minyak zaitun.
Alat Rancimat dikembangkan dari metode AOM. Penggunaan alat
Rancimat lebih berkembang dari segi waktu dan sekarang telah banyak
digunakan dalam standar nasional dan internasional seperti AOCS Cd
12b-92 dan ISO 6886 (Anonim, 1999). Bentuk alat Rancimat dapat dilihat pada
Gambar 12.
Gambar 12. Alat Rancimat
Pada metode AOM dengan menggunakan alat Rancimat, minyak
murni dipaparkan aliran udara pada suhu 50o-220oC. Suhu dapat diatur
sedemikian rupa sehingga periode induksi berkisar 4–15 jam (Gordon,
2001). Suhu yang biasanya digunakan adalah 100oC (Hudson, 1983). Produk
oksidasi yang bersifat volatil lalu ditransfer dengan aliran udara ke alat
pengukur dan diserap oleh air demineral sebagai larutan pengukur
hidroperoksida dan asam format, yang akan meningkatkan konduktivitas air
demineral (Löliger, 1983). Konduktivitas larutan pengukur ini dicatat secara
kontinu sehingga diperoleh kurva konduktivitas. Skema alat Rancimat dapat
dilihat pada Gambar 13.
Gambar 13. Skema deskripsi alat Rancimat (Löliger, 1983)
Kurva konduktivitas pada awalnya akan terlihat landai karena
produk oksidasi belum terbentuk dan belum ada peningkatan konduktivitas.
Kenaikan kurva yang tajam menunjukkan bahwa periode induksi telah
tercapai. Periode induksi berhubungan dengan terbentuknya asam
karboksilat volatil yang merupakan produk akhir oksidasi (Hudson, 1983).
Periode induksi merupakan nilai yang baik untuk menunjukkan stabilitas
oksidasi (Anonim, 1999).
Ada dua cara dalam menentukan periode induksi, yaitu cara
otomatis dan cara manual. Cara otomatis menggunakan turunan kedua dari
kurva konduktivitas yang tercatat. Dengan cara manual, periode induksi
merupakan perpotongan antara dua garis lurus perpanjangan kurva
konduktivitas (Anonim, 1999) seperti yang dapat dilihat pada Gambar 14,
sehingga periode induksi dapat juga disebut titik infleksi. Pada penelitian
BAB III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Bahan sampel yang digunakan dalam penelitian ini adalah yaitu
lengkuas (Alpinia galanga L.), kencur (Kaemferia galanga L.), kunyit (Curcuma domestica Val), jahe (Zingiber officinale rosc.), bawang putih (Allium sativum L.), dan cengkeh (Syzygium aromaticum L.). Sampel segar dibeli di segar tradisional Warung Jambu Bogor, sedangkan sampel bubuk
merk “Koepoe-Koepoe” dibeli di segar swalayan Giant Bogor. Bahan-bahan
lain yang digunakan adalah minyak jagung merk Tropicana Slim, minyak
jagung merk Mazola, minyak kedelai merk Happy, minyak zaitun merk
Bertolli Extra Virgin, kertas saring, pelarut etanol 95%, toluena, pereaksi
Folin Ciocalteau, larutan Na2CO3 10%, asam galat, dan antioksidan BHT
(Butylated Hidroxy Toluena).
Alat-alat yang digunakan adalah botol gelas, tabung reaksi, neraca analitik, rotavapor (Buchi), oven vakum (OSK), filter vakum, gegep besi, spektrofotometer (Spectronic 200+), alat Rancimat (Metrohm 743 Rancimat
1.0), kuvet, pipet tetes, pipet Mohr 1 ml dan 10 ml, bulb, gelas piala, gelas ukur, sudip, gelas pengaduk, labu takar 10 ml, labu erlenmeyer 250 ml,
pemanas pelat, labu didih 100 ml, tabung connector, dan labu Bidwell-Sterling.
B. METODE PENELITIAN
1. Tahap persiapan sampel
Proses pembuatan ekstrak sampel dilakukan sebagai berikut:
Sampel segar (lengkuas, jahe, kencur, kunyit, dan bawang putih)
dicacah halus dan ditimbang sebanyak 100 gram lalu dikeringkan
dengan oven vakum pada suhu 60oC dan tekanan 250 mmHg. Sampel
segar yang sudah kering lalu diblender, ditimbang sebanyak 25 gram,
lalu dimasukkan ke dalam 150 gram pelarut (etanol). Cengkeh dan
rempah bubuk dapat langsung ditimbang sebanyak 25 gram dan
lalu direfluks pada suhu 50oC selama dua jam. Ekstrak yang diperoleh
disaring dengan filter vakum dan sampel dicuci sebanyak dua kali
dengan masing-masing 50 gram etanol, sehingga total etanol (pelarut)
yang digunakan sebanyak 250 gram.
Ekstrak hasil refluks lalu dipekatkan dengan rotavapor pada suhu 50oC selama kurang lebih 50 menit hingga volumenya kurang
dari 10 ml. Ekstrak yang diperoleh dimasukkan dalam labu takar 10 ml
yang telah ditimbang terlebih dahulu berat kosongnya lalu ditera
dengan menambahkan bilasan labu rotavapor agar tidak ada ekstrak pekat yang tertinggal di dalam labu rotavapor. Setelah ekstrak beserta labu takar ditimbang, ekstrak dituang ke dalam botol atau vial. Ekstrak
lalu disimpan di dalam lemari esdan siap digunakan.
2. Uji kadar air (Park, 1996)
Uji kadar air untuk sampel segar (lengkuas, jahe, kencur,
kunyit, dan bawang putih) dilakukan dengan metode azeotropik.
Sampel ditimbang sebanyak 3 gram dan dimasukkan dalam labu didih
100 ml. Toluena sebanyak 60 ml lalu dimasukkan ke dalam labu didih.
Pemanasan dilakukan sampai tidak ada air lagi yang masuk ke labu
Bidwell-Sterling.
Cengkeh dan sampel bubuk ditimbang sebanyak 3-5 gram
lalu dimasukkan ke dalam oven vakum pada suhu 60oC dan tekanan
250 mmHg hingga beratnya stabil.
3. Uji kadar polifenol (Oki et al., 2002)
Pengujian kadar polifenol membutuhkan larutan blanko,
larutan kontrol, dan larutan standar. Larutan blanko dibuat dengan cara
mencampurkan 0.2 ml ekstrak sampel, 1 ml larutan Na2CO3 10%, dan
6 ml akuades. Larutan sampel dibuat dengan cara mencampurkan 0.2
ml ekstrak sampel, 1 ml larutan Na2CO3 10%, 1 ml Folin Ciocalteau,
dan 5 ml aquades. Sebelum dicampurkan, ekstrak sampel jahe,
100 kali sedangkan ekstrak cengkeh dan kunyit diencerkan sebesar
10000 kali. Larutan standar dibuat dengan cara membuat terlebih
dahulu larutan stok dengan konsentrasi 0.10 mg asam galat/gram
etanol. Larutan stok lalu diencerkan hingga konsentrasi 0, 0.02, 0.04,
0.06, 0.08, mg/g etanol. Absorbansi larutan blanko, larutan kontrol,
larutan standar, dan larutan sampel diukur dengan alat
spektrofotometer pada panjang gelombang 750 nm.
4. Metode AOM (Beirao dan Bernardo-Gil, 2005)
Active Oxygen Method adalah suatu metode untuk menentukan stabilitas minyak terhadap oksidasi yang dapat membuat minyak
menjadi tengik (rancid). Minyak sebanyak 3 gram dicampurkan dengan 150 mg ekstrak sampel, lalu dihembuskan oksigen pada suhu
100oC sehingga minyak akan teroksidasi. Produk oksidasi yang
bersifat volatil ditransfer dengan aliran udara ke alat pengukur dan
diserap oleh larutan pengukur (air demineral). Konduktivitas larutan
pengukur ini dicatat secara kontinu sehingga diperoleh kurva
konduktivitas.
Periode dimana jumlah senyawa volatil hasil oksidasi minyak
meningkat dengan cepat disebut periode induksi. Periode induksi
ditentukan dengan mencari perpotongan antara dua garis lurus
perpanjangan kurva konduktivitas versus waktu. Semakin lama periode
induksi, berarti semakin tinggi aktivitas antioksidan sampel.
Pemilihan minyak yang akan digunakan sebagai media pada uji
rancimat dilakukan dengan menyeleksi minyak berdasarkan periode
induksi yang terpendek. Berdasarkan pengamatan di lapangan, terdapat
empat jenis minyak yang memiliki klaim kaya asam lemak tak jenuh
dan 100% murni (tidak ditambahkan pengawet), yaitu minyak jagung
merk Tropicana Slim, minyak jagung merk Mazola, minyak kedelai
merk Happy, dan minyak zaitun merk Bertolli Extra Virgin. Keempat
minyak tersebut diukur periode induksinya dan minyak yang dipilih
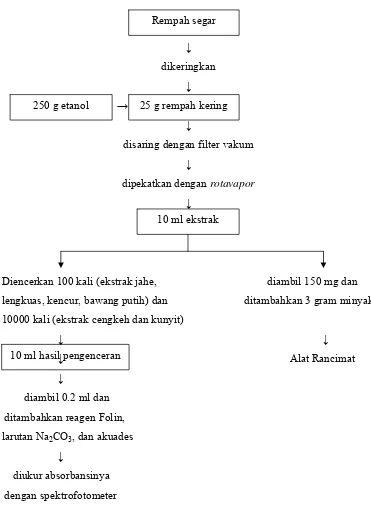
10 ml ekstrak
10 ml hasil pengenceran
Ļ
dikeringkan
Ļ
ĺ
Ļ
disaring dengan filter vakum
Ļ
dipekatkan dengan rotavapor Ļ
Diencerkan 100 kali (ekstrak jahe, diambil 150 mg dan
lengkuas, kencur, bawang putih) dan ditambahkan 3 gram minyak
10000 kali (ekstrak cengkeh dan kunyit)
Ļ Ļ Ļ Alat Rancimat
Ļ
diambil 0.2 ml dan
ditambahkan reagen Folin,
larutan Na2CO3, dan akuades
Ļ
diukur absorbansinya
dengan spektrofotometer
Gambar 15. Diagram alir analisis aktivitas antioksidan dengan uji polifenol dan metode AOM
Rempah segar
C. PERHITUNGAN HASIL PENGAMATAN
1. Uji Kadar Air
Perhitungan kadar air berdasarkan berat kering, yaitu dengan
rumus :
% kadar air = Berat awal - Berat akhir x 100% Berat akhir
2. Uji Kadar Polifenol
Absorbansi larutan standar diplotkan menjadi kurva standar,
dengan sumbu x adalah konsentrasi asam galat (mg/ml pelarut) dan
sumbu y adalah absorbansi. Kadar polifenol larutan sampel diperoleh
dengan cara memasukkan nilai absorbansi sampel ke dalam persamaan
kurva standar. Kadar polifenol sampel berbanding lurus dengan nilai
absorbansi.
3. Metode AOM
Stabilitas oksidasi ditentukan dengan menggunakan kurva
waktu vs konduktivitas yang disebut kurva konduktivitas. Periode
induksi ditentukan dengan mencari perpotongan antara dua garis lurus
perpanjangan kurva waktu vs konduktivitas. Pengukuran periode induksi
dapat dilihat pada Gambar 16.
Konduktivitas (µSiemens)
Waktu (jam)
Periode induksi
Aktivitas antioksidan ditentukan oleh faktor proteksi dengan rumus:
Faktor proteksi (%) = periode induksi minyak + sampel x100% periode induksi minyak + BHT
Semakin tinggi faktor proteksi yang diperoleh, semakin tinggi pula
BAB IV. HASIL DAN PEMBAHASAN
A. KADAR POLIFENOL
Metode Folin Ciocalteau didasarkan pada kekuatan reduksi gugus
hidroksil fenolik dan sangat tidak spesifik karena tidak dapat membedakan
antar jenis komponen fenolik, tetapi dapat mendeteksi semua jenis fenol
dengan sensifitas yang bervariasi. Reaksi oksidasi reduksi ini muncul pada
kondisi alkali dimana fenol mereduksi kompleks
fosfotungstat-fosfomolibdat pada reagen sehingga menjadi warna biru. Semakin tinggi
jumlah gugus hidroksil fenolik maka semakin besar konsentrasi komponen
fenolik yang terdeteksi (Khadambi, 2007).
Standar yang digunakan pada uji kadar polifenol adalah asam galat.
Asam galat adalah asam organik dengan nama kimia asam 3,4,5-trihidroksi
benzoat (C6H2(OH)3CO2H). Struktur asam galat dapat dilihat pada
Gambar 12. Asam galat murni berbentuk bubuk organik kristal tak berwarna
dan berupa molekul bebas atau bagian dari molekul tanin. Asam galat
mempunyai sifat antifungal, antioksidan, dan antiviral.
Gambar 17. Asam galat (Anonim, 2006c)
Larutan standar dibuat dalam satuan g asam galat per g etanol (Oki
et al., 2002). Satuan tersebut perlu dikonversi dalam proses perhitungan menjadi g asam galat per ml etanol dengan menggunakan berat jenis etanol,
yaitu sebesar 0.79 g/ml (Anonim, 2006b). Kurva standar asam galat yang
dihasilkan memiliki persamaan garis linier y = 3.0473x + 0.0223. Gambar
R2 = 0.9866
0.0000 0.0158 0.0316 0.0473 0.0631 0.0789
Kadar polifenol (mg asam galat/ml etanol)
Ab
so
rb
an
si
Gambar 18. Kurva standar uji kadar polifenol dengan standar asam galat
Larutan-larutan yang digunakan di dalam uji kadar polifenol ini
antara lain, larutan blanko digunakan Na2CO3, akuades, dan sampel; dan
sebagai larutan kontrol digunakan Na2CO3, akuades, reagen Folin
Ciocalteau, dan sampel. Penambahan Na2CO3 bertujuan membentuk suasana
basa agar terjadi reaksi reduksi reagen Folin Ciocalteau dengan gugus OH
dari polifenol di dalam sampel. Penambahan sampel di dakam larutan
blanko bertujuan mengurangi kesalahan positif dari perhitungan konsentrasi
polifenol. Hal ini disebabkan sampel itu sendiri sudah memiliki warna yang
dapat terukur oleh spektrofotometer. Hasil absorbansi kontrol nantinya akan
dikurangi dengan absorbansi blanko yang kemudian dimasukkan kedalam
kurva standar sehingga didapatkan konsentrasi polifenol saja di dalam
sampel.
Hasil perhitungan kadar polifenol rempah segar dan rempah bubuk
seperti yang terlihat pada Gambar 19 menunjukkan bahwa kadar polifenol
yang tertinggi dimiliki cengkeh, sedangkan yang terendah dimiliki bawang
putih. Cengkeh segar memiliki kadar polifenol sebesar 619.94 mg/g bahan
kering dan cengkeh bubuk sebesar 790.06 mg/g bahan kering. Bawang putih
segar memiliki kadar polifenol sebesar 2.81 mg/g bahan kering dan bawang
0
Rempah segar 8.53 31.98 27.31 141.79 2.81 619.94
Rempah bubuk 21.49 38.74 3.11 67.64 0.30 790.06
Lengkuas Jahe Kencur Kunyit Baw ang
putih Cengkeh
Cengkeh memiliki kadar polifenol yang sangat tinggi karena
cengkeh merupakan rempah utama penghasil eugenol dan senyawa galat
(Yanishlieva-Maslarova dan Heinonen, 2001). Bawang putih memiliki kadar
polifenol terendah karena senyawa aktif dalam bawang putih, yaitu allicin dengan struktur kimia C3H5-S-S-C3H5 (Farrell, 1985), bukan termasuk
golongan polifenol, melainkan golongan thiosulfonat (Anonim, 2006d).
Bubuk kunyit dilaporkan memiliki konsentrasi curcumin sekitar 3% w/w (Anonim, 2006a). Hasil uji kadar polifenol pada penelitian ini
menunjukkan kunyit bubuk mengandung 67.64 mg polifenol per g bahan
kering atau 6.76% w/w. Perbedaan kadar polifenol tersebut disebabkan
polifenol yang terukur pada penelitian ini adalah polifenol secara
keseluruhan, bukan hanya curcumin. Selain curcumin, kunyit juga mengandung senyawa polifenol lain seperti senyawa cineole, phellandrene, terpinolene, dan turmerone (Tiwari et al., 2006).
* Kadar polifenol sudah dikonversi terhadap kadar air sampel (Lampiran)
Grafik perbandingan kadar polifenol, seperti yang terlihat pada
Gambar 19, menunjukkan ada rempah yang memiliki kadar polifenol dalam
bentuk bubuk lebih rendah dibandingkan bantuk segarnya dan ada juga
rempah yang memiliki kadar polifenol dalam bentuk bubuk lebih tinggi
dibandingkan bantuk segarnya. Lengkuas, jahe, dan cengkeh memiliki kadar
polifenol dalam bentuk bubuk lebih tinggi dibandingkan bentuk segarnya.
Hal ini dapat disebabkan terlepasnya polifenol terikat akibat perlakuan panas
(Tiwari et al., 2006) dan terbebasnya polifenol akibat kerusakan sel yang terjadi selama proses pengeringan (Bartly dan Jacobs, 2000).
Proses pengeringan menyebabkan lapisan-lapisan protein pada
bahan pangan yang berfungsi menghalangi masuknya oksigen dari udara
mengalami kerusakan. Kerusakan lapisan protein menyebabkan butiran
lemak, liposom, atau membran yang dilindungi oleh lapisan protein tersebut
terpapar langsung oleh oksigen yang dapat lewat melalui permukaan lapisan
tipis non-lipid. Oleh karena itu, oksidasi lipid terjadi lebih cepat pada bahan
pangan kering dibandingkan bahan pangan basah. Namun demikian, reaksi
oksidasi tersebut hanya terjadi selama penyimpanan bahan pangan kering.
Selama proses pengeringan itu sendiri, oksidasi lipid terbatas akibat waktu
pengeringan yang singkat, sehingga antioksidan biasanya tidak rusak akibat
proses pengeringan (Pokorny, 2001).
Meskipun antioksidan biasanya tidak rusak akibat proses
pengeringan, penurunan kadar polifenol pada bentuk bubuk dibandingkan
bentuk segarnya sangat besar. Kadar polifenol kencur bubuk 8.8 kali lebih
rendah dibandingkan kencur segar, kadar polifenol kunyit bubuk 2.1 kali
lebih rendah dibandingkan kunyit segar, dan kadar polifenol bawang putih
bubuk 9.4 kali lebih rendah dibandingkan bawang putih segar. Perbedaan
besarnya penurunan kadar polifenol pada bentuk bubuk dibandingkan
bentuk segarnya terjadi karena stabilitas komponen rempah berbeda-beda
tergantung jenis rempah (Tiwari et al., 2006). Meskipun memiliki struktur umum yang sama, polifenol yang terkandung dalam masing-masing rempah
memiliki rantai samping berbeda-beda yang akan mempengaruhi
Penelitian yang dilakukan Sowbhagya et al. (2004) menunjukkan bahwa senyawa curcumin pada kunyit cukup stabil terhadap panas tetapi sensitif terhadap cahaya. Ekstrak etanol dari lengkuas juga terbukti memiliki
stabilitas terhadap panas yang baik (Berghofer dan Juntachote, 2005).
Eugenol pada cengkeh bersifat stabil dalam kondisi normal namun sensitif
terhadap cahaya (Anonim, 2005a). Hanya gingerol yang dilaporkan tidak
stabil terhadap panas akibat adanya grup ß-hidroksi-keto pada struktur
kimianya (Bhattarai et al., 2001).
Salah satu kelemahan uji polifenol adalah tidak mampu
membedakan tipe-tipe fenol yang terkandung (Lee dan Widmer, 1996),
sehingga tidak dapat diketahui secara spesifik jenis polifenol apa yang
berkontribusi besar terhadap penurunan kadar polifenol secara keseluruhan.
Menurut Porter (1979), ada tiga jenis fenol yaitu fenol monohidrat, dihidrat,
dan trihidrat. Fenol monohidrat dapat menghambat rantai radikal bebas,
contohnya BHA dan BHT. Fenol dihidrat menunjukkan efektifitas
antioksidan paling tinggi dibandingkan fenol monohidrat dan trihidrat.
Aktivitas fenol trihidrat disebabkan adanya grup karboksil, seperti yang
terdapat pada asam galat. Semakin besar grup alkil pada struktur fenolik,
semakin rendah efektifitasnya di dalam minyak pada AOM.
B. AKTIVITAS ANTIOKSIDAN BERDASARKAN METODE AOM
Penentuan aktivitas antioksidan dengan menggunakan alat
Rancimat memerlukan media berupa minyak. Minyak yang digunakan
adalah minyak yang memiliki kandungan asam lemak tak jenuh tinggi
karena asam lemak tak jenuh mudah teroksidasi. Hal tersebut bertujuan agar
waktu yang terpakai untuk mencapai waktu infleksi lebih singkat dan lebih
efisien. Pemilihan minyak yang akan digunakan sebagai media pada uji
rancimat dilakukan dengan menyeleksi minyak berdasarkan periode induksi
yang terpendek.
Berdasarkan pengamatan di lapangan, terdapat empat jenis minyak
dengan klaim kaya asam lemak tak jenuh dan 100% murni (tidak
jagung merk Mazola, minyak kedelai merk Happy, dan minyak zaitun merk
Bertolli Extra Virgin. Masing-masing minyak memiliki periode induksi yang
berbeda-beda, seperti yang dapat dilihat pada Tabel 2. Minyak yang
memiliki periode induksi terpendek adalah minyak kedelai merk Happy
dengan periode induksi 7.67 jam, sehingga minyak kedelai merk Happy
dipilih sebagai media pada alat Rancimat.
Tabel 2. Hasil metode AOM untuk seleksi minyak sebagai media pada alat Rancimat
Sampel minyak
Periode induksi (jam)
Ulangan 1 Ulangan 2 Rata-rata
Minyak kedelai Happy 7.69 7.65 7.67
Minyak jagung Tropicana Slim 12.80 12.39 12.60
Minyak jagung Mazola 18.75 20.95 19.85
Minyak zaitun Bertolli Extra Virgin >22.60 >22.60 >22.60
Menurut Almatsier (2002), asam lemak utama pada minyak zaitun
adalah asam lemak tak jenuh tunggal yaitu asam oleat (18:1), sedangkan
asam lemak utama pada minyak kedelai adalah asam lemak tidak jenuh
ganda yaitu asam linoleat (18:2) dan asam linolenat (18:3). Perbandingan
kandungan asam lemak pada minyak kedelai, minyak jagung, dan minyak
zaitun dapat dilihat pada Tabel 3. Pada saat minyak dihembuskan oksigen,
oksigen akan terikat pada ikatan rangkap dan membentuk peroksida aktif.
Peroksida aktif akan terpecah menjadi senyawa dengan rantai karbon pendek
yang bersifat volatil dan menimbulkan bau tengik pada minyak. Perbedaan
kandungan asam lemak itulah yang menyebabkan minyak zaitun sulit
teroksidasi dan memiliki periode induksi yang panjang, sedangkan minyak
kedelai mudah teroksidasi dan memiliki periode induksi yang pendek.
Menurut Hui (1996), minyak kedelai memiliki kandungan asam linoleat
yang sangat tinggi. Semakin tinggi kandungan asam linoleat, semakin
Tabel 3. Komponen asam lemak pada minyak kedelai, minyak jagung, dan
minyak zaitun (Almatsier, 2002)
Komponen asam lemak Minyak kedelai (%)
Asam lemak tak jenuh:
Oleat (18:1)
Ada dua jenis minyak kedelai, yaitu minyak kedelai mentah (crude soybean oil) dan minyak kedelai yang dimurnikan (refined soybean oil). Proses pemurnian tidak mengubah komposisi asam lemak pada minyak
kedelai. Proses pemurnian hanya menghilangkan asam lemak bebas dan
pigmen, serta menurunkan kadar beberapa komponen seperti tokoferol,
sterol, dan squalane, seperti dapat dilihat pada Tabel 4. Minyak kedelai merk Happy adalah salah satu contoh minyak kedelai yang sudah
dimurnikan.
Tabel 4. Komponen minyak kedelai mentah dan minyak kedelai yang dimurnikan (Hui, 1996)
Komponen Crude oil Refined oil
Trigliserida (%) 95-97 >99
Fosfatida (%) 1.5-2.5 0.003-0.045
Nilai aktivitas antioksidan yang diperoleh dengan menggunakan
alat Rancimat dikenal sebagai faktor proteksi, yaitu rasio aktivitas
antioksidan sampel dan aktivitas antioksidan standar. Antioksidan standar
yang digunakan adalah BHT (Butylated Hydroxy Toluena). BHT dipilih sebagai antioksidan standar karena memiliki aktivitas antioksidan yang kuat
dan banyak digunakan dalam industri pangan (O'Sullivan et al., 2004). Aktivitas antioksidan sampel berdasarkan metode AOM dapat dilihat pada
Tabel 5.
Tabel 5. Aktivitas antioksidan berdasarkan metode AOM
Sampel Faktor proteksi rempah segar (%)
Cengkeh 69.32 63.18
Sampel yang memiliki faktor proteksi tertinggi berturut-turut
adalah cengkeh, kunyit, dan jahe dengan faktor proteksi berkisar 37%
hingga 70%, sedangkan lengkuas, kencur, dan bawang putih memiliki faktor
proteksi yang rendah yaitu dibawah 9%. Banyak penelitian membuktikan
bahwa cengkeh, kunyit, dan jahe memiliki aktivitas antioksidan yang tinggi.
Cengkeh menunjukkan aktivitas antioksidan yang sangat tinggi, diikuti
kunyit dan jahe (Yanishlieva-Maslarova dan Heinonen, 2001). Aktivitas
antioksidan dari fraksi yang larut etanol berdasarkan metode AOM
menunjukkan rempah dengan periode induksi terpanjang berturut-turut
adalah cengkeh (18.9 jam), kunyit (12.4 jam), dan jahe (11.7 jam) dengan
periode induksi kontrol 5.7 jam (Simic dan Karel, 1979).
Lengkuas dan kencur memiliki faktor proteksi yang rendah karena