SKRIPSI
PENENTUAN AKTIVITAS ANTIOKSIDAN RIMPANG SEGAR DAN RIMPANG BUBUK DENGAN UJI KADAR POLIFENOL DAN
ACTIVE OXYGEN METHOD (AOM)
Oleh :
CHRISTINE WUISAN F24103041
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PANGAN
INSTITUT PERTANIAN BOGOR BOGOR
PENENTUAN AKTIVITAS ANTIOKSIDAN RIMPANG SEGAR DAN RIMPANG BUBUK DENGAN UJI KADAR POLIFENOL DAN
ACTIVE OXYGEN METHOD (AOM)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pangan Institut Pertanian Bogor
Oleh :
CHRISTINE WUISAN F24103041
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PANGAN
INSTITUT PERTANIAN BOGOR BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PANGAN
PENENTUAN AKTIVITAS ANTIOKSIDAN RIMPANG SEGAR DAN RIMPANG BUBUK DENGAN UJI KADAR POLIFENOL DAN
ACTIVE OXYGEN METHOD (AOM)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pangan Institut Pertanian Bogor
Oleh :
CHRISTINE WUISAN F24103041
Tanggal lulus : 22 Agustus 2007
Menyetujui, Bogor, 23 Agustus 2007
Prof. Dr. Ir. H. Dedi Fardiaz, MSc Dosen Pembimbing
Mengetahui,
Dr. Ir. Dahrul Syah
Ketua Departemen Ilmu dan Teknologi Pangan
RIWAYAT PENULIS
Penulis dilahirkan di Jakarta pada tanggal 17 November 1984 dan merupakan anak tunggal dari pasangan
Charles Wuisan dan Hilda. Pendidikan dasar sampai menengah atas diselesaikan di sekolah Regina Pacis Bogor.
Penulis melanjutkan pendidikannya di Institut Pertanian Bogor pada tahun 2003 melalui jalur USMI. Selama kuliah, penulis aktif berorganisasi di Paduan Suara IPB Agria Swara sebagai staf dan koordinator Divisi Pengembangan Sumber Daya Manusia, serta aktif mengisi konser-konser yang diadakan Agria Swara dan beberapa paduan suara lainnya di luar IPB. Prestasi internasional yang pernah diraih bersama Agria Swara adalah Golden dan Silver Diplome pada the 4th Johannes-Brahms International Choir Competition and Festival di Wernigerode, Jerman pada tahun 2005.
Penulis juga aktif menjadi asisten praktikum Kimia Dasar I di Departemen Kimia. Di waktu luangnya, penulis bekerja sebagai guru biola di sekolah Gema Suara Musik Bogor dan Purwacaraka Music School.
Christine Wuisan. F24103041. Penentuan Aktivitas Antioksidan Rimpang Segar dan Rimpang Bubuk dengan Uji Kadar Polifenol dan Active Oxygen Method (AOM). Dibawah bimbingan: Prof. Dr. Ir. Dedi Fardiaz, MSc.
RINGKASAN
Oksigen sangat dibutuhkan tubuh namun juga merupakan senyawa radikal bebas, yang dapat menyebabkan berbagai penyakit sehingga tubuh memerlukan senyawa antioksidan. Antioksidan dapat melindungi senyawa lainnya dari oksigen dengan mereaksikan dirinya sendiri dengan oksigen. Rempah-rempah diketahui mengandung senyawa fenolik yang memiliki kapasitas antioksidan yang kuat.
Rimpang yang diteliti adalah lengkuas (Alpinia galanga), kencur (Kaemferia galanga L.), kunyit (Curcuma domestica Val), dan jahe (Zingiber officinale Rosc.). Sebagai tambahan perbandingan, diteliti juga bawang putih (Allium sativum L.) dan cengkeh (Syzygium aromaticum L.).
Kadar polifenol tertinggi dimiliki cengkeh, yaitu sebesar 619.94 mg/g solid untuk cengkeh segar dan 790.06 mg/g solid untuk cengkeh bubuk. Cengkeh mengandung kadar polifenol yang sangat tinggi karena cengkeh merupakan rempah utama penghasil eugenol dan senyawa galat. Kadar polifenol terendah dimiliki bawang putih, yaitu sebesar 2.81 mg/g solid untuk bawang putih segar dan 0.30 mg/g solid untuk bawang putih bubuk. Kadar polifenol yang rendah pada bawang putih disebabkan senyawa aktif dalam bawang putih, yaitu allicin bukan termasuk golongan polifenol, melainkan golongan thiosulfonat. Kencur, kunyit, dan bawang putih dalam bentuk segar memiliki kadar polifenol lebih tinggi daripada bentuk bubuknya, namun besarnya penurunan kadar polifenol berbeda- beda tergantung stabilitas masing-masing jenis polifenol. Lengkuas, jahe, dan cengkeh dalam bentuk bubuk memiliki kadar polifenol lebih tinggi dibandingkan bentuk segarnya karena terlepasnya polifenol terikat akibat perlakuan panas dan terbebasnya polifenol akibat kerusakan sel yang terjadi selama proses pengeringan.
Metode AOM dengan menggunakan alat Rancimat adalah metode untuk menentukan stabilitas minyak terhadap oksidasi yang dapat membuat minyak menjadi tengik. Waktu dimana jumlah senyawa volatil hasil oksidasi minyak meningkat dengan cepat disebut periode induksi. Rasio antara periode induksi sampel dan periode induksi standar (BHT) disebut faktor proteksi. Semakin tinggi faktor proteksi, semakin tinggi aktivitas antioksidan. Minyak yang dipilih sebagai media pada metode AOM adalah minyak dengan periode induksi terpendek, yaitu minyak kedelai merk Happy dengan periode induksi 7.67 jam.
Faktor proteksi rempah segar yang tertinggi dimiliki cengkeh (69.32%) dan yang terendah dimiliki lengkuas (5.65%), sedangkan faktor proteksi rempah bubuk yang tertinggi dimiliki cengkeh (63.18%) dan yang terendah dimiliki bawang putih (-4.24%). Lengkuas, jahe, dan cengkeh dalam bentuk bubuk memiliki kadar polifenol yang lebih tinggi dibandingkan bentuk segarnya, namun faktor proteksi dalam bentuk bubuk justru lebih rendah dibandingkan bentuk segarnya. Hal ini dapat terjadi karena polifenol terikat yang terlepas akibat perlakuan panas atau yang terbebas akibat kerusakan sel selama proses pengeringan, kemungkinan memiliki aktivitas antioksidan yang rendah, sehingga
meskipun terdapat dalam jumlah yang lebih banyak tetapi tidak meningkatkan aktivitas antioksidan rempah secara keseluruhan.
Hubungan kadar polifenol dan faktor proteksi menunjukkan kecenderungan meningkat. Semakin tinggi kadar polifenol, maka faktor proteksi juga akan semakin tinggi hingga mencapai batas tertentu. Peningkatan kadar polifenol pada kisaran 0-10 mg polifenol kurang berpengaruh terhadap peningkatan faktor proteksi sedangkan pada kisaran 10-20 mg polifenol, peningkatan kadar polifenol walaupun dalam jumlah sedikit dapat menyebabkan faktor proteksi mengalami banyak peningkatan. Peningkatan kadar polifenol pada kisaran 20-50 mg polifenol masih berpengaruh terhadap peningkatan faktor proteksi, meskipun tidak sebesar pengaruh peningkatan kadar polifenol pada kisaran 10-20 mg polifenol. Setelah melebihi 50 mg polifenol, peningkatan kadar polifenol walaupun dalam jumlah banyak tidak menyebabkan faktor proteksi mengalami banyak peningkatan. Hubungan kadar polifenol dan faktor proteksi tersebut dapat disebabkan perbedaan struktur polifenol dan kadar masing-masing jenis polifenol yang berbeda-beda pada setiap jenis rempah.
Secara keseluruhan, semua sampel dalam bentuk bubuk memiliki faktor proteksi yang lebih rendah dibandingkan bentuk segarnya. Keberadaan oksigen dan cahaya selama penyimpanan merupakan faktor yang mempengaruhi penurunan aktivitas antioksidan.
KATA PENGANTAR
Segala puji dan syukur hanya kepada Tuhan Yesus Kristus, karena berkat kasih karunia dan perlindunganNya penulis dapat menyelesaikan tugas akhir ini.
Pada kesempatan ini, penulis juga menyampaikan terima kepada semua pihak yang telah membantu penulis dalam penyusunan tugas akhir ini:
1. Prof. Dr. Ir. Dedi Fardiaz, MSc. selaku dosen pembimbing atas segala bimbingan dan masukannya yang positif, serta pengorbanan waktunya baik selama penelitian berlangsung maupun dalam penyelesaian skripsi ini.
2. Dr. Ir. Sukarno, MSi. dan Didah Nur Faridah STP, MSi. selaku dosen penguji yang bersedia menyediakan waktu untuk menguji dan memberikan masukan yang berguna bagi perbaikan skripsi ini.
3. Orang tua yang selalu memberikan dukungan moril dan materil.
4. Fany Nely (Nene), teman seperjuanganku. Terima kasih untuk segala ide dan semangat selama penelitian ini berlangsung.
5. Para pegawai dan laboran ITP : Pak Sobirin, Mbak Yane, Mbak Ririn, pak Rojak, Bu Rubiah, pak Misdi, pak Muchtadin, dan Mas Syamsu.
6. Kel atas kesediaannya mendengarkan segala keluhan dan memberikan saran.
7. Tia Hewan, my best roomate I’ve ever had, untuk semua pengalaman seru yang kita lewati bersama selama 4 tahun. Tidak lupa juga kepada Dhino, Puri, mbak Ndung, dan teman-teman lain di Perwira 9.
8. Teman-teman TPG 40, khususnya teman sekos (Tya, Rika, Agnes, Anas), Aji, Andreas, Erick, dan teman-teman golongan B.
9. Teman-teman Agria Swara, khususnya Greth, Putri, dan Inge. Pengalaman latihan sampai tengah malam, konser, dan ke Jerman tak akan terlupakan.
Penulis menyadari bahwa masih terdapat kekurangan dalam penelitian maupun penyusunan tugas akhir ini. Oleh karena itu, kritik dan saran yang membangun sangat penulis harapkan. Penulis berharap agar skripsi ini dapat bermanfaat bagi semua pihak yang membutuhkan.
Bogor, 22 Agustus 2007 Penulis
DAFTAR ISI
KATA PENGANTAR ... ...i
DAFTAR ISI ... ...ii
DAFTAR TABEL ... ...iv
DAFTAR GAMBAR ... ...v
DAFTAR LAMPIRAN ... ...vi
I. PENDAHULUAN ... ...1
A. Latar Belakang ... ...1
B. Tujuan Penelitian ... ...2
II. TINJAUAN PUSTAKA ... ...3
A. Rempah sebagai Sumber Antioksidan ... ...3
B. Lengkuas (Alpinia galanga L.) ... ...4
C. Kencur (Kaemferia galanga L.) ... ...5
D. Kunyit (Curcuma domestica Val.) ... ...6
E. Jahe (Zingiber officinale Rosc.) ... ...8
F. Cengkeh (Syzygium aromaticum L.) ... ...9
G. Bawang Putih (Allium sativum L.) ... ...11
H. Pengukuran Aktivitas Antioksidan dengan Uji Kadar Polifenol...12
I. Pengukuran Aktivitas Antioksidan berdasarkan Active Oxygen Method (AOM) ... ...14
III. METODOLOGI PENELITIAN ... ...18
A. Bahan dan Alat. ... ...18
B. Metode Penelitian ... ...18
1. Tahap Persiapan Sampel ... ...18
2. Uji Kadar Air (Park, 1996) ... ...19
3. Uji Kadar Polifenol (Oki et al, 2002)... ...19
4. Metode AOM (Beirao dan Bernardo-Gil, 2005) ... ...20
C. Perhitungan Hasil Pengamatan ... ...22
1. Uji Kadar Air ... ...22
2. Uji Polifenol ... ...22
3. Metode AOM ... ...22
IV. HASIL DAN PEMBAHASAN ... ...24
A. Kadar Polifenol ... ...24
B. Aktivitas Antioksidan berdasarkan metode AOM ... ...28
C. Hubungan Kadar Polifenol dan Aktivitas Antioksidan berdasarkan metode AOM ... ...32
V. KESIMPULAN DAN SARAN ... ...36
A. Kesimpulan ... ...36
B. Saran ... ...37
DAFTAR PUSTAKA ... ...38
LAMPIRAN ... ...43
DAFTAR TABEL
Tabel 1. Senyawa antioksidan yang telah berhasil diisolasi dari rempah-rempah (Pokorny et al., 2001) ... ...4 Tabel 2. Hasil metode AOM untuk seleksi minyak sebagai media pada alat
Rancimat ... ... 29 Tabel 3. Komponen asam lemak pada minyak kedelai, minyak jagung, dan
minyak zaitun (Almatsier, 2002) ... ...30 Tabel 4. Komponen minyak kedelai mentah dan minyak kedelai yang
dimurnikan (Hui, 1996) ... ...30 Tabel 5. Aktivitas antioksidan berdasarkan metode AOM ...31 Tabel 6. Perbandingan kadar polifenol dan faktor proteksi pada rempah
pasar dan rempah bubuk... ...33
DAFTAR GAMBAR
Gambar 1. Lengkuas (Alpinia galanga L.) ... ...5
Gambar 2. Kencur (Kaemferia galanga L.) ... ...6
Gambar 3. Kunyit (Curcuma domestica Val.) ... ...6
Gambar 4. Struktur kimia senyawa curcumin pada kunyit (Tiwari et al., 2006)..7
Gambar 5. Jahe putih besar (Zingiber officinale Rosc.) ... ...8
Gambar 6. Struktur kimia senyawa gingerol pada jahe (Tiwari et al., 2006)...9
Gambar 7. Bunga cengkeh (Syzygium aromaticum L.) ... ...10
Gambar 8. Struktur kimia eugenol pada cengkeh (Porter, 1979) ... ...10
Gambar 9. Bawang putih (Allium sativum L.) ... ...11
Gambar 10. Struktur kimia senyawa allicin pada bawang putih (Anonim, 2006d) ... ...12
Gambar 11. Asam fosfomolibdat yang tereduksi (The Grape Seed Method Evaluation Committee, 2001) ... ...13
Gambar 12. Alat Rancimat... ...15
Gambar 13. Skema deskripsi alat Rancimat (Löliger, 1983) ... ...16
Gambar 14. Penentuan periode induksi (Löliger, 1983) ... ....17
Gambar 15. Diagram alir analisis aktivitas antioksidan dengan uji polifenol dan metode AOM dengan menggunakan alat Rancimat ... ...21
Gambar 16. Pengukuran periode infleksi pada metode AOM ... ...22
Gambar 17. Asam galat ... ...24
Gambar 18. Kurva standar uji polifenol dengan standar asam galat... ...25
Gambar 19. Grafik perbandingan kadar polifenol rempah segar dan rempah bubuk ... ...26
Gambar 20. Grafik hubungan kadar polifenol dan aktivitas antioksidan berdasarkan metode AOM ... ....34
DAFTAR LAMPIRAN
Lampiran 1. Kadar air rempah segar basah dengan metode azeotropik
(dry basis) ... ...43
Lampiran 2. Kadar air rempah segar kering dengan metode oven vakum (dry basis) ... ...44
Lampiran 3. Kadar air rempah bubuk dengan metode oven vakum (dry basis) . ...45
Lampiran 4. Perhitungan uji kadar polifenol ... ...45
A. Kurva standar asam galat ... ...45
B. Rempah segar ... ...46
C. Rempah bubuk ... ...47
Lampiran 5. Perhitungan metode AOM ... ...48
A. Pemilihan minyak sebagai media pada metode AOM ... ...48
B. Faktor proteksi rempah segar ... ...49
C. Faktor proteksi rempah bubuk ... ...50
D. Kurva konduktivitas AOM dengan alat Rancimat ... ...51
BAB I. PENDAHULUAN
A. LATAR BELAKANG
Reaksi-reaksi yang terjadi di dalam tubuh manusia memerlukan oksigen, namun di lain pihak, oksigen juga merupakan senyawa oksidan yang dapat menimbulkan efek samping berbahaya, yang dapat menyebabkan kerusakan sel sehingga menimbulkan penyakit kronis (Anonim, 2006d).
Senyawa oksidan yang umumnya dikenal sebagai radikal bebas, dapat berasal dari dalam maupun luar tubuh. Sumber eksternal tersebut antara lain paparan sinar matahari dan polusi, minuman beralkohol, makanan yang tidak sehat, dan rokok. Radikal bebas ini menyerang sel-sel sehat dalam tubuh, termasuk DNA, protein, dan lemak, sehingga dapat menyebabkan gangguan fungsi imunitas, mempercepat proses penuaan, serta menimbulkan berbagai penyakit seperti katarak, kanker, penyakit jantung, artritis, dan penyakit kronis lainnya (Anonim, 2006d). Radikal bebas merupakan kunci utama penyebab penyakit infeksi dan non-infeksi serta berbagai penyakit dalam tubuh. Sebenarnya, secara normal tubuh dapat mengatasi radikal bebas tersebut, tapi dalam suatu kondisi tertentu tubuh tidak mampu mengatasinya sehingga memerlukan senyawa antiradikal bebas (Maslimah, 2004).
Antioksidan adalah suatu senyawa yang melindungi senyawa lainnya dari oksigen dengan mereaksikan dirinya sendiri dengan oksigen tersebut (Sizer and Whitney, 2000). Antioksidan juga dapat membantu memperbaiki kerusakan yang terjadi pada sel-sel tubuh. Beberapa enzim antioksidan dapat dihasilkan di dalam tubuh seperti superoksida dismutase, katalase, dan glutathion. Antioksidan lainnya dapat ditemukan di dalam bahan pangan seperti vitamin A, vitamin C, vitamin E, and beta-karoten pada sayur-sayuran berwarna. (Anonim, 2006d). Dalam 20 tahun terakhir, selain buah dan sayuran, rempah-rempah diketahui mengandung senyawa fenolik yang memiliki kapasitas antioksidan yang kuat (Benkeblia, 2005).
Rempah-rempah yang diteliti pada penelitian ini adalah kunyit, jahe, lengkuas, kencur, bawang putih, dan cengkeh. Rempah-rempah tersebut
merupakan rempah yang sering digunakan masyarakat Indonesia sebagai bumbu masakan maupun sebagai obat, serta pada banyak penelitian telah terbukti mengandung senyawa antioksidan.
B. TUJUAN PENELITIAN
Tujuan penelitian ini adalah untuk membandingkan aktivitas antioksidan rimpang segar dan rimpang bubuk. Rimpang yang dibandingkan adalah lengkuas (Alpinia galanga), kencur (Kaemferia galanga L.), kunyit (Curcuma domestica Val.), dan jahe (Zingiber officinale Rosc.). Sebagai tambahan perbandingan, diteliti juga bawang putih (Allium sativum L.) dan cengkeh (Syzygium aromaticum L.). Tujuan dari membandingkan rimpang segar dan rimpang bubuk adalah untuk melihat seberapa besar perbedaan kandungan antioksidan di antara keduanya.
BAB II. TINJAUAN PUSTAKA
A. REMPAH SEBAGAI SUMBER ANTIOKSIDAN
Istilah rempah-rempah (spices) berasal dari bahasa Latin, yaitu Species aromatacea yang berarti buah-buahan bumi (Farrell, 1990). Definisi rempah-rempah adalah segala komponen tumbuhan atau sayuran yang bersifat aromatik yang dikeringkan, berbau, aromatik, atau pedas, dalam bentuk utuh, dihancurkan, atau digiling, yang fungsi utamanya dalam makanan ialah sebagai bumbu. Rempah-rempah dapat berasal dari membran, kulit kayu, pucuk, umbi, bunga, buah, daun, rimpang (rhizoma), akar, biji, atau keseluruhan tanaman (Farrell, 1990).
Rempah-rempah yang merupakan umbi atau rimpang misalnya jahe, kunyit, temulawak, kencur, dan sebagainya. Rempah yang berasal dari biji misalnya pala, kemiri, kapol, dan lain-lain. Kayu manis dan kayu secang merupakan rempah yang berasal dari kulit pohon. Rempah yang berasal dari bunga misalnya cengkeh. Rempah yang berasal dari buah misalnya lada (Muchtadi dan Sugiyono, 1992).
Penelitian-penelitian terhadap sifat antioksidan dari rempah- rempah yang dilakukan pada tahun 1930-an menunjukkan bahwa beberapa jenis rempah-rempah dapat memperlambat terbentuknya peroksida pada minyak kacang dan menghambat ketengikan pada daging. Hak paten untuk antioksidan yang berasal dari rempah-rempah pertama kali dikeluarkan pada tahun 1938, dimana minyak cengkeh dapat mencegah terjadinya oksidasi minyak goreng. Pada banyak penelitian, pala, lada hitam, jahe, kunyit, oregano, rosemary, dan jenis rempah-rempah lainnya terbukti memiliki aktivitas antioksidan yang kuat.
Berdasarkan pelarut yang digunakan dalam ekstraksi rempah- rempah, hampir seluruh aktivitas antioksidan yang kuat ditemukan pada fraksi yang larut dalam etanol. Namun demikian, pelarut etanol memiliki kelemahan, yaitu tidak dapat mengekstraksi komponen hidrofilik (Farrell, 1985). Pengecualian hanya terjadi untuk cengkeh, dimana fraksi yang larut dalam etanol maupun dalam air sama-sama memiliki aktivitas antioksidan
yang kuat (Hirasa dan Takemasa, 1998). Ekstraksi rempah dengan pelarut etanol akan menghasilkan senyawa yang disebut oleoresin. Oleoresin memiliki sifat kental, kaya akan senyawa aromatik, dan secara alami mengandung antioksidan (Farrell, 1985).
Senyawa-senyawa antioksidan yang terdapat dalam berbagai jenis rempah-rempah juga telah dapat diidentifikasi. Contoh-contoh senyawa antioksidan pada rempah-rempah dapat dilihat pada Tabel 1.
Tabel 1. Senyawa antioksidan yang telah berhasil diisolasi dari rempah- rempah (Pokorny et al., 2001)
Nama Nama sistematis Senyawa
Rosemary Rosemarinus officinalis Asam karsonat, karnosol, asam rosmarinat, rosmanol Sage Salvia officinalis Asam karsonat, karnosol,
asam rosmarinat, rosmanol Oregano Origanum vulgare Turunan asam fenolat,
flavonoid, tokoferol
Thyme Thymus vulgaris Thymol, karvakrol, p-cumne- 2,3-diol, bifenil, flavonoid Jahe Zingiber officinalis Gingerol, diarilheptanoid Kunyit Curcuma domestica Kurkumin
Lada hitam Piper nigrum Amida fenolik, flavonoid Paprika merah Capsicum annum Capsaicin
Cabe merah Capsicum frutesence Capsaicin, capsaicinol Cengkeh Eugenia caryophylatta Eugenol, galat
Licorice Glycyrrhiza glabra Flavonoid, fenolik
B. LENGKUAS (Alpinia galanga L.)
Lengkuas termasuk dalam famili Zingiberaceae. Lengkuas dapat hidup di daerah dataran rendah sampai dataran tinggi, lebih kurang 1200 meter di atas permukaan laut. Lengkuas termasuk tumbuhan tegak yang tinggi batangnya mencapai 2-2.5 meter. Lengkuas mempunyai batang pohon
yang terdiri dari susunan pelepah-pelepah daun. Bunganya muncul pada bagian ujung tumbuhan. Rimpang umbi lengkuas selain berserat kasar juga mempunyai aroma yang khas (Anonim, 2005b).
Ada 2 jenis lengkuas berdasarkan warna umbinya yaitu lengkuas putih dan lengkuas merah. Lengkuas putih dipakai sebagai penyedap masakan, sedangkan lengkuas merah digunakan sebagai obat (Anonim, 2005b). Lengkuas yang dipakai pada penelitian ini adalah lengkuas putih, seperti yang terlihat pada Gambar 1.
Gambar 1. Lengkuas (Alpinia galanga L.)
Berdasarkan uji DPPH, minyak volatil lengkuas memiliki aktivitas antioksidan yang kuat dengan persen inhibisi sebesar 86.6-92.5% dengan komponen utamanya adalah trans-3-acetoxy-1,8 cineole. Namun demikian, ekstrak lengkuas dengan pelarut metanol memiliki aktivitas antioksidan yang tidak terlalu tinggi. Komponen utama pada ekstrak lengkuas dengan pelarut metanol adalah p-coumaryl-9-methyl ether (Zaeoung et al., 2005).
C. KENCUR (Kaemferia galanga L.)
Kencur termasuk dalam famili Zingiberaceae. Bentuk kencur dapat dilihat pada Gambar 2. Menurut Tewtrakul et al. (2005), minyak volatil kencur yang diperoleh dari distilasi air mengandung 31.77% etil-p- metoksisinamat, 23.23% metilsinamat, 11.13% karvon, 9.59% eukaliptol, dan 6.41% pentadekan. Namun demikian, kandungan minyak kencur dapat saja berbeda, tergantung kondisi iklim dan geografis tempat asal kencur yang digunakan.
Gambar 2. Kencur (Kaemferia galanga L.)
Ekstrak kencur diketahui dapat melawan infeksi bakteri. Secara tradisional, kencur digunakan untuk mengobati scariasis dan tumor, digunakan secara eksternal untuk mengobati sakit perut, dan secara topikal untuk mengobati rematik. Komponen terbesar minyak kencur yaitu etil-p- metoksisinamat telah dilaporkan memiliki banyak aktivitas biologis seperti antikanker dan anti-monoamin oksidase (Tewtrakul et al., 2005).
D. KUNYIT (Curcuma domestica Val.)
Tanaman kunyit aslinya berasal dari daerah Asia Selatan, kemudian tersebar ke Jepang, Malaysia, dan Sri Langka. Kunyit merupakan tanaman tropis yang memiliki sistem reproduksi berupa rimpang (rhizoma).
Bentuk kunyit dapat dilihat pada Gambar 3.
Gambar 3. Kunyit (Curcuma domestica Val.)
Kunyit banyak digunakan pada makanan kari, acar, dan mustard.
Pigmen warna kuning pada kunyit disebut curcumin atau bis (4-hidroxy-3- methoxy cinnamoyl) methane. Struktur kimia senyawa curcumin dapat
dilihat pada Gambar 4. Warna kunyit sensitif terhadap pH, dimana warna kuning yang paling cerah terbentuk pada suasana asam (Farrell, 1990).
Gambar 4. Struktur kimia senyawa curcumin pada kunyit (Tiwari et al., 2006)
Senyawa antioksidan pada kunyit antara lain curcumin atau bis (4- hidroxy-3-methoxy cinnamoyl) methane, 4-hidroxycinnamoyl (feruloyl) methane, dan bis (4-hidroxycinnamoyl) methane (Hirasa dan Takemasa, 1998). Curcumin akhir-akhir ini populer di banyak majalah dan surat kabar karena terbukti memiliki manfaat kesehatan berdasarkan penelitian- penelitian laboratorium. Bubuk kunyit murni memiliki konsentrasi curcumin sekitar 3% w/w. Para peneliti telah menemukan bahwa curcumin dapat meningkatkan kinerja TRAIL dua hingga tiga kali lipat. TRAIL (Tumor necrosis factor-Related Apoptosis-Inducing Ligand) adalah molekul yang terdapat secara alami dalam tubuh yang membantu membunuh sel-sel kanker. Curcumin juga ditemukan dapat menghentikan replikasi sel-sel leukemia, mengurangi kerusakan jaringan jantung dari kekurangan oksigen dan aliran darah, serta melindungi tubuh dari bahaya asap rokok (Anonim, 2006a).
Kunyit banyak dikonsumsi masyarakat dan saat ini kunyit banyak diteliti kegunaannya karena kandungan metabolitnya yang besar, dengan struktur kurkuminoid yang terbukti mampu menangkap radikal bebas DPPH secara in vitro dua buah radikal aroxyl yang terbentuk setelah curcumin mendonorkan atom hidrogennya kepada radikal DPPH. Mekanisme antioksidan di dalam lipid tak jenuh (linoleat) terjadi karena gugus fenolik pada curcumin dapat bereaksi dengan peroksida radikal (Zaeoung et al., 2005).
E. JAHE (Zingiber officinale Rosc.)
Tanaman jahe termasuk dalam famili Zingiberaceae, merupakan tanaman berumur panjang dengan rimpang di dalam tanah yang bercabang- cabang dan ke atas mengeluarkan tunas serta batang-batang yang dibalut oleh pelepah daun, dengan tinggi tanaman yang dapat mencapai 0.4-0.6 meter.
Bagian jahe yang banyak digunakan manusia adalah rhizoma atau rimpangnya. Rimpang jahe merupakan batang yang tumbuh dalam tanah dan dipanen setelah berumur 9-11 bulan. Rimpang jahe bercabang-cabang tidak teratur, berserat, dan berbau khas aromatik (Sutarno et al., 1999).
Berdasarkan bentuk, ukuran, dan warna rimpangnya, dikenal tigs varietas, yaitu jahe putih besar (jahe gajah, jahe badak), jahe putih kecil (jahe emprit), dan jahe merah (jahe sunti). Diantara ketiga varietas tersebut, yang banyak digunakan sebagai obat adalah jahe merah karena kandungan minyak atsirinya lebih banyak (Wijayakusuma, 2002). Jahe yang digunakan dalam penelitian ini adalah jahe putih besar. Bentuk jahe putih besar dapat dilihat pada Gambar 5.
Gambar 5. Jahe putih besar (Zingiber officinale Rosc.)
Rimpang jahe berasa pedas karena mengandung minyak atsiri sebesar 0.25-3.3%, yang kadarnya bervariasi tergantung jenis jahe. Selain itu, rimpang jahe mengandung oleoresin sebanyak 4.3-6.0% yang terdiri dari gingerol dan shogaol (hasil dehidrasi gingerol). Oleoresin pada jahe juga menimbulkan rasa pedas atau pungent (Sutarno et al., 1999). Minyak jahe berwarna kuning dan kental. Minyak ini kebanyakan mengandung terpen,
fellandren, dekstrokamfen, bahan sesquiterpen yang dinamakan zingiberen, zingeron damar, dan pati (Achyad dan Rasyidah, 2000).
Ekstrak jahe dengan pelarut metanol menunjukkan aktivitas antioksidan yang tinggi, yaitu sekitar 2-4 kali BHT. Aktivitas antioksidan yang tinggi pada ekstrak jahe disebabkan kandungan gingerol dan shogaol yang memiliki gugus hidroksil (Zaeoung et al., 2005). Struktur kimia senyawa gingerol dapat dilihat pada Gambar 6.
Gambar 6. Struktur kimia senyawa gingerol pada jahe (Tiwari et al., 2006)
Ekstrak jahe mempunyai daya antioksidan yang dapat dimanfaatkan untuk mengawetkan minyak dan lemak. Jahe memiliki kandungan senyawa aktif yang mampu berfungsi sebagai antioksidan.
Menurut Vankar et al. (2006), aktivitas antioksidan dengan DPPH pada jahe bubuk sebelum dipanaskan dengan standar BHT adalah sebesar 10.81% dan setelah dipanaskan 120oC adalah 6.01%, sedangkan dengan standar pyragallol, aktivitas antioksidan dengan metode DPPH adalah 4.13% dan setelah dipanaskan 120oC adalah 1.36%.
F. CENGKEH (Syzygium aromaticum L.)
Tanaman cengkeh termasuk ke dalam familii Myrtaceae. Cengkeh merupakan tanaman indigenus dari lima pulau kecil yaitu Pulau Ternate, Tidore, Mutir, Machian, dan Bachian. Cengkeh dalam bahasa Inggris disebut clove, yang diturunkan dari bahasa Perancis dan Spanyol yang berarti paku, karena bentuk cengkeh yang mirip paku berkepala bulat (Farrell, 1990). Bentuk cengkeh dapat dilihat pada Gambar 7.
Gambar 7. Bunga cengkeh
Pohon cengkeh dapat mencapai tinggi 20-30 meter dan umurnya dapat mencapai lebih dari seratus tahun (Hadiwijaya, 1986). Myrtaceae terdiri dari 30000 spesies pohon dan semak dari daerah tropika dan subtropika. Menurut Purseglove et al. (1981), bunga cengkeh mempunyai aroma yang lebih kuat, lebih tajam, dan lebih getir dan pedas dibandingkan gagang dan daun cengkeh. Bunga cengkeh terutama digunakan untuk campuran rokok kretek.
Sifat khas yang dimiliki tanaman cengkeh yaitu semua bagian tanaman mengandung minyak, mulai dari akar, batang, daun, dan bunga.
Kandungan minyak tertinggi terdapat pada bagian bunga (Bintoro, 1986).
Kandungan minyak cengkeh adalah eugenol (2-metoksi-4-alil fenol) 90%, eugenol asetat, metil n-heptil alkohol, benzil alkohol, metil salisilat, metil n-amil karbinol, dan terpene caryophylene (Harris, 1987).
Eugenol adalah senyawa utama pada minyak esensial cengkeh (Hirasa dan Takemasa, 1998). Eugenol inilah yang memberikan aroma khas cengkeh.
Namun demikian, cengkeh yang berasal dari daerah berbeda mempunyai kadar minyak atsiri dan kadar total eugenol yang berbeda (Kardiman, 2005).
Struktur kimia eugenol dapat dilihat pada Gambar 8.
Gambar 8. Struktur kimia eugenol pada cengkeh (Porter, 1979)
Minyak cengkeh merupakan hasil sulingan serbuk kuntum cengkeh kering, yang digunakan untuk penyedap rasa, parfum, dan kebutuhan industri farmasi. Minyaknya banyak digunakan untuk bahan baku industri pangan, parfum, obat-obatan, dan bahan peledak dalam industri senjata (Ketaren, 1985).
Minyak bunga cengkeh merupakan sumber eugenol yang lebih besar dibandingkan tangkai bunga dan daun. Eugenol dapat menjadi bahan pembuat vanilin dalam bentuk isoeugenol (Anonim, 1975). Minyak bunga cengkeh digunakan sebagai bau khas rokok dan obat-obatan seperti analgesik gigi dan karminatif. Dalam bidang farmasi, eugenol ditambahkan formaldehid dan garam natrium yang akan membentuk eugeoform yang berguna sebagai obat kolera, demam, dan tipus. Eugenol juga berguna sebagai antiseptik, desinfektan, penenang syaraf, dan obat penyakit paru- paru (Gardner dan Cooke, 1971).
G. BAWANG PUTIH (Allium sativum L.)
Bawang putih aslinya berasal dari padang gurun Kirghiz dan Asia Barat. Bawang putih dapat tumbuh hampir di seluruh negara beriklim hangat dan semitropis di seluruh dunia (Farrell, 1985). Bawang putih adalah salah satu tanaman paling awal yang ditanam manusia karena kemudahannya dibawa dan disimpan. Bawang putih dapat dikeringkan dan diawetkan untuk beberapa bulan. Bawang putih termasuk dalam famili Allium. Hingga kini sudah ditemukan lebih dari 500 lebih jenis bawang yang termasuk famili Allium, yang masing-masing memiliki rasa, bentuk, dan warna yang berbeda-beda namun mirip dalam kandungan biokimia, fitokimia, dan neutraceutical (Benkeblia, 2005). Bentuk bawang putih dapat dilihat pada Gambar 9.
Gambar 9. Bawang putih (Allium sativum L.)
Senyawa aktif dalam bawang putih disebut allicin (C3H5-S-S- C3H5). Ketika bawang putih dipotong atau dilukai, allicin akan terpecah menjadi dialil disulfida yang menyebabkan bau khas pada bawang putih (Farrell, 1985). Struktur kimia senyawa allicin dapat dilihat pada Gambar 10.
Gambar 10. Struktur kimia senyawa allicin pada bawang putih (Anonim, 2006d)
Ekstrak Allium dikenal memiliki aktivitas antibakteri dan antifungal, mengandung antioksidan yang kuat, sulfur, dan banyak senyawa fenolik, sehingga kini Allium banyak diteliti kegunaannya (Benkeblia, 2005). Bawang putih mengandung alilsulfida yang dapat memperlambat oksidasi pada daging babi (Hirasa dan Takemasa, 1998).
Perlakuan panas dapat menurunkan aktivitas antioksidan dalam ekstrak Allium, sehingga pemanasan dalam persiapan makanan dan pemasakan perlu diperhatikan dengan hati-hati untuk melindungi antioksidan (Benkeblia, 2005). Allicin bersifat tidak stabil jika dikeluarkan dari bawang putih dan proses pengolahan dapat menyebabkan allicin terdegradasi menjadi senyawa yang tidak dapat terdeteksi (Yu dan Wu, 1989).
H. PENGUKURAN AKTIVITAS ANTIOKSIDAN DENGAN UJI KADAR POLIFENOL
Antioksidan adalah suatu senyawa yang melindungi senyawa lainnya dari oksigen dengan mereaksikan dirinya sendiri dengan oksigen tersebut (Sizer dan Whitney, 2000). Antioksidan ada yang berasal secara alami dari tanaman seperti vitamin C dan E, dan ada pula yang antioksidan sintetik seperti BHT dan propil galat (Lindsay, 1996).
Secara umum, antioksidan adalah senyawa yang mampu untuk menghambat dan mencegah proses oksidasi, akan tetapi tidak dapat meningkatkan kualitas dari produk yang sudah teroksidasi. Antioksidan untuk penggunaan dalam makanan harus memenuhi beberapa persyaratan antara lain efektif dalam konsentrasi rendah, dapat bergabung dengan substrat, tidak mempengaruhi sensori produk makanan (off-color, off-odor, off-taste), dan tidak toksik (Schuler, 1990).
Sebelum mengukur kadar antioksidan, sampel harus diekstrak terlebih dahulu. Pelarut yang digunakan untuk ekstraksi sampel adalah etanol karena hampir seluruh aktivitas antioksidan yang kuat ditemukan pada fraksi yang larut dalam etanol (Hirasa dan Takemasa, 1998). Fraksi polar yang larut dalam etanol memiliki aktivitas antioksidan yang lebih kuat daripada fraksi yang tidak larut dalam etanol (Pokorny, 2001). Ekstraksi dilakukan dengan menggunakan refluks pada suhu 50oC.
Uji kadar polifenol didasarkan pada prinsip reaksi oksidasi-reduksi dengan menggunakan reagen Folin-Ciocalteau. Reagen Folin-Ciocalteau merupakan campuran asam fosfomolibdat dan asam fosfotungstat.
Antioksidan dapat mereduksi reagen sehingga terbentuk kompleks warna biru (kromatogen) dengan absorbansi maksimum pada panjang gelombang 745-750 nm (Nollet, 1996). Asam fosfotungstat (P2W18O62-7) tereduksi menjadi H4P2W18O62-8 dan asam fosfomolibdat (H2P2Mo18O62-6) tereduksi menjadi H6P2Mo18O62-6 (The Grape Seed Method Evaluation Committee, 2001). Struktur kimia asam fosfomolibdat yang telah tereduksi dapat dilihat pada Gambar 11.
Gambar 11. Asam fosfomolibdat yang tereduksi (The Grape Seed Method Evaluation Committee, 2001)
Uji kadar polifenol memiliki kelebihan, yaitu dapat menghitung secara kuantitatif semua grup fenolik seperti quercetin, antosianin, dan fenolik pada teh hijau. Namun demikian, uji kadar polifenol juga memiliki kelemahan, antara lain tidak mampu membedakan tipe-tipe fenol yang terkandung (monomer/dimer/trimer). Selain itu, keberadaan protein, asam nukleat, dan asam askorbat dapat mempengaruhi uji polifenol (Lee dan Widmer, 1996).
Sebagai garam basa, Na2CO3 berfungsi memberikan suasana basa karena pembentukan warna biru sangat bergantung pada pH. Nilai pH yang paling sesuai adalah 10 – 10.5. Namun demikian, reagen Folin-Ciocalteau tidak stabil pada pH basa sehingga ketepatan waktu dalam setiap tahap sangat diperlukan. Setelah penambahan pereaksi, selalu dilakukan pendiaman agar reaksi dapat berjalan sempurna. Reaksi yang tidak berjalan sempurna dapat menyebabkan kesalahan negatif, yaitu hasil percobaan lebih rendah dari yang seharusnya (Lee dan Widmer, 1996).
Standar polifenol yang digunakan adalah asam galat (asam 3,4,5- hidroksibenzoat). Asam galat merupakan asam organik yang secara alami terdapat pada daun teh, kayu oak, dan tanaman lainnya. (Anonim, 2006c).
Hasil uji polifenol diekspresikan sebagai GAE (Gallic Acid Equivalents) (The Grape Seed Method Evaluation Committee, 2001).
Semakin tinggi kadar polifenol yang terkandung dalam suatu sampel, semakin banyak molekul kromatogen yang terbentuk. Akibatnya, intensitas warna biru yang dihasilkan semakin tinggi dan nilai absorbansinya juga semakin tinggi. Oleh karena itu, dapat disimpulkan bahwa kadar polifenol berbanding lurus dengan nilai absorbansi.
I. PENGUKURAN AKTIVITAS ANTIOKSIDAN BERDASARKAN ACTIVE OXYGEN METHOD (AOM)
Menurut Almatsier (2002), pada saat lipid bersentuhan dengan udara untuk jangka waktu yang lama, oksigen akan terikat pada ikatan rangkap dan membentuk peroksida aktif. Peroksida aktif ini sangat reaktif dan dapat membentuk hidroperoksida yang bersifat sangat tidak stabil dan mudah pecah menjadi senyawa dengan rantai karbon pendek berupa asam-
asam lemak, aldehida-aldehida, dan keton yang bersifat volatil (mudah menguap) dan menimbulkan bau tengik pada minyak.
Metode AOM pada penelitian ini menggunakan alat Rancimat.
Metode ini membutuhkan minyak murni sebagai media. Minyak yang digunakan adalah minyak yang memiliki kandungan asam lemak tak jenuh tinggi, karena asam lemak tak jenuh mudah teroksidasi. Hal tersebut bertujuan agar waktu yang terpakai untuk mencapai waktu infleksi lebih singkat dan lebih efisien. Beberapa penelitian seperti yang dilakukan Beirao dan Bernardo-Gil (2005) menggunakan minyak bunga matahari, namun sayangnya minyak tersebut sulit didapatkan di Indonesia. Minyak kaya asam lemak tak jenuh yang banyak terdapat di segaran Indonesia antara lain minyak kedelai, minyak jagung, dan minyak zaitun.
Alat Rancimat dikembangkan dari metode AOM. Penggunaan alat Rancimat lebih berkembang dari segi waktu dan sekarang telah banyak digunakan dalam standar nasional dan internasional seperti AOCS Cd 12b- 92 dan ISO 6886 (Anonim, 1999). Bentuk alat Rancimat dapat dilihat pada Gambar 12.
Gambar 12. Alat Rancimat
Pada metode AOM dengan menggunakan alat Rancimat, minyak murni dipaparkan aliran udara pada suhu 50o-220oC. Suhu dapat diatur sedemikian rupa sehingga periode induksi berkisar 4–15 jam (Gordon, 2001). Suhu yang biasanya digunakan adalah 100oC (Hudson, 1983). Produk oksidasi yang bersifat volatil lalu ditransfer dengan aliran udara ke alat pengukur dan diserap oleh air demineral sebagai larutan pengukur (Anonim, 1999). Beberapa produk oksidasi bersifat volatil dan ionik, seperti
hidroperoksida dan asam format, yang akan meningkatkan konduktivitas air demineral (Löliger, 1983). Konduktivitas larutan pengukur ini dicatat secara kontinu sehingga diperoleh kurva konduktivitas. Skema alat Rancimat dapat dilihat pada Gambar 13.
Gambar 13. Skema deskripsi alat Rancimat (Löliger, 1983)
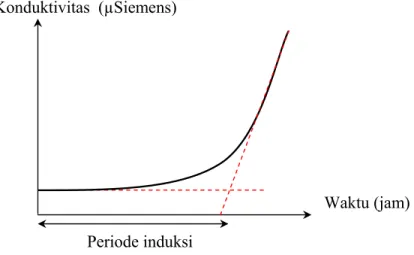
Kurva konduktivitas pada awalnya akan terlihat landai karena produk oksidasi belum terbentuk dan belum ada peningkatan konduktivitas.
Kenaikan kurva yang tajam menunjukkan bahwa periode induksi telah tercapai. Periode induksi berhubungan dengan terbentuknya asam karboksilat volatil yang merupakan produk akhir oksidasi (Hudson, 1983).
Periode induksi merupakan nilai yang baik untuk menunjukkan stabilitas oksidasi (Anonim, 1999).
Ada dua cara dalam menentukan periode induksi, yaitu cara otomatis dan cara manual. Cara otomatis menggunakan turunan kedua dari kurva konduktivitas yang tercatat. Dengan cara manual, periode induksi merupakan perpotongan antara dua garis lurus perpanjangan kurva konduktivitas (Anonim, 1999) seperti yang dapat dilihat pada Gambar 14, sehingga periode induksi dapat juga disebut titik infleksi. Pada penelitian ini, penentuan periode induksi dilakukan dengan cara manual.
Gambar 14. Penentuan periode induksi (Löliger, 1983)
BAB III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Bahan sampel yang digunakan dalam penelitian ini adalah yaitu lengkuas (Alpinia galanga L.), kencur (Kaemferia galanga L.), kunyit (Curcuma domestica Val), jahe (Zingiber officinale rosc.), bawang putih (Allium sativum L.), dan cengkeh (Syzygium aromaticum L.). Sampel segar dibeli di segar tradisional Warung Jambu Bogor, sedangkan sampel bubuk merk “Koepoe-Koepoe” dibeli di segar swalayan Giant Bogor. Bahan-bahan lain yang digunakan adalah minyak jagung merk Tropicana Slim, minyak jagung merk Mazola, minyak kedelai merk Happy, minyak zaitun merk Bertolli Extra Virgin, kertas saring, pelarut etanol 95%, toluena, pereaksi Folin Ciocalteau, larutan Na2CO3 10%, asam galat, dan antioksidan BHT (Butylated Hidroxy Toluena).
Alat-alat yang digunakan adalah botol gelas, tabung reaksi, neraca analitik, rotavapor (Buchi), oven vakum (OSK), filter vakum, gegep besi, spektrofotometer (Spectronic 200+), alat Rancimat (Metrohm 743 Rancimat 1.0), kuvet, pipet tetes, pipet Mohr 1 ml dan 10 ml, bulb, gelas piala, gelas ukur, sudip, gelas pengaduk, labu takar 10 ml, labu erlenmeyer 250 ml, pemanas pelat, labu didih 100 ml, tabung connector, dan labu Bidwell- Sterling.
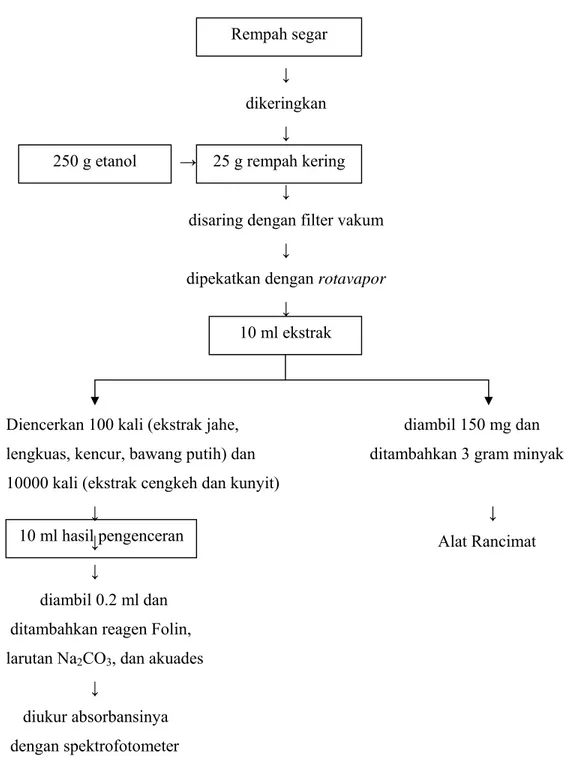
B. METODE PENELITIAN 1. Tahap persiapan sampel
Proses pembuatan ekstrak sampel dilakukan sebagai berikut:
Sampel segar (lengkuas, jahe, kencur, kunyit, dan bawang putih) dicacah halus dan ditimbang sebanyak 100 gram lalu dikeringkan dengan oven vakum pada suhu 60oC dan tekanan 250 mmHg. Sampel segar yang sudah kering lalu diblender, ditimbang sebanyak 25 gram, lalu dimasukkan ke dalam 150 gram pelarut (etanol). Cengkeh dan rempah bubuk dapat langsung ditimbang sebanyak 25 gram dan dimasukkan ke dalam 150 gram pelarut (etanol). Sampel dan pelarut
lalu direfluks pada suhu 50oC selama dua jam. Ekstrak yang diperoleh disaring dengan filter vakum dan sampel dicuci sebanyak dua kali dengan masing-masing 50 gram etanol, sehingga total etanol (pelarut) yang digunakan sebanyak 250 gram.
Ekstrak hasil refluks lalu dipekatkan dengan rotavapor pada suhu 50oC selama kurang lebih 50 menit hingga volumenya kurang dari 10 ml. Ekstrak yang diperoleh dimasukkan dalam labu takar 10 ml yang telah ditimbang terlebih dahulu berat kosongnya lalu ditera dengan menambahkan bilasan labu rotavapor agar tidak ada ekstrak pekat yang tertinggal di dalam labu rotavapor. Setelah ekstrak beserta labu takar ditimbang, ekstrak dituang ke dalam botol atau vial. Ekstrak lalu disimpan di dalam lemari es dan siap digunakan.
2. Uji kadar air (Park, 1996)
Uji kadar air untuk sampel segar (lengkuas, jahe, kencur, kunyit, dan bawang putih) dilakukan dengan metode azeotropik.
Sampel ditimbang sebanyak 3 gram dan dimasukkan dalam labu didih 100 ml. Toluena sebanyak 60 ml lalu dimasukkan ke dalam labu didih.
Pemanasan dilakukan sampai tidak ada air lagi yang masuk ke labu Bidwell-Sterling.
Cengkeh dan sampel bubuk ditimbang sebanyak 3-5 gram lalu dimasukkan ke dalam oven vakum pada suhu 60oC dan tekanan 250 mmHg hingga beratnya stabil.
3. Uji kadar polifenol (Oki et al., 2002)
Pengujian kadar polifenol membutuhkan larutan blanko, larutan kontrol, dan larutan standar. Larutan blanko dibuat dengan cara mencampurkan 0.2 ml ekstrak sampel, 1 ml larutan Na2CO3 10%, dan 6 ml akuades. Larutan sampel dibuat dengan cara mencampurkan 0.2 ml ekstrak sampel, 1 ml larutan Na2CO3 10%, 1 ml Folin Ciocalteau, dan 5 ml aquades. Sebelum dicampurkan, ekstrak sampel jahe, lengkuas, kencur, dan bawang putih diencerkan terlebih dahulu sebesar
100 kali sedangkan ekstrak cengkeh dan kunyit diencerkan sebesar 10000 kali. Larutan standar dibuat dengan cara membuat terlebih dahulu larutan stok dengan konsentrasi 0.10 mg asam galat/gram etanol. Larutan stok lalu diencerkan hingga konsentrasi 0, 0.02, 0.04, 0.06, 0.08, mg/g etanol. Absorbansi larutan blanko, larutan kontrol, larutan standar, dan larutan sampel diukur dengan alat spektrofotometer pada panjang gelombang 750 nm.
4. Metode AOM (Beirao dan Bernardo-Gil, 2005)
Active Oxygen Method adalah suatu metode untuk menentukan stabilitas minyak terhadap oksidasi yang dapat membuat minyak menjadi tengik (rancid). Minyak sebanyak 3 gram dicampurkan dengan 150 mg ekstrak sampel, lalu dihembuskan oksigen pada suhu 100oC sehingga minyak akan teroksidasi. Produk oksidasi yang bersifat volatil ditransfer dengan aliran udara ke alat pengukur dan diserap oleh larutan pengukur (air demineral). Konduktivitas larutan pengukur ini dicatat secara kontinu sehingga diperoleh kurva konduktivitas.
Periode dimana jumlah senyawa volatil hasil oksidasi minyak meningkat dengan cepat disebut periode induksi. Periode induksi ditentukan dengan mencari perpotongan antara dua garis lurus perpanjangan kurva konduktivitas versus waktu. Semakin lama periode induksi, berarti semakin tinggi aktivitas antioksidan sampel.
Pemilihan minyak yang akan digunakan sebagai media pada uji rancimat dilakukan dengan menyeleksi minyak berdasarkan periode induksi yang terpendek. Berdasarkan pengamatan di lapangan, terdapat empat jenis minyak yang memiliki klaim kaya asam lemak tak jenuh dan 100% murni (tidak ditambahkan pengawet), yaitu minyak jagung merk Tropicana Slim, minyak jagung merk Mazola, minyak kedelai merk Happy, dan minyak zaitun merk Bertolli Extra Virgin. Keempat minyak tersebut diukur periode induksinya dan minyak yang dipilih adalah minyak dengan periode induksi terpendek.
10 ml ekstrak
10 ml hasil pengenceran
↓ dikeringkan
↓ →
↓
disaring dengan filter vakum
↓
dipekatkan dengan rotavapor
↓
Diencerkan 100 kali (ekstrak jahe, diambil 150 mg dan lengkuas, kencur, bawang putih) dan ditambahkan 3 gram minyak 10000 kali (ekstrak cengkeh dan kunyit)
↓ ↓ ↓ Alat Rancimat
↓
diambil 0.2 ml dan ditambahkan reagen Folin, larutan Na2CO3, dan akuades ↓
diukur absorbansinya dengan spektrofotometer
Gambar 15. Diagram alir analisis aktivitas antioksidan dengan uji polifenol dan metode AOM
Rempah segar
25 g rempah kering 250 g etanol
C. PERHITUNGAN HASIL PENGAMATAN 1. Uji Kadar Air
Perhitungan kadar air berdasarkan berat kering, yaitu dengan rumus :
% kadar air = Berat awal - Berat akhir x 100%
Berat akhir
2. Uji Kadar Polifenol
Absorbansi larutan standar diplotkan menjadi kurva standar, dengan sumbu x adalah konsentrasi asam galat (mg/ml pelarut) dan sumbu y adalah absorbansi. Kadar polifenol larutan sampel diperoleh dengan cara memasukkan nilai absorbansi sampel ke dalam persamaan kurva standar. Kadar polifenol sampel berbanding lurus dengan nilai absorbansi.
3. Metode AOM
Stabilitas oksidasi ditentukan dengan menggunakan kurva waktu vs konduktivitas yang disebut kurva konduktivitas. Periode induksi ditentukan dengan mencari perpotongan antara dua garis lurus perpanjangan kurva waktu vs konduktivitas. Pengukuran periode induksi dapat dilihat pada Gambar 16.
Konduktivitas (µSiemens)
Waktu (jam) Periode induksi
Gambar 16. Pengukuran periode induksi pada metode AOM
Aktivitas antioksidan ditentukan oleh faktor proteksi dengan rumus:
Faktor proteksi (%) = periode induksi minyak + sampel x100%
periode induksi minyak + BHT
Semakin tinggi faktor proteksi yang diperoleh, semakin tinggi pula aktivitas antioksidan sampel.
BAB IV. HASIL DAN PEMBAHASAN
A. KADAR POLIFENOL
Metode Folin Ciocalteau didasarkan pada kekuatan reduksi gugus hidroksil fenolik dan sangat tidak spesifik karena tidak dapat membedakan antar jenis komponen fenolik, tetapi dapat mendeteksi semua jenis fenol dengan sensifitas yang bervariasi. Reaksi oksidasi reduksi ini muncul pada kondisi alkali dimana fenol mereduksi kompleks fosfotungstat- fosfomolibdat pada reagen sehingga menjadi warna biru. Semakin tinggi jumlah gugus hidroksil fenolik maka semakin besar konsentrasi komponen fenolik yang terdeteksi (Khadambi, 2007).
Standar yang digunakan pada uji kadar polifenol adalah asam galat.
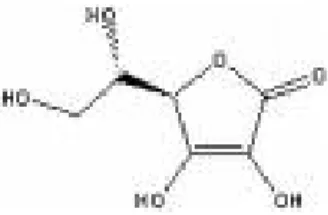
Asam galat adalah asam organik dengan nama kimia asam 3,4,5-trihidroksi benzoat (C6H2(OH)3CO2H). Struktur asam galat dapat dilihat pada Gambar 12. Asam galat murni berbentuk bubuk organik kristal tak berwarna dan berupa molekul bebas atau bagian dari molekul tanin. Asam galat mempunyai sifat antifungal, antioksidan, dan antiviral.
Gambar 17. Asam galat (Anonim, 2006c)
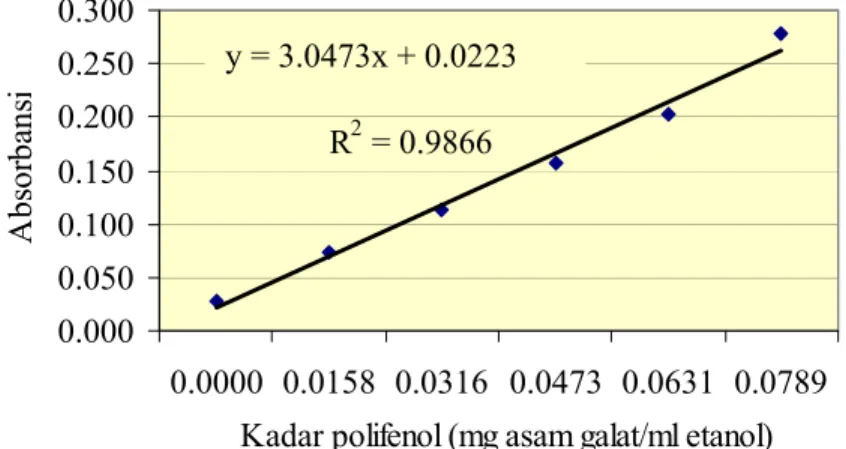
Larutan standar dibuat dalam satuan g asam galat per g etanol (Oki et al., 2002). Satuan tersebut perlu dikonversi dalam proses perhitungan menjadi g asam galat per ml etanol dengan menggunakan berat jenis etanol, yaitu sebesar 0.79 g/ml (Anonim, 2006b). Kurva standar asam galat yang dihasilkan memiliki persamaan garis linier y = 3.0473x + 0.0223. Gambar kurva standar dapat dilihat pada Gambar 13.
R2 = 0.9866
0.000 0.050 0.100 0.150 0.200 0.250 0.300
0.0000 0.0158 0.0316 0.0473 0.0631 0.0789 Kadar polifenol (mg asam galat/ml etanol)
Absorbansi
Gambar 18. Kurva standar uji kadar polifenol dengan standar asam galat
Larutan-larutan yang digunakan di dalam uji kadar polifenol ini antara lain, larutan blanko digunakan Na2CO3, akuades, dan sampel; dan sebagai larutan kontrol digunakan Na2CO3, akuades, reagen Folin Ciocalteau, dan sampel. Penambahan Na2CO3 bertujuan membentuk suasana basa agar terjadi reaksi reduksi reagen Folin Ciocalteau dengan gugus OH dari polifenol di dalam sampel. Penambahan sampel di dakam larutan blanko bertujuan mengurangi kesalahan positif dari perhitungan konsentrasi polifenol. Hal ini disebabkan sampel itu sendiri sudah memiliki warna yang dapat terukur oleh spektrofotometer. Hasil absorbansi kontrol nantinya akan dikurangi dengan absorbansi blanko yang kemudian dimasukkan kedalam kurva standar sehingga didapatkan konsentrasi polifenol saja di dalam sampel.
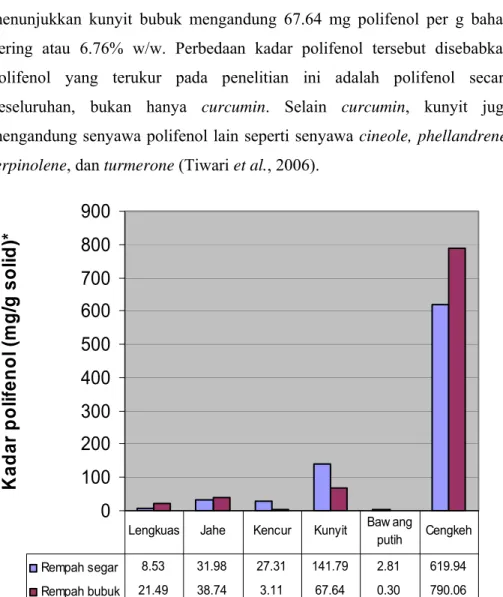
Hasil perhitungan kadar polifenol rempah segar dan rempah bubuk seperti yang terlihat pada Gambar 19 menunjukkan bahwa kadar polifenol yang tertinggi dimiliki cengkeh, sedangkan yang terendah dimiliki bawang putih. Cengkeh segar memiliki kadar polifenol sebesar 619.94 mg/g bahan kering dan cengkeh bubuk sebesar 790.06 mg/g bahan kering. Bawang putih segar memiliki kadar polifenol sebesar 2.81 mg/g bahan kering dan bawang putih bubuk sebesar 0.30 mg/g bahan kering.
y = 3.0473x + 0.0223
0 100 200 300 400 500 600 700 800 900
K a da r po li fe nol ( m g/ g s o li d) *
Rempah segar 8.53 31.98 27.31 141.79 2.81 619.94 Rempah bubuk 21.49 38.74 3.11 67.64 0.30 790.06
Lengkuas Jahe Kencur Kunyit Baw ang
putih Cengkeh
Cengkeh memiliki kadar polifenol yang sangat tinggi karena cengkeh merupakan rempah utama penghasil eugenol dan senyawa galat (Yanishlieva-Maslarova dan Heinonen, 2001). Bawang putih memiliki kadar polifenol terendah karena senyawa aktif dalam bawang putih, yaitu allicin dengan struktur kimia C3H5-S-S-C3H5 (Farrell, 1985), bukan termasuk golongan polifenol, melainkan golongan thiosulfonat (Anonim, 2006d).
Bubuk kunyit dilaporkan memiliki konsentrasi curcumin sekitar 3% w/w (Anonim, 2006a). Hasil uji kadar polifenol pada penelitian ini menunjukkan kunyit bubuk mengandung 67.64 mg polifenol per g bahan kering atau 6.76% w/w. Perbedaan kadar polifenol tersebut disebabkan polifenol yang terukur pada penelitian ini adalah polifenol secara keseluruhan, bukan hanya curcumin. Selain curcumin, kunyit juga mengandung senyawa polifenol lain seperti senyawa cineole, phellandrene, terpinolene, dan turmerone (Tiwari et al., 2006).
* Kadar polifenol sudah dikonversi terhadap kadar air sampel (Lampiran)
Gambar 19. Grafik perbandingan kadar polifenol rempah segar dan rempah bubuk
Grafik perbandingan kadar polifenol, seperti yang terlihat pada Gambar 19, menunjukkan ada rempah yang memiliki kadar polifenol dalam bentuk bubuk lebih rendah dibandingkan bantuk segarnya dan ada juga rempah yang memiliki kadar polifenol dalam bentuk bubuk lebih tinggi dibandingkan bantuk segarnya. Lengkuas, jahe, dan cengkeh memiliki kadar polifenol dalam bentuk bubuk lebih tinggi dibandingkan bentuk segarnya.
Hal ini dapat disebabkan terlepasnya polifenol terikat akibat perlakuan panas (Tiwari et al., 2006) dan terbebasnya polifenol akibat kerusakan sel yang terjadi selama proses pengeringan (Bartly dan Jacobs, 2000).
Proses pengeringan menyebabkan lapisan-lapisan protein pada bahan pangan yang berfungsi menghalangi masuknya oksigen dari udara mengalami kerusakan. Kerusakan lapisan protein menyebabkan butiran lemak, liposom, atau membran yang dilindungi oleh lapisan protein tersebut terpapar langsung oleh oksigen yang dapat lewat melalui permukaan lapisan tipis non-lipid. Oleh karena itu, oksidasi lipid terjadi lebih cepat pada bahan pangan kering dibandingkan bahan pangan basah. Namun demikian, reaksi oksidasi tersebut hanya terjadi selama penyimpanan bahan pangan kering.
Selama proses pengeringan itu sendiri, oksidasi lipid terbatas akibat waktu pengeringan yang singkat, sehingga antioksidan biasanya tidak rusak akibat proses pengeringan (Pokorny, 2001).
Meskipun antioksidan biasanya tidak rusak akibat proses pengeringan, penurunan kadar polifenol pada bentuk bubuk dibandingkan bentuk segarnya sangat besar. Kadar polifenol kencur bubuk 8.8 kali lebih rendah dibandingkan kencur segar, kadar polifenol kunyit bubuk 2.1 kali lebih rendah dibandingkan kunyit segar, dan kadar polifenol bawang putih bubuk 9.4 kali lebih rendah dibandingkan bawang putih segar. Perbedaan besarnya penurunan kadar polifenol pada bentuk bubuk dibandingkan bentuk segarnya terjadi karena stabilitas komponen rempah berbeda-beda tergantung jenis rempah (Tiwari et al., 2006). Meskipun memiliki struktur umum yang sama, polifenol yang terkandung dalam masing-masing rempah memiliki rantai samping berbeda-beda yang akan mempengaruhi stabilitasnya (Suresh et al., 2005).
Penelitian yang dilakukan Sowbhagya et al. (2004) menunjukkan bahwa senyawa curcumin pada kunyit cukup stabil terhadap panas tetapi sensitif terhadap cahaya. Ekstrak etanol dari lengkuas juga terbukti memiliki stabilitas terhadap panas yang baik (Berghofer dan Juntachote, 2005).
Eugenol pada cengkeh bersifat stabil dalam kondisi normal namun sensitif terhadap cahaya (Anonim, 2005a). Hanya gingerol yang dilaporkan tidak stabil terhadap panas akibat adanya grup ß-hidroksi-keto pada struktur kimianya (Bhattarai et al., 2001).
Salah satu kelemahan uji polifenol adalah tidak mampu membedakan tipe-tipe fenol yang terkandung (Lee dan Widmer, 1996), sehingga tidak dapat diketahui secara spesifik jenis polifenol apa yang berkontribusi besar terhadap penurunan kadar polifenol secara keseluruhan.
Menurut Porter (1979), ada tiga jenis fenol yaitu fenol monohidrat, dihidrat, dan trihidrat. Fenol monohidrat dapat menghambat rantai radikal bebas, contohnya BHA dan BHT. Fenol dihidrat menunjukkan efektifitas antioksidan paling tinggi dibandingkan fenol monohidrat dan trihidrat.
Aktivitas fenol trihidrat disebabkan adanya grup karboksil, seperti yang terdapat pada asam galat. Semakin besar grup alkil pada struktur fenolik, semakin rendah efektifitasnya di dalam minyak pada AOM.
B. AKTIVITAS ANTIOKSIDAN BERDASARKAN METODE AOM
Penentuan aktivitas antioksidan dengan menggunakan alat Rancimat memerlukan media berupa minyak. Minyak yang digunakan adalah minyak yang memiliki kandungan asam lemak tak jenuh tinggi karena asam lemak tak jenuh mudah teroksidasi. Hal tersebut bertujuan agar waktu yang terpakai untuk mencapai waktu infleksi lebih singkat dan lebih efisien. Pemilihan minyak yang akan digunakan sebagai media pada uji rancimat dilakukan dengan menyeleksi minyak berdasarkan periode induksi yang terpendek.
Berdasarkan pengamatan di lapangan, terdapat empat jenis minyak dengan klaim kaya asam lemak tak jenuh dan 100% murni (tidak ditambahkan pengawet), yaitu minyak jagung merk Tropicana Slim, minyak
jagung merk Mazola, minyak kedelai merk Happy, dan minyak zaitun merk Bertolli Extra Virgin. Masing-masing minyak memiliki periode induksi yang berbeda-beda, seperti yang dapat dilihat pada Tabel 2. Minyak yang memiliki periode induksi terpendek adalah minyak kedelai merk Happy dengan periode induksi 7.67 jam, sehingga minyak kedelai merk Happy dipilih sebagai media pada alat Rancimat.
Tabel 2. Hasil metode AOM untuk seleksi minyak sebagai media pada alat Rancimat
Sampel minyak
Periode induksi (jam)
Ulangan 1 Ulangan 2 Rata-rata
Minyak kedelai Happy 7.69 7.65 7.67
Minyak jagung Tropicana Slim 12.80 12.39 12.60
Minyak jagung Mazola 18.75 20.95 19.85
Minyak zaitun Bertolli Extra Virgin >22.60 >22.60 >22.60
Menurut Almatsier (2002), asam lemak utama pada minyak zaitun adalah asam lemak tak jenuh tunggal yaitu asam oleat (18:1), sedangkan asam lemak utama pada minyak kedelai adalah asam lemak tidak jenuh ganda yaitu asam linoleat (18:2) dan asam linolenat (18:3). Perbandingan kandungan asam lemak pada minyak kedelai, minyak jagung, dan minyak zaitun dapat dilihat pada Tabel 3. Pada saat minyak dihembuskan oksigen, oksigen akan terikat pada ikatan rangkap dan membentuk peroksida aktif.
Peroksida aktif akan terpecah menjadi senyawa dengan rantai karbon pendek yang bersifat volatil dan menimbulkan bau tengik pada minyak. Perbedaan kandungan asam lemak itulah yang menyebabkan minyak zaitun sulit teroksidasi dan memiliki periode induksi yang panjang, sedangkan minyak kedelai mudah teroksidasi dan memiliki periode induksi yang pendek.
Menurut Hui (1996), minyak kedelai memiliki kandungan asam linoleat yang sangat tinggi. Semakin tinggi kandungan asam linoleat, semakin rendah stabilitas minyak kedelai terhadap oksidasi.
Tabel 3. Komponen asam lemak pada minyak kedelai, minyak jagung, dan minyak zaitun (Almatsier, 2002)
Komponen asam lemak Minyak kedelai (%)
Minyak jagung (%)
Minyak zaitun (%) Asam lemak jenuh :
Kaprilat (8:0) Kaprat (10:0) Laurat (12:0) Miristat (14:0) Palmitat (16:0) Stearat (18:0)
0 0 sedikit sekali sedikit sekali
10 4
0 0 0 1 14 2
0 0 0 sedikit sekali
12 2 Asam lemak tak jenuh:
Oleat (18:1) Linoleat (18:2) Linolenat (18:3)
25 52 7
30 50 2
72 11 1
Ada dua jenis minyak kedelai, yaitu minyak kedelai mentah (crude soybean oil) dan minyak kedelai yang dimurnikan (refined soybean oil).
Proses pemurnian tidak mengubah komposisi asam lemak pada minyak kedelai. Proses pemurnian hanya menghilangkan asam lemak bebas dan pigmen, serta menurunkan kadar beberapa komponen seperti tokoferol, sterol, dan squalane, seperti dapat dilihat pada Tabel 4. Minyak kedelai merk Happy adalah salah satu contoh minyak kedelai yang sudah dimurnikan.
Tabel 4. Komponen minyak kedelai mentah dan minyak kedelai yang dimurnikan (Hui, 1996)
Komponen Crude oil Refined oil
Trigliserida (%) 95-97 >99
Fosfatida (%) 1.5-2.5 0.003-0.045
Bahan tak tersaponifikasi (%) : a. Sterol nabati (%)
a. Tokoferol (%)
b. Hidrokarbon (squalane) (%) 1.6 0.33 0.15-0.21 0.014
0.3 0.13 0.11-0.18 0.01 Asam lemak bebas (%) 0.3-0.7 <0.05 Logam :
a. Besi (ppm)
b.Tembaga (ppm) 1.3
0.03-0.05 0.1-0.3 0.02-0.06
Nilai aktivitas antioksidan yang diperoleh dengan menggunakan alat Rancimat dikenal sebagai faktor proteksi, yaitu rasio aktivitas antioksidan sampel dan aktivitas antioksidan standar. Antioksidan standar yang digunakan adalah BHT (Butylated Hydroxy Toluena). BHT dipilih sebagai antioksidan standar karena memiliki aktivitas antioksidan yang kuat dan banyak digunakan dalam industri pangan (O'Sullivan et al., 2004).
Aktivitas antioksidan sampel berdasarkan metode AOM dapat dilihat pada Tabel 5.
Tabel 5. Aktivitas antioksidan berdasarkan metode AOM
Sampel Faktor proteksi rempah segar (%)
Faktor proteksi rempah bubuk (%)
Lengkuas 5,65 5,41
Jahe 43,54 37,64
Kencur 8,94 2,78
Kunyit 66.46 44,71
Bawang putih 7,63 -4,24
Cengkeh 69.32 63.18
Sampel yang memiliki faktor proteksi tertinggi berturut-turut adalah cengkeh, kunyit, dan jahe dengan faktor proteksi berkisar 37%
hingga 70%, sedangkan lengkuas, kencur, dan bawang putih memiliki faktor proteksi yang rendah yaitu dibawah 9%. Banyak penelitian membuktikan bahwa cengkeh, kunyit, dan jahe memiliki aktivitas antioksidan yang tinggi.
Cengkeh menunjukkan aktivitas antioksidan yang sangat tinggi, diikuti kunyit dan jahe (Yanishlieva-Maslarova dan Heinonen, 2001). Aktivitas antioksidan dari fraksi yang larut etanol berdasarkan metode AOM menunjukkan rempah dengan periode induksi terpanjang berturut-turut adalah cengkeh (18.9 jam), kunyit (12.4 jam), dan jahe (11.7 jam) dengan periode induksi kontrol 5.7 jam (Simic dan Karel, 1979).
Lengkuas dan kencur memiliki faktor proteksi yang rendah karena senyawa antioksidan yang kuat pada lengkuas (trans-3-acetoxy-1,8 cineole) dan kencur (ethyl cinnamate) terdapat pada minyak volatil, bukan pada oleoresin. Komponen utama oleoresin lengkuas adalah p-coumaryl-9-methyl
ether yang memiliki aktivitas antioksidan tidak terlalu tinggi (Zaeoung et al., 2005).
Bawang putih merupakan rempah dengan faktor proteksi terendah.
Hal ini disebabkan senyawa antioksidan utama pada bawang putih, yaitu allicin, bersifat tidak stabil jika dikeluarkan dari bawang putih dan proses pengolahan dapat menyebabkan allicin terdegradasi menjadi senyawa yang tidak dapat terdeteksi (Yu dan Wu, 1989). Perlakuan panas juga dapat menurunkan aktivitas antioksidan dalam ekstrak bawang putih (Benkeblia, 2005). Faktor proteksi bawang putih bubuk bernilai negatif karena periode induksi minyak yang ditambahkan ekstrak bawang putih bubuk lebih rendah daripada periode induksi minyak kontrol. Namun demikian, kemungkinan bawang putih menjadi bersifat prooksidan akibat proses pengeringan perlu diteliti lebih lanjut, karena informasi yang tersedia mengenai kerusakan senyawa bioaktif pada rempah akibat proses pengolahan masih sedikit (Suresh et al., 2005).
C. HUBUNGAN KADAR POLIFENOL DAN AKTIVITAS ANTIOKSIDAN BERDASARKAN METODE AOM
Perbandingan kadar polifenol dan faktor proteksi pada rempah segar dan rempah bubuk, seperti dapat dilihat pada Tabel 6, menunjukkan bahwa rempah yang memiliki kadar polifenol dalam bentuk bubuk lebih tinggi maupun lebih rendah dibandingkan bentuk segarnya, sama-sama memiliki faktor proteksi dalam bentuk bubuk lebih rendah dibandingkan bentuk segarnya. Rempah yang memiliki kadar polifenol sekaligus faktor proteksi dalam bentuk bubuk yang lebih rendah dibandingkan bentuk segarnya adalah kencur, kunyit, dan bawang putih. Lengkuas, jahe, dan cengkeh dalam bentuk bubuk memiliki kadar polifenol yang lebih tinggi dibandingkan bentuk segarnya, namun faktor proteksi dalam bentuk bubuk justru lebih rendah dibandingkan bentuk segarnya.
Tabel 6. Perbandingan kadar polifenol dan faktor proteksi pada rempah segar dan rempah bubuk
Sampel
Rempah segar Rempah bubuk mg polifenol* Faktor proteksi
(%)** mg polifenol* Faktor proteksi (%)**
Lengkuas 3,50 5,65 9,63 5,41
Jahe 13,26 43,54 17,51 37,64
Kencur 11,49 8,94 1,46 2,78
Kunyit 55,47 66.46 29,92 44,71
Bawang putih 1,31 7,63 0,14 -4,24
Cengkeh 265,53 69.32 325,76 63.18
* Dihitung berdasarkan ekstrak yang digunakan dalam uji AOM
** Dihitung berdasarkan faktor proteksi BHT = 100%
Hubungan dimana kadar polifenol dalam bentuk bubuk lebih tinggi dibandingkan bentuk segarnya namun faktor proteksi dalam bentuk bubuk justru lebih rendah dibandingkan bentuk segarnya, seperti yang terjadi pada lengkuas, jahe, dan cengkeh, dapat terjadi akibat jenis polifenol dan kadar masing-masing jenis polifenol yang berbeda pada masing-masing rempah.
Masing-masing jenis polifenol memiliki aktivitas antioksidan yang berbeda- beda. Kadar masing-masing jenis polifenol yang terkandung juga dapat berdeda-beda, tergantung pada umur, tempat asal, dan kondisi penyimpanan yang berbeda-beda (Farrell, 1990). Polifenol terikat yang terlepas akibat perlakuan panas (Tiwari et al., 2006) atau yang terbebas akibat kerusakan sel selama proses pengeringan (Bartly dan Jacobs, 2000) kemungkinan memiliki aktivitas antioksidan yang rendah, sehingga meskipun terdapat dalam jumlah yang lebih banyak tetapi tidak meningkatkan aktivitas antioksidan rempah secara keseluruhan.
Hubungan kadar polifenol dan faktor proteksi dapat digambarkan seperti hubungan garis pada Gambar 20. Semakin tinggi kadar polifenol, maka faktor proteksi juga akan semakin tinggi hingga mencapai batas tertentu. Gambar 20 (A) memperlihatkan bahwa grafik tidak menunjukkan hubungan linear maupun logaritmik. Grafik terlihat landai pada kisaran 0-10 mg polifenol dan meningkat curam pada kisaran 10-20 mg polifenol, namun kecuraman grafik mulai berkurang pada kisaran 20-50 mg polifenol. Hal ini menunjukkan bahwa pada kisaran 0-10 mg polifenol, peningkatan kadar
polifenol kurang berpengaruh terhadap peningkatan faktor proteksi, sedangkan pada kisaran 10-20 mg polifenol, peningkatan kadar polifenol walaupun dalam jumlah sedikit dapat menyebabkan faktor proteksi mengalami banyak peningkatan. Peningkatan kadar polifenol pada kisaran 20-50 mg polifenol masih berpengaruh terhadap peningkatan faktor proteksi, meskipun tidak sebesar pengaruh peningkatan kadar polifenol pada kisaran 10-20 mg polifenol. Setelah melebihi 50 mg polifenol, grafik pada Gambar 20 (B) terlihat landai yang berarti di atas 50 mg, peningkatan kadar polifenol walaupun dalam jumlah banyak tidak menyebabkan faktor proteksi mengalami banyak peningkatan.
(A) (B)
Gambar 20. Grafik hubungan kadar polifenol dan aktivitas antioksidan berdasarkan metode AOM
(A) Lengkuas, kencur, kunyit, jahe, dan bawang putih (B) Cengkeh
Kecenderungan hubungan seperti pada Gambar 20 (A) dapat disebabkan pengaruh konsentrasi antioksidan terhadap kecepatan oksidasi tergantung pada beberapa faktor, salah satunya adalah struktur antioksidan (Shahidi dan Naczk, 1995). Meskipun memiliki struktur umum yang sama, polifenol yang terkandung dalam masing-masing rempah memiliki rantai -20
0 20 40 60 80
0 10 20 30 40 50 60
Kadar polifenol (mg/150 mg ekstrak)
Faktor proteksi (%)
Rempah segar Rempah bubuk
samping berbeda-beda (Suresh et al., 2005). Kadar masing-masing jenis polifenol yang terkandung juga dapat berdeda-beda, tergantung pada umur, tempat asal, dan kondisi penyimpanan yang berbeda-beda (Farrell, 1990).
Kecenderungan hubungan seperti pada Gambar 19 (B) dapat disebabkan sifat polifenol, dimana pada kondisi tertentu seperti konsentrasi tinggi, pH tinggi, atau keberadaan ion besi, senyawa fenolik justru dapat menginisiasi proses autooksidasi dan lebih bersifat seperti prooksidan dibandingkan antioksidan (Furham dan Aviram, 2002). Pada konsentrasi tinggi, antioksidan fenolik seringkali justru bersifat sebagai prooksidan karena antioksidan fenolik tersebut ikut terlibat dalam reaksi inisiasi oksidasi yang menghasilkan produk berupa radikal bebas (Shahidi dan Naczk, 1995).
Secara keseluruhan, Gambar 19 memperlihatkan bahwa semua sampel dalam bentuk bubuk memiliki faktor proteksi yang lebih rendah dibandingkan bentuk segarnya. Menurut Pokorny (2001), antioksidan pada rempah biasanya tidak rusak akibat proses pengeringan, sehingga ada kemungkinan faktor lain yang menyebabkan faktor proteksi rempah dalam bentuk bubuk lebih rendah dibandingkan bentuk segarnya. Faktor lain tersebut adalah oksigen dan cahaya selama penyimpanan. Langkah paling penting sebelum pengemasan untuk mempertahankan aktivitas antioksidan adalah menghilangkan oksigen dengan cepat (Pokorny, 2001), namun kemasan rempah bubuk yang digunakan dalam penelitian ini tidak kedap udara sehingga oksigen masih terdapat di dalam kemasan. Selain itu, kemasan rempah bubuk terbuat dari plastik berwarna putih yang tidak kedap cahaya, sehingga penurunan aktivitas antioksidan dapat terjadi selama penyimpanan rempah bubuk di toko.