LAMPIRAN
1. Hasil Isolasi Bakteri
2. Hasil Pengukuran Nilai OD
Kode Isolat Optical Density (OD)
Minggu ke-0 Minggu ke-1 Minggu ke-2 Minggu ke-3 Minggu ke-4
SP 1 0,125 0,137 0,135 0,132 -
SP 2 0,121 0,240 0,360 0,400 0,490
SP 3 0,111 0,120 0,155 0,200 0,259
SP 4 0,120 0,200 0,350 0,427 0,504
SP 5 0,121 0,133 0,121 - -
SP 6 0,113 0,130 0,125 - -
SP 7 0,113 0,123 0,119 - -
SP 8 0,120 0,127 0,122 - -
SP 9 0,130 0,137 0,121 - -
SP 10 0,123 0,132 0,127 0,122 -
3. Hasil Pengukuran Jumlah Koloni
Kode Isolat Jumlah Koloni
Minggu ke-0 Minggu ke-1 Minggu ke-2 Minggu ke-3 Minggu ke-4
SP 1 19 x 106 22 x 106 6 x 106 0 -
SP 2 22 x 106 37 x 106 74 x 106 111x 106 150 x 106 SP 3 17 x 106 41 x 106 68 x 106 83x 106 103 x 106 SP 4 20 x 106 33 x 106 86 x 106 130x 106 200 x 106
SP 5 21 x 106 27 x 106 0 - -
SP 6 19 x 106 25 x 106 15 x 106 0 -
SP 7 20 x 106 29 x 106 9 x 106 - -
SP 8 23 x 106 20 x 106 13 x 106 - -
SP 9 22 x 106 30 x 106 0 - -
4. MSMB dengan Lembaran Plastik dan Isolat Bakteri setelah Uji Biodegradasi
5. Komposisi MSMB (Per Liter)
KH2PO4 0,7 g
K2HPO4 0,7 g
MgSO4.7H2O 0,7 g
NH4NO3 1 g
NaCL 0,005 g
FeSO4.7H2O 0,002 g
ZnSO4.7H2O 0.002 g
MnSO4 0,001 g
LDPE Powder 0,1%
Glukosa 0,5 %
SP2U1 SP2U2 SP2U3
DAFTAR PUSTAKA
Adam, S. and Clark, D. 2009. Landfill Biodegradation an in-depth Look at Biodegradation in Landfill Environments: Bio-tec Environmental,
Albuquerque & ENSO Bottles, LLC, Phoenix. p. 9-11.
Ainiyah, D. N. dan Shovitri, M. 2014. Bakteri Tanah Sampah Pendegradasi Plastik dalam Kolom Winogradsky. Jurnal Sains dan Seni POMITS. 3 (4) : 2337-3520.
Alex, S. 2011. New Perspectives in Plastic Biodegradation. Journal of Current
Opinion in Biotechnology. 22:422 – 426.
Allen, S. N. 1983. Degradation and Stabilitation Of Polyolefins. Applied Science Publisher. London and New York. page 63.
Arutchelvi, J., Sudhakar, M., Arkatkar, A., Doble, M., Bhaduri, S. and Uppara, P. V. 2007. Biodegradation of Polyethylene and Polypropylene. Indian
Journal of Biotechnology. 7. 9-22.
Bark and Allan N. S. 1982. Analysis of Polymer System. Applied Science Publisher ltd., London.
Bailey, J. E. and Ollis, D. F. 1986. Biochemical Engineering Fundamentals. 2nd ed. McGraw.
Bikiaris, D. N., Papageorgiou, G. Z. and Achilias, D. S. 2006. Synthesis and Comparative Biodegradability Studies of Three Poly(alkaline succinate)s. Polymer Degradation and Stability.
Bollag, W. B., Dec, J. and Bollag, J. M. 2000. Biodegradation and Encyclopedia
of Microbiology. 2nd Edition. In. J. Lederberg (Ed.). New York: Academic
Press, inc. pages 461-471.
Chee, J. Y., Yoga, S. S., Lau, N. S., Ling, S. C., Abed, R. M. M. and Sudesh, K. L. 2010. Bacterially Produced Polyhydroxyalkanoate (PHA): Converting Renewable Resources into Bioplastics. Appl Microbiol & Microbiol
Biotech A Mendez Vilas (Ed).
Chiellini, E., Corti, A. and D’Antone, S. 2007. Oxo-biodegradable Full Carbon Backbone Polymers-Biodegradation Behaviour of Thermally Oxidized Polyethylene in Aqueous Medium. Polymer Degradation and Stability. 92: 1378-1383.
Deepika, S. dan Madhuri, R. 2015. Biodegradation of Low Density Polyethylene by Microorganisms From Garbage Soil. Journal of Experimental Biology
and Agricultural Sci.3 (1).
Erliza dan Sutedja. 1987. Pengantar Pengemasan. Laboratorium Pengemasan, Jurusan TIP. IPB. Bogor.
Fadlilah, F. R. dan Shovitri, M. 2014. Potensi Isolat Bakteri Bacillus dalam Mendegradasi Plastik dengan Metode Kolom Winogradsky. Jurnal Teknik
POMITS. 3 (2).
Gilan (Orr)., Hadar, Y. And Sivan, A. 2004. Colonization, Biofilm Formation and Biodegradation of Polyethylene By A Strain of Rhodococcus ruber. Appl
Microbiol Biotechnol. 65: 97–104.
Gnanavel, G., Valli, V. P. M. J., Thirumarimurugan, M. And Kannadasan, T. 2013. Degradation of Plastic Waste Using Microbes. Elixir Chem Engg. 54: 12212-12214.
Gu, J. D., Ford, T. E., Mitton, D. B. and Mitchell, R. 2000. Microbial corrosion of
metals. The Uhlig Corrosion Handbook. 2nd Ed. New York, USA: Wiley.
Hadad, D., Geresh, S. and Sivan, A. 2005. Biodegradation of Polyethylene by The Thermophilic Bacterium Brevibacillus borstelensis. Journal of Applied
Microbiology. 98: 1093-1100.
Hussein, A., Al-Mayaly, I. K. and Khudeir, S. H. 2015. Isolation, Screening and Identification of Low Density Polyethylene (LDPE) Degrading Bacteria from Contaminated Soil with Plastic Pastes. Mesop. Environ. J. 4 (1): 1-14.
Kavitha, R., Anju, K., Mohanan and Bhuvaneswari. 2014. Biodegradation Of Low Density Polyethylene By Bacteria Isolated From Contaminated Soil.
IJPAES. 3 (4): 601-610.
Leja, K. and Lewandowicz, G. 2009. Polymer Biodegradation and Biodegradable Polymers-a Review. Polish J. of Environ. Stud. 19 (2): 225-226.
Lestari, P., Ningsih, D. R. dan Widyaningsih, S. 2007. Biodegradasi Polietilena Menggunakan Bakteri dari TPA (Tempat Pembuangan Akhir) Gunung Tugel Kabupaten Banyumas. Molekul. 2 (2): 98-106.
Lestari, P., Zusfahair, Ningsih, D. R. dan Widyaningsih, S. 2008. Pemanfaatan Bakteri hasil Isolasi dari TPA (Tempat Pembuangan Akhir) Gunung Tugel Kabupaten Banyumas Sebagai Agen Biodegradasi Polimer Polieugenol.
Mardiana, D., Surdia, N. M., Radiman, C. L., Ratnaningsih, E. A. Dan Rosdiana. 2003. Gliserol : Sumber Monomer Terbaharui dan Pemanfaatannya
sebagai Bahan Baku Polimer Ramah Lingkungan. Dalam Prosiding
Seminar Sehari 70 tahun Noer Mansdjoeriah Surdia. Departemen kimia Institut Teknologi Bandung. Bandung.
Matondang, T. D. S., Wirjosentono, B.dan Yunus, D. 2013. Pembuatan Plastik Kemasan Terbiodegradasikan dari Polipropylena Tergrafting Maleat Anhidrida dengan Bahan Pengisi Pati Sagu Kelapa Sawit. 3 (2) : 110-116. Meyer, B. S. and Fred, W. 1971. Textbook of Polymer Science. 2nd edition.
Sidney: Wiley Interscience.
Mohan, S. K. and Srivastava, T. 2010. Microbial Deterioration and Degradation of Polymeric Materials. J. Biochem Tech. 2 (4): 210-215.
Mukherjee, S. and Chatterjee, S. 2014. A Comparative Study Of Commercially Available Plastic Carry Bag Biodegradation By Microorganisms Isolated from Hydrocarbon Effluent Enriched Soil. Int. J. Curr. Microbiol. App.
Sci. 3 (5): 318-325.
Nanda, S. and Sahu, S. S. 2010. Biodegradability of Polyethylene by
Brevibacillus, Pseudomonas, and Rhodococcus spp. New York Science Journal.3: 95-98.
Oxtoby, D. W., Gillis, H. P. and Nachtrieb, N. H. 2003. Prinsip-Prinsip Kimia
Modern. Edisi Keempat. Jakarta: Erlangga.
Pinzari, F., Pasquariello, G. and Mico, D. A. 2006. Biodeterioration of Paper: A SEM Study of Fungal Spoilage Reproduced Under Controlled Conditions. Macromolecular Symposia 238, 57e. 66.
Pudjiastuti, W., Listyarini, A.dan Sudirman. 2012. Polimer Nanokomposit Sebagai Master Batch Polimer Biodegradable Untuk Kemasan Makanan.
Jurnal Riset Industri.6 (1):51-60.
[PPLH] Pusat Pendidikan Lingkungan Hidup Seloliman. 2007. Bahaya Bahan Plastik. Mojokerto: Move Indonesia.
Rohaeti, E., Surdia, M. N., Radiman, C. L. dan Ratnaningsih, E. 2004. Pengaruh Dua Macam Perlakuan Mikroorganisme terhadap Kemudahan Degradasi Poliuretan Hasil Sintesis dari Monomer Polietilen Glikol Berat Molekul 400 dengan Metilen-4,4’-difenildiisosianat. 36 (1).
Rohaeti, E. 2009. Karakterisasi Biodegradasi Polimer. Prosiding Seminar
Sacharow. S. and Griffin, R. C. 1970. Principles of Food Packaging. The AVI Publishing. Co. Inc. Westport. Connecticut.
Sahwan, F. L., Martono, D. H., Wahyono, S. dan Wisoyodharmo, L. A. 2005. Sistem Pengolahan Limbah Plastik Indonesia. P3LT-BPPT. 6 (1).
Sastrohamidjojo, H. 1992. Spektroskopi Inframerah. Liberty Yogyakarta. Yogyakarta.
Shimao, M. 2001. Biodegradation of plastics. Current Opinion Biotechnology 12:242-247.
Sowmya, H. V., Ramalingappa., Khrishnappa, M. dan Thippeswamy, B. 2014. Biodegradation of Polyethylene by Bacillus cereus. Advances in Polymer Science and Technology: An International Journal. 4(2): 28-32
Tokiwa, Y., Calabia, B. P., Ugwu, C. U. and Aiba, S. 2009. Biodegradability of Plastic. Int. J. Mol. Sci. 10: 3722-3742.
Trachoo, N. 2004. Biofilm Removal Technique Using Sands as A Research Tool for Accessing Microbial Attachment on Surface. J. Sci. Technol. 26 (1). 109-115.
Usha, R., Sangeetha, T. and Palaniswamy, M. 2011. Screening of Polyethylene Degrading Microorganisms from Garbage Soil. Libyan Agric Res Center J
International. 2 (4): 200-204.
Waryat., Romli, M., Suryani, A., Yuliasih, I. dan Johan, S. A. 2013. Karakteristik Mekanik, Permeabilitas dan Biodegrabilitas Plastik Biodegradable Berbahan Baku Komposit Pati Termoplastik-LLDPE. Jurnal Teknologi
Industri Pertanian. 23 (2): 153-163.
BAB 3
METODE PENELITIAN
3.1. Waktu dan tempat
Penelitian ini telah dilaksanakan pada Juni 2015 sampai dengan Juni 2016 di Laboratorium Mikrobiologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, dan Laboratorium Penelitian Fakultas Farmasi, Universitas Sumatera Utara, Medan.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini ialah Fourier Transform
Infrared Spectroscopy (FT-IR Spectroscopy), Scanning Electron Microscopy
(SEM), spektrofotometer, neraca analitik, shaker dan vortex. Adapun bahan yang digunakan ialah Nutrient Agar (NA), Nutrient Broth (NB), Mineral Salt Medium
Broth (MSMB), Plate Count Agar (PCA), glukosa, lembaran plastik Low Density
Pholyethylene (LDPE) dan Xylene
3.3. Metode Penelitian 3.3.1. Pengambilan Sampel
Sampel tanah diambil dari Tempat Pembuangan Akhir (TPA) Namo Bintang, Kecamatan Medan Tuntungan pada 3 titik menggunakan sekop pada ke dalaman 3-5 cm dan dimasukkan ke dalam plastik steril (Kavitha et al. 2014).
3.3.2. Isolasi Bakteri
sudah diinokulasikan dengan larutan bakteri diinkubasi selama 1x24 jam. Koloni-koloni yang berbeda kemudian dimurnikan untuk mendapatkan Koloni-koloni tunggal dan dikarakterisasi (Zusfahair et al. 2007).
3.3.3. Pembuatan Bubuk LDPE
Biji LDPE dimasukkan ke dalam larutan xylene kemudian dididihkan selama 15 menit. Gumpalan LDPE yang terbentuk kemudian disiram dengan etil-alkohol untuk menghilangkan xylene, setelah etil-etil-alkohol dan xylene menguap, gumpalan LDPE dikeringkan dengan oven pada suhu 40-50 selama satu malam. Gumpalan LDPE yang sudah kering dipotong-potong menjadi bagian kecil dan dihaluskan hingga terbentuk bubuk LDPE.
3.3.4. Lembar Tipis LDPE
Lembaran plastik yang digunakan dalam penelitian ini adalah plastik komersial yang berlabel LDPE.
3.3.5. Skrining Awal Bakteri Pendegradasi LDPE
Koloni tunggal yang sudah diperoleh kemudian diambil dengan menggunakan ose dan dibuat inokulumnya dengan kekeruhan yang sama dengan larutan standar Mcfarland 0,5. Inokulum yang sudah dibuat diambil 2 mL kemudian dimasukkan ke dalam 50 mL media MSMB (Mineral Salt Medium
Broth) yang telah ditambahkan 0,5 % glukosa dan bubuk LDPE sebagai sumber
karbon, lalu diinkubasi pada shaker dengan kecepatan 120 rpm pada suhu ambient selama 4 minggu. Pengukuran pertumbuhan dilakukan setiap minggu dengan mengukur nilai Optical Density (OD) dan menghitung jumlah koloni (Hussein et
al. 2015).
3.3.6. Karakterisasi Bakteri
3.3.7. Uji Biodegradasi
Inokulum bakteri yang tumbuh paling baik pada media mengandung LDPE diambil sebanyak 5 ml lalu diinokulasikan kedalam 45 mL MSMB. Lembaran LDPE dimasukkan ke dalam erlenmeyer yang berisi media MSMB dan bakteri, kemudian diinkubasi pada shaker dengan kecepatan 120 rpm selama 4 minggu pada suhu ambient, masing-masing dilakukan 3 kali ulangan. Lembaran tipis LDPE dibersihkan dengan alkohol 70% setelah uji biodegradasi dihentikan dan dibilas beberapa kali dengan menggunakan aquades steril dan LDPE siap dikarakterisasi (Sowmya et al. 2014).
3.3.8. Populasi Bakteri
Pengukuran pertumbuhan bakteri setelah uji biodegradasi dilakukan dengan metode Total Plate Count (TPC). Lembaran LDPE setelah uji biodegradasi dimasukkan ke dalam 10 mL aquades steril dan divortex bersama pasir steril sebagai alat pemisah untuk memisahkan biofilm dari lembaran LDPE (Trachoo, 2004). Biofilm yang sudah terpisah divortex selama 2 menit, diambil 1 mL dengan menggunakan micropipette dan dipindahkan ke dalam tabung pertama yang berisi 9 mL akuades steril serta dihomogenkan. Pengenceran terus dilakukan sampai didapatkan pengenceran 10-7, dari pengenceran 10-4, 10-5, 10-6 dan 10-7 diambil 0,1 mL dan diratakan dengan menggunakan hockey stick pada permukaan cawan yang berisi media PCA kemudian diinkubasi selama 48 jam pada suhu
ambient. Koloni yang tumbuh dihitung dan dicatat jumlahnya (Ainiyah &
Shovitri, 2014).
3.3.9. Karakterisasi Lembaran LDPE
3.3.9.1. Penentuan Persentase Kehilangan Bobot (Kavitha et al. 2014)
Penentuan persentase kehilangan bobot ditentukan berdasarkan penghitungan bobot awal LDPE sebelum uji biodegradasi dan bobot akhir setelah uji biodegradasi.
3.3.9.2. Analisis Sifat Fisika (Permukaan)
Morfologi permukaan dari lembaran LDPE dianalisis dengan menggunakan Scanning Electron Microscopy (SEM) untuk melihat perubahan struktur lembaran LDPE. Lembaran LDPE diletakkan pada sample holder dan diamati dengan perbesaran 5.000x. Hasil yang didapat kemudian dibandingkan dengan kondisi awal dan kontrol.
3.3.9.3. Analisis Sifat Kimia
BAB 4
HASIL DAN PEMBAHASAN
4.1. Isolasi dan Karakterisasi Bakteri
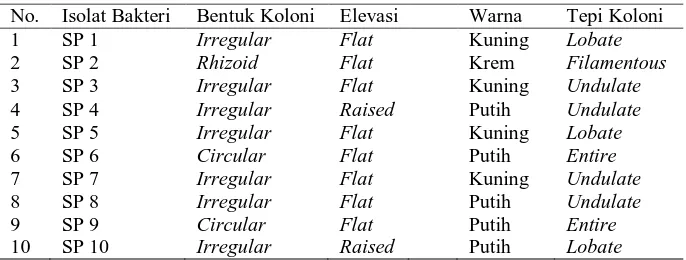
Hasil isolasi bakteri diperoleh 10 koloni yang berbeda dan diberi kode dengan inisial SP. Hasil karakterisasi bakteri-bakteri dari TPA Namo Bintang disajikan pada Tabel 2.
Tabel 2. Karakteristik bakteri-bakteri dari TPA Namo Bintang
No. Isolat Bakteri Bentuk Koloni Elevasi Warna Tepi Koloni koloninya, yaitu 7 isolat berbentuk irregular, 1 isolat berbentuk rhizoid, 2 isolat berbentuk circular, 8 isolat berelevasi flat, 2 isolat berelevasi raised, 4 isolat dengan warna koloni kuning, 1 koloni krem dan 5 isolat dengan warna koloni putih, 3 isolat bertepi lobate, 1 isolat bertepi filamentous, 4 isolat bertepi undulate, dan 2 isolat bertepi entire.
4.2. Skrining Awal Bakteri Pendegradasi LDPE
7 isolat lainnya tidak menunjukkan pertumbuhan. Hasil dari pengukuran tingkat kekeruhan (OD) dapat dilihat pada Gambar 1.
Gambar 1. Profil Pertumbuhan Isolat (Absorbansi pada Panjang Gelombang 600 nm)
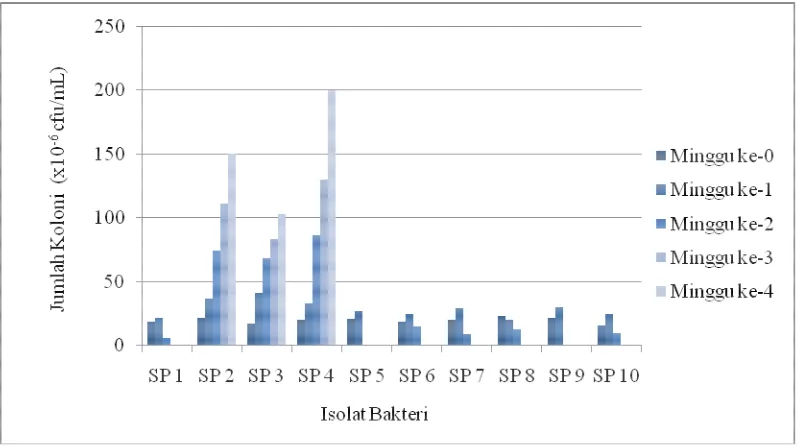
Penghitungan jumlah koloni yang tumbuh dilakukan setiap minggu dengan menggunakan metode Total Plate Count (TPC). Hasil pengukuran jumlah koloni dapat dilihat pada Gambar 2.
Dari Gambar 1 dan Gambar 2 di atas dapat dilihat bahwa semakin tinggi nilai OD pertumbuhan bakteri maka semakin tinggi pula jumlah koloninya. Berdasarkan hasil penelitian bakteri dengan kode isolat SP4 menunjukkan pertumbuhan tertinggi dibandingkan dengan pertumbuhan isolat lainnya, yaitu dengan nilai OD 0,504 pada masa inkubasi minggu ke-4 dengan menghasilkan jumlah koloni 200 x 106 CFU/mL. Isolat bakteri SP2 juga mengalami peningkatan dengan nilai OD 0,490 menghasilkan jumlah koloni 150 x 106 CFU/mL, selanjutnya isolat bakteri SP3 dengan nilai OD 0,259 menghasilkan jumlah koloni 103 x 106 CFU/mL. Isolat bakteri dengan kode SP1,SP5, SP6, SP9 dan SP10 mengalami penurunan nilai OD dan jumlah koloni setiap minggunya, sedangkan SP7 dan SP8 mengalami kontaminasi pada minggu ke-3. Peningkatan nilai OD dan hasil penghitungan jumlah koloni setiap minggunya menunjukkan bahwa isolat bakteri SP2, SP3 dan SP4 dapat bertahan sampai minggu ke-4 sehingga diasumsikan bahwa isolat bakteri SP2, SP3 dan SP4 memiliki kemampuan menggunakan bubuk plastik sebagai sumber karbon sehingga bakteri mampu membelah diri.
Skrining bakteri pendegradasi LDPE juga telah dilakukan oleh Hussein et
al. (2015), menggunakan media MSM dengan penambahan 0,1% glukosa dan
bubuk plastik sebagai sumber karbon, kemudian diinkubasi pada shaker 150 rpm selama 7 hari. Nilai OD kemudian dihitung dan didapatkan sebanyak 3 isolat bakteri yang memiliki pertumbuhan paling tinggi.
4.3. Uji Biokimia dan Karakterisasi Bakteri
Hasil karakterisasi dan uji biokimia bakteri pendegradasi plastik dapat dilihat pada Tabel 3.
Tabel 3. Uji Biokimia dan krakteristik Morfologi Bakteri
Ket:
Hidrolisa Pati (+) : Dapat menghidrolisis pati Hidrolisa Pati (-) : Tidak dapat menghidrolisis pati
Uji Sitrat (+) : Dapat menggunakan sitrat sebagai sumber karbon Uji Sitrat (-) : Tidak dapat menggunakan sitrat sebagai sumber karbon Motility (+) : Memiliki alat gerak
Katalase (-) : Tidak menghasilkan enzim katalase K/M : Kuning pada slant / Merah pada butt
Dari Tabel di atas dapat dilihat bahwa isolat bakteri SP2 dan SP4 memiliki karakteristik sel dan uji fisiologis yang hampir sama. Berdasarkan pengamatan yang dilakukan pada hasil uji isolat bakteri SP2 memiliki morfologi sel berbentuk
coccus dengan penataan streptococcus dan SP4 memiliki morfologi sel berentuk
basil dengan penataan steprobasil, dapat menghidrolisis pati, memfermentasikan glukosa, memiliki alat gerak dan tidak menghasilkan enzim katalase. Isolat bakteri SP2 dan SP4 merupakan bakteri dari kelompok Gram positif. Isolat SP2 dapat menggunakan sitrat sebagai sumber karbon berdasarkan uji sitrat yang dilakukan, sedangkan isolat SP4 tidak dapat menggunakan sitrat sebagai sumber karbon.
Hussein et al. (2015) telah melakukan karakterisasi dan uji biokimia terhadap tiga isolat bakteri pendegradasi LDPE yang diisolasi dari tanah. Berdasarkan pewarnaan Gram bakteri-bakteri tesebut merupakan bakteri dari kelompok Gram negatif. Uji biokimia yang dilakukan diantaranya gelatin
hydrolysis, methyl red, voges-proskauer test, indol test, urease, hidrolisis pati, uji
hidrogen sulfida, uji sitrat, uji katalase, uji oksidase. Hasil identifikasi menggunakan sistem Vitek 2 menunjukkan bahwa ketiga isolat tersebut adalah
Pseudomonas fluorescens, Pseudomonas aeruginosa and Acinetobacter ursingii.
Bakteri dari kelompok Gram negatif lainnya yang ditemukan mampu mendegradasi LDPE adalah Moraxella spp, Burkholderia cepacia dan
Escherichia coli. Bakteri dari kelompok Gram positif juga ditemukan mampu
mendegradasi LDPE yaitu Bacillus weihenstephanensis, Bacillus spp,
Staphylococcus spp, Streptocococcus spp, Diplococcus spp. (Deepika & Madhuri,
2015; Mukherjee & Chaterjee, 2014)
4.4. Populasi Bakteri
Populasi bakteri pada lembaran LDPE berukuran 1,5 x 1,5 cm dihitung dengan menggunakan metode Total Plate Count (TPC) setelah uji biodegradasi dengan masa inkubasi 4 minggu. Data populasi bakteri disajikan pada Tabel 4.
Tabel 4. Rataan Jumlah Koloni (CFU/lembar) No. Kode Bakteri Jumlah Koloni
1 SP2 1,41 x 107
2 SP4 1,36 x109
Dari data di atas dapat dilihat populasi bakteri pada setiap permukaan plastik yang cukup tinggi mencapai 1,36 x 109. Koloni bakteri yang terdapat pada lembaran plastik menandakan bahwa bakteri menempel pada permukaan plastik untuk melakukan proses biodegradasi. Proses biodegradasi ini dilakukan dengan menggunakan medium Mineral Salt Medium Broth (MSMB) tanpa sumber karbon selama 4 minggu masa inkubasi, sehingga mikroorganisme distimulus untuk menggunakan plastik sebagai sumber karbon. Pada keadaan kekurangan nutrisi (seperti kekurangan sumber karbon) mikroorganisme akan cenderung membentuk lapisan biofilm sehingga diasumsikan biofilm ini membantu bakteri yang ada di dalamnya untuk efisiensi energi selama tercekam nutrisi.
4.5. Karakterisasi Lembaran Plastik LDPE 4.5.1. Persentase Kehilangan Berat Kering
Metode yang paling sederhana untuk mengukur terjadinya biodegradasi suatu polimer adalah dengan menentukan kehilangan berat kering. Kehilangan berat kering ditentukan dengan menghitung persentase kehilangan berat lembaran LDPE setelah 4 minggu masa inkubasi, lembaran LDPE yang digunakan berukuran 1,5 x 1,5 cm. Data persentase kehilangan bobot disajikan pada Tabel 5.
Tabel 5. Data persentase kehilangan bobot LDPE
No. Perlakuan Bobot Awal (g) Bobot Akhir (g) % Kehilangan Bobot
1 Kontrol 0,0059 0,0059 0
2 SP 2 0,0059 0,0053 10,16
3 SP 4 0,0058 0,0051 12,06
Pada Tabel di atas dapat dilihat bahwa persentase kehilangan berat LDPE oleh isolat bakteri SP2 dan SP4 yang diinkubasi pada shaker (120 rpm) selama 4 minggu pada suhu ambient adalah sebesar 10,16 % dan 12,06 %. Berkurangnya berat LDPE menandakan bahwa telah terjadi biodegradasi yang disebabkan aktivitas bakteri terhadap LDPE, dimana bakteri menggunakan LDPE sebagai sumber nutrisi. Hasil penelitian ini jauh lebih baik dari hasil yang dilaporkan oleh Kavitha et al. (2014) menunjukkan bahwa isolat bakteri yang didapat memiliki kemampuan mendegradasi plastik dengan persentase kehilangan bobot plastik sebesar 1,2 % dan 1,3 %, diinkubasi dengan shaker (150 rpm) pada suhu 30 oC selama 30 hari. Menurut Matondang et al. (2013) penurunan berat molekul terutama disebabkan oleh pemutusan rantai secara hidrolisis atau oksidatif. Hidrolisis dapat terjadi menggunakan lingkungan air dengan penambahan enzim atau pada kondisi non-enzimatis.
Isolasi mikroba pendegradasi plastik dari TPA namo Bintang juga dilakukan oleh Harefa (2016), didapatkan 2 isolat jamur yang mampu medegradasi plastik yaitu RH03 dan RH06 yang merupakan jamur dari genus
Aspergilus sp. Uji biodegradasi dilakukan selama 45 hari menggunakan media
Mineral Salt Agar (MSA) dengan penambahan 0,5 % glukosa, diinkubasi pada
shaker (120 rpm) pada suhu ambient. Isolat jamur RH03 dan RH06 memiliki
Semakin meningkat aktivitas dari isolat bakteri semakin besar pula persentase kehilangan berat LDPE, sehingga semakin banyak polietilena yang terdegradasi. Peningkatan persentase kehilangan berat disebabkan oleh reaksi enzimatis yang dihasilkan oleh bakteri terhadap permukaan dari polimer, berat polimer berkurang dan persentase kehilangan berat bertambah (Bikiaris et al. 2006). Metode penghitungan persentase kehilangan berat kering juga dilakukan oleh Zusfahair et al. (2007) menunjukkan bahwa semakin lama masa inkubasi maka semakin banyak pula bagian dari plastik yang terbiodegradasi. Penelitian ini menggunakan media NA sebagai media tumbuh bakteri dan diinkubasi dengan variasi waktu 5, 10, 15, 20, 25 dan 30 hari dengan kehilangan berat sebesar 0,46 %, 1,01 %, 1,48 %, 1,78 %, 2,02 % dan 2,33 %.
4.5.2. Analisis Sifat Fisika (Permukaan)
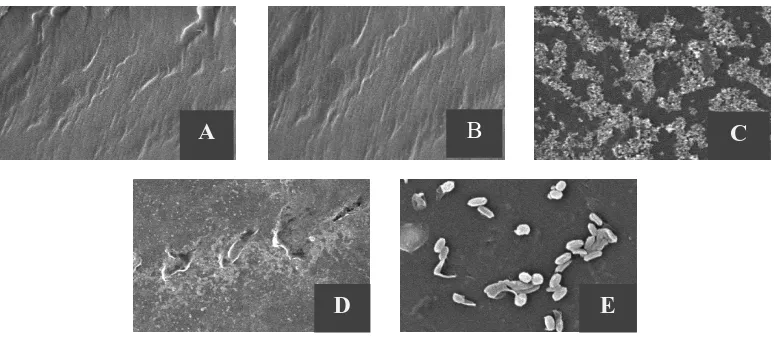
Hasil karakterisasi dengan menggunakan SEM menunjukkan bahwa permukaan lembaran plastik yang telah diinkubasi dengan isolat bakteri SP2 dan SP4 mengalami perubahan seperti ditunjukkan oleh Gambar 3.
Gambar 3. Hasil uji SEM Lembaran LDPE dengan Perbesaran 5000x (A) Kontrol awal (B) Kontrol 4 minggu (C) Perlakuan dengan Isolat bakteri SP2 inkubasi selama 4 minggu (D) Perlakuan dengan isolat bakteri SP4 inkubasi selama 4 minggu (E) Sel bakteri melekat pada permukaan LDPE
Dari Gambar 3 dapat dilihat bahwa pada lembaran plastik yang diberikan perlakuan dengan isolat bakteri SP2 dan SP4 menunjukkan perubahan yang jelas jika dibandingkan dengan kontrol awal dan kontrol setelah diinkubasi selama 4 minggu. Pada kontrol, permukaan tampak halus tanpa adanya lubang, gelombang,
A C
E D
kerutan atau partikel yang melekat pada permukaan, sedangkan pada lembaran plastik yang diberi perlakuan dengan SP3 dan SP4 terlihat adanya gelombang, lubang dan kerutan. Pada gambar E dapat diamati adanya sel bakteri yang melekat pada permukaan LDPE. Hal ini menandakan bahwa telah terjadi biodegradasi yang disebabkan oleh isolat bakteri SP2 dan SP4.
Hasil uji SEM lembaran LDPE yang dilakukan oleh Kavitha et al. (2014) menunjukkan perubahan pada permukaan lembaran LDPE, yaitu terbentuknya lubang dan terjadinya perubaan struktural seperti erosi permukaan pada lembaran LDPE yang diamati dengan 2500x, 5000x, 7500x dan 10000x setelah 30 hari uji biodegradasi. Menurut Gnanavel et al. (2013) biodegradasi plastik biasanya merupakan proses erosi permukaan plastik yang disebabkan oleh sulitnya penetrasi enzim ekstraseluler ke dalam polimer yang hanya bekerja pada permukaan polimer saja. Degradasi plastik terjadi ketika pro-oksidan mengkatalisis pembentukan radikal bebas dalam polietilen, yang bereaksi dengan molekul oksigen untuk merusak matriks polietilen.
Analisis SEM digunakan untuk menganalisis lembaran LDPE setelah periode degradasi. Mikroorganisme memanfaatkan lembaran LDPE sebagai sumber karbon dengan membentuk biofilm pada permukaan lembaran polietilen (Usha et al. 2011). Kemampuan bakteri dalam menggunakan substrat tergantung pada pertumbuhan dan pelekatan bakteri tersebut terhadap substrat. (Gu et al. 2000). Melekatnya bakteri pada substrat yang bersifat hidrofilik atau hidropobik ditentukan oleh banyak faktor, termasuk dorongan yang menyebabkan bakteri melekat ke permukaan serta kandungan dari substrat dan mikroorganisme (Usha
et al. 2011).
4.5.3. Analisis Sifat Kimia
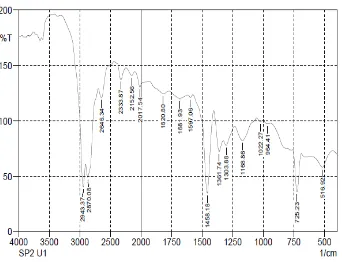
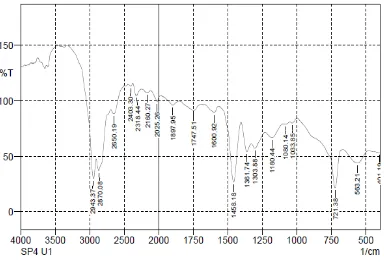
Gambar 4. Spektrum FTIR LDPE pada kontrol.
Gambar 6. Spektrum FTIR LDPE setelah diinkubasi selama 4 minggu dengan isolat bakteri SP4.
Tabel 6. Analisis Gugus Fungsi
No. Perlakuan Bilangan Gelombang (cm-1) Gugus Fungsi 1 Kontrol 2943,37 dan 2870.08
1462,04
Afilatik (C-C) Metilen (CH2) 2 SP2 2943,37 dan 2870,08
1458,18
Afilatik (C-C) Metilen (CH2) 3 SP4 2943,37 dan 2870,08
1458,18
Afilatik (C-C) Metilen (CH2)
Dari Tabel dan Gambar di atas dapat dilihat bahwa intensitas pada daerah bilangan gelombang untuk gugus metilen dalam spektrum polietilena setelah biodegradasi mengalami penurunan. Hal ini menandakan adanya interaksi antara isolat bakteri dan lembaran plastik yang mengakibatkan berkurangnya jumlah rantai polietilena yang mempunyai serapan pada bilangan gelombang tersebut.
monomer yang lebih kecil sebelum dapat diserap dan didegradasi lebih lanjut dalam sel mikroorganisme (Gu et al. 2000).
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Adapun kesimpulan dari penelitian ini ialah:
a. Diperoleh dua isolat bakteri yang paling berpotensi yaitu SP2 dan SP4 yang memiliki kemampuan mendegradasi LDPE dengan persentase kehilangan berat masing-masing sebesar 10,16 % dan 12,06 %.
b. Hasil uji SEM menunjukkan permukaan LDPE menjadi kasar, terbentuknya gelombang, lubang, kerutan serta koloni bakteri melekat pada permukaan LDPE.
c. Hasil uji FTIR menunjukkan adanya perubahan yaitu berkurangnya intensitas bilangan gelombang gugus metilen dari 1462,04 menjadi 1458,18.
5.2. Saran
BAB 2
TINJAUAN PUSTAKA
2.1. Plastik
Perkembangan ilmu pengetahuan dan teknologi, khususnya selama dua dekade terakhir, telah meningkatkan jumlah polimer sintetis yang diproduksi di seluruh dunia setiap tahun (Shimao, 2001). Salah satu polimer sintetik yang sering dikenal dengan polimer buatan adalah plastik. Istilah plastik, yang sering digunakan oleh masyarakat awam untuk menyebut sebagian besar bahan polimer, mulai digunakan pada tahun 1909. Istilah tersebut berasal dari kata “plastikos” yang berarti mudah dibentuk dan dicetak. Plastik didefenisikan sebagai material polimer yang dapat dicetak atau dekstruksi menjadi bentuk yang diinginkan dan yang mengeras setelah didinginkan atau pelarutnya diuapkan. Plastik tidak dipintal menjadi benang yang molekulnya berjajar, seperti dalam serat, tetapi dicetak menjadi bentuk berdimensi tiga atau dibentang menjadi film untuk digunakan sebagai pengemas (Oxtoby et al. 2003).
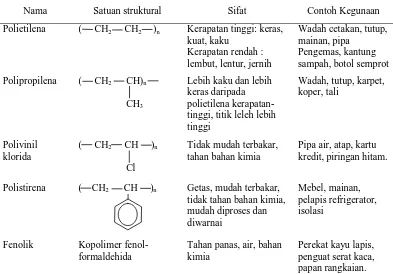
Menurut Erliza dan Sutedja (1987) plastik dapat dikelompokkan atas dua tipe, yaitu termoplastik dan termoset. Termoplastik adalah plastik yang dapat dilunakkan berulangkali dengan menggunakan panas, antara lain polietilen, polipropilen, polistiren dan polivinilklorida. Sedangkan termoset adalah plastik yang tidak dapat dilunakkan oleh pemanasan, antara lain phenol formaldehid dan urea formaldehid.
Material plastik banyak digunakan karena sifatnya praktis, fleksibel, ringan, tahan air, dan harganya relatif murah serta terjangkau oleh semua kalangan masyarakat, selain itu plastik mudah diproduksi secara massal. Tetapi di samping keunggulannya, plastik masih mempunyai sifat kurang menguntungkan. Limbah plastik dapat mencemari lingkungan karena plastik merupakan bahan yang sulit terdegradasi. Plastik tidak mudah hancur karena pengaruh lingkungan seperti cuaca hujan dan panas matahari maupun mikroba yang hidup dalam tanah (Waryat et al. 2013).
Tabel 1. Daftar Beberapa Plastik yang Paling Penting Serta Sifat-Sifatnya
Nama Satuan struktural Sifat Contoh Kegunaan Polietilena ( CH2 CH2 )n Kerapatan tinggi: keras,
ulang plastik, telah disetujui pemberian kode plastik secara internasional. Kode tersebut terutama digunakan pada kemasan plastik yang disposable atau sekali pakai.
a. Polyethylene terephthalate (PET)
Jenis plastik ini berlogo segitiga bernomor 1, biasanya digunakan untuk botol minuman, botol kecap, sambal, obat dan minyak goreng. Bersifat jernih dan transparan, kedap gas dan air. Untuk jenis ini, disarankan hanya untuk satu kali penggunaan dan tidak untuk mewadahi pangan dengan suhu lebih dari 60 .
b. High Density Polyethylene (HDPE)
Jenis plastik ini berlogo segitiga bernomor 2, bersifat keras hingga semifleksibel, tahan terhadap bahan kimia dan kelembaban, dapat ditembus gas, mudah diwarnai, dan dibentuk. Plastik jenis ini melunak pada suhu 75 , biasanya digunakan untuk botol susu, kantong belanja dan tutup plastik. Disarankan hanya untuk satu kali penggunaan karena dikhawatirkan bahan penyusun plastik akan lebih mudah bermigrasi ke dalam makanan jika digunakan berulang kali.
c. Polyvinil chloride (PVC)
Plastik jenis ini berlogo segitiga bernomor 3, sulit di daur ulang, sebaiknya tidak digunakan sebagai wadah makanan yang mengandung lemak dan alkohol. PVC biasanya digunakan untuk botol kecap dan plastik pembungkus. d. Low Density Polyethylene (LDPE)
Plastik ini sebaiknya tidak digunakan kontak langsung dengan makanan. LDPE berlogo segitiga bernomor 4 dengan ciri, bahan mudah diproses, kuat, fleksibel, kedap air, tidak jernih tapi tembus cahaya serta melunak pada suhu 70 .
e. Polypropylene (PP)
f. Polystyrene (PS)
Terdapat dua macam polystyrene, yaitu yang kaku dan lunak atau berbentuk
foam. PS yang kaku biasanya jernih seperti kaca, kaku, getas, mudah
terpengaruh lemak dan pelarut. Plastik ini berlogo segitiga dengan nomor 6, biasanya digunakan sebagai wadah makanan atau minuman sekali pakai serta melunak pada suhu 95 .
g. Plastik Lainnya
Digambarkan dengan logo segitiga bernomor 7, bersifat keras, jernih, dan secara termal sangat stabil, biasanya digunakan untuk peralatan makan bayi, botol susu dan galon air.
h. Melamin
Melamin biasanya digunakan sebagai peralatan makan seperti cangkir, piring, sendok dan garpu. Melamin terbuat dari resin (bahan pembuat plastik) dan formaldehid atau formalin. Kandungan formalin dapat bermigrasi ke dalam pangan, terutama jika produk pangan dalam keadaan panas, asam dan mengandung minyak.
2.2. Polietilena Kerapatan Rendah ( Low Density Polyethylene)
Etilena (CH2= CH2) ialah monomer paling sederhana yang akan berpolimerisasi.
Melalui polimerisasi adisi yang diinisiasi radikal bebas pada tekanan tinggi (1000-3000 atm) dan suhu tinggi (300-500 ), senyawa ini membentuk polietilena:
nCH2 CH2 [ CH2 CH2 ]n. (Oxtoby et al. 2003). Polietilena merupakan
film yang lunak, transparan dan fleksibel, mempunyai kekuatan benturan serta kekuatan sobek yang baik. Dengan pemanasan akan menjadi lunak dan mencair pada suhu 110 . Berdasarkan sifat permeabilitasnya yang rendah serta sifat-sifat mekaniknya yang baik, polietilen mempunyai ketebalan 0.001 sampai 0.01 inchi, yang banyak digunakan sebagai pengemas makanan, karena sifatnya yang termoplastik, polietilen mudah dibuat kantung dengan derajat kerapatan yang baik (Sacharow & Griffin, 1970).
Radikal bebas sering mencabut hidrogen dari bagian tengah rantai dalam sintesis ini, sehingga polietilenanya sangat bercabang dengan rantai samping hidrokarbon yang bervariasi panjangnya. Jenis polietilena ini dinamakan polietilena kerapatan rendah (LDPE) sebab kesulitan dalam mengemas rantai sampingnya yang tak beraturan ini menyebabkan kerapatannya lebih rendah (<0,94 % g cm-3) daripada polietilena linear sempurna. Ketidakberaturan ini juga membuatnya relatif lembut, sehingga kegunaan utamanya ialah dalam pembungkusan, plastik pengemas, kantung sampah, dan botol semprot, yang kelembutannya memang diinginkan, dan bukan suatu kelemahan (Oxtoby et al. 2003). Sifat mekanis jenis plastik LDPE adalah kuat, agak tembus cahaya, fleksibel dan permukaan agak berlemak. Pada suhu di bawah 60 sangat resisten terhadap senyawa kimia, daya proteksi terhadap uap air tergolong baik, akan tetapi kurang baik bagi gas-gas yang lain seperti oksigen.
2.3. Degradasi Plastik
Degradasi polimer dapat disebabkan oleh berbagai faktor, seperti sinar matahari, panas, umur dan faktor alam (Pudjiastuti et al. 2012). Berdasarkan penyebabnya, degradasi dibagi dalam beberapa jenis yaitu, degradasi termal (panas), fotodegradasi (cahaya), radiasi (energi tinggi), kimia, biologi (biodegradasi) dan mekanis (Meyer & Fred, 1971).
kena dampak, apabila didukung oleh faktor oksigen, aditif, kristalin, atau pelarut tertentu. Degradasi mekanis dapat terjadi saat pemrosesan maupun ketika produk digunakan oleh gaya geser, dampak benturan dan sebagainya. Degradasi kimia adalah suatu reaksi perubahan kimia atau peruraian komponen suatu polimer
karena reaksi dengan polimer sekitarnya yang berupa proses penyederhanaan
sebuah molekul menjadi lebih sederhana (kecil) baik secara alami maupun buatan.
(Bark & Allan, 1982). Plastik yang sering digunakan baik di dalam maupun di luar ruangan dan berhubungan langsung dengan sinar matahari dalam jangka waktu yang lama dapat memberikan efek yang merugikan bagi produk plastik tersebut. Radiasi Ultra Violet (UV) dapat memutuskan ikatan kimia polimer. Proses ini disebut fotodegradasi yang pada akhirnya menyebabkan keretakan, pengapuran, perubahan warna, dan menurunnya sifat-sifat fisik tertentu (Allen, 1983).
2.4. Biodegradasi Plastik
Biodegradasi adalah proses dimana mikroorganisme mampu mendegradasi atau memecah polimer alam (seperti lignin, selulosa) dan polimer sintetik (seperti polietilen, polistiren) (Fadlilah & Shovitri, 2014). Mekanisme biodegradasi diawali dengan degradasi secara abiotik yaitu fotodegradasi yang mengubah gugus rantai utama dengan adanya gugus karbonil (C=O), sehingga terjadi oksidasi karbon pada rantai polimer polietilen (Leja & Lewandowicz, 2009). Oksidasi karbon ini menghasilkan gugus fungsional dengan berat molekul rendah seperti keton, asam karboksilat, dan hidrokarbon (Chiellini et al. 2007). Gugus fungsional yang terbentuk akan menyebabkan sifat polimer hidrokarbon yang awalnya hidrofobik berubah menjadi hidrofilik, sehingga permukaan polimer dapat menyerap air dan memudahkan mikroorganisme (bakteri) untuk melakukan proses degradasi (Gilan et al. 2004; Hadad et al. 2005).
biofilm (Das & Kumar, 2013), kemudian bakteri memecah polimer kompleks plastik menjadi senyawa yang lebih sederhana (oligomer, dimer, dan monomer) dengan bantuan enzim intraseluler dan ekstraseluler depolimerase sehingga senyawa tersebut dengan mudah diangkut ke dalam sel bakteri sebagai sumber karbon dan energi (Mohan dan Srivastava, 2010). Plastik yang telah didegradasi akan diabsorbsi oleh sel mikroba untuk metabolisme. Metabolisme secara aerobik menghasilkan karbon dioksida dan air. Sebaliknya metabolisme anaerob menghasilkan karbon dioksida air dan metana sebagai produk akhir metabolisme (Usha et al. 2011). Enzim ekstraseluler sulit melakukan penetrasi ke dalam material polimer sehingga aktivitas enzim hanya terjadi pada permukaan polimer, sehingga biodegradasi plastik biasanya hanya merupakan proses erosi permukaan. Kerusakan secara fisik mampu memacu biodegradasi polimer dengan menambah area permukaan untuk kolonisasi mikroba atau mengurangi berat molekul polimer tersebut (Bollag et al. 2000). Sifat fisik dan kimia yang dimiliki plastik mempengaruhi mekanisme biodegradasi. Kondisi permukaan (luas permukaan, sifat hidrofilik dan hidrofobik), struktur kimia, berat molekul, titik leleh dan struktur kristal memiliki peran penting dalam proses biodegradasi (Tokiwa et al. 2009).
Keragaman mikroorganisme pendegradasi polimer sangat bergantung pada lingkungan, seperti tanah, laut, endapan lumpur aktif, dan sebagainya (Tokiwa et
al. 2009). Sekitar 90 marga mikroorganisme dinyatakan mampu mendegradasi
plastik, baik bakteri dan jamur, mereka mendegradasi plastik dengan cara mendegradasi hidrokarbon yang terkandung dalam plastik dan memanfaatkannya sebagai sumber karbon (Gnanavel et al. 2013). Mikroorganisme yang mampu mendegradasi plastik diantaranya: Bacillus megaterium, Pseudomonas sp.,
Azotobacter, Ralstonia eutropha, Halomonas sp., Xanthomonas spp., Flavobacterium spp., Micrococci, Streptococcus, Sthapylococcus, Phanerochate
chyrosporium, Penicillium frequentans, Bacillus mycoides, Pseudomonas
putidaVM15A, Streptomyces spp., Aspergillus sppdan lainnya (Chee et al. 2010;
1.1. Latar Belakang
Selama kurun waktu 3 dekade, bahan plastik semakin banyak digunakan dalam dunia industri baik industri makanan, pakaian, transportasi, konstruksi, medis maupun rekreasi (Fadlilah & Shovitri, 2014). Plastik banyak dimanfaatkan dalam berbagai keperluan manusia. Hal ini disebabkan sifatnya yang elastis, berbobot ringan tetapi kuat, tidak mudah pecah, transparan, dan tahan air (PPLH, 2007).
Penggunaan polietilen bertambah secara global dengan laju 12% pertahun dan sekitar 140 juta ton polimer sintetik diproduksi setiap tahunnya. Dengan jumlah polietilen yang cukup besar terakumulasi di lingkungan, limbah plastik membutuhkan ribuan tahun untuk terdegradasi secara efisien (Shimao, 2001). Salah satu polietilen yang menjadi sumber utama polusi lingkungan adalah Low
Density Polyethylene (LDPE), jenis polietilen ini digunakan untuk membuat
kantung plastik serta pembungkus makanan dan barang. Plastik yang berasal dari material polietilen, polipropilen, polivinilklorida (PVC) jika dibakar atau dipanaskan dapat menyebabkan terbentuknya dioksin, yaitu suatu zat yang sangat beracun dan merupakan penyebab kanker serta dapat mengurangi sistem kekebalan tubuh seseorang (PPLH, 2007).
sampah plastik yang kering serta dari jenis yang sama dengan formulasi yang tetap (Sahwan et al. 2005).
Cara penanggulangan yang dianggap ramah lingkungan dan tidak menimbulkan masalah baru adalah dengan proses biodegradasi (Rohaeti, 2009). Biodegradasi material organik, terutama polimer alam seperti selulosa, lignin, atau karet alam, dapat terjadi secara mikrobiologis. Mikroorganisme mengeluarkan enzim yang dapat mendegradasi suatu senyawa mejadi senyawa yang lebih sederhana melalui reaksi enzimatik (Adam & Clark, 2009). Reaksi enzimatik terhadap polimer merupakan suatu proses kimiawi agar mikroorganisme memperoleh sumber nutrisi dari polimer (PPLH, 2007).
Beberapa penelitian sebelumnya telah membuktikan potensi bakteri indigenus dari tempat pembuangan sampah dari genus Brevibacillus,
Pseudomonas dan Rhodococcus spp. telah mampu mendegradasi polietilen
dengan persentase kehilangan berat masing-masing sebesar 37,5%, 40,5% dan 33% (Nanda & Sahu, 2010). Sejauh ini, penelitian tentang bakteri pendegrasi plastik LDPE belum banyak dilakukan. Oleh karena itu, perlu dilakukan penelitian isolasi bakteri dari Tempat Pembuangan Akhir (TPA) dan melihat kemampuannya dalam mendegradasi plastik LDPE.
1.2. Permasalahan
Proses degradasi sampah plastik yang sangat lambat mengakibatkan penimbunan sampah itu sendiri di lingkungan. Timbunan sampah plastik tersebut menimbulkan pencemaran lingkungan yang serius. Biodegradasi plastik oleh mikroba merupakan proses yang paling aman dalam mengurangi cemaran plastik di lingkungan. Oleh karena itu, perlu dipelajari apakah bakteri yang diisolasi dari TPA dapat mendegradasi LDPE.
1.3. Tujuan Penelitian
Tujuan dari penelitian ini antara lain:
a. Untuk mendapatkan isolat bakteri yang mampu mendegradasi plastik (low
b. Untuk mengetahui kemampuan bakteri yang diisolasi dari TPA dalam mendegradasi plastik (low density polyethylene) dalam kondisi laboratorium.
1.4. Hipotesis
Terdapat isolat bakteri yang memiliki kemampuan mendegradasi plastik (low density polyethylene) secara in vitro pada sampel tanah dari TPA.
1.5. Manfaat Penelitian
KEMAMPUAN BAKTERI DARI TEMPAT PEMBUANGAN AKHIR (TPA) DALAM MENDEGRADASI PLASTIK (Low Density Polyethylene)
ABSTRAK
Low density polyethylene (LDPE) merupakan salah satu sumber utama polusi
lingkungan dan biodegredasinya merupakan fokus dari penelitian ini. Uji biodegradasi LDPE telah dilakukan dengan bakteri yang diisolasi dari Tempat Pembuangan Akhir (TPA) Namo Bintang, Medan Tuntungan. Skrining bakteri pendegradasi LDPE didasarkan pada kemampuan bakteri untuk tumbuh dalam
Mineral Salt Medium Broth (MSMB) yang mengandung 1% bubuk LDPE dan
diperoleh dua isolat yang potensial dengan kode SP2 dan SP4. Degradasi LDPE dievaluasi dengan mengukur penurunan berat, analisis SEM dan FTIR setelah uji biodegradasi. Uji kemampuan isolat dalam mendegradasi lembar LDPE selama 4 minggu menunjukkan bahwa isolat SP2 dan SP4 mampu menurunkan berat LDPE masing-masing sebesar 10,16% dan 12,06% sedangkan penurunan berat pada kontrol adalah 0%. Hasil analisis SEM menunjukkan permukaan LDPE menjadi kasar, adanya gelombang, kerutan, dan koloni bakteri melekat pada permukaan LDPE. Penurunan intensitas bilangan gelombang pada analisis FTIR menunjukkan LDPE mengalami degradasi.
THE ABILITY OF BACTERIA FROM WASTE DUMP SITE TO DEGRADE PLASTIC (Low Density Polyethylene)
ABSTRACT
The low density polyethylene (LDPE) is one of environtmental pollutant and its biodegradation was the focus of the present study. Biodegradation test of LDPE was done using bacteria isolated from Namo Bintang waste dump site, Medan Tuntungan. The screening of isolates was based on their abilities to growth on Mineral Salt Medium Broth (MSMB) containing 1% LDPE powder. Two potential isolates, SP2 and SP4, were obtained. LDPE degradation was confirmed by measuring weight loss, SEM and FTIR analysis after biodegradation test. The ability of isolates in degrading LDPE showed that isolate SP2 and SP4 reduced weight of LDPE with total weight loss of 10,16 % and 12,06 % while control reduced 0% respectively after 4 weeks of cultivation. SEM analysis showed the surface of LDPE became rough, the formation of waves, wrinkles and bacterial colonies attached to the surface of LDPE. Decrease of intensity of wave number by FTIR analysis confirmed that LDPE was partially degraded.
Density Polyethylene)
SKRIPSI
FAMELA C. BR. SIPAYUNG 110805042
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Density Polyethylene)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
FAMELA C. BR. SIPAYUNG 110805042
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Judul : Kemampuan Bakteri dari Tempat Pembuangan Akhir (TPA) dalam Mendegradasi Plastik (Low
Density Polyethylene )
Kategori : Skripsi
Nama : Famela C. Br. Sipayung
Nomor Induk Mahasiswa : 110805042
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Januari 2017
Komisi Pembimbing : Pembimbing 2,
Dra. Nunuk Priyani, M. Sc. NIP. 196404281999032002
Pembimbing 1,
Prof. Dr. Erman Munir, M.Sc NIP. 196511011991031002
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
KEMAMPUAN BAKTERI DARI TEMPAT PEMBUANGAN AKHIR (TPA) DALAM MENDEGRADASI PLASTIK (LOW DENSITY
POLYETHYLENE)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2017
PENGHARGAAN
Puji syukur penulis ucapkan ke hadirat Tuhan Yang Maha Esa atas kasih dan anugerahNya yang tidak pernah berhenti sehingga penulis dapat menyelesaikan skripsi yang berjudul “Kemampuan Bakteri Dari Tempat Pembuangan Akhir (TPA) Dalam Mendegradasi Plastik (Low Density Polyethylene)”. Skripsi ini dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Sains pada Fakultas MIPA USU Medan.
Ucapan terima kasih penulis sampaikan kepada orangtua ayahanda dan ibunda tercinta, P. Sipayung dan I. Pasaribu yang selalu memberikan doa, cinta kasih, semangat, perhatian dan pengorbanan yang begitu besar kepada penulis. Terima kasih juga kepada abang Juan Rio Sipayung, adik Egion Timotius Sipayung dan kakak Mafe Grace Karo-Karo yang tiada henti memberikan semangat dan bantuan kepada penulis disaat-saat sulit selama pengerjaan skripsi ini. Kepada Maktua dan Paktua Manjung serta seluruh keluarga penulis atas segala bantuan baik moril maupun materil hingga skripsi ini selesai.
Terima kasih penulis sampaikan kepada Bapak Prof. Dr. Erman Munir, M.Sc selaku pembimbing I dan Ibu Dra. Nunuk Priyani M.Sc selaku pembimbing II yang telah banyak meluangkan waktu, tenaga dan pikiran saat bimbingan pada masa penelitian hingga penulisan skripsi ini.Ucapan terima kasih juga penulis ucapkan kepada Ibu Dr. It Jamilah M.Sc dan Bapak Drs. Arlen H. J, M.Si selaku dosen penguji yang telah memberikan banyak masukan dan arahan dalam penyempurnaan penulisan skripsi ini. Ibu Dr. Erni Jumilawaty, M.Si selaku dosen pembimbing akademik yang telah memberikan nasehat dan semangat selama masa perkuliahan. Ibu Dr. Nursahara Pasaribu M. Sc. selaku ketua Departemen Biologi FMIPA USU. Ibu Nurhasni Muluk, Kak Siti, Bang Erwin dan Kak Rosalina Ginting selaku staf pegawai Departemen Biologi FMIPA USU.
Akhirnya dengan penuh ketulusan dan kerendahan hati, penulis menyadari bahwa skiripsi ini masih jauh dari kesempurnaan. Penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skiripsi ini. Semoga Tuhan Yang Maha Esa membalas kebaikan kita semua. Atas partisipasi dan dukungannya penulis ucapkan terima kasih.
Medan, Januari 2017
KEMAMPUAN BAKTERI DARI TEMPAT PEMBUANGAN AKHIR (TPA) DALAM MENDEGRADASI PLASTIK (Low Density Polyethylene)
ABSTRAK
Low density polyethylene (LDPE) merupakan salah satu sumber utama polusi
lingkungan dan biodegredasinya merupakan fokus dari penelitian ini. Uji biodegradasi LDPE telah dilakukan dengan bakteri yang diisolasi dari Tempat Pembuangan Akhir (TPA) Namo Bintang, Medan Tuntungan. Skrining bakteri pendegradasi LDPE didasarkan pada kemampuan bakteri untuk tumbuh dalam
Mineral Salt Medium Broth (MSMB) yang mengandung 1% bubuk LDPE dan
diperoleh dua isolat yang potensial dengan kode SP2 dan SP4. Degradasi LDPE dievaluasi dengan mengukur penurunan berat, analisis SEM dan FTIR setelah uji biodegradasi. Uji kemampuan isolat dalam mendegradasi lembar LDPE selama 4 minggu menunjukkan bahwa isolat SP2 dan SP4 mampu menurunkan berat LDPE masing-masing sebesar 10,16% dan 12,06% sedangkan penurunan berat pada kontrol adalah 0%. Hasil analisis SEM menunjukkan permukaan LDPE menjadi kasar, adanya gelombang, kerutan, dan koloni bakteri melekat pada permukaan LDPE. Penurunan intensitas bilangan gelombang pada analisis FTIR menunjukkan LDPE mengalami degradasi.
THE ABILITY OF BACTERIA FROM WASTE DUMP SITE TO DEGRADE PLASTIC (Low Density Polyethylene)
ABSTRACT
The low density polyethylene (LDPE) is one of environtmental pollutant and its biodegradation was the focus of the present study. Biodegradation test of LDPE was done using bacteria isolated from Namo Bintang waste dump site, Medan Tuntungan. The screening of isolates was based on their abilities to growth on Mineral Salt Medium Broth (MSMB) containing 1% LDPE powder. Two potential isolates, SP2 and SP4, were obtained. LDPE degradation was confirmed by measuring weight loss, SEM and FTIR analysis after biodegradation test. The ability of isolates in degrading LDPE showed that isolate SP2 and SP4 reduced weight of LDPE with total weight loss of 10,16 % and 12,06 % while control reduced 0% respectively after 4 weeks of cultivation. SEM analysis showed the surface of LDPE became rough, the formation of waves, wrinkles and bacterial colonies attached to the surface of LDPE. Decrease of intensity of wave number by FTIR analysis confirmed that LDPE was partially degraded.
DAFTAR ISI
2.2. Polietilena Kerapatan Rendah (Low Density Polyethylene) 7
2.3. Degradasi Plastik 8
2.4. Biodegradasi Plastik 9
BAB 3. BAHAN DAN METODE 11
3.1. Waktu dan Tempat 11
3.2. Alat dan Bahan 11
3.3. Metode Penelitian 11
3.3.1. Lokasi dan Tahap Pengambilan Sampel 11
3.3.2. Isolasi Bakteri 11
3.3.3. Pembuatan Bubuk LDPE 12
3.3.4. Lembar Tipis LDPE 12
3.3.5. Skrining Awal Bakteri Pendegradasi LDPE Skrining Awal Bakteri Pendegradasi LDPE
12
3.3.6. Karakterisasi Bakteri 12
3.3.7. Uji Biodegradasi 13
3.3.8. Populasi Bakteri 13
3.3.9. Karakterisasi Polietilena 13
3.3.9.1. Penentuan persentase Kehilangan Bobot 13
3.3.9.2. Analisis Sifat Fisika 14
3.3.9.3. Analisis Sifat Kimia 14
BAB 4. HASIL DAN PEMBAHASAN 15
4.2. Skrining Awal Bakteri Pendegradasi Polietilena 15
4.3. Uji Biokimia dan Karakterisasi Bakteri 18
4.4. Populasi Bakteri 18
4.5. Karakterisasi Lembaran Plastik LDPE 20
4.5.1. Persentase Kehilangan Bobot 20
4.5.2. Analisis Sifat Fisika 21
4.5.3. Analisis Sifat Kimia 23
BAB 5. KESIMPULAN DAN SARAN 26
5.1. Kesimpulan 26
5.2. Saran 26
DAFTAR TABEL
Tabel Judul Halaman
1 Daftar Beberapa Plastik yang Paling Penting Serta Sifat-Sifatnya
5
2 Karakterisasi Bakteri-Bakteri dari TPA Namo Bintang 15 3 Uji Biokimia dan Karakterisasi Morfologi 18
4 Rataan Jumlah Koloni cfu/ml 19
5 Data Persentase Kehilangan bobot LDPE 20
DAFTAR GAMBAR
Gambar Judul Halaman
1 Profil Pertumbuhan Isolat (Absorbansi pada Panjang Gelombang 600 nm)
16 2 Profil Pertumbuhan Isolat (Jumlah Koloni) 16
3 Hasil Uji SEM 22
4 Spektrum FTIR LDPE pada Kontrol 24
5 Spektrum FTIR LDPE setelah Diinkubasi Selama 30 Hari dengan Isolat Bakteri SP2
24
6 Spektrum FTIR LDPE setelah Diinkubasi selama 30 Hari dengan Isolat Bakteri SP4
DAFTAR LAMPIRAN
Lampiran Judul Halaman
1 Hasil Isolasi Bakteri 31
2 Data Mentah Hasil Pengukuran Nilai OD 31
3 Data Mentah Hasil Pengukuran Jumlah Koloni 31 4 MSMB dengan Lembaran Plastik dan Isolat Bakteri
setelah Uji Biodegradasi
32