ABSTRAK
STUDI ADSORPSI ION Pb(II) dan Cu(II) PADA BIOMASSA ALGA Chaetoceros sp DENGAN PELAPISAN SILIKA-MAGNETIT
Oleh Rudi Jailani
Pada penelitian ini telah dilakukan sintesis hibrida alga silika (HAS), dan HAS-magnetit yang dianalisis dengan menggunakan spektrofotometer inframerah (IR), Scanning Electron Microscope(SEM), dan spektofotometer serapan atom (SSA). Identifikasi gugus fungsi HAS, dan HAS-magnetit dilakukan dengan menggunakan spektrofotometer inframerah (IR) diketahui adanya tambahan serapan baru yang terdapat pada bilangan gelombang 2924,09 cm-1 yang berasal dari serapan vibrasi ulur C-H dari (-CH2) alifatik menunjukkan bahwa hibridisasi silika dengan biomassa alga Chaetoceros sp telah berhasil dilakukan pada HAS maupun HAS-magnetit. Analisis morfologi permukaan pada adsorben dilakukan menggunakan instrumentasi Scanning Electron Microscope(SEM). Pada mikrograf magnetit bersifat kristalin dan pada mikrograf silika magnetit cenderung bersifat amorf. Sedangkan pada mikrograf HAS bersifat amorf dan HAS-magnetit bersifat kristalin. Data kinetika adsorpsi ion Pb(II) dan Cu(II) pada alga, HAS, dan HAS-magnetit cenderung mengikuti model kinetika pseudo orde dua dengan k2 masing-masing 0,018, 0,285 dan 0,428 g mmol-1
menit-1 untuk ion Pb(II) kemudian untuk ion Cu(II) adalah 0,159, 0,344 dan 0,681 g mmol-1 menit-1. Isoterm adsorpsi ion Pb(II) dan Cu(II) pada alga, HAS dan HAS-magnetit cenderung mengikuti model isoterm Freundlich dengan nilai Kf
masing-masing 1,028, 1,116 dan 1,140 mol L-1untuk ion Pb(II), untuk ion Cu(II) adalah 1,253, 1,135 dan 1,218 mol L-1.
STUDI ADSORPSI ION Pb(II) DAN ION Cu(II) PADA BIOMASSA Chaetoceros sp DENGAN PELAPISAN
SILIKA-MAGNETIT
Oleh Rudi Jailani
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
MENGESAHKAN
1. Tim Penguji
Ketua : Dr. Buhani, M.Si. …………....
Sekretaris : Prof. Suharso, Ph.D. …………....
Penguji
Bukan Pembimbing : Kamisah M.Si …………....
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D. NIP 196905301995121001
RIWAYAT HIDUP
Penulis dilahirkan di Palembang, pada tanggal 01 Januari 1990, sebagai anak ketiga dari empat bersaudara, putra dari Mahdi Syamsudin dan Lailita Pawar.
Jenjang pendidikan diawali dari Sekolah Dasar (SD) di SDN 1 Cempaka Lampung Utara, diselesaikan pada tahun 2001. Sekolah Menengah Pertama (SMP) di SMPN 5 Cempaka Lampung Utara diselesaikan pada tahun 2005, dan Sekolah Menengah Atas (SMA) di SMA Hang Tuah Lampung Utara, diselesaikan pada tahun 2008. Tahun 2008, penulis terdaftar sebagai mahasiswa Jurusan Kimia FMIPA Unila melalui jalur SNMPTN (Seleksi Nasional Masuk Perguruan Tinggi Negeri).
Motto
Selama kamu yakin, tak ada yang tak mungkin. Percaya diri!
Kamu lebih hebat dari yang kamu pikirkan.
_Kutipan_
Sukses tak akan datang bagi mereka yang hanya menunggu tak
berbuat apa-apa, tapi bagi mereka yang selalu berusaha
wujudkan mimpinya.
_Kutipan_
Insya ALLAH ada jalan disetiap masalah yang datang.
Kupersembahkan karya sederhana ini kepada :
ALLAH S.W.T
Kedua orang tuaku,
Bapak dan Ibu yang telah memberikan kasih dan sayang dan cintanya
dalam semangat dan doa-doa indah untukku
Kakak-kakakku Tersayang
Rubi Salam, dan Dedi Wijaya
Adik Tersayang
Rangga Brahma
Keponakan-keponakanku tercinta
Kinan dan Icha
Seluruh sahabat terbaikku
Robbi Yansya, Majid Rimbani, Julian, Sukma, dan Edi Putra
SANWACANA
Assalamu’alaikum Wr. Wb.
Alhamdulillah Puji dan syukur Penulis ucapkan atas kehadirat Allah SWT, karena atas segala rahmat dan karunia-Nya skripsi ini dapat diselesaikan.
Skripsi dengan judul "Studi adsorpsi Ion Pb(II) dan Cu(II) Pada Biomassa Alga Chaetoceros sp Dengan Pelapisan Silika-Magnetit" adalah salah satu syarat untuk memperoleh gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Dalam pelaksanaan dan penulisan skripsi ini tidak lepas dari kesulitan dan rintangan, namun itu semua dapat penulis lalui berkat rahmat dan ridha Allah SWT serta bantuan dan dorongan semangat dari orang-orang yang hadir dalam kehidupan penulis. Pada kesempatan ini, penulis menyampaikan terima kasih setulus-tulusnya kepada :
2. Bapak Prof. Suharso, Ph.D, selaku pembimbing II penelitian dan Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung yang telah memberikan kritik, saran dan arahan yang diberikan kepada penulis sehingga skripsi ini terselesaikan dengan baik.
3. Ibu Kamisah D. Pandiangan, M.Si, selaku penguji penelitian yang telah memberikan semangat, kritik, saran dan arahan kepada penulis sehingga skripsi ini terselesaikan dengan baik.
4. Ibu Prof. Tati Suhartati, M.S., selaku Pembimbing Akademik atas
kesediaannya utuk memberikan bimbingan, bantuan, nasehat dan informasi yang bermanfaat kepada penulis.
5. Bapak Andi Setiawan, Ph.D., selaku ketua Jurusan Kimia FMIPA Unila. 6. Seluruh dosen FMIPA Unila yang telah mendidik dan memberikan ilmu
pengetahuan yang sangat berguna kepada penulis selama kuliah.
7. Kedua orang tuaku yang sangat aku cintai. Ayahku Mahdi Syamsudin yang selalu menjadi ayah yang berarti dan tak tergantikan untukku, menjadi penyemangatku dan selalu menjadi inspirasiku. Ayah terima kasih atas do’amu yang tak putus dan segala bentuk pengorbananmu . Ibuku Lailita Pawar yang selalu membuatku tetap semangat dan bangkit dalam menjalani semuanya, selalu setia menjadi pahlawan tanpa tanda jasa. Ibu mungkin hanya baru ini saja yang dapat aku berikan secuil penghargaan kecil dan hanya untukmu ibu. Ibu terima kasih engkau selalu ada saat aku kesusahan, pemberi semangat saat aku terpuruk, pembangkit saat aku terjatuh. Ibu yang selalu memberikan kasih sayang, sabar mengahadapi aku dan selalu
yang selalu menyemangatkanku. Terima kasih telah ikhlas menyayangiku. Tak putus-putus pengorbanan kalian untukku. Sekali lagi, Terima kasih ayah dan Ibuku sayang.
8. Kedua kakakku yang sangat aku sayangi, Rubi Salam dan Dedi Wijaya, terima kasih atas doa dan dukungan kalian. Kalian adalah kakak-kakakku terbaikku.
9. Adikku tersayang, Rangga Brahma yang selalu mendo’akanku dan memberi dukungan untukku..
10. Sahabat-sahabat terbaikku yang selalu rela membagi waktunya untuk mendengarkan ceritaku. Roby Yansya (kuncen), Majid Rimbani (PHP), Edi Putra (paktut), Sukma, Julian, Eko Wahyudi Rais,Tubagus Candra. Kalian semua adalah orang yang terbaik yang pernah aku kenal. Akan selalu
terkenang masa-masa kita sering ngopi, nongkrong, dan curhat bareng (Roby dan Majid). Untuk kalian berdua, Roby dan majid semoga kalian akan cepat wisuda juga ya jangan lama-lama.
11. Teman-teman kosan Kurni Ilahi, Sorgan, Agus, Rais, Sovian, Rois, Yogi, Septa, Nandar, Amin, Agam, Edi dan Noval. Terima kasih atas kebaikan kalian semua. Kalian semua yang terbaik.
12. Teman-teman seperjuangan penelitianku Roby Yansya terima kasih ya atas segala bantuan dan semangat, sukses selalu ya.
14. Teman-teman Kimia 2008 : Miftahudin Ramli, S.Si, Albert Ferdinand P, S.Si, Ani Sulistriani, S.Si, Sundari Riawati, S.Si, Eliana Sari, S.Si, Ni Putu Y, S.Si, Dewi S.Si, Nita (yang selalu mencari cinta sejatinya), Shoffa S.Si, Kiki, Vivi, Putri, Siti, Mifta S.Si, Wanti S.Si, Eny S.Si, Leny S.Si, Evi S.Si, Ayu, Novi, Adek S.Si, Candra, Retno S.Si (orang yang selalu bingung, lucu, aneh, tapi sangat berarti banget dapat mengenal kamu dan semoga kita nantinya dapat
dipertemukan kembali ya dan dengan kata khas nya “maksudnya”), Dewa
S.Si (miss gupekan), Nuro, Eko, Riki S.Si (cowok gaul), Puji S.Si, Mychel, Idrus, Raffel S.Si, Robby (kuncen), Majid (PHP dan jangan godain cewek terus jid, peace), Amin, Ricardo S.Si, Subari, Arif A, Tb, Ruzki, Ramdhan S.Si, Nanda kalian adalah teman-teman terbaik yang pernah aku dapatkan. Terimakasih untuk pertemanan ini, kalian yang terbaik, aku sayang kalian kawan-kawanku.
15. Para Karyawan yang berpengaruh dalam penyusunan skripsi ini, Mas Nomo, Mbak Nora, Mbak Liza, Mbak Iin, Mbak Wiwit, Mbak Eka, Mbak Hade, Mbak Putri. Terima kasih atas bantuannya ya, semoga kalian sukses selalu. 16. Kakak-kakak Kimia 2005, 2006, 2007 dan adik-adik kimia 2009, 2010, 2011
dan 2012 FMIPA Unila terima kasih atas segala dukungannya.
Akhir kata, Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Penulis berharap semoga skripsi yang sederhana ini dapat berguna dan bermanfaat bagi kita semua. Amin.
Bandar Lampung, 8 November 2012 Penulis
DAFTAR TABEL
Tabel Halaman
1. Hasil analisis gugus fungsi pada adsorben ... 29 2. Parameter kinetika adsorpsi ion Pb(II) dan Cu(II) terhadap
material alga, HAS, dan HAS-magnetit ... 33 3. Parameter isotherm adsorpsi Langmuir dan Freundlich ion Pb(II) dan Cu(II) pada material alga, HAS, dan HAS-magnetit ... 41
ABSTRACT
ADSORPTION STUDY OF Pb (II) AND Cu (II) IONS ON Chaetoceros sp ALGAE BIOMASS WITH COATING OF SILICA-MAGNETITE
By
Rudi Jailani
In this study, it had been performed the synthesis of silica algae hybrid (HAS) and HAS-magnetite analyzed with using an infrared spectrophotometer (IR),a scanning electron microscope (SEM) and an atomic absorption spectrophotometer (AAS). HAS and HAS-magnetite functional group identification were performed using infrared spectrophotometer (IR). Spectra data of infrared spectrophotometer showed that the addition of a new absorption with wave number of 2924.09 cm-1, which derived from C-H stretching vibrations of aliphatic (-CH2). Thus, hybridization of silica with Chaetoceros sp algae biomass had been performed successfully on HAS and HAS-magnetite. Surface morphology analysis on the adsorbent was applied using scanning electron microscope (SEM). Micrograph of magnetite is crystalline and micrographs of silica-magnetite tend to be amorphous. While micrograph of HAS are amorphous and HAS-magnetite is crystalline. Adsorption kinetics data of Pb (II) and Cu (II) ion on algae, HAS and HAS-magnetite tend to follow second order pseudo kinetics model with values of k2 respectively, 0.018, 0.285 and 0.428 mmol g-1 min-1 for Pb (II) ion and for Cu(II) ion 0.159, 0.344 and 0.681 mmol g-1 min-1. Adsorption isotherms of Pb (II) and Cu (II) ion on algae, HAS and HAS-magnetite tend to follow Freundlich isotherm models with values of Kf respectively 1.028, 1.116, and 1.140 mol L-1 for the Pb (II) ion, whereas for the Cu (II) ions are 1.253, 1.135, and 1.218 mol L-1.
STUDI ADSORPSI ION Pb(II) DAN ION Cu(II) PADA BIOMASSA Chaetoceros sp DENGAN PELAPISAN
SILIKA-MAGNETIT (Hasil Penelitian)
oleh Rudi Jailani
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
vi
DAFTAR GAMBAR
Gambar Halaman 1. Struktur TEOS (tetraetilortosilikat) ... 8 2. Model Isoterm Adsorpsi Freundlich ... 18 3. Spektra IR (a)Alga (b)Silika, (c)HAS, (d)Silika-magnetit,
(e) HAS-magnetit ... 27 4. Spektra SEM (a) magnetit, (b) silika-magnetit, (c) HAS, dan
(d) HAS-magnetit ... 30 5. Pengaruh waktu interaksi pada adsorpsi ion Pb(II) terhadap
alga, HAS, dan HAS-magnetit ... 31 6. Pengaruh waktu interaksi pada adsorpsi ion Cu(II) terhadap
alga, HAS, dan HAS-magnetit ... 32 7. Analisis kinetika pseudo orde satu pada alga, HAS, dan
HAS-magnetit terhadap logam Pb(II) ... 33 8. Analisis kinetika pseudo orde satu pada alga, HAS, dan
HAS-magnetit terhadap logam Cu(II) ... 34 9. Analisis kinetika pseudo orde dua pada alga, HAS, dan
HAS-magnetit terhadap ion logam Pb(II) ... 35 10. Analisis kinetika pseudo orde dua pada alga, HAS, dan
HAS-magnetit terhadap ion logam Cu(II) ... 36 11. Hubungan antara jumlah logam dengan konsentrasi awal
ion Pb(II) yang digunakan pada proses adsorpsi oleh alga,
HAS, dan HAS-magnetit ... 37 12. Hubungan antara jumlah logam dengan konsentrasi awal
ion Pb(II) yang digunakan pada proses adsorpsi oleh alga,
vii
13. Pola isoterm Langmuir pada material alga, HAS, dan HAS-magnetit yang diinteraksikan dengan
ion Pb(II) ... 38 14. Pola isoterm Langmuir pada material alga, HAS,
dan HAS-magnetit yang diinteraksikan dengan
ion Cu(II) ... 39 15. Pola isoterm Freuendlich pada material alga, HAS,
dan HAS-magnetit yang diinteraksikan dengan
ion Pb(II) ... 39 16. Pola isoterm Freuendlich pada material alga, HAS,
iii
V. KESIMPULAN DAN SARAN A. Kesimpulan ... 44
B. Saran ... 45
Judul Laporan : Studi Adsorpsi Ion Pb(II) dan Cu(II) Pada Biomassa Chetoceros sp dengan Pelapisan Silika-Magnetit.
Nama Mahasiswa : Rudi Jailani
Nomor Pokok Mahasiswa : 0817011055
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI
1. Komisi Pembimbing
Pembimbing I Pembimbing II
Dr. Buhani, M.Si. Prof. Suharso, Ph.D. NIP 196904161994032003 NIP 196905301995121001
2. Ketua Jurusan Kimia
Andi Setiawan, Ph.D.
1
I. PENDAHULUAN
A. Latar Belakang
Dewasa ini upaya pengambilan logam berat di perairan lebih mengarah pada pemanfaatan alga sebagai adsorben logam berat. Penggunaan adsorben alga (rumput laut) karena tersedia hampir di setiap tempat juga harganya relatif lebih murah (Sadhori, 1995). Alga mempunyai kemampuan mengikat ion logam yang cukup tinggi dan kemungkinan pengambilan kembali ion logam tersebut relatif lebih mudah (Hancock, 1996). Secara biokimia alga mudah terdegradasi oleh aktivitas bakteri sehingga penggunaan biomassa alga sebagai biosorben relatif lebih aman bagi lingkungan (Jajali et al., 2002).
Alga memiliki kekurangan antara lain: memiliki ukuran yang sangat kecil dan berat jenis yang rendah serta mudah terdegradasi oleh mikroorganisme lain (Harris and Ramelow, 1990), sehingga perlu dilakukan immobilisasi untuk meningkatkan sifatnya baik secara fisik maupun kimia dari biomassa alga
sehingga efektif dan selektif dalam menyerap ion logam berat (Trevan, 1990; Lan et al., 1998). Dalam penelitian ini biomassa alga yang digunakan adalah
2
penyusun utama dari polisakarida dan juga gugus amina sebagai penyusun pektin dan protein (Buhani et al., 2009).
Pada biomassa alga Chaetoceros sp dilakukan immobilisasi dengan matriks pendukung untuk immobilisasi adalah silika gel. Silika gel merupakan padatan anorganik yang memiliki sisi aktif permukaan seperti gugus silanol (-Si-OH) dan siloksan (Si-O-Si) yang dapat berikatan secara kimia dengan gugus-gugus fungsi yang terdapat pada biomassa alga serta mempunyai luas permukaan yang besar. Oleh karena itu, proses immobilisasi alga pada matriks silika ini diharapkan dapat meningkatkan kapasitas adsorpsi ion-ion logam berat dan juga dapat
mempertahankan keaktifan gugus-gugus fungsi yang terdapat pada biomassa alga tersebut.
Hasil immobilisasi diharapkan dapat digunakan dalam kolom untuk menyerap logam berat, dengan struktur fisik yang lebih padat dalam berbagai ukuran, serta kemampuan yang lebih besar dalam mengadsorpsi logam (Ahalya and
Ramachandra, 2003). Selain itu, dilakukan pula modifikasi dengan pelapisan partikel magnetit pada matriks pendukung seperti pelapisan silika-magnetit (Fe3O4) pada biomassa alga untuk meningkatkan kualitas fisik pada biomassa alga, agar dapat digunakan sebagai adsorben yang lebih efektif terhadap logam berat dari limbah cair yang dihasilkan industri. Teknik ini merupakan metode yang cukup baik untuk mengatasi adanya gumpalan padatan tersuspensi
3
Pada penelitian ini telah dilakukan sintesis material hibrida alga silika dari Chaetoceros sp melalui teknik pelapisan silika-magnet. Penggabungan biomassa alga dengan matrik silika melalui teknik sol-gel diharapkan dapat
mempertahankan keaktifan gugus-gugus fungsi yang terdapat pada biomassa sehingga lebih efektif dalam mengadsorpsi ion-ion logam, terutama logam berat (Buhani and Suharso, 2009). Logam berat yang digunakan dalam penelitian ini adalah logam timbal (Pb) dan tembaga (Cu). Logam berat ini pada konsentrasi yang sedemikian rendah saja efek ion logam berat dapat berpengaruh langsung hingga terakumulasi pada rantai makanan. Logam berat dapat mengganggu kehidupan biota dalam lingkungan dan akhirnya berpengaruh terhadap kesehatan manusia. (Suhendrayatna 2001 ; Jovita et al., 2003).
Material yang diperoleh dikarakterisasi dengan spektrofotometer inframerah (IR) untuk analisis gugus fungsi sedangkan untuk menentukan morfologi permukaan material tersebut dianalisis dengan Scanning Electron Microscope (SEM).
4
B. Tujuan Penelitian
Tujuan penelitian ini adalah:
1. Mempelajari cara sintesis dan karakterisasi material biomassa alga Chaetoceros sp, hibrida alga silika (HAS), dan HAS-magnetit.
2. Membandingkan laju dan isoterm adsorpsi ion Pb(II) dan ion Cu(II) pada material biomassa alga Chaetoceros sp, HAS, dan HAS-Magnetit.
C. Manfaat Penelitian
5
II. TINJAUAN PUSTAKA
A. Silika Gel
Silika merupakan senyawa yang banyak ditemui dalam bahan galian yang disebut pasir kuarsa, terdiri atas kristal-kristal silika (SiO2) dan mengandung senyawa pengotor yang terbawa selama proses pengendapan. Silika biasanya dimanfaatkan untuk berbagai keperluan dengan berbagai ukuran tergantung aplikasi yang
dibutuhkan seperti dalam industri ban, karet, gelas, semen, beton, keramik, tekstil, kertas, kosmetik, elektronik, cat, film, pasta gigi, dan lain-lain (Holmes, 1964).
6
Silika amorf adalah material yang dihasilkan dari reaksi alkali-silika. Reaksi alkali-silika dimulai dengan pecahnya ikatan Si-O-Si dan hasilnya membentuk fasa amorf dan nanokristal (Boinski, 2010). Silika amorf terbentuk ketika silikon teroksidasi secara termal. Silika amorf terdapat dalam beberapa bentuk yang tersusun dari partikel-partikel kecil yang kemungkinan ikut tergabung. Biasanya silika amorf mempunyai kerapatan 2,21 g/cm (Harsono, 2006).
Ketidakteraturan susunan permukaan tetrahedral SiO4 pada silika gel
menyebabkan jumlah distribusi satuan luas bukan menjadi ukuran kemampuan adsorpsi silika gel walaupun gugus silanol dan siloksan terdapat pada permukaan silika gel. Kemampuan adsorpsi silika gel ternyata tidak sebanding dengan jumlah gugus silanol dan siloksan yang ada pada permukaan silika gel, namun bergantung pada distribusi gugus –OH per satuan luas adsorben (Oscik, 1982).
B. Proses Sol-Gel
Proses sol-gel telah banyak dikembangkan terutama untuk pembuatan hibrida, kombinasi oksida anorganik (terutama silika) dengan alkoksisilan. Proses ini didasarkan pada prekursor molekular yang dapat mengalami hidrolisis, kebanyakan merupakan alkoksida logam atau semi logam. Terutama untuk pembuatan hibrida, kombinasi oksida anorganik (terutama silika) dengan alkoksisilan. Proses ini didasarkan pada prekursor molekular yang dapat
7
sebagai pembentukan suatu jaringan oksida melalui reaksi polikondensasi yang progresif dari molekul prekursor dalam medium cair atau merupakan proses untuk membentuk material melalui suatu sol, gelation dari sol dan akhirnya membentuk gel (Schubert and Husing, 2000).
Proses sol-gel berlangsung melalui langkah-langkah sebagai berikut: 1. Hidrolisis dan kondensasi
2. Gelation (transisi sol-gel) 3. Aging (pertumbuhan gel) 4. Drying (pengeringan)
8
mengakibatkan dehidrasi pada hidrogel dan terbentuknya silika gel dengan struktur SiO2.xH2O (Enymia dkk., 1998). Produk akhir yang dihasilkan berupa bahan amorf dan keras yang disebut silika gel kering. Bahan dasar yang
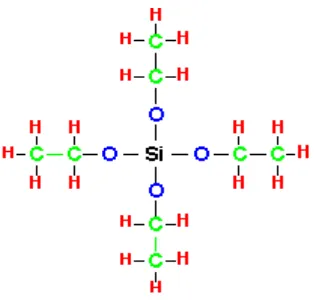
digunakan untuk membuat sol dapat berupa logam alkoksida pada proses sol-gel adalah TEOS. Keunggulan dari TEOS diantaranya: mudah terhidrolisis oleh air dan mudah digantikan oleh gugus OH. Selanjutnya silanol (SI-OH) direaksikan antara keduanya atau direaksikan dengan gugus alkoksida non-hidrolisis untuk membentuk ikatan siloksan (Si-O-Si) dan mulailah terbentuk jaringan silika. Sehingga TEOS baik digunakan dalam proses sol-gel.
Gambar 1. Struktur TEOS (tetraetilortosilikat).
Reaksi pada proses sol-gel dapat dilihat pada persamaan berikut:
Reaksi Hidrolisis
≡Si-OR + H-O-H → ≡Si-OH + ROH
Reaksi Polikondensasi
≡Si-OH + HO-Si → ≡Si-O-Si≡ + H2O
9
C. Biomassa Alga
Banyak mikroorganisme yang hidup di daerah perairan salah satu adalah alga. Mikroorganisme ini memiliki bentuk dan ukuran yang beranekaragam, ada yang mikroskopis, bersel satu, berbentuk benang/ pita atau berbentuk lembaran. Alga dikelompokkan atas beberapa kelas diantaranya: Rhodophyceae (alga merah), Phaeophyceae (alga coklat), Chlorophyceae (alga hijau), dan Cyanophyceae (alga biru). Menurut Pratiwi (2000), alga Chetocheros sp merupakan salah satu jenis alga yang termasuk spesies alga coklat (phaeophyceae). Warna alga coklat disebabkan adanya pigmen coklat (fukosantin), yang secara dominan menyelubungi warna hijau dari klorofil pada jaringan.
Adapun biomassa alga yang digunakan pada penelitian ini adalah biomassa Alga Chaetoceros sp. Chaetocheros sp merupakan salah satu jenis alga yang termasuk spesies alga coklat (phaeophyceae). Warna alga coklat disebabkan adanya pigmen coklat (fukosantin), yang secara dominan menyelubungi warna hijau dari klorofil pada jaringan. Selain fukosantin, alga coklat juga mengandung pigmen lain
seperti klorofil a, klorofil c, violaxantin, β- karotein, dan diadinoxantin (Pratiwi,
10
Alga memiliki kelemahan seperti ukurannya yang sangat kecil, berat jenisnya yang rendah dan mudah rusak karena terdegradasi oleh mikroorganisme lain sehingga kemampuan alga dalam menyerap ion-ion logam sangat di batasi oleh kelemahan tersebut. Immobilisasi biomassa adalah salah satu cara untuk mengatasi kelemahan tersebut, immobilisasi biomassa dapat dilakukan dengan mengunakan silika gel (Harris and Ramelow, 1990).
D. Magnetit (Fe3O4)
Oksida besi di alam memiliki banyak bentuk diantaranya : magnetite, maghemite, dan hematite. Magnetite dikenal sebagai oksida besi hitam (black iron oxide) atau ferrous ferrite merupakan oksida logam yang paling kuat sifat magnetisnya (Teja dan Koh, 2008). Menurut Cabrera dkk (2007), di antara oksida besi lainnya, magnetite yang berukuran nano banyak dimanfaatkan pada proses industri (misalnya sebagai tinta cetak), aplikasi lingkungan (magnetite carrier
presipitation processes untuk penghilangan ion logam dan filtrasi magnetis), dan juga aplikasi dalam bidang medis (biomolecule separation dan contrast agent untuk NMR Imaging). Beberapa di antaranya sangat menarik dan dalam tahap pengembangan (misalnya drug targeting dan hypertermia).
11
tunggal. Karena itu, sintesis nanopartikel yang seragam dengan mengatur ukurannya menjadi salah satu kunci masalah dalam ruang lingkup sintesis ini (Hook and Hall, 1991).
Magnetit memiliki beberapa sifat kemagnetan diantaranya :
1. Diamagnetik (jika semua elektron berpasangan) : ditolak (amat lemah) oleh medan magnet.
2. Paramagnetik (jika ada elektron yang tak berpasangan) : ditarik oleh medan magnet.
3. Feromagnetik (pada Fe, Co, Ni): ditarik (sangat kuat) oleh medan magnet.
Secara kuantitatif ditunjukkan oleh momen magnetik (µ) : µ = √[n(n+2)] BM
dengan n = jumlah elektron tak berpasangan
BM= Bohr Magneton (satuan untuk momenmagnetik) (Saito, 1996).
E.Logam Berat
12
Menurut Sasongko (2002), logam berat memiliki sifat-sifat di antaranya: 1. Sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan
dan keberadaannya secara alami sulit terurai atau berubah.
2. Dapat terakumulasi dalam organisme termasuk kerang dan ikan, yang nantinya dapat membahayakan kesehatan manusia yang mengkonsumsinya. 3. Mudah terakumulasi di sedimen, sehingga konsentrasinya selalu lebih tinggi
dari konsentrasi logam dalam air.
Adapun logam yang digunakan dalam penelitian ini yaitu :
Logam Timbal (Pb)
Timbal (Pb) merupakan suatu logam berat yang lunak berwarna kelabu
kebiruan dengan titik leleh 327 ºC dan titik didih 1,620 ºC. Pada suhu 550–600 ºC timbal menguap dan bereaksi dengan oksigen dalam udara membentuk timbal oksida. Walaupun bersifat lentur, timbal sangat rapuh dan mengkerut pada pendinginan, sulit larut dalam air dingin, air panas dan air asam. Timbal dapat larut dalam asam nitrit, asam asetat dan asam sulfat pekat. Bentuk oksidasi yang paling umum adalah timbal (II) dan senyawa organometalik yang terpenting adalah timbal tetra etil (TEL: tetra ethyl lead), timbal tetra metil (TML : tetra methyl lead) dan timbal stearat merupakan logam yang tahan terhadap korosi atau karat, sehingga sering digunakan sebagai bahan coating (Saryan, 1994 ; Palar, 2004 ; Suciani, 2007).
13
Sumber utama polusi timbal pada lingkungan berasal dari proses pertambangan, peleburan dan pemurnian logam tersebut, hasil limbah industri, dan asap
kendaraan bermotor (Darmono, 2001 dalam Kurniawan 2008).
Logam Tembaga (Cu)
Tembaga merupakan logam yang ditemukan di alam dalam bentuk senyawa dengan sulfide (CuS). Tembaga sering digunakan pada pabrik-pabrik yang memproduksi peralatan listrik, gelas, dan alloy. Tembaga masuk keperairan merupakan faktor alamiah seperti terjadinya pengikisan dari batuan mineral sehingga terdapat debu, partikel-partikel tembaga yang terdapat dalam lapisan udara akan terbawa oleh hujan. Tembaga juga berasal dari buangan bahan yang mengandung tembaga seperti dari industri galangan kapal, industri pengolahan kayu, dan limbah domestik. Pada konsentrasi 2,3 – 2,5 mg/l dapat mematikan ikan dan akan menimbulkan efek keracunan , yaitu kerusakan pada selaput lendir. Tembaga dalam tubuh berfungsi sebagai sintesa haemoglobin dan tidak mudah diekskresikan dalam urine karena sebagian terikat dengan protein, sebagian diekskresikan melalui empedu ke dalam usus dan dibuang ke feses, sebagian lagi menumpuk dalam hati dan ginjal, sehingga menyebabkan penyakit anemia dan tuberkolusis (Marganof, 2003).
F. Adsorpsi
14
merupakan ikatan kuat antara penyerap dan zat yang diserap sehingga tidak mungkin terjadi proses yang bolak-balik.
Berdasarkan sifatnya, adsorpsi dapat digolongkan menjadi dua yaitu : 1. Adsorpsi fisika
Terjadi karena gaya Van der Walls dimana ketika gaya tarik molekul antara larutan dan permukaan media lebih besar daripada gaya tarik substansi terlarut dan larutan, maka substansi terlarut akan diadsorpsi oleh permukaan media. Adsorpsi fisika ini memiliki gaya tarik Van der Walls yang kekuatannya relatif kecil. Molekul terikat sangat lemah dan energi yang dilepaskan pada adsorpsi fisika relatif rendah sekitar 20 kJ/mol. Semakin besar luas permukaan, maka semakin banyak substansi terlarut yang melekat pada permukaan media adsorpsi.
2 . Adsorpsi kimia
15
1. Kinetika adsorpsi
Kinetika kimia adalah tentang kecepatan (laju) reaksi dan bagaimana proses reaksi berlangsung. Kinetika adsorpsi tergantung pada luas permukaan partikel. Urutan reaksi mendefinisikan ketergantungan laju reaksi pada konsentrasi spesies yang bereaksi. Laju reaksi bergantung pada konsentrasi reaktan, tekanan,
temperatur dan pengaruh katalis (Oxtoby, 1990). Kinetika reaksi adsorpsi juga tergantung pada gugus fungsional dan konsentrasi. Tingginya tingkat substitusi gugus fungsional pada polimer inert dapat meningkatkan laju reaksi keseluruhan (Allen et al., 2004). Kinetika reaksi didasarkan pada analisis kinetika terutama pseudo orde pertama atau mekanisme pseudo pertama bertingkat. Menurut Buhani et al., (2010), untuk meneliti mekanisme adsorpsi, konstanta kecepatan reaksi sorpsi kimia untuk ion-ion logam, digunakan persamaan sistem pseudo orde pertama oleh Lagergren dan sistem pseudo orde kedua.
Menurut Soeprijanto dkk., (2006), untuk konstanta laju kinetika pseudo orde satu:
)
Dengan qe adalah jumlah ion logam divalen yang teradsorpsi (mg/g) pada waktu
keseimbangan, qt adalah jumlah ion logam divalen yang teradsorpsi pada waktu t
(menit), k1 adalah konstanta kecepatan adsorpsi (jam-1). Persamaan dapat
16
Dengan menggunakan regreasi linear dan mengalurkan ln(qe– qt ) terhadap t
diperoleh konstanta k1. Untuk konstanta kecepatan reaksi orde kedua proses
kemisorpsi:
Setelah integrasi dan penggunaan kondisi-kondisi batas qt=0 pada t =0 dan qt=qt pada t=t, persamaan linier dapat diperoleh sebagai berikut :
Dengan k2 konstanta keseimbangan order kedua kemisorpsi (g/mg.jam). Model
kinetika order kedua dapat disusun untuk mendapatkan bentuk linear :
Model kesetimbangan adsorpsi yang sering digunakan untuk menentukan kesetimbangan adsorpsi adalah isotermal Langmuir dan Freundlich.
Isoterm Adsorpsi Langmuir
17
dimiliki oleh adsorben yang terletak pada permukaan, akan tetapi jumlah situs-situs ini akan berkurang jika permukaan yang tertutup semakin bertambah.
Model adsorpsi isoterm Langmuir dapat ditulis dalam persamaan:
(6)
Dimana C adalah konsentrasi kesetimbangan (mg L-1), m adalah jumlah logam yang teradsorpsi per gram adsorben pada konsentrasi C (mmol g-1), b adalah jumlah ion logam yang teradsorpsi saat keadaan jenuh (kapasitas adsorpsi) (mg g -1
) dan K adalah konstanta kesetimbangan adsorpsi (L mol-1).
Dengan kurva linier hubungan antara C/m versus C, maka dapat ditentukan nilai b dari kemiringan (slop) dan K dari intersep kurva. Energi adsorpsi (Eads) yang didefinisikan sebagai energi yang dihasilkan apabila satu mol ion logam teradsorpsi dalam adsorben dan nilainya ekuivalen dengan nilai negatif dari perubahan energi bebas Gibbs standar, ∆G0, dapat dihitung menggunakan
persamaan:
(7)
Dimana R adalah tetapan gas umum (8,314 J/mol K), T temperatur (K) dan K adalah tetapan kesetimbangan adsorpsi yang diperoleh dari persamaan Langmuir dan energi total adsorpsi adalah sama dengan energi bebas Gibbs. ∆G sistem negatif artinya adsorpsi berlangsung spontan (Oscik, 1982).
18
Isoterm Adsorpsi Freundlich
Model isoterm Freundlich menjelaskan bahwa proses adsorpsi pada bagian permukaan adalah heterogen dimana tidak semua permukaan adsorben mempunyai daya adsorpsi. Model isoterm Freundlich menunjukkan lapisan adsorbat yang terbentuk pada permukaan adsorben adalah multilayer. Hal tersebut berkaitan dengan ciri-ciri dari adsorpsi secara fisika dimana adsorpsi dapat terjadi pada banyak lapisan (multilayer) (Husin dan Rosnelly, 2005).
Bentuk persamaan Freundlich adalah sebagai berikut:
(8)
Dimana:
Qe = Banyaknya zat yang terserap per satuan berat adsorben
Ce = Konsentrasi adsorbat pada saat kesetimbangan
n = Kapasitas adsorpsi maksimum
Kf = Konstanta freundlich
Persamaan di atas dapat diubah kedalam bentuk linier dengan mengambil bentuk logaritmanya:
(9)
19
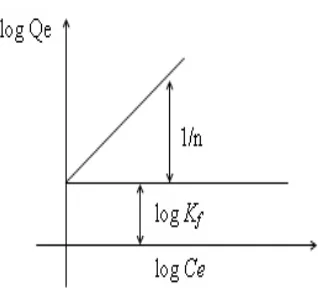
Gambar2. Model Isoterm Adsorpsi Freundlich
Bentuk linear dapat digunakan untuk menentukan kelinearan data percobaan dengan cara mengeplotkan C/Q terhadap Ce. Konstanta Freundlich Kf dapat diperoleh dari kemiringan garis lurusnya dan 1/n merupakan harga slop. Bila n diketahui Kf dapat dicari, semakin besar harga Kf maka daya adsorpsi akan semakin baik dan dari harga Kf yang diperoleh, maka energi adsorpsi akan dapat dihitung menggunakan persamaan berikut (Rousseau, 1987).
E ads = RT ln K (10)
Dengan R adalah tetapan gas ideal (8,314 J/Kmol), T adalah temperatur (dalam Kelfin), dan K adalah konstanta keseimbangan adsorpsi.
Selain itu, untuk menentukan jumlah logam teradsorpsi, rasio distribusi dan koefisien selektivitas pada proses adsorpsi ion logam terhadap adsorben alga Chaetoceros sp, (HAS) dan HAS-magnetit dapat digunakan persamaan berikut:
20
Dimana Q menyatakan jumlah logam teradsorpsi (mg/g), Co dan Ca menyatakan konsentrasi awal dan kesetimbangan dari ion logam (mmol/L), W adalah massa adsorben (g), V adalah volume larutan ion logam (L) (Buhani dkk., 2009).
F. Karakterisasi
1. Spektrofotometer Inframerah (IR)
Spektrofotometri inframerah dari suatu molekul merupakan hasil transisi antara tingkat energi getaran (vibrasi) atau osilasi (oscillation). Bila molekul menyerap radiasi inframerah, energi yang diserap menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat itu. Panjang gelombang eksak dari adsorpsi oleh suatu tipe ikatan, bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan menyerap radiasi inframerah pada panjang gelombang yang berlainan. Menurut Khopkar (2001) spektrum serapan IR merupakan suatu perubahan simultan dari energi vibrasi dan energi rotasi dari suatu molekul. Kebanyakan molekul organik cukup besar sehingga spektrum peresapannya kompleks. Konsep dasar dari spektra vibrasi dapat diterangkan dengan menggunakan molekul sederhana yang terdiri dari dua atom dengan ikatan kovalen.
2. Analisis ion logam dengan SSA
21
kadar ion logam yang teradsorpsi maupun yang terdapat dalam adsorben. Ion logam yang teradsorpsi dihitung secara kuantitatif berdasarkan selisih konsentrasi ion logam sebelum dan sesudah adsorpsi (Yuliasari, 2003).
Metode analisis dengan SSA didasarkan pada penyerapan energi cahaya oleh atom-atom netral suatu unsur yang berada dalam keadaan gas. Penyerapan cahaya oleh atom bersifat karakteristik karena tiap atom hanya menyerap cahaya pada panjang gelombang tertentu yang energinya sesuai dengan energi yang diperlukan untuk transisi elektron-elektron dari atom yang bersangkutan di tingkat yang lebih tinggi sedangkan energi transisi untuk masing-masing unsur adalah sangat khas. Metode ini sangat tepat untuk analisis zat pada konsentrasi rendah. Teknik ini mempunyai beberapa kelebihan dibandingkan dengan metode spektroskopi emisi konvensional. Pada metode konvensional emisi tergantung pada sumber eksitasi, bila eksitasi dilakukan secara termal maka akan tergantung pada temperatur sumber (Khopkar, 2001).
3. Scanning Electron Microscope (SEM)
22
suatu sampel senyawa. Sebelum dianalisis dengan SEM, dilakukan preparasi sampel yang meliputi penghilangan pelarut, pemipihan sampel, dan coating.
23
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini telah dilakukan pada bulan Oktober 2012 sampai Januari 2013 di Laboratorium Kimia Anorganik dan Biokimia Jurusan Kimia Universitas Lampung, serta penyiapan alga Chaetoceros sp di Balai Besar Pengembangan Budidaya Laut Lampung.
B. Alat dan Bahan Penelitian
Peralatan yang digunakan pada penelitian ini antara lain alat-alat gelas laboratorium, pipet tetes, spatula, oven, corong, batang pengaduk, kertas pH, pengaduk magnet, kertas saring whatman No.42, spektrofotometer IR Prestige-21 Shimadzu, SSA Perkin Elmer 3100, dan SEM type JSM 6360 LA
24
C. Prosedur Penelitian
1. Penyiapan Biomassa Alga Chaetoceros sp
Alga Chaetoceros sp dihasilkan dari pembudidayaan dalam skala laboratorium di Balai Budidaya Laut (BBL) Lampung. Alga Chaetoceros sp yang dihasilkan kemudian dinetralkan dengan menggunakan aquades hingga pH 7 dan dikering anginkan selama 3-4 hari pada suhu ruang. Alga yang sudah kering digerus sampai halus setelah itu dioven dengan T±40ºC dalam selang waktu 2-3 jam.
2. Sintesis
a. Hibrida alga silika(HAS)
25
b. HAS-magnetit (Fe3O4)
Larutan A, sebanyak 5 mL larutan TEOS dan akuades 2,5 mL ditambahkan dengan magnetit sebanyak 0,2 g (Musrifatun,2012), lalu ditambahkan beberapa tetes HCl 0,1 M hingga pH 2. Diaduk dengan pengaduk magnet sampai larutan tersebut homogen. Larutan B, sebanyak 5 mL etanol ditambah dengan biomassa alga Chaetoceros sp sebanyak 0,6 (Musrifatun, 2012) diaduk dengan pengaduk magnet. Kedua larutan dicampur hingga terbentuk gel. Gel basah yang terbentuk didiamkan selama 24 jam kemudian dicuci dengan etanol dan akuades sampai pH 7, dikeringkan menggunakan oven dengan suhu 40oC sampai berat konstan.
3. Karakterisasi
Untuk mengetahui perubahan gugus-gugus fungsional utama dalam material alga, silika-alga, dan alga dengan pelapisan silika-magnet dilakukan analisis dengan spektrofotometer IR. Untuk menentukan bentuk morfologi dan unsur yang
26
4. Uji adsorpsi
a. Laju Adsorpsi
Biomassa alga Chaetoceros sp masing-masing sebanyak 50 mg, HAS dan HAS-Magnetit (Fe3O4) masing-masing ditambahkan dari larutan Pb(II) dan Cu(II) 100 mg L-1 sebanyak 20 mL dengan pH 6. Kemudian dilakukan variasi waktu
interaksi yaitu 5, 15, 30, 45, 60 dan 90 menit. Selanjutnya, masing-masing larutan diaduk dan dilanjutkan dengan sentrifugasi. Setelah disentrifus, filtrat dan
endapannya akan terpisah. Filtrat yang dihasilkan, dianalisis dengan SSA (Buhani et al., 2009).
b. Isoterm adsorpsi
44
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan maka dapat disimpulkan bahwa:
1. Laju adsorpsi ion Pb(II) dan Cu(II) oleh biomassa algaChaetoceros sp, HAS, dan HAS-magnetit cenderung mengikuti pseudo orde dua karena memiliki koefisien kolerasi sebesar 0,996. Laju adsorpsi pada HAS-magnetit lebih besar dibandingkan dengan biomassa alga Chaetoceros sp.
2. Isoterm adsorpsi ion Pb(II) dan Cu(II) oleh biomassa alga Chaetoceros sp, HAS dan HAS-magnetit cenderung mengikuti model isoterm Freundlich. Kapasitas adsorpsi dan laju adsorpsi pada HAS-magnetit lebih tinggi
43
B. Saran
Pada penelitian lebih lanjut disarankan perlu dilakukan pengujian lebih lanjut terhadap adsorpsi ion Pb(II) dan Cu(II) oleh HAS, dan HAS-magnetit
46
DAFTAR PUSTAKA
Abdullah, Mikrajuddin & Khairurrijal. 2008. ”Review: Karakterisasi
Nanomaterial”, Jurnal Nanoscience dan Teknologi vol.2, No.1.
Ahalya, N and T.V.Ramachandra. 2003. Biosorption of heavy Metals.Reseach Journal Of Chemistry And Environment. 7 (4):71-78.
Allen, S.J., G. Mckay. and J.F. Porter. 2004. Adsorption isotherm models for basic dye adsorption by peat in single and binary component systems. Journal of Colloid and Interface Science 280: 322-333.
Atkins. 1999. Kimia Fisik III. Jakarta: Erlangga.
Boinski, F. 2010. “Study of the mechanisms involved in reactive silica”. Materials Chemistry and Physiscs 122: 311-315.
Buhani and Suharso. 2009. Immobilization of Nannochloropsis sp biomass by sol-gel technique as adsorbat of metal ion Cu(II) from aqueous solution. Asian J. Chemist., 21 (5) : 3799-3808.
Buhani, Narsito, Nuryono, and Kunarti,E.S. 2009. Amino and Merkapto-Silika Hybrid for Cd (II) Adsorption in Aqueous Solution. Indo. J. Chem. 9
(2): 170-176.
Buhani, Suharso and Sumadi. 2010. Adsorption Kinetics and Isotherm of Cd (II) Ion on Nannochloropsis sp Biomass Imprinted Ionic Polymer.
Desalination. 259: 140-146
Buhani, Suharso, H.Satria. 2011. Hybridization of Nannocloropsis sp Biomass-Silika Through Sol-gel Process to adsorb Cd(II) ion in Aquous Solution. Eur.J.Chem. Vol. 51, pp. 467-476.
Cabrera, L., S. Gutierrez., N. Menendez., M.P. Morales., P. Herrasti. 2008.
“Magnetite nanoparticles: electrochemical synthesis and characterization”,
Electrochimica Acta, 53: 3436-3441.
Darmono. 2005. Toksikologi Logam Berat, Surabaya. Dalam: Kurniawan, 2008. Hubungan Kadar Pb dalam Darah dengan Profil Darah pada Mekanik Kendaran Bermotor di Kota Pontianak. Program Pascasarjana
47
Enymia, S. dan Sulistriani, N. 1998. Pembuatan Silika Gel Kering Dari Sekam Padi Untuk Bahan Pengisi Karet Ban. J. K. Indo. 7(1&2): 1-9.
Fahmiati, Nuryono dan Narsito. 2004. Kajian Kinetika Adsorpsi Cd(II), Ni(II) dan Mg(II) Pada Silika Gel Termodifikasi 3-Merkapto-1,2,4-Triazol.
Alchemy. 3(2): 22-28.
Farook, A.and S. Ravendran. 2000. Saturated Fatty Acids Adsorption By Acidified Rice Hull Ash. J. Chem. Soc. 77: 437-440.
Hancock, I.C., DR. 1996. Symposium and Workshop on Heavy Metal Bioaccumulation, IUC Biotechnology, Gadjahmada University, Yogyakarta
Harris, O. P. and J. G. Ramelow. 1990. Binding of Metal Ions by Particulate Quadricauda. Environt Scient and Technology. 24 : 220-227. Harsono, H. 2006. Pembuatan Silika Abu Amorf dari Abu Sekam Padi.
http://www.unej.ac.id/fakultas/mipa/volume3.no2/harsono.pdf.9 Holmes. 1964. Pembuatan Silika Abu Amorf dari pasir kuarsa. Journal of
HazardousMaterial, B92, 253-262
Hook, J. R., & H.E. Hall. 1991. Solid state physics. 2nd edition, John Willey & Sons: England/Chichester, hal: 241
Husin, H dan C.M. Rosnelly. 2005. Studi Kinetika Adsorpsi Larutan Logam Timbal (Pb) Menggunakan Karbon Aktif dari Batang Pisang. (Tesis). Fakultas Teknik Universitas Syiah Kuala. Banda Aceh.
Jalali, R., Ghafourian, H., Davarpanah,S.J., and Sepehr, S. 2002. "Removal and Recovery of Lead Using Nonliving Biomass of MarineAlgae", Journal of HazardousMaterial, B92, 253-262
Jeon, C. 2011. Adsorption characteristic of cooper ions using magnetically modified medicinal stones, Journal of Industrial and Engineering Chemistry, 17: 1487-1493.
Jovita, T.M. dan Y. Yennie. 2003. Kandungan Logam Berat Pada Kerang Darah (Anadara Granosa), Air Laut dan Sedimen di Perairan Tanjung Balai dan Bagan Siapi-Api, Jurnal Penelitian Perikanan Indonesia Volume 9 Nomor 5.Universitas
Khopkar, S.M. 2001. Konsep Dasar Kimia Analitik. UI Press. Jakarta.
48
Lin, Y., Chen, H., Lin, K., Chen, B., and Chiou, C. 2011. Application of magnetic particles modified with amino groups to adsorb cooper ions in aqueous solution, J. Environt. Sci., 23:44-50.
Mahan, C. A. and J.A. Helcombe. 1989. The Journal of Evaluation of The Metal Uptake of Several Algae Strain in Multicomponent Matrixultizung Inductively Coupled Plasma Emission Spektrofotometry. Analytic Chemist. 61: 624-627.
Marganof, Potensi Limbah Udang sebagai Penyerap Logam Berat, Institut Pertanian Bogor, Bogor, 2003.
Miettinen. 1977. Inorganic trace Element as Water pollutan to health and Aquatic Biota. New York: Academy press
Musrifatun. 2012. Isoterm Adsorpsi Ion Ni(II) dan Zn(II) Pada Material Alga Chaetoceros sp Yang Dimodifikasi Dengan Pelapisan Silika-magnetit. Universitas Lampung: Bandar Lampung
Oscik, J. 1982. Adsorption. Ellis Horwood Limited. England.
Oxtoby, D. 1990. Prinsip-prinsip Kimia Modern. Erlangga. Jakarta. Hal. 285-290 Palar, H. 2004. Pencemaran dan toksikologi logam berat. Rineka cipta. Jakarta. p.
78-86.
Peng, Q., Liu, Y., Zeng, G., Xu, W., Yang, C., and Zhang, J. 2010. Biosorption of Copper (II) Immobilizing Saccharomyces cerevisae on the surface of chitosan coated magnetc nanoparticle from aqueous solution, J. Hazard. Mater., 177: 676-682.
Prassas, M. 2002. Silica Glass from Aerogels, http//www.solgel.com
Pratiwi. 2000. Biologi. Erlangga. Jakarta Press, Inc. San Diego, California. pp 839-880.
Putra, S.E. 2006. Tinjauan Kinetika dan Termodinamika Proses Adsorpsi Ion Logam Pb, Cd, dan Cu oleh Biomassa Alga Nannochloropsis sp.Yang DiImmobilisasi Polietilamina-Glutaraldehid. Laporan Penelitian. Universitas Lampung. Bandar Lampung
Punkels. 2008. Kegunaan silicagel.Fromhttp://punkels.wordpress.com/2008/12/21 /21/kegunaan-silica-gel/,21 juni 2012
49
Rousseau, R. W. 1987. Handbook Of Separation Process Technology, John Wiley and Sons Inc., United States, pp.67.
Sadhori, S.N. 1995. ”Budidaya Rumput Laut” p. 29, Balai pustaka, Jakarta
Saito, Taro. 1996. ebook Kimia Anorganik, Tokyo: Iwanami Publishing Company Sasongko, A. 2002. Studi Adsorpsi Ion Logam Kadmium (Cd) PADA Biomassa
Alga Chlorella sp Yang Terimmobilisasi Silika Gel. Skripsi Universitas Lampung. Bandar Lampung.
Suciani, S. 2007. Kadar Timbal dalam Darah Polisi Lalu Lintas dan
Hubungannya dengan Kadar Hemoglobin (Studi Pada Polisi Lalu Lintas yang Bertugas di Jalan Raya Kota Semarang). Diambil dari : http://eprints.undip.ac.id/15877/1/Sri_Suciani.pdf [Diakses 3 Maret
2011].
Schubert, U., and Husing, N. 2000. Synthesis of Inorganic Material. Willey-VCH Verlag Gmbh. D-69469 Wernbeim. Federal Republik of Germany. Suhendrayatna. 2001. Bioremoval Logam Berat Dengan Menggunakan
Mikroorganisme: Suatu Kajian Kepustakaan. Diakses Tanggal 15 Januari 2012 Pukul 21:15 WIB. (http://www.google.com./biosorpsi logam berat)
Teja., Amyn S. and Koh, P.Y, “Synthesis, properties, and applications of magnetic iron oxide nanoparticles”, Progrees in Crystal Growth and Characterization of Materials, xx: 1-24. 2008.
Trevan, D. 1990. Immobilized Enzymes, John Wiley and Sons, New York, p. 14-15.
Widyawati, P.S. 2006. Kinetika Adsorpsi Ion Fe(II) oleh Biomassa Chaetoceros sp. Unika Widya Mandala Surabaya
Yuliasari, L. 2003. Studi Penentuan Logam Berat Timbal (Pb) dan Kadmium (Cd)