ION Zn(II) DAN Ni(II) (Skripsi)
Oleh
ALBERT FERDINAND PARTOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
A MODIFICATION OF BIOMASSNannochloropsissp WITH A COATING SILIKA-MAGNETITE AS THE ADSORBENT IONS ZN (II) AND NI (II)
By
ALBERT FERDINAND PARTOGI
MODIFIKASI BIOMASSANannochloropsissp DENGAN PELAPISAN SILIKA-MAGNETIT SEBAGAI ADSORBEN
ION Zn(II) DAN Ni(II)
Oleh
ALBERT FERDINAND PARTOGI
Pada penelitian ini telah dilakukan proses adsorpsi ion Zn(II) dan Ni(II) terhadap adsorben biomassa alga Nannochloropsis sp, Hibrida alga silika (HAS), dan HAS-magnetit. Identifikasi gugus fungsi biomassa alga Nannochloropsis sp, HAS, dan HAS-magnetit dilakukan dengan menggunakan spektrofotometer inframerah (IR) dan diketahui dari ketiga adsorben tersebut terdapat adanya pita serapan pada daerah bilangan gelombang 3500-3400 cm-1 yang berasal dari gugus hidroksil (-OH), 3000-2900 cm-1 yang berasal dari serapan vibrasi ulur C-H dari (-CH2) alifatik, dan
1670-1650 cm-1 dari gugus karbonil. Data kinetika adsorpsi ion Zn(II) dan Ni(II) pada
ION Zn(II) DAN Ni(II)
Oleh
ALBERT FERDINAND PARTOGI
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
SEBAGAI ADSORBEN ION Zn(II) DAN Ni(II)
Nama Mahasiswa : Albert Ferdinand Partogi
Nomor Pokok Mahasiswa : 0817011017
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI
1. Komisi Pembimbing
Pembimbing I Pembimbing II
Dr. Buhani, M.Si. Prof. Suharso, Ph.D.
NIP 196904161994032003 NIP 196905301995121001
2. Ketua Jurusan Kimia
Andi Setiawan, Ph.D.
1. Tim Penguji
Ketua :Dr. Buhani, M.Si. …………....
Sekretaris : Prof. Suharso, Ph.D. …………....
Penguji
Bukan Pembimbing :Prof. Sutopo Hadi, Ph.D. …………....
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D.
NIP 196905301995121001
Penulis dilahirkan di Bandar Lampung, pada tanggal 27 April
1990, sebagai anak kedua dari empat bersaudara, putra dari
Justin Pohan Simanjuntak (†) dan Risma br. Siburian.
Jenjang pendidikan diawali dari Taman Kanak-kanak (TK) di TK Xaverius
Bandar Lampung diselesaikan pada tahun 1996. Sekolah Dasar (SD) di SD
Xaverius 3 Bandar Lampung diselesaikan pada tahun 2002. Sekolah Menengah
Pertama (SMP) di SMP Xaverius 4 Bandar Lampung diselesaikan pada tahun
2005, dan Sekolah Menengah Atas (SMA) di SMA Perintis 1 Bandar Lampung
diselesaikan pada tahun 2008. Tahun 2008, penulis terdaftar sebagai Mahasiswa
Jurusan Kimia FMIPA Unila melalui jalur SNMPTN (Seleksi Nasional Masuk
Perguruan Tinggi Negri).
Pada tahun 2011 Penulis melakukan Praktek Kerja Lapangan di Laboratorium
Kimia Anorganik Jurusan Kimia FMIPA Unila di Bandar Lampung. Selama
menjadi mahasiswa penulis pernah menjadi asisten praktikum Kimia Dasar I
Agribisnis, Kimia Dasar I Teknologi Hasil Pertanian, Kimia Anorganik I, dan
Kimia Anorganik II. Penulis juga aktif di Himpunan Mahasiswa Kimia
(HIMAKI) FMIPA Unila sebagai anggota Bidang Sains dan Penalaran Ilmu
Cari dahulu Kerajaan Allah dan Kebenaran-Nya, maka semua itu akan
ditambahkan kepadamu.
(Matius 6 : 33)
Slalu yakin dan percaya bahwa Tuhan akan menggenapi janji-Nya kepada
kita manusia yang percaya kepada-Nya.
(Albert Ferdinand Partogi)
Karena masa depan sungguh ada, dan Harapanmu tidak akan hilang
(Amsal 23 : 18)
Slalu berusaha, berdoa, dan mengucapkan syukur atas berkat yang diperoleh
atas Kasih Karunia Tuhan Yesus Kristus.
Kupersembahkan karya sederhana ini kepada :
Kedua orang tuaku,
Papa ( ) dan Mama yang telah memberikan cinta kasih dan
sayang serta doa untukku. Terima Kasih,
kalianlah inspirasi tuk masa depanku.
Abang dan Adik-adikku terkasih I. F. B. Martin, Christine K.
Magdalena dan D. Veronica R. E
Keluarga besar Albert di Jakarta dan Medan yang telah
mendukungku
Seluruh sahabat terbaikku
Seseorang yang akan mendampingiku kelak
SANWACANA
Syalom..
Puji Tuhan Penulis ucapkan hormat dan puji kepada Tuhan Yesus Kristus, karena atas Kasih dan Karunia-Nya skripsi ini dapat diselesaikan.
Skripsi dengan judul" Modifikasi BiomassaNannochloropsissp dengan Pelapisan Silika-Magnetit Sebagai Adsorben Ion Zn(II) dan Ni(II)"adalah salah satu syarat untuk memperoleh gelar Sarjana Sains pada Jurusan Kimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
Dalam pelaksanaan dan penulisan skripsi ini tidak lepas dari kesulitan dan
rintangan, namun itu semua dapat penulis lalui karena Kasih Setia Tuhan Yesus Kristus serta bantuan dan dorongan semangat dari orang-orang yang hadir
dikehidupan penulis. Dalam kesempatan ini, penulis menyampaikan terima kasih
setulus-tulusnya kepada :
1. Ibu Dr. Buhani, M.Si., selaku pembimbing I penelitian yang telah banyak
2. Bapak Prof. Suharso, Ph.D., selaku pembimbing II penelitian dan selaku
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam yang telah
memberikan kritik, saran, dan arahan yang diberikan kepada penulis sehingga
skripsi ini terselesaikan dengan baik.
3. Bapak Prof. Sutopo Hadi, Ph. D., selaku penguji penelitian yang telah memberikan semangat, kritik, saran, dan arahan kepada penulis sehingga
skripsi ini terselesaikan dengan baik.
4. Bapak Dr. Eng. Suripto Dwi Y. M.T., selaku Pembimbing Akademik atas
kesediaannya utuk memberikan bimbingan, bantuan, nasehat, dan informasi yang bermanfaat kepada penulis.
5. Bapak Andi Setiawan, Ph.D., selaku ketua Jurusan Kimia FMIPA Unila.
6. Seluruh dosen FMIPA Unila yang telah mendidik dan memberikan ilmu pengetahuan yang sangat berguna kepada penulis selama kuliah.
7. Kedua orang tuaku yang sangat aku cintai. Papaku Justin Pohan
Simanjuntak (†) yang selalu menjadi inspirasi dan semangat dalam segala hal. Terima kasih papa atas doamu yang tak putus dan segala bentuk
pengorbananmu. Mamaku Risma br. Siburian yang selalu memberikan kasih sayang, sabar mengahadapi aku dan selalu mendoakanku setiap waktu.
Terima kasih mama atas nasehat dan doa yang selalu menyemangatkanku.
Dengan tulus dan rendah hati kuucapkan atas segala hal terbaik dan semua yang telah diberikan kepadaku serta bentuk pengorbananmu. Sekali lagi
terima kasih mama dan papa
(Kristin), dan Demak Veronica Ramlia Elisabeth (Vero), terima kasih ya atas
doa dan dukungan kalian. Kalian adalah saudara terbaik bagiku. Semangat terus ya abang dan adikku
9. Keluarga besar “Albert” di Jakarta dan Medanyang selalu memberikan
motivasi, dukungan dan doa untukku. Terima kasih
10. Sahabat-sahabat terbaikku yang tidak bosan-bosannya mendengar segala
keluh kesahku selama di kampus : terspesial untuk Citra Oktrine br.Saragih atas semangat dan dukungan yang terus diberikan, teman-teman Polimer
(Leni, Eni, Wanti, Evi, dan Ka Riri), Ricardo, Mychel Dendiko, M.Amin, M Ramdan (kapan kita berenang bersama lagi ?he). Teman-teman satu
angkatanku : Siti, Rafel, Riki, Puji, TB, Eko, Majid, Arif, Sobari, Idrus,
Ruzki, Miftahudin Ramli S.Si, Ria, Ni Putu, Ayu, Sofa, Harnita, Novia, Retno, Nuro, Kiki, Adek, Vivi, dan yang lainnya. Terima kasih teman atas dukungan, kebersamaan selama ini, keceriaan kalian disetiap hari-hariku, aku
sangat bersyukur mengenal kalian, semoga Yang Maha Kuasa selalu
memberikan Anugerah-Nya untuk keberhasilan kita. Sukses untuk kita semua
ya sahabat-sahabatku . SEMANGATT ! GBU all
11. Teman-teman seperjuangan penelitianku Musrifatun, Dewa Putu Suryani, dan Mba Sumartini (terima kasih ya atas segala bantuan kalian dan semangat,
sukses selalu untuk kalian yaa)
12. Teman-teman seperjuangan anorganik : Ani Sulistriani, Elianasari, Putri
Febriani, Miftasani, Rudi Jaelani, Mba Sumartini’06, dan Kak Purwanto ’06.
penelitian dan perkuliahan. Tetap semangat kawan, sukses selalu untuk kita
semua
13. Kakak-kakak Kimia 2005, 2006, 2007, dan adik-adik kimia 2009, 2010, dan
2011 FMIPA Unila terima kasih atas segala dukungannya.
14. Sahabat- sahabat POMMIPA terima kasih atas doa dan dukungannya. Tetap terus berkaya di dalam setiap kegiatan dan tetap smangat melayani Tuhan di
kampus tercinta kita. Semua pelayanan yang telah kita lakukan pasti ada upahnya di sorga kelak. Semangaatt. GB POMMIPA.
15. Sahabat-sahabat Pelayanan di Gerejaku tercinta GKPA Bandar Lampung, saya sangat berterima kasih sekali kepada kalian semua muda/i Gereja atas doa dan dukungannya yang slalu kalian berikan kepada saya, terlebih lagi
untuk Inang Pdt. Novalina br. Batubara. Terima kasih inang atas doanya dan semangat yang engkau berikan kepadaku. Tetap semangat untuk Naposo GKPA dan inang Pendeta, mari kita bersama-sama bersatu membangun
Gereja menjadi lebih baik lagi. Semangat !!!!
16. Semua pihak yang telah membantu dan mendukung penulis dalam
penyusunan skripsi ini. Terima kasih.
Akhir kata, Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan.
Penulis berharap semoga skripsi yang sederhana ini dapat berguna dan bermanfaat bagi kita semua. Amin.
Bandar Lampung, Agustus 2012 Penulis
I. PENDAHULUAN
A. Latar Belakang dan Masalah
Dewasa ini perkembangan industri di Indonesia semakin pesat yang memberikan dampak terhadap pencemaran lingkungan, antara lain dapat berasal dari limbah
industri yang mengandung logam berat. Logam berat merupakan unsur logam yang memiliki berat molekul tinggi. Dalam kadar rendah, logam berat pada umumnya sudah cukup beracun bagi tumbuhan dan hewan, termasuk manusia
(Krauskopf, 1979). Logam berat yang dapat mencemari lingkungan antara lain adalah nikel (Ni) dan seng (Zn). Logam berat tersebut pada konsentrasi yang tinggi dapat bersifat toksik dan cenderung terakumulasi pada organisme (Akotoet al., 2008). Proses terakumulasi tersebut dapat berdampak pada rantai makanan sehingga mempengaruhi kesehatan pada manusia (El-Kammaret al., 2009).
Oleh karena itu, perlu dilakukan upaya untuk menurunkan konsentrasi logam berat pada lingkungan yang sudah tercemar untuk mencegah timbulnya masalah yang baru. Beberapa metode telah dikembangkan untuk mengurangi kadar logam
berat dari air buangan, seperti koagulasi, pengendapan secara kimia, kompleksasi, ekstraksi pelarut, separasi dengan membran, pertukaran ion, dan adsorpsi. Dari
logam berat dalam larutan karena prosesnya yang relatif sederhana dan biaya yang
diperlukan cukup ekonomis (Buhaniet al., 2010).
Metode adsorpsi pada umunya berdasarkan interaksi antara logam dengan gugus
fungsional yang ada pada permukaan adsorben melalui interaksi pembentukan kompleks dan biasanya terjadi pada permukaan padatan yang kaya akan gugus fungsional seperti : -OH, -NH, -SH, dan–COOH (Stum and Morgan, 1996).
Keberhasilan proses adsorpsi ion logam sangat ditentukan oleh jenis adsorben yang digunakan. Beberapa contoh adsorben yang dapat digunakan dalam
penanganan limbah logam berat adalah kitosan (Veeraet al., 2003), serbuk gergaji (Shuklaet al., 2002), rumput laut (Indriani and Akira, 1998), dan alga (Cervantes et al., 2001).
Akhir-akhir ini upaya pengambilan logam berat di perairan lebih mengarah pada pemanfaatan alga sebagai adsorben logam berat. Penggunaan alga sebagai
adsorben dinilai lebih efektif karena tidak membutuhkan biaya yang mahal, bahan
bakunya mudah didapat, dan mudah dibudidayakan. Berbagai spesies alga terutama dari golongan alga hijau, alga coklat, dan alga merah (Martadinata,
2001; Cossichet al., 2002; Buhani dkk., 2007) telah banyak digunakan untuk mengadsorpsi ion logam baik dalam keadaan hidup, biomassa (sel mati), maupun dalam bentuk biomassa terimmobilisasi, salah satunya yaituNannochloropsissp (Buhani dkk., 2007).
Hal tersebut disebabkan karena adanya gugus fungsi pada dinding sel dan di
dalam sitoplasma pada biomassa alga tersebut sehingga mampu berikatan dengan ion logam (Harris and Ramelow, 1990). Telah diketahui bahwa biomassa alga
Nannochloropsissp memiliki gugus fungsional yang dapat bertindak sebagai ligan yaitu–COOH yang merupakan penyusun utama dari polisakarida dan juga gugus amina sebagai penyusun pektin dan protein (Buhaniet al., 2009). Akan tetapi biomassa alga ini memiliki beberapa kelemahan yaitu ukurannya yang kecil, berat jenis rendah, dan strukturnya yang mudah rusak akibat degradasi oleh
mikroorganisme lain (Harris and Ramelow, 1990). Oleh sebab itu dilakukan immobilisasi biomassa alga dengan matriks silika melalui teknik sol-gel, dimana telah diketahui silika mudah diproduksi dan sifat permukaan (struktur geometri
pori dan sifat kimia pada permukan) yang dengan mudah dapat dimodifikasi (Fahmiatiet al., 2004). Selain itu silika gel memiliki situs aktif berupa gugus silanol (≡Si-OH) dan siloksan (≡Si-O-Si≡)(Sriyanti dkk., 2001). Sehingga proses
immobilisasi alga pada matriks silika diharapkan dapat mempertahankan keaktifan gugus-gugus fungsi yang terdapat pada biomassa alga serta dapat
meningkatkan kapasitas adsorpsi ion-ion logam berat.
Selain peningkatan kapasitas adsorpsi melalui proses imobilisasi biomassa alga
terhadap silika, maka peningkatan kualitas fisik pada biomassa alga sangat
dibutuhkan, sehingga dapat digunakan sebagai adsorben yang lebih efektif
terhadap logam berat dari limbah cair yang dihasilkan industri. Oleh sebab itu
dilakukan modifikasi pelapisan partikel magnetit pada matriks pendukung seperti
pelapisan silika-magnetit (Fe3O4) pada biomassa alga. Metode ini merupakan
(flocculant) dalam limbah industri yang diolah (Jeon, 2011; Penget al., 2010; Lin
et al., 2011).
Berdasarkan uraian di atas, maka dalam penelitian ini akan dilakukan sintesis
material hibrida alga silika melalui teknik pelapisan silika-magnetit. Material yang
diperoleh dikarakterisasi dengan spektrofotometer inframerah (IR) untuk
menganalisis adanya gugus fungsi. Selain itu material yang diperoleh juga diuji
sifat adsorpsinya melalui penentuan laju dan isoterm adsorpsi terhadap ion Ni(II)
dan Zn(II). Adapun sebab penggunaan kedua ion logam ini sebagai adsorbat
adalah selain bersifat toksik dan sulit didegradasi di alam, namun juga untuk
membandingkan kemampuan dari adsorben yang dihasilkan dalam mengadsorpsi
ion Ni(II) yang cenderung merupakan asam madya dan ion Zn(II) yang cenderung
merupakan asam lunak (Huheeyet al., 1993). Hasil dari kedua uji tersebut
kemudian ditentukan kadar ion logam yang teradsorpsi pada adsorben dengan
menggunakan spektrofotometer serapan atom (SSA).
B. Tujuan Penelitian
Berdasarkan latar belakang masalah yang telah dipaparkan di atas, penelitian ini
dilakukan dengan tujuan :
1. Mempelajari cara sintesis dan karakterisasi material biomassa alga Nannochloropsissp, hibrida alga silika (HAS), dan HAS-magnetit.
2. Menentukan laju dan isoterm adsorpsi ion Ni(II) dan Zn(II) pada material
C. Manfaat Penelitian
Adapun manfaat penelitian ini adalah memberikan informasi tentang proses
immobilisasi algaNannochloropsissp pada matrikssilika yang dimodifikasi dengan magnetit untuk menghasilkan adsorben dengan kapasitas dan efektifitas
yang lebih besar dalam mengadsorpsi ion logam berat seperti ion Ni(II) dan Zn(II)
II. TINJAUAN PUSTAKA
A. Silika gel
Silika merupakan bahan kimia yang pemanfaatan dan aplikasinya sangat luas seperti di bidang elektronik, mekanik, medis, dan seni. Silika dapat juga
dimanfaatkan sebagai bahan penyerap kadar air di udara sehingga memperpanjang masa simpan bahan dan sebagai bahan campuran serta untuk membuat keramik seni. Silika gel merupakan salah satu adsorben yang paling sering digunakan
dalam proses adsorpsi. Hal ini disebabkan oleh mudahnya silika diproduksi dan sifat permukaan (struktur geometri pori dan sifat kimia pada permukaan) dan dapat dengan mudah dimodifikasi (Fahmiatiet al., 2004). Silika gel termasuk dalam silika amorf yang beragregasi membentuk partikel yang lebih besar (1-2,5 µm) membentuk kerangka tiga dimensi. Silika amorf dapat juga digunakan
sebagai pendukung katalis karena luas permukaan yang besar dan porositasnya tinggi (Amaria, 2007).
Silika amorf terbentuk ketika silikon teroksidasi secara termal. Silika amorf
terdapat dalam beberapa bentuk yang tersusun dari partikel-partikel kecil yang kemungkinan ikut tergabung. Biasanya silika amorf mempunyai kerapatan 2,21
permukaan SiO4tetrahedral yang tidak teratur, maka permukaan gugus–OH pada
(-Si-OH/ gugus silanol) jumlah distribusinya per unit area bukan menjadi ukuran kemampuan adsorpsi silika gel, walaupun gugus siloksan (-Si-O-Si) terdapat pada
permukaan gel.
Silika gel dalam penggunaanya memiliki kelemahan seperti pada rendahnya efektivitas dan selektivitas permukaan dalam berinteraksi dengan ion logam berat
sehingga silika gel tidak mampu berfungsi sebagai adsorben yang efektif untuk ion logam berat. Hal ini terjadi karena situs aktif yang ada hanya berupa gugus
silanol (Si-OH) dan siloksan (Si-O-Si). Akan tetapi kekurangan ini dapat diatasi dengan memodifikasi permukaan dengan menggunakan situs aktif yang sesuai untuk mengadsorpsi ion logam berat yang dikehendaki. Oleh karena itu, perlu
ditambahkan gugus aktif tertentu pada permukaan silika gel. Modifikasi permukaan silika gel dapat dilakukan dengan penambahan gugus fungsional organik yang mampu sebagai pengompleks logam-logam berat baik secara
langsung maupun menggunakan perantara suatu senyawa organosilan. Modifikasi silika dilakukan dengan mendesain molekul menggunakan agen silan sebagai
prekusor untuk membentuk permukaan baru pada silika gel yang mengandung molekul organik (Filhaet al., 2006). Silika gel mampu berikatan dengan senyawa oganik yang memiliki afinitas baik terhadap atom Si atau terhadap atom O
(Ishizaki and Nanko , 1998). Agen pemodifikasi dapat berinteraksi dengan silika gel melalui interaksi fisik dan kimia. Permukaan silika gel dapat dimodifikasi
B. Biomassa algaNannochloropsissp
Alga merupakan mikroorganisme yang hidup di daerah perairan. Mikroorganisme ini memiliki bentuk dan ukuran yang beranekaragam, ada yang mikroskopis,
bersel satu, berbentuk benang/ pita atau berbentuk lembaran. Berdasarkan pigmen (zat warna) yang dikandung, alga dikelompokkan atas empat kelas, yaitu :
Rhodophyceae(alga merah),Phaeophyceae(alga coklat),Chlorophyceae(alga hijau), danCyanophyceae(alga biru).
Nannochloropsissp merupakan alga hijau bersel eukariotik yang hidup berkoloni, ukuran diameternya 2-4µm, dinding selnya keras mengandung selulosa dan pektin serta memiliki flagel. Berdasarkan taksonominya, klasifikasi alga
Nannochloropsissp adalah sebagai berikut :
Kingdom : Protista Super Divisi : Eukaryotes Divisi : Chromophyta
Kelas : Eustigmatophyceae Genus :Nannochloropsis Spesies :Nannochloropsissp
Dari berbagai penelitian telah diketahui bahwa keempat golongan alga ini dalam keadaan hidup maupun dalam keadaan mati (biomassa) dan biomassa
terimmobilisasi telah mendapat perhatian untuk mengadsorpsi ion logam berat. Alga dalam keadaan hidup dimanfaatkan sebagai bioindikator tingkat pencemaran
terimmobilisasi dimanfaatkan sebagai biosorben (material biologi penyerap logam
berat) dalam pengolahan air limbah.
Secara umum, keuntungan pemanfaatan alga sebagai bioindikator dan biosorben
adalah :
1. Alga mempunyai kemampuan yang cukup tinggi dalam mengadsorpsi logam berat karena di dalam alga terdapat gugus fungsi yang dapat melakukan
pengikatan dengan ion logam. Gugus fungsi tersebut terutama gugus karboksil, hidroksil, amina, sulfudril imadazol, sulfat, dan sulfonat yang
terdapat dalam dinding sel dalam sitoplasma.
2. Bahan bakunya mudah didapat dan tersedia dalam jumlah banyak. 3. Biaya operasional yang rendah.
4. Tidak perlu nutrisi tambahan.
Alga dapat dimanfaatkan sebagai bioindikator logam berat karena dalam proses pertumbuhannya, alga membutuhkan sebagai jenis logam sebagai nutrient alami,
sedangkan ketersediaan logam dilingkungan sangat bervariasi. Suatu lingkungan yang memiliki tingkat kandungan logam berat yang melebihi jumlah yang
diperlukan, dapat mengakibatkan pertumbuhan alga terhambat, sehingga dalam keadaan ini eksistensi logam dalam lingkungan adalah polutan bagi alga. Dan adapun syarat utama suatu alga sebagai bioindikator adalah harus memiliki daya
tahan tinggi terhadap toksisitas akut maupun toksisitas kronis.
Pemanfaatan biomassa alga terkadang memiliki beberapa kelemahan yaitu
Untuk mengatasi kelemahan tersebut berbagai upaya dilakukan, diantaranya
dengan mengimmobilisasi biomassanya. Immobilisasi biomassa dapat dilakukan dengan menggunakan:
1. Matrik polimer seperti polietilena, glikol dan akrilat. 2. Oksida seperti alumina dan silika.
3. Campuran oksida seperti kristal aluminasilikat, asam polihetero, dan karbon.
Berbagai mekanisme yang berbeda telah dilakukan untuk mengikat antara ion logam dengan alga/biomassa seperti pertukaran ion, pembentukan kompleks
koordinasi, pengendapan mikro, dan adsorpsi.
C. Magnetit (Fe3O4)
Magnetit (Fe3O4) atau oksida besi hitam merupakan oksida besi yang paling kuat
sifat magnetisnya yang saat ini menarik perhatian para ilmuwan dan rekayasawan untuk mempelajarinya secara intensif (Teja and Koh, 2008). Magnetit yang berukuran nano banyak dimanfaatkan pada proses-proses industri (misalnya
sebagai tinta cetak, pigmen pada kosmetik) dan pada penanganan masalah-masalah lingkungan (misalnya sebagaimagnetic carrier precipitation process untuk menghilangkan anion atau pun ion logam dari air dan air limbah).
Fe3O4dapat dihasilkan dari endapan campuran FeCl24H2O dan FeCl36H2O
dalam suasana basa (dengan kehadiran NH4Cl), reaksinya menurut Dung (2009) adalah sebagai berikut :
FeCl24H2O + FeCl36H2O + 8NH4OHFe3O4+ 8NH4Cl + 20H2O
Secara umum reaksinya: 2Fe3++ Fe2++ 8OH- Fe3O4 + 4H2O
Nanopartikel magnetit digunakan untuk melapisi beberapa surfaktan untuk anti penggumpalan yang diakibatkan oleh interaksi dipol magnet antara partikel.
Nanopartikel magnetit biasanya terdiri dari pusat magnet dan cangkang polimer yang mempunyai gugus fungsi yang aktif dan istimewa untuk berbagai aplikasi.
Aplikasi yang paling terkenal dari teknologi magnetit yaitu kromatografi
bioafinitas, penanggulangan limbah air, penghentian enzim atau biomolekul lain, dan preparasi uji imunologi.
D. Logam berat di perairan
Di perairan, logam berat berada dalam bentuk ion-ion, baik sebagai pasangan ion ataupun bentuk ion-ion tunggal. Kadar logam berat akan meningkat bila limbah
diperkotaan, pertambangan, pertanian, dan perindustrian masuk ke dalam lingkungan. Adapun sifat-sifat logam berat (Peraturan Pemerintah Lingkungan
Hidup IPB, 2001; Sutamihardjaet al., 1982) yaitu :
1. Sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan dan keberadaanya secara alami sulit terurai (dihilangkan).
3. Mudah terakumulasi di sedimen, sehingga konsentrasinya akan lebih tinggi
dari konsentrasi logam dalam air. Selain itu sedimen mudah tersuspensi karena pergerakan massa air yang akan melarutkan kembali logam yang dikandungnya
di dalam air, sehingga sedimen menjadi sumber pencemar potensial dalam skala waktu tertentu.
Menurut Darmono (1995), daftar urutan toksisitas logam paling tinggi ke paling
rendah terhadap manusia yang mengkonsumsi ikan yang sudah tercemar adalah
sebagi berikut Hg2+> Cd2+ > Ag2+> Ni2+> Pb2+> As2+> Cr2+ Sn2+> Zn2+. Ada beberapa upaya yang dilakukan untuk menurunkan kadar logam berat
tersebut di perairan yaitu menggunakan teknik fisika-kimia seperti koagulasi, osmosis balik dan ekstraksi pelarut (Valdman and Leite, 2000), oksidasi reduksi,
membrane pemisah, flotasi, evaporasi, kristalisasi (Barkhordar and Ghiasseddin, 2004), penambahan zat kimia tertentu, dan beberapa metode lain seperti
penyerapan dengan menggunakan karbon aktif, elektrodialisis, dan osmosis balik
(Suhendrayatna, 2001).
E. Ion Ni(II) dan Zn(II)
Bila ditinjau dari definisi asam-basa menurut G.N. Lewis, maka interaksi antara
ion logam dengan adsorben dapat dipandang sebagai reaksi asam Lewis dengan
basa Lewis, yang mana ion logam berperan sebagai asam Lewis yang menjadi
akseptor pasangan elektron dan adsorben sebagai basa Lewis yang menjadi donor
interaksi asam-basa Lewis dapat digunakan dalam adsorpsi ion logam (Keenan
dan Kleinfelter, 1984).
Prinsip yang digunakan secara luas dalam reaksi asam-basa Lewis adalah prinsip
HSAB (High Soft Acid Base) yang dikembangkan Pearson. Prinsip ini didasarkan
pada polarisabilitas unsur yang dikaitkan dengan kecenderungan unsur (asam atau
basa) untuk berinteraksi dengan unsur lainnya. Ion-ion logam yang berukuran
kecil, bermuatan positif besar, elektron terluarnya tidak mudah terdistorsi dan
memberikan polarisabilitas kecil dikelompokkan dalam asam keras. Ion-ion
logam yang berukuran besar, bermuatan kecil atau nol, elektron terluarnya mudah
terdistorsi dan memberikan polarisabilitas yang besar dikelompokkan dalam asam
lunak. Ion Ni(II) termasuk golongan asam menengah/ madya yang mana akan
berinteraksi dengan ligan yang bersifat basa menengah/ madya, sedangkan ion
Zn(II) termasuk golongan asam lunak yang mana akan berinteraksi dengan ligan
yang bersifat basa lunak. Adapun logam yang digunakan dalam penelitian ini
yaitu :
a. Nikel (Ni)
Nikel merupakan unsur kimia dengan lambang Ni, dengan nomor atom 28 dan
massa relatif 58,71. Nikel merupakan logam putih perak yang keras. Logam ini
melebur pada 1455°C, dan bersifat sedikit magnetis. Memiliki sifat tidak berubah
bila terkena udara, tahan terhadap oksidasi dan kemampuan mempertahankan sifat
aslinya di bawah suhu yang ekstrim (Cotton dan Wilkinson, 1989).
b. Seng (Zn)
Seng adalah unsur kimia dengan lambang Zn, dengan nomor atom 30 dan massa
Mineral yang mengandung seng di alam bebas antara lain kelamin, franklinit,
smithsonit, willenit, dan zinkit. Seng merupakan logam putih kebiruan dan logam
ini cukup reaktif. Seng melebur pada 410°C dan mendidih pada 906°C (Cotton
dan Wilkinson, 1989).
F. Proses sol-gel
Proses sol-gel telah banyak dikembangkan terutama untuk pembuatan hibrida,
kombinasi oksida anorganik (terutama silika) dengan alkoksisilan. Proses ini didasarkan pada prekursor molekular yang dapat mengalami hidrolisis,
kebanyakan merupakan alkoksida logam atau semi logam. Proses sol-gel merupakan proses yang dapat digambarkan sebagai pembentukan suatu jaringan oksida melalui reaksi polikondensasi yang progresif dari molekul prekursor dalam
medium cair atau merupakan proses untuk membentuk material melalui suatu sol, gelationdari sol dan akhirnya penghilangan pelarut (Schubert and Husing, 2000).
Prose sol-gel berlangsung melalui langkah-langkah sebagai berikut:
1. Hidrolisis dan kondensasi 2. Gelation(transisi sol-gel) 3. Aging(pertumbuhan gel) 4. Drying(pengeringan)
Melalui polimerisasi kondensasi akan terbentuk dimer, trimer dan seterusnya
sehingga membentuk bola-bola polimer. Sampai pada ukuran tertentu (diameter sekitar 1,5 nm) dan disebut sebagai partikel silika primer. Gugus silanol
disertai pelepasan air sampai terbentuk partikel sekunder dengan diameter sekitar
4,5 nm. Pada tahap ini larutan sudah mulai menjadi gel ditandai dengan
bertambahnya viskositas. Gel yang dihasilkan masih sangat lunak, tidak kaku dan
disebut alkogel. Tahap selanjutnya adalah proses pembentukan gel. Pada tahap ini, kondensasi antara bola-bola polimer terus berlangsung membentuk ikatan siloksan menyebabkan menurunnya jari-jari partikel sekunder dari 4,5 nm menjadi
4 nm dan akan teramati penyusunalkogelyang diikuti dengan berlangsungnya eliminasi larutan garam. Tahap akhir pembentukan silika gel adalahxerogelyang merupakan fasa silika yang telah mengalami pencucian dan pemanasan.
Pemanasan pada temperatur 110 mengakibatkan dehidrasi padahidrogeldan terbentuknya silika gel dengan struktur SiO2 xH2O (Enymia dkk., 1998). Produk akhir yang dihasilkan berupa bahan amorf dan keras yang disebut silika gel
kering.
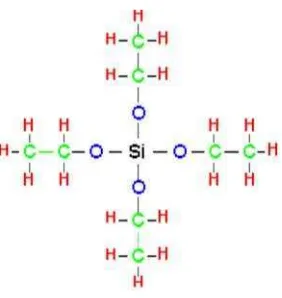
Pada proses sol-gel, bahan dasar yang digunakan untuk membentuk silika dapat berupa logam alkoksida seperti TEOS (tetraetilortosilikat). TEOS mudah
terhidrolisis oleh air dan mudah digantikan oleh gugus OH. Selanjutnya silanol (Si-OH) direaksikan antara keduanya atau direaksikan dengan gugus alkoksida
Gambar 1. Struktur TEOS(Brinker and Scherer, 1990)
Reaksi pada proses sol-gel dapat dilihat pada persamaan berikut: Hidrolisis
≡Si-OR + H-O-H→ ≡Si-OH + ROH Polikondensasi
≡Si-OH + HO-Si→ ≡Si-O-Si≡ + H2O
≡Si-OH + RO-Si→ ≡Si-O-Si≡ + ROH (Prassas, 2002).
G. Adsorpsi
Adsorpsi merupakan fenomena yang terjadi pada permukaan. Adsorpsi secara umum didefinisikan sebagai akumulasi sejumlah molekul, ion atau atom yang
terjadi pada batas antara dua fasa (Alberty and Daniel, 1987). Fasa yang
menyerap disebut adsorben dan fasa yang terserap disebut adsorbat. Kebanyakan adsorben adalah bahan-bahan yang memiliki pori karena adsorpsi berlangsung
Gaya tarik-menarik dari suatu padatan dibedakan menjadi dua jenis gaya, yaitu
gaya fisika dan gaya kimia yang masing-masing menghasilkan adsorpsi fisika (physisorption)dan adsorpsi kimia(chemisorption)(Oscik, 1982). Adsorpsi fisika adalah proses interaksi antara adsorben dengan adsorbat yang melibatkan gaya-gaya antar molekul seperti gaya van der Waals, sedangkan adsorpsi kimia terjadi jika interaksi adsorben dan adsorbat melibatkan pembentukan ikatan kimia.
Dalam proses adsorpsi melibatkan berbagai macam gaya yakni gaya van der Waals, gaya elektrostatik, ikatan hidrogen serta ikatan kovalen (Martell and
Hancock, 1996).
Dalam adsorpsi fisika, molekul-molekul teradsorpsi pada permukaan dengan ikatan yang lemah. Adsorpsi ini umumnya bersifat reversibel sehingga subtansi
yang telah teradsorpsi relatif mudah dilepaskan kembali dengan cara menurunkan tekanan gas atau konsentrasi zat terlarut. Energi yang menyertai fisisorpsi adalah rendah berkisar antara 10 kJ/mol dan lebih rendah dari energi adsorpsi kimia
(Adamson and Gast, 1997).
Pada adsorpsi kimia terjadi pembentukan dan pemutusan ikatan, sehingga energi
adsorpsinya berada pada kisaran yang sama dengan reaksi kimia. Ikatan antara adsorben dan adsorbat cukup kuat sehingga tidak terjadi spesiasi, karena zat teradsorpsi menyatu dengan adsorben membentuk lapisan tunggal dan relatif
reversibel. Batas minimal suatu adsorpsi dikategorikan sebagai kemisorpsi adalah memiliki harga energi adsorpsi sebasar 20,92 kJ/mol (Adamson and Gast, 1997).
Ini diperkuat oleh studi spektroskopi bahwa terjadi transfer elektron dan terbentuk
ikatan kimia antara adsorben dan adsorbat.
Menurut Shaw (1980), proses adsorpsi larutan secara teoritis umumnya
berlangsung lebih rumit dibandingkan proses adsorpsi pada gas, uap atau cairan murni. Hal ini disebabkan pada adsorpsi larutan melibatkan persaingan antara komponen larutan dengan situs adsorpsi. Proses adsorpsi larutan dapat
diperkirakan secara kualitatif dari polaritas adsorben dan komponen penyususn larutan. Kecenderungan adsorbenpolarlebih kuat menyerap adsorbatpolar dibandingkan adsorbatnon-polar,demikian sebaliknya. Kelarutan adsorbat dalam pelarut merupakan faktor yang menentukan dalam proses adsorpsi, umumnya subtansi hidrofilik sukar teradsorpsi dalam larutan encer.
Adsorpsi suatu zat dari larutan berbeda dengan adsorpsi zat secara individu, sebab larutan minimal mengandung dua komponen yang dapat membentuk lapisan yang teratur pada permukaan adsorben. Jika permukaan adsorben dan larutan telah
jenuh dengan molekul adsorbat maka hanya terjadi penggantian satu komponen oleh komponen lainnya.
1. Kinetika adsorpsi
Kinetika adalah deskripsi laju reaksi. Kinetika adsorpsi tergantung pada luas permukaan partikel. Urutan reaksi mendefinisikan ketergantungan laju reaksi
pada konsentrasi spesies yang bereaksi. Orde reaksi ditentukan secara empiris, tetapi tidak berkaitan dengan stoikiometri reaksi. Sebaliknya, kinetika diatur oleh
adsorpsi yang berlangsung dan menentukan kapasitas keseimbangan yang dapat
dimanfaatkan dalam situasi yang dinamis dan praktis. Tingkat adsorpsi
keseluruhan dipengaruhi oleh perubahan sifat dan komponen pelarut, serta ukuran
partikel dan suhu. Kinetika reaksi adsorpsi juga tergantung pada gugus fungsional dan konsentrasi. Tingginya tingkat substitusi gugus fungsional pada polimer inert dapat meningkatkan laju reaksi keseluruhan (Allenet al.,2004).
Analisis kinetika didasarkan pada kinetika reaksi terutama pseudo orde pertama
atau mekanisme pseudo pertama bertingkat. Untuk meneliti mekanisme adsorpsi,
konstanta kecepatan reaksi sorpsi kimia untuk ion-ion logam,digunakan
persamaan sistem pseudo order pertama oleh Lagergren dan mekanisme pseudo
order kedua (Buhaniet al., 2010). Persamaan ini digunakan untuk menguji data
percobaan dari konsentrasi awal, suhu dan berat ion-ion logam dalam larutan
(Zhanget al., 2003). Model kinetika (pseudo urutan pertama dan persamaan orde dua) dapat digunakan dengan asumsi bahwa konsentrasi diukur sama dengan
konsentrasi permukaan adsorben. Tingkat persamaan urutan pertama Lagergren adalah salah satu yang paling banyak digunakan untuk adsorpsi zat terlarut dari
larutan cair (Liuet al.,2004).
Untuk konstanta laju kinetika pseudo orde satu:
)
Denganqeadalah jumlah ion logam divalen yang teradsorpsi (mg/g) pada waktu
keseimbangan,qtadalah jumlah ion logam divalen yang teradsorpsi pada waktut
(menit),k1adalah konstanta kecepatan adsorpsi (jam-1). Integrasi persamaan ini
t
Dengan menggunakan regreasi linear dan mengalurkan ln(qe–qt) terhadapt
diperoleh konstantak1. Untuk konstanta kecepatan reaksi order kedua proses
kemisorpsi:
Integrasi persamaan ini dengan kondisi batast = 0sampait = tdanqt=0sampai
qt=qt, memberikan:
Dengan k2konstanta keseimbangan order kedua kemisorpsi (g/mg.jam). Model
kinetika order kedua dapat disusun untuk mendapatkan bentuk linear :
e
Model kesetimbangan adsorpsi yang sering digunakan untuk menentukan
kesetimbangan adsorpsi adalah isotermal Langmuir dan Freundlich.
Model Adsorpsi Langmuir
antara zat yang teradsorpsi dengan adsorben dapat terjadi secara fisika atau secara
kimia. Ikatan tersebut harus cukup kuat untuk mencegah perpindahan molekul yang telah teradsorpsi sepanjang permukaan adsorben.
Model adsorpsi isoterm Langmuir dapat dinyatakan dalam persamaan:
= + (6)
dimanaCadalah konsentrasi kesetimbangan,madalah jumlah zat yang
teradsorpsi per gram adsorben,badalah kapasitas adsorpsi danKadalah tetapan kesetimbangan adsorpsi. Dengan kurva linier hubungan antaraC/mversusC, maka dapat ditentukan nilaibdari kemiringan(slop)danKdari intersep kurva. Energi adsorpsi (Eads) yang didefinisikan sebagai energi yang dihasilkan apabila
satu mol ion logam teradsorpsi dalam adsorben dan nilainya ekuivalen dengan nilai negatif dari perubahan energi bebas Gibbs standar,∆G0, dapat dihitung menggunakan persamaan:
= = (7)
DenganRadalah tetapan gas umum (8,314 J/mol K),Ttemperatur (K) danK adalah tetapan kesetimbangan adsorpsi yang diperoleh dari persamaan Langmuir dan energi total adsorpsi adalah sama dengan energi bebas Gibbs (Oscik, 1982).
∆G sistem negatif artinya adsorpsi beralangsung spontan.
Model Adsorpsi Freundlich
Model isoterm Freundlich menjelaskan bahwa proses adsorpsi pada bagian
permukaan adalah heterogen dimana tidak semua permukaan adsorben
mempunyai daya adsorpsi. Model isoterm Freundlich menunjukkan lapisan
tersebut berkaitan dengan ciri-ciri dari adsorpsi secara fisika dimana adsorpsi
dapat terjadi pada banyak lapisan(multilayer)(Husin dan Rosnelly, 2005).
Asumsi yang digunakan :
a. Tidak ada asosiasi dan disosiasi molekul-molekul adsorbat setelah teradsorpsi pada permukaan padatan.
b. Hanya berlangsung mekanisme adsorpsi secara fisis tanpa adanya adsorpsi
kimia.
c. Permukaan padat bersifat heterogen (Nollet al., 1992).
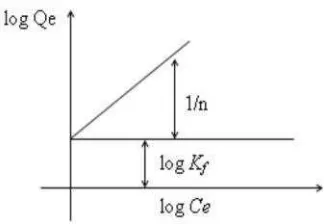
Bentuk persamaan Freundlich adalah sebagai berikut:
= (8)
Dimana:
Qe= Banyaknya zat yang terserap per satuan berat adsorben (mol/g) Ce= Konsentrasi adsorbat pada saat kesetimbangan (mol/L)
n = Kapasitas adsorpsi maksimum (mol/g) Kf= Konstanta freundlich (L/mol)
Persamaan di atas dapat diubah kedalam bentuk linier dengan mengambil bentuk logaritmanya:
= + (9)
Gambar 2. Model Isoterm Adsorpsi Freundlich(Rousseau, 1987).
Bentuk linear dapat digunakan untuk menentukan kelinearan data percobaan dengan cara mengeplotkanC/QterhadapCe. Konstanta FreundlichKfdapat diperoleh dari kemiringan garis lurusnya dan 1/n merupakan harga slop. Bila n diketahuiKf dapat dicari, semakin besar hargaKfmaka daya adsorpsi akan semakin baik dan dari hargaKfyang diperoleh, maka energi adsorpsi akan dapat dihitung (Rousseau, 1987).
Selain itu, untuk menentukan jumlah logam teradsorpsi, rasio distribusi dan
koefisien selektivitas pada proses adsorpsi ion logam terhadap adsorben alga
Nannochloropsissp, hibrida alga silika (HAS) dan HAS-magnetit (Fe3O4) dapat
digunakan persamaan berikut:
Q = (Co-Ca)V/W (10)
Dimana Q menyatakan jumlah logam teradsorpsi (mg/g), Co dan Ca menyatakan
konsentrasi awal dan kesetimbangan dari ion logam (mmol/L), W adalah massa
H. Karakterisasi
1. Spektrofotometer inframerah (IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi
getaran (vibrasi) atau osilasi (oscillation). Bila molekul menyerap radiasi
inframerah, energi yang diserap menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat itu. Jadi molekul ini berada pada keadaan vibrasi
tereksitasi (excited vibrational state); energi yang diserap ini akan dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar. Panjang gelombang
eksak dari absorpsi oleh suatu tipe ikatan, bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan menyerap radiasi inframerah pada panjang gelombang yang berlainan. Dengan demikian
spektrometri inframerah dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul (Supratman, 2010).
2. Analisis ion logam dengan SSA
Metode analisis dengan SSA didasarkan pada penyerapan energi cahaya oleh
atom-atom netral suatu unsur yang berada dalam keadaan gas. Penyerapan cahaya
oleh atom bersifat karakteristik karena tiap atom hanya menyerap cahaya pada
panjang gelombang tertentu yang energinya sesuai dengan energi yang diperlukan
untuk transisi elektron-elektron dari atom yang bersangkutan di tingkat yang lebih
tinggi, sedangkan energi transisi untuk masing-masing unsur adalah sangat khas.
mempunyai beberapa kelebihan dibandingkan dengan metode spektroskopi emisi
konvensional. Pada metode konvensional emisi tergantung pada sumber eksitasi,
bila eksitasi dilakukan secara termal maka akan tergantung pada temperatur
sumber (Khopkar, 2001).
SSA juga dapat digunakan untuk mengetahui kadar ion logam yang teradsorpsi
maupun yang terdapat dalam adsorben. Ion logam yang teradsorpsi dihitung
secara kuantitatif berdasarkan selisih konsentrasi ion logam sebelum dan sesudah
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini telah dilakukan pada bulan April 2012 sampai bulan Juni 2012 di
Laboratorium Kimia Anorganik dan Biokimia Jurusan Kimia Universitas
Lampung, serta penyiapan algaNannochloropsisspdi Balai Besar Pengembangan Budidaya Laut Lampung. Identifikasi gugus fungsional menggunakan alat spektrofotometerIRPrestige-21 Shimadzu dilakukan di
Laboratorium Kimia Organik FMIPA Universitas Gajah Mada. Analisis
kandungan ion logam menggunakan SSA (Perkin Elmer 3100) dilakukan di
Laboratorium Kimia Analitik FMIPA Universitas Gajah Mada.
B. Alat dan Bahan Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas yang biasa
Bahan-bahan yang digunakan dalam penelitian ini adalah algaNannochloropsis sp,Ni(NO3)2⋅6H2O p.a merck, Zn(NO3)2⋅6H2O p.a Merck, magnetit (Fe3O4),
TEOS, NaOH, HCl 1M, NH4OH 1M, etanol, dan aquades.
C. Prosedur Penelitian
1. Penyiapan biomassa algaNannochloropsissp
Biomassa alga diperoleh dari isolasi algaNannochloropsissp yang dihasilkan dari pembudidayaan dalam skala laboratorium di Balai Budidaya Laut (BBL)
Lampung. Biomassa alga yang dihasilkan dalam bentuk nata, dinetralkan dengan menggunakan aquades hingga pH≈7, dan dikeringkan pada suhu ruang selama
3-4 hari. Kemudian alga yang sudah kering digerus sampai halus dan dioven pada suhu 40ºC selama 2-3 jam hingga berat konstan.
2. Sintesis
a. Hibrida alga silika (HAS)
Sebanyak 5 mL TEOS dicampurkan dalam 2,5 mL aquades yang dimasukkan ke
dalam gelas kimia dan diaduk dengan pengaduk magnet selama 30 menit dan ditambahkan HCl 1M hingga pH 2 (Larutan A). Dalam pembuatan larutan B
sebanyak 0,4 g biomassaNannochloropsissp dimasukkan ke dalam gelas plastik yang telah diisi etanol sebanyak 5 mL, kemudian diaduk dengan pengaduk magnet selama 30 menit. Selanjutnya, kedua larutan dicampurkan dan diaduk dengan
didiamkan selama 24 jam. Kemudian dicuci dengan menggunakan aquades dan
etanol (60:40) hingga pH≈ 7. Setelah dicuci, lalu dikeringkan di dalam oven pada suhu 40ºC selama 2-3 jam hingga berat konstan(Buhani and Suharso, 2009).
b. HAS-magnetit (Fe3O4)
Sebanyak 5 mL TEOS, 2,5 mL aquades, dan Fe3O4dengan variasi 0,05 ; 0,1 ; 0,2 g dimasukkan ke dalam gelas plastik dan diaduk dengan pengaduk magnet selama
30 menit serta ditambahkan HCl 1M hingga pH 2 (Larutan A). Dalam pembuatan larutan B, sebanyak 0,4 g biomassaNannochloropsissp ditambahkan etanol sebanyak 5 mL, kemudian diaduk dengan pengaduk magnet selama 30 menit. Selanjutnya, kedua larutan dicampurkan dan diaduk dengan pengaduk magnet hingga membentuk suatu gel. Gel yang terbentuk didiamkan selama 24 jam.
Kemudian dicuci dengan menggunakan aquades dan etanol (60:40) hingga pH≈ 7. Setelah dicuci, dikeringkan di dalam oven pada suhu 40ºC selama 2-3 jam hingga mencapai berat konstan dan dikarakterisasi. Selain itu untukmenentukan
jumlah logam teradsorpsi optimumnya, sebanyak50 mg adsorben yang
dihasilkan masing–masing ditambahkan dengan20 mL larutan Ni(II) atau Zn(II)
dengan konsentrasi 100 ppm pada pH≈6. Kemudian larutan diaduk selama 1
jam dan dilanjutkan dengan sentrifugasi. Filtrat yang dihasilkan, dianalisis dengan SSA (Buhaniet al., 2010).
3. Karakterisasi
Untuk mengetahui adanya perubahan gugus-gugus fungsional utama dalam
analisis dengan spektrofotometerIR. Selain itu, untuk menentukan kadar ion logam yang teradsorpsi digunakan SSA.
4. Uji adsorpsi
a. Laju adsorpsi
Sebanyak 50 mg adsorben yang terdiri dari biomassa algaNannochloropsissp, HAS, dan HAS-magnetitdengan jumlah logam teradsorpsi optimum (2b),
masing-masing ditambahkan 20 mL larutan dari 100 mg L-1Ni(II) atau Zn(II)
dengan pH 6. Kemudian dilakukan variasi waktu interaksi yaitu 5, 15, 30, 45, 60
dan 90 menit. Selanjutnya, masing-masing larutan diaduk dan dilanjutkan dengan
sentrifugasi. Filtrat yang dihasilkan, dianalisis dengan SSA (Buhaniet al., 2010).
b. Isoterm adsorpsi
Sebanyak 50 mg adsorben yang terdiri dari biomassa algaNannochloropsissp, HAS, dan HAS-magnetitdengan jumlah logam teradsorpsi optimum (2b),
masing-masing ditambahkan 20 mL larutan dengan variasi konsentrasi 0, 25, 50,
100, 150, dan 200 mg L-1Ni(II) atau Zn(II) pada pH≈6. Kemudian
masing-masing larutan tersebut diaduk pada waktu optimum (4a) dan dilanjutkan dengan
sentrifugasi. Filtrat yang dihasilkan, dianalisis dengan SSA untuk menentukan
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil yang diperoleh dari penelitian yang telah dilakukan maka dapat
disimpulkan bahwa :
1. Sintesis adsorben HAS-magnetit telah berhasil dilakukan yang ditunjukkan
dengan karakterisasi menggunakan spektrofotometerIR. Adanya pita serapan
3000-2900 cm-1menunjukkan bahwa telah terjadi immobilisasi biomassa alga
Nannochloropsissppada silika dalam HAS dan HAS-magnetit.
2. Laju adsorpsi ion Zn(II) dan Ni(II) olehbiomassa algaNannochloropsissp, HAS, dan HAS-magnetit cenderung mengikuti pseudo orde dua.
3. Isoterm adsorpsi ion Zn(II) dan Ni(II) oleh biomassa algaNannochloropsissp dan HAS cenderung mengikutimodel isoterm Langmuir sedangkan pada HAS-magnetit cenderung mengikuti model isoterm Freundlich.
B. Saran
Pada penelitian lebih lanjut disarankan:
1. Variasi konsentrasi ion Zn(II) dan Ni(II) terhadap HAS-magnetit ditambahkan karena pada plot jumlah ion logam yang teradsorpsi oleh HAS-mganetit belum diperoleh batas optimumnya.
2. Perlu dilakukan pengujian lebih lanjut terhadap adsorpsi ion Zn(II) dan Ni(II) oleh biomassa algaNannochloropsissp, HAS, dan HAS-magnetit