ISOLA
Diajjukan untuuk melengkkapi dan me
FAKUULTAS MA
emenuhi syyarat menccapai gelar Sains
NGETAHUUAN ALAMM UTARA
ISOLA
NGETAHUUAN ALAMM UTARA
PERSETUJUAN
Judul : Isolasi Dan Potensi Bakteri Keratinolitik Dari Feses Ular Sanca (Python sp.) Dalam Mendegradasi Limbah Keratin
Kategori : Skripsi
Nama : Farah Dwi Larasati
Program Studi : Sarjana (S1) Biologi Nomor Induk Mahasiswa : 100805042
Fakultas : Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Disetujui di Medan, Maret 2015
Komisi Pembimbing:
Pembimbing 2 Pembimbing 1
Prof. Dr. Erman Munir, M.Sc. Prof. Dr. Dwi Suryanto, M.Sc. NIP. 196511011991031002 NIP. 196404091994031003
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
Dr. Nursahara Pasaribu, M.Sc. NIP.19630123 199003 2 001
PERNYATAAN
ISOLASI DAN POTENSI BAKTERI KERATINOLITIK DARI
FESES ULAR SANCA (
Python
sp.) DALAM MENDEGRADASI
LIMBAH KERATIN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Maret 2015
FARAH DWI LARASATI 100805042
PENGHARGAAN
Alhamdulilah, segala puji bagi Allah SWT yang telah memberikan rahmat serta karunia-Nya sehingga atas izin-Nya penulis dapat menyelesaikan skripsi yang berjudul “Isolasi dan Potensi Bakteri Keratinolitik dari Feses Ular Sanca (Python sp.) dalam Mendegradasi Limbah Keratin”. Skripsi ini dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Sains pada Fakultas MIPA USU Medan.
Terima kasih penulis sampaikan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc selaku pembimbing 1 dan Bapak Prof. Dr. Erman Munir, M.Sc selaku pembimbing 2 yang telah memberi bimbingan dan banyak masukan selama pelaksanaan penelitian dan penyusunan skripsi ini. Ucapan terima kasih juga penulis ucapkan kepada Ibu Dr. It Jamilah, M.Sc dan Ibu Masitta Tanjung, S.Si. M.Si selaku penguji yang telah memberikan banyak saran, kritikan dan koreksinya dalam penyempurnaan penulisan skripsi ini. Ucapan terima kasih juga saya sampaikan kepada Ibu Dr. Nursahara Pasaribu, M.Sc selaku Ketua Departemen Biologi FMIPA, USU dan Ibu Dr. Saleha Hanum, M.Si selaku Sekretaris Departemen Biologi FMIPA, USU, serta Staf Pengajar Departemen Biologi, FMIPA, USU. Ibu Roslina Ginting dan Bang Erwin selaku Staf Pegawai Departemen Biologi, FMIPA USU yang telah banyak membantu penulis.
Kepada Ayah dan Ibunda tercinta, Susi Indriati dan Endro Sukarsono yang telah memberikan dukungan berupa moril maupun materil, selalu memberikan doa, semangat, kesabaran, perhatian dan kasih sayang yang begitu besar sehingga penulis bisa sampai ke titik ini, semoga Allah selalu memberikan kesehatan dan umur yang berkah. Teruntuk kakak dan adik tersayang yang telah memberikan doa dan semangat sekaligus penghibur bagi penulis, Karin Anggitasari dan Nabilah Tri Ambarwati. Terima kasih juga penulis ucapkan kepada seluruh keluarga besar penulis.
Ucapan terima kasih juga penulis sampaikan kepada Ibu Dr. Sri Amaliah selaku kepala Laboratorium Terpadu Fakultas Kedokteran USU yang telah memberikan izin untuk melakukan penelitian di Laboratorium Terpadu, kepada Ibu Mardiah, Bapak Indra, Ibu Eli, Ibu Winda dan seluruh pegawai Laboratorium Terpadu yang telah membimbing dan membantu saya dalam penelitian ini. Terima kasih juga kepada Pak Jemari selaku pekerja di Penangkaran Buaya Asam Kumbang, yang telah bersedia membantu penulis mengambil sampel penelitian.
Penulis juga menyampaikan ucapan terima kasih kepada Dian Lestari Lubis, Nurfithri Apriani Lubis, Karina Adelia, Mailani Quanti Harahap, Nabila Maisarah, Kiki Dian Pratiwi, Nurul Alfitanisa Lubis, Rahmad Zais Jambak, Vahnoni Lubis dan Anisa Rilla Lubis, kalian telah memberikan arti indahnya sebuah persahabatan, ketulusan, penghilang kebosanan, serta saling memberi semangat kepada penulis dan yang tak terlupakan penulis ucapkan terima kasih kepada stambuk 2010 yang namanya tidak bisa disebutkan satu per satu.
Sahabat yang selalu mendukung penulis, Siti Anggra Maisah Putri dan Ririn Eva Rinduri, terima kasih telah menjadi sahabat terbaik, tempat curhat dan penghibur bagi penulis. Kepada rekan-rekan yang membantu penulis selama penelitian berlangsung, Yuli, Devi, Ledi, Yoan, Norton, Tien dan Nia. Terima kasih atas segala pengertian, dukungan, kebersamaan dan bantuan yang telah diberikan. Terima kasih juga khusus untuk Kak Hilwa yang telah meluangkan waktunya untuk sekedar berdiskusi dan memberikan ilmu yang sangat bermanfaat kepada penulis.
Akhirnya dengan penuh ketulusan dan kerendahan hati, penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun dari semua pihak demi kesempurnaan skripsi ini. semoga Allah SWT membalas semua kebaikan dan ketulusan kita dengan balasan yang setimpal. Amin Ya Rabbal Alamin.
Medan, April 2015
Penulis
ISOLASI DAN POTENSI BAKTERI KERATINOLITIK DARI FESES ULAR SANCA (Python sp.) DALAM MENDEGRADASI LIMBAH
KERATIN
ABSTRAK
Ular seperti ular sanca Python sp. dapat menelan mangsanya termasuk dengan bulu-bulunya dan mengeluarkan feses tanpa ada sisa bulu sedikitpun. Hal ini dapat diasumsikan bahwa terdapat bakteri keratinolitik pada saluran pencernaan ular. Penelitian tentang isolasi dan potensi bakteri keratinolitik dari feses ular sanca ini telah dilakukan. Sebanyak 10 bakteri telah diisolasi dan diuji untuk melihat kemampuannya dalam menghasilkan keratinase pada media feather meal agar. Dua isolat FU7 dan FU10 telah dipilih untuk penelitian lebih lanjut berdasarkan indeks keratinolitik kedua isolat tersebut. Kemampuannya dalam mendegradasi keratin diuji pada media cair yang mengandung bulu ayam dan rambut kambing sebagai sumber karbon dan nitrogen selama 25 hari inkubasi. Hasil penelitian menunjukkan bahwa FU7 dapat mendegradasi bulu ayam dan rambut kambing hingga 62,5% dan 35,9%, sedangkan FU10 mendegradasi kedua substrat masing-masing 56,9% dan 19,2%.
Kata Kunci: bakteri keratinolitik, feses ular, indeks keratinolitik, limbah keratin, Python sp.
ISOLATION AND ASSAY OF POTENTIAL OF KERATINOLYTIC BACTERIA FROM SNAKE FECES (Python sp.) TO DEGRADE KERATIN
WASTE
ABSTRACT
Snake like Python sp. can eat bird including its whole feather and excrete feces with no feather left. It has been assumed that there are keratinolytic bacteria in the intestine of snake. In this study an isolation and an assay of potential of keratinolytic bacteria from feces of Python sp. has been conducted. A total of 10 bacteria were isolated and tested for their abilities to produce keratinase on feather meal agar. Two isolates, FU7 and FU10, were selected based on keratinolytic index for further study. Their abilities to degrade keratin were assayed in liquid medium containing chicken feather and goat hair as carbon and nitrogen source for 25 days of incubation. The result showed that FU7 degraded chicken feather and goat hair by 62,5% and 35,9%, respectively, while FU10 degraded both substrates by 56,9% and 19,2%, respectively.
Keywords: keratinolytic bacteria, keratinolytic index, keratin waste, Python sp., snake feces.
DAFTAR ISI
DAFTAR LAMPIRAN x
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Tujuan Penelitian 3
1.4 Manfaat 3
BAB 2 TINJAUAN PUSTAKA
2.1 Ular Sanca (Python sp.) 4
2.2 Bulu Ayam 4
2.3 Keratinase 5
2.4 Degradasi Keratin 7
BAB 3 METODE PENELITIAN
3.1 Waktu dan Tempat 9
3.2 Bahan dan Alat 9
3.3 Isolasi Bakteri dari Feses Ular Sanca 9 3.4 Uji Aktivitas Proteolitik Secara Kualitatif 10 3.5 Pertumbuhan Isolat Pada Media Feather Meal Agar 10 3.6 Uji Aktivitas Keratinolitik Secara Kualitatif 11 3.7 Pengukuran Potensi Bakteri Keratinolitik 11 BAB 4 HASIL DAN PEMBAHASAN
4.1Karakteristik Isolat Bakteri dari Feses Ular Sanca 13 4.2Aktivitas Proteolitik Secara Kualitatif 16 4.3Aktivitas Keratinolitik Secara Kualitatif 17 4.4Potensi Bakteri Keratinolitik dari Feses Ular Sanca 19 BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 24
5.2 Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 29
DAFTAR TABEL
Nomor Judul Halaman
1 Karakteristik Morfologi dan Pewarnaan Sifat Gram Bakteri dari Feses Ular Sanca (Python sp.)
13 2 Hasil Uji Biokimia Bakteri dari Feses Ular Sanca
(Python sp.)
14
DAFTAR GAMBAR
Nomor Judul Halaman
1 Indeks Proteolitik Isolat Bakteri Keratinolitik secara Kualitatif
16 2 Indeks Keratinolitik Isolat Bakteri Keratinolitik secara
Kualitatif
18
3 Degradasi Limbah Keratin setelah 25 hari 19
4 Peptida terlarut yang diukur pada panjang gelombang 280 nm.
21 5 Pertumbuhan FU7 dan FU10 selama Inkubasi 22
DAFTAR LAMPIRAN
Nomor Judul Halaman
1 Alur Kerja Penelitian 29
2 Alur Kerja Isolasi Mikroba dari Feses Ular Sanca (Python sp.)
30 3 Alur Kerja Karakterisasi Morfologi dan Sifat Biokimia
Isolat Bakteri dari Feses Ular Sanca (Python sp.)
31 4 Alur Kerja Uji Aktivitas Proteolitik Secara Kualitatif 32 5 Alur Kerja Uji Aktivitas Keratinolitik Secara Kualitatif 33 6 Uji Potensi Bakteri Keratinolitik dari Feses Ular Sanca
(Python sp.) dalam Mendegradasi Limbah Sumber Keratin
34
7 Alur Kerja Pengukuran Serapan Optical Density (OD) 35 8 Alur Kerja Estimasi Jumlah Isolat Bakteri dengan
Metode TPC
36
9 Komposisi dan Persiapan Media 37
10 Tabel Indeks Proteolitik 38
11 Tabel Indeks Keratinolitik 39
12 Tabel Pertumbuhan Bakteri Keratinolitik FU7 dan FU10 Setelah 25 Hari Inkubasi
40
13 Foto Hasil Penelitian 41
ISOLASI DAN POTENSI BAKTERI KERATINOLITIK DARI FESES ULAR SANCA (Python sp.) DALAM MENDEGRADASI LIMBAH
KERATIN
ABSTRAK
Ular seperti ular sanca Python sp. dapat menelan mangsanya termasuk dengan bulu-bulunya dan mengeluarkan feses tanpa ada sisa bulu sedikitpun. Hal ini dapat diasumsikan bahwa terdapat bakteri keratinolitik pada saluran pencernaan ular. Penelitian tentang isolasi dan potensi bakteri keratinolitik dari feses ular sanca ini telah dilakukan. Sebanyak 10 bakteri telah diisolasi dan diuji untuk melihat kemampuannya dalam menghasilkan keratinase pada media feather meal agar. Dua isolat FU7 dan FU10 telah dipilih untuk penelitian lebih lanjut berdasarkan indeks keratinolitik kedua isolat tersebut. Kemampuannya dalam mendegradasi keratin diuji pada media cair yang mengandung bulu ayam dan rambut kambing sebagai sumber karbon dan nitrogen selama 25 hari inkubasi. Hasil penelitian menunjukkan bahwa FU7 dapat mendegradasi bulu ayam dan rambut kambing hingga 62,5% dan 35,9%, sedangkan FU10 mendegradasi kedua substrat masing-masing 56,9% dan 19,2%.
Kata Kunci: bakteri keratinolitik, feses ular, indeks keratinolitik, limbah keratin, Python sp.
ISOLATION AND ASSAY OF POTENTIAL OF KERATINOLYTIC BACTERIA FROM SNAKE FECES (Python sp.) TO DEGRADE KERATIN
WASTE
ABSTRACT
Snake like Python sp. can eat bird including its whole feather and excrete feces with no feather left. It has been assumed that there are keratinolytic bacteria in the intestine of snake. In this study an isolation and an assay of potential of keratinolytic bacteria from feces of Python sp. has been conducted. A total of 10 bacteria were isolated and tested for their abilities to produce keratinase on feather meal agar. Two isolates, FU7 and FU10, were selected based on keratinolytic index for further study. Their abilities to degrade keratin were assayed in liquid medium containing chicken feather and goat hair as carbon and nitrogen source for 25 days of incubation. The result showed that FU7 degraded chicken feather and goat hair by 62,5% and 35,9%, respectively, while FU10 degraded both substrates by 56,9% and 19,2%, respectively.
Keywords: keratinolytic bacteria, keratinolytic index, keratin waste, Python sp., snake feces.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Di Indonesia, industri perunggasan semakin berkembang, dengan demikian akan semakin banyak limbah dari perunggasan yang harus dibuang. Salah satu bentuk limbah tersebut adalah bulu ayam. Kesediaan limbah bulu ayam ini cukup melimpah, diketahui bahwa populasi ayam pedaging di Indonesia pada tahun 2008 mencapai 1.076 juta ekor (BPS, 2008). Hasil pemotongan setiap ekor ternak unggas akan diperoleh bulu sebanyak ±6% dari bobot hidup.
Limbah bulu ayam merupakan limbah yang perlu penanganan khusus karena menimbulkan dampak terhadap pencemaran lingkungan. Bulu ayam mengandung protein sebesar 70-80% terutama disusun oleh keratin. Keratin merupakan suatu protein yang tidak larut, sangat stabil dan sulit terdegradasi karena tingginya ikatan disulfida, ikatan hidrogen dan interaksi hidrofobik antar polipeptida sehingga memberikan kekuatan mekanik dan resistensi terhadap beberapa protease (Rahayu, 2010).
2
Keratinase yang diisolasi dari B. licheniformis cukup stabil disimpan dalam suhu rendah. Selain Bacillus, mikroorganisme pemecah keratin yang telah diidentifikasi antara lain, Streptomyces sp. (Bockle & Muller, 1997), Fervidobacterium pennavorans (Friedrich & Antranikian, 1996) dan beberapa parasit kulit (Hanel et
al., 1991). Streptomyces diketahui mampu menghasilkan keratinase yang sangat aktif bila dibandingkan dengan keratinase dari mikroba lainnya. Salah satu spesies yang digunakan adalah Streptomyces pactum DSM 40530. Streptomyces memulai aktivitas proteolitiknya dengan proses denaturasi (reduksi) jembatan disulfida. Enzim yang dihasilkan mampu mendegradasi keratin dari bulu unggas (Bockle & Muller, 1997).
Salah satu alternatif yang dapat dikembangkan untuk meminimalisasi dampak limbah bulu ayam di lingkungan yaitu dengan mencari sumber baru mikroba yang dapat mendegradasi keratin pada bulu ayam misalnya pada feses ular sanca (Python sp.). Feses hewan kaya senyawa organik yang dapat dimanfaatkan untuk isolasi lebih banyak mikroorganisme yang memiliki karakteristik berbeda di lingkungan (Yue et al., 2011). Ular sering memburu mangsanya yang berukuran lebih besar dari mulutnya. Hewan ini mampu menelannya secara utuh karena mereka dapat menggerakkan kedua rahangnya, rahang atas dan rahang bawah, sehingga memungkinkan mulut mereka terbuka lebar. Tubuhnya juga memiliki fleksibilitas untuk menelan mangsanya yang besar. Hewan ini juga memiliki kemampuan untuk memperluas batang tenggorokan atau glottis, sehingga pernapasannya tidak terganggu ketika menelan mangsa (Christoffel et al., 1989).
1.2 Permasalahan
3
didegradasi. Oleh karena itu, diduga bahwa pada feses ular terdapat mikroba keratinolitik yang dapat mendegradasi keratin pada bulu ayam.
1.3 Tujuan Penelitian
a. Untuk mendapatkan dan mengetahui karakter isolat bakteri keratinolitik dari feses ular sanca.
b. Untuk mengetahui potensi bakteri keratinolitik dalam mendegradasi limbah keratin.
1.4 Manfaat
BAB 2
TINJAUAN PUSTAKA
2.1 Ular Sanca (Python sp.)
Ular adalah reptilia yang kehilangan apendiks, sternum, kelopak mata, telinga luar dan kandung kemih. Ular memiliki tengkorak yang lemah, karena bagian-bagian tulangnya dapat bergerak satu sama lain. Gigi tumbuh pada rahang dari tulang langit-langit mulut. Posisi gigi-gigi itu mengarah ke belakang untuk menahan mangsanya. Ular tidak mengunyah atau merobek mangsanya, tetapi menelannya secara utuh. Mangsanya mungkin lebih besar dari penampang tubuhnya. Hal ini mungkin karena: (a) Pertautan ujung dua mandibula oleh ligamentum yang elastis. (b) Tulang kuadrat bebas dari tulang kepala dan mandibula. (c) Tulang langit-langit bergerak bebas. Karena hal tersebut, mulut dapat terbuka lebar. Penelanan mangsa dibantu oleh gigi-gigi yang mengarah ke belakang. (d) Tidak ada tulang dada (sternum) dan rusuk-rusuk bebas, sehingga dada dapat dilatasi. (e) Kulit lunak dan elastis. (f) Esofagus dan lambung dapat melebar (Brotowidjoyo, 1989).
Pythonidae merupakan salah satu keluarga ular yang mencakup ular besar seperti ular sanca batik (Python reticulatus) dan ular sanca bodo (Python molurus). Satwa buruan ular sanca sangat bervariasi dari mamalia dan
unggas/aves. Berbeda dengan ular-ular yang mampu membunuh mangsanya dengan bisa, ular sanca membelit untuk melumpuhkan mangsanya (Matswapati, 2009). Feses yang dikeluarkan oleh ular memiliki ciri diantaranya, bentuk bolus utuh memanjang, mengandung rambut/bulu dan tulang dimana kondisi tulang berupa pasta karena tercerna oleh enzim pencernaan yang kuat dan bau pada feses menyengat (Raharyono & Paripurno, 2001).
2.2 Bulu Ayam
80-5
90%, sehingga berpotensi sebagai pakan alternatif sumber protein hewani. Kendala yang paling umum ditemui dalam penggunaan bulu ayam sebagai pakanadalah adanya ikatan keratin yaitu sejenis protein berserat yang bersifat sukar larut dalam air dan sulit dicerna, dimana kandungan keratin dalam TBA adalah 85-90% dari kandungan proteinnya (Sonjaya, 2001).
Sekarang ini, penggunaan mikroorganisme merupakan salah satu metode alternatif untuk meningkatkan nilai nutrisi dari bulu ayam. Limbah bulu ayam dimanfaatkan sebagai bahan dasar suplemen protein makanan untuk hewan. Sebelum digunakan, limbah bulu ayam ini direbus terlebih dahulu atau dapat ditambahkan dengan campuran bahan-bahan kimia untuk memudahkan daya cerna hewan, tapi proses pembuatannya membutuhkan perlakuan dan energi yang signifikan (Kim et al., 2001). Proses-proses ini selain membutuhkan energi yang cukup besar, juga merusak sejumlah asam amino yang terkandung di dalamnya (Panuju, 2003).
Komponen utama pada bulu adalah protein keratin. Adanya ikatan silang yang terbelit dalam bentuk heliks dan saling berhubungan melalui ikatan disulfida, ikatan hidrogen dan interaksi hidrofobik, menyebabkan keratin sangat stabil, tidak larut dalam air, tahan terhadap asam atau basa kuat dan tahan terhadap enzim proteolitik yang disekresikan oleh kelenjar pencernaan (Lin et al., 1992). Kandungan asam amino tepung bulu ayam sangat mirip dengan kandungan asam amino pada keratin, seperti jumlah asam amino serin, arginin dan prolin. Keratin pada bulu ayam mengandung beberapa nutrisi yang terdiri atas 81% protein kasar, 7% lemak kasar, 1% serat kasar, 0,33% kalsium dan 0,55% posfor. Tingginya kandungan nutrisi pada bulu ayam dianggap sebagai kandungan makanan yang baik bagi ternak (Lintang, 2003).
2.3 Keratinase
6
adalah ikatan hidrogen yang terdapat di antara gugus R residu asam amino rantai samping yang berdekatan, ikatan ion di antara gugus R yang berlawanan, interaksi hidrofobik dari gugus R asam amino hidrofobik dan ikatan kovalen berupa ikatan disulfida dari residu sistin (Copeland, 2000).
Seperti umumnya enzim-enzim ekstraseluler, produksi keratinase akan terhambat apabila asam amino dan peptida sederhana cukup tersedia dalam media. Enzim ekstraseluler akan aktif di luar sel, ketika keluar dari sel, aktivitasnya akan meningkat tajam, kemudian akan menurun karena enzim akan rusak di luar sel. Keratinase termasuk enzim protease yang merupakan enzim ekstraseluler. Enzim ekstraseluler adalah enzim yang dihasilkan di dalam sel tetapi dikeluarkan ke dalam media untuk menghidrolisis dan mendegradasi komponen kompleks menjadi senyawa sederhana yang mudah larut dan diserap oleh mikroorganisme (Winarno, 1983).
Keratinase yang berasal dari mikroba seluruhnya merupakan enzim ekstraseluler dan kebanyakan tergolong protease serin (Friedrich & Antranikian, 1996). Degradasi keratin menjadi molekul yang lebih sederhana merupakan proses yang kompleks dan memerlukan kerja sinergis enzim-enzim keratinolitik. Menurut Bockle & Muller (1997), keratin memiliki struktur yang kaku dan sulit dicerna oleh protease hewan dan manusia. Hal ini disebabkan karena adanya ikatan silang yang intensif dari jembatan sistin, dimana sistein merupakan asam amino penyusun keratin.
7
bulu dalam industri penyamakan kulit, sehingga dapat menggantikan peran natrium sulfida yang beracun dan berpolusi bagi lingkungan (Rahayu, 2010).
Banyak faktor-faktor eksternal yang berpengaruh dalam produksi enzim. Faktor-faktor ini diantaranya variasi pH, suhu, waktu inkubasi dan konsentrasi substrat. Suhu memiliki peran yang sangat penting dalam produksi enzim. Suhu yang lebih tinggi pada umumnya menghasilkan produksi enzim yang tinggi (Pandian et al., 2012). Beberapa spesies bakteri menghasilkan keratinase termostabil dengan aktivitas optimal pada kisaran suhu 60–80oC. Keratinase pada umumnya memiliki aktivitas optimal pada pH netral hingga alkali (pH 7.0 – 12). Berat molekul keratinase yang dihasilkan mikroba sangat bervariasi, berkisar dari 30 kDa hingga lebih dari 200 kDa. Substrat yang banyak digunakan dalam berbagai pengujian keratinase adalah tepung bulu ayam dan bulu sapi dengan konsentrasi berkisar 0.1–10% (Rahayu, 2010). Menurut Kim et al. (2001), aktivitas keratinase dapat dideteksi dengan memakai kultur supernatan yang diendapkan amonium sulfat. Enzim ini melakukan aktivitas hidrolitik terhadap bulu secara optimal pada suhu 45°C dengan pH 8,5.
Bagi mikroorganisme keratinolitik, keratin yang mengandung banyak asam amino sistin dimanfaatkan sebagai sumber sulfur, karbon dan nitrogen. Kelebihan sulfur akan dikurangi dengan cara dioksidasi menjadi sulfat inorganik dan disekresikan ke dalam medium pertumbuhan. Melalui cara tersebut sebanyak lebih dari 90% sulfur organik diubah menjadi sulfat. Kadar sistin dalam rambut/bulu beberapa spesies makhluk hidup di alam menentukan tingkat kesulitan degradasi rambut/bulu oleh mikroba (Kunert, 2000).
2.4 Degradasi Keratin
8
pengurangan ikatan disulfida dengan larutan natrium sulfida (Na2S). Teknik ini efektif untuk mengekstraksi keratin 75% (Kock, 2006).
Banyaknya ikatan disulfida pada struktur keratin tampaknya menstimulasi sel untuk mensekresikan enzim disulfida reduktase sebagai proses awal membuka struktur keratin. Terbukanya struktur keratin menyebabkan keratinase lebih mudah mengakses peptida target pada molekul keratin dan menyempurnakan proses degradasi sehingga nutrisi keratin dapat dimanfaatkan oleh sel. Kandungan sistein pada keratin berkisar antara 11–20% dan tidak dimiliki oleh jenis protein lainnya. Jembatan sistein adalah struktur penting keratin dan merupakan penghambat kerja enzim proteolitik dalam memecah keratin. Berdasarkan strukturnya, maka degradasi lengkap keratin memerlukan enzim keratinase dan disulfida reduktase atau senyawa pereduksi. Keratinase akan memotong ikatan peptida keratin sedangkan disulfida reduktase atau senyawa pereduksi akan mengurai ikatan disulfida pada residu sistin (Rahayu, 2010).
Biodegradasi keratin oleh mikroorganisme yang memiliki aktivitas keratinolitik merupakan metode alternatif yang dapat digunakan untuk meningkatkan nilai limbah keratin pada bulu ayam. Struktur protein keratin dapat didegradasi oleh keratinase yang dihasilkan oleh mikroorganisme. Aplikasi keratinase tidak hanya terbatas untuk mengatasi masalah limbah, namun keratinase juga dipakai pada industri tekstil, pakan ternak, farmasi, kosmetik dan industri kulit (Panuju, 2003). Protease keratinolitik yang tidak memiliki aktivitas kolagenase namun mempunyai cukup aktivitas elastase dapat membantu proses dehairing dengan memutus secara selektif jaringan keratin pada folikel kulit sehingga rambut akan terlepas tanpa memengaruhi kekuatan kulit (Macedo et al., 2005).
BAB 3
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini telah dilaksanakan pada bulan Juni 2014 sampai dengan Maret 2015 di Laboratorium Terpadu, Fakultas Kedokteran, Universitas Sumatera Utara, Medan.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah cawan petri, wadah sampel, Erlenmeyer, tabung reaksi, cling wrap, alumunium foil, spatula, timbangan digital, hot plate, mancis, bunsen, alu dan mortal, hockey stick, rak tabung, vortex, pipet
serologi, pro pipet, ose bengkok, ose lurus, oven, inkubator, kulkas, laminar, penangas air, botol, autoklaf, sentrifus dan spektrofotometer UV.
Sedangkan bahan yang digunakan adalah feses ular sanca (Python sp.), bulu ayam, aseton, akuades, alkohol, spiritus, kapas, kertas cakram, skim milk, agar, KH2PO4, K2HPO4, MgSO4, NaCl, ekstrak yeast, Starch Agar (SA), Simon Citrat Agar (SCA), Triple Sugar Iron Agar (TSIA), Sulfit Indol Motility (SIM),
gelatin, iodin, pewarna kristal violet, safranin dan rambut kambing.
3.3 Isolasi Bakteri dari Feses Ular Sanca
Sampel feses ular sanca diambil dari Penangkaran Buaya Asam Kumbang, Sunggal, Medan. Sampel kering dimasukkan ke dalam wadah sampel. Selanjutnya sampel dibawa ke Laboratorium Terpadu FK USU untuk diisolasi.
Untuk isolasi bakteri dari feses ular disiapkan dua Erlenmeyer. Media skim milk agar (SMA) dibuat dengan menggunakan metode Widhyastuti & Dewi
10
penangas air selama 30 menit pada suhu 63°C. Media agar yang sudah steril dicampur dengan media skim milk. Sebanyak 1 g feses dilarutkan dalam 10 ml akuades. Sampel diencerkan hingga 10¯12, lalu diinokulasikan 0,1 ml suspensi bakteri ke media SMA dan disebar. Kultur diinkubasi pada suhu 30°C selama 24-48 jam dan diamati zona beningnya (Lampiran 2 hal. 30). Koloni yang membentuk zona bening diamati dan dikarakterisasi bentuk, tepi, elevasi, warna koloni dan berdasarkan pewarnaan sifat gram serta dilakukan uji biokimia seperti uji pati, uji sitrat, uji gelatin, uji motilitas, uji sulfida dan uji katalase (Lampiran 3 hal. 31). Isolat murni disimpan pada media SMA miring sebagai stok kultur.
3.4 Uji Aktivitas Proteolitik Isolat Secara Kualitatif
Sebanyak 10 μl suspensi bakteri dengan OD600=0,5 dipipet di atas kertas cakram steril dan kemudian diletakkan di permukaan media SMA. Kultur diinkubasi pada suhu 30°C selama 3 hari dan setiap harinya diukur besar diameter zona bening yang terbentuk. Zona hidrolisis protein secara kualitatif diukur dengan membandingkan diameter zona bening dengan diameter koloni bakteri (Lampiran 4 hal. 32).
3.5 Pertumbuhan Isolat Pada Media Feather Meal Agar
Bulu ayam yang telah direndam selama 1 malam dengan aseton kemudian dikeringkan. Bulu ayam ditumbuk halus hingga teksturnya menjadi bubuk. Media feather meal agar (FMA) dibuat dengan menggunakan metode Agrahari &
11
3.6 Uji Aktivitas Keratinolitik Secara Kualitatif
Sebanyak 10 μl suspensi bakteri dengan OD600=0,5 dipipet di atas kertas cakram steril dan kemudian diletakkan di permukaan media FMA. Kultur diinkubasi pada suhu 30°C selama 1 minggu dan setiap harinya diukur besar diameter zona bening yang terbentuk. Zona hidrolisis protein secara kualitatif diukur dengan membandingkan diameter zona bening dengan diameter koloni bakteri (Lampiran 5 hal. 33).
3.7 Pengukuran Potensi Bakteri Keratinolitik
Pengukuran potensi bakteri keratinolitik dalam mendegradasi limbah keratin dilakukan pada media cair yang dibuat dengan menggunakan metode Matikeviciene et al. (2009) yang telah dimodifikasi (Lampiran 9 hal. 37), yang mengandung NaCl 0,25 g, K2HPO4 0,7 g, KH2PO4 0,35 g, MgSO4 0,05 g dan yeast ekstrak 0,5 g dalam 500 ml akuades. Media cair sebanyak 45 ml dimasukkan ke dalam botol berukuran sedang yang berisi limbah keratin sebanyak 0,5 g kemudian disterilisasi. Limbah keratin yang digunakan adalah bulu ayam dan rambut kambing. Isolat bakteri keratinolitik yang digunakan merupakan dua isolat bakteri yang memiliki indeks keratinolitik terbesar. Suspensi bakteri sebanyak 5 ml diinokulasikan ke dalam media cair yang sudah disterilkan dan kontrol disiapkan dengan perlakuan yang sama tanpa penambahan isolat. Kultur diinkubasi selama 25 hari pada suhu 30°C dan setiap harinya diguncang. Setelah 25 hari inkubasi, kultur disaring dengan kertas saring dan dikeringkan selama 24 jam (Lampiran 6 hal. 34). Potensi bakteri keratinolitik dalam mendegradasi keratin dievaluasi dengan menimbang bobot kering limbah keratin sisa degradasi (hari ke-25) dengan bobot kering limbah keratin awal (hari ke-0), dengan menggunakan rumus persentase penurunan berat kering sampel sebagai berikut:
%Penurunan berat kering Bk awal – Bk akhirBk awal X %
12
Pertumbuhan bakteri selama inkubasi diukur dengan metode Total Plate Count (TPC) pada hari inkubasi ke-0, 10 dan 25, dengan dilakukan pengulangan
sebanyak 2 kali untuk setiap perlakuan isolat bakteri (Lampiran 8 hal. 36). Untuk perhitungan estimasi jumlah el dapat dihituns g dengan umus: r
BAB 4
HASIL DAN PEMBAHASAN
4.1Karakteristik Isolat Bakteri dari Feses Ular Sanca (Python sp.)
Bakteri diisolasi dari feses ular sanca dan ditumbuhkan pada media SMA pada suhu 30°C selama 24-48 jam. Dari hasil isolasi, diperoleh 10 bakteri yang berbeda dari segi bentuk, tepi, elevasi, warna koloni dan sifat gram. Selanjutnya, isolat yang berbeda dipisahkan dengan menggunakan metode gores sehingga diperoleh koloni murni untuk keperluan karakterisasi, seperti yang disajikan pada Tabel 1. Tabel 1. Karakteristik Morfologi dan Pewarnaan Sifat Gram Bakteri dari Feses
Ular Sanca Kode
Isolat
Morfologi Koloni Sifat
Gram
Bentuk Tepi Elevasi Warna
FU1 Rizoid Berlekuk Rata Putih +
FU2 Rizoid Bergelombang Cembung Putih +
FU3 Rizoid Berlekuk Cembung Putih +
FU4 Tidak Beraturan Bergelombang Cembung Putih +
FU5 Tidak Beraturan Berlekuk Cembung Putih Kekuningan +
FU6 Rizoid Berlekuk Cembung Putih +
FU7 Bulat Bergelombang Cembung Putih Kekuningan +
FU8 Tidak Beraturan Berlekuk Cembung Putih +
FU9 Rizoid Berlekuk Rata Putih +
FU10 Bulat Bergelombang Berlekuk Putih Kekuningan +
Keterangan: FU= Feses Ular
14
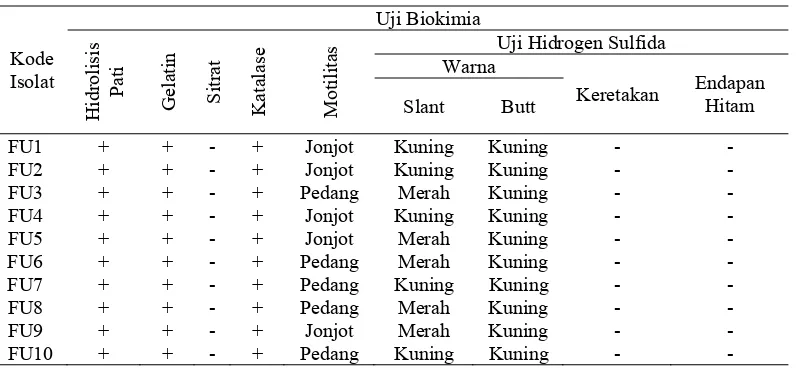
Hasil uji biokimia menunjukkan karakteristik yang berbeda-beda pada setiap isolat bakteri. Hasil karakterisasi biokimia bakteri dari feses ular sanca dapat dilihat pada Tabel 2 dan Lampiran 13 (hal. 41).
Tabel 2. Hasil Uji Biokimia Bakteri dari Feses Ular Sanca
Kode
Gelatin Sitrat Katalase Mo
tilitas Warna
Uji hidrolisis pati dilakukan untuk mengetahui adanya enzim amilase yang berfungsi untuk memecah pati menjadi komponen yang lebih sederhana. Bila zat pati dihidrolisis oleh eksoenzim amilase, maka senyawa tersebut akan diuraikan menjadi maltosa dan glukosa. Zat pati yang bereaksi secara kimia dengan iodine ditandai dengan terbentuknya warna biru kehitaman. Proses iodinisasi zat pati menghasilkan molekul yang dapat mengabsorbsi semua cahaya, terkecuali warna biru. Tidak terbentuknya warna biru sewaktu penambahan larutan iodine ke dalam media merupakan petunjuk adanya hidrolisis zat pati. Hasil uji hidrolisis pati menunjukkan bahwa seluruh isolat bakteri dapat menguraikan zat pati. Hal tersebut ditandai dengan terbentuknya zona bening di sekeliling koloni bakteri sewaktu penambahan larutan iodine ke dalam media. Hasil uji gelatinase dengan media gelatin agar memperlihatkan 10 isolat dapat menghidrolisis gelatin. Hal ini tampak dari bentuk media gelatin yang sudah diinokulasi dan diinkubasi sesudah itu disimpan di kulkas selama 30 menit ternyata tetap cair (Cappuccino & Sherman, 1983).
15
N. Bila mikroorganisme mampu menggunakan sitrat, asam akan dihilangkan dari media, sehingga menyebabkan peningkatan pH dan mengubah warna media dari hijau menjadi biru. Dari hasil uji, diperoleh data bahwa seluruh isolat tidak mampu menggunakan sitrat sebagai sumber energi.
Uji katalase digunakan untuk mengetahui adanya enzim katalase pada isolat bakteri. Hasil uji katalase menunjukkan bahwa seluruh isolat bakteri memiliki enzim katalase. Hal ini tampak pada gelembung-gelembung gas yang dihasilkan di atas object glass yang sebelumnya telah diinokulasikan isolat bakteri kemudian ditetesi dengan reagen katalase. Gelembung-gelembung gas tersebut berasal dari hidrogen peroksida yang terurai menjadi air dan oksigen oleh aktivitas enzim katalase yang dimiliki oleh semua isolat bakteri.
Hasil dari pengujian motilitas bakteri menunjukkan bahwa semua isolat bakteri bersifat motil. Sifat motil dapat dilihat dari pertumbuhannya yang menyebar sepanjang tusukan pada media SIM. Pada uji hidrogen sulfida semua isolat memperlihatkan hasil positif, reaksi positif pada uji hidrogen sulfida ditandai dengan terjadinya perubahan warna merah menjadi kuning pada bagian slant dan butt media. Perubahan warna ini terjadi karena kemampuan bakteri dalam memfermentasi molekul gula yang terdapat dalam media (Cappuccino & Sherman, 1983).
Dari hasil pengamatan morfologi dan uji biokimia diduga isolat FU7 dan FU10 mendekati ciri-ciri bakteri Bacillus. Koloni Bacillus sp. memiliki karakteristik umum yaitu memiliki warna krem keputihan serta dapat berbentuk bulat dan tidak beraturan pada masa inkubasi 24-48 jam. Bacillus sp. tergolong bakteri gram positif pada kultur muda. Genus Bacillus sp. bersifat motil, bersifat aerob (beberapa spesies bersifat anaerob fakultatif), katalase positif. Tiap spesies berbeda dalam penggunaan gula, sebagian melakukan fermentasi dan sebagian tidak (Corbin, 2004).
16
FU1, FU2, FU3, FU6 dan FU9 memiliki ciri mendekati bakteri Actinomycetes. Actinomycetes termasuk bakteri gram positif yang bersifat aerobik, oksidatif dan mampu tumbuh pada berbagai suhu (4-45°C). Bakteri ini mempunyai kemampuan dalam memanfaatkan senyawa karbon (glukosa, fruktosa, maltosa dan sukrosa), nitrogen (histidin, prolin dan sistein), mendegradasi makromolekul (gelatin, pati) dan hidup pada kadar garam cukup tinggi (Goto, 1992).
4.2 Aktivitas Proteolitik Secara Kualitatif
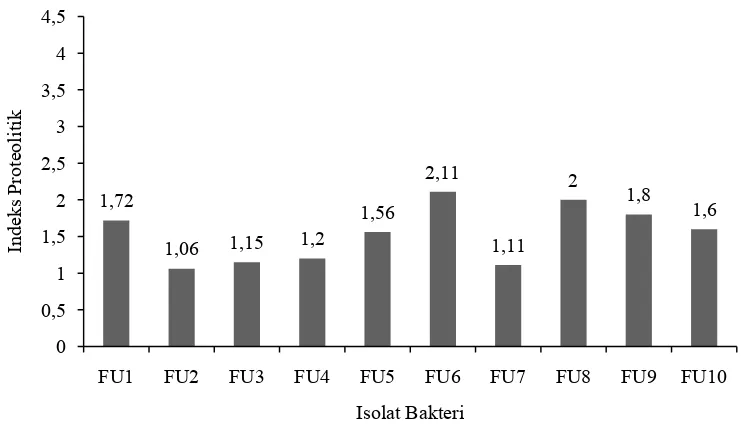
Aktivitas hidrolisis secara kualitatif merupakan gambaran dari kemampuan bakteri proteolitik membentuk zona bening di sekitar isolat yang ditumbuhkan dalam media SMA. Hasil aktivitas proteolitik secara kualitatif dapat dilihat pada Gambar1.
FU1 FU2 FU3 FU4 FU5 FU6 FU7 FU8 FU9 FU10
In
17
terbentuk akan semakin besar dan menandakan aktivitas enzim yang terjadi juga besar. Pada penelitian Panuju (2003), ditemukan 25 isolat proteolitik dari sumber air Pemandian Air Panas Cimanggu Ciwidey, Bandung yang diisolasi pada media SMA yang mengandung 2% susu skim. Isolat dengan indeks proteolitik terbesar adalah CW 3-16 dengan IP sebesar 3,60.
Susu skim digunakan sebagai sumber substrat. Susu skim mengandung kasein sebagai protein susu dimana akan dihidrolisis oleh mikroorganisme proteolitik menjadi peptida dan asam amino yang larut sehingga pada koloni dikelilingi zona bening, menunjukkan mikroba tersebut mempunyai aktivitas proteolitik. Zona bening yang terbentuk di sekitar koloni bakteri merupakan tanda hilangnya partikel kasein di media skim milk agar. Adanya bakteri proteolitik ekstraseluler, kasein akan terhidrolisis menjadi peptida-peptida dan asam amino yang larut (Fardiaz, 1992).
Bacillus sp. merupakan salah satu jenis bakteri yang memiliki kemampuan
untuk menghasilkan protease. Enzim ekstraseluler Bacillus sp. sangat efisien dalam memecah berbagai senyawa karbohidrat, lipid dan protein rantai panjang menjadi unit-unit rantai pendek atau senyawa-senyawa yang lebih sederhana. Setiap spesies bakteri memiliki batas toleransi tertentu terhadap parameter lingkungan tertentu. Fleksibilitas mikroba dalam beradaptasi pada lingkungan yang berbeda terlihat ekspresi genetik yang berubah (Baehaki, 2011).
4.3 Aktivitas Keratinolitik Secara Kualitatif
18
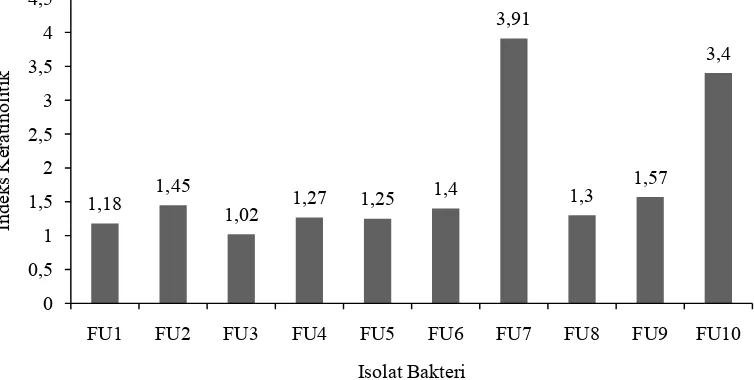
membandingkan besar zona bening di sekitar koloni dengan besar diameter koloni. Hasil aktivitas keratinolitik secara kualitatif dapat dilihat pada Gambar 2.
1,18 1,45
FU1 FU2 FU3 FU4 FU5 FU6 FU7 FU8 FU9 FU10
In
Gambar 2. Indeks Keratinolitik Isolat Bakteri Keratinolitik secara Kualitatif
Indeks keratinolitik isolat bakteri yang berasal dari feses ular sanca bervariasi antara 1,02-3,91. Isolat yang memiliki indeks keratinolitik yang terbesar adalah FU7 yaitu sebesar 3,91 dan FU10 yang memiliki indeks keratinolitik sebesar 3,4. Isolat yang memiliki indeks keratinolitik terkecil adalah FU3 dengan indeks keratinolitik sebesar 1,02. Data selengkapnya dapat dilihat pada Lampiran 11 (hal. 39). Adanya perbedaan nilai indeks keratinolitik, memungkinkan bakteri memiliki aktivitas enzim dan sifat fisiologi yang berbeda dari masing-masing isolat.
Terbentuknya zona bening di sekitar koloni mikroorganisme pada medium padat yang mengandung keratin disebabkan oleh mikroorganisme yang menghasilkan keratinase. Keratinase disekresikan pada medium kemudian menghidrolisis substrat keratin sehingga menyebabkan medium di sekitar koloni kelihatan bening (Friedrich et al., 1999). Dari penelitian Yue et al. (2011), bakteri Bacillus sp. 50-3 yang diisolasi dari feses kadal Calotes versicolor mampu membentuk diameter zona bening sekitar 6 kali lipat lebih besar dari diameter koloni pada media FMA.
19
memiliki aktivitas maksimum pada suhu tertentu, aktivitas enzim akan semakin meningkat sejalan dengan bertambahnya suhu sampai suhu optimum tercapai. Peningkatan suhu akan mempengaruhi perubahan konformasi substrat sehinggasisi aktif substrat mengalami hambatan untuk memasuki sisi aktif enzim dan menyebabkan turunnya aktivitas enzim (Baehaki et al., 2011).
4.4 Potensi Bakteri Keratinolitik dari Feses Ular Sanca (Python sp.)
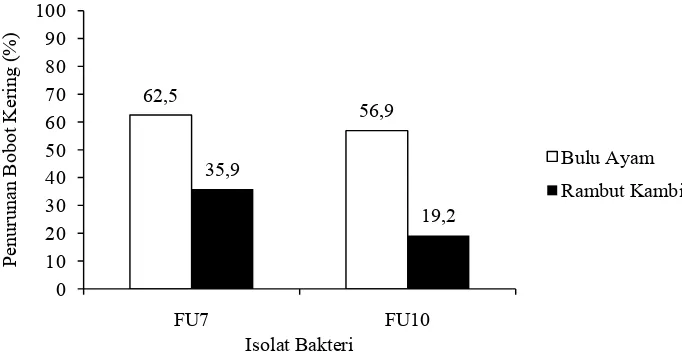
Hasil kemampuan aktivitas keratinolitik didapatkan 2 isolat yang memiliki indeks keratinolitik paling besar yaitu FU7 dan FU10. Selanjutnya isolat diuji kemampuannya dalam mendegradasi limbah keratin. Uji degradasi keratin dilakukan pada media cair dengan penambahan limbah keratin (bulu ayam dan rambut kambing). Kultur diinkubasi selama 25 hari pada suhu 30°C. Pada hari terakhir inkubasi, kultur disaring dengan kertas saring dan dikeringkan pada suhu 45°C selama 24 jam. Setelah kultur disaring dan dikeringkan, didapatkan hasil bobot kering dalam bentuk persentase yang dapat dilihat pada Gambar 3.
62,5
Gambar 3. Degradasi Limbah Keratin setelah 25 hari
20
degradasi keratin. Kadar sistin bulu ayam berkisar 7,63%, sedangkan pada rambut kambing sebesar 9,5% (Wilson & Lewis, 2008).
Mekanisme degradasi keratin diduga diawali oleh enzim disulfida reduktase yang beraksi pada ikatan disulfida yang berfungsi menjaga kestabilan mekanik keratin. Proses tersebut memudahkan keratinase untuk melanjutkan proses degradasi bulu (Rahayu, 2010). Berdasarkan tingkat kemudahan hidrolisis, keratin digolongkan menjadi soft keratin dan hard keratin. Kuku, sisik, bulu, atau wool lebih mudah dihidrolisis dibanding rambut manusia, kemudahan tersebut berkaitan dengan kandungan sistinnya (Kunert, 2000). Kandungan sistin pada keratin berkisar antara 11-20% dan tidak dimiliki oleh jenis protein lainnya. Jembatan sistin merupakan struktur penting keratin yang dapat menghambat kerja enzim proteolitik dalam memecah keratin sehingga diperlukan keratinase untuk memotong ikatan peptida keratin dan mengurai ikatan disulfida pada residu sistin (Presland et al., 1989). Proses keratinolitik memberikan efek langsung berupa dihasilkannya protein, lipid, asam amino terlarut serta residu gugus thiol dari sistein (Wojeiech & Anna, 2010).
Pada penelitian yang dilakukan oleh Yue et al. (2011) diperoleh isolat bakteri keratinolitik Bacillus sp. 50-3 dari feses kadal Calotes versicolor yang dapat mendegradasi bulu ayam utuh sebagai sumber karbon dan nitrogen setelah 36 jam diinkubasi pada suhu 37°C. Bakteri ini memiliki aktivitas keratinase yang relatif tinggi sebesar 680±25 U/ml. Pada hasil pengamatan uji in vitro untuk aktivitas keratinase yang dilakukan oleh Megiandari (2009) menunjukkan tidak adanya perubahan atau lisis dari tepung bulu ayam sebagai substrat dengan berbagai konsentrasi yang ditambahkan ekstrak kasar enzim lapisan mukosa usus biawak air (Varanus salvator). Hal ini menandakan tidak ditemukan adanya suatu aktivitas enzim keratinase.
21
penghasil enzim keratinase. Enzim tersebut akan memutuskan ikatan disulfida pada protein keratin. Keratin merupakan protein yang terdapat pada bulu, rambut, kulit, kuku, tanduk, sisik dan berbagai bagian tubuh makhluk hidup lainnya yang bersifat tidak larut dalam air (insoluble). Keratinase merupakan enzim yang dapat melarutkan keratin dengan memutus ikatan disulfidanya.
Laju dan kesempurnaan degradasi keratin oleh mikroorganisme sangat bergantung pada jenis substratnya dan hal ini erat berkaitan dengan kandungan sistin. Substrat yang sering digunakan untuk mempelajari aktivitas hidrolisis keratinase adalah bulu ayam (Riffel et al., 2003, Werlang & Brandelli, 2005), rambut manusia (Macedo et al., 2005), bulu sapi dan wool (Huang et al., 2003).
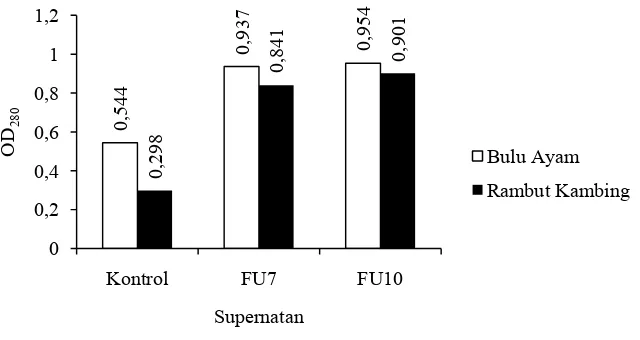
Untuk melihat peptida atau asam amino terlarut, dilakukan pengukuran nilai optical density (OD) pertumbuhan bakteri pada hari ke-25 menggunakan spektrofotometer UV dengan panjang gelombang 280 nm. Hasil pengukuran OD dapat dilihat pada Gambar 4.
0,544
22
banyak cahaya yang diserap sampel (absorbansi tinggi), maka konsentrasi protein terlarut semakin besar.
Kebanyakan protein mengabsorbsi cahaya ultraviolet maksimum pada 280 nm. Panjang gelombang 280 nm merupakan panjang gelombang yang memiliki afinitas kuat dengan asam amino yang memiliki cincin aromatik seperti sistin, triptofan dan tirosin (Layne, 1957). Hal ini terutama untuk mengidentifikasi adanya asam amino, seperti tirosin, triptofan dan fenilalanin yang mempunyai gugus aromatik. Asam amino tersebut merupakan asam amino yang dihasilkan dari pemecahan protein keratin. Triptofan mempunyai absorbsi maksimum pada 280 nm, sedangkan untuk tirosin mempunyai absorbsi maksimum pada 278 nm. Fenilalanin menyerap sinar kurang kuat dan pada panjang gelombang lebih pendek (Tiwary & Gupta, 2012).
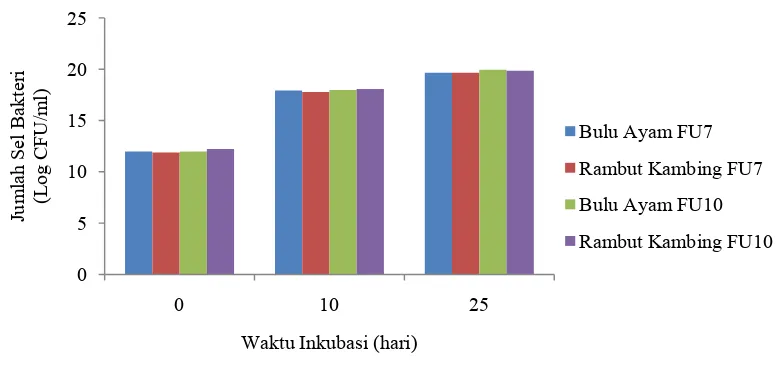
Pengukuran pertumbuhan bakteri selama inkubasi dilakukan pada hari ke-0, 10 dan 25. Berdasarkan pengamatan, pola pertumbuhan meningkat seiring dengan jumlah hari inkubasi. Hasil pengukuran pertumbuhan isolat bakteri dapat dilihat pada Gambar 5.
0
Gambar 5. Pertumbuhan FU7 dan FU10 selama Inkubasi
23
sebanyak 19,66 Log CFU/ml, sedangkan jumlah populasi awal bakteri FU7 pada rambut kambing sebanyak 11,88 Log CFU/ml, pada hari ke-10 menjadi 17,79 Log CFU/ml dan pada hari ke-25 sebanyak 19,65 Log CFU/ml. Data selengkapnya dapat dilihat pada Lampiran 12 (hal. 40). Pertumbuhan jumlah masing-masing isolat berbeda satu sama lain dimungkinkan oleh perbedaan fase pertumbuhannya sehingga mempengaruhi jumlah populasi bakteri.
Menurut Wojeiech & Anna (2010), produksi enzim keratinase maksimal bergantung pada faktor lingkungan seperti suhu, suplemen media, konsentrasi substrat keratin dan waktu inkubasi. Waktu inkubasi merupakan waktu yang dibutuhkan enzim keratinase untuk memecah protein keratin menjadi protein yang larut (soluble protein). Namun, biosintesis enzim proteolitik dan keratinolitik oleh bakteri umumnya berada pada akhir fase eksponensial atau awal fase stasioner.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian tentang isolasi dan potensi bakteri keratinolitik dari feses ular sanca (Python sp.) dalam mendegradasi limbah keratin disimpulkan bahwa isolat FU7 memiliki kemampuan degradasi limbah keratin lebih tinggi daripada isolat FU10. Isolat FU7 mampu mendegradasi bulu ayam sebesar 62,5% dan rambut kambing 35,9%, sedangkan kemampuan FU10 dalam mendegradasi bulu ayam dan rambut kambing berturut-turut sebesar 56,9% dan 19,2%.
5.2Saran
DAFTAR PUSTAKA
Agrahari, S., Wadhwa, N. 2010. Degradation of Chicken Feather a Poultry Waste Product by Keratinolytic Bacteria Isolated from Dumping Site at Ghazipur Poultry Processing Plant. International Journal of Poultry Science. 9 (5): 482-489.
Asmi, A. 2011. Keanekaragaman dan Kepadatan Ular di Hutan Pendidikan dan Penelitian Biologi Universitas Andalas. Universitas Andalas. Padang.
Baehaki, A., Rinto, Arif, B. 2011. Isolasi dan Karakterisasi Protease dari Bakteri Tanah Rawa Indralaya. Jurnal Teknologi dan Industri Pangan. 22 (1): 10-16.
Bockle, B., Muller, R. 1997. Reduction of Disulfide Bonds by Streptomyces pactumduring Growth on Chicken Feathers. Applied Environmental Microbiology. 63(2): 790–792.
Badan Pusat Statistik. 2008. Populasi Ternak 2000-2008. http://www.bps.go.id. Diakses: 23 Desember 2014.
Brotowidjoyo, M. 1989. Zoologi Dasar. Penerbit Erlangga. Yogyakarta.
Burtt, E.H., Ichida, J.M. 1999. Occurrence of Feather-Degrading Bacilli in the Plumage Birds. The Auk.116 (2): 364-372.
Cappuccino, J.G., Sherman, N. 1983. Microbiology a Laboratory Manual. Fourth Edition. Menlo Park: Addison-Wesley Publishing Company, Inc.
Cappuccino, J.G., Sherman, N. 2001. Microbiology a Laboratory Manual. Sixth Edition. Benjamin-Cummings Publishing Company. San Fransisco.
Christoffel, R., Edwards, J., Perry, B. 1989. Snakes and Lizards of Minnesota. Minnesota Department of Natural Resources. Minnesota.
Copeland, R.A. 2000. Enzyme: A Practical Introduction to Structure, Mechanism and Data Analysis. A John Wiley & Sons Inc Publication. New York.
Corbin, B.D. 2004. Identification and Characterization Bacillus thuringiensis. Journal of Bacteriology. 186: 7736-7744.
Crueger, W., Crueger, A. 1984. A Text Book of Industrial Microbiology. Ed. T.D. Brock, Sinauer Associates Inc. New York.
Desi, M. 2002. Aktivitas Keratinase Bacillus lincheniformis dalam Memecah Keratin Bulu Ayam. IPB. Bogor.
Fardiaz, S. 1992. Mikrobiologi Pangan 1. PT Gramedia Pustaka Utama. Jakarta. Floris, T.A.G., Slangen, J.K. 2007. Method for Producing a Low Reducing
Agent-Containing Keratin and Product Thereof. Patent Application Publication. United States.
26
Thermotogales. Applied and Environmental Microbiology. 62 (8): 2875-2877.
Friedrich, J. Gradisar, H., Mandin, D., Chaumont, J.P. 1999. Screening Fungi for Synthesis of Keratinolytic Enzymes. Letters in Applied Microbiology. 28 (2): 127-130.
Goto, M. 1992. Fundamental of Bacterial Plant Pathology. Academic Press. California.
Hanel, H., Kalisch, J., Keil, M., Marsch, W.C., Buslau, M. 1991. Quantification of Keratinolytic Activity from Dermatophilus congolensis. Medical Microbiology and Immunology. 180 (1): 45-51.
Harde, I.B., Bajaj, R.S., Singha. 2011. Optimization of Fermentative Production of Keratinase from Bacillus subtilis NCIM 2724. Agriculture and Food Bacteriology.
Hasan, M.A., Haroun, B.M., Amara, A.A., Serour, E.A. 2013. Production and Characterization of Keratinolytic Protease from New Wool-Degrading Bacillus Species Isolated from Egyptian Ecosystem. Biomed Research International.
Holt, J.G., Krieg, N.R., Sneath, P.H.A., Staley, J.T., Williams, S.T. 1994. Bergey’s Manual of Determinative Bacteriology 9th Edition. Williams and Wilkins Baltimore. USA.
Huang, Q., Peng, Y., Li, X., Wang, H., Zhang, Y. 2003. Purification and Characterization of an Extracellular Alkaline Serine Protease with Dehairing Function from Bacillus pumilus. Current Microbiology. 46 (3): 169-173.
Kim, J.M., Lim, W.J., Suh, H.J. 2001. Feather-Degrading Bacillus Species from Poultry Waste. Process Biochemistry. 37 (3): 287-291.
Kock, J.W. 2006. Physical and Mechanical Properties of Chicken Feather Materials. Georgia Institute of Technology. Georgia.
Kunert, J. 2000. Physiology of Keratinophilic Fungi. Revista Iberoamericana de Micologia. Bilbao: 66-85.
Layne, E. 1957. Spectrophotometric and Turbidimetric Methods for Measuring Proteins. Methods in Enzymology. 3: 447-455.
Lee, H., Suh, D.B., Hwang, J.H., Suh, H.J. 2002. Characterization of Keratinolytic Metalloprotease from Bacillus sp. SCB-3. Applied Biochemistry and Biotechnology. 97 (2): 123-133.
Lehninger, A.L. 2005. Dasar-Dasar Biokimia Jilid 1. Erlangga. Jakarta.
27
Lintang, R.A.J. 2003. Keratinase Pendegradasi Bulu Ayam dari Bakteri Termofilik L-23 Asal Sulawesi Utara. IPB. Bogor.
Macedo, A.J., Beys da Silva, W.O., Gava, R., Driemeier, D., Henriques, J.A.P., Termignoni, C. 2005. Novel Keratinase from Bacillus subtilis S14 Exhibiting Remarkable Dehairing Capabilities. Applied and Environmental Microbiology. 71 (1): 594-596.
Matikeviciene, V., Msiliuniene, D., Griskis, S. 2009. Degradation of Keratin Containing Wastes by Bacteria with Keratinolytic Activity. Rezeknes Augstskola.
Matswapati, D. 2009. Biologi Reproduksi Ular Sanca Batik (Python reticulatus). IPB. Bogor.
Megiandari, A. 2009. Isolasi dan Pencirian Enzim Protease Keratinolitik dari Usus Biawak Air. IPB. Bogor.
Pakpahan, R. 2009. Isolasi Bakteri dan Uji Aktivitas Protease Termofilik dari Sumber Air Panas Sipoholon Tapanuli Utara, Sumatera Utara. Universitas Sumatera Utara. Medan.
Pandian, S., Sundaram, J., Panchatcharam, P. 2012. Isolation, Identification and Characterization of Feather Degrading Bacteria. European Journal of Experimental Biology. 2 (1): 274-282.
Panuju, S. 2003. Isolasi Dan Pemilihan Mikroba Termofilik Penghasil Enzim Hidrolase. Bogor. IPB.
Parry, D.A., North, A.C. 1998. Hard α-Keratin Intermediate Filament Chains: Substructure of The N- and C-Terminal Domains and The Predicted Structure and Function of The C-Terminal Domains of Type I and Type II Chains. Journal of Structural Biology. 122 (1): 67-75.
Pissuwan, D., Suntornsuk, W. 2001. Production of Keratinase by Bacillus sp. FK 28 Isolated in Thailand. Kasetsart Journal. 35 (2): 171-178.
Presland, R.B., Gregg, K., Molloy, P.L., Morris, C.P., Crocker, L.A., Rogers, G.E. 1989. Avian Keratin Genes .I.A Molecular Analysis of the Structure and Expression of a Group of Feather Keratin Genes. Journal of Molecular Biological. 209: 549-559.
Raharyono. Paripurno, E.T. 2001. Berkawan Harimau Bersama Alam. KAPPALA Indonesia. Yogyakarta.
Rahayu, S. 2010. Mempelajari Aktivitas Keratinase dan Disulfida Reduktase dari Bacillus sp. Mts dalam Degradasi Keratin. IPB. Bogor.
Riffel, A., Lucas, F., Heeb, P., Brandelli, A. 2003. Characterization of New Keratinolytic Bacterium that Completely Degrades Native Feather Keratin. Archives of Microbiology. 179 (4): 258-265.
28
Takami, H., Nakamura, S., Aono, R., Horikoshi, K. 1992. Degradation of Human Hair by a Thermostable Alkaline Protease from Alkaliphilic Bacillus sp. No.AH-101. Bioscience, Biotechnology and Biochemistry. 56 (10): 1667-1669.
Tiwary, E., Gupta, R. 2012. Rapid Conversion of Chicken Feather to Feather Meal Using Dimeric Keratinase from Bacillus licheniformis ER-15. Journal of Bioprocessing and Biotechniques. 2 (4): 1-5.
Werlang, P.O., Brandelli, A. 2005. Characterization of a Novel Feather-Degrading Bacillus sp. Strain. Applied Biochemistry and Biotechnology. 120 (5): 71-80.
Widhyastuti, N., Dewi, R.M. 2001. Isolasi Bakteri Proteolitik dan Optimalisasi Produksi Protease. Puslit Biologi-LIPI. Bogor.
Wilson, R.H., Lewis, H.B. 2008. The Cystine Content of Hair and Other Epidermal Tissues. The Journal of Biological Chemistry. 73 (2): 543-553. Winarno, F.G. 1983. Enzim Pangan. PT Gramedia Pustaka Utama. Jakarta.
Wojeiech, L., Anna, R. 2010. Keratinolytic Potential of Feather-Degrading Bacillus polymyxa and Bacillus cereus. Polish Journal of Environmental Studying. 19 (2): 371-378.
LAMPIRAN
Lampiran 1. Alur Kerja Penelitian
Karakterisasi Morfologi, Uji Biokimia dan Pewarnaan Sifat Gram
Uji Aktivitas Proteolitik Secara Kualitatif
Uji Aktivitas Keratinolitik Secara Kualitatif
Uji Potensi Bakteri Keratinolitik dari Feses Ular Sanca (Python sp.) dalam Mendegradasi Limbah Sumber Keratin
Estimasi Jumlah Isolat Bakteri dengan Metode TPC
Perhitungan Optical Density (OD) Isolasi Mikroba dari Feses Ular Sanca
30
Lampiran 2. Alur Kerja Isolasi Mikroba dari Feses Ular Sanca (Python sp.)
Ditimbang sebanyak 1 g
Dilarutkan dalam 10 ml akuades Dilakukan pengenceran hingga 10-12
Diinokulasikan sebanyak 0,1 ml dari masing-masing pengenceran ke media skim milk agar
Disebar menggunakan hockey stick
Diinkubasi selama 24 – 48 jam pada suhu 30οC Diamati terbentuknya zona proteolitik
31
Lampiran 3. Alur Kerja Karakterisasi Morfologi dan Sifat Biokimia Isolat
Bakteri dari Feses Ular Sanca (Python sp.)
Karakterisasi
Morfologi
Pewarnaan Sifat Gram
• Bentuk Koloni • Warna Koloni • Elevasi Koloni • Tepi Koloni
• Uji Pati • Uji Gelatin • Uji Nitrat • Uji Sulfida • Uji Motilitas
Uji Biokimia Isolat Bakteri
32
Lampiran 4. Alur Kerja Uji Aktivitas Proteolitik Secara Kualitatif
Diteteskan diatas kertas cakram sebanyak 10 µl
Diletakkan pada bagian tengah petri yang berisi media skim milk agar
Diinkubasi pada suhu 30°C
Diukur diameter zona bening dengan diameter koloni bakteri
33
Lampiran 5. Alur Kerja Uji Aktivitas Keratinolitik Secara Kualitatif
Diteteskan diatas kertas cakram sebanyak 10 µl Diletakkan pada bagian tengah petri yang berisi media
feather meal agar
Diinkubasi pada suhu 30°C
Diukur diameter zona bening dengan diameter koloni bakteri
34
Lampiran 6. Uji Potensi Bakteri Keratinolitik dari Feses Ular Sanca (Python sp.) dalam Mendegradasi Limbah Keratin
Ditimbang sebanyak 0,5 g Dimasukkan ke dalam botol
Ditambahkan media garam cair yang berisi NaCl, KH2PO4, K2HPO4 , MgSO4, ekstrak yeast sebanyak 45 ml
Disterilisasi menggunakan autoklaf pada suhu 121°C selama 20 menit
Ditambahkan suspensi bakteri sebanyak 5 ml Diinkubasi selama 25 hari pada suhu 30°C Disaring dan dikeringkan hasil penyaringan Ditimbang dan dihitung berat kering sisa d gradasi e
%Penurunan Berat Kering Bk awal – Bk akhirBk awal X %
35
Lampiran 7. Alur Kerja Pengukuran Serapan Optical Density (OD)
Disentrifugasi pada kecepatan 10.000 rpm selama 10 menit
Dimasukkan ke dalam kuvet
Dispektrofotometer pada panjang gelombang 280 nm
36
Lampiran 8. Alur Kerja Estimasi Jumlah Isolat Bakteri dengan Metode TPC
Diencerkan hingga konsentrasi 10-8
Diinokulasikan ke media skim milk agar dengan metode cawan sebar
Diinkubasi selama 24 jam pada suhu 30οC Dihitung jumlah koloni yang terbentuk
Hasil
37
Lampiran 9. Komposisi dan Persiapan Media
a. Komposisi media skim milk agar (Widhyastuti & Dewi, 2001) yang telah dimodifikasi, yaitu media skim milk agar mengandung 20 g susu skim dan 24 g agar per liter. Susu skim sebanyak 20 g dilarutkan dalam 400 ml akuades kemudian dipasteurisasi (63ο C selama 30 menit). Selanjutnya 24 g agar dilarutkan dalam 600 ml akuades steril dan dicampurkan hingga homogen. b. Komposisi media feather meal agar (Agrahari & Wadhwa, 2010) yang telah
dimodifikasi, yaitu bubuk bulu ayam sebanyak 5 g, agar 10 g, NaCl 0,25 g, KH2PO4 0,35 g, K2HPO4 0,7 g, MgSO4 0,05 g, ekstrak yeast 0,5 g, dilarutkan dalam 500 ml akuades. Media dipanaskan di atas hot plate hingga homogen dan disterilisasi menggunakan autoklaf pada suhu 121°C selama 20 menit. c. Komposisi media garam cair (Matikeviciene et al., 2009) yang telah
38
Lampiran 10. Tabel Indeks Proteolitik
Isolat Hari ke-
0 1 2 3
FU1 - 0,70 1,72 1,65
FU2 - 1,18 1,06 1,54
FU3 - 1,77 1,15 1,53
FU4 - 1,14 1,20 1,94
FU5 - 1,20 1,56 1,65
FU6 - 1,45 2,11 2,00
FU7 - 1,83 1,11 1,66
FU8 - 1,83 2,00 1,84
FU9 - 1,60 1,80 1,84
39
Lampiran 11. Tabel Indeks Keratinolitik
Isolat Hari ke-
0 1 2 3 4 5 6 7
FU1 - - 0,30 0,35 0,75 1,29 1,18 1,12
FU2 - - 0,10 0,30 0,70 1,24 1,45 1,13
FU3 - - - 0,15 0,56 1,13 1,02 1,04
FU4 - - - 1,72 1,27 1,27 1,27 1,27
FU5 - - 0,15 0,45 1,20 1,65 1,25 1,69
FU6 - - 0,20 0,94 1,25 1,53 1,40 1,27
FU7 - - 0,75 1,00 2,10 3,80 3,91 2,40
FU8 - - 0,40 0,60 0,74 1,13 1,30 1,21
FU9 - - - 1,56 1,26 1,50 1,57 1,62
40
Lampiran 12. Tabel Pertumbuhan Bakteri Keratinolitik FU7 dan FU10 Setelah 25 Hari Inkubasi
Isolat
Bulu Ayam Rambut kambing