ISOLASI DAN UJI POTENSI BAKTERI TANAH PERTANIAN
BERASTAGI SUMATERA UTARA DALAM MENDEGRADASI
INSEKTISIDA MARSHAL BERBAHAN AKTIF KARBOSULFAN
SKRIPSI
NINA SEPTANIA DAMANIK 080805060
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ISOLASI DAN UJI POTENSI BAKTERI TANAH PERTANIAN
BERASTAGI SUMATERA UTARA DALAM MENDEGRADASI
INSEKTISIDA MARSHAL BERBAHAN AKTIF KARBOSULFAN
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
NINA SEPTANIA DAMANIK 080805060
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI DAN UJI POTENSI BAKTERI TANAH
PERTANIAN BERASTAGI SUMATERA UTARA DALAM MENDEGRADASI INSEKTISIDA MARSHAL BERBAHAN AKTIF KARBOSULFAN
Kategori : SKRIPSI
Nama : NINA SEPTANIA DAMANIK
NIM : 080805060
Program Sudi : SARJANA (S1) BIOLOGI Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
(FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di Medan, April 2013
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
(Prof. Dr. Erman Munir, M.Sc) (Dra. Nunuk Priyani, M.Sc) NIP. 19651101 199103 1 002 NIP. 19640428 199603 2 001
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
ISOLASI DAN UJI POTENSI BAKTERI TANAH PERTANIAN
BERASTAGI SUMATERA UTARA DALAM MENDEGRADASI
INSEKTISIDA MARSHAL BERBAHAN AKTIF KARBOSULFAN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, April 2013
080805060
PENGHARGAAN
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus atas berkat dan kasihNya yang tiada henti sehingga penulis dapat menyelesaikan hasil penelitian yang berjudul “ISOLASI DAN UJI POTENSI BAKTERI TANAH PERTANIAN BERASTAGI SUMATERA UTARA DALAM MENDEGRADASI INSEKTISIDA MARSHAL BERBAHAN AKTIF KARBOSULFAN” yang merupakan syarat untuk melengkapi dan memenuhi syarat mencapai gelar Sarjana Sains di Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Terima kasih penulis sampaikan kepada Ibu Dra. Nunuk Priyani, M.Sc selaku Dosen Pembimbing I dan Bapak Prof. Dr. Erman Munir, M.Sc selaku Dosen Pembimbing II yang telah banyak memberikan bimbingan, masukan, dan ilmu dalam penyelesaian skripsi ini. Ucapan terima kasih juga penulis ucapkan kepada Bapak Drs. Kiki Nurjhahja, M.Sc dan Ibu Dra. Isnaini Nurwahyuni, M.Sc selaku Dosen Penguji yang telah banyak memberikan masukan serta saran dalam kesempurnaan penyelesaian skripsi ini.
Ucapkan terima kasih juga penulis sampaikan kepada Ibu Dra. Isnaini Nurwahyuni, M.Sc selaku Dosen Pembimbing Akademik, Ibu Dr. Nursahara Pasaribu, M.Sc selaku Ketua Departemen Biologi FMIPA USU, Ibu Dra. Nunuk Priyani, M.Sc selaku kepala laboratorium Mikrobiologi dan seluruh staf Pengajar Departemen Biologi FMIPA USU atas ilmu dan ajarannya. Penulis juga mengucapkan terima kasih kepada Ibu Mizarwati S.Si selaku Ketua Panitia Seminar Departemen Biologi FMIPA USU, Ibu Nurhasni Muluk, Bang Erwin dan Ibu Rosalina Ginting selaku staf pegawai Departemen Biologi FMIPA USU.
Ucapan terimakasih yang tak ternilai harganya penulis sampaikan kepada Ayahanda tercinta Kasnan Damanik dan Ibunda tercinta Erita Yani Purba yang selalu mendukung penulis baik berupa doa, dana, semangat maupun nasihat. Terimakasih atas pengertian dan kesabaran yang Ayah dan Ibu berikan. Tanpa dukungan dan bimbingan Ayah dan Ibu, penulis tidak mungkin dapat menyelesaikan pendidikan hingga saat ini. Terima kasih juga, penulis ucapkan kepada adik-adik ku terkasih Winnie Agnesa Damanik, Mulia Novendro Damanik dan Togu Philia Damanik yang selalu menemani penulis disaat suka maupun duka. Terimakasih karena telah menjadi pelengkap hidup penulis, semoga Tuhan selalu menyertai dan memberkati kita semua. Amin.
Inur, Uya, Ika, Juju dan Gilang terima kasih untuk pertemanan yang menyenangkan sejak awal perkuliahan. Terimakasih kepada kekasih hatiku Albert Sembiring yang telah setia dan sabar dalam menemani suka dan duka penulis. Terimakasih kepada seluruh anggota PKBKB yang telah mendukung penulis di dalam doa serta teman-teman lainnya yang turut mendukung dan menyemangati penulis dalam penyelesaian skripsi ini.
Penulis menyadari sepenuhnya bahwa skripsi ini masih jauh dari kata sempurna. Oleh karena itu, penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan penulisan skripsi ini. Penulis berharap tulisan sederhana ini dapat bermanfaat bagi ilmu pengetahuan dan bagi kita semua.
Medan, April 2013
ISOLASI DAN UJI POTENSI BAKTERI TANAH PERTANIAN BERASTAGI SUMATERA UTARA DALAM MENDEGRADASI INSEKTISIDA MARSHAL
BERBAHAN AKTIF KARBOSULFAN
ABSTRAK
Isolasi bakteri tanah pertanian Berastagi Sumatera Utara bertujuan untuk mengetahui kemampuannya dalam mendegradasi insektisida Marshal berbahan aktif karbosulfan. Sebanyak 16 isolat bakteri telah diisolasi dengan menggunakan media selektif Bushnell-Hass Agar yang mengandung 12 ppm karbosulfan. Parameter yang diamati adalah pertumbuhan isolat, aktivitas biosurfaktan, konsentrasi biosurfaktan dan residu karbosulfan selama 21 hari masa inkubasi. Hasil penelitian menunjukkan bahwa semua isolat mampu menggunakan karbosulfan sebagai sumber karbon. Dua Isolat (JBM 3 dan KBM 1) dipilih untuk dilakukan uji lebih lanjut untuk mengetahui kemampuannya dalam mendegradasi karbosulfan. Hasil pengujian menunjukkan bahwa kedua isolat mampu menguraikan karbosulfan. Jika dibandingkan dengan kontrol, isolat JBM 3 mampu menurunkan konsentrasi karbosulfan sebesar 33,33%, sedangkan isolat KBM 1 mampu menurunkan konsentrasi karbosulfan sebesar 40,47%.
ISOLATION AND POTENTIAL TEST OF BERASTAGI AGRICULTURAL SOIL BACTERIA SUMATERA UTARA IN DEGRADING
CARBOSULFAN-BASED MARSHAL INSECTICIDE
ABSTRACT
The isolation of bacteria from Berastagi agricultural soil Sumatera Utara has been done. The aim is to evaluate their ability in degrading carbosulfan. Sixteen bacterial isolates were obtained using selective media Bushnel Hass Agar (BHA) containing 12 ppm of carbosulfan. The parameters observed were the growth of isolates, biosurfactant activity, biosurfactant concentration, and the residue of carbosulfan after 21 days of incubation. The result showed that all isolates were able to use carbosulfan as the sole carbon source. Two isolates (JBM 3 and KBM 1) were selected for further test to determine their ability to degrade carbosulfan.The results showed that both of the isolates were able to degrade carbosulfan. Compare to control, isolate JBM 3 was able to decrease the concentration of carbosulfan by 33.33%, while isolate KBM 1 was able to reduce carbosulfan concentration up to 40.47%.
DAFTAR ISI
DAFTAR LAMPIRAN xii
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Tujuan Penelitian 3
1.4 Hipotesis 3
1.5 Manfaat Penelitian 4
BAB 2 TINJAUAN PUSTAKA
2.1 Pencemaran Pestisida 5
2.2 Dampak Penggunaan Insektisida terhadap Lingkungan 6
2.3 Bakteri Pendegradasi Pestisida 8
2.4 Surfaktan dan Biosurfaktan 9
BAB 3 BAHAN DAN METODE
3.1 Waktu dan Tempat 11
3.2 Alat dan Bahan 11
3.3 Prosedur Penelitian 12
3.3.1 Isolasi Bakteri 12
3.3.2 Karakterisasi Morfologi dan Sifat Biokimia Bakteri 12
3.3.3 Perhitungan Pertumbuhan Isolat 13
3.3.4 Screening Aktivitas Biosurfaktan 13
3.3.5 Uji Potensi Bakteri dalam Memproduksi Biosurfaktan 14 3.3.5.1 Penentuan Kurva Standar Biosurfaktan 14
3.3.5.2 Produksi Biosurfaktan 14
3.3.6 Uji Potensi Bakteri Penghasil Biosurfaktan dalam Mendegradasi Karbosulfan
BAB 4 HASIL DAN PEMBAHASAN
4.1 Karakteristik Bakteri Tanah Pertanian Berastagi Sumatera Utara 16
4.2 Perhitungan Pertumbuhan Isolat 18
4.3 Aktivitas Biosurfaktan 20
4.4 Produksi Biosurfaktan 22
4.5 Potensi Bakteri Penghasil Biosurfaktan dalam Mendegradasi Karbosulfan
24
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 27
5.2 Saran 27
DAFTAR PUSTAKA 28
DAFTAR GAMBAR
Gambar No. Halaman
2.1 Struktur Kimia Karbosulfan 7
4.2.1 Pertumbuhan isolat bakteri selama masa pengkulturan pada media BHB mengandung karbosulfan
19 4.3.1 Aktivitas biosurfaktan isolat bakteri tanah pertanian
Berastagi
21 4.4.1 Produksi biosurfaktan isolat bakteri tanah pertanian
Berastagi
DAFTAR TABEL
Tabel No. Halaman
4.1.1 Karakteristik Morfologi dan Pewarnaan Gram Bakteri Penghasil Biosurfaktan dari Tanah Pertanian Berastagi
16 4.1.2 Karakteristik Biokimia Bakteri Penghasil Biosurfaktan 17 4.2.1 Pertumbuhan Isolat Bakteri Tanah Pertanian Berastagi
Selama Masa pengkulturan pada Media BHB Mengandung Karbosulfan
18
4.3.1 Aktivitas Biosurfaktan Isolat Bakteri dari Tanah Pertanian Berastagi
20 4.4.1 Produksi Biosurfaktan Isolat Bakteri Tanah Pertanian
Berastagi
22 4.5.1 Konsentrasi Karbosulfan Sisa Degradasi oleh Isolat
Bakteri Tanah Pertanian Berastagi
DAFTAR LAMPIRAN
Lampiran No. Halaman
1. Komposisi Media Bushnell-Haas, Larutan Standar Mc. Farland, Larutan Orsinol
32
2. Alur Kerja Isolasi Bakteri 33
3. Alur Kerja Karakterisasi Morfologi dan Sifat Biokimia Bakteri
34 4. Alur Kerja Estimasi Jumlah Isolat Bakteri dengan
Metode Standard Plate Count (SPC)
35 5. Alur Kerja Screening Aktivitas Biosurfaktan Metode
Drop Collapsing Test
36 6. Alur Kerja Pembuatan Kurva Standar Biosurfaktan 37 7. Alur Kerja Produksi Biosurfaktan Metode Orsinol yang
Dimodifikasi
38 8. Penentuan Kurva Standar Biosurfaktan 39 9. Alur Kerja Penentuan Kurva Standar Karbosulfan 41 10. Uji Potensi Bakteri Penghasil Biosurfaktan dalam
Mendegradasi Karbosulfan dan Analisis Karbosulfan Sisa dengan Metode GC (Gas Chromatography)
42
11. Kurva Standar Karbosulfan 43
12. Perhitungan Mencari % Degradasi Karbosulfan 45 13. Hasil Pengujian Karbosulfan Sisa dari Balai Pengujian
Mutu Produk Tanaman Jakarta
46
ISOLASI DAN UJI POTENSI BAKTERI TANAH PERTANIAN BERASTAGI SUMATERA UTARA DALAM MENDEGRADASI INSEKTISIDA MARSHAL
BERBAHAN AKTIF KARBOSULFAN
ABSTRAK
Isolasi bakteri tanah pertanian Berastagi Sumatera Utara bertujuan untuk mengetahui kemampuannya dalam mendegradasi insektisida Marshal berbahan aktif karbosulfan. Sebanyak 16 isolat bakteri telah diisolasi dengan menggunakan media selektif Bushnell-Hass Agar yang mengandung 12 ppm karbosulfan. Parameter yang diamati adalah pertumbuhan isolat, aktivitas biosurfaktan, konsentrasi biosurfaktan dan residu karbosulfan selama 21 hari masa inkubasi. Hasil penelitian menunjukkan bahwa semua isolat mampu menggunakan karbosulfan sebagai sumber karbon. Dua Isolat (JBM 3 dan KBM 1) dipilih untuk dilakukan uji lebih lanjut untuk mengetahui kemampuannya dalam mendegradasi karbosulfan. Hasil pengujian menunjukkan bahwa kedua isolat mampu menguraikan karbosulfan. Jika dibandingkan dengan kontrol, isolat JBM 3 mampu menurunkan konsentrasi karbosulfan sebesar 33,33%, sedangkan isolat KBM 1 mampu menurunkan konsentrasi karbosulfan sebesar 40,47%.
ISOLATION AND POTENTIAL TEST OF BERASTAGI AGRICULTURAL SOIL BACTERIA SUMATERA UTARA IN DEGRADING
CARBOSULFAN-BASED MARSHAL INSECTICIDE
ABSTRACT
The isolation of bacteria from Berastagi agricultural soil Sumatera Utara has been done. The aim is to evaluate their ability in degrading carbosulfan. Sixteen bacterial isolates were obtained using selective media Bushnel Hass Agar (BHA) containing 12 ppm of carbosulfan. The parameters observed were the growth of isolates, biosurfactant activity, biosurfactant concentration, and the residue of carbosulfan after 21 days of incubation. The result showed that all isolates were able to use carbosulfan as the sole carbon source. Two isolates (JBM 3 and KBM 1) were selected for further test to determine their ability to degrade carbosulfan.The results showed that both of the isolates were able to degrade carbosulfan. Compare to control, isolate JBM 3 was able to decrease the concentration of carbosulfan by 33.33%, while isolate KBM 1 was able to reduce carbosulfan concentration up to 40.47%.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Hasil pertanian konvensional tidak lepas dari penggunaan pestisida kimia. Dalam bidang pertanian, pestisida merupakan agen untuk membunuh jasad pengganggu tanaman (Yuantari, 2009). Penggunaan pestisida dalam menopang peningkatan produk pertanian maupun perkebunan telah banyak membantu peningkatan produksi pertanian. Namun penggunaan pestisida juga memberikan dampak negatif baik terhadap manusia, biota maupun lingkungan (Manuaba, 2009).
Pestisida sebagai salah satu agen pencemar lingkungan, baik melalui udara, air maupun tanah (Djafaruddin, 2008; Sulistyono, 2004) dapat berakibat langsung terhadap komunitas hewan, tumbuhan terlebih manusia. Pestisida masuk ke dalam lingkungan melalui beberapa proses baik pada permukaan tanah maupun permukaan bawah tanah (Sulistyono, 2004). Kondisi ini akan mempengaruhi kandungan bahan pada sistem air tanah.
Berbagai jenis pestisida banyak digunakan di negara berkembang (Afriyanto, 2008) termasuk Indonesia. Pestisida kimia dapat dibagi dalam beberapa golongan yaitu organofosfat, karbamat, piretroid sintetik, dan neonikotinoid yang merupakan insektisida yang berspektrum luas. Karbamat merupakan insektisida yang telah banyak digunakan secara luas untuk pengendalian hama tanaman (Ak’yunin, 2008). Semua insektisida karbamat mempunyai bangunan dasar asam karbamat. Di lingkungan penguraian beberapa karbamat menghasilkan metabolit yang masih beracun (Chapalamadugu & Chaudhry, 1992), salah satu bahan aktif yang termasuk karbamat adalah karbosulfan yang bekerja sebagai racun perut (Ak’yunin, 2008). Salah satu insektisida yang menggunakan bahan aktif karbosulfan adalah Marshal 200 EC. Insektisida ini sering digunakan oleh para petani untuk membunuh serangga.
Berastagi merupakan pusat produksi tanaman hortikultura terbesar di Sumatera Utara, dimana produksinya tidak terlepas dari penggunaan berbagai jenis pestisida. Penggunaan pestisida telah lama dilakukan oleh petani, sehingga mikroba yang ada di tanah tersebut mampu menggunakan residu pestisida sebagai salah satu sumber karbon untuk aktivitas metabolismenya (Rahmansyah & Sulistinah, 2009).
1.2 Permasalahan
Pencemaran lingkungan terutama lingkungan pertanian disebabkan oleh penggunaan bahan-bahan kimia pertanian. Bahan-bahan kimia pertanian dalam hal ini insektisida telah meningkatkan produksi pertanian dan membuat pertanian lebih efisien dan ekonomis. Akan tetapi penggunaan dalam jumlah yang berlebih dapat menimbulkan masalah lingkungan. Upaya penanggulangan pencemaran pestisida secara aman dapat dilakukan secara biologis melalui proses biodegradasi dengan bantuan mikroorganisme. Bakteri penghasil biosurfaktan yang berasal dari laut Belawan, Tanjung Balai dan Sibolga telah diuji kemampuannya dalam mendegradasi glifosat. Isolat bakteri diperoleh dari laut, belum diketahui bagaimana kemampuan bakteri tanah yang sering terpapar oleh pestisida seperti pada lahan pertanian Berastagi. Petani di Berastagi sering menggunakan pestisida untuk mengendalikan hama penyakit tanaman, salah satunya adalah insektisida Marshal 200 EC (berbahan aktif karbosulfan) sebagai racun pembunuh serangga. Oleh karena itu perlu dilakukan isolasi dan uji potensi bakteri tanah pertanian Berastagi Sumatera Utara untuk mendegradasi insektisida yang berbahan aktif karbosulfan.
1.3Tujuan Penelitian
a. Untuk memperoleh isolat bakteri potensial penghasil biosurfaktan dari tanah pertanian Berastagi, Sumatera Utara.
b. Untuk mengetahui aktivitas biosurfaktan dari masing-masing isolat.
c. Untuk mengetahui kemampuan isolat bakteri asal tanah pertanian Berastagi Sumatera Utara dalam mendegradasi karbosulfan.
1.4 Hipotesis
1.5 Manfaat Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Pencemaran Pestisida
Pestisida adalah bahan kimia yang digunakan untuk mengendalikan perkembangan/pertumbuhan dari hama, penyakit dan gulma (Sofia, 2001). Menurut Yuantari (2009) pestisida adalah zat atau campuran yang diharapkan sebagai pencegahan, menghancurkan atau pengawasan setiap hama termasuk vektor terhadap manusia dan penyakit pada binatang, tanaman yang tidak disukai dalam proses produksi. Pestisida meliputi herbisida (untuk mengendalikan gulma), insektisida (untuk mengendalikan serangga), fungisida (untuk mengendalikan fungi), nematisida (untuk mengendalikan nematoda), rodentisida (racun vertebrata), mollusida (mengontrol siput) (Hameed & Singh, 1998; Miskiyah & Munarso, 2009). Pestisida mempunyai peranan penting untuk membantu mengatasi permasalahan organisme pengganggu. Bahkan telah menjadi alat yang sangat penting didalam meningkatkan produksi pertanian (Saenong, 2007).
Pencemaran dan keracunan pestisida umumnya terjadi akibat kelalaian manusia dalam penggunaannya yang berlebihan, kesalahan pencampuran dan penanganan yang tidak sesuai prosedur (Indraningsih & Sani, 2006). Penggunaan pestisida yang tidak terkendali akan menimbulkan bermacam-macam masalah kesehatan dan pencemaran lingkungan (Yuantari, 2009). Hal ini juga diperparah dengan perilaku petani dalam menggunakan dan penanganan pestisida yang masih belum arif dan belum ramah lingkungan (Wahyuni, 2010).
2.2 Dampak Penggunaan Insektisida terhadap Lingkungan
Para petani masih sangat mengandalkan insektisida kimia sebagai alat pengendali dengan tujuan untuk memberantas serangga yang ada pada agroekosistem tanpa memperdulikan dampak negatif yang ditimbulkan khususnya terbunuhnya serangga dari golongan musuh alami (Sarjan, 2004; Wudianto, 1997). Dampak penggunaan pestisida terhadap lingkungan sangat ditentukan oleh efektivitas pestisidanya. Suatu jenis pestisida dianggap efektif bila (1) cukup beracun untuk mempengaruhi seluruh kelompok biota termasuk makhluk bukan sasaran sampai batas tertentu tergantung faktor fisiologis dan ekologis dan (2) pestisida harus tahan terhadap degradasi lingkungan sehingga dapat bertahan dalam jangka waktu tertentu. Sifat- sifat ini tentunya akan memberi pengaruh jangka panjang terhadap ekosistem alamiah. Pestisida yang paling banyak digunakan adalah insektisida, diikuti herbisida dan fungisida dalam jumlah yang lebih sedikit (Mukhlis et al., 2011).
Berdasarkan struktur kimianya insektisida dapat dikelompokkan menjadi 3 kelompok yaitu organoklorin, organofosfat dan karbamat. Insektisida organoklorin terdiri atas karbon, klorin, hidrogen dan kadang-kadang oksigen, organoklorin dapat menyebabkan polusi terhadap lingkungan karena sifatnya yang persisten dalam tanah. Insektisida organofosfat mengikuti perkembangan organoklorin. Organofosfat selalu mengandung fosfor dan dapat diidentifikasi oleh S-P atau O-P. Organofosfat adalah peracun syaraf yang membunuh vertebrata dan invertebrata melalui penghambatan kerja enzim kolinesterase di dalam sistem syaraf. Insektisida karbamat merupakan kelompok senyawa yang baru dan mempunyai daya kerja serupa dengan organofosfat, bertindak sebagai peracun syaraf (Triharso, 2004).
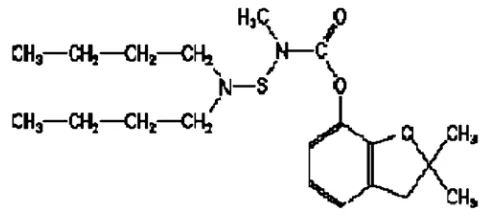
Karbosulfan merupakan insektisida sistemik yang termasuk dalam kelas karbamat seperti halnya karbofuran (EFSA, 2009). Dalam tubuh serangga, karbosulfan akan diubah menjadi karbofuran. Nama kimia karbosulfan adalah 2,3-dihydro-2,2-dimethyl bensofuran-7-yl-(dibutylaminotio) metyl karbamat benzofuran-7-yl- (dibutylaminotio) metylkarbamat (Baehaki, 1993). Karbosulfan tidak stabil dalam medium asam dan akan dikonversi ke karbofuran oleh pemutusan ikatan N-S, tetapi stabil di bawah media netral dan basa. Residu insektisida ini menyebabkan polusi udara dan air (Murthy et al., 2011). Dalam tanah pada kondisi aerob, karbosulfan dirubah menjadi karbofuran. 3-keto-karbofuran juga diproduksi dalam jumlah yang signifikan (EFSA, 2009). Struktur kimia karbosulfan dapat dilihat pada Gambar 2.1
2.3 Bakteri Pendegradasi Pestisida
Proses degradasi adalah proses terjadinya peruraian pestisida setelah digunakan, dapat terjadi sebagai akibat adanya; mikroba, reaksi kimia, dan sinar matahari. Prosesnya dapat terjadi setiap saat dari hitungan jam, hari, sampai tahunan bergantung pada kondisi lingkungan dan sifat-sifat kimia pestisida (Manuaba, 2009). Beberapa penelitian telah menunjukkan bahwa beberapa genus bakteri yang diisolasi dari tanah dan perairan sungai mampu mendegradasi senyawa pestisida dan menggunakannya sebagai sumber karbon dan memiliki gen metabolisme dalam plasmidnya (Sabdono, 2003). Bakteri yang tetap bertahan hidup di lingkungan yang mengandung pestisida merupakan ekspresi bakteri yang mampu hidup dan dapat mendegradasi pestisida (Rahmansyah & Sulistinah, 2009).
Secara alami, mikroba tertentu mampu menyesuaikan hidup atau sintas pada tanah mengandung pestisida. Perkembangan populasi bakteri tanah adalah ciri dinamika kehidupan di tanah. Terjadinya populasi bakteri pada tanah yang mengandung pestisida mencirikan adanya proses degradasi terhadap pestisida. Pendegradasian dapat terjadi melalui proses mineralisasi, secara utuh hasilnya dimanfaatkan langsung oleh sel-sel mikroba. Untuk mengenali alur degradasi atau biokonversi, beberapa hal seperti pengenalan karakter metabolisme mikroba, dan spesifitas enzim terhadap substrat residu pestisida dapat menjadi acuan dalam upaya menghilangkan cemaran pestisida di tanah (Rahmansyah & Sulistinah, 2009). Proses degradasi oleh mikroba ini akan mengalami peningkatan bila temperatur, pH tanah cocokuntuk pertumbuhan mikroba, cukup oksigen, dan fertilitas tanahnya cukup baik (Manuaba, 2009). Asupan sarana produksi berupa pupuk kimia ke dalam tanah pertanian juga akan memberikan pola tersendiri dalam menstimulasi mikroba fungsional yang ada di dalam tanah (Rahmansyah & Sulistinah, 2009).
pencemar. Keragaman diversitas bakteri pada genera Alcaligenes, Flavobacterium, Pseudomonas dan Rhodococcus mampu mendegradasi pestisida yang terdiri dari unsur rekalsitran. Proses degradasi difasilitasi oleh adanya enzim fungsional yang dimiliki bakteri. Pestisida sebagai komponen asing di lingkungan tanah menimbulkan instabilitas terhadap aktivitas enzim. Fosfatase dan esterase sebagai enzim hidrolisa yang dihasilkan mikroba tanah dapat memutus susunan kimia pestisida yang memiliki susunan rantai labil pada karbamat (Rahmansyah & Sulistinah, 2009).
2.4 Surfaktan dan Biosurfaktan
Surfaktan (dari kata surface active agent) adalah senyawa yang dapat menurunkan tegangan permukaan air. Umumnya molekul surfaktan mengandung ujung ekor hidrofobik yang terdiri atas satu rantai hidrokarbon atau lebih (group alifatik atau aromatik) dan kepala hidrofilik (sulfonate, sulfate, amine atau polyoxyethylene). Surfaktan menurunkan tegangan permukaan air dengan cara mematahkan ikatan-ikatan hidrogen melalui peletakan kepala-kepala hidrofiliknya pada permukaan air sedangkan ekor-ekor hidrofobiknya terentang menjauhi permukaan air (Fessenden & Fessenden 1989).
Biosurfaktan adalah senyawa surfaktan yang dihasilkan oleh mikroorganisme, terutama dari golongan bakteri (Aiyushirota, 2010). Dari sudut pandang ekologi, biosurfaktan banyak menguntungkan karena nontoksik dan ramah lingkungan. Biosurfaktan dan mikroba yang menghasilkannya, dapat diterapkan di berbagai sektor industri, kesehatan dan lingkungan. Sektor-sektor ini menunjukkan kondisi suhu ekstrim, kekuatan ion, keasaman, salinitas ekstrim dan pelarut organik (Kadarwati, 2006).
BAB 3
BAHAN DAN METODA
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret sampai dengan November 2012 di Laboratorium Mikrobiologi dan Kultur Jaringan Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan dan Balai Pengujian Mutu Produk Tanaman, Jakarta.
3.2 Alat dan Bahan
Alat yang digunakan pada penelitian ini antara lain sentrifuse, shaker,
spektrofotometer dan Kromatografi Gas Varian CP-3800 kolom ZB-1 (30m x 0,25mm x 0,25µm) dengan detector ECD. Bahan yang digunakan pada penelitian ini antara lain sampel tanah pertanian Berastagi, insektisida berbahan aktif karbosulfan dengan merek dagang Marshal (200 EC), media Bushnell Haas Broth (BHB), Bushnell Haas Agar (BHA) (terdiri atas KH2PO4, K2HPO4, NH4NO3, MgSO4.7H2O, FeCl3,
3.3 Prosedur Penelitian 3.3.1 Isolasi Bakteri
Sampel tanah diambil dari tanah pertanian Berastagi yang mengandung pestisida. Pengambilan sampel tanah dilakukan pada empat lokasi pertanian (cabai, jeruk, kol, dan tomat). Sampel tanah diambil sebanyak 1 kg dan dimasukkan dalam plastik steril secara aseptis. Sampel tanah dibawa ke laboratorium, ditimbang sebanyak 1 gram dan diencerkan dalam 10 ml akuades steril hingga 10-2, diinokulasikan sebanyak 0,1 ml ke media BHA yang telah mengandung 12 ppm karbosulfan dengan merek dagang Marshal 200 EC. Sampel yang telah diinokulasikan ke media diinkubasi pada suhu 30oC selama 10-15 hari. Koloni isolat yang tumbuh dimurnikan pada media TSA. Alur kerja isolasi bakteri dapat dilihat pada Lampiran 2. halaman 33.
3.3.2 Karakterisasi Morfologi dan Sifat Biokimia Bakteri
Koloni bakteri yang tumbuh pada media BHA dikarakterisasi berdasarkan sifat biokimia dan bentuk morfologinya. Karakterisasi morfologi yang diamati adalah bentuk, tepi, elevasi dan warna koloni secara makroskopis. Karakterisasi secara mikroskopis meliputi bentuk, penataan selnya serta sifat Gramnya yang diamati dengan mikroskop cahaya. Pewarnaan Gram menggunakan pewarna safranin dan kristal violet. Sifat biokimia yang diamati mencakup uji katalase dengan menggunakan larutan H2O2 3%, uji motilitas dengan media Sulfide Indole Motility
3.3.3 Pengukuran Pertumbuhan Isolat
Pertumbuhan isolat selama masa inkubasi dilakukan dengan menumbuhkan bakteri pada media mineral BHB yang mengandung 12 ppm karbosulfan. Sebanyak 2 ml inokulum cair isolat bakteri yang setara dengan kekeruhan larutan Mc-Farland
diinokulasikan ke dalam media secara aseptis, diinkubasi pada shaker (150 rpm) pada kondisi gelap dengan suhu 30oC selama 21 hari. Pertumbuhan isolat diamati setiap 7 hari sekali yaitu pada hari ke-0, ke-7, ke-14 dan hari ke-21 masa inkubasi. Pengukuran jumlah sel dilakukan dengan metode Standard Plate Count (Fardiaz, 1992). Sebanyak 1 ml media biakan diencerkan hingga konsentrasi 10-7
Alur kerja perhitungan pertumbuhan sel dapat dilihat pada Lampiran 4. halaman 35. , diinokulasikan ke media PCA secara aseptis dengan metode cawan sebar dan diinkubasi selama 24 jam. Jumlah koloni yang tumbuh dihitung dengan Colony counter. Untuk perhitungan estimasi jumlah sel dapat dihitung dengan rumus:
Estimasi Jumlah Sel = Jumlah koloni x 1
Faktor Pengenceran(CFU ml⁄ )
3.3.4. Screening Aktivitas Biosurfaktan
3.3.5 Uji Potensi Bakteri dalam Memproduksi Biosurfaktan 3.3.5.1 Penentuan Kurva Standar Biosurfaktan
Penentuan kurva standar biosurfaktan dilakukan menggunakan rhamnosa murni dari Sigma Aldrich Company, Amerika Serikat. Rhamnosa dibuat dengan konsentrasi berbeda-beda (0 (blanko), 10, 50, 100 dan 200 ppm) yang dilarutkan dengan larutan sodium bikarbonat (NaHCO3
Y= a + bX
) 0,05M, kemudian masing-masing dimasukkan ke dalam tabung reaksi sebanyak 2 ml. Masing-masing larutan tersebut ditambah 3,6 ml larutan orsinol, dipanaskan hingga mendidih, didinginkan pada temperatur kamar selama 15 menit dan dianalisis dengan menggunakan spektrofotometer dengan panjang gelombang 421 nm. Persamaan garis regresi kurva standar rhamnosa ditentukan dengan metode Least Square (Glover & Mitchell, 2002) dengan rumus:
Dimana: a = intersep a = Y – bX
b = slope (koefisienregresi)
Y = absorbansi X = Konsentrasi
Alur kerja pembuatan kurva standar rhamnosa dapat dilihat pada Lampiran 6. halaman 37.
3.3.5.2 Produksi Biosurfaktan
Bakteri ditumbuhkan pada media BHB yang mengandung karbosulfan sebagai sumber karbon. Inokulum cair isolat bakteri yang setara dengan larutan Mc-Farland sebanyak 2 ml diinokulasikan ke dalam media BHB yang mengandung karbosulfan, diinkubasi pada shaker (150 rpm) dengan kondisi gelap dan suhu 30oC selama 21 hari.
Konsentrasi biosurfaktan yang terbentuk dianalisis dengan metode orsinol yang dimodifikasi (Koch et al., 1991). Kultur bakteri yang telah diinkubasi disentrifugasi dengan kecepatan 6000 rpm selama 10 menit untuk memisahkan bakteri
dengan media biakannya. Supernatan diambil 4 ml diekstrak dengan 2 ml diethylether selama 5 menit, ekstraksi diulangi sebanyak 3 kali. Lapisan ether diambil, dikeringkan dan dilarutkan kembali dalam 2 ml larutan sodium bikarbonat (NaHCO3) 0,05 M.
Kemudian larutan sampel divorteks dan ditambah 3,6 ml larutan orsinol, dipanaskan hingga mendidih, didinginkan pada temperatur kamar selama 15 menit dan dianalisis absorbansinya menggunakan spektrofotometer dengan panjang gelombang 421 nm. Alur kerja produksi biosurfaktan dapat dilihat pada Lampiran 7. halaman 38.
3.3.6 Uji Potensi Bakteri Penghasil Biosurfaktan Dalam Mendegradasi Karbosulfan
BAB 4
HASIL DAN PEMBAHASAN
4.1 Karakteristik Bakteri Tanah Pertanian Berastagi Sumatera Utara
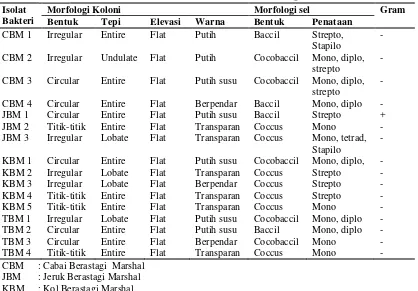
Hasil isolasi yang telah dilakukan diperoleh 16 isolat bakteri penghasil biosurfaktan yang ditumbuhkan pada media Bushnell-Hass Agar (BHA) yang mengandung 12 ppm karbosulfan (merek dagang Marshal 200 EC) sebagai sumber karbon (Lampiran 14a. halaman 49). Isolat yang diperoleh yaitu 4 isolat dari tanah pertanian cabai, 3 isolat dari tanah pertanian jeruk, 5 isolat dari tanah pertanian kol, dan 4 isolat dari tanah pertanian tomat. Isolat bakteri ini memiliki karakteristik morfologi dan Gram yang bervariasi seperti yang terlihat pada Tabel 4.1.1
Tabel 4.1.1 Karakteristik Morfologi dan Pewarnaan Gram Bakteri Penghasil Biosurfaktan dari Tanah Pertanian Berastagi
Isolat Bakteri
Morfologi Koloni Morfologi sel Gram
Bentuk Tepi Elevasi Warna Bentuk Penataan CBM 1 Irregular Entire Flat Putih Baccil Strepto,
Stapilo
-
CBM 2 Irregular Undulate Flat Putih Cocobaccil Mono, diplo, strepto JBM 3 Irregular Lobate Flat Transparan Coccus Mono, tetrad,
Stapilo CBM : Cabai Berastagi Marshal
Isolat yang diperoleh menunjukkan bentuk koloni circular (bulat) sebanyak 6 isolat, irregular (tidak beraturan) sebanyak 6 isolat dan titik-titik sebanyak 4 isolat, dimana tepi koloni berbentuk entire (rata) sebanyak 11 isolat, lobate (berbelah) sebanyak 4 isolat dan undulate (berombak) 1 isolat. Sedangkan elevasi koloni berbentuk flat. Koloni bakteri berwarna putih, putih susu, berpendar dan transparan. Bakteri yang diperoleh berbentuk coccus sebanyak 7 isolat, cocobaccil sebanyak 5 isolat dan baccil sebanyak 4 isolat. Bakteri yang diperoleh didominasi oleh bakteri Gram negatif sebanyak 15 isolat dan Gram positif 1 isolat (isolat bakteri dapat dilihat pada Lampiran 14b. halaman 49). Panjaitan (2010) melakukan isolasi bakteri penghasil boisurfaktan dari laut Belawan dan memperoleh 13 isolat, Gram negatif sebanyak 10 isolat dan Gram positif 3 isolat.
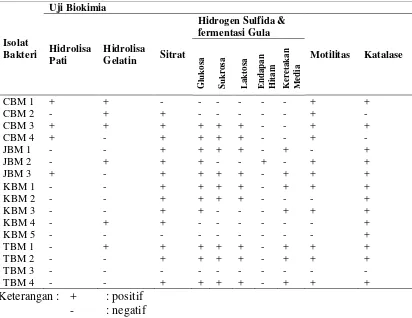
Karakterisasi sifat biokimia yang dilakukan meliputi uji hidrogen sulfida, uji sitrat, uji motilitas, uji pati, uji gelatin dan uji katalase menunjukkan bahwa seluruh isolat memiliki karakteristik yang berbeda seperti yang terlihat pada Tabel 4.1.2 (gambar hasil uji biokimia dapat dilihat pada Lampiran 14c. halaman 50).
Tabel 4.1.2 Karakteristik Biokimia Bakteri Penghasil Biosurfaktan
Menurut Lay (1994), identifikasi mikroba merupakan salah satu hal yang sangat penting. Identifikasi bakteri didasarkan pada morfologi, sifat biakan, sifat biokimiawi. Morfologi mikroorganisme berdasarkan bentuk, ukuran dan penataan biasanya tidak cukup untuk melakukan identifikasi. Ciri lainnya seperti sifat pewarnaan, pola pertumbuhan koloni, reaksi pertumbuhan pada karbohidrat, dan penggunaan asam amino sangat membantu dalam identifikasi mikroba.
4.2 Pertumbuhan Isolat
Isolat bakteri yang diperoleh dari hasil isolasi ditumbuhkan kembali pada media BHA dan dipilih 10 isolat berdasarkan kemampuan tumbuhnya. Kepadatan sel bakteri selama masa inkubasi pada media Bushnell-Hass Broth (BHB) yang mengandung 12 ppm karbosulfan (Lampiran 14d. halaman 51) dihitung dengan menggunakan metode
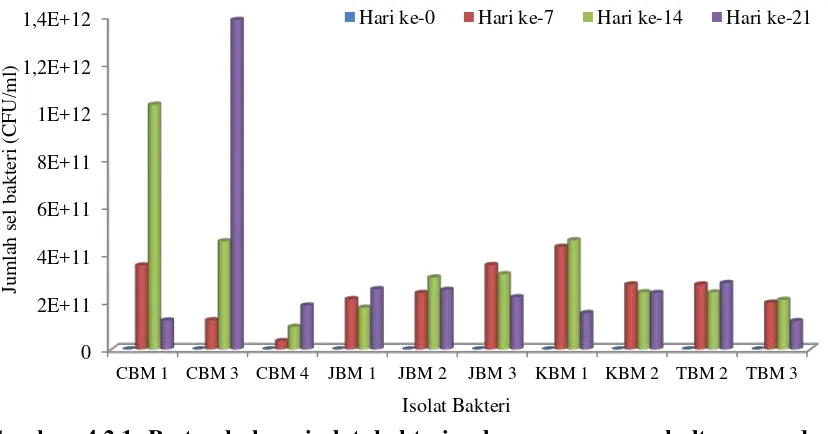
Standard Plate Count (SPC). Perhitungan dilakukan pada hari ke-7, hari ke-14 dan hari ke-21. Hasil pengamatan pertumbuhan isolat bakteri tanah pertanian Berastagi dapat dilihat pada Tabel 4.2.1 (gambar perhitungan pertumbuhan isolat dapat dilihat pada Lampiran 14f. halaman 50).
Tabel 4.2.1 Pertumbuhan Isolat Bakteri Selama Masa Pengkulturan pada Media BHB Mengandung Karbosulfan
Isolat Bakteri Jumlah Sel (CFU/ml)
Hari ke-0 Hari ke-7 Hari ke-14 Hari ke-21
0 tetapi ada beberapa bakteri seperti CBM 3, CBM 4, JBM 1 dan TBM 2 mengalami peningkatan jumlah sel pada hari ke-21. Hal ini disebabkan karena masing-masing isolat memiliki fase pertumbuhan yang berbeda-beda yaitu masa adaptasi dari tiap isolat terhadap nutrisi yang tersedia yaitu karbosulfan berbeda-beda dan kemampuan dari tiap isolat dalam menggunakan karbosulfan sebagai sumber karbon berbeda pula sehingga menyebabkan perbedaan laju pertumbuhan pada tiap isolat bakteri. Pertumbuhan isolat bakteri dapat dilihat pada Gambar 4.2.1
Gambar 4.2.1 Pertumbuhan isolat bakteri selama masa pengkulturan pada media BHB mengandung karbosulfan
Nasution (2011) menyatakan bahwa bakteri yang berasal dari Laut Tanjung Balai (TJB) mampu tumbuh pada media yang mengandung herbisida berbahan aktif glifosat dan memanfaatkannya sebagai sumber karbon dan energi. Pertumbuhan isolat bakteri mencapai 6,2 x 1012 CFU/ml. Tingkat toksisitas berdasarkan waktu paruhnya, karbosulfan lebih lama bila dibandingkan dengan glifosat, hal ini yang kemungkinan menyebabkan pertumbuhan pada media yang mengandung karbosulfan lebih rendah. Andreu & Pico (2004), waktu degradasi glifosat dalam tanah mencapai 47 hari, sedangkan karbofuran (golongan karbamat) mencapai 117 hari.
4.3 Aktivitas Biosurfaktan
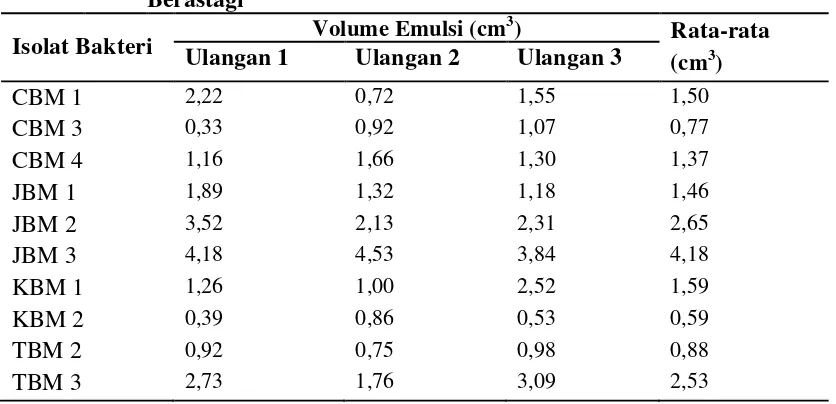
Aktivitas biosurfaktan diamati berdasarkan volume emulsi yang terbentuk diantara lapisan N-heksan dan cairan media (Lampiran 14.e halaman 51). Hasil uji aktivitas emulsifikasi menunjukkan bahwa masing-masing isolat memiliki aktivitas biosurfaktan yang bervariasi. Nilai aktivitas biosurfaktan isolat bakteri tanah pertanian Berastagi, Sumatera Utara dapat dilihat pada Tabel 4.3.1
Tabel 4.3.1 Aktivitas Biosurfaktan Isolat Bakteri dari Tanah Pertanian Berastagi
Isolat Bakteri Volume Emulsi (cm 3
0
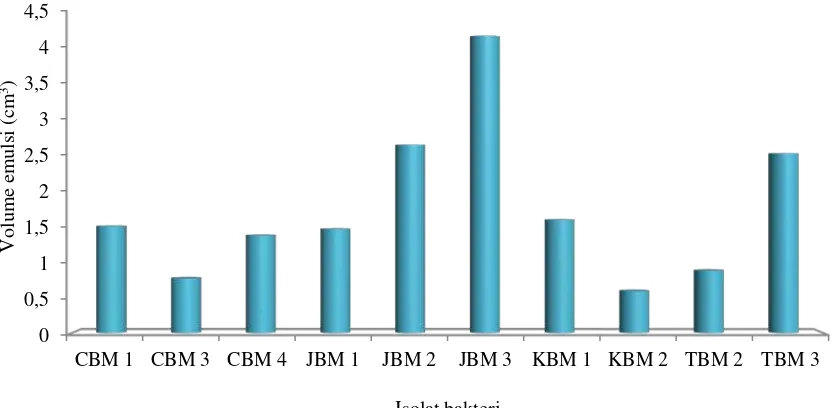
Gambar 4.3.1 Aktivitas biosurfaktan isolat bakteri tanah pertanian Berastagi
Tabel 4.3.1 dan Gambar 4.3.1 menunjukkan bahwa isolat JBM 3 memiliki aktivitas emulsi tertinggi dengan nilai aktivitas sebesar 4,18 cm3 kemudian diikuti oleh isolat JBM 2, TBM 3 dan KBM 1 dengan nilai aktivitas masing-masing sebesar 2,65, 2,53 dan 1,59 cm3. Sedangkan aktivitas emulsi terendah ditunjukkan oleh isolat KBM 2, dan tidak berbeda jauh dengan isolat CBM 3 dengan nilai aktivitas beturut-turut 0,59 dan 0,77 cm3. Dari data pertumbuhan sel isolat bakteri (Tabel 4.2.1) menunjukkan bahwa isolat CBM 3 memiliki laju pertumbuhan tertinggi, sedangkan aktivitas biosurfaktannya memiliki nilai yang terendah dibanding seluruh isolat yang diuji. Hal ini kemungkinan disebabkan karena perbedaan komponen dan jenis dari biosurfaktan yang dihasilkan oleh isolat bakteri.
Menurut Pacwa-Płociniczaket al. (2011) karakteristik utama dari biosurfaktan adalah memiliki bagian hidrofilik dan hidrofobik, dengan adanya bagian tersebut mempermudah bakteri untuk melarutkan zat yang tidak larut dalam air. Aktivitas surfaktan membuat surfaktan menjadi agen pengemulsi yang baik. Kosaric (1992) menyatakan bahwa emulsifikasi dari biosurfaktan dapat terjadi akibat adanya beberapa faktor. Diantaranya adalah keberadaan senyawa hidrofob dan senyawa hidrofil, kondisi air (salinitas dan pH), temperatur dan komponen ataupun molekul biosurfaktan itu sendiri.
4.4 Produksi Biosurfaktan
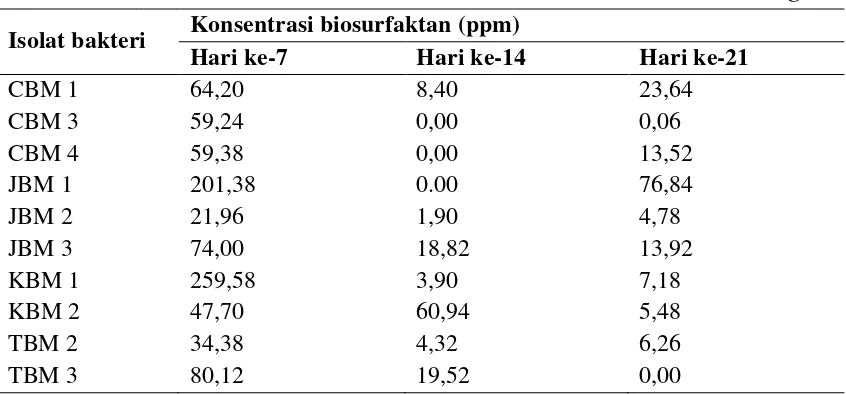
Produksi biosurfaktan dilakukan dengan menumbuhkan isolat bakteri pada media BHB mengandung karbosulfan dan diinkubasi pada shaker selama 21 hari. Sel bakteri dipisahkan dari supernatan dengan cara sentrifugasi dengan kecepatan 6000 rpm selama 10 menit. Pengukuran konsentrasi biosurfaktan yang terbentuk dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 421 nm. Produksi biosurfaktan yang dihasilkan isolat bakteri dapat dilihat pada Tabel 4.4.1
Tabel 4.4.1 Produksi Biosurfaktan Isolat Bakteri Tanah Pertanian Berastagi
Isolat bakteri Konsentrasi biosurfaktan (ppm)
Hari ke-7 Hari ke-14 Hari ke-21
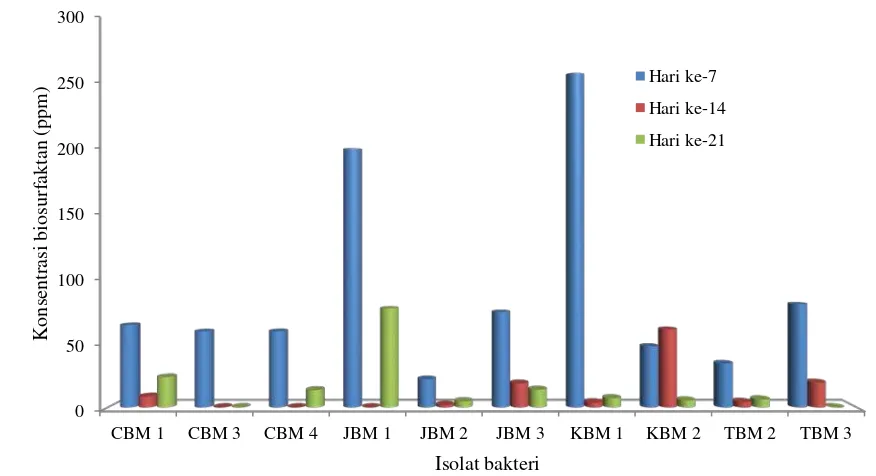
0
Gambar 4.4.1 Produksi biosurfaktan isolat bakteri tanah pertanian Berastagi
Tabel 4.4.1 dan Gambar 4.4.1 menunjukkan bahwa produksi tertinggi biosurfaktan masing-masing isolat terjadi pada hari ke-7 dan produksi biosurfaktan mengalami penurunan pada hari ke-14 dan hari ke-21. Konsentrasi biosurfaktan tertinggi dihasilkan isolat bakteri KBM 1, JBM 1, TBM 3 dan JBM 3 secara berurutan. Dari hasil pegukuran pertumbuhan sel (Tabel 4.2.1) dan aktivitas biosurfaktan (Tabel 4.3.1) isolat KBM 1 memiliki jumlah sel dan aktivitas biosurfaktan yang cukup tinggi, JBM 1 memiliki jumlah sel dan aktivitas biosurfaktan yang lebih rendah dari KBM 1, TBM 3 memiliki produksi biosurfaktan yang tinggi dibanding JBM 3 namun pada pertumbuhan sel dan aktivitas biosurfaktan TBM 3 lebih rendah, sedangkan JBM 3 memiliki jumlah sel yang cukup tinggi dan aktivitas biosurfaktannya tertinggi diantara semua isolat.
bagian karbosulfan yang tidak larut dalam air akan lebih mudah larut karena bisurfaktan memiliki molekul yang hidrofobik dan hidrofilik. Pada hari ke-14 produksi biosurfaktan turun secara drastis, namun pertumbuhan ada yang meningkat dan juga menurun, hal ini kemungkinan disebabkan oleh isolat bakteri lebih memilih menggunakan sumber karbon lain seperti surfaktan sintetik yang terdapat dalam pestisida.
Menurut Komarawidjaja (2009) dalam penelitiannya menyatakan perbedaan pertumbuhan bakteri diduga terjadi karena adanya perbedaan produksi biosurfaktan yang dihasilkan oleh bakteri. Biosurfaktan berperan dalam pembentukan emulsi yang mampu memanfaatkan senyawa hidrokarbon sebagai sumber karbon dalam melipatgandakan kepadatan sel di media uji. Li & Chen (2009) efek positif dari surfaktan dalam degradasi senyawa hidrokarbon berhubungan dengan peningkatan daya kelarutan dan pemutusan senyawa hidrokarbon. Menurut Batubara (2011), jumlah biosurfaktan yang dihasilkan juga tergantung dari bagaimana mikroorganisme tersebut menggunakan nutrisi yang tersedia. Perbedaan nutrisi akan mempengaruhi produksi biosurfaktan.
4.5 Potensi Bakteri Penghasil Biosurfaktan dalam Mendegradasi Karbosulfan
0
Tabel 4.5.1 Konsentrasi Karbosulfan Sisa Degradasi oleh Isolat Bakteri Tanah Pertanian Berastagi
Perhitungan untuk mencari % degradasi karbosulfan dapat dilihat pada Lampiran 12. halaman 45.
Berdasarkan Tabel 4.5.1 diketahui bahwa kedua isolat bakteri mampu menurunkan konsentrasi karbosulfan pada hari ke-21. Hal ini menunjukkan bahwa kedua isolat mampu meggunakan karbosulfan sebagai sumber karbon yang ditandai dengan terjadi penurunan konsentrasi karbosulfan. Dari kedua isolat bakteri, yang memiliki potensi yang lebih tinggi dalam menurunkan konsentrasi karbosulfan adalah isolat bakteri KBM 1. Untuk lebih jelasnya berikut Gambar 4.5.1 pengurangan konsentrasi karbosulfan pada hari ke-21.
Gambar 4.5.1 Konsentrasi karbosulfan sisa degradasi pada hari ke-21
bagi pestisida setelah diaplikasikan ke lingkungan. Degradasi akibat sinar matahari dipengaruhi intensitas, spektrum sinar matahari, lamanya terpapar dan sifat dari pestisida.
Kemampuan isolat bakteri JBM 3 dan KBM 1 dalam menurunkan konsentrasi karbosulfan setelah 21 hari masa inkubasi menunjukkan bahwa isolat bakteri mampu menggunakan karbosulfan sebagai sumber karbon. Mujeeb et al. (2011) bahwa pengayaan, isolasi dan karakterisasi bakteri yang mampu mendegradasi karbosulfan, delapan isolat bakteri dipilih berdasarkan tingkat toleransi terhadap karbosulfan. Isolat tumbuh setelah 72 jam pada media lempeng pestisida. Pengaruh insektisida terhadap mikroorganisme tergantung pada sifat dan konsentrasi insektisida, jenis mikroorganisme dan lingkungan dari mikroorganisme yang tumbuh. Suhu dan pH optimum untuk pertumbuhan bakteri dalam mendegradasi insektisida berkisar 30-42°C dan 6,5-7,5. Tingkat biodegradasi umumnya menurun dengan penurunan suhu, mungkin karena tingkat penurunan aktivitas enzimatik.
Suherman (2000), bioremediasi pestisida organofosfat diazinon dengan menggunakan mikroba indigenous dari areal persawahan menunjukkan penurunan konsentrasi diazinon setelah inkubasi selama 27 jam yaitu sebesar 55,52% konsentrasi awal 50 ppm. Berdasarkan waktu paruhnya, karbosulfan lebih lama bila dibandingkan dengan diazon, hal ini yang kemungkinan menyebabkan penurunan karbosulfan lebih rendah. Andreu & Pico (2004), waktu degradasi karbofuran (golongan karbamat) mencapai 117 hari, sedangkan diazinon (golongan organofosfat) mencapai 40 hari.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian tentang isolasi dan uji potensi bakteri tanah pertanian Berastagi, Sumatera utara dalam mendegradasi insektisida Marshal berbahan aktif karbosulfan dapat diambil kesimpulan sebagai berikut:
a. Isolasi bakteri penghasil biosurfaktan dari tanah pertanian Berastagi, Sumatera utara diperoleh sebanyak 16 isolat.
b. Isolat JBM 3 memiliki nilai aktivitas biosurfaktan tertinggi dengan nilai aktivitas sebesar 4,18 cm3 yang terendah ditunjukkan oleh isolat KBM 2 dengan nilai aktivitas sebesar 0,59 cm3
c. Isolat KBM 1 dan JBM 3 memiliki kemampuan menurunkan konsentrasi karbosulfan selama masa pengkulturan. Isolat KBM 1 mampu menurunkan konsentrasi karbosulfan hingga 50% dan bila dibandingkan dengan kontrol 40,47%, isolat JBM 3 mampu menurunkan konsentrasi karbosulfan sebesar 44 % jika dibandingkan dengan kontrol 33,33%.
. Konsentrasi biosurfaktan terbaik ditunjukkan oleh isolat KBM
1 sebesar 259,58 ppm dan yang terendah ditunjukkan oleh isolat JBM 2 sebesar 21,96 ppm pada hari ke-7.
5.2 Saran
DAFTAR PUSTAKA
Afriyanto. 2008. Kajian Keracunan Pestisida pada Petani Penyemprot Cabe di Desa Candi Kecamatan Bandungan Kabupaten Semarang. Thesis. Semarang: Universitas Diponegoro Semarang.
Aiyushirota. 2010. Biosurfaktan pada Akuakultur: Busa Putih di Air Kolam.
Biotechnology Consulting & Trading.
Ak’yunin, K. 2008. Toksisitas Beberapa Golongan Insektisida terhadap Mortalitas Selenothrips rubrocinctus (Giard) pada Tanaman Jarak Pagar (Jatropha curcas L.). Skripsi. Malang: Universitas Negeri Islam Malang.
Andreu, V & Y. Pico. 2004. Determination of Pesticides and Their Degradation Products in Soil: Critical Review and Comparison of Methods. Trends in Analytical Chemistry 23(10–11): 772-789.
Atlas, R.M. 1946. Handbook of Media for Environmental Microbiology. New York: CRC Press. hlm. 286.
Baehaki. 1993. Insektisida Pengendalian Hama Tanaman. Bandung: Angkasa Bandung. hlm. 56-57.
Batubara, N.R. 2011. Optimasi Produksi Biosurfaktan oleh Pseudomonas aeruginosa dengan Variasi Sumber Karbon dan Nitrogen. Skripsi. Medan: Universitas Sumatera Utara.
Bayoumi, R.A., H.A. Atta, M.A. El-Sehrawey & S.M. Selim. 2011. Microbial Production of Biosurfactants from Some El-Korma Governorate Microbial Isolates for Bioremediation of Crude Oil Spills in the Different Environments.
Journal of Basic and Applied Scientific Research 1(10): 1541-1555.
Cappucino, J.G. & N. Sherman. 1983. Microbiology a Laboratorory Manual. 4th edition. Menlo Park: Addison-Wesley Publishing Company. hlm. 148.
Chapalamadugu, S & G.R. Chaudhry. 1992. Microbiological and Biotechnological Aspects of Metabolism of Carbamates and Organophosphates. Critical Reviews in Biotechnology 12(5): 357-389.
Cheowtirakul, C & N. D. Linh. 2010. The Study of Biosurfactant as a Cleaning Agent For Insecticide Residue in Leafy Vegetables. AU J.T. 14(2): 75-87.
Effendy, E & R.L. Widajatno. 2010. Biodegradasi 2,4-Diklorofenol oleh Bakteri
Alcaligenes sp. dan Bacillus sp. Jurusan Teknik Kimia Fakultas Teknik Universitas Diponegoro: Seminar Rekayasa Kimia Dan Proses.
European Food Safety Authority (EFSA). 2009. Conclusion on the Peer Review of the Pesticide Risk Assessment of the Active Substance Carbosulfan. EFSA Journal: Parma, Italy 7(10): 1-112.
Fardiaz, S. 1992. Mikrobiologi Pangan 1. Jakarta: Gramedia Pustaka Umum. hlm. 34. Fessenden R.J & Fessenden J.S. 1989. Kimia Organik. Terjemahan. Ed 3. Jilid
ke-2. Jakarta: Erlangga. hlm. 61.
Glover, T. & K. Mitchell. 2002. An Introduction to Biostatistic. New York: Mc Graw-Hill Companies, Inc. hlm. 28.
Hameed, S.F & S.P. Singh. 1998. Handbook of Pest Management. New Delhi: Kalayani Publishers. hlm. 32.
Hayatsu, M., M. Hirano & T. Nagata. 1999. Involvement of Two Plasmids in the Degradation of Carbaryl by Arthrobacter sp. Strain RC100. Appl. Environ. Microbiol.65(3):1015-1019.
Indraningsih & Y, Sani. 2006. Residu Pestisida dalam Jaringan Otak Sapi Perah di Lembang, Jawa Barat. Jurnal Ilmu Ternak dan Veteriner 11(1): 76-83.
Jain, D.K., D.L.C. Thompson, H. Lee & J.T. Trevois. 1991. A Drop Collapsing Test for Screening Surfactant Producing Microorganism. Microbial Method 13: 271-279.
Kadarwati, S. 2006. Karakterisasi Biosurfaktan yang Dihasilkan Bakteri Providancia rettgeri dan Bacillus subtilis dari Reservoir Minyak di Indonesia. Lembaran Publikasi Lemigas 42 (3): 18-26.
Katagi, T. 2004. Photodegradation of Pesticides on Plant and Soil Surfaces. Rev Environ Contam Toxicol. 182: 1–195.
Koch, A.K., O. Kappeli, A. Fiecher & J. Reiser. 1991. Hydrocarbon Assimilation and Biosurfactant Production in Pseodomonas aureginosa Mutant. Journal Bacteria 173: 4212-4219.
Komarawidjaja, W. 2009. Karakteristik dan Pertumbuhan Konsorsium Mikroba Lokal dalam Media Mengandung Minyak Bumi. J. Tek. Ling. 10(1): 114-119.
Kosaric, N. 1992. Biosurfactants in Industry. Pure and Appl. Chem. 64: 1731-1737. Lay, B.W. 1994. Analisis Mikroba di Laboratorium. Jakarta: PT. Raja Grafindo
Li Jing-Liang & Chen Bing-Hung. 2009. Surfactant-mediated Biodegradation of Polycyclic Aromatic Hydrocarbons. J. Materials 2: 76-94.
Manuaba, I.B.P. 2009. Cemaran Pestisida Karbamat dalam Air Danau Buyan Buleleng Bali. Jurusan Kimia FMIPA Universitas Udayana: Jurnal Kimia
3(1): 47-54.
Miskiyah & S.J. Munarso. 2009. Kontaminasi Residu Pestisida pada Cabai Merah, Selada, dan Bawang Merah (Studi Kasus di Bandungan dan Brebes Jawa Tengah serta Cianjur Jawa Barat). Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian. Jurnal Hortikultur 19 (1): 101-111.
Mujeeb, K. A., S. Mushtaq, M. H. Abbasi, A. Riaz & S. S. Ali. 2011. Identification and Characterization of Carbosulfan Degrading Bacteria from Different Areas of Punjab. Sci.Int. (Lahore) 23(4): 299-306.
Mukhlis, Sarifuddin dan H, Hanum. 2011. Kimia Tanah Teori dan Aplikasi. Medan: USU Press. hlm. 79.
Murthy, P.K., T. Niranjan & N.V. Naidu. 2011. A Novel Spectrophotometric Method for the Determination of Carbosulfan with 4-Methylaniline. Sri Venkateswara University: Journal of Chemical and Pharmaceutical Research 3(6): 28-32. Nababan, B. 2008. Isolasi dan Uji Potensi Bakteri Pendegradasi Minyak Solar dari
Laut Belawan. Tesis. Medan: Universitas Sumatera Utara.
Nasution, N. 2011. Potensi Isolat Bakteri Penghasil Biosurfaktan Asal Laut Tanjung Balai dan Sibolga Sumatera Utara dalam Mendegradasi Glifosat. Skripsi. Medan: Universitas Sumatera Utara.
Pacwa-Płociniczak, M., G. A. Płaza, Z. Piotrowska-Seget & S. S. Cameotra. 2011. Environmental Applications of Biosurfactants: Recent Advances. Int. J. Mol. Sci. 12: 633-654.
Panjaitan, I.L.W. 2010. Isolasi dan Uji Potensi Bakteri Penghasil Biosurfaktan Asal Laut Belawan Sumatera Utara dalam Mendegradasi Naftalen. Skripsi. Medan: Universitas Sumatera Utara.
Rahmansyah, M & N, Sulistinah. 2009. Performa Bakteri pada Tanah Tercemar Pestisida. Pusat Penelitian Biologi LIPI: Berita Biologi 9 (5): 657-664.
Rosenberg, M., D. Gutnick, & E. Rosenberg. 1980. Adherence of Bacteria to Hydrocarbons: A Simple Method for Measuring Cell-surface Hydrophobicity.
FEMS Microbiology Letters 9: 29-33.
Saenong, M.S. 2007. Beberapa Senyawa Pestisida yang Berbahaya. Prosiding Seminar Ilmiah dan Pertemuan Tahunan PEI dan PFI XVIII Komda Sul-Sel:
192-198.
Sarjan, M. 2004. Pengelolaan Hama Terpadu (Pertarungan antara Teknologi Konvensional Versus Modern) dalam Rangka Pencapaian Produksi Pertanian Secara Kuantitatif dan Kualitatif. Pidato Pengukuhan Guru Besar Universitas Mataram.
Sinulingga, K. 2005. Analisis Residu Piretroid pada Sampel Wortel di Daerah Sentra Produksi Kab. Karo SUMUT. Universitas Sumatera Utara: Jurnal Sistem Teknik Industri 6: 64-68.
Sofia, D. 2001. Pengaruh Pestisida dalam Lingkungan Pertanian. Fakultas Pertanian. Universitas Sumatera Utara.
Suherman, A.D. 2000. Bioremediasi Residu Pestisida Jenis Organofosfat secara Ex Situ dengan Menggunakan Mikroba Indigenous dari Areal Persawahan. Skripsi. Bogor: Institut Pertanian Bogor.
Sulistiyono, L. 2004. Dilema Penggunaan Pestisida dalam Sistem Pertanian Tanaman Hortikultura di Indonesia.. Tesis. Bogor: Institut Pertanian Bogor. Triharso. 2004. Dasar-Dasar Perlindungan Tanaman. Yogyakarta: Gadjah Mada
University Press.hlm. 86.
Untung, K. 2006. Pengantar Pengelolaan Hama Terpadu. Yogyakarta: UGM Press. hlm. 25, 67.
Wahyuni, S. 2010. Perilaku Petani Bawang Merah dalam Penggunaan dan Penanganan Pestisida Serta Dampaknya Terhadap Lingkungan.
Warsito, K. 2009. Isolasi dan Potensi Bakteri Penghasil Biosurfaktan dari Laut Sibolga dan Tanjung Balai Sumatera Utara dalam Mendegradasi Naftalen. Skripsi. Medan: Universitas Sumatera Utara.
Wudianto, R. 1997. Petunjuk Penggunaan Pestisida. Jakarta: PT Penebar Swadaya. hlm. 43-45.
Yuantari, M.G.C. 2009. Studi Ekonomi Lingkungan Penggunaan Pestisida dan Dampaknya pada Kesehatan Petani di Area Pertanian Hortikultura Desa Sumber Rejo Kecamatan Ngablak Kabupaten Magelang Jawa Tengah. Thesis. Semarang: Universitas Diponegoro.
LAMPIRAN
Lampiran 1. Komposisi Media Bushnell-Haas, Larutan Standar Mc. Farland, Larutan Orsinol
a. Komposisi Media Bushnell-Haas per liter (Atlas, 1946)
1) KH2PO4 = 1,0 g 5) FeCl3
Kemudian semua komposisi ini dilarutkan dengan air laut steril sebanyak 1 liter dan disterilkan dengan autoclave.
O = 0,2 g
b. Komposisi Larutan Mc. Farland
Sebanyak 0,5 ml BaCl2 0,048 M ditambahkan ke dalam 99,5 ml H2SO4
Kemudian divorteks hingga homogen.
0,35 N.
c. Komposisi Larutan Orsinol (Koch et al., 1991)
Sebanyak 100 mg orsinol dilarutkan dalam 100 ml H2SO4 53%, kemudian
didiamkan selama 12 jam hingga warna kuning sempurna. d. Insektisida Marshal 200 EC
Komposisi:
Lampiran 2. Alur Kerja Isolasi Bakteri
dimasukkan ke dalam plastik steril diencerkan hingga konsentrasi 10-2
diinokulasikan sebanyak 0,1 ml ke media Bushnell- Hass Agar (BHA) yang mengandung 12 ppm karbosulfan dengan merek dagang Marshal
diinkubasi pada suhu 330
dimurnikan koloni yang berbeda pada media Tripton Soya Agar
C selama 10-15 hari Tanah
Hasil Pengenceran
Lampiran 3. Alur Kerja Karakterisasi Morfologi dan Sifat Biokimia Bakteri (Cappuccino and Sherman, 1983; Lay, 1994)
Isolat Bakteri
Karakterisasi
Morfologi Pewarnaan Gram Uji Biokimia
Bentuk koloni Warna koloni Elevasi koloni Tepi koloni Bentuk sel Penataan sel
Uji motilitas Uji sitrat
Uji hidrolisa pati Uji katalase Uji sulfida Uji gelatin
Lampiran 4. Alur Kerja Estimasi Jumlah Isolat Bakteri dengan Metode Standard Plate Count (SPC)
Dibuat dalam bentuk suspensi yang setara dengan kekeruhan larutan Mc-Farland (≈ 108
Diinokulasikan sebanyak 2 ml ke 100 ml media BHB mengandung 12 ppm karbosulfan dengan merek dagang Marshal
sel/ml)
Diinkubasi pada waterbath shaker dengan kondisi gelap, kecepatan 150 rpm pada suhu 300C selama 21 hari
diencerkan hingga konsentrasi 10
diinokulasikan ke media Plate Count Agar dengan metode cawan sebar
-7
diinkubasi selama 24 jam
dihitung jumlah koloni yang tumbuh Hasil
Lampiran 5. Alur Kerja Screening Aktivitas Biosurfaktan Metode Drop Collapsing Test (Jain, et al., 1991) yang Dimodifikasi
dibuat dalam bentuk suspensi yang setara dengan kekeruhan larutan Mc-Farland (≈108
diinokulasikan sebanyak 2 ml ke 100 ml media
Bushnell-Haas Broth (BHB) yang mengandung 2% dekstros
sel/ml)
diinkubasi pada shaker dengan kondisi gelap, kecepatan 150 rpm pada suhu 30oC selama 15 hari
disaring dengan kertas saring
diambil sebanyak 4 ml
dimasukkan ke dalam tabung reaksi ditambah 4 ml N-heksan
ditambah 2 ml akuades divorteks selama 10 detik
diukur ketebalan emulsi yang terbentuk dengan jangka sorong
Isolat Bakteri
Biakan Bakteri
Filtrat Residu
Absorbansi
Lampiran 6. Alur Kerja Pembuatan Kurva Standar Biosurfaktan
Rhamnosa
Dilarutkan dengan larutan sodium bikarbonat (NaHCO3
Dimasukkan ke dalam tabung reaksi sebanyak 2 ml ) 0,05 M dengan konsentrasi 0 (blanko), 10 ppm, 50 ppm, 100 ppm dan 200 ppm
Dihomogenkan dengan vorteks Ditambahkan 3,6 ml orsinol Dipanaskan hingga mendidih
Didinginkan selama 15 menit pada temperatur kamar Diukur absorbansinya dengan spektrofotometer pada panjang gelombang 421 nm
Ditentukan persamaan garis regresi kurva standar rhamnosa dengan memplot absorbansi dan konsentrasi rhamnosa dengan metode Least Square
Lampiran 7. Alur Kerja Produksi Biosurfaktan Metode Orsinol yang Dimodifikasi
Dibuat dalam bentuk suspensi yang setara dengan kekeruhan larutan Mc-Farland (≈ 108
Diinokulasikan sebanyak 2 ml ke 100 ml media BHB mengandung 12 ppm karbosulfan dengan merek dagang Marshal
sel/ml)
Diinkubasi pada waterbath shaker dengan kondisi gelap, kecepatan 150 rpm pada suhu 300C selama 21 hari
Disentrifugasi dengan kecepatan 6000 rpm selama 10 menit
Diambil sebanyak 4 ml
Diekstrak dengan 2 ml dietileter selama 5 menit Diulangi sampai 3 kali
Dikeringkan
Dilarutkan kembali dalam 2 ml NaOHCO3
Dihomogenkan dengan vorteks
0,05 M
Ditambahkan 3,6 ml larutan orsinol Dipanaskan hingga mendidih
Didinginkan selama 15 menit pada temperatur kamar
Lampiran 8. Penentuan Kurva Standar Biosurfaktan
No Konsentrasi Rhamnosa (ppm) Absorbansi
1 10 0,151
2 50 0,349
3 100 0,523
4 200 1,134
Untuk menentukan persamaan garis regresi kurva standar rhamnosa digunakan metode Least Square, nilai konsentrasi rhamnosa dimasukkan sebagai nilai X dan absorbansi sebagai nilai Y.
Tabel persamaan garis regresi kurva standar rhamnosa metode Least Square,
� = ∑XY−
Sedangkan untuk mencari persamaan garis dari data dan kurva di atas, masukkan nilai yang diperoleh ke rumus berikut:
Y = a + bX Y = a+ bX
b =
n(XY)−(∑ X)(∑ Y)n ∑(X2)− (∑ X)2 a = Y- bX
b = 0,005 = 0,089
Dari nilai a dan b yang diperolehdari data di atas, maka persamaan kurva standar rhamnosa adalah: Y = 0,089 + 0,005 X
Dimana, Y = Absorbansi
X = Konsentrasi biosurfaktan (ppm)
Untuk mencari konsentrasi biosurfaktan dari masing-masing sampel, substitusikan nilai absorbansi yang diperoleh dari sampel ke persamaan di atas.
Isolat bakteri
Absorbansi Konsentrasi Biosurfaktan (ppm)
Lampiran 9. Alur Kerja Penentuan Kurva Standar Karbosulfan
Dibuat dengan konsentrasi 0,3067, 1,0223, 2,0446, 4,0892, dan 8,1784 ppm
Diinjeksikan masing-masing konsentrasi sebanyak 1 μl ke dalam GC
Ditentukan persamaan garis regresi kurva standar karbosulfan dengan memplot luas area dan konsentrasi karbosulfan dengan metode Least Square
Kurva Standar Karbosulfan Luas Area
Lampiran 10. Uji Potensi Bakteri Penghasil Biosurfaktan Dalam Mendegradasi Karbosulfan Dan Analisa Karbosulfan Sisa Dengan Metode GC (Gas Chromatography) (Balai Pengujian Mutu Produk Tanaman)
Dibuat dalam bentuk suspensi yang setara dengan kekeruhan
Mc-Farland (≈ 108 sel/ml)
Diinokulasikan sebanyak 20 ml ke 980 ml media BHB yang mengandung 12 ppm karbosulfan dengan merek dagang Marshal
Diinkubasi pada shaker dengan kondisi gelap, kecepatan 150 rpm pada suhu 300C selama 21 hari
Dimasukkan 300 ml ke dalam corong pisah Ditambahkan diklorometan sebanyak 100 ml Diekstrak hingga terbentuk 2 fasa
Ditambahkan kembali diklorometan 50 ml Dilakukan siklus ini sebanyak dua kali Dilakukan evaporasi hingga hampir kering
Ditambahkan isooktan : toulen (9 : 1) sampai volume mencapai 3 ml Diinjeksikan ke dalam GC
Fasa Air Media Isolat Bakteri
Fasa Organik
Lampiran 11. Kurva Standar Karbosulfan
No Konsentrasi Karbosulfan (mg/kg) Luas Area
1 0,3067 3486,96
2 1,0223 20865,07
3 2,0446 49704,73
4 4,0892 117849,48
5 8,1784 222156,19
Untuk menentukan persamaan garis regresi kurva standar karbosulfan digunakan metode Least Squere, nilai konsentrasi karbosulfan dimasukkan sebagai nilai X dan luas area sebagai Y.
No X Y X2 Y2 XY
1 0,3067 3486,96 0,094065 12158890,04 1069,451
2 1,0223 20865,07 1,045097 435351146,1 21330,36
3 2,0446 49704,73 4,180389 2470560184 101626,3
4 4,0892 117849,48 16,72156 13888499936 481910,1
5 8,1784 222156,19 66,88623 49353372755 1816882
n=5 ΣX=15,6412 X= 3,12824
ΣY=414062,4 Y=82812,49
ΣX2=88,92733 ΣY2=66159942912 ΣXY=2422818
Untuk mencari nilai R (regresi) masukkan nilai yang diperoleh ke rumus berikut:
� = ∑XY−
(∑X)(∑Y)
�
��∑X2−(∑X)2
n ��∑Y2−
(∑Y)2
n �
R=0,9986
Sedangkan untuk mencari persamaan garis dari data dan kurva di atas, masukkan nilai yang diperoleh ke rumus berikut:
Y = a + bX Y = a+ bX
b =
n(XY)−(∑ X)(∑ Y)n ∑(X2)− (∑ X)2 a = Y- bX
b = 28189,7681 = -5371,8742
Dari nilai a dan b yang diperoleh dari data di atas, maka persamaan kurva standar rhamnosa adalah: Y = 28189,7681 X - 5371,8742
Dimana: Y = Luas area
Lampiran 12. Perhitungan Mencari % degradasi Karbosulfan
Isolat bakteri Konsentrasi karbosulfan (ppm) Hari ke-0 Hari ke-21
Kontrol 0,050 0,042
JBM 3 0,050 0,028
KBM 1 0,050 0,025
Pengurangan karbosulfan pada hari ke-21.
= 100% − �konsentrasi karbosulfan hari ke−21
konsentrasi karbosulfan hari ke−0 × 100%�
Contoh:
Pengurangan karbosulfan pada hari ke-21 perlakuan kontrol = 100% − �0,042
0,050× 100%�
= 100% −84%
= 16%
Pengurangan karbosulfan pada perlakuan isolat terhadap kontrol pada hari ke-21.
= 100% − � konsentrasi karbosulfan perlakuan isolat hari ke−21
konsentrasi karbosulfan perlakuan kontrol hari ke−21× 100%�
Contoh:
Pengurangan karbosulfan pada perlakuan isolate JBM 3 terhadap control hari ke-21 = 100% − �0,028
0,042× 100%�
= 100% −[66,666%]
Lampiran 13. Hasil Pengujian Karbosulfan Sisa dari Balai Pengujian Mutu Produk Tanaman, Jakarta
Lampiran 14. Gambar Hasil Penelitian
a. Isolasi bakteri pada Media Bushnell-Hass Agar
b. Isolat bakteri
(a) Isolat bakteri JBM 3, (b) Pewarnaan Gram isolat bakteri JBM 3, (c) Isolat bakteri KBM 1, (d) Pewarnaan Gram isolat bakteri KBM 1
a b
c. Uji Biokimia
(a) Uji hidrogen sulfida dan fermentasi gula, (b) Uji sitrat, (c) Uji motilitas, (d) Uji hidrolisa gelatin
a b
c
a
b
c
d. Kultur cair isolat bakteri pada media Bushnell-Hass Broth
(a) Kultur bakteri JBM 3, (b) Kultur bakteri KBM 1
e. Screening aktivitas biosurfaktan metode emulsifikasi
(a) lapisan N-heksan, (b) emulsi, (c) lapisan kultur isolat
f. Perhitungan pertumbuhan isolat bakteri pada media PCA
(a) JBM 3, (b) KBM 1