Lampiran 2. Bagan alur penelitian
dicuci hingga bersih
ditiriskan hingga tidak ada lagi air
ditimbang
dikeringkan di lemari pengering
dihaluskan dan ditimbang beratnya
Lampiran 3. Gambar teripang, simplisia dan serbuk simplisia teripang
Holothuria atra Jaeger.
Teripang segar Holothuria atra Jaeger
Lampiran 3 (lanjutan)
Simplisia hewan teripang Holothuria atra Jaeger
Lampiran 4. Gambar mikroskopik teripang Holothuria atra Jaeger
Keterangan perbesaran 10x40: 1. Spikula tipe rosettes 2. Spikula tipe rod
3. Spikula tipe pseudo-button
1
Lampiran 5. Perhitungan pemeriksaan karakteristik serbuk simplisia hewan teripang Holothuria atra Jaeger
1. Perhitungan kadar air serbuk simplisia hewan teripang
% Kadar air simplisia = x100%
(g)
2. Perhitungan kadar sari larut dalam air
Lampiran 5 (lanjutan)
3. Perhitungan kadar sari simplisia larut dalam etanol
Lampiran 5 (lanjutan)
4. Perhitungan kadar abu total simplisia
% Kadar abu total = x 100%
5. Perhitungan kadar abu simplisia tidak larut dalam asam
Lampiran 5 (lanjutan)
1. Kadar abu tidak larut dalam asam
=
= 4,02%
2. Kadar abu tidak larut dalam asam =
= 4,21%
3. Kadar abu tidak larut dalam asam =
= 3,93 %
Lampiran 6. Bagan pembuatan ekstrak etanol simplisia hewan teripang.
dimasukkan ke dalam bejana tertutup
dimaserasi dengan etanol 96% selama 3 jam, sambil sesekali diaduk
dimasukkan ke dalam perkolator
ditambahkan pelarut etanol 96% secukupnya sampai terdapat selapis peyari diatas simplisia
didiamkan selama 24 jam
dijalankan perkolator dengan kecepatan 1 mL/menit
dipekatkan dengan rotary evaporator pada suhu 40 - 60° C
ditimbang Ekstrak kental
(40,21 g) Serbuk simplisia
(350 g)
Lampiran 7. Bagan pembuatan fraksi n-heksan dan fraksi etilasetat teripang.
Ditambahkan 20 ml etanol dan 100 ml akuades
Dihomogenkan
Dimasukkan dalam corong pisah Diekstraksi dengan 50 ml n-heksan sebanyak 3 kali
Dikocok dan didiamkan sampai terbentuk dua lapisan dan dipisahkan
Diekstraksi dengan 50 ml Dikumpulkan Etilasetat sebanyak 3 kali Dipekatkan dengan
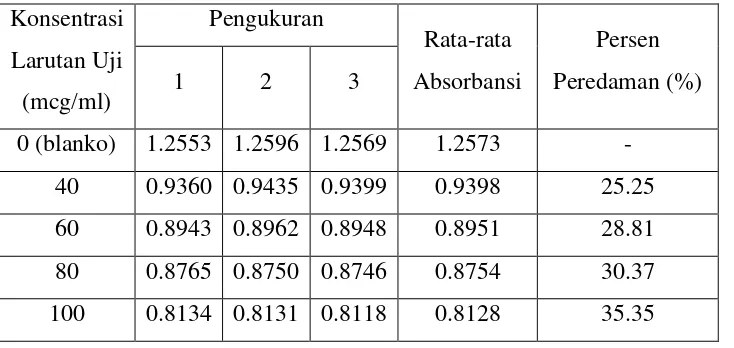
Lampiran 9. Hasil uji aktivitas antioksidan ekstrak etanol dan fraksi teripang 1. Ekstrak etanol teripang Holothuria atra Jaeger
Tabel pengukuran absorbansi ekstrak etanol teripang Holothuria atra Jaeger
Keterangan : A kontrol = Absorbansi tidak mengandung sampel A sampel = Absorbansi mengandung sampel
Perhitungan % peredaman ekstrak etanol teripang Holothuria atra Jaeger
Lampiran 9 (lanjutan)
2. Fraksi n-heksan teripang Holothuria atra Jaeger
Tabel pengukuran absorbansi fraksi n-heksan teripang Holothuria atra Jaeger Konsentrasi
Lampiran 9 (lanjutan)
Perhitungan % peredaman ekstrak etanol teripang Holothuria atra Jaeger
- Konsentrasi 40 mcg/ml
= 1,73 % - Konsentrasi 60 mcg/ml
= 2,35 % - Konsentrasi 80 mcg/ml
= 2,68 % - Konsentrasi 100 mcg/ml
Lampiran 9 (lanjutan)
3. Fraksi etilasetat teripang Holothuria atra Jaeger
Tabel pengukuran absorbansi fraksi etilasetat teripang Holothuria atra Jaeger Konsentrasi
Keterangan : A kontrol = Absorbansi tidak mengandung sampel A sampel = Absorbansi mengandung sampel
Perhitungan % peredaman ekstrak etanol teripang Holothuria atra Jaeger
Lampiran 9 (lanjutan)
4. Fraksi Air (sisa) Teripang Holothuria atra Jaeger
Tabel pengukuran absorbansi fraksi n-heksan teripang Holothuria atra Jaeger Konsentrasi
Lampiran 9 (lanjutan)
Perhitungan % peredaman ekstrak etanol teripang Holothuria atra Jaeger - Konsentrasi 40 mcg/ml
= 32,68 % - Konsentrasi 60 mcg/ml
= 34,17 % - Konsentrasi 80 mcg/ml
= 39,92 % - Konsentrasi 100 mcg/ml
Lampiran 10. Perhitungan nilai IC50 .
a. Perhitungan nilai IC50 ekstrak etanol teripang Holothuria atra Jaeger
X Y XY X2
Jadi, persamaan garis regresi Y = 0,2070X + 3,324
Nilai IC50 : Y = 0,2070X + 3,324
50 = 0,2070X + 3,324 X = 225,49
Lampiran 10 (lanjutan)
b. Perhitungan nilai IC50 fraksi n-heksan teripang Holothuria atra Jaeger
Lampiran 10 (lanjutan)
c. Perhitungan nilai IC50 fraksi etilasetat teripang Holothuria atra Jaeger
X Y XY X2
Jadi, persamaan garis regresi Y = 0,3371X + 7,0784
Nilai IC50 : Y = 0,3371X + 7,0784
50 = 0,3371X + 7,0784 X = 127,33
Lampiran 10 (lanjutan)
d. Perhitungan nilai IC50 fraksi air teripang Holothuria atra Jaeger
X Y XY X2
Jadi, persamaan garis regresi Y = 0,4339X + 6,1176
Nilai IC50 : Y = 0,4339X + 6,1176
50 = 0,4339X + 6,1176 X = 101,13
DAFTAR PUSTAKA
Ain, N. (2010). Daya Antibakteri Ekstrak Teripang Laut (Holothuria atra) Terhadap Kuman Penyebab Infeksi Nasokomial pada Luka Operasi.
Skripsi. Surakarta: Fakultas Kedokteran Universitas Sebelas Maret. Hal. 1-3.
Althunibat, O.Y., Ridzwan, B.H., Taher, M., Daud, J.M., Ichwan, S.J.H. dan Qaralleh, H. (2013). Antioxidan and Cytotoxic Proprties of Two Sea Cucumber, Holothuria edulis Lesson and Stichopus horrens Selenka. Acta Biological Hungarica. 64(1): 10-20.
Anonim. (2014). Teripang Emas Menurut Penelitian Diberbagai Universitas. Pada situs http://www.teripangemas.com/ diakses pada tanggal 15 Oktober 2015.
Baradinath, A.V., Mallikarjuna, K., Chetty, C.M.S., Ramkanth, S., Rajan, T.V.S., dan Gnanaprakash, K. (2010). A Review of In-vitro Antioxidant Methods: Comparisons, Correlations and Consideration. International Journal of Pharm Tech Research. 2(2): 1276-1285.
Basset, J., Denney, R.C., Jeffrey, G.H., dan Mendham, J. (1994). Buku Ajar Vogel: Kimia Analisis Kuantitatif Anorganik. Edisi 4. Jakarta: EGC. Hal. 165.
Behndig A., Svensson B., Marklund S.T., dan Karisson K. (1998). Superoxide Dismutase in Human eye. Invest Ophthalmol Vis Sci. 39(3): 471-475
Conand, C., dan Byrne, M. (1993). A Review of Recent Developments in The World Sea Cucumber Fisheries. Marine Fisheries Review. 55(4):1-13. Day, R.A., dan Underwood, A.L. (1986). Analisis Kimia Kualitatif. Edisi
Keenam. Terjemahan Iis Sopyan. Jakarta: Penerbit Erlangga. Hal. 382. Depkes RI. (1979). Farmakope Indonesia. Edisi III. Jakarta: Direktorat Jenderal
Pengawas Obat dan Makanan Departemen Kesehatan RI. Hal. 772.
Depkes RI. (1995). Materia Medika Indonesia. Jilid Keenam. Jakarta: Direktorat Jenderal Pengawas Obat dan Makanan Departemen Kesehatan RI. Hal. 302, 321, 325.
Depkes RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Direktorat Jenderal Pengawas Obat dan Makanan Departemen Kesehatan RI. Hal. 10-11.
Farnsworth, N. R. (1966). Biological and Phytochemical Screening Of Plants.
Francis, G., Zohar, K., Harinder, P.S., Makkar dan Klaus, B. (2002). The Biological Action of Saponins in Animal System : A Review. British Journal of Nutrition.88(1): 587-605.
Ghufron, M., dan Kordi, H.K. (2010). A to Z Budi Daya Biota Akuatik untuk Pangan, Kosmetik dan Obat-obatan. Yogyakarta: Lily Publisher. Hal. 24-36,39.
Gunawan, D. & Sri, M. (2004). Ilmu Obat Alam (Farmakognosi). Jilid 1. Jakarta: Penebar Swadaya. Hal. 87-92.
Harborne, J.B. (1987). Metode Fitokimia: Penuntun Cara Modern Menganalisa Tumbuhan. Terjemahan: Kosasih Padmawinata. Edisi II. Bandung: ITB Press. Hal. 6-8.
Ionita, P., (2005). Is DPPH Stable Free Radical a Good Scavenger for Oxygen Active Species?. Chem. Pap. 59 (1):11-16.
Kumalaningsih, S. (2006). Antioksidan Alami. Cetakan Pertama. Surabaya: Trubus Agrisarana. Hal. 8-9.
Kwang, S.Y., Omar, A., dan Khairun, Y. (2013). Seashore Organisms In Penang National Park. Malaysia: Penerbit Universitas Sains Malaysia. Hal. 38-44. Mardawati, E., Cucu S.A., dan Herlina M. (2008). Kajian Aktivitas Antioksidan
Ekstrak Kulit Manggis (Garcinia mangostana L.) Dalam Rangka Pemanfaatan Limbah Kulit Manggis di Kecamatan Puspahiang Kabupaten Tasikmalaya. Laporan Penelitian. Bandung: Fakultas Teknologi Industri Pertanian Universitas Padjajaran. Hal. 16.
Marinova, G., dan Batchvarov, V. (2011). Evaluation of the Methods for Determination of the Free Radical Scavenging Activity by DPPH. Bulg. J. Agric. Sci. 17(1): 13-14.
Molyneux, P. (2004). The Use of the Stable Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin J. Sci. Technol. 26(2): 211-219.
Panji, T., Suharyanto., dan Wijayanti, M. (2009). Produksi, Isolasi dan Karakterisasi Superoksida Dismutase dari Spirulina Platensis Yang Dibiakkan dalam Serum Lateks. Menara Perkebunan 77 (1). Hal. 23-35. Prakash, A. (2001). Antioxidant Activity. Medallion Laboratories-Analytical
Progress. Minnesota. 19(2): 1-3.
Purcell, S.W., Yves, S., dan Chantal, C. (2012). Commercially Importantsea Cucumbers Of The World. Roma : Food And Agriculture Organization Of The United Nations. Hal.42.
Rajkumar S., Praveen M.R., Gajjar D., Vasawada A.R., Alapure B., Patel D., dan Kapur S. (2008). Activity Of Superoxide Dismutase Isoenzymes In Epithel Cells Derived From Different Types Of Age-Related Cataract. J Cataract Refrat Surg, 34(1): 470-474.
Rasyid, A. (2012). Identifikasi Senyawa Metabolit Sekunder Serta Uji Aktivitas Antibakteri Dan Antioksidan Ekstrak Metanol Teripang Stichopus Hermanii. Jurnal Ilmu dan Teknologi Kelautan Tropis. 4(2): 360-368. Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Edisi Keenam.
Bandung: Penerbit ITB. Hal. 152-156.
Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Hal. 46-47, 222.
Rosidah., Yam, M.F., Sadikun, A., dan Asmawi, M.Z. (2008). Antioxidant Potential of Gynura procumbens. Pharmaceutical Biology. 46(9): 616-625. Silalahi, J. (2006). Makanan Fungsional. Yogyakarta: Kanisius. Hal. 45-46. Trease, G. E., dan William, C. E. (1983). Pharmacognosy. London: Bailliere
Tindall. Hal. 475-485.
WHO. (1998). Quality Control Methods For Medicinal Plant Materials. Geneva: WHO. Hal. 31-33.
Widodo, A. (2013). Budidaya Teripang Khasiat dan Cara Olah untuk Pengobatan. Yogyakarta: Penerbit Pustaka Baru Press. Hal. 22-23.
BAB III
METODE PENELITIAN
Metode penelitian dilakukan secara eksperimental. Penelitian meliputi pengumpulan hewan, identifikasi hewan, karakterisasi simplisia, pembuatan ekstrak etanol, fraksinasi dan uji aktivitas antioksidan dengan metode peredaman DPPH menggunakan alat spektrofotometer visibel Penelitian dilakukan di Laboratorium Farmakognosi dan Laboratotium Penelitian Fakultas Farmasi Universitas Sumatera Utara.
3.1 Alat
Alat–alat yang digunakan terdiri dari alat-alat gelas laboratorium (Erlenmeyer, gelas beaker, gelas ukur, labu tentukur, tabung reaksi, corong pisah, gelas arloji, matt pipet, corong, seperangkat alat penetapan kadar air, botol bersumbat, cawan berdasar rata), desikator, kaca objek, kaca penutup, krus porselen, lemari pengering, mikroskop (Olympus), neraca kasar, neraca analitis (Boeco Germany), oven (Memmert), penangas air, penjepit tabung, pipet tetes,
rotary evaporator (Stuart), spektrofotometer UV/Vis (Shimadzu UV-1800) dan tanur (Nabertherm).
3.2 Bahan
Bahan yang digunakan pada penelitian adalah teripang Holothuria atra
3.3 Penyiapan Hewan 3.3.1 Pengumpulan hewan
Pengumpulan hewan dilakukan secara purposif, yaitu tanpa membanding kan dengan daerah lain. Hewan yang digunakan adalah teripang yang masih segar dari Pulo Kapuk (Pantai Cemara) Lhoknga, Aceh Besar.
3.3.2 Identifikasi hewan
Identifikasi hewan dilakukan di Lembaga Ilmu Penelitian Indonesia Pusat Penelitian Oseanografi Jakarta. Teripang yang digunakan sama dengan teripang yang diidentifikasi atas nama Ulwan Purnama Sari. Hasil identifikasi dapat dilihat pada Lampiran 1, halaman 44.
3.3.3 Pengolahan hewan
Teripang dibersihkan dari kotoran dengan cara mencuci di bawah air mengalir hingga bersih, kemudian dikeluarkan isi perut dan dicuci kembali. Teripang dipotong dengan ukuran 3 x 3 cm selanjutnya ditiriskan dan ditimbang. Teripang dikeringkan di lemari pengering hinga diperoleh simplisia kering yang dapat dipatahkan. Teripang yang sudah kering ini disebut simplisia hewan. Simplisia dihaluskan sampai menjadi serbuk, kemudian ditimbang beratnya dan disimpan dalam wadah tertutup. Bagan penelitian dapat dilihat pada Lampiran 2, halaman 45.
3.4Pembuatan Pereaksi
3.4.1 Pereaksi Liebermann-Burchard
asam asetat anhidrida ke dalam campuran tersebut dan didinginkan (Depkes RI, 1995).
3.4.2 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida sebanyak 100 ml (Depkes RI, 1995).
3.4.3 Pereaksi asam klorida 2 N
Sebanyak 17 ml larutan asam klorida pekat ditambahkan air suling hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.4.4 Larutan asam sulfat 2 N
Sebanyak 5,5 ml larutan asam sulfat pekat ditambahkan air suling sampai 100 ml (Depkes RI, 1995).
3.4.5 Pereaksi kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam 20 ml air suling (Depkes RI, 1995).
3.4.6 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Depkes RI,1995).
3.4.7 Larutan pereaksi DPPH 0,5 mM (konsentrasi 200 ppm)
Sebanyak 19,7 mg DPPH ditimbang, kemudian dilarutkan dalam metanol hingga volume 100 ml.
3.5 Pemeriksaan Karakteristik Simplisia Hewan
kadar sari larut etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut asam.
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk luar, ukuran permukaan, diameter dan organoleptis teripang. Gambar teripang segar, simplisia dan serbuk simplisia dapat dilihat pada Lampiran 3, halaman 46-47. 3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia hewan teripang ditaburkan di atas kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup (deck glass), kemudian diamati di bawah mikroskop. Gambar mikroskopik teripang dapat dilihat pada Lampiran 4, halaman 48.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen) (WHO, 1998). Alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung penyambung dan tabung penerima.
a. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
2 tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Bagian dalam pendingin dibilas dengan toluen setelah semua air terdestilasi,. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Volume air dibaca dengan ketelitian 0,05 ml setelah air dan toluen memisah sempurna. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen.
3.5.4 Penetapan kadar sari larut air
Penetapan kadar sari larut air dilakukan dengan metode gravimetri menurut Depkes RI (1995). Prosedurnya adalah sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, kemudian disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105ºC sampai bobot tetap. Kadar sari larut air dihitung dalam persen.
3.5.5 Penetapan kadar sari larut etanol
3.5.6 Penetapan kadar abu total
Penetapan kadar abu total dilakukan dengan metode gravimetri menurut Depkes (1995). Prosedurnya adalah sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600ºC selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu total dihitung dalam persen.
3.5.7 Penetapan kadar abu tidak larut asam
Penetapan kadar abu tidak larut asam dilakukan dengan metode gravimetri menurut Depkes RI (1995). Prosedurnya adalah abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu lalu dipijar sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu tidak larut dalam asam dihitung dalam persen. Hasil perhitungan karakteristik dapat dilihat pada Lampiran 5, halaman 49-52.
3.6 Pemeriksaaan Golongan Senyawa Kimia 3.6.1 Pemeriksaan glikosida
sisa digunakan untuk percobaan berikut : 0,1 ml larutan percobaan dimasukkan dalam tabung reaksi dan diuapkan di atas penangas air. Sebanyak 2 ml air dan 5 tetes pereaksi Molish ditambahkan pada sisa penguapan. Secara perlahan lahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna ungu pada batas kedua cairan menunjukkan ikatan gula (Depkes RI, 1995).
3.6.2 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukkan dalam tabung reaksi ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat selama10 detik, jika terbentuk buih yang mantap setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2N menunjukkan adanya saponin (Depkes RI, 1995).
3.6.3 Pemeriksaan steroida/triterpenoida
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama 2 jam, disaring, filtrat diuapkan dalam cawan penguap, dan pada sisanya ditambahkan 1 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat (pereaksi Liebermann-Burchard). Apabila terbentuk warna ungu atau merah atau biru hijau menunjukkan adanya steroida/triterpenoida (Harbone, 1987).
3.7 Pembuatan Ekstrak Etanol Teripang
Pembuatan ekstrak teripang dengan metode perkolasi menggunakan pelarut etanol.
larutan penyari di atas serbuk simplisia, mulut perkolator ditutup dengan plastik dan aluminium foil dan dibiarkan selama 24 jam. Setelah 24 jam kran perkolator dibuka dan cairan perkolat dibiarkan menetes dengan kecepatan 1ml/menit dan ditampung kedalam botol Perkolasi dihentikan setelah tetesan terakhir perkolat tidak berwarna lagi atau apabila sebanyak 500 mg cairan perkolat diuapkan di atas penangas air tidak meninggalkan sisa atau apabila tidak bereaksi dengan pereaksi Liebermann-Burchard. Perkolat dipekatkan dengan bantuan alat penguap rotary evaporator pada suhu 40-60°C hingga diperoleh ekstrak kental teripang. Bagan pembuatan ekstrak etanol dapat dilihat pada Lampiran 6, halaman 53.
3.8 Fraksinasi Teripang
Fraksinasi dilakukan secara ekstraksi cair-cair (ECC) menggunakan pelarut n-heksan dan etilasetat.
a. Fraksinasi dengan n-heksan
Sebanyak 10 g ekstrak etanol pekat teripang ditambahkan 20 ml etanol dan 100 ml air suling, kemudian diektraksi dengan n-heksan sebanyak 50 ml menggunakan corong pisah dilakukan sebanyak 3 kali. Lapisan n-heksan dipisahkan dan kemudian diuapkan hingga diperoleh fraksi n-heksan pekat.
b. Fraksinasi dengan etilasetat
3.9 Pengujian Kemampuan Antioksidan Dengan Spektrofotometer Visibel 3.9.1 Prinsip metode penangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam proses oksidasi DPPH ( 1,1-diphenyl-2-picryl-hidrazyl) sebagai radikal bebas dalam larutan metanol (sehingga terjadi peredaman warna ungu DPPH) dengan nilai IC50 (konsentrasi sampel uji
yang mampu meredam radikal bebas sebesar 50%) digunakan sebagai parameter untuk menentukan aktivitas antioksidan sampel uji tersebut.
3.9.2 Pembuatan larutan blanko
Larutan DPPH 0,5 mM (konsentrasi 200 mcg/ml) dipipet sebanyak 5 ml, kemudian dimasukkan ke dalam labu tentukur 25 ml, dicukupkan volumenya dengan metanol sampai garis tanda (konsentrasi 40 mcg/ml).
3.9.3 Penentuan panjang gelombang serapan maksimum
Larutan DPPH konsentrasi 40 mcg/ml dihomogenkan dan diukur serapannya pada panjang gelombang 400-800 nm.
3.9.4 Pembuatan larutan induk
Sebanyak 25 mg sampel uji ditimbang kemudian dilarutkan dalam labu tentukur 25 ml dengan metanol lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 mcg/ml).
3.9.5 Pembuatan larutan uji
diukur serapannya pada spektrofotometer uv-visibel pada panjang gelombang 516 nm. Gambar spektrofotometer UV/Vis dapat dilihat pada Lampiran 8, halaman 55. 3.9.6 Penentuan persen peredaman
Kemampuan antioksidan diukur sebagai penurunan absorbansi larutan DPPH (peredaman warna ungu DPPH) akibatnya adanya penambahan larutan uji. Nilai absorbansi larutan DPPH sebelum dan sesudah penambahan larutan uji tersebut dihitung sebagai persen peredaman.
Keterangan : Akontrol = Absorbansi tidak mengandung sampel
Asampel = Absorbansi mengandung sampel
Hasil perhitungan persen perdaman radikal bebas DPPH dapat dilihat pada Lampiran 9, halaman 56-61.
3.9.7 Penentuan nilai IC50
Nilai IC50 merupakan bilangan yang menunjukkan konsentrasi sampel uji
(mcg/ml) yang memberikan peredaman DPPH sebesar 50% (mampu menghambat/ meredam proses oksidasi sebesar 50%). Nilai 0% berarti tidak mempunyai aktivitas antioksidan, sedangkan nilai 100% berarti peredaman total dan pengujian perlu dilanjutkan dengan pengenceran larutan uji untuk melihat batas konsentrasi aktivitasnya. Hasil perhitungan dimasukkan ke dalam persamaan regresi dengan konsentrasi ekstrak (mcg/ml) sebagai absis (sumbu X) dan nilai % peredaman (antioksidan) sebagai ordinatnya (sumbu Y). Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 50
100-150 mcg/ml, dan lemah jika IC50 bernilai 151-200 mcg/ml (Mardawati, 2008).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Hewan
Hasil identifikasi hewan yang dilteliti dilakukan oleh Pusat Penelitian Oseanografi LIPI hasilnya adalah hewan teripang jenis Holothuria atra Jaeger, marga Holothuria, suku Holothuroiidae, bangsa Aspidochirotida, kelas Holothuroidea dan filum Echinodermata.
4.2 Hasil Karakteristik Hewan
4.2.1 Hasil pemeriksaan makroskopik
Hasil pemeriksaan teripang segar secara makroskopik yaitu berukuran panjang 28 cm, lebar 7,80 cm dan berat 810 g. Terdapat tonjolan-tonjolan pada permukaan tubuh, berlendir, berwarna hitam dan berbau khas. Hasil pemeriksaan makroskopik serbuk simplisia yaitu berwarna coklat kehitaman, rasa asin dan berbau khas.
4.2.2 Hasil pemeriksaan mikroskopik
Pemeriksaan dilakukan terhadap serbuk siimplisia hewan teripang
Holothuria atra Jaeger. Hasil pemeriksaan mikroskopik serbuk simplisia hewan menunjukkan adanya tiga jenis spikula yang berbeda tipe yaitu tipe rosettes,tipe
rod dan tipe pseudo-button.
4.2.3 Hasil pemeriksaan karakteristik
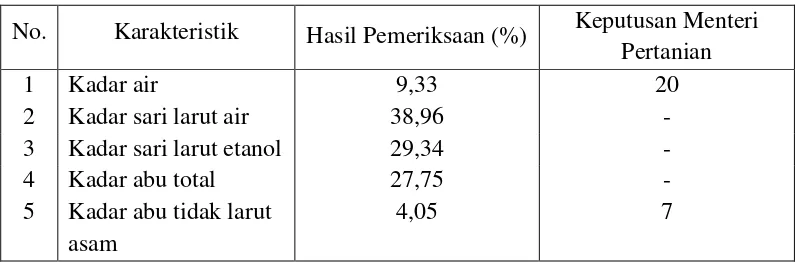
Tabel 4.1 Hasil pemeriksaan karakteristik simplisia hewan teripang Holothuria atra Jaeger.
No. Karakteristik Hasil Pemeriksaan (%) Keputusan Menteri Pertanian memenuhi standar mutu teripang kering (SPI-kan/02/29/1987) sesuai dengan Keputusan Menteri Pertanian No.701/Kpts/TP>830/10/1987 tentang penetapan standar mutu hasil perikanan yang saat ini telah ditetapkan menjadi standar Indonesia oleh Dewan Standarisasi Nasional yang berlaku secara nasional. Standar ini merupakan standar minimum untuk teripang kering (Martoyo, dkk., 1994).
Penetapan kadar abu total dilakukan untuk mengetahui kadar senyawa anorganik dalam simplisia teripang, seperti mineral kalsium, natrium, zat besi, kalium, kromium, stronsium, mangan, fosfor, Zn dan vanadium (Widodo, 2013) sedangkan tujuan penetapan kadar abu tidak larut asam untuk mengetahui kadar zat anorganik yang tidak larut dalam asam, misalnya silikat.
Kadar sari menunjukkan kandungan kimia terendah yang terdapat dalam simplisia. Hasil penetapan kadar sari larut air lebih tinggi daripada kadar sari larut etanol karena diduga dalam air terkandung senyawa kimia metabolit primer yaitu karbohidrat dan protein, senyawa metabolit sekunder terutama glikosida dan saponin, vitamin B1,B2,B3, garam dan mineral (Widodo, 2013). Senyawa yang
4.3 Hasil Pemeriksaan Golongan Senyawa
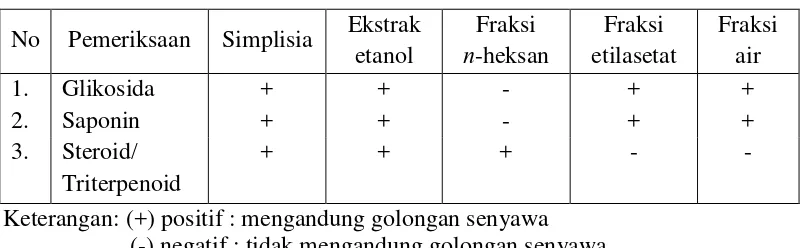
Hasil pemeriksaan golongan senyawa terhadap simplisia hewan, ekstrak etanol, fraksi n-heksan, fraksi etilasetat, dan fraksi air, menunjukkan, bahwa teripang Holothuria atra Jaeger mengandung golongan senyawa-senyawa kimia seperti yang terlihat pada Tabel 4.2 berikut ini.
Tabel 4.2 Hasil pemeriksaan senyawa kimia simplisia hewan, ekstrak etanol dan fraksi teripang.
No Pemeriksaan Simplisia Ekstrak etanol
Keterangan: (+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
Tabel di atas menunjukkan bahwa simplisia memiliki kandungan glikosida, saponin dan steroid/triterpenoid. Holothuria atra Jaeger memiliki potensi sebagai antioksidan, yaitu dengan adanya saponin, glikosida dan steroid/triterpenoid. Senyawa tersebut diduga mampu menetralisir radikal bebas dengan memberikan elektron kepadanya sehingga atom dengan elektron yang tidak berpasangan mendapat pasangan elektron dan tidak lagi menjadi radikal bebas.
4.4 Hasil Analisis Aktivitas Antioksidan Sampel Uji
4.4.1 Hasil penentuan panjang gelombang serapan maksimum
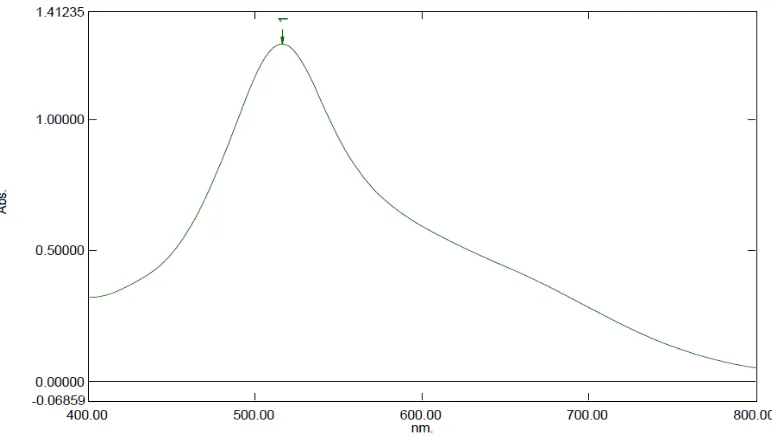
Hasil pengukuran serapan maksimum larutan DPPH 40 mcg/ml dalam metanol dengan menggunakan spektrofotometer UV-Vis. Hasil pengukuran menunjukkan bahwa larutan DPPH dalam metanol menghasilkan serapan maksimum sebesar 1,289 pada panjang gelombang 516 nm dan termasuk dalam kisaran panjang gelombang sinar tampak (400 nm-800 nm) (Rohman, 2007) dan termasuk dalam rentang panjang gelombang DPPH yang berkisar antara 515 – 520 nm (Molyneux, 2004). Data hasil pengukuran dapat dilihat pada Gambar 4.1.
Gambar 4.1.Kurva serapan maksimum larutan DPPH 40 mcg/ml dalam metanol secara spektrofotometri visible.
4.4.2 Hasil analisis aktivitas antioksidan sampel uji
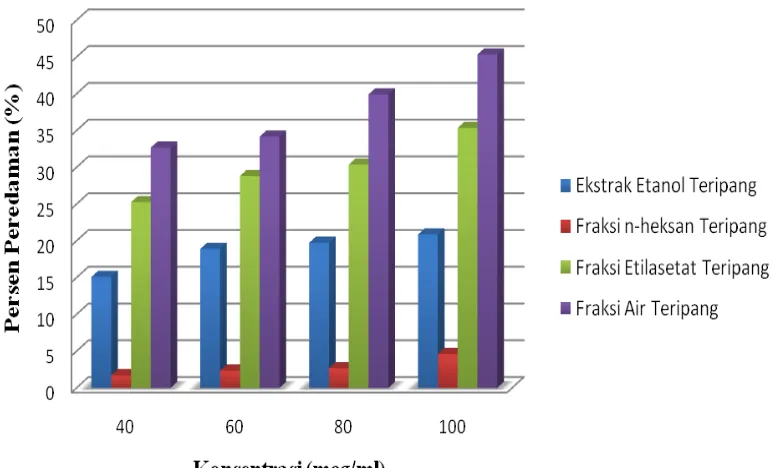
Hasil diperoleh dari pengukuran absorbansi DPPH pada menit ke-60 dengan adanya penambahan larutan uji dengan konsentrasi 40 mcg/ml, 60 mcg/ml, 80 mcg/ml dan 100 mcg/ml yang dibandingkan dengan kontrol DPPH (tanpa penambahan larutan uji).
Tabel 4.3 Data persen pemerangkapan DPPH oleh ekstrak etanol dan fraksi
Data tabel diatas menunjukkan adanya penurunan absorbansi DPPH oleh ekstrak etanol, fraksi n-heksan, fraksi etilasetat dan fraksi air teripang Holothuria atra Jaeger dalam metanol sebagai larutan uji pada berbagai konsentrasi, hal ini menunjukkan adanya aktivitas antioksidan dalam meredam radikal bebas DPPH pada larutan uji.
larutan berubah dari ungu tua menjadi kuning terang dan absorbansi pada panjang gelombang maksimumnya akan hilang (Molyneux, 2004).
Hubungan perbedan konsentrasi dan hubungan perbedaan kepolaran pelarut dengan persen peredaman dengan menganalisis aktivitas antioksidannya dapat dilihat pada Gambar 4.2 berikut ini :
Gambar 4.2 Grafik hasil uji aktivitas antioksidan ekstrak etanol dan fraksi teripang.
Gambar grafik diatas menunjukkan bahwa adanya perbedaan konsentrasi di setiap sampel uji menghasilkan aktivitas antioksidan yang berbeda juga. Semakin tinggi konsentrasi sampel uji maka semakin besar kemampuannya meredam radikal bebas DPPH.
4.5 Analisis Nilai IC50 (Inhibitory Concentration) Sampel Uji
Nilai IC50 diperoleh berdasarkan persamaan regresi linier yang didapatkan
dengan cara memplot konsentrasi larutan uji dan persen peredaman DPPH sebagai parameter aktivitas antioksidan, dimana konsentrasi larutan uji (mcg/ml) sebagai absis (sumbu X) dan nilai % peredaman sebagai ordinat (sumbu Y). Hasil persamaan regresi yang diperoleh untuk ekstrak etanol, fraksi n-heksan, fraksi etilasetat dan fraksi air teripangdapat dilihat pada Tabel 4.4 berikut ini.
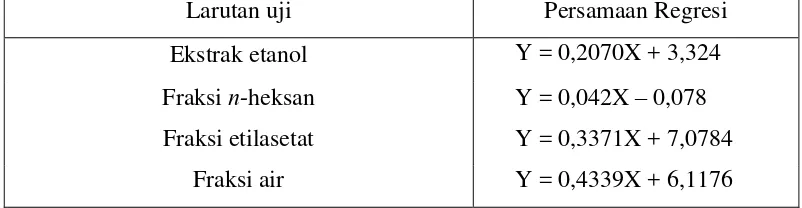
Tabel 4.4..Hasil persamaan regresi linier yang diperoleh untuk ekstrak etanol dan fraksi teripang.
Larutan uji Persamaan Regresi
Ekstrak etanol Y = 0,2070X + 3,324
Fraksi n-heksan Y = 0,042X – 0,078 Fraksi etilasetat Y = 0,3371X + 7,0784
Fraksi air Y = 0,4339X + 6,1176
Kemampuan sampel uji dalam meredam DPPH (1,1-Diphenyl-2 -Picrylhidrazyl) sebagai radikal bebas dalam larutan metanol dengan nilai IC50
(konsentrasi sampel uji yang mampu meredam radikal bebas sebesar 50%) digunakan sebagai parameter untuk menentukan aktivitas antioksidan sampel uji tersebut (Prakash, 2001). Hasil analisis nilai IC50 (Inhibitory Concentration) yang
diperoleh berdasarkan perhitungan persamaan regresi dapat dilihat pada Tabel 4.5 berikut ini.
Tabel 4.5 Nilai IC50 ekstrak etanol dan fraksi teripang.
Sampel IC50 (mcg/ml)
Ekstrak etanol 225,49
Fraksi n-heksan 1192,33
Fraksi etilasetat 127,33
Hasil di atas menunjukkan bahwa ekstrak etanol, fraksi n-heksan, etilasetat dan air dari teripang (Holothuria atra Jaeger) memiliki aktivitas antioksidan. Ekstrak etanol dan fraksi n-heksan memiliki aktivitas antioksidan sangat lemah sedangkan fraksi etilasetat dan fraksi air memiliki aktivitas antioksidan kategori sedang. Perbedaan nilai IC50 pada masing-masing fraksi diduga disebabkan oleh
adanya perbedaan distribusi golongan senyawa metabolit sekunder yang bersifat sebagai antioksidan (saponin, dan steroid/triterpenoid) berdasarkan kepolaran pelarut yang digunakan(Francis, dkk., 2002; Rasyid,2008).
Fraksi air dengan nilai IC50 terendah yaitu 101,13 mcg/ml memiliki
aktivitas antioksidan terkuat diduga karena adanya senyawa saponin. Saponin dalam fraksi air menghasilkan aktivitas yang cukup kuat dalam menangkap radikal bebas. Beberapa senyawa saponin memerangkap superoksida dalam bentuk hidroperoksida antara sehingga dapat mencegah kerusakan biomolekuler oleh radikal bebas (Francis, dkk., 2002). Menurut Althunibat potensi antioksidan teripang lebih tinggi dalam ekstrak air dibandingkan dengan ekstrak organik, ini menunjukkan bahwa sebagian besar molekul antioksidan yang diekstrak merupakan senyawa hidrofilik di alam.
Fraksi n-heksan dengann nilai IC50 tertinggi yaitu 1192,33 mcg/ml
suhu ruangan kemungkinan mengalami penurunan aktivitas selama proses preparasi dan pengujian sampel.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan maka dapat disimpulkan bahwa:
a. hasil pemeriksaan golongan senyawa teripang menunjukkan adanya senyawa kimia golongan glikosida, steroid/triterpenoid dan saponin.
b. hasil karakteristik serbuk simplisia teripang Holothuria atra Jaeger diperoleh kadar air 9,33 %, kadar sari larut air 38,96%, kadar sari larut etanol 29,34%, kadar abu total sebesar 27,75% dan kadar abu tidak larut asam 4,05%.
c. hasil pengujian aktivitas antioksidan menunjukkan bahwa ekstrak etanol dan fraksi n-heksan memiliki aktivitas antioksidan sangat lemah, sedangkan fraksi
etilasetat dan fraksi air memiliki aktivitas antioksidan sedang, dengan nilai IC50
dari masing-masing ekstrak etanol, fraksi n-heksan, fraksi etilasetat dan fraksi air
sebesar 225,49, 1192,33, 127,33 dan 101,13 mcg/ml.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Hewan
Teripang atau timun laut termasuk dalam filum Echinodermata merupakan salah satu biota laut yang banyak ditemukan di perairan Indonesia, sebab secara geografis perairan Indonesia terletak di antara Samudera Pasifik dan Samudera Hindia merupakan habitat terbaik untuk hewan teripang. (Conand dan Byrne, 1993). Uraian hewan meliputi sistematika hewan, sinonim hewan, habitat hewan, morfologi hewan, reproduksi hewan, kandungan dan manfaat dan uraian kimia. 2.1.1 Sistematika hewan
Identifikasi sampel teripang di Pusat Penelitian Oseanografi LIPI. Dengan hasil sebagai berikut:
Filum : Echinodermata Kelas : Holothuroidea
Ordo : Aspidochirotida Grube, 1840 Famili : Holothuriidae Ludwig, 1894 Genus : Holothuria Linnaeus, 1767 Spesies : Holothuria atra Jaeger, 1833 2.1.2 Sinonim
2.1.3 Habitat
Teripang laut hampir ditemui pada semua habitat dalam lingkungan laut tetapi lebih tersebar dan mempunyai distribusi yang besar pada kawasan terumbu karang yang dangkal dengan kedalaman kira-kira 5 meter. Teripang laut bisa dijumpai pada kawasan pasang surut hingga dasar lautan yang dalam (20 meter) (Kwang, 2013).
2.1.4 Morfologi hewan
Teripang Holothuria atra mempunyai tubuh yang berbentuk langsing memanjang. Warna tubuh hitam, dengan tentakel kekuning-kuningan sepanjang 15-20 cm. Jenis ini hidup di perairan atau diantara karang yang tertutup pasir. Badannya tertutup pasir sehingga hanya nelayan yang biasa menangkapnya yang tahu persis tempat persembunyiannya (Ghufran dan Kordi, 2010).
Bagian oral teripang laut dikenali dengan adanya tentakel di bagian tersebut sedangkan bagian anus atau aboral teripang laut terdapat saluran kloaka. Kebanyakan teripang laut merupakan pemakan endapan yang akan menelan sedimen dan mengekstrak komponen organik dalam sedimen (Kwang, 2013).
Jenis kelamin teripang laut tidak dapat dibedakan secara morfologi luar dan hanya dapat diidentifikasi dengan memperhatikan warna gonad di bawah mikroskop dan secara histologi. Gonad jantan pada Holothuria atra berwarna kuning sedangkan betina berwarna merah jambu (Kwang, 2013).
2.1.4 Reproduksi hewan
betina berukuran 600 g dapat mengeluarkan telur 4-5 juta butir dengan ukuran bervariasi antara 160-180 mikron (Ghufran dan Kordi, 2010).
Proses pembuahan terjadi diluar tubuh. Teripang betina biasanya mengeluarkan telur-telurnya terlebih dahulu, kemudian langsung dibuahi oleh sperma jantan. Beberapa jenis teripang di laut dalam, setelah telur dibuahi, telur tersebut akan ditangkap kembali oleh betina dengan tentakelnya, kemudian ditransfer kedalam kantung pengeraman. Telur tersebut akan berkembang dan menetas 32 jam setelah pembuahan (Ghufran dan Kordi, 2010).
2.1.6 Kandungan dan manfaat
Teripang telah dimanfaatkan cukup lama di Indonesia terutama oleh masyarakan sekitar pantai sebagai bahan makanan. Sebagai bahan pangan, teripang mempunyai nilai gizi yang cukup tinggi. Manfaat teripang untuk kesehatan juga sangat banyak, teripang memiliki kandungan Cell Growth factor
yang mampu merangsang regenerasi sel dan jaringan yang rusak. Teripang kering mempunyai kadar protein tinggi, yaitu 82% dan mengandung asam lemak tidak jenuh yang penting untuk kesehatan jantung dan mujarab memperkuat sel hati untuk mengeluarkan antibodi. Teripang juga mengandung lebih dari 80% kolagen menyebabkan teripang disebut imunomodulator (Widodo, 2013).
2.1.7 Uraian Kimia a. Saponin
Saponin mula-mula diberi nama demikian karena sifatnya yang khas menyerupai sabun (bahasa latin sapo = sabun) (Robinson, 1995). Saponin adalah glikosida yang aglikonnya disebut sapogenin. Keberadaan saponin sangat mudah ditandai dengan pembentukan larutan koloidal dengan air yang apabila dikocok menimbulkan buih yang stabil. Saponin juga bersifat menghancurkan butir darah merah lewat reaksi hemolisis darah (Farnsworth, 1966; Gunawan dan Mulyani, 2004).
Berdasarkan struktur dari aglikonnya, saponin dapat dibedakan menjadi dua macam, yaitu saponin steroid dan saponin triterpenoid. Saponin steroid/triterpenoid mudah larut dalam air dan alkohol, tetapi tidak larut dalam eter. Saponin steroid/triterpenoid tersusun dari suatu aglikon steroid/triterpenoid (sapogenin) yang terikat pada suatu oligosakarida yang biasanya heksosa dan pentosa (Farnsworth, 1966). Hasil hidrolisisnya, yaitu sapogenin mudah larut dalam pelarut organik (seperti kloroform, eter, n-heksan) dan tidak larut dalam air (Trease dan Evans, 1983).
antivirus, juga menawarkan potensi yang cukup besar dalam mengelola berbagai penyakit (Francis, dkk., 2002).
b. Steroid/Triterpenoid
Steroid adalah triterpena yang kerangka dasarnya sistem cincin siklopentana perhidrofenantrena. Steroida dianggap sebagai senyawa satwa tetapi makin banyak senyawa steroida yang ditemukan dalam jaringan tumbuhan (fitosterol). Tiga senyawa yang biasa disebut fitosterol terdapat pada hampir setiap tumbuhan tinggi yaitu: sitosterol, stigmasterol dan kampesterol (Harborne, 1987). Beberapa senyawa steroid barangkali mempunyai peran dalam struktur membrane, sebagai hormon kelamin dan feromon, pada tumbuhan steroid berperan sebagai pelindung dari serangga (Robinson, 1995).
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C-30 asiklik yaitu skualena. Triterpenoid dapat dibagi atas empat golongan yaitu triterpenoid sebenarnya, steroid, saponin dan glikosida jantung. Triterpena atau steroid yang terutama terdapat sebagai glikosida. Triterpenoid merupakan senyawa yang berbentuk kristal, bertitik leleh tinggi dan optik aktif, yang umumnya sukar dicirikan karena tidak mempunyai kereaktifan kimia. Sebagian besar senyawa ini memberikan warna hijau-biru dengan pereaksi Liebermann-Burchard (asam asetat anhidrida-asam sulfat pekat (Harborne, 1987).
2.2 Ekstraksi
Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia dari jaringan tumbuhan maupun hewan. Sebelum ekstraksi dilakukan biasanya bahan-bahan dikeringkan terlebih dahulu kemudian dihaluskan pada derajat kehalusan tertentu (Harborne, 1987).
Menurut Depkes RI (2000), beberapa metode ekstraksi yang sering digunakan dalam berbagai penelitian antara lain yaitu:
a. Cara Dingin 1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar. Maserasi yang dilakukan pengadukan secara terus-menerus disebut maserasi kinetik sedangkan yang dilakukan pengulangan penambahan pelarut setelah penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi. 2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pelembaban bahan, tahap perendaman antara dan tahap perkolasi sebenarnya (penetesan/ penampungan ekstrak).
b. Cara Panas 1. Refluks
2. Digesti
Digesti adalah proses penyarian dengan pengadukan kontinu pda temperatur lebih tinggi daripada temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50ºC.
3. Sokletasi
Sokletasi adalah proses penyarian berulang-ulang dengan pelarut tertentu yang mudah menguap, dilakukan dengan menggunakan soklet sehingga menjadi ekstraksi kontinu dengan pelarut relatif konstan dengan adanya pendingin balik.
4. Infundasi
Infundasi adalah proses penyarian dengan pemanasan menggunakan pelarut air pada temperatur 90ºC selama 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan pemanasan menggunakan pelarut air pada temperatur 90ºC selama 30 menit.
2.2.1 Ekstraksi cair-cair
Ekstraksi cair-cair merupakan suatu teknik yang mana suatu larutan (biasanya dalam air) dibuat bersentuhan dengan pelarut kedua (biasanya pelarut organik), yang pada hakikatnya tidak tercampurkan, pada proses ini terjadi pemindahan satu atau lebih zat terlarut (solute) kedalam pelarut yang kedua. Pemisahan yang dilakukan bersifat sederhana, bersih, cepat, dan mudah, yang dapat dilakukan dengan cara mengocok-ngocok dalam sebuah corong pisah selama beberapa menit (Bassett, dkk., 1994).
mudah mengalami ionisasi dan senyawa polar lainnya akan tertahan dalam fase air Pelarut organik yang dipilih untuk ekstraksi pelarut ialah pelarut yang mempunyai kelarutan yang rendah dalam air (>10%), dapat menguap sehingga memudahkan penghilangan pelarut organik setelah dilakukan ekstraksi, dan mempunyai kemurnian yang tinggi untuk meminimalkan adanya kontaminasi sampel (Rohman, 2007)
2.3 Radikal Bebas
Radikal bebas adalah setiap molekul yang mengandung satu atau lebih elektron yang tidak berpasangan. Radikal bebas memiliki reaktivitas yang sangat tinggi, hal ini ditunjukkan dengan sifatnya yang segera menarik electron yang disekelilingnya (Kosasih, dkk., 2004).
Senyawa ini sangat reaktif dan dengan mudah menjurus ke reaksi yang tidak terkontrol menghasilkan ikatan silang (cross-link) pada DNA, protein, lipida atau kerusakan oksidatif pada gugus fungsional yang penting pada biomolekul.. Radikal bebas juga terlibat dan berperan dalam patologi dari berbagai penyakit degeneratif, yakni kanker, aterosklerosis, rematik, jantung koroner, katarak dan penyakit degenerasi saraf seperti parkinson (Silalahi, 2006).
Golongan senyawa oksigen reaktif antara lain adalah hidroksil (OH-), superoksida (O2-), peroksidal (RO2-), asam hipoklorit (HOCl) dan hidrogen
peroksida (H2O2) (Ionita, 2005).
Menurut Kumalaningsih (2006), pembentukan radikal bebas melalui 3 tahapan reaksi, yaitu:
a. tahap inisiasi: tahap awal terbentuknya radikal bebas.
c. tahap terminasi: terjadinya pengikatan suatu radikal bebas dengan radikal bebas yang lain sehingga membentuk senyawa non-radikal yang biasanya kurang reaktif dari radikal induknya.
2.4 Antioksidan
Antioksidan atau reduktor berfungsi untuk mencegah terjadinya oksidasi atau menetralkan senyawa yang telah teroksidasi dengan cara menyumbangkan hidrogen dan atau elektron (Silalahi, 2006).
Atas dasar fungsinya antioksidan dapat dibedakan menjadi 5 (lima) sebagai berikut.
a. Antioksidan primer
Antioksidan ini berfungsi untuk mencegah terbentuknya radikal bebas yang baru karena dapat merubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya. Seperti SOD, glutation peroksidase dan katalase. Antioksidan primer sering disebut antioksidan enzimatis.
b. Antioksidan sekunder
Antioksidan sekunder merupakan senyawa yang berfungsi menangkap radikal bebas serta mencegah terjadinya reaksi berantai sehingga tidak terjadi kerusakan yang lebih besar. Contoh yang populer, antioksidan sekunder adalah
vitamin E, vitamin C dan β-karoten yang dapat diperoleh dari buah-buahan. c. Antioksidan tersier
d. Oxygen scavenger
Antioksidan yang termasuk oxygen scavenger mengikat oksigen sehingga tidak mendukung reaksi oksidasi, misalnya vitamin C.
e. Chelators atau sequesstrants
Mengikat logam yang mampu mengkatalisis reaksi oksidasi misalnya asam sitrat dan asam amino (Kumalaningsih, 2006).
2.4.1 Antioksidan alami
Sayur-sayuran dan buah-buahan kaya akan zat gizi (vitamin, mineral, serat pangan) serta berbagai kelompok zat bioaktif lain yang disebut zat fitokimia. Zat bioaktif ini bekerja secara sinergis, meliputi mekanisme enzim detoksifikasi, peningkatan sistem kekebalan, pengurangan agregasi platelet, pengaturan sintesis kolesterol dan metabolisme hormon, penurunan tekanan darah, antioksidan, antibakteri serta efek antivirus (Silalahi, 2006).
2.4.2 SOD (Superoxide dismutase)
Superoksida dismutase (SOD) merupakan salah satu enzim antioksidan penting yang berasal dari tubuh sendiri, berefek sangat kuat dan merupakan pertahanan tubuh garis pertama dalam mengatasi stres oksidatif (Rajkumar, dkk., 2008). SOD merupakan antioksidan pencegah yang dapat menghambat, sebelum anion superoksida menyebabkan kerusakan. Cara kerja SOD adalah dengan mengkonversi anion superoksida (O2-) menjadi komponen lain yang kurang
berbahaya, yaitu hidrogen peroksida (H2O2) yang selanjutnya dengan bantuan
katalase diubah menjadi air (H2O) (Behndig, dkk., 1998).
mitokondria, ekstraseluler SOD (EC-SOD) dan besi-SOD (Fe-SOD) yang hanya ditemukan pada tumbuhan (Putra, 2014).
Enzim SOD terdapat dalam semua organisme aerob dan sebagian besar berada dalam tingkat subseluler (intraseluler). Organisme aerob selalu membutuhkan oksigen untuk hidupnya, namun dalam setiap aktivitasnya dapat menimbulkan senyawa oksigen reaktif atau ROS. SOD merupakan enzim antioksidan pencegah, yang merupakan suatu antioksidan metalloenzim. SOD berefek sangat kuat dan merupakan pertahanan tubuh pertama dalam menghadapi serangan radikal bebas. SOD adalah enzim antioksidan intraseluler utama yang dapat digunakan untuk menetralisir aktivitas O2- (Putra, 2014).
2.5 Penentuan Aktivitas Antioksidan Dengan Metode DPPH
Pada tahun 1922, Goldschmidt dan Renn menemukan senyawa berwarna ungu radikal bebas stabil DPPH, yang sekarang digunakan sebagai reagen kolorimetri untuk proses redoks. DPPH sangat berguna dalam berbagai penyelidikan seperti inhibisi atau radikal polimerisasi kimia, penentuan sifat antioksidan amina, fenol atau senyawa alami (vitamin, ekstrak tumbuh-tumbuhan, obat obat-obatan) dan untuk menghambat reaksi homolitik. DPPH berwarna sangat ungu seperti KMnO4 dan bentuk tereduksinya yaitu 1,1-difenil-2-picrylhydrazine (DPPH-H) yang berwarna oranye-kuning. DPPH tidak larut dalam air (Ionita, 2005).
2.5.1 DPPH
DPPH merupakan singkatan umum untuk senyawa kimia organik yaitu
dengan rumus molekul C18H12N5O6, larut dalam air. Penyimpanan dalam wadah
tertutup baik pada suhu -20°C (Molyneux, 2004).
Gambar 2.1 Rumus Bangun DPPH (Molyneux, 2004)
DPPH merupakan radikal bebas yang stabil pada suhu kamar. Prinsip metode pemerangkapan radikal bebas DPPH, yaitu elektron ganjil pada molekul DPPH memberikan serapan maksimum pada panjang gelombang 516 nm. Interaksi antioksidan dengan DPPH baik secara transfer elektron atau radikal hidrogen pada DPPH akan menetralkan karakter radikal bebas dari DPPH (Molyneux, 2004). Warna ungu larutan DPPH akan berubah menjadi kuning lemah apabila elektron ganjil tersebut berpasangan dengan atom hidrogen yang dari senyawa antioksidan (Prakash, 2001). Reaksi radikal bebas DPPH dengan antioksidan dapat dilihat pada gambar 2.2 berikut:
2.5.2 Pelarut
Metode DPPH akan bekerja dengan baik menggunakan pelarut metanol atau etanol karena kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.5.3 Pengukuran panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal (Gandjar dan Abdul, 2007). Panjang gelombang maksimum (λmaks) yang digunakan dalam pengukuran sampel uji pada metode pemerangkapan radikal bebas DPPH sangat bervariasi. Menurut beberapa literatur, panjang gelombang maksimum untuk DPPH antara lain 515-520 nm (Molyneux, 2004).
2.5.4 Waktu pengukuran
Waktu pengukuran atau waktu kerja (operating time) bertujuan untuk mengetahui waktu yang tepat untuk melakukan pengukuran yakni saat sampel dalam kondisi yang stabil. Waktu pengukuran yang digunakan dalam beberapa penelitian sangatlah bervariasi, yaitu 1-240 menit. Waktu pengukuran yang paling banyak direkomendasikan menurut literatur adalah 60 menit (Rosidah, dkk., 2008; Molyneux, 2004; Marinova dan Batchvarov, 2011).
2.6 Spektrofotometri UV-Visibel
pengukuran kualitatif dari suatu zat dengan ketelitian yang lebih besar (Day dan Underwood, 1986).
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia sebagai negara kepulauan yang sebagian besar wilayahnya merupakan perairan laut, memiliki keanekaragaman jenis biota laut yang sangat tinggi. Pemanfaatan biota laut saat ini, bukan hanya sekadar untuk konsumtif, tetapi mengarah kepada penelitian penemuan obat-obatan berbahan dasar biota laut. Salah satu biota laut yang berpotensi sebagai bahan baku obat-obatan adalah teripang. Teripang termasuk dalam filum Echinodermata merupakan salah satu biota laut yang banyak ditemukan di perairan Indonesia (Conand dan Byrne, 1993).
Ekstrak teripang laut sejak dahulu digunakan secara tradisional oleh masyarakat Melayu untuk mengobati luka. Berbagai penelitian berkenaan khasiat dari ekstrak teripang laut menyebabkan penggunaannya semakin meluas untuk mengatasi penyakit-penyakit lain, seperti artritis, ekzema dan hipertensi. Cairan selom pada teripang laut mengandung senyawa yang berfungsi sebagai anti-inflamasi dan antioksidan (Ain, 2010).
Teripang memiliki kandungan Cell Growth factor yang mampu merangsang regenerasi sel dan jaringan yang rusak. Kandungan protein dan asam lemak esensial yang sangat tinggi dapat memperkuat sel untuk mengeluarkan antibodi. Kandungan kolagen yang tinggi menjadikan teripang sebagai imunomodulator (Widodo, 2013).
gingseng, ganoderma, dan tumbuhan herbal terkenal lainnya. Senyawa ini diketahui berfungsi sebagai anti kanker dan anti inflamasi. SOD adalah senyawa yang bersifat antioksidan, yang diharapkan menjadi alternatif sumber antioksidan alami bagi manusia dimasa mendatang (Ghufran dan Kordi, 2010).
Teknologi pengolahan teripang saat ini telah menghasilkan produk ekstrak Teripang (Gold-G Sea Cucumber Jelly) yang berasal dari jenis teripang Golden Stichopus variegates. Beberapa penelitian mengenai teripang yang menyebutkan bahwa teripang dapat meningkatkan daya tahan tubuh, mengurangi rasa sakit dan gatal pada permukaan kulit, menurunkan kadar gula, menurunkan kolesterol, menurunkan tekanan darah, melancarkan peredaran darah, menyembuhkan maag, serta dapat menyembuhkan asma kronis. Teripang juga dapat digunakan sebagai bahan perawatan kecantikan dan penyembuhan luka bagi para ibu bersalin, karena mengandung protein dan kolagen teripang yang tinggi (Anonim, 2014).
Penelitian lain juga dilakukan Rasyid (2012) terhadap teripang Stichopus hermanii, melaporkan bahwa teripang mengandung golongan senyawa steroid dan saponin yang memiliki aktivitas antioksidan kuat dengan nilai IC50 65,08 mcg/ml
serta memiliki aktivitas antibakteri terhadap Staphylococcus aureus, Vibrio eltor
dan Bacillus subtilis.
Antioksidan merupakan senyawa yang dapat menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif sehingga kerusakan sel dapat dihambat. Antioksidan dapat berupa enzim (misalnya superoksida dismutase atau SOD, katalase dan glutation peroksidase), vitamin
(misalnya vitamin E, C, A dan β-karoten), dan senyawa lain (misalnya flavonoid,
Radikal bebas adalah atom atau senyawa yang kehilangan pasangan elektronnya. Sebagai contoh, molekul O2 yang bila terjadi reaksi dalam tubuh
yang berlebihan maka akan terbentuk oksigen yang tidak berpasangan dan menjadi radikal bebas (Kumalaningsih, 2006).
Penelitian ini menggunakan metode pemerangkapan radikal bebas DPPH untuk pengujian antioksidan karena metode ini dikenal lebih cepat, praktis, akurat dan murah. Metode ini umum digunakan untuk mengukur kemampuan senyawa yang berperan sebagai peredam radikal bebas atau pendonor hidrogen, dan mengevaluasi aktivitas antioksidan dari makanan. Metode DPPH juga dapat digunakan untuk sampel berwujud padat dan cair serta tidak spesifik terhadap komponen antioksidan tertentu (Prakash, 2001).
Salah satu jenis teripang yang terdapat di Pulo Kapuk (Pantai Cemara) Lhoknga, Aceh Besar adalah teripang Holothuria atra Jaeger yang ditemukan dikawasan terumbu karang dengan kedalaman 5-10 m dari permukaan laut. Berdasarkan uraian di atas, penulis melakukan penelitian meliputi karakterisasi simplisia, pemeriksaan golongan senyawa dan pengujian aktivitas antioksidan dari ekstrak etanol, fraksi n-heksan, fraksi etilasetat, dan fraksi air teripang Holothuria atra Jaeger yang diperoleh dari perairan Pulo Kapuk (Pantai Cemara), Lhoknga, Aceh Besar.
1.2 Perumusan Masalah
Berdasarkan uraian diatas, maka permasalahan dalam penelitian ini dapat dirumuskan sebagai berikut :
a. apakah golongan senyawa kimia yang terdapat dalam teripang Holothuria atra
b. apakah karakteristik simplisia teripang Holothuria atra Jaeger memenuhi persyaratan standar mutu teripang kering menurut Keputusan Menteri Pertanian No. 701/Kpts/TP>830/10/1987 ?
c. apakah ekstrak etanol, fraksi n-heksan, fraksi etilasetat, dan fraksi air teripang
Holothuria atra Jaeger memiliki aktivitas antioksidan?
1.3 Hipotesis
Berdasarkan rumusan masalah di atas, maka hipotesis dari penelitian ini sebagai berikut:
a. golongan senyawa kimia yang terdapat dalam teripang Holothuria atra Jaeger adalah glikosida, saponin dan steroid/triterpenoid.
b. karakteristik simplisia hewan teripang Holothuria atra Jaeger memenuhi persyaratan standar mutu teripang kering menurut Keputusan Menteri Pertanian No. 701/Kpts/TP>830/10/1987.
c. ekstrak etanol, fraksi n-heksan, fraksi etil asetat, dan fraksi air teripang
Holothuria atra Jaeger memiliki aktivitas antioksidan.
1.4 Tujuan
Adapun tujuan dari penelitian ini adalah:
1. untuk mengetahui golongan senyawa kimia yang terdapat teripang Holothuria atra Jaeger.
2. untuk mengetahui karakteristik dariserbuk simplisia teripang Holothuria atra
Jaeger.
1.5 Manfaat
KARAKTERISASI SIMPLISIA DAN UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL SERTA FRAKSI n- HEKSAN DAN ETILASETAT
TERIPANG Holothuria atra Jaeger
Abstrak
Teripang atau timun laut termasuk dalam filum Echinodermata merupakan salah satu biota laut yang banyak ditemukan di perairan Indonesia. Teripang mengandung protein dan kolagen yang sangat tinggi serta mengandung saponin dan SOD (Super Oxide dismutase) sehingga sangat berpotensi untuk dikembangkan dalam bidang pengobatan. Tujuan penelitian ini adalah untuk menentukan karakteristik simplisia, golongan senyawa dan aktivitas antioksidan dari ekstrak etanol, fraksi n-heksan, etilasetat dan air teripang Holothuria atra
Jaeger.
Ekstraksi dilakukan secara perkolasi menggunakan pelarut etanol, fraksinasi dilakukan dengan metode ekstraksi cair-cair dengan pelarut n-heksan dan etilasetat. Pengujian aktivitas antioksidan dari ekstrak etanol dan fraksi teripang menggunakan metode pemerangkapan radikal bebas DPPH ( 1,1-diphenyl-2-picrylhydrazil) diukur pada panjang gelombang 516 nm setelah 60 menit pada suhu kamar. Pemeriksaan karakteristik simplisia meliputi penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total, dan penetapan kadar abu tidak larut asam. Pemeriksaan golongan senyawa terhadap serbuk simplisia hewan meliputi pemeriksaan senyawa glikosida, saponin dan steroid/triterpenoid.
Hasil pemeriksaan karakteristik serbuk simplisia hewan teripang diperoleh kadar air 9,30% kadar sari larut air 38,96% kadar sari larut etanol 29,34%, kadar abu total 27,75%, kadar abu yang tidak larut dalam asam 4,05%. Hasil pemeriksaan golongan senyawa menunjukkan serbuk simplisia mengandung senyawa saponin, glikosida dan steroid/triterpenoid. Hasil uji aktivitas antioksidan teripang dalam memerangkap radikal bebas DPPH diperoleh nilai Inhibitory Concentration (IC50) ekstrak etanol,fraksi n-heksan, fraksi etilasetat dan fraksi air
secara berturut-turut sebesar 225,49 mcg/ml; 1192,33 mcg/ml; 127,33 mcg/ml; dan 101,13 mcg/ml. Hasil menunjukkan aktivitas antioksidan ekstrak etanol dan fraksi n-heksan tergolong dalam kategori sangat lemah, sedangkan fraksi etilasetat dan fraksi air tergolong dalam kategori sedang.
SIMPLEX CHARACTERIZATION AND ANTIOXIDANT ACTIVITY ASSAY OF ETHANOL EXTRACTS WITH n-HEXANE AND
ETHYLACETAT FRACTIONS OF SEA CUCUMBER Holothuria atra Jaeger
Absract
Sea cucumbers are marine invertebrates of the phylum of Echinodermata
that much found in Indonesian. Sea cucumber’s contain are high protein and
collagen, and mineral, mucopolysacarides, glucasaninoglycans, amino acid and chondroitin. Sea cucumber also contain saponin glycosides and Super oxide dismutase activity thus has great potential to developed in the field of medicine. The purpose of this observed is to establish simplex characterization and antioxidant activity assay of ethanol extracts with n-hexane and ethylacetat fractions of sea cucumber (Holothuria atra Jaeger)
Extraction was accomplished by percolation method with ethanol as solvent, fractionated Solvent Extraction Method with n-hexane and ethylacetat. The activity antioxidant assay of ethanol extracts ethanol and the fractions of sea cucumber used DPPH (1,1-diphenyl-2-picrylhydrazil) free radical scavenging method at wave lenght 516 nm after 60 minutes at room temperature. Simplex characterization including water content, water-soluble extract content, ethanol-soluble extract content, total ash content, and acid-inethanol-soluble ash content. Compound screening of simplex powder including determination glycoside, saponin, and steroid/triterpenoid.
The result obtained from simplex characterization of sea cucumber respectively are water content 9.30 %, water-soluble extract content ethanol-soluble extract content, total ash content, and acid-inethanol-soluble ash content 4.05%. The result of compound screening, it contain glycoside, saponin and steroid/triterpenoid. The result of antioxidant activity scavenging DPPH free radical obtained Inhibitory Concentration (IC50) value of ethanol extract, n
-hexane, ethylacetat and water fraction respectively 225.49 mcg/ml; 1192.33 mcg/ml; 127.33 mcg/ml; dan 101.13 mcg/ml. The result indicated antoxidan activity of ethanol extract and n-hexane is very low, meanwhile ethylacetat and water fractions is intermediate.
KARAKTERISASI SIMPLISIA DAN UJI AKTIVITAS
ANTIOKSIDAN EKSTRAK ETANOL SERTA
FRAKSI n-HEKSAN DAN ETILASETAT
TERIPANG Holothuria atra Jaeger
SKRIPSI
OLEH:
MELVA MARTUA HUTAHURUK
NIM 111501045
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN UJI AKTIVITAS
ANTIOKSIDAN EKSTRAK ETANOL SERTA
FRAKSI n-HEKSAN DAN ETILASETAT
TERIPANG Holothuria atra Jaeger
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
MELVA MARTUA HUTAHURUK
NIM 111501045
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
PENGESAHAN SKRIPSI
Pada Tanggal: 24 November 2015 Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Dra. Suwarti Aris, M.Si., Apt. Dr. Marline Nainggolan, M.Si., Apt. NIP 195107231982032001 NIP 195709091985112001
Dra. Suwarti Aris, M.Si., Apt.
Pembimbing II, NIP 195107231982032001
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa yang telah memberikan karunia yang berlimpah sehingga penulis dapat menyelesaikan
skripsi ini dengan judul “Karakterisasi Simplisia Dan Uji Aktivitas Antioksidan
Ekstrak Etanol Serta Fraksi n-Heksan Dan Etilasetat Teripang Holothuria atra
Jaeger”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar
Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan terima kasih kepada Ibu Dr. Masfria, M.S., Apt., selaku Pejabat Dekan Fakultas Farmasi USU Medan, Pembantu Dekan I Fakultas Farmasi USU Medan serta jajarannya, yang telah menyediakan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi. Penulis juga mengucapkan terima kasih kepada Ibu Dra. Suwarti Aris, M.Si., Apt., dan Alm. Ibu Dra. Aswita Hafni Lubis, M.Si., Apt., serta Ibu Prof. Dr. Julia Reveny M.Si., Apt., selaku pembimbing. Ibu Dr. Marline Nainggolan, M.Si., Apt., Ibu Dr. Poppy Anjelisa Z. Hasibuan, M.Si., Apt., dan Ibu Dra. Herawaty Ginting, M.Si., Apt., selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada penulis dalam menyempurnakan skripsi ini. Ibu Dr. Anayanti Arianto, M.Si., Apt., selaku penasehat akademik yang selalu memberikan bimbingan kepada penulis selama masa perkuliahan serta Bapak dan Ibu staf pengajar Fakultas Farmasi USU Medan yang telah mendidik selama perkuliahan.
Hutauruk, atas limpahan kasih sayang, doa dan dukungan yang tidak ternilai apapun. Penulis tak lupa mengucapkan terimakasih kepada teman-teman yang telah banyak membantu selama penulisan skripsi ini.
Penulis telah berusaha semaksimal mungkin untuk menyelesaikan penulisan skripsi ini, namun demikian penulis menyadari sepenuhnya bahwa skripsi ini masih jauh dari kesempurnaan, oleh karena itu penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Penulis berharap semoga skripsi ini dapat memberikan manfaat bagi kita semua.
Medan, 24 November 2015 Penulis