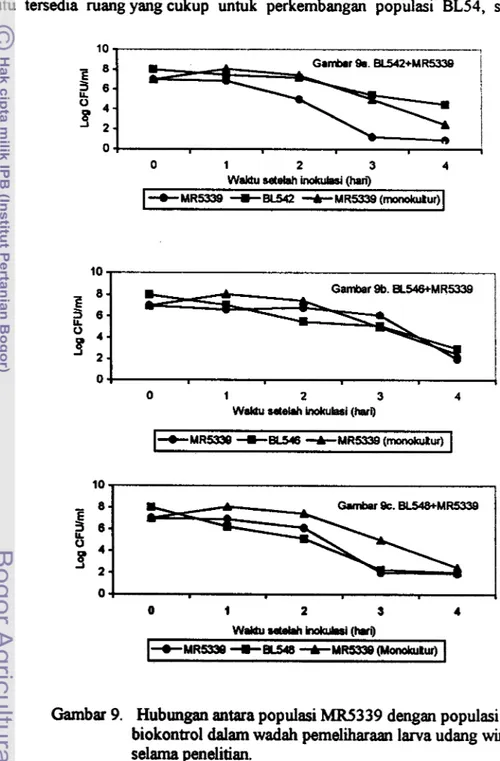
ISOLASI DAN KARAKTERISASI BAKTERI ASAL
LAUT SULAWESI UNTUK BIOKONTROL
PENYAKIT VIBRIOSIS PADA UDANG
WINDU
(Penaeus monodon
Fab.)
OLEH:
MULIANI
PROGRAM PASCASARJANA
INSTITUT PERTANIAN
BOGOR
ABSTRAK
IMULIANI. Isolasi Dan Karakterisasi Bakteri Asal Laut Sulawesi Untuk jBiokontrol Penyakit Vibriosis Pada Udang Windu (Penaeus Monodon Fab.) IDi bawah bimbingan Dr. Ir. Antonius Suwanto, M.Sc sebagai ketua, dan Dr. :Ir. Yusminah Hala, MS sebagai anggota.
Penelitian ini bertujuan untuk mendapatkan koleksi bakteri asal laut Sulawesi Selatan yang dapat maghambat pertumbuhan atau mengurangi virulensi V. harveyi.
Dari
hasil penelitian ini diharapkan ditemukan isolat-isolat bakteri biokontrol yang lebih berpotensi dari isolat-isolat yang ada sebelurnnya atau sumber agen biokontrol untuk penanggulangan penyalut vibriosis pada udang windu.Bakteri kandidat biokontrol diisolasi dari karang, air laut dan sedimen pantai di beberapa lokasi di Sulawesi Selatan. Uji daya hambat bakteri kandidat biokontrol terhadap
V:
harveyi dilakukan baik secara in vitro maupun in vivo.Isolat bakteri laut yang mengharnbat
V:
harveyi selanjutnya diuji patogenisitasnya terhadap larva udang windu pada konsentrasi 1o8
seVml.Uji tantang secara in vitro dilakukan di dalam media kaldu SWC dalam labu erlemeyer. Kepadatan V: harveyi patoga (MRS339 ~ifR) dibuat menjadi 10' seVml, dan kepadatan bakteri penantang (BL542, BL546, dan BL548) dibuat menjadi 10' seVml. Populasi MR5339 ~ifR dalam wadah diarnati pada hari ke 1, 2 , 3, dan 4 setelah inokulasi. Penelitian ini menggunakan rancangan Acak Lengkap dengan tiga kali ulangan.
Untuk menentukan identitas isolat berdasarkan sekuen 16s-rRNA dari t~akteri yang potensial menghambat b! harveyi, dilakukan analis~s sekuen gen
11 6S-rRNA.
Sebanyak 603 isolat bakteri telah diisolasi dari laut dan 15 (2.5%) diantaranya potensial menghambat MR5 339
Rip.
Isolat BL542 memilik~ daya hambat yang paling tinggi dengan diameter zona penghambatan sebesar 1 1,5 mm, lcemudian disusul oleh isolat BL546 dan BL547 masing-masing 1 1,l mm setelah inokulasi selarna 2 hari pada media SWC 100% dalam cawan petri.Ke 15 isolat yang potensial sebagai bakteri biokontrol bersifat gram- negatif, berbentuk batang pendek (kecuali isolat BL566 berbentuk batang ~~anjang), urnurnnya bersifat indol negatif, motilitas negatif (kecuali isolat MK107 tlan BL566) dan semuanya bersifat amilolitik. Uji patogenisitas terhadap enam sola at diantara ke 15 isolat tersebut menunjukkan bahwa semuanya tidak patogen 1 erhadap larva udang windu (PL2 1 atau PL7).
Pada uji in vih-a, populasi MR5339
~ i p
paling rendah pada perlakuan yang dikoinokulasi dengan isolat BL542, kemudian berturut-turut perlakuan yang dikoinokulasi dengan isolat BL546, monokultur M.5339Rip
dan BL548. 1Secara statistik pengaruh perlakuan yang dikoinokulasi dengan isolat BL542 berbeda nyata (P<O. 05) terhadap perlakuan laimya.Pada uji in viw, penurunan populasi MR5339
Rip
dalam air pemeliharaan llarva udang paling tinggi pada perlakuan yang dikoinokulasi dengan isolat .BL542. Populasi MR5339Rip
menurun dari 10' CFUId pada hari ke 0 menjad~ 0 . 8 ~ 1 0 ' CFUIml pada hari ke 4 (hari terakhir). Hasil penelitian ini menyarankan lbahwa isolat BL542 paling potensial untuk digunakan sebagai biokontrol terhadap MR5339Jumlah kumulatif larva udang windu yang mati pada akhir penelitian (96 jam perendaman) tatinggi pada monokultur MR5339
~ i p
(50%), kemudian berturut-turut pada perlakuan yang dikoinokulasi dengan isolat BL548 (52%),SURAT
PERNYATAANDengan saya ini menyatakan bahwa tesis yang be judul :
"ISOLASI DAN KARAKTERISASI BAKTERI ASAL LAUT SULAWESI
UNTUK
BIOKONTROL PENYAKIT VIBRlOSlS PADAUD
ANG WINDU (Penaeus rnonodon Fab)"Adalah benar merupakan hasil karya sendiri dan belum pernah dipublikasikan. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas
dim dapat diperiksa kebenarannya
ISOLASI DAN KARAKTERISASI BAKTERI ASAL LAUT
SULAWESI UNTUK BIOKONTROL PENYAKIT VIBRIOSIS
PADA UDANG WINDU
(Penaeus monodonFab.)
Tesis
Sebagai Salah Satu Syarat Untuk Memperoieh
Gelar Magister Sains Pada
Program Studi Biologi
PROGRAM
PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis
:Isolasi dan karakterisasi bakteri asal laut
Sulawesi
untuk
biokontrol penyakit
vibriosis pada udang windu
(Penaeus monodon
Fab.)
hlama
:Muliani
Program Studi
:Biologi
Menyetujui,
1.
Kornisi Pembimbing
Dr. Ir. Antonius Suwanto, M.Sc
-
Dr. Ir. Yusminah Hala. MS
Ketua
Anggota
]Dr. Ir. Dedv Duryadi S, DEA
PRAKATA
Seiring dengan semakin berkembangnya usaha budidaya udang windu, masalah yang dihadapi juga muncul satu derni satu, mulai dari kasus serangan penyakit udang luxnutan, penyakit insang merah, penyakit udang berkepala kuning, penyakit udang bintik putih, sampai pada penyakit udang berpendar. Kasus-kasus penyakit udang tersebut telah dicoba untuk diatasi oleh pihak-pihak yang berwenang, seperti lembaga penelitian, perguruan tinggi maupun instansi-
instansi pemerintah yang terkait. Sarnpai sekarang ini penanggulangan penyakit ini belum berhasil dengan memuaskan, disebabkan karena kompleknya permasalahan yang terjadi di lapangan.
Di antara kasus-kasus penyakit yang timbul, penyakit udang berpendar
yang disebabkan oleh bakteri Vibrio, merupakan salah satu kasus penyalut udang yang cukup serius. Penyakit ini selain menyerang larva udang di panti-panti perbenihan, juga menyerang udang di tambak pembantutan dan pembesaran. Penyakit ini dapat mempengaruhi produksi dan sekaligus berdarnpak pada penurunan penerirnaan devisa negara dibidang pertambakan.
Meskipun penyakit udang berpendar dapat diatasi dengan antibiotik, tap1 ha1 ini tidak dianjurkan mengingat sifat resistensi bakteri terhadap antibiotik jika digunakan secara term menerus. Jika yang terserang adalah udang yang sedang
dibudayakan di tambak, penggunaan antibiotik sungguh tidak e f e b f dan efisien. Dengan demikian dicari altematif lain untuk mengatasi hal tersebut. Telah
banyak usaha-usaha yang dilakukan di antaranya dengan perbaikan kualitas air
memperbaiki mutu kualitas air tarnbak, namun sering terbentur pada permasalahan sempitnya lahan yang akan dijadikan sebagai tandon atau
kwangnya ketersediaan kekerangan sebagai bahan baku biofilter.
Perkembangan ter&r menunjukkan bahwa penggunaan bakteri sebagai biokontrol baik di panti perbenihan rnapun di tarnbak pembesaran semakin
intcmsif dilakukan. Tanpa didasari pengetahuan tentang kandungan produk- produk biokontrol yang disodorkan oleh produsen, petani langsung menyarnbut produk tersebut dengan antusias, meskipun tidak sedikit dari mereka yang hanya membuang biaya tanpa hasil yang jelas. Berdasarkan ha1 tersebut penulis di b a l d bimbingan Bapak Dr. Ir. Antonius Suwanto,
M.Sc
dan Ibu Dr. Ir. Yulsminah Hala, MS tergerak melakukan penelitian dan mengisolasi bakteri dari lau~t untuk dijadikan cikal bakal bakteri biokontrol terhadap penyakit udang beirpendar. Isolat-isolat bakteri laut yang potensial sebagai bakteri biokontrol terhadap penyakit udang berpendar akan dikoleksi sebagai plasma nutfah.Semoga apa yang penulis lakukan mendapat Ridho dari Allah pernilik alaun semesta sehingga dapat bermadhat bagi penulis khususnya dan masyarakat pada umumnya
UCAPAN TERIMA KASIH
Puji dan syukur penulis panjatkan kehadirat Allah SWT, atas Rahrnat dan W~dayat-Nya yang dilimpahkan kepada penulis, sehingga dapat menyelesaikan
studi, penelitian dan penulisan tesis ini. Penulis berdoa kepada Allah AZZA Wajallah, semoga hasil penelitian yang bejudul "ISOLASI DAN
K ARAKTERIS AS1 BAKTEFU ASAL LAUT SULAWESI UNTUK
BI'OKONTROL PENYAKIT VIBRIOSIS PADA UDANG WINDU (Penelis
Monodom Fab.)" ini dapat bermanfaat bagi penulis khususnya dan bag pembaca urnurnnya
Rasa hormat dan terima kasih yang tiada henti-hentianya penulis haturkan
keipada kedua orang tua yang telah melahirkan dan membesarkan penulis.
Pr?ngorbanan dan birnbingan, kasih dan sayang, ketekunan dan keuletan dalarn menghadapi pahit getimya hidup merupakan suri tauladan bagi penulis untuk psrntang menyerah dalarn meraih cita-cita. Semoga Allah
SWT
senantma menyayangi dan meridhio keduanya baik dunia maupun akhirat.Ucapan terima kasih yang sedalam-dalamnya penulis haturkan kepada suami tercinta Drs. Gunarto, M.Sc atas kasih dan sayang serta bantuan baik moril maupun rnateriil selama penulis menempuh pendidikan sampai pada penulisan teds hi. Semoga pengorbanan dan kesabarannya dalam mendampingi dan
membimbing penulis selama mengikuti kuliah dan penelitian mendapat balasan dslri Allah SWT.
dosen yang sangat banyak membantu selama penulis menempuh studi di P B .
Bag
penulis beliau adalah figur ilmuan yang bejiwa sosial dalam membagikan ilmunya kepada semua orang. Kedisplinan dan keuletan dalam menjalankan tugasnya baik sebagai dosen rnaupun sebagai pembimbing bagi mahasiswanya merupakan suri tauladan yang patut dicontoh. Semoga jasa-jasa dan pengorbanannya mendapiit balasan yang setimpal dari Yang Maha Kuasa Ucapanyang sama penulis hatuxkan kepada Ibu Dr. Ir. Yusminah Hala, MS selaku pembimbing anggota Kepada beliau penulis selalu berkonsultasi selama dalam melaksanakan penelitian dan penyusunan tesis. Beliau begitu banyak memberikan bimbingan sehingga kesulitan-kesulitan yang penulis alami selama melakukan penelitian dapat teratasi. Penulis berdoa semoga jasa-jasa beliau mendapat pahala
yang berlimpah.
Terirna kasih sedaliun-dalamnya juga penulis ucapkan kepada Bapak Dr.
Lr.
Tau6k Ahmad, MS (mantan Ka Balai) dan Bapak Ir. Muharidjadi Atmornarsono,
M.Sc
(Ka
Balai sekarculg) yang telah memberikan ijin kepada penulis untuk melanjutkan studi dan melakukan sebagian tahapan penelitian di Balai Penelitian Periakanan Pantai, Maros. Ucapan yang sama pula penulis haturkan kepada Proyek PAATP, Badan Penelitian dan Pengembangan Pertanian sebagsllpenyandang dana bagi terlaksananya studi ini. Ucapan terima kasih juga penulis sampaikan kepada "International Foundatr on for Science (IFS), Sweden dan
Research Center for Microbial Diversiry
(RCMD)
FMIPA, P B yang telahKepada segenap rekan-rekan di laborotorium Patologi Balai Penelitian Perikanan Pantai (Indah, Elu Irnah, Yay& Nana, Pak Ari, Ayu, Kasma, Bunga, dan Ucin), rekan-rekan di laboratorium Mikrobiologi dan Biokimia PAU IPB (Bu Ika,
Bu Eni, Bu Endang Pak Mardi dan semua yang tidak bisa disebutkan namanya satu persatu), serta rekan-rekan di laboratorium Biologi Molekuler Biotrop (Dik Esti, Irawan, Bu Nyoman Bu Etti, Bu Ella, Pak Dwi, Jim , Pak Husen Yogi, Bu Selly, dan semua yang tidak bisa disebutkan narnanya satu persatu) penulis haturkan terima kasih yalng sedalam-dalamnya atas semua bantuannya selarna
penulis melakukan penelitian.
Teristimewa kepada ternan-teman sepe juangan di Mikrobiologi angkatan
"99", mbak Citra, mbak
Zlmi,
dik Anit, dik Sari, dik Linda, dan dik Yanti penulis mengucapkan terirna kasih yangtak
terhingga atas segala bantuan baik morilmapun materiil selarna m~enempuh kuliah, penelitian, dan penyusunan tesis. Hal
yang sama penulis sampartkan pula kepada teman sekosan, Bu Ros, Mbak Prapti, dan Bu yayu. Terutama pada Bu Ros, yang telah membantu memberi fasilitas selama pengetikan tesis ini.
Akhimya kepada kr~kak-kakak, adik-adik dan semua keluarga serta semua pihak yang telah membleri dorongan dan semangat kepada penulis selama menempuh pendidikan, penulis
tak
lupa mengucapkan terima kasih yangsedalam-dalamnya
.
DAFTAR
IS1
Halamam DAFTAR TABEL
...
v D AFTAR GAMBAR...
vi DAFTARLAMPIRAN...
vi PIENDAHULUAN...
Latar Belakang
.
.
1Tujuan Penelloan
...
5Kegunaan Penelitian
...
5 TINJAUAN PUSTAKAPenyakit Vibriosis Pada Udang Windu ... 6 Karakteristik dan Idmtifikasi Bakteri Dengan Teknik
...
Molekular 8
...
Resistensi antibiotik 11
...
Patogenisitas Bakte. r i Vibrio harveyi Pada Udang Windu 12
Upaya Penanggulanlgan Penyakit Vibriosis
...
13METODE PENELITIAN
Waktu dan Tempat
...
Alat dan Bahan
...
Prosedur Ke rja ...Isolasi Bakteri dari I. aut Sebagai Kandidat Biokontrol ...
Uji Daya Hambat Bilkteri Kandidat Biokontrol
...
Terhadap K harveyi'
a Secara K uali tatif ...
b
.
Secara Semi Kuantitatif ...Karakterisasi Bakteli Kandidat biokontrol ...
a Sifat Fisiologi dan Biokimia ...
b
.
Resisterxi Terhadap Beberapa Antibiotik danPembuat an Mutan Spontan ...
Uji Patogenisitas Bakteri Kandidate Biokontrol Terhadap Larva Udang windu P
.
monodon ...a
Persiapa? Air Laut dan Peralatan Yang digunakan ....
...b
.
Pengadam Larva Udang WinduP
monodon c.
Persiapan Isolat dan lnokulasi ke Dalam wadahPemelihiuaan Larva Udang
...
Uji Tantang Bakteri K harveyi Dengan Bakteri Kandidat
...
Biokontrol
...
a
.
Uji tantang secara in vitro...
.
b Uji tantang secara in vitro
Identifikasi Bakteri Kandidat Biokontrol ... ...
a
Ekstrak DNAb
.
Amplikasi gen 16s-rRNA dengan PCR ...H[ASIL DAN PEMBAHASAN
Isolasi Bakteri Laut Sebagai Kandidat Biokontrol ... 31
Uji daya Hambat Bakteri Kandidat Biokontrol Terhadap K harveyr a Secara kualitatif ... 32 c
.
Secara Stmi Kuantitatif ... 33Karasteristik Bakteri Kandidat Biokontrol ... 35 a Sifat Fisiologi dan Biokimia ... 35
b
.
Resistemsi Terhadap Antibiotik ... 37Patogenisitas Bakteri Kandidat Biokontrol ... 38
Uji Tantang Bakteri Kandidat Biokontrol dengan MR5339 ... 39 ...
a . Uji Tantang skala in vitro 39
b
.
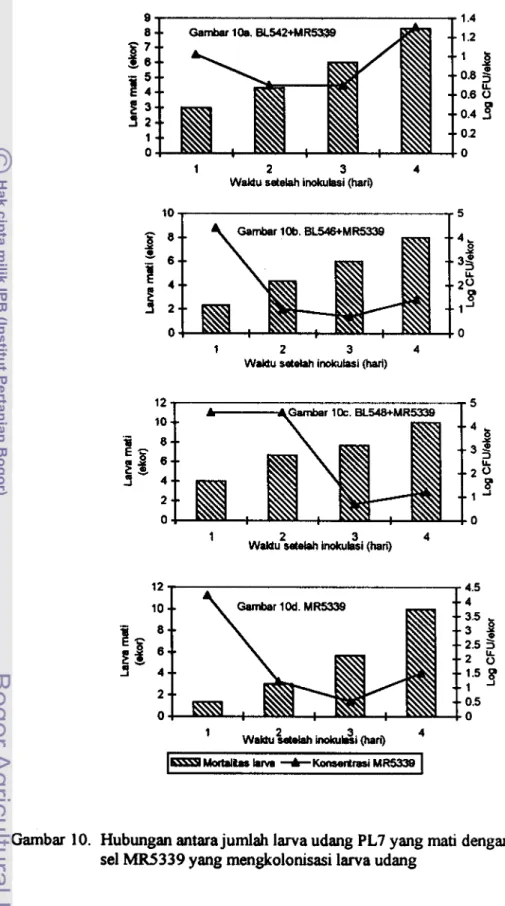
Uji Tantang skala in viw ... 41 Uji tantang menggunakan Larva Udang PL7 ... 41Koloinisasi MRS339, Bakteri biokontrol. dan
Mortalitas Larva Udang Stadia PL7
...
45Uji tantang Menggunakan Larva Udang
Stadia rnysis ... 50
Identifikasi Molekurll Terhadap Isolat BL542 ... 52
ESSIMPULAN DAN SARAN
Kesimpulan
...
55Saran
...
55IIAFTAR PUSTAKA
...
561,AMPJRAN
...
64DAFTAR TABEL
Nomor Halaman
Teks
1
.
Karakteristik V: harveyi yang digunakan sebagai bakteri patogen...
pada uji tantang bai k secara in vitro maupun in vivo 17
2
.
Karakteristik secara morfologi bakteri laut yang potensial sebagai biokontrol terhadap MR5339 ... 323 . Hasil uji daya harnbat ke 15 isolat kandidat biokontrol
terhadapMR5339
...
35...
4
.
Data fisiologi dan biokirnia ke 15 bakteri kandidat biokontrol 36 5.
Pertumbuhan baktari kandidat biokontrol pada media SWC 100%...
yang dibubuhi antibliotik 25 pglrnl 38
6
.
Kelanpungan hidup larva udang setelah 24jam perendaman pada Uji patogenisitas ... 39 7 . Populasi MR5339 clalarn air, pada larva udang, dan jurnlahlarva udang yang mati setelah 24 jam perendaman pada uji
DAFTAR GAMBAR
Nomor Halaman
Teks
1 . Skema langkah kerja penelitian. . .
.
..
. . ..
. . .. . . .
.. . .
..
. . . 1 9 2. Contoh koleksi sampel karang (a), Sedimen (b), dan air laut (c)yang diambil dari lau~t sekitar Makassar
.
.. . .
.
.
. . ..
. . . 2 13. Penampilan
V.
harveyi (MR5339) pada media TCBS A . . ..
. . ..
. . . 22 4. Tata letak wadah perneliharaan larva udang pada uji tantang .. . . .. .. 27 5. Uji daya hambat bakteri kandidat biokontrol dengan metodePenggoresan ... 33 6. Uji daya hambat bakteri kandidat biokontrol menggunakan
paper disk .
. . .
.
. . . .
.
. . . .
..
.. . .
.. .
. . ..
..
. . ..
.. .
. . ..
. . ..
. . . 347. Populasi MR5 339 piula uji tantang secara m vrtro.. .
.
. . ..
. . ..
. . ..
. . . 4 1 8. Populasi MR5339 d;darn wadah pemeliharaan larva udang winduPL7 selama penelitian..
.
. .. . . . .. .
.. .. . . .. . .
.
. . .
..
.. . .
..
. . . . ... 439. Hubungan antara populasi MR5339 dengan populasi bakteri Biokontrol dalam wzrdah pemeliharaan larva udang windu PL7
.
.
selama penellban..
.
.
. . .
. . .
.
. . . .
.
. .
.
.
. .
.
,. . .
.. .
.
. . .
. . . .. .
..
...
4410. Hubungan antara junlah larva udang PL7 yangmati dengan
jumlah sel MR5339 yang mengkolonisasi larva udang..
. .
..
.. .
. .. . . .
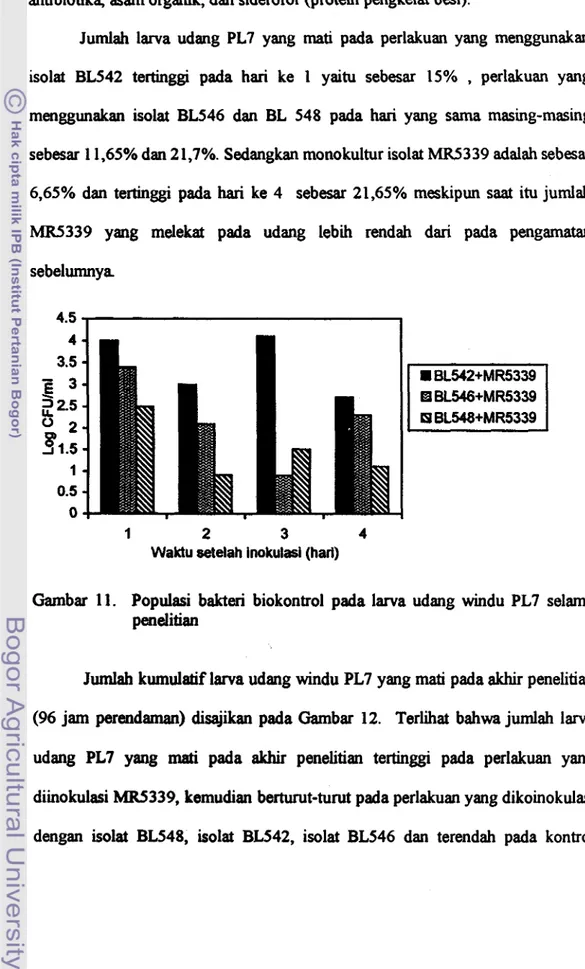
4611. Populasi bakteri biolkontrol pada larva udang windu PL7 selama penelitian
...
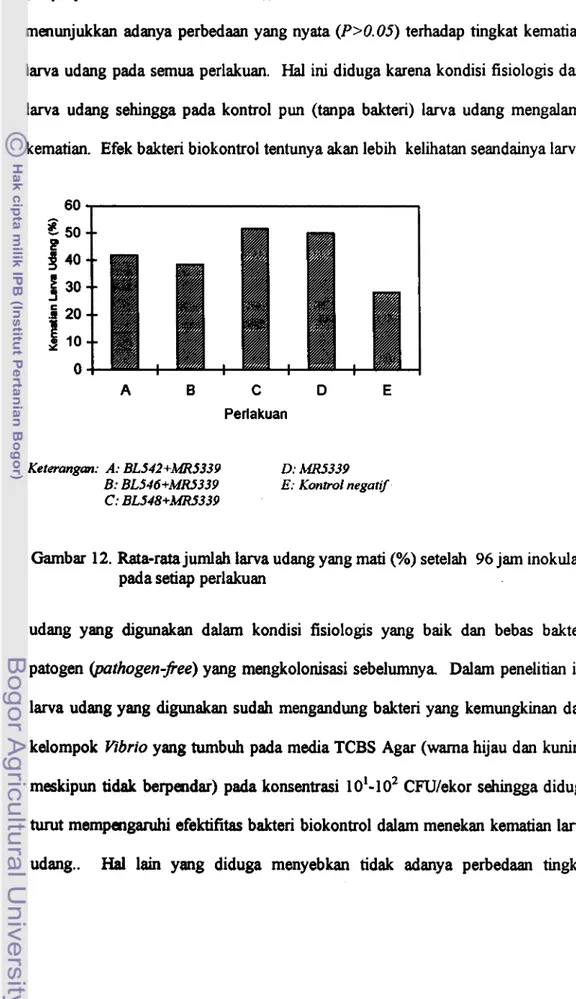
... 4812. Rata-rata persentase jumlah larva udang yang mati (ekor)
setelah 96 jam inok~~lasi pada setiap perlakuan..
. . .
. ..
..
. . ... 49 13. Penampilan koloni isolat BL542 pada media SWC 100%. .. .
. . . 53 14. Pophon filogenetik ~isolat BL542.. ..
.
.
. . .
.
. . .
. . ...
.. .
. . ..
.
.. . .
.
. . .. 54DAFTAR LAMPIRAN
Nomor Halaman
Teks
1. Persiapan pereaksi dan langkah ke rja pada cycle sequencing..
. . .
642. Langkah kerja presipitasi DNA..
. . .
. .
.
.
.
. . .
. .
.
. .
,.
. . .
. .
. . .
. . ... 643. Komposisi dan proses pembuatan gel poliakrilarnid untuk
sekuensing
... ...
..,
,.....
.,. ... ...
...
.,.
... ...
...
... ... ... ... ...
...
... ... ...
654. Data
hasil
fasts isolat BL542.
.
.
. .
.
. . .
. . .
. . .
. . .
.
. . .
.. .
. 66PENDAHULUAN
Latar Belakaog
Budidaya udang wi~idu (Penaeus monodon) di Indonesia telah dilakukan
slejak tahun 70an dan san~pai sekarang
masih
merupakan salah satu kegiatan perilcanan yang cukup potensial (Ahmad dan Mangampa 2000). Puncakperkembangan usaha budidiya udang windu tejadi pada awal tahun 90an, dimana pada periode tersebut pemislgkatan usaha budidaya udang windu bukan hanya
rrlelalui intemifikasi, tetapi juga pembukaan areal hutan bakau menjadi lahan
piertambalm. Konselcuansi dari paningkatan tersebut adalah menurunnya kualitas
lingkungan yang berdampalr pada timbulnya berbagai serangan penyakit. Hal ini menyebabkan penunman plroduksi tambak dan sekaligus berdampak terhadap
pc3nerimaan devisa negara Rukyani (1993) melaporkan bahwa karma adanya serangan penyakit maka hrlnya sekitar 40% dari seluruh areal pertarnbakan di Intdonesia yang masih berogerasi, ha1 ini menyebabkan kerugian rnilyaran rupiah pcxtahun. P e n m a n prodluksi udang windu akibat serangan penyakit terlihat pida periode 1992-1 994 yaitu dari 98.356 MT menjadi 83.193
MT
atau sebesar15% (Anonimus 1999). Surnber lain menyebutkan bahwa ekspor udang lndonesia ke Jepang mengallami p e n m a n selama periode 1994-1998 yaitu dari
63.666
MT
menjadi 53.41 1MT
(Ferdouse 1999).wmdu telah banyak diteliti dan dilaporkan oleh beberapa peneliti baik dari dalarn ncseri (Atmomarsono et al. 1993; Boer et al. 1993; Rukyani 1993; Sugama et al. 1993; Prayitno 1994; Tjahydi et al. 1994, Herawati 1996; Salfira 1998; Haryanti
et al. 2000), rnaupun peneliti dari manca negara seperti Filipina dan Thailand (Lavilla-Pitogo et. al, 1990 dan 1992; Lightner et al. 1992; Chen and Hana 1 994;
Jiravanichpaisal et at. 1994; Sung et al. 1994; Ruangpan et a1 1998, dan Pisharawipas et al. 1998).
Penyakit vibriosis yang disebabkan oleh Vibrio harveyi, oleh petani
tambak dikenal juga sebaglu "Penyakit udang menyala" atau "penyalut kunang- k~unang". Udang yang terscxang bakteri
V.
harveyi pada malam hari atau dalamk d a a n gelap nampak berpendar. Patogenisitas V. harveyi terhadap udang windu te!lah banyak diteliti. Tingkid kematian larva udang windu (PL 1-2) yang diinfeksi d~engan Y: harveyi yang diisolasi dari panti perbenihan dengan konsentrasi 10"
CFUIml dengan lama perendaman 48 jam sebesar 69,0% (Lavilla Pitogo 1990, 11992) dan 5 1,5% (Prayitno dan Latchford 1995). Kematian larva udang windu (l'L 25) yang diinfeksi deng,an V. harveyi (1
o6
CFUIml) dengan lama perendaman48 jam adalah sebesar 53,3'% (Muliani et a1 2000). Jiravanichpaisal et al. (1 994)
nielaporkan bahwa mortalitas udang windu dewasa yang diinjeksi dengan V:
harveyi isolat B-2 dengan kepadatan 8,20x105 CFUIekor udang dengan lama irlkubasi 20 jam dan isolalt B-4 dengan kepadatan 1,55x106 CFUIekor udang slelama 24 jam masing-masing sebesar 100% dan 80%.
Berbagai penelitian telah dilakukan untuk mendapatkan suatu metode
lain ; dengan menggunakan obat-obatan dan antibiotik (Karunasagar et a/. 1994 ; Chnnrrb&akool et al. 1995 ). Penanggulangan penyakit dengan menggunakan obad-obatan dan antibiotik derpat membawa dampak yang serius karena masalah resi~du bahan anti mikroba pauia udang dan timbulnya resistensi bakteri terhadap antnbiotik. Oleh sebab itu kennudian dicari cara penanggulangan yang lain.
Pengelolaan limbah k~udidaya udang menggunakan tandon dan biofilter merupakan salah satu altemlatif pencegahan penyakit vibriosis pada budidaya udmg windu (Atmomarsono et al. 1995 ; Chanratchakool et a1. 1995 ; Muhani et
al. 1998a). Penggunaan tamion
untuk
memperbaiki kualitas air budidaya udang meanpunyai kekurangan kmna memerlukan lahan yang luas, dimana sekitar 30%duri total
area
digunakan stbagai petak tandon (Chanratchacool et al. 1995),setiangkan pemggunaan kekt-an (tiram
dan
kerang bakau) sebagai biofilter menemui kendala tantang ke1,ersediaan pasokan kekerangan.Usaha lain yang blanyak dilakukan
untuk
menanggulangi penyakit vil>riosisadalah
metrangsang: kekebalan non-spesifik udang melalui penggunaanvaksin
dan imunostimulan
(Itami dan Takashi 1991,Sung
et al. 1994 ; dan Dttvaraja et al. 1998 ; Salfiua 1998 ; Vargas-Albores et al. 1998), pengunaan probiotik (Zafhn et al. 199'7 ; Lavilla-Pitogo et a1.1998 ; Rengpipat et a1 1998 ; dam Maeda 1999),dan
penlggunaan bahan aktif dari sponge sebagai antibakteri(PLhmad
et al. 1995 dan Mulliani et al. 1996 dan 1998b).Pmggunaan bakteri yang diisolasi dari berbagai sumber sebagai biokontrol
perbenihan udang (Tjahyadi et al. 1994 dan Haryanti et al. 2000), dari air tambak dian air pemeliharaan larva (Rosa et al. 1997), dan dari larva udang yang sehat (Widarnarni dan Suwanto 2000).
Dari berbagai usaha yang telah dilakukan untuk mengatasi masalah penyakit di bidang pertarnbakan, penggunaan biokontrol merupakan cara yang menjanjikan prospek yang cerah. Menurut Suwanto (1994) keuntungan dalarn rr~enggunakan biokontrol antara lain; ( I ) Organisme yang dipakai telah dipertimbangkan lebih arnan daripada berbagai bahan kimia proteksi yang
sekarang digunakan; (2) Tidak terakumulasi dalam rantai makanan; (3) Adanya proses reproduksi dapat mengurangi pemakaian yang berulang; (4) Organisme s i m a n jarang yang menjadi resisten terhadap agen biokontrol dibandingkan
dengan resistensinya terhadap bahan kirnia; (5) Dapat dipakai untuk pengendalian slecara bersama-sama dengan cara-cara proteksi yang telah ada sampai saat ini.
Berdasarkan hal tersebut di atas rnaka perlu adanya upaya pencarian agen- agen biokontrol yang lebih berpotensi untuk penanggulangan penyakit vibriosis pada udang windu
.
Salah satu surnber bakteri biokontrol yang sudah mulaidipelajari adalah air tambak dan air laut (Tjahyadi et al. 1994; dan Haryanti et nl
2.000). Sumber daya laut yang lain yang diduga menyimpan potensi sebagai sumber plasma nutfah untuk bakteri biokontrol yang sampai saat ini belum blanyak dipelajari adalah s d m e n dan terurnbu karang. Berdasarkan hal tersebut nnaka perlu dilakukan penelitian untuk mencari bakteri kandidat biokontrol yang
Tu j uan Penelitian
Untuk mendapatkan sejumlah isolat bakteri asal laut yang dapat mengharnbat pertumbuhan t a u mengurangi virulensi V; harveyi penyebab penyaki t vibriosis pada udang windu
Melakukan analisis gmetik dan fisiologi bakteri kandidat biokontrol
hkgunaan Peneli tian
TMJAUAN PUSTAKA
Genus Vibrio merupakan kelompok bakteri gram negatif berbentuk batang,
berukuran antara 0,5-0,8 x 1,4-2,6 pm. Bakteri ini bersifat motil dan kebanyakan rnempunyai flagella yang polar, bersifat anaerobik fakultatif, katalase dan oksidase positif, dapat memfermentasi gula dan menguraikan nitrat, tidak rnemproduksi gas, dan dapat hidup pada suhu 20
-
40 "C. Beberapa spesies dapat tiidup pada pH tinggi, sensitif terhadap uji 01129 dan novobiosin (Mandelstam ettrl. 1986; Sanders dan Fryer 1991; Austine and Austine 1993; Alcina and Blanch '1994; Brock et al. 1994; Muir 1996; dan Madigan et a1 2000). Secara fisiologis
lnetabolisme bakteri Vibrio mirip dengan enterobakter dan beberapa jenis di
iintaranya dapat melakukan fermentasi asam campuran (Neidhart et al. 1990 dan lSchlegel and Schmidt, 1994).
Penyakit Vibriosis Pada Udang Windu
Vibrio ditemukan di hampir seluruh habitat, seperti air tawar, estuaria, air laut, dan tanah, merupakan agen penyebab penyakit pada manusia, ikan dan krustase (Singleton, 1992). Masuknya Vtbrio patogen dalam usaha budidaya udang di tambak dapat berasal dari air laut dan benur yang digunakan. Boer el al.
(1993) melaporkan bahwa induk udang yang berasal dari air laut positif membawa
bakteri berpendar sehingga dapat maularkan pada benur (larva) dan akhimya
terbawa masuk ke tarnbak.
~rl. 1994). Bakteri ini menyerang baik larva udang di panti perbenihan rnaupun rldang yang dibudidayakar~ di tambak pembesaran. Larva udang yang terserang bakteri K harveyi, pada kondisi gelap tampak berpendar, sedangkan udang yang dipelihara di tambak sepe~rti ada cahaya jika air tambak ditiup angin. Selain V. harveyi, juga diidentifikasi jenis Vibrio lain yang menyerang udang di tambak, ~seperti;
V:
parahaemol'tas,V:
alginolyticus, dan K anguillarum (Anderson et (al. 1988; Lightner 1992; 'Nash et al. 1992; Partasasmita 1993; Chen dan Hanna1994 ; Abrahm dan Manley 1995; Chanratchakool et a1 1995).
Sedimen tambak dan organisme pengganggu seperti ikan-ikan liar, kepiting, jembret, makro bentos dan pakan buatan yang digunakan di tambak
pembesaran (Atmomarsono et a1 1995.) serta artemia yang digunakan di panti
perbenihan udang wind11 (Widanarni dan Suwanto 2000) merupakan agen pembawa bakteri Vibrio. Pemberian pakan yang tidak terkontrol selama proses budidaya mengakibatkan akumulasi limbah organik di dasar tambak , sehingga menyebabkan terbentuknya lapisan anaerob yang menghasilkan H2S dan bahan toksik lainnya (Anderson et al. 1988). Akibat dari akumulasi H2S tersebut maka bakteri patogen oportunistik (Aeromonas spp, Vibrio spp), jarnur, parasit dan virus mudah berkembang dan rnemungkinkan timbulnya penyakit pada udang (Lightner
et a1 1992; Nash et a1 1992; Madeali et al. 1993 ; Tompo et al. 1993).
Penyakit udang ~di
tarnbak
dapat terjadi karena terjadinya penurunankualitas air yang diikuti oleh keadaan kesehatan udang yang memburuk akibat
stress (Chanratchakool clt a/. 1995). Dalarn keadaan dernikian bakteri Vibrio
btrkteri Vibrio sering ditemukan berenang di pinggir pematang, dengan tanda-
tanda antara lain kulit badan rusak dan berwarna galap atau merah, bagian ekor dim kaki renangnya b m m merah insang berwarna coklat, otot atau dagingnya
berwarna suram dan ususnya kosong, gerakannya lemah dan menyentak-nyentak
(Itukyani 1993 dan Jiravanichpaisal et al. 1 994).
Di Indonesia wabah penyakit akibat serangan bakteri V: harveyi
dilaporkan terjadi di panti-panti perbenihan yang terdapat di Jawa Timur, Jawa Tengah, Jawa Barat, Sumatra Utara, Sulawesi Selatan dan Bali (Lightner et a1
1992; Boer et al. 1993 dan Sugama et al. 1993) Pada umumnya wabah penyakit
ui
memuncak pada awal m u s h penghujan terutama di tambak-tambak pembesaran (Atmomarsono et al. 1993 dan Madeali et al. 1993).Karakterisasi dan Identifikasi Bakteri Dengan Teknik Molekular
Karakterisasi
dan
identifikasi bakteri dapat dilakukan dengan rnenggunakan analisis fenotipik dengan mempelajari sifat fisiologis ataut~iokimianya (Hadioetomo 1993, Alcina and Blanch 1994; Muir 1996) maupun analisis genotipik secara molekuler. Seringkali hasil uji biokimia atau fisiolog~ tersebut berbeda karena perbedaan ekspresi gen. Untuk karakterisasi galur-galur tialam satu spesies perlu dilihat sifat yang paling mendasar dan relatif stabil yaitu
tiengan analisis genotipik (Suwanto, 1995).
DNA dari genom organisme lain. Namun untuk saat ini, cara ini kurang praktis untuk tujuan analisa secara rutin (Suwanto, 1 995).
Metode molekular untuk keperluan pencirian dan identifikasi bakteri dapat digolongkan menjadi metode yang berdasar pada analisis asam nukleat atau analisis protein, seperti yang telah dilakukan oleh Pizzutto dan Hirst (1995) yaitu ulntuk mengklasifikasikan isolat-isolat Vibrio harveyi yang virulen terhadap larva uidang windu. Analisis profil asam nukleat mencakup analisis profil plasmid
C~lasmid profllling), REA (restriction endonuklease analysis),
RFLP
(restriction Pagment-length polymorphism), ribotyping, RAPD (random ampl$cat~on ofpolymorphic DNA), atau MFLP (macrorestriction ji-agment-length polymorphism) dlengan menggunakan
PFGE
@ulsed-jield gel electroforesis) serta amplifikasiasam nukleat (metode yang berdasarkan PCR). Seluruh teknik ini dapat clikombinasikan dengan analisis hibridisasi DNA danlatau analisis DNA sequensing (Suwanto, 1995).
Teknik PCR (Polymerase Chain Reaction) adalah suatu teknik biologi rnolekuler
untuk
memperbanyak sekuaen DNA tertentu (lebih dari 100 juta kopian) dalamwaktu
hanya beberapa jam, oleh karena itu teknik ini disebut pularunplifkasi DNA (Mullis 1990). Dengan PCR, molekul DNA dapat diperbanyak siampai jutaan kopi dalam tabung reaksi. Teknik ini terdiri dari beberapa siklus
jrang setiap siklusnya terdiri atas 3 tahap yaitu tahap denaturasi, pelekatan primer (primer anneling) dan pemanjangan (elongasi).
Polymorphism) yang digunakan untuk mempelajari profil genetik dari komunitas biakteri pada sebuah ekosistem perairan dengan memarnfaatkan perbedaan plergerakan DNA dalam gel elektroforesis karma adanya perbedaan sekuen (Lee et al. 1996), AP-PCR ( Arbitrarily Primed-Polymerase Chain Reaction) yang cligunakan
untuk
mmgetahui karakteristik dan perbedaan genetik galur-galur bakteri (Goarant et al. 1999), PCR-ASA (Polymerase Chain Reaction-AmpliconSequence Analysis) yang digunakan untuk mendeteksi gen-gen cytolytic caterotoxin dan aerolysin pada Aeromonas spp dengan menggunakan sepasang primer
untuk
gen-gen spesifik atau gen-gen virulen dari Aeromonas spp /(Kingombe et al. 1999), dan PCR-RFLP (Polymerase Chain Reaction-Restriction .Fragment Length Polymorphism) gen 16s-rRNA yang digunakan untukmengetahui keragarnan bakteri menggunakan primer universal untuk domain bakteri (Suwanto et al. 2000). Analisis keragaman genetik dilakukan dengan mernbandingkan profil DNA hasil arnplifikasi (gen 16s-rRNA) yang dipotong dengan emim restriksi tertentu setelah proses elektroforesis.
Telcnik PCR juga telah banyak digunakan ddam rnikrobiologi kelautan dan perilcanan, seperti (1) untuk melihat pola profil DNA genom bakteri vibrio berpendar yang berasal dari laut dan tarnbak udang (Tjahyadi et al. 1994; Yuhana 1 999); (2)
untuk
melihat keragaman genetik bakteri berpendar yang diisolasi dari larva udang windu (Suwanto et al. 1998 dan Widanarni and Suwanto 2000); (3)untuk deteksi bakteri Vibrio purahaemolyticus pada hemolim udang (Rojlorsakul
et a1 1998); (4) untuk mengkarakterisasi dan membedakan isolat-isalat bakteri
Vibrio spp yang patogen pada udang dengan melihat sidik jari (Goarant et al.
1999); ( 5 ) analisis keragaman bakteri Vibrio alginolyficus yang diisolasi dari
pantai bagian utara Sardina (Zanetti et al. 1999), ( 6 ) deteksi kolonisasi d m suksesi bakteri pada permukaan air laut @ang and Love11 2000), dan (7) untuk melihat
keragaman gmetik bakteri Vibrio cholerae di teluk Chesapeake (Jiang et al. 2000).
Resistensi Antibiotik
Menurut Chythanya et al.. (1999) beberapa organisme secara alami resisten terhadap beberapa antibiotik. Hal ini disebabkan oleh beberapa faktor, di antaranya karena (1) organisme tidak mempunyai dinding sel sehingga akan resisten terhadap jenis antibiotik yang merusak pada dinding sel seperti kelompok
penislllm, (2) organisme mungkm tidak permeabel terhadap beberapa antibiotik,
(3) mikroorganisme mempunyai kemampuan untuk menginaktifkan beberapa
antibiotik, seperti kelompok Staphylococcus yang memproduksi P-laktam yang
dapat memecah cincin p-laktam dari penisilin sehingga antibiotik tersebut menjadi
memblokir antibiotik tertentu sehingga resisten terhadap antibiotik tersebut, (5)
m~ikroorganisme mempunyai kemampuan untuk memompa antibiotik tertentu kduar dari dinding sel sehingga resisten terhadap antibiotik tersebut.
Pattogenisitas Wrk, harveyi Pada Udang Windu
Patogenisitas beberapa jenis bakteri Vibrio yang diisolasi dari air laut, sedimen tambak, udang dewasa, air pemelihraan larva dan larva udang telah banyak dipelajari. Tingkat kematian udang windu yang diinfeksi V. harveyr
dengan kepadatan lo3 &dm1 (lama perendaman 48 jam) berbeda berdasarkan thgkat umur. Pada stadia zoea I tingkat kematian udang sebesar 74%, stadia mysis I 73%, dan PL1-2 69% (Lavilla-Pitogo et al. 1990) dan 51,5% (Prayitno
dim Latchford 1995). Jiravanichpaisal et al. (1 994) melaporkan bahwa mortalitas udang windu dewasa yang diinjeksi dengan K harveyi isolat B-2 dengan klepadatan 8,20 x 1
o5
CFUIekor udang sebesar 100% selama inkubasi 20 jam, dan u~dang yang W e k s i denganK
harveyi isolat B-4 deagan kepadatan 1,55 x106 CmJIekor udang sebesar 80% selama 24 jam, Sedang kematian larva udang windu yang diinokulasi denganK
carchariae YA32.2 (diisolasi dari larva udang yang mati) paling cepat dan paling banyak dibanding dengan kernatian udang yang diinnokulasi dengan jenis vibrio lainnya (Hala 1999). Muliani et a1 (2000) telah mengisolasi beberapa jenis bakteri Vibrio dari sedimen tarnbak danmen@eksikannya
ke
larva udang windu (PL25) temyata dengan kepadatan danlruna perendaman yang sama (lo6 CFUlrnl dengan lama perendaman 48 jam),
VTingkat patogenisitas suatu bakteri ditentukan oleh suatu mekanisme rielarna dalam proses pertumbuhan. Menurut Greenberg (1 999) suatu mekanisme
yang umurn untuk mengontrol kepadatan populasi pada bakteri gram negatif idalah dengan menghambat komunikasi antar sel. Kemampuan sel untuk lberkomunikasi satu sama lain tejadi setelah mencapai quorum senslng (Freeman and Bassler 1999) yang tejadi karena adanya suatu senyawa yang disebut
acylhomoserine lactone. Sifat patogenisitas suatu bakteri berkaitan erat dengan kemampuan sel
untuk
melakukan komunikasi antar satu dengan yang lainnya,seperti halnya tejadi pada bakteri Staphylococcus aureus (Balaban dalam
Greenberg 1999). Pada bakteri
V.
harveyi sifat virulensinya berkaitan erat denganfenomena kemampuan berluminescens yang dikontrol oleh suatu sistem quorum
sensing (Kamnasagar et al. 1 994
dan
Czyz et al. 200 1 ). K harveyi mengeluarkan suatu senyawa kedalam medium selama pertumbuhan, senyawa ini b e h g s i sebagai autoinduser yang akan menginduksi te jadinya lurninescens. Jenisacylhomoserine Iactone yang diproduksi oleh V. harveyi untuk memonitor populasi mereka dalam medium adalah N-(3-hydroxybutyry1)homocerine lactone
(Cao and Meighen 1993, Greenberg 1999 dan Manefield et al. 2000). Upaya Penanggulangan Penyakit Vibriosis
Penyakit vibriosis pada udang windu bukan hanya tejadi di Indonesia,
akan
tetapi juga di negara-negara tetangga seperti Thailand, Filipina, dan IndiaBerbagai penelitian telah dilakukan untuk mendapatkan suatu metode bagaimana mencegah
dan
menanggulangi penyakit vibriosis pada udang windu antara lainsebagai antibakteri dan telah digunakan secara intensif ditingkat petani dan pengusaha perbenihan (Karunasagar et al. 1994) ; ( 2 ) penggunaan tandon dan biofilter untuk pengolahan limbah budidaya udang baik di tambak intensif maupun tambak tradisional (Atrnomarsono et al. 1995, Chanratchakool et al.
1995 ; Muliani et al. 1998a) ; (3) penggunaan vaksin dan imunostimulan untuk merangsang kekebalan non-spesifik udang (Itarni dan Takashi 1991, Sung et al.
1994 ; dan Devaraja et al. 1998 ; Salfira 1998 ; Vargas-Albores et al. 1998) ; dan (4) pengunaan probiotik (Zafran et al. 1997 ; Lavilla-Pitogo et al. 1998 ; Rengpipat et a1 1998 ; dan Maeda 1999). Usaha lain yang telah dilakukan untuk
mencegah penyakit vibriosis pada udang windu adalah dengan menggunakan bahan aktif dari sponge dan hydrozoan sebagai antibakteri yang dilakukan dalarn skala laborotoriurn (Ahrnad et al. 1995, Muliani et al. 1996 dan 1998b, dan Suryati et al. 2000).
Penggunaan bakteri yang diisolasi dari berbagai sumber sebagai biokontrol terhadap
V:
harveyi juga telah banyak dilaporkan. Tjahyadi et al. 1994melaporkan bahwa populasi
V:
harveyi dilingkungan perneliharaan udang dapat ditekan dengancara
mengintroduksikan bakteri tertentu yang diisolasi dari perairan iaut di sekitar tambak atau pembenihan udang. Sedangkan Rosa et al.(1 997) telah mengisolasi bakteri pengharnbat V. harvey dari air laut, air tambak, dan air perneliharaan larva Hala (1999) mengemukakan bahwa Vibrro metschnicovii Z dan M yang diisolasi dari larva udang sehat efektif mengharnbat pertumbuhan dan pelelcatan Yibrio carchariae YA32.2 (patogen terhadap larva
kemungkinan dapat dikembangkan sebagai probiotik yang efektif pada panti-
planti perbenihan udang. Mmurut Wang et al. (1999) bahwa fkgsi paling penting penggunaan probiotik adalah mempertahankan kestabilan parameter kualitas air tambak dengan menurunkan bahan organik seperti arnoniak, gas hidrogen sufida,
clan gas-gas beracun lainnya. Selain itu probiotik juga mengontrol terjadinya
blooming alga sehingga dapat menjaga kestabilan nilai pH dalam tarnbak, menurunkan kadar
BOD,
dan menjaga ketersediaan oksigen bagi pertumbuhan udang. Haryanti et al. (2000) telah mengisolasi tiga isolat bakteri yang marnpu ~nenghambat perhunbuhanY:
harveyi pada medium agar dalam cawan petri dan!;atu di antara tiga isolat tersebut mampu menelcan pertumbuhan
Y:
harveyi pada ]media pemeliharaan larva udang. Menurut Manefield et al. 2000) bahwa ekspresilluminesams
dm
virulensi dariY:
harveyi yang patogen pada udang windu dapatMETODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Mikrobiologi dan Biokimia,
Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor, Balai Penelitian Perikanan Pantai, Maros Sulawesi Selatan, dan Laboratorium Biologi Molekuler SEAMEO-BIOTROP dari bulan Februari 200 1 sarnpai dengan Februari 2002
Alat dan Bahan
Seperangkat Electroforesis Gel Mini, Gene Amp@ PCR system 2400 (Perkin Elmer, Branchburg, New jersely),
UV
transiluminator, kamera polaroid,refrigerator, freezer, peralatan sanitasi.
Bahan yang digunakan antara lain : Media untuk isolasi bakteri kandidat
biokontrol yaitu Sea water Complete (SWC); media untuk bakteri V. harveyi yaitu
Thiosulfate Citrate Bile Salt Agar (TCBS-Agar); dan reagent untuk uji fisiologi dan biokimia antara lain, uji oksidasi dan fermentasi (OF), uji Voges-Poker (VP),
uji arginin dehidrolase, uji Muller's decarboxilases, uji arnilolitik, dan Sole Carbon Compoud
.
Utilisation (Muir 1 996).Bahan yang digunakan pada uji tantang secara in vitro seperti isolat K
harveyi yang diisolasi dari tarnbak udang yang terserang penyakit di Kab. Selayar (Tabel 1), paper disk, dan media SWC 100% dan 10%.
Bahan dan alat bantu yang digunakan pada uji patogenisitas bakteri
Tabel 1. Karakteristik
K
harveyi sebagai bakteri patogen pada uji tantang baiksecara
in vitro w p u n in viwI
pendekOksidase
Pertumbuhan pada media
TCBS
Uji sensitifitas terhadap antibiotk,Wimpisin Gentamisin Futazolidon Chloramphenicol Erytromicin Uji Oksidatif-Fermentatif Motilitas Penyebaran
Pemdaran
Voges-ProskauerArginin Dehidrase
Produlrsi gas dari glucose Pertumbuhan pada suhu 40" C
Lisin Decarboksilase Pigmentasi Arnilase Sukrose Indol Ornithine Decarboksilase Putriscin
Pertumbuhan pada ethanol 95% Serin Hepatanoat Xanthine Aminobutirate Arabinosa Sellubiosa Glukuronate Alfa-Ketoglutarat L- Alanin
telah dibuat mutan dan diberi kode MR5339 ~ i f R , larva udang (PL 2 1, PL7 dan
Ivlysis) yang diambil dari PT Dewi Windu di Kab. Barm Sul-Sel, pakan udang (Merek Caroon Phophand), air laut, kaporit (Chlorine 60% WIW), Natrium tiosulfat, akuarium kaca, bak penampungan, baskom, refraktometer, blower sebagai sumber aerasi, seser, selang d m batu aerasi, pengatur aerasi dan lain-lain.
Bahan-bahan yang diperlukan dalam analisis sekuen DNA bakteri kandidat
Iiokontrol antara lain : Untuk ekstraksi DNA (SWC broth, buffer
TE,
lisozim, etano1 absolut, Proteinase-K, NaCl, CTAB, phenol, khloroform, isoamylalkohol, atanol 70%, isoprofanol, Buffer EB); untuk pengecekan DNA dengan cslektroforesis (Blue Juice, loading buffer, akuades, etidium bromide); UntukProsedur
Ke
q aPenelitian dilakukan dalam beberapa tahapan kegiatan seperti pada skema
di bawah ini:
Isolasi bakteri dari laut
T
Uji daya harnbat bakteri kandidat biokontrol terhadap K harveyi (MR533 9 ~ifR)
Karakterisasi secara fisiologi dan biokimia bakteri kandidat biokontrol
Uji tantang isolat MR5339
if
dengan bakteri kandidat biokontr1 '
secara molekuler untuk penentuan spesies
Isolasi Bakteri dari Laut Sebagai Kandidat Biokontrol
Bakteri kandidat biokontrol diisolasi dari karang, air laut dan sedimen di beberapa lokasi di Sulawesi Selatan yaitu ; Makassar, Pulau Lae-Lae, Pulau
Kayangan, Pulau Barang Lompo, Pulau Barang Caddi, Pulau Balm Lompo, Pulau B a l m Caddi, Siddo, Bojo, Pare-Pare, Polmas, Wajo dan Bone. Karang, air laut, dan sedimen diambil dalam keadaan segar dan dibawa ke Laboratoriurn Balai Penelitian Perikanan Pantai Maros. Sarnpel karang dan sedimen dikemas dalam kantong plastik steril, sedangkan sampel air diambil menggunakan botol sampel steril (Gambar 2.) dan dirnasukkan dalam cool box yang berisi batu es.
Sebelum digerus dengan lempeng penggerus, yang telah disterilkan, terlebih dahulu karang dan sedimen ditimbang sebanyak 1 g dan dicuci dengan ar laut steril sebanyak 2-3 kali untuk mencegah adanya bakteri kontarninan. Untuk memperoleh koloni tunggal, maka karang dan sedimen yang telah digerus disuspensikan dalam larutan garam fisiologis (0.85% NaCl) dan dilakukan pengenceran berseri (10-'-los3 ), sedangkan untuk contoh air laut diencerkan
sampai 1u2. Selanjutnya dari setiap pengenceran diambil 100 p1 dan disebar
pada media SWC 100% ( air laut 750 ml, akuades 250 ml, bakto pepton 5 g, ekstrak kharnir 1 g, gliserol 3 rnl, dan bakto agar 15 g.), dan SWC 10%.
Pertumbuhan pada media 10% dimaksudkan untuk memberi kesempatan bakteri- bakteri yang pertumbuhannya lambat untuk tumbuh. Jika hanya menggunkanan SWC 100% maka hanya bakteri-bakteri yang pertumbuhannya cepat yang dapat
kesempatan bagi bakteri-bakteri yang lambat pertumbuhannya untuk tumbuh
dengan baik. Setelah disebar pada kedua media tersebut selanjutnya diinkubasi pada suhu mang (28-32 O C ) selarna 24 jam. Koloni-koloni yang tumbuh
diidentifikasi secara morfologis berdasarkan bentuk, warna, tepian, elevasi dan ukuran koloni (Austine 1993, Austine dan Austine 1993, dan Hadioetomo 1993).
Kemudian dikultur pada media agar miring SWC 100% dan SWC 10% yang dimiringkan.
Isolat-isolat tersebut, selanjutnya digunakan untuk esei penghambatan pertumbuhan MR5339
RifR
secara in vitro dalarn cawan petri. Isolat yang pos~tif menghambat perturnbuhan MR5339 Rip, diperbaharui secara berkala untuk selanjutnya diuji tantang dengan MR5339Rip
baik secara m vitro dalarn labu erlermeyer maupun secara m viw dalam wadah pemeliharaan larva udang.Uji Daya Hambat Bakteri Kandidat Biokontrol Terhadap MR5339 ~ i f H a. Secara Kualitatif
Semua bakteri yang telah diisolasi dari laut diuji daya hambatnya terhadap MR5339
Rip.
Bakteri ini ditumbuhkan pada TCBSA selama 24 jam (Garnbar 3).Koloni tunggal yang tumbuh diambil dengan jarum Ose dan disuspensikan dalam larutan garam fisiologis. Kemudian disebar pada media SWC 100% dan SWC
10% dalam cawan petri dan didiarnkan selama beberapa menit hingga kering, selanjutnya di atas permukaan agar tersebut diinokulasi dengan bakteri kandidat biokontrol secara goresan. Biakan bakteri tersebut diinkubasi pada suhu ruang selama 24 jam. Isolat yang maghambat pertumbuhan MI15339 ~ifH yang ditandai dengan adanya zona bening disekitamya, disimpan untuk selanjutnya diuji lanjut untuk menentukan daya hambat isolat tersebut secara semi kuantitatif menggunakan paper disk
b. Secara Semi Kuantitatif
Di atas permukaan media agar (SWC 100% dan SWC 10%) yang telah
disebari dengan MR5339 ~ifR ditaruh paper disk steril yang berdiameter 7 mm. Koloni tunggal dari bakteri kandidat biokontrol (biakan 24 jam) disuspensikan
dalam larutan garam fisiologis SO pl dalam tabung EppendorS, kemudian sebanyak 10-20 jd (konsentrasi biakan dalam suspensi sekitar 1 08-1 '0 sel/ml)
diteteskan pada paper disk tersebut. Selanjutnya diinkubasi pada suhu 28 "C selama 24 jam. Setelah itu diukur zona bening yang terbentuk menggunakan mistar penggaris pada 3 posisi dari setiap paper disk, kemudian dirata-ratakan.
Karakterisasi Bakteri Kandidat Biokontrol
a. Sifat Fisiologi dan Biokimia
Uji fisiologi dan biokirnia yang dilakukan adalah pewarnaan gram, oksidase, katalase, indol, motilitas, aktifitas amilolitik dan pertumbuhan pada
suhu 40°C (Austine 1993; Austine dan Austine 1993; dan Hadioetomo 1993;
b. Resistensi Terhadap Beberapa Antibiotik dan Pembuatan Mutan Spontan Media yang dipakai untuk mempelajari resistensi antibiotik adalah SWC
100% yang dimodifikasi dengan penambahan antibiotik gentamisin, kloramfenikol, eritromisin, furazolidon, dan rifampisin dengan konsentrasi niasing-rnasing 25 pg/ml. Isolat-isolat bakteri laut yang potensial menghambat
M U 3 3 9 R@ digoreskan pada masing-masing media tersebut, lalu diinkubasi pada suhu ruang selama 20
-
24jam.
Respon resistensi dari isolat dapat diketahui dengan mengamati pertumbuhan koloni di atas media tersebut.Pembuatan mutan resisten rifampisin
( ~ i p )
dilakukan terhadap isolat BL542, BL546, dan BL548 menggunakan media SWC 100% cair yangdisuplementasi dengan rifarnpisin 50 pg/ml. Kultur sel yang berumur 24 jam
sebanyak 500 pl disentrifus dengan kecepatan 300 rpm. Pellet yang terbentuk diresuspensi kembali dalam 100 pl garam fisiologis dan selanjutnya disebar pada media SWC
loo%,
lalu diinkubasi pada suhu ruang (28-32 "C) selama 24 jam. Koloni yang tumbuh selanjutnya di goreskan kembali pada media yang sama untuk selanjutnya digunakan dalam uji patogenisitas dan uji tantang.lJji Patogenisitas Bakteri Kandidat Biokontrol Terhadap Larva Udang Whdu
a, Persiapan Air Laut dan Peralatan Yang Digunakan
Semua peralatan dan air laut yang digunakan untuk uji patogenisitas blakteri kandidat biokontrol didisinfeksi dengan merendam dalam larutan kaporit
150 ppm kurang lebih 3 hari, kemudian dinetralisir dengan penambahan Natrium
telah disterilkan dengan kaporit dan dinetralisir dengan Natrium Thiosulfctt
dengan konsentrasi yang sama yaitu 150 ppm dan 75 ppm..
b. Pengadaan Larva Udang Windu I? monodon
Larva udang yang digunakan didatangkan dari panti perbenihan yang ada di kabupaten Barru, Sulawesi Selatan. Sebelum digunakan larva udang terlebih dahulu diadaptasikan selama 3-4 hari untuk menyesuaikan kadar garam media pemelihraan dengan kadar gararn asal larva udang.
c. Persiapan Isolat dan Inokulasi Ke Dalam Wadah Pemeliharaan Larva Udang Windu
Beberapa bakteri laut yang potensial menghmbat MR5339 ~ i f R
selanjutnya diuji patogenisitasnya terhadap larva udang windu. Satu lup dari
rnlasing-masing isolat di tumbuhkan dalarn media SWC kaldu secara terpisah. Kultur ditempatkan pada inkubator bergoyang selama 24 jam pada suhu 28 O C .
Selanjutnya dismtrifugasi dengan kecepatan 3000 rpm pada suhu ruang. Pellet yang terbentuk kemudian diresuspensikan kembali dalarn larutan gararn fisiologis, sc2lanjutnya diuji patogenisitasnya terhadap larva udang windu pada konsentrasi
10' seVml (Hala 1999) secara perendaman (Hameed 1995). Wadah yang
digunakan untuk uji patogenisitas adalah akuarium kaca berkapasitas 3 1 yang tclah disterilkan dengan kaporit 150 ppm dan dinetralisir dengan Nntriurn
I%iosulfat 75 ppm Setiap wadah diisi air laut steril dengan kadar garam 28 ppt sebanyak 2 1 dan ditebari dengan larva udang sebanyak 20 ekorlwadah. Untuk nnenjaga ketecsediaan oksigen, wadah pemeliharaan larva dilengkapi dengan
sebanyak dua kali per
hari
sebanyak 10% bobot tubuh. Patogenisitas bakter~ kandidat biokontrol diamati melalui kematian larva udang setelah 24 jamperendaman (Rengpipat et al. 1998) dan dibandingkan dengan kontrol (tanpa infeksi bakteri kandidat biokontrol). Penelitian dilakukan menggunakan
rancangan acak lengkap dengan tiga kali ulangan (Steel and Torrie 198 1). IJji Tantang Bakteri
K
h a n d Dengan Bakteri Kandidat BiokontrolTiga diantara beberapa isolat yang merniliki daya hambat terhadap
W 3 3 9
F@
yaitu BL542, BL546, dan BL548 digunakan sebagai bakteri biokontrol terhadap pertumbuhan MR5339 I?@, baik secara in vltro dalam gelas erlenmeyer, maupun secara in vivo dalam wadah pemeliharaan larva udanga. Uji Tantang Secara I n vitro
Uji tantang secara in vitro dilakukan dengan menggunakan media SWC kaldu dalam labu erlenmeyer. Kepadatan bakteri MR5339 dibuat menjadi 10' seVml (Rengpipat 1998) dan kepadatan bakteri penantang 1
o8
sel/ml (Hala 1999). Populasi MR5339Rip
dalam wadah diamati pada hari ke 1 , 2 , 3 , dan 4setelah inokulasi. Penelitian dilakukan menggunakan rancangan acak lengkap dengan tiga kali ulangan (Steel and Torrie 1981).
b. Uji Tantang Secara In vivo
Uji tantang MR5339 ~ i f R dengan bakteri biokontrol secara in vivo
dilakukan di Laboratorium Basah Balai Penelitian Perikanan Pantai, Maros. Penelitian dilakukan menggunakan rancangan acak lengkap dengan tiga kali
Wadah yang digunakan untuk uji tantang secara in vivo adalah akuarium kaca berkapasitas 3 1 (Garnbar 4.) yang telah didesinfeksi dengan kaporit 150 ppm dan dinetralisir dengan Natrium Thiosulfat 75 ppm. Setiap wadah diisi air laut
siteril dengan kadar gararn 28 ppt sebanyak 2 1. Suspensi bakteri penantang dirnasukkan ke dalam wadah pemeliharaan larva udang 2 jam sebeium larva udang dimasukkan. Setelah kokultivasi dengan larva udang (PL 7 untuk tahap I dan Mysis untuk tahap 11) sebanyak 20 ekorlwadah selama 6 jam, MR5339 ~ i f K
sebagai patogen selanjutnya dimasukkan ke dalam wadah pemeliharaan larva udang (Hala 1999).
Garnbar 4. Tata letak wadah pemeliharaan Larva udang windu pada uji tantang
dengan BL546, MR5339
RP
ditantang dengan BL548, monokultur MR5339 ~ i f R (sebagai kontrol positif), dan kultur larva udang tanpa penggunaan bakteri (sebagai kontrol netgatif). Pangamatan larva udang yang mati dilakukan setiap 3jam, sedangkan pengamatan populasi bakteri dalam media pemeliharaan tiilakukan setiap 12 jam (Hala 1999) dan nilai yang diperoleh merupakan rata-rata tiari dua kali sampling. Untuk melihat efektifitas bakteri penantang dalam
xnenurunkan kepadatan populasi MR5339 R i p dalam wadah pemeliharaan dan xnangurangi MRS339 pada larva udang windu, maka data dibandingkan dengan kontrol (udang dihfeksi dengan bakteri MR5339 RifR tanpa diberi bakteri
penantang). Data populasi MR5339 R i p dalam wadah pemeliharaan dan yang mnengkolonisasi larva udang, serta kelangsungan hidup larva udang dianalisis ragam dan dilanjutkan dengan uji beda nyata terkecil (Steel and Torrie 198 1).
ldentifikasi Bakteri Kandidat Biokontrol
Untuk menentukan identitas isolat berdasarkan sekuen 16s-rRNA dari bakteri yang potensial mengharnbat MR5339 ~ i f R , dilakukan analisis yang rneliputi beberapa tahapan sesuai dengan metode yang dikemukakan oleh Marchesi et al. (1998) dan telah dimodifikasi oleh Suwanto et al. (2000) yaitu rneliputi ekstraksi DNA, amplifikasi gen 16s-rRNA dengan PCR, gene clean dengan metode glass milk, Cycle sequensing dengan metode BigDye, presipitasi
DNA, dan sekuensing dengan mesin Sequenser.
at. Ekstraksi DNA
jam. Sel bakteri dipanen dengan mengambil 1 rnl suspensi biakan bakteri, lalu dirnasukkan ke dalam Eppendorf volume 1,5 ml. Selanjutnya disentrifugasi
dengan kecepatan 6000 rpm selama 5 menit dan supematannya dibuang. Hal ini dilakukan dua kali. Pellet bakteri yang terbentuk kemudian diresuspensi dengan
250 pi buffer lxTE dan 2 mg/l lisozim, diikubasi 37 OC selama 30 menit.
Selanjutnya ditambahkan SDS 10% sebanyak 50 pl dan 5 pl Proteinase-K, dibolak-balik sampai bening berlendir. Carnpuran ini diinkubasi pada suhu 37 OC
selama satu jam (tiap 15 menit dikocok). Setelah itu ditambahkan 65 pl NaCl 5
hf, di bolak-balik sehingga tercampur dengan baik, kemudian ditambahkan 80 pl C'TAB 10%. Divortex sampai b e m a putih susu, kemudian diinkubasi pada siuhu 65 "C selama 20 menit. Selanjutnya ke dalam campuran tersebut di
tambahkan 650 pl
phenol:chloroform:isoamyl
alkohol(25:24: l), divortex selama30 detik, kemudian disentrifugasi pada kecepatan 5.000 rpm pada suhu ruang selama 10 menit. Setelah itu supematan diambil dengan rnikro pipet dan
dipindahkan ke dalarn Eppendorf yang steril yang sebelurnnya telah diisi dengan
600 pi isopropanol dan dibolak balik sehingga timbul benang-benang DNA
Dibiarkan pada suhu ruang selama 30 menit. Selanjutnya disentrifugasi dengan kecepatan 5.000 rpm pada suhu ruang dan setelah itu supematan dibuang. DNA
dalam bentuk pellet dicuci dengan 300 pl ethanol 70%, disentrifugasi selama 5
akubides bebas nuklease atau buffer lxTE atau Elution Buffer (EB) dan selanjutnya DNA disimpan pada suhu -20 "C untuk keperluan selanjutnya
b. Amplifikasi Gen 16SrRNA dengan PCB
Sebelum dilakukan amplifikasi gen 16s-rRNA dengan PCR, terlebih da