STERILISASI BEGONIA POLKADOT (
Begonia maculata
)
PADA KULTUR IN VITRO
BRAYUDANTO HARDIYADI
DEPARTEMEN KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sterilisasi Begonia Polkadot (Begonia maculata) pada Kultur in Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Brayudanto Hardiyadi
ABSTRAK
BRAYUDANTO HARDIYADI. Sterilisasi Begonia Polkadot (Begonia maculata) pada Kultur In Vitro. Dibimbing oleh EDHI SANDRA dan AGUS HIKMAT
Penelitian mengenai kultur jaringan begonia (Begonia sp.) masih sedikit, namun sterilisasi pada tanaman ini cukup sulit sehingga perlu adanya penelitian mengenai kultur jaringan pada begonia (Begonia sp.). Penelitian ini bertujuan untuk mengidentifikasi teknik sterilisasi yang tepat untuk begonia polkadot (Begonia maculata) pada kultur in vitro. Penelitian ini dilakukan di Laboratorium Kultur Jaringan Esha Flora Bogor dari bulan September sampai Desember 2013. Penelitian dilakukan secara bertahap, pertama dengan penelitian pendahuluan kemudian dilanjutkan dengan penelitian lanjutan. Pada penelitian pendahuluan hanya terdapat dua variabel yaitu penggunaan antibiotik dan HgCl2. Penggunaan
HgCl2 pada konsentrasi 15 % merupakan konsentrasi yang baik untuk begonia
polkadot, karena persentase eksplan kontam lebih sedikit dan persentase yang hidup lebih banyak. Penggunaan eksplan tulang daun memiliki persentase kontaminasi dan browning yang lebih kecil daripada eksplan mata tunas.
Kata kunci: begonia, kultur in vitro, sterilisasi
ABSTRACT
BRAYUDANTO HARDIYADI. Sterilization of Begonia Polkadot (Begonia maculata) in Tissue Culture. Supervised by EDHI SANDRA dan AGUS HIKMAT
Research on Begonia’s tissue culture (Begonia sp.) is still limited. Altough the sterilization in this plants is moderately hard, still we need the research on begonia’s tissue culture (Begonia sp.). This study aims to identify the technique of sterilizing which is proper for begonia polkadot (Begonia maculata) on the culture in vitro. The study is done in Laboratories Tissue Culture Esha Flora Bogor on September until December 2013. Gradually, this research is done first with preliminary research and continued with advanced research. To research prefatory there are only two variables that is using antibiotic and HgCl2. Utilized of HgCl2
at concentrations 15 % is a suitable concentration for begonia polkadot, because the percentage of eksplan contamination fewer and a high percentage of living more. Utilized the bones eksplan of a leaf having the percentage of contamination and browning smaller than buds.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Konservasi Sumberdaya Hutan dan Ekowisata
STERILISASI BEGONIA POLKADOT (
Begonia maculata
)
PADA KULTUR IN VITRO
BRAYUDANTO HARDIYADI
DEPARTEMEN KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Sterilisasi Begonia Polkadot (Begonia maculata) pada Kultur in Vitro
Nama : Brayudanto Hardiyadi NIM : E34080060
Disetujui oleh
Ir Edhi Sandra, MSi Pembimbing I
Dr Ir Agus Hikmat, MScF Pembimbing II
Diketahui oleh
Prof Dr Ir Sambas Basuni, MS. Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2013 ini ialah kultur jaringan, dengan judul Sterilisasi begonia polkadot (Begonia maculata) pada Kultur In Vitro.
Terima kasih penulis ucapkan kepada Bapak Ir Edhi Sandra, MSi dan Bapak Dr Ir Agus Hikmat, MScF selaku pembimbing, serta Ibu Edhi dan Staf Esha Flora yang telah memberi saran dan bantuannya selama penulis melaksanakan penelitian. Di samping itu, penghargaan penulis sampaikan kepada staf Esha Flora bersama-sama berjuang di Esha Flora melaksanakan penelitian. Tak lupa pula Keluarga Besar KSHE 45 yang telah memberi dorongan kepada penulis untuk menyelesaikan penelitian ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR ISI
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
HASIL DAN PEMBAHASAN 5
Penelitian Pendahuluan 5
Pengaruh Pemberian HgCl2 7
Pengaruh Jenis Media 10
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 14
DAFTAR PUSTAKA 14
DAFTAR TABEL
1. Persentase browning dan kontaminasi selama 8 minggu 6 2. Persentase kelangsungan hidup eksplan dan penyebab kematiannya 7 3. Persentase jenis media terhadap kontaminasi dan browning 9 4. Persentase kelangsungan hidup eksplan dan penyebab kematiannya 10
DAFTAR GAMBAR
1. Kontaminasi eksplan oleh mikroba pada minggu ketiga 6 2. Grafik kecepatan kontaminasi cendawan selama seminggu pengamatan 7
3. Kontaminasi eksplan oleh cendawan 8
4. Kontaminasi eksplan oleh bakteri 8
5. Eksplan yang mengalami browning 11
PENDAHULUAN
Latar Belakang
Keanekaragaman spesies begonia (Begonia sp.) dari famili Begoniaceae yang masih tersimpan di lantai hutan Indonesia masih sangat banyak. Keanekaragaman spesies begonia di Indonesia diperkirakan mencapai lebih dari 200 spesies, dan tersebar di Pulau Jawa, Kalimantan, Sumatera, Sulawesi, dan Irian. Spesies begonia di dunia diperkirakan lebih dari 1400 spesies. Di Indonesia Begonia masih belum mendapatkan penanganan serius, bahkan cenderung terabaikan (Hartutiningsih dan Siregar 2005).
Ancaman terbesar dari kelestarian begonia lokal adalah kerusakan habitat. Banyaknya kerusakan hutan dan alih fungsi hutan sebagai pemukiman atau lahan pertanian menyebabkan ruang hidup begonia semakin sempit. Begonia umumnya rentan terhadap cahaya dan panas, biasanya tumbuh di bawah pohon yang memiliki tajuk lebat, sehingga jika pohon itu tumbang akan mengganggu pertumbuhan begonia di bawahnya (Kiew 2005).
Begonia dapat tumbuh cukup sukses pada berbagai jenis media tanam (Catterall 1991). Perbanyakan begonia dapat dilakukan dengan empat cara yaitu stek pucuk, daun, umbi, dan biji. Perbanyakan begonia dilihat dari bentuk morfologinya, sebagai contoh pada begonia polkadot (Begonia maculata Raddi.) yang termasuk dalam golongan cane like begonias dapat dilakukan perbanyakan dengan stek pucuk, batang, daun, dan biji (Hartutiningsih dan Siregar 2005).
Begonia memiliki potensi yang sangat besar untuk dikembangkan. Warna yang menarik, bentuk yang unik, serta keanekaragaman yang melimpah membuat pasar begonia terus hidup. Potensi ekonomi inilah yang menjadikan begonia sebagai salah satu andalan ekonomi masyarakat. Selain itu beberapa spesies begonia ada yang dapat dimakan dan memiliki kasiat obat.
Saat ini masih jarang ditemukan perbanyakan begonia menggunakan teknik kultur jaringan, penyebabnya ialah masyarakat umum masih menganggap tanaman ini masih mudah dikembangkan dengan metode konvensional. Sehingga pengembangan metode kultur jaringan pada begonia masih sedikit. Keuntungan menggunakan teknik kultur jaringan ialah dapat menghasilkan jumlah banyak, relatif singkat dan tidak memerlukan ruangan yang besar.
Problem terbesar yang sering menjadi kendala dalam teknik kultur in vitro
2
Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengidentifikasi teknik sterilisasi yang tepat untuk begonia polkadot (Begonia maculata Raddi.)
2. Mengidentifikasi seberapa besar pengaruh pemberian HgCl2 pada eksplan
terhadap kontaminasi mikroba dan browning
3. Mengidentifikasi seberapa besar pengaruh pemberian antibiotik pada media tanam terhadap kontaminasi mikroba
4. Mengidentifikasi seberapa besar pengaruh pemberian arang aktif dan vitamin C pada media terhadap browning
5. Mengidentifikasi seberapa besar pengaruh penggunaan eksplan terhadap kontaminasi mikroba dan browning
Manfaat Penelitian
Hasil penelitian diharapkan dapat memberikan informasi pada proses sterilisasi pada begonia. Informasi ini di harapkan dapat dijadikan sebagai acuan untuk proses sterilisasi begonia, agar perbanyakan begonia dapat maksimal.
METODE
Lokasi dan Waktu
Penelitian dilakukan di Laboratorium Kultur Jaringan Esha Flora Bogor, selama empat bulan dari bulan September 2013 sampai Desember 2013.
Bahan dan Alat
Bahan
a. Bahan Media
Media yang digunakan dalam penelitian ini terdiri dari tiga media, yaitu : media MS (Murashige dan Skoog) tanpa tambahan konsentrasi lainnya atau biasa disebut dengan MS 0, MS 0 dengan tambahan antibiotik (streptomisin) 0,5 ml/liter, dan MS 0 dengan tambahan vitamin C 250 mg/liter dan arang aktif 5 g/liter. Media ini dibuat dalam bentuk padat dengan tambahan agar-agar dan gula pasir.
b. Bahan Eksplan
Bahan eksplan yang digunakan adalah tumbuhan begonia polkadot (Begonia maculata) bagian yang diambil ialah mata tunas dan tulang daun dari tumbuhan tersebut.
c. Bahan Sterilisasi
Bahan sterilisasi yang digunakan adalah alkohol 70%, HgCl2 5%, 10%,
3
Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi botol kultur,
aluminium foil, cawan petri, pembakar spiritus, scalpel, pinset, gelas piala, pipet tetes, Ph meter, autoklaf, neraca analitik, laminar air flow, plastik, sprayer, karet, dan ruang kultur.
Jenis Data
Data yang diamati dalam penelitian meliputi kecepatan kontaminasi terhadap eksplan, jumlah eksplan yang hidup, jumlah kontaminan, jumlah sumber kontaminan, dan jumlah eksplan browning.
Pelaksanaan Penelitian
Sterilisasi
a. Sterilisasi Lingkungan Kerja
Sebelum digunakan, laminar air flow harus disterilkan dengan menggunakan sprayer berisi alkohol 70%. Setelah laminar air flow disemprot, kemudian dibiarkan sekita 10 menit.
b. Sterilisasi Alat dan Media Kultur
Alat-alat yang digunakan untuk kultur jaringan, dicuci bersih kemudian di bungkus dengan koran, kemudian dimasukan ke dalam autoklaf dengan suhu 121oC dengan tekanan 17,5-20,0 psi selama 45-60 menit. Botol yang telah diisi media juga disterilkan dengan suhu dan tekanan yang sama, tetapi dengan waktu yang lebih singkat sekitar 20-30 menit.
c. Sterilisasi Air
Air yang digunakan berasal dari ledeng, kemudian diendapkan terlebih dahulu. Endapan dari air ini tidak dimasukan ke dalam botol. Air dimasukan kedalam botol kultur kosong. Setelah itu disterilkan menggunakan autoklaf dengan suhu 121oC dengan tekanan 17,5-20,0 psi selama 30-40 menit.
d. Sterilisasi Eksplan
Pada penelitian pendahuluan strerilisasi eksplan hanya menggunakan tunas batang. Eksplan yang telah di cuci air bersih dipotong sekitar 2 cm kemudian di masukan ke dalam detergen dengan konsentrasi 1 gr/100 mlair selama 10 menit. Eksplan kemudian dibilas hingga bersih kemudian dimasukan kedalam larutan fungisida dengan konsentrasi 1 gr/100 ml air dan dikocok selama 15 menit. Kemudian eksplan dibagi menjadi dua perlakuan, satu perlakuan tanpa perendaman antibiotik dan satu lagi menggunakan perendaman antibiotik selama 24 jam. Perendaman antibiotik dilakukan di luar laminar dengan memasukan eksplan dalam botol tertutup yang telah diberi antibiotik (streptomisin) 0,5 ml/liter.
Sterilisasi selanjutnya dilakukan dalam laminar air flow dengan menggunakan 4 variabel berbeda, pertama tanpa penggunaan HgCl2 selanjutnya
menggunakan HgCl2 dengan konsentrasi 5%, 10%, dan 15%. Kemudian dibilas
4
Pada penelitian lanjutan, sterilisasi pada eksplan dilakukan dengan mencuci eksplan yang telah di potong menggunakan detergen dengan konsentrasi 1 gr/100 ml selama 10 menit. Kemudian dibilas hingga bersih. Eksplan kemudian dimasukan kedalam larutan fungisida dengan konsentrasi 1 gr/100 ml dan dikocok selama 15 menit, bilas dengan air bersih selama 1 menit. Kemudian eksplan direndam dengan antibiotik selama satu jam.
Sterilisasi selanjutnya dilakukan dalam laminar air flow dengan menggunakan HgCl2 dengan 4 variabel berbeda, yang pertama tanpa
menggunakan HgCl2 selanjutnya menggunakan HgCl2 dengan konsentrasi 10%,
15%, dan 20%. Kemudian dibilas dengan air steril selama 3 menit. Eksplan kemudian dimasukkan kedalam larutan bayclin 10% selama 7 menit, setelah itu kedalam larutan bayclin 7%, setelah itu kedalam larutan bayclin 5%, terakhir dibilas dengan air steril selama 3 menit dibilas hingga 3 kali.
Pembuatan Media
Media yang digunakan ialah media MS 0 (Murashige dan Skoog), MS 0 ditambah antubiotik 0,5 ml/liter dan MS 0 ditambah arang aktif dan vitamin C. Langkah awal pembuatan media MS 0 dengan membuat larutan induk (stok) yang terdiri dari larutan induk makro, larutan induk mikro, lautan vitamin, dan larutan induk Fe-EDTA.
Tahapan pembuatannya ialah sebagai berikut :
1. Menyiapkan ai 500 ml dalam gelas piala volume 1000 ml
2. Menambahkan larutan stok ke dalam gelas piala. Terdiri dari larutan A sebanyak 20 ml, larutan B sebanyak 20 ml, larutan C sebanyak 5 ml, larutan D sebanyak 5 ml, larutan E sebanyak 5 ml, larutan F sebanyak 5 ml, vitamin sebanyak 5 ml, dan Myo-inositol sebanyak 10 ml.
3. Menimbang dan memasukkan 30 gram gula pasir.
4. Menambah larutan hingga mendekati 1000 ml. Kemudian di ukur ph hingga kisaran 5,8-6,0 bila terlalu asam dtambahkan NaOH dan bila terlalu basa ditambah HCl.
5. Menimbang dan memasukkan agar-agar sebanyak 7 gram, lalu dipanaskan sambil diaduk.
6. Menuangan media ke dalam botol sebanyak kurang lebih 10 ml, kemudian tutup dengan plastik.
7. Tahap terakhir ialah mensterilkan media dalam autoklaf dengan suhu 121o C, tekanan 17,5-20,0 psi selama 20 menit. Lalu media didinginkan dan disimpan minimal 3 hari untuk mengetahui ada tidaknya kontaminasi.
Sedangkan untuk MS 0 yang diberi tambahan antibiotik, pada saat pencampuran larutan di tambahkan antibiotik, untuk MS 0 dengan tambahan arang aktif dan vitamin C, cukup ditambahkan pada saat pencampuran media.
Penanaman
5
Pengamatan
Pengamatan pada eksplan dilakukan setiap hari pada minggu pertama setelah penanaman, kemudian satu kali pada minggu selanjutnya. Pengamatan dilakukan pada seluruh eksplan yang ditanam dalam satuan perlakuan meliputi : a. Kecepatan kontaminasi terhadap eksplan
b. Jumlah eksplan yang hidup dalam persentase
c. Jumlah kontaminan (cendawan dan bakteri) dalam persentase d. Jumlah sumber kontaminan (eksplan atau media) dalam persentase e. Jumlah eksplan browning dalam persentase
Analisis Data
Penelitian dilakukan secara bertahap dan bersifat ekplorasi. Oleh karena itu, analisa data dilakukan dalam dua cara yaitu kualitatif dan kuantitattif. Analisa data secara kualitatif yaitu dengan deskriptif. Sedangkan secara kuantitatif, data dianalisa dengan tabel dan grafik.
HASIL DAN PEMBAHASAN
Penelitian Pendahuluan
Begonia memiliki ciri-ciri berupa terna tegak, semak atau menjalar, batang berair, daun tersebar, gagang daun jelas, mempunyai daun pelindung yang mudah luruh dan helaian daun tidak simetris yang disebut begonifolia (Hartutiningsih dan Siregar 2008). Batang berair inilah yang menyebabkan sulitnya sterilisasi pada begonia polkadot ditambah lagi perbanyakan begonia lebih banyak dilakukan konvensional sehingga belum adanya standar khusus untuk menentukan proses sterilisasi begonia.
Menurut Hendaryono dan Wijayani (1994) sterilisasi eksplan dapat dilaksanakan dengan dua cara, yaitu secara mekanik dan secara kimia. Sterilisasi eksplan secara mekanik digunakan untuk eksplan yang keras atau berdaging yaitu dengan membakar eksplan tersebut di atas lampu spiritus sebanyak tiga kali. Sedangkan sterilisasi eksplan secara kimia digunakan untuk eksplan yang lunak (jaringan muda) seperti daun, tangkai daun, anther, dan sebagainya. Sedangkan Sedangkan menurut Sandra (2003), prinsip dasar sterilisasi eksplan adalah mensterilkan eksplan dari berbagai mikroorganisme, tetapi eksplannya tidak ikut mati. Setiap tanaman memerlukan perlakuan khusus sehingga sebelum mengkulturkan tanaman baru perlu melakukan percobaan sterilisasi. Gunawan (1987) menyatakan bahwa sulit untuk menentukan suatu prosedur sterilisasi standar yang berlaku untuk semua tanaman dan menentukan prosedur standar yang dapat dipergunakan untuk satu spesies tanaman yang berasal dari tempat yang berbeda. Setiap bahan tanaman harus ditentukan melalui percobaan pendahuluan.
Pada penelitian awal dilakukan empat variabel penggunaan HgCl2 dan dua
variabel penggunaan antibiotik. Variabel tersebut ialah tanpa menggunakan HgCl2,
6
dilakukan untuk mengukur tingkat kontaminasi eksplan dengan HgCl2 dan
antibiotik.
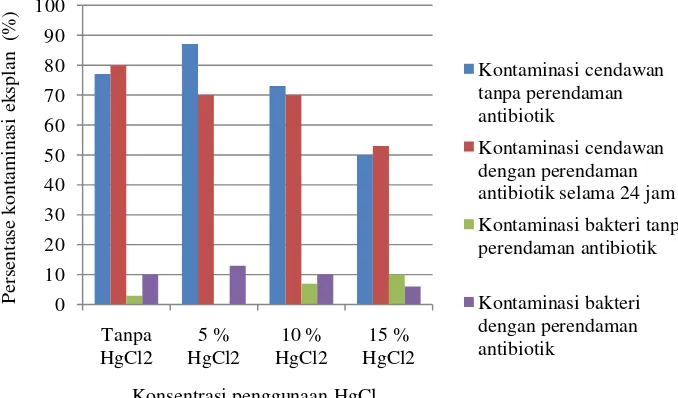
Setelah diamati selama tiga minggu diperoleh hasil yang disajikan pada Gambar 1. Gambar 1 menunjukan bahwa perendaman antibiotik pada eksplan hanya terdapat sedikit perbedaan persentase kontaminan jika dibandingkan dengan eksplan tanpa perendaman antibiotik.
Gambar 1 Kontaminasi eksplan oleh mikroba pada minggu ketiga (%) Gambar 1 menunjukan bahwa perendaman antibiotik pada eksplan hanya terdapat sedikit perbedaan persentase kontaminan jika dibandingkan dengan eksplan tanpa perendaman. Menurut Cantika (2006) antibiotik adalah antimikroba yang diaplikasikan pada jaringan hidup atau secara sistemik membunuh atau menghambat perumbuhan bakteri. Antibiotik pada kutur jaringan mempunyai sifat toksik sehingga pada penelitian lanjutan hanya menggunakan perendaman selama satu jam saja. Cukup tingginya tingkat kontaminasi oleh jamur diatas 45 % pada minggu ketiga, sehingga pada penelitan lanjutan di tambahkan konsentrasi HgCl2
agar persentasi jamur dapat menurun, HgCl2 merupakan bahan kimia bersifat
keras dan beracun (Hendaryono dan Wijayani 1994) tetapi semakin tinggi konsentrasinya semakin berkurang kontaminasi. Sehingga pada penelitian lanjutan meskipun konsentrasi HgCl2 di naikan tetapi penggunaan konsentrasi bayclin
diturunkan.
Pengaruh Pemberian HgCl2
Pada penelitian ini digunakan tiga variabel pemberian HgCl2 sebesar 10 %,
15 %, dan 20 %, serta satu variabel untuk control. Keempat perlakuan tersebut diujicobakan pada dua eksplan yang berbeda yaitu pada tulang daun dan mata tunas. Pengamatan dilakukan setiap hari pada minggu pertama, kemudian minggu berikutnya pengamatan setiap minggu sekali.
Eksplan yang digunakan pada penelitian lanjutan menggunakan eksplan tulang daun dan mata tunas. Menurut Hartutiningsih dan Siregar (2005) jenis cane
7
like begonia lebih cocok dengan perbanyakan stek pucuk, batang, daun dan biji. Dalam penelitian lanjutan ini ditambahkan eksplan tulang daun agar bisa membandingkan mana yang lebih mudah untuk dikembangkan. Menurut Gunawan (1987), ukuran eksplan turut mempengaruhi keberhasilan dari suatu teknik kultur jaringan. Oleh karena itu ukuran eksplan pada penelitian sama tetapi eksplan mata tunas tentu memiliki ketebalan lebih tinggi dibanding dengan eksplan tulang daun.
Pengaruh Pemberian HgCl2 terhadap Kontaminasi dan Browning
Berdasarkan hasil pengamatan, kemunculan kontaminan pertama kali terlihat pada hari kedua pada eksplan tulang daun tanpa pemberian HgCl2 sebesar
3 % untuk jenis kontaminan bakteri dan cendawan. Pada hari ketujuh eksplan sudah cukup banyak terkontaminasi sebesar 30-70 %. Perlakuan yang memiliki tingkat kontaminasi terbesar pada eksplan mata tunas tanpa pemberian HgCl2 dan
pada eksplan dan tulang daun dengan pemberian HgCl2 sebesasar 10 % (Gambar
2).
Menurut Darmono (2003) respon kontaminasi internal yang agak lama disebabkan oleh mikroorganisme yang terdapat dalam ruang antar sel memerlukan waktu untuk keluar dari dalam ruang antar sel. Setelah keluar, mikroorganisme akan menginfeksi semua bagian eksplan. Persentase kontaminan yang tinggi pada awal pengamatan menandakan bahan sterilan kurang kuat, sehingga cendawan masih hidup pada eksplan.
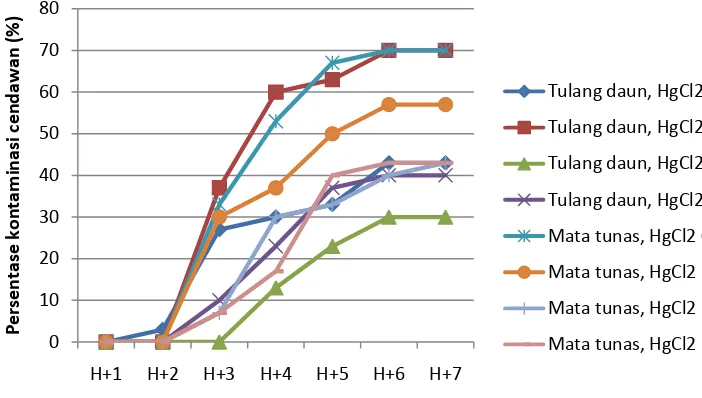
Gambar 2 Grafik kecepatan kontaminasi cendawan selama seminggu pengamatan Pada Gambar 2 terlihat bahwa pada hari ketujuh tidak menunjukan peningkatan yang berarti, sedangkan pada hari ketiga dan keempat kontaminasi menunjukan laju yang cukup tinggi. Menurut Santoso dan Nursandi (2002) bahwa kontaminasi secara bertahap tersebut membuktikan sumber kontaminan tidak hanya berada pada bagian permukaan eksplan saja tetapi juga berada pada bagian dalam eksplan. Biasanya sumber kontaminan yang hanya berada pada bagian
8
permukaan saja respon kontaminasi sangat cepat, dalam tempo 2 x 24 jam sudah bisa nampak. Tetapi bila bersifat internal respon muncul setelah beberapa hari bahkan kadang bisa sampai 1 bulan. Dari Gambar 2 terlihat bahwa penggunaan HgCl2 15 % dan 20 % memiliki kemampuan yang cukup baik dalam mencegah
kontaminasi yang berasal dari luar eksplan.
Biasanya sumber kontaminan yang hanya berada pada bagian permukaan saja respon kontaminasi sangat cepat, dalam tempo 2 x 24 jam sudah bisa nampak. Tetapi bila bersifat internal respon muncul setelah beberapa hari bahkan kadang bisa sampai 1 bulan. Kontaminan berupa cendawan yang muncul pada eksplan akan terlihat seperti Gambar 3, sedangkan kontaminan berupa bakteri akan terlihat seperti Gambar 4. Kontaminasi oleh bakteri pada minggu pertama cenderung lebih sedikit disbanding kontaminasi oleh cendawan.
Gambar 3 Kontaminasi eksplan oleh cendawan
Gambar 4 Kontaminasi eksplan oleh bakteri
Kontaminasi oleh cendawan yang terjadi pada minggu kedelapan untuk eksplan tulang daun paling sedikit pada penggunaan HgCl2 15 % sebesar 37 %
sedangkan untuk eksplan mata tunas paling sedikit pada penggunaan HgCl2 15%
dan 20 % sebesar 60 %. Kontaminasi oleh bakteri (Gambar 4) pada minggu kedelapan untuk eksplan tulang daun paling sedikit pada penggunaan HgCl2 15 %
dan 20 % sebesar 13 % sedangkan untuk eksplan mata tunas paling sedikit pada penggunaan HgCl2 20 % sebesar 27 %. Sumber kontaminan terbesar berasal dari
eksplan dari 37-93 % sedangkan sumber kontaminan dari media hanya sebesar 0-7 %. Eksplan tulang daun pada minggu ke delapan browning paling tinggi pada pemberian HgCl2 15 % dan HgCl2 20 % sebesar 23 %. Pada eksplan mata tunas
browning paling tinggi pada pemberian HgCl2 10 % dan 20 % sebesar 30 %.
Dari hasil pengamatan terlihat bahwa untuk mendapatkan hasil terbaik perlakuan yang dilakukan ialah dengan penggunaan HgCl2 sebesar 15 %, baik
9 sedikitnya cendawan, bakteri, maupun browning yang sedikit pada eksplan tulang daun. Pada eksplan mata tunas, meskipun kontaminasi oleh bakteri lebih banyak terjadi pada perlakuan menggunakan HgCl2 15 %, tetapi sumber kontaminasi yang
berasal dari eksplan dan eksplan browning lebih sedikit dibanding penggunaan HgCl2 20%.
Tabel 1 Persentase browning dan kontaminasi selama 8 minggu (%) Eksplan dan
Perlakuan Cendawan Bakteri Browning
Sumber
Pengaruh Pemberian HgCl2 terhadap Kelangsungan Hidup Eksplan
Penggunaan zat kimia pada sterilisasi eksplan merupakan salah satu cara untuk mencegah terjadinya kontaminasi, tetapi zat tersebut belum tentu aman untuk eksplan oleh sebab itu penggunaannya hendaknya dapat mendapatkan tingkat kontaminasi sekecil mungkin dengan mempertahankan kehidupan eksplan. Darmono (2003) menyebutkan bahwa penggunaan konsentrasi antibiotik yang tinggi dapat mengakibatkan efek fitotoksik pada tanaman. Pada prinsipnya penggunaan bahan sterilan diharapkan dapat mematikan sumber kontaminan tetapi tidak menyebabkan eksplan mati.
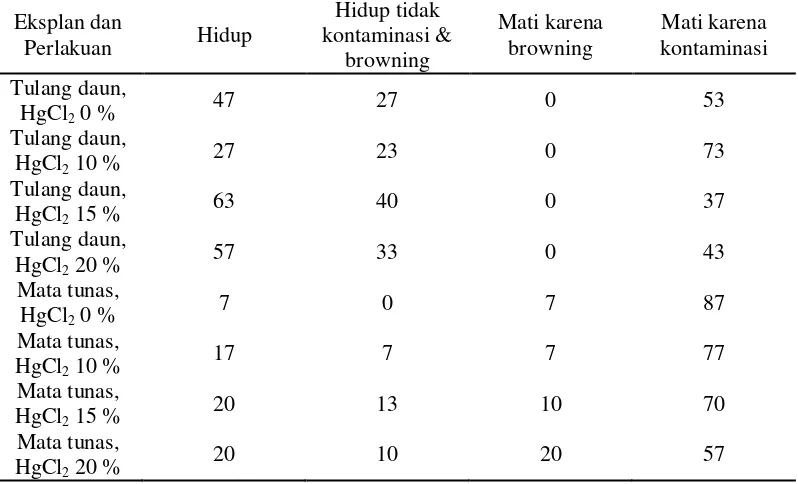
Dari hasil pengamatan selama delapan minggu, untuk eksplan tulang daun penggunaan HgCl2 15 % memiliki persentase hidup yang tinggi (Tabel 2), selain
itu bukan hanya hidup saja tetapi bebas dari kontaminasi dan browning. Untuk eksplan mata tunas, meskipun persentase kehidupan eksplan memiliki persentase yang sama, tetapi pada penggunaan HgCl2 15 % memiliki persentase hidup dan
terbebas dari kontaminasi serta browning yang lebih tinggi di banding penggunaan HgCl2 20 %. Menurut Hendaryono dan Wijayani (1994) HgCl2
merupakan bahan kimia yang bersifat keras dan beracun, sehingga penggunaannya tidak boleh terlalu banyak agar tidak mematikan bagi eksplan, apabila terlalu lama akan menyebabkan kerusakan pada eksplan.
Pertumbuhan mata tunas pada eksplan terjadi pada minggu keempat. Satu individu tumbuh daun pada penggunaan HgCl2 10 %, dua individu tumbuh daun
10
tumbuh akar pada penggunaan HgCl2 20%. Pada perlakuan dengan HgCl2 15 %
juga tumbuh kalus pada minggu kedelapan.
Tabel 2 Persentase kelangsungan hidup eksplan dan penyebab kematiannya Eksplan dan
Media pada kultur jaringan merupakan salah satu aspek yang mempengaruhi kontaminasi dan browning pada eksplan (Gambar 5). Selain itu komposisi media juga dapat menentukan keberlangsungan hidup eksplan. Pada penelitian kali ini digunakan media MS0, MS0 ditambahkan arang aktif serta vitamin C, dan yang ketiga media MS0 dengan tambahan antibiotik 0,5 ml. Pada setiap perlakuan dilakukan pengulangan sebanyak 40 kali.
Gambar 5 Eksplan yang mengalami browning
Pengaruh Jenis media terhadap Kontaminasi dan Browning
11 jumlah kontaminasi. Browning (gambar 6) terjadi umumnya pada tanaman yang sudah tua, karena pada tanaman yang sudah tua dapat mengeluarkan larutan fenol yang akan bereaksi dengan oksigen sehingga membentuk larutan berwarna coklat yang disebut quinon (Sandra 2003).
Penanggulangan perubahan ini dalam praktek seringkali dilakukan melalui perlakuan terhadap eksplan, antara lain dengan cara merendam dan pra-kondisi pada media dasar. Penambahan arang aktif ke dalam media seringkali dapat menghindari pembentukan inhibitor fenolat (Hutami 2006).
Berdasarkan hasil pengamatan selama seminggu terhadap kontaminasi oleh cendawan, terlihat pemberian antibiotik mengurangi laju pertumbuhan cendawan. Meskipun untuk eksplan mata tunas pada hari ketujuh persentase cendawan untuk media MS0 dan MS0 ditambah antibiotik memiliki persentase yang sama tetapi pada pemberian antibiotik untuk eksplan tulang daun memiliki persentase yang lebih kecil terkena kontaminasi cendawan.
Gambar 6 Grafik kecepatan kontaminasi cendawan selama seminggu pengamatan Sedangkan untuk media yang diberi tambahan arang aktif dan vitamin C memiliki kontaminasi terhadap cendawan yang cukup tinggi. Hasil pengamatan selama delapan minggu didapatkan hasil bahwa tingkat kontaminasi untuk eksplan tulang daun paling kecil persentasenya terdapat pada media dengan tambahan antibiotik. Pemberian antibiotik sebesar 0,5 ml/liter sudah cukup tepat terlihat dari persentase browning yang sama pada media MS0 saja. Dari hasil pengamatan juga diperoleh hasil bahwa seluruh sumber kontaminasi pada media MS0 dengan tambahan antibiotik sumber kontaminasinya berasal dari eksplan sebagaimana tersaji pada Tabel 3.
Berdasarkan Tabel 3, menunjukan hasil untuk eksplan mata tunas diperoleh hasil tidak jauh berbeda dengan eksplan tulang daun. Meskipun persentase kontaminasi cendawan lebih besar, tetapi jika memiliki persentase kontam akibat bakteri yang kecil, jika dilihat dari sumber kontaminasinya terlihat bahwa untuk MS0 yang diberi tambahan antibiotik ataupun tidak memiliki persentase yang
12
sama pada sumber kontaminasi dari eksplan, tetapi pada pemberian antibiotik tidak ditemukan kontaminasi yang berasal dari media. Penggunaan arang aktif dan vitamin C mengurangi browning pada eksplan, berkurangnya browning
kemungkinan karena hilanganya senyawa fenol oleh arang aktif. Pendekatan yang sering dilakukan untuk menanggulangi masalah browning dapat dilakukan dengan menghilangkan fenol, memodifikasi potensi redoks, penghambatan aktivasi enzim fenol oksidase dan penurunan aktivitas fenolase dan ketersediaan substrat (George dan Serrington 1984).
Tabel 3 Persentase jenis media terhadap kontaminasi dan browning
Eksplan dan Media cendawan bakteri browning
Sumber
Pengaruh Jenis Media terhadap Kelangsungan Hidup Eksplan
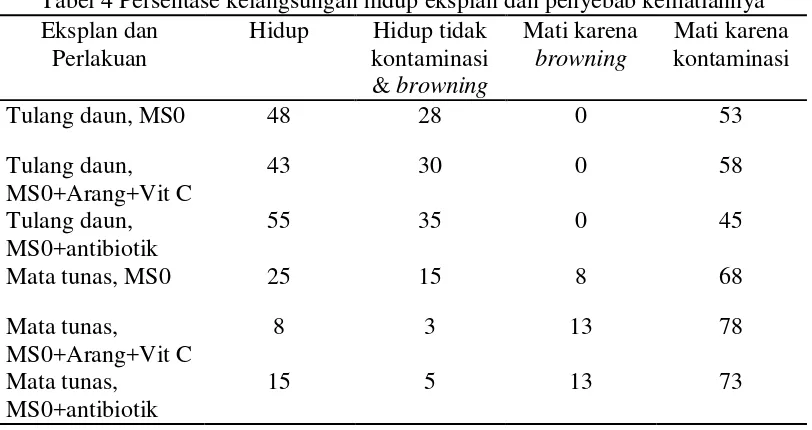
Antibiotik dapat menghambat pertumbuhan cendawan dan bakteri, tetapi disisi lain dapat mengakibatkan eksplan rusak oleh karena itu penggunaannya tidak bisa terlalu banyak. Pada eksplan tulang daun tidak ditemukan eksplan mati karena browning. Dari hasil pengamatan juga terlihat jumlah persentase eksplan yang hidup tidak terkontaminasi dan tidak browning pada media dengan tambahan antibiotik memiliki persentase terbesar sebagaimana tersaji pada Tabel 4.
13
Pada eksplan mata tunas meskipun jumlah yang mati karena kontam lebih tinggi tetapi persentase untuk eksplan yang hidup tidak kontam dan tidak
browning lebih tinggi pada media dengan tambahan antibiotik. Penggunaan arang aktif dan vitamin C pada media tidak menambah persentase hidup eksplan. Prinsip dasar kultur jaringan adalah totipotensi cell yaitu di dalam tubuh multiseluler, setiap sel memiliki potensi genetic seperti zigotnya yang mampu memperbanyak diri dan berdiferensiasi menjadi tanaman lengkap (George dan Sherrungton 1984).
Tabel 4 menunjukan bahwa kelangsungan hidup paling tinggi ialah pada media MS0 dengan eksplan tulang daun sebesar 48 %, tetapi dalam hal pertumbuhan akar dan daun lebih cepat tumbuh pada ekplan mata tunas (Gambar 7). Keberhasilan dalam teknik kultur jaringan ditentukan oleh komposisi hara yang tepat. Media Murashige dan Skoog (MS) adalah media yang paling banyak di gunakan untuk kultur jaringan, media ini mengandung garam-garam mineral dalam konsentrasi tinggi (Gamborg dan Shyluk 1981).
Gambar 7 Eksplan pada minggu kedelapan telah nampak daun dan akar
SIMPULAN DAN SARAN
Simpulan
1. Proses sterilisasi yang baik meliputi sterilisasi lingkungan kerja, sterilisasi alat dan media kultur, sterilisasi air dan sterilisasi eksplan.
2. Penggunaan HgCl2 pada konsentrasi 15 % merupakan konsentrasi yang
baik. Hal ini terlihat dari sedikitnya jumlah eksplan kontaminasi atau
browning.
3. Penggunaan antibiotik pada media tanam mengurangi persentase cendawan pada eksplan.
4. Penambahan arang aktif dan vitamin C memberikan pengaruh yang cukup baik terhadap pengurangan browning. Hal ini terlihat dari persentase
browning yang lebih kecil dibandingkan media lainnya.
14
Saran
Berdasarkan hasil penelitian eksplan tulang daun memiliki persentase kontaminasi dan browning yang rendah, tetapi pertumbuhannya tidak secepat eksplan mata tunas sehingga perlu dilakukan penelitian lanjutan mengenai pengaruh auksin dan sitokinin pada eksplan tulang daun guna mempercepat pertumbuhan eksplan. Perlu diadakan penyelamatan pada eksplan jika terdapat kontaminasi atau browning sehingga tanaman dapat di selamatkan.
DAFTAR PUSTAKA
Cantika. 2006. Pengaruh jenis dan konsentrasi antibiotic terhadap kontaminasi dan perkembangan eksplan Heliconia psittacorum L.f cv. Lady Di
[skripsi]. Bogor (ID): Institut Pertanian Bogor.
Catteral E. 1991. Begonias : The Complete Guide. The Crowood Press. Great Britain.
Darmono DW. 2003. Menghasilkan Anggrek Silangan. Jakarta (ID) : Penebar Swadaya.
Gamborg OL, Shyluk JK. 1981. Nutrition, media and characteristic of Plant Cell and Tissue Culture. New York (US): Academic Pr.
George EF, Sherrington PD. 1984. Plant propagation by tissue culture. Di dalam :
Handbook and Directory of Commercial Laboratories. England (GB): Exegetics Ltd.
Gunawan LW. 1987. Teknik Kultur Jaringan. Bogor: Laboratorium Kultur Jaringan Tanaman Pusat Antar Universitas Bioteknologi IPB – Lembaga Sumberdaya Informasi IPB.
Hartuningsih, Siregar M. 2005. Begonia Kebun Raya Bali. Kebun Raya Eka Karya Bali – LIPI. Bali.
Hartutiningsih, Siregar M. 2005. Adaptasi Jenis-jenis Begonia Alam di Kebun Raya “Eka Karya” Bali. Laporan. Kebun Raya Eka Karya Bali – LIPI. Bali.
Hartuningsih, Siregar M. 2008. Mengenal dan merawat begonia. Jakarta (ID) : PT Agromedia Pustaka.
Hendaryono DPS, Wijayani A. 1994. Teknik Kultur Jaringan Pengenalan dan Petunjuk Perbanyakan Tanaman secara Vegetatif-Modern. Yogyakarta (ID) : Kanisius.
Hutami S. 2006. Penggunaan arang aktif dalam kultur in vitro. Berita Biologi 8 (1) : 83-89.
Kiew R. 2005. Begonias of Peninsular Malaysia. Natural History Publications (Borneo). Singapore
Sandra E. 2003. Kultur Jaringan Anggrek Skala Rumah Tangga. Jakarta (ID) : Agro Media Pustaka.
15 Lampiran 1 Komposisi media Murashige dan Skoog
Bahan Kimia Konsentrasi dalam media (mg/l) Makro nutrien
Nh4NO3 1.650,000
KNO3 1.900,000
CaCl2. H2O 440,000
MgSO4. 7H2O 370,000
KH2PO4 170,000
Iron
Na2EDTA 37,000
FeSO4.7H2O 27,000
Mikro Nutrien
MnSO4.4H2O 23,300
ZnSO4.7H2O 8,600
H3BO3 6,200
KI 0,830
NaMoO4. 2H2O 0,250
CuSO4.2H2O 0,025
Co2Cl.6H2O 0,025
Vitamin
Glycine 2,000
Nicotine Acid 0,500
Pyrodoxin HCl 0,500
Thyamine HCl 0,100
Myo-inositol 100,000
Sukrosa 30.000,000
16
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 10 Februari 1990. Penulis merupakan anak kedua dari pasangan Yohanes Suharto dan Kasmini. Penulis mempunyai seorang kakak yang bernama Aviantoro Hardiyanto.
Jenjang pendidikan formal dimulai tahun 1994 di TK Tunas Muda selama 2 tahun. Kemudian penulis melanjutkan pendidikan dasar di SD Angkasa 1 selama 6 tahun. Tahun 2002 penulis melanjutkan pendidikan di SMPN 6 Bogor. Pendidikan sekolah menengah atas diselesaikan oleh penulis pada tahun 2008 di SMAN 5 Bogor. Pada tahun yang sama penulis diterima sebagai mahasiswa Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan IPB.