RESPON PERTUMBUHAN EMBRIO KEDELAI (Glycine max (L) Merril)
DENGAN PEMBERIAN INDOLE BUTYRIC ACID (IBA) DAN BENZYL AMINO PURINE (BAP) SECARA IN VITRO
SKRIPSI
OLEH :
EVI JULIANITA HARAHAP 090301022
PEMULIAAN TANAMAN
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
RESPON PERTUMBUHAN EMBRIO KEDELAI (Glycine max (L) Merril)
DENGAN PEMBERIAN INDOLE BUTYRIC ACID (IBA) DAN BENZYL AMINO PURINE (BAP) SECARA IN VITRO
SKRIPSI
OLEH :
EVI JULIANITA HARAHAP 090301022
PEMULIAAN TANAMAN
Skripsi Sebagai Salah Satu Syarat Untuk Mendapatkan Gelar Sarjana Di Fakultas Pertanian Universitas Sumatera Utara, Medan
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
Judul Penelitian : Respon Pertumbuhan Embrio Kedelai (Glycine max (L) Merril) Dengan Pemberian Indole Butyric Acid (IBA) dan Benzyl Amino Purine (BAP) Secara In Vitro
Nama : Evi Julianita Harahap
NIM : 090301022
Jurusan : Pemuliaan Tanaman Program Studi : Agroekoteknologi
Disetujui oleh : komisi pembimbing
(Ir. Emmy Harso Kardhinata, MSc.) (Ir. Syafrudin Ilyas Ketua Komisi Pembimbing Anggota Komisi pembimbing
ABSTRACT
Evi Julianita Harahap : Growth response of soybean embryos (Glycine max (L) Merril) by Indole Butyric Acid (IBA) and Benzyl Amino Purine (BAP) delivery in vitro, supervised by Emmy Harso Kardhinata and Syafrudin Ilyas.
The research aimed to know Growth response of soybean embryos (Glycine max (L) Merril) by Indole Butyric Acid (IBA) and Benzyl Amino Purine (BAP) delivery in vitro. The research was carried out in the Tissue Culture Laboratory, Agriculture’s Faculty of Nort Sumatera University from March to June 2013. This research used Completely Randomized Design with two factors. First factor was IBA concentration consist of four levels:0 ppm; 1 ppm; 2 ppm; 3 ppm. The second factor was BAP concentration consist of four levels are 0 ppm; 1 ppm; 2 ppm; 3 ppm.
ABSTRAK
Evi Julianita Harahap : Respon Pertumbuhan Embrio Kedelai (Glycine max (L) Merril)
dengan Pemberian Indole Butyric Acid (IBA) dan Benzil Amino Purine (BAP) Secara In Vitro, dibimbing oleh Emmy Harso Kardhinata dan Syafrudin Ilyas.
Penelitian ini bertujuan untuk mengetahui respon pertumbuhan dan perkembangan embrio kedelai dengan pemberian IBA dan BAP secara in vitro. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan, Fakultas Pertanian Universitas Sumatera Utara, Medan dari Maret sampai Juni 2013. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua faktor perlakuan. Faktor pertama adalah konsentrasi IBA yang terdiri dari 4 taraf yaitu 0 ppm; 1 ppm; 2 ppm; 3 ppm. Faktor kedua adalah konsentrasi BAP yaitu 0 ppm;
1 ppm; 2 ppm; 3 ppm.
Hasil penelitian menunjukkan bahwa konsentrasi IBA berpengaruh nyata terhadap persentase eksplan membentuk tunas, jumlah tunas, jumlah daun dan panjang akar, tetapi belum berpengaruh nyata terhadap persentase pertumbuhan eksplan, persentase pertumbuhan kalus, jumlah akar, dan tinggi plantlet. Pada konsentrasi BAP berpengaruh nyata terhadap persentase eksplan membentuk tunas, jumlah tunas, jumlah daun, panjang akar, dan jumlah akar, tetapi belum berpengaruh nyata terhadap persentase pertumbuhan eksplan, persentase pertumbuhan kalus, dan tinggi plantlet. Interaksi konsentrasi IBA dan BAP berpengaruh nyata terhadap panjang akar dan jumlah akar, tetapi belum berpengaruh nyata terhadap persentase pertumbuhan eksplan, persentase pertumbuhan kalus, persentase eksplan membentuk tunas, jumlah tunas, jumlah daun, dan tinggi plantlet. Visualisasi Eksplan membentuk embriogenesis somatik terbentuk secara tidak langsung (kalus, kalus membentuk tunas, kalus membentuk akar, dan kalus membentuk tunas-akar).
RIWAYAT HIDUP
Evi Julianita Harahap dilahirkan di Pelita pada tanggal 16 Agustus 1991,
putri dari pasangan Ragusta Harahap dan Nurhayati Simbolon merupakan anak
pertama dari dua bersaudara.
Pendidikan formal yang pernah ditempuh adalah SD N 013845 Lestari
lulus pada tahun 2003, SMP N 1 Bandar Pasir Mandoge lulus tahun 2006 dan
tahun 2009 penulis lulus dari SMA N 1 Buntu Pane dan pada tahun yang sama
lulus seleksi penerimaan mahasiswa baru melalui jalur PMP (Pemanduan Minat
dan Prestasi) pada program studi Agroekoteknologi, Fakultas Pertanian
Universitas Sumatera Utara, Medan.
Selama mengikuti Perkuliahan penulis mengikuti organisai BKM (Badan
Kenaziran Mushallah) Al Mukhlisin pada tahun 2010-2012, penulis juga
berkesempatan membantu dosen dalam menjalankan praktikum Dasar Pemuliaan
Tanaman pada tahun 2013, dan Bioteknologi Pertanian pada tahun 2013, serta
melaksanakan Praktek Kerja Lapangan (PKL) di PTPN IV (Persero) Unit Kebun
Sawit Langkat Desa Banjaran Raya Kecamatan Padang Tualang Kabupaten
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas
berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi ini yang berjudul
“Respon Pertumbuhan Embrio Kedelai (Glycine max (L) Merril) Dengan Pemberian Indole Butyric Acid (IBA) dan Benzyl Amino Purine (BAP) Secara In Vitro”, yang merupakan salah syarat untuk mendapatkan gelar sarjana Program Studi Agroekoteknologi Minat Pemuliaan Tanaman Fakultas Pertanian
Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih
kepada kedua orang tua tercinta, Ayahanda Ragusta Harahap dan Ibunda
Nurhayati Simbolon, adik saya Togu Parlindungan Harahap atas kasih sayang,
semua dukungan dan doanya. Penulis mengucapkan terima kasih kepada
Ir. Emmy Harso Kardhinata, MSc. selaku ketua komisi pembimbing dan
Ir. Syafrudin Ilyas selaku anggota komisi pembimbing yang telah membimbing
dan memberikan berbagai masukan berharga kepada penulis dalam menyelesaikan
skripsi ini. Penulis juga mengucapkan terima kasih kepada Laboran Asni, SP dan
teman-teman yang telah memberikan dukungan dan membantu penulis dalam
melaksanakan penelitian.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh
karena itu, penulis mengharapkan kritik dan saran demi perbaikan skripsi ini.
Akhir kata penulis mengucapkan terima kasih. Semoga skripsi ini bermanfaat.
Medan, Oktober 2013
DAFTAR ISI
ABSTRACT ... i
ABSTRAK ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR………..viii
DAFTARLAMPIRAN………ix
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Hipotesis Penelitian ... 3
Kegunaan Penelitian ... 4
TINJAUAN PUSTAKA ... 5
Botani Tanaman ... 5
Kultur Jaringan ... 6
Eksplan ... 8
Media Kultur ... 9
Lingkungan in vitro ... 10
Zat Pengatur Tumbuh ... 11
BAHAN DAN METODE PENELITIAN ... 18
Tempat dan Waktu Penelitian ... 18
Bahan dan Alat Penelitian ... 18
Metode Penelitian ... 18
PELAKSANAAN PENELITIAN ... 21
Sterilisasi Alat ... 21
Pembuatan Media ... 21
Persiapan Ruang Kultur ... 22
Sterilisasi Eksplan ... 23
Penanaman ... 23
Pemeliharaan Tanaman ... 23
Peubah Amatan ... 24
Persentase Pertumbuhan Kalus (%) ... 24
Persentase Eksplan Membentuk Tunas (%) ... 24
Jumlah Tunas (Buah) ... 24
Jumlah Daun (Helai) ... 24
Panjang akar (cm) ... 25
Jumlah Akar (Buah) ... 25
Tinggi Plantlet (cm) ... 25
Visualisasi Eksplan Membentuk Embriogenesis Somatik Secara Langsung dan Tdak Langsung ... 25
HASIL DAN PEMBAHASAN ... 26
Persentase Pertumbuhan Eksplan (%) ... 26
Persentase Pertumbuhan Kalus (%) ... 27
Persentase Eksplan Membentuk Tunas (%) ... 28
Jumlah Tunas (Buah) ... 29
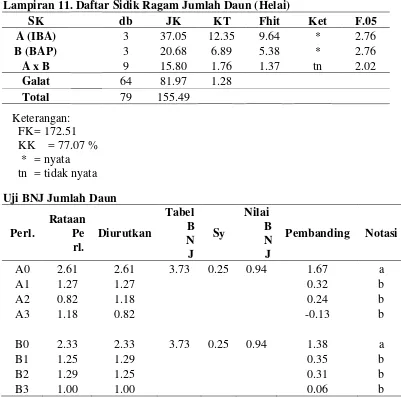
Jumlah Daun (Helai) ... 31
Panjang Akar (cm ... 32
Jumlah Akar (Buah) ... 34
Tinggi Plantlet (cm) ... 36
Visualisasi Eksplan Membentuk Embriogenesis Somatik Secara Langsung dan Tdak Langsung ... 38
KESIMPULAN DAN SARAN ... 39
Kesimpulan ... 39
Saran ... 39
DAFTAR TABEL
No. Hal.
1. Pengaruh konsentrasi IBA dan BAP terhadap persentase eksplan membentuk tunas (%) hasil transformasi √X+0.5...28
2. Pengaruh konsentrasi IBA dan BAP terhadap jumlah tunas (buah) hasil transformasi √X+0.5...29
3. Pengaruh konsentrasi IBA dan BAP terhadap jumlah daun (helai) hasil transformasi √X+0.5...31
4. Pengaruh konsentrasi IBA dan BAP terhadap panjang akar (cm)...32
5. Pengaruh konsentrasi IBA dan BAP terhadap jumlah akar (buah) hasil transformasi √X+0.5... 34
DAFTAR GAMBAR
No. Hal.
1. Foto Perlakuan A0B0 ... 62
2. Foto Perlakuan A0B1 ... 62
3. Foto Perlakuan A0B2 ... 62
4. Foto Perlakuan A0B3……….. 62
5. Foto Perlakuan A1B0 ... 62
6. Foto Perlakuan A1B1 ... 62
7. Foto Perlakuan A1B2 ... 62
8. Foto Perlakuan A1B3 ... 62
9. Foto Perlakuan A2B0……… 62
10.Foto Perlakuan A2B1 ... 62
11.Foto Perlakuan A2B2 ... 62
12.Foto Perlakuan A2B3……….. 62
13.Foto Perlakuan A3B0 ... 62
14.Foto Perlakuan A3B1 ... 62
15.Foto Perlakuan A3B2 ... 62
DAFTAR LAMPIRAN
No. Hal.
1. Data Pengamatan Persentase Pertumbuhan Eksplan (%) ... 43
2. Data Pengamatan Persentase Pertumbuhan Kalus (%)……….. 44
3. Data Pengamatan Persentase Eksplan Membentuk Tunas (%)…………....45
4. Data Transformasi Persentase Eksplan Membentuk Tunas √X+0.5 ...45
5. Daftar Sidik Ragam Persentase Eksplan Membentuk Tunas (%)...46
6. Data Pengamatan Jumlah Tunas (Buah)………...47
7. Data Transformasi Jumlah Tunas √X+0.5………47
8. Daftar Sidik Ragam Jumlah Tunas (Buah)...48
9. Data Pengamatan Jumlah Daun (Helai)………49
10. Data Transformasi Jumlah Daun √X+0.5...49
11. Daftar Sidik Ragam Jumlah Daun (Helai)...50
12. Data Pengamatan Panjang Akar (cm)………...51
13. Daftar Sidik Ragam Panjang Akar (cm)...51
14. Data Pengamatan Jumlah Akar (Buah)………...53
15. Data Transformasi Jumlah Akar √X+0.5………..53
16. Daftar Sidik Ragam Jumlah Akar (Buah)……….54
17. Data Pengamatan Tinggi Plantlet (cm)……….55
18. Data Transformasi Tinggi Plantlet √X+0.5………...55
19. Daftar Sidik Ragam Tinggi Plantlet (cm)...56
21. Deskripsi Kedelai Varietas Burangrang………...58
22. Komposisi Medium Murashige dan Skoog (MS)...59
23. Kegiatan Penelitian...60
24. Bagan Penelitian...61
ABSTRACT
Evi Julianita Harahap : Growth response of soybean embryos (Glycine max (L) Merril) by Indole Butyric Acid (IBA) and Benzyl Amino Purine (BAP) delivery in vitro, supervised by Emmy Harso Kardhinata and Syafrudin Ilyas.
The research aimed to know Growth response of soybean embryos (Glycine max (L) Merril) by Indole Butyric Acid (IBA) and Benzyl Amino Purine (BAP) delivery in vitro. The research was carried out in the Tissue Culture Laboratory, Agriculture’s Faculty of Nort Sumatera University from March to June 2013. This research used Completely Randomized Design with two factors. First factor was IBA concentration consist of four levels:0 ppm; 1 ppm; 2 ppm; 3 ppm. The second factor was BAP concentration consist of four levels are 0 ppm; 1 ppm; 2 ppm; 3 ppm.
ABSTRAK
Evi Julianita Harahap : Respon Pertumbuhan Embrio Kedelai (Glycine max (L) Merril)
dengan Pemberian Indole Butyric Acid (IBA) dan Benzil Amino Purine (BAP) Secara In Vitro, dibimbing oleh Emmy Harso Kardhinata dan Syafrudin Ilyas.
Penelitian ini bertujuan untuk mengetahui respon pertumbuhan dan perkembangan embrio kedelai dengan pemberian IBA dan BAP secara in vitro. Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan, Fakultas Pertanian Universitas Sumatera Utara, Medan dari Maret sampai Juni 2013. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua faktor perlakuan. Faktor pertama adalah konsentrasi IBA yang terdiri dari 4 taraf yaitu 0 ppm; 1 ppm; 2 ppm; 3 ppm. Faktor kedua adalah konsentrasi BAP yaitu 0 ppm;
1 ppm; 2 ppm; 3 ppm.
Hasil penelitian menunjukkan bahwa konsentrasi IBA berpengaruh nyata terhadap persentase eksplan membentuk tunas, jumlah tunas, jumlah daun dan panjang akar, tetapi belum berpengaruh nyata terhadap persentase pertumbuhan eksplan, persentase pertumbuhan kalus, jumlah akar, dan tinggi plantlet. Pada konsentrasi BAP berpengaruh nyata terhadap persentase eksplan membentuk tunas, jumlah tunas, jumlah daun, panjang akar, dan jumlah akar, tetapi belum berpengaruh nyata terhadap persentase pertumbuhan eksplan, persentase pertumbuhan kalus, dan tinggi plantlet. Interaksi konsentrasi IBA dan BAP berpengaruh nyata terhadap panjang akar dan jumlah akar, tetapi belum berpengaruh nyata terhadap persentase pertumbuhan eksplan, persentase pertumbuhan kalus, persentase eksplan membentuk tunas, jumlah tunas, jumlah daun, dan tinggi plantlet. Visualisasi Eksplan membentuk embriogenesis somatik terbentuk secara tidak langsung (kalus, kalus membentuk tunas, kalus membentuk akar, dan kalus membentuk tunas-akar).
PENDAHULUAN
Latar Belakang
Kedelai merupakan tanaman yang sangat penting. Kedelai memiliki
kandungan minyak yang tinggi, dan bijinya kaya protein. Kedelai juga
mengandung mineral seperti kalsium, fosfor, iron, potassium, dan magnesium
daripada tanaman serealia. Kegunaannya antara lain untuk pembuatan tempe,
tahu, susu, tepung, minyak, kosmetik, sabun, produk makanan, farmasi, pupuk,
industri cat, pernis, plastik, dan lain-lain (Pandey, 2007).
Kebutuhan kedelai meningkat setiap tahunnya sehingga menimbulkan
tantangan yang berat bagi pembangunan pertanian kedelai. Tantangan ini semakin
berat karena di satu sisi laju permintaan terus meningkat, akan tetapi disisi lain
muncul beberapa permasalahan diantaranya keterbatasan lahan yang sempit
(Savitri, 2010). Hal ini disebabkan produktivitas kedelai yang masih rendah
sehingga harus dilakukan perbaikan baik secara kuantitas maupun kualitas
(Ilyas, 2005).
Produksi kedelai tahun 2012 diperkirakan sebesar 783,158 ribu ton, menurun
sebanyak 68,128 ribu ton (8,7 %) dibandingkan tahun 2011. Penurunan produksi
kedelai tahun 2012 tersebut diperkirakan terjadi karena turunnya luas panen
sebesar 51.759 ribu hektar (9,07 %) dibandingkan tahun 2011, sedangkan
produktivitas mengalami kenaikan sebesar 0,05 kuintal/ha (0,36 %) (BPS, 2012).
Dalam upaya meningkatkan produksi kedelai untuk memenuhi kebutuhan
tersebut, berbagai usaha dilakukan pemerintah diantaranya melalui perbanyakan
secara vegetatif dapat dikembangkan melalui teknik kultur jaringan, diantaranya
dengan menggunakan perbanyakan melalui kultur embrio (Sofia, 2007).
Kultur embrio merupakan salah satu teknologi somaklonal yang diaplikasi
paling awal dalam pemuliaan tanaman dan telah digunakan dalam sejumlah
keadaan untuk memperoleh hibrida intergenetik atau interspesifik. Dengan kultur
embrio, suatu embrio dipisahkan dari biji yang sedang berkembang beberapa hari
setelah pembuahan dan dibiakkan dalam medium cair atau padat dalam
lingkungan yang terkendali ketat untuk menghasilkan bibit tanaman yang dapat
dipindahkan ke tanah dan menghasilkan tanaman dewasa (Nasir, 2002).
Tujuan utama penggunaan zat pengatur tumbuh pada kedelai adalah
mengusahakan terbentuknya tanaman yang produktif. Ini berarti bahwa zat
pengatur tumbuh tersebut harus mampu mengeliminasi hambatan yang ada pada
tanaman itu sendiri, di antaranya adalah mengurangi keguguran bunga dan
polong, mengurangi aborsi ovul dan biji pada polong yang sudah matang,
meningkatkan buku-buku subur, dan memperpendek tanaman (Manurung, 1995).
Secara umum auksin berperan sebagai pemanjangan sel, pembelahan sel,
dan pembentukan akar adventif. Asam indolbutirat (IBA) lebih lazim digunakan
untuk memacu perakaran dibandingkan dengan NAA atau auksin lainnya. IBA
bersifat aktif, sekalipun cepat dimetabolismekan menjadi IBA-aspartat dan
sekurangnya menjadi satu konjugat peptida lainnya. Diduga, terbentuknya
konjugat tersebut dapat menyimpan IBA, yang kemudian secara bertahap
dilepaskan; hal itu menjadikan konsentrasi IBA bertahan pada tingkat yang tepat,
BAP (6-Benzylaminopurine) merupakan sitokinin sintetik yang umum digunakan dalam kegiatan kultur jaringan yang berfungsi sebagai pembentukan
tunas, menstimulir terjadinya pembelahan sel, proliferasi kalus, mendorong
proliferasi meristem ujung, mendorong klorofil pada kalus, mendorong proses
morfogenesis, pembentukan kloriflas, pemecahan dormansi, pembukaan stomata,
pembungaan, dan penundaan senescence (penuaan) (Santoso dan Nursandi, 2004).
Hasil penelitian Sofia (2008) tentang pengaruh berbagai benzyl amino
purine dan cycocel terhadap pertumbuhan embrio kedelai secara in vitro
menunjukkan bahwa perlakuan zat pengatur tumbuh BAP pada konsentrasi 2 ppm
berpengaruh nyata terhadap parameter tinggi tanaman (0.383 cm), jumlah tunas
(1.570 buah), jumlah akar 1.225 buah), berat akar (0.106 gr), dan berat total
tanaman (0.171 gr).
Berdasarkan uraian di atas, maka peneliti tertarik untuk melakukan penelitian
mengenai respon pertumbuhan embrio kedelai dengan pemberian IBA dan BAP
secara in vitro.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui respon pertumbuhan dan
perkembangan embrio kedelai dengan pemberian IBA dan BAP secara in vitro.
Hipotesis Penelitian
1. Terdapat pengaruh terhadap pertumbuhan dan perkembangan embrio kedelai
akibat pemberian konsentrasi IBA dan BAP.
2. Terdapat pengaruh terhadap pertumbuhan dan perkembangan embrio kedelai
Kegunaan Penelitian
Skripsi sebagai salah satu syarat untuk mendapatkan gelar Sarjana
Pertanian di Fakultas Pertanian, Universitas Sumatera Utara, Medan dan sebagai
bahan informasi bagi pihak-pihak yang berkepentingan terutama dalam kultur
embrio kedelai.
TINJAUAN PUSTAKA
Botani Tanaman
Klasifikasi kedelai adalah sebagai berikut: kingdom plantae, sub divisi
spermatophyta, kelas dicotyledoneae, ordo fabales, famili fabaceae, genus
glycine, dan spesies Glycine max (L.) Merrill (Steenis, 2005).
Sistem perakaran kedelai terdiri dari dua macam, yaitu akar tunggang dan
akar sekunder (serabut) yang tumbuh dari akar tunggang. Pertumbuhan akar
tunggang dapat mencapai panjang sekitar 2 m atau lebih pada kondisi yang
Kegunaan Penelitian
Skripsi sebagai salah satu syarat untuk mendapatkan gelar Sarjana
Pertanian di Fakultas Pertanian, Universitas Sumatera Utara, Medan dan sebagai
bahan informasi bagi pihak-pihak yang berkepentingan terutama dalam kultur
embrio kedelai.
TINJAUAN PUSTAKA
Botani Tanaman
Klasifikasi kedelai adalah sebagai berikut: kingdom plantae, sub divisi
spermatophyta, kelas dicotyledoneae, ordo fabales, famili fabaceae, genus
glycine, dan spesies Glycine max (L.) Merrill (Steenis, 2005).
Sistem perakaran kedelai terdiri dari dua macam, yaitu akar tunggang dan
akar sekunder (serabut) yang tumbuh dari akar tunggang. Pertumbuhan akar
tunggang dapat mencapai panjang sekitar 2 m atau lebih pada kondisi yang
20-30 cm. Akar serabut ini mula-mula tumbuh di dekat ujung akar tunggang,
sekitar 3-4 hari setelah berkecambah dan akan semakin bertambah banyak dengan
pembentukan akar-akar muda yang lain (Irwan, 2006).
Kedelai berumur 1 tahun dengan tinggi 0,2-0,6 m. Batang berbentuk
persegi dengan rambut coklat yang menjauhi batang atau mengarah ke bawah.
Pertumbuhan batang terdiri dari dua tipe yaitu determinate dan indeterminate yang
didasarkan keberadaan bunga pada pucuk batang (Steenis, 2005).
Bentuk daun kedelai yaitu bulat (oval) dan lancip (lanceolate). Tanaman kedelai
mempunyai dua bentuk daun yang dominan, yaitu stadia kotiledon yang tumbuh
saat tanaman masih berbentuk kecambah dengan dua helai daun tunggal dan daun
bertangkai tiga (trifoliate leaves) yang tumbuh selepas masa pertumbuhan.Daun mempunyai bulu dengan warna cerah dan jumlahnya bervariasi. Panjang bulu
1 mm dan lebar 0,0025 mm. Kepadatan bulu bervariasi, tergantung varietas, tetapi
biasanya antara 3-20 buah/mm2 (Irwan, 2006).
Bunga kedelai berada dalam berkas atau tandan. Berkas duduk bertangkai
panjangnya 3 cm. Bagian yang mendukung bunga 0,5-2 cm, anak tangkai bunga
sangat pendek. Tinggi kelopak 5-7 mm, berambut panjang, bertaju 5; taju sempit
dan runcing. Mahkota berwarna putih atau lila, dan panjang bendera 6-7 mm.
Benang sari bendera lepas atau mudah lepas, yang lainnya melekat, dan bakal
buah berambut tipis dan rapat (Steenis, 2005).
Polong biasanya berwarna hijau. Polongnya yang berkembang dalam
kelompok, biasanya mengandung 2-3 biji yang berbentuk bundar atau pipih, dan
Ukuran biji kedelai dari 5 sampai 55 gram per 100 biji. Jumlah biji per
polong dari 1 sampai 5, meskipun secara umum terdapat 2 sampai 3 biji per
polong pada varietas komersil. Warna mantel biji bervariasi, seperti kuning, hijau,
hitam, atau kombinasi dari warna-warna tersebut (Poehlman, 1989).
Kultur Jaringan
Kultur jaringan merupakan teknik menumbuh-kembangkan bagian
tanaman, baik berupa sel, jaringan atau organ dalam kondisi aseptik secara
in vitro. Teknik ini dicirikan oleh kondisi kultur yang aseptik, penggunaan media kultur buatan dengan kandungan nutrisi lengkap dan ZPT (Zat Pengatur Tumbuh),
serta kondisi ruang kultur yang suhu dan pencahayaannya terkontrol
(Yusnita, 2003).
Tujuan kultur embrio adalah mempersingkat siklus pemuliaan tanaman,
mengatasi aborsi embrio, mengatasi inkompatibililitas, dan sebagai sumber
pembentukan kalus (Zulkarnain, 2009).
Kultur jaringan memiliki 2 prinsip dasar yang jelas, yaitu (1) bahan tanam
yang bersifat totipotensi dan (2) budidaya yang terkendali. Konsep dasar ini
adalah mutlak dalam pelaksanaan kultur jaringan karena hanya dengan sifat
totipotensi ini, sel, jaringan, organ yang digunakan akan mampu tumbuh dan
berkembang sesuai arahan dan tujuan budidaya in vitro yang dilakukan. Sifat
bahan yang totipotensi saja tidak cukup untuk kesuksesan kegiatan kultur
jaringan. Keadaan media tempat tumbuh, lingkungan yang mempengaruhinya
(kelembaban, temperatur, cahaya) serta keharusan sterilitas adalah hal mutlak
Menurut Yusnita (2003) tahapan kultur jaringan dapat dilakukan dengan
langkah-langkah sebagai berikut:
a) Pemilihan dan penyiapan tanaman induk sumber eksplan
Kegiatan pertama yang harus dilakukan sebelum melakukan kultur
jaringan adalah memilih tanaman induk yang hendak diperbanyak. Bahan eksplan
harus berasal dari tanaman yang jelas jenis, spesies, dan varietasnya, serta harus
sehat dan bebas dari hama penyakit.
b) Inisiasi kultur
Tujuan tahap ini adalah mengusahakan kultur yang aseptik atau aksenik
dalam pengambilan eksplan dari bagian tanaman yang akan dikulturkan.
c) Multiplikasi atau perbanyakan propagul
Pada prinsipnya, tahap ini bertujuan untuk menggandakan propagul atau
bahan tanaman yang diperbanyak seperti tunas atau embrio, serta memeliharanya
dalam keadaan tertentu sehingga sewaktu-waktu bisa dilanjutkan untuk tahap
berikutnya.
d) Pemanjangan tunas, induksi, dan perkembangan akar
Tunas-tunas yang dihasilkan pada tahap multiplikasi dipindahkan ke
media lain untuk pemanjangan tunas. Setelah tumbuh cukup panjang, tunas
tersebut dapat diakarkan. Pemanjangan tunas dan pengakarannya dapat dilakukan
sekaligus atau secara bertahap yaitu setelah dipanjangkan, baru diakarkan.
e) Aklimatisasi plantlet ke lingkungan luar
Aklimatisasi adalah pengondisian plantlet atau tunas mikro di lingkungan baru
yang septik dengan media tanah sehingga plantlet dapat bertahan dan terus
Eksplan
Organ atau sepotong jaringan tanaman yang akan dikulturkan disebut
eksplan. Seleksi dan pemilihan sumber eksplan merupakan aspek penting
keberhasilan mikropropagasi. Tiga aspek penting yang perlu diperhatikan antara
lain (1) sumber karakteristik genetik dan epigenetik, (2) bebas patogen, dan
(3) kondisi fisiologi tanaman yang mampu berinisiasi sendiri dengan baik yang
akan dikulturkan (Hartmann dkk, 2002).
Ukuran eksplan juga berpengaruh terhadap keberhasilan dalam kultur
jaringan. Eksplan yang berukuran besar beresiko kontaminasi lebih tinggi
dibandingkan dengan yang berukuran kecil, tetapi kemampuan hidupnya lebih
besar dan tumbuhnya lebih cepat. Sebaliknya, eksplan berukuran kecil (meristem
atau tunas pucuk) kemungkinan terkontaminasinya jauh lebih kecil, tetapi tumbuh
lebih lambat (Yusnita, 2003).
Bagian jaringan hidup (eksplan) yang kecil dari banyak spesies tanaman
kini secara aseptik dapat dipisahkan dari tanaman induknya, dan secara artificial
dipertahankan dan ditingkatkan jumlahnya melalui pengendalian media
perbenihan yang sesuai. Proses tersebut dapat berlangsung cepat dan
menghasilkan jenis-jenis tanaman yang seragam dengan mutu yang tinggi
(Smith, 1995).
Embrio terdiri dari axis embrio dan kotiledon. Aksis berhubungan dengan
akar embrio (radikula), hipokotil berada diantara radikula dan kotiledon, dan
pucuk apeks pada daun pertama (plumula). Bentuk embrio dan ukuran pada
Pola yang dibawa dari genetik masing-masing tanaman telah tertentu
dengan demikian potensinya untuk pertumbuhan masa berikutnya ditentukan oleh
faktor lainnya (Lubis, 1985).
Media Kultur
Hampir dapat dipastikan bahwa kesuksesan kegiatan kultur jaringan akan
sangat ditentukan dan tergantung oleh pilihan media yang digunakan. Media
kultur jaringan terdiri dari bahan-bahan esensial dan komponen pengoptimal.
Bahan esensial terdiri atas garam-garam anorganik, sumber karbon dan energi,
vitamin, dan zat pengatur tumbuh. Sedangkan komponen pengoptimal yang
berperan untuk optimalisasi pertumbuhan diantaranya adalah N-organik, asam
organik, substrat komplek, arang aktif, dan lain-lain
(Santoso dan Nursandi, 2004).
Media kultur embrio mencakup garam-garam anorganik, sukrosa, vitamin,
asam amino, hormon, dan substansi yang secara nutrisi tidak terjelaskan seperti
santan kelapa. Embrio yang lebih muda membutuhkan media lebih kompleks
dibandingkan dengan embrio yang lebih tua (Nasir, 2002).
Kebutuhan nutrisi untuk pertumbuhan kultur in vitro yang optimal
bervariasi antar spesies ataupun antar varietas. Bahkan, jaringan yang berasal dari
bagian tanaman yang berbeda pun akan berbeda kebutuhan nutrisinya. Oleh
karena itu, tidak ada satu pun media dasar yang berlaku universal untuk semua
jenis jaringan dan organ. Meskipun demikian, medium dasar MS yang direvisi
(Murashige dan Skoog, 1962) adalah yang paling luas penggunaannya
dibandingkan dengan media dasar lainnya, terutama pada mikropropagasi
memiliki kandungan garam-garam yang lebih tinggi daripada media lain,
dibanding kandungan nitratnya juga tinggi (Zulkarnain, 2009).
Formulasi yang sering digunakan sebagai media kultur adalah media MS.
Media ini merupakan kombinasi antara zat-zat yang mengandung hara makro,
mikro, dan sumber energi, serta vitamin. Formulasi media dasar mineral MS dapat
digunakan untuk sejumlah besar spesies tanaman pada propagasi secara in vitro
(Wethrel, 1982).
Lingkungan In Vitro
Secara umum agar kegiatan kultur jaringan berjalan baik dan bahan tanam
dapat tumbuh berkembang seperti yang diharapkan maka pada tahap inkubasi di
ruang kultur pengendalian temperatur, cahaya, tingkat kelembaban, wadah kultur,
dan faktor lingkungan lain yang menunjang merupakan hal yang perlu mendapat
perhatian (Santoso dan Nursandi, 2004).
Secara umum, intensitas cahaya yang optimum untuk tanaman pada kultur
tahap inisiasi kultur adalah 0-1000 lux, tahap multiplikasi sebesar 1000-10000
lux, tahap pengakaran sebesar 10000-30000 lux, dan tahap aklimatisasi sebesar
30000 lux. Suhu juga berpengaruh terhadap kesehatan tanaman yang dikulturkan.
Suhu yang umum digunakan untuk pengulturan berbagai jenis tanaman adalah
26 + 2 0C. Namun, pada kultur tanaman yang biasanya memerlukan suhu rendah
untuk pertumbuhan terbaiknya, seperti stroberi (Yusnita, 2003).
Kelembaban relatif di dalam ruang kultur sekitar 70 %, namun kebutuhan
kelembaban di dalam media kultur mendekati 90%. Pengaruh CO2 di dalam kultur
jaringan berkaitan erat dengan kebutuhan bagi proses fotosintesis. Secara umum,
di bawah kondisi cahaya. Oksigen (O2) juga dibutuhkan oleh jaringan yang
dikulturkan secara in vitro sebagaimana halnya pada kultur in vivo. Oksigen
merupakan salah satu faktor pembatas bagi pembelahan dan pertumbuhan sel-sel
pada jaringan yang dikulturkan secara in vitro. Seperti peranan oksigen selama
fase proliferasi, laju pertumbuhan kultur sel tanaman Daucus carota lebih rendah dan penyerapan gula mengalami hambatan pada kadar oksigen 10% dibandingkan
kadar oksigen 100% (Zulkarnain, 2009).
Kultivasi sel atau jaringan secara in vitro secara in vitro secara prinsip
dapat dilakukan dengan menggunakan berbagai macam wadah, mulai dari tabung
reaksi, tabung Erlenmeyer, botol kultur, bahkan botol gelas sederhana. Hal yang
paling penting dalam pemilihan wadah untuk kultur in vitro adalah kemudahan
untuk menjaga sterilitasnya selama perbanyakan sel atau jaringan
(Yuwono, 2006).
Zat Pengatur Tumbuh
Auksin adalah substansi organik yang pada konsentrasi rendah (<0,001 M)
meningkatkan pertumbuhan di sepanjang sumbuh longitudinal antara lain
pembesaran sel, pembelahan sel, dan pembentukan akar. Selain itu berpengaruh
pula pada penghambatan tunas dan dominansi apikal (Wilkins, 1992).
Auksin adalah sekelompok senyawa yang fungsinya merangsang
pemanjangan sel-sel pucuk yang spektrum aktivitasnya menyerupai IAA
(indole-3-acetic-acid). Pada umumnya auksin meningkatkan pemanjangan sel,
pembelahan sel, dan pembentukan akar adventif. Auksin berpengaruh pula untuk
menghambat pembentukan tunas adventif dan tunas aksilar, namun kehadirannya
pada kultur suspensi sel. Konsentrasi auksin yang rendah akan meningkatkan
pembentukan akar adventif, sedangkan auksin konsentrasi tinggi akan
merangsang pembentukan kalus dan menekan morfogenesis. Penambahan
konsentrasi yang optimal untuk pertumbuhan akar berbeda pada masing-masing
tanaman (Zulkarnain, 2009).
Rangsangan internal yang normal menyebabkan terjadinya kerja auksin
yang mempengaruhi perkembangan pucuk. Tunas lateral dari batang terbentuk
pada ketiak daun. Tunas-tunas yang berada dekat ujung batang biasanya tinggal
dorman, tetapi tunas-tunas yang berada jauh di sebelah bawah bisa memecah
dormansinya dan berkembang menjadi cabang dari batang tersebut. Efek
pendorong pertumbuhan auksin dikurangi oleh adanya cahaya, oleh sebab itu
tunas yang mendapat penyinaran tidak tumbuh secepat tunas di tempat gelap
(Heddy, 1996).
Hormon IBA adalah salah satu hormon yang termasuk dalam kelompok
auksin. Selain dipakai untuk merangsang perakaran, hormon IBA juga
mempunyai manfaat yang lain seperti menambah daya kecambah, merangsang
perkembangan buah, mencegah kerontokan, pendorong kegiatan cambium dan
lain-lain. IBA mempunyai sifat yang lebih baik dan efektif daripada IAA dan
NAA. Dengan demikian IBA paling cocok untuk merangsang aktifitas perakaran,
Karena kandungan kimianya lebih stabil dan daya kerjanya lebih lama
(Kusumo, 1994).
Auksin seperti IBA, berperan dalam mendorong perpanjangan sel,
pembelahan sel diferensiasi jaringan xylem dan floem, pembentukan akar
akar adventif. Semakin tinggi IBA yang diberikan, maka perpanjangan akar
cenderung lebih panjang. Semakin tinggi tingkat konsentrasi sitokinin akan
menyebabkan regeneran sulit berakar (Gunawan, 1987).
Penambahan auksin dengan konsentrasi tertentu tidak selalu meningkatkan
pertumbuhan akar tetapi justru dapat menurunkan pertumbuhan akar. Hal tersebut
berhubungan dengan kadar nitrogen yang ada pada masing-masing media tumbuh
yang telah dikombinasikan dengan berbagai jenis auksin (Fuchs, 1986).
Mekasnisme pembentukan akar yaitu auksin akan memperlambat
timbulnya senyawa-senyawa dalam dinding sel yang berhubungan dengan
pembentukan kalsium pektat, sehingga menyebabkan dinding sel menjadi lebih
elastis. Akibatnya sitoplasma lebih leluasa untuk mendesak dinding sel ke arah
luar dan memperluas volume sel. Selain itu, auksin menyebabkan terjadinya
pertukaran antara ion H+ dengan ion K+. Ion K+ akan masuk ke dalam sitoplasma
dan memacu penyerapan air ke dalam sitoplasma tersebut untuk mempertahankan
tekanan turgor dalam sel, sehingga sel mengalami pembentangan. Setelah
mengalami pembentangan maka dinding sel akan menjadi kaku kembali karena
terjadi kegiatan metabolik berupa penyerapan ion Ca+ dari luar sel, yang akan
menyempurnakan susunan kalsium pektat dalam dinding sel (Hastuti, 2002).
Sitokinin adalah senyawa yang dapat meningkatkan pembelahan sel pada jaringan
tanaman serta mengatur pertumbuhan dan perkembangan, sama halnya kinetin
(6-furfurylaminopurine). Senyawa tersebut dapat meningkatkan pembelahan sel, proliferasi pucuk, dan morfogenesis pucuk. Sitokinin yang paling banyak
zeatin. Zeatin adalah sitokinin yang disintesis secara alamiah, sedangkan kinetin
dan BA adalah sitokinin sintetik (Zulkarnain, 2009).
Sitokinin dapat mempengaruhi berbagai proses fisiologis dalam sel yang
diperlukan untuk pertumbuhan tunas dan daun. Pertumbuhan tunas terutama
tergantung kepada sumber jaringan, kadar medium hara, jenis kadar hormon
pertumbuhan yang digunakan (Kartha, 1991)
Pembentukan tunas in vitro sangat menentukan keberhasilan produksi
bibit yang cepat dan banyak. Semakin banyak tunas yang terbentuk akan
berkorelasi positif dengan bibit yang dapat dihasilkan melalui kultur jaringan.
Dengan demikian untuk memacu faktor multiplikasi tunas yang tinggi diperlukan
penambahan zat pengatur tumbuh sitokinin. Tunas ganda (tunas majemuk) yang
terbentuk secara langsung lebih stabil secara genetik dibandingkan dengan tunas
tidak langsung (Lestari, 2011).
Dilaporkan bahwa sitokinin dapat mengatur keseimbangan sel. Sitokinin
dalam jumlah yang banyak dapat merangsang pertumbuhan tunas tetapi
pertumbuhan menekan pertumbuhan tinggi tanaman serta merangsang
pertumbuhan akar (George and Sherrington, 1984). Wilkins (1992) juga
menambahkan sitokinin dapat memperluas sel secara lateral yang menyebabkan
kenaikan diameter batang tetapi menurunkan tinggi tanaman.
Auksin umumnya menghambat pertumbuhan tunas, sedangkan kombinasi
konsentrasi sitokinin yang tinggi dengan auksin rendah penting dalam
pembentukan tunas dan daun (Fereol dkk, 2002). Kebanyakan tanaman
membutuhkan sitokinin untuk pembentukan tunas, sebaliknya auksin bersifat
Pada umumnya auksin digunakan dalam kultur jaringan untuk merangsang
pertumbuhan kalus, suspensi sel, dan organ. Auksin berfungsi untuk pembentukan
akar dan kuncup samping dalam konsentrasi tertentu. Sitokinin merupakan zat
pengatur tumbuh yang penting dalam pengaturan pembelahan sel dan
morfogenesis (Karjadi dan Buchory, 2008).
Penggunaan nutrisi yang seimbang dan kehadiran zat pengatur tumbuh,
kemungkinan yang terbentuk adalah perkembangan kalus atau membentuk pucuk,
tunas, dan/atau membentuk akar. Jika sitokinin dan auksin pada taraf yang sama,
maka akan terbentuk kalus; jika proporsi sitokinin lebih tinggi daripada auksin,
maka mendukung pembentukan tunas; dan jika proporsi auksin lebih tinggi
daripada sitokinin, maka mendukung pembentukan akar (Saigo, 1983).
Apabila kondisi auksin dan sitokinin endogen berada pada kondisi sub
optimal, maka diperlukan penambahan auksin dan sitokinin secara eksogen,
sehingga diperoleh perimbangan auksin dan sitokinin optimal (Suyadi dkk, 2003).
Pada pertumbuhan sumbu embrio, awal mula pertumbuhan akar lembaga
(radikula) lebih cepat daripada pucuk lembaga (plumula) dan umumnya radikula
pertama muncul dari kulit biji yang pecah. Zat pengatur tumbuh sitokinin
merangsang pembelahan sel, menghasilkan munculnya akar lembaga dan pucuk
lembaga. Perluasan awal pada koleoriza (munculnya ujung akar) terutama karena
pembesaran sel. Sedangkan auksin meningkatkan pertumbuhan karena
pertumbuhan koleoriza, akar lembaga dan pucuk lembaga dan aktivitas geotropi
(yaitu orientasi yang benar pada pertumbuhan akar dan pucuk, terlepas dari
Hasil penelitian Palestine (2008) pada induksi akar biakan pule pundak
menunjukkan bahwa saat inisiasi akar, jumlah akar dan panjang akar didapatkan
bahwa pemberian IBA pada tanaman pule pundak yang paling efektif adalah pada
konsentrasi 3 ppm. Rata-rata persentase keberhasilan keluarnya akar adalah
sebanyak 70%.
Embriogenesis somatik merupakan suatu proses berkembangnya sel
somatik menjadi suatu jaringan tanpa melalui adanya fusi gamet. Selama fase
awal embriogenesis, sel-sel somatik harus memulai beberapa fase perkembangan
seperti dediferensiasi, induksi dan arah perkembangan. Proses embrio somatik
dimulai dengan terbentuknya sel-sel yang embriogenik berukuran kecil dengan isi
sitoplasma yang penuh, nukleus yang besar, vakuola yang kecil dan kaya akan
butiran-butiran pati yang padat, kemudian sel-sel tersebut berubah menjadi pre
embrio yang bekembang menjadi fase globular, jantung, dan kotiledon
(Wiendi dkk, 1991).
Pembentukan embriogenesis somatik dapat secara langsung maupun tidak
langsung. Embriogenesis somatik langsung adalah pembentukan embriogenesis
somatik secara langsung dari eksplan tanpa melalui pembentukan fase kalus,
sedangkan embriogenesis somatik tidak langsung proses pembentukannya melalui
fase kalus. Tahapan perkembangan dari embriogenesis somatik sama dengan
perkembangan sel pada embrio zigotik dimana pada embrio somatik terdapat ciri
struktur bipolar yaitu mempunyai dua calon meristem yaitu meristem akar dan
meristem tunas (Husni dkk, 2011).
Kelompok auksin adalah yang paling umum digunakan untuk
berpengaruh terhadap diferensiasi sel dalam proses embriogenesis somatik
(Merigo, 2011).
Embriogenesis mempunyai beberapa tahap spesifik, yaitu (1) induksi sel
dan kalus embriogenik, (2) pendewasan, (3) perkecambahan, dan (4) hardening.
Pada tahap induksi kalus embriogenik dilakukan isolasi eksplan dan penanaman
pada media tumbuh. Untuk induksi kalus embriogenik kultur umumnya
ditumbuhkan pada media yang mengandung auksin yang mempunyai daya
aktivitas kuat atau dengan konsentrasi tinggi (Bhojwani dan Razdan, 1989).
BAHAN DAN METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Fakultas
Pertanian Universitas Sumatera Utara, Medan. Penelitian ini dimulai pada bulan
Maret sampai dengan Juni 2013.
Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian ini adalah embrio kedelai varietas
Burangrang dari Balai Penelitian Kacang-kacangan dan Umbi-umbian, Malang,
bahan penyusun media MS, IBA, BAP, agar-agar, akuades steril, alkohol 70 %,
dan bahan lainnya yang mendukung penelitian ini.
Alat yang digunakan dalam penelitian ini adalah botol kultur, timbangan
analitik, botol kultur, erlenmeyer, gelas ukur, beaker glass, pipet ukur, petridis,
pinset, skalpel, cawan petri, aluminium foil, autoklaf, oven, hot plate, magnetik
stirer, batang pengaduk, Laminar Air Flow Cabinet, lampu bunsen, rak kultur,
penggaris, dan alat-alat lainnya yang mendukung penelitian ini.
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Faktorial
yang terdiri dari dua faktor yaitu:
Faktor I: Tingkat Konsentrasi pemberian IBA dengan 4 taraf
A0 = 0 ppm
A1 = 1 ppm
A2 = 2 ppm
Faktor II: Tingkat Konsentrasi pemberian BAP dengan 4 taraf
B0 = 0 ppm
B1 = 1 ppm
B2 = 2 ppm
B3 = 3 ppm
Kombinasi perlakuan ada 16, yaitu:
A0B0 A0B1 A0B2 A0B3
A1B0 A1B1 A1B2 A1B3
A2B0 A2B1 A2B2 A2B3
A3B0 A3B1 A3B2 A3B3
Jumlah ulangan : 5 ulangan
Jumlah Kombinasi : 16 kombinasi
Jumlah Tanaman/botol : 1 tanaman
Jumlah sampel/botol : 1 tanaman
Jumlah seluruh botol : 80 botol kultur
Jumlah seluruh tanaman : 80 tanaman
Data hasil penelitian dianalisis dengan sidik ragam model linier sebagai
berikut:
Yijk = µ + αi + βj + (αβ)ij + εijk
i = 1,2,3,4 j = 1,2,3,4 k = 1,2,3,4,5
Yijk = Hasil pengamatan dari konsentrasi pada taraf ke-i dan konsentrasi pada taraf ke-j dalam ulangan ke-k
µ = Efek dari nilai tengah
βj = Efek konsentrasi BAP pada taraf ke-j
(αβ)ij = Nilai tambah efek dari interaksi IBA ke-i dan BAP ke-j
εijk = Galat dan konsentrasi IBA pada taraf ke-i dengan konsentrasi BAP
pada taraf ke-j dalam ulangan ke-k
Jika perlakuan (konsentrasi IBA, konsentrasi BAP dan interaksi) berbeda
nyata dalam sidik ragam maka dilanjutkan dengan uji Beda Nyata Jujur (BNJ)
PELAKSANAAN PENELITIAN
Sterilisasi Alat
Sterilisasi berguna untuk membersihkan alat-alat agar terhindar dari
hal-hal yang dapat menimbulkan kontaminasi yang akan digunakan dalam kultur
jaringan. Semua alat seperti botol kultur, petridis, gelas ukur, erlenmeyer, cawan
petri, pipet ukur, pinset, skalpel, dan alat-alat gelas lainnya terlebih dahulu
direndam dalam detergen dicuci bersih dan dibilas dengan air mengalir,
selanjutnya dikeringkan. Kemudian alat-alat seperti skalpel, pipet ukur, pinset dan
cawan petri dibungkus dengan kertas sampul coklat, sedang untuk erlenmeyer,
dan gelas ukur permukaannya ditutup dengan aluminium foil. Setelah itu, semua
botol kultur dan alat-alat dimasukkan ke dalam autoklaf pada tekanan 17,5 psi,
dengan suhu 1210C selama 60 menit. Kemudian alat-alat tersebut dimasukkan ke
dalam oven kecuali botol kultur.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah media MS dengan
menggunakan dua zat pengatur tumbuh yaitu IBA dan BAP. Tahap pertama yang
dilakukan adalah pembuatan larutan stok bahan kimia hara makro dengan
pembesaran 20x, hara mikro dengan pembesaran 200x, larutan iron dengan
pembesaran 100x, larutan vitamin dengan pembesaran 200x, sukrosa 30 g/l,
myo-inositol 0,1 g/l, dan agar 7 g/l masing-masing dalam 16 tempat. Untuk pembuatan
media 1 liter dilakukan dengan mengisi beker glass dengan aquades steril
sebanyak 500 ml. Kemudian ditambahkan larutan stok A (makro) sebanyak 50 ml,
Kemudian ditambahkan myo-inositol 0,1 gr/l dan sukrosa 30 gr/l. Kemudian
larutan ditempatkan menjadi 1600 ml. Larutan dibagi dalam empat erlenmeyer
sehingga masing-masing berisi 400 ml. Tiap erlenmeyer diberi perlakuan IBA.
Keempat erlenmeyer dibagi empat sehingga diperoleh enam belas erlenmeyer,
masing-masing berisi 100 ml. Tiap erlenmeyer diberi perlakuan BAP. Kemudian
ditambah akuades pada tiap erlenmeyer hingga erlenmeyer berisi 250 ml.
Keasaman diukur dengan pH meter. pH yang dikehendaki adalah 5,8. untuk
mengatur pH yaitu menaikkan atau menurunkan pH dapat digunakan larutan
NaOH atau HCl 0,1 N.
Selanjutnya, agar ditambahkan ke dalam erlenmeyer setiap perlakuan, lalu
dipanaskan diatas hot plate dengan pengaduk magnetik stirer sampai larutan
menjadi bening (semua agar telah larut). Media siap dipindahkan ke dalam botol
kultur berdiameter 2,5 cm yang sudah diberi label sesuai dengan perlakuan
sebanyak +25 ml/botol. Kemudian botol kultur tersebut ditutup dengan aluminium
foil. Media dalam botol tersebut disterilisasikan di dalam autoklaf dengan tekanan
17,5 Psi, suhu 121°C selama 30 menit. Selanjutnya disimpan dalam ruang kultur
sebelum digunakan.
Persiapan Ruang Kultur
Seluruh permukaan Laminar Air Flow Cabinet sebelumnya dibersihkan
terlebih dahulu dan disemprot menggunakan alkohol 70 %, kemudian dilap. Lalu
blower dihidupkan dan disterilkan dengan sinar Ultra Violet selama 1 jam
sebelum proses penanaman dilakukan. Semua alat yang akan dipakai harus
disemprot dengan alkohol 70 % sebelum dimasukkan ke dalam Laminar Air Flow
Sterilisasi Eksplan
Biji-biji kedelai direndam selama 50 menit. Biji-biji kedelai kemudian
direndam 30 menit dengan deterjen sambil digojok. Setelah itu dibilas dengan air
mengalir sebanyak 3 kali. Pekerjaan selanjutnya dilakukan di Laminar Air Flow
(LAF) yang sudah dibersihkan/disterilkan dengan alkohol 70 %. Eksplan yang
sudah bersih direndam dalam larutan fungisida Dithane M-45 2 g/l, kemudian
digojok selama 30 menit. Selanjutnya dibilas dengan aquades steril minimal
sebanyak 3 kali. Eksplan direndam dalam larutan Chlorox 20 % selama 10 menit
sambil digojok kemudian dibilas dengan aquades steril minimal sebanyak 3 kali.
Eksplan direndam dalam larutan Chlorox 10 % selama 15 menit sambil digojok
kemudian dibilas dengan aquades steril minimal sebanyak 3 kali. Eksplan
direndam dalam larutan Betadine 5 % selama 10 menit sambil digojok kemudian
dibilas dengan aquades steril minimal sebanyak 3 kali.
Penanaman
Penanaman eksplan dilakukan di LAF yang telah disterilkan dengan
alkohol 70 %. Eksplan yang akan ditanam adalah embrio dari biji kedelai. Eksplan
yang akan dikulturkan ke dalam media tanam diletakkan di petridis, dimana
embrio dipisahkan dari bagian endosperm secara hati-hati dengan menggunakan
pinset. Kemudian eksplan ditanamkan ke dalam botol media sesuai dengan
perlakuan. Setiap botol kultur terdiri dari 1 eksplan. Botol kultur diletakkan di rak
kultur di bawah cahaya.
Pemeliharaan
Botol-botol kultur yang telah ditanami eksplan diletakkan pada rak kultur
mikrooorganisme (bakteri dan jamur) yang menyebabkan terjadi kontaminasi.
Suhu ruangan kultur yang digunakan 18- 22 0C dan intensitas cahaya 2000 lux.
Peubah Amatan
Persentase Pertumbuhan Eksplan (%)
Pengamatan dilakukan pada akhir penelitian dengan rumus sebagai
berikut:
Persentase pertumbuhan eksplan = Jumlah eksplan yang tumbuh Jumlah eksplan per perlakuan
x 100%
Persentase Pertumbuhan Kalus (%)
Pengamatan dilakukan pada akhir penelitian dengan rumus sebagai
berikut:
Persentase pertumbuhan kalus = Jumlah kalus yang tumbuh Jumlah eksplan per perlakuan
x 100%
Persentase Eksplan Membentuk Tunas (%)
Pengamatan dilakukan pada akhir penelitian dengan menghitung jumlah
eksplan membentuk tunas.
Persentase eksplan membentuk tunas = Jumlah eksplan memb. tunas Jumlah eksplan per perlakuan
x100%
Jumlah Tunas (Buah)
Jumlah tunas dihitung pada akhir penelitian dengan menghitung jumlah
tunas baru yang terbentuk dari setiap eksplan.
Jumlah Daun (Helai)
Jumlah daun dihitung pada akhir penelitian dengan menghitung jumlah
Panjang akar (cm)
Diukur pada akhir penelitian dengan menggunakan penggaris atau kertas
milimeter mulai dari tempat munculnya akar (pangkal) sampai ujung akar.
Jumlah Akar (Buah)
Jumlah akar dihitung pada akhir penelitian dengan menghitung jumlah
akar yang muncul pada eksplan.
Tinggi Plantlet (cm)
Tinggi plantlet diukur pada akhir penelitian dengan menggunakan
penggaris atau kertas milimeter mulai dari pangkal batang sampai ujung daun
tertinggi pada eksplan.
Visualisasi Eksplan Membentuk Embriogenesis Somatik Secara Langsung dan Tidak Langsung
Visualisasi Eksplan Membentuk Embriogenesis Somatik Secara Langsung
dan Tidak Langsung dilihat pada akhir penelitian dengan melihat eksplan
embriogenesis somatik secara langsung (tanpa melalui kalus) dan tidak langsung
(kalus, kalus membentuk tunas, kalus membentuk akar, dan kalus membentuk
HASIL DAN PEMBAHASAN
Dari analisa data yang di lakukan diperoleh hasil bahwa pemberian IBA
berpengaruh nyata terhadap parameter persentase eksplan membentuk tunas,
jumlah tunas, jumlah daun, dan panjang akar, dan berpengaruh tidak nyata
terhadap parameter persentase pertumbuhan eksplan, persentase pertumbuhan
kalus, jumlah akar dan tinggi plantlet. Pemberian BAP berpengaruh nyata
terhadap parameter persentase eksplan membentuk tunas, jumlah tunas, jumlah
daun, panjang akar, dan jumlah akar, dan berpengaruh tidak nyata terhadap
parameter persentase pertumbuhan eksplan, persentase pertumbuhan kalus, dan
tinggi plantlet. Adapun interaksi antara IBA dan BAP berpengaruh nyata terhadap
parameter panjang akar dan jumlah akar dan berpengaruh tidak nyata terhadap
parameter persentase pertumbuhan eksplan, persentase pertumbuhan kalus,
persentase eksplan membentuk tunas, jumlah tunas, jumlah daun, dan tinggi
plantlet. Visualisasi Eksplan membentuk embriogenesis somatik terbentuk secara
tidak langsung (kalus, kalus membentuk tunas, kalus membentuk akar, dan kalus
membentuk tunas-akar).
Persentase Pertumbuhan Eksplan (%)
Berdasarkan hasil pengamatan dapat dilihat pada lampiran 1 menunjukkan
bahwa persentase pertumbuhan eksplan untuk semua perlakuan konsentrasi IBA
dan BAP sebesar 100 %. Dari pengamatan diketahui bahwa perlakuan konsentrasi
IBA, BAP, dan interaksi kedua perlakuan berpengaruh tidak nyata terhadap
persentase pertumbuhan eksplan. Hal ini diduga terjadi akibat rasio zat pengatur
Dalam kultur jaringan tanaman, kebutuhan nutrisi setiap eksplan berbeda-beda
pada tiap konsentrasi yang diberikan pada media kultur. Zulkarnain (2009)
menyatakan bahwa kebutuhan nutrisi untuk pertumbuhan kultur in vitro yang
optimal bervariasi antar spesies ataupun antar varietas. Bahkan, jaringan yang
berasal dari bagian tanaman yang berbeda pun akan berbeda kebutuhan nutrisinya.
Lubis (1985) juga menyatakan bahwa pola yang dibawa dari genetik
masing-masing tanaman telah tertentu dengan demikian potensinya untuk pertumbuhan
masa berikutnya ditentukan oleh faktor lainnya.
Persentase Pertumbuhan Kalus (%)
Berdasarkan hasil pengamatan dapat dilihat pada lampiran 2 menunjukkan
bahwa persentase pertumbuhan kalus untuk semua perlakuan konsentrasi IBA dan
BAP sebesar 100 %. Dari pengamatan diketahui bahwa pola pertumbuhan embrio
kedelai untuk menjadi tanaman lengkap dengan terlebih dahulu membentuk kalus.
Jika konsentrasi auksin dan sitokinin pada proposrsi yang sama akan membentuk
kalus. Kalus terbentuk biasanya karena adanya zat pengatur tumbuh baik auksin
maupun sitokinin, namun zat pengatur tumbuh yang paling sering terbentuknya
kalus karena dipengaruhi zat pengatur tumbuh auksin. Sesuai literatur Saigo
(1983) menyatakan bahwa jika sitokinin dan auksin pada taraf yang sama, maka
akan terbentuk kalus. Karjadi dan Buchory (2008) menyatakan bahwa pada
umumnya auksin digunakan dalam kultur jaringan untuk merangsang
pertumbuhan kalus, suspensi sel, dan organ. Sitokinin merupakan zat pengatur
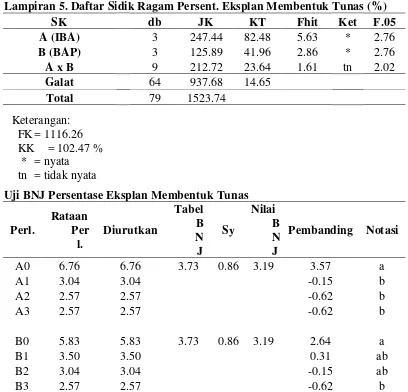
Persentase Eksplan Membentuk Tunas (%)
Data pengamatan dan sidik ragam persentase eksplan membentuk tunas
dapat dilihat pada lampiran 3-5. Dari tabel sidik ragam diketahui bahwa perlakuan
konsentrasi IBA dan BAP berpengaruh nyata terhadap eksplan membentuk tunas,
sedangkan interaksi antara kedua perlakuan berpengaruh tidak nyata terhadap
persentase eksplan membentuk tunas. Rataan persentase eksplan membentuk
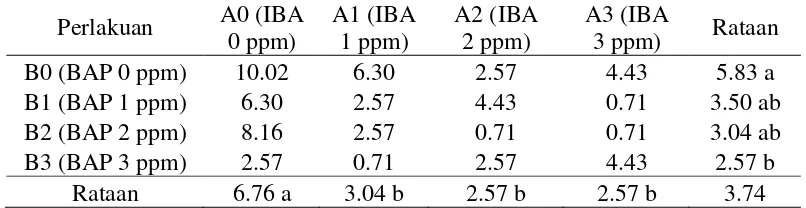
[image:44.595.115.518.320.424.2]tunas dari perlakuan konsentrasi IBA dan BAP dapat dilihat pada tabel 1.
Tabel 1. Pengaruh konsentrasi IBA dan BAP terhadap persentase eksplan membentuk tunas (%) hasil transformasi √x+0.5
Perlakuan A0 (IBA 0 ppm)
A1 (IBA 1 ppm)
A2 (IBA 2 ppm)
A3 (IBA
3 ppm) Rataan
B0 (BAP 0 ppm) 10.02 6.30 2.57 4.43 5.83 a
B1 (BAP 1 ppm) 6.30 2.57 4.43 0.71 3.50 ab
B2 (BAP 2 ppm) 8.16 2.57 0.71 0.71 3.04 ab
B3 (BAP 3 ppm) 2.57 0.71 2.57 4.43 2.57 b
Rataan 6.76 a 3.04 b 2.57 b 2.57 b 3.74
Keterangan: angka-angka yang diikuti huruf yang tidak sama menunjukkan pengaruh nyata pada uji BNJ pada taraf kepercayaan 5 % pada kolom atau baris yang sama
Berdasarkan uji BNJ pada tabel 1, persentase eksplan membentuk tunas
tertinggi terdapat pada perlakuan 0 ppm IBA (6.76 %) yang berbeda nyata
terhadap perlakuan 1 ppm (3.04 %), 2 ppm dan 3 ppm IBA (2.57 %), sedangkan
terendah pada perlakuan 2 ppm dan 3 ppm IBA (2.57 %). Pada pemberian
konsentrasi BAP persentase eksplan membentuk tunas tertinggi terdapat pada
perlakuan 0 ppm BAP (5.83 %) yang berbeda nyata pada perlakuan 3 ppm BAP
(2.57 %), tetapi berbeda tidak nyata terhadap perlakuan 1 ppm (3.50 %) dan
2 ppm BAP (3.04 %), sedangkan terendah pada perlakuan 3 ppm BAP (2.57 %).
Dari data dapat dilihat bahwa ada kecenderungan semakin tinggi
konsentrasi IBA yang diberikan maka persentase eksplan membentuk tunas yang
diberikan untuk respon pertumbuhan embrio kedelai diduga masih terlalu tinggi
sehingga proses pemanjangan sel dan pembelahan sel pada eksplan terhambat
yang menyebabkan pertumbuhannya kurang efektif. Bhojwani (1980) menyatakan
bahwa kebanyakan tanaman membutuhkan sitokinin untuk pembentukan tunas,
sebaliknya auksin bersifat menghambat. Selain itu juga ada kemungkinan
sitokinin endogen yang sudah ada di dalam eksplan sudah mencukupi untuk
pertumbuhan tunas dan daun. Sesuai literatur Kartha (1991) yang menyatakan
bahwa sitokinin dapat mempengaruhi berbagai proses fisiologis dalam sel yang
diperlukan untuk pertumbuhan tunas dan daun. Berhasilnya pertumbuhan tunas
terutama tergantung kepada sumber jaringan, kadar medium hara, jenis kadar
hormon pertumbuhan yang digunakan.
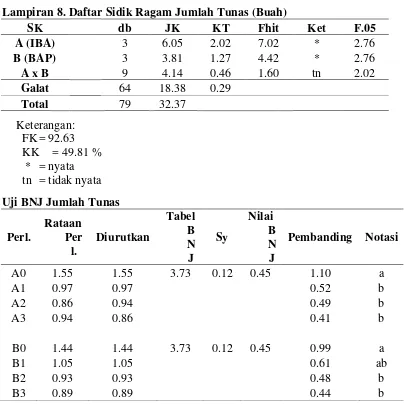
Jumlah Tunas (Buah)
Data pengamatan dan sidik ragam jumlah tunas dapat dilihat pada
lampiran 6-8. Dari tabel sidik ragam diketahui bahwa perlakuan konsentrasi IBA
dan BAP berpengaruh nyata terhadap jumlah tunas, sedangkan interaksi antara
kedua perlakuan berpengaruh tidak nyata terhadap jumlah tunas. Rataan jumlah
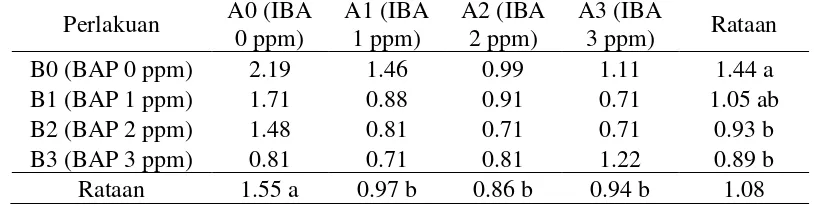
[image:45.595.107.514.570.673.2]tunas dari perlakuan konsentrasi IBA dan BAP dapat dilihat pada tabel 2.
Tabel 2. Pengaruh konsentrasi IBA dan BAP terhadap jumlah tunas (buah) hasil transformasi √x+0.5
Perlakuan A0 (IBA 0 ppm)
A1 (IBA 1 ppm)
A2 (IBA 2 ppm)
A3 (IBA
3 ppm) Rataan
B0 (BAP 0 ppm) 2.19 1.46 0.99 1.11 1.44 a
B1 (BAP 1 ppm) 1.71 0.88 0.91 0.71 1.05 ab
B2 (BAP 2 ppm) 1.48 0.81 0.71 0.71 0.93 b
B3 (BAP 3 ppm) 0.81 0.71 0.81 1.22 0.89 b
Rataan 1.55 a 0.97 b 0.86 b 0.94 b 1.08
Keterangan: angka-angka yang diikuti huruf yang tidak sama menunjukkan pengaruh nyata pada uji BNJ pada taraf kepercayaan 5 % pada kolom atau baris yang sama
Berdasarkan uji BNJ pada tabel 2, jumlah tunas tertinggi terdapat pada
(0.97 buah), 2 ppm (0.86 buah) dan 3 ppm IBA (0.94 buah), sedangkan terendah
pada perlakuan 2 ppm IBA (0.86 buah). Pada pemberian konsentrasi BAP jumlah
tunas tertinggi terdapat pada perlakuan 0 ppm BAP (1.44 buah) yang berbeda
nyata pada perlakuan 2 ppm (0.93 buah) dan 3 ppm BAP (0.89 buah), tetapi
berbeda tidak nyata terhadap perlakuan 1 ppm (1.05 buah), sedangkan terendah
pada perlakuan 3 ppm BAP (0.89 buah).
Dari data dapat dilihat bahwa ada kecenderungan semakin tinggi
konsentrasi IBA yang diberikan maka jumlah tunas yang dihasilkan semakin
rendah. Walaupun pada peubah amatan jumlah tunas terjadi kenaikan kembali
pada konsentrasi A3 (3 ppm) yaitu 0.94 buah, namun tidak signifikan. Hal ini
menunjukkan bahwa konsentrasi IBA dan BAP yang diberikan untuk respon
pertumbuhan embrio kedelai diduga masih terlalu tinggi sehingga proses
pemanjangan sel dan pembelahan sel pada eksplan terhambat yang menyebabkan
pertumbuhannya kurang efektif. Zulkarnain (2009) menyatakan bahwa pada
umumnya auksin meningkatkan pemanjangan sel, pembelahan sel dan
pembentukan akar adventif. Wilkins (1992) menyatakan bahwa selain itu auksin
berpengaruh pula pada penghambatan tunas dan dominansi apikal. Hal ini juga
diduga bahwa komposisi media MS tanpa penambahan zat pengatur tumbuh IBA
dan BAP sudah mencukupi untuk membentuk tunas dan biasanya jumlah tunas
dikuti dengan terbentuknya jumlah daun. Zulkarnain (2009) menyatakan bahwa
hal itu dikarenakan medium MS memiliki kandungan garam-garam yang lebih
tinggi daripada media lain, dibanding kandungan nitratnya juga tinggi. Fereol dkk
sedangkan kombinasi konsentrasi sitokinin yang tinggi dengan auksin rendah
penting dalam pembentukan tunas dan daun.
Jumlah Daun (Helai)
Data pengamatan dan sidik ragam jumlah daun dapat dilihat pada lampiran
9-11. Dari tabel sidik ragam diketahui bahwa perlakuan konsentrasi IBA dan BAP
berpengaruh nyata terhadap jumlah daun, sedangkan interaksi antara kedua
perlakuan berpengaruh tidak nyata terhadap jumlah daun. Rataan jumlah daun
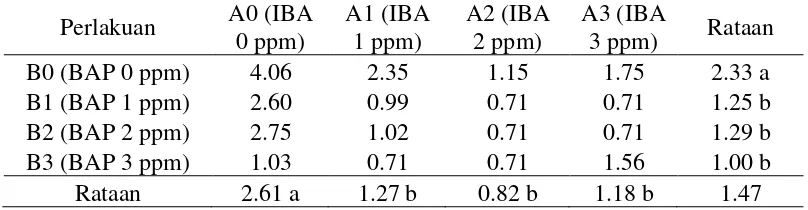
[image:47.595.111.515.334.439.2]dari perlakuan konsentrasi IBA dan BAP dapat dilihat pada tabel 3.
Tabel 3. Pengaruh konsentrasi IBA dan BAP terhadap jumlah daun (helai) hasil transformasi √x+0.5
Perlakuan A0 (IBA 0 ppm)
A1 (IBA 1 ppm)
A2 (IBA 2 ppm)
A3 (IBA
3 ppm) Rataan
B0 (BAP 0 ppm) 4.06 2.35 1.15 1.75 2.33 a
B1 (BAP 1 ppm) 2.60 0.99 0.71 0.71 1.25 b
B2 (BAP 2 ppm) 2.75 1.02 0.71 0.71 1.29 b
B3 (BAP 3 ppm) 1.03 0.71 0.71 1.56 1.00 b
Rataan 2.61 a 1.27 b 0.82 b 1.18 b 1.47
Keterangan: angka-angka yang diikuti huruf yang tidak sama menunjukkan pengaruh nyata pada uji BNJ pada taraf kepercayaan 5 % pada kolom atau baris yang sama
Berdasarkan uji BNJ pada tabel 3, jumlah daun tertinggi terdapat pada
perlakuan 0 ppm IBA (2.61 helai) yang berbeda nyata terhadap perlakuan 1 ppm
(1.27 helai), 2 ppm (0..82 helai) dan 3 ppm IBA (1.18 helai), sedangkan terendah
pada perlakuan 2 ppm IBA (0.82 helai). Pada pemberian konsentrasi BAP jumlah
daun tertinggi terdapat pada perlakuan 0 ppm BAP (2.33 helai) yang berbeda
nyata pada perlakuan 1 ppm (1.25 helai), 2 ppm (1.29 helai), dan 3 ppm BAP
(1.00 helai), sedangkan terendah pada perlakuan 3 ppm BAP (1.00 helai).
Dari data dapat dilihat bahwa ada kecenderungan semakin tinggi
konsentrasi IBA dan BAP yang diberikan maka jumlah daun yang dihasilkan
kembali pada konsentrasi A3 (3 ppm) yaitu 1.18 helai, namun tidak signifikan.
Hal ini menunjukkan bahwa konsentrasi IBA dan BAP yang diberikan untuk
respon pertumbuhan embrio kedelai diduga masih terlalu tinggi sehingga proses
pemanjangan sel dan pembelahan sel pada eksplan terhambat yang menyebabkan
pertumbuhannya kurang efektif. Selain itu dapat diduga akibat rasio ZPT yang
diberikan belum sesuai untuk mendukung proses morfogenesis. Dalam pemakaian
pada kultur jaringan tanaman, konsentrasi yang efektif untuk masing-masing ZPT
berbeda. Santi dan Kusumo (1996) menyatakan bahwa pemberian zat pengatur
tumbuh harus sesuai jenis dan konsentrasinya karena akan mempengaruhi
pertumbuhan eksplan.
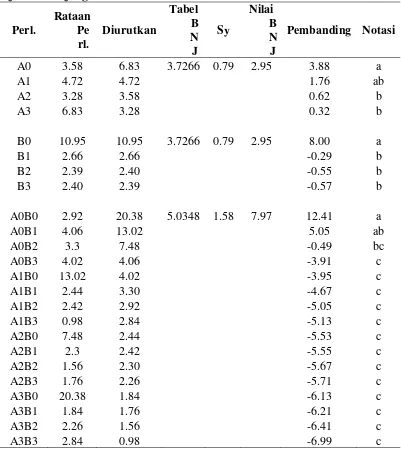
Panjang Akar (cm)
Data pengamatan dan sidik ragam panjang akar dapat dilihat pada
lampiran 12-13. Dari tabel sidik ragam diketahui bahwa perlakuan konsentrasi
IBA, BAP, dan interaksi antara kedua perlakuan berpengaruh nyata terhadap
panjang akar. Rataan panjang akar dari perlakuan konsentrasi IBA dan BAP dapat
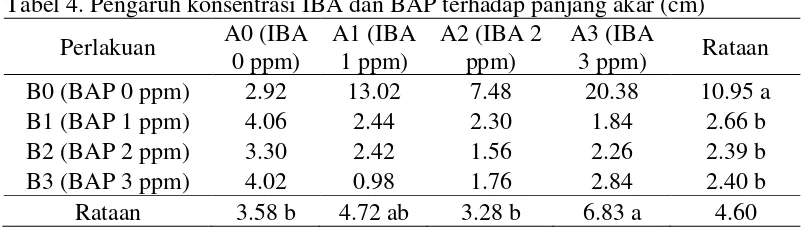
[image:48.595.111.514.531.646.2]dilihat pada tabel 4.
Tabel 4. Pengaruh konsentrasi IBA dan BAP terhadap panjang akar (cm)
Perlakuan A0 (IBA 0 ppm)
A1 (IBA 1 ppm)
A2 (IBA 2 ppm)
A3 (IBA
3 ppm) Rataan B0 (BAP 0 ppm) 2.92 13.02 7.48 20.38 10.95 a
B1 (BAP 1 ppm) 4.06 2.44 2.30 1.84 2.66 b
B2 (BAP 2 ppm) 3.30 2.42 1.56 2.26 2.39 b
B3 (BAP 3 ppm) 4.02 0.98 1.76 2.84 2.40 b
Rataan 3.58 b 4.72 ab 3.28 b 6.83 a 4.60
Keterangan: angka-angka yang diikuti huruf yang tidak sama menunjukkan pengaruh nyata pada uji BNJ pada taraf kepercayaan 5 % pada kolom atau baris yang sama
Berdasarkan uji BNJ pada tabel 4, panjang akar tertinggi terdapat pada
perlakuan 3 ppm IBA (6.83 cm) yang berbeda nyata terhadap perlakuan 0 ppm
perlakuan 1 ppm IBA (4.72 cm), sedangkan terendah pada perlakuan 2 ppm IBA
(3.28 cm). Pada pemberian konsentrasi BAP panjang akar tertinggi terdapat pada
perlakuan 0 ppm BAP (10.95 cm) yang berbeda nyata pada perlakuan 1 ppm
(2.66 cm), 2 ppm (2.39 cm), dan 3 ppm BAP (2.40 cm), sedangkan terendah pada
perlakuan 2 ppm BAP (2.39). Kombinasi kedua perlakuan panjang akar tertinggi
terdapat pada perlakuan 3 ppm IBA dan 0 ppm BAP (20.38 cm) yang berbeda
tidak nyata terhadap perlakuan 1 ppm IBA dan 0 ppm BAP (13.02 cm) dan 2 ppm
IBA dan 0 ppm BAP (7.48 cm), tetapi berbeda nyata terhadap kombinasi
perlakuan lainnya. Begitu pula dengan kombinasi perlakuan 1 ppm IBA dan
0 ppm BAP (13.02 cm) berbeda tidak nyata terhadap perlakuan 2 ppm IBA dan
0 ppm BAP (7.48 cm), tetapi berbeda nyata terhadap kombinasi perlakuan
lainnya.
Hal ini menunjukkan bahwa kerja auksin endogen dan eksogen bersinergis
dengan sitokinin endogen yang telah ada di dalam ekaplan sehingga terbentuk
akar. Telah diketahui bahwa apabila konsentrasi auksin lebih tinggi daripada
sitokinin maka akan terbentuk akar. Gunawan (1987) menyatakan bahwa
pemberian IBA akan mendorong pembentukan akar adventif. Semakin tinggi IBA
yang diberikan, maka perpanjangan akar cenderung lebih panjang. Saigo (1983)
menyatakan bahwa jika proporsi auksin lebih tinggi daripada sitokinin, maka
mendukung pembentukan akar. Hasil penelitian Palestine (2008) pada induksi
akar biakan pule pundak menunjukkan bahwa saat inisiasi akar, jumlah akar dan
panjang akar didapatkan bahwa pemberian IBA pada tanaman pule pundak yang
paling efektif adalah pada konsentrasi 3 ppm. Hal ini juga diduga komposisi
akar embrio kedelai. Sesuai literatur Wethrel (1982) yang menyatakan bahwa
formulasi yang sering digunakan sebagai media kultur adalah media MS. Media
ini merupakan kombinasi antara zat-zat yang mengandung hara makro, mikro, dan
sumber energi, serta vitamin. Semakin tinggi kandungan sitokinin eksogen yang
diberikan ditambah dengan sitokinin endogen dapat menghambat pertumbuhan
akar, seperti panjang akar. Sesuai literatur Gunawan (1987) yang menyatakan
bahwa semakin tinggi tingkat konsentrasi sitokinin akan menyebabkan regeneran
sulit berakar. Interaksi antara konsentrasi IBA dan BAP berpengaruh nyata
terhadap panjang akar pada konsentrasi 3 ppm IBA dan 0 ppm BAP diduga
kinerja auksin eksogen yang diberikan bersinergis dengan auksin dan sitokinin
endogen yang terdapat dalam eksplan. Jika konsentrasi auksin lebih tinggi
daripada sitokinin maka akan terbentuk akar dan tunas terhambat. Sesuai literatur
Gunawan (1987) menyatakan bahwa auksin seperti IBA, berperan dalam
mendorong perpanjangan sel, pembelahan sel diferensiasi jaringan xylem dan
floem, pembentukan akar adventif, dan dominan apikal. Kusumo (1994)
menyatakan bahwa dengan demikian IBA paling cocok untuk merangsang
aktifitas perakaran, karena kandungan kimianya lebih stabil dan daya kerjanya
lebih lama.
Jumlah Akar (Buah)
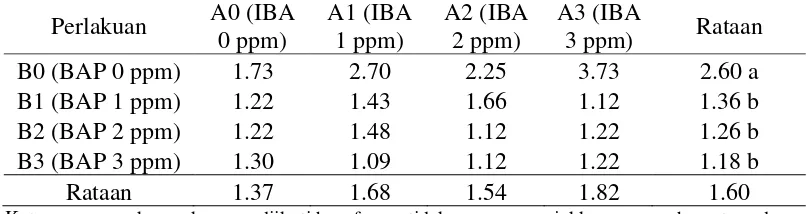
Data pengamatan dan sidik ragam jumlah akar dapat dilihat pada lampiran
14-16. Dari tabel sidik ragam diketahui bahwa perlakuan konsentrasi BAP dan
interaksi antara kedua perlakuan berpengaruh nyata terhadap jumlah akar,
akar. Rataan jumlah akar dari perlakuan konsentrasi IBA dan BAP dapat dilihat
[image:51.595.111.516.169.276.2]pada tabel 5.
Tabel 5. Pengaruh konsentrasi IBA dan BAP terhadap jumlah akar (buah) hasil transformasi √x+0.5
Perlakuan A0 (IBA 0 ppm)
A1 (IBA 1 ppm)
A2 (IBA 2 ppm)
A3 (IBA
3 ppm) Rataan
B0 (BAP 0 ppm) 1.73 2.70 2.25 3.73 2.60 a
B1 (BAP 1 ppm) 1.22 1.43 1.66 1.12 1.36 b
B2 (BAP 2 ppm) 1.22 1.48 1.12 1.22 1.26 b
B3 (BAP 3 ppm) 1.30 1.09 1.12 1.22 1.18 b
Rataan 1.37 1.68 1.54 1.82 1.60
Keterangan: angka-angka yang diikuti huruf yang tidak sama menunjukkan pengaruh nyata pada uji BNJ pada taraf kepercayaan 5 % pada kolom atau baris yang sama
Berdasarkan uji BNJ pada tabel 5, jumlah akar tertinggi terdapat pada
perlakuan 0 ppm BAP (2.60 buah) yang berbeda nyata terhadap perlakuan 0 ppm
(1.36 buah), 2 ppm (1.26 buah) dan 3 ppm BAP (1.18 buah), sedangkan terendah
pada perlakuan 3 ppm BAP (1.18 buah). Kombinasi kedua perlakuan jumlah akar
tertinggi terdapat pada perlakuan 3 ppm IBA dan 0 ppm BAP (3.73 buah) yang
berbeda tidak nyata terhadap perlakuan 1 ppm IBA dan 0 ppm BAP (2.70 buah)
dan 2 ppm IBA dan 0 ppm BAP (2.25 buah), tetapi berbeda nyata terhadap
kombinasi perlakuan lainnya. Begitu pula dengan kombinasi perlakuan 1 ppm
IBA dan 0 ppm BAP (2.70 buah) berbeda tidak nyata terhadap perlakuan 2 ppm
IBA dan 0 ppm BAP (2.25 buah), tetapi berbeda nyata terhadap kombinasi
perlakuan lainnya.
Hal ini juga diduga semakin tinggi kandungan sitokinin eksogen yang
diberikan ditambah dengan sitokinin endogen dapat menghambat pertumbuhan
akar, seperti jumlah akar dan panjang akar. Sesuai literatur Gunawan (1987) yang
menyatakan bahwa semakin tinggi tingkat konsentrasi sitokinin akan
diberikan belum sesuai untuk mendukung proses morfogenesis. Fuchs (1986)
menyatakan bahwa penambahan auksin dengan konsentrasi tertentu tidak selalu
meningkatkan pertumbuhan akar tetapi justru dapat menurunkan pertumbuhan
akar. Zulkarnain (2009) menyatakan bahwa penambahan konsentrasi yang
optimal untuk pertumbuhan akar berbeda pada masing-masing tanaman. Interaksi
antara konsentrasi IBA dan BAP berpengaruh nyata terhadap jumlah akar dengan
konsentrasi 3 ppm IBA dan 0 ppm BAP diduga kinerja auksin eksogen yang
diberikan bersinergis dengan auksin dan sitokinin endogen yang terdapat dalam
eksplan. Karjadi dan Buchory (2008) menyatakan bahwa auksin berfungsi untuk
pembentukan akar dan kuncup samping dalam konsentrasi tertentu.
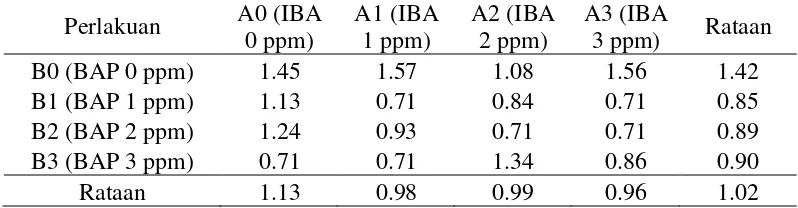
Tinggi Plantlet (cm)
Data pengamatan dan sidik ragam tinggi plantlet dapat dilihat pada
lampiran 17-19. Dari tabel sidik ragam diketahui bahwa perlakuan konsentrasi
IBA, BAP, dan interaksi kedua perlakuan berpengaruh tidak nyata terhadap tinggi
plantlet. Rataan jumlah akar dari perlakuan konsentrasi IBA dan BAP dapat
[image:52.595.111.510.555.659.2]dilihat pada tabel 6.
Tabel 6. Pengaruh konsentrasi IBA dan BAP terhadap tinggi plantlet (cm) hasil transformasi √x+0.5
Perlakuan A0 (IBA 0 ppm)
A1 (IBA 1 ppm)
A2 (IBA 2 ppm)
A3 (IBA
3 ppm) Rataan
B0 (BAP 0 ppm) 1.45 1.57 1.08 1.56 1.42
B1 (BAP 1 ppm) 1.13 0.71 0.84 0.71 0.85
B2 (BAP 2 ppm) 1.24 0.93 0.71 0.71 0.89
B3 (BAP 3 ppm) 0.71 0.71 1.34 0.86 0.90
Rataan 1.13 0.98 0.99 0.96 1.02
Keterangan: angka-angka yang diikuti huruf yang tidak sama menunjukkan pengaruh nyata pada uji BNJ pada taraf kepercayaan 5 % pada kolom atau baris yang sama
Berdasarkan uji BNJ pada tabel 6, tinggi plantlet tertinggi terdapat pada
(0.96 cm). Pada pemberian konsentrasi BAP tinggi plantlet tertinggi terdapat pada
perlakuan 0 ppm BAP (1.42 cm) dan terendah pada perlakuan 3 ppm IBA