KAJIAN AWAL PEMANFAATAN BEBERAPA IKAN
LAUT DALAM DI PERAIRAN BARAT SUMATERA
SEBAGAI SUMBER PANGAN DAN OBAT-OBATAN
Oleh :
ARIN DAMAYANTI C34101072
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
RINGKASAN
ARIN DAMAYANTI (C34101072). Kajian Awal Pemanfaatan Beberapa Ikan Laut Dalam di Perairan Barat Sumatera sebagai Sumber Pangan dan Obat-obatan. Dibimbing oleh: SUGENG HERI SUSENO
Pemanfaatan ikan pelagis di perairan selat Malaka dan laut Jawa telah mencapai tingkat lebih dari 100% atau dengan kata lain telah terjadi over fishing. Oleh karena itu perlu dilakukan alternatif penangkapan (fishing ground) baru untuk mengganti dan mempertahankan hasil tangkapan dalam pemenuhan gizi masyarakat, yaitu laut dalam. Kandungan gizi dan senyawa bioaktif yang menyebabkan ikan laut dalam dapat berfungsi sebagai obat-obat masih belum diketahui. Oleh karena itu tujuan dari penelitian ini untuk mengetahui kandungan gizi, kandungan hormon steroid dan antibakteri dari ikan laut dalam.
Untuk menentukan kandungan gizi ikan laut dalam dilakukan uji proksimat dan asam amino, sedangkan penentuan potensi ikan laut dalam sebagai obat-obatan dilakukan uji hormon steroid, antibakteri dan toksisitas.
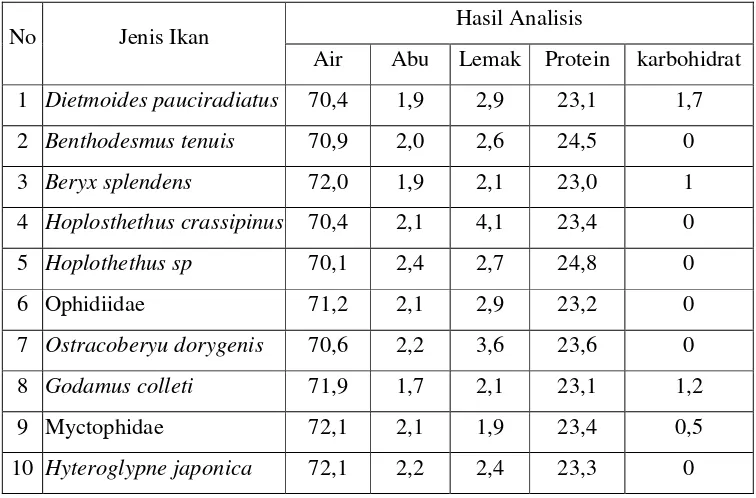
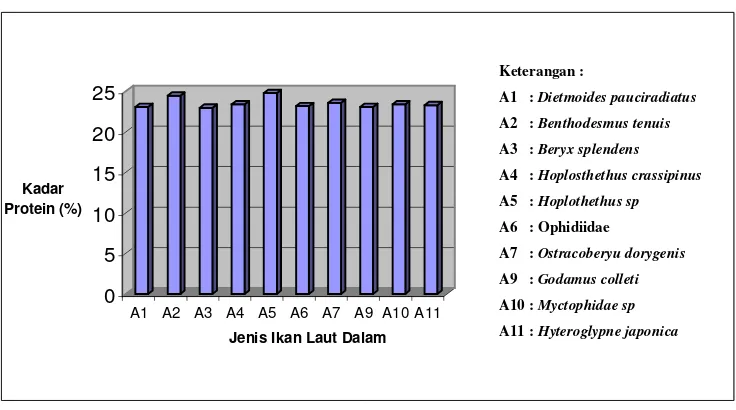
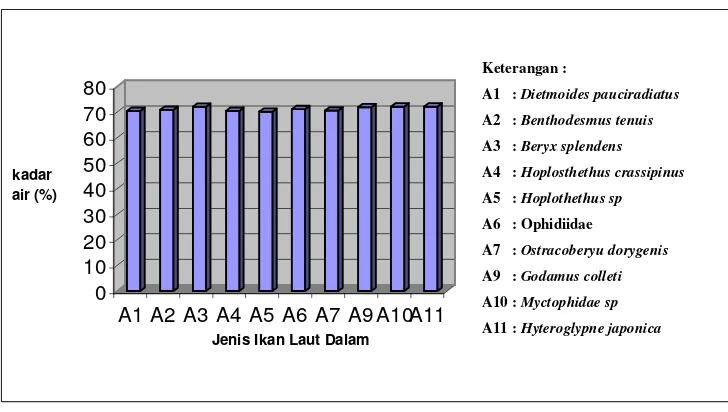
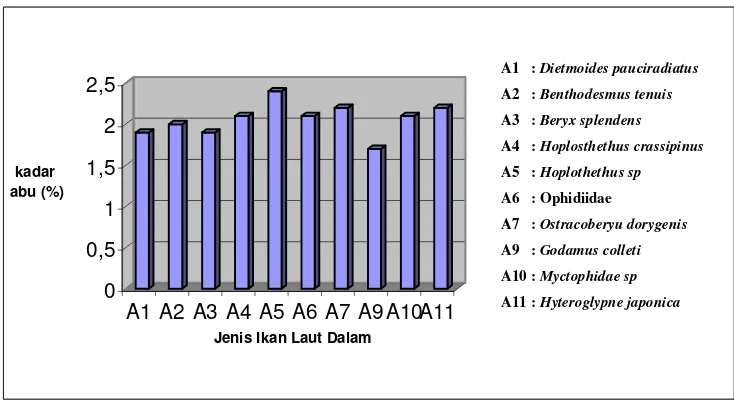
Dari hasil analisis proksimat terhadap kandungan gizi beberapa ikan laut dalam, adalah kandungan protein berkisar 23,0-24,8 %, kadar lemak berkisar 2,1-4,1 %, kadar air berkisar 70,1-72,1 % dan kadar abu berkisar 1,7-2,4%.
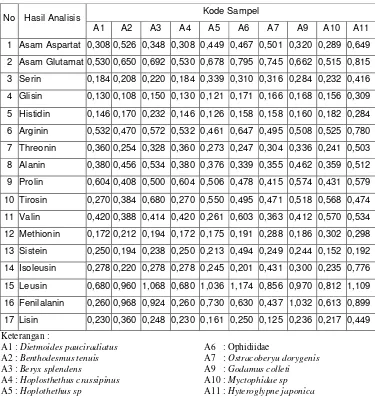
Ikan laut dalam memiliki 17 asam amino penting yang diperlukan tubuh. Sembilan diantaranya adalah asam amino essensial (Arginin, Histidin, Isoleusin, Leusin, Lisin, Metionin, Fenilalanin, Triptofan, Valin), dan delapan lainnya adalah asam amino non essensial (Asam Glutamat, Asam Aspartat, Sistein, Glutamin, Glisin, Prolin, Serin, Alanin).
Pada uji Liebermann Burchad, ikan laut dalam menunjukkan hasil positif terhadap pendugaan adanya steroid. Hasil ini diperkuat dengan uji Infrared yang menunjukkan adanya kemiripan gugus fungsi ikan laut dalam dengan steroid standar.
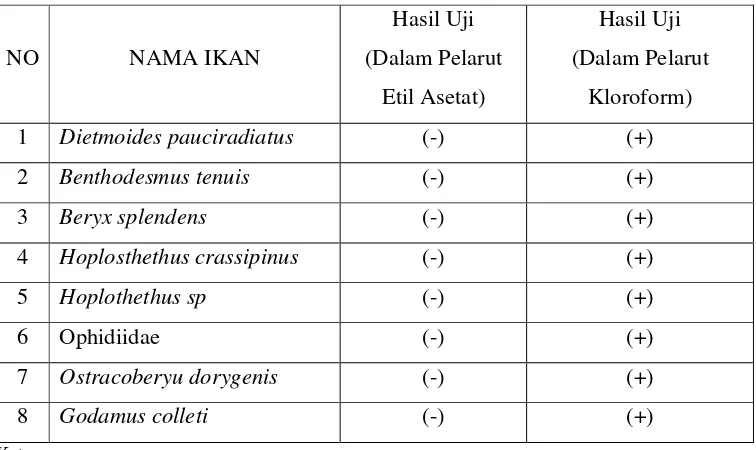
Berdasarkan uji antibakteri, hanya ekstrak dari ikan Beryx splendens yang dapat menghambat kedua bakteri uji, Escherichia coli dan Staphylococcus aureus. Ekstrak kloroform dapat menghambat pertumbuhan kedua bakteri uji, sedangkan ekstrak metanol dan etil asetat tidak menghambat pertumbuhan bakteri uji. Zona hambat ekstrak kloroform 50 ppm dari ikan Beryx splendens terhadap bakteri Staphylococcus aureus dan Escherichia coli masing-masing sebesar 2,5 dan 0,5 mm. Sedangkan zona hambat ekstrak kloroform 700 ppm sebesar 11,5 dan 3,5 mm. Aktivitas antibakteri ekstrak kloroform bersifat bakteristatik.
Tingkat toksisitas ditentukan berdasarkan LC50. Nilai LC50 menunjukkan
KAJIAN AWAL PEMANFAATAN BEBERAPA IKAN
LAUT DALAM DI PERAIRAN BARAT SUMATERA
SEBAGAI SUMBER PANGAN DAN OBAT-OBATAN
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan dan Ilmu Kelautan pada
Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor
Oleh :
ARIN DAMAYANTI C34101072
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
SKRIPSI
Judul Penelitian : KAJIAN AWAL PEMANFAATAN BEBERAPA IKAN LAUT DALAM DI PERAIRAN BARAT SUMATERA SEBAGAI SUMBER PANGAN DAN OBAT-OBATAN Nama : Arin Damayanti
Nrp : C34101072
Menyetujui, Pembimbing
Sugeng Heri Suseno, Spi,Msi. NIP 132 234 941
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Dr. Ir. Kadarwan Soewardi, MSc. NIP 130 805 031
KATA PENGANTAR
Segala puji bagi Allah swt atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian ini. Penelitian ini dapat menjadi penuntun bagi penulis dalam rangka menyelesaikan tugas akhir dan merupakan salah satu syarat untuk memperoleh gelar sarjana. Penelitian yang dilaksanakan berjudul ”Kajian Awal Pemanfaatan Ikan Laut Dalam di Perairan Barat Sumatera Sebagai Sumber Pangan dan Obat-obatan”.
Penulis mengucapkan banyak terima kasih kepada Dosen pembimbing Bapak Sugeng Heri Suseno,SPi, MSi yang telah memberikan bimbingan dalam penelitian ini, Ibu Desniar,Spi, Msi dan Ibu Ir.Nurjanah, MS selaku Dosen penguji atas kritik dan masukan yang sangat membantu. Ucapan terima kasih juga kepada Ayah dan Ibu tercinta serta anggota kelurga yang lain, karena doa dan usaha mereka penulis bisa menyelesaikan skripsi ini. Terima kasih pada para sahabat seperti Intan, Ima, Titis, Mira, Yanti, Hani serta novi yang selalu mensupport untuk bersemangat, Fanni dan Aqi, Ikwah FPIK yang tiada kenal menyerah dalam berjuang karena Allah, anak-anak MATRIX 38, THP 38, anak-anak Citra lslami, teman-teman di Darul fikri dan yang tidak dapat disebutkan satu persatu.
Saya berharap semoga karya ilmiah ini diridhoi oleh Allah serta memberikan manfaat bagi seluruh umat manusia.
Bogor, Oktober 2005
Penulis
RIWAYAT HIDUP
Penulis dilahirkan di Pontianak, 15 Februari 1983 dari ayah Surip Djunaedi dan ibu Karsiyem. Penulis merupakan putri kedua dari tiga bersaudara. Penulis sekolah dasar di SD Negeri 2, Pontianak dan sekolah menengah pertama di SMP Negeri 3, Pontianak. Kemudian penulis melanjutkan sekolah menengah umum di SMU Negeri 1 Pontianak.
Penulis masuk ke Institut Pertanian Bogor pada tahun 2001 melalui jalur Ujian Masuk Perguruan Tinggi Negeri. Penulis memilih Program Studi Teknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama sebagai mahasiswa di IPB, penulis pernah menjadi asisten mata kuliah Teknologi Pengolahan Hasil Perikanan Tradisional dan asisten Pendidikan Agama Islam. Selain di bidang non akademik, penulis juga pernah aktif di berbagai organisasi, seperti Himasilkan, Fish Processing Club dan FKM-C.
DAFTAR ISI
Halaman
KATA PENGANTAR... iv
DAFTAR ISI... vi
DAFTAR TABEL... viii
DAFTAR GAMBAR... ix
1. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Tujuan Penelitian... 2
1.3. Waktu dan Tempat ... 2
2. TINJAUAN PUSTAKA 2.1. Pembagian Zonasi Laut Dalam ... 3
2.2. Karakteristik Laut Dalam ... 4
2.3. Identifikasi Ikan Laut Dalam ... 6
2.4. Kandungan Nutrisi Ikan Laut Dalam ... 10
2.5. Analisis asam amino dengan High Ferformance Liquid Cromatography (HPLC) ... 12
2.6. Steroid ... 13
2.6.1. Struktur steroid ... 13
2.6.2. Steroid yang terdapat di alam ... 14
2.6.3. Aktivitas steroid ... 14
2.6.4. Identifikasi steroid... 14
2.6.5. Uji infra merah ... 15
2.7. Antimikroba ... 15
2.7.1. Ekstraksi senyawa antimikroba ... 16
2.7.2. Bakteri uji ... 17
2.8. Uji Toksisitas... 18
3. METODOLOGI PENELITIAN 3.1 Bahan dan Alat ... 20
3.2 Prosedur Penelitian... 20
3.2.1 Penelitian tahap pertama ... 20
3.2.1.1. Uji proksimat... 21
3.2.2. Penelitian tahap kedua... 24
3.2.2.1. Uji hormon steroid ... 24
3.2.2.2. Uji antibakteri... 27
3.2.2.3. Uji toksisitas ... 30
4. HASIL DAN PEMBAHASAN 4.1. Penelitian Tahap Pertama... 32
4.1.1. Uji proksimat... 32
4.1.2. Uji asam amino... 37
4.2. Penelitian Tahap Kedua... 40
4.2.1. Uji hormon steroid ... 40
4.2.1.1. Ekstraksi senyawa hormon steroid ... 40
4.2.1.2. Uji liebermann burchad ... 42
4.2.1.3. Uji infra merah ... 44
4.2.2. Uji Antibakteri... 55
4.2.2.1. Ekstraksi senyawa antibakteri ... 55
4.2.2.2. Uji aktivitas antibakteri ... 57
4.2.3. Uji toksisitas ... 62
5. KESIMPULAN DAN SARAN DAFTAR PUSTAKA... 74
DAFTAR TABEL
Nomor Halaman
1. Zona-zona fauna laut dalam ... 4
2. Karakteristik lingkungan laut (daerah beriklim sedang dan tropika) ... 6
3. Hasil analisis proksimat pada ikan laut dalam (%) ... 32
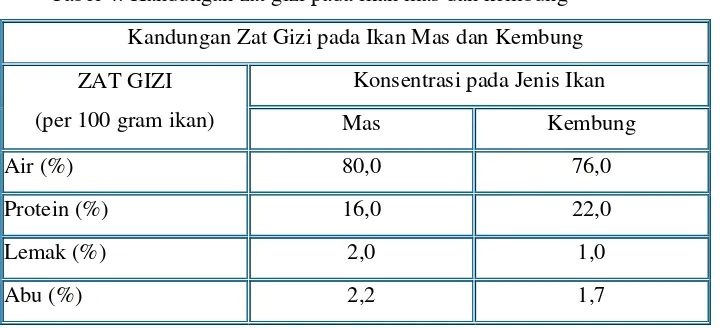
4. Kandungan zat gizi pada ikan mas dan kembung ... 34
5. Hasil analisis asam amino pada ikan laut dalam (%) ... 38
6. Rendemen hasil ekstraksi senyawa steroid ikan laut dalam... 41
7. Hasil analisis hormon steroid pada ikan laut dalam ... 42
8. Ikatan-ikatan penting absorpsi infra red (ir) ... 45
9. Ikatan-ikatan penting absorpsi infra red (ir) ikan Diretmoides pauciradiatus... 47
10. Ikatan-ikatan penting absorpsi infra red (ir) ikan Benthodesmus tenuis.. 48
11. Ikatan-ikatan penting absorpsi infra red (ir) ikan Beryx splendens... 49
12. Ikatan-ikatan penting absorpsi infra red (ir) ikan Hoplothethus crassipinus... 50
13. Ikatan-ikatan penting absorpsi infra red (ir) ikan Hoplothethus sp ... 51
14. Ikatan-ikatan penting absorpsi infra red (ir) ikan Ophidiidae... 52
15. Ikatan-ikatan penting absorpsi infra red (ir) ikan Ostracoberyu dorygenis... 53
16. Ikatan-ikatan penting absorpsi infra red (ir) ikan Godamus colleti... 54
17. Rendemen hasil ekstraksi senyawa antibakteri ikan laut dalam ... 56
18. Hasil uji antibakteri pada ikan laut dalam dengan konsentrasi 50 ppm .... 58
DAFTAR GAMBAR
Nomor Halaman
1. Klasifikasi lingkungan laut Hedgpeth (1957) ... 4
2. Struktur konformasi steroid... 13
3. Ekstraksi senyawa steroid ikan laut dalam... 26
4 Ekstraksi senyawa anti bakteri ikan laut dalam ... 28
5. Histogram persentase protein dalam ikan laut dalam... 33
6. Histogram persentase kadar lemak ikan laut dalam ... 35
7. Histogram persentase kadar air ikan laut dalam... 36
8. Histogram persentase kadar abu ikan laut dalam ... 37
9. Keberadaan hormon steroid pada pelarut kloroform... 43
10. Grafik spektrum infra merah pada standar (Norethindrone asetat)... 44
11. Aktivitas ekstrak ikan laut dalam terhadap bakteri S.aureus konsentrasi 50 ppm... 59
12. Aktivitas ekstrak ikan laut dalam terhadap bakteri E.coli konsentrasi 50 ppm... 60
13. Aktivitas ekstrak ikan laut dalam terhadap bakteri S.aureus dan E.coli konsentrasi 700 ppm... 61
14. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Dietmoides pauciradiatus... 64
15. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Benthodesmus tenuis... 65
16. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Beryx splendens... 66
17. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Hoplosthethus crassipinus... 67
18. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Hoplosthethus sp... 68
19. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Ophidiidae ... 69
20. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Ostracoberyu dorygenis... 70
KAJIAN AWAL PEMANFAATAN BEBERAPA IKAN
LAUT DALAM DI PERAIRAN BARAT SUMATERA
SEBAGAI SUMBER PANGAN DAN OBAT-OBATAN
Oleh :
ARIN DAMAYANTI C34101072
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
RINGKASAN
ARIN DAMAYANTI (C34101072). Kajian Awal Pemanfaatan Beberapa Ikan Laut Dalam di Perairan Barat Sumatera sebagai Sumber Pangan dan Obat-obatan. Dibimbing oleh: SUGENG HERI SUSENO
Pemanfaatan ikan pelagis di perairan selat Malaka dan laut Jawa telah mencapai tingkat lebih dari 100% atau dengan kata lain telah terjadi over fishing. Oleh karena itu perlu dilakukan alternatif penangkapan (fishing ground) baru untuk mengganti dan mempertahankan hasil tangkapan dalam pemenuhan gizi masyarakat, yaitu laut dalam. Kandungan gizi dan senyawa bioaktif yang menyebabkan ikan laut dalam dapat berfungsi sebagai obat-obat masih belum diketahui. Oleh karena itu tujuan dari penelitian ini untuk mengetahui kandungan gizi, kandungan hormon steroid dan antibakteri dari ikan laut dalam.
Untuk menentukan kandungan gizi ikan laut dalam dilakukan uji proksimat dan asam amino, sedangkan penentuan potensi ikan laut dalam sebagai obat-obatan dilakukan uji hormon steroid, antibakteri dan toksisitas.
Dari hasil analisis proksimat terhadap kandungan gizi beberapa ikan laut dalam, adalah kandungan protein berkisar 23,0-24,8 %, kadar lemak berkisar 2,1-4,1 %, kadar air berkisar 70,1-72,1 % dan kadar abu berkisar 1,7-2,4%.
Ikan laut dalam memiliki 17 asam amino penting yang diperlukan tubuh. Sembilan diantaranya adalah asam amino essensial (Arginin, Histidin, Isoleusin, Leusin, Lisin, Metionin, Fenilalanin, Triptofan, Valin), dan delapan lainnya adalah asam amino non essensial (Asam Glutamat, Asam Aspartat, Sistein, Glutamin, Glisin, Prolin, Serin, Alanin).
Pada uji Liebermann Burchad, ikan laut dalam menunjukkan hasil positif terhadap pendugaan adanya steroid. Hasil ini diperkuat dengan uji Infrared yang menunjukkan adanya kemiripan gugus fungsi ikan laut dalam dengan steroid standar.
Berdasarkan uji antibakteri, hanya ekstrak dari ikan Beryx splendens yang dapat menghambat kedua bakteri uji, Escherichia coli dan Staphylococcus aureus. Ekstrak kloroform dapat menghambat pertumbuhan kedua bakteri uji, sedangkan ekstrak metanol dan etil asetat tidak menghambat pertumbuhan bakteri uji. Zona hambat ekstrak kloroform 50 ppm dari ikan Beryx splendens terhadap bakteri Staphylococcus aureus dan Escherichia coli masing-masing sebesar 2,5 dan 0,5 mm. Sedangkan zona hambat ekstrak kloroform 700 ppm sebesar 11,5 dan 3,5 mm. Aktivitas antibakteri ekstrak kloroform bersifat bakteristatik.
Tingkat toksisitas ditentukan berdasarkan LC50. Nilai LC50 menunjukkan
KAJIAN AWAL PEMANFAATAN BEBERAPA IKAN
LAUT DALAM DI PERAIRAN BARAT SUMATERA
SEBAGAI SUMBER PANGAN DAN OBAT-OBATAN
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan dan Ilmu Kelautan pada
Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor
Oleh :
ARIN DAMAYANTI C34101072
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
SKRIPSI
Judul Penelitian : KAJIAN AWAL PEMANFAATAN BEBERAPA IKAN LAUT DALAM DI PERAIRAN BARAT SUMATERA SEBAGAI SUMBER PANGAN DAN OBAT-OBATAN Nama : Arin Damayanti
Nrp : C34101072
Menyetujui, Pembimbing
Sugeng Heri Suseno, Spi,Msi. NIP 132 234 941
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Dr. Ir. Kadarwan Soewardi, MSc. NIP 130 805 031
KATA PENGANTAR
Segala puji bagi Allah swt atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian ini. Penelitian ini dapat menjadi penuntun bagi penulis dalam rangka menyelesaikan tugas akhir dan merupakan salah satu syarat untuk memperoleh gelar sarjana. Penelitian yang dilaksanakan berjudul ”Kajian Awal Pemanfaatan Ikan Laut Dalam di Perairan Barat Sumatera Sebagai Sumber Pangan dan Obat-obatan”.
Penulis mengucapkan banyak terima kasih kepada Dosen pembimbing Bapak Sugeng Heri Suseno,SPi, MSi yang telah memberikan bimbingan dalam penelitian ini, Ibu Desniar,Spi, Msi dan Ibu Ir.Nurjanah, MS selaku Dosen penguji atas kritik dan masukan yang sangat membantu. Ucapan terima kasih juga kepada Ayah dan Ibu tercinta serta anggota kelurga yang lain, karena doa dan usaha mereka penulis bisa menyelesaikan skripsi ini. Terima kasih pada para sahabat seperti Intan, Ima, Titis, Mira, Yanti, Hani serta novi yang selalu mensupport untuk bersemangat, Fanni dan Aqi, Ikwah FPIK yang tiada kenal menyerah dalam berjuang karena Allah, anak-anak MATRIX 38, THP 38, anak-anak Citra lslami, teman-teman di Darul fikri dan yang tidak dapat disebutkan satu persatu.
Saya berharap semoga karya ilmiah ini diridhoi oleh Allah serta memberikan manfaat bagi seluruh umat manusia.
Bogor, Oktober 2005
Penulis
RIWAYAT HIDUP
Penulis dilahirkan di Pontianak, 15 Februari 1983 dari ayah Surip Djunaedi dan ibu Karsiyem. Penulis merupakan putri kedua dari tiga bersaudara. Penulis sekolah dasar di SD Negeri 2, Pontianak dan sekolah menengah pertama di SMP Negeri 3, Pontianak. Kemudian penulis melanjutkan sekolah menengah umum di SMU Negeri 1 Pontianak.
Penulis masuk ke Institut Pertanian Bogor pada tahun 2001 melalui jalur Ujian Masuk Perguruan Tinggi Negeri. Penulis memilih Program Studi Teknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama sebagai mahasiswa di IPB, penulis pernah menjadi asisten mata kuliah Teknologi Pengolahan Hasil Perikanan Tradisional dan asisten Pendidikan Agama Islam. Selain di bidang non akademik, penulis juga pernah aktif di berbagai organisasi, seperti Himasilkan, Fish Processing Club dan FKM-C.
DAFTAR ISI
Halaman
KATA PENGANTAR... iv
DAFTAR ISI... vi
DAFTAR TABEL... viii
DAFTAR GAMBAR... ix
1. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Tujuan Penelitian... 2
1.3. Waktu dan Tempat ... 2
2. TINJAUAN PUSTAKA 2.1. Pembagian Zonasi Laut Dalam ... 3
2.2. Karakteristik Laut Dalam ... 4
2.3. Identifikasi Ikan Laut Dalam ... 6
2.4. Kandungan Nutrisi Ikan Laut Dalam ... 10
2.5. Analisis asam amino dengan High Ferformance Liquid Cromatography (HPLC) ... 12
2.6. Steroid ... 13
2.6.1. Struktur steroid ... 13
2.6.2. Steroid yang terdapat di alam ... 14
2.6.3. Aktivitas steroid ... 14
2.6.4. Identifikasi steroid... 14
2.6.5. Uji infra merah ... 15
2.7. Antimikroba ... 15
2.7.1. Ekstraksi senyawa antimikroba ... 16
2.7.2. Bakteri uji ... 17
2.8. Uji Toksisitas... 18
3. METODOLOGI PENELITIAN 3.1 Bahan dan Alat ... 20
3.2 Prosedur Penelitian... 20
3.2.1 Penelitian tahap pertama ... 20
3.2.1.1. Uji proksimat... 21
3.2.2. Penelitian tahap kedua... 24
3.2.2.1. Uji hormon steroid ... 24
3.2.2.2. Uji antibakteri... 27
3.2.2.3. Uji toksisitas ... 30
4. HASIL DAN PEMBAHASAN 4.1. Penelitian Tahap Pertama... 32
4.1.1. Uji proksimat... 32
4.1.2. Uji asam amino... 37
4.2. Penelitian Tahap Kedua... 40
4.2.1. Uji hormon steroid ... 40
4.2.1.1. Ekstraksi senyawa hormon steroid ... 40
4.2.1.2. Uji liebermann burchad ... 42
4.2.1.3. Uji infra merah ... 44
4.2.2. Uji Antibakteri... 55
4.2.2.1. Ekstraksi senyawa antibakteri ... 55
4.2.2.2. Uji aktivitas antibakteri ... 57
4.2.3. Uji toksisitas ... 62
5. KESIMPULAN DAN SARAN DAFTAR PUSTAKA... 74
DAFTAR TABEL
Nomor Halaman
1. Zona-zona fauna laut dalam ... 4
2. Karakteristik lingkungan laut (daerah beriklim sedang dan tropika) ... 6
3. Hasil analisis proksimat pada ikan laut dalam (%) ... 32
4. Kandungan zat gizi pada ikan mas dan kembung ... 34
5. Hasil analisis asam amino pada ikan laut dalam (%) ... 38
6. Rendemen hasil ekstraksi senyawa steroid ikan laut dalam... 41
7. Hasil analisis hormon steroid pada ikan laut dalam ... 42
8. Ikatan-ikatan penting absorpsi infra red (ir) ... 45
9. Ikatan-ikatan penting absorpsi infra red (ir) ikan Diretmoides pauciradiatus... 47
10. Ikatan-ikatan penting absorpsi infra red (ir) ikan Benthodesmus tenuis.. 48
11. Ikatan-ikatan penting absorpsi infra red (ir) ikan Beryx splendens... 49
12. Ikatan-ikatan penting absorpsi infra red (ir) ikan Hoplothethus crassipinus... 50
13. Ikatan-ikatan penting absorpsi infra red (ir) ikan Hoplothethus sp ... 51
14. Ikatan-ikatan penting absorpsi infra red (ir) ikan Ophidiidae... 52
15. Ikatan-ikatan penting absorpsi infra red (ir) ikan Ostracoberyu dorygenis... 53
16. Ikatan-ikatan penting absorpsi infra red (ir) ikan Godamus colleti... 54
17. Rendemen hasil ekstraksi senyawa antibakteri ikan laut dalam ... 56
18. Hasil uji antibakteri pada ikan laut dalam dengan konsentrasi 50 ppm .... 58
DAFTAR GAMBAR
Nomor Halaman
1. Klasifikasi lingkungan laut Hedgpeth (1957) ... 4
2. Struktur konformasi steroid... 13
3. Ekstraksi senyawa steroid ikan laut dalam... 26
4 Ekstraksi senyawa anti bakteri ikan laut dalam ... 28
5. Histogram persentase protein dalam ikan laut dalam... 33
6. Histogram persentase kadar lemak ikan laut dalam ... 35
7. Histogram persentase kadar air ikan laut dalam... 36
8. Histogram persentase kadar abu ikan laut dalam ... 37
9. Keberadaan hormon steroid pada pelarut kloroform... 43
10. Grafik spektrum infra merah pada standar (Norethindrone asetat)... 44
11. Aktivitas ekstrak ikan laut dalam terhadap bakteri S.aureus konsentrasi 50 ppm... 59
12. Aktivitas ekstrak ikan laut dalam terhadap bakteri E.coli konsentrasi 50 ppm... 60
13. Aktivitas ekstrak ikan laut dalam terhadap bakteri S.aureus dan E.coli konsentrasi 700 ppm... 61
14. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Dietmoides pauciradiatus... 64
15. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Benthodesmus tenuis... 65
16. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Beryx splendens... 66
17. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Hoplosthethus crassipinus... 67
18. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Hoplosthethus sp... 68
19. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Ophidiidae ... 69
20. Grafik kematian Artemia pada berbagai konsentrasi ekstrak ikan Ostracoberyu dorygenis... 70
LAMPIRAN
Nomor Halaman
1. Contoh perhitungan senyawa asam amino pada uji asam amino ... 81
2. Hasil uji asam amino ikan standar sampel ... 82
3. Hasil uji asam amino ikan Dietmoides pauciradiatus... 83
4. Hasil uji asam amino ikan Benthodesmus tenuis... 84
5. Hasil uji asam amino ikan Beryx splendens... 85
6. Hasil uji asam amino ikan Hoplosthethus crassipinus... 86
7. Hasil uji asam amino ikan Hoplosthethus sp... 87
8. Hasil uji asam amino ikan Ophidiidae ... 88
9. Hasil uji asam amino ikan Ostracoberyu dorygenis... 89
10. Hasil uji asam amino ikan Godamus colleti... 90
11. Hasil uji asam amino ikan Myctophidae ... 91
12. Hasil uji asam amino ikan Hyteroglypne japonica... 92
13. Contoh perhitungan persen rendemen... 93
14. Contoh perhitungan konsentrasi ekstrak pada uji aktivitas antibakteri... 94
15. Contoh perhitungan konsentrasi ekstrak pada uji toksisitas dengan Artemia salina Leach ... 95
16. Grafik spektrum panjang gelombang infra merah ikan Dietmoides pauciradiatus... 96
17. Grafik spektrum panjang gelombang infra merah ikan Benthodesmus tenuis... 97
18. Grafik spektrum panjang gelombang infra merah ikan Beryx splendens... 98
19. Grafik spektrum panjang gelombang infra merah ikan Hoplosthethus crassipinus... 99
20. Grafik spektrum panjang gelombang infra merah ikan Hoplosthethus sp. 100 21. Grafik spektrum panjang gelombang infra merah ikan Ophidiidae ... 101
22. Grafik spektrum panjang gelombang infra merah ikan Ostracoberyu dorygenis... 102
23. Grafik spektrum panjang gelombang infra merah ikan Godamus colleti.. 103
1. PENDAHULUAN
1.1. Latar Belakang
Pemanfaatan ikan pelagis menurut data estimasi potensi, produksi dan tingkat pemanfaatan sumber daya ikan pelagis di Indonesia tahun 2001, di perairan selat Malaka dan laut Jawa telah mencapai tingkat lebih dari 100% atau dengan kata lain telah terjadi over fishing (BRKP 2001). Oleh karena itu perlu dilakukan alternatif penangkapan (fishing ground) baru untuk mengganti dan mempertahankan hasil tangkapan dalam pemenuhan gizi masyarakat, dimana laut dalam memiliki potensi untuk menjadi alternatif fishing ground baru.
Ikan laut dalam seperti famili Ophidiidae telah dipasarkan secara komersil untuk dikonsumsi di beberapa bagian negara seperti Amerika Serikat, Jepang, Amerika Selatan dan Eropa dalam bentuk filet segar tanpa tulang dan tanpa kulit atau filet beku, dengan rasa yang manis dan warna daging putih (Perkins 1992). Di Australia, pemanfaatan ikan laut dalam sebagai ikan konsumsi seperti ikan Beryx splendens sudah sangat optimal bahkan sudah melebihi kapasitas penangkapan (over fishing) (Info fish 2004), sedangkan ikan-ikan laut dalam di perairan Indonesia kurang terasa pemanfaatannya, penyebab utamanya adalah kurangnya informasi ekologi tentang laut dalam tersebut. Hal ini disebabkan ciri ekosistem laut yang dinamis dan kegiatan survei tidak dilakukan terus menerus dan berkesinambungan terhadap ikan laut dalam (Nybakken 1988).
Pemanfaatan ikan laut dalam di luar negeri sudah dioptimalkan dalam bidang obat-obatan. Salah satunya ikan hiu (Centrophorus atromarginatus gaman) yang hidup pada kedalaman 500 ~ 1.000 meter dimanfaatkan hatinya sebagai squalene,dalam pencegahan infeksi dan penyakit. Selain itu, tulang rawan ikan hiu berfungsi sebagai anti kanker (Miller 1913). Di dalam negeri, khususnya di daerah Banten, pemanfaatan ikan laut dalam masih dalam taraf tradisional (Suman 2005). Ikan laut dalam khususnya ikan Satyrrichtys welchii digunakan oleh masyarakat pesisir Banten sebagai obat kuat dengan cara membakar dan dilarutkan dengan air untuk dikonsumsi sebagai minuman (Suman 2005).
kuat yang terdapat pada ikan laut dalam yang diduga karena adanya senyawa-senyawa bioaktif didalamnya masih belum diketahui (Suman 2005). Oleh karena itu perlu dikaji kandungan gizi dan penemuan bahan obat-obatan baru dari ikan-ikan laut dalam.
1.2. Tujuan
Tujuan dari penelitian ini untuk mengetahui kandungan gizi, identifikasi kandungan hormon steroid serta untuk mendapatkan informasi mengenai bahan farmasi (obat-obatan) dari ikan laut dalam.
1.3. Waktu dan Tempat
2. TINJAUAN PUSTAKA
2.1. Pembagian Zonasi Laut Dalam
Yang dimaksud laut dalam adalah bagian dari lingkungan bahari yang terletak di bawah kedalaman yang dapat diterangi sinar matahari di laut terbuka dan lebih dalam dari paparan benua (>200 m) (Nybakken 1988).
Beberapa pembagian daerah (zonasi) laut dalam telah diajukan oleh banyak ilmuwan, namun sampai saat ini belum ada yang dapat diterima secara universal. Penyebab utamanya adalah kurangnya informasi ekologi tentang laut dalam tersebut. Pembagian daerah laut dalam pada umumnya dilakukan dengan membagi kolom air secara sederhana berdasarkan perubahan kedalaman, perubahan suhu, atau keduanya. Juga ada yang mencirikan berdasarkan salinitas atau berdasarkan intensitas cahaya. Cara lainnya yang biasa digunakan adalah membagi laut dalam menjadi beberapa zona berdasarkan kelimpahan, penyebaran (distribusi), dan asosiasi spesies (Nybakken 1988).
Berdasarkan asosiasi makhluk hidup terhadap lingkungan, membagi laut dalam menjadi dua zona, yaitu zona bentik (berasosiasi dengan dasar) dan zona pelagis (berasosiasi dengan kolom air). Pencirian zona tersebut juga dihubungkan dengan intensitas cahaya. Ada dua ciri zonasi laut yaitu fotik (ada cahaya) dan zona afotik (tidak ada cahaya) (Nybakken 1988). Pencirian zona tersebut selengkapnya disajikan pada Gambar 1.
Pembagian zona dari Gambar 1 kemudian dijelaskan kedalam Tabel pengklasifikasian lingkungan laut. Klasifikasi zona-zona tersebut disajikan pada Tabel 1.
Tabel 1. Zona-zona fauna laut dalam Cahaya Zona Pelagis Kisaran
Kedalaman (m)
Zona Bentik Kisaran Kedalaman
(m) Ada (fotik) Epipelagis atau
eufotik
0-200 Paparan benua atau sublitoral 0-200 Tidak ada (Afotik) Mesopelagis Batipelgis (?) Abisal pelagis (?) Hadal pelagis 200-1000 1000-4000 4000-6000 6000-10000 Batial Abisal Hadal 200-4000 4000-6000 6000-10000
Sumber : Hedgpeth, 1957 yang diacu dalam Nybakken, 1988 Catatan : (?) = Berubah-ubah.
2.2. Karakteristik Laut Dalam
Tabel 2. Karakteristik lingkungan laut (daerah beriklim subtropis dan tropika) Zona Karakteristik Epipelagis (0-100 atau 200 m) Mesopelagis
(100 atau 200
sampai 1000 m)
Batipelagis dan
lebih dalam
(sekitar 1000 m
sampai dasar)
Bentik
dangkal
(air di atas
dasar)
Bentik dalam (air
sepanjang dasar)
Intensitas
cahaya
Cukup untuk
fotosintesis
Zona twiligth Secara esensial
tidak ada cahaya
Ada bagian
yang dapat
cahaya
Secara esensial
tidak ada cahaya
dari atas Persediaan makanan Terjadi produktivitas primer
Sedikit atau tidak
ada produktivitas
primer, organisme
migrasi ke atas
untuk makanan
atau menunggu
makanan jatuh
Sedikit atau tidak
ada produktivitas
primer,
organisme
migrasi ke atas
untuk makanan atau menunggu makanan jatuh Terjadi produktivitas primer Tidak ada produktivitas primer kecuali kemosintesis; oganisme menunggu
makanan jatuh dari
atasnya
Suhu
Biasanya
sekitar 28oC
sampai 10oC;
kadang-kadang
mendekati 0oC
di musim
dingin
Biasanya sekitar
15-5oC
Biasanya antara
5oC dan –2oC;
biasanya turun
sampai 1oC atau
kurang di bawah
4000 m
Biasanya
sekitar 30oC
sampai
sekitar 10oC
Biasanya antara
15oC dan –2oC;
biasanya turun
sampai 1oC atau
kurang di bawah
4000 m Salinitas Biasanya sekitar 37-32‰ Biasanya sekitar 35-34,5‰;air tengah dari lintang tinggi memiliki salinas lebih kecil Biasanya sekitar 35-34.5‰;dan sekitar 34,52‰
di bawah 4000 m
Biasanya antara 40‰ dan 30‰ dengan runoff air tawar Biasanya sekitar 35-34,5‰; dan
34.52‰ di bawah
4000 m Kandungan oksigen Biasanya sekitar 7-3,5‰ Biasanya sekitar 5-4‰, dengan
nilai lebih kecil
dari 1 pada
oksigen minimum Biasanya sekitar 6-5‰ Biasanya sekitar 7-3.5‰, dengan beberapa supersaturasi dan daerah anoksik
Biasanya sekitar
6-4‰, dengan
mendekati kondisi
anoksik pada
daerah oksigen
minimum dan di
Kandungan nutrisi (pospat di lingkungan pelagis dan karbon organik untuk lingkungan bentik) Biasanya sekitar 0-30
mg/m3; tinggi
di daerah
upwelling
Biasanya sekitar
30-90 mg/m3
tinggi di daerah
upwelling
Biasanya sekitar
90 mg/m3
Biasanya
tinggi di
sedimen
bentik
dangkal
Biasanya rendah di
sedimen bentik
dalam, tapi tinggi
di bawah daerah
upwelling
Sumber : Pipkin et al. (1987)
2.3. Identifikasi Ikan Laut Dalam
Ikan laut dalam merupakan ikan yang berada di bagian dari lingkungan bahari yang terletak di bawah kedalaman yang dapat diterangi sinar matahari di laut terbuka dan lebih dalam dari paparan benua (>200 m) (Nybakken 1988).
Klasifikasi ikan laut dalam berdasarkan famili: 1) Myctophidae
Myctophidae adalah ikan laut dalam yang melimpah sekali pada semua lautan dan menunjukkan adanya migrasi vertikal ke lapisan atas pada malam hari. Ikan ini makan di lapisan atas dan dimakan di lapisan bawah, bertindak sebagai suatu penghubung atau perantara pada sirkulasi makanan dari lapisan atas yang kaya ke lapisan bawah yang miskin makanan (Gloerfelt, Kailola 1984).
Nama fotofor seharusnya hanya diterapkan pada suatu struktur yang spesifik yang dibentuk dari dua sisik yang dimodifikasi: satu terdiri atas sebuah “cungkup” dengan sel yang tipis dan bertumpuk mendatar, yang lain membentuk suatu lensa bikonveks pada bagian atas “cungkup”. Cahaya kebiru-biruan yang dipancarkan oleh fotofor berasal dari suatu reaksi kimia di dalam sel, ini tergantung pada daerah absorpsi maksimum dari pigmen visual ikan pada ikan-ikan laut dalam. Nama Inggrisnya Lanternfishes (Gloerfelt dan Kailola 1984). 2) Ophidiidae
Seperti “ikan putih” laut lainnya, kingklip (Ophidiidae) memiliki rasa agak manis, aromanya mild. Tekstur dagingnya kenyal, berwarna putih, keras dan padat, kadang-kadang menggantikan lophiidae, tetapi lebih lembut dengan jonjot lepas yang besar. Di pasar dapat dijumpai dalam bentuk filet segar tanpa tulang dan tanpa kulit atau filet beku. Berat keseluruhan rata-rata 20 kg walaupun ikan ini dapat tumbuh dengan panjang 6 kaki dan berat 100 kg (Perkins 1992).
Di Eropa, kingklip dipasarkan sebagai cusk eel. Di Selandia Baru disebut ling dan di Amerika Selatan disebut congrio. Di Jepang disebut kingu. Kingklip terutama dipasarkan dalam jumlah eceran dan jarang terlihat di restoran, karena kualitasnya yang bagus dan daging yang bertekstur khas. Kingklip emas, merah dan hitam dipasarkan secara internasional, tetapi di Amerika Serikat lebih menyukai yang berwarna emas dan merah (Perkins 1992). Tidak ditemukan adanya bahaya bagi kesehatan, apabila ditangani dengan baik. Ditemukan pada kedalaman 800 m (Wheeler 1975).
3) Macrouridae
Grenadir (Macrouridae) memiliki rasa yang mild (ringan) dan aroma yang harum gurih, sama dengan ikan cod tetapi lebih manis. Di pasaran bebas jarang dijumpai dalam bentuk filet beku tanpa kulit. Dagingnya berwarna putih. Beratnya berkisar antara 7-11 kg dengan panjang berkisar antara 0,6-0,76 meter. Ditemukan pada kedalaman 600 m (Perkins 1992).
suatu persoalan setelah perontok sisik menanggalkan “baju zirah” ikan tersebut (Perkins 1992).
Walaupun belum ada perikanan yang langsung mengusahakan grenadir, di Kanada spesies ini naik dan datang sebagai hasil samping jaring insang dasar dari perikanan ikan turbot di Greenland. Ikan ini memberikan gambaran yang menjanjikan sebagai ikan berwarna putih dengan rasa ringan dan dapat dipasarkan. Jika ditangani dengan benar, grenadir tidak berbahaya bagi kesehatan. Pembekuan grenadir yang hati-hati dapat memberikan daging yang kualitasnya bagus (Perkins 1992).
4) Trichiuridae
Ikan Benthodesmus tenuis merupakan famili trichiuridae yang termasuk famili kecil dari ikan-ikan laut yang berasal dari laut tropika di seluruh dunia. Umumnya habitat mereka di permukaan atau kolom air, beberapa ditemukan di kedalaman 914 m.
Tiga puluh atau lima puluh spesies dari famili ini bertubuh panjang, langsing dan pipih, dengan kepala elongate dan kulit dilapisi midabe dagger seperti gigi. Sirip dorsal di belakang kepala dan sirip tersusun hingga ke seluruh tulang belakang. Sirip anal tidak berkembang. Banyak spesies memiliki sirip ekor yang kecil, dengan bagian tubuh berujung dalam bentuk titik. Sirip pektoral berkurang. Kebanyakan dari Trichiurid yang dikenal secara luas sebagai scabbardfishes, cutlassfishes, hairtails, atau frostfish, memiliki cakupan wilayah yang luas. Beberapa dieksploitasi secara lokal sebagai makanan dan memiliki kualitas daging yang baik (Wheeler 1975).
5) Berycidae
anterior yang keras. Banyak ikan-ikan berycoid memiliki warna yang merah bersinar. Ditemukan pada kedalaman 183-732 m (Wheeler 1975).
6) Trachichthydae
Ikan Hoplotethus sp. merupakan famili dari ikan-ikan laut yang jarang kemunculan dan keberadaannya di seluruh dunia. Beberapa adalah ikan laut dalam yang ditemukan hanya di laut terbuka, tetapi beberapa ditemukan pada daerah dangkal dekat pantai. Semuanya memiliki tubuh yang besar, kepala besar dengan banyak sisik. Sirip-sirip pektoral terletak di depan perut dan punya satu sisik tajam yang besar. Sirip dorsal dan anal mengandung sisik yang tajam dan bersinar. Sisik tubuh biasanya besar dan berujung bundar serta bersinar pada perut. Ditemukan pada kedalaman 366-914 m (Wheeler 1975).
7) Centrolophidae
Ikan Hyperoglyphe japonica merupakan famili centrolophidae yang ditemukan pada laut-laut bertemperatur dingin di utara Hermiphere. Telah banyak dtemukan (dengan nama-nama ilmiah berbeda) di Atlantik Utara (Tristan dan Cunha), Afrika Selatan, selatan Australia dan New Zealand. Berbeda dengan ikan dewasa, pengetahuan tentang keberadaan ikan yang muda jarang ditemui. Hidup pada kedalaman 824 m dan tertangkap dengan trawl dasar dan longline. Dagingnya sangat lezat dan spesies ini mewakili dengan baik penelitian makanan yang tidak dimanfaatkan. Ikan ini telah dimanfaatkan di Utara Pasifik. Ikan ini tersamarkan dengan mulut yang besar dan lingkaran pada bagian atas dari kepala. Warna ikan biru baja bersinar (Wheeler 1975).
8) Diretmidae
9) Serranidae
Ikan Ostracoberyx dorygenis merupakan famili ikan laut tropikal, walaupun beberapa spesies yang lain ditemukan di laut dingin. Habitat ikan ini pada dasar perairan, walaupun beberapa merupakan spesies aktif yang bergerak yang hampir semuanya pada perairan dekat pantai. Umumnya bertubuh besar dengan kepala besar dan mulut yang lebar, memiliki dua sirip dorsal dan yang pertama tersusun dari sisik yang kuat. Memiliki 3 sisik kuat di sirip anal. Kebanyakan memiliki badan yang berskala kecil, dan linea lateralis berlanjut dari kepala hingga ekor. Banyak serranid yang hermaprodit. Beberapa spesies memiliki telur-telur dan sperma yang berkembang dalam ikan yang sama, dan pada satu spesies terjadi fertilisasi. Biasanya ikan berkelamin betina ketika muda dan berubah menjadi jantan ketika lebih dewasa. Ditemukan pada kedalaman 240-2000 m di laut Florida (Wheeler 1975).
2.4. Kandungan Nutrisi Ikan Laut Dalam
Sumber pendukung kehidupan yang berubah-ubah dan sangat kritis di laut dalam adalah pakan. Keberadaan pakan menjadi faktor penting yang membatasi jumlah spesies, kelimpahan dan biomassa di laut dalam. Ada dua sumber utama energi di laut dalam. Pertama cahaya matahari dan fotosintesis di zona eufotik. Sumber kedua adalah molekul organik yang diproduksi secara kemosintesis. Dibandingkan fotosintesis, kemosintesis lebih terbatas (Webber, Thurman 1991). Semua organisme yang hidup di bawah zona fotosintetik harus bergantung pada pakan yang jatuh dari zona di atasnya. Pakan berarti energi yang tersimpan pada materi organik, karena energi semacam itu harus dapat dimanfaatkan oleh bakteri heterotrof pada saat asimilasi yang akan menyediakan materi organik terlarut bagi organisme lainnya (Bruun 1957, Nybakken 1988 yang diacu oleh Sumich 1992).
protein dan lemak yang akhirnya dapat menyediakan sumber pakan penting bagi hewan-hewan laut dalam (Bruun 1957).
Walaupun di laut dalam tidak berlangsung proses produksi primer, namun terdapat penghubung antara produksi primer pada zona eufotik dengan zona di bawahnya. Penghubung tersebut adalah ikan lentera yang melakukan migrasi vertikal di sekitar lapisan pemberai dalam (deep scattering layer) (Marshall 1971; Gloerfelt, Kailola 1984; Nybakken 1988). Sumber pakan di laut dalam selain adanya migrasi vertikal, juga merupakan jatuhan vegetasi daratan, pelet, tinja, kitin dari krustasea, ikan, cumi-cumi dan mamalia besar (Nybakken 1988 yang diacu oleh Sumich 1992).
Sumber pakan potensial yang lain adalah bahan organik yang larut atau berbentuk koloid dan bahan yang berasal dari plankton dalam bentuk gelatin (”salju bahari”). Sumber pakan untuk hewan laut dalam yang berasal dari permukaan, bisa berupa: (1) ”hujan” plankton atau partikel organik lainnya yang jatuh ke bawah; (2) jatuhan bangkai hewan besar atau potongan tumbuhan yang dengan cepat dapat tenggelam ke dasar sebelum habis terurai oleh bakteri pemakan bangkai; (3) bakteri, yang merupakan pakan organik yang potensial bagi biota; dan (4) bahan organik terlarut (Nontji 1987).
Alasan utama memanfaatkan ikan laut dalam adalah kandungan nutrisinya. Nutrisi diartikan secara lebih luas sebagai bahan yang bukan hanya untuk dimakan, tetapi juga dimanfaatkan untuk keperluan lain seperti obat (kedokteran) atau industri. Meskipun di beberapa negara, eksploitasi ikan laut dalam sudah dimulai, namun tingkat pemanfaatannya masih rendah. Bahkan ada yang menyebutkan bahwa ikan laut dalam bukan ikan ekonomis penting. Alasannya adalah mereka terlalu kecil atau terlalu besar ukurannya, banyak tulang, atau memiliki rasa yang terlalu tajam untuk dikonsumsi oleh manusia. Sebagian besar ikan yang tidak diminta oleh industri perikanan adalah ikan oseanik dan banyak yang hidup di laut dalam (Davis 1991).
grenadir (brotulida), roughi dan black scabbard yang betul-betul dapat dimakan, walaupun bentuknya mungkin tidak indah. Saat ini ketiganya belum dapat dimanfaatkan walaupun tersedia banyak. Adanya harapan bahwa jika cukup konsumen potensial yang terdidik untuk menerima ikan ini sebagai pangan, kita dapat tanpa ragu untuk memanfaatkannya dalam kuantitas komersil. Oleh karena itu disarankan menggunakan teknologi baru untuk mendapatkan lebih banyak dari daging ikan tangkapan, yaitu dengan alat pemisah daging hingga sampai 5%. Cara ini mungkin dapat dipakai pada spesies “baru” yang sangat bertulang yaitu ikan grenadir dari laut dalam (Barton 1977).
2.5. Analisis Asam Amino dengan High Ferformance Liquid Cromatography (HPLC)
Kandungan asam amino protein dapat ditentukan melalui analisis asam amino. Salah satu analisis asam amino adalah dengan kromatografi partisi cair-cair atau sering disebut dengan metode High Performance Liquid Cromatography (HPLC). Keuntungan menggunakan HPLC adalah daya ulangnya lebih baik, waktu yang dibutuhkan singkat, dari data kelarutan hasilnya telah dapat diramalkan, koefisien distribusinya konstan dalam kisaran konsentrasi yang agak luas dan mampu memisahkan senyawa yang sangat serupa dengan baik (Adnan 1997).
Kromatografi partisi cair-cair memiliki fase stasioner (fase diam) dan fase mobil (fase gerak) yang berupa cairan atau pelarut yang tidak bercampur. Pelarut yang lebih polar biasanya digunakan sebagai fase stasioner. Secara umum dapat dikatakan bahwa kromatografi adalah suatu proses migrasi differensial dimana komponen-komponen sampel ditahan secara selektif oleh fase diam (Sudarmadji et al. 1989). Pemisahan dengan partisi dipengaruhi terutama oleh perbedaan polaritas solut yang dipisahkan. Hal ini disebabkan karena polaritas merupakan faktor yang menentukan daya larut dan terjadinya adsorpsi solut. Proses partisi sangat tergantung dari daya larut solut dalam dua macam cairan, oleh karena itu sangat peka terhadap perbedaan berat molekul solut (Adnan 1989).
yang umum digunakan yaitu HCL 6 N, menyebabkan kerusakan triptofan dan sedikit kerusakan juga terjadi pada serin dan treonin. Hidrolisis basa biasanya menggunakan NaOH 2-4 N dan tidak merusak triptofan tetapi menyebabkan deaminasi asam amino lain (Nur, Adijuwana 1992).
2.6. Steroid
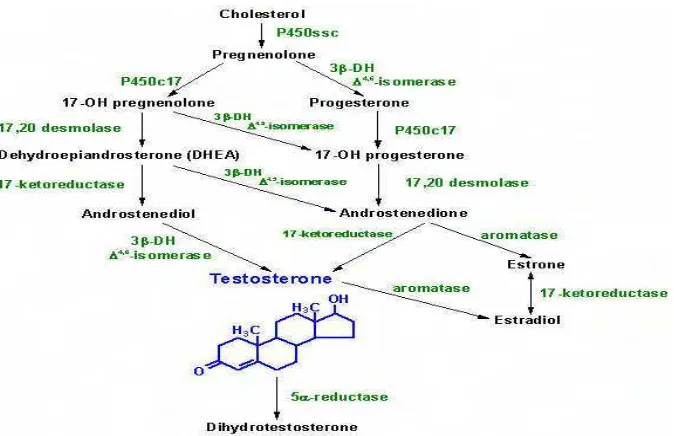
2.6.1. Struktur steroid
Secara kimia hormon diklasifikasikan menjadi empat jenis yaitu hormon peptida, hormon amina, eikosanoid dan hormon steroid (Bhagavan 1992). Semua hormon steroid berasal dari kolesterol dan berstruktur inti perhidrosiklopentanofenantren yang terbagi atas tiga cincin sikloheksana (Devlin 1993).
Steroid banyak terdapat di alam tetapi dalam jumlah yang terbatas dan mempunyai aktivitas biologis, mempunyai karakteristik tertentu yaitu:
1. Subsitusi oksigen pada atom C-3, suatu sifat khas steroid alam.
2. Subsitusi gugus metil angular pada atom C-10 dan C-13 yang dikenal dengan atom C-18 dan C-19 berturut-turut, kecuali pada senyawa steroid dengan cincin A berbentuk benzenoid seperti pada kelompok estrogen. 3. Kemungkinan subsitusi gugus alifatik (R) pada atom C-17. Subsitusi ini
memberikan dasar pembagian senyawa steroid.
[image:34.612.162.499.476.694.2]2.6.2. Steroid yang terdapat di alam
Di alam senyawa steroid terdapat pada hewan, tanaman tingkat tinggi, bahkan terdapat pula pada beberapa tanaman tingkat rendah seperti jamur (fungi). Pada hewan dapat dijumpai antara lain sebagai hormon korteks adrenal (contohnya kortikosteron), asam empedu (contohnya asam kolat), dan hormon kelamin (contohnya androgen dan estrogen) (Harborne 1973).
Hormon steroid dibentuk dari jaringan tertentu di dalam tubuh dan dibagi ke dalam dua kelas yaitu hormon adrenal dan hormon seks (testosteron, estrogen dan progesteron. Antara ketiga hormon seks ini saling berhubungan, testosteron berperan dalam pengaturan perilaku seksual jantan, sedangkan estrogen dan progesteron berperan dalam pengaturan perilaku seksual betina (Devlin 1993). Kolesterol adalah steroid yang mengandung 27 atom karbon dan memiliki titik lebur 150-1510C (Poedjiadi 1994). Waktu paruh hormon-hormon steroid alamiah di dalam tubuh hewan sangat singkat. Oleh karena itu beberapa steroid termasuk testosteron, dengan berbagai modifikasi struktur biokimianya telah disintesis untuk dipakai dalam berbagai keperluan. (Aldrich 1993).
2.6.3. Aktivitas steroid
Senyawa-senyawa steroid telah banyak dimanfaatkan sebagai obat. Berdasarkan efek farmakologisnya senyawa steroid antara lain terdiri dari :
a. Anti radang dan anti reumatoid, yaitu: Cortison, corticosteron, hidrocortison, preduison, dan triamicinolon.
b. Diuretika, anti diuretika dan anestika lokal, yaitu: aldosteron, Natrium hidroksidion dan spironolakton.
c. Kontraseptik, yaitu turunan progesteron dan turunan estron.
2.6.4. Uji steroid
kuantitatif . Kelemahan dari uji ini adalah uji ini tidak hanya digunakan untuk menentukan kolesterol tetapi juga digunakan untuk menentukan sterol lain seperti stigmasterol dan ergosterol, serta tidak dapat menentukan struktur kimia dari steroid, serta tidak dapat digunakan untuk menentukan steroid secara kuantitatif (Dence 1980).
2.6.5. Uji infra merah
Untuk mengidentifikasi steroid, Uji infrared (IR) dan uji ultra violet (UV) spektrometri merupakan uji yang paling berguna. Perbedaan antara IR dan UV spektrometri ditunjukkan dari range panjang gelombang radiasi yang diberikan. Pada spektrometer IR konvensional, panjang gelombang berjarak 2500-16.000 nm, sedangkan UV spektrometer jarak panjang gelombang biasanya berkisar 200-400 nm. UV spektrum menunjukkan struktur elektronik dari molekul, dan IR spektrum menunjukkan karakteristik vibrasi dari ikatan kimia dalam molekul.
Infrared spektrum menyediakan informasi mengenai tipe dari gugus fungsi yang terdapat dalam steroid. Pelarut yang biasa digunakan dalam IR spektrometri untuk penentuan steroid adalah kloroform, karbon tetraklorid, dan karbon disulfid. Spektrum ditunjukkan sebagai plot dari persen transmitan terhadap panjang gelombang kemudian diartikan dalam unit dari cm-1. Arti dari cm-1 adalah panjang gelombang dalam cm persatuan unit (Dence 1980).
2.7 Antimikroba
Zat antimikroba adalah senyawa biologis atau kimia yang dapat menghambat pertumbuhan atau aktivitas mikroba. Zat antimikroba khusus untuk menghambat bakteri disebut antibakteri, dapat bersifat bakterisidal (membunuh bakteri) dan bakteriostatik (menghambat pertumbuhan bakteri). Zat yang menghambat kapang disebut antikapang (Fardiaz 1992). Senyawa antimikroba adalah jenis obat yang digunakan dengan tujuan untuk membasmi mikroba (Branen, Davidson 1993).
antimikroba alami yang berasal dari hewani, tanaman maupun mikroorganisme, misalnya bakteriosin (Branen, Davidson 1993).
Efektivitas antimikroba dengan cara mengontrol pertumbuhan mikroorganisme maupun secara langsung memusnahkan seluruh atau sebagian mikroorganisme (Branen, Davidson 1993). Mekanisme zat antimikroba dalam membunuh atau menghambat pertumbuhan mikroba antara lain: (1) merusak dinding sel bakteri sehingga mengakibatkan lisis atau menghambat pembentukan dinding sel pada sel yang sedang tumbuh, (2) mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien dari dalam sel, misalnya yang disebabkan oleh senyawa fenolik, (3) menyebabkan denaturasi sel, misalnya oleh alkohol dan (4) menghambat kerja enzim didalam sel (Pelczar Reid 1977). Beberapa faktor yang mempengaruhi efektivitas antimikroba adalah: (1) jenis, jumlah, umur dan latar balakang kehidupan mikroba, (2) konsentrasi zat antimikroba, (3) suhu dan waktu kontak dan (4) sifat fisikokimia substrat (pH, kadar air, tegangan permukaan, jenis dan zat terlarut) (Frazier, Westhoff 1978).
2.7.1. Ekstraksi senyawa antimikroba
Ekstraksi merupakan suatu proses yang secara selektif mengambil zat terlarut dari campuran dengan bantuan pelarut. Teknik ekstraksi didasarkan pada kenyataan bahwa jika suatu zat dapat larut dalam dua fase yang tak tercampur, maka zat itu dapat dialihkan dari satu fase ke fase yang lain dengan mengocoknya bersama-sama. Zat terlarut yang diekstraksi dapat berada dalam medium padat atau cair. Pelarut yang digunakan untuk ekstraksi dapat bersifat polar seperti alkohol atau yang non polar seperti heksana dan kloroform. Pemilihan pelarut yang digunakan tergantung pada sifat zat yang dilarutkan, karena setiap zat memiliki daya kelarutan yang berbeda-beda dalam pelarut yang berlainan (Achmadi 1992).
Beberapa pertimbangan dalam memilih pelarut (Achmadi 1992), yaitu: 1. Pelarut polar akan melarutkan senyawa polar dan pelarut non polar akan
melarutkan senyawa non polar.
2. Pelarut organik cenderung melarutkan zat terlarut organik
4. Asam-asam organik yang larut dalam pelarut organik dapat diekstraksi ke dalam air dengan menggunakan basa (NaOH, Na2CO3 dan NaHCO3).
Beberapa zat terutama bahan alam dapat dipisahkan dari padatannya dengan ekstraksi sederhana. Teknik paling sederhana untuk mengekstraksi bahan padatan ialah dengan mencampurkannya dalam larutan pengekstraksi, dibantu dengan pengadukan menggunakan alat pengaduk, lalu dipisahkan melalui penyaringan biasa atau vakum (Achmadi 1992).
2.7.2. Bakteri uji
Pada penelitian ini digunakan 2 spesies bakteri uji yang telah diketahui bersifat patogen terhadap manusia. Bakteri uji yang digunakan adalah dari kelompok bakteri gram negatif yaitu Eschericia coli serta bakteri kelompok gram positif yaitu Staphylococcus aureus.
1)Eschericia coli
Escherichia coli pada umumnya merupakan mikroba yang secara normal terdapat pada saluran pencernaan manusia dan hewan. Habitat pada umumnya adalah tanah, lingkungan akuatik, makanan, air seni, dan tinja. Karena sifatnya yang patogen, bakteri ini dapat menyebabkan beberapa penyakit pada manusia, antara lain : menyebabkan infeksi primer pada usus (misalnya diare pada anak), infeksi pada saluran kemih, pneumonia, abses, dan meningitis pada bayi yang baru lahir. Bakteri ini berbentuk batang atau koma, bersifat anaerob fakultatif dan tergolong sebagai bakteri gram negatif. Escherichia coli termasuk famili Enterobacteriaceae, berukuran panjang 2,0-6,0 µm dan lebar 1,1-1,5 µm serta tunggal atau berpasangan. Nilai pH optimum untuk pertumbuhannya adalah 7,0-7,5 serta kisaran suhu pertumbuhannya 10-40 oC, dengan suhu optimum 37 oC dan aw optimum 0,96 (Fardiaz 1992). Bakteri ini sensitif terhadap antibiotik jenis
sulfonamid, kloramfenikol, kanamisin dan penisilin (Tortora et al. 1989).
2) Staphylococcus aureus
fermentatif dan respiratif (Pelczar, Chan 1988). Bakteri ini sering ditemukan di tanah, air tawar, kulit dan selaput lendir pada binatang berdarah panas termasuk manusia. Patogenis dari bakteri ini antara lain dapat menyebabkan infeksi kulit, infeksi paru-paru, meningitis dan diare.
2.8 Uji Toksisitas
Toksisitas adalah kemampuan suatu zat untuk menyebabkan keracunan (Koesman 1983). Toksikan adalah materi atau agen yang mampu menghasilkan efek merugikan pada sistem biologi yang menyebabkan kematian (Canadian Executing Agency 1992 yang diacu oleh Ferdiansyah 2000). Toksisitas suatu bahan dapat ditentukan dengan menganalisa besarnya (persen) kematian organisme uji (Boyd 1990).
Beberapa parameter yang mempengaruhi toksisitas diantaranya adalah temperatur, oksigen terlarut, pH, kesadahan, salinitas dan bahan organik (Sprague 1990). Toksisitas suatu bahan pencemar akan meningkat dengan meningkatnya temperatur (Herman 1972) dan mempercepat terwujudnya gejala keracunan (Metelev et al. 1983).
Uji toksisitas diperlukan untuk mengevaluasi, memonitor dan memprediksi bahaya dari zat racun bagi organisme lingkungan (Trevors 2000 yang diacu oleh Marni 2001). Banyak metode yang digunakan untuk menguji tingkat toksisitas dari suatu bahan. Metode yang digunakan pada penelitian ini yaitu uji toksisitas menggunakan Artemia salina.
Uji toksisitas dengan Artemia salina digunakan sebagai langkah awal untuk identifikasi racun jamur, toksisitas dari ekstrak tumbuhan, identifikasi adanya logam berat, racun sianobakter, pestisida dan untuk uji sitotoksisitas yang berhubungan dengan gigi dan mulut (Carballo et al. 2002).
Artemia yang digunakan dalam bentuk telur istirahat yang disebut dengan kista. Kista yang berkualitas baik akan menetas sekitar 18-24 jam. Umumnya Artemia tumbuh dengan baik pada kisaran suhu 25-30oC, kadar garam antara 30-50 ppt dan pH air laut untuk budidayanya berkisar antara 7,5-8,8 (Isnansetyo, Kurniastuty 1995 yang diacu oleh Marni 2001).
bahan untuk membunuh kultur Artemia yang telah dibiakkan dalam air laut dengan kadar salinitas tertentu (Carballo et al. 2002).
Tingkat toksisitas ditentukan dengan nilai LC50 menunjukkan konsentrasi
dari bahan kimia di lingkungan (air atau udara) yang mampu membunuh 50% dari binatang uji pada suatu waktu tertentu (CCOHS 1999). Nilai LC50 yang
diperoleh menunjukkan kategori toksisitas dari suatu bahan.
Kamrin (1997) membagi bahan toksik yang menyebabkan 50% kematian organisme uji dalam beberapa grup yaitu: (1) Toksisitas sangat tinggi, jika bahan tersebut mematikan organisme uji pada konsentrasi <100 µ/l; (2) toksisitas tinggi, jika konsentrasi yang mematikan adalah 100 µ/l hingga 1.000 µ/l; (3) toksisitas sedang jika 1.000 µ/l hingga 10.000 µ/l; (4) toksisitas rendah jika 10.000 µ/l hingga 100.000 µ/l; (5) tidak toksik jika >100.000 µ/l.
3. METODOLOGI
3.1. Bahan dan Alat
Bahan utama yang digunakan adalah beberapa ikan laut dalam yaitu: Dietmoides pauciradiatus dengan berat 190 gram dan panjang 24 cm, Ophidiidae dengan berat 60 gram dan panjang 24 cm, Benthodesmus tenuis dengan berat 60 gram dan panjang 40 cm, Ostracoberyx dorygenis dengan berat 50 gram dan panjang 13 cm, Beryx splendens dengan berat 110 gram dan panjang 14 cm, Gadomus colleti dengan berat 70 gram dan panjang 29,5 cm, Hoplosthethus crassipinus dengan berat 210 gram dan panjang 23,5 cm, Myctophidae dengan berat 25 gram dan panjang 14,8 cm, Hoplothethus sp dengan berat 1090 gram dan panjang 34,5 cm, Hyteroglypne japonica dengan berat 20 gram dan panjang 15 cm yang diperoleh dari perairan di Barat Sumatera, Samudera Hindia. Bakteri Escherichia coli dan Staphylococcus aureus digunakan sebagai bakteri uji untuk bahan antimikroba dan Artemia salina sebagai organisme uji untuk bahan toksisitas.
Sedangkan bahan pembantu yang digunakan pada penelitian ini adalah bahan kimia untuk pelarut uji yaitu aseton, metanol, etil asetat, kloroform dan medium pertumbuhan bakteri (lauria broth dan lauria agar), tablet kjelteb, larutan H2SO4, CH3COOH, NaOH, H3BO4, HCL, Buffer Kalium Karbonat,
indikator metil merah, pelarut lemak heksana, es, dan kapas bebas lemak.
Alat-alat yang digunakan adalah erlenmeyer 250 ml, labu destruksi, inkubator shaker, destruktor, destilator, titrameter, gelas piala, labu lemak, oven, desikator, selongsong soxhlet, tanur listrik, timbangan analitik, spektrofotometer, blender, kain kasa, kertas saring, erlenmeyer, sudip, corong pemisah, paper disc, petri dish, freezer, waterbath, sentrifuse, clean banch, autoclave, rotary vacum, tabung reaksi, labu evaporator, sintered glass, Infrared spektrofotometer, membran filter 0,045 µm dan HPLC.
3.2. Prosedur Penelitian
3.2.1. Penelitian tahap pertama
pada tahap ini dilakukan pengujian beberapa ikan laut dalam dengan menggunakan uji proksimat dan analisis asam amino.
3.2.1.1. Uji proksimat
Analisa yang dilakukan meliputi kadar protein, lemak, air dan abu. a. Kadar Air (Apriyantono dkk 1989)
Cawan porselin dikeringkan pada suhu 102-105oC selama kurang lebih 10-12 jam. Kemudian cawan diletakkan dalam desikator (± 30 menit), ditimbang (A gram). Lalu cawan ditimbang dengan contoh yang sudah dihomogenkan (B gram), dengan kertas sampel contoh sebanyak 5 gram. Setelah itu dikeringkan dalam oven pada suhu 102-105oC selama kurang lebih 3-5 jam. Cawan diletakkan ke dalam desikator dan ditimbang ( C gram).
Perhitungan:
%
×
100
%
−
−
=
A
B
C
B
KadarAir
Keterangan: A = Cawan porselin (gr) B = Cawan berisi sampel (gr) C = Cawan berisi sampel kering (gr) b. Kadar Abu (Apriyantono dkk 1989)
Cawan porselin dipijarkan sampai merah dalam tungku pengabuan bersuhu sekitar 650oC selama 1 jam. Setelah suhu tungku turun menjadi sekitar 200oC, cawan didinginkan dalam desikator selama 30 menit dan ditimbang (A gram). Lalu cawan berisi sampel sebesar 5 gram ditimbang (B gram) dan dimasukkan ke dalam tungku pengabuan dan diatur suhu secara bertahap hingga suhu 650oC dilakukan pengabuan hingga abu berwarna putih. Setelah tungku pengabuan turun menjadi sekitar 200oC. Cawan didinginkan selama 30 menit dan ditimbang beratnya (C gram).
Perhitungan: % 100 % × − − = A B A C Abu
c.Kadar Protein (Apriyantono dkk 1989) a). Destruksi
Sampel ditimbang sebanyak 0,3 gram dan dimasukkan ke dalam tabung Kjelteb. Dimasukkan satu buah tablet Kjelteb ke dalam tabung tersebut, tablet Kjelteb disini berfungsi sebagai katalisator. Adapun reaksi yang terjadi:
Komponen Nitrogen Organik H2SO4 CO2 + H2O + (NH4)2SO4 Katalis
(Kjeltab)
Bahan katalis yang sering digunakan antara lain merkuri (Hg), Ag atau Selenium (Se). Tablet Kjeltab tersebut terdiri dari campuran unsur K2SO4 dan Se.
Kemudian dilakukan destruksi hingga warna larutan berubah menjadi bening. b). Destilasi
Labu hasil destruksi didinginkan dan dimasukkan ke dalam labu penyuling, kemudian diencerkan dengan 200 ml air yang tidak mengandung nitrogen dan ditambahkan beberapa butir batu didih serta 100 ml NaOH agar larutan menjadi basa. Labu penyuling dipasang dengan cepat diatas alat penyuling. Proses ini berlangsung sampai semua nitrogen tertangkap oleh H2SO4
yang ada di dalam Erlenmeyer atau bila 2/3 bagian dari cairan dalam labu telah menguap.
c). Titrasi
HCl dimasukkan ke dalam buret, lalu dilakukan titrasi hingga warna larutan pada erlenmeyer berubah menjadi merah muda, kemudian dicatat volume HCl yang digunakan:
D
C B A N =14,01×( − )× %
% Protein = % Nitrogen x faktor konversi (6,25)
Keterangan: A = ml titrasi C = Molaritas asam standar
d. Kadar Lemak (Apriyantono dkk 1989)
Sampel atau contoh yang sudah disampelkan ditimbang sebanyak 3 gram (W1), lalu dibungkus dengan kertas saring dengan bagian atas dan bawah diberi kapas bebas lemak lalu disiapkan labu lemak yang sudah diketahui beratnya (W2) dan disambung dengan tabung Soxhlet. Selongsong dimasukkan ekstraktor tabung Soxhlet, lalu disiram dengan pelarut lemak (Petroleum benzene). Setelah itu dilakukan ekstraksi selama 16 jam pada suhu sekitar 40oC. Setelah ekstraksi selesai, dikeluarkan selongsong yang berisi sampel. Pelarut lemak yang ada dalam labu lemak didestilasi sehingga semua pelarut lemak menguap, kemudian labu lemak dikeringkan dalam oven pada suhu 105oC selama 3-5 jam.
Labu lemak yang sudah didinginkan ditimbang dalam desikator sampai berat konstan (W3).
% 100 1
2 3
% = − ×
W W W Lemak
Keterangan : W1 = Sampel (gr) W2 = Labu lemak (gr)
W3 = Labu lemak berisi ekstrak (gr) e.Kadar Karbohidrat (Winarno 1992)
Kadar karbohidrat diperoleh dengan menghitung selisih dari empat komponen yaitu kadar air, protein, lemak dan abu. Perhitungannya sebagai berikut:
% Karbohidrat = 100% - (% air + % lemak + % protein + % Abu)
3.2.1.2. Uji asam amino (Nur et al. 1992)
Ikan laut dalam dianalisis lebih lanjut dengan metode High Performance Liquid Cromatography (HPLC). Sebelum dianalisis, sampel dihidrolisis dengan asam yaitu dengan cara 10 gram sampel ditimbang dalam tabung reaksi bertutup lalu ditambahkan 1,5 ml HCL 6N. Sampel diendapkan dalam larutan HCl, kemudian dialiri gas N2 yang berfungsi untuk mencegah oksidasi. Tabung lalu
Hasil hidrolisis dipindahkan kedalam labu evaporator dan disaring dengan Sintered Glass sambil dibilas dengan air High Pure (HP) secukupnya. Hasil penyaringan dikeringkan dengan pompa vakum selama 10 menit, lalu ditambahkan 10 ml HCl 0,01 N ke dalam sampel dan disaring kembali dengan membran filter berukuran 0,045 µm.
Sekitar 12,5 µm sampel diinjeksikan ke dalam tabung vial dan ditambahkan 12,5 µl buffer kalium borat pH 10,4 (perbandingan 1:1), lalu dicampur hingga homogen. Campuran tersebut diambil lima mikroliter dan dimasukkan ke tabung vial yang lain, lalu ditambahkan 25 µl pereaksi OPA, biarkan selama satu menit agar proses derivatisasi sempurna. Sekitar lima mikroliter sampel diinjeksikan ke dalam kolom HPLC dan ditunggu sampai pemisahan semua asam amino selasai. Waktu yang diperlukan sekitar 25 menit. Pengerjaan pada tahap penambahan pereaksi OPA sampai pemisahan asam amino selesai dilakukan secara otomatis. Persentasi asam amino dalam 100 gram ikan laut dalam dapat dihitung dengan rumus:
luas area contoh
x konsentrasi standar x 10 ml x BMA x 100 luas area standar
% asam amino =
bobot sampel
Ket: BMA = berat molekul asam amino
3.2.2. Penelitian tahap kedua
Untuk mendapatkan informasi mengenai kandungan hormon steroid dan farmasi dari ikan laut dalam, dilakukan uji hormon steroid, uji antimikroba dan uji toksisitas.
3.2.2.1. Uji hormon steroid
1) Ekstraksi steroid (Touchstone dan Kasparow 1970 yang diacu oleh Riris 1994).
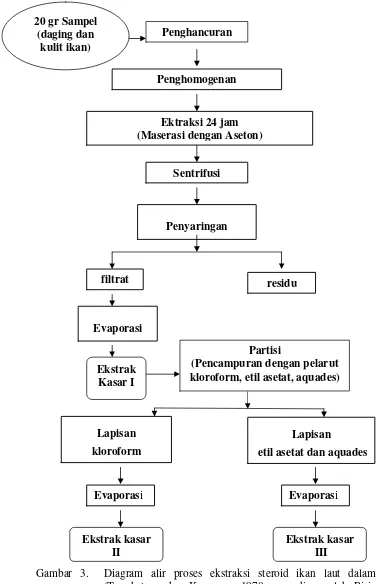
10 menit. Endapan yang diperoleh dipisahkan dari fase cairnya. Fase cairnya kemudian diuapkan dalam penangas air pada suhu 400C. Residu yang diperoleh dipartisi atau diekstraksi 2 kali dalam larutan etil asetat, kloroform dan air (1:1:1) dengan menggunakan corong pisah sehingga terbentuk dua lapisan. Larutan pengekstrak (lapisan bawah, kloroform dan lapisan atas, etil asetat) diuapkan dalam penangas air pada suhu 400C sampai kering. Ekstrak ini yang kemudian digunakan untuk identifikasi steroid. Proses ekstraksi steroid disajikan pada Gambar 3.
2) Identifikasi steroid
Identifikasi steroid dilakukan dengan uji Liebermann Burchad dan uji Infrared.
a. Uji Liebermann Burchad (Cook 1958 yang diacu oleh Riris 1994).
Uji ini dilakukan dengan cara penambahan beberapa tetes asam asetat anhidrat dan 0,5 ml kloroform pada sedikit ekstrak ikan laut dalam, lalu diaduk. Selanjutnya ditambahkan satu tetes asam sulfat pekat. Timbulnya warna hijau menunjukkan bahwa ekstrak tersebut memberikan hasil yang positif atas keberadaan golongan sterol.
b. Uji Infra Merah (Florey 1975 yang diacu olehPrijanto 1984).
Gambar 3. Diagram alir proses ekstraksi steroid ikan laut dalam (Touchstone dan Kasparow 1970 yang diacu oleh Riris 1994).
Penghancuran
Penghomogenan
Penyaringan Ektraksi 24 jam (Maserasi dengan Aseton)
Sentrifusi
residu
Lapisan kloroform
Lapisan etil asetat dan aquades
Evaporasi filtrat
Ekstrak kasar II 20 gr Sampel
(daging dan kulit ikan)
Evaporasi
Ekstrak Kasar I
Partisi
(Pencampuran dengan pelarut kloroform, etil asetat, aquades)
Evaporasi
[image:47.612.131.508.78.662.2]3.2.2.2. Uji antibakteri
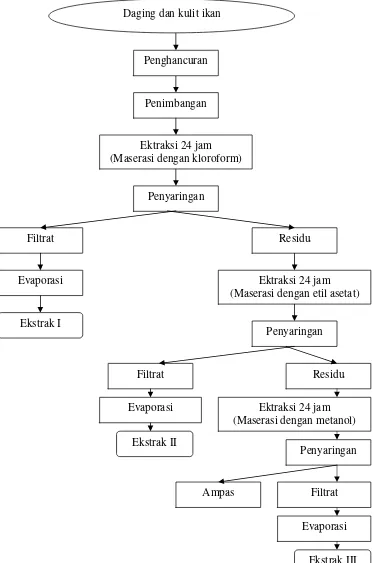
1) Ekstraksi senyawa antibakteri ikan laut dalam (Quinn 1988 yang diacu oleh Darusman dkk 1995)
Untuk mengisolasi komponen antibakteri dari ikan laut dalam, perlu dilakukan ekstraksi. Sebelum proses dimulai, ikan laut dalam yang baru dipanen dibersihkan dengan air tawar, disortir dari kotoran, kemudian dipisahkan antara isi perut dengan daging dan kulit.
Daging dari ikan laut dalam dipotong kecil-kecil dengan pisau, kemudian dihancurkan dengan mortar dan ditimbang.
Masing-masing bahan dicampur dengan pelarut pertama yaitu kloroform dan dilakukan maserasi pertama selama 24 jam untuk memastikan senyawa antibakteri yang terkandung dalam ikan keluar dan terlarut dalam pelarut. Selama ekstraksi, bagian atas wadah ditutup dengan kertas aluminium foil untuk mencegah kemungkinan menguapnya kandungan senyawa volatil dalam bahan. Ekstrak disaring dengan kertas saring whatman 42. Penyaringan ini dimaksudkan untuk memperoleh filtrat pertama yang terbebas dari ampas dan kotoran. Ampas pertama dimaserasi lagi dengan etil asetat, disaring, dan diperoleh filtrat kedua. Selanjutnya ampas kedua dimaserasi lagi dengan metanol selama 24 jam dan disaring sampai didapat filtrat ketiga.
Daging dan kulit ikan
Penghancuran
Penimbangan
Ektraksi 24 jam (Maserasi dengan kloroform)
Penyaringan
Filtrat
Filtrat
Penyaringan Ektraksi 24 jam (Maserasi dengan etil asetat)
Residu
Penyaringan Residu Evaporasi
Evaporasi Filtrat Ektraksi 24 jam (Maserasi dengan metanol) Evaporasi
[image:49.612.135.509.81.644.2]Ampas
Gambar 4. Diagram alir proses ekstraksi senyawa bioaktif ikan laut dalam (Quinn 1988 yang diacu oleh Darusman et al. 1995)
Ekstrak III Ekstrak I
2) Uji zat antibakteri dari ikan laut dalam (Sherley 1998).
Langkah-langkah yang dilakukan pada tahap pengujian aktivitas zat antibakteri adalah sebagai berikut :
a. Persiapan bakteri uji
Biakan masing-masing bakteri uji diremajakan dalam media cair (lauria broth). Komposisi lauria broth (tripton 1 gram, yeast extract 0,5 gram dan NaCl 1,5 gram) dilarutkan dalam 100 ml akuades dengan pH 7,0. Media tersebut dihomogenkan dengan menggunakan hotplate pada suhu 100oC sampai mendidih dan dipipet 10 ml ke dalam tabung reaksi yang kemudian ditutup dengan menggunakan kapas dan kasa steril. Media tersebut kemudian disterilisasi pada 121oC selama 15 menit dalam keadaan terbungkus plastik. Media didinginkan pada suhu ruang. Dengan menggunakan jarum ose, biakan diambil satu ose secara aseptik dimasukkan ke dalam media cair, di shaker pada suhu 37 oC dengan kecepatan agitasi 90 rpm Setelah mencapai fase log (berdasarkan penelitian tahap pengkulturan bakteri uji), masing-masing bakteri uji siap dipakai.
b. Persiapan ekstrak ikan laut dalam
Masing-masing ekstrak dari bagian daging dan kulit dilarutkan dalam pelarut uji yaitu metanol, etil asetat, dan kloroform dengan konsentrasi masing-masing 50 ppm dan 700 ppm. Untuk kontrol positif digunakan kloramfenikol dengan konsentrasi 4 ppm dan untuk kontrol negatif digunakan masing-masing pelarut uji. Kemudian dengan menggunakan pipet mikro ekstrak yang telah dicampur dengan pelarut diteteskan sebanyak 20µl pada paper disc yang berdiameter 6 mm.
c. Pengujian aktivitas ekstrak ikan laut dalam (Bauer et al. 1966 yang diacu oleh Jamal et al. 2003)
Pengujian aktifitas antibakteri dilakukan dengan metode difusi agar. Suspensi masing-masing bakteri uji diambil sebanyak 20µl dengan OD550 nm
menggunakan kapas dan kasa steril. Kasa steril digunakan untuk mengikat kapas agar tetap menyatu. Media tersebut kemudian disterilisasi pada 121oC selama 15 menit dalam keadaan terbungkus plastik. Media didinginkan pada suhu ruang. Kemudian ke dalam tiga tabung reaksi berisi media dimasukan bakteri E. coli dan tiga tabung reaksi lainnya bakteri S.aureus masing-masing sebanyak 20µl. Setelah itu masing-masing tabung dihomogenkan dengan vortex kemudian dituangkan ke dalam cawan petri, digoyang secara perlahan hingga merata. Selanjutnya agar disimpan dalam refrigerator dengan posisi terbalik dalam beberapa saat untuk menunggu pembuatan ekstrak dalam paper disc. Kemudian di atas media agar diletakkan paper disc yang telah berisi ekstrak.
Agar diinkubasikan selama 12-18 jam pada temperatur 370C pada posisi terbalik. Setelah inkubasi aktivitas antibakteri dapat diamati, diameter daerah penghambatan yang terbentuk pada cawan petri diukur dengan cara mengukur diameter hambatan yang terbentuk di sekeliling paper disc dikurangi diameter paper disc, yaitu 6 mm.
3.2.2.3. Uji toksisitas dengan artemia salina leach (Michael et al. 1956 yang diacu oleh Carballo et al. 2002).
Metode ini terdiri atas dua tahap, yaitu proses penetasan Artemia yang masih dalam bentuk kista dan uji toksisitas.
1) Penetasan artemia
Artemia yang digunakan masih dalam bentuk telur istirahat yang disebut kista sehingga diperlukan prose