KERAGAMAN KOMUNITAS BAKTERI
YANG BERPERAN DALAM SIKLUS NITROGEN
DI SITU SAWANGAN-BOJONGSARI, JAWA BARAT
LENA NOVITA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman Komunitas Bakteri yang Berperan dalam Siklus Nitrogen di Situ Sawangan-Bojongsari, Jawa Barat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Lena Novita NIM G351100111
RINGKASAN
LENA NOVITA. Keragaman Komunitas Bakteri yang Berperan dalam Siklus Nitrogen di Situ Sawangan-Bojongsari, Jawa Barat. Dibimbing oleh IMAN RUSMANA dan TRI WIDIYANTO.
Salah satu permasalahan yang sering dihadapi dalam pengelolaan ekosistem perairan darat diantaranya penurunan kualitas air yang disebabkan polusi senyawa nitrogen. Mekanisme transformasi senyawa nitrogen oleh bakteri indigenous yang terjadi pada badan air merupakan faktor penting untuk diperhatikan dalam upaya menangani dan mengantisipasi permasalahan tersebut. Situ Sawangan-Bojongsari merupakan situ terluas di kota Depok, Jawa Barat. Kegiatan antropogenik sekitar situ dapat menyebabkan polusi senyawa nitrogen. Penelitian ini bertujuan untuk mengetahui kelimpahan dan keragaman komunitas bakteri yang berperan dalam siklus nitrogen serta profil parameter fisika dan kimia yang mempengaruhinya.
Sampel air dan sedimen diambil dari 3 titik dengan masing-masing 3 ulangan. Pengambilan sampel air dilakukan pada 3 titik dengan 3 strata kedalaman yaitu permukaan (0 cm), kedalaman secchi (110) cm, dan dasar (230 cm). Pengambilan sampel sedimen juga dilakukan pada titik dengan 3 strata kedalaman yaitu 0-2 cm, 2-5 cm, dan 5-10 cm. Analisis fisika dilakukan pada saat pengambilan sampel yang meliputi pengukuran parameter suhu, pH, dan oksigen terlarut. Analisis kimia air dan air pori sedimen meliputi parameter TN, TP, TOM, DOM, TOC, N-NH3, N-NO3, dan N-NO2. Analisis kelimpahan bakteri yang berperan dalam siklus N dilakukan menggunakan metode MPN. Analisis keragaman bakteri dilakukan menggunakan DGGE. Produk amplifikasi gen nifH, amoA, dan nosZ dijadikan sebagai target untuk analisis DGGE.
Kelimpahan tertinggi bakteri pemfiksasi nitrogen terdapat di sedimen pada strata 2-5 cm (4.43 Log sel/g) dan kelimpahan terendah terdapat pada kolom air strata 0 cm (2.46 Log sel/mL). Bakteri pengoksidasi amonium dan nitrit hanya terdapat pada bagian kolom air. Kelimpahan tertinggi bakteri pengoksidasi amonium terdapat pada strata 0 cm (2.43 Log sel/mL) dan kelimpahan terendah terdapat pada strata 230 cm (1.86 Log sel/mL). Kelimpahan tertinggi bakteri pengoksidasi nitrit terdapat pada strata 0 cm (2.87 Log sel/mL) dan kelimpahan terendah terdapat pada strata 230 cm (1.48 Log sel/mL). Kelimpahan tertinggi bakteri pereduksi nitrat- denitrifikasi terdapat pada sedimen dengan strata 2-5 dan 5-10 cm (6.04 Log sel/g) dan kelimpahan terendah terdapat pada strata 0 cm (1.32 Log sel/mL). Kelimpahan tertinggi bakteri pereduksi nitrat-DNRA terdapat pada sedimen strata 5-10 cm (4.32 Log sel/g) dan kelimpahan terendah terdapat pada kolom air strata 0 dan 110 cm (1.56 Log sel/mL). Kelimpahan tertinggi bakteri amonifikasi terdapat pada sedimen dengan strata 5-10 cm (4.43 Log sel/g) dan kelimpahan terendah terdapat pada strata 0 cm (1.86 Log sel/ml).
dan keenam isolat gen tersebut memiliki identitas dan score value tertinggi dengan gen nifH dari uncultured bacterium (80-90%). Hasil analisis kemiripan sekuen asam amino dari gen nifH tersebut menunjukkan bahwa keenam isolat gen nifH memilki kemiripan antara 65 dan 92% dengan protein fungsional dai nifH (nitrogenase). Sebanyak 5 isolat gen nifH merupakan nitrogenase reductase dari uncultured bacterium dan 1 isolat gen nifH merupakan nitrogenase reductase dari Methylomonas sp. MKI. Analisis filogenetik menunjukkan bahwa keenam isolat gen nifH diantaranya memiliki kekerabatan terdekat dengan kelompok bakteri α atau
proteobakteria yaitu Bradyrhizobium sp. ORS324, Azospirillum brasilense, dan Azotobacter vinelandii.
Fragmen gen amoA hanya dapat teramplifikasi dari sampel air. Tidak ada fragmen gen amoA dari sampel sedimen. Total sebanyak 10 pita DNA gen amoA unik dihasilkan setelah DGGE. Sebanyak 6 dari 10 pita DNA gen amoA berdasarkan analisis BlastN merupakan amoA dari uncultured bacterium (86-97%). Analisis sekuen asam amino keenam isolat gen amoA menunjukkan kemiripan antara 56 dan 93% dengan protein fungsional dari amoA (amonia monooksigenase). Sebanyak 5 isolat gen merupakan amonia monooksigenase dari uncultured bacterium dan 1 isolat gen merupakan amonia monooksigenase dari bakteri Nitrosospira sp. III7 (93%). Berdasarkan analisis filogenetik keenam isolat gen amoA memiliki kekerabatan paling dekat dengan genus Nitrosospira.
Fragmen gen nosZ hanya teramplifikasi dari sampel sedimen dan tidak ada fragmen gen nosZ dari sampel air. Total sebanyak 12 pita DNA gen nosZ unik terdeteksi setelah analisis DGGE. Sebanyak 7 dari 12 pita DNA telah diisolasi dan analisis BlastN dari isolat gen tersebut menunjukkan bahwa ketujuh isolat gen merupakan nosZ dari uncultured bacterium (91-98%). Analisis kemiripan sekuen asam amino dari ketujuh isolat gen nosZ menunjukkan kemiripan antara 87 dan 99% dengan protein fungsional dari nosZ (nitrous oksida reduktase) dan ketujuh isolat gen nosZ merupakan nitrous oksida reduktase dari uncultured bacterium. Berdasarkan hasil analisis filogenetik ketujuh isolat gen nosZ memiliki kekerabatan terdekat dengan genus Azospirillum.
SUMMARY
LENA NOVITA. Diversity of Bacterial Community that Contribute in Nitrogen Cycle at Lake of Situ Sawangan-Bojongsari, West Java. Under direction of IMAN RUSMANA and TRI WIDIYANTO.
One of the problems in freshwater management is the declining of water quality due to pollution of nitrogen compound. Mechanisms of nitrogen transformation by indigenous bacteria in water body have been considered to solve this problem. Situ Sawangan-Bojongsari is the largest lake at Depok city, West Java. Antrophogenic activities on the lake have been accused to cause nitrogen pollution. Accordingly, the aim of this research is to investigate the abundance and diversity of bacterial community that contribute in N cycle as well as to study the profile of physical and chemical parameters that influence the bacterial community.
Water and sediment samples were collected from three sampling station, each with three replicate. Water samples were collected from the surface of the water column (0 cm), secchi depth (110) and the bottom (230 cm). Sediment samples were collected by sediment core and divided to three section depth (0-2 cm, 2-5 cm, and 5-10 cm). Analysis of physical factors was fermormed at the time of sampling which included temperature, pH, and DO. Wheter analysis of chemical factors from water and pore water sediment covered some parameters: TN, TOM, DOM, TOC, NH3, N-NO3, dan N-NO2. Analysis of the bacterial abundance that contribute in N cycle was done using MPN method. The community structure of the bacteria was analyzed using DGGE method. Amplification product of nifH, amoA, and nosZ gene were targeted for DGGE analysis.
The most abundance of nitrogen fixing bacteria was found at the sediment in the depth of 2-5 cm (4.43 log cell/mL) and the less abundance was found at the water coloumn in the depth of 0 cm (2.46 log cell/mL). The most abundance of ammonia oxidizing bacteria was found in the depth of 0 cm (270 cell/mL). The less abundance of the bacteria was found in the depth of 230 cm (73 cells/Ml). The most abundance of nitrite oxidizing bacteria was found at the water column in the depth of 0 cm (2.87 log cell/mL) and the less abundance of the bacteria was found in the depth of 230 cm. There was no ammonia and nitrite oxidizing bacteria found in the sediment. The most abundance of nitrate reducing bacteria (denitrification) was found at the sediment in the depth of 2-5 and 5-10 cm (6.04 log cell/mL) and the less abundance of the bacteria was found at the water column in the depth of 0 cm (1.32 log cell/mL). The most abundance of nitrate reducing bacteria (DNRA) was found at the sedimen in the depth of 5-10 cm (4.32 log cell/ml) and the less abundance of the bacteria was found at the water column in the depth of 0 and 110 cm (1.56 log cell/mL). The most abundance of amonifying bacteria was found at the sediment in the depth of 5-10 cm (4.43 log cell/mL) and the less abundance of the bacteria was found at the water column in the depth of 0 cm (1.86 cell/mL).
identified by searching against Genbank using BlastN, and the highest identity and score values of the six isolated sequences were the nifH gene of uncultured bacterium in non-redundant database of Genbank (80-90%). Analysis of amino acid sequence from the six isolated of nifH gene showed similarity between 65 and 92% with the functional protein of nifH (nitrogenase). A total of 5 isolated nifH gene were nitrogenase reductase of uncultured bacterium and one isolated nifH gene was nitrogenase reductase of Methylomonas sp. MKI. However, the most probable affiliations of the bacteria harboring the nifH gene were the nitrogen fixing bacteria from α- or -proteobacteria, including Bradyrhizobium sp. ORS324, Azospirillum brasilense, and Azotobacter vinelandii.
Fragment of amoA gene was amplified from water samples. There was no fragment amoA gene from sediment samples. Total of 10 unique bands of amoA gene can be detected after DGGE anaysis. Six of teen bands of amoA genes according to BlastN analysis were the amoA of uncultured bacterium (86-97 %). Amino acid sequences analysis of the six isolated of amoA genes revealed similarity between 56 and 93 % with functional protein of amoA (ammonia monooxygenase). Total of five isolated of the gene were as ammonia monooxygenase of uncultured bacterium and one isolated was as ammonia monooxygenase of Nitrosospira sp.III7. However based on phylogenetic analysis, the six isolated of amoA gene was belong to the genus Nitrosospira.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
LENA NOVITA
Judul Tesis : Keragaman Komunitas Bakteri yang Berperan dalam Siklus Nitrogen Di Situ Sawangan-Bojongsari, Jawa Barat
Nama : Lena Novita NIM : G351100111
Disetujui oleh Komisi Pembimbing
Dr Iman Rusmana, M.Si Ketua
Dr Tri widiyanto, M.Si Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, M.S
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc.Agr
Tanggal Ujian: 24 Januari 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2012 sampai dengan September 2013 ini ialah Keragaman Komunitas Bakteri yang Berperan dalam Siklus Nitrogen di Situ Sawangan-Bojongsari, Jawa Barat.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Iman Rusmana, M.Si dan Dr Tri Widiyanto, M.Si selaku pembimbing yang telah memberikan arahan, masukan dan pembimbingan terhadap kesempurnaan tesis ini. Terima kasih penulis ucapakan kepada Ibu Dr Munti Yuhana, S.Pi, M.Si sebagai penguji luar komisi dalam ujian tesis yang telah memberikan saran dan kritiknya. Terima kasih juga penulis ucapkan kepada Kementrian Riset dan Teknologi atas beasiwa yang telah diberikan selama menempuh masa pendidikan. Terima kasih yang sebesar-besarnya penulis ucapkan kepada Kepala Pusat Penelitian Limnologi (Puslit)-LIPI dan Kepala Bidang Produktivitas Perairan darat, Puslit Limnologi-LIPI yang telah memberikan ijin dan dukungan untuk melanjutkan studi. Terima kasih tak lupa penulis sampaikan kepada seluruh teknisi Laboratorium Mikrobiota Puslit Limnologi-LIPI dan Laboratorium Mikrobiologi-IPB, teman-teman program studi Mikrobiologi 2010, serta teman-teman semua yang bekerja di laboratorium penelitian Mikrobiologi-IPB.
Keberhasilan penyelesaian tesis ini tidak terlepas dari dukungan keluarga, oleh karena itu penulis ucapkan terima kasih kepada Ayahanda Sukardi, Ibunda
Rohmah dan Ibunda Euis Suryati yang selalu memberikan do’a dan dukungan
selama penulis menyelesaikan pendidikan. Terima kasih yang tak terhingga kepada suami tercinta Adam Adithya, ananda Afrina Damia Khairunisa dan
ananda Fathan Arsyad Hammani yang senantiasa memberikan semangat dan do’a.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
2 TINJAUAN PUSTAKA 3
Senyawa Nitrogen di Perairan 3
Siklus Nitrogen di Perairan
Keragaman Bakteri Pemfiksasi N2 8
Keragaman Bakteri Pengoksidasi NH3 9
Keragaman Bakteri Pengoksidasi NO2 9
Keragaman Bakteri Pereduksi NO3 10
Keragaman Bakteri Amonifikasi 10
3 METODE 11
Waktu dan Tempat Penelitian 11
Pengambilan Sampel 11
Analisis Parameter Fisika dan Kimia 12
Analisis Kelimpahan Bakteri 12
Analisis Keragaman Bakteri 13
4 HASIL 15
Profil Parameter Fisika dan Kimia Perairan Situ Sawangan-Bojongsari 15
Profil Kelimpahan Bakteri yang Berperan dalam Siklus N 18
Profil Keragaman Bakteri yang Berperan dalam Siklus N 19
5 PEMBAHASAN 29
6 SIMPULAN DAN SARAN 39
Simpulan 39
Saran 39
DAFTAR PUSTAKA 40
LAMPIRAN 46
RIWAYAT HIDUP 55
DAFTAR TABEL
1 Berbagai bentuk nitrogen yang terdapat di perairan ... 3 2 Kuantitas dan kualitas DNA hasil ... 19 3 Kemiripan sekuen nukleotida gen nifH hasil DGGE
terhadap sekuen nukleotida yang terdapat di Genbank (BlastN) ... 21 4 Kemiripan sekuen asam amino gen nifH hasil DGGE
terhadap sekuen asam amino yang terdapat di Genbank (BlastX) ... 22 5 Kemirirpan sekuen nukleotida gen amoA hasil DGGE terhadap
sekuen nukleotida yang terdapat di Genbank (BlastN) ... 25 6 Kemiripan sekuen asam amino gen amoA hasil DGGE
terhadap sekuen asam amino yang terdapat di Genbank (BlastX) ... 25 7 Kemiripan sekuen nukleotida gen nosZ hasil DGGE terhadap
sekuen nukleotida yang terdapat di Genbank (BlastN) ... 28 8 Kemiripan sekuen asam amino gen nosZ hasil DGGE
terhadap sekuen asam amino yang terdapat di Genbank (BlastX) 28
DAFTAR GAMBAR
1 Siklus nitrogen diperairan ... 5 2 Lokasi pengambilan sampel di situ Sawangan-Bojongsari ... 12 3 Profil parameter fisika pada kolom air situ Sawangan-Bojongsari ... 15 4 Profil kelimpahan senyawa organik pada kolom air (a) dan air pori
sedimen (b) di situ Sawangan-Bojongsari ... 16 5 Profil kelimpahan senyawa nitrogen pada kolom air (a) dan air pori
sedimen (b) di situ Sawangan-Bojongsari ... 17 6 Profil kelimpahan bakteri yang berperan dalam siklus N pada kolom
air di situ Sawangan-Bojongsari ... 18 7 Profil kelimpahan bakteri yang berperan dalam siklus N pada
sedimen di situ Sawangan-Bojongsari ... 19 8 Visualisasi hasil amplifikasi gen nifH dari sampel air dan sedimen ... 20 9 Profil DGGE gen nifH dari perairan situ Sawangan-Bojongsari ... 21 10 Konstruksi pohon filogenetik berdasarkan sekuen nukleotida hasil
DGGE (kode : nifH) dan sekuen-sekuen nukleotida yang terdapat di
Genbank. ... 23 11 Visualisasi hasil amplifikasi gen amoA dari sampel air dan sedimen . 24 12 Profil DGGE gen amoA dari perairan situ Sawangan-Bojongsari. ... 24 13 Konstruksi pohon filogenetik berdasarkan sekuen nukleotida hasil
DGGE (kode : amoA) dan sekuen-sekuen nukleotida yang terdapat
di Genbank. ... 26 14 Visualisasi hasil amplifikasi gen nosZ dari sampel air dan sedimen ... 27 15 Profil DGGE gen nosZ dari perairan situ Sawangan-Bojongsari. ... 27 16 Konstruksi pohon filogenetik berdasarkan sekuen nukleotida hasil
DAFTAR LAMPIRAN
1 Urutan nukleotida hasil sekuensing dari pita DNA-DGGE gen nifH 46 2 Urutan nukleotida hasil sekuensing dari pita DNA-DGGE gen
amoA ... 48 3 Urutan nukleotida hasil sekuensing dari pita DNA-DGGE gen nosZ 51 4 Surat keterangan bahwa sebagian dari tesis sudah dipublikasikan 54
1
PENDAHULUAN
Latar Belakang
Permasalahan yang sering dihadapi dalam pengelolaan ekosistem perairan darat diantaranya rendahnya kualitas air yang disebabkan polusi senyawa nitrogen. Pemasukan senyawa nitrogen didominasi oleh aktivitas antropogenik dimana sebanding dengan peningkatan populasi manusia dan pemanfaatan ekosistem perairan (Carpenter et al. 1998). Kegiatan pemanfaatan ekosistem perairan darat seperti danau, sungai, dan situ oleh masyarakat Indonesia yang menyebabkan meningkatnya kadar senyawa nitrogen antara lain budidaya perikanan dan pembuangan limbah industri dan limbah domestik.
Polusi senyawa nitrogen pada lingkungan perairan menimbulkan efek negatif baik secara langsung maupun tidak langsung. Efek negatif secara langsung di antaranya disebabkan oleh toksisitas senyawa nitrogen inorganik seperti amonia (NH3), nitrit (NO2) dan nitrat (NO3) (Alonso dan Camargo 2006). Senyawa NH3, NO2 dan NO3 merupakan bentuk-bentuk nitrogen inorganik terlarut yang pada umumnya terdapat di sistem perairan. Senyawa tersebut secara alami diperoleh dari deposisi atmosfer, disolusi dari deposit geologi yang kaya nitrogen, fiksasi nitrogen oleh mikroorganisme tertentu dan degradasi dari senyawa organik secara biologis (Rabalais 2002). Konsentrasi tertentu senyawa NH3, NO2 dan NO3 dapat menyebabkan kematian pada hewan akuatik (Alonso dan Camargo 2006). Senyawa NH3 bersifat toksik terhadap hewan akuatik terutama ikan (Richardson 1997). Senyawa ini dapat menyebabkan gangguan secara fisiologis, neurologis dan sitologis sehingga pada akhirnya dapat menyebabkan berkurangnya aktivitas konsumsi makanan, fekunditas dan ketahanan tubuh pada organisme akuatik (Richardson 1997; Constable et al. 2003). Senyawa NO2 bersifat toksik dimana menyebabkan perubahan bentuk dan fungsi hemoglobin (Harris dan Coley 1991). Senyawa NO3 memiliki aktivitas toksik yang sama dengan NO2 akan tetapi NO3 harus diubah menjadi NO2 terlebih dahulu pada jaringan tubuh sehingga toksisitas ion NO3- sangat erat kaitannya dengan permeabilitas jaringan tubuh dari organisme akuatik (Jensen 1996; Cheng dan Chen 2002). Sedangkan efek negatif secara tidak langsung di antaranya menyebabkan eutrofikasi (Rabalais et al. 2002). Eutrofikasi dapat menjadi permasalahan yang besar dalam upaya konservasi perairan darat. Eutrofikasi dapat mempercepat pendangkalan sistem perairan sehingga terjadi perubahan bahkan kehilangan fungsinya. Eutrofikasi merupakan status tropik perairan dimana tingginya konsentrasi unsur hara. Peningkatan konsentrasi senyawa NH3, NO2 dan NO3 dapat memicu pertumbuhan, ketahanan dan proliferasi produsen primer seperti fitoplankton, alga, dan makrofit (Anderson et al. 2002). Pengendapan fitoplankton dan tumbuhan air yang mati menyebabkan pendangkalan dan meningkatkan kadar hara perairan (Rabalais et al. 2002).
2
nitrogen (N2), denitrifikasi baik yang dilakukan secara aerob maupun anaerob, nitrifikasi baik secara autotrof maupun heterotrof, oksidasi NH4 secara anaerob (anammox) dan mineralisasi (Hayatsu et al. 2008). Senyawa NH4 dapat lepas dari lingkungan melalui proses oksidasi dengan dua tahapan reaksi yaitu NH4 dioksidasi menjadi NO2 dan selanjutnya NO2 dioksidasi menjadi NO3 oleh bakteri kemoautotrofik pada kondisi aerob. Senyawa NO2 selain dapat dioksidasi oleh bakteri nitrifikasi pada kondisi aerob juga dapat digunakan sebagai akseptor elektron oleh bakteri denitrifikasi pada kondisi lingkungan anaerob (Zumft 1997). Bakteri denitrifikasi dapat pula menggunakan NO3 sebagai akseptor elektron pada kondisi lingkungan anaerob. Senyawa NO3 dan NO2 oleh bakteri denitrifikasi akan direduksi menjadi gas N2O dan N2 (Zumft 1997; Richardson 2000).
Meskipun keragaman bakteri yang berperan dalam siklus N telah banyak diteliti, akan tetapi beberapa hasil penelitian dalam sepuluh tahun terakhir menunjukkan perkembangan yang luar biasa. Adanya penemuan bakteri (Schubert et al. 2006) maupun arkea (Francis et al. 2007) yang dapat melakukan oksidasi NH3 pada kondisi anaerob (anammox) di lingkungan perairan, fototrof pengoksidasi NO2 (Griffin et al. 2007), serta berhasilnya dilakukan analisis genomik organisme yang berperan dalam siklus N (Arp et al. 2007) merupakan beberapa contoh yang menunjukkan bahwa biodiversitas dan kemampuan metabolik yang berperan dalam siklus N masih banyak yang belum diketahui. Keragaman dari mikroba tersebut berkaitan dengan keragaman fungsinya di lingkungan sebagai indikasi adanya perubahan dalam siklus N secara global (Hayatsu et al. 2008). Pemahaman yang baik mengenai mikroba yang berperan dalam siklus N sangat diperlukan untuk mengetahui sekaligus memberikan solusi dalam menangani permasalahan polusi senyawa nitrogen di perairan. Selain itu, dapat memberikan informasi dasar dalam penetapan kelayakan ekosistem tersebut untuk budidaya perikanan.
Situ Sawangan-Bojongsari merupakan situ terluas di Kota Depok, Jawa Barat. Adanya peralihan fungsi sempadan situ Sawangan-Bojongsari menjadi lahan pertanian dan lahan terbangun, serta pembuangan limbah domestik ke perairan situ, maka diperkirakan menyebabkan perubahan yang bersifat kurang menguntungkan bagi perairan tersebut seperti dapat menimbulkan pendangkalan situ dan pencemaran air. Purnama (2008) melaporkan bahwa situ Sawangan-Bojongsari telah mengalami pendangkalan 3-5 m akibat adanya sedimentasi dari limbah domestik yang meningkat seiring dengan meningkatnya pemukiman penduduk di sekitar situ. Selain itu, hampir setiap tahun perairan situ Sawangan-Bojongsari ditumbuhi eceng gondok (Eichhornia crassipes), bahkan pertumbuhan Salvinia sp. dapat menutupi hampir 60% perairan (Efendi et al. 1996; Purnama 2008).
Tujuan Penelitian
3
2 TINJAUAN PUSTAKA
Senyawa Nitrogen di Perairan
Nitrogen merupakan komponen kimia dari atmosfer bumi dengan kelimpahan yang paling tinggi (hampir 80%). Nitrogen juga merupakan komponen penting yang menyusun biomolekul seluruh organisme hidup. Unsur ini terdapat dalam protein, asam nukleat, dan beberapa biomolekul lainnya, dimana keberadaannya dalam bentuk senyawa dengan tingkat oksidasi –III (sebagai NH3). Senyawa nitrogen dapat ditemukan diperairan dalam berbagai bentuk, termasuk dalam bentuk terlarut untuk diasimilasi oleh mikroorganisme (Tabel 1). Di perairan, nitrogen dapat berada dalam berbagai bentuk, yaitu NH4, NO2 dan NO3 atau N yang terikat oleh bahan organik atau anorganik (Francis et al. 2007).
Tabel 1 Berbagai bentuk nitrogen yang terdapat di perairan (Sigee 2005)
Organik Inorganik
Larut Dissolved Organic Nitrogen (DON) Autochthonous : urea, protein, dan
Senyawa NH3, NO2 dan NO3 merupakan bentuk senyawa nitrogen inorganik yang pada umumnya terdapat di sistem perairan. Senyawa tersebut secara alami diperoleh dari deposisi atmosfer, disolusi dari deposit geologi yang kaya nitrogen, fiksasi nitrogen oleh mikroorganisme tertentu dan degradasi dari senyawa organik secara biologis (Rabalais 2002). Menurut Jickells (2005) senyawa nitrogen inorganik di atmosfer berasal dari emisi secara alami gas NH3 dan N2O dari area tanah, tanaman, dan hasil ekskresi hewan. Deposisi nitrogen inorganik di atmosfer menjadi bentuk senyawa nitrogen teroksidasi (NO3) dan tereduksi (NH4) menjadi bagian penting untuk masuknya senyawa nitrogen inorganik ke sistem perairan (Paerl et al. 2002; Krishnamurthy et al. 2007).
4
dekomposisi bahan organik (tumbuhan dan biota akuatik yang telah mati). Sumber NH3 yang lain adalah reduksi gas nitrogen yang berasal dari proses difusi udara atmosfer (Paerl et al. 2002; Krishnamurthy et al. 2007), limbah industri dan domestik. Senyawa NH3 yang terdapat dalam mineral masuk ke badan air melalui erosi tanah. Senyawa NH3 juga dapat terserap ke dalam bahan-bahan tersuspensi dan koloid sehingga mengendap di dasar perairan. Senyawa NH3 jarang ditemukan pada perairan yang mendapat cukup pasokan oksigen. Sebaliknya, kadar NH3 relatif tinggi pada wilayah anoksik (tanpa oksigen) yang biasanya terdapat di dasar perairan.
Senyawa NH3 bersifat toksik terhadap hewan akuatik terutama pada ikan (Richardson 1997). Aktivitas toksik dari NH3 pada organisme akuatik dapat menyebabkan beberapa hal, antara lain kerusakan efitel insang, ketidakseimbangan osmoregulasi, kegagalan ginjal, ekskresi NH3 darah terhambat, kegagalan neurologis dan cytologist, meningkatkan konsumsi O2 jaringan tubuh, menurunkan kemampuan darah untuk transport O2 ke seluruh jaringan (Richardson 1997; Constable et al. 2003).
Di perairan alami, senyawa NO2 biasanya ditemukan dalam kelimpahan yang sangat rendah, lebih rendah daripada NO3, karena bersifat tidak stabil dengan keberadaan O2. Adapun bentuk senyawa NO2 diperairan dapat berupa ion NO2- dan bentuk terionisasi asam nitrit (HNO2) (Russo et al. 2001). Konsentrasi relatif dari NO2- dan HNO2 dipengaruhi oleh pH perairan. Konsentrasi NO2 -cenderung meningkat dan konsentrasi HNO2 menurun ketika pH -cenderung meningkat (Alonso dan Camargo 2006).
Senyawa NO2 baik dalam bentuk terionisasi ataupun tidak dapat bersifat toksik terhadap hewan akuatik (Russo et al. 2001). Akan tetapi, dikarenakan pada sistem perairan konsentrasi ion NO2- cenderung lebih tinggi dibandingkan HNO2 maka ion NO2- lebih berperan terhadap toksisitas senyawa NO2 (Jensen 1996). Aktivitas toksik utama dari senyawa NO2 adalah menyebabkan perubahan pada struktur dan fungsi pigmen pembawa O2 (hemoglobin) (Jensen 1996). Pada ikan, masuknya senyawa NO2 ke plasma darah akan berasosiasi dengan oksidasi dari atom Fe (Fe2+ menjadi Fe3+), hemoglobin secara fungsional berubah menjadi methemoglobin sehingga tidak dapat melepaskan O2 (Jensen 1996). Pada dasarnya efek toksisitas dari senyawa NO2 pada ikan antara lain (1) menyebabkan deplesi Cl- baik secara ekstraseluler maupun intraseluler sehingga menimbulkan ketidakseimbangan elektrolit, (2) deplesi K+ intraseluler dan elevasi K+ ekstraseluler yang dapat mempengaruhi potensial membran, nuerotransmisi, dan fungsi hati, (3) pembentukan senyawa N-nitroso yang bersifat mutagenik dan karsinogenik, (4) kerusakan mitokondria pada sel-sel hati (5) represi pada sistem pertahanan tubuh sehingga menurunkan toleransi terhadap penyakit yang disebabkan oleh bakteri dan parasit (Harris dan Coley 1991; Jensen1996).
5
Siklus Nitrogen di Perairan
Nitrogen seperti unsur penting lainnya juga mengalami transformasi secara biologi di lingkungan perairan. Keseluruhan proses transformasi senyawa nitrogen bergabung dalam suatu siklus yang disebut siklus N (Gambar 1).
Gambar 1 Siklus N diperairan (Francis et al. 2007)
Siklus N meliputi proses biologis yang melibatkan peran mikroorganisme. Beberapa mikroorganisme menghasilkan dan menggunakan energi dari reaksi oksidasi dan reduksi senyawa nitrogen. Mikroorganisme dalam reaksi biologi pada siklus N antara lain berperan dalam proses fiksasi N2, denitrifikasi baik yang dilakukan secara aerob maupun anaerob oleh bakteri, arkea maupun fungi, nitrifikasi baik yang dilakukan oleh bakteri maupun arkea secara autotrof maupun heterotrof, oksidasi NH4 secara anaerob (annamox) dan mineralisasi (Hayatsu et al. 2008).
6
senyawa tersebut mengikat molekul N2, mereduksinya dan dilanjutkan dengan pelepasan NH3. Adapun reaksi fiksasi N2 adalah sebagai berikut :
N2 + 8H+ + 8e- + 16 ATP 2NH3 + 16 ADP + 16 Pi + H2
Enzim nitrogenase disandikan oleh gen nif (Fischers 1994; Siegbahn et al. 1998). Nitrogenase terdiri dari dua komponen protein yang sensitif terhadap oksigen. Komponen I (dinitrogenase) merupakan protein Mo-Fe yang berukuran 300 kDa yang terdiri dari dua subunit yaitu subunit α yang disandikan oleh nifK
dan subunit yang disandikan oleh nifD (Fischers 1994). Komponen II (dinitrogenase reductase) merupakan protein Fe-S yang berukuran 35 kDa yang disandikan oleh nifH (Fischers 1994).
Aktivitas nitrogenase memerlukan ketersediaan energi dan hanya dapat terjadi pada kondisi anaerob. Aktivitas enzim yang hanya akan terjadi pada kondisi anaerob inilah yang menjadi faktor pembatas fiksasi N2 pada kondisi atmosfer yang kaya akan oksigen. Selain itu, aktivitas enzim nitrogenase juga dihambat oleh ion NH4+ dan sintesisnya dihambat oleh ion NO3- (Fischers 1994).
Selain proses fiksasi dalam siklus N juga melibatkan proses oksidasi yaitu nitrifikasi. Proses nitrifikasi meliputi oksidasi NH3 dan oksidasi NO2. Oksidasi NH3 melalui dua tahapan reaksi yaitu reaksi oksidasi NH3 menjadi hidroksilamin (NH2OH) dilanjutkan dengan reaksi oksidasi NH2OH menjadi NO2 (Bothe et al. 2000). Tahapan reaksi dalam proses oksidasi NH3 melibatkan enzim yang berbeda, yaitu :
1. Amonia Monooksigenase (AMO)
Enzim AMO mengubah NH3 menjadi NH2OH melalui reaksi : NH3 + O2 + 2H+ + 2e- NH2OH + H2O
Enzim AMO pada bakteri Nitrosomonas europea dan juga bakteri pengoksidasi NH3 autotrof lainnya yang termasuk Proteobakteria sub kelas dan , terdiri dari tiga sub unit yaitu AMO-A, AMO-B, dan AMO-C. Enzim ini disandikan oleh gen amoA, amoB, dan amoC. Ketersediaan amonium sangat berpengaruh dalam regulasi ekspresi gen amo baik pada tahap transkripsi, translasi, maupun posttranslasi. Keterbatasan jumlah NH4 menghambat secara spesifik terhadap aktivitas enzim ini (Bothe et al. 2000).
2. Hidroksilamine Oksidoreduktase (HAO)
Enzim HAO berperan dalam reaksi oksidasi hidroksilamin menjadi nitrit, yaitu melalui reaksi :
NH2OH + H2O NO2- + 5H+ + 4e-
Enzim ini memiliki struktur yang kompleks, berada sebagai enzim yang dapat larut di dalam ruang periplasma. Setiap subunit trimerik yang menyusun enzim ini merupakan situs aktif. Enzim HAO disandikan oleh gen hao (Bothe et al. 2000).
Senyawa NO2 selanjutnya dioksidasi oleh bakteri pengoksidasi nitrit dengan melibatkan kerja enzim terikat membran yaitu nitrit oksidoreduktase (NOR) (Sinha dan Annachhatre 2007). Reaksi yang terjadi sebagai berikut:
-7 Reaksi oksidasi dalam siklus N tidak hanya dalam proses nitrifikasi yang terjadi pada kondisi aerob, tetapi juga melibatkan reaksi oksidasi yang terjadi pada kondisi anaerob yaitu reaksi oksidasi NH4 atau anaerob ammonium oxidation (anammox) dimana NH4 secara langsung dioksidasi menjadi gas N2 dengan NO2 sebagai akseptor elektron. reaksi oksidasi ini terjadi di dalam bagian khusus pada sel yang disebut anamoksosom (Niftrik et al. 2004). pada proses ini NH4 dioksidasi dengan menghasilkan hidrazine (N2H4) dan NH2OH (Schalk et al. 1998).
Proses anammox dapat terjadi pada berbagai sistem perairan dan tidak hanya terbatas di perairan laut atau payau. Di danau, lapisan sedimen-air merupakan relung ekologi untuk bakteri anammox. Schubert et al. (2006) pertama kali melaporkan terjadinya proses anammox pada lapisan kolom air suboksik di danau Tanganyika. Proses anammox terdapat pada semua lapisan anoksik dengan menyumbangkan 9-13% dari total produksi N2 dari danau tersebut.
Adapun proses reduksi senyawa inorganik juga memegang peranan penting dalam siklus N. Proses reduksi NO3 menjadi NO2 merupakan langkah awal untuk 3 proses reaksi selanjutnya dalam siklus N, yaitu asimilasi NO3, denitrifikasi, Dissimilatory Nitrate Reduction to Ammonium (DNRA). Denitrifikasi merupakan proses reduksi NO3 menjadi NO2, NO2 menjadi nitrik oksida (NO), NO menjadi gas nitrous oksida (N2O) hingga pada akhirnya dihasilkan gas N2 (Richardson 2000; Zumft 1997). Setiap tahapan reaksi pada proses denitrifikasi dikatalisis oleh enzim yang berbeda. Reduksi NO3 menjadi NO2 dikatalisis oleh enzim nitrat reduktase. Ada dua macam nitrat reduktase yaitu nitrat reduktase terikat membran (NAR) dan nitrat reduktase pada periplasmik (NAP). Enzim NAR disandikan oleh gen narGHI sedangkan enzim NAP disandikan oleh gen napAB. Aktivitas enzim NAP terjadi pada kondisi aerob dan anaerob, sedangkan aktivitas enzim NAR diduga hanya terjadi pada kondisi anaerob. Hal ini disebabkan adanya penghambatan sistem transfer NO3 ke dalam sel oleh O2 (Moreno-Vivian et al. 1999; Zumft 1997). Richardson (2000) mengemukakan bahwa proses reduksi nitrat oleh enzim NAR berhubungan dengan konservasi energi yaitu sebagai akseptor elektron terakhir dalam rantai respirasi pada kondisi anaerob, sedangkan aktivitas enzim NAP cenderung untuk mengontrol keseimbangan energi pereduksi Reduksi NO2 menjadi NO dikatalisis oleh enzim nitrit reduktase (NIR). Enzim ini disandikan oleh gen nirS dan nirK (Bothe et al. 2000). Nitrik oksida diubah menjadi gas N2O dengan melibatkan enzim nitrik oksidoreduktase (NOR) yang disandikan oleh gen norB dan norC, sedangkan N2O diubah menjadi gas N2 dengan melibatkan enzim nitrous oksidoreduktase (NOS) yang disandikan oleh gen nosZ (Zumft 1997; Richardson 2000).
Proses reduksi NO3 juga dapat menghasilkan NH4 sebagai produk akhir, yaitu melalui reaksi reduksi NO3 menjadi NH4 secara disimilatif (DNRA). Proses ini melibatkan dua tahap reaksi yaitu reduksi NO3 menjadi NO2 yang dikatalisis oleh enzim NAR dan reduksi NO2 menjadi NH4 yang dikatalisis oleh dua enzim yaitu NirBD dan multiheme cytochrome c nitrite reductase (Nrf) yang disandikan oleh gen nrfA (Moreno-Vivian et al. 1999; Richardson 2001; Mohan et al. 2004).
8
dalam bentuk mineral. Tahapan penting dalam proses tersebut adalah deaminasi, yaitu pemindahan gugus amino dari protein dan asam amino yang melepaskan NH4. Amonium juga dilepaskan ke lingkungan ketika senyawa organik didegradasi oleh bakteri heterotrofik. Perombakan senyawa nitrogen organik oleh mikroba akan melepaskan protein yang selanjutnya oleh bakteri yang memiliki enzim proteolitik akan diubah menjadi peptida dan selanjutnya peptida akan menjadi asam amino. Senyawa nitrogen organik dengan berat molekul rendah seperti asam amino, amina, dan amida yang dihasilkan dari proses dekomposisi proteolitik ataupun yang berasal dari residu limbah organik selanjutnya akan mengalami dekomposisi enzimatik melalui reaksi deaminasi yang melibatkan aktivitas enzim deaminase ekstraseluler (Zaman et al. 1999) atau senyawa nitrogen tersebut diasimilasi secara langsung oleh sel mikroba (Barak et al. 1990). Proses deaminasi meliputi reaksi hidrolisis NH2-N yang berikatan α pada gugus C dari asam amino menjadi NH3 dan CO2. Beberapa asam amino dilaporkan dapat dimineralisasi secara langsung, akan tetapi ada beberapa asam amino yang memerlukan waktu lebih lama untuk dimineralisasi (Alef dan Kleiner 1986). Hampir semua bakteri heterotrof dapat melakukan proses deaminasi baik di dalam sel maupun di luar sel. Pelepasan NH3 juga dihasilkan dari reaksi deaminasi dari urea dan nukleotida.
Keragaman Bakteri Pemfiksasi N2
Kelompok mikroorganisme diazotrof memiliki peran utama dalam proses fiksasi N2 dimana berperan sebesar 60% dalam proses masuknya N2 ke lingkungan biosfer. Kelompok bakteri ini merupakan bagian dari Prokariota yang termasuk dalam Eubakteria dan Arkea. Mikroorganisme diazotrof pada umumnya dikelompokan berdasarkan kebiasaan hidupnya seperti berupa mikroorganisme yang hidup bebas (free living), simbiotik atau berasosiasi secara tertutup dengan akar tanaman. Mikroorganisme diazotrof yang hidup bebas melakukan fiksasi N2 untuk keuntungannya sendiri dan prosesnya dapat terjadi pada kondisi aerob, anaerob, atau mikroaerob. Pada umumnya mikroorganisme tersebut merupakan kemotrof atau fototrof. Sedangkan diazotrof simbiotik selalu hidup dan melakukan fiksasi N2 pada kondisi mikroaerob atau anaerob. Kelompok mikroorganisme ini berperan dalam penyediaan N terfiksasi untuk inangnya.
9
Keragaman Bakteri Pengoksidasi NH3
Bakteri pengoksidasi NH3 pada umumnya diketahui sebagai bakteri nitrifikasi yang bersifat aerob. Di lain pihak, perkembangan ilmu pengetahuan telah menunjukkan adanya penemuan bakteri (Schubert et al. 2006) maupun arkea (Francis et al. 2007) yang dapat melakukan oksidasi NH3 pada kondisi anaerob (anammox) di lingkungan perairan, sehingga dapat disimpulkan mikroorganisme pengoksidasi NH3 dapat tersebar pada kelompok Beta-proteobakteria, Gamma-proteobakteria, Planktomiset, dan Arkea. Pada umumnya di lingkungan, bakteri pengoksidasi NH3 didominasi oleh kelompok bakteri pengoksidasi NH3 autotrofik gram negatif. Kelompok tersebut pada awalnya ditempatkan pada satu kelompok taksonomi berdasarkan kemampuannya untuk tumbuh secara autotrof yang mendapatkan energi dari oksidasi NH3. Sebanyak 5 genus bakteri pengoksidasi NH3 pada awalnya dikelompokan berdasarkan karakteristik fenotip yaitu morfologi sel di mana diklasifikasikan menjadi genus Nitrosomonas, Nitrosococcus, Nitrosospira, Nitrosovibrio, dan Nitrosolobus (Bothe et al. 2000). Berdasarkan kemiripan sekuen 16S rRNA genus Nitrosospira, Nitrosovibrio, dan Nitrosolobus mengacu pada satu genus yaitu Nitrosospira (Head et al. 1993).
Semua genus memiliki kekerabatan terdekat dengan organisme -proteobakteria kecuali Nitrosococcus (Teske et al. 1994). Secara filogenetik anggota dari genus Nitrosococcus tidak homogen. N. mobilis termasuk ke dalam kelompok -proteobakteria, sedangkan N. oceani dan N. halophilus termasuk -proteobakteria (Teske et al. 1994). Sejauh ini hanya beberapa bakteri pengoksidasi NH3 yang
termasuk -proteobakteria telah dapat diisolasi dari perairan laut. Sementara dari habitat tanah atau perairan darat belum ada informasi yang berhasil mengisolasinya.
Adapun bakteri anammox diketahui sampai saat ini merupakan bakteri yang termasuk ke dalam filum Plaktomisetes. Keragaman bakteri anammox di perairan tawar pertama kali dilaporkan oleh Schubert et al. (2006) yang menunjukkan bahwa bakteri anammox yang ditemukan di danau Tanganyika berdasarkan analisis filogenetik dari gen 16S rRNA memiliki kekerabatan terdekat dengan Candidatus Scalindua brodae. Sedangkan hasil penelitian Zhang et al. (2007) dengan kajian keragaman dan kelimpahan bakteri pengoksidasi NH4 pada kondisi aerob dan anerob dari sedimen sungai Xingi (China) menunjukkan bahwa berdasarkan analisis 16S rRNA bakteri tersebut memiliki kekerabatan terdekat dengan bakteri anamox Candidatus Brocardia anammoxidans.
Keragaman Bakteri Pengoksidasi NO2
10
menjadi 4 genus antara lain Nitrobacter (bentuk batang) dan Nitrococcus (bentuk kokus) yang memiliki membran sitoplasma dan barkaitan dengan bakteri fotosintetik, Nitrospina (bentuk batang atau spiral) yang tidak memiliki membran sitoplasma, dan Nitrospira yang tumbuh membentuk sel heliks (rantai). Analisis filogenetik dari sekuen 16S rRNA keempat genus tersebut menempatkan keempat genus termasuk pada empat kelompok proteobakteria. Ketersediaan informasi paling banyak saat ini adalah kajian mengenai Nitrobacter (alfa-proteobakteria) dan Nitrospira (beta-proteobakteria). Sedangkan genus bakteri yang masih sangat perlu diperhatikan kajiannya adalah beberapa bakteri yang hanya dikaji sebagai organisme yang dikulturkan seperti Nitrospina gracilis (delta-proteobakteria) dan Nitrococcus mobilis (gamma-proteobakteria) (Bock et al. 1983).
Keragaman Bakteri Pereduksi NO3
Beberapa genus bakteri yang dapat mereduksi nitrat antara lain paracoccus (Ellington 2002) dan pseudomonas (Firth dan Edwards 2000). P. stutzeri merupakan bakteri denitrifikasi yang mampu mereduksi NO3 dengan menghasilkan gas N2 (Rius et al. 2001). Bakteri gram negatif lain yang dapat mereduksi NO3 adalah Azospirillum. Beberapa arkea juga diketahui memiliki enzim-enzim yang berperan dalam denitrifikasi di antaranya Pyrobaculum aerophilum yang bersifat halofilik dan termofilik dan Haloarcula marismortui yang juga bersifat halofilik. Selain bakteri, fungi juga diketahui memiliki beberapa enzim reduktase yang berperan dalam proses denitrifikasi seperti pada beberapa khamir dan Fusarium oxysporum (Richardson et al. 2000).
Proses reduksi NO3 secara disimilasi menghasilkan NH4 (DNRA) melibatkan bakteri ananerob. Bakteri fakultatif anaerob yang berperan dalam proses tersebut antara lain Klebsiella pneumoniae, Escherichia coli dan Staphylococcus carnosus yang dapat mereduksi NO3 menjadi NH4 pada sitoplasma (Mohan et al. 2004). Sedangkan kelompok enterobakteria yang bersifat anaerob obligat seperti Sulfospirillum delayiani dan Desulfovibrio desulfuricans serta mikroaerofilik obligat seperti Campylobacter jejuni dapat melakukan reduksi NO3 menjadi NH4 melalui enzim-enzim reduktase yang terdapat pada periplasma (Mohan et al. 2004).
Keragaman Bakteri Amonifikasi
11 purin sebagai sumber N (Nygaard et al. 2000). Bakteri dari genus Clostridium juga diketahui berperan dalam proses deaminasi. Witheley dan Tahara (1996) melaporkan bahwa Clostridium tetanomorphum memiliki enzim treonina deaminase. Adapun Clostridium botulinum juga dilaporkan dapat melakukan deaminasi beberapa asam amino seperti asparagina, treonina, serina, arginina, ornitina, dan metionina (Landgrebe dan Weaper 1966). Selain itu, bakteri Echerichia coli juga diketahui memiliki kemampuan untuk deaminasi asam amino treonin (Umbarger dan Brown 1957).
3 BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan dari bulan Januari 2012 sampai dengan September 2013. Pengambilan sampel dilakukan di Situ Sawangan-Bojongsari, Kota Depok, Jawa Barat pada tanggal 7 Januari 2012. Analisis parameter kimia dan analisis kelimpahan bakteri dilakukan di laboratorium Mikrobiota, Pusat Penelitian Limnologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI). Sedangkan analisis keragaman bakteri dilakukan di laboratorium Mikrobiologi, Departemen Biologi, Institut Pertanian Bogor (IPB).
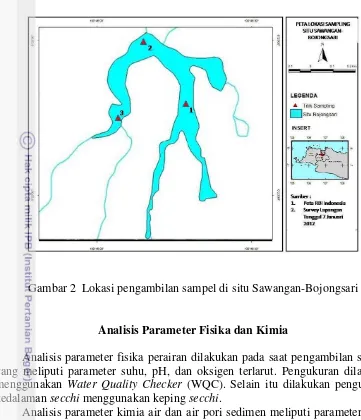
Pengambilan Sampel
12
Gambar 2 Lokasi pengambilan sampel di situ Sawangan-Bojongsari
Analisis Parameter Fisika dan Kimia
Analisis parameter fisika perairan dilakukan pada saat pengambilan sampel yang meliputi parameter suhu, pH, dan oksigen terlarut. Pengukuran dilakukan menggunakan Water Quality Checker (WQC). Selain itu dilakukan pengukuran kedalaman secchi menggunakan keping secchi.
Analisis parameter kimia air dan air pori sedimen meliputi parameter Total Nitrogen (TN), Total Organic Matter (TOM), Dissolve Organic Matter (DOM), Total Organic Carbon (TOC), N-NH3, N-NO3, dan N-NO2 (Greenberg et al. 1992).
Analisis Kelimpahan Bakteri
Bakteri pemfiksasi N2
Sebanyak 1 ml sampel air diencerkan dengan larutan NaCl fisiologis (0.85%) melalui beberapa pengenceran berseri. Selanjutnya sebanyak 1 ml hasil pengenceran dari 3 pengenceran terakhir diinokulasikan pada 9 ml medium cair bebas N dengan komponen utama (per liter) yaitu 1 g K2HPO4, 3 g KH2PO4, 0.065 g MgSO4, 0.01 g FeCl3.6H2O, 0.07 g CaCl2.2H2O, 5 g dekstrosa serta
komponen minor yaitu β40 μg Na2MoO4.2H2O, γ μg H3BO4, 1,8γ μg MnSO4.H2O,
13 setelah diberi pereaksi fenol alkohol 10 %, nitroprusid 0.5 %, dan campuran hipoklorit teknis dan asam sitrat 20 % (1:4) (Greenberg et al. 1992). Kelimpahan bakteri dihitung melalui metode Most Probable Number (MPN) (Cappucino dan Sherman 1983).
Bakteri pengoksidasi NH3 dan NO2
Sebanyak 1 ml sampel air dan 1 gram sedimen diencerkan dengan NaCl fisiologis (0.85%) melalui beberapa pengenceran berseri. Selanjutnya sebanyak 1 ml hasil pengenceran dari 3 pengenceran terakhir diinokulasikan pada 9 ml medium cair yang memiliki komposisi yang terdiri dari (per liter) sebagai berikut 0,9 g Na2HPO4, 0,2 g KH2PO4, 0,1 g MgSO4.7H2O, 0,005 g FeCl3. 6H2O, 0,0184 g CaCl2.6H2O, 0,25 g Yeast Ekstrak, dan penambahan 5 g Na2CO3 sebagai sumber C. Untuk bakteri pengoksidasi NH3dilakukan modifikasi dengan penambahan 1 g NH4Cl dan untuk bakteri pengoksidasi NO2 dilakukan penambahan NaNO2. Inkubasi dilakukan pada suhu ruang selama 7 hari. Uji positif bakteri pengoksidasi NH3 dinyatakan apabila kultur bakteri berwarna merah muda hingga keunguan setelah diberi pereaksi sulfanilamid 1 % dan NED (Naftalena Etilena Diamina) 0.1 %. Sedangkan uji positif bakteri pengoksidasi NO2 dinyatakan apabila kultur bakteri berwarna kuning setelah diberi pereaksi brucine dan asam sulfat pekat (Greenberg et al. 1992). Kelimpahan bakteri dihitung melalui metode MPN (Cappucino dan Sherman 1983).
Bakteri pereduksi NO3
Sebanyak 1 ml sampel air dan 1 g sedimen diencerkan dengan larutan NaCl fisiologis (0.85%) dengan beberapa pengenceran berseri. Selanjutnya sebanyak 1 ml hasil pengenceran dari 3 pengenceran terakhir diinokulasikan pada 9 ml medium cair yang sama seperti untuk bakteri pengoksidasi NH3 tetapi dengan modifikasi penambahan 1 g NaNO3 dan 5 g asetat sebagai sumber C untuk bakteri pereduksi NO3-denitrifikasi serta 5 g glukosa untuk bakteri DNRA. Kondisi anaerob pada media diberikan melalui metode OFN (Oxygen Free Nitrogen) yaitu dengan mengalirkan gas N2 ke dalam media menggunakan syiringe steril selama 3 menit. Inkubasi dilakukan pada suhu ruang selama satu hari. Uji positif bakteri pereduksi NO3-denitrifikasi dinyatakan apabila kultur bakteri berwarna merah muda hingga keunguan setelah diberi pereaksi sulfanilamid 1 % dan NED (Naftalena Etilena Diamina) 0.1 %. (Greenberg et al. 1992). Uji positif bakteri DNRA dinyatakan apabila kultur bakteri berwarna biru setelah diberi pereaksi fenol alkohol 10 %, nitroprusid 0.5 %, dan campuran hipoklorit teknis dan asam sitrat 20 % (1:4) (Greenberg et al. 1992). Kelimpahan bakteri dihitung melalui metode MPN (Cappucino dan Sherman 1983).
Bakteri amonifikasi
14
alkohol 10 %, nitroprusid 0.5 %, dan campuran hipoklorit teknis dan asam sitrat 20 % (1:4) (Greenberg et al. 1992). Kelimpahan bakteri dihitung melalui metode MPN (Cappucino dan Sherman 1983).
Analisis Keragaman Bakteri
Ekstraksi DNA dari sampel air dan sedimen
Sebanyak 250 ml sampel air disaring menggunakan membran filter Whatman dengan diameter pori 0.22 µm. Ekstraksi DNA menggunakan Ultraclean Water DNA Extraction Kit (MOBIO). Sebanyak ± 1 g sedimen digunakan untuk ekstraksi DNA dari sampel sedimen menggunakan Ultraclean Soil DNA Extraction Kit (MOBIO). Kualitas dan kuantitas hasil ekstraksi DNA diukur menggunakan Nanodrop.
Amplifikasi DNA
Amplifikasi DNA dilakukan untuk mendeteksi gen yang berperan dalam proses fiksasi N2 yaitu nifH, gen yang berperan dalam proses oksidasi NH3 yaitu amoA, dan gen yang berperan dalam proses reduksi N2O yaitu gen nosZ. Amplifikasi gen nifH dilakukan dengan nested PCR menggunakan primer FGPH19 dan PolR untuk amplifikasi pertama serta primer AQER dan PolF/PolF-GC Clamp untuk amplifikasi kedua (Zhan dan Sun 2011). Amplifikasi gen amoA dilakukan menggunakan primer AmoA-1F dan AmoA-2R (Chu et al. 2007). Amplifikasi gen nosZ dilakukan menggunakan primer NosZF/ NosZF-GC Clamp dan NosZ1622R (Hou et al. 2012).
Setiap reaksi amplifikasi terdiri dari 2 μl DNA template, 5 μl buffer, 5 μl dNTP, 1 unit primer, 0,5 μl KOD Hot Start DNA Polymerase (Novagen) dan akuades steril hingga volume 25 μl. Amplifikasi gen nifH dilakukan pada kondisi denaturasi awal 94 °C selama 5 menit, diikuti 30 siklus pada suhu denaturasi 94 °C selama 1 menit, annealing 56 °C (amplifikasi kedua: 50 °C) selama 1 menit, pemanjangan 72 °C selama 2 menit, selanjutnya pemanjangan akhir pada suhu 72 °C selama 5 menit. Amplifikasi gen amoA dilakukan pada kondisi denaturasi awal 94 °C selama 5 menit, dilanjutkan 35 siklus pada suhu denaturasi 94 °C selama 1 menit, annealing 58 °C selama 1 menit, pemanjangan 72 °C selama 1 menit, diikuti pemanjangan akhir pada suhu 72 °C selama 5 menit. Sedangkan untuk amplifikasi gen nosZ digunakan program touchdown PCR yang meliputi denaturasi awal 94 °C selama 2 menit, denaturasi 94 °C selama 1 menit, dilanjutkan annealing 58-53 °C selama 45 detik dan pemanjangan 72 °C selama 1 menit. Untuk 10 siklus pertama suhu annealing diturunkan 0.5 °C/siklus dan 25 siklus selanjutnya suhu annealing pada 53°C. Hasil amplifikasi DNA dianalisis menggunakan elektroforesis gel agarosa 1.5% dan visualisasi dengan UV transluminator.
Denaturing Gradient Gel Electrophoresis (DGGE)
15 40% (b/v) larutan stok acrylamide (acrylamide-N,N'-methylenebisacrylamide, 37.5:1) dan mengandung denaturan (100% denaturan : 7 M urea dan 40% (v/v) formamide). Denaturan untuk elektroforesis gen nifH dan amoA dibuat antara 35-65% serta nosZ antara 40-70%. Elektroforesis dilakukan menggunakan DCode Mutation Detection System (Biorad) pada suhu 60°C dan 130 Volt selama 4 jam. Setelah elektroforesis, gel direndam selama 15 menit dengan larutan pewarna Ethidium Bromide (0.5 mg/L). Analisis hasil denaturasi dilakukan menggunakan Gel Doc System.
Analisis urutan nukleotida dan filogenetik
Fragmen DNA pada gel elektroforesis DGGE yang sudah dipotong direndam dengan 40 μl akuades dan diinkubasi pada inkubator berpenggoyang dengan suhu 37 °C selama 2 jam. Selanjutnya campuran tersebut diinkubasi pada suhu 4 °C selama 24 jam. Campuran digunakan sebagai template untuk amplifikasi ulang primer tanpa GC-Clamp. Produk amplifikasi dianalisis urutan nukleotidanya melalui proses sekuensing menggunakan jasa perusahaan First Base Malaysia dengan protokol standar DNA sekuenser (ABI PRISM 3100). Analisis kemiripan sekuen dilakukan menggunakan program BLAST
(http://www.ncbi.nlm.nih.gov/BLAST/). Analisis filogenetik dilakukan menggunakan piranti lunak MEGA 5.0 berdasarkan metode Neighbour-Joining (NJ) dan nilai bootstrap 1000x.
5
HASIL
Profil Parameter Fisika dan Kimia Perairan Situ Sawangan-Bojongsari
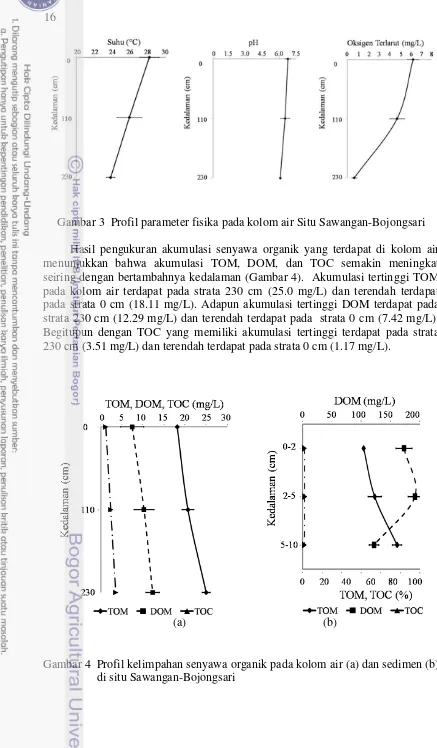
Hasil pengukuran pada saat pengambilan sampel di tiga titik sampling yang berbeda menunjukkan bahwa masing-masing titik sampling memiliki kedalaman secchi yang sama yaitu 110 cm serta kedalaman dasar pada titik sampling mencapai rata-rata 230 cm. Pengukuran parameter pada saat pengambilan sampel menunjukkan nilai parameter suhu kolom air situ Sawangan-Bojongsari menurun seiring dengan bertambahnya kedalaman (Gambar 3). Kisaran suhu pada strata 0 cm yaitu 26.1-31.1 °C dan pada strata 110 cm yaitu 24.2-29.1 °C. Sedangkan kisaran suhu pada strata 230 cm memiliki nilai yang paling rendah yaitu 23.4-24.9 °C.
16
Gambar 3 Profil parameter fisika pada kolom air Situ Sawangan-Bojongsari Hasil pengukuran akumulasi senyawa organik yang terdapat di kolom air menunjukkan bahwa akumulasi TOM, DOM, dan TOC semakin meningkat seiring dengan bertambahnya kedalaman (Gambar 4). Akumulasi tertinggi TOM pada kolom air terdapat pada strata 230 cm (25.0 mg/L) dan terendah terdapat pada strata 0 cm (18.11 mg/L). Adapun akumulasi tertinggi DOM terdapat pada strata 230 cm (12.29 mg/L) dan terendah terdapat pada strata 0 cm (7.42 mg/L). Begitupun dengan TOC yang memiliki akumulasi tertinggi terdapat pada strata 230 cm (3.51 mg/L) dan terendah terdapat pada strata 0 cm (1.17 mg/L).
(a) (b)
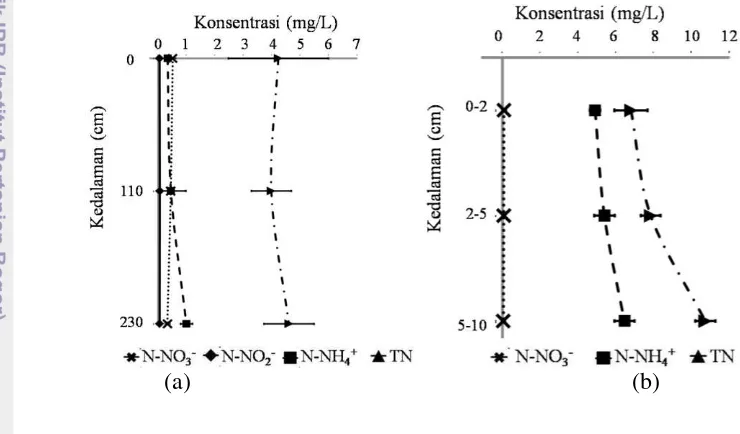
17 Profil akumulasi senyawa organik pada sedimen menunjukkan bahwa hanya TOM yang meningkat seiring dengan bertambahnya kedalaman. Akumulasi tertinggi TOM pada sedimen terdapat pada strata 5-10 cm (96.67%) dan terendah terdapat pada strata 0-2 cm (62.55%). Adapun akumulasi tertinggi DOM terdapat pada strata 2-5 cm (191.29 mg/L) dan terendah terdapat pada strata 5-10 cm (121.85 mg/L). Akumulasi tertinggi TOC juga terdapat pada strata 2-5 cm (2.22%) dan terendah terdapat pada strata 5-10 cm (1.96%).
Akumulasi TN pada sedimen lebih tinggi dibandingkan pada kolom air. Akan tetapi akumulasi senyawa nitrogen anorganik pada masing-masing strata menunjukan nilai yang bervariasi (Gambar 5). Akumulasi TN tertinggi terdapat pada sedimen strata 5-10 cm (10.721 mg/L) dan terendah terdapat pada kolom air strata 110 cm (3.98 mg/L).
(a) (b)
Gambar 5 Profil kelimpahan senyawa nitrogen pada kolom air (a) dan air pori sedimen (b) di situ Sawangan-Bojongsari
18
Profil Kelimpahan Bakteri yang Berperan dalam Siklus N
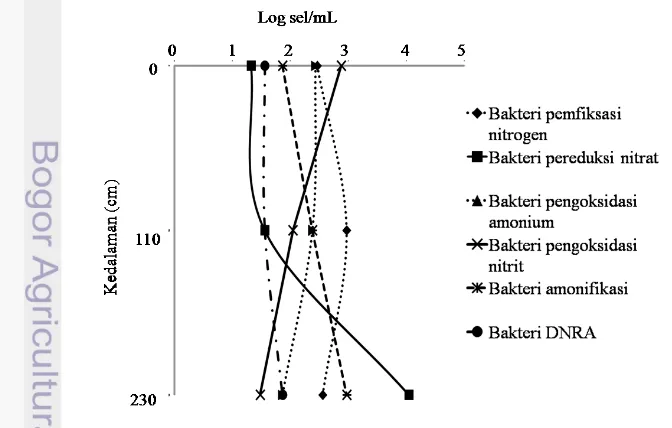
Kelimpahan bakteri pemfiksasi N2 cenderung tidak menunjukan profil linier seiring dengan bertambahnya kedalaman baik pada kolom air (Gambar 6) maupun pada sedimen (Gambar 7). Kelimpahan tertinggi di kolom air terdapat pada strata 110 cm (2.97 Log sel/ ml) dan kelimpahan terendah terdapat pada strata 0 cm (2.46 Log sel/ml). Adapun kelimpahan tertinggi di sedimen terdapat pada strata 2-5 cm (4.43 Log sel/g) dan kelimpahan terendah terdapat pada strata 2-5-10 cm (3.97 Log sel/g).
Bakteri pengoksidasi NH3 dan NO2 di situ Sawangan-Bojongsari hanya terdapat pada bagian kolom air. Kelimpahan bakteri tersebut cenderung semakin menurun seiring dengan bertambahnya kedalaman (Gambar 6). Kelimpahan tertinggi bakteri pengoksidasi terdapat pada strata 0 cm (2.43 Log sel/ml) dan kelimpahan terendah terdapat pada strata 230 cm (1.86 Log sel/ml). Adapun kelimpahan tertinggi bakteri pengoksidasi NO2 terdapat pada strata 0 cm (2.87 Log sel/ml) dan kelimpahan terendah terdapat pada strata 230 cm (1.48 Log sel/ml).
Bakteri pereduksi NO3 yang terdapat di situ Sawangan-Bojongsari cenderung memiliki kelimpahan yang semakin meningkat dengan semakin bertambahnya kedalaman baik pada kolom air (Gambar 6) maupun pada sedimen (Gambar 7). Kelimpahan tertinggi terdapat pada sedimen dengan strata 2-5 dan 5-10 cm (6.04 Log sel/g) dan kelimpahan terendah terdapat pada kolom air strata 0 cm (1.32 Log sel/ml).
Bakteri pereduksi NO3 menjadi NH4 (DNRA) juga dapat ditemukan pada kolom air (Gambar 6) maupun sedimen (Gambar 7) dengan kelimpahan yang cenderung semakin meningkat seiring dengan bertambahnya kedalaman. Kelimpahan tertinggi terdapat pada sedimen strata 5-10 cm (4.32 Log sel/g) dan kelimpahan terendah terdapat pada kolom air strata 0 dan 110 cm (1.56 Log sel/ml).
19
Gambar 7 Profil kelimpahan bakteri yang berperan dalam siklus N pada sedimen di situ Sawangan-Bojongsari
Kelompok bakteri amonifikasi dapat ditemukan dengan kelimpahan yang cenderung semakin meningkat dengan bertambahnya kedalaman baik pada kolom air (Gambar 6) maupun sedimen (Gambar 7). Kelimpahan tertinggi terdapat pada sedimen dengan strata 5-10 cm (4.43 Log sel/g) dan kelimpahan terendah terdapat pada kolom air dengan strata 0 cm (1.86 Log sel/ml).
Profil Keragaman Bakteri yang Berperan dalam Siklus Nitrogen
Total DNA dari sampel air maupun sedimen dapat diisolasi dengan baik. Konsentrasi DNA yang diperoleh dari sampel sedimen cenderung lebih tinggi dibandingkan dari sampel air (Tabel 2). Total DNA yang diperoleh merupakan DNA cetakan yang digunakan untuk amplifikasi sekuen gen nifH, amoA dan nosZ.
Tabel 2 Kuantitas dan kualitas DNA hasil isolasi Sampel Strata(cm) DNA (ng/µl) OD 260/280
Air 0 15.5 2.05
110 1.8 1.65
230 2.5 1.86
Sedimen 0-2 19.1 2.09
2-5 37.4 1.82
20
Bakteri pemfiksasi N2
Keragaman bakteri pemfiksasi N2 dilihat berdasarkan hasil DGGE dari produk amplifikasi gen nifH. Amplifikasi gen nifH melalui nested PCR dari semua sampel telah berhasil dilakukan. Hasil visualisasi produk PCR menunjukkan terdeteksinya pita DNA berukuran ~320 bp (Gambar 8).
Gambar 8 Visualisasi hasil amplifikasi gen nifH dari sampel air dan sedimen. Lajur M: Marker 100 bp, Lajur 1: air strata0 cm, Lajur 2: air strata110 cm, Lajur 3: air strata230 cm, Lajur 4: sedimen strata0-2 cm, Lajur 5: sedimen strata2-5 cm, Lajur 6: sedimen strata5-10 cm
Analisis DGGE dari gen nifH hasil amplifikasi tersebut menunjukkan bahwa terdapat sebanyak 22 pita DNA gen nifH yang tersebar pada beberapa posisi elektroforetik. Adapun sebanyak 11 pita DNA gen nifH yang berada pada posisi yang berbeda (Gambar 9). Hal ini dapat menunjukkan bahwa di perairan situ Sawangan-Bojongsari terdapat komunitas bakteri pemfiksasi nitrogen dengan jumlah 11 keragaman.
21
Gambar 9 Profil DGGE gen nifH dari perairan situ Sawangan-Bojongsari. Lajur 1: air strata0 cm, Lajur 2: air strata 110 cm, Lajur 3: l air strata230 cm, Lajur 4: sedimen strata0-2 cm, Lajur 5: sedimen strata2-5 cm, Lajur 6: sedimen strata5-10 cm
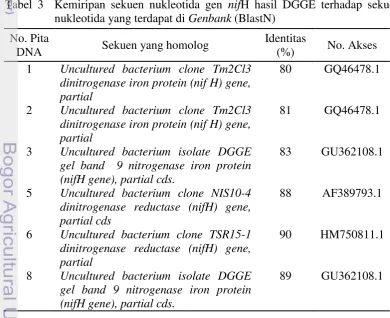
Tabel 3 Kemiripan sekuen nukleotida gen nifH hasil DGGE terhadap sekuen nukleotida yang terdapat di Genbank (BlastN)
No. Pita
DNA Sekuen yang homolog
Identitas
(%) No. Akses 1 Uncultured bacterium clone Tm2Cl3
dinitrogenase iron protein (nif H) gene, partial
80 GQ46478.1
2 Uncultured bacterium clone Tm2Cl3 dinitrogenase iron protein (nif H) gene, partial
81 GQ46478.1
3 Uncultured bacterium isolate DGGE gel band 9 nitrogenase iron protein (nifH gene), partial cds.
83 GU362108.1
5 Uncultured bacterium clone NIS10-4 dinitrogenase reductase (nifH) gene, partial cds
88 AF389793.1
6 Uncultured bacterium clone TSR15-1 dinitrogenase reductase (nifH) gene, partial
90 HM750811.1
8 Uncultured bacterium isolate DGGE gel band 9 nitrogenase iron protein (nifH gene), partial cds.
22
Adapun hasil analisis kemiripan sekuen asam amino menunjukkan bahwa sekuen asam amino dari keenam isolat gen nifH memiliki kemiripan antara 65-92% dengan protein fungsional dari nifH (nitrogenase reductase), dimana 5 isolat gen nifH merupakan nitrogenase reductase dari uncultured bacterium dan 1 isolat gen nifH merupakan nitrogenase reductase dari Methylomonas sp. MK1 (Tabel 4).
Tabel 4 Kemiripan sekuen asam amino gen nifH hasil DGGE terhadap sekuen asam amino yang terdapat di Genbank (BlastX)
No. Pita
DNA Sekuen yang homolog
Identitas
(%) No. Akses 1 Dinitrogenase reductase (Uncultured
bacterium)
80 CBJ25170.1 2 Dinitrogenase reductase (Uncultured
nitrogen-fixing bacterium)
82 AAZ06699.1 3 Dinitrogenase reductase (Uncultured
soil bacteria)
65 AGR39948
5 Dinitrogenase reductase (Uncultured bacteria)
92 AFY12634.1 6 Nitrogenase reductase (Methylomonas
sp. MK 1)
79 WP020483285.1 8 Dinitrogenase reductase (Uncultured
bacterium)
84 ADV51711.1
Konstruksi pohon filogenetik untuk gen nifH dibuat menggunakan sekuen nukleotida dari keenam isolat gen nifH hasil DGGE dan beberapa sekuen yang memiliki kemiripan di GenBank. Analisis filogenetik menunjukkan bahwa semua sekuen mengacu kepada kelompok Proteobacteria (Gambar 10).
23
Gambar 10 Konstruksi pohon filogenetik berdasarkan sekuen nukleotida hasil DGGE (kode : nifH) dan sekuen-sekuen nukleotida yang terdapat di Genbank
Bakteri pengoksidasi NH3
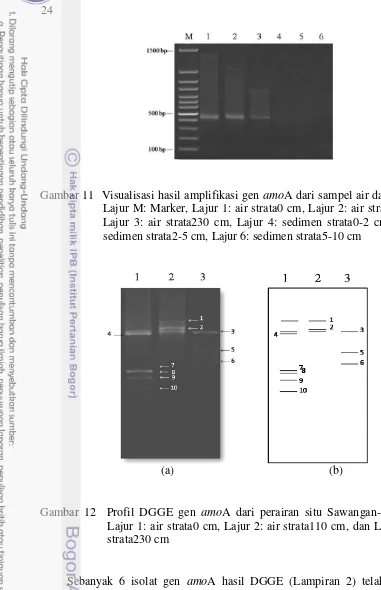
Keragaman bakteri pengoksidasi NH3 ditentukan berdasarkan analisis gen amoA sebagai penyandi enzim kunci amonia monooksigenase. Gen amoA hanya dapat teramplifikasi pada sampel air yaitu dengan terdeteksinya pita DNA berukuran 490 bp pada gel elektroforesis (Gambar 11).
24
Gambar 11 Visualisasi hasil amplifikasi gen amoA dari sampel air dan sedimen. Lajur M: Marker, Lajur 1: air strata0 cm, Lajur 2: air strata110 cm, Lajur 3: air strata230 cm, Lajur 4: sedimen strata0-2 cm, Lajur 5: sedimen strata2-5 cm, Lajur 6: sedimen strata5-10 cm
(a) (b)
Gambar 12 Profil DGGE gen amoA dari perairan situ Sawangan-Bojongsari. Lajur 1: air strata0 cm, Lajur 2: air strata110 cm, dan Lajur 3: l air strata230 cm
25 amoA sebagai ammonia monooxygenase dari bakteri Nitrosospira sp. III7 (Tabel 6).
Tabel 5 Kemiripan sekuen nukleotida gen amoA hasil DGGE terhadap sekuen nukleotida yang terdapat di Genbank (BlastN)
No. pita
DNA Sekuen yang homolog
Identitas
(%) No. Akses 1 Uncultured beta proteobacterium clone
Wekeromm pHN 12b AmoA (amoA) gene, partial
97 DQ435827.1
3 Uncultured beta proteobacterium clone Wekeromm pHN 126 AmoA (amoA) gene, partial
93 DQ435827.1
4 Uncultured ammonia-oxidizing bacterium isolate DGGE bands BS AOB 4 putative ammonia monooxygenase subunit A (AmoA) gene, partial
93 EU667649.1
6 Uncultured ammonia-oxidizing bacterium clone E AOB 24 putative ammonia
monooxygenase subunit a(AmoA) gene, partial
87 JQ365904.1
7 Uncultured ammonia-oxidizing bacterium isolate DGGE bands BS AOB 4 putative ammonia monooxygenase subunit A (amoA) gene, partial
86 EU667649.1
8 Uncultured beta proteobacterium clone pm-amoA-1 AmoA (amoA) gene, partial
94 DQ009878.1
Tabel 6 Kemiripan sekuen asam amino gen amoA hasil DGGE terhadap sekuen asam amino yang terdapat di Genbank (BlastX)
No. pita
DNA Sekuen yang homolog
Identitas
(%) No. Akses 1 Ammonia monooxygenase (Nitrosospira sp.
III7)
93 AAM77413
3 Ammonia monooxygenase (uncultured bacterium)
86 AAP88532.1 4 Ammonia monooxygenase (uncultured
beta proteobacterium)
83 CBL43085.1 6 Ammonia monooxygenase (uncultured beta
26
Berdasarkan analisis filogenetik dari keenam sekuen nukleotida isolat gen amoA hasil DGGE menunjukkan bahwa keenam isolat gen amoA mengacu kepada bakteri yang termasuk ke dalam kelompok Proteobacteria dan memiliki kekerabatan paling dekat dengan genus Nitrososopira (Gambar 13).
Gambar 13 Konstruksi pohon filogenetik berdasarkan sekuen nukleotida hasil DGGE (kode : amoA) dan sekuen-sekuen nukleotida yang terdapat di Genbank
Bakteri Pereduksi N2O
Amplifikasi gen nosZ dari semua sampel menunjukkan bahwa pada sampel air tidak terdapat gen nosZ. Hasil visualisasi produk PCR menunjukkan terdeteksinya pita DNA berukuran ~453 bp (termasuk GC clamp) pada sampel sedimen (Gambar 14). Analisis DGGE dari produk PCR gen nosZ tersebut menunjukkan bahwa terdapat sebanyak 19 pita DNA gen nosZ yang tersebar di beberapa posisi elektroforetik pada gel. Sebanyak 12 pita DNA gen nosZ berada pada posisi yang berbeda (Gambar 15). Hal ini menunjukkan bahwa di perairan situ Sawangan-Bojongsari terdapat komunitas bakteri pereduksi gas nitrous oksida dengan jumlah 12 keragaman. Keragaman tertinggi terdapat pada sedimen strata 2-5 cm dan keragaman terendah terdapat pada strata 5-10 cm.
27
Gambar 14 Visualisasi hasil amplifikasi gen nosZ dari sampel air dan sedimen. Lajur M: Marker, Lajur 1: air strata0 cm, Lajur 2: air strata110 cm, Lajur 3: air strata230 cm, Lajur 4: sedimen strata0-2 cm, Lajur 5: sedimen strata2-5 cm, Lajur 6: sedimen strata5-10 cm
Gambar 15 Profil DGGE gen nosZ dari perairan situ Sawangan-Bojongsari.Lajur 1: sedimen strata0-2 cm, Lajur 2: sedimen strata2-5 cm, dan Lajur 3: sedimen strata 5-10 cm
28
bahwa ketujuh isolat gen nosZ teridentifikasi sebagai nitrous oxide reductase dari uncultured bacterium.
Tabel 7 Kemiripan sekuen nukleotida gen nosZ hasil DGGE terhadap sekuen nukleotida yang terdapat di Genbank (BlastN)
No. Pita
DNA Sekuen yang homolog
Identitas
(%) No. Akses 1 Uncultured bacterium nosZ gene for
nitrous oxide reductase, partial cds
95 AB672490 2 Uncultured bacterium clone ISA00346
putative nitrous oxide reductase (nosZ) gene, partial cds
96 FJ209535.1
3 Uncultured bacterium clone ISA00346 putative nitrous oxide reductase (nosZ) gene, partial cds
97 FJ209535.1
4 Uncultured bacterium clone ISA00179 putative nitrous oxide reductase (nosZ) gene, partial cds
97 FJ209368.1
5 Uncultured bacterium clone ISA00179 putative nitrous oxide reductase (nosZ) gene, partial cds
98 FJ209368.1
7 Uncultured bacterium clone ISA00346 putative nitrous oxide reductase (nosZ) gene, partial cds
89 FJ209535.1
10
Uncultured bacterium nosZ gene for nitrous oxide reductase partial cds clone D20H2109
95 AB672490
Tabel 8 Kemiripan sekuen asam amino gen nosZ hasil DGGE terhadap sekuen asam amino yang terdapat di Genbank
No. Pita
DNA Sekuen yang homolog
Identitas
(%) No. Akses 1 Nitrous oxide reductase (Uncultured
bacterium)
87 ABX57712.1
2 NosZ (Uncultured bacterium) 93 ABY19464.1
3 Putative nitrous oxide reductase (Uncultured bacterium)
93 ADR10855.1 4 Putative nitrous oxide reductase 98 ACI48827.1 5 Putative nitrous oxide reductase 99 ACI48827.1 7 Putative nitrous oxide reductase 86 ACI48827.1 10 Nitrous oxide reductase, partial
(uncultured bacterium)
29 Adapun hasil analisis filogenetik dari ketujuh gen nosZ hasil DGGE menunjukkan bahwa ketujuh gen tersebut termasuk ke dalam kelompok proteobacteria dan memiliki kekerabatan terdekat dengan Genus Azospirillum (Gambar 16).
Gambar 16 Konstruksi pohon filogenetik berdasarkan sekuen nukleotida hasil DGGE (kode : nosZ) dan sekuen-sekuen nukleotida yang terdapat di Genbank
5 PEMBAHASAN
Akumulasi berbagai bentuk senyawa nitrogen di perairan berkaitan erat dengan proses transformasi senyawa nitrogen oleh mikroorganisme yang berperan dalam siklus N pada ekosistem tersebut. Keseluruhan proses transformasi senyawa nitrogen pada suatu lingkungan perairan dipengaruhi oleh parameter fisika dan kimia. Beberapa parameter fisika yang berperan penting di perairan di antaranya suhu, derajat keasamaan (pH) dan oksigen terlarut. Sedangkan beberapa parameter kimia yang penting adalah konsentrasi bentuk senyawa nitrogen dan senyawa organik.
Stratifikasi suhu yang terjadi pada kolom air situ Sawangan-Bojongsari diduga disebabkan oleh berkurangnya intensitas cahaya matahari yang masuk ke