610.28
Ind
p
ISO 9001 :2008 82410013105
PETUNJUK EKN S
ALA
ESEHATAN
Kementerian Kesehatan RI
Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan
Direktorat Bina Produksi Dan Distribusi Alat Kesehatan
Katalog Dalam Terbitan. Kemenlerian Kesehalan RI
610 .28 Ind p
Indonesia . Kementerian Kesehatan RI. Direklorat Jenderal Bina Kefarmaslan dan Alat Kesehatan
Pelunjuk leknis alaI kesehalan.- Jakarta Kementerian Kesehatan RI. 2014
ISBN 978-602-235-701-8
KATA PENGANTAR
AlaI kesehalan berbeda dan komodili biasa, merupakan sualu produk hasil induslri yang dalam peredaran dan penyalurannya memerlukan perlakuan dan persyaralan-persyaralan lertenlu agar lelap dapal lerjamin keamanan, mulu dan kemanfaalannya.
Unluk memenuhi persyaralan-persyaralan lertenlu guna lerjaminnya alaI kesehalan yang aman, bermulu dan bermanfaal lersebul, maka disusunlah Pelunjuk Teknis AlaI Kesehalan .
Pelunjuk Teknis AlaI Kesehalan ini disusun berdasarkan persyaralan pendaftaran izin edar alaI kesehalan melalui regislrasi online.
Dengan adanya Pelunjuk Teknis ini diharapkanakan lebih memudahkan para pemangku kepentingan di dalam penerapannya .
Dengan demikian diharapkan seliap pelaku usaha yang ingin melakukan regislrasi alaI kesehalan dapal memahami bagaimana cara pengisian permohonan izin edar.
Jakarta , November 2014
Direktur,
Bina roduksi dan Distribusi Alat Kesehatan
Drg. Arianli Anaya , MKM
TIM PENYUSUN
PETUNJUK TEKNIS ALAT KESEHATAN
Penanggungjawab Ketua
Sekretaris Anggota
Sekretariat
: Org . Arianti Anaya , MKM
: Ora . Rully Makarawo, Apt. : Siti Nurhasanah,S.Si ,Apt : Hasnil Randa Sari , S.Si , Apt
Nuning Lestin Bintari , S.Farm, Apt. Handika Yudha K, S.Si , Apt. Anissa,Amf
Nazmi,S.Farm,Apt
Rachmi Sugiarti , S.Farm., Apt Nasa Milta Sahara, S.Farm ., Apt : Meyra Setyarti
DAFTAR
lSI
KATA PENGANTAR
TIM PENYUSUN
DAFTAR 151. .
BABI.PENDAHULUAN
A. LatarBelakang ... ... .
B. DasarHukum
c.
Defenisi ..BAB II. Klasifikasi Kelas Alat Kesehatan
BAB III. Pedoman Pengisian Permohonan Izin Edar Alat Kesehatan ..
A. Formulir Permohonan .
B. Form A. Data Administrasi .
C. Form B. InformasiProduk ..
D. Form C. Informasi Spesifikasidan Jaminan Mutu
E. Form D. Petunjuk Penggunaan . ... ... .. .. . .
F. Form E. Post Market Evaluation ... ... ... .
BAB IV. Matriks Persyaratan Izin Edar Alat Kesehatan
LAMPIRAN ..
" ... i
... ii
.. ii
... . 1
. ... 1
... 2
... .... . 3
... 6
9
. ... 9
. ... 9
. ... 14
... 18
. ... 24
... 26
... .. 27
BABI
PENDAHULUAN
A. Latar Belakang
Dalam menJamin keamanan, mutu dan manfaat (safety, quality, and
efficacy) alat kesehatan impor maupun dalam negeri yang beredar di Indonesia maka harus dilakukan pengendalian alat kesehatan. Sesuai Undang-Undang Nomor 36 Tahun 2009 tentang Kesehatan Pasal 106 ayat (1) bahwa Sediaan farmasi dan alat kesehatan hanya dapat diedarkan setelah mendapat izin edar dari Menteri Kesehatan.
Mengacu Undang-Undang Nomor 36 Tahun 2009 tentang Kesehatan maka Kementerian Kesehatan RI mengeluarkan beberapa peraturan yang menyangkut tentang alat kesehatan sebagai berikut:
1. Peraturan Menteri Kesehatan Nomor 1189/Menkes/PerNIII/2010 Tentang Produksi Alat Kesehatan dan Perbekalan Kesehatan Rumah Tangga;
2. Peraturan Menteri Kesehatan Nomor 1190/Menkes/PerNIII/2010
Tentang Izin Edar Alat Kesehatan dan Perbekalan Kesehatan Rumah Tangga;
3. Peraturan Menteri Kesehatan Nomer 1191/Menkes/PerNIII/2010
Tentang Penyalur Alat Kesehatan.
Berkaitan dengan Peraturan Menteri Kesehatan Nomer
Oengan adanya pelunjuk leknis ini diharapkan dapal dijadikan sebagai
pedoman baik oleh pemerinlah pusal dan daerah, pelaku usaha maupun
pengguna alaI kesehalan .
Unluk meningkatkan pelayanan publik yang baik dan memberikan informasi
yang lebih jelas maka pedoman ini diharapkan juga dapat menjadi acuan
bagi regulator pelaksana maupun pelaku usaha dalam proses permohonan
izin edar alaI kesehatan .
B.Oasar Hukum
Dalam melaksanakan pelayanan Direkloral Bina Produksi dan Distribusi AlaI
Kesehatan berdasarkan atas peraturan perundang-undangan sebagai berikul:
a . Undang-Undang No. 8 Tahun 1999 tentang Perlindungan Konsumen
(Iembaran Negara RI No. 42 Tambahan Lembaran Negara RI No. 3821)
b. Undang-undang No.20 tahun 2000 lentang Otonomi Oaerah
c. Undang -undang NO.32 tahun 2004 tentang Pemerinlahan Daerah
d Undang-undang NO.36 tahun 2009 tenlang Kesehatan
e. Peraturan Pemerintah No 7 tahun 1973 tentang Pengawasan alas
Peredaran , Penyimpanan , dan Penggunaan Peslisida ;
f. Peraluran Pemerintah NO.72 tahun 1998 tentang Pengamanan Sediaan
Farmasi dan Alat Kesehatan
g . Peraturan Pemerintah No 38 lahun 2007 Tentang Pembagian Urusan
Pemerintahan antara Pemerintah, Pemerintah Daerah Propinsi dan
Pemerintah Daerah Kabupalen/Kota
h. Peraturan Pemerintah No. 13 tahun 2009 Tentang Jenis dan Tarif alas Jenis
Penerimaan Negara Bukan Pajak yang Berlaku pada Oepartemen Kesehatan
Peraturan Menteri Kesehatan RI NO.1184/Menkes/PerIXl2004 tentang
Pengamanan Alat Kesehatan dan PKRT
Pemerintah, Pemerintah daerah Propinsi, dan Pemerintah Daerah
Kabupaten/Kota
k. Peraturan Menteri Pertanian RI No. 07/Penmentan/SR.14012l2007 tentang
Syarat dan Tata Cara Pendattaran Pestisida :
C. Defenisi
Dalam petunjuk teknis pedoman ini yang dimaksud dengan:
1. Alat kesehatan adalah instrumen, apparatus, mesin dan/atau imp Ian yang tidak mengandung obat yang digunakan untuk mencegah , mendiagnosis ,
menyembuhkan dan meringankan penyakrt, merawat orang sakrt,
memulihkan kesehatan pada manusia, dan/atau membentuk struktur dan
memperbaiki fungsi tubuh .
Selain alat kesehatanyang di sebut di atas, alat kesehatan dapal juga
mengandung obat yang lidak mencapai kerja utama pada atau dalam
tubuh manusia melalui proses fanmakologi, imunologi atau metabolisme
telapi dapat membantu fungsi yang diinginkan dari alat kesehalan dengan
cara tersebut.
Alai kesehatan berdasarkan lujuan penggunaan sebagaimana dimaksud
oleh produsen, dapal digunakan sendiri maupun kombinasi untuk manusia
dengan salu alau beberapa lujuan sebagai berikut:
a. diagnosis, pencegahan, pemanlauan, perlakuan alau pengurangan
penyaki!;
b. diagnosis, pemanlauan, perlakuan, pengurangan alau kompensasi kondisi
saki!;
c. penyelidikan , pengganlian, pemodifikasian, mendukung analomi atau
proses fisiologis ;
d. mendukung alau mempertahankan hidup;
e. menghalangi pembuahan;
f. desinfeksi alai kesehalan ; dan
2. Produk Rekondisi/Produk remanufakturing adalah produk yang diproduksi dari produk alat kesehatan bukan baru yang diperlakukan sebagai bahan baku dengan persyaratan produksi sesuai standar awal.
3. Perusahaan adalah badan usaha yang memproduksilmenyalurkan alat
kesehatan dan/atau memproduksi PKRT.
4. Penyalur Alat Kesehatan adalah badan hukum yang memiliki izin untuk menyalurkan, memperdagangkan alat kesehatan sesuai dengan ketentuan
perundang-undangan yang berlaku dan mempunyai hak untuk
mendapatkan izin edar.
5. Perusahaan Rumah Tangga adalah perusahaan yang memproduksi alat kesehatan tertentu dan dengan fasilitas sederhana yang tidak akan menimbulkan bahaya bagi pengguna, pasien, pekerja dan lingkungan. 6. Izin edar adalah izin yang diberikan kepada perusahaan untuk produk alat
kesehatan atau PKRT, yang akan diimpor, digunakan dan/atau diedarkan di wilayah Indonesia, berdasarkan penilaian terhadap keamanan, manfaat dan mutu.
7. Surat Keterangan impor adalah izin kepada perusahaan yang memasukkan alat kesehatan yang tidak memiliki registrasi ke dalam wilayah Republik Indonesia untuk kepentingan tertentu sesuai ketentuan berlaku.
8. Surat Keterangan Izin ekspor adalah izin yang diberikan kepada perusahaan yang memproduksi alat kesehatan khusus untuk ekspor dan tidak diedarkan di wilayah Indonesia.
9. Mutu adalah ukuran kualitas produk yang dinilai dari cara pembuatan yang baik dan menggunakan bahan dengan spesifikasi yang sesuai dan memenuhi persyaratan yang ditentukan.
10. Penandaan adalah etikeUlabel, brosur atau bentuk pernyataan lainnya yang ditulis, dicetak, atau digambar, berisi informasi penting yang disertakan pada atau berhubungan dengan alat kesehatan.
11. EtikeUlabel adalah tanda yang berupa tulisan, dengan atau tanpa gambar yang dilekatkan, dicetak, diukir, dicantumkan dengan cara apapun pada wadah atau pembungkus.
13. Direk!ur Jenderal adalah Direk!ur Jenderal yang tugas dan tanggung
13. Direktur Jenderal adalah Direktur Jenderal yang tugas dan tanggung
BAB II
KLASIFIKASI KELAS ALAT KESEHATAN
KELAS Tingkat risiko GHTF Contoh
I Risiko rendah A Kursi roda, penekan lidah, plester, alat , bantu 「・セ。ャ。ョL@ pembalut luka, pewama biologi
II Risiko sedang-rendah
Risiko sedang -tinggi B
C
Jarum hipodermik, kateter sekali pakai , kontak lensa, monitor tekanan darah digital, alat Bantu dengar,
Ventilator paru, implant ortopedik , lensa intraocular ( IOL ), incubator bayi, kantong darah, Tes Kehamilan
III Risiko tinggi 0 Benang bedah yang dapat diserap, implant pacu jantung , stent jantung, IOL, Tes HIV
Prinsip klasifikasi berdasarkan resiko
1) Masa penggunaan
2) Tingkat invasive
3) Lokasi pemakaian
4) Sumber tenaga
5) Efek biologi terhadap pasien
Keterangan :
1) Masa penggunaan , terbagi 3 yaitu
a) Transien : ditujukan untuk digunakan terus menerus selama tidak
kurang kurun dari 60 menit
b) Jangka pendek : dilujukan unluk digunakan lerus menerus selama
BAB II
KLASIFIKASI KELAS ALAT KESEHATAN
KELAS Tingkat risiko GHTF Contoh
I Risiko rendah A Kursi roda , penekan lidah , plester, alat, bantu berjalan, pembalut luka, pewama biologi
II Risiko sedang-rendah
Risiko sedang -tinggi B
C
Jarum hipodermik, kateter sekali pakai, kontak lensa, monitor tekanan darah digital, alat Bantu dengar,
Ventilator paru , implant ortopedik , lensa intraocular ( IOL ), incubator bayi, kantong darah , Tes Kehamilan
III Risiko tinggi 0 Benang bedah yang dapat diserap, implant pacu jantung , stent jantung , IOL, Tes HIV
Prinsip klasifikasi berdasarkan resiko
1) Masa penggunaan
2) Tingkat invasive
3) Lokasi pemakaian
4) Sumber tenaga
5) Efek biologi terhadap pasien
Keterangan:
1) Masa penggunaan, terbagi 3 yaitu
a) Transien: ditujukan untuk digunakan terus menerus selama tidak
kurang kurun dari 60 menit
b) Jangka pendek: ditujukan unluk digunakan lerus menerus selama
c) Jangka panjang: ditujukan untuk digunakan terus menerus selama
lebih dari 30 hari.
d) Artinya , semakin lama penggunaan alat maka tingkat risiko yang
ditimbulkan semakin besar.
2) Tingkat invasive
a) Alat invasive: alat yang seluruh atau sebagian , penetrasi kedalam
tubuh baik melalui lubang tubuh maupun permukaan tubuh .
b) Lubang tubuh : setiap lubang alami pada tubuh , termasuk
permukaan luar bola mala, atau setiap pembukaan artificial yang
permanent, seperti stoma alau tracheotomy permanent
c) Alat invasive bedah : alat invasive yang berpenetrasi kedalam
tubuh melalui permukaan tubuh , dengan bantuan atau dalam
konteks pelaksanaan bedah. Memecah lapisan kulit.
d) Jadi , semakin tinggi tingkat invasive suatu alat, maka tingkat
resiko yang ditimbulkan akan semakin besar
3) Lokasi penggunaan
a) Sistim sirkulasi pusat
Adalah pembuluh darah mayor yang termasuk pembuluh darah
paru , jantung, arteri koroner, arteri serebral, aorta, superior vena
cava , arteri ginjaL
b) Sistem syaraf pusat
Termasuk otak, meninges dan batang otak.
Jika suatu alat 「・ォ・セ。@ pad a atau mempengaruhi Sistem darah
4) Sumber tenaga
Alat kesehatan aktif: adalah alat yang tergantung pada sumber energi
dari listrik atau sumber ebergi lain dan bekerja dengan mengubah
energi tersebut.
5) Efek biologi terhadap pasien
Sifat alat yang dapat diserap tubuh; akan menimbulkan resiko yang
lebih besar dibandingkan alat yang tidak diserap tubuh, karenanya
セMM
MMMMMMMMMM
MMMMMMMMMMMMMMMMMM
MMMMM
MM
BAB III
PEDOMAN PENGISIAN PERMOHONAN IZIN EDAR ALAT KESEHATAN
A . FORMULIR PERMOHONAN
Format formulir Permohonan sesuai Permenkes No. 1190/MENKES/PERNII1I2010 tentang IZIN EDAR ALAT KESEHATAN DAN
PERBEKALAN KESEHATAN RUMAH TANGGA. Formulir ditandatangani oleh
Pimpinan Perusahaan dan Penanggung Jawab Teknis sesuai nama yang
tercantum pad a Sertifikat Produksi atau Izin Penyalur Alat Kesehatan (lPAK).
Jika Pimpinan Perusahaan berhalangan untuk menandatangani, dapat
diwakilkan kepada orang lain yang ditunjuk dengan melampirkan Surat Kuasa
dari Pimp inan Perusahaan bermaterai Rp . 6000.
FORM A. DATA ADMINISTRASI
1. Sertifikat Produksi
Sertifikat produksi alat kesehatan adalah sertifikat yang diberikan kepada
perusahaan yang akan melakukan produksi atau mengemas ulang alat
kesehatan di Indonesia . Sertifikat Produksi alat kesehatan dikeluarkan
oleh Menteri Kesehatan RI cq Direktorat Jenderal Bina Kefarmasian dan
Alat Kesehatan .
Sertifikat Produksi berlaku selama 5 tahun . Jika pada saat registrasi izin
edar alat kesehatan masa berlaku Sertifikat Produksi kurang dari 6 bulan,
lampirkan Sertifikat Produksi beserta rekomendasi dari Dinas Kesehatan
Provinsi setempat dan Tanda Terima dari loket ULT Kemenkes .
Sertifikat Produksi harus mencantumkan jenis produk yang didaftar. Jika
jenis produk belum tercantum , Pemohon harus melakukan penambahan
(addendum) jenis produk melalui Dinas Kesehatan Provinsi .
yang masih berlaku beserta rekomendasi dari Dinas Kesehalan Provinsi
dan Tanda Terima dan lokel ULT Kemenkes.
2. Izin Penyalur Alat Kesehatan (IPAK)
Izin Penyalur AlaI Kesehalan (IPAK) adalah izin yang diberikan kepada
perusahaan yang melakukan dislribusi/penyaluran alaI kesehalan . Izin
Penyalur AlaI Kesehalan dikeluarkan oleh Menleri Kesehalan RI cq
Direklur Jenderal Bina Kefarmasian dan AlaI Kesehalan.
IPAK harus mencanlumkan kelompok alaI kesehatan yang boleh
disalurkan sesuai kemampuan sarana sbb :
Alkes non eleklromedik non sleril
Alkes non eleklromedik sleril
Alkes eleklromedik non radiasi
Alkes eleklromedik radiasi
IV Diagnostik dan Reagensia
Jika belum ada kelompok alaI kesehalan yang akan didaftar harus
melakukan penambahan (addendum) kelompok produk dalam IPAK
melalui Dinas Kesehalan Provinsi.
IPAK wajib dilampirkan bila .
Mendaftarkan alaI kesehalan impor
Mendaftarkan alaI kesehalan dalam negeri oleh Penyalur AlaI
Kesehalan .
IPAK berlaku selerusnya selama perusahaan masih aklif melakukan
kegialan penyaluran alaI kesehalan.
Jika ada perubahan nama Pimpinan Perusahaan dan/alau Penanggung
Jawab Teknis pada IPAK. Pernohon masih dapal melakukan regislrasi
alaI kesehalan dengan melampirkan IPAK lama beserta rekomendasi dari
Dinas Kesehalan Provinsi alauTanda Terima dari lokel UL T Kemenkes.
Unluk perubahan NPWP pada IPAK yang bukan karena perubahan
alamat. Pernohon harus membual sural permohonan perubahan NPWP
3. Surat Kuasa Sebagai Sole Agent / Sole Distributor I Letter of
Authorization (LoA)
Surat kuasa berisi penunjukan kepada distributor sebagai sole agent/sole distributor/exclusive agent/exclusive distributor. Jika distributor hanya ditunjuk sebagai agent/distributor saja, tambahkan surat kuasa untuk meregistrasi (to register) dari pabrik. Jadi, penunjukan kepada distributor harus mencakup kuasa untuk meregistrasi dan mendistribusi produk. LoA dibuat oleh pabrik Iprinsipal kepada distributor dengan masa berlaku keagenan minimal 2 tahun dan dilegalisasi KBRI setempat, dimana pabrik Iprinsipal berkedudukan untuk produk impor atau legalisasi notaris untuk produk dalam negeri.
Jika LoA tidak mencantumkan masa berlaku keagenan, lampirkan
Distribution Agreement atau surat konfirmasi dari pabrik yang mencantumkan masa berlaku keagenan. Distributor yang merupakan cabang pabrik, tidak perlu melampirkan distribution agreement walaupun LoA tidak mencantumkan masa berlaku keagenan.
Masa berlaku keagenan yang tercantum pada LoA akan menjadi acuan dalam menentukan masa berlaku izin edar alat kesehatan, maksimal 5 tahun sejak tanggal dikeluarkannya izin edar. Jika distributor adalah cabang dengan nama perusahaan sarna dengan nama pabrik, masa berlaku keagenan dihitung 5 tahun sejak tanggal dikeluarkannya izin edar.
Jika nama dan/atau alamat pabrik berbeda dengan prinsipal, lampirkan surat hubungan kerjasama pabrik dengan prinsipal.
4. Certificate of Free Sale (CFS)
Lembaga yang berwenang mengeluarkan CFS adalah Kementerian Kesehatan atau Ministry of Health atau Department of Health at au FDA sesuai peraturan negara setempat.
CFS harus mencantumkan nama dan tipe/ukuran produk yang didaftar, tandai/stabilo produk yang didaftar pada CFS jika tipe produk yang didaftarkan lebih dari satu.
Untuk produk alkes yang di negara pabrik bukan termasuk alkes, berikan
CFS dari Kementerian Perdagangan atau Chamber of Commerce atau
Asosiasi yang diakui dan lampirkan surat keterangan dari lembaga yang berwenang bahwa produk tersebut bukan alkes.
Untuk produk yang tidak dijual di negara produsen alat kesehatan berasal, CFS bisa digantikan dengan salah satu CFS dari negara-negara anggota GHTF (United States, Canada, Japan , Europe (United Kingdom ,German, 8elanda, Perancis, Italy, Spanyol) danAustralia) dengan mencantumkan nama dan alamat pabrik
Jika CFS dikeluarkan oleh instansi yang berwenang di Negara legal manufacturer maka harus mencantumkan nama dan alamat pabrik yang memproduksi (physical manufacturer/manufacturing site).
5. Sertifikasi Kesesuaian terhadap Standar
Lampirkan sertifikat ISO 9001, ISO 13485, dan CE bernomor yang masih berlaku dan dikeluarkan oleh Notified Body seperti TUV , SGS, 8S1 dsb. Nama dan alamat pabrik yang tercantum pad a sertifikat harus sama dengan nama dan alamat pabrik yang tercantum pada CFS .
Scope produk yang didaftar harus tercantum pada sertifikat .
6. Ringkasan Eksekutif (Executive Summary)
Ringkasan eksekutif mencakup informasi sebagai berikut :
Suatu tinjauan , misalnya informasi deskriptif untuk mengenali alat kesehatan , tujuan penggunaan dan indikasi
Sejarah pemasaran termasuk status peredaran prod uk tersebut di negara lain
Daftar izin dari pemerintah atau izin pemasaran yang diperoteh, dan Informasi penting yang berhubungan dengan keamanan/kinerja alat.
7. Standar yang Digunakan dan Bukti Kesesuaian Standar
Lampirkan Declaration of Conformity (DoC) yang dibuat oleh pabrik yaitu pernyataan dari pabrik mengenai standar-standar yang digunakan atau yang terlibat dalam pembuatan produk alat kesehatan.
Untuk alat kesehatan produksi dalam negeri, lampirkan Surat Pernyataan dari pabrik yang mencantumkan standar nasional atau internasional yang digunakan dalam memproduksi alat kesehatan antara lain ISO prod uk, SNI , Farmakope, ASTM . Surat Pernyataan bermaterai Rp. 6000,- dan ditandatangani oleh Pimpinan Perusahaan dan/atau Penanggung Jawab Teknis sesuai nama yang tercantum pad a Sertifikat Produksi serta lampirkan dokumen standar yang digunakan .
8. Surat Pernyataan Paten Merek/Surat Pelepasan Keagenan
a. Paten Merek/Pernyataan Merek
Untuk produk dalam negeri atau produk impor yang menggunakan merek sendiri, lampirkan Sertifikat Paten Merek dari Instansi yang berwenang . Jika produk yang digunakan menggunakan paten merek perusahaan/orang lain maka lampirkan surat kuasa penggunaan merek untuk prod uk yang didaftar dan ditandatangani oleh pemilik merek dan bermaterai Rp. 6000.
Jika belum memiliki Sertifikat Merek, lampirkan Surat Pernyataan Merek yang berisi pernyataan bahwa merek tersebut adalah milik perusahaan dan bersedia melepas merek bila ada pihak lain yang lebih berhak. Surat Pernyataan Merek bermaterai Rp. 6000,- dan ditandatangani oleh Pimpinan Perusahaan sesuai nama yang tercantum pada tPAK.
b. Surat Pelepasan Keagenan
didaftarkan dari pabrik tersebut apabila ada pihak yang lebih berhak. Surat Pelepasan Keagenan bermaterai Rp. 6000,- dan ditandatangani oleh Pimpinan Perusahaan sesuai nama yang tercantum pada IPAK .. Surat pernyataan melepas keagenan harus mencantumkan nama produk yang didaftar dan nama pabrik, dengan maksimal 5 (lima) produk dalam satu surat.
Penyalur yang merupakan cabangl perwakilan pabrik (nama
perusahaan sama dengan nama pabrik), tidak perlu melampirkan Surat Pelepasan Keagenan .
9. Surat Pernyataan Keaslian Data
Surat Pernyataan keaslian data berisi pernyataan bahwa data dan dokumen yang diisi dan dilampirkan adalah sesuai asli. Surat Pernyataan
bermaterai Rp . 6000,- dan ditandatangani oleh Pimpinan
Perusahaan dan/atau Penanggung Jawab Tekn is sesuai nama yang
tercantum pada IPAK.
FORM B. INFORMASI PRODUK
1. Uraian Alat
Uraian alat termasuk : Cara penggunaan Indikasi penggunaan alat Material produk Kadaluarsa
2. Deskripsi dan Fitur Alat Kesehatan
Disamping gambaran umum dari alat kesehatan, diperlukan gambaran yang lebih detail untuk menjelaskan fungsi dari alat, konsep ilmiah dasar yang digunakan untuk mendasari penggunaan alat, komponen material
dan aksesori yang digunakan pada pengoperasian alat serta
3. Tujuan Penggunaan
Yang dimaksud di sini adalah penggunaan yang sesuai dengan lujuan penggunaan alai, yang dilengkapi dengan data yang disediakan oleh produsen alai kesehalan dalam benluk pelunjuk penggunaan serta kemampuan fungsional dari alaI. Mencanlumkan lujuan penggunaan dalam bahasa Indonesia sesuai pelunjuk penggunaan produk (Instruction For Use) .
4 . Indikasi
Uraian umum dari penyakil alau kondisi dimana alai kesehalan dapal mendiagnosa , merawal, mencegah, alau meringankan , serta melipuli uraian dari target pasien yang dituju. Mencanlumkan indikasi dalam bahasa Indonesia sesuai petunjuk penggunaan produk (Instruction For Use) .
5. Petunjuk Penggunaan
Semua informasi yang diperlukan dari pabrik alat kesehatan lerkait penggunaan, terrnasuk prosedur, metode, frekuensi , durasi, jumlah dan cara penyiapan yang harus diikuti untuk keamanan . Petunjuk yang diperlukan untuk dapat menggunakan alat dengan cara yang aman yang lerdapat pada alat atau kemasan . Mencantumkan petunjuk penggunaan dalam bahasa Indonesia sesuai petunjuk penggunaan produk (Instruction For Use).
6. Kontra Indikasi Uika ada)
Merupakan uraian umum dari penyakit atau kondisi dan populasi pasien yang tidak boleh menggunakan alat tersebut untuk tujuan diagnosa, perawatan , penyembuhan atau meringankan penyakil.
7. Peringatan (jika ada)
Informasi mengenai bahaya yang mungkin dapat エ・セ。、ゥL@ yang harus diketahui oleh pengguna sebelum menggunakan alaI. Mencantumkan peringatan dalam bahasa Indonesia sesuai petunjuk penggunaan produk
(Ins/ruction For Use).
8. Perhatian (jika ada)
Perhatian kepada pengguna mengenai hal-hal yang perlu
diperhatikan untuk menjamin keamanan dan kemanfaatan alat dalam penggunaan
Perhatian ini termasuk hal-hal yang perlu dilakukan untuk menghindari efek terhadap pasien/pengguna alat yang tidak berpotensi mengancam jiwa atau menimbulkan cidera serius, tetapi perlu diketahui oleh pengguna alat
Perhatian ini dapat membuat pengguna waspada terhadap efek yang tidak diinginkan dari penggunaan atau kesalahan penggunaan alat dan hal-hal yang diperlukan untuk menghindari efek tersebut
Mencantumkan perhatian dalam bahasa Indonesia sesuai petunjuk penggunaan produk (Instruction For Use)
9. Potensi Efek yang Tidak Diinginkan (jika ada)
Potensi efek yang tidak diinginkan dan berakibat serius (kematian, cidera atau kejadian serius lainnya) terhadap pasien atau pengguna atau efek samping yang ditimbulkan pada penggunaan alat kesehatan secara normal. Mencantumkan potensi efek yang tidak diinginkan dalam bahasa Indonesia sesuai petunjuk penggunaan produk (Instruction For Use)
10. Alternalif Terapi (jika ada)
Merupakan uraian dari cara atau prosedur alternatif unluk mendiagnosa, merawat, mengobali atau meringankan penyakit yang merupakan tujuan
penggunaan alai lersebul. Mencanlumkan alternalif lerapi dalam bahasa
11. Material
Uraian dari material penyusun alat kesehatan serta sitat fisik yang diperlukan untuk membuktikan kesesuaian dengan prinsip utama yang berhubungan .
Informasi yang diberikan harus meliputi bah an kimia , biologis, dan karakter fisik dari komponen alat kesehatan secara lengkap. Nama bah an bakulformula/komponen yang digunakan. Untuk formula , berikan secara kualitatif dan kuantitatif dengan jumlah sampai 100% dan fungsi tiap bahan atau mencantumkan komponen bahan baku penyusun produk. Lampirkan formula/komponen bahan baku dari pabrik.
12. Informasi Pabrik (jika ada)
Bagian ini merupakan ringkasan atau rujukan atau berisi dokumentasi yang berhubungan dengan proses produksi, termasuk pengukuran jaminan mutu yang memadai sesuai dengan tingkat kerumitan dan tingkat resiko alaI. Mencantumkan informasi mengenai legal manufacturer, pabrik tempat produksi dan fasilitas sterilisasi produk (untuk produk steril) Informasi yang diberikan adalah nama dan alamat fasilitas terkail. 13. Proses Produksi
Informasi proses pembuatan alat :
Harus diberikan dalam bentuk daftar dari sumber daya dan kegiatan dari mulai produksi sampai produk jadi
Dapat berupa flowchart lengkap proses produksi
Jika ada beberapa fasilitas yang terkait dalam pembuatan alat. maka informasi untuk setiap fasilitas perlu disertakan seperti sertitikasi jaminan mutu yang dikeluarkan oleh pihak ketiga yang terakreditasi Perusahaan yang dikontrak (Tool Manufacture) oleh pabrik alat kesehatan untuk membuat atau memproses seluruhl sebagian alat harus memberikan informasi pembuatan
Contoh :
pengendalian yang digunakan unluk pembualan, pengemasan, penandaan dan penyimpanan.
FORM C. INFORMASI SPESIFIKASI DAN JAMINAN MUTU
1. Jelaskan karakteristik fungsional dan spesifikasi kinerja teknis alat Spesifikasi leknis alaI kesehalan merupakan karaklerislik fungsional dari alaI kesehalan yang dihasilkan unluk membuklikan dengan kesesuaian prinsip ulama produk. Parameler kesesuaian produk yang lerdapal dalam spesifikasi anlara lain melipuli : gambar produk Oika ada), lermasuk kimia, fisika, eleklrik, mekanis, biologi, piranli lunak, slerililas, slabililas, penyimpanan, pengangkulan dan pengemasan.
2. Berikan informasi tambahan karakteristik alat yang belum
dicantumkan pada bag ian sebelumnya (jika ada)
Informasi penling lenlang karaklerislik alaI yang belum dicanlumkan pada bag ian sebelumnya yang diperlukan unluk membuktikan kesesuaian lerhadap prinsip utama.
3. Berikan ringkasan dari verifikasi rancangan dan dokumen validasi (validasi steril)
Bagian ini berisi ringkasan alau referensi alau verifikasi desain dan dala validasi desain yang diperlukan, sesuai dengan lingkal kerumilan dan resiko dari alaI. Unluk alaI kesehalan noneleklromedik sleril yang diperlukan adalah validasi proses slerilisasi yailu dokumen yang berisi proses validasi slerilisasi yang dilakukan oleh pabrik pembual produk alkes sleril.
Jika sterilisasi dilakukan oleh pihak ketiga harap lampirkan sertifikat ISO untuk perusahaan yang melakukan sterilisasi serta lampirkan hasil uji steril untuk produk tersebut.
4. Studi Pre-klinis (wajib untuk kelas 0)
Kemampuan material untuk menghasilkan respon biologis sesuai dengan aplikasi dalam tubuh . Untuk mengetahui suatu bahan tidak mempunyai pengaruh toksik terhadap fungsi biologi tubuh, untuk menguji komponen suatu bahan, apakah dapat diterima oleh tubuh , serta memiliki potensi toksik atau tidak.
Rineian harus dilengkapi dengan semua uji biokompatbilitas yang dilakukan terhadap material dari alat kesehatan, eontohnya uji Genotoxieity, Citotoxieity, Sensitization dan uji biokompatibilitas lainnya yang berlaku untuk produk tersebut. Sekurang kurangnya harus dilakukan pada produk jadi. Semua material yang berbeda seeara signifikan harus dapat ditandai. Informasi tempat pengujian, hasil dan analisa data harus diberikan .
Untuk produk dengan formula atau komponen yang sama dari satu produsen, data uji biokompatibilitas dari produk lain dengan fonmula atau komponen yang sama, dapat dilampirkan sebagai justifikasi untuk produk yang didaftarkan .
Data uji fisik pre-klinis lengkap harus ada sesuai kebutuhan . Laporan ini harus meliputi tujuan, metodologi, hasil dan kesimpulan dari pabrik alat kesehatan terhadap keseluruhan penelitian fisik alat kesehatan dan komponen .
Pengujian fisik harus dilakukan untuk memperkirakan kemampuan respon alat terhadap tekanan fisiologi, kondisi dan gaya yang tidak diinginkan, penggunaan jangka panjang dan semua hal yang dapat menyebabkan kegagalan . Uji pre-klinis pada hewan yang mendukung kemungkinan efektivitas pada manusia harus dilaporkan.
percobaan. Alasan (dan keterbatasan) dari pemilihan hewan percobaan
tertentu harus dijelaskan.
5. Berikan hasil pengujian validasi piranti lunak Uika dapat diterapkan)
Ketepatan piranti lunak (software) adalah karakteristik kritis produk yang tidak dapat diverifikasi secara keseluruhan pada produk jadi
6. Hasil penelitian untuk alat yang mengandung material biologi
Harus diberikan hasil penelitian yang memuat kecukupan pengukuran
yang berhubungan dengan material yang mempunyai resiko dapat
menularkan. Termasuk pernyataan bebas virus dari bahaya yang sudah
diketahui. Pernyataan bebas virus diperoleh dari instansi yang
berwenang, contohnya dari Departemen Pertanian atau Hewan (instansi
berwenang di Negara Asal hewan).
Penapisan donor harus dijelaskan sepenuhnya dan metode
pengambilannya harus dijelaskan. Hasil validasi proses dibutuhkan untuk
menunjukkan proses produksi sudah dapat meminimalkan reaksi biologis.
7. Bukti klinis (wajib untuk kelas D)
Evaluasi klinis merupakan suatu penilaian dan analisa dari data klinis
berkaitan dengan alat kesehatan demi memastikan keamanan dan kinerja
alat tersebut secara klinis.
Bagian ini menyatakan bagaimana persyaratan prinsip utama untuk
evaluasi klinis alat telah dipenuhi. Jika dapat diterapkan , evaluasi ini
dapat berbentuk studi pustaka yang sistematis, bukti klinis pada alat yang
serupa atau dengan melakukan investigasi klinis.
Investigasi klinis terutama diperlukan oleh alat kesehatan dengan resiko
yang lebih tinggi atau untuk alat kesehatan yang tidak atau sedikit sekali
memiliki bukti klinis .
Penggunaan daftar pustaka
harus spesifik untuk alat tersebut berdasarkan urutan kronologis . Harus dipastikan agar rujukan yang diberikan masih berlaku dan relevan . Bukti klinis efektivitas meliputi investigasi terhadap alat yang dilakukan di dalam atau di luar negen. Bukti klinis dapat diperoleh dari publikasi yang berhubungan dengan literatur ilmiah hasil penelaahan bersama .
Dokumen bukti klinis harus meliputi tujuan , metodologi dan hasil yang sesuai cakupan uji klinis, jelas dan bermakna . Kesimpulan dari hasil uji klinis harus didahului dengan pembahasan sesuai literatur yang sudah dipublikasikan .
Kesimpulan hasil uji klinis dapat berupa pemyataan safety dan efficacy
atau kesesuaiannya dengan ォゥョ・セ。@ prod uk.
Untuk produk innovator, Pemohon harus melampirkan hasil uji klinis terpublikasi untuk produk yang didaftarkan . Sedangkan untuk produk noninnovator/me too , Pemohon dapat melampirkan hasil studi literatur atau hasil uji klinis dari pabrik.
Untuk produk diagnostik in vitro HIV harus menyertakan uji klinis dari RSUPN Dr. Cipto Mangunkusumo.
8. Anallsa resiko dari alat (wajib untuk kelas 0)
Merupakan proses mengidentifikasi , memperkirakan , dan
memprioritaskan resiko yang ada, diikuti dengan pengkoordinasian serta aplikasi ekonomis dari sumber daya untuk meminimalkan, memonitor dan mengontrol kemungkinan serta akibat dari kejad ian yang tidak diinginkan dari suatu produk alat kesehatan .
Berupa ringkasan, atau rujukan atau hasil dari analisa resiko . Analisa resiko harus berdasarkan standar internasional atau standar lain yang diakui dan harus disesuaikan dengan tingkat kerumitan dan tingkat resiko alat.
9. Hasil analisa resiko (wajib untuk kelas 0)
Resiko tidak langsung dari alat kesehatan yang diakibatkan oleh bahaya
dari alat penyerta seperti bag ian bergerak yang dapat menyebabkan
cidera yang berkelanjutan , atau bahaya yang berhubungan dengan
pengguna .
Penilaian terhadap resiko dibandingkan dengan keuntungan dari alat dan
metode yang digunakan untuk mengurangi resiko sampai ke tingkat yang
dapat diterima harus dijabarkan . Orang atau organisasi yang melakukan
analisis resiko harus disebutkan dengan jelas.
Teknik yang digunakan untuk melakukan analisa resiko harus disebutkan
secara rinci untuk memastikan bahwa analisa ini memadai untuk alat dan
resiko yang terkait.
10. Berikan spesifikasi dan atau persyaratan bahan baku
(wajib untuk kelas 0)
Merupakan spesifikasi bah an baku atau sertifikat analisa (CoA) zat aktif
yang digunakan untuk mengetahui apakah bahan baku yang digunakan
telah memenuhi standar kualitas yang dipersyaratkan. CoA zat aktif
diberikan oleh supplier bahan baku yang digunakan oleh pabrik .
11. Berikan spesifikasi kemasan (produk diagnostik)
Penjelasan mengenai jenis, bahan , ukuran dan warna kemasan (misal:
botol kaca 5 ml, tidak berwarna), bahan baku kemasan primer dan
sekunder (misal: PVC)
12. Berikan data hasil analisis dan atau uji klinis (spesifisitas,
sensitivitas dan stabllitas) untuk pereaksi atau produk diagnostik in
vitro
Evaluasi Karakteristik (Performance characteristic evaluation) produk jadi meliputi: metode/prosedur (spesifisitas, sensitivitas dan akurasi), hasil
(spesifisitas, sensitivitas dan akurasi) dan kesimpulan .
Data stabilitas dapat dibuat berdasarkan waktu sebenarnya (realtime stability study) rnaupun dipercepat (accelerated stability study), sesuai dengan klaim yang diberikan.
13. Berikan hasil uji analisis dan atau uji klinis dan keamanan alat kesehatan (CoA produk jadi)
Merupakan sertifikat analisa produk jadi (CoA) yang dikeluarkan oleh bag ian QAlQC pabrik yang menguji/mengetahui apakah produk jadi yang dihasilkan telah memenuhi persyaratan sesuai spesifikasi yang ditentukan oleh pabrik pembuat. CoA produk jadi dapat juga dikeluarkan oleh legal manufacturer dengan melampirkan pernyataan bahwa data hasil pengujian produk jadi tersebut sesuai dengan hasil pengujian yang dilakukan oleh pabrik asal (physical manufacturer/ manufacturing site) .
CoA produk jadi harus mencakup parameter yang diuji terhadap alat kesehatan yang dihasilkan , spesifikasinya serta hasil uji yang jelas dan mencantumkan nilai spesifik tertentu .
Untuk produk alat kesehatan nonelektromedik tertentu harus
mencantumkan hasil uji terhadap produk dari laboratorium terakreditasi di Indonesia. Alat kesehatan tersebut antara lain adalah disposable syringe,
kondom , kasa,kapas serap keperluan medis, pembalut wanita, panty liner
dan popok dewasa.
Untuk produk syringe berikan hasil uji sterilitas dari laboratorium di Indonesia yang sudah terakreditasi. Jika pabrik tidak memiliki data hasil uji pirogenitas dan toksis itas , lampirkan hasil pengujian 2 parameter tersebut dari laboratorium di Indonesia yang sudah terakreditasi
Untuk produk kondom berikan hasil uji daya letup dan kebocoran dari laboratorium di Indonesia yang sudah terakreditasi
Untuk produk kasa , kapas serap keperluan medis, popok dewasa, pembalut wan ita, pantyliner, harus memberikan hasil uji daya serap
dan fluorese nsi dari laborato ri u m d i Indonesia ya ng sudah
FORM D. PETUNJUK PENGGUNAAN
1. Contoh penandaan
Merupakan uraian dan informasi produk yang melekat pada alat. seperti
manual untuk pengguna, penandaan pada kemasan , materi promosi,
brosur produk dan sebagainya.
Bagian ini berisi ringkasan atau acuan atau berisi data penandaan yang
diperlukan sesuai dengan kerumitan dan tingkat resiko alaI. Contoh
penandaan pada alat dan kemasannya (Ii hat Permenkes 1190 pasal 26
ayat 5) sebagai berikut :
Petunjuk penggunaan
Literatur lain atau bahan pelatihan
Petunjuk pemasangan dan pemeliharaan Uika ada)
Setiap informasi dan petunjuk yang diberikan kepada pasien ,
termasuk petunjuk untuk setiap prosedur yang harus dilakukan oleh
pasien Uika ada)
Nama produk
Nama dan alamat pabrik
Nama dan alamat penyalur
Nama dan alamat perusahaan representatif Uika ada)
Penempatan nomor izin edar
Jumlah box/netto
Lot number
Hal hal lain tentang penandaan :
Berupa desain kemasan produk jadi, pembungkus alat, label yang
menempel pada prod uk dan/atau kemasan
Informasi produk dalam bentuk cetakan, tulisan atau grafik pada atau
melekat pada satu atau lebih kemasan , termasuk kemasan luar atau
pembungkus wadah luar
Setiap penandaan kemasan yang tidak tersedia pada kemasan luar
harus mudah dilihat dari kemasan luar
Jika secara fisik tidak memung kinka n u ntuk menyertakan contoh dari
direkatkan pada mesinl, maka cukup diberikan contoh dengan menggunakan metode alternatif (seperti brosur dengan spesifikasi teknisl, sesuai yang diperlukan
Penandaan nonelektromedik yang berupa blister dan/atau dus harus mencantumkan ukuran dan spesifikasi produk. Untuk produk steril harus mencantumkan tanggal kadaluarsa dan cara sterilisasi Penandaan diberikan dua rangkap dan berwarna
2. Contoh penandaan pada alat dan kemasannya
Harus memberikan informasi dan penjelasan terhadap simbol-simbol yang terdapat pada kemasan/label dan penjelasannya seperti batch no, serial nomor, dU.
3. Petunjuk penggunaan, materi pelatihan & petunjuk pemasangan dan pemeliharaan
Merupakan:
Petunjuk penggunaan umumnya merujuk pada buku panduan dokter, panduan pengguna, panduan operator, panduan pemberi resep atau panduan rujukan.
Berisi arahan agar dokter dan pengguna dapat menggunakan alat dengan aman dan sesuai dengan tujuan penggunaannnya.
Bagian ini harus berisi informasi ten tang indikasi, kontraindikasi, peringatan, perhatian, kemungkinan adanya efek yang tidak diinginkan, alternatif terapi dan kondisi yang harus diatur selama
penggunaan normal untuk mempertahankan keamanan dan
efektivitas alat.
Jika memungkinkan, bagian ini harus termasuk petunjuk untuk pelatihan bagi pengguna agar mampu menggunakan alat sesuai dengan tujuannya, serta melakukan pemasangan dan pemeliharaan alat.
4. Berikan kode produksi dan artinya
Bagian ini harus menjelaskan kode produksi (/ol/batchlserial number) dan arti kode tersebut dari pabrikasal.
5. Daftar aksesoris
Berisi daftar tipe/kode atau aksesoris produk yang didaftarkan sesuai katalog yang akan dilampirkan pada izin edar
Aksesoris adalah merupakan bag ian yang tidak terpisah dari alat utama agar bisa berfungsi sebagaimana mestinya
FORM E. POST MARKET EVALUATION
1. Berikan prosedur yang digunakan dan sistem pencatatan,
penanganan komplain, dll.
Post Market evaluasi adalah evaluasi yang dilakukan terhadap keamanan dan efikasi alat kesehatan setelah diedarkan di pasaran.
Uraian ini meliputi Standar Operational Procedure (SOP) atau Prosedur Tetap (Protap) dari :
Fonmulir pencatatan Penanganan komplain Kejadian yang tidak diinginkan
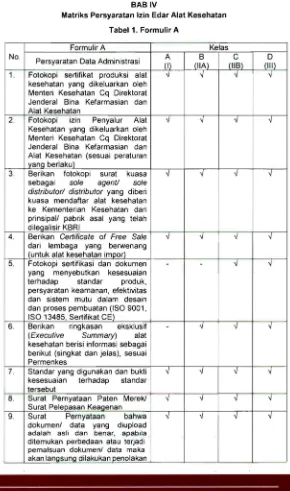
BAB IV
[image:35.423.57.347.68.559.2]Matriks Persyaratan Izin Edar Alat Kesehatan
Tabel1. Formulir A
No.
Formulir A Kelas
Persyaratan Data Administrasi A (I) B (IIA) C (lIB) D (III) 1. Fotokopi sertifikat produksi alat
kesehatan yang dikeluarkan oleh Menteri Kesehatan Cq Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan
-.J
" "
-.J2 . Fotokopi izin Penyalur Alat Kesehatan yang dikeluarkan oleh Menteri Kesehatan Cq Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan (sesuai peraturan yang berlaku)
v
-.J -.Jv
3. Berikan fotokopi surat kuasa sebagai sole agenV sole distributor/ distributor yang diberi kuasa mendaftar alat kesehatan ke Kementerian Kesehatan dari prinsipall pabrik asal yang telah dilegalisir KBRI
v
" "
v
4 . Berikan Certificate of Free Sale
dari lembaga yang berwenang (untuk alat kesehatan impor)
-J -J -J -J
5. Fotokopi sertifikasi dan dokumen yang menyebutkan kesesuaian terhadap standar produk, persyaratan keamanan, efektivitas dan sistem mutu dalam desain dan proses pembuatan (ISO 9001, ISO 13485, Sertifikat CE) Berikan ringkasan eksklusif
(Executive Summary) alat
kesehatan berisi informasi sebagai berikut (sing kat dan jelas), sesuai Permenkes
-
-
-J"
6 .
-
-.J -.Jv
7. Standar yang digunakan dan bukti kesesuaian terhadap standar
tersebut
" "
-.J -J
8. Surat Pernyataan Paten Merek! Surat Pelepasan Keaoenan
v
v
v
v
9. Surat Pernyataan bahwa dokumenl data yang diupload adalah asli dan benar, apabila . ditemukan perbedaan atau terjadi pemalsuan dokumenl data maka akan langsung dilakukan penolakan
label 2. Formulir B
No,
Formulir B Kelas
Persyaralan Informasi Produk A (I) B (IIA) C (liB) D (III) 1, Uraian alallerdiri dari :
-
Oeskripsi alai-
lujuan penggunaan Iindikasi
-
Material atau komponen produk- Kelerangan lentang masa kadaluarsa (unluk produk slerillreagensia)
-
Brosur/Qambar produkv
v
v
v
2, Deskripsi dan filur alai kesehalan
v
v
v
..J3, Tujuan penggunaan
" "
"
"
4 , Indikasi 'i
j
" "
5, Pelunjuk penggunaan
"
v
v
v
6, Konlraindikasi Uika ada)
"
"
" "
7, Peringalan Uika ada)
" " "
v
8, Perhalian (jika ada)
v
"
"
v
g, Polensi efek yang lidak diinginkan (jika ada)
10, Altemalif lerapi Uika ada)
-
-"
"
11 , Malerial
v
v
"
v
12, Informasi pabrik
" "
v
"
13, Proses produksi" " "
v
label 3. Formulir C
No,
Formulir C Kelas
Informasi dan Spesifikasi Mulu A (I) B (IIA) C (liB) D
Uill
1, Karaklerislik fungsional danspesifikasi kinerja leknis alai
v
"
"
v
2 Informasi lambahan karaklerislik alai yang belum dicanlumkan pada baQian sebelumnya
v
"
"
v
3 Ringkasan verifikasi rancangan dan dokumen validasi
v
v
v
v
4, Siudi Pre-klinis
-
-
-"
5, Hasil pengujian validasi piranli lunak (jika dapal dilerapkan)
v
6. Hasil penelitian alat yang
mengandung material biologi
" " " "
7. Bukti klinis
-
-
-"
8. Analisa resiko dari alat
-
--
v
9. Hasil ana lisa resiko
-
-
-
v
10. Spesifikasi dan atau persyaratan bahan baku
-
-" -"
11. Spesifikasi kemasan (produk diagnostik)
12. Berikan data hasil analisis dan atau uji klinis (spesifisitas, sensitivitas dan stabilitas) untuk pereaksi atau produk diagnostik in vitro)
13. Berikan hasil uji analisisl hasil uji klinis dan keamanan alat
v
v
v
v
Tabel 4. Formulir 0
No. Formulir D Kelas
Persyaratan Data Administrasi A (I) B (IIA) C (liB) D (III) 1. Contoh penandaan
" " " "
2. Penjelasan penandaaan
v
v
v
v
3. Petunjuk penggunaan, materi pelatihan dan petunjuk
pemasangan serta pemeliharaan
"
"
" "
4. Kode produksi dan artinya
"
" "
"
5. Daftar aksesoris
v
v
v
v
Tabel 5. Formulir ENo.
Formulir E Kelas
Post Market Evaluation A (I) B (IIA) C (liB) D (III) 1. Prosedur yang digunakan dan
sistem pencatatan, penanganan komplain, dU.
[image:37.422.68.355.83.470.2]Lampiran 1 Formulir Pendaftaran Alat Kesehatan
DIREKTORAT JENDERAL BlNA KEFARMASIAN DAN ALAT KESEHATAN
DIREKTORAT BINA PRODUKSI DAN DlSTRIBUSI ALAT KESEHATAN
PERMOHONAN PENDAFTARAN ALAT KESEHATAN
PERATURAN MENTERI KESEHATAN RI
NOMOR ... ..
TANGGAL ... ..
ALAT KESEHATAN
DALAM NEGERI 0
IMPORT 0
Nama Perusahaan yang mendaftarkan Alamal Lengkap dan Nomor T efepon Alamat Surat-menyurat dan Nomor T elepon
2. NPWP
3. Nama Oagang AlaI Kesehatan
4 . Kategon dan Sub Kategori AlaI Kesehatan
5. HS Code
6. Kelerangan lain mengenai AlaI Kesehatan (Tipe, Netto, lsi, Kemasan, Ukuran)
7. Nama Pemberi lisensi Alamat lengkap
6. Nama PabJik Induk Alamat lengkap
9. Nama Penerima lisensi Alamat lengkap
10 Permohonan ini dilengkapi dengan ... lampiran (sebulkan jumlahnya)
Jakarta , .
Tanda Tangan Tanda Tangan
Penanggung Jawab Tekms Pimpinan Perusahaan
Lampiran 2
Kategori dan Sub Kategori Alat Kesehatan dan PKRT
KATEGORI DAN SUB KATEGORI ALAT KESEHATAN
1. PERALA TAN KIMIA KLiNIK DAN TOKSIKOLOGI KLiNIK a. Sistem Tes Kimia Klinik
b. Peralatan Laboratorium klinik c. Sistem Tes Toksikobgi klinik
2. PERALATAN HEMATOLOGI DAN PATOLOGI a. Pewarna Biological
b. Produk Kultur Sel dan Jaringan c. Peralatan dan Asesori Patologi d. Pereaksi Penyedia Specimen
e. Peralatan Hematologi Otomatis dan Semi Otomatis f. Peralatan Hematologi Manual
g. Paket dan Kit hematologi h. Pereaksi Hematologi
Produk yang digunakari dalam pembuatan sediaan darah dan sediaan berasal dan darah
3. PERALATAN IMUNOLOGI DAN MIKROBIOLOGI a. Peralatan Diagnostika
b. Peralatan Mikrobiologi c. Pereaksi Serologi
d. Perlengkapan dan Pereaksi Laboratorium Imunologi e. Sistem Tes Imunologikal
f . Sistem Tes Imunologikal Antigen Tumor
4. PERALA TAN AN ESTES I
a. Peralatan Anestesi Diagnostik b. Peralatan Anestesi Pemantauan c. Peralatan Anestesi Terapetik d. Peralatan Anestesi Lainnya
5. PERALATAN KARDIOLOGI
c. Peralatan Kardiologi Prostetik d. Peralatan Kardiologi Bedah e. Peratatan Kardiologi Terapetik
6. PERALA T AN GIGI
a. Peralatan Gigi Diagnostik b. Peralatan Gigi Prostetik c. Peralatan Gigi Bedah d. Peralatan Gigi Terapetik e. Perala tan Gigi Lainnya
7. PERALATAN TELINGA, HIDUNG DAN TENGGOROKAN (THT) a. Peralatan THT Diagnostik
b. Peralatan THT Prostetik c. Peralatan THT Bedah d. Peralatan THT Terapetik
8. PERALATAN GASTROENTEROLOGI -UROLOGI (GU ) a. Peralatan GU Diagnostik
b. Peralatan GU Pemantauan c. Peralatan GU Prostetik d. Peralatan GU Bedah e. Peralatan GU Terapetik
9. PERALATAN RUMAH SAKIT UMUM DAN PERORANGAN (RSU & P) a. Peralatan RSU & P Pemantauan
b. Peralatan RSU & P Terapetik c. Peralatan RSU & P Lainnya
10. PERALATAN NEUROLOGI
a. Peratatan Neurologi Diagnostik b. Peralatan Neurologi Bedah c. Peralatan Neurotogi Terapetik
11 . PERALATAN OBSTETRIK DAN GINEKOLOGI (OG) a. Peralatan OG Diagnostik
e. Peralatan OG Terapetik f. Peralatan Bantu Reproduksi
12. PERALATAN MATA
a. Peralatan Mata Diagnostik b. Peralatan Mata Prostetik c. Peralatan Mata Bedah d. Peralatan Mata Terapetik
13. PERALATAN ORTOPEDI
a. Peralatan Ortopedi Diagnostik b. Peralatan Ortopedi Prostetik c. Peralatan Ortopedi Bedah
14 . PERALATAN KESEHATAN FISIK
a. Peralatan Kesehatan Fisik Diagnostik b. Peralatan Kesehatan Fisik Prostetik c. Peratatan Kesehatan Fisik terapetik
15. PERALATAN RADIOLOGI
a. Peralatan Radiologi Diagnostik b. Peralatan Radiologi Terapetik c. Peralatan Radiologi Lainnya
16. PERALATAN BEDAH UMUM DAN BEDAH PLASTIK a. Peralatan Bedah Diagnostik