INDUKSI KALUS EMBRIOGENIK DUA GENOTIPE MUTAN
JAGUNG (
Zea mays
L.) PADA MEDIA DASAR MS DAN N6
RISKA APRISA
A24070034
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
RINGKASAN
RISKA APRISA. Induksi Kalus Embriogenik Dua Genotipe Mutan Jagung (Zea mays L.) pada Media Dasar MS dan N6. (Dibimbing oleh SURJONO H. SUTJAHJO dan DEWI SUKMA).
Adanya pengaruh genotipe dalam perbanyakan klon jagung, menyebabkan perlu dilakukan penelitian yang spesifik terhadap genotipe tertentu yang ingin dikembangkan untuk tujuan pemuliaan. Penelitian bertujuan untuk mempelajari pengaruh komposisi media dan ukuran eksplan (embrio muda) terhadap induksi kalus embriogenik dari dua genotipe mutan jagung. Genotipe mutan yang digunakan berasal dari galur G8 (SgPD/660/15) dan G3 (Gw92D343L4DMR PC3S4-56) yang telah diradiasi sinar gamma, diseleksi dan dimurnikan hingga generasi ketujuh. Penelitian dilaksanakan dari bulan Februari 2011-Januari 2012. Tempat penelitian di Laboratorium Kultur Jaringan 1, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Penelitian terbagi menjadi dua percobaan. Percobaan pertama disusun menggunakan Rancangan Acak Kelompok (RAK) dengan tiga faktor. Pengelompokan berdasarkan hari tanam, karena hari tanam yang berbeda dengan eksplan yang sama menyebabkan kesegaran eksplan berbeda-beda akibat adanya penyimpanan. Faktor pertama adalah genotipe, yaitu G3M7 dan G8M7. Faktor kedua adalah panjang embrio, yaitu 0.3 cm dan 0.4 cm. Faktor ketiga adalah komposisi media yang terdiri atas 6 komposisi media yaitu 1) N6 + 2 ppm 2.4-D; 2) N6 + 3 ppm 2.4-D; 3) N6 + 6 ppm 2.4-D; 4) MS + 6 ppm 2.4-D; 5) MS + 2 ppm 2.4-D + 100 mg/l arginin + 2 mg/l glycine + 100 mg/l glutamine; 6) MS + 1 ppm 2.4-D + 1 % mannitol. Semua kombinasi perlakuan ditanam dalam 10 kelompok, sehingga terdapat 240 satuan percobaan (botol kultur). Setiap botol kultur ditanam 5 eksplan sebagai satuan amatan.
digunakan pada percobaan kedua adalah G8M7 karena diketahui lebih baik dalam menginduksi kalus pada percobaan pertama.
Hasil percobaan pertama menunjukkan Genotipe G8M7 dapat menginduksi kalus kompak embriogenik (tipe I) pada komposisi media N6 + 2 ppm 2.4-D, MS + 6 ppm 2.4-D, MS + 2 ppm 2.4-D + 100 mg/l arginin + 2 mg/l glycine + 100 mg/l glutamine dan MS + 1 ppm 2.4-D + 1 % mannitol. Media terbaik berdasarkan jumlah kalus kompak dan embriogenik (kalus tipe I) untuk genotipe G8M7 adalah MS + 6 ppm 2.4-D, namun tidak ada tunas yang terbentuk dari kalus embriogenik yang diinduksi. Selanjutnya untuk media terbaik berdasarkan jumlah planlet yang dihasilkan adalah media MS + 2 ppm 2.4-D + asam amino (arginin, glutamin, dan glycine). Genotipe G3M7 hanya dapat menginduksi kalus embriogenik dan planlet pada media N6 + 3 ppm 2.4-D. Eksplan embrio muda dengan panjang 0.3 cm dan 0.4 cm dapat diinduksi menjadi kalus embriogenik. Komposisi media MS + 6 ppm 2.4-D dan N6 + 6 ppm 2.4-D menghambat pertumbuhan organogenesis tunas dan akar pada kalus embriogenik. Media pendewasaan yang digunakan dalam penelitian adalah MS + 1 ppm 2.4-D + 1 % mannitol. Interaksi hanya terjadi pada 2 hari setelah tanam (HST) terhadap waktu dan persentase pembentukan kalus. Interaksi genotipe dan ukuran eksplan mempengaruhi bobot kalus yang dihasilkan.
INDUKSI KALUS EMBRIOGENIK DUA GENOTIPE MUTAN
JAGUNG (
Zea mays
L.) PADA MEDIA DASAR MS DAN N6
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
RISKA APRISA
A24070034
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
Judul
: Induksi Kalus Embriogenik Dua Genotipe Mutan
Jagung (
Zea mays
L.) pada Media Dasar MS dan N6
Nama
: RISKA APRISA
NIM
:
A24070034
Menyetujui,
Pembimbing I Pembimbing II
Prof. Dr. Ir. Surjono H. Sutjahjo, M.S. Dr. Dewi Sukma, S.P., M.Si. NIP 19600204 198503 1 003 NIP 19700404 199702 2 001
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian
Dr. Ir. Agus Purwito, M.Sc.Agr. NIP 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Pangkalan Bun, Kalimantan Tengah pada tanggal 27 April 1989 sebagai putri kedua dari pasangan Bapak Musyahadad (Alm.) dan Ibu Romdanah.
Pendidikan SD, SMP dan SMA ditempuh di Pangkalan Bun (Kal-Teng) berturut-turut lulus, pada tahun 2001, 2004, dan 2007. Penulis melanjutkan pendidikan di Institut Pertanian Bogor melalui jalur USMI, Departemen Agronomi dan Hortikultura, Fakultas Pertanian. Selama kegiatan perkuliahan, penulis aktif dalam beberapa kepanitiaan dan organisasi. Organisasi yang pernah diikuti penulis diantaranya IAAS (International Association of students in Agricultural and related Sciences) Local Committee IPB sebagai staf Divisi
Project dan menjabat sebagai manajer Express Course IAAS (2008/2009). Tahun
2009 penulis aktif di Himpunan Mahasiswa Agronomi (HIMAGRON) sebagai sekretaris umum. Selain organisasi, penulis pernah berkesempatan mengikuti PIMNAS XXII di Universitas Brawijaya, Malang (2009) dan The Second International Agricultural Student Symposium di Universiti Putra Malaysia
(2010).
Penulis juga berkesempatan menjadi asisten paktikum mata kuliah Dasar Pemuliaan Tanaman, Dasar Teknologi Benih, dan Pembiakan Tanaman pada tahun ajaran 2010/2011. Penulis juga telah mengikuti berbagai pelatihan-pelatihan selama menjadi mahasiswa Institut Pertanian Bogor.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberi kekuatan dan hidayah sehingga skripsi ini dapat diselesaikan. Penulis menyampaikan terimakasih kepada Prof. Dr. Ir. Surjono H. Sutjahjo, M.S. sebagai pembimbing akademik sekaligus dosen pembimbing skripsi I dan Dr. Dewi Sukma, S.P., M.Si. sebagai dosen pembimbing skripsi II atas semua ilmu, bimbingan, arahan, saran, serta motivasi yang diberikan sejak perkuliahan sampai masa penyusunan rencana, pelaksanaan dan penulisan skripsi ini.
Rasa terimakasih disampaikan pula kepada:
1. Dr. Ir. Ni Made Armini Wiendi, M.S. sebagai dosen penguji, atas nasihat yang diberikan dan masukan yang sangat membangun dalam perbaikan skripsi ini.
2. Seluruh staf pengajar Departemen Agronomi dan Hortikultura atas semua ilmu yang diberikan.
3. Ir. Atra Romeida M.S. dan Dr. Rustikawati M.Si. atas bimbingan dan arahan sebelum dan selama penelitian berlangsung.
4. Ibu Juariah selaku laboran dan para peneliti yang berkerja di Laboratorium Kultur Jaringan 1 atas perhatian, kerjasama dan bantuan selama penelitian. 5. Ibunda dan saudari-saudariku tercinta atas iringan do’a yang tiada henti,
pengertian, harapan, kepercayaan, motivasi, dukungan materil sehingga studi ini dapat terselesaikan.
6. Teman-teman Kost Andaleb 2, Pondok Rizky dan AGH 44 atas rasa persahabatan dan kekeluargaan selama studi berlangsung.
7. Seluruh pihak yang membantu dalam penelitian dan penyusunan skripsi ini. Penulis berharap dengan adanya skripsi ini dapat bermanfaat bagi pengembangan ilmu pengetahuan khususnya di bidang pertanian.
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
Hipotesis... 3
TINJAUAN PUSTAKA... 4
Botani dan Syarat Tumbuh Jagung ... 4
Kultur Jaringan ... 5
Embriogenesis Somatik ... 10
Regenerasi Tanaman dari Kultur Jaringan Jagung ... 13
BAHAN DAN METODE ... 17
Tempat dan Waktu Percobaan ... 17
Bahan dan Alat ... 17
Metode Percobaan ... 18
Pelaksanaan Percobaan ... 20
Penanaman Bahan Eksplan Penelitian ... 20
Sterilisasi Alat dan Botol ... 21
Pembuatan Media Kultur ... 21
Sterilisasi Sumber Eksplan dan Penanaman in vitro ... 21
Pengamatan ... 22
HASIL DAN PEMBAHASAN ... 25
Percobaan 1 ... 25
Kondisi Umum ... 25
Waktu dan Persentase Eksplan Membentuk Kalus ... 27
Respon Perkembangan Eksplan pada Media Induksi Kalus Embriogenik ... 29
Persentase Kalus Embriogenik (Tipe I) dan Struktur Embrio ... 36
Diameter dan Bobot Kalus ... 42
Warna Kalus ... 44
Respon Pembentukan Organ Akar dan Tunas ... 47
Percobaan 2 ... 52
Kondisi Umum ... 52
Respon Perkembangan Eksplan pada Media Induksi Kalus Embriogenik ... 52
Waktu dan Persentase Pembentukan Kalus ... 53
Diameter dan Bobot Kalus ... 54
Persentase Eksplan Membentuk Akar ... 56
Persentase Kalus Embriogenik (Tipe I) dan Jumlah Struktur Embrio ... 56
KESIMPULAN DAN SARAN ... 59
Kesimpulan ... 59
Saran ... 59
DAFTAR PUSTAKA ... 60
DAFTAR TABEL
No. Halaman
1. Senyawa organik yang umum digunakan dalam media kultur
jaringan ... 7 2. Zat pengatur tumbuh yang umum digunakan dalam kultur
jaringan ... 8 3. Persentase kontaminasi eksplan (embrio muda) jagung dalam
media induksi kalus embriogenik ... 25 4. Rekapitulasi sidik ragam waktu dan persentase eksplan berkalus
jagung ... 27 5. Pengaruh komposisi media induksi kalus embriogenik terhadap
waktu dan persentase eksplan berkalus jagung ... 28 6. Pengaruh genotipe, ukuran eksplan, dan komposisi media induksi
kalus embriogenik jagung terhadap persentase eksplan yang
mengalami pemanjangan koleoptil dan berakar (7HST)... 30 7. Pengaruh genotipe, ukuran eksplan, dan komposisi media induksi
kalus embriogenik terhadap persentase eksplan membentuk kalus
lembut (soft callus) jagung pada 7 HST ... 33 8. Pengaruh interaksi genotipe dan komposisi media induksi kalus
embriogenik terhadap persentase kalus kompak jagung (7 HST) ... 35 9. Pengaruh media induksi kalus embriogenik terhadap persentase
jumlah kalus kompak yang berpotensi embriogenik pada dua
genotipe dan ukuran eksplan jagung ... 37 10.Pengaruh media induksi kalus embriogenik terhadap jumlah kalus
tipe I, struktur embrio dan planlet jagung yang terbentuk pada 8
MST... 38 11.Rekapitulasi sidik ragam rata-rata diameter dan bobot kalus
jagung ... 42 12.Pengaruh genotipe, ukuran eksplan dan komposisi media induksi
kalus embriogenik jagung terhadap rataan diameter dan bobot
kalus pada 2 MST ... 43 13.Pengaruh interaksi genotipe dan ukuran eksplan terhadap rataan
bobot kalus jagung (2 MST) pada tiap komposisi media induksi
kalus embriogenik ... 44 14.Persentase eksplan membentuk organ tunas pada media induksi
15.Pengaruh media induksi kalus embriogenik terhadap bobot (2-3 MST), diameter (2 MST), waktu dan persentase pembentukan
kalus jagung G8M7 ... 54 16.Persentase kalus kompak, kalus tipe I, jumlah struktur embrio dan
tunas yang terbentuk pada media induksi kalus embriogenik
DAFTAR GAMBAR
No. Halaman
1. Keseimbangan Auksin dan Sitokinin dalam Proses Morfogenesis... 9 2. Perbandingan antara Embriogenesis Somatik dan Embriogenesis
Zigotik (Zimmerman, 1993) ... 12 3. Struktur Kimia Zat Pengatur Tumbuh 2.4-D ... 13 4. Perkembangan Embrio Zigotik Jagung (Rochon et al., 1998) ... 14 5. Proses Pengambilan Embrio Jagung (a) Arah Pemotongan Kernel;
(b) Pengeluaran Embrio dari Kernel ... 22 6. Respon Perkembangan Eksplan (Embrio Muda) Jagung Umur 1
MST terdiri atas Pemanjangan Koleoptil (K); a) Pembentukan Kalus Kompak (Kk); b) Pembentukan Akar (A); c) Pembentukan
Kalus Lembut (Kl); dan d) Kalus Embriogenik Tipe I Umur 3 MST.... 23 7. Kualifikasi Warna Kalus yang Terbentuk pada Induksi Kalus dari
Dua Genotipe Mutan Jagung (Keterangan: didasarkan pada
keragaan kalus penelitian) ... 24 8. Bagan Alir Proses Kultur Pembentukan Embrio Zigotik Sekunder
Jagung Selama Penelitian ... 26 9. Eksplan pada Kultur Jaringan Jagung yang Terkontaminasi (a)
Kontaminasi Bakteri yang Berasal dari Eksplan; (b) Kontaminasi
Cendawan yang Berasal dari Media Kultur... 26 10.Skema Proses Perkembangan Eksplan (Embrio Muda) Jagung
Selama Penelitian ... 29 11.Keragaan Pertumbuhan Koleoptil dari Embrio Zigotik Jagung pada
Media N6A (N6 + 2 ppm 2.4-D) dan N6C (N6 + 3 ppm 2.4-D) ... 31 12.Eksplan Membentuk Kalus Lembut Jagung. (a) Struktur Kalus
Lembut Menyerupai Akar pada 1 MST; (b) Kalus Lembut pada 2 MST dan Struktur Menyerupai Akar Masih Tampak; (c) Pertumbuhan Dominan Kalus Lembut pada G3M7 dengan Umur Eksplan 14 HSS; (d) Kalus Lembut yang Berasal dari Daerah Koleoptil dilihat dengan Mikroskop Diseksi; (e) Tunas Berwarna
Ungu yang Tumbuh dari Permukaan Kalus Lembut. ... 32 13.Eksplan yang Membentuk Kalus Kompak Jagung dengan Banyak
Nodul a) Kalus Kompak Berwarna Kuning Tembus Cahaya; b) Kalus Kompak yang Memiliki Sedikit Warna Putih Tidak Tembus
Cahaya ... 35 14.Kalus Embriogenik Jagung Genotipe G8M7 yang Membentuk
15.Perkembangan Kalus Embriogenik Jagung Genotipe G8M7 Sampai Membentuk Tunas a) Struktur Koleptilar ditunjukkan Mata Panah (3 MST); b) Struktur Skutelar ditunjukkan Mata Panah (5 MST); c)
Terbentuk Tunas (8MST) ... 41 16.Perkembangan Kalus Embriogenik Jagung Genotipe G3M7 (0.3)
Sampai Membentuk Tunas a) Struktur Embrio Terbentuk pada Media Pendewasaan (36 HST) Menunjukkan Ciri Kalus Tipe I, Kompak, Putih, dan Struktur Menyerupai Skutelar; b) Terbentuk
Tunas (41 HST); c) Tunas umur 48 HST ... 41 17.Grafik Pola Perubahan Warna Kalus Jagung ... 45 18.Grafik Persentase Kalus Hijau Jagung 1-3 MSK pada Beberapa
Media Induksi Kalus Embriogenik ... 47 19.Grafik Pengaruh Media Induksi Kalus Embriogenik terhadap
Persentase Eksplan Berakar Jagung ... 48 20.Keragaan Pertumbuhan Organ Akar pada Kalus Jagung dalam
Media MS9 (MS + 1 ppm 2.4-D + 1 % mannitol) dan MS6 (MS + 6 ppm 2.4-D). Komposisi Media MS9 Mendorong Pertumbuhan Akar
yang Lebih Banyak ... 49 21.Kalus Jagung yang Menghasilkan Nodul diduga Embriogenik, pada
Perkembangannya Nodul Membentuk Akar (Umur 30 HST) ... 50 22.Akar yang Terbentuk pada Kalus Jagung saat di Subkultur ke
Media Pendewasaan dan Regenerasi (a) Akar pada Kalus Embriogenik dalam Media Pendewasaan MS9; (b) Akar pada Kalus
Embriogenik dalam Media Regenerasi MS0 ... 50 23.Grafik Pengaruh Media Induksi Kalus Embriogenik Jagung G8M7
terhadap Respon Pemanjangan Tunas, Pembentukan Akar, Kalus
Lembut (Soft Callus) dan Kalus Kompak (Compact Callus) 7 HST ... 53 24.Grafik Perubahan Warna pada Kalus Jagung Percobaan 2 ... 55 25.Pengaruh Media Induksi Kalus Embriogenik Jagung G8M7
terhadap Persentase Eksplan Berakar... 56 26.Perkembangan Kalus Embriogenik Jagung sampai Membentuk
Tunas pada media P2M (MS + 2 ppm Picloram); a) Struktur Embrio Koleoptilar ditunjukkan Mata Panah (4 MST); b) Kalus Embriogenik Jagung G8M7 pada Media Pendewasaan MS9 (MS + 1 % mannitol + 1 ppm 2.4-D) Umur 6 MST; c) Tunas yang
Terbentuk pada 8 MST ... 57 27.Perkembangan Kalus Embriogenik Jagung G8M7 pada Media MS2
(MS + 2 ppm + 2.4-D); a) Kalus Embriogenik (Tipe I) Jagung yang ditunjukkan Mata Panah pada Tahap Pendewasaan; (b) Tahap
DAFTAR LAMPIRAN
No. Halaman
1. Rekapitulasi Beberapa Penelitian Embriogenesis Jagung ... 64
2. Komposisi Media Murashige dan Skoog. ... 71
3. Komposisi Media Chu (N6) ... 71
4. Embrio yang dihasilkan dari Dua Genotipe Mutan Jagung (a) Ukuran Embrio G8M7 dengan Umur 12-13 HSS; (b) Ukuran Embrio G3M7 dengan Umur 14 HSS ... 72
5. Sidik Ragam Persentase Eksplan Membentuk Kalus 1 HST (Percobaan 1) ... 72
6. Sidik Ragam Persentase Eksplan Membentuk Kalus 2 HST (Percobaan 1) ... 72
7. Sidik Ragam Persentase Eksplan Membentuk Kalus 3 HST (Percobaan 1) ... 73
8. Sidik Ragam Persentase Eksplan Membentuk Kalus 4 HST (Percobaan 1) ... 73
9. Sidik Ragam Persentase Eksplan Membentuk Kalus 5 HST (Percobaan 1) ... 73
10.Sidik Ragam Persentase Eksplan Membentuk Kalus 6 HST (Percobaan 1) ... 74
11.Sidik Ragam Persentase Eksplan Membentuk Kalus 7 HST (Percobaan 1) ... 74
12.Sidik Ragam Respon Pemanjangan Koleoptil (Percobaan 1) ... 75
13.Sidik Ragam Respon Pembentukan Akar (Percobaan 1) ... 75
14.Sidik Ragam Respon Pembentukan Kalus Lembut (Percobaan 1) ... 75
15.Sidik Ragam Respon Pembentukan Kalus Kompak (Percobaan 1)... 76
16.Sidik Ragam Bobot Kalus 2-3 MST (Percobaan 1) ... 76
17.Sidik Ragam Kalus Kompak (Percobaan 1) ... 77
18.Sidik Ragam Bobot Kalus 2 MST (Percobaan 2) ... 77
PENDAHULUAN
Latar Belakang
Jagung (Zea mays L.) merupakan tanaman C4 yang ditandai dengan aktivitas fotosintesis tinggi serta potensi hasil biji dan biomassa yang bernilai ekonomis. Pemanfaatan jagung tidak hanya untuk bahan pangan tetapi juga sebagai pakan ternak, bahan baku industri, dan biofuel. Selain itu, jagung yang termasuk tanaman monokotil juga tergolong spesies tanaman menyerbuk silang, Oleh karena sifat-sifat agronominya, jagung sering digunakan menjadi tanaman model untuk penelitian dasar maupun yang bersifat aplikatif.
Penelitian mengenai regenerasi tanaman jagung melalui kultur jaringan telah dilakukan sejak tahun 1982 oleh Green dan Philips. Hingga saat ini, perbaikan sifat tanaman jagung melalui pendekatan bioteknologi dengan mengkombinasikan teknik kultur jaringan dan transformasi genetik, telah sampai pada aplikasinya dalam pembentukan jagung transgenik. Tahapan awal dalam kultur jaringan jagung adalah mencari protokol untuk menginduksi kalus embriogenik lalu meregenerasikannya menjadi tanaman utuh. Oleh Green dan Philips (1983) induksi kalus embriogenik jagung telah berhasil diinisiasi dari eksplan embrio muda. Kalus embriogenik yang dihasilkan dibedakan menjadi dua tipe yaitu tipe I dan tipe II. Kalus tipe I memiliki ciri kompak, sedangkan kalus tipe II remah. Kalus tipe I telah ditemukan pada banyak nomor genotipe jagung sementara kalus tipe II hanya pada genotipe tertentu seperti A188 (genotipe jagung subtropis) dan beberapa hibrida silangan A188.
Duncan et al. (1985) menemukan bahwa dalam kultur jaringan jagung ukuran embrio, genotipe, dan zat pengatur tumbuh dalam media kultur sangat berpengaruh terhadap induksi kalus embriogenik pada jagung. Adanya pengaruh genotipe dalam perbanyakan klon jagung secara in vitro, menyebabkan perlu adanya penelitian spesifik tiap genotipe jagung yang ingin dikembangkan untuk kebutuhan pemuliaan.
berbagai taraf konsentrasi 2.4-D. Hasil yang diperoleh menunjukkan bahwa galur G8 (SgPD/660/15) dan G3 (Gw92D343L4DMR PC3S4-56) menunjukkan frekuensi kalus embriogenik tertinggi (100%) daripada genotipe lain. Sementara untuk tipe kalus embriogenik yang dihasilkan dari penelitian tersebut tidak dijelaskan.
Selanjutnya oleh Sutjahjo et al. (2009) galur G3 dan G8 diinduksi mutasi radiasi menggunakan sinar gamma, lalu diseleksi secara in vivo (di lapang) dan in vitro (dalam botol kultur) ke arah toleran tanah masam. Tanaman hasil seleksi
yang diperoleh kemudian dimurnikan sampai generasi ke-4. Galur mutan yang diperoleh kemudian diuji daya gabung melalui persilangan dialel untuk menghasilkan kultivar hibrida nasional yang toleran terhadap tanah masam. Hasil penelitian tersebut menunjukkan hibrida G3 x G8 merupakan salah satu hibrida yang memiliki penampilan vegetatif dan vigor yang baik pada tanah masam Podsolik Merah Kuning Jasinga. Galur mutan G3 dan G8 selanjutnya terus dikembangkan untuk pemuliaan lanjut.
Tujuan
Tujuan penelitian ini adalah:
1. Mempelajari pengaruh kombinasi media dan ukuran eksplan (embrio muda) pada umur tertentu terhadap daya pembentukan kalus embriogenik dua genotipe mutan jagung.
2. Mengetahui perkembangan kalus embriogenik dua genotipe mutan jagung secara morfologi dalam lingkungan in vitro.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1. Terdapat respon yang berbeda dari dua genotipe mutan jagung terhadap media induksi kalus.
2. Terdapat komposisi media yang dapat meningkatkan induksi kalus embriogenik dari dua genotipe mutan jagung.
3. Ukuran atau umur eksplan (embrio muda) memberikan pengaruh yang berbeda dalam pembentukan kalus embriogenik.
TINJAUAN PUSTAKA
Botani dan Syarat Tumbuh Jagung
Jagung merupakan salah satu anggota dari famili Gramineae (Poaceae), subfamili Panicoideae, ordo Andropogoneae, subordo Tripsacineae dan genus Zea. Jagung merupakan tanaman pangan beriklim panas dan pada dasarnya
tumbuh pada temperatur antara 21-30 oC (70-86 F), meskipun benih berkecambah optimum pada temperatur yang lebih rendah, antara 18-21 oC (64-58 F) (Martin, 1989). Jagung menunjukkan pertumbuhan yang kerdil pada suhu dibawah 10 oC dan diatas 45 oC. Hasil atau produksi tinggi ditemukan di area dimana jagung membutuhkan waktu 130-140 hari untuk mencapai kematangan (White dan Johnson, 2003). Varietas-varietas yang adaptif pada hari panjang di daerah berilklim sedang akan menjadi pendek dan tidak produktif pada hari pendek di daerah beriklim tropis. Produktivitas jagung akan berkurang di tanah yang cukup masam (pH <5) atau tanah basa (pH >8) (Martin, 1989).
Jagung merupakan salah satu spesies pertama yang diketahui memiliki lintasan fotosintesis asam dikarboksilat C4. Tanaman C4 lebih efisien dalam penggunaan air daripada kebanyakan tanaman C3. Daun jagung memiliki laju fotosintesis yang tinggi, tingkat kompensasi CO2 yang rendah, dan tidak jenuh cahaya untuk fotosintesis, sekalipun saat cahaya matahari penuh (Fisher dan Palmer, 1992).
Heterozigositas dan keragaman genetik adalah karakteristik dari tanaman menyerbuk silang. Berdasarkan ilmu pemuliaan, varietas jagung dapat dibedakan menjadi dua yaitu varietas bersari bebas (open pollinated) dan hibrida. Sumber polen pada jagung bersari bebas dapat berasal dari tetua yang berbeda. Hal ini menyebabkan di suatu pertanaman jagung bersari bebas tidak ada jagung yang benar-benar tepat memiliki genotipe yang sama (Poehlman dan Sleper, 1995).
Jagung hibrida menggantikan kultivar bersari bebas karena produksi jagungnya yang lebih tinggi. Potensi untuk hasil tinggi adalah sasaran yang kompleks disebabkan oleh ekspresi gen yang berasosiasi dengan pengambilan nutrisi, fotosintesis, transpirasi, translokasi, dan metabolisme pada tanaman jagung, serta interaksi gen dengan lingkungan. Produksi hasil juga dipengaruhi oleh asosiasi gen dengan karakter-karakter yang berperan dalam stabilitas produksi, seperti kemasakan optimum, kualitas batang, dan ketahanan terhadap stres lingkungan atau ketahanan terhadap hama penyakit (Poehlman dan Sleper, 1995).
Kultur Jaringan
Kultur jaringan adalah suatu metode untuk mengisolasi bagian dari tanaman, seperti protoplasma, sel, sekelompok sel, jaringan dan organ, serta menumbuhkannya dalam kondisi aseptik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi mejadi tanaman utuh kembali (Gunawan, 1992). Teknik ini digunakan untuk tujuan propagasi, modifikasi genotipe (pemuliaan tanaman), produksi biomassa produk-produk biokimiawi, patologi tanaman, penyimpanan dan pengawetan, penelitian ilmiah dan lain-lainnya (Hartmann et al., 1990).
ginogenesis. George et al. (2008) mengelompokkan jenis regenerasi tanaman dalam dua tipe kultur yaitu kultur struktur terorganisir (cultures of organized structures) dan kultur struktur tidak terorganisir (cultures of unorganized
structure). Pengelompokan kultur tersebut berdasarkan asal eksplan.
Kultur struktur terorganisir (kultur organ). Kultur organ digunakan sebagai istilah umum untuk jenis-jenis kultur dimana suatu pertumbuhan bentuk organ dapat dipelihara secara kontinyu. Hal ini mencakup kultur meristem (meristem cultures), kultur tunas ujung atau kultur tunas, kultur node (node culture) dari mata tunas leteral yang terpisah, kultur isolasi akar (isolated root
cultures dan kultur embrio (embryo cultures).
Kultur struktur yang tidak terorganisir. Kultur jaringan umumya digunakan sebagai sebuah istilah untuk mendeskripsikan semua jenis kultur tanaman secara in vitro. Walaupun seharusnya hanya mengacu pada kultur agregat sel yang tidak terorganisir. Jenis kultur berikut ini yang paling umum dikenal yaitu: kultur kalus (atau jaringan), kultur suspensi, kultur protoplasma dan kultur anther.
Kultur jaringan memerlukan media kultur yang mampu memenuhi kebutuhan hara tanaman. Media kultur jaringan terdiri atas kompenen-komponen yang dapat dikategorikan menjadi empat kelompok: elemen mineral, senyawa organik, zat pengatur tumbuh (ZPT), dan pH media (Acquaah, 2004).
1. Elemen mineral
Elemen mineral terdiri atas nutrisi makro dan mikro seperti yang terdapat dalam tanah mineral. Beberapa komposisi dari elemen mineral yang paling umum digunakan adalah media Murashige dan Skoog (MS). Elemen mineral terdiri atas nutrisi inorganik yang berfungsi sebagai nutrisi makro dan mikro bagi tanaman. Nutrisi makro meliputi Nitrogen dari NO3 dan NH4, Fosfor (P), dan Pottasium (K). Nutrisi mikro meliputi Ca, Mg, Cl, Fe, S, Na, B, Mn, Zn, Cu, Mo, Co, dan I.
2. Senyawa Organik
vitamin, dan myo-inositol (Tabel 1). Gula yang paling umum adalah sukrosa, gula utama yang ditransportasikan di hampir semua spesies tanaman (Acquaah, 2004).
Tabel 1. Senyawa organik yang umum digunakan dalam media kultur jaringan
Senyawa Fungsi
Gula Biasanya sukrosa (terkadang fruktosa, glukosa, sorbitol); energi karbon; berkontribusi dalam potensial osmotik.
Vitamin Biasanya thiamine (B1), tetapi juga nicotinic acid (niacin/ B2), pyridoxine (B6), vitamin C, E; syarat untuk metabolisme karbohidrat.
Myo-inositol
Gula alkohol; memiliki peran pada perkembangan membran dan dinding sel.
Organik kompleks
Meliputi santan, ekstrak ragi (yeast), jus buah; secara umum meningkatkan pertumbuhan.
Arang aktif Menyerap senyawa racun yang dikeluarkan oleh jaringan tanaman; membantu dalam induksi akar.
3. Zat pengatur tumbuh
Tabel 2. Zat pengatur tumbuh yang umum digunakan dalam kultur jaringan
Senyawa Fungsi
Auksin Menyebabkan pemanjangan sel, akar adventif dan dormansi apikal. Berguna juga untuk induksi kalus dari eksplan dan embriogenesis somatik. Contoh auksin alami adalah Indole-3-Acetic Acid (IAA), Indole-3-Butyric Acid (IBA), auksin sintetik
meliputi 1-Naphthalene Acetic Acid (NAA), 2.4-Dichlorophenoxy Acetic Acid (2.4-D), 2.4.5-Trichloropenoxy Acetic Acid (2.4.5-T),
Dicamba, Tordon 4-CPA, dan Picloram.
Sitokinin Menyebabkan dampak yang berlawanan terkait dominansi apikal. Sering menghambat embriogenesis dan induksi akar. Terdiri atas sitokinin alami (contohnya zeatin) dan sintetik (contohnya benzyladine atau BA, kinetin)
Giberellin Peran utamanya adalah untuk memicu pemanjangan batang dan pembungaan. Hanya dua bentuk yang dapat digunakan dalam kultur jaringan yaitu GA3 dan GA4+7.
Menurut Wattimena et al. (1992) peran fisiologi auksin adalah mendorong pemanjangan sel, pembelahan sel, diferensiasi jaringan xylem dan floem, pembentukan akar, dominansi apikal, respon tropisme, menghambat pengguguran daun, bunga dan buah, pada tanaman diocious berperan dalam pembentukan bunga betina. Peran fisiologis sitokinin adalah mendorong pembelahan sel, morfogenesis, pertunasan, pembentukan kloroplas, pemecahan dormansi, pembukaan stomata, pembentukan buah partenokarpi dan pembentukan umbi pada kentang. Sitokinin juga menghambat senescence dan absisi. Contoh sitokinin sintetik lainnya adalah 2-iP, PBA. Konsentrasi yang diperlukan dari masing-masing ZPT tersebut (auksin dan sitokinin) tergantung dari: jenis eksplan, kondisi (lingkungan kultur) serta jenis sitokinin dan auksin yang dipergunakan.
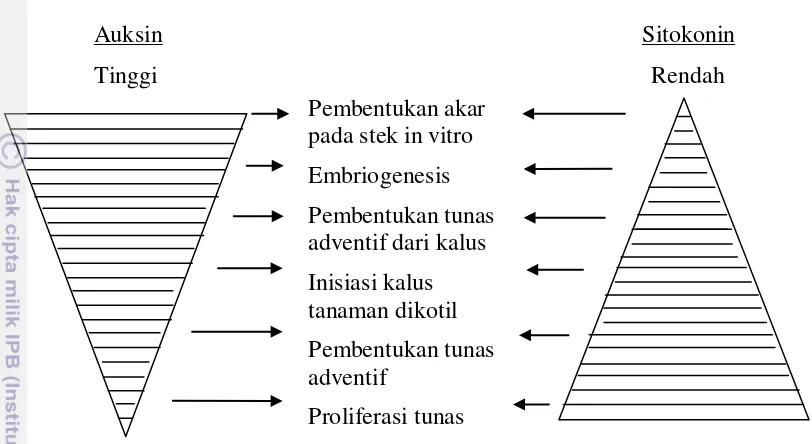
dari Skoog dan Miller (1975) digambarkan oleh George dan Sherrington (1984) dalam Wattimena et al. (1992) seperti pada Gambar 1.
.
Auksin Sitokonin
Tinggi Rendah
Gambar 1. Keseimbangan Auksin dan Sitokinin dalam Proses Morfogenesis
Gambar tersebut menjelaskan tentang keseimbangan auksin dan sitokinin sebagai berikut:
1. Pembentukan akar pada stek in vitro hanya memerlukan auksin tanpa sitokinin atau dengan sitokinin dalam konsentrasi rendah sekali.
2. Embriogenesis memerlukan nisbah auksin sitokinin yang tinggi (konsentrasi auksin lebih tinggi dari konsentrasi sitokinin).
3. Pembentukan akar adventif dari kalus selain auksin tetap dibutuhkan sitokinin.
4. Pembentukan kalus dari tanaman dikotil tetap memerlukan sitokinin disamping auksin yang tinggi, sedangkan pada tanaman monokotil pembentukan kalus hanya membutuhkan auksin yang tinggi tanpa sitokinin.
5. Pembentukan tunas adventif disamping memerlukan sitokinin dalam taraf konsentrasi yang tinggi tetap diperlukan juga auksin dalam taraf konsentrasi rendah.
Pembentukan akar pada stek in vitro Embriogenesis Pembentukan tunas adventif dari kalus Inisiasi kalus tanaman dikotil Pembentukan tunas adventif
6. Proliferasi tunas aksilar hanya memerlukan sitokinin dalam konsentrasi yang tinggi, tanpa auksin atau dengan auksin dalam konsentrasi yang rendah sekali.
Embriogenesis Somatik
Embriogenesis somatik adalah proses dimana sel somatik berkembang melalui tahapan embriogeni menjadi tanaman utuh tanpa fusi gamet. Embriogenesis somatik dapat terjadi secara langsung (direct) dengan sel embriogenik berkembang secara langsung dari sel eksplan, atau secara tidak langsung (indirect) dengan sejumlah ketidak teraturan, siklus mitosis non embrionik yang terjadi antara jaringan eksplan terdiferensiasi dan struktur embrionik (Merkle et al., 1990). Struik (1991) menyatakan dalam artian yang lebih sederhana bahwa embriogenesis somatik dapat terjadi melalui dua jalur yang berbeda, secara tidak langsung (setelah beberapa tipe kultur kalus) dan secara langsung (tanpa fase pertumbuhan kalus). Secara skematis menurut Wattimena et al. (1992) tahapan kultur kalus (morfogenesis secara tidak langsung) tersebut
adalah:
Pembentukan tunas secara tidak langsung Planlet Eksplan Kalus
Embriogenesis tidak langsung Bibit
dan batang muda merupakan bagian yang mudah untuk dediferensiasi dan menghasilkan kalus (Gunawan, 1992)
Wattimena et al. (1992) mengelompokkan embriogenesis somatik secara tidak langsung menjadi empat, yaitu: (1) embriogenesis pada kultur kalus primer (kalus yang terbentuk dari eksplan pada tahap inisiasi), (2) embriogenesis pada kultur kalus sekunder yaitu kalus primer yang tidak memiliki kemampuan bermorfogenesis, namun bisa diinduksi melalui subkultur ke medium yang menginduksi morfogenesis, (3) embriogenesis dari kultur suspensi dimana embrio somatik dapat diinisiasi dari kalus embriogenik maupun dari kalus non-embriogenik, sel-selnya tetap memiliki kemampuan untuk beregenerasi membentuk embriosomatik dan pada umumnya embrio diinisiasi dari kalus yang dikulturkan dalam medium cair, (4) pembentukan protocorm pada kultur jaringan anggrek dan dapat dikatakan sebagai embriogenesis. Disamping terbentuk langsung dari eksplan, protocorm juga dapat terbentuk secara tidak langsung dari kalus atau kultur suspensi.
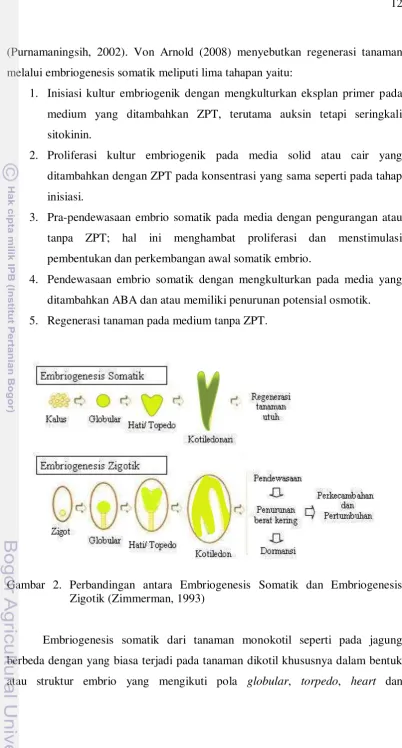
Embrio somatik adalah suatu struktur bipolar yang bebas, yang secara fisik tidak menempel pada jaringan asalnya dan dihasilkan dari suatu sel somatik (sel yang tidak reproduktif dan mengandung dua set kromosom). Tidak seperti embrio zigotik yang diproduksi secara seksual (hasil dari reproduksi seksual) (Struik, 1991). Vajrabhaya, (1988) menyebutkan bahwa embrio zigotik dan embrio somatik berasal dari sumber yang berbeda, namun memiliki kesamaan urutan dari bentuk embrio mulai tahapan globular, hati, dan torpedo (embriogenesis). Embrio somatik bisa berasal dari sel tunggal atau bahkan protoplas, tetapi juga dapat dikembangkan dari banyak sel yang berasal dari sumber yang sama. Menurut Gray (2005) embrio zigotik dan non-zigotik memiliki pola perkembangan yang sama, yaitu melalui tahap globular, skutelar, dan koleoptilar untuk tanaman monokotil, atau tahap globular, hati, torpedo, dan kotiledonari untuk tanaman dikotil dan konifer. Zimmerman (1993) menggambarkan kesamaan tahapan embriogenesis somatik dan zigotik seperti pada Gambar 2.
(Purnamaningsih, 2002). Von Arnold (2008) menyebutkan regenerasi tanaman melalui embriogenesis somatik meliputi lima tahapan yaitu:
1. Inisiasi kultur embriogenik dengan mengkulturkan eksplan primer pada medium yang ditambahkan ZPT, terutama auksin tetapi seringkali sitokinin.
2. Proliferasi kultur embriogenik pada media solid atau cair yang ditambahkan dengan ZPT pada konsentrasi yang sama seperti pada tahap inisiasi.
3. Pra-pendewasaan embrio somatik pada media dengan pengurangan atau tanpa ZPT; hal ini menghambat proliferasi dan menstimulasi pembentukan dan perkembangan awal somatik embrio.
4. Pendewasaan embrio somatik dengan mengkulturkan pada media yang ditambahkan ABA dan atau memiliki penurunan potensial osmotik. 5. Regenerasi tanaman pada medium tanpa ZPT.
Gambar 2. Perbandingan antara Embriogenesis Somatik dan Embriogenesis Zigotik (Zimmerman, 1993)
cotiledonary. Embrio non-zigotik untuk tanaman monokotil memiliki pola
perkembangan melalui tahap globular, scutellar, dan coleoptilar (Gray, 2005). Berbagai hasil penelitian menunjukkan bahwa 2.4-D merupakan auksin yang efektif untuk induksi kalus embriogenik. Zat pengatur tumbuh tersebut merupakan auksin sintetis yang cukup kuat dan tahan terhadap degradasi karena reaksi enzimatik dan fotooksidasi (Purnamaningsih, 2002). Auksin sintetik, seperti 2.4-D, yang cukup efektif untuk memacu pembentukan dan proliferasi kultur embriogenik, biasanya tidak dimetabolisme oleh sel pada tingkat yang sama seperti auksin alami. Oleh karena itu, untuk menstimulasi pertumbuhan lebih lanjut dari embrio somatik perlu mentransfer kultur embriogenik pada medium yang rendah atau tanpa auksin. Salah satu mekanisme dimana auksin dapat mengatur embriogenesis adalah melalui pengasaman sitoplasma dan dinding sel (Zimmerman, 1993).
Konsentrasi 2.4-D yang paling umum digunakan adalah satu sampai sepuluh mikromolar. Kebutuhan auksin atau ZPT lain untuk inisiasi embriogenesis somatik secara umum ditentukan oleh stadia perkembangan jaringan eksplan (Kutschera, 1994 dalam Von Arnold, 2008). Gambar 3 menunjukkan struktur kimia dari 2.4-Dicholophenoxyacetic acid.
Gambar 3. Struktur Kimia Zat Pengatur Tumbuh 2.4-D
Regenerasi Tanaman dari Kultur Jaringan Jagung
(indirect atau melalui fase kalus). Embriogenesis secara langsung hampir selalu terjadi dalam sistem embriogenesis (Merkle et al., 1990). Finer (1995) dalam percobaan embriogenesis langsung pada jagung menyatakan bahwa produksi kalus biasanya justru tidak diinginkan jika tujuan penelitian adalah embriogenesis. Eksplan yang sering digunakan untuk menginduksi dan mempelajari embriogenesis secara langsung adalah embrio zigotik muda (Merkle et al., 1990). Jaringan ini secara alami telah embriogenik dan membutuhkan sedikit nutrisi dibandingkan jaringan embriogenik lainnya untuk menginduksi respon embrio somatik. Menurut Gunawan (1992), bagian tanaman seperti embrio muda, hipokotil, kotiledon dan batang muda merupakan bagian yang mudah untuk didiferensiasi dan menghasilkan kalus. Embrio zigotik juga harus berada pada suatu status perkembangan yang responsif. Umur embrio atau jumlah hari setelah polinasi harus dievaluasi guna menentukan stadia untuk induksi optimal (Finer, 1995). Proses perkembangan embrio zigotik jagung berdasarkan stadia umur setelah polinasi disajikan pada Gambar 4.
Gambar 4. Perkembangan Embrio Zigotik Jagung (Rochon et al., 1998)
Keterangan: HSP= Hari Setelah Polinasi; A) pembelahan sel zigotik; B) pretransisional proembrio; C) transisional proembrio; D) stadia koleoptilar; E) stadia koleptilar 1; F) Stadia koleptilar 2; ep= embrio proper; bc= sel dasar; s= suspensor; m= meristem; sc= skutelum; sa= apeks tunas; cr= cincin koleptilar; ea= aksis embrio.
meningkatkan proliferasi sel skutelar untuk menghasilkan kalus yang dapat diregenerasikan. Kalus yang dihasilkan kompak (pencampuran proliferasi dari seluruh jaringan kalus, meristem tunas, dan struktur menyerupai skutelum). Kalus
ini telah dimodelkan sebagai kalus ‘Tipe I’. Istilah Tipe I digunakan untuk
mendeskripsikan kalus jagung yang kompak dan embriogenik, mengindikasikan bahwa kalus yang kompak pada beberapa kasus mendukung organogenesis dan embriogenesis. Kalus Tipe I telah ditemukan pada banyak nomor genotipe jagung. Kalus tipe I yang dihasilkan memiliki ciri kompak dan pertumbuhannya lambat (Somers et al., 1988)
Kalus jagung yang friable dan embriogenik (tipe II) diisolasi dari sektor embriogenik yang ditemukan pada kalus tipe I A188 di laboratorium B.G. Gengenbach. Kalus ini berisi proembrio somatik dan embrio lahir dari suspensor (semacam suatu struktur, yang diperkirakan asal suatu sel tunggal). Oleh karena remah (friable) atau kurang kompak, dan pertumbuhannya cepat, kalus tipe II dipilih untuk digunakan dalam percobaan seleksi in vitro. Amstrong dan Green (1985) kemudian mendemonstrasikan bahwa prolin dikombinasikan dengan medium N6 mampu menginduksi kalus yang remah dan embriogenik pada genotipe A188. Kemanjuran prolin dalam menginduksi kalus remah dan embriogenik bergantung pada genotipe dan ukuran/ umur eksplan embrio muda. Hanya sedikit genotipe yang menghasilkan kalus remah dan embriogenik jika dibandingkan dengan jumlah yang menghasilkan kalus Tipe I. Berdasarkan studi genetik frekuensi inisiasi kalus tipe I dan II, telah menunjukkan bahwa inisiasi kalus yang dapat diregenerasikan pada jagung di kontrol dengan oleh hanya sedikit gen (Somers et al., 1988). Secara skematis regenerasi tanaman jagung dengan menggunakan eksplan embrio muda yang ditemukan oleh Green dan Philips (1975) dapat digambarkan sebagai berikut.
1. Eksplan (embrio muda) Kalus embriogenik tipe I (kompak) Planlet 2. Eksplan (kalus embriogenik tipe I) kalus embriogenik tipe II (remah)
Planlet
regenerasi tanaman juga dapat terjadi melalui embriogenesis somatik. Kedua tipe regenerasi tersebut berasal dari kalus yang keras, kompak, putih atau kuning yang dideskripsikan sebagai struktur mirip skutelar (scutellar) (Lu et al., 1983). Studi histologi memberikan fakta bahwa embriogenesis adalah jalur regenerasi tanaman yang lebih umum terjadi pada poliferasi jaringan kompak yang berasal dari skutelum embrio muda jagung (Vasil et al., 2005).
BAHAN DAN METODE
Tempat dan Waktu Percobaan
Penelitian dilaksanakan dari Februari 2011 sampai Januari 2012 di Laboratorium Kultur Jaringan 1, Departemen Agronomi dan Hortikultura, Fakultas Pertanian IPB. Eksplan (embrio muda) yang digunakan untuk penelitian diperoleh dari hasil pertanaman genotipe mutan di Kebun Percobaan Leuwikopo, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB Darmaga Bogor.
Bahan dan Alat
Bahan yang digunakan sebagai eksplan adalah embrio muda yang diambil dari dua genotipe mutan jagung generasi ke-7 (G3M7 dan G8M7), yang diperoleh dari pertanaman G3M6 dan G8M6 kemudian dilakukan penyerbukan sendiri. Eksplan (embrio muda) dalam penelitian ditentukan berdasarkan ukuran embrio dan tidak berdasarkan umur selfing (penyerbukan sendiri), hal ini disebabkan oleh penanaman jagung yang dilakukan di lapang. Penanaman di lapang mempengaruhi keberhasilan penyerbukan sendiri karena pembuahan di hari yang sama sangat dipengaruhi oleh faktor lingkungan. Eksplan embrio muda jagung pada genotipe G8M7 dengan panjang 0.3 cm diperoleh dari embrio yang berumur 12 hari setelah selfing (HSS), sedangkan embrio muda dengan panjang 0.4 cm diperoleh dari embrio yang berumur 13 HSS. Eksplan embrio muda jagung genotipe G3M7 dengan panjang embrio 0.3 cm diperoleh dari embrio berumur 12-13 HSS, sedangkan eksplan dengan panjang 0.4 cm berasal dari embrio berumur 14 HSS (Lampiran 4).
Bahan yang digunakan untuk pembuatan media meliputi larutan stok makro dan mikro dari media dasar Chu (N6), dan Murashige dan Skoog (MS), zat pengatur tumbuh 2.4-D (2.4-Dichlorophenoxy Acetic Acid) dan picloram, sukrosa (gula pasir), asam amino L-arginin, L-glutamine, dan glycine serta D-mannitol. Media regenerasi menggunakan ZPT BAP (Benzyl Amino Purin) dan IAA (Indole Acetic Acid). Bahan-bahan lain yang digunakan adalah bahan untuk sterilisasi
Alat-alat yang digunakan spiritus, korek api, bunsen, plastik penutup, karet gelang, plastik wrap, tissue, sudip, autoclave, botol kultur, oven, Laminar Air Flow (LAF), erlenmeyer, gelas ukur, gelas piala, petridish, botol kultur, pipet
hisap, labu ukur, corong, timbangan analitik, kompor, tabung gas, alat diseksi (scalpel dan mata pisau, pinset, gunting), mikroskop diseksi, alat tulis, hand sprayer, kertas pH, kertas millimeter blok, masker, dan rak kultur.
Metode Percobaan
Percobaan 1
Penelitian menggunakan percobaan faktorial yang disusun secara acak kelompok. Pengelompokan berdasarkan hari tanam, karena hari tanam yang berbeda dengan eksplan yang sama menyebabkan kesegaran eksplan berbeda akibat adanya penyimpanan. Percobaan pertama terdiri atas 3 faktor. Faktor pertama yaitu genotipe, terdiri atas 2 genotipe mutan jagung generasi ketujuh (G3M7 dan G8M7). Faktor kedua adalah panjang embrio, yaitu 0.3 cm dan 0.4 cm. Faktor ketiga adalah 6 komposisi media kultur. Semua kombinasi perlakuan ditanam dalam 10 kelompok, sehingga terdapat 240 satuan percobaan (botol kultur). Setiap botol kultur ditanam 5 eksplan sebagai satuan amatan. Berikut adalah penjabaran komposisi media yang digunakan.
N6A : garam Chu (N6) + vitamin B5 + 100 mg/l myoinositol + 2 ppm 2.4-D N6C : garam Chu (N6) + vitamin B5 + 100 mg/l myoinositol + 3 ppm 2.4-D N6F : garam Chu (N6) + vitamin B5 + 100 mg/l myoinositol + 6 ppm 2.4-D MS6 : MS + vitamin B5 + 6 ppm 2.4-D
MS8 : MS + vitamin B5 + 2 ppm 2.4-D + 100 mg/l arginin + 2 mg/l glycine + 100 mg/l glutamin
MS9 : MS + vitamin B5 + 1 ppm 2.4-D + 1 % mannitol
Semua media dasar diberi tambahan gula pasir 3 % (30 g/l). Komposisi media MS dan Chu (N6) disajikan pada Lampiran 2 dan Lampiran 3.
Model linier yang digunakan adalah sebagai berikut:
Yijkl = Nilai pengamatan pada faktor genotipe taraf ke-i, faktor ukuran eksplan taraf ke-j, faktor media ke-k, dan kelompok ke-l.
µ = nilai tengah umum
αi = Pengaruh taraf ke-i dari genotipe j = Pengaruh taraf ke-j dari ukuran eksplan
(α )ij = Pengaruh interaksi taraf ke-i dari genotipe dan taraf ke-j dari ukuran eksplan
k = Pengaruh media ke-k
(α )ik = Pengaruh interaksi taraf ke-i dari genotipe dan media ke-k
( )jk = Pengaruh interaksi taraf ke-j dari ukuran eksplan dan media ke-k
(α )ijk = Pengaruh interaksi taraf ke-i dari genotipe, taraf ke-j dari ukuran eksplan dan taraf ke-k dari media
l = Pengaruh kelompok ke-l
εijkl = Galat percobaan taraf ke-i dari genotipe, taraf ke-j dari ukuran eksplan, media ke-k, dan kelompok ke-l
Data dianalisis menggunakan Uji Ragam dengan prosedur General Linier Model. Perlakuan yang berpengaruh nyata, diuji lanjut menggunakan Duncan Multiple Range Test (DMRT) di antara perlakuan pada taraf 5% untuk mengetahui beda nilai tengah.
Percobaan 2
Rancangan percobaan yang digunakan pada percobaan dua adalah Rancangan Acak Kelompok (RAK) dengan satu faktor yaitu 3 kombinasi media. Tiap kombinasi diulang 10 kali, sehingga terdapat 30 satuan percobaan. Eksplan yang digunakan adalah genotipe G8M7. Berikut adalah penjabaran 3 komposisi media yang digunakan:
P2M : MS + vitamin B5 + 2 ppm Picloram P2N : N6 + vitamin B5 + 2 ppm Picloram MS2 : MS + vitamin B5 + 2 ppm 2.4-D
Model linier yang digunakan adalah sebagai berikut (Gomez dan Gomez, 1995):
Yij = Nilai pengamatan yang dihasilkan µ = nilai tengah umum
αi = Pengaruh media ke-i
j = Pengaruh kelompok ke-j
εij = Galat percobaan
Analisis data dilakukan menggunakan Uji Ragam dengan prosedur General Linier Model. Jika hasil analisis ragam yang diperoleh menunjukkan perlakuan berpengaruh nyata, maka dilakukan uji lanjut Duncan Multiple Range Test (DMRT) di antara perlakuan pada taraf 5% untuk mengetahui beda nilai tengah.
Pelaksanaan Percobaan
Penanaman Bahan Eksplan Penelitian
Bahan tanaman di lapang untuk menghasilkan embrio muda (generasi ke-7) adalah mutan generasi ke-6 hasil radiasi sinar gamma pada dua galur yaitu G8 (SgPD/660/15) dan G3 (Gw92D343L4DMR PC3S4-56) yang telah diseleksi dan dimurnikan. Pengolahan lahan dilakukan dengan mencangkul, menggemburkan tanah, serta pemberian pupuk kandang. Biji setiap individu ditanam dalam barisan. Jarak tanam yang digunakan adalah 75 cm x 25 cm dengan 1 biji per lubang, terdapat 20 tanaman untuk tiap genotipe. Lubang tanam yang digunakan sedalam 5 cm dan telah ditaburi furadan. Penanaman dilakukan tiap minggu, dengan jumlah yang ditanam tiap minggu adalah 2 tanaman untuk masing-masing genotipe. Hal ini bertujuan untuk mengatur waktu antara panen di lapang dan penanaman embrio muda di kultur jaringan, sehingga dapat mengurangi waktu penyimpanan eksplan.
penyungkupan bunga betina (tongkol) 1-3 hari setelah antesis bunga jantan. Sebelum penyungkupan tongkol, ujung tongkol dipotong. Setelah muncul rambut jagung (silk) yang merupakan tangkai putik maka penyerbukan sendiri dapat dilakukan. Panen jagung untuk mengambil embrio mudanya dilakukan pada 12-14 hari setelah selfing (HSS), yaitu saat warna jagung putih ke kuningan dan ukuran bijinya ± 0.5 cm dan ukuran embrio 0.3-0.4 cm.
Sterilisasi Alat dan Botol
Sebelum alat dan botol digunakan, terlebih dahulu semuanya dicuci bersih dengan sabun cuci atau detergen kemudian disterilkan dalam autoklaf selama 45 menit dengan tekanan 20 psi.
Pembuatan Media Kultur
Pembuatan media dasar MS dan N6 dilakukan dengan memipet media stok sesuai dengan volume pipet pada protokol yang telah ada. Setelah itu, ditambahkan 30 g gula pasir yang telah dilarutkan dalam aquades dan dimasukkan dan ditera dalam labu takar 1 liter. Kemasaman (pH) media di atur sebesar 5.7-5.8 sebelum di autoklaf, dengan penambahan beberapa tetes KOH 0.1 N atau HCl 0.1 N ke dalam media, kemudian ditambahkan agar sebanyak 6 g. Lalu media dipanaskan sampai agar-agar larut (sambil diaduk). Selanjutnya larutan media ditakar dan dimasukkan ke dalam botol yang sudah disterilkan sebelumnya sebanyak 20 ml setiap botol. Setelah itu botol ditutup dengan plastik, diikat dengan karet dan disterilkan dalam autoklaf selama 20 menit dengan suhu 121oC pada tekanan 17-18 psi. Setelah diautoklaf media disimpan dahulu selama 3-7 hari di ruang kultur. Media yang tidak terkontaminasi dipergunakan untuk inisiasi kultur.
Sterilisasi Sumber Eksplan dan Penanaman in vitro
dibilas satu kali. Setelah itu, direndam sambil dikocok dalam chlorox 20 % (v/v), masing-masing selama 10 menit. Selanjutnya biji dibilas dengan aquades steril sebanyak tiga kali.
Embrio dikeluarkan dengan memotong bagian endosperma biji satu persatu, seperti pada Gambar 5. Embrio yang sudah diambil kemudian ditanam di dalam botol kultur dengan posisi aksis tunas dan akar menempel pada permukaan media.
Penanaman dilakukan di dalam LAF dan tiap botol kultur ditanam 5 buah eksplan. Selanjutnya botol kultur ditutup dengan plastik dan diikat dengan karet. Kemudian semua botol yang telah berisi eksplan ditempatkan dalam ruang gelap selama 2-4 minggu tergantung perkembangan embrio. Suhu ruang dijaga agar stabil 28 oC. Setelah masa inkubasi, koleoptil yang tumbuh di ujung kalus dipotong dan dibuang. Selanjutnya kalus dikulturkan kembali pada media pendewasaan (MS9= MS + 1 ppm 2.4-D + 1 % mannitol) selama 2 minggu di ruang terang dengan suhu 21-25 oC. Setelah masa pendewasaan embrio diregenerasikan pada media regenerasi.
Pengamatan
Pengamatan dilakukan selama 8 minggu. Pengamatan dilakukan pada seluruh eksplan. Adapun peubah-peubah yang diamati adalah:
Gambar 5. Proses Pengambilan Embrio Jagung (a) Arah Pemotongan Kernel; (b) Pengeluaran Embrio dari Kernel
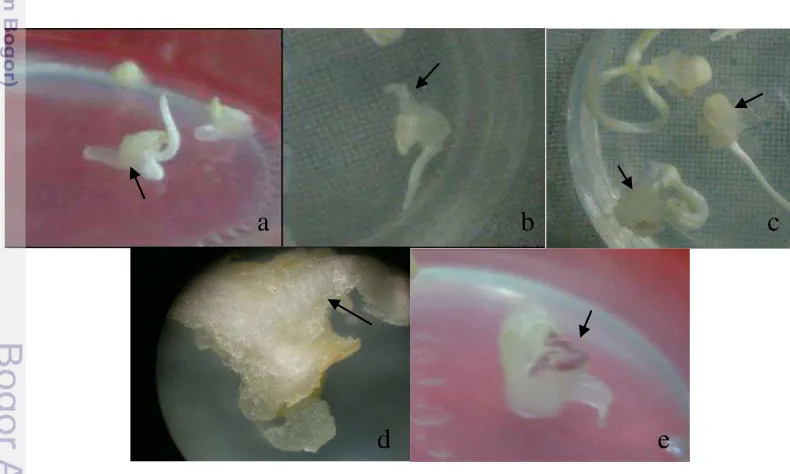
a. Persentase eksplan mati dan terkontaminasi, serta penyebab kontaminasi. b. Hari pembentukan kalus yaitu dihitung berdasarkan hari setelah tanam (HST). c. Respon eksplan pada 7 hari setelah tanam (HST) berupa persentase eksplan yang mengalami pemanjangan koleoptil (K), pembentukan akar (A): pembentukan kalus lembut (soft callus) (Kl), dan kalus kompak (callus compact) (Kk) (Gambar 5).
d. Morfologi kalus lembut, kalus kompak, dan kalus tipe I yaitu kalus yang kompak dan embriogenik (Gambar 6).
e. Persentase eksplan membentuk kalus.
Persentase kalus = embrio muda berkalus
embrio muda yang ditanam ×100% f. Persentase kalus embriogenik.
Persentase kalus embriogenik = kalus embriogenik
kalus yang ditanam ×100% g. Pengamatan mikroskopik kalus/ kalus embriogenik.
h. Diameter kalus diukur pada 2 MST.
Gambar 6. Respon Perkembangan Eksplan (Embrio Muda) Jagung Umur 1 MST terdiri atas Pemanjangan Koleoptil (K); a) Pembentukan Kalus Kompak (Kk); b) Pembentukan Akar (A); c) Pembentukan Kalus Lembut (Kl); dan d) Kalus Embriogenik Tipe I Umur 3 MST
K
K
Kk
A
Kl
a b
i. Bobot kalus diukur pada 2-3 MST. j. Pengamatan warna kalus.
Pengamatan warna kalus dikelompokkan ke dalam 4 kategori (Gambar 7). Kategori warna kalus didasarkan pada keberagaman kalus dari embrio muda yang diinduksi. Opaque merupakan istilah yang digunakan untuk menunjukkan kalus yang memiliki warna kekuningan dengan dominan putih (tidak transparan). Kalus ada yang berbentuk bulat tanpa nodul dan bulat bernodul. Translucent merupakan istilah yang digunakan untuk menunjukkan kalus yang berwarna kuning dan bening atau transparan.
k. Persentase eksplan membentuk organ tunas dan akar.
l. Jumlah planlet yang berhasil diregenerasikan dari kalus embriogenik
Gambar 7. Kualifikasi Warna Kalus yang Terbentuk pada Induksi Kalus dari Dua Genotipe Mutan Jagung (Keterangan: didasarkan pada keragaan kalus penelitian)
B Translucent A
Opaque
C Coklat
HASIL DAN PEMBAHASAN
Percobaan 1
Kondisi Umum
Kematian eksplan hanya terjadi pada genotipe G8M7. Persentase eksplan mati pada eksplan dengan panjang 0.3 cm sebesar 1.35 %, sedangkan pada eksplan dengan panjang 0.4 cm hanya 0.35 %. Persentase kontaminasi yang terjadi terus meningkat dari 1 MST sampai 4 MST, seperti yang disajikan pada Tabel 3.
Tabel 3. Persentase kontaminasi eksplan (embrio muda) jagung dalam media induksi kalus embriogenik
Genotipe Panjang Eksplan (cm)
Minggu Setelah Tanam (MST)
1 2 3 4
……….….%...
G8M7 0.3 3.15 4.08 6.36 15.38
0.4 1.03 2.92 16.01 31.58
G3M7 0.3 2.22 6.82 13.70 33.61
0.4 1.50 5.13 13.70 20.99
Subkultur dilakukan dua minggu sekali. Media pendewasaan diperoleh dari hasil percobaan pendahuluan pada beberapa komposisi media pendewasaan dan diperoleh media pendewasaan yang terbaik adalah MS9 dengan komposisi MS + 1 ppm 2.4-D + 1% mannitol (data tidak ditampilkan). Kalus embriogenik yang terbentuk kemudian diregenerasikan dalam media MS0 (MS tanpa hormon) atau media MS11 yaitu MS + 0.1 ppm IAA dan 0.5 ppm BAP. Secara skematis proses kultur in vitro jagung selama penelitian sebagai berikut.
Gambar 9. Bagan Alir Proses Kultur Pembentukan Embrio Zigotik Sekunder Jagung Selama Penelitian
Gambar 8. Eksplan pada Kultur Jaringan Jagung yang Terkontaminasi (a) Kontaminasi Bakteri yang Berasal dari Eksplan; (b) Kontaminasi Cendawan yang Berasal dari Media Kultur
a b
Media induksi kalus embriogenik (2-3 minggu)
N6A= N6 + 2 ppm 2.4-D;
N6C= N6 + 3 ppm 2.4-D;
N6F= N6 + 6 ppm 2.4-D;
MS6= MS + 6 ppm 2.4-D;
MS8= MS + 2 ppm 2.4-D + 100 mg/l arginin + 2 mg/l glycine + 100 mg/l glutamine;
MS9= MS + 1 ppm 2.4-D + 1 % mannitol
Media pendewasaan
(4 minggu)
MS9= MS + 1 ppm 2.4-D + 1 % mannitol
Media regenerasi
MS0 = MS tanpa hormon
[image:40.595.124.494.89.224.2]Waktu dan Persentase Eksplan Membentuk Kalus
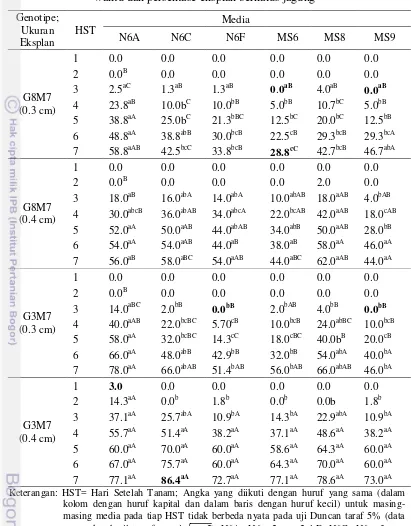
Embrio muda mulai berkalus pada 2 hari setelah tanam (HST) yaitu ditandai dengan munculnya kalus lembut (soft callus). Hasil sidik ragam pada Tabel 4 menunjukkan bahwa genotipe, eksplan, dan media berpengaruh nyata pada rata-rata persentase eksplan berkalus, dan interaksinya berpengaruh nyata pada 2 HST. Tabel 4 menunjukkan bahwa genotipe, ukuran eksplan, dan media berpengaruh sangat nyata terhadap rata-rata persentase eksplan berkalus dimulai dari 3 HST.
Tabel 4. Rekapitulasi sidik ragam waktu dan persentase eksplan berkalus jagung
HST Genotipe (G)
Ukuran Eksplan
(E)
Media
(M) G*E G*M E*M G*E*M
KK (%)
1 tn tn tn tn tn tn tn 2.46
2 * * * * * * * 5.94
3 ** ** ** tn tn tn tn 13.32
4 ** ** ** tn tn tn tn 17.54
5 ** ** ** tn tn tn tn 16.92
6 ** ** ** tn tn tn tn 15.68
7 ** ** ** tn tn tn tn 14.23
Keterangan: *, **= berbeda nyata pada taraf 5% dan 1%; tn= tidak berbeda nyata pada taraf 5%; data merupakan hasil transformasi x + 2; HST= Hari Setelah Tanam
Tabel 5. Pengaruh komposisi media induksi kalus embriogenik terhadap waktu dan persentase eksplan berkalus jagung
Genotipe; Ukuran Eksplan
HST Media
N6A N6C N6F MS6 MS8 MS9
G8M7 (0.3 cm)
1 0.0 0.0 0.0 0.0 0.0 0.0
2 0.0B 0.0 0.0 0.0 0.0 0.0
3 2.5aC 1.3aB 1.3aB 0.0aB 4.0aB 0.0aB
4 23.8aB 10.0bC 10.0bB 5.0bB 10.7bC 5.0bB 5 38.8aA 25.0bC 21.3bBC 12.5bC 20.0bC 12.5bB 6 48.8aA 38.8abB 30.0bcB 22.5cB 29.3bcB 29.3bcA 7 58.8aAB 42.5bcC 33.8bcB 28.8cC 42.7bcB 46.7abA
G8M7 (0.4 cm)
1 0.0 0.0 0.0 0.0 0.0 0.0
2 0.0B 0.0 0.0 0.0 2.0 0.0
3 18.0aB 16.0abA 14.0abA 10.0abAB 18.0aAB 4.0bAB
4 30.0abcB 36.0abAB 34.0abcA 22.0bcAB 42.0aAB 18.0cAB 5 52.0aA 50.0aAB 44.0abAB 34.0abB 50.0aAB 28.0bB 6 54.0aA 54.0aAB 44.0aB 38.0aB 58.0aA 46.0aA
7 56.0aB 58.0aBC 54.0aAB 44.0aBC 62.0aAB 44.0aA
G3M7 (0.3 cm)
1 0.0 0.0 0.0 0.0 0.0 0.0
2 0.0B 0.0 0.0 0.0 0.0 0.0
3 14.0aBC 2.0bB 0.0bB 2.0bAB 4.0bB 0.0bB 4 40.0aAB 22.0bcBC 5.70cB 10.0bcB 24.0abBC 10.0bcB 5 58.0aA 32.0bcBC 14.3cC 18.0cBC 40.0bB 20.0cB 6 66.0aA 48.0abB 42.9bB 32.0bB 54.0abA 40.0bA 7 78.0aA 66.0abAB 51.4bAB 56.0bAB 66.0abAB 46.0bA
G3M7 (0.4 cm)
1 3.0 0.0 0.0 0.0 0.0 0.0
2 14.3aA 0.0b 1.8b 0.0b 0.0b 1.8b
3 37.1aA 25.7abA 10.9bA 14.3bA 22.9abA 10.9bA 4 55.7aA 51.4aA 38.2aA 37.1aA 48.6aA 38.2aA 5 60.0aA 70.0aA 60.0aA 58.6aA 64.3aA 60.0aA 6 67.0aA 75.7aA 60.0aA 64.3aA 70.0aA 60.0aA 7 77.1aA 86.4aA 72.7aA 77.1aA 78.6aA 73.0aA Keterangan: HST= Hari Setelah Tanam; Angka yang diikuti dengan huruf yang sama (dalam
kolom dengan huruf kapital dan dalam baris dengan huruf kecil) untuk masing-masing media pada tiap HST tidak berbeda nyata pada uji Duncan taraf 5% (data merupakan hasil transformasi x + 2); N6A= N6 + 2 ppm 2.4-D; N6C= N6 + 3 ppm D; N6F= N6 + 6 ppm D; MS6= MS + 6 ppm D; MS8= MS + 2 ppm 2.4-D + 100 mg/l arginin + 2 mg/l glycine + 100 mg/l glutamine; MS9= MS + 1 ppm 2.4-D + 1 % mannitol
[image:42.595.105.516.108.634.2]2.4-D) untuk kedua genotipe dengan ukuran eksplan 0.3 cm. Selanjutnya, persentase eksplan berkalus terkecil pada 7 HST dihasilkan oleh genotipe G8M7 (0.3) dalam media MS6, sedangkan yang tertinggi dihasilkan oleh genotipe G3M7 (0.4) dalam media N6C.
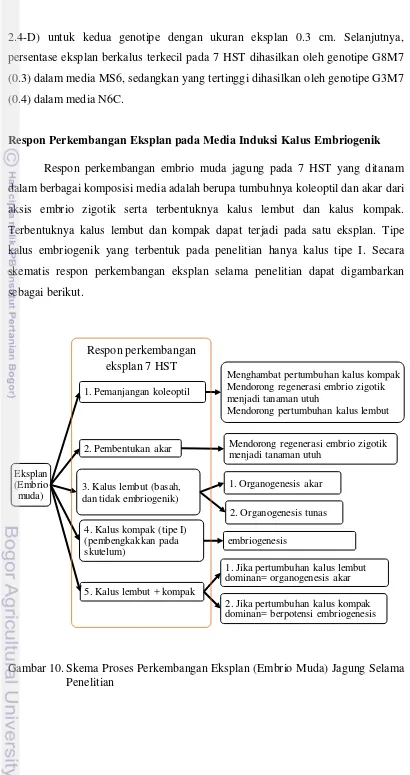
Respon Perkembangan Eksplan pada Media Induksi Kalus Embriogenik
[image:43.595.106.516.55.830.2]Respon perkembangan embrio muda jagung pada 7 HST yang ditanam dalam berbagai komposisi media adalah berupa tumbuhnya koleoptil dan akar dari aksis embrio zigotik serta terbentuknya kalus lembut dan kalus kompak. Terbentuknya kalus lembut dan kompak dapat terjadi pada satu eksplan. Tipe kalus embriogenik yang terbentuk pada penelitian hanya kalus tipe I. Secara skematis respon perkembangan eksplan selama penelitian dapat digambarkan sebagai berikut.
Gambar 10. Skema Proses Perkembangan Eksplan (Embrio Muda) Jagung Selama Penelitian
Eksplan (Embrio
muda) 3. Kalus lembut (basah, dan tidak embriogenik)
1. Organogenesis akar
2. Organogenesis tunas
5. Kalus lembut + kompak
1. Jika pertumbuhan kalus lembut dominan= organogenesis akar
2. Jika pertumbuhan kalus kompak dominan= berpotensi embriogenesis 4. Kalus kompak (tipe I)
(pembengkakkan pada skutelum)
embriogenesis 1. Pemanjangan koleoptil
Menghambat pertumbuhan kalus kompak Mendorong regenerasi embrio zigotik menjadi tanaman utuh
Mendorong pertumbuhan kalus lembut
2. Pembentukan akar Mendorong regenerasi embrio zigotik menjadi tanaman utuh
Lu et al. (1983) mengelompokkan respon pembentukan kalus embrio muda jagung menjadi soft callus dan embryogenic callus. Penggunaan istilah kalus kompak sebagai salah satu respon (7 HST) dalam penelitian ini, dikarenakan tidak semua kultur kalus yang kompak berpotensi embriogenik. Kalus lembut dan kalus kompak ada yang dihasilkan secara bersamaan dalam satu eksplan.
a. Pemanjangan Koleoptil dan Pembentukan Akar
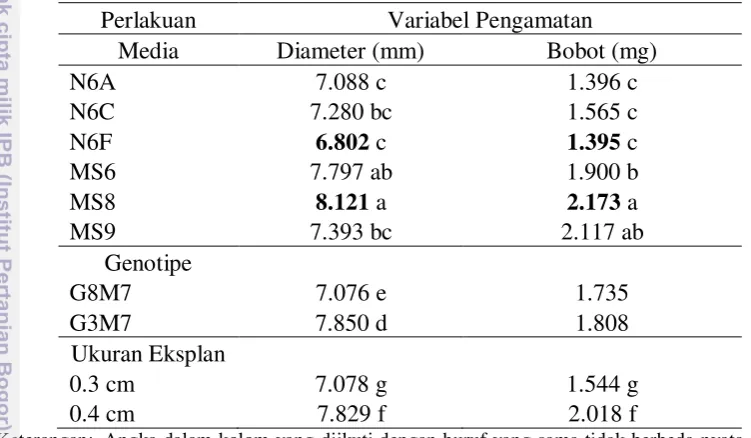
Pengamatan respon perkembangan eksplan yang mengalami pemanjangan koleoptil dan pembentukan akar dilakukan pada 7 HST. Pengaruh genotipe, ukuran eksplan, dan komposisi media induksi kalus embriogenik jagung terhadap persentase eksplan yang mengalami pemanjangan koleoptil dan eksplan berakar disajikan pada Tabel 6.
Tabel 6. Pengaruh genotipe, ukuran eksplan, dan komposisi media induksi kalus embriogenik jagung terhadap persentase eksplan yang mengalami pemanjangan koleoptil dan berakar (7HST)
Perlakuan Variabel Pengamatan
Media Pemanjangan Koleoptil (%) Eksplan berakar (%)
N6A 91.9 13.2 a
N6C 85.7 2.1 b
N6F 82.8 3.7 b
MS6 79.4 2.1 b
MS8 85.4 1.7 b
MS9 82.5 9.8 a
Genotipe
G8M7 85.7 7.4 c
G3M7 83.8 3.0 d
Ukuran Eksplan
0.3 cm 81.5 f 6.2
0.4 cm 88.7 e 3.4
Keterangan: Angka dalam kolom yang diikuti dengan huruf yang sama menunjukkan tidak berbeda nyata pada uji Duncan taraf 5 %; HST= Hari Setelah Tanam; N6A= N6 + 2 ppm 2.4-D; N6C= N6 + 3 ppm 2.4-D; N6F= N6 + 6 ppm 2.4-D; MS6= MS + 6 ppm 2.4-D; MS8= MS + 2 ppm 2.4-D + 100 mg/l arginin + 2 mg/l glycine + 100 mg/l glutamine; MS9= MS + 1 ppm 2.4-D + 1 % mannitol
Gambar 11. Keragaan Pertumbuhan Koleoptil dari Embrio Zigotik Jagung pada Media N6A (N6 + 2 ppm 2.4-D) dan N6C (N6 + 3 ppm 2.4-D)
N6A N6C
Koleoptil
Kalus
pemanjangan koleoptil. Ukuran eksplan memberikan pengaruh yang nyata terhadap persentase eksplan berkoleoptil. Ukuran eksplan 0.4 cm secara nyata memberikan persentase eksplan berkoleoptil lebih tinggi daripada ukuran eksplan 0.3 cm. Hal ini menunjukkan umur eksplan yang lebih tua pada ukuran embrio 0.4 cm mendorong perkecambahan eksplan lebih banyak. Semua persentase eksplan yang mengalami pemanjangan koleoptil di atas 70 %. Pemberian konsentrasi 6 ppm 2.4-D pada komposisi media MS6 dan N6F ternyata belum mampu mengurangi persentase eksplan mengalami pemanjangan koleoptil. Pengaruh taraf konsentrasi 2.4-D pada media N6 terlihat pada pertumbuhan panjang koleoptil yang dihasilkan (Gambar 11). Secara umum, pertumbuhan koleoptil pada komposisi media dengan N6 + 2 ppm 2.4-D (N6A) terlihat lebih panjang dibandingkan dengan koleoptil yang tumbuh pada komposisi media N6 + 3 ppm 2.4-D (N6C). Penggunaan komposisi media N6 dengan penambahan auksin 2.4-D sebanyak 3 ppm ternyata sudah dapat menghambat pertumbuhan panjang koleoptil.
Gambar 12. Eksplan Membentuk Kalus Lembut Jagung. (a) Struktur Kalus Lembut Menyerupai Akar pada 1 MST; (b) Kalus Lembut pada 2 MST dan Struktur Menyerupai Akar Masih Tampak; (c) Pertumbuhan Dominan Kalus Lembut pada G3M7 dengan Umur Eksplan 14 HSS; (d) Kalus Lembut yang Berasal dari Daerah Koleoptil dilihat dengan Mikroskop Diseksi; (e) Tunas Berwarna Ungu yang Tumbuh dari Permukaan Kalus Lembut.
a
b
c
d
e
terhadap persentase eksplan berkalus. Komposisi media N6A (N6 + 2 ppm 2.4-D) secara nyata memberikan persentase eksplan berakar lebih tinggi daripada media N6C (N6 + 3 ppm 2.4-D), N6F (N6 + 2 ppm 2.4-D), MS6 (MS + 6 ppm 2.4-D), dan MS8 (MS + 2 ppm 2.4-D + 100 mg/l arginin + 2 mg/l glycine + 100 mg/l glutamine), namun tidak berbeda nyata dengan komposisi media MS9 (MS + 1 ppm 2.4-D + 1 % mannitol). Genotipe juga berpengaruh nyata terhadap persentase eksplan berakar. Genotipe G8M7 secara nyata memberikan persentase eksplan berakar lebih tinggi daripada genotipe G3M7.
b. Pembentukan Kalus Lembut (Soft callus)
Kalus lembut diduga berasal dari daerah koleoriza pada embrio zigotik, pangkal koleoptil, dan permukaan bawah skutelum (Gambar 12). Kalus lembut jagung tidak embriogenik, sehingga berbeda dengan kalus friabel (tipe II), yang memiliki struktur remah dan embriogenik serta berasal dari isolasi jaringan embriogenik kalus tipe I. Perkembangan kalus lembut cenderung membentuk akar dan sedikit sekali membentuk organ tunas, oleh karena itu pertumbuhannya tidak diharapkan.
Menurut Green dan Philips (1975) hubungan antara umur, ukuran, dan genotipe pada embrio dan konsentrasi hormon mempengaruhi tipe kalus yang dihasilkan. Persentase respon eksplan membentuk kalus lembut pada 7 HST disajikan dalam Tabel 7.
Tabel 7. Pengaruh genotipe, ukuran eksplan, dan komposisi media induksi kalus embriogenik terhadap persentase eksplan membentuk kalus lembut (soft callus) jagung pada 7 HST
Perlakuan Variabel Pengamatan Media Soft callus (%)
N6A 67.2 a
N6C 62.6 ab
N6F 52.6 bc
MS6 50.8 c
MS8 61.6 abc
MS9 52.2 bc
Genotipe
G8M7 46.4 e
G3M7 71.4 d
Ukuran Eksplan
0.3 cm 49.3 g
0.4 cm 67.7 f
Keterangan: Angka dalam kolom yang diikuti dengan huruf yang sama menunjukkan tidak berbeda nyata pada uji Duncan taraf 5 %; HST= Hari Setelah Tanam; N6A= N6 + 2 ppm 2.4-D; N6C= N6 + 3 ppm 2.4-D; N6F= N6 + 6 ppm 2.4-D; MS6= MS + 6 ppm 2.4-D; MS8= MS + 2 ppm 2.4-D + 100 mg/l arginin + 2 mg/l glycine + 100 mg/l glutamine; MS9= MS + 1 ppm 2.4-D + 1 % mannitol
persentase eksplan membentuk kalus lembut sebesar 67.2 %, tidak berbeda nyata dengan komposisi media N6C (N6 + 3 ppm 2.4-D) dan MS8 (MS + 2 ppm 2.4-D + 100 mg/l arginin + 2 mg/l glycine + 100 mg/l glutamine). Komposisi media MS9 dengan konsentrasi 1 ppm 2.4-D dan penambahan 1% mannitol mampu memberikan rata-rata persentase eksplan membentuk kalus lembut tidak berbeda nyata dengan komposisi media MS6 (MS + 6 ppm D), N6F (N6 + 6 ppm D), N6C dan MS8. Hal ini menunjukkan komposisi media MS9 (MS + 1 ppm 2.4-D + 1 % mannitol) mampu meminimalisir pembentukan kalus lembut. Penambahan 1 % mannitol pada media MS9 yang hanya mengandung 1 ppm 2.4-D dapat membantu meminimalisir kalus lembut. Hal ini diduga karena mannitol merupakan gula alkohol, yang biasanya tidak dimetabolisme oleh jaringan tanaman sehingga tidak tersedia sebagai sumber karbon. Oleh karena itu, mannitol lebih berperan sebagai osmotikum untuk memodifikasi potensial air dalam media kultur (Thorpe et al., 2008). Hasil penelitian Lu et al. (1983) menunjukkan bahwa pemberian 6 % sukrosa mampu mengurangi terbentuknya kalus lembut. Peningkatan osmotikum yang disebabkan oleh penambahan 1 % mannitol dalam media MS9 diduga menyebabkan pengaruh yang sama seperti pada pemberian sukrosa 6 %.
Pengaruh genotipe terhadap persentase eksplan membentuk kalus lembut pada tabel 7 menunjukkan genotipe G8M7 secara nyata memberikan persentase yang lebih rendah daripada genotipe G3M7. Selanjutnya ukuran eksplan 0.3 cm secara nyata juga memberikan persentase eksplan membentuk kalus lembut lebih rendah dibandingkan ukuran eksplan 0.4 cm.
c. Pembentukan Kalus Kompak (Compact callus)
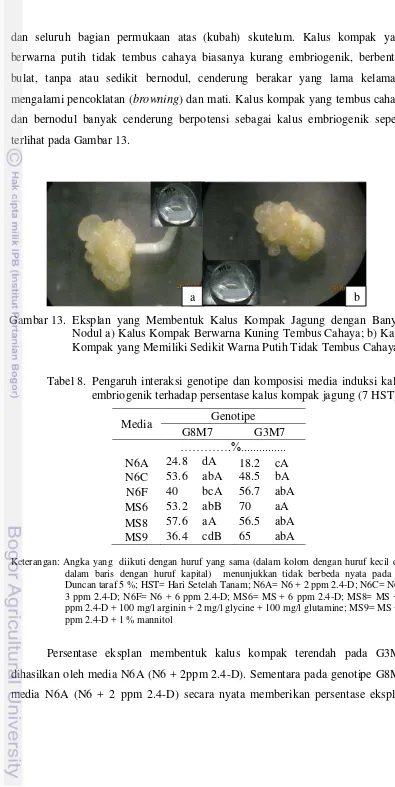
Selain kalus lembut eksplan juga membentuk kalus kompak (compact callus). Berdasarkan pengamatan visual kalus kompak memiliki struktur yang
dan seluruh bagian permukaan atas (kubah) skutelum. Kalus kompak yang berwarna putih tidak tembus cahaya biasanya kurang embriogenik, berbentuk bulat, tanpa atau sedikit bernodul, cenderung berakar yang lama kelamaan mengalami pencoklatan (browning) dan mati. Kalus kompak yang tembus cahaya dan bernodul banyak cenderung berpotensi sebagai kalus embriogenik seperti terlihat pada Gambar 13.
Tabel 8. Pengaruh interaksi genotipe dan komposisi media induksi kalus embriogenik terhadap persentase kalus kompak jagung (7 HST)
Media Genotipe
G8M7 G3M7
………….%...
N6A 24.8 dA 18.2 cA N6C 53.6 abA 48.5 bA N6F 40 bcA 56.7 abA MS6 53.2 abB 70 aA MS8 57.6 aA 56.5 abA MS9 36.4 cdB 65 abA
Keterangan: Angka yang diikuti dengan huruf yang sama (dalam kolom dengan huruf kecil dan dalam baris dengan huruf kapital) menunjukkan tidak berbeda nyata pada uji Duncan taraf 5 %; HST= Hari Setelah Tanam; N6A= N6 + 2 ppm 2.4-D; N6C= N6 + 3 ppm 2.4-D; N6F= N6 + 6 ppm 2.4-D; MS6= MS + 6 ppm 2.4-D; MS8= MS + 2 ppm 2.4-D + 100 mg/l arginin + 2 mg/l glycine + 100 mg/l glutamine; MS9= MS + 1 ppm 2.4-D + 1 % mannitol
[image:49.595.103.498.55.842.2]Persentase eksplan membentuk kalus kompak terendah pada G3M7 dihasilkan oleh media N6A (N6 + 2ppm 2.4-D). Sementara pada genotipe G8M7 media N6A (N6 + 2 ppm 2.4-D) secara nyata memberikan persentase eksplan Gambar 13. Eksplan yang Membentuk Kalus Kompak Jagung dengan Banyak
Nodul a) Kalus Kompak Berwarna Kuning Tembus Cahaya; b) Kalus Kompak yang Memiliki Sedikit Warna Putih Tidak Tembus Cahaya
membentuk kalus kompak lebih rendah daripada media N6C, N6F, MS6, dan MS8, namun tidak berbeda nyata dengan media MS9. Persentase kalus kompak pada genotipe G8M7 yang dihasilkan pada komposisi media MS8 mencapai 57.6 % tidak berbeda nyata dengan komposisi media N6C dan MS6 Sementara untuk genotipe G3M7 persentase kalus kompak mencapai 70 % pada komposisi media MS6 namun tidak berbeda nyata dengan komposisi media N6F, MS8 dan MS9. Pengaruh interaksi genotipe dengan media, menunjukkan persentase eksplan membentuk kalus kompak genotipe G3M7 secara nyata lebih tinggi daripada genotipe G8M7 pada media MS8 dan MS9 (Tabel 8).
Persentase Kalus Embriogenik (Tipe I) dan Struktur Embrio
Lu et al. (1983) mendeskripsikan tipe regenerasi jagung berasal dari kalus yang keras, kompak, putih atau kuning yang dideskripsikan sebagai struktur mirip skutelar. Green dan Philips (1975) menyebutkan kalus embriogenik tersebut sebagai kalus tipe I. Sementara kalus embriogenik tipe II merupakan istilah untuk kalus yang remah (friable) dan embriogenik. Kalus tipe II merupakan hasil isolasi jaringan embriogenik kalus tipe I dan dihasilkan hanya pada genotipe-genotipe tertentu seperti A188 dan hibridanya.
Kalus embriogenik jagung yang dihasilkan dalam penelitian ini adalah kalus tipe I. Kalus tipe I yang embriogenik memiliki struktur mirip skutelar, berwarna putih dan kompak diduga berasal dari kalus kompak yang mengalami proliferasi pada bagian skutelar, berwarna kuning tidak tembus cahaya dan kuning tembus cahaya, serta bernodul. Berdasarkan ciri tersebut pengamatan kalus yang berpotensi embriogenik diamati pada 2 MST.