IDENTIFIKASI SPESIES
FABAVIRUS
PENYEBAB
PENYAKIT MOSAIK PADA TANAMAN NILAM
FITRIANI BR MILALA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRACT
FITRIANI BR MILALA. Identification of Fabavirus Species Causing Mosaic Disease on Patchouli Plants. Supervised by GEDE SUASTIKA.
A survey was performed in West Java to detect Fabavirus infection in patchouli (Pogostemon cablin Benth) plants and to identify the virus species according its nucleotide sequences. From 25 plant samples of patchouli showing mosaic symptoms, two samples obtained from Cicurug, Sukabumi and other two samples from Gunung Bunder, Bogor were positively infected by Fabavirus
(designed as CG15 and CG16 & GB 27 and GB29, respectively) based on enzyme-linked immunosorbent assay (ELISA) using general antiserum to
Fabavirus. Evidence of the Fabavirus infections in the patchouli plant samples were also reconfirmed by reverse transcription-polymerase chain reaction (RT-PCR) using general primer for Fabavirus. To elucidate the species of the virus isolates, the RT-PCR products of CG16 and GB 29 were sequenced directly without cloned to any plasmid vector. The sequence consisted of about 322
nucleotide, accordance with designed primers [BBWVVSSP (5‟ -GTBTCDAGTGCTYTDGAAGG-3‟, B = C, G, or T; D = A, G, or T; Y = C or T)
and BBWVKMRM (5‟-TDGWDCCATCVAGICKCATTTT-3‟, W = A or T; V = A, C, or G; I = Inosine; K = G or T)]. The alignment of nucleotide sequences confirmed the identities of the virus isolates as Broad bean wilt virus 2 (BBWV-2). This is the first report for occurrence of BBWV-2 causing mosaic symptoms in patchouli plant in Indonesia.
ABSTRAK
FITRIANI BR MILALA. Identifikasi spesies Fabavirus penyebab penyakit mosaik pada tanaman nilam. Dibimbing oleh GEDE SUASTIKA.
Survei di daerah Jawa Barat dilakukan untuk mendeteksi infeksi Fabavirus
pada tanaman nilam (Pogostemon cablin Benth) dan untuk mengidentifikasi spesies virus berdasarkan sikuen nukleotidanya. Dari 25 sampel tanaman nilam yang menunjukkan gejala mosaik dan variasinya, dua sampel didapatkan dari Cicurug, Sukabumi dan dua lainnya berasal dari Gunun Bunder, Bogor positif diinfeksi oleh Fabavirus (dibuat dengan nama CG15 dan CG16 & GB27 dan GB29, berturut-turut) berdasarkan enzyme-linked immunosorbent assay (ELISA) menggunakan antiserum untuk Fabavirus. Keberadaan infeksi Fabavirus pada sampel tanaman nilam dikonfirmasi dengan uji molekuler melalui reverse transcription-polymerase chain reaction (RT-PCR) menggunakan primer untuk
Fabavirus. Untuk menguraikan spesies dari isolat virus, produk RT-PCR CG16 dan GB29 disikuensing langsung tanpa kloning pada vektor plasmid. Sikuen terdiri dari sekitar 322 nukleotida, berdasarkan primer yang didesain [BBWVVSSP (5‟-GTBTCDAGTGCTYTDGAAGG-3‟, B = C, G, or T; D = A,
G, or T; Y = C or T) and BBWVKMRM (5‟ -TDGWDCCATCVAGICKCATTTT-3‟, W = A or T; V = A, C, or G; I = Inosine; K = G or T)]. Penjajaran sikuen nukleotida mengonfirmasi identitas dari isolat virus sebagai Broad bean wilt virus 2 (BBWV-2). Penelitian ini merupakan laporan pertama keberadaan BBWV-2 penyebab penyakit mosak pada tanaman nilam di Indonesia.
IDENTIFIKASI SPESIES
FABAVIRUS
PENYEBAB
PENYAKIT MOSAIK PADA TANAMAN NILAM
FITRIANI BR MILALA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian
Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
LEMBAR PENGESAHAN
Judul : Identifikasi Spesies Fabavirus Penyebab Penyakit Mosaik pada Tanaman Nilam
Nama : Fitriani Br. Milala
NRP : A34070025
Disetujui, Pembimbing I
Dr. Ir. Gede Suastika, MSc. NIP.19620607 198703 1 003
Diketahui,
Plh. Ketua Departemen Proteksi Tanaman
Dr. Ir. Ruly Anwar, MSi. NIP. 19641224 199103 1 003
RIWAYAT HIDUP
Penulis dilahirkan di desa Singgamanik, Medan, Sumatera Utara pada tanggal 6 Mei 1989 dari pasangan Naksir Milala (Alm.) & Bungaros Sinuraya dan merupakan anak kedua dari dua bersaudara. Penulis menyelesaikan pendidikan menengah atas di SMA Negeri 9 Bogor tahun 2007. Pada tahun yang sama diterima sebagai mahasiswa baru program studi Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Ujian Saringan Masuk IPB (USMI).
Selama kuliah, penulis mengikuti kegiatan kepanitiaan dan organisasi mahasiswa, diantaranya tergabung dalam Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) sebagai anggota Divisi Kreativitas, Minat & Bakat serta bertanggung jawab sebagai koordinator acara-acara Himasita yang berkaitan dengan kreativitas mahasiswa PTN selama periode 2009-2010. Penulis juga terlibat dalam Program Kreativitas Mahasiswa bidang Gagasan Tertulis (PKM-GT) yang berjudul “Potensi Bahan Aktif Keladi Tikus (Typonium flagelliforme
Ldd.) sebagai Biofungisida Cendawan Antraknosa Buah Cabai (Capsicum
PRAKATA
Puji syukur hanya kepada Tuhan Yesus Kristus yang melimpah kasih setia-Nya, sehingga penulis dapat menyelesaikan penulisan skripsi dengan judul
“Identifikasi spesies Fabavirus penyebab penyakit mosaik pada tanaman nilam”. Penulisan skripsi ini sebagai syarat untuk memperoleh gelar Sarjana Pertanian pada program studi Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Penulis menyampaikan rasa terima kasih kepada Dr Ir Gede Suastika, MSc. sebagai dosen pembimbing skripsi dan dosen pembimbing akademik yang melalui arahan, nasihat dan teladannya serta dukungan materi bahan penelitian selama proses menyelesaikan studi di IPB, sehingga penulis dapat menyelesaikan pengerjaan skripsi ini. Penulis juga mengucapkan terima kasih kepada Dr Ir Pudjianto, MSi. selaku dosen penguji tamu yang telah menyediakan waktu dan perhatiannya dalam seminar dan sidang. Dan secara khusus kepada Bu Dr Ir Nina, MSi yang memberikan dorongan semangat pada penulis untuk menyelesaikan tugas akhir ini.
Penulis mengucapkan terima kasih kepada rekan-rekan di Laboratorium Virologi Tumbuhan; Mbak Tuti, Mbak Miftah, dan Bu Rita yang memberikan arahan teknis selama proses penelitian, serta Mbak Mel, Mbak Dwi, Kak Aceu, Pak Irwan, Bu Asni, Pak Edi, Shora, Rita, Sherly, Harwan, Rizki, Santi, dan Avanty yang membantu penulis selama bekerja di laboratorium. Untuk saudaraku Devi, Erika, Mia, Basten dan Han yang setia memotivasi dan memberi perhatian tulus kepada penulis. Penulis juga bersyukur dan berterimakasih diberi kesempatan tergabung dalam Departemen Proteksi Tanaman bersama teman-teman DPT 44 dan keluarga Komisi Pelayanan Khusus PMK IPB serta semua pihak yang tidak disebutkan satu per satu.
Penghargaan dan rasa terima kasih penulis haturkan untuk ibunda Bungaros Sinuraya, kakak terkasih Desnatalia Milala, juga teladan & kenangan akan ayahanda Naksir Milala (Alm.) serta keluarga besar Sinuraya dalam memberikan dukungan semangat dan doa.
Penulis menyadari skripsi ini jauh dari sempurnanya sebuah tulisan ilmiah. Oleh karena itu, penulis menerima segala kritik dan saran agar isi dan materi skripsi ini semakin selaras dengan peruntukannya. Akhir kata penulis menyerahkan skripsi ini sebagai bagian dari literasi virologi yang kiranya bermanfaat.
Bogor, Agustus 2012
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
TINJAUAN PUSTAKA ... 3
Sistematika dan Karakteristik Nilam ... 3
Penyakit pada Tanaman Nilam ... 4
Fabavirus ... 5
Enzyme-Linked Immunosorbent Assay (ELISA) ... 7
Reverse Transcription-Polymerase Chain Reaction (RT-PCR) ... 8
BAHAN DAN METODE ... 10
Tempat dan Waktu Penelitian ... 10
Metode Penelitian ... 10
Penyiapan Sampel Tanaman ... 10
Deteksi Virus dengan Teknik Serologi DAS-ELISA ... 10
Deteksi dan Identifikasi secara Molekuler ... 11
Ekstraksi RNA Total ... 11
Sintesis cDNA ... 12
Amplifikasi DNA ... 13
RT-PCR ... 13
Elektroforesis ... 14
Analisis sikuen nukleotida ... 15
HASIL DAN PEMBAHASAN ... 16
Deteksi Fabavirus pada Tanaman Nilam ... 16
Deteksi Fabavirus Melalui Uji Serologi ... 16
Deteksi Fabavirus Melalui RT-PCR ... 17
Identifikasi Spesies Fabavirus pada Tanaman Nilam ... 18
Nilai Penjajaran Sikuen Nukleotida ... 18
Hubungan Kekerabatan antara Isolat ... 21
KESIMPULAN DAN SARAN ... 24
Kesimpulan ... 24
Saran ... 24
DAFTAR TABEL
Nomor Halaman
1. Komposisi reagensia Reverse Transcription (RT) (Promega; USA) untuk reaksi sintesis complementary DNA terhadap RNA genom
Fabavirus isolat nilam Cicurug dan Gunung Bunder ... 13 2. Komposisi reagensia Polymerase Chain Reaction (PCR)
(Promega; USA) amplifikasi gen coat protein (CP) Fabavirus
isolat nilam Cicurug dan Gunung Bunder ... 14 3. Tingkat homologi isolat Cicurug dan Gunung Bunder dengan
isolat BBWV 2 dari beberapa negara berdasarkan sikuen
DAFTAR GAMBAR
Nomor Halaman
1. Organisasi genom Fabavirus (SIB 2009) ... 6 2. Organisasi genom BBWV-ME RNA1 (A) dan RNA2 (B)
mewakili genus Fabavirus spesies BBWV 2 (Koh et al. 2001) ... 7 3. Variasi gejala yang berasosiasi dengan infeksi Fabavirus pada
tanaman nilam dari daerah Cicurug (CG) dan Gunung Bunder
(GB) ... 17 4. Hasil amplifikasi DNA sebagian genom virus (di daerah gen
coat protein) melalui RT-PCR menggunakan pasangan primer spesifik Fabavirus. Lajur M = marker 100 bp DNA ladder; Lajur K(-) = Kontrol negatif dari tanaman nilam sehat; Lajur CG15 dan CG16 = isolat asal Cicurug no. 15 dan no. 16; Lajur GB27
dan GB29= isolat asal Gunung Bunder no. 27 dan no. 29 ... 18 5. Penjajaran sikuen nukleotida hasil ClustalW sebagian gen CP
Fabavirus-GB (isolat Gunung Bunder) dan Fabavirus-CG (isolat Cicurug) terhadap ke-11 isolat pada basis data GeneBank
menggunakan program GeneDoc v2.7... 20 6. Kladogram sikuen nukleotida sebagian gen CP Fabavirus isolat
Cicurug dan Gunung Bunder dibandingkan terhadap ke-11 isolat pada basis data GeneBank menggunakan metode UPGMA Tree
PENDAHULUAN
Latar Belakang
Tanaman nilam (Pogostemon cablin Benth) merupakan salah satu tanaman penghasil minyak atsiri yang penting, menyumbang devisa lebih dari 50% total ekspor minyak atsiri di Indonesia. Data Direktorat Jenderal Perkebunan (Ditjenbun 2007) pada tahun 2004 menyebutkan ekspor nilam Indonesia mencapai 2074 ton atau setara dengan US$ 27,137 juta. Angka ekspor ini terus bertambah karena kebutuhan nilam dunia semakin meningkat diantaranya digunakan sebagai bahan baku dalam industri pembuatan minyak wangi, kosmetika, farmasi, insektisida, aromaterapi dan digunakan juga sebagai bahan aditif dalam makanan. Minyak nilam (patchouli oil) diperoleh dari proses penyulingan daun nilam yang digunakan sebagai bahan fixative (pengikat) dalam industri parfum dan hingga saat ini belum dapat dibuat bahan substitusinya secara sintesis (Wikardi et al. 1990; Ibnusantoso 2000).
2 dari golongan Fabavirus dapat menurunkan produksi sebesar 35% dan kadar
patchouli alcohol turun sebesar 2%.
Hingga saat ini belum ada laporan mengenai status penyakit mosaik dan kerugian yang diakibatkan Fabavirus pada nilam di Indonesia, sehingga sebagai langkah awal pengendalian penyakit yang tepat perlu dilakukan upaya deteksi dan identifikasi terhadap temuan penyakit mosaik di lapangan. Penelitian yang dilakukan Apindiati (2012) merupakan laporan pertama tentang infeksi alami TeMV (Telosma mosaic virus) yang termasuk genus Potyvirus pada tanaman nilam di Indonesia dan didukung juga oleh hasil penelitian Satyani (2012) terhadap kemungkinan infeksi Potyvirus dan atau Fabavirus serta infeksi keduanya secara bersamaan pada tanaman nilam, mengindikasikan diperlukannya langkah deteksi dan identifikasi Fabavirus yang berasosiasi dengan tanaman nilam dalam kajian terpisah.
Tujuan Penelitian
Penelitian bertujuan mendeteksi dan mengidentifikasi Fabavirus yang menyebabkan penyakit mosaik pada tanaman nilam.
Manfaat Penelitian
TINJAUAN PUSTAKA
Sistematika dan Karakteristik Nilam
Menurut Guenther (1952 dalam Nuryani 2006) sistematika nilam adalah sebagai berikut:
divisi : Spermatophyta kelas : Angiospermae ordo : Lamiales famili : Labiateae genus : Pogostemon
spesies : - Pogostemon cablin Benth - Pogostemon heyneanus Benth - Pogostemon hortensis Backer
Tanaman nilam adalah tanaman perdu wangi yang berakar serabut, permukaan daun seperti beludru jika diraba dengan tangan, bentuk daun membulat lonjong seperti jantung dengan warna hijau agak pucat. Bagian bawah daun dan rantingnya berbulu halus. Batangnya berkayu dengan diameter 10 – 20 mm relatif hampir berbentuk segi empat. Sebagian besar daun yang melekat pada ranting hampir selalu berpasangan satu sama lain. Jumlah cabang yang banyak dan bertingkat mengelilingi batang sekitar 3–5 cabang per tingkat. Tanaman ini memiliki umur tumbuh yang cukup panjang, yakni sekitar tiga tahun, panen perdana dapat dilakukan pada bulan ke 6–7 dan seterusnya setiap 2–3 bulan sekali bergantung pemeliharaan dan pola tanam, kemudian dapat diremajakan kembali dari hasil tanaman melalui persemaian maupun pembibitan berupa setek (Mangun 2002).
4 dari 6 bulan, ketinggian tanaman nilam dapat mencapai 60-90 cm dengan radius cabang sekitar 60 cm.
Hasil produksi tanaman nilam yang dapat dipetik untuk disuling adalah bagian daun. Selain itu, bagian lain seperti ranting, batang dan akar, dalam prakteknya juga ikut disuling dalam keadaan bercampur.tetapi kandungan minyak yang dimilikinya relatif lebih sedikit daripada bagian daun. (Mauludi & Asman 2005).
Di Indonesia terdapat tiga jenis nilam yang dibudidayakan secara umum, ketiganya dapat dibedakan dari karakter morfologi, kandungan & kualitas minyak serta ketahanan terhadap cekaman biotik dan abiotik. Ketiga jenis nilam tersebut adalah: 1) P. cablin Benth. sinonim P. patchouli Pellet van Suavis Hook disebut nilam Aceh, 2) P. heyneanus Benth. disebut nilam Jawa dan 3) P. hortensis
Becker disebut nilam sabun. Nilam dengan penyebaran paling luas dan banyak dibudidayakan adalah nilam Aceh, karena kualitas minyaknya berkadar tinggi (> 2,5%) dibandingkan dengan jenis nilam lainnya. (Nuryani 2006)
Nilam adalah salah satu tanaman penghasil minyak atsiri, oleh sebab itu produksi, kadar dan mutu minyak serta sifat ketahanan terhadap penyakit merupakan faktor penting yang dapat dipergunakan untuk menentukan keunggulan suatu varietas. Banyak faktor yang mempengaruhi kadar dan mutu minyak nilam, antara lain sifat genetik, budidaya, lingkungan, panen dan pasca panen (Nuryani 2006). Berdasarkan sifat genetiknya telah dilepas tiga varietas nilam unggul pada tahun 2005 yakni, varietas Tapak Tuan, varietas Lhokseumawe, dan varietas Sidikalang (Nuryani 2005).
Penyakit pada Tanaman Nilam
Dalam pengembangan budidaya nilam banyak kendala yang dihadapi oleh petani, salah satunya adalah serangan penyakit seperti layu bakteri, nematoda, budok, infeksi virus dan beberapa penyakit yang belum diketahui penyebabnya. (Sukamto & Wahyuno 2007)
terhambat sehingga rumpun tanaman tidak bertambah besar. Sedangkan penyakit yang diakibatkan oleh infeksi virus ditandai beberapa macam gejala berupa gejala belang-belang (mottle) atau bintik-bintik yang membentuk mosaik pada permukaan daun nilam, maupun kombinasi keduanya. Gejala ini muncul pada daun muda dan kemudian diikuti oleh seluruh permukaan daun tanaman nilam. Infeksi virus umumnya muncul seiring serangan hama kutu daun. Apabila tidak dilakukan pengendalian penyakit akan cepat meluas dan pada serangan lanjut akan menurunkan produksi tanaman nilam.
Menurut Natsuaki et al. (1994) dan Sugimura et al. (1995), tanaman nilam Indonesia dan Taiwan diinfeksi oleh Patchouli mottle virus (PaMoV) genus
Potyvirus dan Patchouli mild mosaic virus (PaMMV) genus Fabavirus dengan persentase tinggi. Kedua virus ini juga menyerang tanaman nilam di Bogor, Bandung dan Cianjur (Sukamto et al. 2007). Dengan adanya laporan awal ini perlu dilakukan deteksi dan identifikasi sebagai langkah awal pengendalian yang tepat terhadap keberadaan virus ini di Indonesia. Salah satu pertanaman nilam di Indonesia, daerah Brebes diindikasikan telah terinfeksi oleh virus dengan gejala mosaik. Berdasarkan deteksi awal dengan uji serologi, gejala tersebut disebabkan oleh Fabavirus.
Fabavirus
Genus Fabavirus dapat menginfeksi tanaman dalam berbagai kisaran inang, termasuk tanaman yang memiliki nilai ekonomi tinggi dan tanaman hortikultura dari berbagai spesies sehingga menyebabkan kehilangan hasil yang tinggi pada berbagai tanaman di dunia setiap tahunnya (Ferrer et al. 2007).
Fabavirus yang termasuk ke dalam famili Comoviridae, berbentuk isometric
6 ditranslasikan menjadi single polyprotein awal, dimana protein fungsional diperoleh dari pemecahan proteolytic yang terjadi seperti pada Comoviridae
(Wellink et al. 2000).
Gambar 1 Organisasi genom Fabavirus (SIB 2009)
Hingga saat ini, terdapat tiga spesies dalam genus Fabavirus yaitu Broad bean wilt virus 1 (BBWV-1), Broad bean wilt virus 2 (BBWV-2), Lamium mild mosaic virus (LaMMV) dan kandidat spesies baru, Gentian mosaic virus
(GeMV) (Kobayashi et al. 2005). BBWV-1 dan BBWV-2 dapat dibedakan berdasarkan uji serologi (Uyemoto & Provvidenti 1974). Kobayashi et al. (2003) dalam penelitian sebelumnya melaporkan bahwa seluruh sikuen nukleotida dari RNA BBWV-1 dan BBWV-2 memiliki hubungan genetik satu dengan lainnya. Tanaman yang terdeteksi tunggal BBWV memiliki gejala mosaik,
vein-clearing, rugosity, dan malformasi pada daun (Kondo et al. 2005). BBWV memiliki kisaran inang yang luas pada tanaman dikotil dan beberapa famili tanaman monokotil (Qi et al. 2000). Patchouli mild mosaic virus (PaMMV) juga telah diklasifikasikan sebagai spesies yang termasuk dalam Fabavirus (Ferrer et al. 2005; Kobayashi et al. 2003) dan telah diusulkan sebagai salah satu isolat BBWV-2 (Ikegami 1998, 2001). Isolat BBWV-ME merupakan isolat Broad bean wilt virus 2
bagian yang diketahui dan dugaan fungsinya. Tanda tanya mewakili bagian yang tidak dapat ditentukan tapi diduga merupakan keberadaan VPg dan (A)n adalah
polyadenylated tail.
(A)
(B)
Gambar 2 Organisasi genom BBWV-ME RNA1 (A) dan RNA2 (B) mewakili genus Fabavirus spesies BBWV 2 (Koh et al. 2001)
Virus yang termasuk kedalam genus Fabavirus dapat ditularkan oleh kutu daun (aphid) secara non-persisten dan dapat menyebabkan penyakit pada bagian tanaman dan buah (Kobayashi 2005). Selain itu, dapat juga ditularkan secara mekanis, namun tidak melalui benih. Untuk mendeteksi dan melakukan diagnosis penyakit akibat Fabavirus pada tanaman, dapat dilakukan uji serologi DAS-ELISA (Kobayashi et al. 2005) dengan antiserum BBWV-1 dan BBWV-2 yang telah tersedia secara komersial (Ferrer et al. 2007).
Enzyme Linked Immunosorbent Assay (ELISA)
Penggunaan teknik serologi Enzyme Linked Immunosorbent Assay
8 dan 103–104 sel bakteri/ml); (5) prosedurnya relatif sederhana dan cepat, antara 5– 24 jam; (6) hasilnya berupa data kuantifikasi; (7) dapat digunakan untuk menguji sampel dalam jumlah besar sekaligus; dan (8) dapat digunakan langsung di lapangan (Thomas et al. 1989; Converse & Martin 1990; Agrios 2005).
Dalam perkembangannya, teknik ELISA dimodifikasi baik dari segi praktis maupun keunggulannya sehingga muncul berbagai varian teknik ELISA (Randles et al. 1996; Seal 1997). Namun secara umum dalam prosedurnya ELISA dibagi menjadi dua kategori, yakni ELISA secara langsung yang dikenal dengan DAS-ELISA (Double Antibody Sandwich) dan ELISA tidak langsung atau
Indirect ELISA (I-ELISA). Perbedaan kedua metode ini adalah pada tempat enzim terikat. Bila konjugasi enzim dilakukan pada imunoglobulin antivirus maka metode itu termasuk DAS-ELISA, tetapi bila konjugasi enzim dilakukan pada imunoglobulin dari serum darah hewan maka metode tersebut diklasifikasikan sebagai I-ELISA (Badan Karantina Tanaman 2009).
Sebagai uji serologi, prinsip dasar ELISA adalah reaksi antara antigen (Ag) dengan antibodi (Ab) menjadi molekul Ag-Ab yang lebih besar dan mudah mengendap. Pengamatan hasil reaksi pada ELISA berdasarkan perubahan warna yang terjadi pada substrat pereaksi sesuai dengan label atau imunoprob (immuno probe) konjugat antibodi-enzim. Perubahan warna terjadi akibat hidrolisis enzimatik pada reaksi antara konjugat antibodi-enzim dengan substratnya, sehingga hasil ELISA lebih peka dan dapat dikuantifikasi (Converse & Martin 1990). Tahapan umum ELISA meliputi penempelan (trapping) Ag atau Ab pada media reaksi (solid phase) pada cawan mikrotiter ELISA, diikuti penambahan konjugat, dan diakhiri dengan penambahan substrat serta bufer penghenti reaksi (blocking buffer). Setelahnya, cawan mikrotiter ELISA dibaca pada ELISA-reader pada panjang gelombang 405 nm. Nilai absorbansi dari hasil ELISA dapat diverifikasi dengan melanjutkan uji molekuler seperti PCR.
Reverse Transcription-Polymerase Chain Reaction (RT-PCR)
terlebih dahulu diubah menjadi cDNA (complementary DNA) menggunakan enzim reverse transcriptase.
Metode Polymerase Chain Reaction (PCR) merupakan metode deteksi yang sensitif dan cepat dalam mendeteksi virus. PCR merupakan sebuah metode yang digunakan untuk memperbanyak suatu fragmen DNA yang spesifik secara in-vitro. Posisi fragmen DNA yang spesifik tersebut ditentukan oleh sepasang primer yang akan menjadi cetakan awal untuk proses perbanyakan fragmen DNA selanjutnya dengan bantuan enzim polimerase dan deoxyribonucleotide triposphate (dNTPs) yang dikondisikan pada suhu tertentu. Fragmen DNA, yang pada awalnya terdapat dalam konsentrasi yang sangat rendah akan diperbanyak menjadi cetakan fragmen DNA baru yang cukup untuk dapat divisualisasi pada gel agarosa (Badan Karantina Tanaman 2009).
Dalam prinsipnya, PCR merupakan proses yang dilakukan berulang-ulang antara 20–30 kali. Setiap siklus terdiri dari tiga tahap. Berikut adalah tiga tahap kerja PCR dalam satu siklus:
1. Tahap peleburan (melting) atau denaturasi. Pada tahap ini, berlangsung pada suhu tinggi (94 °C–96 °C), ikatan hidrogen DNA terputus karena mengalami denaturasi akibat suhu tinggi sehingga struktur DNA terpisah menjadi utas tunggal. Biasanya tahap ini dapat dilakukan agak lama (hingga 5 menit) untuk memastikan semua berkas DNA terpisah. Pada pemisahan ini DNA tidak stabil dan siap menjadi template bagi primer. Durasi tahap ini 1–2 menit.
2. Tahap penempelan atau annealing. Primer menempel pada bagian DNA template yang komplementer urutan basanya. Ini dilakukan pada suhu antara 45 °C–60 °C. Penempelan ini bersifat spesifik. Suhu yang tidak tepat menyebabkan tidak terjadinya penempelan atau primer menempel di sembarang tempat. Durasi tahap ini 1–2 menit. 3. Tahap pemanjangan atau elongation. Suhu untuk proses ini tergantung
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Survei penyakit mosaik dan koleksi sampel tanaman nilam sakit dilakukan di Kebun Percobaan Balai Tanaman Obat dan Aromatik (BALITTRO) di daerah Gunung Bunder dan Cicurug, Jawa Barat. Deteksi virus dilakukan di Laboratorium Virologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan dari bulan Maret sampai Desember 2011.
Metode Penelitian
Penyiapan Sampel Tanaman
Sampel tanaman nilam yang memperlihatkan gejala mosaik dikoleksi dari dua lokasi Kebun Percobaan Balittro di daerah Cicurug, Sukabumi dan daerah Gunung Bunder, Bogor. Setiap sampel yang diambil didokumentasikan dengan melihat gejala pada daun nilam yang diindikasikan merupakan asosiasi dengan
Fabavirus yakni, mosaik dan modifikasi gejalanya; mosaik ringan, bintik-bintik, belang, hingga malformasi seperti daun mengeriting dan daun melekuk. Selanjutnya sampel daun nilam sakit dari lapangan digunakan sebagai sumber inokulum pertama dan diuji secara serologi menggunakan berbagai antiserum termasuk antiserum terhadap Fabavirus.
Deteksi Virus dengan Teknik Serologi DAS-ELISA
Teknik serologi melalui DAS-ELISA menggunakan produk DSMZ (Germany), dengan prosedur seperti yang telah dijelaskan oleh Clark & Adams (1977): IgG atau antiserum diencerkan pada coating buffer (1.59 g sodium carbonate [Na2CO3], 2.93 g sodium bicarbonate [NaHCO3], dan 0.20 g sodium
azide [NaN3] dilarutkan dalam 900 ml H2O dengan mengatur pH pada 9.6
menggunakan HCl, kemudian jadikan larutan hingga 1000 ml). Dengan menggunakan perbandingan 1:1000, larutan dimasukkan ke setiap well pada
dicuci dengan PBST-Tween (8.0 g sodium chloride [NaCl], 0.2 g monobasic potassium phospate [KH2PO4], 1.15 g dibasic sodium phospate [Na2HPO4], 0.2
potassium chloride [NaN2], dilarutkan dalam 900 ml H2O (pH diatur 7,4 dengan
NaOH dan HCl) kemudian larutan ditambahkan H2O hingga volume menjadi
1000 ml, selanjutnya ditambahkan 0.5 Tween 20), kemudian plate dikeringkan dengan membalikkan plate diatas kertas tissue. Pencucian diulang tiga kali. Sampel (diekstraksi dengan ekstrak buffer PBST + 2% PVP [sediakan PVP-15 polyvinyl pyrrolidone]) lalu dimasukkan ke dalam tiap well sebanyak 100 µl dilanjutkan dengan inkubasi semalam. Setelahnya plate dicuci dengan PBST sebanyak tiga kali. Antivirus conjugate dilarutkan pada conjugate buffer
(PBST+2% egg albumin [Sigma A-5253] sesuai rekomendasi), ditambahkan 100 µl di setiap well, inkubasikan selama 4 jam pada suhu 37 °C. Plate dicuci dengan PBST tiga kali. Kemudian siapkan substrat baru; 10 mg p-nitrophenyl phospate (Sigma; Fluka) yang dilarutkan pada 10 ml substrate buffer (97 ml diethanolamine, 600 ml H2O, 0.2 g sodium azide [NaN3], pH diatur 9.8 dengan
HCl, dan volume dijadikan 1000 ml). Substrat tersebut ditambahkan sebanyak 100 µl dalam tiap well, lalu diinkubasi pada suhu ruang selama 30, 60 dan 90 menit. Selama waktu-waktu tersebut plat mikrotiter diuji secara kuantitatif menggunakan ELISA-reader (Bio-RAD 550) pada panjang gelombang 405 nm. Dalam setiap pengujian disertakan kontrol negatif, yaitu tanaman sehat dan buffer. Pengujian dikatakan positif jika nilai absorban sampel yang diuji menunjukkan nilai dua kali (2X) lebih besar daripada kontrol negatif tanaman sehat.
Deteksi dan Identifikasi secara Molekuler
Ekstraksi RNA total. RNA total diekstraksi dari jaringan daun tanaman
nilam bergejala penyakit mosaik dengan menggunakan kit komersial Bench-Top Protocols for Xprep Plant RNA Mini Kit (PKT; Korea). Tanaman yang diekstraksi merupakan tanaman yang telah diuji menggunakan ELISA dan positif
12 dipipet, lalu dimasukkan ke dalam filter column putih dan ditempatkan pada tabung koleksi 2 ml, lalu disentrifuse pada kecepatan 12000 rpm selama 2 menit. Supernatan dipipet tanpa menyentuh pelet dalam tabung koleksi, ukur volume supernatan yang diperoleh lalu dipindahkan ke dalam tabung mikro 2 ml baru. Kemudian ethanol 96% ditambahkan (sebanyak setengah dari volume supernatan) dan dicampur dengan rata. Sampel dimasukkan ke dalam XPPLR
mini column merah, kemudian ditempatkan pada tabung koleksi 2 ml lalu disentrifuse pada kecepatan 12000 rpm selama 1 menit. Cairan yang terdapat pada tabung koleksi dibuang, kemudian ditambahkan 500 µl wash buffer 1 ke dalam XPPLR mini column, lalu ditutup dengan baik dan disentrifuse pada kecepatan 12000 rpm selama 1 menit. Cairan yang terdapat pada tabung koleksi dibuang, kemudian ditambahkan 700 µl wash buffer 2 ke dalam XPPLR mini column, lalu ditutup dengan baik dan disentrifuse pada kecepatan 12000 rpm selama 1 menit. Cairan yang terdapat pada tabung koleksi dibuang, kemudian untuk mengeringkan XPPLR mini column disentrifuse selama 3 menit pada 12000 rpm. Untuk meyakinkan bahwa tabung column telah kering, column dipindahkan pada tabung koleksi baru. Selanjutnya, 50 µl RNAse free water ditambahkan ke dalam pusat membran XPPLR mini column, didiamkan selama 1 menit lalu disentrifuse pada kecepatan 12000 rpm selama 2 menit. Siapan RNA total ini digunakan sebagai template dalam reaksi RT-PCR.
Sintesis cDNA. Total RNA didenaturasi dengan pemanasan 5 menit pada
suhu 95 °C. RNA hasil ekstraksi selanjutnya ditranskripsi balik menjadi cDNA (complementary DNA) dengan menggunakan teknik Reverse Transcription
(RT) selama 1 jam pada suhu 42 °C. RNA. Konsentrasi reagensia yang digunakan dalam reaksi RT pada Tabel 1 dicampurkan dalam microtube. Reaksi RT dilakukan dalam sebuah mesin Automated Thermal cycler Gene Amp PCR
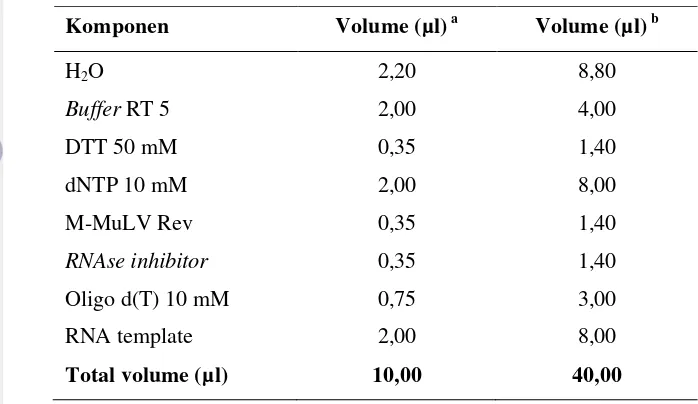
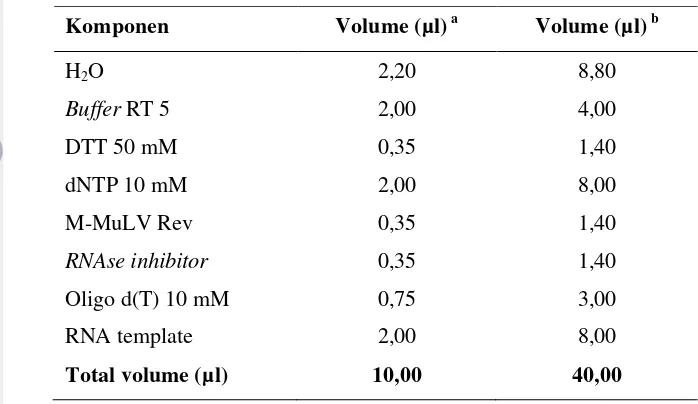
Tabel 1 Komposisi reagensia Reverse Transcription (RT) (Promega; USA) untuk reaksi sintesis complementary DNA terhadap RNA genom Fabavirus
isolat nilam Cicurug dan Gunung Bunder
Komponen Volume (µl) a Volume (µl) b
H2O 2,20 8,80
Buffer RT 5 2,00 4,00
DTT 50 mM 0,35 1,40
dNTP 10 mM 2,00 8,00
M-MuLV Rev 0,35 1,40
RNAse inhibitor 0,35 1,40
Oligo d(T) 10 mM 0,75 3,00
RNA template 2,00 8,00
Total volume (µl) 10,00 40,00
a
Volume total yang diperlukan sebanyak 10 µl untuk 1X reaksi; bVolume total yang diperlukan sebanyak 40 µl untuk 4X reaksi
Amplifikasi DNA. Total RNA hasil ekstraksi RNA dipakai sebagai template untuk amplifikasi sebagian genom Fabavirus. Amplifikasi gen penyandi
coat proteinFabavirus dilakukan dengan teknik RT-PCR menggunakan pasangan
primer spesifik digunakan untuk mendeteksi Fabavirus yang terdiri dari forward
primer dan reverse primer, yaitu [BBWVVSSP (5‟-
GTBTCDAGTGCTYTDGAAGG-3‟, B = C, G, atau T; D = A, G, atau T; Y = C
atau T) dan BBWVKMRM (5‟-TDGWDCCATCVAGICKCATTTT-3‟, W = A atau T; V = A, C, atau G; I = Inosine; K = G atau T)] dengan prediksi ukuran produk 322 bp mencakup wilayah dari C-terminal dari large coat protein (LCP) ke N-terminal small coat protein (SCP) (Kondo et al. 2005).
14 Tabel 2 Komposisi reagensia Polymerase Chain Reaction (PCR) (Promega; USA) amplifikasi gen coat protein (CP) Fabavirus isolat nilam Cicurug dan Gunung Bunder
Komponen Volume(µl)a Volume(µl)b
H2O 9,5 38
Go Tag Green Master Mix 2x 12,5 50
Primer BBWVVSSP 1 4
Primer BBWVKMRM 1 4
cDNA 1 4
Total Volume 25 100
a
Volume total yang diperlukan sebanyak 25 µl untuk 1X reaksi; bVolume total yang diperlukan sebanyak 100 µl untuk 4X reaksi
Program PCR diatur untuk mengamplifikasi cDNA yang didahului dengan tahap denaturasi awal pada suhu 95 °C selama 5 menit. Dilanjutkan dengan 35 siklus yang terdiri dari denaturasi pada 95 °C selama 1 menit, penempelan primer (annealing) pada 51 °C selama 1 menit, dan pemanjangan (extention/elongation) pada 72 °C selama 1 menit. Khusus untuk siklus terakhir, ditambahkan 5 menit pada 72 °C untuk tahapan sintesis, dan siklus berakhir pada suhu 4 °C. Setelah dilakukan PCR, maka hasil yang diperoleh dapat dielektroforesis.
Elektroforesis. Visualisasi hasil RT-PCR dilakukan dengan elektroforesis gel agarosa 1%. Sebanyak 0,3 gr agarosa dimasukkan ke dalam tabung Erlenmeyer 100 ml, lalu ditambahkan 30 ml buffer Tris-Borate EDTA (TBE) 0,5x (0,045 M Tris-Borate, 0,01 M EDTA), untuk pembuatan gel agarose. Kemudian dipanaskan dalam microwave oven selama 2 menit atau sampai agarose larut. Larutan agar didinginkan terlebih dahulu selama kurang lebih 15 menit, ditambahkan 1,5 µl ethidium bromida kemudian diaduk. Siapkan cetakan dan
„sisir‟ gel yang diletakkan di bagian atas pencetak gel kemudian larutan agarose
dituang ke dalam cetakan. Gel didiamkan sampai mengeras (30-45 menit). Setelah mengeras, gel diambil dan diletakkan ke dalam bak elektroforesis yang berisi
buffer TBE 0,5 kali. DNA hasil PCR dimasukkan ke dalam sumur gel
dilakukan dengan tegangan 100 volt selama 25 menit. Hasil elektroforesis dilihat di bawah UV transluminator. Pita DNA yang terbentuk pada hasil elektroforesis tersebut didokumentasikan dengan kamera digital.
Analisis sikuen nukleotida. Sampel yang terdeteksi positif terinfeksi
Fabavirus pada tanaman nilam uji kemudian dianalisis sikuen nukleotidanya. Perunutan susunan nukleotida menggunakan sequencer machine ABI-Prism 3100-Avant Genetic Analyzer. Hasil sikuen nukleotida dianalisis menggunakan software Blast yang dapat diakses di situs web National Center for Biotechnology
Information (NCBI) [www.ncbi.nlm.nih.gov] untuk memperoleh kesamaan
nukleotida yang didapatkan dan untuk mendapatkan file dalam format fasta
berupa database nukleotida dari virus yang diindikasikan sama dengan virus yang sedang dianalisis. BLAST (Basic Local Alignment Search Tool) merupakan alat yang tersedia untuk mencari database sehingga didapatkan sikuen yang sama pada sebuah penggunaan sequence query supplied.
Analisis sikuen dilakukan setelah mendapatkan database nukleotida dari virus tersebut kemudian dianalisis menggunakan BioEdit Sequence Alignment Editor untuk mendapatkan database nukleotida dari Fabavirus yang dianalisis berdasarkan coat protein Fabavirus tersebut. Perunutan sikuen merupakan landasan bioinformatika berupa variabel yang telah dikonversi dan digunakan sebagai dasar database metode filogeni (Higgs & Attwood 2005).
Metode filogeni secara molekuler menggunakan sikuen molekuler untuk membangun sebuah pohon evolusi. Informasi secara tipikal yang dikembangkan dari sebuah teori evolusionari dipaparkan dalam bentuk diagram pohon sehingga dapat diinterpretasikan dengan baik berupa diagram bercabang-cabang yang dapat dikonstruksi berdasarkan kesamaan atau perbedaan sifat fisik maupun genetik seperti sikuen DNA, sikuen asam amino (protein), dan lainnya. Metode filogeni dapat menggunakan program Molecular Evolutionary Genetics Analysis (MEGA
4.0 or newer version) dengan memasukkan hasil multi-alignment untuk
HASIL DAN PEMBAHASAN
Deteksi Fabavirus pada Tanaman Nilam
Deteksi Fabavirus Melalui Uji Serologi
Tanaman nilam dari sampel yang telah dikoleksi dari daerah Cicurug dan Gunung Bunder telah berhasil diuji secara serologi (DAS-ELISA) menggunakan antiserum Fabavirus. Dari tanaman nilam yang dikoleksi, dipilih dua sampel dari daerah Cicurug (isolat CG15 dan CG16) dan dua sampel dari Gunung Bunder (isolat GB27 dan GB29) yang terdeteksi terinfeksi Fabavirus dengan nilai absorbansi tertinggi (data tidak ditampilkan). Tanaman nilam yang ditemukan terinfeksi Fabavirus tersebut memperlihatkan gejala mosaik dengan beberapa variasi, seperti bintik-bintik kuning pada daun (Gambar 3 A), daun melekuk berwarna keunguan (Gambar 3 B), mosaik dengan malformasi (Gambar 3 C), dan mosaik tanpa malformasi (Gambar 3 D). Banyaknya variasi gejala yang ditemukan atau tidak adanya gejala khas pada tanaman nilam dari infeksi Fabavirus ini mempertegas pendapat banyak peneliti bahwa gejala penyakit tidak dapat digunakan sebagai satu-satunya faktor penentu untuk mendeteksi/ mengindentifikasi suatu virus pada tanaman. Seperti yang diungkapkan Bock (1982
Gambar 3 Variasi gejala yang berasosiasi dengan infeksi Fabavirus pada tanaman nilam dari daerah Cicurug (CG) dan Gunung Bunder (GB)
Deteksi Fabavirus Melalui RT-PCR
Sampel tanaman nilam yang positif terinfeksi Fabavirus (isolat CG15, CG16, GB27, dan GB29) selanjutnya diuji dengan RT-PCR menggunakan pasangan primer yang spesifik Fabavirus (Kondo et al. 2005). Seperti ditampilkan Gambar 2, pada keempat sampel tersebut terbentuk pita DNA yang berukuran sesuai dengan desain primer yaitu sekitar 322 bp. Hasil ini mempertegas hasil deteksi Fabavirus yang telah dilakukan melalui uji serologi. Adapun pita DNA yang terbentuk pada sampel CG15 dan GB27 sangat tipis, kemungkinan karena konsentrasi partikel virus sangat rendah pada jaringan tanaman. Hal ini tidaklah mengherankan karena pengujian dilakukan terhadap sampel yang langsung diambil dari lapangan, sehingga konsentrasi virus saat sampel tersebut diambil bergantung dari dinamika perkembangannya, meskipun demikian kemungkinan ini perlu dipastikan dengan menguji konsentrasi virus sampel tanaman yang didapat menggunakan spektrofotometer pada 206 nm atau menggunakan
18 mendeteksi keberadaan virus dalam konsentrasi rendah sekalipun. Selama ada
cukup utas tunggal DNA atau RNA yang menjembatani 5‟ ends dari dua primer oligonukleotida, maka amplifikasi dapat menunjukkan hasil berupa pita DNA yang terbentuk setelah dilakukan prosedur elektroforesis. (Jackson et al. 1991)
Gambar 4 Hasil amplifikasi DNA sebagian genom virus (di daerah gen coat protein) melalui RT-PCR menggunakan pasangan primer spesifik
Fabavirus. Lajur M = marker 100 bp DNA ladder; Lajur K(-) = Kontrol negatif dari tanaman nilam sehat; Lajur CG15 dan CG16 = isolat asal Cicurug no. 15 dan no. 16; Lajur GB27 dan GB29= isolat asal Gunung Bunder no. 27 dan no. 29
Identifikasi Spesies Fabavirus pada Tanaman Nilam
Nilai Penjajaran Sikuen Nukleotida
Produk RT-PCR isolat Cicurug dan Gunung Bunder yang jumlahnya cukup memadai (Gambar 5) berhasil disikuen. Hasil sikuen nukleotida tersebut kemudian dianalisis menggunakan program Basic Local Alignment Search Tool
(BLAST) pada www.ncbi.nlm.nih.gov untuk melakukan pemetaan spesies-spesies
dibandingkan berasal dari golongan Fabavirus dan digunakan satu spesies di luar genus Fabavirus yang masih berada dalam satu famili (Comoviridae) sebagai
outgroup, yakni CPMV (Cowpea mosaic virus) genus Comovirus. Genus
Comovirus memiliki kisaran inang yang terbatas pada sedikit dari spesies famili Leguminosae dengan gejala khas yang ditimbulkan berupa mosaik, belang dan secara umum tidak menimbulkan gejala bercak/ mosaik cincin. Penularannya di alam dilakukan oleh kumbang, khususnya famili Chrysomelidae (Wellink et. al
2000). CPMV memiliki bentuk partikel yang relatif sama dengan Fabavirus, yakni bentuk isometric yang terdiri dari dua molekul RNA, RNA1 dan RNA2 (Bertens 2000).
Gambar 5 Penjajaran sikuen nukleotida hasil ClustalW sebagian gen CP
Fabavirus-GB (isolat Gunung Bunder) dan Fabavirus-CG (isolat Cicurug) terhadap ke-11 isolat pada basis data GeneBank
menggunakan program GeneDoc v2.7
20 Cicurug dan Gunung Bunder hanya sebesar 65,2%, nilai ini cukup rendah dan diduga keduanya memiliki karakterisasi yang berbeda. Isolat CG16 memiliki similaritas tertinggi terhadap BBWV-2 asal Singapura (AF225954) dengan
alignment score 91,8% menunjukkan bahwa isolat asal Cicurug merupakan strain
yang sama dengan isolat asal Singapura. Sementara sikuen isolat GB29 mempunyai alignment score 77,8% terhadap BBWV-2 asal China2 (GQ202215) (Tabel 3). Clavarie & Notredame (2003 dalam Jamil 2005) menyatakan bahwa dua gen atau fragmen DNA dikatakan homolog jika 70% urutan nukleotidanya atau 25% urutan asam aminonya identik, dengan panjang urutan minimal 100.
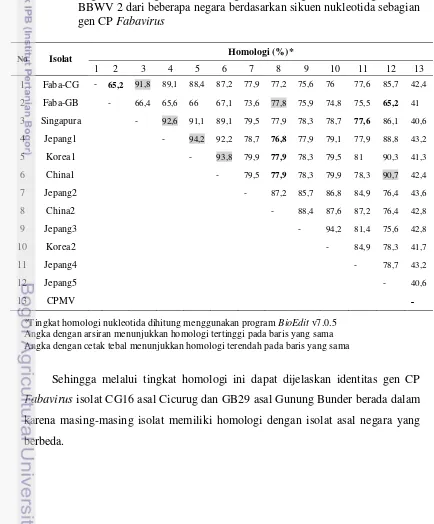
Tabel 3 Tingkat homologi isolat Cicurug dan Gunung Bunder dengan isolat BBWV 2 dari beberapa negara berdasarkan sikuen nukleotida sebagian gen CP Fabavirus
No Isolat Homologi (%)*
1 2 3 4 5 6 7 8 9 10 11 12 13
1 Faba-CG - 65,2 91,8 89,1 88,4 87,2 77,9 77,2 75,6 76 77,6 85,7 42,4
2 Faba-GB - 66,4 65,6 66 67,1 73,6 77,8 75,9 74,8 75,5 65,2 41
3 Singapura - 92,6 91,1 89,1 79,5 77,9 78,3 78,7 77,6 86,1 40,6
4 Jepang1 - 94,2 92,2 78,7 76,8 77,9 79,1 77,9 88,8 43,2
5 Korea1 - 93,8 79,9 77,9 78,3 79,5 81 90,3 41,3
6 China1 - 79,5 77,9 78,3 79,9 78,3 90,7 42,4
7 Jepang2 - 87,2 85,7 86,8 84,9 76,4 43,6
8 China2 - 88,4 87,6 87,2 76,4 42,8
9 Jepang3 - 94,2 81,4 75,6 42,8
10 Korea2 - 84,9 78,3 41,7
11 Jepang4 - 78,7 43,2
12 Jepang5 - 40,6
13 CPMV ˗
*Tingkat homologi nukleotida dihitung menggunakan program BioEdit v7.0.5 Angka dengan arsiran menunjukkan homologi tertinggi pada baris yang sama Angka dengan cetak tebal menunjukkan homologi terendah pada baris yang sama
Sehingga melalui tingkat homologi ini dapat dijelaskan identitas gen CP
Fabavirus isolat CG16 asal Cicurug dan GB29 asal Gunung Bunder berada dalam
[image:30.595.90.524.298.822.2]Perbandingan dengan Cowpea mosaic virus (CPMV) menunjukkan homologi nukleotida yang rendah berkisar dari 40,6% hingga 43,2% yang berarti bahwa BBWV-2 memiliki hubungan yang jauh dengan CPMV walaupun masih dalam genus yang sama.
Hubungan Kekerabatan antara Isolat. Pohon filogenetika dibangun
menggunakan metode UPGMA (Unweighted Pair-Group Method with. Arithmetic) pada program MEGA v5.05 (Tamura et al. 2011) untuk menunjukkan hubungan kekerabatan antara isolat yang dibandingkan seperti yang disajikan dalam bentuk kladogram disertai nilai penghitungan boostrap di setiap percabangannya (Gambar 6). Metode ini mengasumsikan nilai substitusi nukleotida atau asam amino adalah sama pada semua garis keturunan secara evolusi. Pohon filogeni yang terbentuk menghasilkan jumlah panjang cabang = 2,04051194 dan persentase replikasi yang berasosiasi dalam kelompok taksa sama dengan uji bootstrap (1000 replikasi) diperlihatkan di tiap cabang pada pohon dengan nilai cutoff 70%. Pohon digambarkan dalam skala dengan panjang cabang sama seperti pada jarak evolusinya untuk menduga hubungan kekerabatannya. Jarak evolusi dihitung menggunakan metode Maximum Composite Likelihood dan berada dalam unit substitusi basa yang sama di tiap bagiannya. Analisis data menyertakan 13 sikuen nukleotida dan pada semua posisi basa yang tidak terisi maupun data hilang (gaps and missing data), dihapus atau tidak dimasukkan saat mengolah data sikuen. Total akhir data didapatkan 234 posisi basa nukleotida.
Gambar 6 memperlihatkan filogenetika nukleotida gen CP Fabavirus isolat Cicurug & Gunung Bunder terhadap isolat-isolat negara lain dengan CPMV sebagai outgroup, terbagi menjadi tiga kelompok utama. Kedua isolat, Fabavirus -CG dan Fabavirus-GB terpisah ke dalam kelompok yang berbeda. Isolat
Fabavirus-CG mengelompok dengan isolat BBWV-2 asal AB018698-Jepang1,
22
Gambar 6 Kladogram sikuen nukleotida sebagian gen CP Fabavirus isolat Cicurug dan Gunung Bunder dibandingkan terhadap ke-11 isolat pada basis data GeneBank menggunakan metode UPGMA Tree
pada MEGA v5.05
Sedangkan, BBWV-2 asal AB013616-Jepang4, GQ202215-China2, AB161179-Jepang3, AF104335-Korea2 dan AB161177-Jepang2 berada di kelompok kedua. Isolat asal Gunung Bunder (Fabavirus-GB) terpisah di luar dua kelompok tersebut dengan nilai bootstrap 81 terhadap kesebelas isolat BBWV-2 lainnya, yang masih mengindikasikan kesamaan spesies. Kedua isolat tidak berada dalam kelompok yang sama meskipun seluruh sampel tanaman berasal dari spesies Pogostemon
cablin Benth (nilam aceh) varietas Sidikalang, hal tersebut diduga
kemungkinannya disebabkan perbedaan asal nenek moyang tanaman nilam yang dikembangkan dari kedua daerah survei maupun kemungkinan adanya mutasi sehingga menyebabkan keragaman antar isolat Fabavirus, mengingat bahwa nilam bukanlah tanaman asli Indonesia. Demikian juga indikasi sumber penularan virus yang berasal dari tempat yang berbeda, karena nilam aceh umumnya diperbanyak dengan cara vegetatif (stek batang) akan memudahkan penyebaran virus dari dan ke negara lain. Selain itu, tidak hanya minyak nilam olahan, komposit daun & batang nilam juga menjadi komoditas ekspor, sehingga peredarannya dalam skala besar ke negara-negara terdekat menjadi kurang terawasi. Dapat dilihat dari hasil pemetaan spesies (Gambar 5; Tabel 3)
menyertakan isolat asal negara Jepang, China, dan Singapura yang merupakan negara pengimpor minyak nilam dan juga menjadi negara yang mengembangkan teknik budidaya nilam.
KESIMPULAN
Berdasarkan identifikasi dan analisis sikuen nukleotida dapat disimpulkan bahwa Fabavirus yang berasosiasi dengan penyakit mosaik pada tanaman nilam di daerah Jawa Barat, baik isolat nilam asal Cicurug dan Gunung Bunder adalah
Broad bean wilt virus 2 (BBWV-2). Hasil penelitian ini merupakan laporan pertama (first report) mengenai infeksi alami BBWV-2 pada tanaman nilam di Indonesia.
SARAN
Pengujian isolat lain dari Cicurug (CG15) dan Gunung Bunder (GB27) yang memiliki hasil pengujian serologi dan molekuler positif berasosiasi dengan
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. Edisi ke-5. New York: Academic Press. Apindiati RK. 2012. Identifikasi Telosma mosaic virus penyebab penyakit mosaik
pada tanaman nilam (Pogostemon cablin Benth.) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Bertens P. 2000. Molecular characterisation of the Cowpea mosaic virus
movement protein [tesis]. Belanda: Wageningen University.
Clark MF & Adams AN. 1977. Characteristics of the microplate method of enzyme-linked immunosorbent assay for the detection of plant viruses. J. Gen. Virol. 34: 475–483.
Converse RH & Martin RR. 1990. ELISA methods for plant viruses. Di dalam: Hampton R, E. Ball, S. De Boer, editor. Serological Methods for Detection and Identification of Viral and Bacterial Plant Patogens. St. Paul: APS Press. hlm 179-196.
[DEPTAN] Departemen Pertanian, Badan Karantina Tanaman. 2009. Pedoman diagnosis OPTK golongan virus. Deptan: Jakarta.
[Ditjenbun] Direktorat Jenderal Perkebunan. 2007. Nilam. Statistik Perkebunan Indonesia 2003-2006. Jakarta: Direktorat Jenderal Perkebunan, Departemen Pertanian. Hlm. 1-19.
Ferrer RM, et al. 2005. The complete sequence of a Spanish isolate of Broad bean wilt virus 1 (BBWV-1) reveals a high variability and conserved motifs in the genus Fabavirus. Arch Virol 150: 2109-2116.
Ferrer RM, et al. 2007. Detection and identification of species of the genus
Fabavirus by RT-PCR with a single pair of primers. J Virol Methods 144: 156-160.
Filho PEM, Resende RDO, Lima MI, Kitajima EW. 2002. Patchouli virus X, a new Potexvirus from Pogostemon cablin. Annals of Applied Biology 141(3): 267-274.
Hall TA. 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucl. Acids. Symp. Ser. 41:95-98. Higgs PG, Attwood TK. 2005. Bioinformatics and Molecular Evolution. UK:
Blackwell Publishing.
Ibnusantoso G. 2000. Kemandegan pengembangan minyak atsiri Indonesia [abstrak]. Di dalam: Seminar Pengusahaan Minyak Atsiri Hutan Indonesia; Bogor, 23 Mei 2000. Bogor: Fakultas Kehutanan IPB Dramaga.
26 Ikegami M, Onobori Y, Sugimura N, Natsuaki T. 2001. Complete nucleotide sequence and the genome organization of Patchouli mild mosaic virus
RNA1. Springer 355-358.
Jackson DP, Hayden JD, Quirke P. 1991. Extraction of nucleic acid from fresh and archival material. Di dalam: McPherson MJ, Quirke P, Taylor GR, editor. PCR, A Practical Approach. Oxford University Press: New York. Hlm 29-31.
Jamil I. 2005. Analisis sekuen daerah ITS DNA ribosom (rDNA) dan desain primer untuk mendeteksi Phytophthora palmivora Butl. pada kakao [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Kobayashi YO, et al. 2003. Analysis of genetic relations between Broad bean wilt virus 1 and Broad bean wilt virus 2. J Gen Plant Pathol. 69: 320-326. Kobayashi YO, Kobayashi A, Hagiwara K, Uga H, Mikoshiba Y, Naito T, Honda
Y, Omura T. 2005. Gentian mosaic virus: a new species in the genus
Fabavirus. Phytopathology 95: 192–197.
Koh LH, Cooper JI, Wong SM. 2001. Complete sequences and phylogenetic analyses of a Singapore isolate of broad bean wilt fabavirus. Arch Virol
(2001) 146: 135-147.
Kondo T, Fuji S, Yamashita K, Kang DK, Chang MU. 2005. Broad bean wilt virus 2 in yams. J Gen Plant Pathol. 71:441-443.
Mangun HMS. 2002. Nilam. Jakarta: Penebar Swadaya.
Mauludi L, Asman A. 2005. Profil Investasi Pengusahaan Nilam. Bogor: Balai Penelitian Tanaman Rempah dan Obat Departemen Pertanian.
Naidu RA, Hughes JDA. 2003. Methods for the detection of plant viral diseases of plant viral diseases in plant virology in sub-Saharan Africa. Di dalam: Proceedings of plant virology. Nigeria: IITA. 233–260. [internet]. http://old.iita.org/cms/details/virology/pdf_files/233-260.pdf [21 Agu 2012] Natsuaki KT, Tomaru K, Ushiku S, Ichikawa Y, Sugimura Y, Natsuaki T, Okuda
S, Teranaka M. 1994. Characteristics of two viruses isolated from patchouli in Japan. Plant Disease 78(11):1094-1097.
Nuryani Y. 2005. Pelepasan varietas unggul nilam. Warta Penelitian dan
Pengembangan Tanaman Industri 11(1):1-3.
Nuryani Y. 2006. Budidaya Tanaman Nilam (Pogostemon cablin Benth). Bogor: Balai Penelitian Tanaman Rempah dan Obat Departemen Pertanian.
Qi Y, Zhou X, Li D. 2000. Complete nucleotide sequence and infectious cDNA clone of the RNA1 of a Chinese isolate of Broad bean wilt virus 2. Virus Genes 20: 201-207.
Satyani V. 2012. Deteksi diferensial Potyvirus dan Fabavirus dengan Reverse
Transcription-Polymerase Chain Reaction (RT-PCR) [skripsi]. Bogor:
Fakultas Pertanian, Institut Pertanian Bogor.
Seal S, Elphinstone J. 1994. Advances in identification and detection of P. solanacearum. Di dalam: Hayward A.C. & G.L. Hartman, editor. The Disease and Its Causative Agent, P. solanacearum. CAB International, Wallingford: UK. hlm 42-57.
Seal S. 1997. Molecular methods for detection and discrimination of R. solanacearum. Di dalam: Prior, Allen C, Elphinstone J, editor. Bacterial Wilt Disease: Molecular and Ecological Aspects. Springer. hlm 103-109.
[SIB] Swiss Institute of Bioinformatics. 2009. Molecular biology of Fabavirus.
Plant Viruses Online. http://viralzone.expasy.org/ [10 Agu 2012].
Sugimura Y, Padayhag BF, Ceniza MS, Kamata N, Eguchi S, Natsuaki T, Okuda S. 1995. Essential oil production increased by using virus free patchouli plants derived from meristem-tip culture. Plant Pathology 44:510-515. Sukamto, Wahyuno D. 2007. Penyakit budok pada tanaman nilam. Balai
Penelitian Obat dan Aromatika Edisi khusus No. 1.
Sukamto, Rahardjo IB, Sulyo Y. 2007. Detection of Potyvirus on patchouli plant (Pogostemon cablin Benth) from Indonesia. Proceeding of International Seminar on Essential Oil; Jakarta, 7-9 November 2007. Jakarta: ISEO. hlm 72-77.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, and Kumar S. 2011. MEGA5: Molecular Evolutionary Genetics Analysis using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods. Molecular Biology and Evolution (submitted).
Thomas JE, Wong WC, Goanlock DH. 1989. Modern methods for the detection of plant pathogens. Queensland Agric 49-53.
Uyemoto JK, Provvidenti R. 1974. Isolation and identification of two serotypes of Broad bean wilt virus. Phytopathology 64: 1547-1548.
Wellink JLG, Sanfacon O, Ikegami MH, Jones AT. 2000. Family Comoviridae. Di dalam: Regenmortel MHV et. al. , editor. Virus Taxonomy. Seventh
Report of the International Committee on Taxonomy of Viruses New York:
Academic Press. hlm 691-701.
PENDAHULUAN
Latar Belakang
Tanaman nilam (Pogostemon cablin Benth) merupakan salah satu tanaman penghasil minyak atsiri yang penting, menyumbang devisa lebih dari 50% total ekspor minyak atsiri di Indonesia. Data Direktorat Jenderal Perkebunan (Ditjenbun 2007) pada tahun 2004 menyebutkan ekspor nilam Indonesia mencapai 2074 ton atau setara dengan US$ 27,137 juta. Angka ekspor ini terus bertambah karena kebutuhan nilam dunia semakin meningkat diantaranya digunakan sebagai bahan baku dalam industri pembuatan minyak wangi, kosmetika, farmasi, insektisida, aromaterapi dan digunakan juga sebagai bahan aditif dalam makanan. Minyak nilam (patchouli oil) diperoleh dari proses penyulingan daun nilam yang digunakan sebagai bahan fixative (pengikat) dalam industri parfum dan hingga saat ini belum dapat dibuat bahan substitusinya secara sintesis (Wikardi et al. 1990; Ibnusantoso 2000).
dari golongan Fabavirus dapat menurunkan produksi sebesar 35% dan kadar
patchouli alcohol turun sebesar 2%.
Hingga saat ini belum ada laporan mengenai status penyakit mosaik dan kerugian yang diakibatkan Fabavirus pada nilam di Indonesia, sehingga sebagai langkah awal pengendalian penyakit yang tepat perlu dilakukan upaya deteksi dan identifikasi terhadap temuan penyakit mosaik di lapangan. Penelitian yang dilakukan Apindiati (2012) merupakan laporan pertama tentang infeksi alami TeMV (Telosma mosaic virus) yang termasuk genus Potyvirus pada tanaman nilam di Indonesia dan didukung juga oleh hasil penelitian Satyani (2012) terhadap kemungkinan infeksi Potyvirus dan atau Fabavirus serta infeksi keduanya secara bersamaan pada tanaman nilam, mengindikasikan diperlukannya langkah deteksi dan identifikasi Fabavirus yang berasosiasi dengan tanaman nilam dalam kajian terpisah.
Tujuan Penelitian
Penelitian bertujuan mendeteksi dan mengidentifikasi Fabavirus yang menyebabkan penyakit mosaik pada tanaman nilam.
Manfaat Penelitian
TINJAUAN PUSTAKA
Sistematika dan Karakteristik Nilam
Menurut Guenther (1952 dalam Nuryani 2006) sistematika nilam adalah sebagai berikut:
divisi : Spermatophyta kelas : Angiospermae ordo : Lamiales famili : Labiateae genus : Pogostemon
spesies : - Pogostemon cablin Benth - Pogostemon heyneanus Benth - Pogostemon hortensis Backer
Tanaman nilam adalah tanaman perdu wangi yang berakar serabut, permukaan daun seperti beludru jika diraba dengan tangan, bentuk daun membulat lonjong seperti jantung dengan warna hijau agak pucat. Bagian bawah daun dan rantingnya berbulu halus. Batangnya berkayu dengan diameter 10 – 20 mm relatif hampir berbentuk segi empat. Sebagian besar daun yang melekat pada ranting hampir selalu berpasangan satu sama lain. Jumlah cabang yang banyak dan bertingkat mengelilingi batang sekitar 3–5 cabang per tingkat. Tanaman ini memiliki umur tumbuh yang cukup panjang, yakni sekitar tiga tahun, panen perdana dapat dilakukan pada bulan ke 6–7 dan seterusnya setiap 2–3 bulan sekali bergantung pemeliharaan dan pola tanam, kemudian dapat diremajakan kembali dari hasil tanaman melalui persemaian maupun pembibitan berupa setek (Mangun 2002).
dari 6 bulan, ketinggian tanaman nilam dapat mencapai 60-90 cm dengan radius cabang sekitar 60 cm.
Hasil produksi tanaman nilam yang dapat dipetik untuk disuling adalah bagian daun. Selain itu, bagian lain seperti ranting, batang dan akar, dalam prakteknya juga ikut disuling dalam keadaan bercampur.tetapi kandungan minyak yang dimilikinya relatif lebih sedikit daripada bagian daun. (Mauludi & Asman 2005).
Di Indonesia terdapat tiga jenis nilam yang dibudidayakan secara umum, ketiganya dapat dibedakan dari karakter morfologi, kandungan & kualitas minyak serta ketahanan terhadap cekaman biotik dan abiotik. Ketiga jenis nilam tersebut adalah: 1) P. cablin Benth. sinonim P. patchouli Pellet van Suavis Hook disebut nilam Aceh, 2) P. heyneanus Benth. disebut nilam Jawa dan 3) P. hortensis
Becker disebut nilam sabun. Nilam dengan penyebaran paling luas dan banyak dibudidayakan adalah nilam Aceh, karena kualitas minyaknya berkadar tinggi (> 2,5%) dibandingkan dengan jenis nilam lainnya. (Nuryani 2006)
Nilam adalah salah satu tanaman penghasil minyak atsiri, oleh sebab itu produksi, kadar dan mutu minyak serta sifat ketahanan terhadap penyakit merupakan faktor penting yang dapat dipergunakan untuk menentukan keunggulan suatu varietas. Banyak faktor yang mempengaruhi kadar dan mutu minyak nilam, antara lain sifat genetik, budidaya, lingkungan, panen dan pasca panen (Nuryani 2006). Berdasarkan sifat genetiknya telah dilepas tiga varietas nilam unggul pada tahun 2005 yakni, varietas Tapak Tuan, varietas Lhokseumawe, dan varietas Sidikalang (Nuryani 2005).
Penyakit pada Tanaman Nilam
Dalam pengembangan budidaya nilam banyak kendala yang dihadapi oleh petani, salah satunya adalah serangan penyakit seperti layu bakteri, nematoda, budok, infeksi virus dan beberapa penyakit yang belum diketahui penyebabnya. (Sukamto & Wahyuno 2007)
5 terhambat sehingga rumpun tanaman tidak bertambah besar. Sedangkan penyakit yang diakibatkan oleh infeksi virus ditandai beberapa macam gejala berupa gejala belang-belang (mottle) atau bintik-bintik yang membentuk mosaik pada permukaan daun nilam, maupun kombinasi keduanya. Gejala ini muncul pada daun muda dan kemudian diikuti oleh seluruh permukaan daun tanaman nilam. Infeksi virus umumnya muncul seiring serangan hama kutu daun. Apabila tidak dilakukan pengendalian penyakit akan cepat meluas dan pada serangan lanjut akan menurunkan produksi tanaman nilam.
Menurut Natsuaki et al. (1994) dan Sugimura et al. (1995), tanaman nilam Indonesia dan Taiwan diinfeksi oleh Patchouli mottle virus (PaMoV) genus
Potyvirus dan Patchouli mild mosaic virus (PaMMV) genus Fabavirus dengan persentase tinggi. Kedua virus ini juga menyerang tanaman nilam di Bogor, Bandung dan Cianjur (Sukamto et al. 2007). Dengan adanya laporan awal ini perlu dilakukan deteksi dan identifikasi sebagai langkah awal pengendalian yang tepat terhadap keberadaan virus ini di Indonesia. Salah satu pertanaman nilam di Indonesia, daerah Brebes diindikasikan telah terinfeksi oleh virus dengan gejala mosaik. Berdasarkan deteksi awal dengan uji serologi, gejala tersebut disebabkan oleh Fabavirus.
Fabavirus
Genus Fabavirus dapat menginfeksi tanaman dalam berbagai kisaran inang, termasuk tanaman yang memiliki nilai ekonomi tinggi dan tanaman hortikultura dari berbagai spesies sehingga menyebabkan kehilangan hasil yang tinggi pada berbagai tanaman di dunia setiap tahunnya (Ferrer et al. 2007).
Fabavirus yang termasuk ke dalam famili Comoviridae, berbentuk isometric
ditranslasikan menjadi single polyprotein awal, dimana protein fungsional diperoleh dari pemecahan proteolytic yang terjadi seperti pada Comoviridae
[image:43.595.114.481.82.492.2](Wellink et al. 2000).
Gambar 1 Organisasi genom Fabavirus (SIB 2009)
Hingga saat ini, terdapat tiga spesies dalam genus Fabavirus yaitu Broad bean wilt virus 1 (BBWV-1), Broad bean wilt virus 2 (BBWV-2), Lamium mild mosaic virus (LaMMV) dan kandidat spesies baru, Gentian mosaic virus
(GeMV) (Kobayashi et al. 2005). BBWV-1 dan BBWV-2 dapat dibedakan berdasarkan uji serologi (Uyemoto & Provvidenti 1974). Kobayashi et al. (2003) dalam penelitian sebelumnya melaporkan bahwa seluruh sikuen nukleotida dari RNA BBWV-1 dan BBWV-2 memiliki hubungan genetik satu dengan lainnya. Tanaman yang terdeteksi tunggal BBWV memiliki gejala mosaik,
vein-clearing, rugosity, dan malformasi pada daun (Kondo et al. 2005). BBWV memiliki kisaran inang yang luas pada tanaman dikotil dan beberapa famili tanaman monokotil (Qi et al. 2000). Patchouli mild mosaic virus (PaMMV) juga telah diklasifikasikan sebagai spesies yang termasuk dalam Fabavirus (Ferrer et al. 2005; Kobayashi et al. 2003) dan telah diusulkan sebagai salah satu isolat BBWV-2 (Ikegami 1998, 2001). Isolat BBWV-ME merupakan isolat Broad bean wilt virus 2
7 bagian yang diketahui dan dugaan fungsinya. Tanda tanya mewakili bagian yang tidak dapat ditentukan tapi diduga merupakan keberadaan VPg dan (A)n adalah
polyadenylated tail.
(A)
(B)
Gambar 2 Organisasi genom BBWV-ME RNA1 (A) dan RNA2 (B) mewakili genus Fabavirus spesies BBWV 2 (Koh et al. 2001)
Virus yang termasuk kedalam genus Fabavirus dapat ditularkan oleh kutu daun (aphid) secara non-persisten dan dapat menyebabkan penyakit pada bagian tanaman dan buah (Kobayashi 2005). Selain itu, dapat juga ditularkan secara mekanis, namun tidak melalui benih. Untuk mendeteksi dan melakukan diagnosis penyakit akibat Fabavirus pada tanaman, dapat dilakukan uji serologi DAS-ELISA (Kobayashi et al. 2005) dengan antiserum BBWV-1 dan BBWV-2 yang telah tersedia secara komersial (Ferrer et al. 2007).
Enzyme Linked Immunosorbent Assay (ELISA)
Penggunaan teknik serologi Enzyme Linked Immunosorbent Assay
dan 103–104 sel bakteri/ml); (5) prosedurnya relatif sederhana dan cepat, antara 5– 24 jam; (6) hasilnya berupa data kuantifikasi; (7) dapat digunakan untuk menguji sampel dalam jumlah besar sekaligus; dan (8) dapat digunakan langsung di lapangan (Thomas et al. 1989; Converse & Martin 1990; Agrios 2005).
Dalam perkembangannya, teknik ELISA dimodifikasi baik dari segi praktis maupun keunggulannya sehingga muncul berbagai varian teknik ELISA (Randles et al. 1996; Seal 1997). Namun secara umum dalam prosedurnya ELISA dibagi menjadi dua kategori, yakni ELISA secara langsung yang dikenal dengan DAS-ELISA (Double Antibody Sandwich) dan ELISA tidak langsung atau
Indirect ELISA (I-ELISA). Perbedaan kedua metode ini adalah pada tempat enzim terikat. Bila konjugasi enzim dilakukan pada imunoglobulin antivirus maka metode itu termasuk DAS-ELISA, tetapi bila konjugasi enzim dilakukan pada imunoglobulin dari serum darah hewan maka metode tersebut diklasifikasikan sebagai I-ELISA (Badan Karantina Tanaman 2009).
Sebagai uji serologi, prinsip dasar ELISA adalah reaksi antara antigen (Ag) dengan antibodi (Ab) menjadi molekul Ag-Ab yang lebih besar dan mudah mengendap. Pengamatan hasil reaksi pada ELISA berdasarkan perubahan warna yang terjadi pada substrat pereaksi sesuai dengan label atau imunoprob (immuno probe) konjugat antibodi-enzim. Perubahan warna terjadi akibat hidrolisis enzimatik pada reaksi antara konjugat antibodi-enzim dengan substratnya, sehingga hasil ELISA lebih peka dan dapat dikuantifikasi (Converse & Martin 1990). Tahapan umum ELISA meliputi penempelan (trapping) Ag atau Ab pada media reaksi (solid phase) pada cawan mikrotiter ELISA, diikuti penambahan konjugat, dan diakhiri dengan penambahan substrat serta bufer penghenti reaksi (blocking buffer). Setelahnya, cawan mikrotiter ELISA dibaca pada ELISA-reader pada panjang gelombang 405 nm. Nilai absorbansi dari hasil ELISA dapat diverifikasi dengan melanjutkan uji molekuler seperti PCR.
Reverse Transcription-Polymerase Chain Reaction (RT-PCR)
9 terlebih dahulu diubah menjadi cDNA (complementary DNA) menggunakan enzim reverse transcriptase.
Metode Polymerase Chain Reaction (PCR) merupakan metode deteksi yang sensitif dan cepat dalam mendeteksi virus. PCR merupakan sebuah metode yang digunakan untuk memperbanyak suatu fragmen DNA yang spesifik secara in-vitro. Posisi fragmen DNA yang spesifik tersebut ditentukan oleh sepasang primer yang akan menjadi cetakan awal untuk proses perbanyakan fragmen DNA selanjutnya dengan bantuan enzim polimerase dan deoxyribonucleotide triposphate (dNTPs) yang dikondisikan pada suhu tertentu. Fragmen DNA, yang pada awalnya terdapat dalam konsentrasi yang sangat rendah akan diperbanyak menjadi cetakan fragmen DNA baru yang cukup untuk dapat divisualisasi pada gel agarosa (Badan Karantina Tanaman 2009).
Dalam prinsipnya, PCR merupakan proses yang dilakukan berulang-ulang antara 20–30 kali. Setiap siklus terdiri dari tiga tahap. Berikut adalah tiga tahap kerja PCR dalam satu siklus:
1. Tahap peleburan (melting) atau denaturasi. Pada tahap ini, berlangsung pada suhu tinggi (94 °C–96 °C), ikatan hidrogen DNA terputus karena mengalami denaturasi akibat suhu tinggi sehingga struktur DNA terpisah menjadi utas tunggal. Biasanya tahap ini dapat dilakukan agak lama (hingga 5 menit) untuk memastikan semua berkas DNA terpisah. Pada pemisahan ini DNA tidak stabil dan siap menjadi template bagi primer. Durasi tahap ini 1–2 menit.
2. Tahap penempelan atau annealing. Primer menempel pada bagian DNA template yang komplementer urutan basanya. Ini dilakukan pada suhu antara 45 °C–60 °C. Penempelan ini bersifat spesifik. Suhu yang tidak tepat menyebabkan tidak terjadinya penempelan atau primer menempel di sembarang tempat. Durasi tahap ini 1–2 menit. 3. Tahap pemanjangan atau elongation. Suhu untuk proses ini tergantung
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Survei penyakit mosaik dan koleksi sampel tanaman nilam sakit dilakukan di Kebun Percobaan Balai Tanaman Obat dan Aromatik (BALITTRO) di daerah Gunung Bunder dan Cicurug, Jawa Barat. Deteksi virus dilakukan di Laboratorium Virologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilakukan dari bulan Maret sampai Desember 2011.
Metode Penelitian
Penyiapan Sampel Tanaman
Sampel tanaman nilam yang memperlihatkan gejala mosaik dikoleksi dari dua lo