KONSTRUKSI GEN PENYANDI PLANTARICIN S DARI
Lactobacillus plantarum S34
RABIATUL ADAWIYAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Konstruksi Gen Penyandi Plantaricin S dari Lactobacillus plantarum S34 adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2013
ABSTRAK
RABIATUL ADAWIYAH. Konstruksi Gen Penyandi Plantaricin S dari Lactobacillus plantarum S34. Dibimbing oleh SURYANI dan APON ZAENAL MUSTOPA.
Bakteriosin merupakan peptida antimikrobial yang umumnya digunakan sebagai pengawet pangan alami. Bakteriosin dihasilkan baik oleh bakteri Gram positif maupun Gram negatif, salah satunya adalah Lactobacillus plantarum S34 yang diisolasi dari bekasam daging sapi. Bakteriosin yang dihasilkan oleh L. plantarum S34 disebut plantaricin. Gen plnSmerupakan gen penyandi plantaricin S. Penelitian bertujuan mengisolasi gen plnS dari L. plantarum S34. Gen plnS diamplifikasi dengan teknik PCR (Polymerase Chain Reaction), kemudian pengklonan menggunakan vektor pGEM-T Easy dan ditransformasi ke Escherichia coli DH5. Transformasi gen menggunakan metode kejut panas. Seleksi transforman menggunakan metode koloni biru putih. Amplifikasi gen menghasilkan amplikon gen plnS berukuran sekitar ±500 pb. Ligasi gen plnS dengan vektor pGEM-T Easy (3015 pb) menghasilkan plasmid rekombinan berukuran sekitar ±3500 pb. Konfirmasi koloni putih dari seleksi biru-putih dilakukan dengan PCR koloni menghasilkan amplikon berukuran sekitar ±500 pb. Plasmid rekombinan pada koloni 2 dikonfirmasi dengan enzim restriksi SalI dan NcoI. Hasil pemotongan menunjukkan ukuran gen yang disisipkan sesuai dengan yang diharapkan, yaitu sekitar ±500 pb
Kata Kunci: Lactobacillus plantarum S34, bekasam daging sapi, bakteriosin, plantaricin S
ABSTRACT
RABIATUL ADAWIYAH. Construction of Gene Encoding Plantaricin S Lactobacillus plantarum S34. Under supervision of SURYANI and APON ZAENAL MUSTOPA.
Bacteriocins are antibacterial peptides that commonly used as food biopreservative. Bacteriocins were produced by both either Gram positive or Gram negative bacteria, one of them is Lactobacillus plantarum S34 isolated from beef bekasam. L. plantarum S34 produced bacteriocins called plantaricin. PlnS gene is gene that encoding plantaricin. The study purposed is to isolate plnS gene from L. plantarum S34. The plnS gene amplified by PCR (Polymerase Chain Reaction) technique, and then cloned into cloning vector pGEM-T Easy and transformed into E. coli DH5α. Transformation gene using heat shock method. Selection of transformants using the blue and white colonies. Gene amplification produces plnS gene amplicon size about ±500 bp. PlnS gene ligation with pGEM-T Easy (3015 bp) vector generating plasmid size about ±3500 bp. pGEM-The confirmation of white colonies from blue-white screening was carried out with PCR colony, generated amplicons size was about ±500 bp. Recombinant plasmid in colony 2 was confirmed by restricition analysis using SalI and NcoI. The result showed that the gene insert had expected size ±500 bp.
KONSTRUKSI GEN PENYANDI PLANTARICIN S DARI
Lactobacillus plantarum S34
RABIATUL ADAWIYAH
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Konstruksi Gen Penyandi Plantaricin S dari Lactobacillus plantarum S34
Nama : Rabiatul Adawiyah NIM : G84080001
Disetujui oleh
Dr. Suryani, S.P, M.Sc Ketua
A. Zaenal Mustopa, M.Si Anggota
Diketahui oleh
Dr. I Made Artika M.App.Sc. Ketua Depertemen Biokimia
PRAKATA
Puji syukur penulis ucapkan kehadirat Allah SWT. yang telah melimpahkan berkah, rahmat, dan ridho-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini sebagai tugas akhir pada program studi Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Shalawat serta salam selalu tercurahkan kepada Nabi Muhammad SAW, keluarga, dan para sahabat. Penelitian yang dilakukan berjudul “Konstruksi Gen Penyandi Plantaricin S dari Lactobacillus plantarum S34”. Penelitian ini dilakukan dari bulan Maret hingga Desember 2012 di Laboratorium Bakteriologi dan Virologi Molekular, Pusat Penelitian Bioteknologi, LIPI, Cibinong. Penelitian ini didanai dari Hibah Bersaing tahun 2012 dengan peneliti utama Dr. Suryani, M.Sc.
Penulis mengucapkan terima kasih kepada semua pihak yang telah memberikan dukungan selama proses penulisan karya ilimiah ini. Ucapan terima kasih penulis sampaikan kepada Dr. Suryani, S.P, M.Sc selaku pembimbing utama dan A. Zaenal Mustopa, M.Si selaku pembimbing kedua yang telah memberikan saran, kritik, dan bimbingannya, Nenek Siti Sanariah tercinta, Ayahanda Alimuddin Paada dan Ibunda Elfira Abubakar, serta Kakak Nona, Kakak Ayu, dan Adik Adit atas segala doa yang telah diberikan kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada Linda Sukmarini, M.Eng, Rifqiyah Umami, M.S, M. Ridwan, S.Farm, Kak Meita, Neng Tanty, Krisna, Harry, Aksar, Yuni, Putri, Mba Anggun, Mas Bobby, Mas Aris, Kang Ace atas segala bantuannya selama di Lab, Dita, Anis, Isul, Aros, Yoan, Nur, Dhani.
Penulis berharap skripsi ini dapat bermanfaat bagi berbagai pihak dan ilmu pengetahuan, khususnya ilmu Biokimia.
Bogor, Mei 2013
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
BAHAN DAN METODE 2
Bahan dan Alat 2
Metode Penelitian 2
HASIL 4
Genom L. plantarum S34 4
Amplikon Gen PlnS dari L. plantarum S34 4
Plasmid Rekombinan PlnS 4
Transforman E. coli DH5 yang Membawa Gen PlnS 5
PCR Koloni dan Pemotongan Plasmid Rekombinan 6
PEMBAHASAN 7
Isolasi Genom L. plantarum S34 7
Amplikon Gen PlnS dari L. plantarum S34 8
Plasmid Rekombinan PlnS 9
Transforman E. coliDH5α 9
E. coli DH5 yang Membawa Gen plnS 10
SIMPULAN 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR GAMBAR
1 Elektroforegram genom L. plantarum S34 5 2 Elektroforegram gen plnS dari L. plantarum S34 5 3 Elektroforegram plasmid rekombinan plnS 5 4 Hasil seleksi koloni biru-putih dari E. coliDH5α yang membawa plasmid
rekombinan plnS 6
5 Elektroforegram PCR koloni pada plasmid rekombinan plnS 6 6 Elektroforegram pemotongan plasmid rekombinan plnS 6
7 Peta vektor pGEM-T Easy 11
DAFTAR LAMPIRAN
1 BLAST Primer Forward Gen PlnS 14 2 BLAST Primer Reverse Gen PlnS 14
PENDAHULUAN
Daging sapi, susu maupun produk olahan ternak lainnya, seperti bakso daging, sosis, keju merupakan pangan yang mudah rusak. Kerusakan bahan pangan dan produk olahannya dapat terjadi saat proses pengolahan, distribusi, maupun penyimpanan. Penyimpanan dalam jangka waktu lama dapat menyebabkan terjadinya pertumbuhan mikroba yang dapat merusak bahan pangan sehingga diperlukan teknik pengawetan bahan pangan tersebut. Pengawetan bertujuan mencegah pertumbuhan mikroba perusak pada bahan pangan maupun produk olahannya, menghambat reaksi enzimatis, kimiawi, serta kerusakan fisik sehingga dapat memperpanjang waktu penyimpanannya (Marselly 2012).
Pemanfaatan BAL (bakteri asam laktat) sebagai pengawet pangan alami telah digunakan sejak Awal tahun 1900 karena mampu menghasilkan asam laktat. Selain itu, BAL juga menghasilkan peptida yang memiliki kemampuan antimikrobial yang disebut bakteriosin. Bakteriosin yang dihasilkan oleh BAL umumnya diisolasi dari bahan pangan, seperti produk susu dan daging, sehingga bakteriosin aman untuk digunakan sebagai bahan pengawet alami (Udhayashree et al. 2012; Kalmokoff et al. 1996).
Salah satu spesies BAL penghasil bakteriosin adalah Lactobacillus plantarum. Bakteriosin yang dihasilkan oleh L. plantarum dikenal dengan nama plantaricin. Salah satu plantaricin yang dihasilkan oleh L. plantarum adalah plantaricin S. Plantaricin S termasuk dalam bakteriosin kelas IIb (kecil, tahan panas, dua peptida). Plantaricin S memiliki motif GxxxG yang berperan dalam mediasi interaksi heliks-heliks antara dua peptida sebelum memasuki membran sel bakteri patogen. Motif ini menunjukkan adanya aktivitas antibakteri pada plantaricin S. Plantaricin S juga aktif melawan Listeria monocytogenes, Enterococcus faecalis, dan Staphylococcus aureus (Soliman et al. 2011).
Penapisan komponen bioaktif dari 34 isolat bakteri asam laktat yang diisolasi dari bekasam daging sapi diuji aktivitas inhibisinya terhadap pertumbuhan Escherichia coli, Staphylococcus aureus, Salmonella typhi, Listeria monocytogenes, dan enzim RNA (ribonucleic acid) helikase virus hepatitis C. Aktivitas komponen bioaktif BAL tertinggi terdapat pada isolat S34, namun jenis BAL dan komponen bioaktifnya belum diketahui (Mustopa et al. 2010; Solehudin 2010). Putri (2011) melaporkan bahwa isolat S34 tersebut memiliki kesamaan 99% dengan sekuen DNA (deoxyrinonucleic acid) bakteri L. plantarum WCFS1 yang kemudian diberi nama L. plantarum S34. Bakteri L. plantarum S34 juga dilaporkan menghasilkan bakteriosin kelas II. Bakteriosin kelas II meliputi plantaricin EF, JK, dan S. Isolasi dan karakterisasi gen pln dari L. plantarum S34 yang telah dilakukan oleh Nurhaeni (2011), yaitu gen plnEF (penyandi plantaricin EF) dan gen plnJK (plantaricin JK). Oleh karena itu, gen plnS perlu diisolasi dari genom L. plantarum S34 agar gen tersebut dapat dianalisis sehingga didapatkan informasi mengenai plnS.
2
BAHAN DAN METODE
Bahan dan Alat
Pembiakan L. plantarum adalah isolat L. plantarum S34, MRS (de Man, Rogosa, Sharpe) broth (10 g pepton, 8 g ‘lab-lemco’ powder, 4 g ekstrak ragi, 20 g glukosa, 1 ml sorbitan mono-oleat, 2 g dikalium fosfat, 5 g natrium asetat, 2 g triamonium sitrat, 0.2 g magnesium sulfat, dan 0.05 mangan sulfat per liter), dan natrium azida 20%. Bahan-bahan yang digunakan untuk isolasi genom terdiri atas biakan L. plantarum S34 (koleksi Laboratorium Bakteriologi dan Virologi Molekular, LIPI), bufer Tris-EDTA (Tris-HCl 10 mM dan etilenadiaminatetraasetat 1 mM) pH 8, lisozim 60 mg/mL, SDS (sodium dodesil sulfat) 10%, NaCl (natrium klorida) 5 M, CTAB (cetyl Trimethylammonium bromide) 10%, kloroform 10%, isopropanol, etanol 70%, ultrapure distilled water, dan RNase 1 mg/mL. Elektroforesis menggunakan agarosa 1%, 1x TBE (tris borat EDTA), DNA marker berukuran 100 pb dan 1000 pb, loading dye, dan EtBr (etidium bromida). Bahan amplifikasi gen, yaitu kit PCR KAPA2G Robust, ultrapure distilled water, primer forward gen plnS(5’ ACT AAA TAT CAC TGT GGT AAA GTA AAG-3’), dan primer reverse gen plnS (5’ GAC CGA AAC AAT CAT GGG AAG-3’). Pemurnian hasil PCR menggunakan kit komersial QIAquick Gel Extraction, sedangkan ligasi gen plnS menggunakan kit pGEM-T Easy vector system. Media selektif transforman, yaitu LB agar, ampisilin 100 mg/mL, X-gal, dan IPTG (isopropil β-D-1-tiogalaktopiranosida). Isolasi plasmid rekombinan menggunakan kit GeneJet plasmid miniprep. sedangkan bahan-bahan yang diperlukan untuk restriksi plasmid adalah bufer 10x T, serta enzim restriksi SalI dan NcoI.
3
campuran yang telah diinkubasi, kemudian disentrifugasi selama 10 menit dengan kecepatan 13000 rpm. Lapisan atas ditambahkan isopropanol sebanyak 0.6 kali volume supernatan tersebut, selanjutnya diinkubasi selama 2 jam pada suhu -20C. Sentrifugasi kembali dilakukan dengan kecepatan 13000 rpm selama 6 menit. Pelet ditambahkan etanol 70% sebanyak 1 mL, kemudian kembali disentrifugasi dengan kecepatan 13000 rpm selama 6 menit, dan pelet dikeringkan. Tahap selanjutnya adalah penambahan RNase 0.1 mg/mL pada pelet yang telah dikeringkan, kemudian diinkubasi pada suhu 37C selama 30 menit. Genom hasil isolasi disimpan pada suhu -20C. Uji kualitatif genom dilakukan melalui elektroforesis gel agarosa 1% dan uji kuantitatif dilakukan pada A260 nm
dan A280 nm.
Amplifikasi Gen PlnS pada Genom L. plantarum S34 (Saenz et al. 2009 yang dimodifikasi; QIAGEN 2008)
Amplifikasi gen plnS L. plantarum menggunakan PCR. Volume total amplifikasi sebanyak 20 µL yang mengandung 11.2 µL ultrapure distilled water, 1x bufer A KAPA2G, MgCl2 1.25 mM, dNTP Mix 2.5 mM, 2.5 µM untuk
masing-masing primer forward dan reverse, 1.5 U DNA polimerase KAPA2G Robust, dan 30.65 ng/µL DNA genom L. plantarum S34. Reaksi PCR diawali pradenaturasi pada suhu 94C selama 3 menit, denaturasi selama 30 detik, annealing pada suhu 56.5C selama 30 detik, dan ekstensi pada suhu 72C selama 30 detik. Tahap denaturasi, annealing, dan ekstensi dilakukan sebanyak 32 siklus, dan diikuti dengan tahap ekstensi akhir pada suhu 72C selama 6 menit. Produk PCR dipisahkan dengan elektroforesis gel agarosa 1%. Pemurnian hasil PCR dari gel agarosa dilakukan dengan metode ekstraksi gel menggunakan kit komersial QIAGEN QIAquick Gel Extraction. Hasil pemurnian DNA dianalisis dengan elektroforesis gel agarosa.
Ligasi Gen plnS pada vektor pGEM-T Easy (Promega 2010)
Gen plnS yang didapatkan dari hasil PCR diligasikan pada vektor pGEM-T. Bufer 2X rapid ligation T4 DNA ligase sebanyak 4 µL ditambahkan ke dalam tabung 1.5 mL, kemudian ditambahkan vektor pGEM-T Easy sebanyak 1 µL. Produk PCR dan T4 DNA ligase ditambahkan secara berturut sebanyak 4 µL dan 1 µL. Campuran tersebut diinkubasi overnight pada suhu 4C untuk mendapatkan jumlah transforman maksimal.
Transformasi Plasmid Rekombinan plnS ke Escherichia coli DH5 (Sambrook & Rusell 2001)
4
mengandung ampisilin, 50 µL IPTG 200 mM dan 20 µL X-gal 50 mg/mL dengan menggunakan metode cawan sebar. Koloni tunggal berwarna putih diambil untuk PCR koloni.
Isolasi Plasmid Rekombinan plnS dari E. coli DH5 Menggunakan GeneJETTM Plasmid Miniprep Kit (Fermentas 2011)
Proses isolasi plasmid dikerjakan pada suhu ruang. Kultur bakteri yang telah ditumbuhkan selama 16 jam disentrifugasi selama 10 menit. Tahap isolasi plasmid rekombinan dilakukan sesuai dengan protokol kit GeneJETTM plasmid miniprep.
Restriksi Plasmid Rekombinan plnSE. coli DH5 (Takara 2012)
Hasil isolasi plasmid dipotong dengan enzim restriksi SalI dan NcoI. Reaksi dilakukan dengan komposisi sebagai berikut: 13 µL ddH2O dimasukkan ke dalam
tabung. Bufer 10x T ditambahkan sebanyak 2 µL, kemudian dilanjutkan dengan penambahan SalI dan Nco I masing-masing sebanyak 1 µL. Plasmid ditambahkan sebanyak 3 µL. Tabung kemudian diinkubasi selama 1 jam pada suhu 37C. Hasil restriksi selanjutnya dipisahkan dengan elektroforesis gel agarosa 1%.
HASIL
Genom L. plantarum S34
Genom L. plantarum S34 yang telah diisolasi diuji secara kuantitatif dan uji kualitatif melalui pengukuran absorbansi pada panjang gelombang 260 dan 280 nm. Konsentrasi genom yang diisolasi sebesar 306.5 ng/µ L. Nilai rasio absorbansi pada A260/A280 sebesar 1.019. Elektroforegram genom L. plantarum S34
menunjukkan ukuran genom lebih dari 10000 pb (Gambar 1).
Amplikon Gen PlnS dari L. plantarum S34
Elektroforegram gen plnS ditunjukkan oleh Gambar 2(a). Gen plnS pada lajur 1 berukuran sekitar ±500 pb. Elektroforegram gen plnS yang telah dimurnikan ditunjukkan oleh Gambar 2(b) juga berukuran sekitar ±500 pb. Konsentrasi gen plnS hasil pemurnian ini sebesar 67.2 ng/µ L dan rasio A260/A280
sebesar 2.
Plasmid Rekombinan PlnS
5
Gambar 1 Elektroforegram genom L. plantarum S34 (1) genom L. plantarum S34; (2) marker DNA 1 kb
(a) (b)
Gambar 2 Elektroforegram gen plnS dari L. plantarum S34; (1) gen plnS; (2) marker DNA 100 pb; (3) gen plnS telah dimurnikan; (4) marker DNA 100 pb
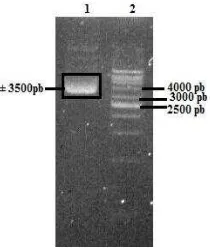
Gambar 3 Elektroforegram plasmid rekombinan plnS (1) plasmid rekombinan plnS; (2) marker DNA 1000 pb
Transforman E. coli DH5 yang Membawa Gen PlnS
6
Gambar 4 Hasil seleksi koloni biru-putih dari E. coli DH5α yang membawa plasmid rekombinan plnS
Gambar 5 Elektroforegram PCR koloni pada plasmid rekombinan plnS (1) koloni 1; (2) koloni 2; (3) koloni 3; (4) koloni 5; (6) koloni 6; (7) koloni 7; (8) marker DNA 100 pb
Gambar 6 Elektroforegram pemotongan plasmid rekombinan plnS (1) plasmid E. coli DH5 koloni 2 hasil restriksi; (2) marker DNA 100 pb
PCR Koloni dan Pemotongan Plasmid Rekombinan
Hasil PCR koloni ditunjukkan oleh Gambar 6. Koloni 1 sampai 7 menunjukkan koloni tersebut mengandung DNA dengan ukuran sekitar 500 pb. Koloni 2 dipilih untuk diisolasi plasmidnya, kemudian plasmid tersebut direstriksi. Plasmid tersebut kemudian dipotong dengan enzim restriksi untuk
Koloni biru Koloni
putih
7
memastikan terdapatnya gen plnS pada plasmid tersebut. Enzim restriksi yang digunakan adalah NcoI dan SalI. Pemotongan dengan kedua enzim restriksi ini menghasilkan dua pita dengan ukuran sekitar ±3000 pb dan ±500 pb (Gambar 6).
PEMBAHASAN
Genom L. plantarum S34
Kualitas DNA genom ditentukan melalui analisis elektroforesis gel agarosa 1%. Hasil elektroforesis gel agarosa menunjukkan pita DNA yang cukup tebal, integritas yang cukup baik, dan tidak terjadi degradasi pada pita DNA. Tebalnya pita DNA tersebut menunjukkan konsentrasi DNA yang cukup tinggi. Ukuran DNA ditentukan berdasarkan DNA marker yang digunakan. Analisis elektroforesis ini menggunakan DNA marker 1000 pb. Genom L. plantarum WCSF1 yang homolog dengan L. Plantarum S34 berukuran sebesar 3,3 Mb (Siezen & Vlieg 2011). Pita DNA genom L. plantarum S34 terdapat pada bagian atas DNA marker yang digunakan, dan oleh karena itu, ukurannya belum dapat ditentukan secara akurat karena DNA L. plantarum S34 melebihi ukuran DNA marker yang digunakan. Namun, posisi pita yang berada di atas DNA marker menunjukkan bahwa ukuran genom L. plantarum S34 cukup besar dan melebihi ukuran 10000 pb.
Konsentrasi DNA ditentukan melalui pengukuran absorbansi sampel DNA pada panjang gelombang 260 nm. Konsentrasi DNA genom L. plantarum S34 hasil isolasi sebesar 306.5 ng/µ L. Nurhaeni (2011) melakukan isolasi DNA genom L. plantarum S34 dengan metode yang sama dan menghasilkan konsentrasi DNA genom sebesar 76.4 ng/µ L. Isolasi DNA genom juga dilakukan oleh Sachinandan et al. (2010) terhadap Lactobacillus yang berasal dari susu fermentasi dengan menggunakan kit komersial dan metode ampisilin-lisozim. Isolasi DNA genom dengan menggunakan kit komersial menghasilkan rerata konsentrasi DNA sebesar 760.5 ng/µ L, sedangkan isolasi menggunakan metode ampisilin-lisozim menghasilkan rerata konsentrasi DNA sebesar 2187.654 ng/µ L. Konsentrasi DNA genom yang didapatkan pada penelitian ini sudah cukup tinggi jika dibandingkan dengan hasil isolasi yang dilakukan oleh Nurhaeni (2011), tetapi masih relatif rendah jika dibandingkan dengan hasil isolasi DNA yang dilakukan oleh Sachinandan et al. (2010). Namun, konsentrasi DNA genom hasil isolasi sudah cukup baik untuk digunakan sebagai cetakan DNA pada tahap PCR gen plnS.
Kualitas genom hasil isolasi juga dapat diketahui melalui rasio absorbansi genom pada panjang gelombang 260 nm dan 280 nm. Rasio tersebut menunjukkan kemurnian DNA terhadap protein. Panjang gelombang 260 nm merupakan panjang gelombang optimum yang dapat diserap oleh asam nukleat, sedangkan panjang gelombang 280 nm merupakan panjang gelombang optimum yang dapat diserap oleh protein. Nilai rasio 1.7-2.0 menunjukkan kemurnian DNA yang baik, sedangkan jika nilainya <1.7 menunjukkan masih terdapat kontaminan protein dalam ekstrak DNA (Kheyrodin & Ghazvinian 2011). Hasil perbandingan pengukuran absorbansi pada A260/A280 sebesar 1.019 yang mengindikasikan
8
absorbansi ekstrak DNA genom menunjukkan masih terdapat kontaminan, namun DNA genom tersebut masih dapat digunakan sebagai cetakan dalam PCR gen plnS. Cetakan DNA untuk PCR tidak harus mempunyai kemurnian yang tinggi karena primer PCR dapat menempel secara spesifik pada sekuen DNA yang akan diamplifikasi sehingga menghasilkan untai DNA yang spesifik pula sesuai dengan primer yang digunakan (Kalia et al. 1999).
Teknik isolasi DNA yang ideal sebaiknya menghasilkan DNA yang cukup optimal, mengurangi terjadinya degradasi DNA, menghindari terdapatnya kontaminan pada sampel DNA, dan efisien dalam penggunaan waktu, dan harga (Chen et al. 2010). Metode isolasi DNA dalam penelitian ini menghasilkan DNA yang cukup baik untuk digunakan sebagai cetakan DNA dalam proses PCR, baik dari segi konsentrasi maupun integritas DNA, walaupun kemurniannya masih relatif rendah. Ekstrak DNA hasil isolasi tersebut selanjutnya digunakan sebagai cetakan DNA dalam proses PCR untuk mendapatkan gen plnS.
Amplikon Gen PlnS dari L. plantarum S34
Amplifikasi gen plnS menggunakan sepasang primer plnS forward dan plnS reverse yang dirancang berdasarkan Saenz et al. (2009) yang spesifik mengamplifikasi gen plnS berukuran 466 pb. Primer tersebut menempel secara optimum pada cetakan DNA pada suhu 56.5C, kemudian akan memulai sintesis gen plnS pada suhu 72C. Konsentrasi primer baik forward maupun reverse yang digunakan sebesar 2.5 µM. Primer yang dirancang harus dapat menghasilkan produk yang diinginkan dengan konsentrasi tinggi, dan mengurangi amplifikasi sekuens yang tidak diinginkan (Sambrook & Russell 2001).
Hasil amplifikasi gen plnS dengan PCR dianalisis dengan elektroforesis gel agarosa 1%. Amplifikasi gen plnS menggunakan primer yang dirancang berdasarkan Saenz et al. (2009) yang akan menghasilkan gen plnS berukuran sebesar 466 pb. Gen plnS hasil PCR berdasarkan analisis dengan elektroforesis gel menunjukkan ukuran sekitar 500 pb. Ukuran gen plnS yang teramplifikasi tersebut tidak tepat 466 pb. Hal ini disebabkan analisis dengan eletroforesis gel belum dapat digunakan untuk penentuan ukuran gen secara akurat. Namun, ukuran gen plnS hasil PCR juga tidak berbeda jauh dengan ukuran gen plnS menurut Saenz et al. (2009). Sepasang primer yang digunakan juga merupakan primer spesifik yang hanya mengampifikasi gen plnS yang ketika dianalisis dengan BLAST menunjukkan homologi sebesar 100% dengan L. plantarum WCFS1 (Lampiran 1 dan 2) sehingga pita DNA ±500 pb tersebut merupakan gen plnS Pita DNA yang terbentuk juga cukup bagus, yaitu berupa pita tunggal utuh, intensitas pita yang cukup tebal, dan tidak terdegradasi. Gen yang akan diklon harus dalam kondisi murni sehingga hasil PCR harus dimurnikan terlebih dahulu untuk menghilangkan kontaminan yang dapat berasal dari pereaksi PCR.
Hasil pemurnian produk PCR diuji kualitatif melalui elestroforesis gel agarosa 1%. Pita DNA setelah pemurnian berukuran sekitar 500 pb yang berarti proses pemurnian berhasil dilakukan. Gen plnS yang berukuran ±500 pb selanjutnya dapat diligasikan ke vektor pGEM-T Easy. Rasio A260/A280 hasil
9
tersebut kemudian diligasikan ke vektor pGEM-T Easy agar dapat ditransformasikan ke dalam sel inang.
Sintesis DNA baru oleh DNA polimerase tidak selalu menghasilkan salinan yang sama tepat dengan cetakan DNA. Hal ini dikarenakan DNA polimerase tidak memiliki aktivitas 3’-5’ eksonuklease sehingga sering terjadi kesalahan pada proses polimerisasi DNA. Tahap akhir PCR akan menghasilkan salinan fragmen DNA yang memiliki kesalahan pemasangan nukleotida secara acak. Oleh karena itu, pengklonan gen plnS perlu dilakukan untuk mendapatkan banyak salinan molekul DNA yang identik. Tahap awal yang dilakukan adalah ligasi plnS ke vektor pGEM-T Easy.
Plasmid Rekombinan PlnS
Vektor yang digunakan dalam penelitian ini adalah pGEM-T Easy. Vektor bertindak sebagai pembawa gen agar dapat masuk ke dalam sel inang. Tahap memasukkan gen plnS ke vektor pGEM-T Easy tidak memerlukan tahap restriksi. Hal ini dikarenakan bentuk vektor pGEM-T Easy yang linear dengan tambahan satu dTMP pada ujung 3’ dapat berpasangan dengan dAMP yang terdapat pada ujung produk PCR gen plnS sehingga tahap ligasi lebih efisien. Hal ini dikarenakan DNA polimerase menambahkan dAMP pada ujung DNA produk PCR. Selain itu, residu T yang terdapat pada ujung 3’ juga dapat mencegah terjadinya pelingkaran pada vektor itu sendiri (Promega 2010; Rapley 2000) (Lampiran 2). Ligasi dilakukan dengan menggunakan enzim T4 ligase. Enzim tersebut mempercepat reaksi pembentukan ikatan fosfodiester antara ujung 5’P dan 3’OH pada DNA (Promega 2010; Pheiffer & Zimmerman 1983).
Hasil ligasi gen plnS ke vektor pGEM-T Easy menghasilkan plasmid rekombinan plnS. Ukuran pGEM-T Easy sebesar 3015 pb, sedangkan ukuran gen plnS yang teramplifikasi sekitar 500 pb sehingga ukuran total plasmid rekombinan yang sekitar 3500 pb (Promega 2010). Hasil isolasi plasmid rekombinan plnS berdasarkan analisis dengan elektroforesis gel ukurannya diantara 3000-4000 pb, yang berarti ukuran tersebut masih berkisar diantara total ukuran vektor pGEM-T Easy dan gen plnS. Plasmid rekombinan plnS tersebut selanjutnya ditransformasikan ke sel inangnya agar dapat bereplikasi. Sel inang yang digunakan adalah E. coli DH5.
Transforman E. coliDH5α
Hasil transformasi plasmid rekombinan plnS diseleksi dengan menggunakan metode koloni biru putih. Media seleksi yang digunakan dalam metode ini mengandung ampisilin, IPTG, dan X-gal. Ampisilin sebagai penanda sel yang mengandung plasmid pGEM-T Easy. Sel yang mengandung plasmid pGEM-T Easy dapat tumbuh pada media ini karena pGEM-T membawa gen resisten ampisilin, sedangkan IPTG dan X-gal pada media untuk mengetahui adanya gen plnS yang dibawa oleh pGEM-T Easy.
10
tumbuh menjadi koloni putih. Hal ini disebabkan oleh rusaknya gen LacZ. Gen tersebut terletak pada multiple cloning site plasmid pGEM-T sehingga dapat terjadi kerusakan pada gen tersebut ketika disisipkan gen plnS. Kerusakan gen tersebut mengakibatkan gen LacZ tidak dapat mengekspresikan -galaktosidase. X-gal yang terdapat pada permukaan media tidak dapat terurai karena tidak adanya enzim -galaktosidase sehingga koloni berwarna putih. Koloni biru menunjukkan koloni tersebut tidak mengandung sel yang membawa gen plnS. Hal ini disebabkan karena gen LacZ pada pGEM-T dapat mengekspresikan -galaktosidase. IPTG merupakan analog laktosa yang dapat menonaktifkan represor lacZ sehingga terjadi induksi transkripsi operon lac, dan enzim -galaktosidase dapat terekspresikan. Enzim -galaktosidase kemudian menghidrolisis X-gal yang berperan sebagai substrat enzim tersebut menghasilkan senyawa berwarna biru sehingga dihasilkan koloni berwarna biru (Brown 2010; Promega 2010).
E. coli DH5 yang Membawa Gen plnS
Gen plnS yang terkandung dalam E. coli ditentukan melalui PCR koloni dan pemotongan plasmid rekombinan dengan enzim restriksi. Tujuh koloni dari 69 koloni putih dipilih untuk dikonfirmasi adanya gen plnS pada koloni tersebut. Hasil PCR koloni 1 sampai 7 dengan menggunakan primer spesifik gen plnS menunjukkan koloni tersebut mengandung DNA dengan ukuran sekitar 500 pb. Ukuran tersebut mendekati ukuran gen plnS yang berarti hasil PCR koloni tersebut berhasil. Koloni 2 dipilih untuk diisolasi plasmidnya, kemudian plasmid tersebut direstriksi.
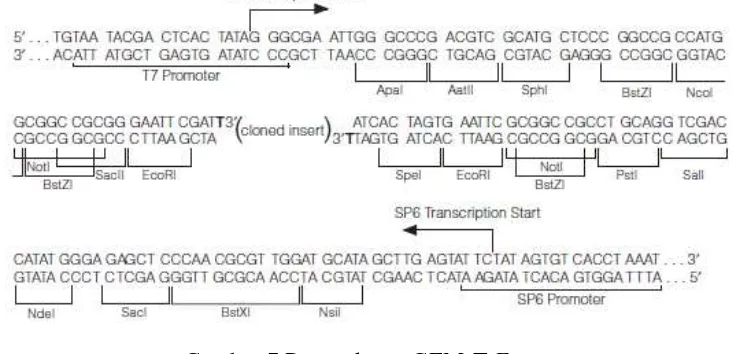
Plasmid tersebut kemudian dipotong dengan enzim restriksi untuk memastikan terdapatnya gen plnS pada plasmid tersebut. Enzim restriksi yang digunakan sesuai dengan situs restriksi yang terdapat pada MCS (multiple cloning site) vektor pGEM-T Easy. Enzim restriksi yang pilih adalah NcoI dan SalI yang masing-masing memiliki satu situs restriksi pada vektor pGEM-T Easy sehingga hasil pemotongan dengan kedua enzim tersebut hanya akan menghasilkan dua pita DNA, yaitu pita gen yang disisipkan dan pita vektor pGEM-T Easy itu sendiri. Posisi situs restriksi kedua enzim tersebut juga tidak terlalu jauh maupun terlalu dekat dengan situs penyisipan gen (Gambar 7).
11
Gambar 7 Peta vektor pGEM-T Easy
SIMPULAN
Gen plnS berhasil diisolasi dari isolat L. plantarum S34. Hasil amplifikasi gen plnS berukuran sekitar 500 pb. Konfirmasi dari PCR koloni menghasilkan pita DNA berukuran ±500 pb, sedangkan pemotongan plasmid rekombinan yang berukuran sekitar 3500 pb menghasilkan dua pita DNA yang berukuran ±3000 pb dan ±500 pb.
Penentuan ukuran nukleotida dari gen plantaricin S dari L. plantarum S34 perlu dilakukan. Hasil penentuan urutan nukleotida tersebut dapat digunakan untuk mengetahui homologi dan informasi dari gen plantaricin S tersebut.
DAFTAR PUSTAKA
Brown TA. 2010. Gene Cloning & DNA Analysis An Introduction, 6th Edition. Australia: Blackwell Publishing.
Chen H, Rangasamy M, Tan SY, Wang H, Siegfried BD. 2010. Evaluation of five methodes for total DNA extraction from Western Corn Rootworm Beetles. Plos ONE 5.
Cho GS, Huch M, Hanak A, Holzapfel WH, Franz CMAP. 2010. Genetic analysis of plantaricin EFI locus of Lactobacillus plantarum PCS20 reveals an unusual plantaricin E gene sequence a result of mutation. Int J Food Microbiol 141: 117-124.
Fermentas. 2011. GeneJET Plasmid Miniprep Kit. Thermo Fisher Scientific Inc.
Kalia A, Rattan A, Chopra P. 1998. A method for extraction of high-quality and high-quantity genomic DNA generally applicable to pathogenic bacteria. Analytical Biochemistry 275: 1-5.
12
Kheyrodin H, Ghazvinian K. 2011. DNA purification and isolation of genomic DNA from bacterial species by plasmid purification system. African Journal of Agriculture Research 7: 433-442.
Marselly TS. 2012. Produksi bakteriosin asal Lactobacillus plantarum sebagai antimikrob dan pengujian ketahanannya terhadap panas [skripsi]. Fakultas Peternakan, Institut Pertanian Bogor.
Mustopa AZ, Balia R, Putranto WS, Ridwan M, Solehudin M. 2010. Penapisan bakteri asam laktat yang diisolasi dari bekasam daging sapi dalam menghasilkan bakteriosin untuk menghambat bakteri patogen. Di dalam: Sistem Produksi Berbasis Ekosistem Lokal. Prosiding Seminar Nasional Fakultas Peternakan Unpad ke-2; Sumedang, 10 November 2010. Bandung: Fakultas Peternakan Universitas Padjajaran Bandung. Hlm 679-685.
Nurhaeni R. 2011. Isolasi dan karakterisasi gen plantaricin EF dan JK dari Lactobacillus plantarum S34 [skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Pheiffer BH, Zimmerman SB. 1983. Polymer-stimulated ligation: enhanced blunt- or cohesive-end ligation of DNA or deoxyribooligonucleotides by T4 DNA ligase in polymer solutions. Nucleic Acid Res 11: 7853-7871.
Promega. 2010. pGEM-T and pGEM-T Easy Vector Systems. Promega Corporation, Madison.
Putri SF. 2011. Isolasi dan purifikasi inhibitor RNA helikase virus hepatitis C dari bakteriosin bakteri asam laktat S34 [skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rapley R. 2000. Recombinant DNA technology. In: Walker JM, Rapley R (eds). Molecular Biology And Biotechnology. Cambridge: The Royal Society of Chemistry.
Saenz Y, Rojo-Beazares B, Navarro L, Diez L, Somalo S, Zarazaga M, Ruiz-Larrea F, Torres C. 2009. Genetic diversity of the plantaricin locus among oenological Lactobacillus plantarum strains. J Food Microbiology 134: 176-183.
Sachinandan De, Kaur G, Roy A, Dogra G, Kaushik R, Yadav P, Singh R, Datta TK, Goswami SL. 2010. A simple method for efficient isolation of genomic DNA from Lactobacilli isolated from traditional indian fermented milk (dahi). Indian J. Microbiol. 50: 412-418.
Sambrook J, Russelll DW. 2001. Molecular Cloning: a laboratory manual vol 2 third edition. Cold Spring Harbour: Cold Spring Laboratory Pr.
Siezen RJ, Vlieg JET. 2011. Genomic diversity and versatility of Lactobacillus plantarum, a natural metabolic engineer. Microbial Cell Factories 10: 1-13
13
Soliman W, Wang L, Bhattacharjee S, Kaur K. 2011. Structure-activity relationships of an antimicrobial peptide plantaricin S from two-peptide class IIb bacteriocins. J Medicinal Chemistry 54: 2399-2408.
Takara. 2012. Buffer Activity Chart: relative restriction enzyme activity in universal and basal buffers. [terhubung berkala] http://www.clontech.com/takara/US/Support/Applications/Restriction_Enzy mes/Bufer_Activity_Chart [7 November 2012]
Udhayashree N, Senbagam D, Senthilkumar B, Nithya K, Gurusamy R. 2012. Production of bacteriocin and their application in food products. Asian Pasific Journal of Tropical Biomedicine S406-S410.
14
LAMPIRAN
Lampiran 1 BLAST Primer Forward Gen PlnS
15
RIWAYAT HIDUP
Penulis dilahirkan di Palu pada tanggal 26 Januari 1990, putri dari Bapak Alimuddin Paada dan Ibu Elfira Abubakar. Penulis merupakan anak ketiga dari empat bersaudara.
Pendidikan Sekolah Dasar di SD Negeri 15 Palu tamat tahun 2002. Penulis melanjutkan ke Sekolah Menengah Pertama 1 Palu tamat tahun 2005. Tahun 2008 penulis lulus dari SMA Negeri 1 Palu dan pada tahun yang sama lulus seleksi masuk IPB jalur Undangan Seleksi Masuk IPB. Penulis memilih mayor Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.