SOMATIK
JULIS ANTON MERIGO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul Studi Regenerasi Tanaman Jeruk Keprok Batu 55 (Citrus reticulata L) Melalui Jalur Embriogenesis Somatik adalah karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk karya apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, 15 September 2011
Julis Anton Merigo
JULIS ANTON MERIGO. Study Regeneration of Tengerine Citrus Batu 55 (Citrus reticulata) Through Somatic Embryogenesis Path Way. Supervised by AGUS PURWITO and ALI HUSNI
The global world market of citrus fruit that is consumed in fresh form to the current needs to fill a category of fruit that do not have seeds, easy to peel and has an attractive color (pigmented). Tangerine citrus Batu 55 is one of the mainstay of fresh fruit horticulture. Tangerine citrus Batu 55 has superior character who naturally have had so distinguished by citrus Siam but the characters are not as good as tangerine imports. Somatic embryogenesis is an important tool for supplying new varieties to be used cultivar genetic improvement programs in citrus, this technology has been extensively used and has many important implications. The objective of this research is to produce somatic embryos of Tangerine citrus Batu 55 from nucellar embryo. The research comprised: embryogenic callus induction, callus prolifertation, maturation of somatic embryo, germination of somatic embryo, shoot multiplication, roots induction, chromosome counting, acclimatization and grafting. The results showed that the medium of Murashige & Tucker + 3 mg/l BAP + 1 mg/l 2,4-D + 500 mg /l malt extract increased the percentage of the callus formation up to 40% after 4 weeks with total number of pre-embryos (PEM ) 31.0. The medium proliferation used was MS with the addition of vitamin Morell & Wetmore (MW) +3 mg/l BAP+300 mg/l casein hydrolisat. These medium improved callus diameter up to 2.3 mm after 4 weeks cultured. Maturation of embryos was obtained by transferring globular structure in the medium MW + 2.5 mg/l ABA + 500 mg/l malt extract. These medium increased the percentage of mature somatic embryo up to 98% after 4 weeks cultured. Somatic embryos up to 84% germinated when the cotyledons grown in the medium MW + 2.5 mg/l GA3. The shoot multiplication containing MW medium + 7 mg/l biotin +500 mg/l malt extract was able to produce the highest percentage of shoot multiplication up to 86 %. The root induction containing MS medium + 3 mg/l IBA was able to produce the highest percentage of root induction up to 86%. Acclimatization of plantlets with roots increased survival rate up to 90% after 5 weeks acclimatization.
reticulata L) Melalui Jalur Embriogenesis Somatik. Dibimbing oleh AGUS PURWITO dan ALI HUSNI
Kebutuhan pasar dunia secara global terhadap buah jeruk yang dikonsumsi dalam bentuk segar untuk saat ini perlu memenuhi kategori buah yang tidak berbiji (seedless), mudah dikupas (easy peeling) dan mempunyai warna yang menarik (pigmented). Jeruk keprok batu 55 merupakan salah satu andalan buah segar hortikultura. Jeruk keprok batu 55 mempunyai karakter unggul yang secara alami telah dimilikinya sehingga membedakan dengan jeruk Siam akan tetapi karakter tersebut tidak sebaik jeruk keprok impor. Jeruk keprok impor telah mengalami perbaikan secara genetik sehingga buah tersebut memiliki karakter-karakter unggul. Hal inilah yang menjadikan jeruk keprok lokal kalah bersaing. untuk itu perlu adanya kesinambungan antara pemuliaan konvensional dan pemuliaan secara bioteknologi dalam memperbaiki sifat-sifat genetik jeruk keprok lokal agar dapat bersaing dengan jeruk keprok impor.
Secara konvensional, perbaikan sifat dilakukan dengan persilangan antar varietas, spesies, genera atau kerabat yang lebih jauh yang memiliki sifat yang diinginkan. Namun teknik pemuliaan konvensional memerlukan waktu yang cukup lama dan biaya yang besar. Perbaikan genetik jeruk melalui hibridisasi dihambat dan dibatasi oleh sifat heterozigositas yang tinggi dan inkompatibilitas. Salah satu alternatif pemecahan masalah yaitu melalui teknik kultur jaringan atau teknik in vitro. Dalam hal ini teknik regenerasi tanaman secara embriogenesis somatik sangat penting dalam keberhasilan pemuliaan non konvensional.
Penelitian ini bertujuan untuk mendapatkan metode regenerasi jeruk keprok Batu 55. Penelitian ini terdiri dari: induksi kalus embriogenik, proliferasi kalus, pendewasaan embrio somatik, perkecambahan embrio somatik, multiplikasi tunas, induksi akar, penghitungan jumlah kromosom, aklimatisasi planlet serta grafting.
terlebih dahulu. Hasil grafting dengan menggunakan tunas ES selama 4 minggu menunjukkan persentase hidup 89 %.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencamtumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan sebagian besar pengutipan tersebut tidak merugikan kepentingan.yang.wajar.IPB.
SOMATIK
JULIS ANTON MERIGO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Mayor Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Julis Anton Merigo
NIM : A253080101
Disetujui Komisi Pembimbing
Dr. Ir. Agus Purwito, M.Sc. Agr Dr. Drs. Ali Husni, M.Si Ketua Anggota
Diketahui
Koordinator Mayor Dekan Sekolah Pascasarjana Pemuliaan dan Bioteknologi Tanaman
Dr. Ir. Tri koesoemaningtyas, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas rahmat-Nya dalam penyelesaian tesis ini yang merupakan syarat untuk mendapat gelar Magister di Institut Pertanian Bogor (IPB), dengan judul “Studi Regenerasi Tanaman Jeruk Keprok Batu 55 (Citrus reticulata L) Melalui Jalur Embriogenesis Somatik”.
Penulis menyampaikan ucapan terima kasih kepada Dr. Ir. Agus Purwito, Msc. Agr dan Dr. Ali Husni, Msi atas bimbingan, saran, ilmu, waktu serta perhatiannya dalam pelaksanaan penelitian sampai penulisan tesis ini dapat selesai dengan baik. Terima kasih juga disampaikan kepada dekan sekolah Pascasarjana IPB, Dr. Ir. Trikoesomaningtyas selaku ketua Program studi Pemuliaan dan Bioteknologi Tanaman IPB, seluruh staf pengajar, dan semua teknisi yang telah memberikan bantuan selama penulis belajar di IPB. Ucapan terima kasih dan penghargaan yang mendalam penulis sampaikan kepada ayah dan ibu yang setia mendoakan, membimbing, dan mengarahkan saya menjadi anak lebih baik.
Penelitian ini dilakukan di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-Biogen) Bogor. Untuk itu, penulis menyampaikan terima kasih kepada kepala Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian atas izin yang diberikan kepada penulis untuk melaksanakan penelitian di BB-Biogen. Terimakasih juga diucapkan kepada Dr. Ir. Ika Mariska, APU sebagai ketua Kelompok Peneliti dan kepada semua peneliti serta teknisi BB-BIOGEN Bogor. Penulis juga mengucapkan terimakasih kepada bapak Ujang Hapid sebagai staf di LIPI dan bapak Joko sebagai staf di Laboraturium mikro teknik IPB yang telah banyak membantu penulis dalam pembuatan preparat dalam analisis jumlah kromosom.
Bogor, September 2011
DAFTAR ISI
DAFTAR TABEL
No Halaman
1. Respon nuselus pada media induksi... 22
2. Pengaruh penambahan ABA pada embrio somatik... 28
3. Pengaruh penambahan GA3 pada embrio somatik... 31
4. Pengaruh konsentrasi biotin... 36
5. Pengaruh jenis auksin pada perakaran... 38
6. Pengaruh penambahan ABA pada embrio somatik sekunder. 42 7. Pengaruh penambahan GA3 pada embrio somatik sekunder. 43 8. Pengaruh aklimatisasi... 44
9. Perkembanan batang atas setelah grafting... 46
DAFTAR GAMBAR
No Halaman
1. Alur kerangka pikir………...…. 4
2. Jeruk Keprok Batu 55………. 8
3. Bagian nuselus dan embrio pada jeruk……… 15
4. Pengamatan mikroskopis jaringan nuselus... 18
5. Induksi kalus embriogenik………. 23
6. Grafik laju pertambahan kalus…..………...…... 25
7. Proliferasi kalus... 27
8. Pertumbuhan dan perkembangan embrio somatik... 31
9. Perkecambahan embrio somatik... 34
10. Variasi perkecambahaan... 35
11. Multiplikasi tunas... 37
12. Variasi induksi perakaran... 39
13. Pengamatan kromosom pada akar... 40
14. Embrio somatik sekunder... 43
15. Fase pendewasaan... 44
16. Aklimatisasi tunas embrio somatik... 46
17. Pertumbuhan tunas grafting umur 1 minggu... 48
DAFTAR LAMPIRAN
No Halaman
1. Lampiran deskripsi jeruk keprok batu 55……...…... 59
2. Lampiran komposisi media kultur... 61
PENDAHULUAN
Latar Belakang
Perdagangan bebas secara global (AFTA) yang telah dimulai tahun 2003 lalu telah menjadikan Indonesia sebagai salah satu negara konsumen produk impor terbesar di Asia. Salah satu produk impor yang paling banyak dijumpai di pasaran adalah produk hortikultura khususnya buah-buahan (Deptan 2003). Salah satu produk buah-buahan impor tersebut adalah buah jeruk keprok Mandarin (Citrus reticulata.L). Jeruk keprok Mandarin sangat digemari karena penampilan yang menarik, kulitnya mudah dikupas, rasanya segar dan hampir tidak mempunyai biji (seedless). Hal inilah yang menjadikan jeruk keprok impor sangat digemari oleh masyarakat. Tingginya permintaan jeruk keprok impor ditandai dengan masih tingginya angka impor jeruk keprok dari tahun 2005-2009 sebesar
504.063 ton atau sekitar 100.813 ton/pertahun dengan nilai mencapai U$ 80.569.300 (Badan Pusat Statistik 2010). Jeruk keprok Mandarin sebagian
besar diimpor dari China dan Pakistan (Dirjen Hortikultura Departemen Pertanian 2008).
Tingginya kebutuhan buah yang dikonsumsi dalam bentuk segar menjadikan buah jeruk keprok sebagai salah satu buah yang paling disukai oleh masyarakat. Kebutuhan jeruk keprok nasional belum dapat memenuhi kebutuhan masyarakat sehingga harus dipenuhi dengan jeruk keprok impor. Salah satu faktor penting yang menyebabkan rendahnya produksi jeruk nasional yaitu belum tersedianya bibit jeruk yang dapat berproduksi secara optimal, dapat beradaptasi dengan lingkungan ekstrim, bebas dari penyakit dan mudah dalam mendapatkan bibit yang berkualitas dalam jumlah yang banyak (Deptan 2003).
teknik kultur jaringan. Regenerasi tanaman melalui embriogenesis somatik dengan keberhasilan yang tinggi dapat membantu mendapatkan varietas atau genotipe unggul melalui pemuliaan non konvensional. Keuntungan lain menggunakan teknik regenerasi ini adalah untuk memproduksi bibit dalam jumlah yang banyak, tidak dipengaruhi oleh musim, bebas penyakit, dan tidak merusak pohon induk.
Regenerasi tanaman melalui jalur ES sudah banyak dilakukan, akan tetapi belum pernah dilakukan pada jeruk keprok batu 55. Pembentukan embrio somatik dari berbagai jenis eksplan juga telah dilaporkan, namun tingkat keberhasilannya relatif rendah dan masih mengalami kesulitan dalam meregenerasikan menjadi planlet. Pembentukan ES bisa secara langsung maupun tidak langsung. Embrio somatik langsung adalah pembentukan ES secara langsung dari eksplan tanpa melalui pembentukan fase kalus, sedangkan ES tidak langsung proses pembentukannya melalui fase kalus. Pembentukan struktur bipolar pada ES merupakan pertumbuhan meristem tunas dan akar. Struktur bipolar tersebut juga dialami pada perkembangan embrio zigotik (Husni 2010), akan tetapi pada sebagian besar tanaman pembentukan embrio somatik masih tergolong sulit.
Faktor eksplan yang digunakan untuk ES sangat mempengaruhi tingkat keberhasilan terbentuknya embrio somatik. Bagian nuselus merupakan eksplan yang paling baik digunakan untuk terbentuknya embrio somatik pada tanaman jeruk (Kepiro & Roose 2007). Maheshwari dan Rangaswamy (1958) pertama kali melaporkan keberhasilan pembentukan ES melalui eksplan nuselus. Regenerasi embrio somatik jeruk yang diinduksi dari jaringan nuselus telah dilaporkan oleh Rangan et al. (1968). Husni et al. (2011) juga telah melaporkan keberhasilan meregenerasikan kalus embriogenik tanaman jeruk siam Pontianak dan siam Simadu melalui jalur ES dengan tingkat keberhasilan tinggi. Keberhasilan embrio somatik ditentukan oleh pemilihan jaringan yang tepat sebagai sumber eksplan, selain juga ditentukan oleh beberapa faktor, diantaranya genotipe (Berthuoly & Michaux 1995) dan komposisi zat pengatur tumbuh (ZPT) dalam media.
penggunaan ZPT karena ZPT mempunyai kemampuan untuk merangsang pertumbuhan eksplan dan mempengaruhi pertumbuhan dan perkembangan. Zat pengatur tumbuh berperan penting dalam menentukan arah pertumbuhan suatu kultur (Watimena 1998). Kelompok auksin adalah yang paling umum digunakan untuk menginduksi ES, selain itu ZPT sitokinin juga berpengaruh terhadap diferensiasi sel dalam proses embriogenesis somatik (Pierk 1987).
Pemberian jenis dan konsentrasi ZPT yang tepat diharapkan menghasilkan embrio yang pertumbuhannya normal dan memungkinkan untuk terbentuknya kalus atau sel-sel yang tersuspensi dalam media kultur. Kalus atau sel-sel tersebut akan terus berkembang sehingga mencapai jumlah yang cukup banyak, sehingga sebagian besar dari sel-sel tersebut menjadi sel embriogenik yang dapat berkembang dan menjadi embrio dan planlet.
Regenerasi tanaman melalui embriogenesis somatik pada jeruk keprok Batu 55 sangat penting untuk dikuasai. Regenerasi tanaman melalui embriogenesis somatik memberi peluang untuk mendapatkan tanaman jeruk keprok Batu 55 yang lebih unggul melalui teknik mutasi, fusi protoplas dan teknik rekayasa genetika.
Tujuan penelitian
Penelitian ini bertujuan untuk mendapatkan metode induksi kalus dan regenerasi ES yang berasal dari jaringan nuselus tanaman jeruk keprok Batu 55 hingga tahap aklimatisasi dan grafting.
Hipotesis Penelitian
1. Terdapat media yang tepat untuk menginduksi terjadinya kalus embriogenik jeruk keprok batu 55
2. Terdapat konsentrasi ABA terbaik untuk pendewasaan embrio somatik. 3. Terdapat konsentrasi GA3 terbaik terhadap perkecambahan embrio
somatik.
4. Terdapat konsentrasi biotin terbaik dalam multiplikasi tunas embrio somatik
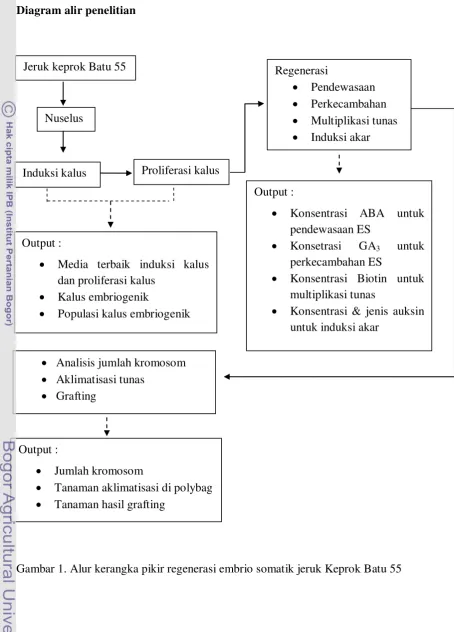
Diagram alir penelitian
$
Gambar 1. Alur kerangka pikir regenerasi embrio somatik jeruk Keprok Batu 55 Jeruk keprok Batu 55
Nuselus
Induksi kalus Proliferasi kalus
Regenerasi
Pendewasaan Perkecambahan Multiplikasi tunas Induksi akar
Output :
Media terbaik induksi kalus dan proliferasi kalus
Kalus embriogenik
Populasi kalus embriogenik
Output :
Konsentrasi ABA untuk pendewasaan ES
Konsetrasi GA3 untuk perkecambahan ES
Konsentrasi Biotin untuk multiplikasi tunas
Konsentrasi & jenis auksin untuk induksi akar
Analisis jumlah kromosom Aklimatisasi tunas
Grafting
Output :
Jumlah kromosom
TINJAUAN PUSTAKA
Botani Tanaman Jeruk Keprok Batu 55
Tanaman jeruk keprok (citrus reticulata. L) varietas Batu 55 merupakan tanaman subtropik yang dapat tumbuh dan berproduksi secara optimal pada suhu optimum 25 - 30 °C. Curah hujan optimal untuk pertumbuhan dan produksi adalah 1.900 -2.400 mm/tahun dengan rata-rata 2 - 4 bulan basah dan 3 - 5 bulan kering. Tanah yang cocok bertekstur gembur, berpasir, hingga lempung berliat dengan kedalaman efektif lebih dari 60 cm. Tingkat keasaman tanah (pH) yang optimum sekitar 5 - 7, cocok adalah ditanam di daerah dengan ketinggian 700 - 1300 m dpl. Untuk dataran rendah tanaman jeruk keprok dapat tumbuh pada ketinggian 100 – 400 m dari permukaan laut (dpl). Jeruk keprok menghendaki iklim relatif kering dengan lama masa kering sekitar 3 bulan untuk proses pembungan dan berada di tempat terbuka. Klasifikasi Citrus reticulata L. dalam sistematika tumbuhan (Van Steenis 1975) adalah sebagai berikut:
Divisi : Spermatophyta Subdivisio : Angiospermae Class : Dicotyledonae Ordo : Rutales
Familia : Rutaceae Subfamili : Aurantioidae Genus : Citrus
Spesies : Citrus reticulata L
Tumbuhan ini merupakan jenis pohon dengan tinggi 2 - 5 meter. Tajuknya tidak beraturan, dahan kecil, cabangnya banyak, dan tajuknya rindang. Daun berbentuk tunggal, kecil, helaian daun berbentuk bulat telur memanjang, elliptic
Tanaman ini berbunga majemuk dimana bunga keluar dari ketiak daun atau pada ujung. Daun berbentuk cawan bulat telur dan tajuk bunga umumnya berjumlah lima lembar. Bekal buah berbentuk seperti bola dengan diameter rata-rata 0,1 - 0,2 cm. Buah yang sudah jadi bentuknya agak besar hampir seragam menyerupai bentuk bola tertekan dengan diameter cabang, bentuk bunga bulat telur panjang ke arah pangkal seragam dan berbau harum. Tangkai bunga pendek dengan bunga pelindungnya kecil, kelopak 5 - 8 cm dengan ruang buah (septa buah) 9 - 19. Tebal kulitnya 0,2 - 0,3 cm mudah dikupas, penuh pori-pori dan daging buahnya berwarna oranye dan sedikit berbau harum. Daging buah banyak mengandung air, tiap sapta mengandung banyak biji lebih kurang 10 - 30 biji (Badan Litbang Departement Pertanian 2006).
Perkembangan Jeruk Keprok
Karakter tanpa biji, muda dikupas, penampilan yang menarik, dan rasa yang manis merupakan karakteristik utama untuk pasar buah jeruk segar pada saat ini (Ladaniya 2008). Selain untuk dikonsumsi sebagai buah segar, karakter unggul tersebut sangat diharapkan oleh industri yang bergerak dibidang pembuatan jus, suplemen vitamin, dan senyawa aromatik. Masalah yang dijumpai pada buah jeruk sering dikaitkan dengan senyawa aromatik yang tidak menguntungkan, tingkat kepahitan akibat jumlah biji yang banyak dan tampilan yang kurang menarik (Singh & Rajam 2009).
Perkembangan jeruk keprok di Indonesia mengalami ketidakstabilan bahkan cenderung mengalami penurunan, hal tersebut ditandai dengan masih tinginya angka impor jeruk keprok tersebut. Penurunan produksi jeruk keprok tersebut diakibatkan oleh beberapa faktor seperti serangan hama dan penyakit yang ditimbulkan akibat perubahan iklim. Gencarnya impor buah khususnya jenis keprok juga mengakibatkan konsumen jeruk keprok lokal beralih untuk mengkonsimsi jeruk keprok impor yang memiliki karakter-karakter unggul atau beralih ke jeruk jenis Siam.
dengan beberapa tingkat kesulitan seperti inkompatibilitas dan heterosigositas yang tinggi. Karakter unggul pada jeruk sangat dipengaruhi oleh aksesi jeruk dan faktor lingkungan (Mayer et al. 2009) Jeruk Mukaku Kishiu merupakan salah satu jenis jeruk yang benar-benar tanpa biji walau dalam kondisi lingkungan apapun, sementara pada Navel orange dan Mandarin Satsuma pada umumnya tanpa biji, namun jika dilakukan penyerbukan pada lingkungan yang berbeda akan menghasilkan biji (Olitrault et al. 2007).
Perbaikan sifat secara konvensional telah lama dikembangkan untuk perbaikan karakter akan tetapi masih terkendala oleh beberapa faktor seperti sifat inkompatibilitas pada tanaman. Selain itu, waktu yang digunakan untuk persilangan secara konvensional masih tergolong lama. Persilangan konvensianal pada intergeneric antara jeruk kultivar Kiyomi Tangor dengan jeruk Meiwa Kumquat untuk membentuk triploid dibutuhkan waktu ± 6 tahun (Yasuda et al.
2010). Sulitnya mendapatkan tanaman bebas virus juga menjadi kendala dalam perbaikan sifat tanaman. Terlepas dari teknik pemuliaan yang digunakan, beberapa varietas komersial penting jeruk keprok seperti Batu 55, Garut, SoE, dan Konde telah dikembangan melalui teknik induksi mutasi. Teknik induksi seperti iradiasi atau mutagen kimia dapat meningkatkan keragaman dalam spesies tanaman. Sifat acak yang dimiliki induksi mutasi yang menyebabkan arah mutasi tidak bisa diatur sehingga sulit dalam memperbaiki sifat genetik secara khusus (Sutarto 2009). Untuk mengatasi kelemahan-kelemahan pemuliaan jeruk keprok di atas maka perlu adanya sentuhan bioteknologi melalui teknik kultur jaringan. Perbaikan sifat melalui teknik kultur jaringan pada jeruk khususnya embrio somatik telah lama dikembangkan dan terbuki memberikan hasil yang baik (Husni 2010).
Perkembangan Jeruk Keprok Batu 55
tangeritin, terpinen-4-ol, terpineolene, tetradecanal, threonine, thymol,
thymyl-methyl-ether, tryptophan, tyrosine, nobiletin, cis-3-hexenol, cis-carveol,
citric-acid, citronellal, citronellic-citric-acid, citronellyl-acetate, cystine, decanal,
decanoic-acid, decanol. Senyawa dalam kulit jeruk keprok yang memiliki aktivitas antikanker adalah tangeritin dan nobiletin. Tangeritin merupakan senyawa
methoxyflavone yang mempunyai potensi sebagai agen antikanker (Ardiani et al. 2008).
Gambar 2 menunjukkan bahwa jeruk keprok batu 55 memiliki penampilan yang menarik dengan karakter warna kulit orange dengan daging berwarna kuning kemerahan. Selain rasa yang manis dan tanpa biji karakter panampilan yang menarik merupakan syarat untuk pasar buah segar.
Perkembangan jeruk keprok Batu 55 masih mengalami hambatan, terutama dalam memproduksi bibit yang bebas penyakit. Sulitnya mendapatkan bibit yang bebas virus dan seragam menjadi kendala dalam usaha peningkatan produksi jeruk keprok Batu 55. Menurut Deptan (2010) luas area pertanaman jeruk keprok Batu 55 di kota Batu mencapai 25 Ha. Dari 25 Ha area pertanaman hanya 5 Ha area terluas ditanami jeruk keprok Batu 55 yang terletak di dusun Dresel kecamatan Batu. Selain itu ada juga yang ditanam di area tempat tinggal penduduk. Tidak tersedianya bibit yang bebas penyakit menjadikan para petani jeruk keprok tidak optimum dalam usaha peningkatkan produksi jeruk tersebut.
Penyediaan bibit secara seperti: okulasi, cangkok, stek, dan perbanyakan melalui biji masih memiliki kelemahan sehingga perlu adanya peran teknik bioteknologi untuk mengatasi kelemahan tersebut. Teknik ES sangat membantu program peerbaikan sifat pada tanaman jeruk. Melalui teknik ES banyak kegiatan pemuliaan yang bisa dilakukan seperti mendapatkan tanaman bebas dari penyakit yang disebabkan oleh virus (D'Onghia et al. 2001), ketahanan terhadap salinitas (Carimi 2007), micro grafting (Germana et al. 2000), bahan fusi protoplas (Husni 2010), bahan transformasi gen (Bond et al. 1998) dan mutasi (Ling et al. 2000). Perbanyakan bibit secara massal dan bebas dari virus dan seragam juga dapat diusahakan melalui jalur embrio somatik (Sutanto & Azzis 2006).
Kultur Jaringan Tanaman Jeruk
Perbanyakan tanaman secara kultur jaringan dikembangkan berdasarkan teori sel yang pertama kali dikemukakan oleh Scheleiden dan Schawn, yaitu totipotensi sel. Namun kemudian pada perkembangannya teknik kultur jaringan menjadi sarana penting dalam bidang fisiologi tumbuhan dan dalam aspek biokimia tumbuh-tumbuhan serta pemuliaan tanaman (zulkarnain 2009). Totipotensi didefinisikan sebagai kemampuan setiap sel yang dari manapun sumbernya untuk berdeferensiasi dan tumbuh membentuk individu yang sempurna apabila sel tersebut ditumbuhkan pada lingkungan yang sesuai untuk pertumbuhannya dan terkendali (Doyle & Griffiths 1999).
bahan tanaman (eksplan), medium pertumbuhan, zat pengatur tumbuh yang digunakan (auksin, sitokinin, giberelin, zat inhibitor) dan asam amino (Carimi 2005).
Ladaniya (2008) menyatakan bahwa kultur jaringan pada jeruk telah lama dipergunakan sebagai metode untuk propagasi dan perbaikan sifat. Perbaikan sifat jeruk melalui kultur jaringan dapat dilakukan dengan berbagai cara seperti teknik ES, induksi mutasi, fusi protoplas, variasi somaklonal, dan seleksi in vitro
(Yuwono 2008).
Eksplan merupakan faktor utama yang menentukan keberhasilan suatu teknik kultur jaringan. Penggunaan eksplan dalam teknik kultur jaringan pada dasarnya adalah pemanfaatan sifat totipotensi sel yang terdapat pada eksplan (Wetter & Constabel 1992). Sifat tersebut mungkin terdapat pada semua jaringan tanaman akan tetapi ekspresinya terbatas pada kondisi tertentu yaitu sel yang meristematik. Ada lima faktor yang harus diperhatikan dalam regenerasi in vitro
dari eksplan, yaitu: organ yang digunakan, umur fisiologis, musim pada saat pengambilan eksplan, ukuran eksplan dan kualitas tanaman asal. Hampir semua jaringan tanaman dapat dijadikan eksplan akan tetapi memerlukan kajian khusus untuk mempelajari sistem perkembangan sel hingga menjadi jaringan. Daun, kotiledon, hipokotil, bagian dari embrio, struktur repoduktif, tunas aksilar dan tunas lateral merupakan organ yang umum untuk regenerasi secara in vitro.
Media tanam yang digunakan dalam teknik kultur jaringan berperan sangat penting. Media kultur pada prinsipnya harus dapat menyediakan unsur–unsur hara untuk pertumbuhan seperti tanaman di lapang. Umumnya media pada teknik kultur jaringan terdiri dari campuran garam-garam anorganik, karbon, vitamin, asam amino, dan zat pengatur tumbuh. Beberapa kasus tertentu penggunaan arang aktif biasa digunakan pada media tanam. Dalam kultur jaringan dikenal beberapa jenis media yang umum digunakan diantaranya media solid dan cair. Pemilihan jenis media tergantung pada jenis tanaman, faktor aerasi, bentuk pertumbuhan dan diferensiaisi yang diinginkan.
Persenyawaan lain yang dapat digunakan adalah glukosa, maltosa dan fruktosa (Altaf et al. 2009). Tomaz et al. (2001) menyatakan bahwa jenis dan konsentrasi gula sebagai sumber energi sangat mempengaruhi inisiasi kalus embriogenik jeruk keprok. Vitamin yang paling sering digunakan dalam media kultur jaringan tanaman adalah thiamin, niacin, dan pyridoxine (Gunawan 1992). Beberapa media juga mengandung pantotenat dan biotin (Gamborg & Shyluk 1981). Penambahan myoinositol pada media kultur dapat memperbaiki pertumbuhan dan morfogenesis, sehingga sering dipandang sebagai golongan vitamin untuk tanaman (George & Sherrington 1984).
Asam-asam amino merupakan sumber nitrogen organik yang lebih cepat tersedia dari pada nitrogen yang terdapat dalam bentuk nitrogen anorganik media (shiaty et al. 2004). Asam amino yang umum digunakan pada media kultur adalah sistein, L-glutamin, asparagin, L-arigin, l-tirosin, glisin serta campuran glutamin dan asparagin serta campuran asam amino kompleks seperti kasein hidrolisat, ekstak mal dan yeast ekstrak. Konsentrasi glutamin dan asparagin yang umum digunakan 100 mg/l, L-argini dan sistein 10 mg/l, L-tirosin 100 mg/l, glisin 2 mg/l dan asam amino kompleks 0.05% - 0.1% (Wattimena 1999).
perkembangan sel, terkadang jaringan atau eksplan dapat memproduksi ZPT sendiri (endogen). Menurut Gunawan (1992) pemberian ZPT dari luar adalah untuk mengubah nisbah ZPT yang ada pada tanaman. Perubahan nisbah selanjutnya dapat mengubah laju pertumbuhan dan perkembangan tanaman. Penggunaan konsentrasi ZPT yang tepat dapat menghasilkan perkembangan sel ke arah yang dikehendaki.
Berdasarkan kegunanya ZPT digolongkan kedalam lima golongan yaitu: auksin, sitokinin, asam absisik (ABA), giberelin dan etilen. Menurut Wattimena (1998) 2,4-D merupakan salah satu auksin yang mempunyai aktivitas tinggi jika dibandingkan dengan auksin alami seperti IAA. Senyawa 2,4-D digunakan secara luas dalam kultur jaringan terutama untuk merangsang pembentukan kalus yang bersifat embriogenik. Hal tersebut disebabkan karena 2,4-D merupakan auksin sintesis yang sangat aktif dan kuat, cukup resisten terhadap degradasi ensimatik dan proses konjungasi dengan senyawa lain (Moore 1979). Sedangkan kelompok sitokinin yang sering digunakan untuk membantu penginduksian kalus yaitu BAP dan kinetin. Sitokinin berperan dalam pembelahan sel pada jaringan yang digunakan sebagai eksplan. Menurut Wattimena (1992) pada beberapa tanaman sitokinin sangat dibutuhkan untuk proliferasi kalus. Husni (2010) menyatakan bahwa pemberian BAP dapat digunakan untuk proliferasi kalus embriogenik jeruk Siam.
Kelompok ZPT GA3 merupakan kelompok ZPT yang paling banyak dijumpai di dalam tanaman. Hampir pada setiap perkembangan tanaman GA3 berperan aktif termasuk pada proses perkecambahan benih, pembentukan trikoma pada daun, pemanjangan batang dan daun, induksi pembungaan, perkembangan anter dan buah serta perkembangan benih (Acar et al 2010). Penggunaan GA3 pada kultur jaringan khususnya untuk elongasi tunas. GA3 akan mendorong percepatan pertumbuhan dari setiap sel jaringan sehingga perkembangan tanaman menjadi optimal. Ricci et al. 2001 menyatakan bahwa penambahan GA3 pada media kultur dapat memperbesar peluang jeruk untuk melakukan proses elongasi tunas.
Embriogenesis Somatik
Perkembangan media kultur jaringan dalam perbanyakan sel dan jaringan vegetatif telah sampai pada level yang memungkinkan untuk melakukan industrialisasi perbenihan dan penyediaan bahan dasar industri. Selain mampu menghasilkan tanaman yang sama dengan induknya, menghasilkan tanaman yang bebas patogen sistemik, memungkinkan untuk propagasi tanaman secara masal, dan mengatasi perbanyakan tanaman yang tidak dapat diperbanyak secara konvensional (zulkarnain 2009). Teknologi ini kemudian dikenal dengan istilah teknologi embriogenesis somatik. Embriogenesis somatik merupakan teknologi yang sangat efisien dan memiliki potensi propagasi secara massa yang komersil dengan biaya yang relatif murah. Embrio somatik berpotensi dikembangkan dalam sistem regenerasi tanaman karena kapasitas proliferasi yang tinggi, memungkinkan untuk mendapatkan sel tunggal yang dapat menghindarkan dari resiko kimera pada pemuliaan mutasi dan teknologi rekombinan DNA ( Lou et al. 1999)
kalus. Proses embrio somatik dimulai dengan terbentuknya sel-sel yang embriogenik berukuran kecil dengan isi sitoplasma yang penuh, nukleus yang besar, vakuola yang kecil dan kaya akan butiran-butiran pati yang padat, kemudian sel-sel tersebut berubah menjadi pre embrio yang bekembang menjadi fase globular, jantung, dan kotiledon. Tahapan perkembangan dari embrio somatik sama dengan perkembangan sel pada embrio zigotik dimana pada embrio somatik terdapat ciri struktur bipolar yaitu mempunyai dua calon meristem yaitu meristem akar dan meristem tunas (Husni et al.2010).
Embrio somatik juga bermanfaat sebagai model untuk mempelajari fungsi gen yang terlibat dalam embriogenesis karena ada persamaan antara regenerasi tanaman secara in vitro ataupun in vivo. Secara umum perkembangan embrio somatik terjadi pada dua tahapan, tahap pertama disebut morfogenetik yaitu pembentukan stuktur dasar sel yang mengarah ke arah pembentukan bipolar dan pembentukan jaringan-jaringan primer yang meristem (Husni et al. 2010). Tahap kedua yaitu perkembangan embrio pada fase ini terjadi pematangan sel yang ditandai dengan adanya aktifitas perkembangan jaringan menjadi organ dan penyimpanan makro molekul seperti protein dan karbohidrat yang diperlukan selama proses perkecambahan dan pertumbuhan (Carimi 2005). Embrio somatik merupakan salah satu teknik in vitro yang dapat membantu konservasi tanaman dengan penyediaan bibit yang cepat. Kunitake et al. (2005) menyatakan bahwa penelitian embrio somatik pada jeruk sangat penting dalam aplikasi teknik rekayasa sel untuk meningkatkan hasil produksi.
Embriogenesis Somatik pada Jeruk
Perbaikan sifat tanaman melalui embrio somatik juga telah banyak dilakukan pada tanaman jeruk salah satu metode yang dapat dilakukan dengan hibrida somatik (Saito et al. 1994 ; Guo & Deng 1998 ; Guo & Grosser 2005; Husni 2010), studi protoplas (Kunitake et al. 2005), serta uji ketahan (Gmiter & Moore 2005; Carimi et al. 2007). Konsep regenerasi tanaman melalui embrio somatik pada tanaman jeruk tidak berbeda halnya pada tanaman dikotil lainya. Keberhasilan regenerasi dari embrio somatik juga dipengaruhi oleh beberapa faktor, yaitu: eksplan, ZPT, media tanam serta arah tujuan perkembangan yang diinginkan (Yujin & Xiuyin 2002).
Nuselus pada tanam jeruk merupakan eksplan yang mempunyai peluang
lebih besar dalam mengiduksi sel yang embriogenik (Saito et al. 1994; Ricci et al 2001; Altaf et al. 2009; Husni 2010). Adapun beberapa keuntungan menggunakan jaringan nuselus sebagai eksplan antara lain: memiliki struktur genetik identik dengan tanaman induk (true to type), tingkat keberhasilan menghasilkan kalus yang embrionik lebih tinggi jika dibandingkan dengan organ vegetatif lainnya, tidak dipengaruhi oleh mutasi secara alami sebagai mana yang dialami oleh kebanyakan embrio zigotik (Krueger & Navarro 2007).
Jaringan nuselus berkembang dari jaringan ovul yang mengelilingi atau menyelimuti kantung embrio seksual (embryo sac) dan mempunyai materi genetik yang sama dengan indukya (Kepiro & Roose 2007). Jaringan nuselus umumnya terdapat pada bji yang diperoleh dari buah yang muda.
yang aktif membelah (Obukosia & Waithaka 2000). Embrio yang dihasilkan dari jaringan nuselus mempunyai vigor yang tinggi (Iwamasa et al. 2007). Donghia
et al. (2001) dan Carimi (2007) menambahkan bahwa embrio yang dihasilkan dari jaringan nuselus sebagai bahan eksplan sering dimanfaatkan pada teknik kultur jaringan khususnya untuk perbanyakan tanaman jeruk bebas dari virus (Obukosia & Waithaka 2000).
Penggunaan eksplan nuselus pada jeruk pertama kali digunakan pada kultur jaringan untuk mengembangkan tanaman yang bebas virus (Tomaz et al. 2000). Nuselus yang digunakan sebagai sumber eksplan haruslah dari tanaman yang sehat dan tidak dalam keadaan stress atau mengalami mutasi secara spontan, dan umur buah saat diisolasi. Hal tersebut penting diperhatikan karena pembentukan kalus sangat tergantung pada status jaringan. Inisiasi kalus lebih mudah terjadi pada jaringan yang masih muda karena eksplan masih mengandung sel-sel yang aktif membelah (Carimi 2007). Nuselus merupakan eksplan yang sangat baik untuk penginduksian kalus embriogenik (Ricci et al. 2007). Christopani (1991) menyatakan bahwa nuselus sangat baik digunakan sebagai eksplan karena memiliki peluang yang lebih besar dalam menghasilkan jumlah sel yang embriogenik. Faktor lingkungan tumbuh, genotipe, umur eksplan, komposisi media tanam juga merupakan faktor yang sangat mempengaruhi dalam induksi kalus embriogenik pada eksplan nuselus (Grosser & Gmiter 1990).
METODOLOGI PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboraturium Kultur Jaringan Kelompok Peneliti Biologi dan Jaringan Sel Balai Besar Bioteknologi dan Sumber Daya Genetik Pertanian dan di Laboraturium Kultur Jaringan Tanaman, Departemen Agronomi dan Hortikultura Fakutas Pertanian IPB, berlangsung mulai dari Juni 2010 sampai Mei 2011
Bahan dan Alat
Bahan tanaman yang digunakan adalah jaringan nuselus jeruk keprok Batu 55 dari buah muda berumur 60 - 70 hari setelah antesis. Media tanam yang digunakan media Murashige & Skoog (1962), Murashige & Tucker (1969) dan MW (MS modifikasi, Husni et al. 2010) kombinasi zat pengatur tumbuh (2,4-D, BAP, Picloram, Kinetin, ABA, GA3, NAA, IAA, dan IBA). Vitamin yang digunakan meliputi vitamin MS Vitamin MT dan vitamin Morel & Wetmore. Sedangkan alat yang digunakan air flow cabinet, dan perlengkapan kultur jaringan lainnya
Metode Percobaan
Penelitian ini dilakukan dalam 7 tahap kegiatan: 1) induksi kalus
embriogenik. 2) proliferasi kalus embriogenik. 3) pendewasaan ES. 4) perkecambahan ES. 5). multiplikasi 6) induksi akar ES. 7) penghitungan
kromosom. 8) aklimatisasi ES. 9) grafting tunas ES
1. Induksi Kalus Embriogenik
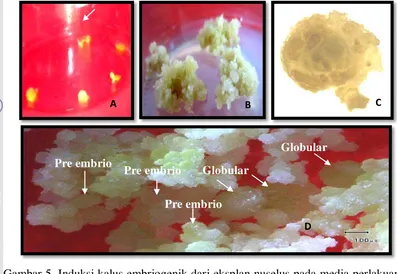
ulangan adalah satu botol sebagai unit percobaan dengan enam eksplan. Bahan yang digunakan adalah buah jeruk keprok Batu 55 muda yang berumur 60 - 70 hari setelah antesis. Buah disterilisasi dengan alkohol 96% selama 15 menit kemudian dilewatkan pada bunsen hingga api padam lalu dibilas dengan aquades steril sebanyak tiga kali. Kulit jeruk dibuka di bawah kondisi steril. Biji muda diambil dari buah dan dipindah pada petridish steril dengan bantuan stereo microscope, bagian nuselus (Gambar 4) ditanam pada berbagai kombinasi media perlakuan.
Pengamatan pada percobaan ini meliputi perkembangan eksplan. Peubah yang diamati adalah: waktu terbentuknya kalus (hari), jumlah PEM (pre embrio) dan persentase pembentukan kalus. Peresntase pembentukan kalus didapat dengan cara :
2. Proliferasi Kalus.
Prolifersai kalus embriogenik bertujunan untuk mendapatkan populasi PEM yang banyak. Bahan yang digunakan pada percobaan ini adalah kalus embriogenik yang diperoleh dari hasil induksi kalus pada percobaan satu. Data diolah berdasarkan standar deviasi setiap perlakuan pada setiap minggu. Kalus disubkultur pada media perlakuan yang terdiri dari: MK1 = MS + 500 mg/l Ekstrak malt. MK2 = MS + 300 mg/l Casein hidrolisat. MK3 = MW + 500 mg/l Ekstrak malt. MK4 = MW + 300 mg/l Casein hidrolisat. Semua media kultur ditambah 3 mg/l BAP. Peubah yang diamati adalah: penambahan diameter kalus per minggu.
Gambar 4. Pengamatan mikroskopik dengan binokular (jaringan nuselus dan embrio zigotik keprok Batu 55 ).
Nuselus
Nuselus
Zigotik
3. Pendewasaan Embrio Somatik
Pendewasaan embrio somatik bertujuan agar didapat embrio dewasa pada fase kotiledon. Rancangan lingkungan yang digunakan adalah RAL satu faktor dengan empat perlakuan taraf konsentrasi ABA yaitu: 1.5 mg/l, 2 mg/l, 2.5 mg/l dan 3 mg/l dengan media dasar MW diulang 10 kali. Satu ulangan adalah satu botol sebagai unit percobaan dengan 15 struktur globular. Bahan yang digunakan pada percobaan ini adalah struktur globular yang diperoleh dari percobaan dua. Peubah yang diamati adalah: perubahan globular menjadi fase jantung, fase terpedo, kotiledon, dan efisiensi pendewasaan. Efisiensi pendewasaan didapatkan dengan cara :
4. Perkecambahan Embrio Somatik.
Perkecambahan kotledon bertujuan agar didapat planlet dengan sturktur bipolar. Rancangan lingkungan yang digunakan adalah RAL satu faktor dengan empat perlakuan konsentrasi GA3 yaitu: 1.5 mg/l, 2 mg/l, 2.5 mg/l dan 3 mg/l dengan media dasar MW diulang 10 kali. Satu ulangan adalah satu botol sebagai unit percobaan dengan 10 struktur kotiledon. Bahan yang digunakan pada percobaan ini adalah struktur kotiledon yang diperoleh dari percobaan tiga dan ditanam pada media dasar MW. Peubah yang diamati adalah jumlah planlet yang terbentuk dan fisiensi perkecambahan. Efisiensi perkecambahan didapatkan dengan cara :
5. Multiplikasi Tunas
Multiplikasi tunas bertujuan agar didapat duplikasi tunas. Rancangan lingkungan yang digunakan adalah RAL satu faktor dengan lima perlakuan konsentrasi biotin yaitu: 0 mg/l, 1 mg/l, 3 mg/l, 5 mg/l, dan 7 mg/l dengan media dasar MW diulang 15 kali. Satu ulangan adalah satu botol sebagai unit percobaan dengan 5 tunas emrbrio somatik. Multiplikasi tunas embrio somatik menggunakan tunas ES yang didapat pada percobaan empat dan ditanam pada media dasar MW. Peubah yang diamati adalah embrio somatik yang bertunas, jumlah tunas, umur muncul tunas dan efisiensi multiplikasi tunas.
6. Induksi Perakaran
Induksi akar dilakukan dengan tujuan agar didapat akar sekunder pada tunas. Rancangan lingkungan yang digunakan adalah RAL satu faktor dengan ulangan 15 kali. Satu ulangan adalah satu botol sebagai unit percobaan dengan 1 tunas emrbrio somatik. Bahan yang digunakan pada percobaan ini adalah planlet hasil perkecambahan yang dihasilkan dari percobaan lima dan ditanam pada media MW. Percobaan dilakukan pada berbagai jenis auksin (IBA, NAA, dan IAA) konsentrasi 3 mg/l. Sebagai kontrol tunas tanpa media auksin. Peubah yang diamati adalah: umur muncul akar, jumlah akar, panjang akar dan efisiensi induksi akar.
Efisiensi induksi akar : 7. Penghitungan Kromosom
Penghitungan kromosom dilakukan dengan metode praperlakuan lengkap (Sastrosumarjo 2006). 20 Sampel akar diambil secara acak kemudian diberi perlakuan. Pengamatan dilakukan dibawah microscope. Penghitungan kromosom diulang 10 kali pada setiap sampel.
8. Embrio Somatik Sekunder
Bahan yang digunakan adalah embrio somatik sekunder yang didewasakan pada media dengan konsentrasi ABA terbaik embrio somatik primer. Peubah yang diamati adalah perubahan globular menjadi fase jantung, fase terpedo, kotiledon, dan efisiensi pendewasaan. Perkecambahan embrio somatik sekunder pada media dengan konsentrasi GA3 terbaik embrio somatik primer. Peubah yang diamati adalah jumlah planlet yang terbentuk dan efisiensi perkecambahan.
9. Aklimatisasi
Bahan yang digunakan pada percobaan ini adalah planlet ES yang mempunyai akar primer dan skunder hasil induksi perakaran. Percobaan dilakukan pada planlet 20 ES hasil induksi perakaran dan 20 ES tanpa induksi perakaran. Media aklimatisasi yang digunakan merupakan campuran sekam dan kompos. Peubah yang diamati adalah: jumlah dan persentase tunas embrio somatik yang bertahan hidup.
Jumlah tunas yang berakar
10. Grafting
Grafting dilakukan dengan tujuan agar tunas in vitro dapat menyesuaikan diri dengan batang bawah.Bahan yang digunakan pada percobaan ini adalah tunas ES sebanyak 40 tunas. Batang bawah yang digunakan jeruk JC (Japanese Citroen). Peubah yang diamati adalah jumlah daun baru, tinggi tunas setelah grafting dan persentase tunas yang hidup setelah digrafting. Efisiensi tunas yang hidup dapat dicari dengan cara : Jumlah tunas grafting hidup
HASIL DAN PEMBAHASAN
1. Induksi Kalus Embriogenik.
Jenis media dasar dan komposisi media yang digunakan dalam kultur in vitro sangat mempengaruhi kecepatan terjadinya induksi kalus dari jaringan yang digunakan. Selain itu, adanya zat pengatur tumbuh (ZPT) dalam media kultur juga merupakan faktor yang sangat menentukan dalam keberhasilan induksi kalus dari jaringan eksplan yang dikulturkan. Shirin et al. (2007) mengatakan bahwa adanya auksin 2,4-D dalam media kultur dapat mempercepat terjadinya induksi kalus. Tao (2002) menyatakan bahwa 2,4-D merupakan golongan auksin paling baik untuk mengiduksi terjadinya kalus dibandingkan golongan auksin 4-CPA, NAA, 2.4.5-T, MCPA, dicamba, dan picloram.
Berdasarkan hasil percobaan yang telah dilakukan diperoleh bahwa respon nuselus terhadap perlakuan media kultur memberikan pengaruh terhadap peubah lamanya induksi kalus. Berdasarkan uji F terhadap umur tumbuh kalus dari setiap media kultur yang di uji (M1, M2, M3, M4) secara umum memperlihatkan adanya perbedaan yang nyata antar perlakuan. Tabel 1 menunjukan bahwa komposisi media kultur M1 merupakan media yang terbaik untuk menginduksi terjadinya kalus dari eksplan nuselus, diikuti oleh media M2, M3 dan M4. Kecepatan induksi kalus pada media M1 adalah selama 22.4 hari, 25.2 hari pada media M2, 27.3 hari pada media M3, dan 29.1 hari pada media M4.
Kecepatan terjadinya induksi kalus pada media M1 diduga karena adanya kombinasi auksin (1 mg/l 2,4-D) dengan sitokonin (3 mg/l BAP) dan penambahan 500 mg/l ekstrak malt. 2,4-D merupakan senyawa golongan auksin yang sangat baik untuk mengiduksi terbentuknya kalus. Kiong et al. (2008) menyatakan 2,4-D merupakan senyawa auksin yang paling baik digunakan untuk induksi kalus embriogenik pada berbagai jenis eksplan jeruk manis dimana waktu inisiasi rata-rata selama 25.7 hari. Watter dan Constabel (1992) menyatakan bahwa BAP dapat memacu pertumbuhan kalus baru dan dapat meningkatkan persentase terbentuknya tunas. Aftal et al. 2009. Menyatakan bahwa BAP merupakan sitokinin yang sangat baik untuk memacu pertumbuhan kalus setelah terinduksi oleh auksin. Husni (2010) menyatakan bahwa dengan pemberian 3 mg/l BAP dapat mempercepat waktu inisiasi kalus dimana rata-rata waktu yang dibutuhkan selama 14 hari pada jeruk Siam Simadu dan Siam Pontianak. Hal ini didukung oleh Wattimena (1992) yang menyatakan bahwa pada beberapa tanaman sitokinin sangat dibutuhkan untuk proliferasi kalus. Sitokinin di dalam kultur jaringan tanaman berfungsi antara lain untuk proses pembelahan sel.
Pada Tabel 1 juga terlihat bahwa persentase kalus terbesar yang terbentuk
juga berasal dari media kultur M1 dengan persentase kalus tumbuh sebesar 40%.
Hal ini berbeda nyata dengan perlakuan pada media kultur M2, M3 dan M4
dimana persentase terbentuknya kalus tumbuh berturut 32.12%, 25% dan 27.02%.
Husni 2010 menyatakan bahwa media MT merupakan media terbaik bila
dibandingkan dengan media MS dan MW dimana persenatse pembentukan kalus
pada media MT sebesar 82 %. Altaf et al. 2009 menyatakan bahwa kombinasi
0.25 mg/l BAP dan 0.05 mg/l 2,4 D juga dapat menginduksi kalus embriogenik
pada jeruk Kinov Mandarin.
Kalus yang dihasilkan dari media perlakuan M1 bersifat embriogenik
dimana ciri kalus embriogenik yaitu mempunyai sturktur pre embrio (PEM)
(Husni 2010). Tingginya jumlah PEM yang dihasilkan pada media M1, selain
pengaruh ZPT yang diberikan kemungkinan dikarenakan komposisi media dasar
dan vitamin penunjang. Komposisi media dasar pada media kultur M1 adalah
Murashige & Tucker (MT) dimana komposisi vitaminnya10 kali lebih banyak dari
Gambar 5. Induksi kalus embriogenik dari eksplan nuselus pada media perlakuan M1 (A= nuselus, B = kalus, C = PEM perbesaran 40x, D = kalus embriogenik mengandung PEM dan globular)
Hasil penelitian Husni (2010) yang menggunakan media dasar tersebut mendapatkan persentase pembentukan kalus pada jeruk siam Simadu sebesar 86% dan jeruk siam Pontianak sebesar 88%. PEM yang dihasilkan merupakan calon embrio somatik (Gambar 5C). PEM akan berkembang menjadi tanaman baru setelah ditumbuhkan pada media pendewasaan dan dilanjutkan pada media perkecambahan. Media M1 merupakan media yang baik untuk menginduksi kalus embriogenik walaupun hasilnya tidak berbeda nyata dengan media lainnya. Gambar 5B menunjukkan kalus terbaik pada media M1 stelah 4 MST dengan tekstur yang remah. Rata-rata PEM yang terbentuk pada media M1 adalah 31.0, kemudian diikuti media perlakuan M2, M4 dan M3. Gambar 5D memperlihatkan struktur kalus yang embriogenik dimana pada kalus tersebut terlihat banyak PEM dan sebagian ada yang mangandung struktur globular. Selain pengaruh ZPT diduga komposisi vitamin yang terdapat pada media MT lebih kaya unsur hara yang dibutuhkan sel untuk dapat berkembang. Hal ini didukung oleh pendapat Olivera et al. (1994) yang melaporkan bahwa media dasar MT merupakan media yang baik untuk menginduksi kalus embriogenik pada jeruk Cleopatra Mandarin (Citrus reticulata Blanco). Hal serupa juga dilaporkan oleh Husni et al. (2010)
B A
C
D
C
Globular Pre embrio
Pre embrio
Globular
yang melaporkan bahwa media MW dan MT merupakan media terbaik untuk menginduksi terjadinya kalus dengan struktur PEM pada jeruk siam Simadu dan Pontianak.
2. Proliferasi Kalus Embriogenik
Komposisi media dasar sangat mempengaruhi pertumbuhan dan perkembangan kalus. Inisiasi pembentukan kalus baru berhubungan dengan penambahan diameter kalus. Diharapkan dengan terbentuknya kalus baru maka peluang memperbanyak kalus yang embriogenik semakin besar. Selain media dasar, komposisi vitamin sebagai faktor penunjang juga memberikan peranan penting dalam terjadinya pembentukan kalus baru.
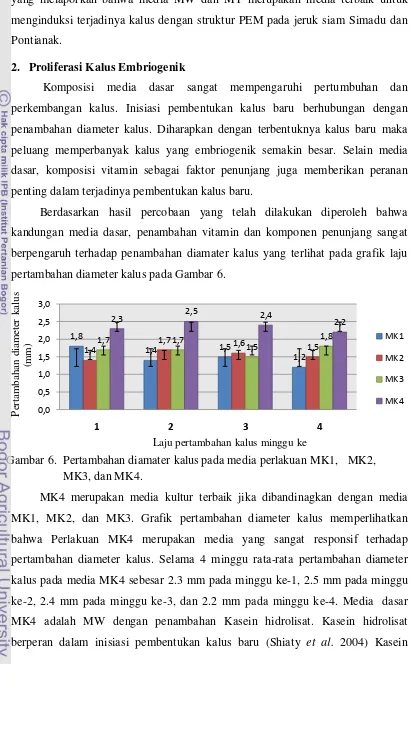
Berdasarkan hasil percobaan yang telah dilakukan diperoleh bahwa kandungan media dasar, penambahan vitamin dan komponen penunjang sangat berpengaruh terhadap penambahan diamater kalus yang terlihat pada grafik laju pertambahan diameter kalus pada Gambar 6.
hidrolisat merupakan senyawa organik kompleks dan ditambahkan dalam media
in vitro sebagai sumber asam amino (Gunawan 1992). Sukma (2004) menyatakan Penambahan kasein hidrolisat dapat membantu meningkatkan hasil biomasa dan kandungan protein total yang didapat dari kultur tanaman paria belut (Trichosanthes cucumerina).
Vitamin yang digunakan pada media kultur MK4 adalah MW dimana di
dalam komposisi vitamin ini terdapat biotin dan ca-pantothenat. Peran
ca-panthotenat pada media MW sebagai penyumbang kalsium dan asam panthotenat yang berfungsi untuk mencegah terjadinya penuaan pada jaringan. Defisiensi kalsium menyebabkan translokasi karbohidrat terganggu sehingga sel yang terdapat pada jaringan yang aktif membelah menjadi mati (Gunawan 1992). Sedangkan asam pantotenat yang terdapat pada ca-panthotenat berperan dalam proses perubahan karbohidrat menjadi energi dan dapat mempercepat proses proliferasi jaringan (Wetter & Constabel 1992). Hal ini sesuai dengan pendapat Husni (2010) yang menyatakan bahwa respon inisiasi kalus dari eksplan nuselus jeruk Siam terbaik berasal dari media kultur dengan penambahan vitamin MW. Penambahan vitamin MW pada induksi kalus embriogenik, regenerasi kalus embriogenik menjadi tunas, regenerasi protoplas menjadi kalus dan tunas pada tanaman terung-terungan sangat baik digunakan (Husni et al. 2004).
Penambahan kasein hidorlisat pada media MK4 turut memberikan pengaruh yang lebih baik dibandingkan media kultur lainnya. Pengaruh kasein hidrolisat terhadap pertumbuhan sel kalus pernah dilaporkan Rahim et al. (2000); Ricci et al. (2007); Carimi (2005) menyatakan bahwa asam amino yang terdapat pada kasein hidrolisat dapat meningkatkan bobot dan laju pertumbuhan kalus. Kasein hidrolisat merupakan senyawa organik kompleks dan dapat ditambahkan dalam media in vitro sebagai sumber asam amino (Siregar et al. 2004). Penambahan kasein hidrolisat pada media kultur dapat memperbesar fase sekunder dari eksplan yang dikulturkan (Sukma et al. 2003).
diserap tanaman dari pada sumber N anorganik. Lestari et al. (2009) menyatakan bahwa penambahan 500 mg/l kasein hidrolisat memberikan pengaruh yang baik dalam regenerasi kalus embriogenik. Kalus yang dihasilkan pada media kultur MK4 juga tetap bersifat embriogenik dengan struktur kalus yang remah dan banyak mengandung PEM (Gambar 7C )
Gambar 7. Proliferasi kalus embriogenik dari pada media MK4 (A= umur kalus 3 minggu, B = penampakan kalus secara mikroskopik C= PEM ).
Penambahan kasein hidrolisat pada media yang mengandung vitamin Morel dan Wetmore (MK4) terbukti dapat meningkatkan pertumbuhan kalus baru sehingga diameter kalus bertambah. Gambar 7B menunjukkan bahwa kalus yang dihasilkan masih bersifat embriogenik dimana terlihat banyak PEM. Heimer dan Filner (1970) melaporkan bahwa kasein hidrolisat pada media merupakan sumber nitrogen yang sangat baik untuk pertumbuhan kalus pada tembakau, kacang-kacangan (Crocomo et al. 1976) dan produksi kalus dari tanaman ercis (Cardi & Monti 1993).
Vitamin Morel dan Wetmore merupakan vitamin yang komposisinya lebih lengkap dibandingkan dengan vitamin MS, yaitu mengandung kalsium pantotenat dan biotin yang dapat memacu pertumbuhan jaringan. Elshiaty et al. (2004) dan Badawy et al. (2009) menyatakan bahwa pemberian biotin mempengaruhi perkembangan kalus embriogenik. Penambahan komponen tersebut pada media berpengaruh baik terhadap regenerasi kalus sebesar 63% pada pepaya (Damayanti 2007) dan dapat memacu proliferasi kalus nilam (Hutami el al. 2001)
3. Pendewasaan embrio somatik
Embriogenesis somatik secara langsung terbentuk dari sel-sel tunggal yang meristemoid dengan sifat embrioid serta aktif membelah sehingga tumbuh dan berkembang membentuk embrio somatik yang mempunyai dua kutub (bipolar) yang muncul sebagai tunas dan akar (Husni 2010). Salah satu faktor paling penting yang berkaitan dengan pertumbuhan dan pendewasaan dari jaringan embrio somatik adalah komposisi media kultur yang digunakan.
Tabel 2 menunjukan bahwa penambahan 2.5 mg/l ABA berbeda nyata dengan semua perlakuan pada peubah fase jantung dan fase kotiledon. Penambahan 2.5 mg/l ABA dalam media kultur merupakan konsentrasi ABA yang paling baik memacu pertumbuhan dan perkembangan embrio somatik struktur globular menjadi fase jantung, fase torpedo, dan fase kotiledon dengan efisiensi pendewasaan sebesar 98.6 %. Efisiensi pendewasaan adalah kemampuan ABA dalam mendewasakan struktur globular hingga didapat embrio dengan fase akhir yaitu kotiledon. Efisiensi pendewasaan didapatkan dengan cara menjumlahkan tahap pendewasaan ES (fase jantung, fase terpedo dan kotiledon) kemudian dibagi dengan jumlah globular awal dan dikali 100%.
Tabel 2. Pengaruh penambahan ABA terhadap rata-rata pendewasaan embrio somatik pada umur 4 minggu setelah tanam.
Media kultur perkembangan embrio somatik pada fase globular menjadi fase jantung, torpedo, kotiledon dan sitologinya terdapat pada Gambar 8. Hasil percobaan pendewasaan Keterangan : Angka yang diikuti huruf yang sama pada setiap peubah pada kolom yang sama
embrio somatik pada Tabel 2 terlihat bahwa penambahan konsentrasi 2.5 mg/l ABA pada medium MW berpengaruh nyata terhadap semua fase pendewasan embrio.Tingginya efisiensi pendewasaan embrio somatik yang terdapat pada perlakuan dengan penambahan 2.5 mg/l ABA diduga karena konsentrasi yang diberikan mampu untuk mempercepat fase pendewasaan embrio somatik. Perlakuan dengan penambahan 3 mg/l ABA efisensi pendewasannya sebesar 82.6 % lebih kecil jika dibandingkan dengan penambahan konsentrasi 2 mg/l ABA dengan efisiensi 88%. Hal ini kemungkinan disebabkan ABA yang diberikan terlalu besar sehingga menghambat proses pendewasaan embrio somatik. Hal serupa juga disampaikan oleh Kobashi et al. (2001) yang menyatakan bahwa penambahan konsentrasi 10-6 mg/l ABA berpengaruh nyata bila dibandingkan penambahan konsentrasi 10-4 mg/l ABA dengan sumber gula fruktosa.
Pendewasaan embrio somatik pada tanaman jeruk sangat tergantung dari komposisi ZPT yang diberikan kepada eksplan (Husni 2010). Pendewasaan embrio somatik dipengaruhi oleh beberapa faktor seperti lintasan kultur in vitro, konsentrasi karbohidrat, dan level dari ABA (Anjaneyulu & Giri 2008). Embrio somatik pada proses pendewasaan akan berhenti berproliferasi, ukurannya membesar, dan mulai mengakumulasi cadangan nutrisi seperti karbohidrat, protein dan lemak. Embrio dirangsang untuk menjadi dewasa dengan menggunakan asam absisik (ABA) dan meningkatkan potensial osmotik (Egerstsdotter 1999). Menurut Renukdas et al. (2006) peningkatan efisiensi pendewasaan embrio somatik dapat dilakukan dengan penambahan etilen antagonis pada konsentrasi tinggi (10 μM) seperti spermidine, ABA, dan AgNO3. Pemberian ABA harus sesuai dengan konsentrasi yang diberikan karena akan
mempengaruhi pertumbuhan eksplan (Santi & Kusumo 1996). Husni (2010)
menambahkan bahwa dengan penambahan 0.5 mg/l ABA dapat meningkatan efisiensi pendewasaan embrio somatik jeruk Siam sampai 90%. ABA merupakan salah satu inhibitor yang berperan dalam proses pematangan atau pendewasaan.
terpedo (Gambar 8C). Memasuki fase terpedo, sel akan mengarahkan pertumbuhannya ke arah bawah dan membentuk meristem akar hal ini ditandai dengan terbentuknya struktur batang. Akhir dari pematangan embrio akan terbentuk kotiledon sempurna dimana pada bagian meristem tunas dan meristem akar mulai terbentuk (Gambar 8D).
A1 A2
B1 B2
C1 C2
D1 D2
kotiledon
Bakal tunas
Bakal akar
4. Perkecambahan Embrio Somatik.
Perkecambahan embrio somatik setelah fase pendewasaan menjadi tanaman lengkap sangat dipengaruhi oleh beberapa faktor seperti pengaruh faktor lingkungan (suhu dan cahaya ) dan komposisi ZPT yang terdapat pada media perkecambahan. Zat pengatur tumbuh merupakan senyawa organik yang mampu mendorong, mengatur dan menghambat proses fisiologis tanaman. Salah satu ZPT yang berperan dalam proses perkecambahan embrio somatik adalah GA3 (Davies, 2004). GA3 berperan dalam menggiatkan fungsi kerja aktivitas α-amilase dalam metabolisme sehingga terjadi perkecambahan (Woodger et al. 2004). Hal ini juga terbukti pada perkecambahan embrio somatik jeruk siam Simadu dan Pontianak dengan menggunakan GA3 yang mengakibatkan efisiensi perkecambahan menjadi meningkat (Husni 2010).
Tabel 3. Pengaruh penambahan GA3 terhadap rata-rata perkecambahaan embrio somatik pada umur 4 minggu setelah tanam.
Media kultur digunakan Murashige & Skoog dengan penambahaan vitamin morel & wetmore
perkecambahan tanaman dengan penambahaan kosentrsi 3 mg/l GA3 sebesar 68% dengan rata-rata planlet 6.8, penambahan konsentrasi 2 mg/l GA3 sebesar 54% dengan rata-rata planlet 5.4 dan penambahan konsentrasi 1.5 mg/l GA3 sebesar 52 % dengan rata-rata planlet 5.2.
Perkecambahan embrio yang sempurna ditandai dengan pembentukan akar dan munculnya tunas (Gmietter & Moore 1986). Hasil penelitian Husni (2010) didapatkan informasi bahwa dengan penambahan GA3 dengan konsentrasi 1.5 mg/l memberikan pengaruh yang nyata terhadap fase-fase perkecambahan embrio somatik. Hal ini juga didukung oleh pendapat Kuniktake et al. (1991) yang menyatakan bahwa penambahan GA3 pada media kultur meningkatkan efisensi perkecambahan sebesar 5 % dengan waktu 30-60 hari pada jeruk.
Tingginya efisiensi perkecambahan pada perlakuan 2.5 mg/l GA3 diduga karena konsentrasi tersebut merupakan kondisi optimum yang diperlukan eksplan untuk melakukan proses perkecambahan dari embrio somatik, sedangkan pada penambahan konsentrasi 3 mg/l GA3 terlalu tinggi untuk inisiasi perkecambahan sehingga terjadi penurunan efisiensi perkecambahan. Hal serupa pernah dilaporkan oleh Acar et al. (2010) yang menyatakan terjadinya penurunan persentase perkecambahan hingga 50% pada Pistacia vera dengan penambahan konsentrasi GA3 hingga 100 mg/l. Hal tersebut juga didukung oleh hasil percobaan Ake et al. (2007) yang mendapatkan penurunan efisiensi perkecambahan 40% pada konsentrasi 46 μM GA3 bila dibandingkan dengan konsentrasi yang lebih rendah. Penambahan konsentrasi 3 mg/l GA3 tidak terlalu efisien dalam perkecambahan embrio somatik karena terjadinya pembelahan sel yang terjadi terus menerus sehingga menurunkan efisiensi perkecambahan.
GA3 merupakan senyawa yang mengandung gibban skeleton yang berperan dalam menstimulasi pembelahan sel serta mobilisasi cadangan makanan dari endosperm untuk pertumbuhan embrio. Perkecambahan dari embrio somatik yang ditunjukan pada Gambar 9 dimulai dari fase perkembangan kotiledon muda yang memasuki fase terompet (Gambar A) dan pembukaan kotiledon (Gambar 9B). Pada fase ini terlihat bahwa perkembangan kotiledon terjadi pada bagian tunas atas dimana bagian daun mulai terbentuk. Fase perkecambahaan embrio somatik dimulai ketika kotiledon mulai membuka yang ditandai dengan terbentuknya akar (Gambar 9C).
Terbentuknya akar akan mengoptimalkan penyerapan hara sehingga pertumbuhan planlet yang dikecambahkan menjadi maksimal. Akar akan tumbuh pada fese ini dan berkembang untuk menyerap hara yang terdapat di sekitar media. Terbentuknya akar pada embrio somatik menjadikan pertumbuhan embrio somatik menjadi optimal yang ditandai dengan terbentuknya organ lengkap seperti akar, daun dan batang pada tanaman (Gambar 9E). Pertumbuhan dan pekembangan planlet dioptimalkan dengan cara dipindakan ke media tanpa ZPT. Hal ini bertujuan untuk mengurangi resiko penuaan pada planlet akibat perkembangan sel yang terjadi secara cepat karena terinduksi oleh ZPT.
Pemberian konsentrasi GA3 yang berbeda pada embrio somatik ternyata memberikan pengaruh terhadap tipe-tipe perkecambahan embrio somatik (Gambar 10). Variasi pekecambahan yang ditunjukkan merupakan efek dari pemberian konsentrasi GA3 mulai dari tipe yang sulit untuk berkecambah (roset) pada gambar 10E, hingga perkecambahan tunas yang lebih dari dua tunas (Gambar 10D). Variasi tunas yang muncul lebih dari dua paling banyak Gambar 9. Fase perkecambahan embrio somatik pada media 2.5 mg/l GA3 (A = fase
terompet, B = fase pembukaan kotiledon, C = fase perkecambahan membentuk akar, D = perkecambahan membentuk akar dan tunas, E = Planlet umur 4 minggu setelah berkecambah)
ditemukan pada perlakuan 2.5 mg/l GA3 sedangkan variasi embrio somatik dengan tipe roset banyak dijumpai pada perlakuan 3 mg/l GA3. Hal yang sama juga diperoleh dari hasil perkecambahan biji jeruk yang menghasilkan tunas lebih dari satu karena sifat poli embrioni yang dimilikinya. Hal ini membuktikan bahwa embrio somatik yang berasal dari sel-sel nuselus juga memilki sifat yang sama seperti embrio yang yang tumbuh dari biji jeruk. Gambar 10 memperlihatkan perbandingan berbagai tipe perkecambahan embrio somatik dan embrio zigotik .
Gambar 10A merupakan perkecambahan dengan menggunakan biji pada media kultur tanpa pemberian GA3 jika dibandingkan dengan Gambar 10C dan 10D terlihat bahwa melalui ES yang berkembang dari jaringan non zigotik juga memiliki kemampuan yang sama dalam berkecambah dimana rata-rata tunas yang dihasilkan lebih dari satu.
5. Multiplikasi Tunas Embrio Somatik.
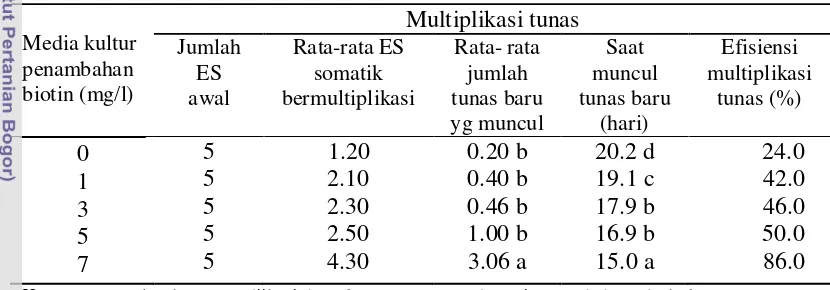
Multiplikasi tunas pada embrio somatik tanaman jeruk secara khusus bertujuan untuk memgoptimalkan jumlah tunas yang tumbuh dengan cara memanfaatkan sifat poli embrioni. Hasil multiplikasi pada teknik kultur jaringan dioptimalkan dengan cara memodifikasi media tumbuh seperti manambahkan vitamin (Park et al. 2000) thiamin, pyridoxin (Dods & Robert. 1995) dan biotin (Shiaty et al. 2004).
Vitamin yang diujikan sebagai perlakuan pada percobaan ini adalah biotin. Biotin merupakan salah satu jenis vitamin yang umum digunakan untuk embrio somatik (Shiaty et aI. 2004) serta regenerasi tanaman (Khalil & Elbanna 2003).
D C
B
A E
Embrio somatik yang dihasilkan kemudian dikulturkan pada media MW dengan penambahan beberapa konsentrasi biotin (0, 1, 3, 5, dan 7 mg/l). Hasil percobaan pada Tabel 4 menunjukan bahwa pemberian konsentrasi yang berbeda ternyata berpengaruh nyata terhadap jumlah tunas baru yang terbentuk. Semakin tinggi konsentrasi biotin yang ditambahkan maka akan semakin tinggi pula efisiensi multiplikasi tunas yang dihasilkan dan jumlah tunas yang dihasilkan juga lebih banyak. Penambahan 7 mg/l biotin merupakan konsentrasi terbaik dimana efisiensi multiplikasi tunas sebesar 86% dengan pertambahan tunas rata-rata 3.06. Hal ini berbeda nyata dengan kosentarsi 0, 1, 3, 5 mg/l biotin dimana efisiensi multiplikasi tunasnya sebesar 24 %, 42 %, 46 % dan 50%.
Tabel 4. Pengaruh konsentrasi biotin terhadap rata-rata jumlah multiplikasi tunas
Media kultur digunakan Murashige & Skoog dengan penambahaan vitamin morel & wetmore
Gambar 11 memperlihatkan bahwa pemberian 7 mg/l biotin memberikan pengaruh terhadap jumlah tunas baru. Gambar 11A, 11B, dan 11C menunjukkan secara jelas bahwa tunas-tunas baru yang muncul setelah 4 mst. Kondisi tunas pada saat tersebut masih sangat muda dimana jumlah daun rata-rata 2-3 helai sedangakan pada Gambar 11D umur tunas telah di atas 5 minggu dimana tunas-tunas baru mulai menunjukan fase dewasa. Gambar 11D memperlihatkan bahwa batang dan daun telah terbentuk sempurna pada kondisi ini tunas-tunas tersebut telah siap dipisah untuk ditanam dan atau diberi perlakuan untuk pertumbuhan perakaran.
6. Induksi Perakaran.
Sistem perakaran pada embrio somatik merupakan hal yang penting dan sangat dibutuhkan. Secara umum fungsi utama akar pada tanaman in vitro sama seperti fungsi akar pada tanam lapang yaitu menyerap unsur hara yang terkandung pada media dan sebagai penopang agar tanaman tidak reba. Sifat poli embrioni yang terdapat pada embrio somatik jeruk memungkinkan embrio somatik untuk menumbuhkan tunas-tunas baru. Akar pada kondisi tersebut yang terbentuk pada tunas primer tidak akan cukup banyak untuk menyarap hara pada media untuk itu diperlukan pengiduksian akar pada tanaman hasil multiplikasi tunas embrio somatik tersebut. Percobaan induksi perakaran dilakuan pada tunas hasil multiplikasi dengan beberapa jenis ZPT golongan auksin. Auksin merupakan golongan zat pengatur tumbuh yang dapat mengatur terjadinya pertumbuhan akar (Liu et al. 1998). Gaspar et al. (1996) menyatakan bahwa auksin sangat diperlukan dalam organogenesis termasuk dalam pembentukan akar. Auksin
A B C
Gambar 11. Multiplikasi tunas dengan penambahan 7 mg/l Biotin (tanda panah merupakan tunas baru ) A , B , C = tunas umur 4 mst, D = tunas dewasa)
dengan konsentrasi yang tepat dapat meningkatkan inisiasi dan induksi akar (IBA, NAA dan IAA) (Nandagopal & Kumari 2007).
Tabel 5. Pengaruh IBA, NAA dan IAA terhadap induksi perakaran 5 mst
Media kultur digunakan Murashige & Skoog dengan penambahaan vitamin morel & wetmore.
Dari hasil percobaan yang telah dilakukan diperoleh informasi bahwa dengan menambahkan 3 mg/l IBA dapat menginduksi terbentuknya akar pada tunas embrio somatik jeruk. Semua jenis auksin yang digunakan dapat menginduksi terbentuknya akar (Tabel 5).
Tabel 5 menunjukan bahwa pemberian auksin IBA, NAA, dan IAA pada tunas tidak berpengaruh nyata terhadap peubah saat muncul akar tetapi berbeda nyata dengan tunas tanpa auksin. Pemberian 3 mg/l IBA memberikan pengaruh yang nyata pada peubah jumlah akar dan panjang akar. Pemberian 3 mg/l IBA lebih baik dari pada 3 mg/l NAA dan 3 mg/l IAA dengan efisiensi keberhasilan pembentukan akar menggunakan ZPT IBA sebesar 86%. Kemudian diikuti NAA sebesar 73.3% dan IAA sebesar 69% . Efek IBA terhadap keberhasilan dalam menginduksi akar juga di laporkan Islam et al. (2005) dimana efesiensi perakaran tanaman Cicer arietinum naik sampai 90% dengan pemberian 0.50 mg/l IBA. Sedangkan pada tanaman Sugarcane penambahan 3 mg/l IBA memberikan efisiensi perakaran sebesar 88 %.