KATA PENGANTAR
Segala puji dan syukur kita ucapkan kehadirat Allah SWT, karena berkat rahmat, dan hidayah serta karunianya penulis dapat menyelesaikan penulisan makalah ini untuk memenuhi salah satu tugas pada mata pelajaran elektronika.
Penulis telah melakukan penulisan makalah ini dengan semaksimal mungkin tetapi penulis adalah manusia biasa yang tidak luput dari kesalahan, sehingga materi tersebut masih mengandung kekurangan dan kelemahan. Oleh sebab itu penulis mengharapkan saran dan kritik dan konstruktif dari semua pihak guna penyempurnaan makalah ini dan penulisan selanjutnya.
Terlaksananya penulisan makalah ini tidak lepas dari bantuan dan bimbingan dari berbagai pihak, oleh karena itu penulis mengucapkan terima kasih kepada pihak-pihak yang telah membantu.
Penulis hanya dapat mendo’akan kepada Allah SWT agar semua pihak yang telah membantu penulis dalam menyelesaikan makalah ini semoga diberikan rahmad dan karunia oleh Allah SWT. Dan semoga makalah ini dapat bermanfaat dan berguna bagi para pembaca khususnya rekan-rekan mahasiswa/i.
Binjai, November 2016 Penulis
BAB I PENDAHULUAN 1. Latar Belakang
Elektronika adalah ilmu yang mempelajari alat listrik arus lemah yang dioperasikan dengan cara mengontrol aliran elektron atau partikel bermuatan listrik dalam suatu alat seperti komputer, peralatan elektronik, termokopel, semikonduktor, dan lain sebagainya. Ilmu yang mempelajari alat-alat seperti ini merupakan cabang dari ilmu fisika, sementara bentuk desain dan pembuatan sirkuit elektroniknya adalah bagian dari teknik elektro, teknik komputer, dan ilmu/ teknik elektronika dan instrumentasi.
Komponen Elektronika merupakan komponen atau bahan utama dalam pembuatan suatu alat elektronika dimana mereka memiliki fungsi serta cara kerja masing-masing. Untuk dapat menggunakannya kita harus memahami terlebih dahulu fungsi dari komponen itu masing-masing.
2. Rumusan Masalah
Berdasarkan latar belakang diatas, terkait dengan pembahasan Komponen Elektronika, maka penulis dapat merumuskan permasalahan pokok yaitu :
a. Pengertian dari komponen-komponen yang ada pada elektronika tersebut b. Macam-macam komponen elektronika tersebut
BAB II
PEMBAHASAN
A. ELEMEN LISTRIK DASAR
Elemen adalah suatu sumber arus listrik yang dihasilkan dari reaksi kimia. Pada dasarnya elemen dapat dibedakan menjadi dua, yaitu :
1. Elemen Primer
Elemen Primer adalah elemen yang tidak dapat digunakan lagi jika energinya sudah habis terpakai. Pada umumnya elemen primer terdiri dari satu sel.
Pada elemen primer, reaksi kimia yang menyebabkan electron mengalir dari elektroda negatif (katoda) ke elektroda positif (anoda) tidak dapat dibalik arahnya. Dengan demikian elemen ini tidak dapat dimuati kembali jika muatannya habis. Elemen primer ialah elemen elektro kimia yang memerlukan pergantian bahan-bahan pereaksi setelah memberikan sejumlah energi listrik kepada rangkaian luar.
a. Elemen Volta (Elemen Galvani)
bergerak. Volta menyimpulkan peristiwa ini sebagai gejala listrik yang timbul karena kedua logam yang dihubungkan oleh larutan yang ada dalam kaki katak.
Bila sebatang logam dimasukkan ke dalam larutan elektrolit, batang logam menjadi negatif sedangkan larutan menjadi bermuatan positif atau potensial larutan menjadi lebih tinggi daripada potensial logam. Perbedaan potensial logam dari larutan dinamakan potensial kontak. Ternyata, setiap logam mempunyai potensial kontak yang berbeda.
Sebuah elemen sederhana dapat dibuat berdasarkan prinsip diatas, yanitu dengan mencelupkan batang tembaga (Cu) dan batang seng (Zn) kedalam larutan asam sulfat (H2SO4) encer. Batang tembaga menjadi kutub positif atau anoda dan batang seng menjadi katoda. Beda potensial antara anoda dan katoda adalah 1 volt.
Dalam larutan, molekul-molekul asam sulfat akan terurai menjadi ion-ion hydrogen yang bermuatan positif dan ion-ion sulfat yang bermuatan negative. Elemen Volta mempunyai kelemahan, yaitu hanya dapat bekerja dalam waktu yang pendek sehingga tidak cocok untuk kehidupan sehari-hari
Bagian utama elemen Volta, yaitu kutub positif (anode) terbuat dari tembaga (Cu),kutub negatif (katode) terbuat dari seng(Zn),larutan elektrolit terbuat dari asam sulfat (H2SO4). Lempeng tembaga memiliki potensial tinggi, sedangkan lempeng seng memiliki potensial rendah. Jika kedua lempeng logam itu dihubungkan melalui lampu, lampu akan menyala. Hal ini membuktikan adanya arus listrik yang mengalir pada lampu. Ketika lampu menyala, larutan elektrolit akan bereaksi dengan logam tembaga maupun seng sehingga menghasilkan sejumlah elektron yang mengalir dari seng menuju tembaga.
Adapun, reaksi kimia pada elemen Volta adalah sebagai berikut. Pada larutan elektrolit terjadi reaksi H2SO4 2H+ + SO2–4→ Pada kutub positif terjadi reaksi Cu + 2H+ polarisasi H2→ Pada kutub negatif terjadi reaksi Zn + SO4 ZnSO4+ 2e→
sehingga gas hidrogen hanya menempel dan menutupi lempengtembaga yang bersifat isolator listrik. Hal ini menyebabkan terhalangnya aliranelektron dari seng menuju tembaga maupun arus listrik dari tembaga menujuseng. Peristiwa tertutupnya lempeng tembaga oleh gelembung-gelembung gashidrogen disebut polarisasi. Adanya polarisasi gas hidrogen pada lempengtembaga menyebabkan elemen Volta mampu mengalirkan arus listrik hanyasebentar. Tegangan yang dihasilkan setiap elemen Volta sekitar 1,1 volt.Penggunaan larutan elektrolit yang berupa cairan merupakan kelemahanelemen Volta karena dapat membasahi peralatan lainnya. b. Elemen Lechlance (Basah) dan Elemen Kering (Baterai)
Elemen basah ini ditemukan oleh Leclanche tahun 1886. Elemen ini terdiri dari bejana kaca berisi karbon ( C ) sebagai elektroda positif, batang seng sebagai elektroda negatif, larutan ammonium klorida ( NH4CI) sebagai elektrolit, dan depolarisator mangan dioksida ( MnO2 ) bercampur dengan sebuk karbon ( C ) dalam bejana berpori.
Ketika ion-ion seng masuk kedalam larutan ammonium klorida , batang seng akan mejadi negative terhadap larutan logam. Ammonium klorida memberikan ion NH4+ menembus bejana berpori menuju batang karbon dan memberikan muatan positifnya pada batang karbon dan terurai menjadi amoniak ( Nh3 ) dan gas hidrogen ( H2 ).
Elemen Leclanche dapat menghasilkan tegangan listrik sekitar 1,5V. Elemen ini tidak mengandung asam yang berbahaya dan pelopor dari sumber arus listrik portable yang sering dikenal dengan baterai.
Pada perkembangannya, elemen Leclanche berubah menjadi elemen kering (baterai) yang lebih mudah dipakai. Sebenarnya elemen kering diperoleh hanya dengan mengganti elektrolit larutan ammonium klorida menjadi campuran pasta ammonium klorida dengan serbuk kayu, tepung atau getah.
Depolarisator : Mangan dioksida dan serbuk karbon ( MnO2 + C ). Cara kerja :
Ketika kedua elektroda dihubungkan dengan suatu penghantar maka akan terjadi reaksi kimia yang menghasilkan aliran arus listrik. Pada saat yang sama akan terjadi gelembung gas Hidrogen yang kemudian diserap olehcampuran MnO2 + C sehingga tidak menempel pada anoda.Baterai mengubah energi kimia menjadi energi listrik. Beda potensial yang dihasilkan + 1,5 volt. Sel karbon seng termasuk elemen primer karena jika muatanya habis maka tidak dapat diisi ulang. Namun ada juga sel kering yang bisa diisi ulang. Contohnya sel Nicad.
c. Elemen Daniell
Elemen ini dibuat oleh John Daniell pada tahun 1835. untuk mencegah terjadinya polarisasi, elektroda dilindungi oleh suatu bahan kimia yang disebut depolarisator. Pada elemen Daniell yang digunakan adalah tembaga sulfat (CuSO4) yang dipisahkan dengan elektrolit asam sulfat encer oleh bejana berpori. Jadi, ion-ion masih dapat pergi dari elektroda ke elektroda lain melalui depolarisator.
Elemen ini menggunakan air raksa sebagai anoda dan amalgama cadmium sebagai katoda. Sebagai depolarisator digunakan campuran merkurosulfat dan kadmium sulfat berbentuk pasta. Sebagai elektrolit digunakan larutan jenuh cadmium sulfat. Hablur-hablur kadmium sulfat ditambahkan untuk menjaga supaya larutan tetap jenuh.
2. Elemen Sekunder
Tidak seperti elemen primer, elemen sekunder bersifat dapat diperbaharui. Artinya tegangan yang berasal dari elemen sekunder suatu saat akan habis, tetapi kamu masih dapat mengisi elemen tersebut.
Elemen sekunder adalah elemen yang masih dapat digunakan kembali ketika energinya telah habis terpakai dengan cara mencasnya. Pada umumnya elemen sekunder terdiri dari beberapa sel. Contoh elemen sekunder adalah akumulator. Akumulator banyak digunakan dalam kendaraan bermotor seperti sepeda motor dan mobil.
a. Aki ( akumulator )
Sama seperti pada baterai, akumulator juga mempunyai dua buah kutub, yaitu kutub positif dan kutub negatif. Kutub negatif terletak pada timbal dan kutub positif pada timbal dioksida. Timbal dan timbal dioksida dicelupkan ke dalam larutan elektrolit asam sulfat. Keuntungan pemakaian elemen sekunder misalnya akumulator yaitu dapat diperbaharui. Agar akumulator dapat berfungsi kembali, perlu dimuati oleh sumber arus searah (DC).
Susunan Accumulator sebagai berikut : Anoda : timbal dioksida (PbO2)
Katoda : timbal (Pb)
Elektrolit : asam sulfat (H2SO4)
Beda potensial yang dihasilkan satu sel accumulator + 2 volt.Sebuah aki 12 volt memiliki 6 sel yang disusun seri.
Cara Kerja :
Ketika accumulator digunakan terjadi :
- perubahan energi kimia menjadi energi listrik
- Reaksi kimia : PbO2 + Pb + 2 H2SO4 2PbSO4 + 2H2O
berkurang. Pada nilai massa jenis tertentu, aki tidak dapat menghasilkan muatan listrik (accumulator mati/ soak). Agar dapat digunakan kembali accu harus di muati ulang.
Ketika accumulator diisi (dicharge) terjadi : - perubahan energi listrik menjadi energi kimia9
- reaksi kimia : 2PbSO4 + 2H2O PbO2 + Pb + 2H2SO4
Pengisian aki dilakukan dengan mengalirkan arus searah yang memiliki beda potensial lebih besar dari beda potensial aki dengan cara menghubungkan kutub positif sumber arus pengisi dengan kutub positif aki (PbO2) dan kutub negatif sumber arus pengisi dengan kutub negatif aki ( Pb).
Kapasitas penyimpanan aki diukur dalam satuan ampere hour(AH). Contoh: sebuah aki memiliki 12 V 40 AH berarti ggl aki 12 volt dan dapat mengalirkan arus 1 ampere selama 40 jam atau 0,5 ampere selama 80 jam sebelum aki dimuati ulang. b. Baterai Nikel Kadmium ( Ni – Cd )
Biasa dikenal sebagai baterai Nikel-Kadmium (Ni-Cd) adalah selkering yang dapat diisi ulang. Baterai ini sangat populer karena mempunyaikemampuan memberikan arus yang kuat dan setiap waktu dapat diisiulang.Baterai Nikel-Kadmium terdiri atas nikel hidrosida ( Ni (OH2) ) sebagaielektroda positif dan Kadmium hidrosida ( Cd (OH2) )sebagai elektrodanegatif.Larutan yang digunakan adalah potassium hidrosida ( KOH ).Bateraijenis ini memiliki tegangan sel sebesar 1,2 Volt dengan kerapatan energi duakali lipat dari baterai asam timbal. Baterai nikel kadmium memiliki nilaihambatan intenal yang kecil dan memungkinkan untuk di charge dandischarge dengan rate yang tinggi.
dikeluarkan/digunakan. Selainitu, baterai nikel kadmium juga sangat sensitif terhadap kelebihan pengisian,sehingga perlu perhatian khusus pada saat pengisian muatan listrik padabaterai.
Ada beberapa kelebihan elemen sekunder jika dibanding dengan elemen primer,antara lain :
Ø Elemen sekunder lebih tahan lama Ø Arus listrik yang dihasilkan lebih besar Ø Dapat diisi ulang ( di cas )
B. RAPAT ARUS
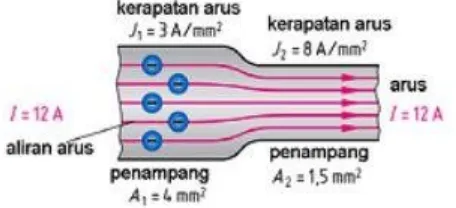
“rapat arus ialah besarnya arus listrik tiap-tiap mm² luas penampang kawat”.
Gambar kerapatan arus listrik
Arus listrik mengalir dalam kawat penghantar secara merata menurut luas penampangnya. Arus listrik 12 A mengalir dalam kawat berpenampang 4mm², maka kerapatan arusnya 3A/mm² (12A/4 mm²), ketika penampang penghantar mengecil 1,5mm², maka kerapatan arusnya menjadi 8A/mm² (12A/1,5 mm²).
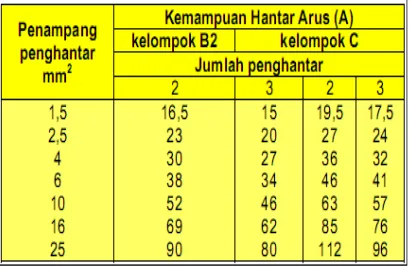
Tabel Kemampuan Hantar Arus (KHA)
Berdasarkan tabel KHA kabel pada tabel diatas, kabel berpenampang 4 mm², 2 inti kabel memiliki KHA 30A, memiliki kerapatan arus 8,5A/mm². Kerapatan arus berbanding terbalik dengan penampang penghantar, semakin besar penampang penghantar kerapatan arusnya mengecil.
Rumus-rumus dibawah ini untuk menghitung besarnya rapat arus, kuat arus dan penampang kawat:
J = I/A Dimana :
I = J x A J = Rapat arus [a/mm2]
A = I/J I = Kuat arus [Amp]
C. SILIKON DAN GERMANIUM
Silikon dan Germanium adalah bahan semikonduktor yang paling banyak
digunakan dalam pembuatan komponen elektronika. Silikon lebih banyak digunakan daripada Gemanium karena sifatnya yang lebih stabil pada suhu tinggi. Silikon adalah material dengan struktur pita energi tidak langsung (indirect bandgap), di mana nilai minimum dari pita konduksi dan nilai maksimum dari pita valensi tidak bertemu pada satu harga momentum yang sama. Ini berarti agar terjadi eksitasi dan rekombinasi dari pembawa muatan diperlukan perubahan yang besar pada nilai momentumnya atau dapat dikatakan dibutuhkan bantuan sebuah partikel dengan momentum yang cukup (seperti phonon) untuk mengkonservasi momentum pada semua proses transisi. Dengan kata lain, silikon sulit memancarkan cahaya. Sifat ini menyebabkan silikon tidak layak digunakan sebagai piranti fotonik/optoelektronik.
1. Silikon (Latin: silex, silicis, flint, silicium)
Davy pada tahun 1800 menganggap silika sebagai senyawa ketimbang suatu unsur. Sebelas tahun kemudian pada tahun 1811, Gay Lussac dan Thenard mungkin mempersiapkan amorphous sillikon tidak murni dengan cara memanaskan kalium dengan silikon tetrafluorida.
Pada tahun 1824 Berzelius, yang dianggap sebagai penemu pertama silikon, mempersiapkan amorphous silikon dengan metode yang sama dan kemudian memurnikannya dengan membuang fluosilika dengan membersihkannya berulang kali. Deville pada tahun 1854 pertama kali mempersiapkan silikon kristal, bentuk alotropik kedua unsur ini.
Silikon sering digunakan untuk membuat serat optik dan dalam operasi plastik digunakan untuk mengisi bagian tubuh pasien dalam bentuk silikone. Silikon dalam bentuk mineral dikenal pula sebagai zat kersik.
langsung batuan, pasir silika, dan tanah liat dalam pembangunan gedung. Silika juga terdapat pada keramik.
Banyak senyawa silikon modern seperti silikon karbida yang dipakai dalam pembuatan keramik berdaya tahan tinggi. Silikon juga dipakai sebagai monomer dalam pembuatan polimer sintetik silikone.
Unsur silikon juga berperan besar terhadap ekonomi modern. Meski banyak silikon digunakan pada proses penyulingan baja, pengecoran aluminium, dan beberapa proses industri kimia lainnya, sebagian silikon juga digunakan sebagai bahan semikonduktor pada elektronik-elektronik. Karena penggunaannya yang besar pada sirkuit terintegrasi, dasar dari komputer, maka kelangsungan teknologi modern bergantung pada silikon.
Silikon juga merupakan elemen esensial pada biologi, meskipun hanya dibutuhkan hewan dalam jumlah amat kecil. Beberapa jenis makhluk hidup yang membutuhkannya antara lain jenis porifera dan mikroorganisme jenis diatom. Silikon digunakan untuk membuat struktur tubuh mereka.
a. Pengertian Silikon
Silikon adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Si dan nomor atom 14. Senyawa yang dibentuk bersifat paramagnetik. Unsur kimia ini ditemukan oleh Jöns Jakob Berzelius. Silikon merupakan unsur metaloid tetravalensi, bersifat lebih tidak reaktif daripada karbon (unsur nonlogam yang tepat berada di atasnya pada tabel periodik, tetapi lebih reaktif daripada germanium, metaloid yang berada persis di bawahnya pada tabel periodik. Kontroversi mengenai sifat-sifat silikon bermula sejak penemuannya: silikon pertama kali dibuat dalam bentuk murninya pada tahun 1824 dengan nama silisium (dari kata bahasa Latin: silicis), dengan akhiran -ium yang berarti logam. Meski begitu, pada tahun 1831, namanya diganti menjadi silikon karena sifat-sifat fisiknya lebih mirip dengan karbon dan boron.
pasir dengan karbon berkualitas tinggi dengan menggunakan tungku listrik. Silikon dengan kemurnian tinggi dihasilkan dengan reduksi SiHCl3 dengan menggunakan hidrogen. SiHCl3 dihasilkan dengan melakukan hidrokhlorasi silikon berkemurnian rendah diikuti dengan pemurnian.
Silikon merupakan polimer nonorganik yang bervariasi, dari cairan, gel, karet, hingga sejenis plastik keras. Beberapa karakteristik khusus silikon: tak berbau, tak berwarna, kedap air, serta tak rusak akibat bahan kimia dan proses oksidasi, tahan dalam suhu tinggi, serta tidak dapat menghantarkan listrik.
Silikon yang digunakan untuk semikonduktor dimurnikan lebih lanjut dengan metoda pelelehan berzona kristal Czochralski. Kristal silikon (mp 1410o C) memiliki kilap logam dan mengkristal dengan struktur intan.
Silikon murni berwujud padat seperti logam dengan titik lebur 14100C. silikon dikulit bumi terdapat dalam berbagai bentuk silikat, yaitu senyawa silikon dengan oksigen. Unsur ini dapat dibuat dari silikon dioksida (SiO2) yang terdapat dalam pasir, melalui reaksi:
SiO2(s) + 2C(s) → Si(s) + 2CO(g)
Silikon murni berstruktur seperti Intan ( tetrahedral) sehingga sangat keras dan tidak menghantarkan listrik, jika dicampur dengan sedikit unsur lain, seperti alumunium (Al) atau boron (B). silikon bersifat semikonduktor (sedikit menghantarkan listrik), yang diperlukan dalam berbagai peralatan, elektronik, seperti kalkulator dan Komputer. Itulah sebabnya silikon merupakan zat yang sangat penting dalam dunia modern. Untuk itu dibutuhkan silikon yang kemurniannya sangat tinggi dan dapat dihasilkan dengan reaksi:
SiCl4(g) + 2H2(g) → Si(s) + 4HCl(g)
Si(s) + 4OH–(aq) → SiO4(aq) + 2H2(g)
Pada suhu tinggi, silikon dapat bereaksi dengan hidrogen membentuk hidrida, dan dengan halogen membentuk halide, seperti:
Si(s) + 2H2 → SiH4 Si(s) + 2Cl2 → SiCl4
Batuan dan mineral yang mengandung silikon, umumnya merupakan zat padat yang mempunyai titik tinggi, keras, yang setiap keping darinya merupakan suatu kisi yang kontinu terdiri dari atom-atom yang terikat erat. Sebuah contoh dari zat padat demikian, adalah silikon dioksida, yang terdapat dialam dalam bentuk kuarsa, aqata (akik), pasir, dan seterusnya.
Ada tiga isotop silikon, 28Si (92.23%), 29Si (4.67%), dan 30Si (3.10%). Sebab spin intinya I = 1/2, 29Si digunakan dalam studi NMR senyawa silikon organik atau silikat (NMR padatan). Silikat dan senyawa organosilikon menunjukkan variasi struktur. Kimia organosilikon merupakan area riset dalam kima anorganik yang sangat aktif. Kimia silikon berkembang dengan pesat sejak perkembangan proses industri untuk menghasilkan senyawa organosilikon dengan reaksi langsung metil khlorida CH3Cl dengan kehadiran katalis tembaga. Proses historis ini ditemukan oleh E. G. Rochow tahun 1945. Resin silikon, karet silikon, dan minyak silikon digunakan di banyak aplikasi. Akhir-akhir ini, senyawa silikon telah digunakan dengan meluas dalam sintesis organik selektif.
14 aluminium ← silikon → fosfor
Silikon terdapat di matahari dan bintang-bintang dan merupakan komponen utama satu kelas bahan meteor yang dikenal sebagai aerolites. Ia juga merupakan komponen tektites, gelas alami yang tidak diketahui asalnya.
Silikon membentuk 25.7% kerak bumi dalam jumlah berat, dan merupakan unsur terbanyak kedua, setelah oksigen. Silikon tidak ditemukan bebas di alam, tetapi muncul sebagian besar sebagai oksida dan sebagai silikat. Pasir, quartz, batu kristal, amethyst, agate, flint, jasper dan opal adalah beberapa macam bentuk silikon oksida. Granit, hornblende, asbestos, feldspar, tanah liat, mica, dsb merupakan contoh beberapa mineral silikat.
Silikon dipersiapkan secara komersil dengan memanaskan silika dan karbon di dalam tungku pemanas listrik, dengan menggunakan elektroda karbon. Beberapa metoda lainnya dapat digunakan untuk mempersiapkan unsur ini. Amorphous silikon dapat dipersiapkan sebagai bubuk cokelat yang dapat dicairkan atau diuapkan. Proses Czochralski biasanya digunakan untuk memproduksi kristal-kristal silikon yang digunakan untuk peralatan semikonduktor. Silikon super murni dapat dipersiapkan dengan cara dekomposisi termal triklorosilan ultra murni dalam atmosfir hidrogen dan dengan proses vacum float zone.
c. Sifat-Sifat Silikon
pada silikon. Unsur silikon mentransmisi lebih dari 95% gelombang cahaya infra merah, dari 1,3 sampai 6 mikrometer.
d. Kegunaan Silikon
Dalam bentuknya sebagai pasir dantanah liat, dapat digunakan untuk membuat bahan bangunana seperti batu bata. Ia juga bergunasebagai bahan tungku pemanas dan dalam bentuk silikat ia digunakan untuk membuat enamels(tambalan gigi), pot-pot tanah liat, dsb. Silika sebagai pasir merupakan bahan utama gelas Gelasdapat dibuat dalam berbagai macam bentuk dan digunakan sebagai wadah, jendela, insulator, danaplikasi-aplikasi lainnya.
Silikon tetraklorida dapat digunakan sebagai gelas iridize.Silikon super murni dapat didoping dengan boron, gallium, fosfor dan arsenik untukmemproduksi silikon yang digunakan untuk transistor, sel-sel solar, penyulingan, dan alat-alatsolid-state lainnya, yang digunakan secara ekstensif dalam barang-barang elektronik dan industri antariksa. Hydrogenated amorphous silicone memiliki potensial untuk memproduksi sel-sel murah untuk mengkonversi energi solar ke energi listrik.Silikon sangat penting untuk tanaman dan kehidupan binatang. Diatoms dalam air tawar dan airlaut mengekstrasi silika dari air untuk membentuk dinding-dinding sel. Silika ada dalam abuhasil pembakaran tanaman dan tulang belulang manusia. Silikon bahan penting pembuatan bajadan silikon karbida digunakan dalam alat laser untuk memproduksi cahaya koheren dengan panjang gelombang 4560 A.
e. Manfaat Silikon dalam Elektronika Teknologi Pembuatan Processor
- Sand (Pasir)
Pasir, terutama Quartz, memiliki persentase tinggi dalam pembentukan Silicon dioksida (SiO2) dan merupakan bahan dasar untuk produksi semikonduktor.
- Silikon Cair
sebuah atom asing setiap satu triliun atom Silikonnya. Pada gambar di bawah ini Anda bisa lihat bagaimana sebuah kristal besar tumbuh dari silikon cair yang dimurnikan. Hasilnya adalah kristal tunggal yang disebut Ingot.
Silikon cair – skala: level wafer (~300mm / 12 inch) - Kristal Silikon Tunggal – Ingot
Sebuah ingot dibuat dari Electronic Grade Silicon. Sebuah ingot memiliki berat sekitar 100 kilogram (220 pound) dan memiliki kemurnian Silicon 99.9999%.
Mono-crystal Silicon Ingot scale: wafer level (~300mm / 12 inch)
- Pengirisan Ingot
Ingot kemudian diiris menjadi disc-disc silikon individual yang disebut wafer. Ingot Slicing — scale: wafer level (~300mm / 12 inch)
- Wafer
Wafer-wafer ini dipoles sedemikian rupa hingga tanpa cacat, dengan permukaan selembut kaca cermin. Process rumit 45nm High-K/Metal Gate oleh Intel
menggunakan wafer dengan diameter 200 milimeter. Saat Intel mulai membuat chip-chip, perusahaan ini mencetak sirkuit-sirkuit di atas wafer 50 milimeter. Dan untuk saat ini menggunakan wafer 300mm, yang menghasilkan penghematan biaya per-chip. Wafer — scale: wafer level (~300mm / 12 inch)
- Mengaplikasikan Photo Resist
Cairan (warna biru) yang di tuangkan di atas wafer saat diputar adalah sebuah proses dari photo resist yang sama seperti yang kita kenal di film untuk fotografi. Wafer diputar selama tahap ini untuk membuatnya sangat tipis dan bahkan mengaplikasikan layer photo resist.
Applying Photo Resist — scale: wafer level (~300mm / 12 inch)
- Exposure
oleh tahap pada proses tersebut, sama dengan apa yang terjadi pada material film pada sebuah kamera saat Anda menekan tombol shutter.
Exposure — scale: wafer level (~300mm / 12 inch)
Hasil dari photo resist yang diekspos ke sinar UV akan bersifat dapat larut. Exposure diselesaikan menggunakan mask yang berfungsi seperti stensil dalam tahap proses ini. Saat digunakan dengan cahaya UV, mask membentuk pola-pola sirkuit yang bervariasi di atas tiap layer dari mikroprosesor. Sebuah lensa (di tengah) mengurangi image dari mask. Sehingga yang dicetak di atas wafer biasanya adalah empat kali lebih kecil secara linier daripada pola-pola dari mask.
- Exposure (transistor level)
Meskipun biasanya ratusan mikroprosesor bisa dihasilkan dari sebuah wafer tunggal, cerita bergambar ini hanya akan fokus pada sebuah bagian kecil dari sebuah
mikroprosesor, yaitu pada sebuah transistor atau bagian-bagiannya. Sebuah transistor berfungsi seperti sebuah switch, mengendalikan aliran arus listrik dalam sebuah chip komputer. Peneliti-peneliti di Intel telah mengembangkan transistor-transistor yang sangat kecil sehingga sekitar 30 juta transistor dapat diletakkan pas di kepala sebuah peniti.
Exposure — scale: transistor level (~50-200nm)
- Membersihkan Photo Resist
Photo resist yang lengket dilarutkan sempurna oleh suatu pelarut. Proses ini meninggalkan sebuah pola dari photo resist yang dibuat oleh mask.
Washing off of Photo Resist scale: transistor level (~50-200nm)
- Etching (Menggores)
Photo resist melindungi material yang seharusnya tidak boleh tergores. Material yang ditinggalkan akan digores (disketch) dengan bahan kimia.
Etching — scale: transistor level (~50-200nm)
Setelah proses Etching, photo resist dihilangkan dan bentuk yang diharapkan menjadi terlihat.
Removing Photo Resist — scale: transistor level (~50-200nm)
- Mengaplikasikan Photo Resist
Terdapat photo resist (warna biru) diaplikasikan di sini, diekspos dan photo resist yang terekspos dibersihkan sebelum tahap berikutnya. Photo resist akan melindungi
material yang seharusnya tidak tertanam ion-ion.
Applying Photo Resist — scale: transistor level (~50-200nm)
- Penanaman Ion
Melalui seuatu proses yang dinamakan “ion implantation” (satu bentuk proses yang disebut doping), area-area wafer silikon yang diekspos dibombardir dengan “kotoran” kimia bervariasi yang disebut Ion-ion. Ion-ion ini ditanam dalam wafer silikon untuk mengubah silikon pada area ini dalam memperlakukan listrik. Ion-ion ditembakkan di atas permukaan wafer pada kecepatan tinggi. Suatu bidang listrik mempercepat ion-ion ini hingga kecepatan 300.000 km/jam.
Ion Implantation scale: transistor level (~50-200nm)
- Menghilangkan Photo Resist
Setelah penanaman ion, photo resist dihilangkan dan material yang seharusnya di-doped (warna hijau) memiliki atom-atom asing yang sudah tertanam (perhatikan sekilas variasi warnanya).
- Transistor yang Sudah Siap
Transistor ini sudah dekat pada proses akhirnya. Tiga lubang telah dibentuk (etching) di dalam layer insulasi (warna magenta) di atas transistor. Tiga lubang ini akan terisi dengan tembaga yang akan menghubungkannya ke transistor-transistor lainnya. Ready Transistor — scale: transistor level (~50-200nm)
Wafer-wafer diletakkan ke sebuah solusi sulfat tembaga di tahap ini. Ion-ion tembaga ditanamkan di atas transistor melalui proses yang disebut electroplating. Ion-ion tembaga bergerak dari terminal positif (anoda) menuju terminal negatif (katoda) yang dipresentasikan oleh wafer.
Electroplating scale: transistor level (~50-200nm)
- Tahap Setelah Electroplating
Pada permukaan wafer, ion-ion tembaga membentuk menjadi suatu lapisan tipis tembaga.
After Electroplating scale: transistor level (~50-200nm)
- Pemolesan
Material ekses dari proses sebelumnya di hilangkan Polishing — scale: transistor level (~50-200nm)
- Lapisan Logam
Lapisan-lapisan metal dibentuk untuk interkoneksi (seperti kabel-kabel) di antara transistor-transistor. Bagaimana koneksi-koneksi itu tersambungkan ditentukan oleh tim desain dan arsitektur yang mengembangkan funsionalitas prosesor tertentu (misal Intel® Core™ i7 Processor). Sementara chip-chip komputer terlihat sangat flat, sesungguhnya didalamnya memiliki lebih dari 20 lapisan yang membentuk sirkuit yang kompleks. Jika Anda melihat pada pembesaran suatu chip, Anda akan
menemukan jaringan yang ruwet dari baris-baris sirkuit dan transistor-transistor yang mirip sistem jalan raya berlapis di masa depan.
Metal Layers — scale: transistor level (six transistors combined ~500nm)
- Testing Wafer
Bagian dari sebuah wafer yang sudah jadi ini diambil untuk dilakukan test
Wafer Sort Test scale: die level (~10mm / ~0.5 inch)
- Pengirisan Wafer
Wafer di iris-iris menjadi bagian-bagian yang disebut Die. Wafer Slicing scale: wafer level (~300mm / 12 inch)
- Memisahkan Die yang Gagal Befungsi
Die-die yang saat test pola merespon dengan benar akan diambil untuk tahap berikutnya. Discarding faulty Dies — scale: wafer level (~300mm / 12 inch) Discarding faulty Dies scale: wafer level (~300mm / 12 inch)
- Individual Die
Ini adalah die tunggal yang telah jadi pada tahap sebelumnya (pengirisan). Die yang terlihat di sini adalah die dari sebuah prosesor Intel® Core™ i7.
Individual Die scale: die level (~10mm / ~0.5 inch)
- Packaging
Bagian dasar, die, dan heatspreader digabungkan menjadi sebuah prosesor yang lengkap. Bagian dasar berwarna hijau membentuk interface elektris dan mekanis bagi prosesor untuk berinteraksi dengan sistem komputer (PC). Heatspreader berwarna silver berfungsi sebagai pendingin (cooler) untuk menjaga suhu optimal bagi prosesor. Packaging scale: package level (~20mm / ~1 inch)
- Prosessor
Inilah prosesor yang sudah jadi (Intel® Core™ i7 Processor).
- Class Testing
Selama test terakhir ini, prosesor-prosesor akan ditest untuk key karakteristik mereka (diantaranya test pemakaian daya dan frekuensi maksimumnya)
Class Testing — scale: package level (~20mm / ~1 inch)
- Binning
Berdasarkan hasil test dari class testing, prosesor dengan kapabilitas yang sama di kumpulkan pada transporting trays yang sama pula.
Binning — scale: package level (~20mm / ~1 inch)
- Retail Package
Prosesor-prosesor yang telah siap dan lolos test akhirnya masuk jalur pemasaran dalam satu kemasan box.
2. Germanium (Latin: Germania, Jerman)
Keberadaan germanium telah ditemukan sekitar 100 tahun yang lalu oleh ahli kimia Rusia, Mendeleev Omitri. Sementara pada tahun 1886, seorang kimiawan Jerman, Clemens Winkler, membuat analisis kimia bijih argyrodite, melihat pada penyelesaian analisisnya bahwa jumlah semua bahan tidak menambahkan ke jumlah sebelumnya. Dalam upaya untuk menemukan substansi yang hilang, ia mengembangkan dan bereksperimen dengan beberapa tes sampai akhirnya ia berhasil mengisolasi itu. Dalam analisis berikutnya ia menemukan bahwa itu cocok deskripsi dari elemen Mendeleev sebelumnya disebut "ekasilicon." Winkler memutuskan untuk memberi nama unsur baru germanium, sebagai penghormatan kepada tanah airnya.
Dalam bentuknya yang murni, germanium berbentukkristal dan rapuh. Germanium merupakan bahan semikonduktor yang penting. Tehnik pengilangan-zona (zone-refining techniques) memproduksi germanium kristal untuk semikonduktor dengan kemurnian yang sangat tinggi.
Ketika germanium didoping dengan arsenik, galium atau unsur-unsur lainnya, ia digunakansebagai transistor dalam banyak barang elektronik. Kegunaan umum germanium adalah sebagaibahan semikonduktor. Kegunaan lain unsur ini adalah sebagai bahan pencampur logam, sebagaifosfor di bola lampu pijar dan sebagai katalis. Germanium dan germanium oksida tembus cahayasinar infra merah dan digunakan dalam spekstroskopi infra mera dan barang-baran optik lainnya,termasuk pendeteksi infra merah yang sensitif. Index refraksi yang tinggi dan sifat dispersioksidanya telah membuat germanium sangat berguna sebagai lensa kamera wide-angle danmicroscope objectives. Bidang studi kimia organogermanium berkembang menjadi bidang yangpenting. Beberapa senyawa germanium memiliki tingkat keracunan yang rendah untuk mamalia,tetapi memiliki keaktifan terhadap beberap jenis bakteria, sehingga membuat unsur ini sangatberguna sebagai agen kemoterapi.
a. Pengertian Germanium
Germanium adalah unsur kimia dengan simbol Ge dan nomor atom 32. Germanium adalah metaloid berkilau, keras, berwarna abu-abu keputihan dalam golongan karbon, secara kimiawi bersifat sama dengan unsur segolongannya timah dan silikon. Germanium murni adalah semikonduktor, dengan penampilan hampir sama dengan unsur silikon. Germanium, sama halnya dengan silikon, secara alamiah bereaksi dan membentuk senyawa kompleks dengan oksigen di alam. Berkebalikan dengan silikon, germanium terlalu reaktif untuk ditemukan secara alami di Bumi dalam bentuk bebasnya.
lainnya. Germanium tidak dianggap sebagai unsur yang esensial untuk semua organisme hidup.
Germanium adalah unsur ketiga pada kolom keempat belas tabel periodik. Germanium diklasifikasikan sebagai metaloid. Atom germanium memiliki 32 elektron dan 32 proton dengan 4 elektron valensi di kulit terluar.
b. Karakteristik dan Sifat Germanium
Simbol: Ge Nomor atom: 32 Berat atom: 72,64 Klasifikasi: metaloid
Fase pada Suhu Kamar: Padat
Dalam kondisi standar Germanium adalah logam sulit, mengkilap, berwarna abu-abu keperakan padat yang sangat rapuh. Ini adalah salah satu dari beberapa elemen yang mengembang ketika membeku atau berubah menjadi padat.
Sebagai logam metalloid, germanium memiliki kualitas logam dan non-logam. Germanium juga merupakan semikonduktor, yang berarti memiliki konduktivitas listrik antara isolator dan konduktor. Karakteristik ini telah menyebabkan itu digunakan dalam elektronik.
Germanium tidak bereaksi dengan oksigen pada suhu kamar, tapi akan membentuk dioksida germanium pada suhu yang lebih tinggi.
Germanium adalah elemen yang cukup langka yang ditemukan di kerak bumi. Meskipun ada beberapa mineral yang mengandung cukup banyak germanium seperti germanite dan argyrodite, mereka jarang untuk ditambang. Mayoritas germanium digunakan oleh industri, diproduksi sebagai produk sampingan dari pertambangan bijih sfalerit di mana ia ditemukan dalam jumlah kecil.
Mayoritas germanium digunakan dalam sistem optik. Karena Germania (GeO2) memiliki kualitas yang baik untuk bekerja dengan cahaya dan laser. Aplikasi seperti kamera, serat optik, dan mikroskop memanfaatkan sifat-sifat ini. Germanium juga digunakan dalam optik inframerah.
Aplikasi lain mencakup dalam penggunaan elektronik (dimana dikombinasikan dengan silikon untuk membuat silikon germanium (SiGe), panel surya, dan beberapa paduan logam.
Germanium pertama kali diperkirakan ada oleh kimiawan Rusia Dmitri Mendeleev pada tahun 1869 berdasarkan tabel periodik. Namun, kimiawan Jerman Clemens Winkler yang pertama kali mengisolasi elemen dan membuktikan keberadaannya pada tahun 1886. Winkler menemukan unsur dalam mineral argyrodite.
Germanium mendapatkan namanya dari negara asal Winkler yaitu Jerman (Germany). Ada lima isotop alami dari Germanium. Yang paling umum adalah Germanium-74.
Argirodite, sulfide germanium dan perak Germanite, yang mengandung 8% unsure ini Biji seng
Batu bara
Mineral-mineral lainnya
Germanium murni ditemukan dalam bentuk yang keras, berkilauan, berwarna putih keabu-abuan, tapi merupakan metalloid yang rapuh. Germanium stabil di udara dan air pada keadaan yang normal, dan sukar bereaksi dengan alkali dan asam, kecuali dengan asam nitrat.
d. Senyawa-Senyawa Germanium
Germanium tidak larut dalam asam dan basa encer, tetapi larut perlahan dalam asam sulfat pekat dan bereaksi keras dengan alkali cair untuk menghasilkan germinates ( 2-. Germanium terjadi terutama di bilangan oksidasi +4, meskipun banyak senyawa yang dikenal dengan keadaan oksidasi +2. Oksidasi lainnya jarang terjadi seperti +3 ditemukan dalam senyawa.
Dua germanium oksida dikenal yaitu Germanium dioksida (Germania) dan monoksida germanium GEO. Dioksida ini dapat diperoleh dengan pemanggangan sulfide germanium dan merupakan bubuk putih yang hanya sedikit larut dalam air tetapi bereaksi dengan alkali untuk membentuk germinates. Monoksida, oksida germaous dapat diperoleh dengan reaksi suhu tinggi dari dengan logam Ge. Senyawa biner lainnya, kalkogen juga dikenal seperti disulpida , diselenide dan monosulfida GES, selenide GeSe, dan telluride GeTe. Bentuk sebagai endapan putih ketika hydrogen sulfide dilewatkan melalui larutan asam kuat yang mengandung Ge (IV). Disulfide ini lumayan larut dalam air dan dalam larutan alkali kaustik atau sulfida basa. Tetapi tidak larut dalam air asam.
Germanium klorida diperoleh sebagai cairan berwarna merah, mendidih pada 83º C dengan pemanasan logam dengan klorin. Senyawa-senyawa germanium yang lainnya adalah bismuth germanae, tetra ethil germane, tetra metal germane.
Kegunaan
Ketika germanium didoping dengan arsenik, galium atau unsur-unsur lainnya, ia digunakan sebagai transistor dalam banyak barang elektronik. Kegunaan umum germanium adalah sebagai bahan semikonduktor. Kegunaan lain unsur ini adalah sebagai bahan pencampur logam, sebagai fosfor di bola lampu pijar dan sebagai katalis. Germanium dan germanium oksida tembus cahaya sinar infra merah dan digunakan dalam spekstroskopi infra mera dan barang-baran optik lainnya, termasuk pendeteksi infra merah yang sensitif. Index refraksi yang tinggi dan sifat dispersi oksidanya telah membuat germanium sangat berguna sebagai lensa kamera wide-angle dan microscope objectives. Bidang studi kimia organogermanium berkembang menjadi bidang yang penting. Beberapa senyawa germanium memiliki tingkat keracunan yang rendah untuk mamalia, tetapi memiliki keaktifan terhadap beberap jenis bakteria, sehingga membuat unsur ini sangat berguna sebagai agen kemoterapi.
Germanium dipandang sebagai pengganti potensial untuk silicon pada chip mini. Kegunaan lain dalam elektronika termasuk posfor di lampu neon. Germanium transistor masih digunakan di beberapa pedal efek oleh musisi yang ingin memproduksi karakter nada khas. Germanium dioksida juga digunakan dalam katalis untuk polimerisasi dalam produksi polyethylene terephtalate. Selain itu juga germanium telah mendapatkan popularitas dalam beberapa tahun terakhir terkenal karena kemempuannya untuk meningkatkan fungsi system kekebalan tubuh pada pasien kanker. Ini tersedia di Amerika Serikat sebagai suplemen makanan dalam bentuk kapsul, oral atau tablet, dan juga telah ditemukan sebagai larutan injeksi. Sebelumnya bentuk anorganik, khususnya garam sitrat-laktat, menyebabkan sejumlah kasus disfungsi ginjal, steatosis hati.
Germanium anorganik mampu melindungi tubuh dari pertumbuhan tumor dan kanker ganas dengan jalan memperkuat sistem imun. Germanium dibutuhkan oleh tubuh, dalam satu hari minimal 1 mg. Seperti halnya selenium, germanium juga termasuk ke dalam golongan trace mineral.
Amyloidosis diketahui berhubungan dengan penyakit inflammatori kronis, kelainan sel plasma, deposisi amyloid di organ neuroendokrin, dan defisiensi kongenital enzim (terutama enzim yang berperan dalam penguraian prekursor amyloid). Selain itu, germanium organik juga melindungi sistein (suatu asam amino sulfhidril) dari oksidasi.
Bahaya
Bahaya fisik yang dapat ditimbulkanoleh germanium, dilihat dari bentuk gasnya, yang lebih berat dari pada udara sehingga dapat berpindah dengan cepat sepanjang permukaan bumi. Selain itu, sebagi salah satu logam berat, germanium juga memiliki dampak negatif apabila terakumulasi dalam sistem perairan
f. Pembuatan Germanium
D. IKATAN ZAT PADAT
Pada sebuah molekul, atom satu dan lainnya diikat oleh ikatan atomik yang salah satunya adalah ikatan kovalen. Ikatan-ikatan kovalen yang mengikat sejumlah atom untuk bersatu dalam sebuah molekul juga dapat mengikat sejumlah atom-atom tak terbatas untuk membentuk zat padat.
Sifat zat padat selain bergantung kepada jenis atom-atom penyusunnya juga bergantung pada struktur materialnya, yaitu cara penyusunan atom di dalam zat padat. Misalkan kristal garam dan kaca, keduanya memiliki susunan atom yang berbeda walaupun keduanya merupakan zatpadat.
Berdasarkan cara penyusunan atom-atomnya zat padat dikenal sebagai zat padat kristal dan zat padat amorf. Zat padat kristal adalah zat yang susunan atom-atom atau molekul-molekulnya memiliki keteraturan jarak panjang dan periodik. Contoh dari zat padar kristal adalah es, tembaga, garam dll. Zat Padat amorf adalah zat padat yang susunan atom-atomnya hanya memiliki keteraturan jarak pendek. Misalnya adalah plastik, kaca, aspal. Difraksi Sinar X adalah salah satu cara untuk mengetahui sifat-sifat bahan dengan melihat susunan partikelnya. Namun demikian susunan partikel yang ada dalam benda padat tidak mungkin dilihat manusia dengan mata telanjang.
Ikatan ionik terjadi karena gaya tarik elektrostatik antara ion positif dan ion negatif. Pada kristal ionik, tiap ion dikelilingi oleh ion-ion yang lain. Contoh : kristal NaCl, ion-ion Na + dikelilingi oleh 6 ion-ion Cl -.
Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terjadi karena adanya pemakaian bersama elektron-elektron dari atom-atom yang bersangkutan. Contoh : Atom hidrogen (H) memiliki konfigurasi 1s 1 akan lebih stabil jika pemakaian bersama sepasang elektron dengan sebuah elektron hidrogen yang lain sehingga membentuk molekul H 2 + = H H H2H2.
Contoh lainnya yaitu intan karbon, mempunyai konfigurasi elektron 1s 2 2s 2 2p 2 membutuhkan 4 elektron agar kulitnya penuh (2p 6 ). Empat elektron ini diperoleh dari pemakaian 4 atom C yang dikenal sebagai intan, 1 atom C akan berikatan kovalen dengan 4 atom C lainnya Karbon mempunyai konfigurasi elektron 1s 2 2s 2 2p 2 membutuhkan 4 elektron agar kulitnya penuh (2p 6 ). Empat elektron ini diperoleh dari pemakaian 4 atom C yang dikenal sebagai intan, 1 atom C akan berikatan kovalen dengan 4 atom C lainnya.
Ikatan Hidrogen
Atom H hanya punya 1 elektron, diharapkan berikatan kovalen dengan semua atom. Molekul H 2 O, ikatan kovalen antara 2 atom H dan 1 atom O, bukan ikatan kovalen murni. Elektron bersamanya lebih ditarik ke arah atom O, shg muncul suatu Dipol listrik (atom H lbh positif dan atom O lbh negatif). Atom H yang lebih positif dapat mengikat atom O dari molekul H 2 O yang lain. Atom H seolah-olah menjadi perekat antara satu molekul H 2 O dgn 4 molekul H 2 O yang lain.
Ikatan Van der Waals
antar dipol sesaat). Gaya van der Waals merupakan penyebab dari kondensasi gas menjadi zat cair dan pembekuan zat cair menjadi zat padat walau tdk terdapat mekanisme ikatan ionik, kovalen atau ikatan logam. Tarikan Van der Waals berbanding lurus dengan r -7, sehingga hanya penting untuk molekul yang sangat berdekatan. Gaya ini sangat lemah dibandingkan dengan gaya pada ikatan kovalen maupun ikatan ionik. Karena lemahnya ikatan ini, maka gas-gas menguap pada suhu yang rendah.
Ikatan Logam
E. PRINSIP EKSLUSI PAULI
“Hanya satu elektron dalam atom yang diizinkan menempati keadaan 4 bilangan kuantum atau, paling banyak dua elektron dapat menempati satu orbital yang didefinisikan oleh tiga bilangan kuantum n, l dan m”.
Menurut prinsip eksklusi Pauli menyatakan, bahwa dalam suatu atom yang sama tidak mungkin ada dua elektron dengan keempat bilangan kuantum (n, l, m, s) yang sama. Orbital yang sama akan mempunyai bilangan kuantum n, l, m, yang sama, tetapi yang membedakan hanyalah bilangan kuantum spin (s). Setiap orbital hanya dapat berisi dua elektron dengan spin yang antiparalel (berlawan arah). Jadi, satu orbital dapat ditempati maksimum oleh dua elektron, karena jika elektron ketiga dimasukkan maka akan memiliki spin yang sama dengan salah satu elektron sebelumnya.
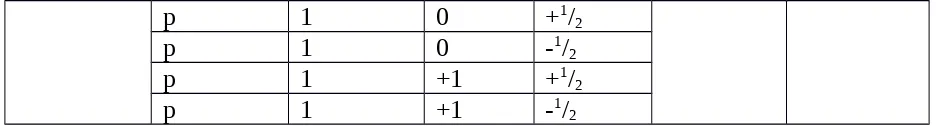
Contoh : Pada orbital 1s, akan ditempati oleh 2 elektron, yaitu: Elektron Pertama : n = 1, l = 0, m = 0, s = +1/2
Elektron Kedua : n = 1, l = 0, m = 0, s = -1/2
Dapat dilihat, elektron pertama dan elektron kedua mempunyai harga bilangan kuantum n, l, dan m yang sama, tetapi harga bilangan kuantum s-nya berbeda.
Elektron ketiga tidak dapat menempati orbital 1s lagi, sebab jika elektron ketiga menempati orbital 1s, maka harga bilangan kuantum n, l, m, dan s elektron ketiga akan sama dengan elektron pertama atau elektron kedua.
Dengan menggunakan prinsip eksklusi Pauli dan ketentuan harga bilangan kuantum m dan l yang diperbolehkan untuk setiap harga bilangan kuantum n dapat disusun berbagai kombinasi 4 bilangan kuantum pada setiap kuantum grup sebagai berikut:
p 1 0 +1/2
p 1 0 -1/2
p 1 +1 +1/2
p 1 +1 -1/2
Tabel Jumlah Maksimum Elektron yang Menempati Tiap Kulit
No. Kulit 1 Simbol Jumlah Maksimal
Elektron Total Dikulit
1 K 0 1s 2 (2 = 2×12 ¿
2 L 0 2s 2 (8 = 2× 22¿
1 2p 6
3 M 0 3s 2 (18 = 2×32)
1 3p 6
2 3d 10
4 N 0 4s 2 (32 = 2×42)
1 4p 6
2 4d 10
F. ELEKTRON BEBAS Dan HOLE
Elektron adalah salah satu bagian dari atom yang berperan penting dalam adanya arus listrik. Karena arus listrik itu sendiri merupakan aliran dari elektron-elektron yang berpindah dari satu atom ke atom yang lain secara teratur. Elektron yang dapat berpindah-pindah ini disebut dengan elektron bebas. Perpindahan elektron itu disebabkan karena adanya perbedaan tenaga pada kedua ujung peghantar. Semakin besar perbedaan tenaga tersebut maka semakin banyak pula arus listrik yang dialirkan. Benda atau alat yang dapat menghasilkan arus listrik disebut dengan sumber arus listrik antara lain Baterai, Accumulator, Solar Cell, dan generator listrik.
G. ELEKTRON VALENSI
Elektron Valensi adalah elektron di tingkat energi terluar atom yang dapat berpartisipasi dalam interaksi dengan atom lain. Karena elektron valensi sangat penting, atom dapat diwakili oleh diagram titik elektron yang menunjukkan hanya elektron valensi mereka.
Karena elektron valensi sangat penting, atom sering diwakili oleh diagram sederhana yang hanya menampilkan elektron valensi mereka. Ini disebut diagram titik elektron, dan tiga contoh akan ditunjukkan di bawah ini.
Dalam jenis diagram ini, simbol kimia unsur ini dikelilingi oleh titik-titik yang mewakili elektron valensi. Biasanya, titik-titik yang diambil membentuk persegi yang mengelilingi simbol unsur yang terisi hingga dua titik per sisi.
Sebuah unsur tidak pernah memiliki lebih dari delapan elektron valensi, sehingga tidak bisa lebih dari delapan titik per atom. Elektron valensi adalah elektron yang berperan dalam pembentukan ikatan kimia antar atom.
Elektron valensi sering dijumpai (terutama pada unsur kelompok utama) sebagai elektron yang mempunyai kedudukan di orbital paling luar dalam sebuah atom. Pada logam transisi, elektron valensi berada pada orbital dalam.
Adanya elektron valensi menentukan sifat kimia dari suatu unsur dan menentukan apakah atom unsur tersebut mampu berkaitan dengan unsur lain atau tidak. Atom yang mempunyai elektron valensi yang terisi penuh (contoh : konfigurasi elektron s2 p6) cenderung inert atau stabil.
Atom dengan kelebihan satu atau dua elektron cenderung reaktif, karena elektron dapat dilepas dengan mudah sehingga dapat membentuk ion positif. Atom yang kekurangan satu atau dua elektron juga bersifat reaktif, karena dengan mudah dapat menarik elektron dari atom lain sehingga membentuk ion negatif, atau berbagi elektron valensi sehingga membentuk ikatan kovalen.
H. SEMIKONDUKTOR
Secara umum semikonduktor adalah bahan yang sifat-sifat kelistrikannya terletak antara sifat-sifat konduktor dan isolator. Operasi semua komponen benda padat seperti dioda, LED, Transistor Bipolar dan FET serta Op-Amp atau rangkaian terpadu lainnya (solid state) didasarkan atas sifat-sifat semikon- duktor. Sifat-sifat kelistrikan konduktor maupun isolator tidak mudah berubah oleh pengaruh temperatur, cahaya atau medan magnit, tetapi pada semikon- duktor sifat-sifat tersebut sangat sensitif.
1. Kegunaan Semikonduktor
Bila dibanding dengan logam daya hantar listrik semikondutor lebih kecil. Aliran yang kecil menyebabkan aliran listrik pada semikonduktor mudah dikontrol. Dasar penggunaan semikonduktor adalah terbentuknya sambungan p-n (p-n juncktion) apabila semikonduktor tipe-p dan tipe-n digabungkan. Sambungan ini yang merupakan dasar terjadinya terjadinya revolusi industri akibat ditemukan transisistor oleh wiliam Shocklye, John Barden dan Walter Brattain di laboratorium Bell pada tahun 1948. Selain itu semikonduktor digunakan untuk membuat sel surya (solar cell) dan penyearah. Berikut beberapa kegunaan semikonduktor.
a. Sel Surya (Solar Cell)
Solar cell terdiri dari dua semikonduktor yaitu:
2) Semikonduktor tipe-n, yang diperoleh dari semikonduktor silikon yang dikotori dengan arsen.
Dua semikonduktor tersebut disambung seperti pada gambar berikut:
Sebelum kedua semikonduktor tersebut disambung, jumlah hole pada pita valensi semikonduktor tipe-p lebih banyak dibanding jumlah hole pada pita valensi semikonduktor tipe-n, sebaliknya jumlah elektron pada pita konduksi semikonduktor n lebih banyak dibanding jumlah elektron pada pita konduksi semikonduktor tipe-p. setelah keduanya disambungkan maka:
Pada pita valensi akan terjadi aliran hole dari semikonduktor tipe-p ke semikonduktor tipe-n dan sebaliknya, serta aliran elektron dari semikonduktor tipe-n ke semikonduktor tipe-p dan sebaliknya sampai terjadi kesetimbangan.
Pada pita konduksi akan terjadi aliran elektron dari semikonduktor tipe-n ke semikonduktor tipe-p dan sebaliknya sampai terjadi kesetimbangan.
muatan positif dan pada semikonduktor tipe-p akan berkembang muatan negatif. Dengan kata lain antara kedua bagian tersebut timbul potensial listrik.
Pada sel surya semikonduktor tipe-p dibuat lebih tipis dibanding semikonduktor tipe-n. Pada pengoperasian sel suria, bagian yang dikenakan sianr matahari adalah semikonduktor tipe-p.
Pada waktu sel surya terkena sinar matahari maka elektron-elektron pada semikonduktor tipe-p mendapatkan tambahan energi termal. Elektron-elektron tersebut dapat melewati sambungan p-n (p-n junction) dan memasuki semikonduktor tipe-n. Apabila daya gerak elektron-elektron tersebut cukup besar maka mereka akan melewati kawat penghantar (menuju ke semikonduktor tipe-p kembali) sehingga arus listrik yang energinya daapat langsung dimanfaatkan atau disimpan dalam baterai. Jadi fungsi dari sel suria adalah merubah energi cahaya matahari menjadi energi listrik.
Silikon yang digunakan pada sel surya selain sebagai kristal tunggal (single crystal), silikon dapat diperoleh dalam bentuk amorf. Silikon amor dapat diperoleh melalui deposisi uap silikon. Kemampuan silikon amorf dalam menyerap sinar matahri 40 kali lebih efisien dibanding kristal silikon. Oleh karena itu sel suria banyak digunakan semikonduktor dengan bahan dasar silikon amorf.
Sel surya dengan bahan dasar amorf adalah lebih tahan lama dibanding sel suria dengan bahan dasar kristal tunggal. Disamping itu, silion amorf dapat dibuat pada temperatur rendah dan dapat di depositkan pada substrat yang harganya relatif murah. Sel suria dengan bahan dasar amor banyak digunakan sebagai sumber energi pada kalkulator.
Harga silikon amor cenderung semakin murah. Oleh karena itu pemakian semikonduktor dengan bahan dasar silikon amor pada peralatan elektronik yang lain cenderung semakin meluas di massa yang akan datang.
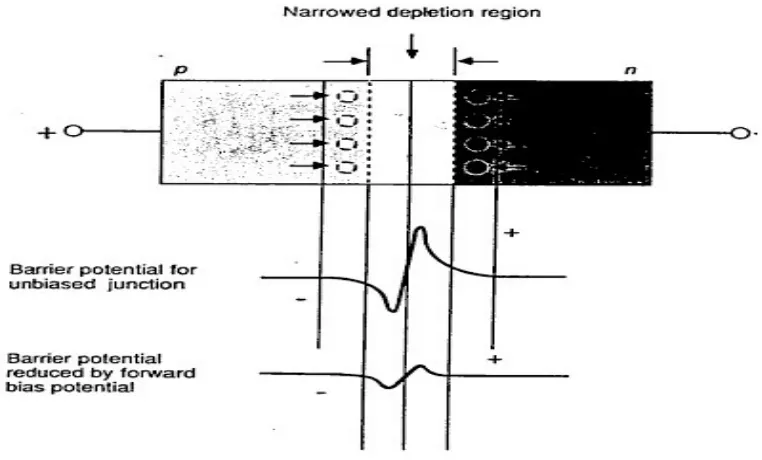
b. Penyearah (rectifer) atau Dioda
Penyearah terdiri dari semikonduktor tipe-p dan semikonduktor tipe-n yang dihubungkan oleh sambungan p-n (p-n jucktion) seperti pada gambar:
Semikonduktor tipe-p yang disambungkan dengan semikonduktor tipe-n tersebut membentuk suatu diode. Semikonduktor tipe-p dapat dianggap kelebihan hole sedangkan semikonduktor tipe-n dapat dianggap kelebihan elektron. Simbol umum dioda adalah seperti yang tertera pada gambar:
Apabila pada semikonduktor tipe-p diberi potensial positif (kutub positif dari sumber) sedangkan pada semikonduktor tipe-n diberi potensial negatif, maka hole pada semikonduktor tipe-p akan bergerak menuju sambungan p-n dan elektron-elektron pada semikonduktor tipe-n akan bergerak menuju sambungan p-n seperti yang ditunjukan pada gambar:
Apabila semikonduktor tipe-p dihubungkan dengan potensial negatif sedangkan pada semikonduktor tipe-n diberi potensial positif, maka hole pada semikonduktor tipe-p akan bergerak menjauhi sambungan p-n dan elektron pada pada semikonduktor tipe-n akan bergerak menjauhi sambungan p-n seperti yang ditunjukan pada gambar birikut. Karena tidak hole dan elektron elektron yang saling meniadakan maka tidak ada arus listrik yang menalir atau tidak terjadi arus listrik:
Berikut adalah beberapa jenis dioda: 1) Dioda biasa.
Di buat dari silikon yang telah diberi pengotor dan dan germanium. Prinsip kerjanya seperti pada penjelasan di atas.
2) Dioda cahaya.
Dioda cahaya merupakan dioda yang pada sambungan p-n (p-n jucktion) dapat memancarkan cahaya. Misalnya LED.
3) Dioda foto.
Dioda foto merupakan jenis dioda yang berfunsi mendeteksi cahaya kemudian mengubahnya menjadi energi listrik. Jenis cahaya yang dapat di deteksi yakni infra merah, cahaya tampak, ultra ungu sampai sinar-x.
4) Dioda laser.
5) Dioda zener.
Dioda zener prinsip kerjanya seperti dioda biasa tetapi arus listrik dapat mengalir ke arah yang berlawanan jika tegangan yang diberikan melampaui batas atau mencapai tegangan rusak semikonduktor.
c. LED
LED (Light Emitting Diode atau Light Emitting Device) merupakan salah satu diode semikonduktor yang dirancang untuk menghasilkan sejumlah besar cahaya monokromatis yang tidak koheren dengan rentang panjang gelombang yang sempit ketika diberi tegangan maju. LED dan bagian-bagiannya disajikan pada Gambar:
Arus maju yaitu arus dimana potensial positif (kutub positif (anoda) sumber arus) disambungkan pada bagian positif dari LED dan potensial negatif (kutub negatif sumber arus) dishubungkan pada bagian negatif (katoda) dari LED (lihat gambar 1). Sedangkan cahaya monokromatis tidak koheren yaitu cahaya dengan rentang panjang gelombang artinya walaupun sebagai cahaya monokromatis tetapi masih memiliki rentang panjang gelombang (lihat tabel). Untuk membedakan anoda dan katoda dapat dilihat dari kaki atau tangkai LED, yang bertangkai panjang merupakan anoda (kutub negatif) sedangkan yang lebih pendek merupakan katoda (kutup positif).
menggabungkan bahan semikonduktor dari warna merah, kuning dan hijau yang telah diperoleh sebelumnya. Karena warna yang dihasilkan sangat banyak, aplikasi LED kini sangat beragam misalnya menambah keindahan desain interion dan eksterion. Bahkan kini LED dengan cahaya merah dan LED dengan cahaya biru dimanfaatkan untuk membantu melangsungkan proses fotosintesis pada tanaman-tanaman yang ada dalam sebuah ruangan.
Bila dibanding lampu pijar LED memiliki keunggulan bila dibanding lampu pijar diantaranya:
Dengan arus yang rendah cahaya yang dihasilkan lebih banyak dibanding dibanding lampu pijar.
Tidak mudah rusak sebab dirancang dalam bentuk padat, sedangkan lampu neon atau lampu pijar rapuh dan mudah rusak.
Waktu pemakaian lebih lama karena tidak ada filamen yang terbakar. Dimana penambahan gas seperti CO2 atau pengaturan tekanan tidak diperlukan.
Cahaya yang dihasilkan lebih terfokus ke satu arah sehingga dalam hal-hal tertentu hal ini sangat menguntungkan.
LED selain sebagai sistem pencayaan dimanfaatkan pula sebagai sensor dan digunakan pula pada peralatan elektronik seperti remote control.
Chip LED yang dibungkus menggunakan bohlam plastik pada umumnya mempunyai tegangan rusak yang relatif rendah. Bila diberikan tegangan beberapa volt ke arah terbalik akan menyebabkan sifat isolator searah LED jebol sehingga arus dapat mengalir ke arah sebaliknya.
Warna berbagai LED dengan panjang gelombang masing-masing LED serta penyusunnya seperti yang tertera pada tabel di halaman selanjutnya:
Warna Panjang Gelombang (nm) Bahan Semikonduktor Penyusun
IR λ> 760 Gallium arsenida (GaAs)
Aluminium gallium arsenida (AlGaAs)
Merah 610 < λ < 760
Aluminium gallium arsenida(AlGaAs) Gallium arsenida fosfida (GaAsP)
Aluminium gallium indium fosfida (AlGaInP) Gallium(III) fosfida (GaP)
Jingga 590 < λ < 610
Gallium arsenida fosfida (GaAsP)
Aluminium gallium indium fosfida (AlGaInP) Gallium(III) fosfida (GaP)
Kuning 570 < λ < 590
Gallium arsenida fosfida (GaAsP)
Aluminium gallium indium fosfida (AlGaInP) Gallium(III) fosfida (GaP)
Hijau 500 < λ < 570
Indium gallium nitrida (InGaN) / gallium(III)nitrida Gallium(III) fosfida (GaP)
Aluminium gallium indium fosfida (AlGaInP) Aluminium gallium fosfida (AlGaP)
Indium gallium nitrida (InGaN) Silikon karbida (SiC) sebagai substrat
Silikon (Si) sebagai substrat – dalam pengembangan Violet 400 < λ < 450 Indium gallium nitrida (InGaN)
Ungu Berbagai jenis LED dua warna (biru dan merah, biru dengan fosfor merah, atau putih dengan plastik ungu)
UV λ < 400
berlian (235 nm)
Boron nitride (215 nm) [ 34 ][ 35 ] Boron nitrida (215 nm) Aluminium nitride (AlN) (210 nm) [ 36 ] Aluminium nitrida (AlN) (210 nm)
Aluminium gallium nitride (AlGaN) Aluminium galium nitrida (AlGaN)
Aluminium gallium indium nitride (AlGaInN) — (down to 210 nm) [ 37 ] Indium gallium aluminium nitrida
(AlGaInN) – (hingga 210 nm)
Putih Spektrum luas Dioda UV/biru dengan fosfor kuning
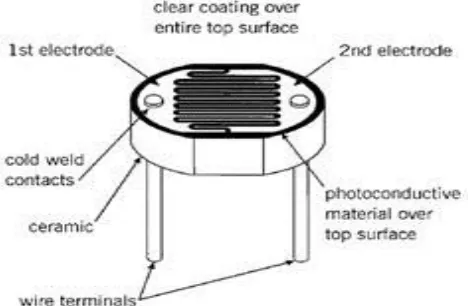
d. Fotosel CdS
Prinsip kerja fotosel CdS sebagai detektor adalah perubahan nilai resistansi atau hambatan fotosel berbanding terbalik dengan intensitas cahaya yang mengenai permukaannya. Jika dihubungkan dengan multimeter atau avometer CdS menjadi konduktor yang buruk atau CdS memiliki resistansi besar pada saat cahaya gelap atau redup, dan sebaliknya CdS menjadi konduktor yang baik atau CdS memiliki resistansi kecil pada saat cahaya terang.
a) Semikonduktor Intrinsik (Murni)
Semikonduktor intrinsik adalah bahan semikonduktor murni (belum diberi campuran/pengotoran) dimana jumlah electron bebas dan holenya adalah sama sehingga memungkinkan perpindahan muatan. Perpindahan muatan pada umumnya terjadi karena dua sebab yaitu : karena adanya perpindahan elektron bebas dan karena adanya perpindahan hole (lubang), kedua-duanya bisa terjadi bersama-sama. Dalam semikonduktor jenis intrinsic karena banyaknya elektron bebas sama dengan banyaknya hole yang terjadi. Selain itu konduktivitas semikonduktor intrinsik sangat rendah, karena terbatasnya jumlah pembawa muatan hole maupun elektron bebas. Suatu kristal Silikon yang murni, dimana setiap atomnya adalah atom Silikon saja, disebut sebagai semikonduktor intrinsik. Untuk kebanyakan aplikasi, tidak terdapat pasangan elektron-hole yang cukup banyak didalam suatu semikonduktor intrinsik untuk dapat menghasilkan arus yang berguna.
Semikonduktor instrinsik adalah sebuah unsur semikonduktor kristal tunggal tanpa atom jenis lain didalamnya. Pada sebuah semikonduktor instrinsik, kepadatan elektron dan hole adalah sama (seimbang), karena satu-satunya sumber partikel ini adalah elektron dan hole yang terbentuk secara thermal. Untuk itu, kita menggunakan notasi ni untuk menyatakan konsentrasi pembawa intrinsik, yakni konsentrasi dari elektron bebas ataupun hole. Rumus untuk nilai ni ini adalah sebagai berikut :
Dimana :
T adalah suhu atau temperatur (K)
k adalah konstanta Boltzman (86 X 10-6 eV/K) e adalah notasi eksponensial
Nilai B dan E unsur dapat dilihat pada tabel dibawah ini,
Konsentrasi instrinsik ni adalah parameter penting yang sering muncul dalam persamaan-persamaan arus-tegangan pada komponen semikonduktor.
*elektron-Volt (eV) adalah satuan energi dimana sebuah elektron dipercepat melalui medan listrik sebesar 1 V, dan 1 eV setara 1.6e-19 Joule
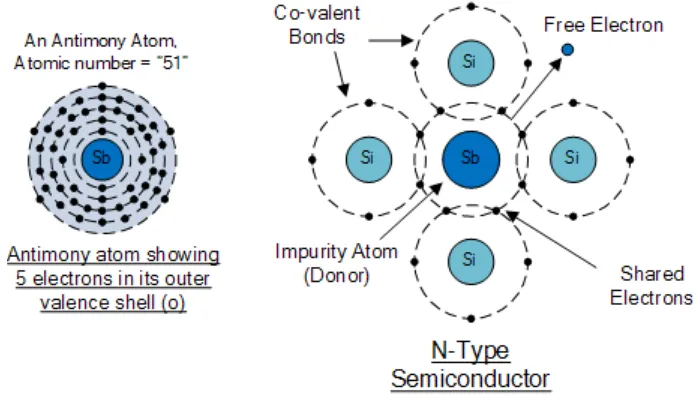
b) Semikonduktor Ekstrinsik (Tidak Murni)
Semikonduktor ekstrinsik adalah semikonduktor yang sudah dimasukkan sedikit ketidakmurnian (doping). Pemberian doping dimaksudkan untuk mendapatkan elektron valensi bebas dalam jumlah lebih banyak dan permanen, yang diharapkan akan dapat mengahantarkan listrik. Akibat doping ini maka hambatan jenis semikonduktor mengalami penurunan. Semikonduktor jenis ini terdiri dari dua macam, yaitu semikonduktor tipe-P (pembawa muatan hole) dan tipe-N (pembawa muatan elektron).
2. Bahan Semikonduktor
Ada beberapa bahan yang termasuk kategori semikonduktor seperti silikon, germanium dan selenium. Bahan-bahan ini merupakan semikonduktor yang masih murni dan belum bisa dipakai untuk membuat komponen. Jadi sebelum bisa digunakan, bahan-bahan ini harus diinjeksi dengan bahan lain yang dikenal dengan istilah doping semikonduktor.
Proses doping pada semikonduktor adalah proses menambahkan material tertentu pada bahan semikonduktor murni sehingga merubah sifat kelistrikannya. Bahan-bahan yang umum dipakai untuk proses doping semikonduktor adalah Arsenic dan Indium. Bahan-bahan ini disebut juga dengan Dopant Semikonduktor.
Semikonduktor merupakan bahan yang penting dalam perkembangan dunia elektronika. Banyak sekali alat elektronika yang menggunakan bahan semikonduktor seperti komputer, laptop, smartphone, televisi, camera dan alat elektronik lainnya. Dengan semikonduktor, peralatan elektronik dapat dibuat lebih kecil dan compact serta menggunakan daya yang kecil. Semikonduktor menggantikan fungsi tabung sinar katoda yang memiliki ukuran dan daya yang lebih besar.
Semikonduktor murni yang sudah "didoping" dengan material lain akan memiliki tipe atau sifat kelistrikan tertentu. Tipe bahan semikonduktor ini dibedakan menjadi dua yaitu Semikonduktor tipe N dan semikonduktor tipe P. Nah, kombinasi dari kedua tipe semikonduktor inilah yang nantinya akan dibuat komponen yang siap dirangkai pada alat elektronika.
a. Struktur Fisis Bahan Semi konduktor
Silikon dan germanium adalah bahan yang biasanya dipakai sebagai bahan semi konduktor. Kedua bahan tersebut terdapat dalam kolom ke empat dari sistem periodik unsur-unsur kimia. Pada material ini, lapisan terluar elektron-elektron yang sering juga disebut lapisan valensi (menurut model atom Bohr), terdiri dari empat elektron yang memungkinkan suatu hablur atau kristal murni untuk membentuk ikatan-ikatan kovalen yang kuat.
terdapat empat lapisan masing-masing mengandung dua, delapan, delapan belas, dan empat elektron.
Ikatan kovalen yang terjadi adalah sangat kuat sekali, sehingga akan diperlukan energi yang cukup besar untuk membebaskan sebuah elektron dari ikatannya. Dapat dikatakan bahwa pada temperatur kamar, bahan semi konduktor murni mempunyai tahanan listrik yang sangat tinggi, oleh karena itu merupakan bahan isolator. Tahanan jenis bahan semi konduktor akan turun dengan naiknya temperatur.
Untuk mempersiapkan bahan semi konduktor murni, misalnya digunakan sebagai transistor atau penyearah (rectifier), perlu dilakukan rekayasa (engineering) sehingga energi dari elektron-elektron pada lapisan valensi bertambah. Hal ini dapat dilakukan dengan suatu proses yang biasanya disebut doping, dimana bahan semi konduktor dicampur dengan bahan lain.
b. Macam-macam bahan semi konduktor
Bahan-bahan semi konduktor yang sering digunakan adalah Germanium dan Silikon. Sifat-sifat bahan tersebut dapat dijelaskan sebagai berikut :
1) Germanium
Germanium merupakan salah satu bahan semi konduktor yang banyak dipakai. Germanium diperoleh sebagai serbuk berwarna kelabu melalui proses kimia, yaitu dengan mereduksi germanium oksida. Selain itu juga dapat diperoleh dari pemurnian Kadmium dan seng.
Germanium adalah bahan semi konduktor yang bervalensi 4 dan mempunyai susunan seperti karbon atau silikon. Spesifikasi germanium adalah sebagai berikut:
Daya hantar panas : 0,14 Cal/cm dt °C
Kapasitas panas : 0,08 Cal/gr °C
Koefisien muai panjang (0-100°C) : 6 x
Titik lebur : 936°C
Permitivitas : 16 C2/N m2 Tahanan jenis listrik pada 20°C : 0,47 Ω m
penghantar yang baik. Germanium merupakan bahan yang sangat luas pemakaianya didalam pembuatan rectifier, transistor, dan peralatan semi konduktor yang lain.
Germanium yang dicampur dengan Arsen (As) disebut N-Germanium. N artinya negatif, karena pada temperatur kamar, germanium tipe N ini mempunyai banyak elektron bebas yang bermuatan negatif. Arsen yang memberikan elektron disebut donor. Germanium yang dicampur dengan Indium (In) yang mempunyai 3 elektron valensi disebut P-Germanium. P artinya positif, dan menunjukkan bahwa banyak sekali hole yang bermuatan positif yang ada dalam Germanium tipe P ini.
2) Silikon
Silikon (Si) tidak ditemukan dalam bentuk aslinya, akan tetapi ditemukan dalam bentuk silika yang direduksi dengan kokas dan kemudian dimurnikan dengan converter, menghasilkan SiO atau SiHCl , atau dengan proses didestilasi
berulang-ulang dan kemudian direduksi dengan hydrogen menghasilkan SiH . Sifat-sifat silikon :
Mempunyai mobilitas yang tinggi Konstanta dielektriknya kecil Konduktivitas termis yang besar Disipasi panas yang baik.
Impurity ionization energy yang sangat kecil
Dari sifat-sifat silikon tersebut diatas, maka silikon banyak digunakan sebagai bahan semi konduktor, misalnya sebagai dioda rectifier, thyristor (SCR), dan lain-lain. Senyawa silikon, SiO (quartz), sering dipergunakan pada alat-alat optik dengan index bias 1,54.
Jenis bahan semi konduktor intrinsik umumnya mempunyai valensi empat dan ikatan dalam kristalnya adalah ikatan kovalen, hal ini dapat dimengerti karena elektron valensi pada kulit terluar dipakai bersama-sama.
Pada bahan semi konduktor intrinsik, hantaran listrik yang terjadi disebabkan oleh mengalirnya elektron karena panas. Apabila temperatur naik, maka akan terjadi random thermis sehingga akan ada elektron yang terbebas dari ikatan atomnya (elektron pada kulit terluarnya). Dengan terlepasnya elektron ini, maka terjadilah kekosongan elektron yang sering disebut “hole”. Hole ini mempunyai sifat seperti partikel-pertikel yang dapat menghantarkan arus listrik karena dapat berpindah-pindah, dan dianggap sebagai partikel yang bermuatan positif sebesar muatan elektron. Gerakan hole ini menyebabkan gerakan elektron yang terikat.
Sifat-sifat semi konduktor intrinsik:
Jumlah elektron bebas sama dengan hole
Hantaran arus disebabkan oleh elektron bebas dan hole
Arah pergerakan hole sama dengan arah polaritas medan listrik E dan berlawanan arah dengan pergerakan elektron
Umur rata-ratanya adalah antara 100-1000 detik atau lebih. Umur rata-rata dari sepasang elektron-hole (electron-hole pair) adalah jumlah waktu saat tertutupnya pasangan elektron-hole sampai bertemunya elektron bebas dengan hole. Adapun yang mengisi hole pada umumnya adalah elektron yang terikat dilapisan sebelah bawahnya. 2) Bahan Semi konduktor Ekstrinsik (semi konduktor tidak murni)
Jenis bahan semi konduktor ekstrinsik didapat dengan jalan mengadakan doping antara bahan semi konduktor intrinsik dengan bahan yang valensinya berada dibawah atau di atas bahan intrinsik tersebut. Atas dasar tersebut, dibedakan dua jenis semi konduktor ekstrinsik, yaitu :
Agar bisa dipakai pada peralatan elektronika, sebuah semikonduktor harus dibuat komponen. Ada dua jenis komponen yang terbuat dari bahan semikonduktor yaitu discrete/potongan dan intergrated/kesatuan. Contoh komponen semikonduktor discrete yaitu dioda, transistor dan mosfet. Sedangkan contoh semikonduktor integrated adalah komponen IC.
Alat-alat elektronika yang menggunakan komponen semikonduktor dikenal dengan istilah solid state atau bentuk padat. Penggunaan komponen semikonduktor menggantikan fungsi tabung hampa yang dikenal dengan istilah vacum state atau bentuk hampa. Contoh alat elektronika pada zaman dahulu yang dibuat dengan semikonduktor dan paling fenomenal adalah radio transistor.
4. Doping Semikonduktor