GLIKASI ISOLAT PROTEIN KEDELAI GMO DAN NON-
GMO SECARA IN VITRO DAN PENGUJIAN SIFAT
ALERGENISITASNYA
RAHAYU SUSENO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul glikasi isolat protein kedelai GMO dan non-GMO secara in vitro dan pengujian sifat alergenisitasnya
adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Rahayu Suseno
RINGKASAN
RAHAYU SUSENO. Glikasi Isolat Protein Kedelai GMO dan Non-GMO Secara
In Vitro dan Pengujian Sifat Alergenisitasnya. Dibimbing oleh NURHENI SRI
PALUPI dan ENDANG PRANGDIMURTI.
Alergi pangan merupakan sebuah respon imunologis yang disebabkan oleh alergen yang terdapat pada pangan. Kacang kedelai merupakan satu dari delapan jenis bahan pangan yang sering menyebabkan alergi. Tanaman pangan hasil rekayasa genetika yang banyak diproduksi di dunia adalah kacang kedelai yaitu sekitar 47%. Produk GMO dikhawatirkan dapat meningkatkan alergenisitasnya. Proses pengolahan yang melibatkan reaksi Maillard dapat digunakan untuk mengurangi sifat alergenisitas dari protein kedelai. Pengolahan menggunakan reaksi Maillard ini dapat dilakukan dengan mengonjugasikan protein dengan gula pereduksi. Konjugasi ini akan meningkatkan sisi pengenalan pada permukaan protein sehingga dapat menurunkan alergenisitasnya.
Penelitian ini bertujuan untuk mengarakterisasi kimia serta menguji reaktivitas imunologi isolat protein kedelai GMO dan non-GMO yang diglikasi secara kuantitatif dan kualitatif. Isolat protein kedelai (IPK) GMO dan non-GMO diglikasi dengan fruktooligosakarida melalui reaksi Maillard dengan sistem cair. Alergenisitas diukur secara kualitatif menggunakan immunobloting dan secara kuantitatif menggunakan ELISA.
Peningkatan derajat glikasi IPK GMO dan non-GMO pada system cair masing-masing memperlihatkan hasil 75.03% dan 73.50%. Terdapat 9 protein alergen pada kacang kedelai GMO dan 8 protein alergen pada kacang kedelai non-GMO. Reaksi glikasi dapat mengurangi alergen pada kacang kedelai GMO dan non-GMO hingga 91.69% dan 87.07%.
SUMMARY
RAHAYU SUSENO. In vitro Glycation and Allergenicity of GMO and
non-GMO Soy Protein Isolates. Supervised by NURHENI SRI PALUPI and ENDANG PRANGDIMURTI.
Food allergy is an immunological response caused by allergens contained in food. Soybean is one of the eight kinds of food products that oftenly cause allergies. Genetically modified food crops that are most widely produced worldwide is soybean which is about 47%. GMO products is concerned may increase the allergenicity of the product. Processing using Maillard reaction can be used to reduce the allergenicity of soy protein. Processing using the Maillard reaction can be carried out by conjugate the protein with reducing sugars. This conjugate will increase the recognition on the protein surface and therefore reduces the allergenicity.
The aims of the research were to characterized the chemical and immunological reactivity of glycated GMO and non-GMO soy protein isolate quantitatively and qualitatively. GMO and non-GMO SPI were glycated with fructooligosaccharides (FOS) through the Maillard reaction in liquid systems. Allergenicity was determined qualitatively using immunoblotting and quantitatively using ELISA.
An increase of glycation degree of GMO and non-GMO SPI up to 75.03% and 73.50% was observed in the liquid system, respectively. There were 9 protein allergens in GMO soybean and 8 protein allergens in non-GMO soybean. The glycation reaction can reduced protein allergens in GMO and non-GMO SPI up to 91.69 % and 87.07%.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
GLIKASI ISOLAT PROTEIN KEDELAI GMO DAN NON-
GMO SECARA IN VITRO DAN PENGUJIAN SIFAT
ALERGENISITASNYA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Glikasi Isolat Protein Kedelai GMO dan non-GMO Secara In Vitro
dan Pengujian Sifat Alergenisitasnya Nama : Rahayu Suseno
NIM : F251124061
Disetujui oleh Komisi Pembimbing
Dr Ir Nurheni Sri Palupi, MSi Ketua
Dr Ir Endang Prangdimurti, MSi Anggota
Diketahui oleh
Tanggal Ujian: 19 Agustus 2015 Tanggal Lulus: Ketua Program Studi
Ilmu Pangan
Prof Dr Ir Ratih Dewanti, MSc
Dekan Sekolah Pascasarjana
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah subhanahu wa ta’ala yang telah melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penyusunan tesis yang berjudul Glikasi Isolat Protein Kedelai GMO dan non-GMO Secara In Vitro dan Pengujian Sifat Alergenisitasnya. Tesis
ini disusun untuk memenuhi salah satu syarat untuk menyelesaikan pendidikan strata dua (S2) Program Studi Ilmu Pangan, Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Nurheni Sri Palupi, MSi dan Dr Ir Endang Prangdimurti, MSi selaku pembimbing yang telah memberikan pengarahan, bimbingan, saran, motivasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr Puspo Edi Giriwono selaku dosen penguji.
Ungkapan terima kasih yang tak terhingga juga penulis ucapkan kepada kedua orang tua Bapak Suseno dan Ibu Yan Nurreviani serta seluruh keluarga besar tercinta, atas segala doa, semangat, dukungan, motivasi dan kasih sayangnya selama ini. Penulis juga ingin menyampaikan terima kasih kepada semua pihak, teknisi laboratorium dan teman-teman yang telah membantu dan berbagi ilmu dalam penelitian ini. Terima kasih kepada teman-teman seperjuangan Pascasarjana Ilmu Pangan IPB. Semoga karya tulis ini bermanfaat bagi kemajuan ilmu pengetahuan selanjutnya.
Bogor, Agustus 2015
DAFTAR ISI
2.1 Kacang Kedelai dan Isolat Protein Kedelai 4
2.2 Alergi Pangan 5
2.3 Glikasi dan Penurunan alergenisitas 8
3 METODE PENELITIAN 12
3.1 Waktu dan Tempat Penelitian 12
3.2 Bahan 12
3.3 Alat 12
3.4 Tahapan Kerja 12
3.4.1 Isolasi Protein 13
3.4.2 Konjugasi IPK-FOS 13
3.4.3 Karakterisasi Kimia Konjugat IPK-FOS 13
a. Pengukuran Glikasi 13
b. Penentuan Profil Berat Molekul Konjugat IPK-FOS 14
3.4.4 Pengujian Alergenisitas 17
a. Preparasi Serum Penderita Alergi 17
b. Pengujian Respon AntigenikmenggunakanImmunoblotting 17 c. Pengujian Reaktivitas Imunologi menggunakan ELISA 17
4 HASIL DAN PEMBAHASAN 19
4.1 Isolat Protein Kacang Kedelai 19
4.2 Karakteristik Isolat Protein Kacang Kedelai 19
a. Derajat Glikasi 19
b. Grup Amino Bebas 21
c. Profil Berat Molekul Protein berdasarkan Elektroforesis SDS-PAGE 22
4.3 Sifat Alergenisitas 26
a. Respon Antigenik Isolat Protein Terglikasi 26 b. Reaktivitas Imunologi Kacang Kedelai berdasarkan Uji ELISA 28
5 SIMPULAN DAN SARAN 33
5.1 Simpulan 33
DAFTAR PUSTAKA 34
LAMPIRAN 40
DAFTAR TABEL
1 Perbandingan tipe-tipe hipersensitivitas 6
2 Jenis-jenis alergen pada kacang kedelai 7
3 Pengaruh konjugasi protein terhadap alergenisitas 100 4 Rendemen dan kadar protein isolat protein kedelai 19 5 Berat molekul protein kedelai GMO sebelum dan sesudah glikasi 24 6 Berat molekul protein kedelai non-GMO sebelum dan sesudah glikasi 25
7 Persen penurunan reaktivitas (OD) 30
DAFTAR GAMBAR
1 Mekanisme reaksi alergi (Singh dan Bhalla 2008) 7 2 Skema reaksi glikasi protein (Zhang et al. 2009). 8
3 Skema reaksi Maillard (Zhang dan Zhang 2007) 9
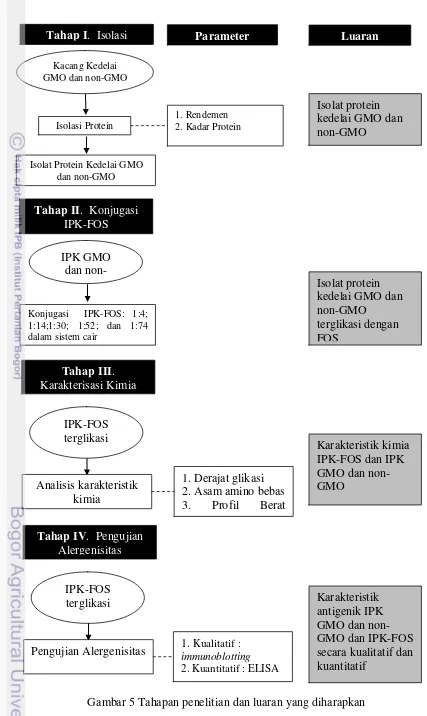
4 Struktur fruktooligosakarida (Eurofins 2015) 10 5 Tahapan penelitian dan luaran yang diharapkan 15 6 Derajat glikasi kedelai setelah diberi perlakuan FOS 20 7 Skema representasi kondensasi protein dan FOS 21
8 Kadar asam amino bebas 22
9 Profil berat molekul protein kedelai GMO 23
10 Profil berat molekul protein kedelai non-GMO 25
11 Profil protein alergen kedelai GMO 27
12 Profil protein alergen kedelai non-GMO 28
13 Reaktivitas imunologi kacang kedelai GMO dan non-GMO 30 14 Pengaruh pengolahan pada integritas epitop protein 31
15 Diagram pita dari struktur Gly m BD 28K 32
DAFTAR LAMPIRAN
1. Pembuatan larutan kerja untuk SDS-PAGE 40
2. Hasil analisis proksimat kacang kedelai GMO dan non-GMO 41 3. Perbandingan pembuatan larutan sampel campuran IPK-FOS 42
4. Hasil analisis derajat glikasi 43
5. Hasil analisis asam amino bebas metode Bradford 44 6. Hasil analisis berat molekul protein dengan elektroforesis SDS-PAGE 45 7. Hasil pengujian alergenisitas menggunakan ELISA 47
8. ANOVA Derajat Glikasi 48
9. ANOVA konsentrasi Bradford 49
10. ANOVA Optical Dencity ELISA 50
11. Inform Consent 52
1
PENDAHULUAN
setiap reaksi tak diinginkan yang timbul setelah mengonsumsi pangan selalu dianggap sebagai alergi terhadap pangan tersebut. Alergi pangan adalah alergi yang disebabkan oleh alergen yang terdapat dalam pangan. Senyawa yang sering bersifat alergen adalah glikoprotein yang larut dalam air dengan berat molekul antara 10-70 KDa (Cianferoni dan Jonathan 2009).Terdapat 8 jenis sumber pangan utama yang sering menimbulkan reaksi alergi yaitu berbagai jenis protein yang terdapat dalam kacang tanah, kacang pohon (tree nuts seperti kenari, walnut, hazelnut), susu sapi, ikan, kerang, telur,
kedelai, dan gandum (Gupta et al.2013). Alergi dapat memicu gejala ringan
seperti gatal-gatal, hidung dan mata berair, pembengkakan, namun dapat juga dapat menyebabkan reaksi yang cukup berat seperti anafilaksis yang dapat menyebabkan kematian. Kedelai adalah tanaman kaya protein yang banyak dikonsumsi baik berupa produk olahan kedelai maupun sebagai ingredien bahan pangan seperti isolat kedelai. Isolat protein kedelai merupakan produk dari kedelai yang digunakan sebagai ingredien pada berbagai produk olahan seperti sosis, nugget, susu formula, hingga biskuit. Keberadaan protein alergen pada kedelai dapat membatasi penderita alergi untuk mengonsumsi produk olahan yang mengandung kedelai.
Pengolahan memengaruhi protein yang dapat menyebabkan alergi pada kacang kedelai. Pengolahan pangan, seperti pemanasan, hidrolisis enzimatik, dan fermentasi, dapat mengurangi alergenisitas dari kedelai karena peptida menjadi terurai dan menurunkan reaktivitas dalam mengikat reseptor pada antibodi IgE (Amnuaycheewa dan Elvira 2010). Proses pengolahan yang melibatkan reaksi Maillard merupakan salah satu cara untuk menurunkan sifat antigenisitas protein kedelai. Banyak bukti yang menunjukkan bahwa reaksi Maillard dapat memengaruhi aktivitas IgE dalam mengenali alergen dalam pangan (Nakamura et al. 2008). Pengolahan yang melibatkan reaksi Maillard ini dapat dilakukan dengan
mengonjugasikan protein dengan gula pereduksi (Xue et al. 2013). Konjugasi ini
akan menurunkan sisi pengenalan pada permukaan protein alergen sehingga dapat menurunkan antigenisitas (Nakamura et al. 2013).
Salah satu jenis gula yang banyak digunakan dalam bahan pangan adalah fruktooligosakarida (FOS). FOS adalah oligosakarida yang terdapat secara alami pada tanaman seperti bawang, sawi putih, bawang putih, asparagus, pisang, artichoke, dan banyak lainnya. FOS memiliki efek fisiologis menguntungkan seperti efek prebiotik, meningkatkan penyerapan mineral dan penurunan kadar kolesterol, trigliserida dan fosfolipid pada darah. Saat ini FOS semakin banyak digunakan dalam produk pangan dan susu formula karena potensi prebiotik yang dapat merangsang pertumbuhan mikroflora usus (Sabater-Molina 2009). Legamat
protein terglikasi melalui reaksi Maillard. Glikasi adalah reaksi non enzimatis ikatan kovalen molekul protein atau lipida dengan molekul gula. Melalui perlakuan tersebut, protein alergen utama yang terdapat pada kacang kedelai seperti glycinin (11S) dan β-conglycinin akan termodifikasi dan menurunkan antigenisitas.
Kedelai merupakan tanaman pangan hasil rekayasa genetika yang paling banyak diproduksi di seluruh dunia yaitu sekitar 47%. Rekayasa genetika adalah teknik yang digunakan untuk memodifikasi genetika guna memperoleh karakteristik tertentu (Arun et al. 2013) yang lebih dikenal dengan Genetically modified organisms (GMO). Produk GM ini dikawatirkan dapat meningkatkan
alergenisitas pada produk tersebut (Fernandez et al. 2013) untuk itu perlu
dilakukan uji alergenisitas terhadap kedelai GMO dan non-GMO untuk melihat perbedaan keduanya.
Berdasarkan hal yang telah dikemukakan, dalam penelitian ini dilakukan karakterisasi kimia, pengujian respon antigenik isolat protein kedelai GMO dan non-GMO serta yang diglikasi secara in vitro dengan FOS.
1.2 Perumusan Masalah
Berdasarkan latar belakang yang telah dikemukakan dapat dirumuskan permasalahan sebagai berikut :
1 Pengaruh glikasi terhadap karakteristik kimia isolat protein kedelai GMO dan non-GMO.
2 Pengaruh glikasi terhadap reaktivitas imunologi isolat protein kacang kedelai GMO dan non-GMO terhadap IgE serum responden penderita alergi
1.3 Tujuan Penelitian
Berdasarkan latar belakang dan perumusan masalah yang telah dikemukakan, maka penelitian dilakukan dengan tujuan :
1 Mengarakterisasi isolat protein kedelai GMO dan non-GMO yang diglikasi secara in vitro.
2 Menguji reaktivitas imunologi isolat protein kedelai GMO dan non-GMO yang diglikasi secara in vitro menggunakan teknik ELISA (Enzyme linked immunosorbent assay) dan immunoblotting.
1.4 Hipotesis
1.5 Manfaat Penelitian
Penelitian yang dilakukan dapat bermanfaat dalam :
1 Memperoleh data ilmiah mengenai karakteristik kimia dan derajat glikasi isolat protein yang terglikasi.
2 Memperoleh informasi teknologi pengolahan kacang kedelai yang dapat meminimalisasi risiko terjadinya alergi.
2
TINJAUAN PUSTAKA
2.1 Kacang Kedelai dan Isolat Protein Kedelai
Kedelai (Glycine max) adalah tanaman kaya protein yang dikonsumsi di
dunia. Di Indonesia, kedelai merupakan komoditas strategis ketiga berdasarkan tingkat konsumsinya setelah padi dan jagung, karena setiap hari dikonsumsi oleh hampir sebagian masyarakat dengan tingkat konsumsi rata-rata 8.12 kg/kapita/tahun. Kedelai sebagian besar dikonsumsi dalam bentuk produk olahan seperti tahu, tempe, kecap, tauco, tauge dan susu kedelai (Harsono 2008).
Kedelai merupakan sumber protein, lemak dan nutrisi lainnya. Protein kedelai dapat digunakan sebagai pengganti protein hewani karena kedelai memiliki kandungan protein yang baik sekitar 34-43% (Ginting et al. 2009).
Keuntungan protein kedelai adalah memiliki keseimbangan komposisi asam amino yang baik, karena mengandung asam amino esensial. Kedelai memiliki komponen yang menguntungkan secara fisiologis, karena terbukti dapat menurunkan kolesterol sehingga dapat mengurangi risiko hiperlipidemia dan penyakit kardiovaskuler. Kedelai juga memiliki keunggulan dalam membentuk gel, mengemulsi, serta kemampuan mengikat air dan minyak yang bermanfaat pada pengolahan pangan (Nishinari et al. 2014).
Selain jagung, canola, kentang dan tomat, kedelai merupakan salah satu tanaman yang banyak dikembangkan menggunakan teknologi GMO (genetically modified organism). Tanaman direkayasa secara genetik guna merubah komposisi
genetik untuk memperoleh karakteristik baru, seperti toleransi terhadap herbisida, resistensi terhadap serangga, meningkatkan umur simpan atau memodifikasi komposisi gizi (Arun 2013). Disamping itu, tanaman GMO ini dikhawatirkan dapat merubah dan meningkatkan senyawa endogen yang berdampak negatif salah satunya adalah alergen (Fernandez et al. 2013).
Keamanan produk GMO ini telah banyak diteliti, namun pro dan kontra terhadap produk ini masih terus terjadi. Mishra et al. (2012) menguji secara in silico yaitu simulasi menggunakan komputer terhadap potensi alergenisitas
transgen yang digunakan dalam pengembangan tanaman pangan GMO, bahwa terdapat potensi alergi dari beberapa gen, seperti Pers a 1 dan Hev b 11 yang
dapat berikatan dengan 7 dari 75 serum pasien alergi pangan selain kedelai. Gen
Ole e 9, Cla h 10 dan Alt a 10 memiliki alergen yang homolog dengan gandum.
Hasil ini diharapkan dapat berfungsi sebagai panduan untuk pemilihan transgen dalam mengembangkan tanaman GMO.
Fernandez et al. (2013) juga menyampaikan panduan yang dikeluarkan oleh
EFSA (European Food Safety Authority) tahun 2011 bahwa pengujian
alergenisitas terhadap tanaman GMO mencakup dua hal, yaitu pengujian protein baru yang terekspresikan dan pengujian terhadap keseluruhan tanaman GMO tersebut. Salah satu aspek dalam penilaian alergenisitas keseluruhan tanaman GMO adalah untuk memastikan bahwa modifikasi genetik tidak memengaruhi tingkat atau karakteristik senyawa endogen yang akan berdampak negatif terhadap kesehatan manusia maupun hewan.
antinutrisi, alergen, atau zat bioaktif baru yang secara tidak sengaja terekspresikan. Diperlukan studi untuk memastikan bahwa transformasi yang terjadi tidak mengekspresikankan senyawa baru yang mengakibatkan perubahan negatif yang dapat memengaruhi kesehatan manusia (Kőnig et al. 2004).
Kacang kedelai dapat diolah langsung menjadi produk pangan atau diolah menjadi produk antara atau disebut dengan produk intermediet seperti tepung kedelai, protein hidrolisat, konsentrat protein dan isolat protein kedelai (Nishinari
et al. 2014). Produk intermediet ini dapat digunakan sebagai ingredien pangan
sebagai pengental, campuran daging hingga sebagai emulsifier. Dikarenakan sifat fungsionalnya yang baik isolat protein kedelai banyak digunakan dalam industri sebagai bahan formulasi berbagai pangan (Manohar et al. 20011).
Isolat protein kedelai (IPK) adalah bentuk murni dari bubuk protein kedelai yang tersedia secara komersial, mengandung 90% protein, dan memiliki beberapa fungsi yang diinginkan seperti kemampuan sebagai pengemulsi. Protein kedelai menjadi bahan pangan yang banyak digunakan dalam formulasi pangan berbasis protein, karena memiliki protein tinggi dan kemampuan yang baik untuk meningkatkan kualitas pangan. Aplikasi yang paling penting dari IPK salah satunya adalah digunakan sebagai emulsifier dalam pembuatan pangan, seperti produk daging (Chen et al. 2013). Terdapat berbagai macam metode yang dapat
digunakan untuk mengisolasi protein diantaranya adalah isoelectric precipitation, alcohol precipitation, isoelectric precipitation combined with alcohol precipitation, serta alkali solution with isoelectric precipitation (Wu et al. 2009).
Konsumsi pangan berbasis kedelai telah meningkat sejak Food and Drug Administration (FDA) memutuskan untuk menerima klaim kesehatan terhadap
protein kedelai. Klaim ini menghubungkan asupan produk kaya protein kedelai terhadap potensi yang bermanfaat bagi kesehatan (Dolores et al. 2012).
Disamping manfaatnya tersebut, kedelai memiliki potensi sebagai alergen karena mengandung protein yang dapat memicu alergi. Alergen pada kedelai adalah protein dengan berat molekul rendah atau peptida yang umumnya merupakan golongan glikoprotein (Ballmer-Weber et al. 2007).
2.2 Alergi Pangan
Alergi pangan secara signifikan memengaruhi morbiditas dan mortalitas hingga 2.5% dari populasi orang dewasa dan 6-8% dari anak-anak kurang dari 3 tahun (Sampson 1999). Menurut laporan AS terbaru menunjukkan bahwa tingkat kejadian anafilaksis meningkat menjadi 49.8% dalam 100.000 orang per tahun. Pangan merupakan penyebab utama anafilaksis, sehingga pasien karena anafilaksis yang diinduksi pangan dilaporkan telah meningkat sebesar 350% selama dekade terakhir (Ben-Shoshan 2010).
Reaksi hipersensitivitas yang terjadi pada manusia digolongkan menjadi 4 tipe, yaitu tipe I, II, III dan IV. Reaksi tipe I (immediate hypersensitivity) terjadi
dalam waktu yang relatif cepat, dimana pengikatan antigen dan respon IgE menyebabkan pelepasan berbagai mediator oleh sel mastosit yang mengakibatkan inflamasi. Reaksi tipe II (antibody-dependent cytotoxic hypersensitivity)
permukaan sel. Reaksi tipe III (immune complex-mediated hypersensitivity)
memberikan respon dalam waktu 3-10 jam, diperantarai oleh reaksi imun yang yang mengandung antibodi IgG dan pada reaksi ini kompleks antigen-antibodi yang terdeposit di jaringan menginduksi aktivasi komplemen dan respon inflamasi. Reaksi tipe IV (delayed-type hypersensitivity) dikenal sebagai reaksi
alergi tertunda dan melibatkan sel T dalam proses reaksinya. Sel T tersensitisasi melepas sitokin yang mengaktivasi makrofag dan sel Tc sehingga mengakibatkan kerusakan sel (Roitt dan Delves 2001). Perbandingan tipe-tipe hipersensitivitas dapat dilihat pada Tabel 1.
Tabel 1 Perbandingan tipe-tipe hipersensitivitas
Parameter Tipe hipersensitivitas Manifestasi anafilaksis Hemolitik
neonatus Sumber : (Roitt dan Delves 2001)
Alergi pangan dikenal sebagai reaksi tipe I yang dimediasi oleh antibodi IgE. IgE Imunoglobulin E (IgE) adalah salah satu dari tubuh 5 kelas (isotypes) imunoglobulin (antibodi). Seperti imunoglobulin lainnya, IgE diproduksi oleh sel B dan sel plasma. Berbeda dengan imunoglobulin lain, konsentrasi IgE dalam sirkulasi sangat rendah. Konsentrasi immunoglobulin E dalam darah biasanya kurang dari 1 µg/mL. Konsentrasi IgE dalam darah berbeda-beda pada tiap golongan umur. Antara usia 10 sampai 14 tahun, kadar IgE lebih tinggi daripada orang dewasa. Setelah usia 70 tahun, kadar IgE menurun sedikit dan lebih rendah dari pada orang dewasa dibawah 40 tahun (Winter et al. 2000).
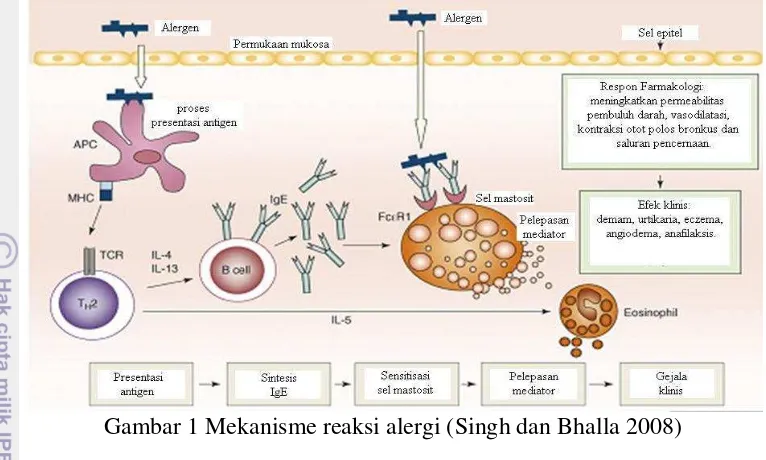
Gambar 1 Mekanisme reaksi alergi (Singh dan Bhalla 2008) Tabel 2 Jenis-jenis alergen pada kacang kedelai
Alergen atau fraksi protein BM (kDa) Sumber
Gly m 1.0101 (Gly m 1A), Protein hidrofobik 7,5 Ogawa et al. (2000)
Gly m 1.0102 (Gly m 1B), Protein hidrofobik 7 Ogawa et al. (2000)
Gly m 2, Defesin 8 Ogawa et al. (1991)
Methionine rich protein 8-12 Amnuaycheewa dan
Elvira (2010)
Gly m 3, Profilin 14 Cordle (2004)
Gly m 4, 2S-globulin 17 Vorlova (2010)
Whey fraction 18-21 Amnuaycheewa dan
Elvira (2010) Kunitz trypsin inhibitor, 2S-globulin 20 Cordle (2004) Glisinin G2, Glisinin (11S globulin) 22 Helm et al. (2000)
Gly m BD 28K, Fraksi 7S-globulin 26-28 Xiang et al. (2004)
Whey fraction 29-31 Ogawa et al. (1991)
Soy Lesitin 32 Amnuaycheewa dan
Elvira (2010) Gly m Bd 30 k, protein vacuolar P34 30-34 Ogawa et al. (1991)
Glisinin G1, 35-40 Beardslee dan Ebner
(2000)
P39 39 Xiang et al.( 2008)
7S-Globulin 40-41 Ogawa et al. (1991)
β-conglycinin subunit β 42 Ogawa et al. (1991)
7S-Globulin 47-50 Ogawa et al. (1991)
7S-Globulin 52-55 Ogawa et al. (1991)
Gly m BD 60K, β-conglycinin subunit α 57-67 Ogawa et al. (2000)
Gly m BD 68K, β-conglycinin subunit α’ 71 Ogawa et al. (2000)
leukotrien D4, serta kinins dan tryptase. Selain itu, ada reaksi tunda yang terjadi
setelah 4-8 jam dan dipengaruhi oleh sitokin seperti IL-1, tumor necrosis factor,
IL-4, IL-5, IL-13 dan berbagai faktor colony-stimulating seperti granulosit pada
monosit colony-stimulating factor. Selain sel mastosit dan basofil, eosinofil dan
neutrofil juga mungkin terlibat dalam reaksi hipersensitif. Contoh reaksi hipersensitif adalah anafilaksis, yang ditandai dengan dilatasi dari pembuluh darah dan penyempitan saluran pernafasan dan dapat terjadi sebagai respon terhadap alergen yang terdapat dalam pangan seperti kacang-kacangan dan susu. Alergi pangan yang difokuskan pada penelitian ini adalah alergi terhadap kacang kedelai. Beberapa jenis protein alergen yang terdapat pada kedelai dapat dilihat pada Tabel 2.
2.3 Glikasi dan Penurunan alergenisitas
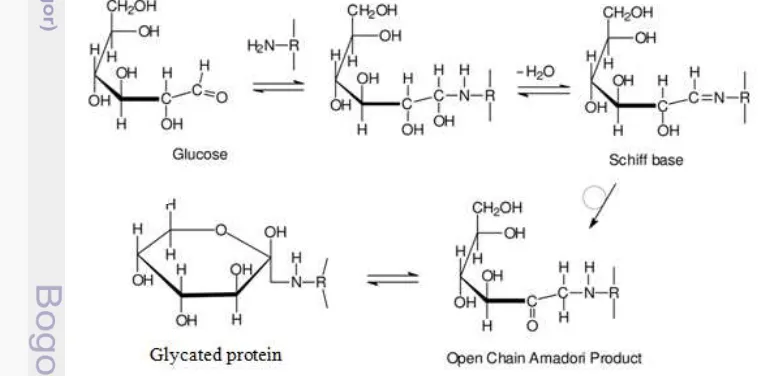
Reaksi glikasi adalah ikatan gula pereduksi ke molekul protein atau lemak tanpa melibatkan aktivitas enzim. Reaksi Maillard adalah serangkaian kompleks reaksi kimia nonenzimatis yang terjadi antara gugus amino dari suatu asam amino, peptida atau protein dan gugus karbonil dari gula pereduksi atau produk akhir dari peroksidasi lipid. Saat ini banyak penelitian membuktikan bahwa fungsi protein dapat secara signifikan ditingkatkan melalui ikatan kovalen dengan sakarida pada reaksi Maillard. Beberapa faktor yang memengaruhi reaksi Maillard serta sifat fungsional dari produk yang terbentuk adalah suhu, waktu, kelembaban relatif (RH), pH dan rasio molar reaktan (Garcia-Amezquita et al. 2014). Skema reaksi
yang terjadi pada glikasi protein dapat dilihat pada Gambar 2.
Gambar 2 Skema reaksi glikasi protein (Zhang et al. 2009).
melanoidin dan terbentuk advance glycation end products (AGEs) (Liu et al.
2012).
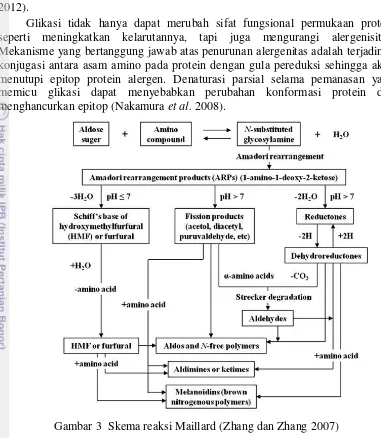
Glikasi tidak hanya dapat merubah sifat fungsional permukaan protein seperti meningkatkan kelarutannya, tapi juga mengurangi alergenisitas. Mekanisme yang bertanggung jawab atas penurunan alergenitas adalah terjadinya konjugasi antara asam amino pada protein dengan gula pereduksi sehingga akan menutupi epitop protein alergen. Denaturasi parsial selama pemanasan yang memicu glikasi dapat menyebabkan perubahan konformasi protein dan menghancurkan epitop (Nakamura et al. 2008).
Gambar 3 Skema reaksi Maillard (Zhang dan Zhang 2007)
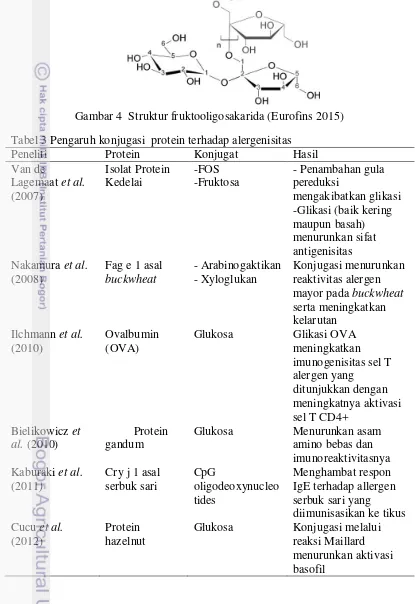
Gambar 4 Struktur fruktooligosakarida (Eurofins 2015) Tabel 3 Pengaruh konjugasi protein terhadap alergenisitas
Peneliti Protein Konjugat Hasil
Van de
Gula pereduksi yang dapat digunakan pada reaksi glikasi salah satunya adalah Fruktooligosakarida (FOS). FOS merupakan substansi karbohidrat dari famili fruktan, terdiri dari bermacam-macam gugus polimer fruktosa. Zat ini terdapat pada berbagai jenis tanaman yang disimpan sebagai karbohidrat oleh tanaman. Dalam penggolongan serat pangan, FOS termasuk dalam serat fungsional karena memiliki efek fisiologis yang berguna bagi kesehatan manusia. FOS mengandung campuran oligomer dan polimer -(2-1)-fruktosa. Karena adanya konfigurasi pada monomer fruktosa, FOS tidak dapat dihidrolisis oleh enzim pencernaan usus halus (Ratna dan Savitri 2011). Formula umum dari FOS adalah GFn dimana G adalah Glukosa, F adalah Fruktosa dan n adalah jumlah polimer antara 2 – 10 (Kusumawati dan Noor 2005). Struktur FOS disajikan dalam Gambar 4.
FOS adalah suatu senyawa kimia yang termasuk prebiotik. Prebiotik adalah komponen pangan yang tidak dapat dicerna oleh enzim-enzim pada pencernaan manusia dan berperan secara selektif dalam menstimulasi pertumbuhan mikroflora yang menguntungkan, sehingga dapat menghambat pertumbuhan bakteri patogen yang terdapat di dalam usus (Tri et al. 2010). FOS juga dapat digunakan baik
untuk meningkatkan nilai gizi atau memperbaiki sifat organoleptik produk. FOS sering digunakan sebagai pengganti gula (Padma dan Prabhasankar 2013). Selain manfaat-manfaat tersebut, FOS dapat digunakan untuk dikonjugasikan dengan protein melalui reaksi Maillard sehingga dapat menurunkan sifat alergenisitas protein tersebut. FOS memiliki kemampuan untuk mereduksi sehingga dapat ikut berperan dalam reaksi Maillard (Mesa et al. 2008). Pengaruh konjugasi protein
3
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari Mei 2014 sampai April 2015 di Laboratorium Kimia Pangan, Laboratorium Biokimia Pangan Departemen Ilmu dan Teknologi Pangan FATETA-IPB, laboratorium bioteknologi Seafast Center LPPM-IPB dan laboratorium Bioteknologi Pusat Studi Satwa Primata IPB.
3.2 Bahan
Bahan utama yang digunakan dalam penelitian ini adalah kedelai GMO (Tiga Roda Super) dan non-GMO (SB&B Food) yang diperoleh dari Koperasi Produsen Tahu Tempe Indonesia (KOPTI), FOS (fruktooligosakarida) komersial Orafti® P95, serta darah yang diambil dari responden penderita alergi kacang. Bahan kimia yang digunakan antara lain adalah heksana (teknis), NaOH (Merck), K2HPO4 (Merck), KH2PO4 (Merck), HCl 38.0 % (Merck), amonium perisulfat
(APS) (Sigma), asam oksalat 99.5% (Merck), asam trikloroasetat 99.9% (TCA) 641730-500GM (Merck), asam tiobarbiturat (1081800025) (TBA) (Merck), methanol Pa (Merck), etanol 95% (Merck), asam fosfat (Merck), asam asetat glacial (Merck), akuades, tween-20, TEMED (N,N,N’,N’ -tetramethyl-ethane-1,2-diamine) (Merck), tris base (Tri(hydroxymethyl)aminomethane) (Sigma), SDS
(sodium dodecyl sulphate) (Merck), N,N-metilen-bisakrilamid (BIO-RAD), BSA
(bovine serum albumin), akrilamid (BIO-RAD), glisin (Merck), TBS (tris buffer saline) (Sigma), PBS (phosphate buffer saline) (Sigma), akuades, akuabides,
coomasie brilliant blue G-250 (Merck), antibodi IgG tikus anti IgE manusia yang berlabel enzim HRP (Horseradish Peroxydase) (ICL Lab, ME-80P-24A), substrat
DAB (3,3’ Diaminobenzidine) (Sigma-Aldrich), Spectra Multicolor Broad Range Protein Ladder yang mengandung 10 protein dengan berat molekul 10-260 kDa
(Thermo Scientific, 26634).
3.3 Alat
Peralatan yang digunakan adalah alat sentrifuse, SDS-PAGE (BIO-RAD), lempeng mikrotiter datar polistiren 96 well (Nunc Maxisorb), ELISA reader
(BIO-RAD), spektrofotometer (UV-160, Shimadzu Japan), water bath (GFL
D-30938, Germany), inkubator (Memmert), membran nitroselulosa 0.45 µm
(BIO-RAD) untuk immunoblotting, timbangan analitik (KERN), pH meter (Eutech
Instrument), vortex (Stuart Scientific), stirrer (Cimarec), tabung Eppendorf,
mikropipet, kertas saring Whatman no. 1, Sentrifus (Eppendorf Centrifuge 5810 R) dan peralatan gelas lainnya.
3.4 Tahapan Kerja
3.4.1 Isolasi Protein
Kacang kedelai digiling, dan diayak dengan ayakan 60 mesh. Isolasi protein sampel diawali dengan penghilangan lemak (Liu et al. 2007). Sampel yang telah
dihaluskan direndam dalam heksana teknis (rasio 1:5 w/v) selama 1 jam pada suhu kamar, kemudian disentrifus (8.000 g selama 15 menit pada suhu 4oC).
Supernatan yang diperoleh dibuang, sedangkan endapannya diekstraksi kembali sebanyak dua kali untuk menghilangkan kandungan lemak yang masih tersisa. Isolasi protein menggunakan metode pengaturan pH (Speroni et al. 2010). Sampel
bebas lemak dicampur dengan akuades (rasio 1:10 w/v), kemudian pH suspensi dinaikkan sampai 8 dengan menggunakan NaOH 1 N, diaduk selama 90 menit pada suhu ruang dan disentrifus (10.000 g selama 30 menit pada suhu 4oC). Nilai pH supernatan yang diperoleh diturunkan sampai 4.5 dengan menggunakan HCl 1 N, lalu disentrifus selama 20 menit. Supernatan yang diperoleh dibuang, sedangkan endapan proteinnya diambil dan dikeringkan dengan pengering beku. 3.4.2 Konjugasi IPK-FOS
Isolat protein kedelai (IPK) GMO dan non-GMO digunakan sebagai model produk pangan dengan kandungan protein yang terglikasi melalui ikatan dengan gula pereduksi Fruktooligosakarida (FOS). Formulasi IPK-FOS dicobakan dalam sistem pangan cair (liquid) berdasarkan cara kerja Van de Lagemaat (2007).
Tahapan konjugasi IPK dan FOS adalah dengan cara melarutkan IPK dan FOS dalam 0.5 M buffer fosfat (pH 7.4) dengan rasio molar antara lisin yang terdapat pada isolat protein kedelai dan fruktosa pada FOS yaitu 1:4; 1:14; 1:30; 1:52; dan 1:74. Campuran dituang ke dalam tabung bertutup rapat dan dipanaskan dalam water-bath bersuhu 95°C, dengan pengadukan konstan selama 1 jam.
Setiap kali pengambilan, sampel didinginkan segera dalam waterbath berisi es, dilanjutkan dengan penyimpanan pada suhu -20 °C. Masing-masing perbandingan dilakukan pengujian derajat glikasi dan dipilih satu perbandingan optimal yang selanjutnya akan digunakan pada sampel.
Sampel IPK GMO dan non-GMO yang telah dikonjugasi dengan FOS sesuai perbandingan optimum kemudian dianalisis derajat glikasi dan alergenisitasnya secara in vitro sehingga dapat diketahui profil respon antigenik protein IPK-FOS
yang terglikasi setelah proses pengolahan dengan pemanasan. 3.4.3 Karakterisasi Kimia Konjugat IPK-FOS
a. Pengukuran Glikasi
Pengukuran glikasi dilakukan berdasarkan pendekatan:
1. Derajat glikasi berdasarkan banyaknya gula terikat/terkonjugasi (Sheikh
et al. 2004)
selama 10 menit pada 3000 rpm. Supernatan dipisahkan dan ditambahkan 0.5 mL TBA 50 mmol/L ke dalam 1 mL larutan supernatan tersebut, kemudian disimpan dalam penangas air dengan suhu 40°C selama 30 menit. Absorbansi sampel diukur pada 443 nm.
2. Grup amino bebas dengan metode Bradford (Bradford 1976)
Pengujian Bradford tergantung pada interaksi antara residu asam amino basa (terutama arginin, lisin dan histidin) dengan Coomassie brilliant blue G-250
(CBB) pada matriks asam. Ikatan CBB dengan protein akan menghasilkan warna biru. Tahapan pengujian adalah sebagai berikut:
Pembuatan pereaksi Bradford
Sebanyak 100 mg pewarna CBB G-250 dilarutkan ke dalam 50 mL etanol 95%. Selanjutnya ditambahkan 100 mL asam fosfat 85% dan ditepatkan hingga 1 L menggunakan akuades. Larutan kemudian disaring menggunakan kertas Whatman No.1, lalu larutan disimpan dalam botol gelap dan pada suhu refrigerasi. Pembuatan larutan standar
Deret larutan standar BSA dibuat dengan mengencerkan larutan stok BSA ke dalam tabung reaksi 1.2 x 10 cm. Kemudian ditambahkan 5 mL pereaksi Bradford. Larutan divorteks dan diukur secara spektrofotometri pada = 5λ5 nm setelah 5 menit. Untuk blanko, sebanyak 100 L akuades ditambahkan 5 mL pereaksi Bradford dan diukur dengan cara yang sama. Kurva standar yang diperoleh digunakan untuk mengukur konsentrasi sampel.
Pengukuran sampel
Sampel diambil sebanyak 100 L dan dimasukkan ke dalam tabung reaksi berukuran 1.2x10 cm, lalu ditambahkan 5 mL pereaksi Bradford. Larutan divorteks dan diukur secara spektrofotometri pada = 5λ5 nm setelah 5 menit.
b. Penentuan Profil Berat Molekul Konjugat IPK-FOS berdasarkan elektroforesis SDS-PAGE (Bollag dan Edelstein 1991)
Elektroforesis SDS-PAGE akan memisahkan protein berdasarkan berat molekul. Protein dengan berat molekul kecil akan lebih cepat bergerak menuju anoda dibandingkan dengan protein dengan berat molekul besar. Hasil akhir adalah terbentuknya pita-pita protein pada gel akrilamid. Setiap pita menunjukkan berat molekul dari protein dan ketebalan pita menunjukkan tingkat konsentrasi protein dalam sampel.
Masing-masing isolat protein kacang kedelai GMO dan non-GMO serta isolat yang terglikasi dianalisis dengan elektroforesis menggunakan gel akrilamid. Gel yang digunakan terdiri atas dua bagian, yaitu gel atas (stacking gel) dan gel
bawah (separating gel) dengan konsentrasi stacking gel 5% dan separating gel
Tahap I. Isolasi
Pembuatan separating gel
Dua lempengan kaca (mini slab) yang akan digunakan sebagai cetakan gel
dirangkai sesuai dengan petunjuk pemakaian. Sebanyak 4 mL larutan A dipipet ke dalam gelas piala, kemudian ditambahkan 2.5 mL larutan B dan 3.5 mL akuabides. Larutan tersebut kemudian diaduk perlahan dengan menggoyangkan gelas piala. Selanjutnya, sebanyak 50 L APS 10% dan 5 L TEMED ditambahkan ke dalam larutan dan diaduk kembali dengan perlahan. Larutan dimasukkan ke dalam lempengan kaca (mini slab) tanpa menimbulkan gelembung
udara dengan menggunakan mikropipet sampai sekitar 1 cm dari atas lempengan. Bagian yang tidak diisi gel diberi akuades untuk meratakan gel yang terbentuk. Gel dibiarkan mengalami polimerisasi selama 30-60 menit. Pembuatan stacking gel
Air dibuang dari atas separating gel dan dikeringkan dengan menggunakan tissue. Akuabides, larutan A, dan larutan C masing-masing sebanyak 2.3 mL; 0.67
mL; dan 1.0 mL dicampurkan ke dalam gelas piala dan diaduk perlahan dengan menggoyangkan gelas piala. Selanjutnya, sebanyak 30 L APS 10% dan 5 L TEMED ditambahkan ke dalam campuran dan diaduk kembali dengan perlahan. Kemudian sisir dimasukkan dengan cepat tanpa menimbulkan gelembung udara.
Stacking gel dibiarkan mengalami polimerisasi selama 30-60 menit. Setelah gel
berpolimerisasi, sisir diangkat dari atas gel dengan perlahan dan slab ditempatkan
ke dalam wadah elektroforesis. Buffer elektroforesis dimasukkan ke wadah elektroforesis di bagian dalam dan luar agar gel terendam.
Preparasi dan injeksi sampel
Sebanyak 40 L sampel dimasukkan ke dalam tabung Eppendorf dan ditambahkan 10 L buffer sampel. Tabung kemudian dipanaskan selama 5 menit dalam air mendidih 100°C. Sampel siap diinjeksikan sebanyak 16 L ke dalam sumur menggunakan mikropipet. Mikropipet dibilas menggunakan akuades setiap kali akan memasukkan sampel lain. Pada salah satu sumur, ditempatkan sebanyak 7 L protein marker. Standar yang digunakan adalah Spectra Multicolor Broad Range Protein Ladder yang mengandung 10 protein dengan berat molekul 10-260
kDa.
Running SDS-PAGE
Katup elektroda dipasang dengan arus mengalir ke anoda. Sumber listrik dinyalakan dan dijaga konstan pada 70 V. Running dilakukan selama 180 menit
sampai migrasi dye tersisa sekitar 0.5 cm dari dasar. Setelah selesai, aliran listrik
dimatikan dan katup elektroda dilepaskan, lalu plat gel dipindahkan dari elektroda.
Pewarnaan gel
Gel diangkat dari slab dan dipindahkan ke dalam wadah tertutup yang telah
berisi pewarna coomasie brilliant blue G-250 (kurang lebih 20 mL). Kemudian
digoyanggoyangkan sesekali selama 5-10 menit.
Destaining gel
Gel diangkat dan dicuci menggunakan akuades beberapa kali. Larutan penghilang warna ditambahkan (destaining solution) dan digoyangkan sesekali
Penentuan berat molekul protein yang terpisahkan
Berat molekul protein sampel dapat dihitung dari persamaan regresi yang diperoleh dari kurva hubungan antara mobilitas relatif protein marker (Rf) dan logaritma berat molekul protein marker. Mobilitas relatif protein dihitung dengan membandingkan jarak migrasi protein, diukur dari garis awal separating gel
sampai ujung pita protein, dan jarak migrasi tracking dye. Mobilitas relatif
tersebut dirumuskan sebagai berikut:
� = �
�
3.4.4 Pengujian Alergenisitas
a. Preparasi Serum Penderita Alergi (Zakaria et al. 1998)
Serum diambil dari seorang responden penderita alergi kacang kedelai yang telah diseleksi dari tiga penderita alergi pada penelitian sebelumnya. Responden diambil darahnya oleh tenaga medis sebanyak 20 mL. Darah segera diinkubasi pada 37°C selama 30 menit, lalu disentrifus 1250 g selama 20 menit. Sehingga diperoleh serum yang mengandung IgE antiprotein kedelai dan disimpan pada -20°C. Untuk kontrol negatif digunakan serum dari seorang responden yang tidak menderita alergi.
b. Pengujian Respon Antigenik menggunakan Immunoblotting (Bollag dan Edelstein 1991)
Prinsip immunoblotting adalah prinsip ikatan antigen-antibodi komplek. Protein pada membran nitroselulosa dianggap sebagai antigen. Antibodi primer (serum) adalah antibodi yang dapat berikatan secara spesifik dengan antigen pada nitroselulosa. Ikatan dari antigen-antibodi komplek ditandai dengan warna coklat pada antigen-antibodi tersebut.
Gel hasil elektroforesis yang tidak diwarnai ditransfer ke membran nitroselulosa (0.45 µm). Gel dan membran nitroselulosa disusun dalam alat
transblotting (metode sandwich), lalu diisi dengan bufer. Blotting dilakukan
selama 1.5 jam pada arus konstan 0.25 A. Membran dicuci dengan TBS selama 10 menit, lalu diblok dengan BSA 2% dalam TBS selama 2 jam pada suhu kamar. Membran nitroselulosa dicuci dengan TBS dan ditambah serum subyek alergi yang diencerkan 5 kali dalam TBS. Selanjutnya diinkubasi selama 1 jam pada suhu kamar. Pencucian dilakukan lagi dengan TBS, lalu diberi antibodi IgG tikus anti IgE manusia yang berlabel enzim HRP (pengenceran 1:3000 dalam TBS) kemudian diinkubasi selama 1 jam sambil digoyang. Hasil deteksi kompleks protein alergen dengan serum subyek akan terlihat setelah diberikan substrat DAB. Deteksi positif ditandai dengan terjadinya kompleks berwarna coklat pada kertas nitroselulosa.
c. Pengujian Reaktivitas Imunologi menggunakan ELISA (Rupa et al. 2008) ELISA mengukur IgE spesifik yang dapat berikatan dengan alergen dan dideteksi menggunakan antibodi yang terkonjugasi dengan enzim dan menggunakan substrat berwarna (Cordle 2004). Optical Density (OD) kemudian
Pembuatan blanko
Sebanyak 200 L BSA 3% dalam PBS dilapiskan ke dalam lempeng mikrotiter dan diinkubasi selama 1.5 jam pada 37°C. Selanjutnya lempeng mikrotiter dicuci 3 kali dengan PBST (PBS yang mengandung 0.05% tween-20) sebanyak 200 L/sumur, lalu ditambah IgG tikus anti IgE manusia yang berlabel HRP sebanyak 100 L/sumur yang sebelumnya telah diencerkan 1μ3000 dalam PBS pH 7.2. Inkubasi dilakukan selama 1 jam pada 37°C, lalu lempeng mikrotiter dicuci dengan PBST (200 L/sumur) sebanyak 3 kali, kemudian ditambah substrat DAB sebanyak 100 L/sumur, dan diinkubasi lagi selama 20 menit pada 37°C. OD diukur dengan menggunakan ELISA reader pada panjang gelombang 450 nm. Penentuan sifat alergenisitas isolat protein kedelai
Sebanyak 100 L/sumur protein sampel (100 g/mL) dilapiskan pada lempeng mikrotiter, kemudian diinkubasi pada suhu 4°C selama 18 jam dan dicuci 3 kali dengan PBST sebanyak 200 L/sumur. Selanjutnya, lempeng mikrotiter diblok dengan larutan BSA 3% dalam PBS sebanyak 200 L/sumur, dan diinkubasi selama 1.5 jam pada suhu 37°C. Setelah itu, lempeng mikrotiter dicuci dengan PBST (200 L/sumur) sebanyak 3 kali. Serum (antibodi primer) yang telah diencerkan 1:5 dalam PBS ditambahkan pada lempeng mikrotiter sebanyak 100 L/sumur, selanjutnya diinkubasi selama 2 jam pada suhu 37°C. Setelah inkubasi, lempeng mikrotiter dicuci dengan PBST (200 L/sumur) sebanyak 3 kali. Penambahan antibodi sekunder (IgG tikus anti IgE manusia yang berlabel HRP) dilakukan setelah mengencerkannya (1:3000) dalam PBS pH 7.2. Antibodi sekunder yang ditambahkan ke dalam lempeng mikrotiter sebanyak 100 L/sumur, lalu diinkubasi selama 1 jam pada 37°C, kemudian dicuci dengan PBST (200 L/sumur) sebanyak 3 kali dan ditambah substrat DAB sebanyak 100 L/sumur. Selanjutnya lempeng mikrotiter diinkubasi lagi selama 20 menit pada suhu 37°C. Hasil positif ditandai dengan timbulnya warna biru. Reaksi dihentikan dengan menggunakan H2SO4 2 M sebanyak 50 µL/sumur sehingga larutan akan
berubah warna menjadi kuning. OD diukur dengan menggunakan ELISA reader pada panjang gelombang 450 nm. Persen penurunan reaktivitas digitung dengan rumus berikut (Frias et al. 2008):
% � = � − �
4
HASIL DAN PEMBAHASAN
4.1 Isolat Protein Kacang Kedelai
Isolasi protein sampel kacang kedelai GMO dan non-GMO dilakukan menggunakan metode pengaturan pH. Sebelum proses isolasi, dilakukan penghilangan lemak pada kacang kedelai menggunakan heksana agar lemak yang terdapat dalam kacang kedelai tidak mengganggu proses isolasi protein. Rendemen isolat protein kacang kedelai GMO dan non-GMO dari proses isolasi adalah 18.51 % dan 20.74%. Rendemen isolat protein didapatkan berdasarkan berat kedelai awal dengan berat akhir isolat yang diperoleh. Pada Tabel 4 dapat dilihat hasil pengujian terhadap kadar protein pada sampel dan isolat protein kedelai.
Isolat protein kedelai adalah produk protein kedelai yang memiliki protein lebih dari 90% (berat kering). Isolat protein kedelai telah banyak diterapkan di industri pangan karena memiliki nilai gizi dan sifat fungsional yang diinginkan (Chen et al. 2011). Kadar protein isolat protein kedelai (IPK) GMO dan
non-GMO yang diperoleh berturut-turut sebesar 90.13% dan 90.37%. Isolat protein kedelai yang diperoleh pada penelitian ini dapat dikategorikan sebagai isolat protein karena mengandung lebih dari 90% kadar protein di dalamnya. Wu et al.
(2009) melakukan isolasi protein kacang tanah dengan beberapa cara presipitasi yang berbeda. Dari penelitian tersebut ditunjukkan bahwa gabungan alkali dan isoelektrik presipitasi menghasilkan kadar protein yang tinggi serta memiliki kelarutan protein, kapasipas pembuat busa dan stabilitas protein yang baik.
Tabel 4 Rendemen dan kadar protein isolat protein kedelai
Parameter Kedelai GMO Kedelai non-GMO
Rendemen Isolat Protein (%) 18.51±1.19a 20.74±1.02b Kadar protein kedelai (%BK) 36.06±0.89a 39.71±0.39b Kadar protein isolat (%BK) 90.13±0.13a 90.37±0.18a aAngka-angka pada baris yang sama yang diikuti oleh huruf yang berbeda menunjukkan perbedaan nyata pada (p<0.05)
4.2 Karakteristik Isolat Protein Kacang Kedelai
a. Derajat Glikasi
Alergenisitas protein kedelai dapat diturunkan dengan melakukan beberapa proses untuk mengubah struktur alergen dan membuat alergen lebih tidak dikenali antibodi. Perlakuan panas, fermentasi, hidrolisis enzimatik, modifikasi genetik, ekstrusi dan konjugasi gula telah dipelajari sebagai strategi untuk menurunkan alergenitas protein kedelai (Wilson et al. 2005).
gula yang berikatan dengan asam amino dapat merubah struktur epitop dari protein alergen sehingga dapat menurunkan sisi pengenalan IgE. Penurunan inilah yang dapat mengurangi atau bahkan menghilangkan sifat alergen protein kacang kedelai.
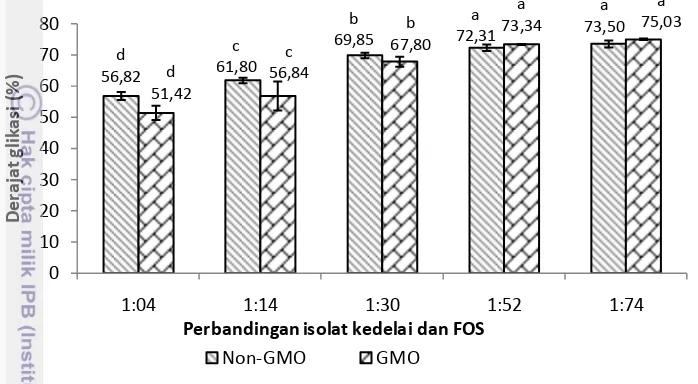
Gambar 6 Derajat glikasi isolat protein kedelai GMO dan non-GMO setelah ditambahkan FOS. aAngka-angka yang diikuti oleh huruf yang berbeda
menunjukkan perbedaan nyata pada (p<0.05) pada jenis kedelai yang sama.
Reaksi glikasi yang terjadi dengan FOS dapat dilihat pada Gambar 7. Lisin digunakan karena lisin merupakan asam amino pembatas dan memiliki dua amino grup selain histidin dan arginin sehingga dapat beraksi lebih cepat serta banyak terdapat pada kacang-kacangan. Pada Gambar 6 dapat dilihat hasil pengukuran besaran glikasi yang terjadi. Pada perlakuan terendah yaitu rasio 1:4 derajat glikasi yang dihasilkan adalah 56.82% pada IPK non-GMO dan 51.42% pada IPK GMO. Pada perlakuan tertinggi dengan rasio 1:74 didapat nilai 75.03% dan 73.50% masing-masing untuk IPK GMO dan non-GMO. Dari data yang diperoleh dapat dilihat bahwa penambahan rasio FOS berbanding lurus dengan derajat glikasi yang diperoleh, karena jumlah gula pereduksi yang dapat digunakan semakin banyak. Apabila telah mencapai titik tertentu maka peningkatan tersebut akan berhenti (Van de Lagemaat et al. 2007).
Bu et al. (2010) melakukan glikasi pada konjugasi β-lactoglobulin dan
glukosa dengan mengukur perubahan warna pada panjang gelombang 420 nm. Peningkatan warna coklat dapat dilihat dengan bertambahnya suhu, lama reaksi dan banyaknya glukosa yang ditambahkan. Peningkatan warna coklat menunjukkan bahwa reaksi glikasi yang terjadi semakin tinggi.
Pengikatan atau konjugasi protein dengan gula pereduksi merupakan salah satu cara yang dapat digunakan untuk menurunkan tingkat alergenisitas suatu produk pangan. Bielikowicz et al. (2010) melaporkan bahwa glikasi pada protein
Pengaruh glikasi isolat protein kedelai dengan penambahan FOS sebagai gula pereduksi memiliki pengaruh dalam meningkatkan kelarutan, kemampuan emusi dan dari segi fisikokimia dapat meningkatkan kemampuan sifat antioksidan dengan cara mengikat radikal dan mencegah oksidasi LDL. Selain itu, pengaruh penambahan FOS yang memiliki kemampuan sebagai prebiotik dapat menurunkan daya cerna protein dari isolat protein kedelai, namun tidak secara signifikan yakni hanya sekitar 4% dari isolat kacang kedelai (Mesa et al. 2008).
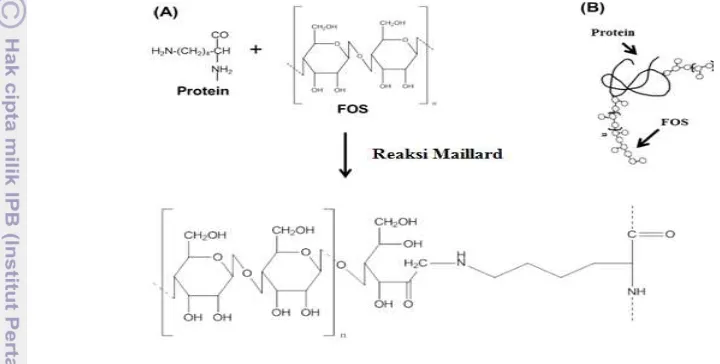
Gambar 7 Skema representasi kondensasi protein dan FOS melalui reaksi Maillard (A) dan konjugat yang dihasilkan (B) (Munialo et al. 2014)
b. Grup Amino Bebas
Analisis protein umumnya bertujuan untuk mengukur kadar protein dalam bahan pangan. Analisis protein dapat dilakukan antara lain dengan metode Kjeldahl, Lowry, Biuret, Bradford, dan turbidimetri. Metode Kjeldahl mengukur seluruh kadar nitrogen pada sampel dengan cara destruksi, destilasi dan titrasi sehingga dapat mengukur nitrogen yang bukan berasal dari protein. Metode Lowry, Biuret, Bradford dan turbidimetri merupakan metode kolorimetrik. Metode Biuret mengukur interaksi antara reagen dan ikatan peptida, metode turbidimetri berdasarkan tingkat kekeruhan setelah pemberian trikloroasetat. Metode Lowry dan Bradford merupakan metode kolorimetri yang lebih sensitif yang dapat mengukur sampel pada konsentrasi yang lebih rendah. Metode Lowry mengombinasikan pereaksi biuret dengan pereaksi lain (Folin-Ciocalteau phenol) yang dapat mengukur pembentukan kompleks antara Biuret dengan ikatan peptida dan Folin-Ciocalteu. Namun, dapat terjadi kesalahan pengukuran dengan keberadaan polifenol yang juga dapat bereaksi dengan reagen Folin-Ciocalteu sehingga dapat berkontribusi pada pengukuran (Redmile-Gordon et al. 2013).
Analisis kadar protein menggunakan Bradford menjadi pengujian kolorimetri yang banyak dipilih dikarenakan memiliki sensitivitas yang tinggi, spesifik serta analisis yang cepat. Pengujian Bradford tergantung pada interaksi antara residu asam amino dasar (terutama arginin, lisin dan histidin) dengan
Coomassie brilliant blue G-250 (CBB) pada matriks asam. Ikatan CBB dengan
protein akan menghasilkan warna biru (Redmile-Gordon et al. 2013). Dari
grup amino bebas pada sampel yang telah diberi perlakuan FOS. Hal ini disebabkan FOS telah berikatan dengan residu asam amino misalnya lisin, sehingga terjadi penurunan lisin bebas yang dapat di ikat oleh CBB saat pengujian. Dengan berkurangnya residu lisin bebas tersebut maka konsentrasi grup amino bebas pada sampel akan berkurang. Hal ini sesuai dengan hasil pengujian derajat glikasi sampel, bahwa semakin meningkatnya derajat glikasi maka akan menurunkan konsentrasi protein sampel.
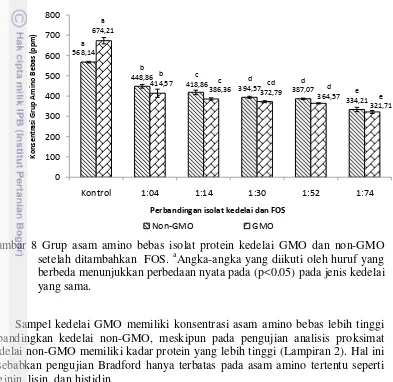
Gambar 8 Grup asam amino bebas isolat protein kedelai GMO dan non-GMO setelah ditambahkan FOS. aAngka-angka yang diikuti oleh huruf yang
berbeda menunjukkan perbedaan nyata pada (p<0.05) pada jenis kedelai yang sama.
Sampel kedelai GMO memiliki konsentrasi asam amino bebas lebih tinggi dibandingkan kedelai non-GMO, meskipun pada pengujian analisis proksimat kedelai non-GMO memiliki kadar protein yang lebih tinggi (Lampiran 2). Hal ini disebabkan pengujian Bradford hanya terbatas pada asam amino tertentu seperti arginin, lisin, dan histidin.
Jiang et al. (2013) yang melakukan konjugasi tripeptida dengan ribosa
melaporkan hasil jumlah asam amino bebas terus menurun selama waktu pemanasan. Penurunan keseluruhan sebesar 84.3% gugus amino bebas setelah 8 jam perlakuan pemanasan. Hal ini menunjukkan bahwa kelompok α-amino dari tripeptida semakin terikat pada gugus karbonil.
c. Profil Berat Molekul Protein berdasarkan Elektroforesis SDS-PAGE Elektroforesis merupakan analisis untuk memeriksa pergerakan molekul bermuatan dalam medan listrik. Elektroforesis mampu menganalisis dan memurnikan berbagai jenis biomolekul terutama protein. Dalam teknik ini, gel terpolimerisasi seperti matriks yang dapat digunakan sebagai media pendukung. Migrasi molekul dipengaruhi oleh beberapa parameter, yaitu arus listrik, ukuran
matriks gel, bentuk, muatan dan komposisi kimia dari molekul agar dapat terpisah (Roy et al. 2012).
Hasil elektroforesis SDS-PAGE kacang kedelai GMO menunjukkan adanya 11 pita protein (Gambar 9) yang memiliki berat molekul antara 4.80 kDa-145.8 kDa dengan beberapa pita protein yang cukup tebal yaitu 103.3 kDa, 51.1 kDa dan 19.1 kDa. Kacang kedelai non-GMO memiliki 9 pita protein (Gambar 10) yang memiliki berat molekul antara 4.8 kDa-103.3 kDa. Ketebalan pita protein menunjukkan bahwa pada pita tersebut terkandung konsentrasi protein yang tinggi, namun belum tentu menunjukkan bahwa pita tersebut merupakan protein alergen. Sitorus (2014) melaporkan hasil elektroforesis SDS-PAGE isolat kacang kedelai memiliki 8 pita protein dengan berat molekul antara 9.6 kDa-114.7 kDa. Sedangkan Astuti (2012) mendapatkan 7 protein pada kacang kedelai dengan berat molekul antara 20 kDa-83.7 kDa. Hal ini dapat disebabkan karena perbedaan sampel kacang kedelai yang digunakan seperti varietas hingga tempat tumbuh.
Kedelai GMO kontrol
GMO 1:4 GMO 1:14 GMO 1:30 GMO 1:52 GMO 1:74
Gambar 9 Profil berat molekul protein kacang kedelai GMO sebelum dan sesudah glikasi
Proses glikasi dengan FOS merubah profil berat molekul protein kedelai baik GMO maupun non-GMO yang dapat dilihat pada Gambar 9 – 10. Pada kedelai GMO dan non-GMO yang telah terglikasi terdapat beberapa protein yang tidak ditemui seperti pada kedelai kontrol. Dari hasil elektroforesis dapat dilihat bahwa jumlah FOS yang ditambahkan tidak berpengaruh terhadap pita protein, hal ini dapat dilihat bahwa pada konsentrasi yang paling kecil telah dapat merubah pita protein kedelai.
dengan galaktomanan dan kitosan menghasilkan pola elektroforesis yang lemah pada protein yang terglikasi.
Pada gambar 9 juga dapat dilihat protein alergen yang masih terdeteksi setelah glikasi yaitu Gly m BD 68K (69.7 kDa), alergen dari fraksi whey protein (19.1 kDa) dan alergen methionine rich protein (12.4 kDa). Pada protein kacang
kedelai GMO terdapat 5 pita protein yang hilang akibat glikasi yaitu dengan berat molekul 10.3 kDa; 58.3 kDa; 82.8 kDa; 126.1 kDa dan 145.8 kDa. Protein pada 10.3 kDa merupakan protein alergen dengan kandungan metionin yang tinggi (Amnuaycheewa dan Elvira 2010) dengan berat molekul antara 8-12 kDa. Glikasi juga dapat menghilangkan salah satu protein alergen mayor yaitu pada 58.3 kDa yang merupakan subunit αdari β-conglycinin yaitu Gly m BD 60K. β-conglycinin dikenal sebagai protein cadangan utama yang mencakup tiga subunit yaitu α (~67 kDa ), α' (~71 kDa ) dan β (~50 kDa) (Ogawa et al. 2000). Alergen mayor adalah
alergen yang dapat berikatan dengan IgE dari lebih 90% penderita alergi pangan spesifik (Mills et al. 2003). Sedangkan protein dengan berat molekul 82.8 kDa;
126.1 kDa dan 145.8 kDa dapat merupakan gabungan dari beberapa subunit protein alergen kedelai sehingga memiliki berat molekul yang cenderung lebih tinggi. Berat molekul protein yang terdeteksi pada kedelai GMO disajikan pada Tabel 5 dibawah ini.
Tabel 5 Berat molekul protein kedelai GMO sebelum dan sesudah glikasi BM sebelum glikasi BM sesudah glikasi Alergen
145.8 - -
12.4 12.4 Methionine rich protein
10.3 - Methionine rich protein
4.8 4.8 -
alergen Gly m Bd 60K yang juga merupakan subunit dari β – conglycinin Ogawa
et al. (2000). β – conglycinin memiliki berat molekul antara 140-180 kDa yang
terdiri dari 3 subunit (Cordle 2004).
Kedelai
non-Gambar 10 Profil berat molekul protein kacang kedelai non-GMO sebelum dan sesudah glikasi
Tabel 6 Berat molekul protein kedelai non-GMO sebelum dan sesudah glikasi BM sebelum glikasi BM sesudah glikasi Alergen
103.3 103.3 -
10.3 - Methionine rich protein
4.8 4.8 -
sedangkan kacang kedelai yang diberi perlakuan pemanasan hanya memiliki 2 sampai 6 pita protein.
Menurut Bielikowicz et al. (2010) glikasi yang dilakukan dengan
penambahan gula pereduksi dapat mengurangi jumlah dan ketebalan pita protein pada pola elektroforesis jika dibandingkan perlakuan yang hanya dengan pemanasan saja. Reaksi glikasi isolat protein kedelai dengan gum akasia membentuk konjugat protein-polisakarida yang memberikan pola elektroforesis dengan pita yang lebar dan tebal diantara stacking gel dan separating gel. Hal ini diduga disebabkan oleh konjugat dengan berat molekul tinggi tidak bisa masuk ke dalam stacking gel (Mu et al. 2011). Konjugat yang memiliki berat molekul tinggi
ini kurang dapat berpenetrasi ke dalam separating gel, untuk itu perlu dilakukan verifikasi. Verifikasi profil elektroforesis dapat dilakukan dengan menggunakan protein standar dengan berat molekul tinggi yaitu pada kisaran 30-460 kDa. Dengan demikian maka perubahan profil eketroforesis yang ditunjukkan dengan jumlah dan berat molekul pita protein pada penelitian ini disebabkan oleh faktor pengolahan dan proses glikasi.
4.3 Sifat Alergenisitas
a. Respon Antigenik Isolat Protein Terglikasi
Immunoblotting merupakan teknik pengujian alergenisitas secara kualitatif yang dapat melihat pita protein yang dapat menyebabkan alergi. Teknik immunoblotting dilakukan dengan menransfer hasil elektroforesis yang belum diwarnai pada membran nitroselulosa serta menggunakan serum penderita alergi yang kemudian akan mengenali pita protein yang mengandung alergen. Pita berwarna coklat menunjukkan bahwa protein alergen berikatan dengan IgE serum penderita alergi.
Dari hasil immunoblotting kacang kedelai GMO (Gambar 11) dapat dilihat terdapat 9 protein alergen. Pada hasil elektroforesis terdapat 11 pita protein (Gambar 9), dengan demikian 2 protein tidak terdeteksi sebagai protein alergen yaitu pada berat molekul 145.8 dan 4.8 KDa. Sedangkan pada kacang kedelai non-GMO (Gambar 12) terdapat 8 protein alergen dari 9 protein pada hasil elektroforesis. Protein yang tidak terdeteksi sebagai protein alergen pada kedelai non-GMO sama seperti protein kedelai GMO yaitu dengan berat molekul 4.8 KDa.
Proses pengolahan pangan yang melibatkan reaksi glikasi dapat menurunkan tingkat alergenisitas suatu bahan pangan. Hal ini terbukti dari hasil penelitian ini yang dapat dilihat pada Gambar 9 untuk kedelai GMO dan Gambar 10 untuk kedelai non-GMO. Proses glikasi dapat mengurangi protein alergen pada kedelai GMO dan non-GMO. Dari Gambar 12 dan Gambar 13 dapat dilihat bahwa perlakuan terkecil yaitu 1:4 sudah dapat menurunkan alergenisitas kacang kedelai, karena dapat dilihat bahwa tidak terdapat perbedaan hasil dari berat molekul pita yang mengandung alergen. Hasil pengujian immunoblotting ini juga menunjukkan hal yang sama dengan pita yang terdapat pada elektroforesis yaitu tidak ada perbedaan antara perlakuan terkecil hingga terbesar. Bielikowicz et al. (2010)
tanpa gula pereduksi namun terjadi penurunan reaktivitas pada sampel yang terglikasi dengan penambahan gula pereduksi.
Kedelai GMO kontrol
GMO 1:4 GMO 1:30 GMO 1:74
Gambar 11 Profil protein alergen kacang kedelai GMO sebelum dan sesudah glikasi
Setelah glikasi pada kedua protein kedelai ditemukan 2 pita protein alergen dengan berat molekul berbeda. Pada kedelai GMO protein yang masih dapat berikatan dengan serum adalah protein dengan berat molekul 19.1 kDa dan 126.1 kDa. Alergen 19.1 kDa (Amnuaycheewa dan Elvira et al. 2010) merupakan fraksi
whey pada protein kedelai sedangkan protein dengan 126.1 kDa merupakan protein yang memiliki berat molekul >70 kDa namun memiliki sisi protein yang dapat dikenali oleh antibodi. Protein ini sama seperti protein alergen yang masih terdeteksi pada protein kedelai non-GMO yang telah terglikasi yaitu 103.3 kDa. Protein lainnya yang juga terdeteksi pada protein kedelai non-GMO yang telah terglikasi adalah dengan berat molekul 10.3 kDa yang merupakan protein alergen dengan kandungan metionin yang tinggi (Amnuaycheewa dan Elvira 2010).
Kedelai
Gambar 12 Profil protein alergen kacang kedelai non-GMO sebelum dan sesudah glikasi
Protein yang masih terdeteksi setelah dikonjugasi dengan FOS menunjukkan bahwa protein ini merupakan jenis protein yang stabil terhadap pengolahan sehingga protein tersebut masih dapat menimbulkan reaksi alergi. Wilson et al.
(2005) menyebutkan bahwa denaturasi, hidrolisis atau konjugasi dapat menurunkan alergenisitas kedelai secara keseluruhan terutama alergen P34 pada kedelai. Namun, tidak ada satupun perlakuan tunggal yang benar-benar dapat menghilangkan alergenisitas P34, tetapi kombinasi perlakuan mungkin dapat menunjukkan hasil yang lebih baik dari pada hanya satu perlakuan. Diduga bahwa gabungan perlakuan dapat memberikan hasil yang lebih baik dari pada perlakuan tunggal.
Salah satu contoh pengolahan yang dapat dikombinasikan dengan glikasi adalah high hydrostatic pressure (HHP). HHP merupakan teknik pengolahan
pangan yang dapat menginaktivasi mikroorganisme dengan tetap menjaga karakteristik bahan pangan. Li et al. (2012) menggunakan teknik pengolahan HHP
dalam pembuatan susu formula berbasis isolat protein kedelai. Susu formula berbasis isolat protein kedelai ini diproduksi bagi konsumen yang menderita alergi susu sapi, namun 17-47% penderita alergi susu sapi juga memiliki alergi terhadap kacang kedelai (El-Agamy 2007). Untuk itu perlu dilakukan pengolahan yang dapat menurunkan alergenisitas kacang kedelai. Pada penelitian ini diketahui bahwa penggunaan HHP pada 300 MPa selama 15 menit dapat mengurangi alergenisitas susu formula berbasis isolat protein kedelai sebanyak 48.6%.
b. Reaktivitas Imunologi Kacang Kedelai berdasarkan Uji ELISA
Pada penelitian ini dapat dilihat perbedaan reaksi IgE terhadap kedelai GMO dan non-GMO (Gambar 13) karena adanya perbedaan OD (optical Density) antara
dikembangkan dengan memasukkan gen dari kacang merah menciptakan protein yang bertindak sebagai pestisida yang bersifat alergen pada tikus. Pengamatan ini menunjukkan bahwa reaksi alergi yang sama mungkin terjadi pada orang yang mengkonsumsi produk GMO ini (Mahgoub 2015). Perbedaan ini belum dapat membuktikan bahwa kedelai GMO memiliki alergenisitas yang lebih tinggi daripada kedelai non-GMO karena sampel yang digunakan pada penelitian bukan merupakan kedelai yang memiliki varietas yang sama, sehingga perbedaan ini juga dapat disebabkan oleh perbedaan varietas dari sampel yang digunakan. Pada penelitian dilakukan pendekatan dengan menggunakan sampel kedelai yang banyak beredar di pasaran dikarenakan sulit mendapatkan sampel kedelai GMO dan non-GMO dengan varietas yang sama.
Dari hasil pengujian Elisa juga dapat dilihat bahwa perlakuan FOS dapat menurunkan tingkat alergenisitas kedua sampel protein kedelai namun tidak dapat menghilangkannya secara keseluruhan. Hal ini karena OD sampel yang terglikasi lebih tinggi dibandingkan OD serum kontrol negatif atau serum bukan penderita alergi. Pada Gambar 13 dapat dilihat juga bahwa peningkatan FOS yang diberikan tidak menunjukkan hasil yang berbeda nyata (p<0.05) baik untuk protein kedelai GMO maupun non-GMO, hasil ini sesuai dengan pengujian immunoblotting yang menunjukkan pita alergi yang sama pada semua perlakuan.
Bielikowicz et al. (2010) melakukan konjugasi protein gandum dan glukosa
dengan penyimpanan selama tiga hari pada suhu 60 °C menunjukkan imunoreaktivitas yang lebih rendah dibandingkan perlakuan kontrol yaitu dengan perlakuan penyimpanan yang sama namun tanpa glukosa. Faktor pemanasan saja (kontrol) pada penelitian tersebut justru menaikkan imunoreaktivitas dari protein gandum mentah. Hal ini disebabkan sebagian besar protein alergen yang ada memiliki epitop linear yang justru akan terekspos akibat proses pemanasan.
Pengujian alergi produk GMO merupakan kunci dalam pengujian keamanan untuk produk GMO (Fernandez et al. 2013). Telah banyak penelitian baik secara in vivo maupun in vitro yang menunjukkan bahwa tidak terdapat perbedaan
alergenisitas antara produk GMO dan non-GMO. Brake dan Evenson (2004) melakukan pengujian secara in vivo menggunakan tikus terhadap efek glikofosfat
toleran pada kedelai menunjukkan bahwa tidak ada dampak kedelai GMO terhadap tikus. Pengujian in vitro dilakukan oleh Kim et al. (2006) pada kedelai
Gambar 13 Reaktivitas imunologi kacang kedelai GMO dan non-GMO. aAngka- angka yang diikuti oleh huruf yang berbeda menunjukkan perbedaan nyata pada (p<0.05) pada jenis kedelai yang sama.
Pada Tabel 7 dapat dilihat persen penurunan alergenisitas dari kacang kedelai GMO dan non-GMO setelah glikasi. Pada kedelai GMO penurunan terbesar dapat dilihat pada perlakuan 1:4 yaitu sebesar 91.69 %, sedangkan pada kedelai non-GMO pada perlakuan 1:14 sebesar 87.07. Jika hasil ini dibandingkan dengan hasil immunoblotting dapat dikatakan bahwa pada perlakuan 1:4 sudah dapat menurunkan reaktivitas kacang kedelai baik itu GMO maupun non-GMO. Tabel 7 Persen penurunan reaktivitas (OD) serum penderita alergi terhadap isolat
kacang kedelai GMO dan non-GMO setelah proses glikasi
Perlakuan GMO Non-GMO
IPK:FOS (1:4) 92.15±3.52 82.02±2.68
IPK:FOS (1:14) 90.61±1.35 86.94±7.24
IPK:FOS (1:30) 89.96±1.19 81.88±5.03
IPK:FOS (1:52) 85.06±3.25 75.11±3.36
IPK:FOS (1:74) 81.79±4.63 74.35±7.24
Mekanisme penurunan alergenisitas akibat glikasi telah banyak dikemukakan, Yoshida et al. (2005) menyampaikan bahwa konjugasi β
-Lactoglobulin dan oligosakarida dapat mengurangi imunogenisitas dengan melindungi epitop sel B. APC memproses antigen setelah dimasukkan endosom dan kemudian dipresentasikan. Oleh karena itu, ketahanan antigen terhadap protease endosomal akan sangat penting untuk menentukan imunogenisitas antigen. Proses glikasi dapat menurunkan ketahanan antigen terhadap protease endosomal, yaitu apabila semakin rendah ketahanannya maka memiliki alergenisitas yang rendah. Selanjutnya Yoshida et al. (2005) juga
menambahkan bahwa kemungkinan mekanisme lainnya dapat menurunkan alergenisitas pada antigen dengan keberadaan konjugat. APC biasanya memakan antigen pada fagositosis. Sakarida pada konjugasi protein diduga mengganggu proses fagositosis sehingga menyebabkan berkurangnya alergenisitas. Hal serupa juga disampaikan oleh Bielikowicz et al. (2010) yang melakukan konjugasi
gugus protein dapat menutupi (masking) beberapa epitop sehingga mengurangi
imunoreaktivitas sampel yang terglikasi, meskipun pengenalan epitop baru tidak dapat diabaikan. Bielikowicz et al. (2012) melaporkan bahwa globulin 7S pada
kacang polong yang terglikasi mengakibatkan penurunan afinitas terhadap antibodi yang menyebabkan keterbatasan sifat-sifat alergenisitasnya. Di sisi lain, globulin 7S yang terglikasi dapat menstimulasi pematangan sel Th0 ke Th2 yang juga dapat berpartisipasi dalam proses peningkatan alergi pangan. Penurunan sitotoksisitas dan transportasi melalui Caco-2 monolayer dari globulin 7S kacang polong terglikasi dapat menurunkan alergenisitas yang disebabkan oleh keterbatasan transportasi ke sel sistem kekebalan tubuh atau sel imun.
Gambar 14 Pengaruh pengolahan pada integritas epitop protein (Nowak-Wegrzyn dan Fiocchi 2009)