POTENSI EKSTRAK BIOAKTIF BAKTERI SIMBION SPONS
Spirastrella
sp
DAN
Plakinastrella
sp SEBAGAI ANTELMINTIKA
TERHADAP CACING TRICHOSTRONGYLIDAE PARASIT DOMBA
MUHAMMAD REZA FAISAL
C551130221
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Ekstrak Bioaktif Bakteri Simbion Spons Spirastrella sp dan Plakinastrella sp sebagai Antelmintika terhadap Cacing Trichostrongylidae Parasit Domba adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2015
Muhammad Reza Faisal
RINGKASAN
MUHAMMAD REZA FAISAL. Potensi Ekstrak Bioaktif Bakteri Simbion Spons Spirastrella Sp dan Plakinastrella Sp sebagai Antelmintika terhadap Cacing Trichostrongylidae Parasit Domba. Dibimbing oleh MUJIZAT KAWAROE dan FADJAR SATRIJA
Pemanfaatan senyawa bioaktif yang dihasilkan oleh spons laut telah dibuktikan dapat digunakan sebagai obat-obatan. Salah satu pemanfaatan bioaktif yang dihasilkan oleh spons adalah sebagai antelmintka. Infeksi yang disebabkan oleh cacing Trichostrongylidae (nematoda) menyebabkan kerugian terhadap domba. Telah diketahui terdapat resistensi pada Trichostrongylidae terhadap antelmintika. Dengan demikian dibutuhkan antelmintika alternatif alami yang dapat mengatasi permasalahan tersebut. Spons memiliki simbion mikroorganisme seperti bakteri yang terdapat di dalam tubuhnya. Telah diketahui bahwa bakteri simbion dapat menghasilkan senyawa bioaktif yang serupa dengan inangnya. Hal ini efektif digunakan sehingga dapat menghindari eksploitasi terhadap spons di dalam. Pemanfaatan bakteri simbion spons diduga memiliki potensi bioaktif sebagai antelmintika terhadap cacing Trichostrongylidae (Nematoda). Tujuan penelitian ini adalah menentukkan aktivitas ekstrak bakteri simbion spons laut sebagai antelmintika terhadap larva nematoda parasit domba. Isolat bakteri simbion spons terbaik dapat ditentukan sebagai antelmintika larva nematoda parasit pada domba.
Metode dalam penelitian ini yaitu dimulai dengan karakterisasi morfologi koloni bakteri, pengamatan kurva pertumbuhan bakteri, ekstraksi bakteri, uji kandungan fitokimia, uji toksisitas Brain Shrimp Lethality Test (BSLT), uji hambatan migrasi larva nematoda. Bakteri simbion spons yang digunakan dalam penelitian ini yaitu S1 dan S2 yang merupakan bakteri yang berasosiasi dengan spons Spirastrella sp. dan Plakinastrella sp. Isolat S1 dan S2 merupakan golongan bakteri Gram positif dengan fase stasioner pertumbuhan pada jam ke 42 untuk S1 dan jam ke-48 untuk S2. Ekstraksi bahan bioaktif yang berasal dari bakteri diekstrak menggunakan pelarut metanol. Rendemen ekstrak metanol yang berasal dari bakteri menghasilkan jumlah rendemen 0.015% dan 0.02%. Ekstrak S1 dan S2 memiliki golongan senyawa triterpenoid. Golongan senyawa flavonoid hanya teridentifikasi pada ekstrak S1. Ekstrak S1 dan S2 memiliki kandungan toksisitas dengan nilai LC50 69.38 µg.ml-1 dan 58.48 µg.m-1. Uji hambatan migrasi
terhadap larva nematoda memiliki potensi dengan nilai LC50 165.63 µg.ml-1 dan
374.91 µg.ml-1. Kedua isolat dapat dibuktikan memiliki toksisitas terhadap larva A. salina dan larva nematoda Trichostrongylidae walaupun perlakuan kontrol positif dengan menggunakan albendazol memiliki nilai hambat yang tertinggi dibandingkan kedua esktrak isolat bakteri simbion.
SUMMARY
MUHAMMAD REZA FAISAL. Potential of Bacteria Derived Marine Sponge
Spirastrella sp and Plakinastrella sp Extract As Anthelmintic of
Trichostrongylidae Sheep Parasite. Supervised by MUJIZAT KAWAROE dan FADJAR SATRIJA
Utilization of bioactive compound derived from marine sponges was proved as drugs. One of bioactive compound utilization was Anthelmintic. Infections caused by Trichostrongylidae worms (nematodes) could harmful for sheep. It had known that Trichostrongylidae could be resistance from Anthelmintic. It was necessary to takes alternatives of natural Anthelmintic then solved of those problems. Sponges had symbiotic microorganisms such as bacteria in their body. It was known that symbiotic bacteria produced similar bioactive compounds with their host. It was effective to avoid of marine sponges exploitation. Utilization of bacteria derived from marine sponges were assumed had potential as Anthelmintic against Trichostrongylidae larvae (nematodes). This study was to determine the activity of extracts of bacteria derived from marine sponges as Anthelmintic against parasitic nematodes (Trichostrongylidae) in sheep. The best of bacteria extract was determine as Anthelmintic against parasitic nematodes in sheep.
The methods of this research were begining with morphology characterization of bacteria colonies, curves of the bacteria growth observation, bacteria isolates extraction, phytochemical screening test, Brain Shrimp Lethality Test (BSLT), Larva Migration Inhibition Assay (LMIA). Sponges symbiotic bacteria that used in this study were S1 and S2 which bacteria derived from
Spirastrella sp. and Plakinastrella sp. Isolates S1 and S2 were Gram Positive bacteria which have a stationary phase of growth at 42 hours (S1) and 48 hours (S2). Extraction of bioactive compounds derived from isolates were using methanol solvent. The yield of methanol extracts derived from isolates were 0.015% (S1) and 0.02% (S2). S1 and S2 extracts were containing group of triterpenoid compounds. Group of flavonoid compounds were only identified by S1 extract. The LC50 toxicity of S1 and S2 extracts was 69.38 μg.ml-1 (S1) and
58.48 μg.ml-1 (S2). Larva Migration Inhibition Assay (LMIA) against parasitic nematodes in sheep had the potential of LC50 for both extracts were 165.63
μg.mL-1
(S1) and 374.91 μg.mL-1 (S2). Both of isolates were proved to have toxicities against A. salina larvae and Trichostrongylidae larvae while positive control treatment using albendazole has the highest value compared for both of symbiotic bacteria extract.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Kelautan
POTENSI EKSTRAK BIOAKTIF BAKTERI SIMBION SPONS
Spirastrella
sp
DAN
Plakinastrella
sp SEBAGAI ANTELMINTIKA
TERHADAP CACING TRICHOSTRONGYLIDAE PARASIT DOMBA
MUHAMMAD REZA FAISAL
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Potensi Ekstrak Bioaktif Bakteri Simbion Spons Spirastrella sp dan
Plakinastrella sp Sebagai Antelmintika terhadap Cacing
Trichostrongylidae Parasit Domba Nama : Muhammad Reza Faisal
NIM : C551130221
Disetujui oleh Komisi Pembimbing
Dr. Ir. Mujizat Kawaroe, M.Si Ketua
drh. Fadjar Satrija, M.Sc, PhD Anggota
Diketahui oleh
Ketua Program Studi Ilmu Kelautan
Dr. Ir. Neviaty P. Zamani, M.Sc
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2014 ini Eksplorasi potensi bioaktif bakteri simbion spons laut sebagai antelmintika.
Selama menjalani perkuliahan hingga terselesaikannya tesis ini, penulis banyak mendapatkan bantuan moral maupun material dari berbagai pihak. Terima kasih penulis ucapkan kepada Ibu Dr Ir Mujizat Kawaroe dan Bapak drh. Fadjar Satria M.Sc, Ph.D selaku pembimbing atas kesabarannya dalam memberikan saran, bimbingan, dukungan dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Penghargaan penulis sampaikan kepada Ibu Meutia Samira Ismet, M.Sc dari Departemen Ilmu dan Teknologi Kelautan IPB, Tim Eksplorasi Spons dan Bakteri Simbion di Pulau Pramuka (Annisa, Era, Novi dan Juraij) yang telah membantu selama pengumpulan data. Penulis juga berterima kasih atas Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) yang diperoleh dari Direktorat Jenderal Pendidikan Tinggi (DIKTI) pada tahun 2013. Terima kasih juga penulis sampaikan kepada Prof. Dr.Ir. Dedi Soedharma, DEA atas kesediaannya sebagai penguji luar komisi atas yang telah memberikan saran dan bimbingan dalam penyempurnaan tesis ini. Penulis menyampaikan terima kasih kepada Dr. Tri Partono M.Sc atas kesediaannya sebagai penguji mutu lulusan program studi Ilmu Kelautan Pascasarjana IPB. Rasa terima kasih penulis ucapkan kepada teman Pascasarjana Ilmu Kelautan 2013 yang telah memberikan saran dalam diskusi perkuliahan. Ungkapan rasa kasih dan hormat disampaikan kepada Ayah (Soejadi), Ibu (Ani Romlah), Saudara (Rizky M.D dan Astri P.A) serta seluruh keluarga atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
METODE 3
Waktu dan Lokasi Penelitian 3
Prosedur Penelitian 3
HASIL DAN PEMBAHASAN 6
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
LAMPIRAN 19
DAFTAR TABEL
1 Karakterisasi morfologi isolat bakteri S1 dan S2 6 2 Skrining fitokimia ekstrak isolat bakteri S1 dan S2 8 3 Persentase mortalitas larva A. salina pada uji toksisitas ekstrak bakteri
S1 dan S2 9
4 Persentase mortalitas larva Trichostrongylidae terhadap ekstrak kasar
S1 dan S2 11
DAFTAR GAMBAR
1 Alur tahapan penelitian 3
2 Pengujian pewarnaan Gram isolat (a) S1 dan (b) S2 6 3 Kurva pertumbuhan isolat bakteri simbion (a) S1 dan (b) S2 7 4 Analisis regresi log konsentrasi dengan probit % mortalitas ekstrak
kasar (a) S1 dan (b) S2 terhadap larva A. salina. 10 5 Analisis regresi log konsentrasi dengan probit % mortalitas ekstrak
kasar (a) S1 dan (b) S2 terhadap larva Trichostrongylidae 12
DAFTAR LAMPIRAN
1 Komposisi medium Zobell Agar (1/2 strength) 19
2 Ekstrak kasar bakteri yang berasosiasi dengan spons S1 (kiri) dan S2
(kanan) telah diencerkan 19
3 Contoh perhitungan rendemen ekstrak bakteri yang berasosiasi dengan
spons 19
4 Uji toksisitas ektrak bakteri simbion spons terhadap larva A. salina 20 5 Contoh perhitungan uji toksisitas ektrak bakteri simbion spons terhadap
larva A. salina 20
6 Dokumentasi pengamatan larva A.salina setelah inkubasi 24 jam 20 7 Uji hambatan migrasi larva (Larval Migration Inhibition Assay)
nematoda domba 21
8 Uji hambatan Non-migrasi larva (Larval Migration Inhibition Assay)
nematoda domba 21
9 Contoh perhitungan uji hambatan migrasi larva (Larval Migration
Inhibition Assay) nematoda domba 22
10 Dokumentasi kultur larva nematoda dan uji hambatan migrasi larva
1
PENDAHULUAN
Latar Belakang
Spons adalah invertebrata laut yang termasuk dalam Filum Porifera. Kelas Demospongiae merupakan kelompok spons terdominan dibandingkan dengan lainnya (Romimohtarto dan Juwana 1999). Spons menjadi perhatian utama dalam berbagai riset mengenai senyawa bioaktif (Harper et al. 2001; Taylor et al. 2007). Senyawa bioaktif yang dihasilkan berasal dari mekanisme respon yang diberikan oleh spons dalam menyikapi perubahan baik terhadap lingkungan maupun ancaman predator. Taylor et al. (2007) menyatakan spons telah menjadi penghasil mayoritas senyawa bioaktif dari laut dengan lebih dari 200 senyawa metabolit baru dilaporkan tiap tahunnya. Spons sebagai filter feeder menghisap air laut yang mengandung berbagai macam mikroorganisme salah satunya bakteri (Ribes et al.
2003; Yahel et al. 2003).
Jumlah bakteri yang terkandung dalam spons dapat mencapai 40-60% dari total biomassa spons (Lee et al. 2001; Proksch et al. 2002). Fungsi interaksi antara spons dan mikroorganisme tersebut antara lain untuk pertukaran nutrisi, stabilitas struktur spons dan produksi metabolit sekunder (Hentschel et al. 2002). Mikroorganisme yang bersimbiosis dengan invertebrata laut diduga dapat menghasilkan senyawa metabolit sekunder yang sama dengan inangnya (Faulkner
et al. 2000). Pemanfaatan senyawa bioaktif bakteri simbion menjadi solusi dalam pengendalian eksploitasi spons dalam jumlah besar. Eksplorasi terhadap kandungan senyawa metabolit sekunder spons dan bakteri simbionnya telah dilakukan sebagai antibiotik seperti antibakteri, antifungi, antivirus, antikanker dan antelmintika (Mayer and Hamann 2005; Taylor et al. 2007; Thomas et al.
2010; Banoet 2011; Abubakar 2012).
Antelmintika adalah obat yang digunakan untuk melawan infeksi cacing (helminth) dalam tubuh penderita (Dargatz et al. 2000). Saat ini pengobatan secara berkala dengan antelmintika merupakan strategi utama untuk mengendalikan kecacingan pada hewan dan manusia. Kecacingan akibat infeksi cacing parasit saluran pencernaan merupakan salah satu faktor utama yang menjadi kendala dalam peningkatan produksi ternak domba (Ademola dan Ellof 2010; Simon et al.
1988). Estimasi kerugian produksi daging yang diakibatkan dari infeksi tersebut berkisar 7,68-10,56 milyar rupiah per tahun (He et al. 1988). Cacing yang berparasit dalam saluran pencernaan ruminansia didominasi oleh anggota Super Famili Trichostrongylidae (Nematoda) diantaranya Haemonchus, Trichostrongylus dan Cooperia. Berbagai studi menunjukan bahwa telah terjadi resistensi yang meluas dari cacing nematoda pada domba terhadap antelmintika yang beredar di pasar pada saat ini (Waller 1998; Hrckova and Velebny 2013). Hal ini diperkirakan karena intensifitas penggunaan obat cacing yang tinggi dalam satu tahun (5-12 kali) serta pemberian dengan dosis yang tidak tepat (Dargatz et al. 2000).
telah dilakukan untuk mempelajari kemampuan antelmintik dari spons terhadap nematoda Haemonchus contortus pada domba (McDougal et al. 1986; Capon et al.1999). Spons Trachycladus laevispirulife diketahui mampu mengambat perkembangan larva Haemonchus contortus (Vuong et al. 2001). Informasi mengenai eksplorasi senyawa bioaktif mikroorganisme bakteri simbion spons terhadap infeksi nematoda parasitik pada domba belum dilakukan. Penelitian mengenai eksplorasi senyawa bioaktif bakteri simbion spons laut terhadap migrasi larva nematoda pada saluran pencernaan domba diharapkan menjadi antelmintika alternatif yang alami.
Perumusan Masalah
Berdasarkan data di atas maka dapat dirumuskan permasalahan sebagai berikut :
1. Apakah ekstrak bakteri simbion spons dapat menghasilkan golongan senyawa bioaktif yang memiliki khasiat antelmintik ?
2. Apakah ekstrak bakteri simbion spons memiliki bioaktif lebih baik dibandingkan dengan senyawa antelmintik komersial?
Tujuan Penelitian
Tujuan dari penelitian adalah menguji aktivitas ekstrak bakteri simbion spons laut Spirastrella sp. dan Plakinastrella sp. dalam menghasilkan ekstrak kasar bioaktif sebagai antelmintika terhadap larva nematoda gastointestinal domba. Penelitian ini juga menentukan isolat bakteri simbion spons terbaik sebagai antelmintika larva nematoda parasit pada domba.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah dapat menemukan ekstrak bioaktif dari bakteri simbion spons yang potensial sebagai antelminthika. Ekstrak bioaktif dari isolat terbaik yang memiliki pengaruh lebih baik dibandingkan anthelmintik komersial diharapkan sebagai dasar penemuan senyawa antelmintik yang baru dan ramah lingkungan di bidang biomedis
Ruang Lingkup Penelitian
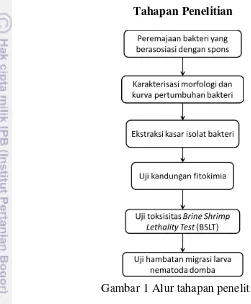
Upaya untuk menangani permasalahan terhadap penggunaan obat sintetis antelmintika yang komersial dan eksploitasi biomassa spons dalam skala besar, maka perlu dilakukan eksplorasi terhadap senyawa bioaktif dari ekstrak bakteri simbion spons sebagai solusi alternatif antelmintika yang ramah lingkungan. Penelitian ini mencakupi peremajaan bakteri yang berasosiasi dengan spons, karakterisasi morfologi dan kurva pertumbuhan bakteri, ekstraksi kasar isolat bakteri, uji kandungan fitokimia, uji toksisitas Brine Shrimp Lethality Test
3
METODE
Penelitian ini merupakan penelitian eksploratif yang terdiri atas eksplorasi perlakuan untuk memanipulasi objek penelitian dan diperlukan kontrol sebagai pembandingnya. Kontrol penelitian yang digunakan yaitu obat sintetis dan objek penelitian yang tidak diberi perlakuan. Penelitian ini terdiri atas beberapa tahap. Tahapan kerja penelitian disajikan pada Gambar 1. Dokumentasi penelitian terlampir pada bab Lampiran.
Tahapan Penelitian
Gambar 1 Alur tahapan penelitian
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan September 2014 – April 2015 di Laboratorium Mikrobiologi Laut, Laboratorium Terpadu Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Helminthologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor dan Laboratorium Pusat Studi Penelitian Biofarmaka LPPM IPB..
Prosedur Penelitian
Peremajaan bakteri yang berasosiasi dengan spons
Isolat bakteri simbion spons yang digunakan dalam penelitian merupakan koleksi Laboratorium Mikrobiologi Laut, FPIK-IPB yaitu bakteri dengan kode S1 yang diisolasi dari spons Spirastrella sp. dan S2 dari spons Plakinastrella sp. Kedua isolat tersebut memiliki aktifitas paling tinggi dalam membunuh cacing
(2,5 g bacto pepton, 0,5 g ektrak yeast dan 1 l air laut). Isolat yang sudah dipindahkan diinkubasi pada suhu 28˚C selama 2x24 jam (Devi et al. 2010).
Karakterisasi morfologi dan kurva pertumbuhan bakteri
Karakterisasi morfologi dilakukan dengan menentukan ciri-ciri morfologi koloni. Pengamatan mikroskopis dilakukan terhadap morfologi bakteri yang diwarnai dengan pewarnaan Gram dengan menggunakan larutan kristal volet, iodium dan safranin (Sunatmo 2009). Bakteri Gram positif akan menampilkan warna ungu, sedangkan bakteri Gram negatif akan ditandai dengan warna merah atau merah muda. Pengamatan kurva pertumbuhan dilakukan berdasarkan Sunatmo (2009) yang dimodifikasi dengan mengultur cair isolat bakteri (30oC/150rpm/72jam). Pembuatan kurva pertumbuhan bakteri dilakukan dengan menghitung jumlah bakteri pada agar dan pengukuran Optical Density (OD) dengan panjang gelombang 660 nm setiap 6 jam.
Ekstraksi kasar isolat bakteri
Isolat bakteri simbion dibiakkan pada 100 ml media Zobell 2216 (½
strength) sebagai kultur starter kemudian diinkubasi selama 24 jam pada suhu 37oC. Ekstraksi senyawa bioaktif menggunakan metode Sunaryanto et al. (2010) yang telah dimodifikasi dimana isolat bakteri starter dikultur pada 1000 ml media Zobell 2216 (½ strength). Kultur diinkubasi pada inkubator bergoyang (30oC /150 rpm) selama mencapai fase stasioner kemudian dilakukan penambahan metanol dengan perbandingan kultur berbanding metanol (1:0.75). Larutan selanjutnya dikeringkan dengan menggunakan rotary evaporator pada suhu 40oC. Ekstrak kasar akan didapatkan dengan mengering-bekukan ekstrak menggunakan freeze drier. Ekstrak kasar disimpan pada suhu 5oC untuk pengujian selanjutnya.
Uji kandungan fitokimia
Uji kandungan fitokimia dari ekstrak kasar isolat bakteri dilakukan secara kualitatif di Laboratorium Biofarmaka LPPM IPB. Uji fitokimia dilakukan untuk mengetahui kandungan golongan senyawa bioaktif yang terdapat dalam isolat meliputi uji golongan senyawa alkaloid, flavanoid, saponin, tanin, antrakuinon dan steroid/triterpenoid (Harborne 1987).
Uji toksisitas Brine Shrimp Lethality Test (BSLT)
5 Pengamatan terhadap kematian larva dilakukan setelah masa inkubasi 24 jam. Jumlah larva yang mati dihitung nilai Total Kematian Larva (TKLn) (%) kemudian dilakukan analisis data untuk menghitung konsentrasi yang jumlah kematiannya setengah dari populasi larva (LC50).
TKLn (%) =
...(1)
kpn = Jumlah kematian larva perlakuan konsentrasi ke-n (ekor) kk = Jumlah kematian larva pada kontrol (ekor)
l0 = Julmah larva awal diberikan (ekor)
Nilai kematian organisme 50% (LC50) ditentukan dengan menggunakan kurva
hubungan antara logaritma konsentrasi ekstrak (x) dan nilai probit dari persentase kematian larva (y) (Utami et al. 2014).
Uji hambatan migrasi larva (Larval Migration Inhibition Assay) nematoda domba
Uji hambatan migrasi larva infektif nematoda domba (Larval Migration Inhibition Assay/LMIA) dilakukan secara in vitro dengan menggunakan metode yang dikembangkan oleh Molan et al. (2000). Uji dilakukan terhadap kedua ekstrak kasar dengan beberapa konsentrasi yaitu 25 µg.ml-1, 50 µg.ml-1, 100 µg.ml-1, 250 µg.ml-1 dan 500 µg.ml-1. Sampel ekstrak dilarutkan dengan larutan NaCl fisiologis sesuai dengan konsentrasi uji yang diinginkan. Perlakuan kontrol negatif dilakukan dengan larutan NaCl fisiologis dan tanpa penambahan ekstrak. Larutan albendazol diberikan sebanyak 100 µg.ml-1 sebagai kontrol positif. Larva uji didapatkan dari hasil penetasan telur nematoda domba milik Unit Pengelolaan Hewan Laboratorium Fakultas Kedokteran Hewan dimana sebagian besar terinfeksi Famili Trichostrongylidae (Haemonchus contortus 55%, Cooperia sp 25%, Nematodirus sp. 10%, Trichostrongylus sp. 10%). Pelepasan selubung larva L3 dilakukan pada 3 ml larva divortex dan dicampurkan dengan 75µl.ml-1 2%
NaClO. Hasil campuran divortex selama 15 detik dan inkubasi (40oC/3 menit). Larutan disaring dengan menggunakan kertas saring ukuran 5 µm. Hasil larva yang terlepas dari selubung didapatkan dengan merendam kertas saring ke dalam larutan fisiologis dan siap dilakukan uji.
Sumur uji dipersiapkan untuk setiap perlakuan kemudian ditambahkan 100 µl suspensi larva (~150 larva L3). Larutan ekstrak diberikan sebanyak 100 µl pada
LMIA (%) =
(2) An = jumlah larva yang bermigrasi pada konsentrasi ke-n (ekor) Bn = jumlah larva yang tidak bermigrasi pada konsentrasi ke-n (ekor)
Nilai 50% konsentrasi kematian dimana konsentrasi yang dapat secara efektif menghambat 50% migrasi larva ditentukan oleh kurva dosis-respon antara nilai mortalitas probit (y) dengan konsentrasi logaritmik (x)
HASIL DAN PEMBAHASAN
Karakterisasi morfologi dan pertumbuhan sel bakteri
Karakterisasi morfologi terhadap isolat bakteri S1 dan S2 dapat dilihat pada Tabel 1. Hasil uji pewarnaan Gram bakteri menghasilkan isolat S1 dan S2 termasuk ke dalam Gram positif (Gambar 2). Hal ini dilihat warna dari larutan krisital violet isolat bakteri yang tidak hilang ketika dibilas alkohol dan safranin (Fardiaz 1989). Gram positif memiliki dinding sel yang tersusun oleh sebagian besar peptidoglikan di mana mampu mengikat zat warna dan tidak rusak saat dicuci dengan alkohol.
(a) (b)
Gambar 2 Pengujian pewarnaan Gram isolat (a) S1 dan (b) S2 Tabel 1 Karakterisasi morfologi isolat bakteri S1 dan S2
Ciri-ciri Koloni S1 S2
Pewarnaan Gram Positif Positif
Diameter 2 mm 2 mm
Warna Keabuan Putih
Tepian Licin Licin
Bentuk Bundar Bundar
Konsistensi Cair Padat
Elevasi Timbul Timbul
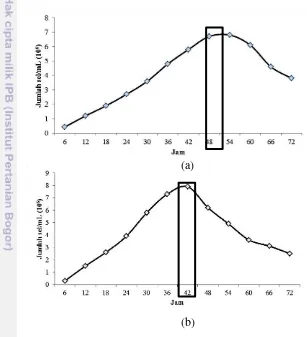
7 fase pertumbuhan sel mencapai pada fase stasioner selama 48 jam untuk S1 dan 42 jam untuk S2 (Gambar 3). Jumlah sel yang dihasilkan pada jam ke- 48 oleh S1 yaitu 6.7 x 106 sel.ml-1 dan jam ke-42 oleh S2 yaitu 7.9 x 106 sel.ml-1. Produksi sel mengalami penurunan pada jam selanjutnya hingga jam ke 72 untuk kedua isolat. Hasil pengamatan kurva pertumbuhan kedua isolat dapat dijadikan sebagai penentuan waktu ekstraksi isolat bakteri. Penentuan fase dilakukan pada produksi sel mencapai kondisi maksimal dan masuk ke fase stasioner dimana nutrisi media yang semakin menipis. Kondisi nutrisi yang semakin berkurang menyebabkan bakteri merespon secara fisiologis seperti menghasilkan senyawa metabolit sekunder untuk dapat bertahan hidup sebelum menuju fase kematian (Bacun-Druzina et al. 2011).
(a)
(b)
Gambar 3 Kurva pertumbuhan isolat bakteri simbion (a) S1 dan (b) S2
Kandungan Fitokimia Ekstrak Bakteri Simbion Spons
bobot total tubuhnya (Lee et al. 2012; Tang et al. 2012; Ebada et al. 2009). Ekstraksi senyawa bioaktif dari mikroorganisme lebih efektif dibandingkan dengan inangnya yaitu spons. Hal ini dikarenakan ekstrak isolat bakteri membutuhkan waktu yang lebih cepat dan dalam kondisi yang lebih terkontrol dibandingkan dengan mengambil dari alam yang dapat mengganggu kelestarian spons. Budidaya spons laut membutuhkan waktu panen yaitu sekitar 2 hingga 3 tahun (MacMillan 1999). Hasil ekstrak kasar yang didapatkan selanjutnya dikarakterisasi untuk mengetahui golongan senyawa bioaktif yang terkandung dalam ekstrak bakteri.
Uji kandungan fitokimia terhadap ekstrak S1 dan S2 dapat dilihat pada Tabel 2. Hasil skrining memperlihatkan golongan senyawa triterpenoid dimiliki oleh kedua isolat. Akan tetapi golongan senyawa flavonoid hanya dimiliki oleh isolat S1.
Tabel 2 Skrining fitokimia ekstrak isolat bakteri S1 dan S2
Golongan
Keterangan : + terdeteksi, - tidak terdeteksi
Ada dan tidaknya komposisi golongan senyawa bioaktif yang dihasilkan dalam masing-masing ekstrak mengindikasikan perbedaan aktivitas biologis yang dimiliki dari setiap isolat. Golongan senyawa triterpenoid dan flavonoid telah dibuktikan memiliki kandungan bioaktif dalam bidang medis (Simmons et al.
2005; Ebada et al. 2010; Utami et al. 2014). Penelitian mengenai potensi senyawa triterpenoid terhadap nematoda masih terbatas pada ekstrak tanaman seperti
Pulsatilla koreana (Li et al. 2013) dan beberapa tanaman terestrial lainnya (Eguale et al. 2007). Turunan dari senyawa tersebut yaitu saponins dari ekstrak tumbuhan Corchorus olitorius, Cinnamomum camphora, Portulace oleraceae dan
Lantana camar mampu menghambat metabolisme nematoda Meloidogyne Spp. (Ibrahim et al. 2014). Vickery dan Vickery (1981) menyatakan bahwa triterpenoid saponin memiliki potensi, sebagai antibiotik dan fungisidal. Penggunaan senyawa ini pun dalam dunia medis telah diketahui sebagai sebagai obat pencernaan. Hal ini dapat diasumsikan kandungan triterpenoid pada kedua ekstrak pun dapat diindikasikan memiliki potensi terhadap nematoda khususnya larva infektif pada domba.
9 golongan senyawa flavonoid menunjukkan efek merusak pada spesies cacing parasit tertentu (Hrckova and Velebny 2013).
Uji Toksisitas Brine Shrimp Lethality Test (BSLT)
Hasil uji toksisitas ekstrak kasar isolat bakteri memiliki variasi kematian larva yang berbeda dalam masing-masing konsentrasinya dilihat pada Tabel 3. Hasil menunjukkan bahwa tiap isolat dengan konsentrasi yang berbeda memiliki kandungan bioaktif yang mempengaruhi larva A. salina.
Tabel 3 Persentase mortalitas larva A. salina pada uji toksisitas ekstrak bakteri S1 dan S2
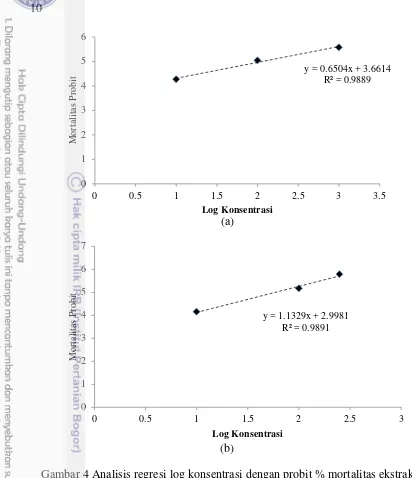
Hasil uji toksisitas pada Tabel 3 memperlihatkan bahwa nilai persentase mortalitas dari kedua ekstrak isolat yang mendekati nilai 50% kematian larva terletak pada konsentrasi 100 µg.ml-1. Kematian larva A.salina tidak terjadi pada perlakuan kontrol terhadap kedua ekstrak isolat. Penentuan konsentrasi yang tepat dalam menghentikan kematian 50% larva dapat dilakukan dengan menggunakan nilai mortalitas probit. Selain itu dengan mengetahui nilai mortalitas probit dalam setiap konsentrasi maka akan diketahui grafik hubungan log konsentrasi ekstrak (x) terhadap nilai mortalitas probit (y) yang dihasilkan pada ekstrak kasar seperti pada Gambar 4.
Hasil uji toksisitas ekstrak kasar S1 dan S2 memperlihatkan bahwa nilai mortlitas probit berbanding lurus dengan log konsentrasi uji. Semakin besar konsentrasi yang digunakan maka semakin besar persentase mortalitas yang terjadi. Nilai kolerasi yang didapatkan dari kedua ekstrak mendekati 1 yaitu 0.98. Nilai persentase tertinggi yang dimiliki oleh kedua isolat terdapat pada konsentrasi 500 µg.ml-1 sebesar 100%. Hasil analisis probit menunjukkan ekstrak kasar S1 mendapatkan nilai LC50 dalam 24 jam sebesar 69.38 µg.ml-1 sedangkan
y = 0.6504x + 3.6614
Gambar 4 Analisis regresi log konsentrasi dengan probit % mortalitas ekstrak kasar (a) S1 dan (b) S2 terhadap larva A. salina.
Uji toksisitas Brain Shrimp Lethality Test dengan menggunakan larva
A.salina merupakan uji toksisitas yang umum digunakan sebagai tahapan awal (prescreening) dalam penapisan senyawa bioaktif. Beberapa penelitian menunjukkan bahwa A. salina memiliki korelasi positif terhadap ekstrak yang bersifat bioaktif (Meyer et al. 1982). Keuntungan menggunakan metode BSLT yaitu prosedurnya sederhana, cepat, tidak memerlukan biaya yang besar dan hasilnya akurat (Sargeloos et al. 1978). Hasil uji yang didapatkan menunjukkan bahwa efek toksisitas yang dimiliki kedua isolat dapat dijadikan uji awal terhadap larva nematoda. Konsentrasi ekstrak S1 dan S2 memiliki efek toksisitas dengan nilai LC50 dibawah 1000 µg.ml-1 (Meyer et al. 1982). Suatu bahan kimia
11 isolat bersifat bioaktif. Hasil uji toksisitas menunjukkan perbedaan nilai LC50 24
jam yang didapatkan dari kedua ekstrak kasar isolat dimana S2 memiliki nilai toksisitas yang lebih tinggi dibandingkan dengan S1. Hal ini dikarenakan semakin rendah konsentrasi yang didapatkan dalam membunuh 50% larva uji maka nilai toksisitas yang dimiliki semakin tinggi (Meyer et al. 1982).
Efek toksisitas yang dihasilkan terhadap larva A.salina diindikasikan berasal dari golongan senyawa bioaktif yang dimiliki oleh kedua ekstrak tersebut yaitu golongan triterpenoid dan flavonoid. Golongan senyawa alkaloid, steroid, dan flavonoid dapat bersifat toksik yang dapat menyebabkan kematian terhadap hewan uji larva A. salina (Utami et al. 2014). Kemudian telah diketahui bahwa adanya efek toksisitas ekstrak kasar pada A salina telah mengindikasikan potensi senyawa bioaktif sebagai anti-kanker dan antibiotik lainnya (Utami et al. 2014). Kematian hewan uji A. salina diperkirakan melalui proses senyawa yang terkandung dapat menghambat daya makan larva (antifedant). Cara kerja senyawa-senyawa tersebut adalah dengan bertindak sebagai racun perut (stomach poisoning). Apabila senyawa-senyawa ini masuk ke dalam tubuh larva maka alat pencernaannya akan terganggu. Senyawa ini menghambat reseptor perasa pada daerah mulut larva. Hal ini mengakibatkan larva gagal mendapatkan stimulus rasa sehingga tidak mampu mengenali makanannya dan akibatnya larva mati kelaparan (Rita et al. 2008). Persentase mortalitas pada kontrol (0 µg.ml-1) sebesar 0% menunjukkan bahwa kondisi lingkungan A.salina baik untuk hidup dan tidak menyebabkan kematian. Kematian yang terjadi pada larva dapat disimpulkan karena pengaruh dari ekstrak kasar kedua isolat apabila kita melihat dari setiap perlakuan yang diberikan.
Uji hambatan migrasi larva (Larval Migration Inhibition Assay) nematoda domba
Hasil uji migrasi larva menggunakan ekstrak kasar isolat dengan konsentrasi yang berbeda memiliki nilai persentase yang bervariasi seperti pada Tabel 4. Hasil uji kedua isolat memperlihatkan bahwa semakin tinggi konsentrasi ekstrak yang diberikan menyebabkan nilai hambat larva untuk migrasi semakin besar. Hal ini dapat dibuktikan dengan nilai korelasi yang mendekati 1 yaitu 0.99 pada kedua ekstrak. Konsentrasi yang memiliki pengaruh rendah hingga tertinggi dimulai dari konsentrasi 25<50<100<250<500 µg.ml-1.
y = 1.8705x + 0.849
Nilai konsentrasi tertinggi nilai hambat migrasi larva terjadi pada masing-masing ekstrak isolat yaitu 500 µg.ml-1. Ekstrak S1 memiliki nilai toksisitas paling tinggi dibandingkan dengan ekstrak S2 dimana konsentrasi 500 µg.ml-1 dapat menghambat 83.70% dari seluruh total larva yang diuji. Konsentrasi tertinggi yang diuji dari ekstrak S2 yaitu 55.7% memiliki hasil yang tidak jauh berbeda dengan esktrak S1 pada konsentrasi 250 µg.ml-1 yaitu 57.92%. Kontrol negatif pada uji migrasi larva tidak menghasilkan larva yang tersangkut pada kertas saring. Berbeda dengan larutan albendazol sebagai kontrol positif uji yang menunjukkan hasil tertinggi terhadap seluruh perlakuan. Pengaruh peningkatan konsentrasi yang diberikan terhadap besarnya larva yang tidak melewati saringan tidak mengalami peningkatan yang sebanding. Hal ini menunjukkan bahwa diperlukan penentuan untuk nilai toksisitas yang tepat terhadap pengaruh dari migrasi larva. Berdasarkan nilai mortalitas probit yang didapatkan terhadap migrasi larva yang diuji menunjukkan perbandingan lurus terlihat dari grafik yang dihasilkan antara nilai mortalitas probit dengan log konsentrasi (Gambar 5). Persamaan yang dihasilkan dari analisis probit dapat menujukkan bahwa konsentrasi larva yang tidak mengalami migrasi sebanyak 50% yaitu 165.63 µg.ml-1 untuk S1 dan 374.91 µg/ml untuk S2.
13
Gambar 5 Analisis regresi log konsentrasi dengan probit % mortalitas ekstrak kasar (a) S1 dan (b) S2 terhadap larva Trichostrongylidae
Uji in vitro yang dilakukan dalam penelitian ini memperlihatkan adanya pengaruh daya hambat ekstrak isolat terhadap migrasi larva nematoda gastrointestinal pada domba yang terinfeksi secara alami. Penelitian terhadap potensi spons sebagai antelmintika sudah terekam cukup baik (Vuong et al. 2001; Capon et al. 2005; Mayer and Hamann 2005). Penelitian mengenai potensi spons laut diketahui memiliki potensi bioaktif yang baik dimiliki oleh spons genus
Spirastrella sp (Jang et al. 2012; Morinaka et al. 2011; Bharathiraja et al. 2014) dan Plakinastrella sp (Chen et al. 2002; Zhang et al. 2005). Akan tetapi informasi potensi bakteri simbion dari kedua Genus spons tersebut belum ditemukan. Informasi mengenai potensi bakteri terhadap menghambat perkembangan larva nematoda masih sedikit seperti potensi toksisitas Bacillus spp. dalam menghambat pertumbuhan larva Haemonchus contortus (Sinott et al. 2012). Berdasarkan hasil uji migrasi yang dilakukan dapat memberikan informasi baru mengenai potensi bioaktif dari ekstrak bakteri simbion spons laut terhadap larva nematoda domba.
Hasil skrining fitokimia yang dimiliki oleh kedua ekstrak tersebut yaitu golongan senyawa triterpenoid dan flavonoid telah dilaporkan memiliki peran bioaktif dari beberapa penelitian baik dari spons (Ravi and Wells 1981; Rao et al.
kandungan triterpenoid akan tetapi flavonoid. Golongan senyawa flavonoid telah diindikasikan memiliki potensi dalam menghasilkan antelmintika (Molefe et al.
2012). Kehadiran senyawa ini pun dimiliki oleh bakteri laut yang berpotensi terhadap farmakologi laut (Utami et al. 2014). Eksplorasi antelmintika alami yang telah dilakukan sebagian besar berasal dari lingkungan terestrial. Beberapa penelitian membuktikan bahwa kandungan senyawa bioaktif dari organisme laut memiliki aktifitas yang tidak kalah tinggi dibandingkan lingkungan terestrial. Lysek et al. (2003) menyatakan bahwa jumlah rata-rata kandungan total flavonoid yang ada di tanaman terestrial memiliki hasil yang serupa dengan spons.
Perbandingan pemberian albendazol dengan ekstrak kedua isolat jauh berbeda dimana albendazol memberikan efek tiga kali lebih besar pada S1 dan 4 kali lebih besar pada S2. Albendazol telah digunakan secara luas untuk mengobati domba dikarenakan memiliki khaisat antelmintika terhadap cacing nematoda (EMeA 2004). Proses aktivitas albendazol yaitu dengan mengikat kuat dengan tubulin dalam sel nematoda. Sel-sel usus dari nematoda yang sangat terpengaruh mengakibatkan hilangnya fungsi serap sehingga nematoda mati kelaparan. Namun larutan pemakaian albendazol yang berlebihan dapat mengakibatkan akumulasi senyawa sintetis yang dapat membahayakan kesehatan domba. Produk obat komersial yang memiliki kandungan albendazol tersebar dalam jumlah besar. Pemberian albendazol tidak diizinkan ketika domba pada masa hamil karena akan menyebabkan abortus (Teruel et al. 2011). Pemakaian albendazol yang berlebihan pun menyebabkan gangguan pada hati dan saluran pencernaan pada domba. Selain itu pemakaian albendazol yang intensif dapat menimbulkan resistensi nematoda. Kehadiran larva infektif yang resisten terhadap pengaruh obat sintetis akan memberikan dampak yang panjang terhadap peternak melalui penyebaran cacing nematoda infektif resisten ke domba yang lain (Easwaran et al. 2009). Hasil uji migrasi yang didapatkan terhadap kedua isolat bakteri telah terbukti memberikan kontribusi obat alternatif alami dalam menghadapi infeksi nematoda pada domba.
SIMPULAN
Simpulan
Ekstrak bioaktif dari bakteri laut yang bersimbiosis dengan spons
Spirastrella sp. dan Plakinastrela sp telah terbukti memiliki potensi dalam menghambat migrasi larva nematoda domba dengan nilai toksisitas yang tinggi terhadap larva A. salina dan nematoda Famili Trichostrongylidae. S1 memiliki toksisitas yang lebih tinggi dalam menghambat migrasi larva nematoda gastrointestinal domba dibandingkan dengan S2. Akan tetapi pemakaian albendazol tetap memiliki pengaruh yang lebih tinggi dibandingkan kedua ekstrak tersebut.
Saran
Berdasarkan hasil dan kesimpulan yang telah didapatkan, maka penulis menyarankan untuk dilakukan isolasi senyawa murni dengan teknik kromatografi untuk mendapatkan nilai IC50 yang lebih rendah dan diperlukan karakterisasi
15
DAFTAR PUSTAKA
Abubakar H, Wahyudi AT, Yuhana M. 2011. Skrining bakteri yang berasosiasi dengan spons Jaspis sp. sebagai penghasil senyawa antimikroba. Ilmu Kelautan. 16:35-40.
Ademola IO, Eloff JN. 2010. In vitro antelmintic activity of Combretum molle (R. Br. ex G. Don) (Cunbretaceae) against Haemonchus contortus ova and larvae. Veterinary Parasitology.169(1-2):198-203.
Bacun-Druzina V, Butorac A, Mrvcic J, Dragicevic TL, Sthelik-Tomas V. 2011. Bacterial stationary-phase evolution. Food Technology and Biotechnology. 49(1): 13–23.
Banoet Y. 2011. Aktivitas senyawa bioaktif antimikrob dari bakteri yang berasosiasi dengan spons Haliclona sp. dan telaah genetiknya [tesis]. Bogor (ID): Institut Pertanian Bogor.
Bharathiraja S, Rajasekaran R, Suriya J. 2014. Antibacterial activity of marine bacteria isolated from sponge Spirastrella inconstans. Journal of Chemical and Pharmaceutical Research.6(11):395-398.
Chen Y, Mc Carthy PJ, Harmody DK, Schimoler-O’Rourke R, Chilson K, Selitrennikoff C, Pomponi SA, Wright AE. 2002. New bioactive peroxides from marine sponges of the family Plakiniidae. Journal of Natural Products. 65: 1509-1512.
Dargatz DA, Dargatz JLT, Sangster NC. 2000. Antimicrobic and antelmintic resistance. Veterinary Clinic of North America. 16(3):515-536.
Devi P, Wahidullah S, Rodrigues C, Souza LD. 2010. The sponge-associated bacterium Bacillus licheniformis SAB1: a source of antimicrobial compounds. Marine Drugs. 8:1203-1212.
Easwaran C, Harikrishnan TJ, Raman M. 2009. Multiple antelmintic resistance in gastrointestinal nematodas of sheep in Southern India. Veterinarski Arhiv.
79(6):611-620.
Ebada SS, Lin W, Proksch P. 2010. Bioactive sesterterpenes and triterpenes from marine sponges: occurrence and pharmacological significance. Marine Drugs. 8: 313-346.
Eguale T, Tilahun G. Debella A, Feleke A, Makonnen E. 2007. Haemonchus contortus: in vitro and in vivo antelmintic activity of aqueous and hydro-alcoholic extracts of Hedera Helix. Experimental Parasitology.116: 340– 345.
[EmeA] European Medicines Agency. 2004. Veterinary medicines and inspections committee for medicinal products for veterinary use albendazol (extrapolation to all ruminants) Summary report (3). London (UK):EMA. Faulkner DJ, Harper MK, Haygood MG, Salomon CE, Schmidt EW. 2000.
symbiotic bacteria in sponges; sources of bioactive substances. Di dalam : Fusetani N, editor. Drugs from the sea.Karger; San Diego (USA) hlm 107-119.
Gupta J, Misra S, Mishra SK, Srivastava S, Srivastava MN, Lakshmi V, Misra-Bhattacharya S. 2012. Antifilarial activity of marine sponge Haliclona oculata against experimental Brugia malayi infection. Experimental Parasitology. 130:449–455.
Harborne. 1987. Metode Fitokimia, Penuntun Cara Modern Menganalisis Tumbuhan. Bandung (ID): ITB Pr.
Harper MK, Bugni TS, Copp BR, James RD, Lindsay BS, Richardson AD, Ireland CM. 2001. Introduction to the Chemical Ecology of Marine Natural Products. Di dalam McClintock and Baker BJ, editor. Marine Chemical Ecology. London: CRC Pr. hlm 3-71.
He Simon, Tiuria R, Satrija F. 1988. Taksiran kerugian produksi daging akibat infeksi cacing saluran pencernaan pada ternak domba. Seminar Parasitologi Nasional V. 85-96.
Hentschel U, Hopke J, Horn M, Hacker J, Friedrich AB. 2002. Molecular evidence for a uniform microbial community in sponges from different oceans. Applied and Environmental Microbiology. 68:4431–4440.
Hrckova G, Velebny S. 2013. Parasitic helminths of humans and animals: health impact and control. Di dalam : Hrckova G, Velebny S. Pharmacological Potential of Selected Natural Compounds In The Control of Parasitic Diseases, Volume 9. Pharmaceutical Science & Drug Development.
United Kingdom (UK). Springer. hlm 31-99.
Ibrahim HS, Hamouda SES, El-kady AMA, Abd-Alla HI. 2014. Study the nematicidal efficiency of Corchorus olitorius, Cinnamomum camphora, Portulace oleraceae and Lantana camara extracted saponins and their formulations on root-knot nematodas Meloidogyne Spp. Nature and Science.12(11): 40-45.
Jang KH, Lee Y, Sim CJ, Ki-Bong O, Shin J. 2012. Bioactive lipids from the sponge Spirastrella abata. Bioorganic & Medicinal Chemistry Letters
22:1078–1081.
Lee Hyi-Seung, Seo Y, Cho KW, Rho Jung-Rae, Shin J, Valerie JP. 2000. New triterpenoid saponins from the sponge Melophlus isis. Journal of Natural Products.63: 915-919.
Lee Y, Jang KH, Jeon J, Yang WY, Sim CJ, Oh KB, Shin J. 2012. Cyclic Bis-1,3- dialkylpyridiniums from the Sponge Haliclona sp. Marine Drugs 10: 2126- 2137
Lee YK, Lee JH, Lee HK. 2001. Microbial Symbiont in Marine Sponges. Journal of Microbiology. 39:254-264.
Li Wei, Sun YN, Yan XT, Yang SY, Lee SJ, Byun HJ, Moon CS, Han BS, Kim YH. 2013. Isolation of nematicidal triterpenoid saponins from Pulsatilla koreana root and their activities against Meloidogyne incognita.
Molecules.18: 5306-5316.
Li Yong-Xin, Himaya SWA, Kim Se-Kwon. 2013. Triterpenoids of marine origin as anti-cancer agents. Molecules. 18: 7886-7909.
Lysek N, Kinscherf R, Claus R, Lindeld T. 2003. L-5-Hydroxytryptophan: antioxidant and anti-apoptotic principle of the intertidal sponge
Hymeniacidon heliophila. Z. Naturforsch : 568-572.
17 Mayer AMS, Hamann MT. 2005. Marine pharmacology in 2001–2002: marine compounds with antelmintic, antibacterial, anticoagulant, antidiabetic, antifungal, anti-inflammatory, antimalarial, antiplatelet, antiprotozoal, antituberculosis, and antiviral actities; affectin the cardiovascular, immune and nervous system and other miscellaneous mechanisms of action.
Comparative Biochemistry and Physiology.140:265–286.
McDougal PG, Rico JG, VanDerveer D. 1986. Bengamides, heterocyclic antelminthics from a Jaspidae marine sponge. The Journal of Organic Chemistry. 51:4494-4497.
Meyer BN, Ferrighi NR, Putnam JE, Jacobsen LB, Nichols DE, McLaughlin JL. 1982. Brine shrimp: a convenient general bioassay for active plant constituents. Planta Medica. 45:31-34.
Middleton E, Kandaswami CH, Theoharides TC. 2000. The effects of plant flavonoids on mammalian cells: implications for inflammation, heart disease, and cancer. Pharmacology Reviews. 52: 673–751.
Molan AL, Waghorn GC, Min BR, McNabb WC. 2000. The effect of condensed tannins from seven herbages on Trichostrongylus colubriformis larval migration in vitro. Folia Parasitologica. 47: 39-44.
Molefe NI, Tsotetsi AM, Ashafa AOT, Thekisoe OMM. 2012. In vitro antelmintic effects of Artemisia afra and Mentha longifolia against parasitic gastro-intestinal nematodas of livestock. Bangladesh Journal of Pharmacology. 7: 157-163.
Morinaka BI, Molinski TF. 2011. Mollenyne A, a long-chain chlorodibromohydrin amide from the sponge Spirastrella mollis. Organic Letters.13(24):6338–6341.
Proksch P, Edrada RA, Ebel R. 2002. Drugs from the seas-current status and microbial implications. Applied Microbiology and Biotechnology 59:125-134.
Rabel B, Mc Gregor R, Douch PGC. 1994:Improved bioassay for estimation of inhibitory effects of ovine gastrointestinal mucus and anthelmintics on nematoda larval migration. International Journal for Parasitology. 24: 671-676.
Rao Z, Deng S, Wu H, Jiang S. 1997. Rhabdastrellic acid-A, a novel triterpenoid from the marine sponge Rhabdastrella globostellata. Journal of Natural Products.60: 1163-1164.
Ravi BN, Wells RJ. 1981. Malabaricane triterpenes from a fijian collection of the sponge Jaspis stellifera. The Journal of Organic Chemistry. 46:1998-2001. Ribes M, Coma R, Atkinson MJ, Kinzie RA. 2003. Particle removal by coral reef
communities: picoplankton is a major source of nitrogen. Marine Ecology Progress Series. 257:13-23.
Rita WS, Suirta IW, Sabikin A. 2008. Isolasi dan Identifikasi Senyawa yang Berpotensi sebagai Antitumor Pada Daging Buah Pare (Momordica charantia L.).Jurnal Kimia. 2(1): 1-6
Romimohtarto K, Juwana S. 1999. Biologi laut. Ilmu Pengetahuan tentang Biota Laut. Jakarta (ID): LIPI.
Simmons TL, Andrianasolo E, McPhail K, Flat P, Gerwick WH. 2005. Marine natural product as anticancer drugs. Minireview. Molecular Cancer Therapeutics 4:333-342.
Sinott MC, Filho NAC, Castro LLD, Lorenzon LB, Pinto NB, Capella GA, Leite FPL. 2012. Bacillus spp. toxicity against Haemonchus contortus larvae in sheep fecal cultures. Experimental Parasitology.132: 103–108.
Sunaryanto R, Marwoto B, Irawadi TT, Mas’ud ZA, Hartato L. 2010. Isolation and characterization of antimicrobial substance from marine Streptomyces
sp. Journal of Microbiology Indonesia. 4: 84-89.
Tang S, Xu R, Lin W, Duan H. 2012. Jaspiferin A and B: two new secondary metabolites from the south China sea sponge Jaspis stellifera. Records of Natural Products.6:398-401.
Taylor MW, Radax R, Steger D, Wagner M. 2007. Sponge-associated microorganisms: evolution, ecology, and biotecnological potential. Microbiology and Molecular Biology Reviews. 2:295-347.
Teruel M, D’ercole J, Catalano R. 2011. Evaluation of potential embryo toxicity of albendazol sulphoxide in CF1 mice. Biocell. 35(1): 29-33.
Thomas TRA, Kavlelar DP, LokaBharathi PA .2010. Marine drugs from sponge-microbe association—a review. Marine Drugs 8:1417–1468.
Utami AWA, Wahyudi AT, Batubara I. 2014. Toxicity, anticancer and antioxidant activity of extracts from marine bacteria associated with sponge Jaspis sp.
International Journal of Pharmacy and Biological Sciences 5(4): 917-923. Vickery ML, Vickery B. 1981. Secondary Plant Methabolism. London (UK) : The
Macmillan Pr.
Vuong D, Capon RJ, Lacey E, Gill JH, Heiland K, Friedel T. 2001. Onnamide F: a new nematocide from a southern Australian marine sponge, Trachycladus laevispirulifer. Journal of Natural Products. 64:640–642.
Waller PJ. 1998. Parasite epidemiology, resitance and the prospect for implementation of alternative control programs. FAO Animal Health Paper
141:1-10.
Yahel G, Sharp J, Marie D, Hase C, Genin A. 2003. In situ feeding and element removal in the symbiont-bearing sponges Theonella swinhoei, bulk DOC is the major source for carbon. Limnology and Oceanography. 48:141-149. Yoshihara E, Minho AP, Cardim ST, Tabacow VBD, Yamamura MH. 2014. In
vitro ovicidal and larvicidal activity of condensed tannins on gastrointestinal nematoda infestations in sheep (Ovis aries). Ciências Agrárias. Londrina. 35(6): 3173-3180
19
LAMPIRAN
Lampiran 1 Komposisi medium Zobell Agar (1/2 strength) Komposisi untuk 1000 ml
Peptone 2,5 gram
Yeast Extract 0.5 gram Agar Bacto 15 gram Air laut Steril 1000 ml
Lampiran 2 Ekstrak kasar bakteri yang berasosiasi dengan spons S1 (kiri) dan S2 (kanan) telah diencerkan
Lampiran 3 Contoh perhitungan rendemen ekstrak bakteri yang berasosiasi dengan spons
Rendemen (S1) =
=
= 0.015% Rendemen (S2) =
=
=
Lampiran 4 Uji toksisitas ektrak bakteri simbion spons terhadap larva A. salina Kode
Isolat
Konsentrasi (µg.ml-1)
Mortalitas (Ulangan)
Rata-rata %
Mortalitas
U1 U2 U3
Kontrol 0 0 0 0 0 0
S1 10 3 4 7 0,23 23,3
100 10 12 9 0,52 51,7
250 17 14 12 0,72 71,7
500 20 20 20 1 100
S2 10 4 3 5 0,20 20
100 9 11 14 0,57 56,7
250 16 18 13 0,78 78,3
500 20 20 20 1 100
Lampiran 5 Contoh perhitungan uji toksisitas ektrak bakteri simbion spons terhadap larva A. salina
% BSLT S1(10) =
=
= 0.233 x 100 = 23.33 % % BSLT S2(10) =
=
= 0.2 x 100 = 20%
21
LMIA = Larva Migration Inhibition Assay
Lampiran 9 Contoh perhitungan uji hambatan migrasi larva (Larval Migration Inhibition Assay) nematoda domba
%LMIA S1(25) =
=
= 0,0663 x 100 = 6.63 %
%LMIA S2(25) =
=
= 0.0586 x 100 = 5.89%
Lampiran 10 Dokumentasi kultur larva nematoda dan uji hambatan migrasi larva
23