INDUKSI MATURASI PADA UDANG VANAME
Litopenaeus vannamei
JANTAN MENGGUNAKAN OODEV
FAHMI AKBAR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa Tesis berjudul: Induksi Maturasi pada Udang Vaname Litopenaeus vannamei Jantan menggunakan Oodev adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
.
Bogor, September 2015
Fahmi Akbar
RINGKASAN
FAHMI AKBAR. Induksi Maturasi pada Udang Vaname Litopenaeus vannamei
Jantan menggunakan Oodev. Dibimbing oleh AGUS OMAN SUDRAJAT dan SITI SUBAIDAH
Udang jantan sangat berperan penting dalam produktifitas udang terutama pada kualitas dan kuantitas spermanya. Induksi maturasi secara hormonal merupakan salah satu alternatif yang dapat dilakukan untuk mempercepat maturasi dan meningkatkan kinerja reproduksi udang. Pada beberapa penelitian dilaporkan keberadaan GnRH, FSH dan LH endogenus pada krustasea. GnRH dilaporkan terdeteksi pada Central Nervous System (CNS) di otak dan thoracic ganglion, sedangkan FSH dan LH dilaporkan terdeteksi pada otak dan thoracic ganglion. Dilaporkan juga bahwa pada krustasea terdapat reseptor estrogen dan androgen yang terletak di otak dan thoracic ganglion. Oodev merupakan bahan aktif yang mangandung hormonpregnant mare serum gonadotropin (PMSG) dan
anti dopamine (AD). Aplikasi Oodev pada induk betina baik itu pada ikan maupun udang telah banyak dilakukan dan terbukti memberikan hasil yang positif, namun pada induk jantan belum pernah dilakukan. Penelitian ini bertujuan untuk mengevaluasi peran induksi maturasi menggunakan Oodev dalam mempercepat maturasi dan meningkatkan kinerja reproduksi udang vaname (Litopenaeus vanname) jantan.
Penelitian dilakukan dalam 2 tahap percobaan yaitu percobaan 1 menggunakan enam perlakuan terdiri dari perlakuan tanpa ablasi mata (kontrol), ablasi mata, Oodev dosis 0,1 mL/kg; 0,25 mL/kg; 0,5 mL/kg dan 1 mL/kg per bobot udang. Tahap 1 menggunakan metode penyuntikan menggunakan syringe tuberculine ukuran 1 mL. Hewan uji yang digunakan yaitu induk udang vaname jantan belum matang gonad dengan bobot 35 - 45 gram per ekor sebanyak 60 ekor. Parameter yang diamati jumlah sperma, persentase sperma normal dan abnormal, histologi gonad dan konsentrasi testosteron. Tahap 2 dilakukan dengan mengkawinkan induk jantan hasil percobaan Tahap 1 dengan induk betina tanpa diberi perlakuan dengan perbandingan 3 jantan dan 1 betina. Parameter yang diamati yaitu jumlah telur, jumlah naupli danhatching rate(HR).
Hasil penelitian menunjukkan induksi Oodev dapat meningkatkan jumlah sel sperma dengan persentase normalitas sel sperma tinggi dan abnormalitas rendah. Induksi Oodev meningkatkan konsentrasi testosteron lebih tinggi dibandingkan kontrol, mempercepat kematangan gonad 85% - 90% sedangkan kontrol hanya 80%, meningkatkan kualitas pembuahan yaitu menghasilkan rata-rata jumlah naupli tertinggi sebesar 45.637 naupli dengan HR 56,50% sedangkan kontrol 37.450 naupli dengan HR 46,68%. Oodev dosis 0,5 mL/kg merupakan dosis optimal dalam meningkatkan kinerja reproduksi udang jantan. Hasil ini membuktikan bahwa induksi maturasi menggunakan Oodev yang diadopsi dari induk betina dapat juga memberikan respon positif pada induk jantan. Laporan tersebut meyakinkan bahwa sistem kontrol reproduksi pada ikan dan udang memiliki kesamaan sistem kontrol reproduksi. Induksi Oodev dapat mempercepat maturasi dan meningkatkan kinerja reproduksi udang jantan.
SUMMARY
FAHMI AKBAR. Induction Maturation of Males Shrimp Litopenaeus vannamei
by Oodev. Supervised by AGUS OMAN SUDRAJAT dan SITI SUBAIDAH The male shrimp play important role in shrimp productivity, particularly on the sperm quantity and quality. Induction of maturation by hormonal is the one of an alternative to accelerate maturation and improve the reproductive performance of males shrimp. Several studies reported the presence of GnRH, FSH and endogenous LH on crustaceans. GnRH detected in the Central Nervous System (CNS) in the brain and the thoracic ganglion, whereas FSH and LH detected in the brain and the thoracic ganglion. It was also reported that the crustaceans has estrogen receptor and androgen receptors located in the brain and the thoracic ganglion. Oodev is a combination of the chemical active substance of
Pregnant Mare Serum Gonadotropin (PMSG) and Anti Dopamine (AD). The application of Oodev usage to female neither shrimp nor fish brood stock has been widely use nor the result shows effectively proven, nevertheless the application to male brood stock has been not compromised. This research was aim to evaluate the role of maturation induction by Oodev to accelerate maturation and improve reproductive performance of male vaname (Litopenaeus vanname) shrimp.
This research consist of two stage trial, the first trial was used six treatments which are control (without ablation), ablation, Oodev dossage of 0.1 ml/kg, 0.25 ml/kg; 0.5 ml/kg and 1 ml/kg shrimp biomass. The first trial uses the injection method using 1 mL tuberculin syringe. The test animals used were 60 individuals’ immature of male vaname shrimp broodstocks with initial weighs 35-45 grams per shrimp. The parameters observed such as the amount of sperm, percentage of normal and abnormal sperm, the gonad histology and testosterone concentrations. The second trial conducted by mating the male broodstock from first trial with female broodstock without interfere any treatment, with ratio 3 males and 1 female. Parameters observed such as the number of eggs, number naupli and hatching rate (HR).
The results showed that Oodev induction can improve number of sperm cells with high normality of sperm cell and lower abnormality. Oodev induction increases the testosterone concentration higher compared with control, accelerate the maturity of the gonads as high as 85% - 90% compared with control that only 80% and improve the quality of spawning which produces an average number of 45,637 naupli with HR 56.50%, while the controls only produces 37,450 naupli with HR 46.68%. Oodev dosage of 0.5 mL/kg was the optimal dose usage improves the reproductive performance of male shrimp. The results prove that techniques maturation induction by Oodev adopted from female broodstock give a positive response to male broodstock. The report assures that the control system of reproduction in fish and shrimp have a common control system of reproduction. Oodev induction can accelerate maturation and improve the reproductive performance of males shrimp.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
INDUKSI MATURASI PADA UDANG VANAME
Litopenaeus vannamei
JANTAN MENGGUNAKAN OODEV
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Induksi Maturasi pada Udang VanameLitopenaeus vannamei Jantan menggunakan Oodev
Nama : Fahmi akbar NIM : C151130601
Disetujui oleh Komisi Pembimbing
Dr Ir Agus Oman Sudrajat, MSc Ketua
Dr Ir Siti Subaidah, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 6 Juli 2015
PRAKATA
Puji dan syukur Penulis panjatkan kehadirat Allah SWT, atas segala rahmat dan karunia-Nya sehingga karya ilmiah yang berjudul Induksi Maturasi pada Udang Vaname Litopenaeus vannamei Jantan menggunakan Oodev dapat terselesaikan. Penelitian dilaksanakan sejak bulan Agustus sampai Oktober 2014 di Balai Perikanan Budidaya Air Payau (BPBAP) Situbondo Jawa Timur dan proses penulisan dan penyusunan dapat terselesaikan hingga juni 2015.
Pada kesempatan ini Penulis mengucapkan terima kasih kepada pihak-pihak yang telah banyak membantu dan memberikan gagasan dalam penyusunan karya ilmiah ini.
1. Ayahanda Muhammad A. Bakar dan ibunda St. Nurhasanah Usman tercinta serta kakak Fahrurozi, Fauqurahman dan adik Putrian Farhani yang selama ini telah memberikan doa, perhatian, nasihat, motivasi, dan kasih sayang yang tulus kepada penulis selama ini.
2. Bapak Dr Ir Agus Oman Sudrajat, MSc selaku ketua komisi pembimbing dan Ibu Dr Ir Siti Subaidah MSi selaku anggota komisi pembimbing yang telah banyak memberikan bimbingan, arahan dan motivasi kepada Penulis selama ini mulai dari penyusunan rencana penelitian, hingga penyelesaian tesis ini.
3. Wendy Tri Prabowo, SPi, Ibu Gemi, Mas sandi, Mas Mulyadi, Mas Erfan Mas Deni, Fuad, rekan-rekan dari Universitas Brawijaya dan seluruh staf pegawai serta teknisi di Gelung atau Pecaron BPBAP Situbondo yang telah banyak membantu penulis selama kegiatan penelitian.
4. Dr Ir Tatag Budiardi, MSi selaku Dosen Penguji Tamu dan Dr Ir Eddy Supriyono, MSc selaku Wakil Komisi Pendidikan, Departemen Budidaya Perairan.
5. Rekan rekan Program Studi Ilmu Akuakultur, khususnya Tiara Ikma, Anti, Iwid Andre, Didi yang telah banyak membantu memberikan bantuan, motivasi dan saran selama penyusunan tesis, serta terima kasih kepada semua sahabat seperjuangan Ilmu Akuakultur angkatan 2013 yang tak dapat Penulis sebutkan satu persatu namanya yang telah banyak memberikan bantuan dan dukungan kepada Penulis mulai dari awal perkuliahan, proses penelitian sampai penyusunan tesis ini.
Semoga Allah SWT membalas dengan kebaikan yang berlipat ganda atas segala bantuan dari semua pihak yang telah diberikan kepada Penulis. Amin.
.
Bogor, September 2015
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Kerangka Pemikiran 3
Tujuan Penelitian 4
Manfaat penelitian 4
3 METODE 4
Waktu dan Tempat 4
Rancangan Penelitian 5
Prosedur Penelitian 5
Parameter Penelitian 8
Analisis Data 9
4 HASIL DAN PEMBAHASAN 9
Hasil 9
Pembahasan 14
5 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 23
DAFTAR GAMBAR
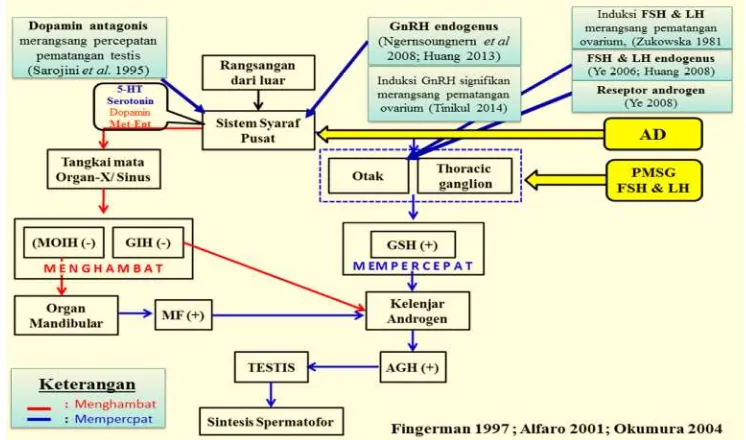
1 Diagram alur mekanisme induksi maturasi menggunakan Oodev untuk mempercepat maturasi dan meningkatkan kinerja reproduksi udang
vaname jantan. 4
2 Ciri-ciri sel sperma normal dan sel sperma abnormal udang vaname 8 3 Jumlah sel sperma udang vaname selama 12 hari pengamatan 10 4 Persentase sperma normal udang vaname selama 12 hari pengamatan 10 5 Persentase sperma abnormal udang vaname selama 12 hari pengamatan 10 6 Fluktuasi konsentrasi hormon testosteron dalam hemolim udang
vanameselama 12 hari pengamatan 11
7 Histologi gonad udang vaname jantan hari ke-0 12 8 Histologi gonad udang vaname jantan hari ke-6 12 9 Histologi gonad udang vaname jantan hari ke-12 13
DAFTAR LAMPIRAN
1 Data pengamatan sel sperma udang vaname selama 12 hari
pemeliharaan 23
2 Hasil analisa konsentrasi testosteron udang vaname selama 12 hari
pemeliharaan 24
3 Hasil Perhitungan jumlah telur dan jumlah naupli udang vaname 24 4 Hasil analisis sidik ragam data jumlah naupli 24 5 Prosedur analisis hormon Testosteron dengan teknik ELISA 25 6 Dokumentasi proses persiapan hormon dan penyuntikan Oodev pada
udang vaname 25
1 PENDAHULUAN
Latar Belakang
Udang vaname (Litopenaeus vannamei) merupakan salah satu komoditas perikanan unggulan yang bernilai ekonomis penting dan banyak diminati oleh konsumen dipasaran. Produksi udang vaname mengalami peningkatan setiap tahunnya. Dalam lima tahun terakhir, produksi udang nasional meningkat cukup signifikan yaitu 13,9 % per tahun. Tahun 2015 ditargetkan produksi udang nasional sebesar 785.900 ton atau meningkat sekitar 32 % dari produksi udang tahun 2014 sebesar 592.000 ton (JI 2015). Untuk menunjang produksi udang vaname, ketersediaan benih dengan kualitas baik dan kontinuitas jumlah dalam kegiatan budidaya merupakan hal penting yang harus diusahakan. Dalam budidaya udang vaname khususnya pada kegiatan pembenihan, ketersediaan induk menjadi persyaratan utama. Kurangnya ketersediaan induk yang berkualitas menjadi kendala dalam kegiatan pembenihan udang. Salah satu diantaranya yaitu terjadinya penurunan daya tetas telur yang dapat mempengaruhi jumlah serta kualitas nauplius yang diproduksi. Diduga salah satu penyebab atas kejadian tersebut karena kualitas dan kuantitas sel sperma yang masih rendah dalam membuahi sel telur pada proses pembuahan. Menurut Alfaro (1993) udang jantan dalam reproduksi memiliki peran penting terutama pada kualitas dan kuantitas spermanya. Kualitas dan kuantitas sel sperma udang jantan menjadi faktor pembatas pada reproduksi karena berperan penting dalam kemampuannya untuk membuahi sel telur (Perez-Jar 2007)
Perkembangan gonad udang secara alami masih rendah dan cukup lama untuk matang gonad secara sempurna karena ditentukan oleh beberapa kerja hormon (Ceballos-Vazques et al. 2010). Gonad stimulating hormone (GSH) dan
methyl farnesoate (MF) merupakan hormon gonadotropin yang berperan penting pada aktivitas kelenjar seks dan androgen pada udang jantan karena berfungsi untuk merangsang pembentukan sel sperma dan perkembangan gonad. Namun, produksi GSH dan MF secara alami dihambat oleh aktivitas gonad inhibiting hormone (GIH) dan mandibular organ inhibiting hormone (MOIH) yang dihasilkan oleh organ-X yang terletak pada tangkai mata (Huberman 2000).
Manipulasi lingkungan dengan induksi hormon steroid merupakan salah satu alternatif yang dapat dilakukan sebagai upaya untuk menjamin ketersedian hormon steroid endogenus yang berperan penting dalam aktivitas reproduksi. Studi tentang penggunaan induksi hormon steroid pada induk betina telah banyak dilakukan dan terbukti cukup efektif, namun pada induk jantan belum banyak dilaporkan. Alfaro (1996) melaporkan induksi hormon steroid 17α -Methyltestosteron dan 17α-Hydroxyprogesterone pada induk jantan dapat meningkatkan kualitas sel sperma dengan jumlah sel sperma yang tinggi dan persentase abnormalitas sel sperma yang rendah.
2
luteinizing hormone (LH) (Hafez dan Hafez 2000). PMSG bekerja untuk merangsang terjadinya lonjakan kadar gonadotropin realesing hormone (GnRH) yang selanjutnya akan mempengaruhi pituitaryuntuk memproduksi gonadotropin FSH dan LH (Bolamba et al. 1992). Pada udang, induksi FSH dan LH eksogenus mampu merangsang perkembangan ovarium udang pasir Crangon crangon. (Zukowska dan Arendarczk 1981).
AD merupakan senyawa kimia berperan sebagai neurotransmiter yang bekerja memblokade aktivitas reseptor dopamin (Dufour et al. 2010). Dopamin tersebar luas dalam sistem saraf krustasea dan berperan menghambat pematangan gonad udang dengan menstimulasi sekresi hormon GIH dan menghambat sekresi hormon GSH (Fingerman 1997). AD yang terkandung dalam Oodev diharapkan akan bekerja memblok aktivitas dopamin, sehingga sekresi GSH tidak terhambat.
Aplikasi premiks PMSG dan AD pada induk betina baik itu pada ikan maupun udang telah banyak dilakukan dan terbukti efektif meningkatkan kinerja reproduksi. Pada ikan, penyuntikan Oodev dilaporkan dapat menginduksi pematangan gonad pada ikan torsoro (Farastuti 2014), dan lele dumbo Clarias sp.
(Mayasari et al. 2012). Pada udang, induksi hormon PMSG + AD + rekombinan growth hormon (rGH) dalam pakan meningkatkan kematangan gonad sebesar 80% pada induk udang vaname betina (Qonitah 2013). Namun aplikasi Oodev pada induk jantan, baik pada ikan maupun udang belum ada yang melaporkan. Oleh karena itu induksi maturasi menggunakan Oodev yang diadopsi dari teknik induksi pada induk betina diharapkan akan memberikan respon yang positif pada perbaikan kinerja reproduksi induk vaname jantan.
Perumusan Masalah
Terjadinya penurunan kualitas daya tetas telur induk udang betina menjadi salah satu masalah pada reproduksi udang sehingga hal tersebut dapat mempengaruhi jumlah serta kualitas dan kuantitas nauplius yang diproduksi. Diduga hal tersebut terjadi karena kualitas sel sperma yang rendah dalam membuahi sel telur. Pendekatan secara hormonal dengan manipulasi lingkungan menggunakan induksi hormon steroid dari luar tubuh diharapkan bekerja efektif dalam mempercepat maturasi dan meningkatkan kinerja reproduksi udang vaname jantan.
Oodev merupakan bahan aktif organik yang mengandung premix hormon PMSG dan AD. Aplikasi penggunaan Oodev pada ikan maupun udang betina telah banyak dilakukan dan terbukti efektif mempercepat maturasi dan meningkatkan kinerja reproduksi. Farastuti (2014) melaporkan penyuntikan Oodev dapat menginduksi pematangan gonad pada ikan torsoro, sedangkan Qonitah (2013) melaporkan induksi hormon PMSG + AD + rGH dalam pakan dapat meningkatkan kematangan gonad sebesar 80% pada induk udang vaname betina.
3
Kerangka Pemikiran
GnRH sangat berperan penting sebagai kontrol reproduksi pada ikan. GnRH yang disekresikan oleh hipotalamus akan mengatur sintesis dan pelepasan FSH dan LH dari kelenjar hipofisis dan selanjutnya mengatur steroidogenesis dan gametogenesis (Chen dan Fernald 2008). Pada krustasea, yang berperan penting sebagai hormon kontrol reproduksi yaitu GSH. Sekresi GSH dikendalikan oleh
neuroregulator 5-hidroxytriptamin (5-HT), serotonin, methionine enkephalin
(Met-Ent) dan dopamine (DA) yang menstimulasi sistem syaraf pusat untuk merangsang pelepasan GSH di otak dan ganglion thorac. GSH kemudian mengaktifkan sintesis dan sekresiandogenik gland hormone(AGH) oleh kelenjar androgen. Selanjutnya AGH memicu pematangan testis dan spermatogenesis Namun sintesis GSH dihambat oleh GIH, sedangkan MOIH bekerja pada organ mandibula untuk menghambat MF yang diyakini untuk merangsang spermatogenesis pada kelenjar androgen (Alfaro 2001; Okumura 2004).
Pada krustasea telah dilaporkan keberadaan GnRH endogenus seperti vertebrata terdeteksi pada central nervous system (CNS) di otak dan ganglion thorac udang galah Macrobrachium rosenbergii (Ngernsoungnern et al. 2008).
Hasil yang sama dilaporkan juga oleh Huang (2013) yaitu GnRH endonenus terdeteksi pada otak kepiting Tachypleus tridentatus. Hal tersebut diperkuat hasil penelitian Ngernsoungnernet al. (2009) yaitu induksi GnRH eksogenus pada induk betina M. rosenbergii secara signifikan dapat mempersingkat pematangan ovarium dibandingkan kontrol dan hasil yang sama dilaporkan Tinikul et al. (2014) yaitu induksi GnRH pada udang L. vannamei memiliki efek yang signifikan dalam merangsang pematangan ovarium. Selain GnRH,dilaporkan juga keberadaan FSH dan LH endogenus di krustasea terdeteksi pada otak kepiting bakauScylla serrata
(Ye et al. 2006) dan juga terdeteksi pada otak dan ganglion thorac rajungan
Portunus trituberculatus (Huang 2008). Zukowska dan Arendarczk (1981) melaporkan induksi FSH dan LH eksogenus memiliki efek merangsang pematangan ovarium udang pasirCrangon crangon. Dari laporan tersebut Huang (2008) menyakini bahwa krustasea dapat mensintesis hormon gonadotropin seperti pada vertebrata. Selain itu, Ye et al. (2008) menyatakan bahwa pada krustasea terdapat reseptor estrogen and androgen yang terletak pada otak dan
ganglion thorackepitingScylla paramamosain.
Laporan tersebut meyakinkan keberadaan GnRH, FSH dan LH endogenus pada krustasea yang berperan penting sebagai kontrol reproduksi. Diduga sistem kontrol reproduksi antara ikan dan udang memiliki kesamaan konsep, sehingga penyuntikan FSH dan LH eksogenus yang terkandung dalam Oodev akan bekerja efektif mempengaruhi GnRH endogenus untuk merangsang percepatan sintesis dan sekresi FSH dan LH endogenus. Selanjutnya FSH dan LH yang tersirkulasi dalam hemolim akan merangsang kelenjar androgen untuk memproduksi hormon androgen dan mempengaruhi testis untuk mensintesis dan mensekresikan hormon testosteron yang berperan penting mengatur perkembangan spermatozoa dan tingkah laku seksual induk jantan. Selain FSH dan LH, AD akan bekerja efektif memblok aktivitas dopamin pada sistem syaraf pusat yang terletak di otak dan
4
PMSG dan AD yang terkandung dalam Oodev akan bekerja sinergis dalam tubuh udang untuk meningkatkan kinerja reproduksi udang vaname jantan.
Gambar 1 Diagram alur mekanisme induksi maturasi menggunakan Oodev untuk mempercepat maturasi dan meningkatkan kinerja reproduksi udang vaname jantan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi peran induksi maturasi menggunakan Oodev dalam mempercepat maturasi dan meningkatkan kinerja reproduksi udang vaname jantan.
Manfaat Penelitian
Manfaat penelitian adalah dapat menyediakan informasi dasar tentang aplikasi Oodev pada induk jantan khususnya pada udang vaname jantan untuk mempercepat maturasi dan meningkatkan kinerja reproduksi.
2 METODE PENELITIAN
Waktu dan Tempat
5
Rancangan Penelitian
Penelitian dilakukan dengan metode eksperimental dalam dua tahap percobaan yaitu percobaan Tahap 1 induksi Oodev dan percobaan Tahap 2 perkawinan dan pemijahan induk.
Percobaan Tahap 1
Percobaan Tahap 1 dilakukan untuk menganalisis pengaruh kombinasi dosis Oodev dalam mempercepat maturasi dan meningkatkan kualitas sel sperma udang. Tahap 1 menggunakan Rancangan Acak Lengkap (RAL) dengan enam perlakuan yaitu tanpa ablasi mata (kontrol) ablasi mata, Oodev dosis 0,1 mL/kg; 0,25 mL/kg; 0,5 mL/kg dan 1 mL/kg per bobot udang. Tahap 1 menggunakan metode penyuntikan yang dilakukan sekali selama 12 hari pemeliharaan. Parameter yang diamati yaitu jumlah sel sperma, persentase sel sperma normal dan abnormal, histologi gonad, konsentrasi hormon testosteron dan kualitas air (temperatur, pH dan salinitas).
Percobaan Tahap 2
Percobaan Tahap 2 dilakukan untuk menganalisis kualitas sel sperma induk jantan perlakuan dalam membuahi sel telur. Percobaan Tahap 2 menggunakan RAL dengan enam perlakuan sama seperti pada percobaan Tahap 1. Percobaan tahap 2 dilakukan dengan mengkawinkan induk jantan hasil perlakuan Tahap 1 dengan induk betina matang gonad tanpa perlakuan. Parameter yang diamati yaitu jumlah telur, jumlah naupli danhatching rate(HR)
Prosedur Penelitian
Percobaan Tahap I Persiapan Bak
Bak pemeliharaan yang digunakan yaitu 6 bak beton berbentuk bulat dengan diameter 3 m, tinggi 2 m, kapasitas air 5 m3. Sebelum digunakan bak dibersihkan menggunakan detergen dan dibilas dengan air tawar. Bak dikeringkan selama 2 hari kemudian diisi air laut sebanyak 2,5 m3 yang sebelumnya telah melalui proses filter dengan temperatur 28 - 29 oC, salinitas 32 ppt dan pH 7,6 -7,9. Menurut Arcos et al. (2003) kisaran kualitas air tersebut merupakan kondisi paling optimal pada perkembangan gonad udang L. vannamei. Bak yang telah diisi air laut kemudian diberi aerasi sebanyak 6 titik untuk setiap bak.
Pemilihan Calon Induk
Induk yang digunakan yaitu induk udang Vaname Nusantara berasal dari BPBAP Situbondo. Induk diseleksi dengan kriteria tubuh tidak cacat, sehat, organ tubuh lengkap, bebas dari penyakit, induk jantan belum matang gonad bobot 35 -45 gram per ekor sebanyak 60 ekor dan induk betina sudah matang gonad dengan bobot 60 - 62 gram per ekor sebanyak 18 ekor.
Penebaran dan Aklimatisasi Induk
6
diaklimatisasi selama 2 hari dengan memelihara dan mengadaptasikan induk di dalam bak penelitian. Langkah ini penting untuk dilakukan untuk menghindari udang stres pada saat diberi perlakuan.
Pemeliharaan Induk
Selama pemelihaaraan induk diberi pakan berupa cacing dan tiram segar sebanyak 20% dari biomassa dengan komposisi 50% cacing dan 50% tiram. Pakan diberikan 4 kali dalam sehari yaitu pukul 06.00, 11.00, 16.00 dan pukul 21.00 WIB. Untuk menjaga kualitas air dalam wadah pemeliharaan dilakukan penyiponan dan pergantian air setiap hari sebelum pemberian pakan pukul 11.00 WIB.
Pemberian Perlakuan
Sebelum dilakukan proses penyuntikan, Oodev diracik terlebih dahulu dengan dosis sesuai perlakuan yang telah ditentukan. Karena dosis hormon yang digunakan sangat kecil dan sulit untuk diberi suntikan pada udang, maka dilakukan pengenceran terlebih dahulu dengan larutan NaCl 0.9%.
Induksi hormon dilakukan dengan menyuntikan Oodev pada pangkal kaki jalan kelima menggunakan syringe tuberculineukuran 1 mL. Proses penyuntikan dilakukan pada sore hari pukul 16.00 WIB karena suhu mulai rendah sehingga mengurangi stres pada udang. Selain itu dilakukan sore hari berkaitan dengan sistem endokrin pada udang karena produksi dopamin pada kondisi sore hari cukup rendah dalam tubuh udang sehingga hal tersebut sangat baik untuk efektifitas hormon yang diberikan dalam tubuh udang. Proses ablasi dilakukan dengan memotong salah satu tangkai mata dengan gunting yang telah dipanaskan.
Pengamatan Sel Sperma
Pengamatan sel sperma dilakukan dengan mengambil sampel gonad yaitu bagian vas deferens dan terminal ampula mengunakan pinset dan dimasukkan dalam plastik bening yang berisi larutan Ca2+free saline solution. Ca2+free saline solutiondibuat dengan komposisi per 1 L larutan : 21,63 g NaCl, 1,12 g KCl, 0,53 g H3BO3, 0,19 g NaOH, 4,93 g MgSO47H2O dan pH-nya disesuaikan sampai 7,4
dengan HCl 1 N. Larutan tersebut digunakan sebagai larutan fisiologis agar sel sperma tetap dalam keadaan hidup. Sel sperma dikeluarkan dari gonad untuk mendapatkan larutan Ca2+ free saline solution dengan cara ditekan-tekan dari bagian luar plastik menggunakan jari tangan, lalu diberi pewarna triphan blue
sebanyak 0,5 mL dan didiamkan selama 10-15 menit. Perhitungan jumlah sel sperma menggunakan Neubauer hemacytometer dan diamati mikroskop perbesaran 40x dan 100x (Leung-Trujillo dan Lawrence 1987). Setiap perlakuan diambil satu ekor udang sebagai sampel untuk dibedah dan diambil gonadnya. Sampling pengamatan sel sperma dilakukan setiap 3 hari sekali selama 12 hari pemeliharaan.
Pengamatan Histologi
Pengamatan histologi dilakukan dengan mengambil sampel gonad bagian
7
alkohol 70% dan disimpan sampai hari analisis (Leung-Trujillo dan Lawrence 1978).
Prosedur histologi yaitu gonad difiksasi dan didehidrasi dengan etanol dan dijernihkan dengan kloroform. Contoh gonad kemudian diembeding dalam campuran paraffin-paraplas selanjutnya dipotong menggunakan mikrotom ketebalan 5 µm dan diberi pewarnaan hematoxylin-eosin. Preparat histologi yang telah selesai dikerjakan kemudian diamati dengan mikroskop cahaya perbesaran 40x dan 100x untuk ditentukan tingkat perkembangan gonadnya. Kriteria tingkat perkembangan gonad udang jantan L. vannamei diacu pada Alfaro-montoya dan Hernandes (2012) dan Chowet al.,(1991).
Pengamatan Konsentrasi Testosteron
Sampel hemolim diambil sebanyak 0,3 mL menggunakan syringe volume 1 mL yang telah dibilas dengan antikoagulan, kemudian dimasukkan dalam
mikrotube ukuran 0,5 mL. Sampel hemolim selanjutnya disentrifus dengan kecepatan 5000 rpm dan suhu 40C selama 20 menit. Sampel hemolim yang sudah disentrifus disimpan dalam freezer suhu -20 oC dan simpan sampai proses analisis. Prosedur analisis hormon testosteron dengan teknik ELISA
Percobaan Tahap II
Perkawinan Induk
Perkawinan induk dilakukan dengan menggabungkan induk jantan dan betina dalam satu bak dengan perbandingan 3 jantan 1 betina. Proses perkawinan dilakukan pada sore hari pukul 17.00 WIB. Selama proses perkawinan bak ditutup dengan plastik warna hitam dengan tujuan untuk menciptakan suasana gelap dan berkaitan dengan tingkah laku seksual dan sistem endokrin pada udang. Proses perkawinan dilakukan selama 4 - 5 jam karena apabila dilakukan lebih dari 5 jam betina akan mengeluarkan telur pada bak perkawinan. Induk betina yang telah dibuahi jantan ditandai dengan adanya cairan spermatopori yang menempel pada telikum.
Pemijahan dan Penetasan Telur
Induk betina yang telah dibuahi dipindahkan dari bak perkawinan kedalam drum plastik (blonk) diameter 50 cm dan tinggi 1 m kapasitas air 200 liter yang berfungsi sebagai bak pemijahan. Setiap blonk diisi satu induk betina dan dipisah sesuai perlakuan. Proses pemijahan berlangsung selama 7 - 8 jam kemudian induk diangkat dan dipindahkan kedalam bak penampungan induk. Setelah induk diangkat, telur dalam masing-masing blonk disampling untuk dihitung jumlahnya. Selanjutnya air dalam blonk diberi heater untuk meningkatan suhu air agar mendukung proses penetasan telur.Heaterdibiarkan sampai suhu air mencapai 30
o
8
Parameter Penelitian
Jumlah Sel Sperma
Jumlah sel sperma diperoleh dengan menghitung jumlah keseluruhan sel sperma dalam gonad yaitu jumlah sel sperma normal, abnormal, hidup dan mati yang dihitung setiap 3 hari sekali selama 12 hari pemeliharaan. (Lampiran 1).
Persentase Sel Sperma Nomal atau Abnormal
Persentase sperma normal dan abnormal diperoleh melalui perhitungan :
=jumlah sel sperma normal atau abnormal
jumlah total sel sperma X 100 %
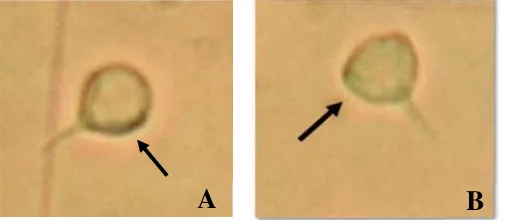
Sel sperma normal bercirikan tubuhspheriesdan ekor panjang, sedangkan sel sperma abnormal bercirikan tubuh cacat seperti bengkok, pendek dan ekor hilang (Leung- Trujillo dan Lawrence 1985)
Gambar 2 Ciri-ciri sel sperma normal (A) dan sel sperma abnormal (B) udang vaname.
Konsentrasi Testosteron
Analisa konsentrasi testoteron dilakukan untuk mengetahui pengaruh induksi Oodev terhadap fluktuasi hormon testoteron dalam hemolim udang jantan selama penelitian. Analisa testosteron dilakukan pada awal, tengah dan akhir penelitian.
Histologi Gonad
Histologi gonad dilakukan untuk mengetahui pengaruh penyuntikan Oodev terhadap perkembangan sel sperma dalam gonad. Pengambilan sampel gonad dilakukan pada awal tengah dan akhir penelitian.
Jumlah Telur
Jumlah telur dari setiap ekor induk ditentukan atas dasar contoh sebanyak 1 liter dari media yang diambil acak 3 kali. Jumlah telur contoh dalam media dihitung untuk dijadikan dasar penentuan jumlah total telur yang dilepas induk betina dengan menggunakan rumus:
Jt = Bp
Ps x Gc x Yt
9
Keterangan:
Jt = jumlah telur yang dihasilkan setiap ekor induk Bp = volume air wadah pemijahan
Ps = frekwensi pengambilan contoh telur
Gc = volume sampel air yang digunakan dalam pengambilan contoh telur Yt = jumlah telur dari seluruh contoh
Jumlah Naupli
Jumlah naupli diperoleh dari banyaknya telur yang dibuahi oleh jantan dan menjadi naupli. Perhitungan jumlah naupli dilakukan 9 jam setelah telur menetas secara keseluruhan.
Hatching Rate (HR)
HR atau derajat penetasan telur didapatkan dengan rumus perhitungan :
HR =Jumlah nauplius menetas
Jumlah telur dibuahi x 100%
Kualitas air
Kualitas air diukur pada awal dan akhir penelitian. Kualitas air dalam bak pemeliharaan selama 12 hari penelitian yaitu temperatur 28 sampai 29oC, salinitas 32 ppt dan pH 7,6 – 7,9. Perubahan kualitas air dalam bak pemeliharaan tidak terlalu fluktuatif karena selama penelitian dilakukan pergantian setiap hari sebanyak 80% agar kualitas air tetap optimal sehingga dapat menunjang pertumbuhan udang selama pemeliharaan.
Analisis Data
Data pengamatan sperma dan konsentrasi testosteron dan pemijahan diolah dan ditabulasi dengan Microsoft Excel 2010. Data sperma dan testosteron dibahas secara deskriptif berdasarkan tren dan grafik sedangkan data pemijahan dianalisis dengan uji ANOVA menggunakan program SPSS. Apabila uji tersebut memberikan hasil yang berbeda nyata dilanjutkan dengan uji lanjut Tukey. Histologi gonad dibahas deskriptif berdasarkan perkembangan morfologi organ.
3
HASIL DAN PEMBAHASAN
Hasil
Jumlah Sperma
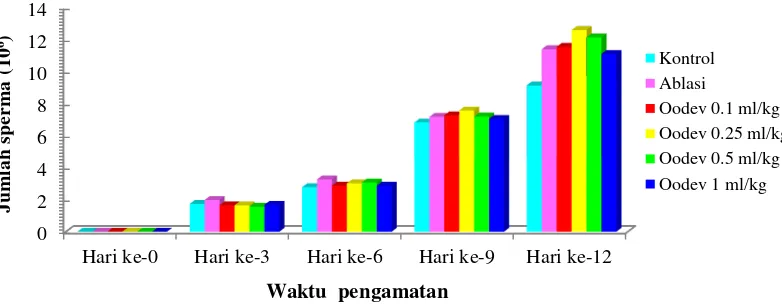
10
menunjukkan peningkatan jumlah sel sperma lebih tinggi. Jumlah sel sperma tertinggi ditunjukkan Oodev dosis 0,25 mL/kg yaitu menghasilkan 12,60x106 sel sperma dan terendah 9,15x106sel sperma pada kontrol.
Gambar 3 Jumlah sel sperma udang vaname selama 12 hari pengamatan
Gambar 4 menunjukkan persentase sel sperma normal tertinggi pada Oodev dosis 0,25 mL/kg yaitu 88,6% (11,10x106) dan terendah 80,3% (7,35x106) pada kontrol. Gambar 5 menunjukkan persentase sel sperma abnormal tertinggi pada ablasi mata yaitu 18,5% (1,8x106) dan terendah 8,6% (0,90x106) pada Oodev dosis 0,5 mL/kg. Hasil tersebut menunjukkan perlakuan Oodev menghasilkan persentase sel sperma normal tertinggi dan abnormalitas terendah jika dibandingkan perlakuan ablasi mata dan kontrol.
Gambar 4 Persentase sperma normal udang vaname selama 12 hari pengamatan
Gambar 5 Persentase sel sperma abnormal udang vaname selama 12 hari pengamatan
Hari ke-0 Hari ke-3 Hari ke-6 Hari ke-9 Hari ke-12
J
Kontrol Ablasi 0.1 ml/kg 0.25 ml/kg 0.5 ml/kg 1 ml/kg
80.3 84.4 87.0 88.1 88.6 85.1
P
Kontrol Ablasi 0.1 ml/kg 0.25 ml/kg 0.5 ml/kg 1 ml/kg
11
Konsentrasi Hormon Testosteron
Gambar 6 menunjukkan konsentrasi testosteron pada awal pengamatan (sebelum penyuntikan Oodev) yaitu 0,11 ng/mL. Hari ke-6 (setelah penyuntikan Oodev) konsentrasi testosteron meningkat pada semua perlakuan. Peningkatan tertinggi ditunjukkan perlakuan ablasi mata yaitu dari 0,11 ng/mL menjadi 0,64 ng/mL sedangkan terendah pada Oodev dosis 0,1 mL/kg yaitu dari 0,11 ng/mL menjadi 0,13 ng/mL. Hari ke-12 terjadi penurunan konsentrasi testosteron kecuali pada kontrol dan Oodev dosis 1 mL/kg menunjukkan peningkatan. Nilai peningkatan konsentrasi hormon testosteron perlakuan Oodev lebih tinggi dibandingkan kontrol.
Gambar 6 Fluktuasi konsentrasi hormon testosteron dalam hemolim udang vaname selama 12 hari pengamatan
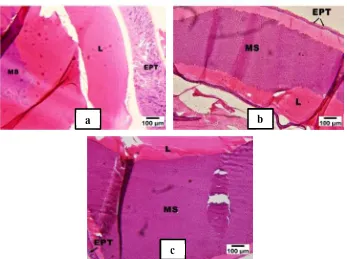
Histologi gonad
Pengamatan histologi gonad sebelum diberi perlakuan (Hari ke-0) menunjukkan gonad belum berkembang. Hal ini ditandai dengan belum ditemukannya sel sperma dalam terminal ampul (Gambar 7). Terminal ampula berfungsi sebagai cetakan spermatofor dan tempat terjadinya ejakulasi selama proses kopulasi. Spermatofor merupakan tempat sel sperma dipaket dan ditampung. Spermatofor terletak dalam terminal ampula, namun pembentukannya terjadi di dalam vas deferens dengan bantuan sel-sel epitel yang melapisi saluran sekretori (Mohammed 1993).
Histologi gonad hari ke-6 menunjukkan terjadi pemindahan sel sperma dalam spermatofor pada semua perlakuan, hal ini ditandai dengan terlihatnya sel sperma. Dari pengamatan secara mikroskopis terlihat bahwa sintesis sel sperma pada perlakuan ablasi dan Oodev melebihi 50% (Gambar 8b dan 8c), sedangkan pada kontrol berkisar 40 - 45% (Gambar 8a). Pada hari ke-12 perlakuan ablasi mata dan Oodev dosis 0,1 mL/kg dan 1 mL/kg terjadi pemindahan sel sperma berkisar 85% (Gambar 9b), sedangkan Oodev dosis 0,25 mL/kg dan 0,5 mL/kg melebihi 90% hal itu terlihat dari hampir sebagian besar bagian lumen dalam terminal ampula terisi sel sperma (Gambar 9c). Perlakuan kontrol menunjukkan pemindahan sel sperma yang lebih lambat dibandingkan perlakuan lain, hal itu terlihat dari beberapa bagian lumen dalam terminal ampula belum terisi sel sperma dan masih terlihat sel epitel dibeberapa bagian terminal ampula. Pemindahan sel sperma pada kontrol berkisar 80% (Gambar 9a). Alfaro-montoya
0.0
(Hari ke-0) (Hari ke-6) (Hari ke-12)
12
(2010) menjelaskan mekanisme pematangan gonad (pembentukan spermatozoa) pada udang jantan yaitu spermatogenesis terjadi di dalam testis, selanjutnya van deferens bekerja mengangkut atau memindahkan sel sperma dari testis kedalam spermatofor. Selain itu vas deferens berfungsi sebagai tempat pematangan sel sperma. Selanjutnya dalam spermatofor sel sperma akan disimpan dan dipaketkan sampai menunggu proses perkawinan.
Gambar 7 Histologi gonad udang vaname hari ke-0 sebelum diberi perlakuan. Ket. EPT:Lapisan epitel; MSX:Lapisan otot; NUC:Nukleus; L:Lumen; AG: Kelenjar androgenic; MS: Massa sperma
Gambar 8 Histologi gonad udang vaname hari ke-6 setelah diberi perlakuan. Kontrol (a), Ablasi Mata (b), Oodev (C). Ket EPT:Lapisan epitel; MSX:Lapisan otot; L:Lumen; MS: Massa sperma
b a
13
Gambar 9 Histologi gonad udang vaname hari hari ke-12. Kontrol (a), Ablasi Mata (b), Oodev (c) Ket EPT:Lapisan epitel; L:Lumen; MS: Massa sperma
Jumlah Telur, Jumlah Naupli dan HR
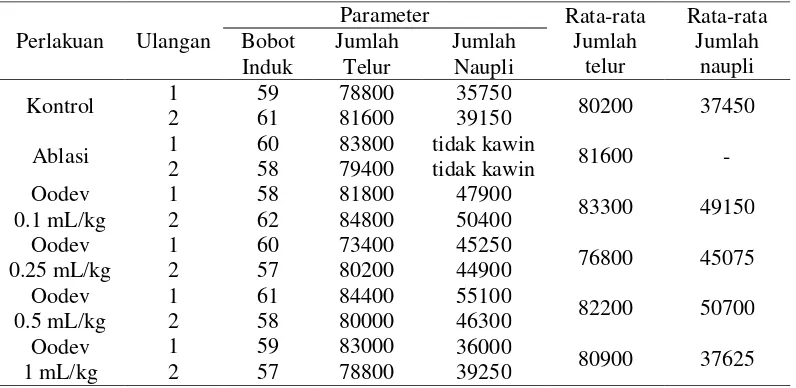
Rata-rata jumlah telur, jumlah naupli dan HR yang dihasilkan pada masing-masing perlakuan disajikan pada Tabel 1.
Tabel 1. Rata-rata jumlah telur dan jumlah naupli udang vaname
Perlakuan Rata-rata bobotinduk betina (gram)
Rata-rata jumlah telur (butir)
Rata-rata jumlah
naupli (ekor) HR (%)
Kontrol 61 ± 1,41 80.200a± 1.838,4 37.450b± 2.404,2 46,68b Ablasi 60 ± 1,41 81.600a±1.979,9 Tidak kawin -0.1 mL/kg 60 ± 2,83 83.300a± 2.121,3 49.150ab± 1.767,8 59,00ab 0.25 mL/kg 58,5 ± 2,12 76.800a± 2.262,7 45.075ab± 2.651,6 58,82ab 0.5 mL/kg 59,5 ± 2,12 82.200a± 3.111,3 50.700a± 1.979,8 61,58a
1 mL/kg 58 ± 1,41 80.900a± 2,969,8 37.625b± 2.298,1 46,59b Keterangan: Angka-angka yang ditandai dengan huruf (superscript) yang berbeda pada baris yang
sama menunjukkan ada perbedaan (p<0.05) antar perlakuan dan angka dibelakang ± menyatakan nilai standar deviasi
Rata-rata jumlah telur yang dihasilkan pada masing-masing perlakuan menunjukkan jumlah yang tidak berbeda nyata (P>0.05). Sedangkan rata-rata jumlah naupli menghasilkan jumlah yang berbeda nyata (P<0.05). Jumlah naupli tertinggi ditunjukkan perlakuan Oodev yaitu menghasilkan 45.637 naupli dengan HR 56,50%, sedangkan kontrol hanya menghasilkan rata-rata jumlah naupli 37.450 dengan persentase 46,68% yang merupakan jumlah naupli terendah dari semua perlakuan. Oodev dosis 0,5 mL/kg menghasilkan rata-rata jumlah naupli tertinggi yaitu 50.700 naupli dengan HR 61,58% dan berbeda nyata dengan
a
c
14
kontrol (P<0,05). Pada perlakuan ablasi mata, induk tidak menghasilkan naupli diduga karena masing-masing tangkai mata pada induk jantan dan betina sudah dihilangkan sehingga induk susah untuk melakukan perkawinan.
Pembahasan
Jumlah sel sperma dengan persentase sel sperma normal dan abnormalitas yang rendah merupakan salah satu tolok ukur yang menentukan kualitas sel sperma udang (Leung-Trujillo dan Lawrence 1987). Jumlah sel sperma yang tinggi dengan abnormalitas yang rendah akan meningkatkan kualitas pembuahan karena dapat memperbesar peluang sel sperma dalam membuahi sel telur sehingga akan berpengaruh terhadap jumlah nauplius yang dihasilkan (Perez-Jar 2007).
Pengamatan sel sperma hari ke-3 sampai hari ke-6 perlakuan ablasi mata menunjukkan peningkatan jumlah sel sperma yang lebih tinggi. Diduga pengaruh organ-X pada tangkai mata yang menghambat produksi sel sperma pada udang sudah dihilangkan sehingga menurunkan sekresi hormon penghambat GIH dan MOIH. Huberman (2000) menyatakan bahwa Organ-X merupakan organ yang mensintesis dan mensekresikan hormon penghambat GIH dan MOIH. Pengaruh kedua hormon tersebut sangat dominan dalam tubuh udang karena dapat menghambat akftitas sekresi GSH. Pada hari ke-9 sampai hari ke-12 terjadi peningkatan jumlah sel sperma pada perlakuan Oodev. Diduga Oodev yang disuntikan baru bereaksi optimal dalam tubuh udang diatas hari ke-6. Hal ini didukung dari data analisis testosteron yang menunjukkan peningkatan konsentrasi testosteron dalam hemolim diatas hari ke-6. Peningkatan testosteron diduga akan meningkatan kinerja testis untuk percepatan produksi sel sperma karena testosteron merupakan hormon yang berperan penting sebagai bahan pembentukan sel sperma.
Perlakuan Oodev dosis 0,25 mL/kg dan 0,5 mL/kg menunjukkan performa kualitas sel sperma yang lebih baik dibandingkan perlakuan lain. Oodev dosis 0,25 mL/kg menghasilkan jumlah sel sperma sebesar 12,60x106dengan persentase sel sperma normal 88,1% dan abnormalitas 9,5%. Oodev dosis 0,5 mL/kg menghasilkan jumlah sel sperma 12,15x106dengan persentase sel sperma normal 89% dan abnormalitas 8,6%. Kontrol menghasilkan 9,15x106sel sperma dengan persentase sel sperma normal 80,3% dan abnormalitas 18,4%. Alfaro (1996) melaporkan induksi hormon steroid 17α-methyltestosteron dan 17α -hydroxyprogesterone pada udang vaname jantan dapat meningkatkan jumlah sel sperma sebesar 32x106dengan abnormalitas sel sperma sebesar 23,5%, sedangkan kontrol menghasilkan 11x106sel sperma dengan abnormalitas sel sperma 48%.
Perlakuan ablasi mata menghasilkan jumlah sel sperma sebesar 11.5x106 dengan persentase sel sperma normal 84,4% dan abnormalitas 18,5%. Jumlah tersebut masih lebih rendah jika dibandingkan perlakuan Oodev, tetapi jika dibandingkan kontrol, ablasi mata menunjukkan jumlah lebih tinggi. Hasil tersebut sama seperti yang dilaporkan oleh Leung-Trujillo dan Lawrence (1985) yaitu ablasi mata meningkatkan jumlah sel sperma sebesar 81,8x106 sedangkan kontrol menghasilkan 31,9x10 sel sperma.
15
untuk merangsang sintesis GSH endogenus dalam mempercepat dan meningkatkan kualitas sperma. Sedangkan dosis Oodev diatas 0,5 dan bawah 0,1 mL/kg diduga dapat menghambat kerja organ target. Menurut Nugraha (2014) pada ikan patin dosis Oodev diatas 0,5 mL/kg dan di bawah 0,25 mL/kg dapat menghambat kerja hipotalamus melepaskan GnRH untuk merangsang sekresi dan sintesis hormon gonadotropin.
Penyuntikan Oodev selain dapat meningkatkan jumlah sel sperma, juga dapat memperbaiki tingkat abnormalitas sel sperma dibandingkan perlakuan ablasi mata dan kontrol. Mekanisme terjadinya abnormalitas sperma pada udang belum diketahui secara pasti. Menurut Leung-Trujillo dan Lawrence (1985) kualitas sel sperma udang dipengaruhi oleh infeksi bakteri dan sel sperma abnormal dapat mempengaruhi kemampuan fertilisasi sel sperma normal sehingga berpengaruh terhadap jumlah nauplius yang dihasilkan. Namun pada penelitian ini tidak dilakukan pengamatan terhadap infeksi bakteri pada sel sperma.
Penelitian ini adalah laporan pertama dari perbaikan kinerja reproduksi induk jantan vaname khususnya dalam hal peningkatan kualitas sperma dengan penyuntikan hormon Oodev, karena aplikasi Oodev lebih banyak digunakan pada induk betina baik itu pada udang maupun ikan.
Induksi Oodev melalui penyuntikan bekerja efektif dan sinergis dalam tubuh udang untuk mempercepat dan meningkatkan kualitas sperma udang vaname. Diduga bahan aktif yang terkandung dalam Oodev tersirkulasi dalam hemolim kemudian bekerja secara parakrin dalam organ target untuk merangsang percepatan sintesis sel sperma. Zara (2012) menyatakan, spermatogenesis pada udang terjadi di lobulus seminiferus yang terletak di testis. Menurut Schulz et al.
(2010) pada ikan proses spermatogenesis dipengaruhi kerja hormon androgen dan gonadotropin FSH dan LH. FSH merangsang reseptor FSH pada sel sertoli yang terletak di tubulus seminiferous untuk memacu pematangan sel sperma dan mendukung perkembangan dan kelangsungan hidupgerminal sel. LH merangsang produksi androgen disel leydig melalui aktivasi reseptor LH. Didalam testis, sel-sel leydigterletak diantaratubulus seminiferousdi daerah interstisial, yaitu tempat androgen berdifusi kedalam seminiferous dan memediasi akfititas biologis LH yang menyebabkan sel sperma dihidrasi oleh larutan seminal untuk menghasilkan larutan sperma yang disebut cairan semen. Laporan keberadaan FSH dan LH endogenus pada krustasea telah dilaporkan (Ye et al. 2006) yaitu FSH dan LH seperti pada vertebrata terdeteksi pada otak kepiting bakau Scylla serrata, dan laporan yang sama dikemukakan oleh Huang (2008) yaitu FSH dan LH endogenus terdeteksi pada otak dan ganglion thorac rajungan Portunus trituberculatus.
Huang (2008) menyatakan bahwa dari laporan tersebut dapat dipastikan bahwa krustasea dapat mensintesis gonadotropin FSH dan LH endogenus seperti pada vertebrata.
Testis dewasa memiliki dua peran penting yaitu selain produksi sel sperma, testis juga berperan dalam sintesis dan sekresi hormon testosteron. Testosteron merupakan hormon androgen (jantan) yang berfungsi mengatur pertumbuhan organ kelamin sekunder, perilaku seksual dan fungsi reproduksi (McLachlan et al. 1996). Induksi Oodev meningkatkan konsentrasi testosteron dalam hemolim udang. Meningkatnya konsentrasi testosteron diduga disebabkan FSH dan LH eksogenus yang terkandung dalam Oodev merangsang otak dan
16
gonadotropin sebagai pemicu diproduksinya hormon androgen testosteron. Alur mekanismenya sebagaimana dijelaskan oleh Fingerman (1997) yaitu, GSH yang ditransportasikan melalui hemolim merangsang kelenjar androgen yang terletak didalam gonad untuk mengaktifkan sintesis dan sekresi pelepasan AGH.
Oodev dosis 0,5 mL/kg menunjukkan konsentrasi testosteron tertinggi dibandingkan kontrol. Tingginya konsentrasi testosteron pada dosis 0,5 mL/kg diduga dosis tersebut merupakan dosis optimal yang mempengaruhi kerja otak dan
ganglion thorac untuk mengatur sintesis AGH oleh kelenjar androgen yang berperan dalam produksi testosteron. Meningkatnya konsentrasi testosteron pada perlakuan ablasi mata diduga terjadi penurunan sekresi dan sintesis hormon penghambat GIH dan MOIH pada organ-X yang terletak pada tangkai mata. Fingerman (1997) menyatakan bahwa GIH dan MOIH sangat berpengaruh terhadap aktivitas reproduksi udang karena menghambat kerja otak dan ganglion thorac untuk mensintesis dan mensekresikan GSH. Hilangnya salah satu tangkai mata pada udang berpengaruh terhadap sintesis dan sekresi GSH yang tidak terhambat.
Menurunnya konsentrasi testosteron hari ke-12 karena gonad telah mencapai tahap kematangan. Hal ini diperkuat dari data histologi yang menunjukkan telah terjadi pemindahan sel sperma dalam terminal ampula. Menurut Schulz dan Miura (2002) pada saat tahap spermatozoa dan mencapai tahap fertilisasi, sintesis dan sekresi testosteron dalam testis akan cenderung lambat. Mirheydari (2014) menjelaskan bahwa terdapat hubungan antara tingkat hormon seks steroid yaitu testosteron, 17β-estradiol dan progesteron dengan proses spermatogenesis dan pemijahan pada Astacus leptodactylus. Pada kontrol, konsentrasi testosteron hari ke-12 menunjukkan peningkatan. Hal ini menandakan gonad belum mencapai tahap kematangan sempurna. Hal tersebut diperkuat dari hasil histologi yang menunjukkan pemindahan sel sperma dalam terminal ampula pada kontrol cenderung lebih lambat yaitu berkisar 85%.
17
testosteron asetat (TSA) pada udangParapenaeopsis hardwickii secara signifikan meningkatkan diameter folikel gonad, berat gonad, indeks gonad dan jumlah spermatosit dibandingkan dengan kontrol. Selain itu folikel gonad dari udang kontrol memiliki sel-sel epitel lebih kecil dan hanya berisi spermatogonium dan spermatosit dalam lumina, sedangkan udang disuntikkan hormon memiliki sel-sel epitel lebih besar dan spermatozoa ditemukan di lumina folikel gonad. Hasil positif tersebut sama seperti yang didapatkan pada penelitian ini yaitu induksi Oodev meningkatkan 85 - 90% spermatozoa dalam lumina folikel gonad sedangkan kontrol berkisar 80%.
Oodev dosis 0,25 mL/kg dan 0,5 mL/kg menunjukkan kematangan gonad yang lebih cepat dibandingkan perlakuan lain yaitu lebih dari 90%. Hal ini diperkuat dari data pengamatan sel sperma yang menunjukkan percepatan pemindahan sel sperma pada spermatofor sehingga berpengaruh terhadap peningkatan jumlah sel sperma. Perlakuan ablasi mata menunjukkan respon positif dalam meningkatkan kinerja reproduksi udang, hal tersebut diperkuat dari hasil histologi yang menunjukkan percepatan kematangan gonad dibandingkan kontrol meskipun perlakuan Oodev menunjukan hasil yang lebih baik. Selain itu pada parameter konsentrasi testosteron ablasi mata menunjukkan nilai konsentrasi tertinggi dibandingkan perlakuan lain serta menghasilkan kualitas sperma lebih baik dibandingkan kontrol.
Selain peran PMSG, AD yang terkandung dalam Oodev dapat memberikan respon positif dalam memperbaiki kinerja reproduksi udang. Hal ini dibuktikan dari beberapa parameter penelitian yang menunjukkan perlakuan Oodev dapat meningkatkan kualitas sel sperma, konsentrasi testosteron dan mempercepat kematangan gonad. Sarojini et al. (1995) melaporkan penggunaan dopamin antagonis dapat merangsang percepatan pematangan testis dan spermatogenesis pada udangP. clarkii. Selain itu Rodriguezet al. (2002) melaporkan DA antagonis, spiperone (SP), dapat meningkatkan indeks gonadosomatik (GSI) di P. clarkii, ketika disuntikkan pada vitelogenesis awal. Dopamin merupakan neurotransmiter
yang berperan negatif dalam menghambat aktivitas reproduksi udang. Pada udang, dopamin memiliki efek penghambatan pada pematangan gonad dengan merangsang pelepasan GIH dan menghambat pelepasan GSH (Fingerman 1997). Diduga AD bekerja efektif dalam tubuh udang untuk memblok aktivitas dopamin pada sistem syaraf pusat udang. Hasil positif ini membuktikan bahwa premix bahan aktif PMSG dan AD dan yang terkandung dalam Oodev bekerja sinergis untuk percepatan maturasi dan perbaikan kinerja reproduksi pada udang jantan L. vannamei.
18
Jumlah naupli dan HR dihasilkan pada perlakuan Oodev menunjukkan jumlah tertinggi dibandingkan kontrol. Oodev dosis 0,5 mL/kg menghasilkan jumlah naupli tertinggi dibandingkan perlakuan lain. Tingginya jumlah naupli dan HR dihasilkan perlakuan Oodev dosis 0,5 mL/kg diduga induk pada perlakuan tersebut memiliki performa kualitas dan kuantitas sel sperma yang lebih baik sehingga akan mempengaruhi kualitas pembuahan. Hal tersebut diperkuat dari data pengamatan sel sperma yang menunjukkan Oodev dosis 0,5 mL/kg menghasilkan jumlah sel sperma tertinggi dengan sel sperma normal tinggi dan abnormalitas rendah. Perez-Jar (2007) menyatakan kualitas dan kuantitas sel sperma udang jantan menjadi faktor pembatas pada reproduksi udang karena berkaitan dengan kemampuannya untuk membuahi sel telur. Selain faktor kualitas sel sperma derajat pembuahan dan penetasan telur sangat ditentukan juga pada kemampuan penempelan sel sperma pada telikum. Hasil tersebut menunjukkan bahwa induksi Oodev selain dapat memperbaiki kinerja reproduksi udang dengan meningkatkan kualitas sel sperma dan mempercepat kematangn gonad juga terbukti secara kuantitatif dapat meningkat kualitas pembuahan yaitu menghasilkan jumlah naupli dan HR yang tinggi dibandingkan kontrol.
Hasil positif yang didapatkan dari beberapa parameter diatas membuktikan bahwa induksi maturasi menggunakan Oodev yang diadopsi dari induk betina dapat juga memberikan respon positif pada induk jantan. Hasil tersebut meyakinkan bahwa mekanime kerja Oodev dalam tubuh udang sama seperti pada ikan. Selain itu diyakini juga bahwa sistem kontrol reproduksi pada ikan dan udang memiliki kesamaan sistem kontrol reproduksi. Hal ini diperkuat dari beberapa penelitian yang menyatakan bahwa pada krustasea terdapat GnRH, FSH dan LH endogenus. Pada ikan hormon tersebut sangat berperan penting sebagai pengontrol proses reproduksi. Keberadaan GnRH seperti pada vertebrata telah dilaporkan Ngernsoungnern et al.(2008) terdeteksi pada Central Nervous System
(CNS) di otak danganglion thorac udang GalahM. rosenbergiidan laporan yang sama dijelaskan Huang et al. (2013) yaitu GnRH endogenus terdeteksi pada otak kepiting Tachypleus tridentatus. Menurut Ngernsoungnern et al. (2008) GnRH diduga terlibat dalam aktiftas reproduksi pada udang, Lebih lanjut dikatakan GnRH terlibat langsung dalam perkembangan oosit udang Galah Macrobrachium rosenbergii. Hal tersebut diperkuat hasil penelitian Tinikul et al. (2014) yaitu induksi GnRH pada udang L. vannamei secara signifikan merangsang percepatan pematangan ovarium sampai tahap IV, meningkatkan gonad somatik indeks (GSI) dan diameter oocyte. Namun hubungan antara GnRH dan GSH dalam tubuh udang diperlukan kajian lebih lanjut (Ngernsoungnernet al.2008).
19
ganglion thorackepitingS. Paramamosain. Beberapa laporan diatas memperkuat hasil yang didapatkan pada penelitian ini yaitu induksi Oodev dapat mempercepat maturasi dan meningkatkan kinerja reproduksi udang vaname jantan
4 SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa :
1. Induksi maturasi menggunakan Oodev yang diadopsi dari teknik induksi pada induk betina dapat juga mempercepat maturasi dan meningkatkan kinerja reproduksi udang vaname jantan.
2. Induksi Oodev dapat meningkatkan jumlah sel sperma dengan persentase normalitas sel sperma tinggi dan abnormalitas rendah, meningkatkan konsentrasi testosteron lebih tinggi dibandingkan kontrol, mempercepat kematangan gonad 85% - 90% sedangkan kontrol hanya 80%, meningkatkan kualitas pembuahan yaitu menghasilkan rata-rata jumlah naupli tertinggi sebesar 45.637 naupli dengan HR 56,50% sedangkan kontrol 37.450 naupli dengan HR 46,68%.
3. Oodev dosis 0,5 mL/kg merupakan dosis optimal untuk mempercepat maturasi dan meningkatkan kinerja reproduksi udang vaname jantan.
Saran
1. Untuk mempercepat maturasi dan meningkatkan kinerja reproduksi udang vaname jantan,disarankan menggunakan Oodev dosis 0,5 mL/kg.
2. Diperlukan penelitian dan kajian lebih lanjut tentang metode induksi maturasi menggunakan Oodev yang lebih praktis dan dapat meminimalisir stres pada udang akibat penyuntikan.
DAFTAR PUSTAKA
Alfaro J. 1993. Reproductive quality evaluation of malePenaeus srylirosrrisfrom a grow-out pond.Journal of the World Aquaculture Society,24:6-11.
Alfaro J. 1996. Effect of17α-Methyltestosteron and 17α-Hydroxyprogesteroneon the Quality of White Shrimp Penaeus vannamei Spermatophores. Journal of the World aquaculture society,28:35-39.
Alfaro J. 2001. Controlled reproduction of penaeid shrimp: a contribution to its improvement. [Thesis]. Wageningen: Wageningen university.
Alfaro-montoya 2010. The reproductive conditions of male shrimps, genus
Penaeus, sub-genus Litopenaeus (open thelyca penaeoid shrimps): a review.
20
Alfaro-montoya J, Hernandez L. 2012. The histological structure of the androgenic gland and cellular cord of the male reproductive system of adult Litopenaeus and Rimapenaeus byrdi. Journal of Crustacean Biology, 32(3): 351-357.
Arcos FG, Ibara AM, Palacios E, Vasquez-bouncard C, Racotta IS. 2003. Feasible predictive criteria for reproduction performance of white shrimp Litopenaeus vannamei: egg quality and female physiological condition. Aquaculture, 228: 335-349.
Bolamba D, Matton P, Estrada R, Dufour JJ. 1992. Effect of Pregnant Mare Serum Gonadotropin on follicular population and ovulation rates in prepubertal gilts with two morphologically different ovarium types. J. Anim.Sci70 : 1916-1992.
Ceballos-Vásquez BP, Palacios E, Aguilar-Villavicencio J, Racotta I. 2010. Gonadal development in male and female domesticated whiteleg shrimp,
Litopenaeus vannamei, in relation to age and weight. Aquaculture, 308:116-123.
Chen C, Fernald D. 2008. Review Paper.GnRH and GnRH receptors: distribution, function and evolution.Journal of Fish Biology, 73:1099–1120.
Chow S, Dougherty MM, Dougherty WJ and Sandifer PA. 1991. Spermatophore formation in the white shrimps Penaeus setiferus and Penaeus vannamei. Crust. Biol.,11:20l-216.
Dufour S, Sebert ME, Weltzien FA, Rousseau K, Pasqualini C. 2010. Neuroendocrine control by dopamine of teleost reproduction. Journal of Fish Biology,76:129-160.
Farastuti ER, 2014. Induksi Maturasi Gonad, Ovulasi dan Pemijahan pada Ikan Torsoro (Tor Soro) menggunakan Kombinasi Hormon. [Tesis] Bogor: Institut Pertanian Bogor.
Fingerman M. 1997. Roles of neurotransmitters in regulating reproductive hormone release and gonadal maturation in decapod crustaceans. Invertebrat. Reprod. Dev.31:47-54.
Hafez ESE, Hafez B. 2000. Reproduction in farm animal. Ed ke-7. Philadelphia, Pennsyvania: Lappicod Williams & Wilkins.
Huang H, Ye H, Li S, Wang G, 2008. Immunocytological evidence for the presence of vertebrate FSHand LH-like substances in the brain and thoac ganglion of the swimming crab, Portunus trituberculatus.Progress in Natural Science,18:1453–1457.
Huang HY, Li L, Ye H, Feng B, Li S. 2013. Identification and distribution of gonadotropin-releasing hormone-like peptides in the brain of horseshoe crab
Tachypleus tridentatus. Chinese Journal of Oceanology and Limnology, Vol. 31 No. 2: 384-390
Huberman A. 2000. Shrimp endocrinology. A review.Aquaculture. 191:191-208. [JI] Jurnal Maritim. 2015. Produksi udang ditargetkan meningkat 32% tahun
2015. [internet]. [diacu 2015 juni 10]. Tersedia dari: http://jurnalmaritim.com/category/e-magazine/.
21
Leung-Trujillo J., Lawrence AL. 1987. Observations on the decline in sperm quality of Penaeus setiferus under laboratory conditions.Aquaculture, 65:363-370.
Mayasari N, Sudrajat AO, Chrismadha T. 2012. Induksi pertumbuhan dan perkembangan gonad serta kemampuan reproduksi ikan lele dumbo (Clarias sp.) betina dengan spirulina dan hormon pmsg. Jurnal Limnotek, 19(2):193-205
McLachlan RI, Wreford. NG, O’Donnell L, Kretser DM de and Robertson DM. 1996. The endocrine regulation of spermatogenesis: independent roles for testosteron and FSH.Journal of Endocrinology,148:1-9.
Mirheydari SM, Paolucci M, Matinfar A, Soltani M, Kamali A, Asadpour-Ousalou Y. 2014. Occurrence of Vertebrate-Like Steroids in the Male Narrow-Clawed CrayfishAstacus leptodactylus. Global Veterinaria13 (2): 247-254 Mohamed SK, Diwan AD. 1993. Spermatogenesis and spermatophore formation
in the indian white prawnpenaeus indicus.Journal of the Marine Biological Association of India 35(1-2): 180-192.
Nagabhushanam R, Kulkarni GK. 1981. Effect of exogenous testosteron on the androgenic gland and testis of a marine penaeid prawn, Parapenaeopsis hardwickii (Crustacea Decapoda, Penaeidae).Aquaculture,23:19-27.
Ngernsoungnern P, Ngernsoungnern A, Kavanaugh S, Sobhon P, Sower SA, Sretarugsa P. 2008. The identification and distribution of gonadotropin-releasing hormone-like peptides in the central nervous system and ovary of the giant freshwater prawn,Macrobrachium rosenbergii.Invert Neurosci8:49-57. Ngernsoungnern P, Ngernsoungnern A, Sobhon P, Sretarugsa P. 2009.
Gonadotropin releasing hormone (GnRH) and a GnRH analog induce ovarian maturation in the giant freshwater prawn, Macrobrachium rosenbergii.
Invertebr. Reprod. Dev. 53:125-135.
Nugraha AD. (2014). Induksi Pematangan Gonad Ikan Patin Siam Pangasianodon hypophthalmus Secara Hormonal Menggunakan Oodev Melalui Pakan Selama Empat Minggu. [Skripsi] Bogor : Institut Pertanian Bogor.
Okumura T. 2004. Perspectives on hormonal manipulation of shrimp reproduction review. JARQ 38:49–54.
Perez-Jar L, Ramos L, Palocios E, Racotta ES. 2007. Reproductive performance and sperm quality in wild and pond-reared southern white shrimpLitopenaeus schmittiadult males during continuous reproductive activity. Rev. Invest Mar. 28(3):237-246.
Qonitah AM. 2013. Rekayasa Hormonal Pada Udang Vaname Selama 14 Hari Sebagai Pengganti Teknik Ablasi Mata Dalam Usaha Percepatan Pematangan Gonad. [Skripsi] Bogor : Institut Pertanian Bogor.
Sarojini R, Nagabhushanam R, Fingerman M. 1995. In vivo effects of DA and DArgic antagonists on testicular maturation in the red swamp crayfish,
Procambarus clarkii.Biol. Bull.189:340–346.
Schulz WR, Miura Takeshi. 2002. Spermatogenesis and its endocrine regulation.
Fish Physiology and Biochemistry26:43–56.
Schulz RW, Franca LR, Lareyre JJ,et al. (2010) Spermatogenesis in fish.General and Comparative Endocrinology. 165: 390-411.
22
hormones and dopamine on ovarian maturation in the Pacific white shrimp,
Litopenaeus vannamei and their presence in the ovary during ovarian development. Aquaculture 420-421:79-88
Ye HH, Huang HY, Li SJ, Wang GZ. 2006. Immunorecognition of vertebrate FSH and LH brain of Scylla serrata.Prog. Nat.Sci. 16:768-770. (in chinese with english abstract)
Ye HH, Huang H, Li S, Wang G. 2008. Immunorecognition of estrogen and androgen receptors in the brain and ganglion thorac mass of mud crab, Scylla paramamosain. Progress in Natural Science18:691-695
Zara FJ. Toyama MH. Caetano FH. López-Greco LS. 2012. Spermatogenesis, spermatophore, and Seminal fluid production in the adult blue crab Callinestes danae(Portunidae). Journal of Crustacean Biology32(2):249-262.
23
LAMPIRAN
Lampiran 1 Data pengamatan sel sperma udang vaname selama 12 hari pemeliharaan
Perlakuan Jumlah Sel sperma (10
6
)
Rata-rata SD Hari ke-3 Hari ke-6 Hari ke-9 Hari ke-12
Kontrol 1.74 2.784 6.825 9.150 4.100 3.776
Ablasi 1.98 3.264 7.175 11.400 4.764 4.543
Oodev 0.1 ml/kg 1.65 2.880 7.275 11.550 4.671 4.697 Oodev 0.25 ml/kg 1.65 3.024 7.575 12.600 4.970 5.112 Oodev 0.5 ml/kg 1.56 3.072 7.200 12.150 4.796 4.907 Oodev 1 ml/kg 1.68 2.880 7.050 11.100 4.542 4.497
Perlakuan Sel sperma Normal (10
6
)
Rata-rata SD Hari ke-3 Hari ke-6 Hari ke-9 Hari ke-12
Kontrol 0.69 1.776 5.4 7.35 3.804 3.182
Ablasi 0.51 2.064 5.25 9.75 4.393 4.043
Oodev 0.1 ml/kg 0.63 1.968 6.225 10.05 4.718 4.266 Oodev 0.25 ml/kg 0.54 2.208 6.525 11.1 5.093 4.689 Oodev 0.5 ml/kg 0.45 2.208 6.3 10.8 4.939 4.564
Oodev 1 ml/kg 0.57 1.968 6 9.45 4.497 4.025
Perlakuan Sel sperma Abnormal (10
6
)
Rata-rata SD Hari ke-3 Hari ke-6 Hari ke-9 Hari ke-12
Kontrol 0.78 0.816 1.125 1.5 0.844 0.554
Ablasi 1.05 0.96 1.275 1.8 1.017 0.655
Oodev 0.1 ml/kg 0.75 0.816 0.825 1.05 0.688 0.401 Oodev 0.25 ml/kg 0.78 0.72 0.9 1.05 0.690 0.406 Oodev 0.5 ml/kg 0.84 0.72 0.675 0.9 0.627 0.362 Oodev 1 ml/kg 0.72 0.816 0.75 1.2 0.697 0.435
Perlakuan Sperma Mati (10
6
)
Rata-rata SD Hari ke-3 Hari ke- 6 Hari ke- 9 Hari ke- 12
Kontrol 0.27 0.192 0.375 0.9 0.347 0.3379
Ablasi 0.36 0.24 0.375 1.2 0.435 0.4532
24
Lampiran 2 Hasil analisis konsentrasi testosteron udang vaname selama 12 hari pemeliharaan
Kontrasi testosteron (ng/mL)
Perlakuan
Hari ke-0 Hari ke-6 Hari ke-12
Rata-rata SD
Kotrol 0.11 0.13 0.16 0.133 0.025
Ablasi 0.11 0.64 0.22 0.323 0.280
Oodev 0.1 ml/kg 0.11 0.19 0.17 0.157 0.042 Oodev 0.25 ml/kg 0.11 0.20 0.18 0.163 0.047 Oodev 0.5 ml/kg 0.11 0.24 0.19 0.180 0.066
Oodev 1 ml/kg 0.11 0.16 0.19 0.153 0.040
Lampiran 3 Hasil Perhitungan jumlah telur dan jumlah naupli udang vaname
Lampiran 4 Hasil analisis sidik ragam data jumlah naupli
TabelAnalysis of variancejumlah naupli
Sumber keragaman db JK KT F hitung P
perlakuan 4 312222500 78055625 7.3682565 .0251 *
error 5 52967500 10593500<
total 9 365190000
Tabel Hasil Uji Lanjut Beda Nyata Jujur (BNJ) Taraf 5 % Urutan Perlakuan Rata-rata Notasi
1 0.5 mL/kg 50700 a BNJ 5% = 8366.6416817
Perlakuan Ulangan
Kontrol 1 59 78800 35750
39150 80200 37450
2 61 81600
Ablasi 1 60 83800 tidak kawin
tidak kawin 81600
-2 58 79400
Oodev 0.1 mL/kg
1 58 81800 47900
50400 83300 49150
2 62 84800
Oodev 0.25 mL/kg
1 60 73400 45250
44900 76800 45075
2 57 80200
Oodev 0.5 mL/kg
1 61 84400 55100
46300 82200 50700
2 58 80000
Oodev 1 mL/kg
1 59 83000 36000
39250 80900 37625
25
Lampiran 5 Prosedur analisis hormon testosteron dengan teknik ELISA
Semua reagen harus dikondisikan pada suhu kamar (18-25 °C) sebelum digunakan. Selanjutnya, dipersiapkan terlebih dahulu larutan standar dengan kosentrasi 0,2; 0,5; 1; 2; 4; 8; 16 ng/ml dan larutan QC (quality control). Adapun prosedur pengerjaan ELISA adalah sebagai berikut:
1. Dimasukkan ke dalam masing-masing sumur pelat (microplate) sebanyak 25 μl standar, sampel dan QC (quality control).
2. Ditambahkan 200μl konjugat enzim HRP Testosteron (Enzym Conjugate)ke dalam setiap sumur, kemudian digoyang perlahan selama kurang lebih 10 detik.
3. Diinkubasi pada suhu kamar selama 1 jam
4. Setelah diinkubasi,larutan pada mikroplate dibuang dan dicuci dengan larutan pencuci (washing solution) dengan volume 300 μl setiap sumur. Pencucian dilakukan sebanyak 4 kali menggunakan alat Microplate Strip Washer Elx50TM. Setelah pencucian selesai,kemudian dikeringkan.
5. Ditambahkan 200 μl larutan substrat (TBM Substrate) pada masing-masing sumur pelat.
6. Inkubasi selama 20 menit pada suhu ruang.
7. Setelah inkubasi dengan larutan substrat, reaksi enzimatis dihentikan dengan menambahkan 100μl larutan penyetop (Stop Solution, H2SO40,5 M) ke dalam
setiap sumur pelat.
8. Setelah itu, absorbans dibaca pada panjang gelombang 450 nm menggunakan
ELISA reader (absorbance microplate reader Elx808TM) yang telah dilengkapi dengan program Gen 5 (BioTek® Instruments, Inc.). Pembacaan dilakukan tidak boleh lebih dari 10 menit setelah penambahan larutan penyetop reaksi.
Lampiran 6. Dokumentasi proses persiapan dan penyuntikan Oodev
1
4 3
2
26
Keterangan :
1. Proses peracikan oodev
2. Karena dosis oodev yang digunakan sangat kecil dan sulit diberi suntikan pada udang maka dilakukan pengenceran dengan Nacl 0,9% sebanyak 0.2 mL untuk setiap perlakuan.
3. Oodev yang sudah dilakukan pengenceran dimasukkan kedalam mikrotube sesuai dengan dosis perlakuan, selanjutnya dilakukan vortex.
4. Sebelum hormon disuntikan pada udang dilakukan penimbangan bobot udang terlebih dahulu untuk menyesuaikan dosis hormon dan bobot tubuh udang 5. Dilakukan penyuntikan pada pangkal jalan ke lima menggunakan syringe
ukuran 1 mL. Penyuntikan dilakukan pada sore hari pukul 16.00 WIB
Lampiran 7 Dokumentasi proses pemijahan dan penetasan telur udang vaname
1. Mengkawinkan jantan dan betina dengan perbandingan 3 jantan dan 1 betina. Selama proses perkawinan bak ditutup plastik warna hitam.
2. Induk betina yang telah dibuahi jantan ditandai adanya spermatopori yang menempel pada telikum.
3. Setelah dibuahi induk dipindahkan dalam drum plastik (blonk) berdiameter 50 cm tinggi 1 m kapasitas air 200 liter yang digunakan sebagai bak pemijahan dan penetasan telur. Proses pemijahan berlangsung 7-8 jam.
4. Heater dipasang untuk meningkatkan suhu air selama proses penetasan telur sampai suhu 30 oC. Proses penetasan telur mancapai tahap naupli berlangsung 9-10 jam.
5. Naupli dipanen dengan cara mengeluarkan air dalam blonk dan menyaring naupli dengan seser bermata jaring ukuran 10 mikron. Naupli yang telah dipanen, ditampung didalam bak ukuran 5 liter
1
5 5
4
27
RIWAYAT HIDUP
Fahmi akbar, S.Pi dilahirkan di Dompu, Nusa Tenggara Barat pada tanggal 10 Oktober 1990 dari pasangan bapak Muhammad A. Bakar S.Pd.i dan ibu St. Nurhasanah Usman. Penulis merupakan anak ketiga dari empat bersaudara. Pada tahun 2008 Penulis lulus dari SMA Negeri 1 Dompu dan pada tahun yang sama penulis menempuh pendidikan sarjana di Universitas Mataram pada Program Studi Budidaya Perairan dan lulus pada tahun 2013. Pada tahun 2013, Penulis melanjutkan studi program Magister Sains, di Sekolah Pascasarjana Program Studi Ilmu Akuakultur Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor. Penulis menyelesaikan tugas akhir dalam pendidikan tinggi dengan menulis tesis yang berjudul “Induksi Maturasi pada Udang Vaname Jantan