PENGARUH GALAKTOSA, GLUKOSA DAN HIDROLISAT
E. COTTONII
TERHADAP PERTUMBUHAN
PACHYSOLEN
TANNOPHILUS
DAN PRODUKSI BIOETANOL
ALFIAN RAHMANDANI PERMADI
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKIRPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Galaktosa, Glukosa dan Hidrolisat E. cottonii Terhadap Pertumbuhan P. tannophilus dan Produksi Bioetanoladalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
ABSTRAK
ALFIAN RAHMANDANI PERMADI. Pengaruh Galaktosa, Glukosa dan Hidrolisat E. cottoni Terhadap Pertumbuhan P. tannophilus dan Produksi Bioetanol Dibimbing oleh MULYORINI RAHAYUNINGSIH dan DWI SETYANINGSIH.
P. tannophilus adalah salah satu produsen etanol yang baik dalam campuran pentose dan heksosa. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh glukosa, galaktosa, dan hidrolisat E. cottonii terhadap pertumbuhan P. tannophilus dan produksi bioetanol. Penelitian ini difokuskan pada analisa kurva pertumbuhan dan produksi bioetanol. Kurva pertumbuhan dibuat berdasarkan konsentrasi dan jenis substrat. Kemudian dilakukan fermentasi. Berdasarkan kurva pertumbuhan tersebut dapat ditentukan waktu inkubasi P. tannophilus yaitu 24 jam. Hasil fermentasi P. tannophilus pada media YMP galaktosa dan glukosa dengan konsentrasi 2.5%, 5%, 7.5% dan 10% dianalisis dengan analisis varian dan uji Duncan didapati konsentrasi dan jenis gula berpengaruh terhadap produksi etanol oleh P. tannophilus. Sedangkan produksi etanol pada hidrolisat E. cottonii pun mempengaruhi terhadap produksi etanol dan pertumbuhan P. tannophilus.
Kata kunci: P. tannophilus, produksi bioetanol, kurva pertumbuhan
ABSTRACT
ALFIAN RAHMANDANI PERMADI. Effect of Galactose, Glucose and hydrolyzate E. cottoni to Growth P. tannophilus and Bioethanol Production Supervised by MULYORINI RAHAYUNINGSIH and DWI SETYANINGSIH.
P. tannophilus is one good producer of ethanol in the mixture pentose and hexose. The objectives of this research was to determine the effect of glucose, galactose, and hydrolyzate E. cottonii to P. tannophilus growth and production of bioethanol. This research focused on the analysis of the growth curve and the production of bioethanol. The growth curve is based on the concentration and type of substrate. Then do the fermentation. Based on the growth curve can be determined P. tannophilus incubation time is 24 hours. The result of P. tannophilus fermentation on YMP galactose and glucose medium with concentration of 2.5%, 5%, 7.5% and 10% were analyzed with analysis of variance and Duncan test, the concentration and type of sugar found to affect the production of ethanol by P. tannophilus. While ethanol production on hydrolyzate E. cottonii also affect the production of ethanol and growth P. tannophilus.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
PENGARUH GALAKTOSA, GLUKOSA DAN HIDROLISAT
E. COTTONII
TERHADAP PERTUMBUHAN
PACHYSOLEN
TANNOPHILUS
DAN PRODUKSI BIOETANOL
ALFIAN RAHMANDANI PERMADI
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Pengaruh Galaktosa, Glukosa dan Hidrolisat E. cottonii Terhadap Pertumbuhan P. tannophilus dan Produksi Bioetanol
Nama : Alfian Rahmandani Permadi NIM : F34090145
Disetujui oleh
Dr Ir Mulyorini Rahayuningsih M Si Pembimbing I
Dr Dwi Setyaningsih STP M Si Pembimbing II
Diketahui oleh
Prof Dr Ir Nastiti Siswi Indrasti Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2010 ini ialah karakterisasi khamir, dengan judul Pengaruh Galaktosa, Glukosa dan Hidrolisat E. cottoni Terhadap Pertumbuhan P. tannophilus daan Produksi Bioetanol.
Terima kasih penulis ucapkan kepada Dr. Ir. Mulyorini Rahayuningsih, M.Si dan Dr. Dwi Setyaningsih, STP, M.Si. selaku pembimbing. Penulis juga mengucapkan terima kasih kepada Dr. Ir. Liesbetini Hartoto, M.Si. selaku dosen penguji yang telah bersedia menguji dan memberikan saran saat ujian dan penulisan karya ilmiah. Di samping itu, penghargaan penulis sampaikan kepada Indah Khayati dan Neli Muna dari Surfactant and Bioenergy Research Center dan seluruh staf Surfactant and Bioenergy Research Center, yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
METODE 2
Bahan 2
Alat 2
Prosedur Penelitian 3
HASIL DAN PEMBAHASAN 6
Kinetika Pertumbuhan P. tannophilus 6
Konsumsi Gula 12
Fermentasi 15
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 20
DAFTAR TABEL
1 Nilai laju pertumbuhan spesifik maksimum (µmaks) pada YMP
galaktosa 8
2 Nilai laju pertumbuhan spesifik maksimum (µmaks) pada YMP glukosa 10
3 Hasil fermentasi P. tannophilus pada media YMGP 15
4 Hasil fermentasi P. tannophilus pada hidrolisat E. cottonii 17
DAFTAR GAMBAR 1 Proses fermentasi 4 2 Kurva peningkatan nilai OD 600 nm pada media YMP galaktosa 6
3 Kurva peningkatan jumlah sel pada media YMP galaktosa 7
4 Kurva peningkatan nilai OD 600nm pada media YMP glukosa 9
5 Kurva peningkatan jumlah sel pada media YMP glukosa 10
6 Kurva penurunan gula pereduksi pada media YMP galaktosa 13
7 Kurva penurunan gula pereduksi pada b media YMP glukosa 14
DAFTAR LAMPIRAN 1 Komposisi berbagai medium yang digunakan dalam penelitian 20
2 Pembuatan media PDA 20 3 Proses pembuatan hidrolisat Euchema cottonii 21
4 Metode analisis gula pereduksi metode DNS dan total gula fenol 22
5 Hasil plot gula pereduksi pada media YMP galaktosa dan glukosa 23 6 Contoh perhitungan µmaks 24
PENDAHULUAN
Latar Belakang
Bioetanol merupakan produk biokimia hasil proses fermentasi gula dari sumber karbohidrat dengan menggunakan bantuan mikroorganisme. Proses pembuatan bioetanol dibedakan menjadi tiga berdasarkan bahan bakunya yaitu bahan baku sumber gula, pati dan serat. Proses pembuatan bioetanol meliputi aspek fermentasi dan destilasinya. Karena proses pembuatan etanol meliputi proses fermentasi dan berbahan bakar biomassa, maka etanol dapat diartikan sebagai cairan biokimia dari proses fermentasi gula (sumber karbohidrat) dengan menggunakan bantuan mikroorganisme (Lowenstein 1985).
Pemilihan hidrolisat Euchema cottonii sebagai media fermentasi untuk produksi bioetanol, karena pada penelitian sebelumnya yang dilakukan oleh Nababan (2013) agen biologis yang digunakan adalah Saccharomyces cerevisiae. Sedangkan pada penelitian ini agen biologis yang digunakan adalah Pachysolen tannophilus. Selain itu pemilihan makroalga dikarenakan, produksi bioetanol menggunakan bahan baku pati atau gula dari bahan yang berbasis makanan seperti singkong dan jagung diartikan sebagai generasi pertama. Perlu dilakukan penelitian produksi bioetanol generasi kedua. Memang bioetanol generasi pertama yang berbahan baku berbasis pangan lebih mudah untuk dikonversi menjadi etanol akan tetapi pada kasus ini akan terjadi perdebatan antara persaingan kebutuhan pangan dan energi. Salah satu bahan yang berpotensi adalah makroalga. Keuntungan dari makroalga itu adalah kandungan polisakarida dari makroalga yang sebagian besar mengandung karagenan. Karagenan merupakan senyawa polisakarida yang tersusun dari unit D-Galaktosa dan L-Galaktosa 3,6 anhidrogalaktosa yang dihubungkan oleh ikatan 1-4 glikosilik. Maka dari itu dilakukan penelitian pada jenis gula galaktosa dan glukosa.
Penelitian terhadap mikroorganisme yang berpotensi untuk digunakan sebagai mikroorganisme pengkonversi gula menjadi etanol telah dilakukan di Surfactant and Bioenergy Research Center (SBRC). Pada umumnya produksi bioetanol lebih sering menggunakan S. cerevisiae sebagai agen biologisnya. Akan tetapi di SBRC telah diteliti ada agen biologis lain yang dapat digunakan sebagai agen biologis yaitu P. tannophilus. Penelitian yang telah dilakukan tersebut barulah sebatas uji kualitatif hanya dengan fermentasi pada media Yeast Malt Peptone (YMP) galaktosa dan dilihat gas CO2 yang terbentuk. Didapati gas CO2 yang terbentuk cukup banyak dan hal
2
Perumusan Masalah
1. Bagaimanakah kurva pertumbuhan P. tannophilus pada berbagai konsentrasi galaktosa?
2. Bagaimanakah kurva pertumbuhan P. tannophilus pada berbagai konsentrasi glukosa?
3. Bagaimanakah pengaruh jenis dan konsentrasi gula terhadap etanol yang dihasilkan oleh P. tannophilus?
4. Bagaimanakah produksi etanol P. tannophilus pada media hidrolisat E. cottonii?
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui pertumbuhan P. tannophilus pada berbagai konsentrasi substrat dengan jenis gula galaktosa dan glukosa, dan untuk mengetahui kinerja P. tannophilus terhadap produksi bioetanol dengan substrat YMP glukosa, YMP galaktosa, dan hidrolisat E. cottonii.
Manfaat Penelitian
Karakterisasi P. tannophilus akan memberikan informasi tentang pertumbuhan P. tannophilus pada substrat YMP galaktosa dan YMP glukosa, dari pertumbuhan tersebut akan diketahui kondisi optimum dan lama fermentasinya serta potensinya sebagai agen biologis untuk menghasilkan etanol.
Ruang Lingkup Penelitian
Penelitian ini difokuskan pada analisa kurva pertumbuhan dan produksi bioetanol. Kurva pertumbuhan dibuat berdasarkan konsentrasi dan jenis substrat. Setelah diketahui kurva pertumbuhan barulah dilakukan fermentasi pada kondisi yang optimum.
METODE
Waktu dan Tempat
Penelitian dilaksanakan April 2013 – September 2013. Penelitian dilaksanakan di Laboratorium Surfactant and Bioenergy Research Center (SBRC) Institut Pertanian Bogor.
Bahan
Bahan yang digunakan dalam penelitian ini adalah media Yeast Malt Peptone (YMP) galaktosa 2.5%, 5%, 7.5% dan 10% cair (Lampiran 1A), Yeast Malt Peptone (YMP) glukosa 2.5%, 5%, 7.5% dan 10% cair (Lampiran 1B), larutan DNS, H2SO4(p),
3
Alat
Alat yang digunakan dalam penelitian ini adalah peralatan gelas, mikroskop majemuk, autoklaf, pH universal, destilator, densitometer, spektrofotometer, dan seperangkat alat inokulasi.
Prosedur Penelitian
Penentuan kurva pertumbuhan
Tahap pertama pada penelitian ini adalah penentuan kurva pertumbuhan P. tannophilus pada media YMP glukosa/galaktosa dengan konsentrasi glukosa/galaktosa 2.5%; 5%; 7.5%; dan 10%. Sebelum pembuatan media tersebut dilakukan peremajaan kultur dengan cara menumbuhkan kultur pada media PDA dengan waktu inkubasi selama 48 jam, pembuatan media PDA dapat dilihat pada Lampiran 2. Kultur P. tannophilus digoreskan pada media cawan agar secara aseptis. Pembuatan media YMP glukosa dan galaktosa adalah yeast, malt dan peptone masing-masing ditimbang sebanyak 1 gram sedangkan glukosa/galaktosa ditimbang 5 gram untuk 2.5%, 10 gram untuk 5%, 15 gram untuk 7.5% dan 20 gram untuk 10% dilarutkan dengan akuades hingga 200 mL. Kemudian disterilisasi dengan autoklaf pada suhu 121oC selama 15 menit. Setelah itu diinokulasikan kultur secara aseptis pada
media yang telah steril dengan cara memasukkan 6 ose kultur P. tannophilus dari media cawan agar ke media YMP glukosa dan YMP galaktosa. Kemudian diinkubasikan selama 96 jam pada shaker dengan suhu 30oC dan 150 rpm. Dilakukan sampling pada jam ke-1, 2, 3, 4, 5, 6, 12, 18, 24, 48, 72, 96. Penentuan kurva pertumbuhan dilakukan dengan mengukur OD 600 nm dan jumlah sel. Sedangkan kadar gula pereduksi dilakukan untuk menghitung efisiensi substrat. Pengukuran OD dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 600 nm. Pengukuran jumlah sel dilakukan cara perhitungan mikroskopik langsung (Petroff-Hausser, hemasitometer), sedangkan kadar gula pereduksi dilakukan dengan menggunakan metode DNS.
Fermentasi
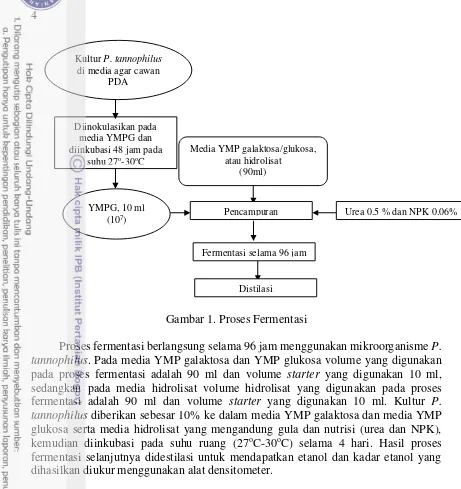
4
Gambar 1. Proses Fermentasi
Proses fermentasi berlangsung selama 96 jam menggunakan mikroorganisme P. tannophilus. Pada media YMP galaktosa dan YMP glukosa volume yang digunakan pada proses fermentasi adalah 90 ml dan volume starter yang digunakan 10 ml, sedangkan pada media hidrolisat volume hidrolisat yang digunakan pada proses fermentasi adalah 90 ml dan volume starter yang digunakan 10 ml. Kultur P. tannophilus diberikan sebesar 10% ke dalam media YMP galaktosa dan media YMP glukosa serta media hidrolisat yang mengandung gula dan nutrisi (urea dan NPK), kemudian diinkubasi pada suhu ruang (27oC-30oC) selama 4 hari. Hasil proses fermentasi selanjutnya didestilasi untuk mendapatkan etanol dan kadar etanol yang dihasilkan diukur menggunakan alat densitometer.
Pengolahan data
Jumlah sel yang didapat dari hasil kurva pertumbuhan digunakan untuk menghitung laju pertumbuhan spesifik. Pertumbuhan mikrobial biasanya dicirikan dengan waktu yang dibutuhkan untuk menggandakan massa sel atau jumlah sel. Waktu ganda massa dapat berbeda dengan waktu ganda sel karena massa sel dapat meningkat tanpa peningkatan jumlah sel. Pada pertumbuhan eksponensial, interval massa sel atau penggandaan jumlah sel adalah konstan (Gumbira-Sa’id 1987). Pertumbuhan mikrobial pada fase ini dinyatakan sebagai berikut.
Kultur P. tannophilus di media agar cawan
PDA
Diinokulasikan pada media YMPG dan diinkubasi 48 jam pada
suhu 27o-30oC
YMPG, 10 ml
(107) Pencampuran Urea 0.5 % dan NPK 0.06% Media YMP galaktosa/glukosa,
atau hidrolisat (90ml)
Fermentasi selama 96 jam
5
� =ln � − ln �− 0
0
Perhitungan koefisien penggunaan substrat dinyatakan sebagai berikut :
Perhitungan koefisiensi fermentasi dinyatakan sebagai berikut :
% efisiensi fermentasi = .5 � � � � � %
Rancangan percobaan yang digunakan untuk analisis data hasil fermentasi adalah Rancangan Acak Lengkap Faktorial dengan dua kali ulangan. Faktor yang diamati terdiri atas dua faktor, yaitu (A) konsentrasi gula (2.5 %, 5 %, 7.5% dan 10 %) dan (B) jenis gula (galaktosa dan glukosa). Model matematika RAL Faktorial dapat dirumuskan sebagai berikut:
Yijk = + Ai + Bj + ABij + k(ij)
dengan : Yijk nilai pengamatan pada Konsentrasi gula taraf ke-i Jenis gula
taraf ke-j dan ulangan ke k
µ nilai rata-rata yang sesungguhnya (rata-rata populasi) Ai pengaruh aditif taraf ke-i dari Konsentrasi gula Bi pengaruh aditif taraf ke-j dari Jenis gula
(AB)ij pengaruh aditif taraf ke-i dari Konsentrasi gula dan taraf ke-j
dari Jenis gula
εijk pengaruh acak dari satuan percobaan ke-k yang memperoleh
kombinasi perlakuan ij.
6
HASIL DAN PEMBAHASAN
Kinetika Pertumbuhan P. tannophilus
1. Kurva pertumbuhan pada media YMP galaktosa
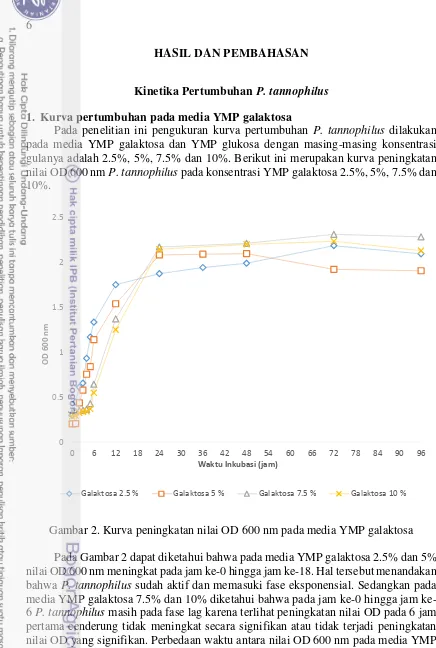
Pada penelitian ini pengukuran kurva pertumbuhan P. tannophilus dilakukan pada media YMP galaktosa dan YMP glukosa dengan masing-masing konsentrasi gulanya adalah 2.5%, 5%, 7.5% dan 10%.Berikut ini merupakan kurva peningkatan nilai OD 600 nm P. tannophilus pada konsentrasi YMP galaktosa 2.5%, 5%, 7.5% dan 10%.
Gambar 2. Kurva peningkatan nilai OD 600 nm pada media YMP galaktosa Pada Gambar 2 dapat diketahui bahwa pada media YMP galaktosa 2.5% dan 5% nilai OD 600 nm meningkat pada jam ke-0 hingga jam ke-18. Hal tersebut menandakan bahwa P. tannophilus sudah aktif dan memasuki fase eksponensial. Sedangkan pada media YMP galaktosa 7.5% dan 10% diketahui bahwa pada jam 0 hingga jam ke-6 P. tannophilus masih pada fase lag karena terlihat peningkatan nilai OD pada 6 jam pertama cenderung tidak meningkat secara signifikan atau tidak terjadi peningkatan nilai OD yang signifikan. Perbedaan waktu antara nilai OD 600 nm pada media YMP galaktosa 2.5 % dan 5 % dengan media YMP galaktosa 7.5 % dan 10 % sepertinya diakibatkan oleh konsentrasi gula yang lebih tinggi pada konsentrasi gula yang tinggi terjadi delay time yang lebih lama. Hal tersebut dapat diakibatkan sel khamir memerlukan waktu lebih banyak untuk beradaptasi dan kemungkinan kondisi substrat berada pada kondisi hipertonik. Kemudian setelah 96 jam nilai OD 600 nm cenderung
0 0.5 1 1.5 2 2.5
0 6 12 18 24 30 36 42 48 54 60 66 72 78 84 90 96
O
D 6
00
nm
Waktu Inkubasi (jam)
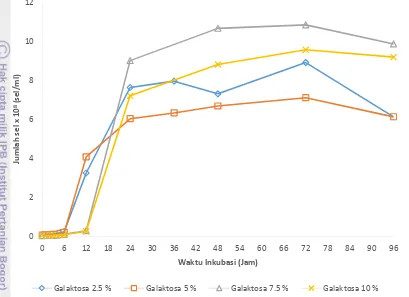
7 tetap meskipun nilai OD 600 nm menurun sedikit demi sedikit. Cara untuk menentukan kurva pertumbuhan adalah dengan mengukur jumlah sel nya pada waktu tertentu. Pada Gambar 3 berikut ini merupakan kurva pertumbuhan P. tannophilus berdasarkan jumlah sel.
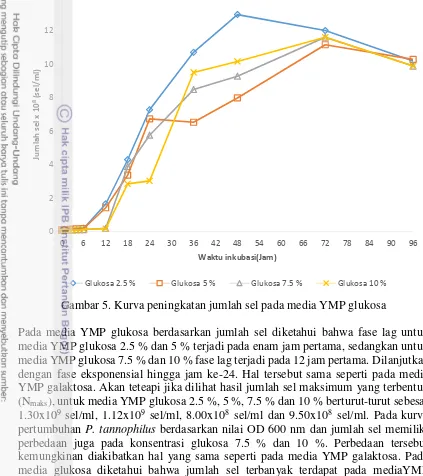
Gambar 3. Kurva peningkatan jumlah sel pada media YMP galaktosa
Berdasarkan Gambar 3 diketahui bahwa, memang benar semakin meningkatnya jumlah sel maka semakin meningkat pula nilai ODnya. Pada media YMP galaktosa berdasarkan jumlah sel diketahui bahwa delay time (fase lag) untuk media YMP galaktosa 2.5 % dan 5 % terjadi pada enam jam pertama, sedangkan untuk media YMP galaktosa 7.5 % dan 10 % fase lag terjadi pada 12 jam pertama.. Dilanjutkan dengan fase eksponensial hingga jam ke-24. Pada kurva pertumbuhan berdasarkan jumlah sel pun terdapat perbedaan antara konsentrasi rendah dan tinggi, hal tersebut dapat diakibatkan hal yang sama seperti pada kurva pertumbuhan berdasarkan nilai OD 600 nm. Jika dibandingkan dengan hasil dari kurva pertumbuhan berdasarkan nilai OD 600 nm terdapat perbedaan, pada kurva pertumbuhan berdasarkan jumlah sel diketahui sel mulai aktif memperbanyak diri pada jam ke-6 untuk media YMP galaktosa dengan konsentrasi 2.5 % dan 5 %, sedangkan pada media YMP galaktosa 7.5 % dan 10 % sel mulai aktif memperbanyak diri pada jam ke-12. Perbedaan antara kurva pertumbuhan berdasarkan nilai OD 600 nm dan kurva pertumbuhan berdasarkan jumlah sel dapat diakibatkan pada pengukuran nilai OD 600 nm cahaya dari spektrofotometer tidak hanya terserap oleh sel saja melainkan ada sel-sel yang mati serta zat-zat lain yang menyerap cahaya sehingga nilai OD sudah meningkat dari awal. Sedangkan pada kurva pertumbuhan berdasarkan jumlah sel, yang terhitung adalah sel hidup yang memang terdapat pada media tersebut sehingga lebih mendekati kebenarannya.
0
8
Perhitungan jumlah sel pada setiap media dilakukan dengan perhitungan langsung, pada media YMP galaktosa 2.5 %, 5 %, 7.5%, dan 10 % masing-masing jumlah sel maks berturut-turut adalah 8.90x108 sel/ml, 7.10x108 sel/ml, 1.08x109 sel/ml, dan 9.55x108 sel/ml. Berdasarkan data tersebut diketahui bahwa sel yang terbentuk paling banyak adalah pada media YMP galaktosa 7.5%, dan 10 %. Hal tersebut dibuktikan juga oleh laju pertumbuhan spesifik maksimum pada tabel 1 berikut ini.
Tabel 1. Nilai laju pertumbuhan spesifik maksimum (µmaks) pada YMP galaktosa
Jenis media Nilai µmaks (jam-1)
YMP galaktosa 2.5 % 0.17
YMP galaktosa 5 % 0.16
YMP galaktosa 7.5 % 0.28 YMP galaktosa 10 % 0.27
Pada tabel 1 diatas diketahui pada media YMP galaktosa 7.5 % dan 10 % memiliki µmaks terbesar yaitu sebesar 0.28 jam-1 dan 0.27 jam-1. Laju pertumbuhan spesifik (µ)
merupakan gambaran kecepatan reproduksi sel. Semakin tinggi nilai µ, maka semakin cepat sel tumbuh. Dikarenakan pada saat fase eksponensial laju spesifik pertumbuhan relatif tetap, pada saat inilah laju spesifik dapat dihitung. Pada saat sel tidak tumbuh nilai dari µ adalah nol, hal tersebut terjadi pada fase kematian. Keadaan pada fase eksponensial dapat digambarkan dengan nilai µ. Kurva pertumbuhan P. tannophilus berdasarkan jumlah sel pada Gambar 3 diketahui pertumbuhan P. tannophilus pada konsentrasi media YMP galaktosa yang tinggi pada awalnya mengalami fase lag yang cukup lama yaitu 12 jam tetapi setelah memasuki fase eksponensial laju pertumbuhan P. tannophilus menjadi sangat tinggi sehingga sel yang terbentuk lebih banyak dibandingkan dengan pertumbuhan P. tannophilus pada media YMP galaktosa dengan konsentrasi yang lebih rendah. Berdasarkan kurva pertumbuhan P. tannophilus pada media YMP galaktosa dan laju pertumbuhan spesifik diketahui bahwa konsentrasi galaktosa berpengaruh terhadap pertumbuhan P. tannophilus.
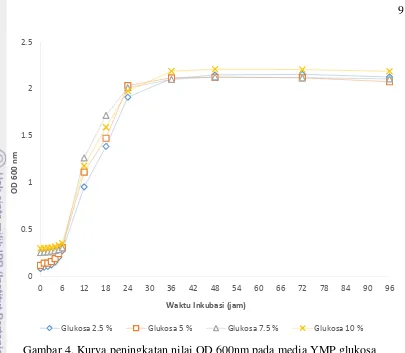
2. Kurva pertumbuhan pada media YMP glukosa
9
Gambar 4. Kurva peningkatan nilai OD 600nm pada media YMP glukosa Pada Gambar 4 diketahui bahwa pada media YMP glukosa 2.5%, 5%, 7.5% dan 10% terjadi fase lag pada jam ke-0 hingga jam ke-6. Kemudian dilanjutkan fase eksponensial hingga jam ke 24. Dan fase stasioner pada jam ke 24 hingga jam ke-72. Sedangkan fase kematian dimulai pada jam ke-96.
Pada Gambar 5 berikut ini menggambarkan peningkatan jumlah sel pada media YMP glukosa 2.5%, 5%, 7.5% dan 10%.
0 0.5 1 1.5 2 2.5
0 6 12 18 24 30 36 42 48 54 60 66 72 78 84 90 96
O
D
600 n
m
Waktu Inkubasi (jam)
10
Gambar 5. Kurva peningkatan jumlah sel pada media YMP glukosa
Pada media YMP glukosa berdasarkan jumlah sel diketahui bahwa fase lag untuk media YMP glukosa 2.5 % dan 5 % terjadi pada enam jam pertama, sedangkan untuk media YMP glukosa 7.5 % dan 10 % fase lag terjadi pada 12 jam pertama. Dilanjutkan dengan fase eksponensial hingga jam ke-24. Hal tersebut sama seperti pada media YMP galaktosa. Akan teteapi jika dilihat hasil jumlah sel maksimum yang terbentuk (Nmaks), untuk media YMP glukosa 2.5 %, 5 %, 7.5 % dan 10 % berturut-turut sebesar
1.30x109 sel/ml, 1.12x109 sel/ml, 8.00x108 sel/ml dan 9.50x108 sel/ml. Pada kurva pertumbuhan P. tannophilus berdasarkan nilai OD 600 nm dan jumlah sel memiliki perbedaan juga pada konsentrasi glukosa 7.5 % dan 10 %. Perbedaan tersebut kemungkinan diakibatkan hal yang sama seperti pada media YMP galaktosa. Pada media glukosa diketahui bahwa jumlah sel terbanyak terdapat pada mediaYMP glukosa 2.5 % dan 5 %. Jika dilihat pada tabel 2 diketahui laju pertumbuhan spesifik P. tannophilus pada media YMP glukosa.
Tabel 2. Nilai laju pertumbuhan spesifik maksimum (µmaks) pada YMP glukosa
Jenis Substrat YMP Nilai µmaks (jam-1)
Glukosa 2.5 % 0.20
Glukosa 5 % 0.19
Glukosa 7.5 % 0.14
Glukosa 10 % 0.15
11 berkolerasi positif terhadap jumlah sel yang terbentuk semakin tinggi nilai µ maka semakin tinggi jumlah sel yang terbentuk. Berdasarkan kurva pertumbuhan P. tannophilus pada media YMP glukosa diketahui bahwa P. tannophilus tumbuh lebih baik pada media YMP glukosa yang rendah yaitu 2.5 % dan 5 %. Hal tersebut merupakan kebalikan dari hasil kurva pertumbuhan P. tannophilus pada media YMP galaktosa, ini dapat menjadi indikasi bahwa P. tannophilus memang lebih menyukai sumber gula berupa galaktosa ketimbang glukosa.
Berdasarkan informasi dari kurva pertumbuhan P. tannophilus dapat ditentukan siklus pertumbuhan P. tannophilus. Diketahuinya siklus hidup P. tannophilus dapat memudahkan untuk kultivasi mikroorganisme kedalam suatu media, penyimpanan kultur, dan penggantian media. Kultivasi P. tannophilus pada media membutuhkan komposisi media dan kondisi inkubasi yang tepat. Kedua faktor tersebut bervariasi tergantung dari mikroorganisme yang ditumbuhkan dan tujuan fermentasi. Umumnya media harus mengandung unsur-unsur yang diperlukan untuk metabolisme sel yaitu berupa unsur makro seperti C, H, O, N, P dan unsur-unsur mikro misalnya kalsium. Media yang digunakan untuk menumbuhkan mikroorganisme harus disterilisasi terlebih dahulu untuk mencegah kemungkinan tumbuhnya mikroorganisme lain yang tidak diinginkan. Adanya mikroorganisme lain pada media dapat menghambat pertumbuhan mikroorganisme yang diinginkan karena terjadi kompetisi antar spesies mikroorganisme untuk memperebutkan nutrisi yang terdapat dalam media.
Penentuan karakteristik pertumbuhan sel P. tannophilus dilakukan pada media YMP glukosa dan YMP galaktosa yang mengandung ekstrak khamir, malt, bakto pepton, dan glukosa/galaktosa. Glukosa/galaktosa pada media digunakan sebagai sumber karbon oleh sel, sedangkan ekstrak khamir, ekstrak malt, dan bakto pepton digunakan sebagai sumber nitrogen. Ekstrak khamir terbuat dari ragi pengembang roti atau pembuat alkohol, serta mengandung asam amino lengkap dan vitamin B kompleks. Bakto pepton mampu menyediakan nutrien esensial untuk metabolisme khamir.
Pertumbuhan P. tannophilus yang ditumbuhkan dalam media YMGP dapat diukur secara turbidimetri menggunakan spektofotometer pada panjang gelombang 600 nm. Metode turbidimetri dilakukan dengan prinsip mengukur kenaikan biomassa sel. Cahaya yang dibiaskan sumber cahaya akan diserap oleh sel sehingga semakin tinggi pertumbuhan sel akan memberikan nilai absorbansi yang lebih besar. Sel khamir pada umumnya dapat menyerap cahaya optimum dengan panjang gelombang 600 nm. Akan tetapi menurut Matlock (2011), sebenarnya optical density adalah bukan mengukur absorbansi melainkan mengukur cahaya yang terpencar oleh suspensi mikroorganisme yang pada kenyataannya lebih disebut absorbansi. Selain itu dapat dilakukan juga dengan metode pengukuran jumlah sel dengan cara perhitungan mikroskopik langsung (Petroff-Hausser, hemasitometer). Sel dihitung secara langsung dengan melakukan sampling jumlah sel sebanyak lima kotak pada 16 kotak yang tersedia.
12
pertumbuhan sel khamir lebih lambat daripada sel bakteri, maka pengamatan dilakukan setiap satu jam sekali selama 6 jam, lalu dilanjutkan setiap 12 jam sekali hingga 96 jam. Pengamatan yang dilakukan adalah OD 600 nm dan jumlah sel untuk mengetahui kurva pertumbuhan, serta kadar gula sisa untuk mengetahui substrat yang tersisa.
Berdasarkan kurva peningkatan nilai OD 600 nm dan kurva peningkatan jumlah sel pada Gambar 2, 3, 4, dan 5 didapati fase lag untuk tiap konsetrasi pada tiap media berbeda. Pada media YMP galaktosa/glukosa dengan konsentrasi gula rendah (2.5%-5%) didapati fase lag terjadi pada 6 jam pertama. Dari gambar 3 dan 5 dapat dilihat bahwa pada 6 jam pertama jumlah sel yang terbentuk cenderung naik akan tetapi naik dengan sangat kecil yang mana hal tersebut mengindikasikan sel sedang dalam fase lag. Pertumbuhan biomassa pada fase cenderung lambat diakibatkan adanya adaptasi sel terhadap media YMP galaktosa/glukosa. Pada fase ini sel tidak memperbanyak diri, akan tetapi memperbesar ukuran selnya sendiri. Sedangkan pada media YMP konsentrasi galaktosa/glukosa dengan konsentrasi gula tinggi (7.5%-10%) didapati fase lag terjadi pada 12 jam pertama. Hal tersebut dikarenakan sel membutuhkan waktu lebih banyak untuk adaptasi pada konsentrasi gula yang tinggi. Menurut Moat (1988), pada konsentrasi substrat yang tinggi sel khamir akan mengalami plasmolisis (hancurnya lapisan pelindung terluar pada sel). Dengan terjadinya plasmolisis aktivitas fermentasi terhambat bahkan dapat menyebabkan kematian pada sel khamir.
Fase eksponensial (log) dari P. tannophilus terjadi pada jam dimana fase lag berakhir hingga jam ke-24. Karena berdasarkan gambar 2, 3, 4 dan 5 peningkatan nilai OD 600 nm dan jumlah sel hingga jam ke-24 meningkat secara signifikan. Pada fase eksponensial ini sel mulai menggunakan sumber karbon dan bahan-bahan lainnya yang terdapat pada media YMP galaktosa/glukosa untuk tumbuh (memberbanyak diri). Peningkatan yang signifikan nilai OD dan jumlah sel terjadi akibat pembelahan biner sel yang meningkatkan jumlah sel hidup sehingga semakin banyak jumlah selnya dan semakin banyak pula cahaya dari spektrofotometer yang terserap oleh sel tersebut yang mengakibatkan nilai absorbansi semakin besar pula. Setelah jam ke-24 kurva pertumbuhan menunjukan laju pertumbuhan biomassa sel cenderung tetap, biarpun masih meningkat akan tetapi terlihat meningkat secara sedikit. Pada fase ini terjadi pertumbuhan sel yang sebanding dengan jumlah sel yang mati, sehingga jumlah sel cenderung konstan. Hal tersebut diakibatkan oleh menurunnya jumlah nutrisi yang terdapat pada media YMP galaktosa/glukosa, ditambah dengan adanya penimbunan hasil metabolisme seperti etanol yang dapat menghambat pertumbuhan sel.
Konsumsi Gula
13
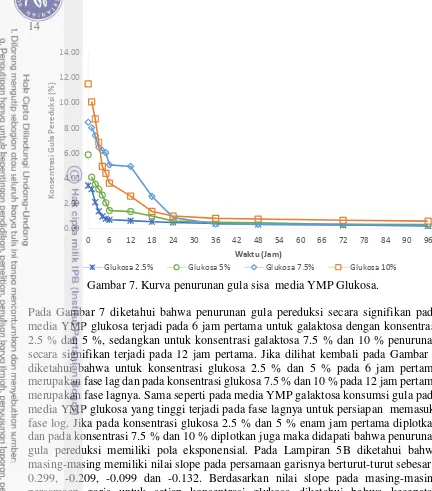
Gambar 6. Kurva penurunan gula pereduksi pada media YMP galaktosa Pada Gambar 6 diketahui bahwa penurunan gula pereduksi secara signifikan pada media YMP galaktosa terjadi pada 6 jam pertama untuk galaktosa dengan konsentrasi 2.5 % dan 5 %, sedangkan untuk konsentrasi galaktosa 7.5 % dan 10 % penurunan secara signifikan terjadi pada 12 jam pertama. Jika dilihat kembali pada Gambar 3 diketahui bahwa untuk konsentrasi galaktosa 2.5 % dan 5 % pada 6 jam pertama merupakan fase lag dan pada konsentrasi galaktosa 7.5 % dan 10 % pada 12 jam pertama merupakan fase lagnya. Berdasarkan informasi dari gambar 3 dan 4 diketahui bahwa P. tannophilus mengkonsumsi banyak gula pada fase lagnya, konsumsi gula yang tinggi oleh P. tannophilus pada fase lag kemungkinan untuk persiapan reproduksi sel dengan menyerap terlebih dahulu gula pada substrat kedalam sel dan setelah kandungan gula dalam sel telah cukup maka sel mulai reproduksi. Jika pada konsentrasi galaktosa 2.5 % dan 5 % enam jam pertama diplotkan dan pada konsentrasi 7.5 % dan 10 % diplotkan juga maka didapati bahwa penurunan gula pereduksi memiliki pola eksponensial. Pada Lampiran 5A diketahui bahwa masing-masing memiliki nilai slope pada persamaan garisnya berturutturut sebesar 0.101, 0.138, -0.177 dan -0.108. Berdasarkan nilai slope pada masing-masing persamaan garis untuk setiap konsentrasi galaktosa diketahui bahwa kecepatan konsumsi gula oleh P. tannophilus hampir sama.
14
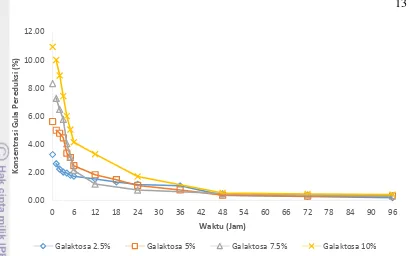
Gambar 7. Kurva penurunan gula sisa media YMP Glukosa.
Pada Gambar 7 diketahui bahwa penurunan gula pereduksi secara signifikan pada media YMP glukosa terjadi pada 6 jam pertama untuk galaktosa dengan konsentrasi 2.5 % dan 5 %, sedangkan untuk konsentrasi galaktosa 7.5 % dan 10 % penurunan secara signifikan terjadi pada 12 jam pertama. Jika dilihat kembali pada Gambar 5 diketahui bahwa untuk konsentrasi glukosa 2.5 % dan 5 % pada 6 jam pertama merupakan fase lag dan pada konsentrasi glukosa 7.5 % dan 10 % pada 12 jam pertama merupakan fase lagnya. Sama seperti pada media YMP galaktosa konsumsi gula pada media YMP glukosa yang tinggi terjadi pada fase lagnya untuk persiapan memasuki fase log. Jika pada konsentrasi glukosa 2.5 % dan 5 % enam jam pertama diplotkan dan pada konsentrasi 7.5 % dan 10 % diplotkan juga maka didapati bahwa penurunan gula pereduksi memiliki pola eksponensial. Pada Lampiran 5B diketahui bahwa masingmasing memiliki nilai slope pada persamaan garisnya berturutturut sebesar -0.299, -0.209, -0.099 dan -0.132. Berdasarkan nilai slope pada masing-masing persamaan garis untuk setiap konsentrasi glukosa diketahui bahwa kecepatan konsumsi gula oleh P. tannophilus tertinggi pada konsentrasi glukosa 2.5 %.
Pada Gambar 6 dan 7 dapat diketahui bahwa pada 6 jam pertama konsumsi P. tannophilus sangatlah tinggi terhadap substrat. Karena pada enam jam pertama P. tannophilus masih pada fase lag, dimana Pada fase ini, pembelahan sel yang terjadi sangat kecil yang dapat berlangsung selama 1 jam atau beberapa hari. Selama fase ini, sel-sel tidak aktif dan sedang mengalami aktivitas metabolik. Untuk melakukan aktivitas metabolik itu sendiri mikroba memerlukan asupan nutrisi sebagai sumber energi. Terlihat pada Gambar 6 dan 7 bahwa konsumsi substrat tertinggi terjadi pada 6 jam pertama. Menurut Meyer (1978), pada kondisi aerobik pemanfaatan gula menghasilkan penambahan biomassa sel dengan reaksi:
C6H12O6 CO2 + H2O + Biomassa sel
15 Hal tersebut terbukti pada Gambar 6 dan 7 bahwa konsumsi terbanyak substrat terjadi pada waktu 6 jam pertama untuk konsentrasi 2.5 % dan 5 % sedangkan untuk konsentrasi 7.5 % dan 10 % konsumsi terbanyak terjadi pada waktu 12 jam pertama sama seperti fase lagnya masing-masing. Substrat tersebut digunakan untuk persiapan memperbanyak diri sel pada fase log. Pada Gambar 6 dan 7 pun dapat diketahui bahwa untuk setiap konsentrasi media YMP galaktosa/glukosa penurunan konsumsi substrat menunjukan perbedaan. Semakin tinggi konsentrasi gulanya semakin tinggi delay time untuk memasuki fase lognya. Pada khamir, galaktosa tidak dapat masuk ke dalam jalur metabolisme primer untuk menghasilkan energi, melainkan harus diubah dulu menjadi glukosa-6P (Timson 2007). S. cerevisiae mengonversi galaktosa menjadi glukosa-6P melalui jalur Laloir dengan bantuan 5 enzim, yaitu galactose mutarotase, galactokinase, galactose-1-phosphate uridylyltransferase UDP-galactose 4-epimerase, dan pospoglukomutase (Timson 2007). Gen-gen yang terlibat dalam metabolisme galaktosa akan terinduksi jika dalam lingkungan tumbuh tersedia galaktosa sebagai sumber karbon tunggal (Brink et al. 2009). Gen-gen tersebut ialah galaktokinase (GAL1), galaktosa permease (GAL2), galaktosa-1-phosphate uridylyltransferase (GAL7) dan uridine-diphosphoglukosa 4-epimerase (GAL10).
Fermentasi
Fermentasi adalah proses pemecahan senyawa organik (khususnya bahan yang tersusun dari unsur C seperti pati ataupun senyawa polisakarida lainnya) oleh mikroorganisme dalam kondisi anaerob menghasilkan produk-produk organik yang lebih sederhana. Fermentasi etanol merupakan proses biologi yang melibatkan mikroorganisme untuk mengubah bahan organik menjadi komponen sederhana. Selama proses fermentasi berlangsung, mikroorganisme memproduksi enzim untuk menghidrolisis substrat menjadi komponen sederhana (gula) selanjutnya mengubahnya menjadi etanol.
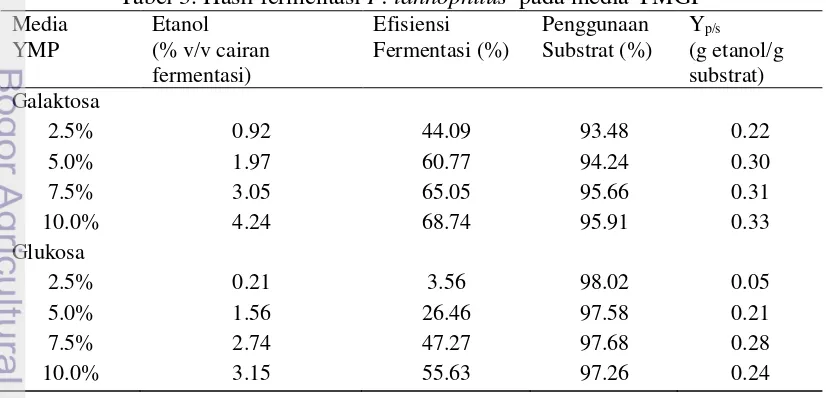
Pada penelitian ini selain untuk mengetahui kurva pertumbuhan dari P. tannophilus, dilakukan juga pengukuran kadar etanol pada setiap media fermentasi. Hasil fermentasi pada media YMP galaktosa dan glukosa dapat dilihat pada tabel 2 berikut ini.
16
Berdasarkan tabel 2 diketahui bahwa produksi bioetanol tertinggi dari P. tannophilus dengan media YMP galaktosa adalah pada media YMP galaktosa 10 % dengan bioetanol yang dihasilkan sebesar 4.24 % v/v cairan fermentasi, efisiensi fermentasi sebesar 68.74 % dan efisiensi substrat 95.91 %. Sedangkan produksi bioetanol pada media YMP glukosa adalah pada media YMP glukosa 10 % dengan bioetanol yang dihasilkan sebesar 3.15 % v/v cairan fermentasi, efisiensi fermentasi sebesar 55.63 % dan efisiensi substrat 97.26 %. Untuk mengetahui pengaruh dari jenis gula dan konsentrasi gula dilakukan analisis varian dengan model rancangan acak lengkap faktorial dengan dua kali ulangan. Jika hasil analisis varian menunjukan hasil berbeda nyata maka dilanjutkan dengan ujiDuncan.
Hasil analisis varian dapat dilihat pada Lampiran 7. Pada Lampiran 7 diketahui bahwa ada jenis gula dan konsentrasi yang berpengaruh terhadap respon (yaitu bioetanol yang dihasilkan). Untuk mengetahui jenis gula dan konsentrasinya yang berpengaruh terhadap respon dilakukan uji Duncan. Pada Lampiran 7 diketahui bahwa galaktosa 10 % berbeda nyata terhadap terhadapa jenis gula dan konsentrasi lainnya. Sedangkan untuk glukosa 10 %, 7.5 % dan galaktosa 7.5 % berada pada grup yang sama, artinya ketiga jenis dan konstrasi gula ini tidak berbeda nyata terhadap ketiganya. Berdasarkan hasil analisis varian dan uji Duncan diketahui bahwa jenis gula dan konsentrasi gula berpengaruh terhadap produksi bioetanol pada media YMGP oleh P. tannophilus.
Pada fermentasi oleh P. tannophilus dengan menggunakan media YMGP ini, dapat dilihat bahwa terjadi penurunan gula pereduksi dengan diimbangi dengan meningkatnya nilai OD, jumlah sel dan dihasilkannya etanol. Pada tabel 3 dapat diketahui nilai efisiensi substrat, efisiensi substrat itu sendiri merupakan jumlah substrat yang digunakan mikroorganisme untuk pertumbuhan dan metabolismenya. Sedangkan efisiensi fermentasi merupakan jumlah substrat yang digunakan untuk dikonversi menjadi produk metabolit. Pada tabel 3 diketahui bahwa efisiensi fermentasi lebih kecil dari efisiensi substrat, hal tersebut dikarenakan tidak semua substrat digunakan untuk dikonversi menjadi etanol tetapi digunakan juga untuk perbanyakan sel. Menurut Yulianto (2001), tipe fermentasi yang berkorelasi positif seperti ini dikenal sebagai pertumbuhan associated. Tipe fermentasi ini menunjukkan bahwa etanol yang dihasilkan pada fase log merupakan metabolit primer, karena terlibat langsung dalam metabolisme sel, sedangkan metabolit sekunder dihasilkan ketika sel berada pada fase stasioner.
Selain media YMGP untuk fermentasi, digunakan juga media hidrolisat rumput laut jenis E. cottonii untuk fermentasi. Pemilihan E. cottonii sebagai media fermentasi karena E. cottonii memiliki kandungan polisakarida yang tinggi dan dapat dikonversi menjadi gula yang dapat difermentasi setelah dihidrolisis menggunakan enzim atau asam. Polisakarida Euchema cottonii terdiri dari 29.45% (bk) karbohidrat, 3.21% (bk) hemiselulosa, dan 11.30% (bk) selulosa. Jenis gula yang terdapat pada hidrolisat asam Euchema cottonii terdiri dari 4.95% galaktosa, 0.25% glukosa, 0.04% xilosa, dan 0.02% maltoheptaosa. Dengan penambahan vitamin, nitrogen, dan mineral-mineral (trace element) untuk memacu aktivitas pertumbuhan khamir dalam mengkonversi galaktosa pada hidrolisat E. cottonii menjadi etanol.
17
dihasilkan meningkat seiring dengan kandungan gula pada substrat. Akan tetapi toleransi khamir terhadap konsentrasi gula pun terbatas sekitar 15 %. Jika P. tannophilus berada pada konsentrasi gula yang tinggi maka sel akan berada pada kondisi hipertonik, air dalam sel keluar ke lingkungan menyebabkan sel menjadi mengkerut (Black 2005).
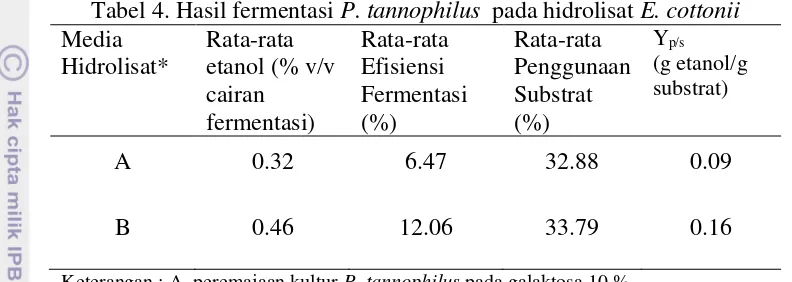
Hasil fermentasi P. tannophilus pada media hidrolisat E. cottonii dapat dilihat pada tabel 4 berikut ini.
Tabel 4. Hasil fermentasi P. tannophilus pada hidrolisat E. cottonii Media
Keterangan : A, peremajaan kultur P. tannophilus pada galaktosa 10 % B, peremajaan kultur P. tannophilus pada glukosa 10 %
*)mengandung 4.95% galaktosa, 0.25% glukosa, 0.04% xilosa, dan 0.02% maltoheptaosa
Berdasarkan tabel 2 dapat diketahui bahwa etanol yang dihasilkan sangat rendah jika dibandingkan pada media YMGP. Menurut Sarfat (2013) dalam penelitiannya, didapati hasil fermentasi P. tannophilus teradaptasi pada media hidrolisat E. cottonii
dengan rata-rata etanol 0.11 % v/v cairan fermentasi, efisiensi fermentasi sebesar 2.6 %, dan efisiensi substrat sebesar 15.39 %.
18
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian menunjukkan bahwa pada kurva pertumbuhan P. tannophilus untuk setiap jenis gula dan konsentrasinya tidak berbeda. Pada setiap kurva pertumbuhan P. tannophilus yang dibuat pada media YMP galaktosa dan glukosa diketahui bahwa pada media YMP galaktosa dan YMP glukosa dengan konsentrasi 2.5 % dan 5 % fase lag terjadi pada enam jam pertama, kemudian dilanjutkan dengan fase log hingga jam ke-24, setelah jam ke-24 mulai memasuki fase stasioner dan setelah jam ke-72 terjadi penurunan yang menandakan sudah pada fase kematian. Pada media YMP galaktosa dan glukosa dengan konsentrasi 7.5 % dan 10 % fase lag terjadi pada 12 jam pertama, kemudian dilanjutkan dengan fase log hingga jam ke-24, setelah jam ke-24 mulai memasuki fase stasioner dan setelah jam ke-72 terjadi penurunann yang menandakan sudah pada fase kematian. Konsentrasi galaktosa yang menghasilkan jumlah sel terbesar (1.08x109 sel/ml) adalah pada konsentrasi 7.5 % dan konsentrasi glukosa yang menghasilkan jumlah sel terbesar (1.12x109 sel/ml) adalah pada
konsentrasi 2.5 %.
Hasil fermentasi dengan kadar etanol tertinggi adalah pada konsentrasi galaktosa 10 % sebesar 4.24 % v/v cairan fermentasi dan pada konsentrasi glukosa 10 % sebesar 3.15 % v/v cairan fermentasi. Hasil fermentasi P. tannophilus pada media YMP galaktosa dan glukosa dengan konsentrasi 2.5 %, 5 %, 7.5 % dan 10 % dianalisis dengan analisis varian dan uji Duncan didapati hasil bahwa ada pengaruh jenis gula dan konsentrasi terhadap respon (produksi etanol).
Sedangkan produksi etanol pada hidrolisat E. cottonii pun mempengaruhi terhadap produksi etanol dan pertumbuhan P. tannophilus karena pada hidrolisat rumput laut terdapat senyawa-senyawa inhibitor.
Saran
19
DAFTAR PUSTAKA
Black, Jacquelyn G. 2005. Microbioloy: Principles and Exploration 6th ed. US: John Wiley & Sons, Inc.
Brink JVD, Akeroyd M, Hoeven RVD, Pronk JT, Winde JHD, Lapujade PD. 2009. Energetic limits to metabolic flexibility: responses of 12 Saccharomyces cerevisiae to glucose–galactose transitions. Microbiology. 155:1340-1350.
Dubois M, K.A. Gilles, J.K. Hamilton, P.A. Rebers, F. Smith. 1956. Colorimetric method for determination of sugar and related substances. Analitical Chemists 28: 350-356.
Gumbira-Sa’id, E. 1987. Bioindustri. Penebar Swadaya, Jakarta.
Lowenstein, M. Z. 1985. Energy Applications of Biomass. Solar Energy Research Institute. Colorado. USA.
Maharani DM. 2011. Adaptasi Saccharomyces cerevisiae terhadap hidrolisat asam ubi kayu untuk produksi bioetanol [tesis]. Bogor (ID): Institut Pertanian Bogor. Matlock, Brian C. et all. 2011. Differences in Bacterial Optical Density Measurements
between Spectrophotometers. Thermo Electron Scientific Instruments LLC, Madison,WI USA.
Meinita NDM, Kang YJ, Jeong TG, Koo MH, Park MS, Hong KY. 2011. Bioethanol production from acid hydrolysate of the carrageenophyte Kappaphycus alvarezii (cottonii). Journal of Applied Phycology. 24:857-862.
Meyer, H. L. 1978. Food Chemistry. Reinhold Publishing Corporation, New York. Moat, A.G. and J. W. Foster. 1988. Microbial Physicology Second Edition. John
Willey & Sons Inc, New York.
Nababan, Dody. 2013. Hidrolisis Enzimatik untuk Meningkatkan Produksi Bioetanol dari Makroalga (E. cottonii) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Pelczar MJ, Chan ECS. 2008. Dasar-dasar Mikrobiologi. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Radesiyani I. 2013. Potensi khamir dalam fermentasi hidrolisat rumput laut (Kappaphycus alvarezii) Menjadi bioetanol [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sarfat M.S. 2013. Modifikasi Fermentasi Hidrolisat Asam Encer Euchema cottonii Menjadi Bioetanol Menggunakan Saccharomyces cerevisiae dan P. tannophilus [tesis]. Bogor (ID): Institut Pertanian Bogor.
Timson DJ. 2007. Galactose metabolism in Saccharomyces cerevisiae: A review. Dynamic Biochemistry. 3:63-73.
20
Lampiran 1Komposisi berbagai medium yang digunakan dalam penelitian A. Komposisi medium Yeast Malt Peptone (YMP) Galaktosa 2.5%, 5%. 7.5% dan
10% cair (dalam 200mL) Yeast extract 1 g
Malt 1 g Peptone 1 g
Galaktosa 2.5 % 5 g; 5% 10 g; 7.5% 15 g; 10% 20 g Akuades 200 mL
B. Komposisi medium Yeast Malt Peptone (YMP) Glukosa 2.5%, 5%. 7.5% dan 10% cair (dalam 200mL)
Yeast extract 1 g Malt 1 g
Peptone 1 g
Glukosa 2.5 % 5 g; 5% 10 g; 7.5% 15 g; 10% 20 g Akuades 200 mL
Lampiran 2Pembuatan media PDA
21 Lampiran 3Proses pembuatan hidrolisat Euchema cottonii
Bahan kering 15 g, vol 100ml
Hidrolisis Asam (H2SO4 2% 100 ml)
Otoklaf 45 menit, 121oC
Ditambahkan bahan kering lagi 15 g
Otoklaf 45 menit, 121oC
Penetralan (NaoH 10%, pH 6)
Penyaringan
22
Lampiran 4 Metode analisis gula pereduksi metode DNS dan total gula fenol. A. Gula Pereduksi
Prinsip metode ini yakni dalam suasana alkali gula pereduksi akan mereduksi asam 3,5-dinitrolisilat (DNS) membentuk senyawa yang dapat diukur absorbansinya pada panjang gelombang 550 nm.
1. Penyiapan Pereaksi DNS
Pereaksi DNS dibuat dengan melarutkan 10.6 g asam 3,5 dinitrolisat dan 19.8 NaOH ke dalam 1416 ml air. Setelah itu ditambahkan 306 g Na-K Tatrat, 7.6 g fenol yang dicairkan pada suhu 50 oC dan 8.3 g Na-Metabisulfit. Kemudian diaduk rata, 3 ml larutan ini dititrasi dengan HCL 0,1 N dengan indikator fenolftalein. Banyaknya titran berkisar 5-6 ml. jika kurang dari itu harus ditambahkan 2 g NaOH untuk setiap ml kekurangan HCL 0,1 N.
2. Penentuan Kurva Standar
Kurva standar dibuat dengan mengukur mengetahui nilai gula pereduksi pada glukosa pada selang 0,2-0,5 mg/l. Kemudian nilai gula pereduksi dicari dengan metode DNS. Hasil yang didapatkan diplotkan dalam grafik secara linear.
B. Total gula dengan metode fenol H2SO4 (Dubois et al. 1956)
23 Lampiran 5 Hasil plot gula pereduksi pada media YMP galaktosadan glukosa
A. Hasil plot gula pereduksi pada media YMP galaktosa
B. Hasil plot gula pereduksi pada media YMP glukosa y = 2.9362e-0.101x
Galaktosa 2.5% Galaktosa 5% Galaktosa 7.5% Galaktosa 10%
y = 3.6381e-0.295x
24
Lampiran 6 Contoh perhitungan µmaks
Contoh perhitungan diambil dari kurva pertumbuhan P. tannophlius pada media YMP glukosa 2.5 % .
Langka ketiga, diplotkan ln jumlah sel kedalam grafik.
µmaks = slope,
berdasarkan persamaan pada grafik didapat nilia µmaks adalah 0.195 jam-1
25 Lampiran 7 Tabel Anova respon produksi etanol (α = 10 %) dan tabel uji lanjut
Duncan respon produksi etanol Sumber
keragaman SS df MS F F crit
Konsentrasi
(Faktor i) 2104.866625 3 701.6222083 390.7534315 4.066 Jenis Bahan
(Faktor j) 124.3225 1 124.3225 69.2387483 5.318
Interaksi
(i*j) 26.90955 3 8.96985 4.995565457 4.066
Error 14.3645 8 1.7955625
Total 2270.463175 15
H0 : jenis gula dan konsntrasi tidak berpengaruh terhadap produksi etanol H1 : ada jenis gula dan konsentrasi yang berpengaruh terhadap produksi etanol Kesimpulan :
Fhit > Ftabel, tolak H0
Ada jenis gula dan konsentrasi yang berpengaruh terhadap produksi etanol Perlakuan Duncan Grouping
Galaktosa 10 % A
Glukosa 10 % B
Galaktosa 7.5 % B
Glukosa 7.5 % B
Galaktosa 5 % C
Glukosa 5 % C
Galaktosa 2.5 % D
Glukosa 2.5 % E
Keterangan :
Indeks pada Duncan Grouping yang sama menunjukkan perbedaan yang tidak berbeda nyata dari perlakuan.
26
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, pada tanggal 11 April 1990 dengan nama lengkap Alfian Rahmandani Permadi. Penulis merupakan anak pertama dari tiga bersaudara, dari pasangan alm. Asep Permadi dan Eny Nurhayani. Tahun 2009 penulis lulus dari Sekolah Menengah Analisis Kimia Bogor dan pada tahun yang sama penulis lulus melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) dan diterima di Departemen Teknologi Industri Pertanian, Fakultas Teklonogi Pertanian. Penulis mendapatkan beasiswa Bantuan Belajar Mahasiswa (BBM) dari DIKTI pada tahun 2009-2013.