Analisis Struktur Sekretori, Histokimia, Fitokimia, dan Potensi
Antibakteri dari Beberapa Tumbuhan Obat Antiinfeksi di Taman
Wisata Alam Telaga Warna Bogor
FIFI KURNIAWAN
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Analisis Struktur Sekretori, Histokimia, Fitokimia, dan Potensi Antibakteri dari Beberapa Tumbuhan Obat Antiinfeksi di Taman Wisata Alam Telaga Warna Bogor adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
Fifi Kurniawan
ABSTRAK
FIFI KURNIAWAN. Analisis Struktur Sekretori, Histokimia, Fitokimia, dan Potensi Antibakteri dari Beberapa Tumbuhan Obat Antiinfeksi di Taman Wisata Alam Telaga Warna Bogor. Dibimbing oleh YOHANA C SULISTYANINGSIH dan MOHAMAD RAFI.
Sebagian besar jenis tumbuhan tingkat tinggi merupakan sumber metabolit sekunder yang bermanfaat sebagai obat. Tumbuhan yang diteliti merupakan tumbuhan obat yang digunakan untuk penanganan penyakit infeksi yang diperoleh dari Taman Wisata Alam Telaga Warna Bogor yakni ki tabo (Tithonia diversifolia), ki ajag (Ardisia fuliginosa), kuray (Trema orientalis), dan kirinyuh (Austroeupatorium inulifolium). Uji histokimia yang dilakukan meliputi uji keberadaan terpenoid, alkaloid, fenol dan senyawa lipofil. Uji fitokimia dilakukan menurut metode Harborne (1987) menggunakan serbuk kasar tumbuhan obat. Uji aktivitas penghambatan terhadap bakteri gram positif Staphyllococcus aureus dan bakteri gram negatif Escherichia coli dilakukan dengan metode difusi sumur. Struktur sekretori berupa trikoma kelenjar tipe peltat dan uniseriat ditemukan pada
T. diversifolia. Trikoma uniseriat dan sel idioblas terdapat pada A. fuliginosa. Trikoma kapitat, trikoma uniseriat, dan trikoma berisi kristal ditemukan pada T. orientalis. Trikoma peltat dan trikoma uniseriat dijumpai pada A. inulifolium. Uji histokimia menunjukkan hasil positif keberadaan alkaloid, terpenoid dan senyawa lipofil pada trikoma peltat T. diversifolia. Trikoma uniseriat A. fuliginosa positif mengandung alkaloid, terpenoid, senyawa lipofil dan fenol. Trikoma kapitat T. orientalis positif mengandung terpenoid dan senyawa lipofil. Trikoma peltat A. inulifolium positif mengandung alkaloid, terpenoid, dan fenol. Aktivitas penghambatan terhadap bakteri S. aureus ditunjukan oleh ekstrak keempat tumbuhan dengan daya hambat paling besar dihasilkan oleh T. diversifolia.
ABSTRACT
FIFI KURNIAWAN. Analysis of Secretory Structure, Histochemistry, Phytochemistry, and Antibacterial Potency of Some Medicinal Plant from Taman Wisata Alam Telaga Warna. Supervised by YOHANA CAECILIA SULISTYANINGSIH and MOHAMAD RAFI.
Many species of vascular plant serve as source of secondary metabolites utilized as medicine. Plants studied in this research were the medicinal plants used for infectious diseases treatment originated from the Taman Wisata Alam Telaga Warna Bogor i.e.: ki tabo (Tithonia diversifolia), ki ajag (Ardisia fuliginosa), kuray (Trema orientalis), and kirinyuh. The presence of terpenoids, alkaloids, phenols and lipophilic compounds in the plant tissue were identified by using histochemical test. The terpenoids, alkaloids, phenols and steroids content in plant tissues were determined by using a qualitative phytochemical test of plant tissues powder. Antibacterial activity of plant extract was tested to a gram-positive bacteria, Staphyllococcus aureus and a gram-negative bacteria
Escherichia coli by using the well diffusion method. The result showed that the peltate and uniseriate glandular trichomes were found in T. diversifolia. Uniseriat trichomes and idioblas cells were present in A. fuliginosa. Capitate, uniseriat trichomes and other trichomes containing crystals were observed in T. orientalis. Peltate and uniseriat trichomes were found in A. inulifolium. Histochemical test showed positive results of alkaloids, terpenoids and lipophilic compounds in peltate trichomes of T. diversifolia. Uniseriat trichomes of A. fuliginosa showed the precence of alkaloids, terpenoids, lipophilic compounds and phenols. Capitate trichomes of T. orientalis positively containing terpenoids and lipophilic compounds. Peltate trichomes of A. inulifolium showedpositive test for alkaloids, terpenoids, and phenol. Inhibitory activity against S. aureus was shown by extracts of all medicinal plant tested, whereas the greatest inhibition activity produced by T. diversifolia.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biologi
Analisis Struktur Sekretori, Histokimia, Fitokimia, dan Potensi
Antibakteri dari Beberapa Tumbuhan Obat Antiinfeksi di Taman
Wisata Alam Telaga Warna Bogor
FIFI KURNIAWAN
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala kebaikan dan cinta kasih-Nya kepada penulis sehingga karya ilmiah dengan judul Anatomi Struktur sekretori, Histokimia, Fitokimia, dan Potensi Antibakteri dari Beberapa Tumbuhan Obat Antiinfeksi di Taman Wisata Alam Telaga Warna Bogor ini berhasil diselesaikan. Penulis mengucapkan terima kasih kepada Ibu Dr Yohana C. Sulistyaningsih, MSi dan Bapak Dr Mohamad Rafi, MSi selaku pembimbing yang telah sabar membimbing dan mengarahkan selama penelitian ini berlangsung. Terima kasih kepada Ibu Dr Nisa Rachmania Mubarik, MSi selaku dosen penguji yang telah memberikan saran untuk perbaikan penulisan karya ilmiah ini. Penelitian yang berlangsung dari bulan April hingga November 2014 ini tidak terlepas dari dukungan banyak pihak baik secara moril maupun materi.
Terima kasih kepada Ibu Dorly dan Kak Darius atas saran yang diberikan Terima kasih kepada Pak Aki dan pihak Taman Wisata Alam Telaga Warna Bogor yang telah memberi izin dan membantu dalam memperoleh sampel penelitian. Terima kasih kepada Bapak Naryo, Bapak Jaka, Ibu Heni, Bapak Eman, dan Ibu Nunung yang telah banyak membantu di laboratorium dan menyediakan tempat bagi saya untuk melaksanakan penelitian. Terima kasih kepada Kak Shinta, Devi, Aya, Rifai dan teman-teman miktek tumbuhan atas kebersamaan dan semangatnya selama penelitian. Terima kasih kepada teman-teman PMK IPB angkatan 47, rekan-rekan GSM komisi anak, adik-adik kelompok kecil Sara, Iin, Putri dan Vero serta sahabat-sahabat kosan Palem 3 Fung, Sara, Asa, Retno dan Oliv. Terima kasih kepada Papa, Ko Welly, dan Rudy atas kasih sayang tulus, semangat dan dukungan yang diberikan. Penulis juga mengucapkan terima kasih kepada pihak-pihak yang tidak dapat disebutkan satu persatu. Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Februari 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
HASIL DAN PEMBAHASAN 5
Karakter Morfologi dan Pemanfaatan Tumbuhan Obat 5
Analisis Histokimia 11
Analisis Fitokimia 13
Analisis Penghambatan Aktivitas Bakteri 14
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 18
LAMPIRAN 21
DAFTAR TABEL
1 Jenis dan kegunaan tumbuhan obat asal Telaga Warna 8
2 Ukuran dan kerapatan struktur sekretori 10
3 Hasil uji histokimia tumbuhan obat asal Telaga Warna 12 4 Hasil uji fitokimia tumbuhan obat asal Telaga Warna 13 5 Aktivitas penghambatan ekstrak tumbuhan obat terhadap bakteri S. aureus 15
DAFTAR GAMBAR
1 Tumbuhan Tithonia diversifolia 6
2 Tumbuhan Ardisia fuliginosa 6
3 Tumbuhan Trema orientalis 6
4 Tumbuhan Austroeupatorium inulifolium 7
5 Struktur sekretori pada tumbuhan obat antiinfeksi asal Telaga Warna 9 6 Pengujian histokimia struktur sekretori tumbuhan obat asal Telaga Warna 12
7 Hasil uji fitokimia tumbuhan obat 14
8 Hasil penghambatan ekstrak tumbuhan obat terhadap bakteri S. aureus 17
DAFTAR LAMPIRAN
1 Data lingkungan TWA Telaga Warna Bogor 21
2 Sayatan paradermal penampang abaksial tumbuhan obat 21 3 Sayatan paradermal penampang adaksial tumbuhan obat 22
PENDAHULUAN
Latar Belakang
Tumbuhan tingkat tinggi memiliki banyak manfaat. Selain berperan sebagai sumber pangan, sandang, dan papan, tumbuhan tingkat tinggi juga dimanfaatkan sebagai bahan pembuat kosmetik dan obat. Indonesia sebagai salah satu negara megabiodiversitas memiliki keanekaragaman flora yang tinggi. Di antara sekitar 28.000 jenis tumbuhan di Indonesia, sekitar 1300 spesies diketahui sebagai tumbuhan obat, namun baru sekitar 180 jenis yang telah dimanfaatkan sebagai obat secara tradisional (Supriatna 2008). Sesuai dengan namanya tumbuhan obat merupakan tumbuhan yang memiliki kandungan senyawa sebagai bahan obat. Komponen senyawa aktif yang berperan pada tumbuhan obat tersimpan pada berbagai organ berupa daun, akar, batang, maupun kulit batang (Ogundare 2007). Bagian tumbuhan tersebut diolah dengan teknik tertentu untuk diisolasi senyawa bioaktif yang diinginkan.
Metabolit sekunder umum ditemukan pada sebagian besar tumbuhan. Keberadaan metabolit sekunder tertentu seperti alkaloid, flavonoid dan terpenoid pada tumbuhan berkhasiat untuk kesehatan seperti untuk tonikum (penambah stamina) dan antibakteri. Sebagian besar metabolit sekunder ditimbun dalam jaringan sekretori, namun tidak sedikit metabolit sekunder yang ditimbun di vakuola maupun sitosol sel parenkim (Hartanto 2014). Trikoma yang merupakan salah satu jenis struktur sekretori mulai banyak diteliti untuk keperluan sintesis metabolit sekunder secara komersil, melalui penerapan ilmu biokimia, bioteknologi, dan genetika molekular (Wagner et al. 2004). Pengamatan anatomi yang didukung dengan uji histokimia dapat memberikan informasi mengenai tipe struktur sekretori yang terdapat pada tumbuhan obat serta kandungan senyawa metabolit yang dihasilkan atau diakumulasi pada struktur tersebut. Informasi mengenai lokasi dan distribusi struktur sekretori dalam jaringan tumbuhan obat dapat dimanfaatkan untuk pengembangan tanaman obat, antara lain melalui sintesis senyawa metabolit dengan kultur sel.
Penyakit infeksi adalah penyakit yang disebabkan oleh mikrob patogenik seperti bakteri, virus, parasit, atau cendawan (WHO 2014). Terdapat beragam jenis penyakit infeksi di antaranya ialah diare dan penyakit kulit. Diare adalah keadaan defekasi dengan banyak cairan dengan frekuensi lebih dari 3 kali sehari atau lebih dari standar normal setiap individu. Diare dapat disebabkan oleh beragam faktor, faktor terbesar ialah agen biologi berupa bakteri, virus, atau parasit (Baughman dan Hackley 2000; WHO 2014). Penyakit kulit juga terdapat beragam jenis dan faktor penyebab. Bakteri E. coli dan S. aureus merupakan salah satu agen biologis penyebab diare dan penyakit kulit.
2
dilakukannya uji secara ilmiah akan membantu pengembangan tumbuhan obat asal Telaga Warna untuk pemanfaatan yang lebih luas sebagai bahan obat modern.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengamati struktur sekretori tumbuhan obat antiinfeksi asal Telaga Warna dan menganalisis kandungan metabolitnya secara kualitatif serta menguji pengaruh ekstrak tumbuhan tersebut terhadap pertumbuhan bakteri.
METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan pada pada bulan April-November 2014. Pengambilan sampel tumbuhan obat dilakukan di Taman Wisata Alam (TWA) Telaga Warna, Bogor. Pengamatan struktur sekretori dan histokimia dilakukan di Laboratorium Anatomi dan Morfologi Tumbuhan, pengujian aktivitas antibakteri dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, sedangkan ekstraksi dan analisis fitokimia dilakukan di Laboratorium Kimia Analitik, Departemen Kimia, FMIPA IPB.
Bahan
Bahan yang digunakan ialah daun dari tumbuhan ki tabo (Tithonia diversifolia), ki ajag (Ardisia fuliginosa), kuray (Trema orientalis), serta kirinyuh (Austroepatorium inulifolium). Pengujian aktivitas antibakteri menggunakan kultur bakteri E. coli dan S. aureus yang diperoleh dari koleksi Laboratorium Mikrobiologi, Departemen Biologi FMIPA IPB.
Alat
Alat yang digunakan untuk membuat sayatan transversal ialah mikrotom beku dan silet, alat yang digunakan untuk pengamatan antara lain kamera digital, mikroskop cahaya Olympus CX 21 yang dilengkapi dengan mikrometer, serta kamera optilab dengan software image raster. Alat yang digunakan untuk ekstraksi ialah oven, penggiling, seperangkat alat gelas, kertas saring dan rotary evaporator. Alat yang digunakan untuk pengujian aktivitas bakteri antara lain sedotan steril ukuran 0.8 cm, cawan petri disposable ukuran 8 cm, autoklaf,
3
Prosedur Penelitian
Koleksi dan Identifikasi Tumbuhan Obat
Koleksi tumbuhan dilakukan di TWA Telaga Warna Bogor. Identifikasi tumbuhan obat dilakukan dengan bantuan petugas setempat, identifikasi lebih lanjut dilakukan di Herbarium Bogoriensis, LIPI. Pengamatan morfologi tumbuhan dilakukan secara langsung. Sampel daun tumbuhan dikoleksi dalam bentuk segar dan awetan. Sampel segar digunakan untuk keperluan pengujian histokimia, fitokimia, dan uji aktivitas antibakteri. Sampel awetan dalam etanol 70% digunakan untuk keperluan pengamatan struktur sekretori. Sebagai informasi pendukung dilakukan pengukuran data lingkungan berupa suhu, kelembapan, pH, dan intensitas cahaya.
Pengamatan Struktur Sekretori
Struktur sekretori diamati pada sayatan paradermal dan sayatan transversal daun. Sayatan paradermal dibuat pada bagian abaksial dan adaksial dengan metode whole mount menurut Sass (1951). Daun yang telah difiksasi dalam etanol 70% dicuci dengan air. Bagian daun kemudian direndam dalam HNO3 50% selama dua hari untuk melunakkan jaringan. Sayatan bagian abaksial dibuat dengan mengerik bagian adaksial daun dan sebaliknya. Sayatan transversal dibuat dengan mikrotom beku dan silet. Pengamatan struktur sekretori meliputi bentuk, jumlah sel penyusun, ukuran, dan kerapatannya. Kerapatan struktur sekretori (KS) ditentukan dengan menghitung jumlah struktur sekretori yang terdapat dalam tiap bidang pandang mikroskop, selanjutnya dihitung dengan persamaan sebagai berikut:
Uji Histokimia
Uji histokimia dilakukan dengan membuat sayatan transversal menggunakan mikrotom beku dengan ketebalan 15-25 µm. Keberadaan senyawa terpenoid dideteksi dengan reagen kupri asetat 5% dalam akuades (Martin et al.
4
kandungan alkaloid ditunjukkan melalui pengamatan struktur sekretori dengan hasil yang tidak berwarna.
Ektraksi dan Uji Fitokimia Kualitatif
Sampel berupa daun tumbuhan obat dicuci dengan air untuk menghilangkan kotoran. Daun dikeringkan pada udara terbuka selama 1 hari, dilanjutkan dengan pengeringan dalam oven pada suhu 50ºC selama 5 hari kemudian digiling hingga berbentuk serbuk. Serbuk dibagi menjadi dua bagian. Bagian pertama digunakan untuk ekstraksi. Bagian lainnya digunakan untuk uji fitokimia kualitatif.
Ekstraksi dilakukan dengan metode maserasi dengan merendam 50 gram serbuk kering daun dalam 250 ml larutan metanol 70% selama 24 jam kemudian disaring. Maserasi dilakukan dalam beberapa kali pengulangan hingga pelarut terlihat jernih. Sisa pelarut kemudian diuapkan dengan rotary evaporator. Ekstrak kental diencerkan dengan akuades hingga diperoleh konsentrasi 25 mg/ml, 50 mg/ml, 75 mg/ml, dan 100 mg/ml.
Uji fitokimia kualitatif dilakukan dengan metode Harborne (1987) menggunakan serbuk kasar tumbuhan.
Penentuan keberadaan alkaloid
Sebanyak 2 gram serbuk sampel diekstrak dengan sedikit kloroform, kemudian ditambah dengan 10 ml kloroform-amoniak dan disaring. Filtrat ditambahkan dengan beberapa tetes H2SO4 2M, kemudian dikocok hingga terbentuk dua lapisan. Lapisan asam (tidak berwarna) dipipet ke dalam tabung reaksi yang lain, kemudian larutan dibagi menjadi 3 lalu masing-masing larutan diuji dengan beberapa tetes pereaksi Dragendorf, Mayer, dan Wagner. Uji ini dinyatakan positif bila larutan-larutan tersebut menghasilkan endapan berwarna jingga (Dragendorf), putih kekuningan (Mayer), dan coklat (Wagner).
Penentuan keberadaan flavonoid
Sebanyak 2 gram sampel diekstraksi dengan sejumlah metanol absolut sampai bahan terendam semua. Campuran dididihkan dan kemudian disaring. Filtrat kemudian ditambah dengan NaOH 10%. Terbentuknya warna merah setelah penambahan NaOH 10%, menunjukkan keberadaan flavonoid.
Penetuan keberadaan steroid/triterpenoid
Sebanyak 2 gram serbuk sampel diekstraksi dengan sejumlah etanol absolut sampai terendam seluruhnya, kemudian dipanaskan sampai mendidih, dan disaring. Filtrat diuapkan, kemudian ditambahkan dietil eter pada sisa endapan. Pada fraksi dietil eter ditambahkan Liebermann-Buchard (3 tetes asam asetat anhidrat + 1 tetes H2SO4). Uji steroid dinyatakan positif bila dihasilkan warna kehijauan dan uji positif untuk triterpenoid bila dihasilkan warna kemerahan atau ungu.
Penentuan keberadaan fenol
5 Sebanyak 1 ml filtrat diuapkan sampai kering, bagian yang tertinggal dilarutkan dengan 2 ml etanol 95% kemudian ditambahkan pereaksi H2SO4 pekat. Jika terbentuk warna hijau kehitaman menunjukkan adanya senyawa fenol.
Uji Aktivitas Antibakteri Tumbuhan Obat
Aktivitas antibakteri diuji menggunakan metode difusi sumur. Kultur murni bakteri E.coli dan S. aureus diremajakan pada media nutrient agar (NA) miring selanjutnya disuspensikan ke dalam media nutrient broth (NB) steril. Kultur bakteri disuspensikan dalam media NA cair dengan konsentrasi 1%. Media NA dituang dalam cawan petri dan dibiarkan hingga memadat (Gebby et al. 2013). Sumur berdiameter 0.8 cm dibuat sebanyak 6 buah pada media yang telah memadat. Pembuatan sumur dilakukan dengan bantuan sedotan yang telah disterilkan. Empat buah sumur diisi dengan 100 µl ekstrak tumbuhan obat dengan konsentrasi berbeda yakni 25 mg/ml, 50 mg/ml, 75 mg/ml, dan 100 mg/ml.
Antibiotik Cefotaxime® 50 µg/ml digunakan sebagai kontrol positif, dan akuades steril sebagai kontrol negatif. Kultur selanjutnya diinkubasi selama 24 jam pada suhu 37ººC. Pengujian aktivitas antibakteri dilakukan dengan pengulangan
sebanyak 3 kali. Indeks penghambatan (IP) dihitung dengan persamaan sebagai berikut
HASIL DAN PEMBAHASAN
Karakter Morfologi dan Pemanfaatan Tumbuhan Obat
Empat jenis tumbuhan obat yang diperoleh dari taman wisata alam Telaga Warna memiliki morfologi yang beragam. Tumbuhan T. diversifolia merupakan tumbuhan merambat berperawakan herba yang bersifat perenial dengan tinggi mencapai 2 hingga 3 meter. Daun T. diversifolia merupakan daun tunggal dengan bentuk bulat berbagi menjari (Gambar 1). Tumbuhan A. fuliginosa berperawakan pohon dengan tinggi kurang lebih 3 meter (Gambar 2). Daun A. fuliginosa
6
Gambar 1 Tumbuhan Tithonia diversifolia. Habitus (A); morfologi daun (B).
Gambar 2 Tumbuhan Ardisia fuliginosa. Habitus (A); morfologi daun (B).
7
Gambar 4 Tumbuhan Austroeupatorium inulifolium. Habitus (A); morfologi daun (B).
Tumbuhan obat yang diteliti merupakan jenis-jenis tumbuhan yang digunakan untuk pengobatan berbagai penyakit yang berkaitan dengan infeksi, meliputi luka, radang, dan diare. T. diversifolia dan A. inulifolium digunakan untuk penanganan penyakit kulit, sementara A. fuliginosa dan T. orientalis
dimanfaatkan sebagai obat diare (Tabel 1). Pada keempat tumbuhan yang diteliti bagian tumbuhan yang digunakan sebagai bahan obat adalah daun, kecuali T. orientalis yang juga dimanfaatkan bagian kulit batangnya. Dari empat tumbuhan yang digunakan dua di antaranya, yakni T. diversifolia dan A. inulifolium
8
Tabel 1 Jenis dan kegunaan tumbuhan obat asal Telaga Warna Nama
lokal Nama ilmiah Famili Kegunaan* Cara pemakaian*
Ki tabo Tithonia
Keterangan (*): (komunikasi pribadi dengan Aki 2014)
Pemanfaatan T. diversifolia di TWA Telaga Warna ialah sebagai obat luka luar, antiinflamasi, dan obat gatal. Di Nigeria, tumbuhan ini lazim dimanfaatkan sebagai sebagai obat malaria (Fasola dan Iyamah 2008). Seperti T. diversifolia, T. orientalis juga telah dimanfaatkan di berbagai tempat di dunia. Pemanfaatan T. orientalis sebagai bahan obat, dapat berupa herbal tunggal atau digabung dengan bahan tanaman lain. Daun T. orientalis direbus bersamaan dengan daun Bidens pilosa, Citrus aurantifolia, dan kulit nanas mentah kemudian air rebusannya diminum selanjutnya digunakan sebagai obat penyakit kuning. Pengolahan lain, daun T. orientalis dapat dimaserasi dengan jus lemon digunakan sebagai obat bronkitis, pneumonia, dan pleuritis (Katande 1995). Masyarakat Sunda memanfaatkan daun A. fuliginosa sebagai obat diare (komunikasi pribadi dengan Aki 2014), sedangkan masyarakat Indonesia lainnya menggunakan getah batang tumbuhan ini sebagai obat gatal Wiart (2006), namun belum pernah ada laporan ilmiah yang menyatakan efek farmakologis tumbuhan ini.
Struktur Sekretori pada Tumbuhan Obat
9 1). Ciri morfologi dari trikoma tipe kapitat ialah tangkai trikoma yang memanjang dan bagian kepala yang membulat dan meruncing, sedangkan trikoma peltat memiliki tangkai yang pendek dan bagian kepala yang tersusun oleh beberapa sel (Werker 2000).
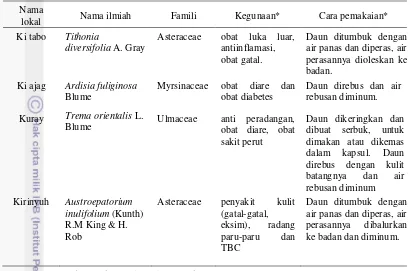
Gambar 5 Struktur sekretori pada tumbuhan obat antiinfeksi asal Telaga Warna. Trikoma kapitat dengan 2 sel kepala (A); trikoma kapitat dengan banyak sel kepala (B); trikoma peltat (C); trikoma uniseriat (D); trikoma berisi kristal (E), dan sel idioblas (F). Bar berukuran 50 µm (A, B, C). Bar berukuran 30 µm (D, E, F).
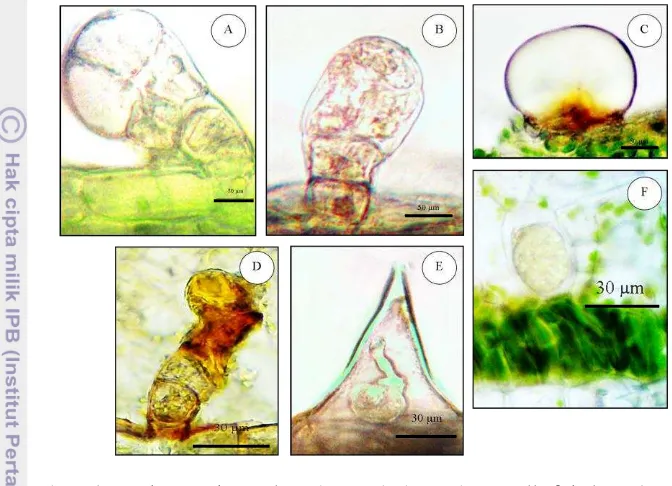
Struktur sekretori yang terdapat pada T. diversifolia ialah trikoma peltat dan trikoma uniseriat (Lampiran 2). Trikoma peltat pada T. diversifolia terdiri atas 1-2 sel kepala dan beberapa sel tangkai, namun sebagian besar bersifat sesil. Diameter sel kepala pada trikoma peltat bagian abaksial (37.8±3.3 µm) tidak berbeda dengan bagian adaksial (38.0±5.0 µm) (Tabel 2). Nilai kerapatan trikoma peltat T. diversifolia tidak berbeda antara bagian abaksial (6.2±0.9 mm-2) dan adaksial daun (7.1±1.4 mm-2). Nilai kerapatan trikoma uniseriat T. diversifolia
pada kedua sisi lebih besar dibanding trikoma peltat.
Sel idioblas dan trikoma uniseriat ditemukan pada A. fuliginosa. Sel idioblas adalah sel tumbuhan yang terspesialisasi dan mengandung senyawa kimia dengan komposisi yang berbeda dibandingkan dengan sel sekitarnya (Khafagi 2007). Sel idioblas pada A. fuliginosa berada di jaringan mesofil dengan ukuran yang relatif lebih besar dibanding sel di sekitarnya. Diameter sel idioblas A. fuliginosa ialah 61.1±12.1 µm, dengan nilai kerapatan sebesar 14.5±7.2 mm-2. Trikoma uniseriat pada A. fuliginosa terdiri atas 3-5 sel yang tersusun dalam satu baris dengan orientasi tegak. Ukuran trikoma uniseriat pada bagian abaksial relatif lebih besar dibanding bagian adaksial, namun nilai kerapatan lebih besar pada bagian adaksial (11.0±4.0).
10
orientalis memiliki jumlah sel kepala 2 hingga 8 sel dan sel tangkai 3-5 sel. Panjang sel tangkai trikoma kapitat T. orientalis lebih besar pada bagian adaksial (157.9±14.8 µm) dibanding abaksial (139.2±15.3 µm) daun. Kerapatan trikoma kapitat pada bagian abaksial (1.4±0.5 mm-2) lebih rendah dibanding adaksial (5.0±2.8 mm-2). Trikoma kapitat merupakan struktur sekretori dengan nilai kerapatan paling kecil di antara jenis struktur sekretori lain pada T. orientalis. Trikoma uniseriat yang dijumpai pada T. orientalis memiliki kerapatan bagian abaksial (32.0±4.2 mm-2) tidak berbedadibandingkan bagian adaksial (29.4±15.3 mm-2). Trikoma berisi kristal terdistribusi secara merata pada bagian abaksial dan adaksial daun T. orientalis.
Struktur sekretoriyang ditemukan pada A. inulifolium ialah trikoma peltat dan trikoma uniseriat. Trikoma peltat A. inulifolium terdiri atas 1-2 sel kepala, dan memiliki sel tangkai. Nilai kerapatan pada sisi abaksial (16.7±2.1 mm-2) lebih besar dibandingkan pada sisi adaksial (9.9±1.1 mm-2). Diameter sel kepala trikoma peltat pada bagian adaksial (51.3±0.9 µm) tidak berbeda dibanding abaksial (48.0±3.7 µm). Ukuran trikoma uniseriat bagian abaksial relatif lebih besar dibanding adaksial. Kerapatan trikoma uniseriat bagian abaksial dan adaksial tidak berbeda.
Tabel 2 Ukuran dan kerapatan struktur sekretori
Tumbuhan Struktur
sekretori
Dimensi struktur sekretori (µ m) Kerapatan (mm-2)
Abaksial Adaksial Abaksial Adaksial
T. diversifolia
Keterangan: p (panjang), l (lebar), d (diameter)
11 kerapatan trikoma kelenjar yang lebih besar pada bagian adaksial (26.5-39.2 mm -2
) dibanding abaksial (14.2-28.4 mm-2) (Juliarni et al. 2007). Keberadaan trikoma kelenjar pada tumbuhan bermanfaat sebagai struktur pertahanan diri terhadap herbivor dan patogen (Werker 2000).
Analisis Histokimia
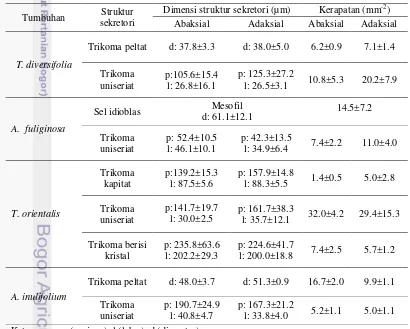
Sampel tumbuhan obat yang diteliti diambil di lingkungan dengan pH yang relatif seragam (5.1-6.8). Kelembapan relatif berkisar antara 72-92% dengan intensitas cahaya relatif rendah (Lampiran 1). Struktur sekretori pada tumbuhan obat menghasilkan senyawa metabolit yang keberadaanya pada jaringan tumbuhan dideteksi melalui uji histokimia. Reaksi dengan reagen tertentu pada uji histokimia menghasilkan warna spesifik. Hasil uji histokimia menunjukkan trikoma kapitat pada T. orientalis mengandung terpenoid dan senyawa lipofil (Tabel 3). Trikoma kapitat yang terdapat pada permukaan abaksial daun
Otacanthus coeruleus (Scrophularlaceae) dilaporkan mensekresikan senyawa minyak esensial yang mengandung diterpena dan alkaloid (Bajaj 1997). Alkaloid dan terpenoid dijumpai pada trikoma peltat T. diversifolia dan A. inulifolium. Senyawa lipofil hanya dijumpai pada trikoma peltat T. diversifolia (Gambar 8), sedangkan fenol dijumpai pada trikoma peltat A. inulifolium. Hasil penelitian Gersbach et al. (2001) menunjukkan bahwa trikoma peltat pada Thymus vulgaris
mengandung thymol sedangkan Oreganum vulgare mengandung carvacrol. Kedua senyawa tersebut merupakan golongan fenol. Karakterisasi histokimia dari oleoresin yang disintesis oleh trikoma peltat pada Leonotis leonurus (Lamiaceae) menunjukkan kandungan alkaloid dan terpenoid aglikon (Ascensao et al. 1997).
Senyawa alkaloid merupakan metabolit sekunder yang terdapat pada keempat trikoma uniseriat pada tumbuhan obat yang diteliti. Terpenoid dan senyawa lipofil juga terkandung pada trikoma uniseriat semua tumbuhan yang diteliti kecuali pada T. diversifolia, sedangkan senyawa fenol hanya terdeteksi pada trikoma uniseriat T. diversifolia dan A. fuliginosa. Uji histokimia trikoma uniseriat pada Sigesbeckia jorullensis (Asteraceae) menunjukkan keberadaan terpenoid dengan senyawa turunan terbanyak dalam bentuk diterpena dan
sesquisterpene lactones (Heinrich et al. 2002). Trikoma berisi kristal pada T. orientalis menunjukkan hasil negatif pada semua uji histokimia (Gambar 6). Trikoma berisi kristal diduga tidak mensekresikan ataupun mengakumulasikan alkaloid, terpenoid, flavonoid, dan senyawa lipofil. Sel idioblas pada A. fuliginosa
mengandung senyawa alkaloid dan fenol. Idioblas merupakan salah satu tempat biosintesis alkaloid. Khafagi (2007) melaporkan bahwa sel idioblas pada
12
Tabel 3 Hasil uji histokimia tumbuhan obat asal Telaga Warna
Struktur sekretori Tumbuhan
Metabolit sekunder
Alkaloid Terpenoid Senyawa
lipofil Fenol
Trikoma kapitat T. orientalis - + + -
Trikoma peltat T. diversifolia + + + -
A. inulifolium + + - +
Trikoma uniserat
T. diversifolia + - - +
A. fuliginosa + + + +
T. orientalis + + + -
A. inulifolium + + + -
Trikoma berisi kristal T. orientalis - - - -
Sel idioblas A. fuliginosa + - - +
Keterangan: + (terdeteksi senyawa) - (tidak terdeteksi senyawa)
Gambar 6 Pengujian histokimia struktur sekretori tumbuhan obat asal Telaga Warna. Trikoma kapitat T. orientalis dengan uji alkaloid (A), terpenoid (B), lipofil (C), fenol (D). Trikoma peltat T. diversifolia
dengan uji alkaloid (E), terpenoid (F), lipofil (G), fenol (H). Trikoma uniseriat T. diversifolia dengan uji alkaloid (I), terpenoid (J), lipofil (K), fenol (L). Trikoma berisi kristal T. orientalis dengan uji alkaloid (M), terpenoid (N), lipofil (O), fenol (P). Sel idioblas A. fuliginosa
13
Analisis Fitokimia
Seperti uji histokimia, uji fitokimia yang dilakukan juga bersifat kualitatif sehingga hanya dapat mengetahui keberadaan kelompok senyawa metabolit tanpa informasi yang lebih detil tentang jenis dan konsentrasi metabolit secara spesifik. Hasil positif ditunjukkan dengan terbentuknya endapan atau perubahan warna. Semakin pekat warna yang ditimbulkan menunjukkan semakin banyak kadar senyawa yang terkandung dalam tumbuhan. Uji fitokimia yang dilakukan dengan metode Harborne (1987) menunjukkan bahwa semua ekstrak tumbuhan tidak mengandung alkaloid (Tabel 4). Uji kandungan triterpenoid dan steroid dilakukan bersamaan dalam satu plat tetes, karena kesamaan dalam bentuk glikosida. Tumbuhan A. inulifolium memiliki kandungan triterpenoid terbanyak dibanding tumbuhan lainnya yang ditunjukkan dengan warna merah yang dominan, sebaliknya kandungan steroid yang dimiliki rendah. Uji steroid bernilai positif apabila warna hijau yang terbentuk lebih dominan dibanding warna merah. Kadar steroid terbanyak dikandung oleh T. orientalis (Gambar 7). Menurut Accra (2012), daun T. orientalis mengandung tanin, saponin, flavonoid dan triterpenoid berupa simiarenol, simirenone, dan trematol.
Tabel 4 Hasil uji fitokimia tumbuhan obat asal Telaga Warna
Tumbuhan Metabolit Sekunder
Alkaloid Triterpenoid Steroid Flavonoid Fenol
T. diversifolia - ++ +++ +++ + komponen fitokimia berupa sesquisterpene lactones dan flavonoid dalam jumlah besar. Sesquisterpene lactones merupakan kelompok metabolit sekunder lipofilik yang ditemukan di sebagian besar tumbuhan di antaranya famili Euphorbiceae, Cactaceae, Araceae, dan Solanaceae, namun keberadaan paling banyak ditemukan pada famili Asteraceae. Vernonia amygdalina yang juga merupakan tumbuhan dari famili Asteraceae mengandung senyawa sesquisterpene lactones berupa vernolide dan vernodalol (Audu et al. 2012). Biosintesis sesquisterpene lactones
14
keseluruhan bagian daun sementara hasil uji histokimia langsung diamati pada struktur sekretori pada jaringan daun. Kandungan alkaloid memiliki proporsi lebih rendah pada uji fitokimia dibanding uji histokimia.
Gambar 7 Hasil uji fitokimia tumbuhan obat. Uji alkaloid (A); uji fenol (B); uji flavonoid (C); uji triterpenoid dan steroid (D).
Analisis Penghambatan Aktivitas Bakteri
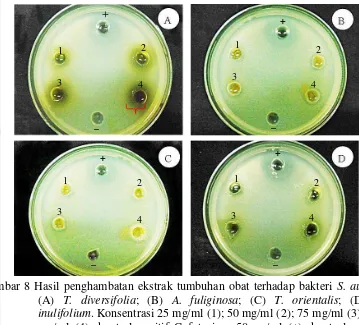
Efektivitas tumbuhan obat sebagai antiinfeksi dapat dilihat dari kemampuannya membunuh atau menghambat aktivitas bakteri. Zat antibakteri dalam tumbuhan obat diharapkan dapat berperan sebagai bakteriostatik maupun bakterisida (Suhaya 2014). Proses tersebut dilakukan melalui penghambatan sintesis dinding sel, protein, asam nukleat, atau penghambatan jalur metabolisme bakteri sehingga menghancurkan struktur membran sel bakteri (Tenover 2006). Gangguan tersebut menyebabkan penghambatan pertumbuhan bakteri yang ditunjukkan dengan pembentukan zona bening pada media yang mengandung antibiotik atau ekstrak yang diduga mengandung komponen aktif antibakteri. Terbentuknya zona hambat menunjukkan adanya aktivitas antibakteri pada ekstrak tumbuhan obat asal Telaga Warna. Diameter zona hambat menunjukkan tingkat efektivitas penghambatan oleh ekstrak tumbuhan. Semakin besar indeks penghambatan menunjukkan semakin efektif peranan ekstrak tumbuhan tersebut sebagai antibakteri.
Tumbuhan obat yang diteliti mengandung metabolit sekunder dalam kadar yang berbeda-beda. Metabolit sekunder berupa alkaloid, flavonoid, terpenoid, dan. fenol berperan sebagai komponen aktif dalam tumbuhan obat. Komponen fenolik dalam asam kandis (Garcinia diocinia Blume) dilaporkan memiliki khasiat sebagai antimikrob yang menghambat pertumbuhan S. aureus dan E. coli
(Ardiningsih et al. 2012). Ekstrak sereh (Cymbopogon citratus) menunjukkan aktivitas penghambatan yang tinggi terhadap bakteri gram positif, gram negatif,
15 dan cendawan karena kandungan flavonoid yang dominan (Shah et al. 2011). Efek farmakologis dari bahan alam tidak hanya ditentukan oleh satu komponen tunggal, melainkan oleh beberapa komponen yang saling terintegrasi. Ekstrak tumbuhan obat yang diteliti berpengaruh positif pada bakteri S. aureus (Gambar 8), sementara pada E. coli tidak menghasilkan zona hambat sama sekali. Perbedaan sensitivitas bakteri terhadap ekstrak tumbuhan obat disebabkan oleh perbedaan komposisi dinding sel bakteri. Bakteri E. coli yang tergolong dalam kelompok bakteri gram negatif memiliki lapisan dinding luar berupa membran fosfolipid yang berisi komponen lipopolisakarida struktural. Adanya lapisan ini menyebabkan dinding sel bakteri bersifat impermeabel terhadap senyawa antimikrob. Bakteri gram positif S. aureus memiliki lapisan peptidoglikan yang tebal pada dinding selnya, lapisan tersebut bukan barier yang efektif untuk menahan difusi senyawa bioaktif. Dinding sel bakteri gram negatif lebih kompleks dibanding bakteri gram positif, sehingga menyebabkan bakteri gram negatif lebih resisten terhadap senyawa bioaktif dibanding bakteri gram positif (Nostro et al.
2000; Hodges 2002).
Antibiotik Cefotaxime® tergolong ke dalam kelompok Sefalosporin. Pemilihan antibiotik dari kelompok Sefalosporin sebagai kontrol positif yang digunakan pada penelitian ini didasarkan pada spektum penghambatannya yang luas, yaitu dapat menghambat bakteri gram positif dan negatif. Antibiotik bekerja dengan 2 mekanisme yaitu sebagai bakteriostatik maupun bakterisida. Bakteriostatik dalam konsentrasi tinggi dapat menjadi bakterisida dan sebaliknya bakterisida dalam konsentrasi rendah dapat menjadi bakteristatik (Craig 1995).
Hasil pengujian aktivitas antibakteri menunjukkan bahwa ekstrak daun T. diversifolia pada konsentrasi 100 mg/ml memiliki efektivitas paling tinggi dalam menghambat pertumbuhan bakteri S. aureus yaitu dengan indeks zona hambat sebesar 0.74 (Tabel 5). Kemampuan penghambatan ekstrak T. diversifolia yang tinggi terhadap S. aureus terlihat dari indeks penghambatan tumbuhan ini pada konsentrasi 75 mg/ml (0.55) masih lebih tinggi dibandingkan dengan ekstrak A. fuliginosa (0.36), T. orientalis (0.47), dan A. inulifolium (0.17) pada konsentrasi 100 mg/ml.
Tabel 5 Aktivitas penghambatan ekstrak tumbuhan obat terhadap bakteri S. aureus
Konsentrasi (mg/ml)
Indeks Zona Hambat
T. diversifolia A. fuliginosa T. orientalis A. inulifolium
25 0.41 0.10 0.26 0.07
Keterangan: (*) akuades, (**): Cefotaxime 50 µg/ml
16
diversifolia sebagai antibakteri tergolong dalam kelompok moderat dengan indeks penghambatan yang lebih besar dibanding tumbuhan Baccharis pseudotenuifolia. Alkaloid, terpenoid dan fenol yang dikandung T. diversifolia diduga berperan dalam menghambat pertumbuhan bakteri patogen. Kunyit mengandung komponen fenolik berupa kurkumin yang berperan sebagai antimikrob dan antioksidan (Goel 2009).
Ekstrak A. inulifolium memiliki daya hambat bakteri paling lemah jika dibandingkan dengan keempat tumbuhan lainnya. Faktor cara ekstraksi serta jenis pelarut yang digunakan dapat mempengaruhi senyawa bioaktif yang diperoleh. Pemilihan metanol sebagai pelarut disebabkan sifatnya yang universal yakni mampu menarik senyawa polar dan nonpolar karena keberadaan gugus (-OH) dan (-CH3) (Astarina et al. 2013). Namun senyawa nonpolar akan lebih baik diisolasi dengan pelarut yang juga bersifat nonpolar. Hal yang sama juga berlaku untuk senyawa semi polar. Pengujian sifat antibakteri dapat menunjukkan hasil yang tepat dengan penggunaan pelarut yang sesuai sehingga dapat menarik komponen bioaktif yang terkandung dalam jaringan tumbuhan secara maksimal.
Pemanfaatan T. diversifolia di Telaga Warna ialah sebagai obat gatal, obat luka luar dan antiinflamasi. Tumbuhan T. diversifolia berpotensi untuk dikembangkan sebagai bahan obat antiinfeksi ditinjau dari pemanfaatanya di negara lain dan setelah diuji secara ilmiah. Studi terhadap tanaman obat menunjukkan sesquisterpene lactones yang dikandung T. diversifolia merupakan komponen aktif untuk pengobatan berbagai penyakit seperti diare, luka bakar, influenza, kerusakan syaraf serta berperan sebagai antimikrob (Chadwick et al.
17
Gambar 8 Hasil penghambatan ekstrak tumbuhan obat terhadap bakteri S. aureus. (A) T. diversifolia; (B) A. fuliginosa; (C) T. orientalis; (D) A. inulifolium. Konsentrasi 25 mg/ml (1); 50 mg/ml (2); 75 mg/ml (3); 100 mg/ml (4); kontrol positif Cefotaxime 50 µg/ml (+); kontrol negatif akuades steril (-).
SIMPULAN DAN SARAN
Simpulan
Struktur sekretori yang terdapat pada tumbuhan obat T. diversifolia, A. fuliginosa, T. orientalis, A. inulifolium adalah trikoma peltat, trikoma kapitat, trikoma uniseriat, trikoma berisi kristal, dan sel idioblas. Trikoma kelenjar jenis peltat ditemukan pada tumbuhan T. diversifolia dan A. inulifolium. Kerapatan terbesar struktur sekretori terdapat pada trikoma uniseriat T. orientalis bagian abaksial. Uji histokimia dan fitokimia menunjukkan keberadaan senyawa bioaktif berupa flavonoid, alkaloid, dan terpenoid dalam tumbuhan obat yang diteliti. Pengujian antibakteri menunjukkan ekstrak metanol T. diversifolia menghambat S. aureus dengan daya hambat paling besar.
Saran
Perlu dilakukan penelitian lebih lanjut tentang tumbuhan obat asal Telaga Warna serta komponen fitokimianya secara lebih spesifik melalui uji kuantitatif. Ekstraksi tumbuhan obat perlu dilakukan dengan pelarut nonpolar dan semi polar sehingga dapat diketahui keterwakilan dari masing-masing jenis pelarut terhadap kemampuannya menarik senyawa bioaktif dalam tumbuhan.
18
DAFTAR PUSTAKA
Accra.1992. Ghana Herbal Pharmacopeia. Ghana (ZA): The Adventist Pr.
Ambrosio SR, Oki Y, Heleno VC, Chaves JS, Naschimento PG, Lichston JE, Costantino MG, Varanda EM, Da Costa FB. 2008. Constituents of glandular trichomes of Tithonia diversifolia: relationships to herbivory and antifeedant activity. J Phytochem. 69(10): 52-60.
Ardiningsih P, Sumarni, Nofiani R, Jayuska R. 2012. Phythochemical screening and antimicrobial activity of sub fractions asam kandis (Garcinia diocia
Blume). J Pharm Appl Sci. 2(12): 172-174.
Ascensao L, Marques N, Salome MP. 1997. Peltate glandular trichomes of
Leonotis leonurus leaves: ultrastructure and histochemical characterizations of secretions. Int J Plant Sci. 158(3): 249-258.
Astarina NWG, Astuti KW, Warditiani NK. 2013. Skrinning fitokimia ekstrak metanol rimpang bangle (Zingiber purpureum Roxb.). J Farm Udayana.1: 5-10.
Audu SA, Taiwo AE, Ojuolape AR. 2012. A study review of documented phytochemistry of Vernonia amygdalina (family Asteraceae) as the basis of pharmacology plant extract. 2012. J Nat Sci Res. 2(7): 1-5.
Bajaj YPS. 1997. Biotechonology in Agriculture and Forestry 41: Medicinal and Aromatic Plant X. New Delhi (IN): Springer.
Baughman DC dan Hackley JC. 2002. Keperawatan Medikal Bedah: Buku Saku untuk Brunner dan Suddrath. Yasmin A, penerjemah; Ester M, editor. Jakarta (ID): Penerbit buku kedokteran EGC. Terjemahan dari Handbook for Brunner and Suddrath’s Textbook of Medical-Surgical Nursing.
Boix YF, Victoria CP, Defaveri ACA, Arruda RCO, Sato A, Lage CLS.2013. Glandular trichomes of Rosmarinus officinalis anatomical and phytochemical analyses of leaf volatiles. Plant Biosyst. 145(4): 848-856. Chadwick M, Trewin H, Gawthrop F, Wagstaff C. 2013. Sesquisterpene lactones:
benefit to plants and people. Int J Mol Sci.14: 12780-12805.
Chagas-Paula DA, Rejane B, Vanessa CDS, Leothnardo GN. 2011. Chlorogenic acids from Tithonia diversifolia demonstrate better anti-inflammatory effect than indomethacin and its sesquisterpene lactones. J Ethnopharmacol. 136: 355-362.
Cutler DF, Botha T, Stevenson DW. 2007. Plant Anatomy An Applied Approach. Oxford (GB): Blackwell Pub.
Craig WA. 1995. Interrelationship between pharmacokinetics and pharmacodynamics in determining dosage regimens for broad-spectrum cephalosporins. Diagn Microbiol Infect Dis. 22(1): 89-96.
Facchini PJ. 2001. Alkaloid biosynthesis in plants: biochemistry, cell biology,molecular regulation, and metabolic engineering applications.
Annu Rev Plant Physiol Plant Mol Biol. 52: 29-66.
Fahn A. 1979. SecretoryTissue in Plant. New York (US): Academic Pr.
19 Fuhr Y, Mahlberg PG. 1981. Histochemical analysis of laticifers and glandular
trichomes in Cannabis sativa. J Nat Prod. 44(2): 153-159.
Goel S. 2009. Bioprotective of properties of turmeric an investigation of the antioxidant and antimicrobial activities. J Young Investigat. 16:12.
Gebby AE, Oktavia, Ibrahim M, Lisdiana L. 2013. Pengaruh pemberian ekstrak etanol biji mahoni (Swietenia mahagoni) terhadap penghambatan pertumbuhan Escherichia coli dengan metode difusi cakram. JLentera Bio. 2(3): 239-243.
Gersbach PV, Wyllie SG, Sarafis V. 2001. A new histochemichal method for localization of the site of monoterpene phenol accumulation in plant secretory structures. Ann Bot. 88: 521-525.
Harborne JB. 1987. Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan Ed 2. Padmawinata K, Soedira L, penerjemah; Nikosolihin S, editor. Bandung (ID): Penerbit ITB Pr. Terjemahan dari: Phytochemical Methods.
Hartanto LN. 2014. Memanfaatkan produk jaringan sekretori pada tumbuhan. Di dalam Hartanto LN, Satria, editor. Peran Biologi dalam Kesejahteraan Manusia. Peringatan Dies Natalis Fakultas Biologi ke-59 Fakultas Biologi UGM. [internet]. [Yogyakarta, 19 September 2014]. Yogyakarta (ID): Universitas Gadjah Mada; [diunduh 2014 Desember 20]. Tersedia pada:
http://ugm.ac.id/id/berita/9294memanfaatkan.produk.jaringan.sekretori.pa
da.tumbuhan.
Heinrich G, Pfeifhofer HW, Stabentheiner E, Sawidis T. 2001. Glandulars hairs of
Sigesbeckia jorullensis Kunth (Asteraceae): Morphology, histochemistry and composition of essential oil. Ann Bot. 89: 459-469.
Hodges S. 2002. Pharmaceuticals Applications Of Microbiological Techniques In Pharmaceutics: The Science Of Dosage Design. London (GB): Harcout. Johansen DA. 1940. Plant Microtechnique. New York (US): McGraw-Hill.
Juliarni. 2007. Karakter anatomi daun dari kultur tunas Artemisia annua L. Bul Agron. 35 (3): 225-232.
Katande AB. 1995. Useful trees and shrubs for Uganda: identification, propagation and management for agricultural and pastoral communities. Stockholm (SE): Swedish International Development Authority (SIDA). Khafagi IK. 2007. Generation of alkaloid containing idioblast during cellular
morphogenesis of Peganum harmala L. cell suspension cultures. Am J Plant Physiol. 2(1): 17-26.
Khan JA, Kumar N. 2011. Evaluation of antibacterial properties of Piper betel
leaf. J Pharm BiomedSci. 11(1): 1-3.
Martin D, Tholl D, Gershenzon J, Bohlmann J . 2002. Methyl jasmonate induces traumatic resin ducts, terpenoid resin biosynthesis, and terpenoid accumulation in developing xylem of norway spruce stems. Plant Physiol. 129: 1003-1018.
Mulyani ESS. 2006. Anatomi Tumbuhan. Yogyakarta (ID): Kanisius.
Nostro A, Germano MP, Angelo VD, Marino A dan Cannatelli MA. 2000. Extraction methods and bioautobiography for evaluation of medicinal plants antimicrobial activity. J Appl Microbiol. 30: 379-384.
20
Sass JE. 1951. Botanical Microtechnique. Iowa (US): Iowa State College Pr. Shah G, Shri R, Panchal V, Sharma N, Singh B, Mann AS. 2011. Scientific basis
for the therapeutic use of Cymbopogon citratus stapf (lemon grass). J Adv Pharm Technol Res. 2(1): 3-8.
Smania AJ, Cleidson V, Simone MS, Elza FAS. 2007. Screening methods to determine antibacterial activity of natural products. Braz J Microbiol. 38: 369-380.
Suhaya DD. 2014. Efektivitas ekstrak ki pahit (Tithonia diversifolia) dan kirinyuh (Eupatorium inulifolium) untuk pencegahan dan pengobatan penyakit akibat infeksi Aeromonas hydrophila pada ikan lele Clarias sp. melalui pakan [skripsi] Bogor (ID): Institut Pertanian Bogor.
Rieseberg, LH, Raymond OD, Rosenthal M, Lai KZ. Livingstone T, Nakazato JL, Durphy AE, Schwarzbach LA, Donovan CL. 2003. Major ecological transitions in wild sunflowers facilitated by hybridization. Science. 301: 1211-1216.
Supriatna J. 2008. Melestarikan Alam Indonesia. Jakarta (ID): Yayasan Obor Indonesia
Tenover FC. 2006. Mechanism of antimicrobial resistance in bacteria. Am J Med. 119: S3-S10.
Wagner GJ, Wang E, Shepherd RW. 2004. New approaches for studying and exploting an old protuberence, the plant trichome. Ann Bot. 93: 3-11. [WHO] World Health Organization. 2014. Diarrhoea. [internet]. [Diunduh 2014
Desember 29]. Tersedia pada: http://www.who.int/topics/diarrhoea/en/. Wiart C. 2006. Medicinal Plants of Asia and Pacific. Boca Raton (US): Taylor
and Francis Group CRC Pr.
Werker E. 2000. Trichome diversity and development. Adv Bot Res. 31: 2-10. Zobel Am. 1985. Localizations of phenolic compounds in tannin secreting cells
21
LAMPIRAN
Lampiran 1 Pengukuran data lingkungan TWA Telaga Warna Bogor
Tumbuhan pH tanah Kelembapan udara
relatif (%)
Intensitas cahaya (Lx)
Suhu udara (ºC)
T. diversifolia 5.8 92 338 22
A. fuliginosa 5.1 92 38 22
T. orientalis 5.2 89.5 270 22
A. inulifolium 6.8 72 102 22
Lampiran 2 Penampang paradermal sayatan adaksial tumbuhan obat
Keterangan: TK (trikoma kapitat); TP (trikoma peltat); TU (trikoma uniseriat). Bar berukuran 50 µm.
T. diversifolia A. fuliginosa
T. orientalis A. inulifolium
TK
TU TP
22
Lampiran 3 Penampang paradermal sayatan abaksial tumbuhan obat
Keterangan: TP (trikoma peltat); SI (sel idioblas); TU (trikoma uniseriat); TBK (trikoma berisi kristal). Bar berukuran 50 µm.
TP SI
TBK TP
23
RIWAYAT HIDUP
Fifi Kurniawan lahir di Jakarta pada 10 Juli 1992. Penulis merupakan anak perempuan pertama dari tiga bersaudara dari pasangan Jenny Mulyawan (almh) dan Edyson. Penulis menempuh pendidikan di SMPK Mater Dei Pamulang pada tahun 2004-2007 dan melanjutkan ke SMAN 74 Jakarta. Lulus SMA pada tahun 2010, penulis melanjutkan studi ke Institut Pertanian Bogor melalui progam USMI. Penulis diterima sebagai mahasiswa Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Penulis melaksanakan kegiatan praktik lapangan di Pusat Studi Satwa Primata (PSSP) LPPM IPB pada Juli-Agustus 2012
dengan topik “Pemeliharaan Kultur Sel Kanker pada Mamalia sebagai Persiapan Uji Senyawa Bioaktif” dibawah bimbingan Dr Ibnul Qayim, MSi dan Silmi Mariya, MSi.