AKTINOMISET FILOSFER PADI SEBAGAI AGENS
PENGENDALI HAYATI PENYAKIT HAWAR DAUN
BAKTERI PADA PADI
NOOR ANDRYAN ILSAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Aktinomiset Filosfer Padi sebagai Agens Pengendali Hayati Penyakit Hawar Daun Bakteri pada Padi” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Noor Andryan Ilsan
G351130021
RINGKASAN
NOOR ANDRYAN ILSAN. Aktinomiset Filosfer Padi sebagai Agens Pengendali Hayati Penyakit Hawar Daun Bakteri pada Padi. Dibimbing oleh ARIS TRI WAHYUDI dan ABDJAD ASIH NAWANGSIH.
Penyakit hawar daun bakteri (HDB) yang disebabkan oleh bakteri
Xanthomonas oryzae pv. oryzae (Xoo) adalah penyakit yang destruktif serta dapat mengurangi produktivitas padi terutama di Asia. Penggunaan pestisida kimia dalam jangka waktu yang lama dapat memberikan efek toksik pada hasil produksi dan konsumennya. Agens pengendali hayati berbasis mikrob memiliki efisiensi yang tinggi serta aman untuk manusia dan organisme bukan sasaran. Agens pengendali hayati berbasis mikrob juga meninggalkan residu yang sedikit bahkan tidak ada sama sekali pada makanan. Sumber mikrob sebagai agens pengendali hayati untuk mengendalikan penyakit tanaman yang disebabkan patogen dapat berasal dari tanah atau filosfer. Mikrob tanah tidak dapat digunakan secara langsung sebagai agens pengendali hayati karena gagalnya mikrob pengkolonisasi akar dalam mengkolonisasi permukaan daun. Aktinomiset merupakan bakteri Gram positif yang telah diketahui memproduksi senyawa bioaktif hingga 70% dari total keseluruhan senyawa bioaktif yang dapat dihasilkan bakteri termasuk senyawa antimikrob. Beberapa strain aktinomiset telah diketahui dapat melindungi tanaman dari penyakit tanaman. Oleh karena itu penelitian ini bertujuan untuk mencari agens pengendali hayati asal filosfer dalam menekan penyakit hawar daun bakteri di dalam rumah kaca.
Sampel daun padi sehat diambil dari wilayah persawahan yang terdapat penyakit HDB di Situgede, Bogor. Sebanyak 22 isolat aktinomiset berhasil diisolasi dari filosfer tanaman padi. Diketahui sebanyak delapan isolat dapat menghambat Xoo menggunakan metode plug agar dan delapan isolat pula yang dapat menghambat Pyricularia oryzae (Po) penyebab penyakit blas padi secara in vitro menggunakan metode dual culture. Supernatan isolat juga diuji aktivitasnya dalam menghambat pertumbuhan baik Xoo dan Po. Kedelapan isolat yang dapat menghambat Xoo tersebut, enam isolat tidak berpotensi sebagai patogen tanaman dan manusia setelah diuji reaksi hipersensitivitas, patogenisitas, serta hemolitik.
Analisis sekuen gen 16S rRNA menunjukkan bahwa isolat STG 1 berkerabat dekat dengan Micromonospora chersina, STG 4 dan STG 8 berkerabat dekat dengan Actinomadura sp., STG 11 berkerabat dekat dengan Streptomyces luteogriseus, STG 15 berkerabat dekat dengan Nonomuraea sp., dan STG 16 berkerabat dengan Streptomyces alboniger. Sebanyak empat isolat secara signifikan dapat mengurangi gejala penyakit HDB pada aplikasi di dalam rumah kaca. Tanaman yang diberi formulasi pelet STG 2 memiliki penghambatan relatif terhadap penyakit HDB sebesar 22.81% pada 14 hari setelah inokulasi Xoo, STG 4 sebesar 23.48%, STG 8 sebesar 21.9%, STG 11 sebesar 24.93% dan STG 15 sebesar 25.87% jika dibandingkan dengan tanaman kontrol yang diinokulasi Xoo
saja. STG 15 merupakan isolat terbaik dalam menekan gejala HDB pada aplikasi di dalam rumah kaca dan berkerabat dekat dengan Nonomuraea sp.
SUMMARY
NOOR ANDRYAN ILSAN. Rice Phyllosphere Actinomycetes as Biological Control of Bacterial Leaf Blight Disease in Rice. Supervised by ARIS TRI safety for humans and other non-target organisms. They leave small amount or no residue in foods. Soil microbes cannot be used directly as biopesticides because common root-colonizers fail to establish on leaves. Actinomycetes are Gram positive bacteria that are known to produce bioactive compound up to 70% of the total compound produced by bacteria, including antimicrobes. Several strains of actinomycetes are known capable of protecting plants against plant disease. The research aimed to search rice phyllosphere actinomycetes which capable of suppress bacterial leaf blight severity in greenhouse application.
Rice plants with healthy leaves were collected from Situgede, Bogor rice field that showed BLB symptoms. A total of 22 isolates were successfully obtained. A total of eight isolates were capable of inhibiting Xoo in vitro using plug agar method and eight isolates were capable of inhibiting Pyricularia oryzae
(Po) causing blast disease using dual culture method. Supernatant isolates were tested against both Xoo and Po. A total of six isolates which capable of inhibiting
Xoo were not pathogenic in plant and human indicated by hypersensitivity, closely related to Streptomyces aboniger. A total of four isolates significantly reduce disease severity of BLB in greenhouse experiment. Pellet formulation of STG 2 showed 22.81% control efficiency of BLB severity at 14 days after inoculation (DAI) using Xoo, 23.48% by STG 4, 21.9% by STG 8, 24.93% by STG 11 and 25.87% by STG 15 compared to control. Isolate STG 15 which has the highest capability to control BLB incidence was identified as Nonomuraea sp. Keywords: actinomycetes, phyllosphere, bacterial leaf blight, Nonomuraea sp.,
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
AKTINOMISET FILOSFER PADI SEBAGAI AGENS
PENGENDALI HAYATI PENYAKIT HAWAR DAUN
BAKTERI PADA PADI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2014 sampai Agustus 2015 dengan judul Aktinomiset Filosfer Padi sebagai Agens Pengendali Hayati Penyakit Hawar Daun Bakteri pada Padi.
Terima kasih penulis ucapkan kepada Bapak Prof Aris Tri Wahyudi, MSi sebagai ketua komisi pembimbing dan Ibu Dr Abdjad Asih Nawangsih, MSi sebagai anggota komisi pembimbing, yang telah memberikan nasehat, saran, motivasi, waktu konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Bapak Dr Aris Tjahjoleksono, DEA dan Ibu Prof Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan motivasi selama studi dan masukan pada saat ujian sidang tesis. Kepada Direktorat Jenderal Pendidikan Tinggi terima kasih atas pemberian beasiswa calon dosen BPP-DN untuk beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB. Terima kasih atas dana penelitian program Kerjasama Kemitraan Penelitian dan Pengembangan Pertanian Nasional (KKP3N) dari Kementerian Pertanian Indonesia yang diberikan kepada Prof Aris Tri Wahyudi sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik. Sebagian hasil penelitian ini telah dipublikasikan di jurnal internasional Asian Journal of Plant Pathology terindeks Scopus (tahap
press ready article) dengan judul “Rice Phyllosphere Actinomycetes as Biocontrol of Bacterial Leaf Blight Disease on Rice”.
Penulis juga mengucapkan terima kasih kepada Ibu Heni dan Bapak Jaka selaku staf Laboratorium Mikrobiologi IPB, kepada Ibu Retnowati selaku staf Laboratorium Terpadu Biologi IPB, Ibu Dr Alina Akhdiya yang telah memberikan isolat Xanthomonas oryzae pv. oryzae dan Dr Abdjad Asih Nawangsih yang telah memberikan isolat Pyricularia oryzae, serta ka Wahyu Eka Sari, Krishanti Ratna, Eka Septia dan seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi, dan bantuannya selama penelitian ini. Ucapan terima kasih tak terhingga juga penulis ucapkan kepada Bapak Waryo, Ibu Nurmi, dan adikku tercinta Noor Agustiani dan Muhammad Noor Zakaria atas doa, dukungan, kasih sayang dan semangat yang diberikan.Terima kasih untuk kebersamaan yang singkat, penuh makna, dan sangat indah teruntuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2013.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
Penyakit Hawar Daun Bakteri (HDB) pada Padi 6
Penyakit Blas pada Padi 7
Gen 16S rRNA 8
Poliketida Sintase Tipe I 8
3 METODE 9
Kerangka Penelitian 9
Waktu dan Tempat 9
Bahan dan Alat 10
Prosedur Penelitian 10
Metode Isolasi Aktinomiset Filosfer Padi 10 Uji Penghambatan Isolat Aktinomiset Filosfer Padi terhadap Xoo 11 Uji Penghambatan Isolat Aktinomiset Filosfer Padi terhadap Po 11 Uji Reaksi Hipersensitivitas Isolat Aktinomiset Filosfer Padi pada
Daun Tembakau 12
Uji Patogenisitas Isolat Aktinomiset Filosfer Padi pada Daun Padi 12
Uji Aktivitas Kitinolitik 12
Uji Aktivitas Hemolitik 12
Identifikasi Molekuler Berdasarkan Analisis Gen 16S rRNA 13
Deteksi Gen PKS Tipe I 13
Persiapan Aplikasi Agens Pengendali terhadap penyakit HDB di
dalam Rumah Kaca 13
Rancangan Percobaan Aplikasi Agens Pengendali di dalam Rumah
Kaca 14
4 HASIL 15
Karakteristik Aktinomiset Filosfer Padi 15
Aktivitas Penghambatan Isolat Aktinomiset Filosfer Padi terhadap
Xoo 15
Aktivitas Penghambatan Isolat Aktinomiset Filosfer Padi terhadap Po 17 Aktivitas Kitinolitik Aktinomiset Filosfer Padi 19 Aktivitas Hemolitik Aktinomiset Filosfer Padi 19 Reaksi Hipersensitivitas dan Uji Patogenisitas 19 Identifikasi Molekuler Isolat Aktinomiset Filosfer Padi 20
Profil Gen PKS Tipe I 21
Aplikasi Aktinomiset Filosfer Padi sebagai Agens Pengendali
terhadap Penyakit HDB di dalam Rumah Kaca 22
6 SIMPULAN DAN SARAN 26
Simpulan 26
Saran 27
DAFTAR PUSTAKA 27
DAFTAR TABEL
1 Aktivitas penghambatan aktinomiset filosfer padi terhadap Xoo
menggunakan metode plug agar pada media LA 15 2 Aktivitas penghambatan supernatan aktinomiset filosfer padi terhadap
Xoo menggunakan metode agar well pada media cair YM dan MNG 17 3 Aktivitas penghambatan aktinomset filosfer padi terhadap Po
menggunakan metode dual culture dan peracunan media 18 4 Hasil BlastN sekuen gen 16S rRNA isolat aktinomiset filosfer padi 20
5 Hasil BlastX seuen gen PKS I iolat STG 15 22
6 Penghambatan relatif gejala HDB pada tanaman yang diberi formulasi isolat aktinomiset dan pengaruhnya terhadap tinggi tanaman serta
jumlah anakan pada 14 hari setelah inokulasi Xoo 23
DAFTAR GAMBAR
1 Area permukaan daun (filosfer) 4
2 Bentuk adaptasi bakteri filosfer 5
3 Penampakan penyakit hawar daun bakteri dan morfologi Xanthomonas
oryzae pv. oryzae 7
4 Struktur poliketida sintase tipe I 9
5 Diagram alir penelitian 10
6 Keragaman morfologi koloni isolat aktinomiset filosfer padi umur ± 10
hari ada media YMA dan keragaman tipe miselia aktinomiset 16 7 Zona penghambatan aktinomiset filosfer padi terhadap Xoo
menggunakan beberapa metode 17
8 Aktivitas penghambatan isolat aktinomiset filosfer padi terhadap
cendawan Po dengan beberapa metode pada masa inkubasi 7 hari 18 9 Respon pertumbuhan hifa Po pada uji antagonis terhadap aktinomiset
filosfer padi menggunakan metode dual culture pada media PDA 18 10 Aktivitas kitinolitik isolat aktinomiset filosfer padi 19 11 Aktivitas hemolitik isolat aktinomiset filosfer padi pada media
agar-agar darah 19
12 Reaksi hipersensitivitas (HR) pada daun tembakau dan gejala nekrosis
pada padi setelah inokulasi isolat aktinomiset 20 13 Pohon filogenetik gen 16S rRNA 6 isolat aktinomiset filosfer padi 21
14 Pohon filogenetik gen PKS I isolat STG 15 21
15 Gejala HDB ditandai dengan nekrotik di ujung daun pada 14 hari
setelah inokulasi Xoo (38 hari setelah tanam) 22
DAFTAR LAMPIRAN
1 Sekuen gen 16s rRNA beserta kromatogram 6 isolat aktinomiset
filosfer padi 32
3 Hasil aplikasi aktinomiset filosfer padi dalam menekan gejala HDB di
dalam rumah kaca 41
4 Bobot kering isolat pada media YM dan MNG 42
5 Ringkasan semua uji yang dilakukan isolat dalam pencarian agens
1
1 PENDAHULUAN
Latar Belakang
Padi merupakan tanaman yang menjadi bahan baku makanan pokok masyarakat Asia terutama Indonesia. Produksi padi nasional Indonesia tahun 2014 mencapai 70.61 juta ton gabah kering giling, mengalami penurunan sebanyak 0.67 juta ton (0.94%) dibandingkan dengan tahun 2013 (BPS 2014). Pada tahun 2014, Indonesia menghasilkan 40 juta ton beras dengan konsumsi beras nasional sekitar 34.4 juta ton. Penurunan produksi diperkirakan terjadi karena penurunan luas panen seluas 66.93 ribu hektar (0.48%) dan penurunan produktivitas sebesar 0.24 kuintal hektar-1 (0.47%). Salah satu penyebab menurunnya produktivitas padi di beberapa wilayah Asia dikarenakan penyakit hawar daun bakteri (HDB) yang disebabkan Xanthomonas oryzae pv. oryzae (Xoo). Beberapa lahan padi mengalami kehilangan produktivitas 10-20% karena hawar daun bakteri pada kondisi sedang (Ou 1985), bahkan diatas 50% pada kondisi optimal (Mew et al.
1993). Intensitas penyakit ini meningkat pada musim hujan karena Xoo memasuki tanaman melalui lubang alami seperti hidatoda, stomata, atau luka (Mew et al.
1984).
Penanggulangan penyakit HDB karena Xoo merupakan masalah serius. Penggunaan pestisida kimia dalam jangka waktu yang lama dapat memberikan efek toksik pada hasil produksi dan konsumen (Kumari et al. 2014). Mikrob sebagai agens pengendali hayati memiliki efisiensi yang tinggi serta aman untuk manusia dan organisme bukan sasaran. Penggunaannya juga meninggalkan residu yang sedikit bahkan tidak ada dalam makanan (Usta 2013). Beberapa mikrob pengendali hayati dilaporkan dapat mengurangi penggunaan senyawa kimia pertanian (Adesemoye et al. 2009). Sumber mikrob pengendali hayati untuk patogen tanaman dapat berasal dari tanah (Zarandi et al. 2009) atau filosfer (Wang dan Ma 2011). Sebagian besar jenis mikrob pengendali hayati yang diisolasi dari tanah tidak dapat digunakan sebagai agens pengendali secara langsung pada daun. Komposisi komunitas bakteri yang berbeda pada daun dan akar dibuktikan dengan gagalnya pengkolonisasi akar seperti Rhizobium dalam mengkolonisasi daun
(O’Brien dan Lindow 1989).
Bagian tanaman diatas tanah secara normal dikolonisasi bermacam bakteri, khamir dan cendawan. Sedikit jenis mikrob yang dapat diisolasi dari jaringan tanaman dan sebagian besar berasal dari permukaan tanaman yang sehat. Bagian aerial yang terkolonisasi mikrob ini disebut filosfer, sedangkan tempat melekatnya mikrob disebut epifit (Andrews dan Harris 2000). Mikrobiologi filosfer lebih fokus pada daun. Komunitas mikrob pada daun mencakup banyak genus yang terdiri atas bakteri, cendawan berfilamen, khamir, alga, dan sedikit protozoa serta nematoda (Andrews dan Harris 2000). Bakteri merupakan mikrob terpenting yang mendiami filosfer (Hirano dan Upper 1989).
2
Sejauh ini belum banyak penelitian yang melaporkan tentang aktinomiset asal filosfer sebagai agens pengendali hayati. Penelitian sebelumnya melaporkan bahwa aktinomiset filosfer mentimun memiliki aktivitas fungistatik serta filtrat dari kulturnya dapat menghambat perkecambahan spora cendawan patogen tanaman Corynespora cassiicola (Wang dan Ma 2011). Hal tersebut mendasari penelitian ini dalam pencarian agens pengendali hayati asal filosfer padi dalam mengendalikan Xoo yang menginfeksi tanaman melalui daun. Oleh karena itu, tujuan penelitian ini adalah mengisolasi dan menyeleksi aktinomiset asal filosfer padi sebagai agens pengendali hayati untuk mengendalikan Xoo serta diharapkan mampu menekan penyakit hawar daun bakteri pada padi didalam rumah kaca.
Tujuan Penelitian
Penelitian ini bertujuan melakukan skrining aktinomiset filosfer padi yang memiliki aktivitas antagonistik terhadap Xoo dan Po secara in vitro. Selanjutnya mengaplikasikan isolat aktinomiset terpilih di dalam rumah kaca untuk menghambat atau menekan gejala penyakit HDB pada padi.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi acuan dalam pencarian agens pengendali hayati terhadap Xoo penyebab HDB pada padi yang bersifat ramah lingkungan sebagai pengganti pestisida kimia. Langkah tersebut bertujuan untuk meningkatkan produktivitas tanaman padi sehingga dapat mendukung ketahanan pangan nasional.
2 TINJAUAN PUSTAKA
Aktinomiset dan Potensinya
Aktinomiset merupakan bakteri Gram positif yang membentuk percabangan filamen dan spora dengan komposisi basa DNA (Guanin+Sitosin) berkisar antara 63-78% di dalam genomnya. Aktinomiset diklasifikasikan sebagai berikut (Stackebrandt et al. 1997):
Domain : Bacteria Filum : Actinobacteria Kelas : Actinobacteria Subkelas : Actinobacteridae Ordo : Actinomycetales
Secara klasifikasi molekuler, aktinomiset terbagi dalam 10 subordo. Sebagian besar aktinomiset (95%) beranggotakan genus Streptomyces
(Lachevalier et al 1977). Secara morfologi, koloni aktinomiset yang tergolong
3 memiliki rantai spora seperti kait, spiral, atau heliks (Miyadoh 1997). Adanya perbedaan pembentukan miselia dan penataan rantai spora tersebut menunjukkan karakter unik yang dimiliki oleh Streptomyces spp. Aktinomiset yang tidak membentuk miselia aerial atau hanya membentuk miselia dalam substrat tergolong ke dalam kelompok non-Streptomyces. Contoh utama aktinomiset sebagai agens pengendali hayati adalah Streptomyces griseoviridis K61. Strain ini berasal dari lumut Sphagnum (Tahvonen 1982) yang dilaporkan memiliki aktivitas antagonistik terhadap bermacam patogen tanaman seperti Alternaria bassicola, Botrytis cinerea, Fusarium avenaceum, F. culmorum, F. oxysporum, Pythium debaryanum, Phomopsis sclerotioides, Rhizoctonia solani dan
Sclerotinia sclerotiorum. S. griseoviridis strain K61 digunakan dengan merendam akar pada tanaman di pot maupun tanaman mentimun di dalam rumah kaca dan bermacam sayuran lain (Doumbou et al. 2002). MycostopTM (dikembangkan oleh Kemira Oy) merupakan biofungisida yang mengandung S. griseoviridis sebagai bahan aktif. Produk ini tersedia di Amerika Serikat dan Eropa. Aktinomiset memiliki kemampuan luas dalam menghasilkan bermacam enzim ekstraseluler. Kapasitas aktinomiset dalam menghasilkan enzim ekstraseluler menjadi faktor penting dalam mengendalikan patogen tanaman. Beberapa korelasi antara antagonisme cendawan dengan bakteri penghasil kitinase dan glukanase telah dilaporkan (Fayad et al. 2001). Mekanisme antibiosis aktinomiset sebagai agens pengendali hayati telah banyak dilaporkan. Gottlieb (1976) juga telah merangkum bukti bahwa antibiotik dihasilkan oleh beberapa aktinomiset asal mikroflora tanah.
Kasugamisin adalah senyawa hasil metabolit yang bersifat bakterisida dan fungisida. Kasugamisin ditemukan oleh Umezawa yang berasal dari Streptomyces kasugaensis (Umezawa et al. 1965). Antibiotik ini berperan sebagai inhibitor biosintesis protein pada mikrob tetapi tidak pada mamalia serta aktivitas toksisitasnya sangat baik. Hokko Chemical Industries mengembangkan produksi bahan aktif kasugamisin untuk mengendalikan blas padi yang disebabkan cendawan Po dan penyakit Pseudomonas pada pertanian. Polioksin B dan D diperoleh dari metabolit Streptomyces cacaoi var. asoensis pada tahun 1965 oleh Isono et al. (1965) sebagai bahan fungisida baru. Mekanisme aksi polioksin membuat polioksin sangat diterima dalam penggunaannya di lingkungan. Polioksin menghambat sintesis dinding sel cendawan dengan secara spesifik menghambat sintesis kitin (Endo dan Misato 1969). Polioksin B digunakan untuk melawan cendawan patogen pada buah dan sayuran. Polioksin D telah dijual oleh beberapa perusahaan untuk mengendalikan penyakit hawar pelepah padi yang disebabkan oleh Rhizoctonia solani.
Streptomyces violasceusniger YCED9 merupakan contoh potensial aktinomiset sebagai agens pengendali hayati. S. violasceusniger tersebut diisolasi pada tahun 1990 dari rizosfer dan berhasil menekan penyakit damping-off pada selada yang disebabkan Phytium ultimum (Crawford et al. 1993). Penelitian selanjutnya menunjukkan bahwa agens pengendali hayati tersebut menghasilkan tiga senyawa antimikrob yaitu nigerisin, geldanamisin dan senyawa fungisida seperti polien AFA (Anti-Fusarium Activity) yaitu guanidilfungin A.
Streptomyces sp. asal tanah telah dilaporkan dapat mengurangi kejadian HDB pada musim kemarau (Hastuti et al. 2012). Metode inokulasi Streptomyces
4
rizosfer cabai telah dilaporkan dapat menekan penyakit hawar pelepah yang disebabkan oleh Rhizoctonia solani pada skala rumah kaca (Boukaew dan Prasertsan 2014). Filtrat dari kultur S. philanthi yang telah diautoklaf efektif menekan penyakit hawar pelepah hingga 65%.
Mikrob Filosfer
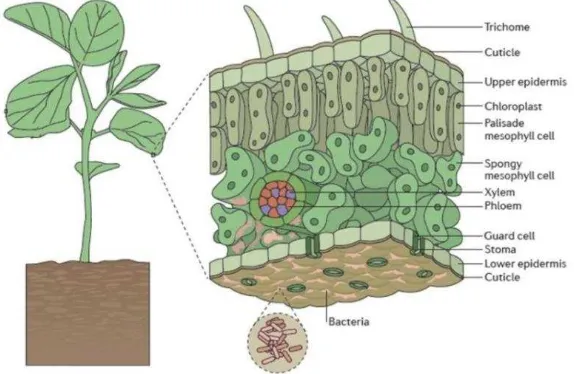
Tumbuhan didiami oleh mikrob baik di bagian bawah maupun atas tanah. Filosfer terdiri atas bagian aerial tumbuhan yang didominasi oleh daun. Bagian atas tumbuhan secara normal dikolonisasi bermacam bakteri (termasuk aktinomiset), khamir, dan cendawan. Sedikit jenis mikrob yang dapat diisolasi dari jaringan tumbuhan tersebut, namun banyak diantaranya berasal dari permukaan tumbuhan sehat. Habitat aerial yang dikolonisasi oleh mikrob ini disebut filosfer dan tempat melekatnya mikrob disebut epifit. Beberapa penelitian mengkaji kolonisasi pada tunas dan bunga, tetapi penelitian mikrob filosfer difokuskan pada daun yang merupakan struktur aerial dominan pada tumbuhan. Bakteri merupakan mikrob terbanyak yang mengkolonisasi daun dengan rata-rata 106-107 sel (cm2)-1 daun atau >108 sel g-1 daun (Andrews dan Harris 2000). Sejauh ini bakteri merupakan mikrob paling penting dalam filosfer (Gambar 1).
Gambar 1 Area permukaan daun (filosfer) (Vorholt 2012)
5 bertahan dari radiasi ultraviolet dan ketersediaan air yang rendah dan fluktuatif. Hal tersebut menyebabkan mikrob menyebar tidak merata di permukaan daun. Mikrob yang mendiami filosfer berhadapan dengan senyawa antimikrob yang dihasilkan tanaman atau mikrob lain. Mikrob filosfer juga dapat masuk menuju apoplas (mikrob tersebut sering disebut endofit) dan memicu plant defence responses. Patogen tanaman dapat melawan reaksi tersebut dengan memanipulasi inang setelah mentransfer efektor (Boller dan Felix 2009). Mikrob filosfer didominasi oleh mikrob komensal, akan tetapi banyak patogen tanaman yang mengkolonisasi daun sebagai fase awal proses infeksi. Fase tersebut memulai masuknya bakteri patogen melalui daun (melalui stomata atau hidatoda) kemudian memulai penyakit (Wilson et al. 1999).
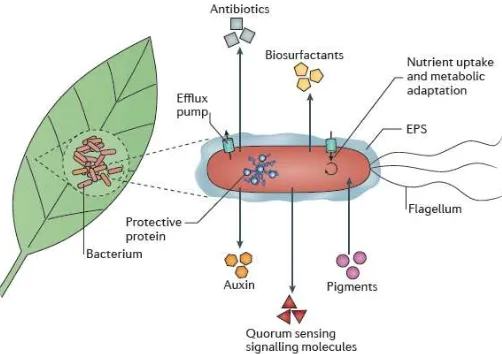
Sumber karbon di atas permukaan daun yang telah diketahui mencakup karbohidrat, asam amino, asam organik dan gula alkohol (Tukey 1970). Sampai saat ini belum diketahui pasti mengenai hubungan antara lilin permukaan daun dengan pertumbuhan mikrob. Bakteri filosfer juga dapat mempengaruhi ketersediaan nutrisi dengan menghasilkan biosurfaktan yang menyebabkan kelembapan dan meningkatkan peluruhan substrat (Schreiber et al. 2005). Bakteri dan cendawan juga dapat menghasilkan hormon tumbuhan mencaup indol-3-acetic acid (IAA, juga dikenal sebagai auksin). Terdapat bukti bahwa IAA meningkatkan ketersediaan nutrisi dengan menstimulasi pelonggaran dinding sel dan keluarnya sakarida dari dinding sel tumbuhan (Lindow dan Brandl 2003).
Kunci penting keberhasilan pertumbuhan mikrob epifit secara langsung adalah interaksi dengan anggota komunitas yang lain. Pada komunitas mikrob, kompetisi untuk ketersediaan ruang dan sumber nutrisi, produksi antibiotik dan interferensi dengan sistem sinyal sel merupakan mekanisme prinsip yang dimiliki bakteri dan cendawan dalam melakukan antagonis satu sama lain (Gambar 2) (Lindow dan Brandl 2003). Meskipun antibiosis merupakan mekanisme yang paling banyak dipelajari dari agens pengendali hayati berbasis mikrob, telah diketahui bahwa antibiosis secara in vitro belum tentu sukses secara in planta
dalam mengendalikan penyakit tanaman yang disebabkan patogen (Ji dan Wilson 2002). Saat ini, faktor yang menentukan interaksi antara mikrob epifit dan perubahan komunitas mikrob masih belum banyak diketahui.
6
Sebagian besar bakteri yang berada di atas permukaan daun bukan merupakan sel soliter atau berkelompok dengan jumlah yang kecil melainkan membentuk agregat yang besar (Morris et al. 1998). Agregat ini umumnya berada di lekukan pada celah antar sel epidermis, sepanjang vena dan dasar trikoma. Pada lekukan ini mereka menempel menggunakan extracellular polymeric substances
(EPS) (Lindow dan Brandl 2003). EPS berperan dalam mempertahankan kelembapan permukaan di sekitar bakteri sehingga dapat mengurangi efek kekeringan pada daun. Filosfer terpapar oksigen dari hasil fotosintesis tanaman dan juga cahaya sepanjang hari. Akibatnya, mikrob pengkolonisasi filosfer cenderung terpapar reactive oxygen species (ROS) yang dapat merusak asam nukleat, protein dan lipid. Mekanisme proteksi terhadap agen tersebut berperan penting dalam keberlangsungan bakteri epifit seperti produksi pigmen dan aktivasi mekanisme perbaikan DNA oleh fotoliase (Gunasekera dan Sundin 2006). Katalase dan superoksida dismutase juga berperan penting dalam detoksifikasi ROS.
Penyakit Hawar Daun Bakteri (HDB) pada Padi
Hawar daun bakteri (HDB) merupakan penyakit pembuluh yang menghasilkan infeksi sistemik padi dan menghasilkan luka kelabu sampai putih sepanjang pembuluh. Gejala dapat terlihat pada fase anakan dan kejadian penyakit meningkat seiring dengan pertumbuhan tanaman dan mencapai puncaknya pada fase berbunga. HDB yang disebabkan oleh bakteri Xanthomonas oryzae pv.
oryzae (Xoo) merupakan salah satu penyakit padi yang serius. HDB telah dilaporkan terdapat di beberapa bagian di Asia, Australia Selatan, Afrika dan Amerika Serikat. Bakteri Xoo merupakan kelompok bakteri Gram negatif, aerob obligat, optimal pada suhu 25-30 °C, tidak membentuk spora, katalase positif, tidak dapat mereduksi nitrat dan sedikit memproduksi asam dari karbohidrat (Nino-liu et al. 2006) serta memproduksi polisakarida ekstraseluler (EPS). EPS penting dalam formasi droplet eksudat bakteri dari daun yang terinfeksi, sehingga dapat melindungi dari kekeringan dan membantu penyebaran melalui angin dan air hujan (Ou 1985). Sel Xoo berbentuk batang pendek dengan ukuran 1-2 x 0.8-1
µm dengan flagel yang monotrik berukuran 6-8 µm x 30 nm. Sel bakteri diselubungi oleh kapsul lendir. Koloni berbentuk sirkuler, cembung, berwarna putih hingga kuning seperti jerami dengan permukaan yang halus (Gambar 3) (Gnanamanickam 2009).
Xoo memasuki daun padi umumnya melalui hidatoda pada ujung dan tepi daun. Sel dari permukaan daun dapat tersuspensi di dalam air gutasi pada malam hari dan memasuki tanaman dengan berenang atau secara pasif menuju daun. Xoo
7
Gambar 3 Penampakan penyakit hawar daun bakteri dan morfologi Xanthomonas oryzae pv oryzae. Penyakit HDB di daerah persawahan Situgede, Bogor (a), koloni Xoo di media padat glucose yeast extract (b) dan
scanning electron micrograph sel Xoo tunggal (bar, 1.0 µm; foto K. Tsuchiya) (c) (Nino-liu et al. 2006)
Terdapat dua fase penyakit HDB yaitu fase hawar daun dan fase kresek. Kresek merupakan akibat yang paling merugikan dari penyakit HDB. Tanaman menjadi berwarna kuning pucat hingga layu selama fase pembenihan hingga fase anakan awal menghasilkan sebagian hingga keseluruhan gagal panen. Telah dilaporkan di Filipina, Indonesia dan India diperkirakan mengalami kehilangan hasil panen hingga 60-75% tergantung cuaca, lokasi dan varietas padi. HDB juga mengurangi hasil panen dengan menurunkan kualitas biji karena terganggunya proses pendewasaan tanaman (Ou 1985). Penyakit HDB dapat terjadi pada semua fase pertumbuhan, lebih umum pada fase anakan hingga fase dewasa (Gnanamanickam 2009). Di Filipina, Indonesia dan India mengalami kerugian karena gejala kresek oleh BLB hingga mencapai 60-75% tergantung cuaca, lokasi dan varietas padi (Ou 1985).
Pencegahan penyakit HDB dapat dimulai dari tahap pembenihan mencakup disinfeksi biji dan membuang benih yang terinfeksi. Sebelum menanam, sawah terlebih dahulu disinfeksi dengan membakar jerami hasil musim tanam sebelumnya. Sebaiknya menghindari pemupukan nitrogen yang berlebihan karena dapat memicu pertumbuhan vegetatif tanaman menjadi lebih cepat. Hal ini dapat mempercepat perkembangan infeksi Xoo (Nino-liu et al. 2006). Agens pengendali hayati merupakan solusi alternatif yang ramah lingkungan dibandingkan dengan pengendali kimia. Bakteri antagonis terhadap Xoo memperoleh perhatian penting sebagai kandidat agens pengendali hayati karena secara umum cepat tumbuh, penanganan yang relatif mudah serta efektif dalam mengkolonisasi rizosfer (Gnanamanickam 2009).
Penyakit Blas pada Padi
Penyakit blas padi yang disebabkan oleh cendawan Po menimbulkan gejala lesi yang terbentuk di daun, batang, malai, biji bahkan akar. Po (teleomorph: Magnaporthe oryzae) merupakan fase aseksual dari Magnaporthe oryzae. Po
8
berupa askospora. Spora aseksual berupa konidia diproduksi di dalam lesi dan di atas kultur pada tangkai terspesialisasi yang dikenal dengan konidiospora. Konidia terdiri atas tiga sel dan diproduksi di ujung konidiofor. Di lingkungan yang sesuai, cendawan sporulasi di tengah lesi pada kultivar yang sensitif. Sporulasi juga dapat terjadi di biji yang terinfeksi. Spora diproduksi di daun yang terinfeksi, malai dan biji (Gnanamanickam 2009).
Siklus penyakit blas padi dapat dimulai baik dari infeksi akar maupun dari konidium pada tanah tempat tumbuhnya padi pada genotip yang sensitif untuk memulai perkembangan lesi daun. Siklus infeksi terus berlanjut pada kondisi optimal yaitu permukaan daun yang basah dan suhu dingin pada malam hari (12-32 °C). Telah diketahui bahwa lesi blas tunggal dapat menghasilkan 20.000 konidia untuk mempertahankan siklus infeksi blas tetap berjalan. Blas leher merupakan fase serius yang menyebabkan patahnya leher padi dan biji yang tidak berisi.
Gen 16S rRNA
Terdapat bermacam gen yang digunakan untuk mempelajari filogenetik suatu mikrob. Gen yang paling banyak digunakan dalam menentukan kekerabatan mikrob prokariotik adalah gen pengkode 16S rRNA. 16S ribosomal RNA (16S rRNA) merupakan komponen ribosom prokariotik subunit 30S. Gen yang mengkode RNA ribosom ini merupakan gen yang terdapat pada semua prokariotik. Ribosom prokariotik tersusun atas subunit besar (50S) dan subunit kecil (30S). Subunit ini dibangun oleh protein-protein dan molekul RNA yang disebut RNA ribosom (rRNA). Terdapat tiga jenis rRNA pada prokariotik yaitu 16S, 23S, dan 5S. Gen pengkode 16S rRNA telah digunakan secara ekstensif untuk analisis tingkat evolusi berbasis sekuens karena terdistribusi secara universal, berfungsi secara konstan dan cukup konservatif (tidak mudah untuk berubah) (Madigan et al.
2009). Penempelan messanger RNA (mRNA) pada ribosom prokariot terjadi pada 16S rRNA di bagian subunit 30S, karena pada mRNA prokariot terdapat urutan basa tertentu yang disebut sebagai tempat pengikatan ribosom (ribosom binding site) atau urutan Shine-Dalgarno (5’-AGGAGGU-3’). Urutan tersebut spesifik dikenali oleh 16S rRNA, dengan demikian dapat dikatakan bahwa sekuen 16S rRNA berfungsi sebagai sekuen anti-Shine Dalgarno. Gen 16S rRNA berukuran panjang antara 1500 hingga 1550 pb dan kaya akan basa nitrogen guanin dan sitosin (G+C) (Moat et al. 2002). Identifikasi gen 16S rRNA dari suatu mikrob dimulai dengan tahap isolasi DNA genom, amplifikasi menggunakan teknik
polymerase chain reaction (PCR), dan dilanjutkan ke tahap sekuensing untuk diperoleh urutan basa nukleotida yang kemudian dianalisis lebih lanjut untuk konstruksi pohon filogenetik.
Poliketida Sintase Tipe I
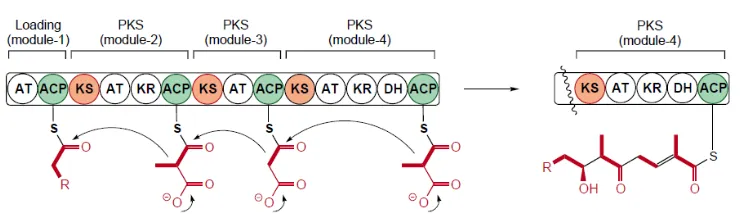
9 rapamisin dan lovastatin. Telah diketahui terdapat tiga tipe PKS yang dihasilkan bakteri yaitu PKS tipe I, PKS II dan PKS III. PKS I merupakan enzim multifungsi yang terorganisir dalam modul. Setiap modul memiliki aktivitas yang tidak berulang dan bertanggung jawab dalam mengkatalisis satu siklus pembentukan rantai poliketida (Shen 2003) (Gambar 4). Setiap modul PKS I mengkode minimal tiga domain yaitu ketosintase (KS), asiltransferase (AT) dan acyl carrier protein
(ACP). Terdapat juga enzim tambahan seperti enoilreduktase, dehidratase dan
ketoreduktase yang melibatkan aktivitas pembentukan kelompok β-keto. Semua domain tersebut berperan dalam program sintesis rantai poliketida baru (Donadio dan Katz 1992). Beberapa dekade terakhir, skrining produk alami mendapat perhatian khusus dari peneliti dengan tujuan untuk mencari metabolit aktif yang memiliki peran biologis, terutama berasal dari aktinomiset. Deteksi sekuen gen yang melibatkan sintesis metabolit sekunder telah diketahui, termasuk gen pengkode PKS I (Ayuso-Sacido et al. 2004).
Gambar 4 Struktur poliketida sintase tipe I (Shen 2003)
3 METODE
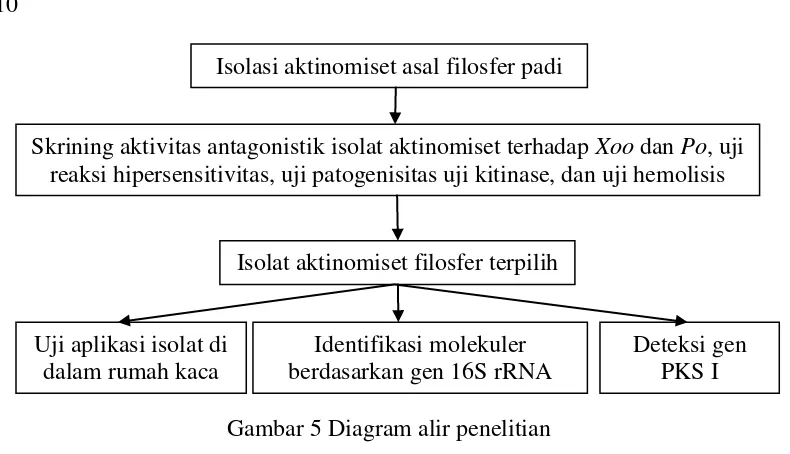
Kerangka Penelitian
Kerangka penelitian meliputi isolasi aktinomiset filosfer padi kemudian dilanjutkan dengan uji penghambatan isolat tersebut terhadap Xoo dan Po secara
in vitro. Isolat terpilih diuji reaksi hipersensitivitas tembakau dan uji patogenisitas terhadap padi. Selanjutnya isolat diuji aktivitas kitinolitik dan hemolitiknya. Isolat terpilih diidentifikasi berdasarkan gen 16S rRNA. Tahap terakhir adalah uji aplikasi agens pengendali dalam menekan penyakit HDB di dalam rumah kaca (Gambar 5).
Waktu dan Tempat
10
Gambar 5 Diagram alir penelitian
Bahan dan Alat
Bahan yang digunakan adalah media Humic Acid Vitamin Agar (HV), Yeast Malt Extract (YM), Luria Bertani (LB), Luria Bertani Agar (LA), Modified Nutrient Glucose (MNG), Potato Dextrose Agar (PDA), dan kit isolasi genom bakteri dari Geneaid. Alat yang digunakan adalah Laminar Air Flow (LAF), sentrifugator, vortex, Thermal cycler, mesin elektroforesis, inkubator bergoyang serta alat-alat yang umum digunakan dalam percobaan mikrobiologi. Isolat patogen yang digunakan adalah Xoo strain 8004 dan Po.
Prosedur Penelitian
Metode Isolasi Aktinomiset Filosfer Padi
Pengambilan sampel dilakukan pada tanggal 25 Juli 2014 di lahan padi Situgede, Bogor. Metode isolasi aktinomiset filosfer menggunakan metode pencucian (Jacques dan Morris 1995). Tanaman padi sehat masing-masing berumur 1 bulan (fase vegetatif), 2 bulan (fase generatif) dan 3 bulan (fase generatif) diambil dari lahan pertanian yang terdapat gejala padi terserang HDB dan blas menggunakan plastik steril. Sebanyak 10 g daun padi dipotong menjadi bagian kecil kemudian dimasukkan ke dalam botol berisi 90 mL garam fisiologis steril, selanjutnya dihomogenkan selama 1 jam. Kemudian aktinomiset diisolasi dengan teknik cawan sebar pada pengenceran 10-1-10-4 menggunakan media
Humic Acid Vitamin Agar (CaCO3 0.02 g l-1, FeSO4 0.01 g l-1 , MgSO4 0.05 g l-1, Na2HPO4 0.5 g l-1, KCL 1.7 g l-1 , Agar 20 g l-1). Sebanyak 40 mL stok Humic
Acid (1 g Humic acid dimasukkan dalam 40 mL NaOH 0.4%) ditambahkan pada 1 L media. Sebanyak 5 mL Vitamin B (0.25 g Vit. B dicampurkan ke dalam 200 mL akuades steril) dimasukkan ke dalam 1 L media. Daun diberi perlakuan panas di dalam oven pada suhu 70 °C selama 15 menit. Sebanyak 50 ppm asam nalidiksat dan 50 ppm sikloheksimida ditambahkan pada media isolasi. Tumbuhnya isolat diamati pada 2-3 minggu masa inkubasi. Isolat yang diperoleh kemudian dimurnikan pada media padat Yeast Malt Extract (YM).
Skrining aktivitas antagonistik isolat aktinomiset terhadap Xoo dan Po, uji reaksi hipersensitivitas, uji patogenisitas uji kitinase, dan uji hemolisis
11 Uji Penghambatan Isolat Aktinomiset Filosfer Padi terhadap Xoo
Uji penghambatan isolat aktinomiset terhadap patogen tanaman padi penyebab penyakit HDB (Xoo) menggunakan metode plug agar. Strain patogen yang digunakan adalah Xoo 8004 yang diperoleh dari Balai Besar Litbang Bioteknologi dan Sumber Daya Genetik Pertanian (BBIOGEN), Bogor, Jawa Barat, atas kebaikan Dr. Alina Akhdiya. Inokulum Xoo uji yang digunakan memiliki kepadatan 107 CFU mL-1 dengan OD 0.6 pada panjang gelombang 530 nm menggunakan spektrofotometer UV-vis. Kultur bibit Xoo ditumbuhkan pada media LB dengan waktu inkubasi selama 24 jam pada suhu 37 °C diatas inkubator bergoyang dengan kecepatan 150 rpm. Kemudian 1 mL kultur bibit dicampurkan pada 100 mL media LA, selanjutnya dituang pada cawan Petri. Plug agar yang berisi kultur aktinomiset pada media padat YM dengan masa inkubasi 7 hari dipindahkan dengan pelubang berdiameter 6 mm sesaat setelah media bibit tersebut memadat. Kemudian media antagonis diinkubasi selama 24 dan 48 jam untuk melihat adanya zona penghambatan. Aktivitas antagonistik supernatan isolat terhadap Xoo diuji menggunakan metode agar well. Isolat aktinomiset dikulturkan pada media cair YM dan MNG sebanyak 50 mL dengan inkubasi selama 7 hari pada inkubator bergoyang dengan kecepatan 150 rpm. Kultur isolat selanjutnya disentrifugasi dengan kecepatan 8880 x g selama 20 menit. Sebanyak 90 µL supernatan dimasukkan kedalam sumuran pada media LA berisi Xoo.
Sumur dibuat dengan melubangi media menggunakan pelubang steril berdiameter 6 mm. Zona bening diamati setelah inkubasi selama 24 dan 48 jam.
Uji Penghambatan Isolat Aktinomiset Filosfer Padi terhadap Po
Uji penghambatan isolat aktinomiset terhadap Po menggunakan metode
dual culture (El-Tarabily et al. 2000). Isolat Po diperoleh dari Departemen Proteksi Tanaman, Fakultas Pertanian IPB, atas kebaikan Dr. Abdjad Asih Nawangsih. Isolat aktinomiset digores pada media PDA dengan jarak 3 cm dari koloni cendawan Po. Koloni Po diambil menggunakan pelubang steril berdiameter 6 mm. Pengamatan interaksi diamati setelah 7 hari masa inkubasi pada suhu 37 °C. Persentase penghambatan dihitung menggunakan rumus berikut:
Penghambatan B B x
12
Persentase penghambatan pertumbuhan hifa - r x
R adalah jari-jari koloni Po pada PDA tanpa adanya supernatan (kontrol) dan r adalah jari-jari koloni Po pada PDA dengan adanya supernatan isolat. Pengamatan dilakukan setelah 7 hari inkubasi (Boukaew dan Prasertsan 2014). Penghambatan pertumbuhan hifa Po diamati menggunakan mikroskop cahaya dengan perbesaran 400x.
Uji Reaksi Hipersensitivitas Isolat Aktinomiset Filosfer Padi pada Daun Tembakau
Isolat aktinomiset ditumbuhkan pada media YM cair dengan masa inkubasi 7 hari pada suhu 37 °C diatas inkubator bergoyang dengan kecepatan 150 rpm. Sumber inokulum berasal dari koloni gores pada media padat YM masa inkubasi 7 hari yang dipindahkan menggunakan pelubang steril berdiameter 6 mm. Kepadatan sel kultur cair tersebut dihitung menggunakan metode hitung cawan. Kultur yang diinjeksikan pada tembakau merupakan kultur dengan kepadatan minimal 106 CFU mL-1. Kultur diinjeksikan pada bagian bawah daun (bagian daun diantara dua vena mayor) menggunakan syringe steril (Zou et al. 2006). Kontrol positif yaitu kultur Xoo sedangkan kontrol negatif yaitu E. coli DH5α.
Tanaman tembakau diinkubasi selama 2 hari pada sungkup plastik. Pengamatan dengan melihat adanya nekrosis pada jaringan bagian daun yang terinjeksi. Gejala nekrosis yang muncul pada jaringan daun menandakan isolat aktinomiset yang diinjeksikan memiliki potensi sebagai patogen tanaman.
Uji Patogenisitas Isolat Aktinomiset Filosfer Padi pada Daun Padi
Kultur cair isolat aktinomiset pada media cair YM dengan kepadatan koloni minimal 106 CFU mL-1 dipersiapkan untuk uji reaksi hipersensitivitas pada tanaman padi IR64. Padi yang digunakan berumur 2 bulan. Daun padi dipotong menggunakan gunting yang telah direndam kultur cair isolat. Kemudian daun yang telah dipotong tersebut direndam kultur cair isolat selama 10 detik (Krishanti
et al. 2015). Tanaman padi diinkubasi selama 14 hari di dalam rumah kaca. Pengamatan dengan melihat ada atau tidaknya nekrosis pada jaringan bagian ujung daun sampai bagian bawah mendekati tanah. Gejala nekrosis yang muncul pada jaringan daun menandakan isolat aktinomiset tersebut memiliki potensi sebagai patogen tanaman padi.
Uji Aktivitas Kitinolitik
Isolat aktinomiset digoreskan pada media kitin padat (3 g koloidal kitin, 1 g K2HPO4, 0.2 g MgSO4.7H2O, 1 g yeast extract, 20 g agar dan 1 L akuades). Inkubasi dilakukan selama 6 hari pada suhu 37 °C. Pengamatan dilakukan dengan melihat adanya zona bening di sekitar koloni yang mengindikasikan kelarutan kitin oleh isolat (Tahtamouni et al. 2006).
Uji Aktivitas Hemolitik
13 zona bening menandakan adanya aktivitas hemolitik oleh isolat (Garcia-Bernal et al. 2015).
Identifikasi Molekuler Berdasarkan Analisis Gen 16S rRNA
DNA genom bakteri diekstraksi menggunakan kit ekstraksi Genomic DNA Mini Kit (Blood/Cultured Cell). Sekuen gen 16S rRNA diamplifikasi menggunakan primer universal gen 16S rRNA untuk domain bakteri 63f (5’-CAG GCC TAA CAC ATG CAA GTC-3’) dan 387r(5’-GGG CGG WGT GTA CAA GGC-3’) (Marchesi et al. 1998) dengan panjang target amplikon ~1300 pb. Komposisi reaksi campuran PCR untuk volume total 50 µL terdiri atas Go Taq Green 25 µL, primer reverse dan forward masing masing 4 µL, DNA 8 µL dan
nuclease free water 9 µL. Kondisi PCR diawali dengan inisial denaturasi selama 4 menit pada suhu 94 °C diikuti dengan proses 30 siklus denaturasi selama 30 detik pada suhu 94 °C, annealing selama 30 detik pada suhu 55 °C, elongation selama 1 menit pada suhu 72 °C dan final elongation selama 7 menit pada suhu 72 °C.
DNA genom maupun produk PCR dielektroforesis untuk mengetahui ukuran dan kualitas produk yang dihasilkan. Elektroforesis dilakukan dengan menggunakan gel agarosa 1% dan migrasi pada 80 V selama 45 menit. Selanjutnya gel direndam di dalam Ethidium Bromide (EtBr) selama 15 menit kemudian divisualisasi di atas UV transilluminator. Selanjutnya produk PCR disekuensing melalui jasa sekuensing First Base. Hasil sekuensing disejajarkan dengan data GenBank menggunakan program Basic Local Alignment Search Tool-Nucleotida (BlastN) dari situs National Center for Biotechnology Information
(NCBI). Analisis filogenetik dilakukan menggunakan program MEGA 6.0 dengan metode Neighbour Joining (NJ) dengan bootstrap 1000X.
Deteksi Gen PKS tipe I
Amplifikasi gen penyandi enzim poliketida sintase tipe I (PKS I) dari isolat aktinomiset dilakukan menggunakan primer oligonukleotida degenerasi dengan sekuen domain K1 adalah: 5’-TSAAGTCSAACATCGGBCA-3’, M6R: 5’ -CGCAGGTTSCSGTACCAGTA-3’ (Ayuso-Sacido dan Genilloud 2005). Reaksi PCR dilakukan sebanyak 35 siklus yang terdiri atas beberapa tahap yaitu pre-denaturasi selama 5 menit dan pre-denaturasi selama 1 menit pada suhu 94 °C,
annealing pada 50 °C selama 1 menit, elongation pada 72 °C selama 1 menit dan
final elongation pada 72 °C selama 10 menit. Hasil amplikon menunjukkan pita berukuran 1300 pb. Produk amplifikasi dianalisis dengan elektroforesis pada 1% (w/v) gel agarosa yang diwarnai dengan EtBr.
Persiapan Aplikasi Agens Pengendali terhadap penyakit HDB di dalam Rumah Kaca
14
Sebanyak enam isolat yang digunakan untuk aplikasi (STG 1, STG 2, STG 4, STG 8, STG 11, STG 15) terlebih dahulu dimutasi spontan menggunakan rifampisin hingga konsentrasi 75 µg mL-1 (Wahyudi et al. 2011). Sebanyak dua formulasi yang digunakan pada aplikasi di dalam rumah kaca yaitu pelet dan supernatan. Formulasi pelet dipersiapkan dengan menumbuhkan isolat pada 100 mL media cair YM/MNG selama 7 hari pada suhu 37 °C dengan inkubator bergoyang pada kecepatan 150 rpm. Kultur disentrifugasi pada kecepatan 3820 x g selama 20 menit untuk memisahkan supernatan dari pelet. Pelet dan supernatan dicampurkan dengan perbandingan 1:1, kemudian sebanyak 40 mL pada campuran tersebut ditambahkan 1% arabik gum (Hastuti et al. 2012). Formulasi kedua yaitu menggunakan supernatan. Supernatan dipersiapkan dengan menumbuhkan isolat pada 100 mL media cair YM/MNG menggunakan inkubator bergoyang pada suhu 37 °C. Setelah 7 hari inkubasi, kultur cair disentrifugasi pada 3820 x g selama 20 menit kemudian supernatan dipisahkan dengan pelet (Boukaew dan Prasertsan 2014).
Inokulum Xoo dipersiapkan dengan menginokulasi Xoo ke dalam 100 mL media LB kemudian diinkubasi pada inkubator bergoyang dengan kecepatan 150 rpm selama 2 hari pada suhu 37 °C. Inokulum yang digunakan untuk penyemprotan adalah kultur dengan kepadatan 107-108 CFU mL-1. Infeksi patogen
Xoo dilakukan dengan cara disemprot kemudian ujung daun padi digunting dengan gunting yang dicelup kultur cair Xoo (Kauffman et al. 1973) pada saat tanaman berumur 24 hari setelah dipindahkan ke pot.
Rancangan Percobaan Aplikasi Agens Pengendali di Dalam Rumah Kaca Sebanyak enam isolat aktinomiset terpilih (STG 1, STG 2, STG 4, STG 8, STG 11, STG 15) yang diuji sebagai agens pengendali hayati penyakit HDB di dalam rumah kaca. Kontrol positif yaitu tanaman padi yang diinokulasi oleh patogen Xoo saja. Kontrol negatif yaitu tanaman padi yang digunting tanpa inokulasi Xoo. Setiap perlakuan dilakukan sebanyak tiga kali ulangan (3 pot). Inokulasi pelet isolat (formulasi pelet diinokulasi dengan mengoles daun menggunakan kuas steril) dan penyemprotan supernatan dilakukan setiap sekali dalam 7 hari dan dimulai selama 7 hari setelah tanam (HST) sampai 21 HST. Inokulasi Xoo dilakukan dengan menggunting ujung daun menggunakan gunting yang dicelup Xoo hanya pada 24 HST. Pembacaan dan evaluasi persentase serangan penyakit dilakukan 14 hari setelah inokulasi Xoo. Parameter yang diamati adalah panjang gejala tiap daun (persen keparahan penyakit), tinggi tanaman dan jumlah anakan. Setelah dilakukan pengamatan, selanjutnya dilakukan isolasi ulang bakteri pada daun padi menggunakan media HV+50 µg mL-1 rifampisin untuk mengetahui keberadaan isolat aktinomiset. Perhitungan persentase keparahan penyakit HDB (Gnanamanickam et al. 1999) dan persentase penghambatan relatif (Li et al. 2015) diperoleh melalui persamaan :
eparahan penyakit ejala nekrotik otal panjang daun x Panjang gejala
15 Rancangan percobaan menggunakan Rancangan Acak Lengkap (RAL) satu faktor dengan tiga ulangan setiap perlakuan. Data dianalisis dengan General Linear Model menggunakan SPSS 21. Rata-rata antar perlakuan dibedakan menggunakan uji Duncan pada taraf P=(0.05).
4 HASIL
Karakteristik Aktinomiset Filosfer Padi
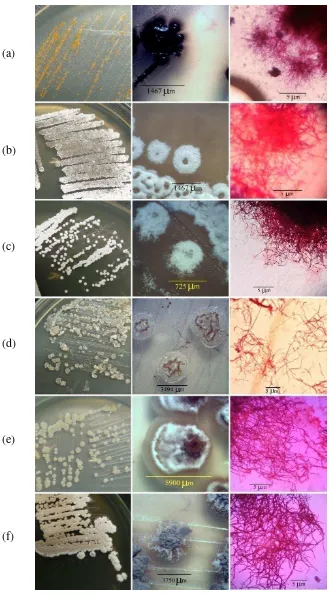
Hasil isolasi aktinomiset filosfer padi menggunakan media HV diperoleh total sebanyak 22 isolat yang terdiri atas 17 isolat berasal dari padi fase anakan produktif, empat isolat berasal dari padi fase pembungaan dan satu isolat berasal dari padi pada fase berbulir. Sebanyak enam isolat aktinomiset terpilih kemudian diamati karakteristik morfologi koloni di atas media padat dari mulai warna putih, abu-abu sampai kuning, serta bentuk miselia secara mikroskopis (Gambar 6).
Aktivitas Penghambatan Isolat Aktinomiset Filosfer Padi terhadap Xoo
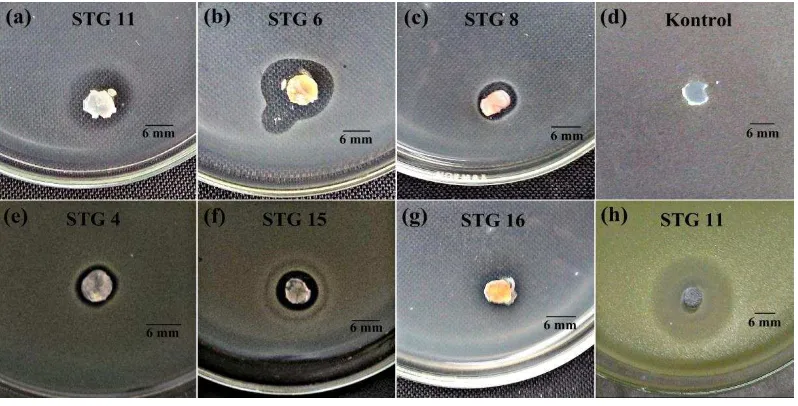
Sebanyak delapan isolat dari total 22 isolat aktinomiset yang diperoleh diketahui dapat menghambat Xoo menggunakan metode plug agar pada media padat LA. Aktivitas penghambatan aktinomiset filosfer padi terhadap Xoo
menggunakan metode plug agar ditunjukkan dengan terbentuknya zona hambat yang bervariasi berkisar antara 8-28.5 mm (Gambar 7; Tabel 1).
Semua isolat yang dapat menghambat Xoo berasal dari padi fase anakan produktif. Hasil uji penghambatan supernatan aktinomiset (skrining sekunder) menunjukkan tiga supernatan aktinomiset dapat menghambat Xoo menggunakan metode agar well, dengan zona hambat berkisar antara 7.5-21 mm (Tabel 2). Berdasarkan data tersebut, beberapa isolat memiliki aktivitas anti-Xoo yang beragam tergantung pada media tumbuh isolat.
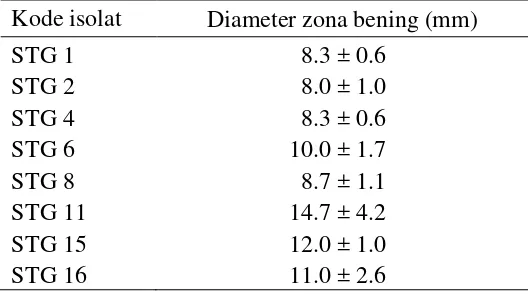
Tabel 1 Aktivitas penghambatan aktinomiset filosfer padi terhadap Xoo
menggunakan metode plug agar pada media LA Kode isolat Diameter zona bening (mm)
STG 1 8.3 ± 0.6
STG 2 8.0 ± 1.0
STG 4 8.3 ± 0.6
STG 6 10.0 ± 1.7
STG 8 8.7 ± 1.1
STG 11 14.7 ± 4.2
STG 15 12.0 ± 1.0
16
(a)
(b)
(c)
(d)
(e)
(f)
17
Gambar 7 Zona penghambatan aktinomiset filosfer padi terhadap Xoo
menggunakan beberapa metode. (a-g) metode plug agar, (h) metode
agar well, dan (d) kontrol
Tabel 2 Aktivitas penghambatan supernatan aktinomiset filosfer padi terhadap
Xoo menggunakan metode agar well pada media cair YM dan MNG Kode isolat Media
tumbuh Diameter zona bening (mm) STG 11
YM cair 21.0 ± 1.4
STG 16 7.5 ± 2.1
STG 11
MNG cair 21.0 ± 1.4
STG 15 7.5 ± 2.1
Aktivitas Penghambatan Isolat Aktinomiset Filosfer Padi terhadap Po
Sebanyak delapan isolat aktinomiset dapat menghambat Po dengan persen penghambatan berkisar antara 17.5-72.5%. Skrining sekunder menggunakan supernatan menunjukkan enam isolat dapat menghambat Po. Sebanyak 1 mL supernatan STG 6 pada media MNG cair yang dicampurkan dengan 10 mL PDA menunjukkan penghambatan miselia tertinggi yaitu sebesar 42.5% (Gambar 8; Tabel 3). Isolat STG 11, STG 6 dan STG 8 dapat menghambat Xoo dan Po secara
18
Gambar 8 Aktivitas penghambatan isolat aktinomiset filosfer padi terhadap cendawan Po dengan beberapa metode pada masa inkubasi 7 hari. (a) kontrol Po, (b) metode dual culture, (c) metode peracunan media
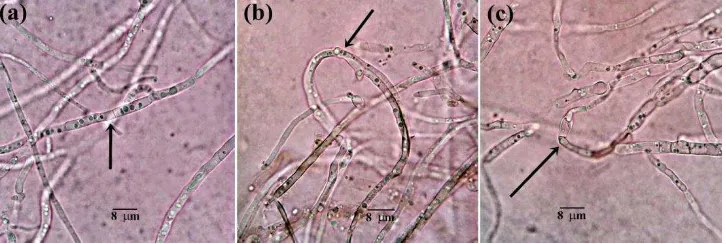
Gambar 9 Respon pertumbuhan hifa Po pada uji antagonis terhadap aktinomiset filosfer padi menggunakan metode dual culture pada media PDA, diamati dibawah mikroskop cahaya dengan perbesaran 400x. (a) pertumbuhan Po tanpa aktinomiset filosfer padi; terganggunya arah pertumbuhan hifa Po oleh adanya isolat (b) STG 6, dan (c) STG 11 Tabel 3 Aktivitas penghambatan aktinomiset filosfer padi terhadap Po
menggunakan metode dual culture dan peracunan media
Kode isolat
Dual culture Peracunan media
Penghambatan (%)
19 Aktivitas Kitinolitik Aktinomiset Filosfer Padi
Sebanyak lima isolat memiliki aktivitas kitinolitik (Gambar 10). Aktivitas kitinolitik terlihat dengan adanya zona bening pada media koloidal kitin.
Gambar 10 Aktivitas kitinolitik isolat aktinomiset filosfer padi. (a) STG 10, (b) STG 13, (c) STG 15, (d) STG 16, dan(e) STG 17
Aktivitas Hemolitik Aktinomiset Filosfer Padi
Sebanyak satu isolat aktinomiset filosfer padi memiliki aktivitas hemolitik positif dari 12 isolat terpilih yang dapat menghambat Xoo dan Po, sehingga dapat dikatakan bahwa 11 isolat aktinomiset tidak bersifat patogen pada hewan dan manusia. Reaksi hemolitik positif terlihat dengan adanya zona bening pada media agar-agar darah (Gambar 11).
Gambar 11 Aktivitas hemolitik isolat aktinomiset filosfer padi pada media agar-agar darah. Reaksi hemolitik negatif oleh isolat (a) STG 15, (b) STG 16, (c) STG 6, (d) STG 10; (e) reaksi hemolitik positif oleh isolat STG 17
Reaksi Hipersensitivitas dan Patogenisitas
20
Gambar 12 Reaksi hipersensitivitas (HR) pada daun tembakau dan gejala nekrosis pada padi setelah inokulasi isolat aktinomiset. (a) kontrol negatif uji HR: E. coli DH5α, (b) kontrol positif uji HR: Xoo, (c) reaksi negatif uji HR: STG 6, (d) reaksi positif uji HR: STG 6, (e) kontrol positif uji patogenisitas: Xoo, (f) kontrol negatif uji patogenisitas: E. coli DH5α, (g) reaksi positif uji patogenisitas: STG 6, dan (h) reaksi negatif uji patogenisitas: STG 11
Identifikasi Molekuler Isolat Aktinomiset Filosfer Padi
Hasil amplifikasi gen 16S rRNA dari enam isolat terpilih menunjukkan panjang fragmen DNA yang diharapkan yaitu sepanjang ~1300 pb. Sekuen parsial gen 16S rRNA enam isolat (Lampiran 1) dibandingkan dengan sekuen gen 16S rRNA pada database GenBank (Tabel 4). Analisis pohon filogenetik menunjukkan 6 isolat tersebut dikelompokkan ke dalam kelompok Streptomyces
dan non-Streptomyces (rare actinomycetes). Isolat STG 4, STG 8, STG 15, dan STG 1 terletak pada kluster 1 yaitu kelompok non-Streptomyces, sedangkan STG 11 dan STG 16 terletak pada kluster 2 yaitu kelompok Streptomyces. Kedua kluster terpisah dari X. oryzae sebagai outgroup (Gambar 13).
Tabel 4 Hasil BlastN sekuen gen 16S rRNA isolat aktinomiset filosfer padi Kode
luteogriseus strain 3-7 100% 0.0 97% KJ571036.1
21
Gambar 13 Pohon filogenetik gen 16S rRNA enam isolat aktinomiset filosfer padi berdasarkan metode neighbour joining dengan bootstrap 1000x
Profil Gen PKS tipe I
Hasil amplifikasi gen PKS I dari enam isolat aktinomiset filosfer padi terpilih menunjukkan panjang fragmen DNA yang diharapkan yaitu ~1300 pb, tetapi hanya satu isolat yang memiliki hasil kromatogram sekuen yang baik yaitu STG 15 (Lampiran 2). Hal ini menyebabkan hanya sekuen STG 15 yang berhasil dianalisis menggunakan BlastX (Tabel 5) dan kemudian direkonstruksi pohon filogenetiknya. Berdasarkan hasil BlastX dan konstruksi pohon filogenetik, dapat dilihat bahwa isolat STG 15 memiliki kemiripan gen PKS tipe I dengan polyketide synthase Kitasatospora azatica (Gambar 14).
Tabel 5 Hasil BlastX sekuen gen PKS I isolat STG 15
Isolat Sekuen pembanding (Database Genbank)
Query cover
E value
Identitas
maksimum No. Akses STG 15
Poliketide synthase [Kitasatospora
azatica]
92% 7E-79 59% WP
22
Gambar 14 Pohon filogenetik gen PKS I isolat aktinomiset STG 15 berdasarkan metode neighbour joining dengan bootstrap 1000x
Aplikasi Aktinomiset Filosfer Padi sebagai Agens Pengendali terhadap Penyakit HDB di Dalam Rumah Kaca
Keberhasilan aplikasi agens pengendali hayati ditandai dengan rendahnya gejala penyakit HDB pada tanaman padi yang diberi perlakuan formulasi jika dibandingkan dengan tanaman kontrol yang hanya diinokulasi patogen Xoo.
Pengamatan dilakukan pada 14 hari setelah inokulasi Xoo atau 38 hari setelah tanam berupa reaksi gejala nekrotik, tinggi tanaman, dan jumlah anakan. Hasil uji aplikasi isolat aktinomiset menunjukkan bahwa perlakuan pelet isolat STG 2, STG 4, STG 8, STG 11, STG 15 serta supernatan STG 11 dan STG 8 secara signifikan mampu menekan keparahan penyakit HDB dibandingkan dengan kontrol patogen Xoo. Penghambatan relatif tertinggi yaitu sebesar 25.87% (gejala nekrotik sebesar 62.23%) terjadi pada tanaman yang diberi pelet STG 15 jika dibandingkan dengan tanaman kontrol yang diinokulasi patogen Xoo saja (gejala nekrotik sebesar 88%) (Gambar 15; Tabel 6; Lampiran 3).
23 Tabel 6 Penghambatan relatif gejala HDB pada tanaman padi yang diberi formulasi isolat aktinomiset dan pengaruhnya terhadap tinggi tanaman serta jumlah anakan pada 14 hari setelah inokulasi Xoo (38 hari setelah
Penghambatan relatif dibandingkan dengan kontrol yang diinokulasi Xoo.
Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan perbedaan yang tidak signifikan berdasarkan uji MDRT pada taraf 5% (P<0.05 untuk gejala nekrotik dan P>0.05 untuk tinggi tanaman dan jumlah anakan)
5 PEMBAHASAN
24
menekan kontaminan seperti bakteri dan cendawan (Hayakawa dan Nonomura 1987; Khanna et al. 2011). Perlakuan pemanasan kering sampel tanah menyebabkan koloni bakteri tertekan sedangkan aktinomiset yang tumbuh lambat akan terpacu untuk tumbuh (Hayakawa 2008).
Sebanyak 22 isolat berhasil diisolasi dari sampel padi saat musim kemarau. Berdasarkan karakteristik morfologinya, sebagian besar isolat merupakan kelompok non-Streptomyces. Karakterisasi jenis non-Streptomyces spp. secara umum meliputi warna miselia substrat, produksi pigmen terlarut serta bentuknya (Ghadin et al. 2008). Jumlah terbanyak isolat aktinomiset yang diperoleh berasal dari daun padi pada fase vegetatif sebanyak 17 isolat, empat isolat dari fase pembungaan dan satu isolat dari fase berbulir. Beberapa penelitian melaporkan bahwa terdapat variasi jumlah bakteri filosfer pada masing-masing umur padi (Ercolani 1991; Krishanti et al. 2015). Khususnya filosfer, telah diketahui beberapa faktor lingkungan seperti radiasi, polusi, pemupukan nitrogen, dan faktor biotik seperti umur daun dan keberadaan mikrob lain dapat mempengaruhi struktur komunitas bakteri. Hasil analisis MLTreeMap dari empat sampel filosfer yaitu Glycine max (kedelai), Trifolium repens, Arabidopsis thaliana, dan Oryza sativa (padi) menunjukkan bahwa Proteobacteria merupakan filum terbanyak yang mendiami filosfer dari empat sampel tersebut dengan anggota kelas
Alphaproteobacteria sebanyak ~70%. Menariknya, sebanyak ~40% komposisi bakteri filosfer padi didiami oleh kelas aktinobakteria (termasuk aktinomiset). Jumlah tersebut merupakan jumlah tertinggi dibandingkan dengan jumlah aktinobakteria yang mendiami sampel filosfer lainnya (Vorholt 2012).
Uji reaksi hipersensitivitas (HR) dan patogenisitas dilakukan untuk menentukan potensi isolat sebagai patogen tanaman khususnya pada padi. Reaksi hipersensitivitas (HR) adalah kematian sel terprogram pada lokasi masuknya patogen. Kloroplas berperan penting dalam reaksi HR dan pertahanan pada tanaman. HR dimulai dari sumber terpenting dalam sinyal pertahanan seperti
reactive oxygen species (ROS), reactive nitrogen oxide intermediates (NOI), hormon pertahanan asam salisilat dan asam jasmonat. Reaksi HR tersebut dapat menghambat pertumbuhan patogen tanaman. HR juga merupakan mekanisme tanaman dalam mencegah pertumbuhan patogen pada incompatible plant-pathogen interactions sehingga menyebabkan resistensi penyakit (Coll et al.
2011). Reaksi positif akan tampak jika terjadi nekrosis pada daun. Sebanyak 10 isolat menunjukkan reaksi negatif baik reaksi HR maupun uji patogenisitas. Sebanyak enam isolat aktinomiset diantaranya berpotensi menghambat pertumbuhan Xoo sehingga direkomendasikan sebagai agens pengendali hayati dalam menekan penyakit HDB di dalam rumah kaca.
Uji antagonistik isolat aktinomiset filosfer padi terhadap Xoo dilakukan untuk mengetahui kemampuannya dalam menghasilkan senyawa antibakteri terhadap Xoo. Uji antagonistik tersebut menggunakan metode plug agar untuk skrining primer dan metode agar well untuk skrining sekunder. Berdasarkan data yang diperoleh, beberapa isolat memiliki aktivitas antimikrob yang bervariasi tergantung pada medium tumbuh. Uji antagonistik isolat menggunakan metode
25 diamati dengan mengukur bobot kering pelet (Lampiran 4). Sedangkan pada uji agens pengendali di dalam rumah kaca, perlakuan tanaman yang diberi pelet STG 15 dan STG 11 menunjukkan penghambatan relatif terhadap gejala HDB tertinggi masing-masing sebesar 25.87% dan 24.93% jika dibandingkan dengan tanaman kontrol yang diinokulasi patogen Xoo saja. Data ini menunjukkan adanya kesinambungan antara uji in vitro (Hastuti et al. 2012) dan kecepatan tumbuh terhadap respon uji aplikasi di dalam rumah kaca dalam menekan keparahan penyakit HDB (Tabel 6). Uji lapangan yang dilakukan oleh Hastuti et al. (2012) menggunakan aktinomiset endofit padi dalam menekan penyakit HDB hingga 70 hari setelah tanam menunjukkan penurunan gejala HDB jika dibandingkan dengan tanaman padi kontrol, tetapi perbedaannya tidak signifikan. Berdasarkan analisis statistika, perlakuan tidak berpengaruh nyata terhadap respon tinggi tanaman dan jumlah anakan (P>0.05). Perlakuan juga tidak menghambat pertumbuhan tanaman terlihat dari respon tinggi tanaman dan jumlah anakan. Isolasi ulang telah dilakukan untuk mengetahui keberadaan agens pengendali hayati secara kualitatif pada daun yang telah diinokulasi.
Uji antagonistik isolat terhadap Po penyebab penyakit blas padi dilakukan sebagai uji tambahan. Beberapa isolat memiliki aktivitas antagonistik baik terhadap Po maupun Xoo (Lampiran 5). Beberapa isolat yang mampu menghambat Po secara in vitro juga memiliki aktivitas kitinolitik. Pengamatan pertumbuhan hifa yang terhambat oleh adanya isolat menunjukkan adanya gangguan arah pertumbuhan hifa. Gangguan tersebut menyebabkan hifa tumbuh melengkung jika dibandingkan dengan kontrol hifa tanpa isolat. Pseudomonas chlororaphis sebagai rizobakteria yang memiliki aktivitas antagonistik terhadap cendawan Rosellinia necatrix penyebab penyakit busuk putih akar alpukat mampu menghasilkan metabolit antifungal 2-hexyl, 5-propyl resorcinol (HPR). Interaksi
in vitro P. chlororaphis terhadap R. necatrix salah satunya menunjukkan adanya gangguan arah pertumbuhan hifa sehingga pertumbuhan hifa melengkung (Calderon et al. 2014).
Penggunaan mikrob sebagai agens pengendali hayati penyakit tanaman umumnya dilakukan oleh manusia sehingga perlu menjamin bahwa isolat tersebut aman terhadap manusia. Uji hemolitik dilakukan untuk memastikan isolat tidak menghasilkan hemolisin yang dapat melisiskan sel darah merah manusia. Isolat yang memiliki hemolisin berpotensi sebagai patogen manusia dan hewan. Adanya zona bening pada media agar-agar darah mengindikasikan isolatmenghasilkan hemolisin (Hidayati et al. 2014). Produksi hemolisin oleh isolat menjadi salah satu dasar untuk menentukan isolat yang akan diuji aplikasi di dalam rumah kaca.
Terdapat bermacam gen yang digunakan untuk mengidentifikasi suatu mikrob menggunakan pendekatan molekuler. Gen yang paling banyak digunakan dalam identifikasi maupun menentukan kekerabatan mikrob prokariotik adalah gen pengkode 16S rRNA (Madigan et al. 2009). Berdasarkan identifikasi molekuler gen 16S rRNA, sebanyak enam isolat terpilih tersebut tergolong atas genus Streptomyces, Nonomuraea, Actinomadura dan Micromonospora. Streptomyces telah dikenal luas sebagai penghasil antibiotik. Telah diketahui bahwa Streptomyces griseoviridis asal lumut Spaghnum telah dikomersialkan sebagai biopestisida dengan nama dagang MycostopTM (Minuto et al. 2005). Genus Nonomuraea, Actinomadura dan Micromonospora merupakan golongan
26
2012). Pelet isolat STG 15 yang teridentifikasi genus Nonomuraea merupakan isolat terbaik dalam menekan keparahan penyakit HDB pada aplikasi di dalam rumah kaca. Sekuen gen Polyketide synthase I (PKS I) isolat STG 15 menunjukkan kemiripan dengan poliketida sintase dari Kitasatospora azatica. Primer PKS I dan kondisi amplifikasi merujuk pada Ayuso-sacido dan Genilloud (2005). Poliketida merupakan kelompok produk alami dengan bermacam bentuk struktural yang memiliki fungsi aktivitas biologi yang luas (Hopwood 1997). Senyawa tersebut telah digunakan pada bidang kesehatan dan pertanian sebagai antimikrob, imunosupresan, antiparasit dan agens antikanker. Antibiosis merupakan salah satu mekanisme penting dalam penekanan penyakit tanaman oleh agens pengendali hayati berbasis mikrob. Proses tersebut melibatkan interaksi antara senyawa antimikrob yang dihasilkan agens pengendali hayati yang memberikan efek langsung terhadap mikrob lain termasuk mikrob patogen (Weller et al. 1988).
Organisme yang berpotensi dan berhasil secara in vitro belum tentu berhasil juga dalam uji skala besar seperti rumah kaca dan lapangan. Uji in vitro tidak mempertimbangkan faktor lingkungan. Sekarang ini banyak peneliti sependapat bahwa agens pengendali hayati dengan target daun, harus diaplikasikan menggunakan teknik penyemprotan. Namun keberhasilannya sangat terbatas karena ketidaktepatan peralatan, efikasi yang rendah karena formulasi atau kombinasi keduanya (Navon ). Permukaan daun juga dianggap “lingkungan
yang tidak bersahabat” untuk koloni bakteri. Permukaan daun terpapar temperatur
dan kelembapan yang dapat berubah secara cepat. Daun juga memiliki sumber nutrisi yang terbatas untuk bakteri (Lindow dan Brandl 2003). Mayoritas besar koloni bakteri filosfer dapat dengan mudah terbunuh oleh agens yang tidak terpenetrasi seperti peroksida dan UV (Wilson et al. 1999). Beberapa faktor tersebut menjadi dasar pentingnya ketepatan formulasi dalam menjaga keberlangsungan agens pengendali hayati terutama menggunakan teknik penyemprotan pada daun.
6 SIMPULAN DAN SARAN
Simpulan
Aktinomiset filosfer padi yang diperoleh berjumlah 22 isolat, delapan isolat diantaranya memiliki aktivitas anti-Xoo secara in vitro. Berdasarkan karakteristik morfologinya, sebagian besar isolat merupakan kelompok non-Streptomyces. Hasil uji hipersensitivitas dan patogenisitas diketahui bahwa enam isolat diantaranya bersifat tidak patogen terhadap padi dan lima isolat diantaranya secara signifikan mampu menekan penyakit HDB. Hasil uji aplikasi isolat di dalam rumah kaca terhadap gejala nekrotik menunjukkan bahwa pelet isolat STG 2, STG 4, STG 8, STG 11, STG 15 serta supernatan 11 dan STG 8 secara signifikan mampu menekan keparahan penyakit HDB dibandingkan dengan kontrol patogen