ORGANIK PADA LIMBAH CAIR TAHU
INNA PUSPA AYU
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Biodiversitas dan Peran Mikrofungi Isolat Telaga Warna dalam Mendekomposisi Bahan Organik pada Limbah Cair Tahu adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini
Bogor, Mei 2008
Inna Puspa Ayu
Inna Puspa Ayu. Biodiversity of Microfungi Isolated from Telaga Warna and There Role in Organic Decomposition of Tofu Liquid Waste. Under the direction of Hefni Effendi and Yusli Wardiatno
Biodiversity of Microfungi Isolated from Telaga Warna and Its Role in Decomposing Organic Matter of Tofu Liquid Waste
The biodiversity of microfungi isolated from Telaga Warna and its role in decomposing organic matter of tofu liquid waste. Microfungi are decomposer microorganism of organic matter and could be used as biological agent in waste process. Aquatic fungi exploration in Indonesia is still in low number. As a conservation area, Telaga Warna has fungi biodiversity such as Abisidia spinosa
(AS), Cephalosphorium acremonium (CA), Acremonium strictum (ACST),
Penicillium rugulosum (PR), Penicillium viridicatum (PV) and, K (Control). Those microfungi have been experimented in order to reduce organic matter content in Tofu Liquid waste. This content was measured for six days through COD (Chemical Oxygen Demand) and organic nitrogen also its effect to microfungi’s growth. The experiment result shows the treatments that could reduce organic matter faster and biggest also followed with increasing of coverage percentage are PV and PV on second day. Each of treatments could reduce COD 73,96% and 63,54% with percentage of coverage 53,33% and 46,67%. Meanwhile, organic matter in ACST and CA treatments reduce on fourth day 77,08% and 72,92% but the percentage of coverage was followed by the life of new organisms. All fungi in AS treatment were died in first day even COD reduced in the fifth day because of the living of other microorganism. Control treatment also faced the reducing of COD in the forth day which followed by existence of other microorganism.
Warna dalam mendekomposisi bahan organik pada limbah cair tahu. Dibimbing oleh HEFNI EFFENDI dan YUSLI WARDIATNO.
Tujuan dari penelitian ini adalah untuk mengkaji jenis-jenis mikrofungi dari Telaga Warna serta menjelaskan kemampuannya dalam memanfaatkan bahan organik yang berasal dari limbah cair tahu. Penelitian ini dilakukan dalam dua rangkaian, yaitu penelitian pendahuluan dan utama. Penelitian pendahuluan meliputi pengambilan sampel mikrofungi dari perairan Telaga Warna pada musim hujan dan kemarau, pengisolasian, kultivasi, dan identifikasi mikrofungi, kemudian penentuan konsentrasi limbah tahu yang akan digunakan untuk media mikrofungi pada penelitian utama. Penelitian utama merupakan rangkaian kegiatan yang terdiri dari pengujian jenis-jenis mikrofungi pada konsentrasi limbah hasil penelitian pendahuluan. Pada penelitian utama dilakukan pengukuran kandungan bahan organik dalam air limbah melalui hasil pengukuran COD serta N organik. Selain itu, dilakukan juga pengukuran DO, pH, kekeruhan, TDS, suhu, serta persentase penutupan mikrofungi.
Analisis data yang digunakan adalah analisis ragam menggunakan Rancangan Acak Lengkap dan uji lanjutan (uji Tukey) untuk melihat pengaruh perbandingan konsentrasi limbah terhadap pertumbuhan mikrofungi, keragaman konsentrasi bahan organik antarwaktu pada masing-masing jenis mikrofungi uji. Selain itu digunakan pula Rancangan Acak Lengkap (RAL) dalam waktu untuk melihat jenis mikrofungi yang memberikan pengaruh terhadap penurunan konsentrasi bahan organik.
Isolat mikrofungi yang didapatkan dari Perairan Telaga Warna pada musim kemarau adalah jenis Mucor hiemalis, Mucor plumbeus, Mucor substilissimus, Abisidia spinosa, Aspergillus niger, Aspergillus conicus, Penicillium viridicatum, Penicillium rugulosum, Trichoderma koningii, Acremonium strictum, Cephalosporium acremonium. Sedangkan yang ditemukan pada musim hujan adalah Mucor rouxianus, Mucor ramannianus, Mucor genevensis, Mucor jansseni, Mucor pussilus, Rhizopus cohnii, Rhizopus stolonifer, Rhizopus oryzae, Penicillium rugulosum, Cephalosporium acremonium, Penicillium citrinum, Penicillium urticae, Penicillium spinulosum, Aspergillus amstelodami, Monilia humicola.
Mikroorganisme uji yang digunakan dalam peneltian ini adalah
Penicillium rugulosum (PR), Penicillium viridicatum (PV), Acremonium strictum
(ACST), Cephalosphorium acremonium (CA), dan Abisidia spinosa (AS).
@HakCipta milik Institut Pertanian Bogor, tahun 2008 Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruhnya karya tulis ini tanpa mencatumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan.
penelitian, penulisan karya ilmiah. penyusunan laporan, penul isan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
ORGANIK PADA LIMBAH CAIR TAHU
INNA PUSPA AYU
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Perairan
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Nama : Inna Puspa Ayu
NIM : C151050051
Disetujui Komisi Pembimbing
Dr. Ir. Hefni Effendi, M.Phil. Dr. Ir. Yusli Wardiatno, M.Sc. Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pasca Sarjana IPB Ilmu Perairan Dekan
Prof. Dr. Ir. Enang Harris, MS. Prof. Dr. Ir. Khairil A. Notodiputro, MS.
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga Tesis yang berjudul “Biodiversitas dan peran mikrofungi isolat Telaga Warna dalam mendekomposisi bahan organik pada limbah cair tahu” dapat diselesaikan. Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar Master of Sains pada Fakultas Pascasarjana, Institut Pertanian Bogor. Pada kesempatan ini penulis mengucapkan terima kasih kepada: 1. Dr. Ir. Hefni Effendi, M.Phil. sebagai dosen pembimbing I atas bimbingan
dan arahan selama penelitian serta telah memberikan kesempatan penulis untuk turut serta dalam penelitian mikrofungi.
2. Dr. Ir. Yusli Wardiatno, M.Sc. selaku dosen pembimbing II yang senantiasa memotivasi, mengarahkan, dan memberi saran bagi penulis.
3. Dr. Ir. Niken TM Pratiwi, M.Si. selaku penguji tamu untuk saran dan masukan dalam perbaikan tesis ini serta bantuannya selama penelitian.
4. Osaka Gas Foundation melalui PPLH IPB yang telah mendanai penelitian ini. 5. Kedua orang tua, adikku serta keluarga besar yang telah mendoakan dan
memberi dorongan untuk mencapai ridho-Nya.
6. Anton Aliabbas dan keluarga lampung atas doa, semangat dan bantuannya. 7. Ibu Maya, bu Nur, Pak Sodikin, Aan, Devit, Ari, Tina, Yeyen, Apri, Ningsih,
Rommy serta seluruh anggota Lab. ProLingkungan Perairan atas segala kebaikan dan kerjasamanya.
8. Ibu Utami, Toni, Senin untuk masukkannya dalam penyususnan tesis. 9. Iis, Usman, Rabbani, Indah, Endang serta teman-teman Pasca Air. 10. Bapak Satari, anti, serta seluruh kerabat di Malabar, Bogor.
11. Seluruh kerabat dan teman yang telah membantu dalam penelitian, serta semua pihak yang tidak dapat disebutkan satu per satu.
Semoga tesis ini bermanfaat bagi semua pihak yang memerlukan. Akhir kata, penulis mohon maaf atas segala kekurangan yang terdapat dalam tesis ini.
Bogor, Mei 2008
DAFTAR TABEL ... iii
2.1.4. Metabolisme (absorbsi nutrien) mikrofungi ... 12
2.2. Karakteristik tahu dan limbah cair tahu ... 13
2.4. Proses pengolahan limbah secara biologi ... 20
III. METODE PENELITIAN ... 23
3.1. Waktu dan tempat ... 23
3.2. Penelitian pendahuluan... 23
3.5. Analisis statistik ... 26
3.5.1. Penelitian pendahuluan ... 26
3.5.2. Penelitian utama ... 27
IV. HASIL DAN PEMBAHASAN ... 30
4.1. Hasil ... 30
4.1.1. Penelitian pendahuluan ... 30
4.1.1.1. Biodiversitas mikrofungi akuatik dari Telaga Warna ... 30
4.1.1.2. Penentuan konsentrasi limbah ... 31
4.1.2. Penelitian Utama ... 33
4.1.2.1. Analisis COD (Chemical Oxygen Demand) ... 33
4.1.2.2. Analisis persentase penutupan ... 37
4.1.2.3. Analisis N organik ... 43
4.1.2.4. Analisis N anorganik ... 48
4.1.2.5. Analisis TDS dan TSS ... 50
4.1.2.6. Analisis pH ... 52
4.1.2.7. Analisis oksigen terlarut (Dissolved oxygen) ... 53
4.1.2.8. Analisis suhu ... 53
4.2. Pembahasan ... 55
4.2.1. Hubungan antara keberadaan bahan organik dengan persen penutupan ... 55
4.2.2. Pertumbuhan mikrofungi ... 59
V. KESIMPULAN DAN SARAN ... 62
5.1. Kesimpulan ... ... 62
5.2. Saran ... 62
DAFTAR PUSTAKA ... 63
DAFTAR TABEL
Halaman
1. Karakteristik air limbah tahu ... ...16
2. Baku mutu limbah cair industri dan kegiatan usaha lainnya ... 16
3. Tabel sidik ragam RAL ... 27
4. Tabel sidik ragam RAL dalam waktu ... 29
5. Pengelompokkan jenis-jenis mikrofungi akuatik yang terdapat di Danau Telaga Warna ... 31
DAFTAR GAMBAR
Halaman
1. Skema perumusan masalah ... 4
2. Morfologi mikrofungi...8
3. Kurva pertumbuhan mikrofungi ... 9
4. Bagan proses pembuatan tahu ... 14
5. Skema mikroscreen pada recycle reaktor ... 21
6. Rata-rata konsentrasi COD pada limbah cair tahu dengan mikrofungi Abisidia spinosa ... 33
7. Rata-rata konsentrasi COD pada limbah cair tahu dengan mikrofungi Cephalosphorium acremonium ... 34
8. Rata-rata konsentrasi COD pada media dengan mikrofungi Acremonium strictum ... 35
9. Rata-rata konsentrasi COD pada media dengan mikrofungi Penicilium rugulosum ... 35
10. Rata-rata konsentrasi COD pada limbah cair tahu dengan mikrofungi Penicilium viridicatum ... 36
11. Rata-rata konsentrasi COD pada limbah cair tahu tanpa mikrofungi ... 36
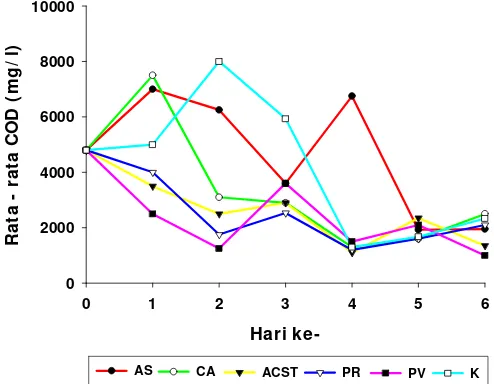
12. Rata-rata konsentrasi COD (mg/l) pada limbah cair tahu Pada tiap perlakuan fungi ... 38
13. Keberadaan mikroorganisme kontaminan pada media ... 39
14. Persentase penutupan mikroorganisme pada limbah cair tahu ... 40
15. Kurva pertumbuhan mikrofungi pada limbah cair tahu ... 42
16. Rata-rata konsentrasi N organik pada limbah cair tahu dengan mikrofungi Abisidia spinosa ... 44
17. Rata-rata konsentrasi N organik pada limbah cair tahu dengan mikrofungi Cephalosphorium acremonium... 44
18. Rata-rata konsentrasi N organik pada limbah cair tahu dengan mikrofungi Acremonium strictum ... 45
19. Rata-rata konsentrasi N organik pada limbah cair tahu dengan mikrofungi Penicilium rugulosum ... 45
20. Rata-rata konsentrasi N organik pada limbah cair tahu dengan mikrofungi Penicilium viridicatum ... 46
22. Rata-rata konsentrasi N organik (mg/l) pada limbah cair tahu
pada tiap perlakuan fungi ... 47 23. Nilai rata-rata ammonia (mg/l) pada limbah cair tahu
pada tiap perlakuan fungi ... 49 24. Nilai rata-rata nitrat (mg/l) pada limbah cair tahu
pada tiap perlakuan fungi ... 49 25. Nilai rata-rata nitrit (mg/l) pada limbah cair tahu
pada tiap perlakuan fungi ... 50 26. Nilai rata-rata TDS (mg/l) pada limbah cair tahu
pada tiap perlakuan fungi ... 51 27. Nilai rata-rata TSS (mg/l) pada limbah cair tahu
pada tiap perlakuan fungi ... 52 28. Nilai rata-rata pH pada limbah cair tahu
pada tiap perlakuan fungi ... 53 29. Nilai rata-rata oksigen terlarut (mg/l) pada limbah cair tahu
pada tiap perlakuan fungi ... 54 30. Konsentrasi COD limbah dan persentase penutupan
tiap jenis mikrofungi ... 57 31. Konsentrasi N organik limbah dan persentase penutupan
tiap jenis mikrofungi ... 58
DAFTAR LAMPIRAN
Halaman
1. Potatoes Dextrose Agar ... 67
2. Treatment limbah dengan menggunakan UV ... 68
3. Prosedur pengukuran COD ... 69
4. Karakteristik spesial mikrofungi di perairan Telaga Warna ... 70
5. Persentase pertumbuhan mikrofungihari ke empatpada konsentrasi uji ... 72
6. Hasil analisis statistik konsentrasi uji terhadap pertumbuhan mikrofungi ... 73
7. Hasil pengukuran nilai COD serta persentase penurunannya pada limbah cair tahu ... 74
8. Hasil analisis statistik pengaruh waktu terhadap konsentrasi COD ... 75
9. Hasil analisis statistik pengaruh jenis mikrofungi, waktu serta interaksinya terhadap penurunan COD pada limbah cair tahu ... 78
10. Nilai rata-rata persentase penutupan pada berbagai perlakuan (%) ... 81
11. Nilai rata-rata N organik serta persentase penurunnanya pada limbah cair tahu ... 82
12. Hasil analisis statistik pengaruh waktu terhadap konsentrasi N organik ... 83
13. Hasil analisis statistik pengaruh jenis mikrofungi, waktu serta interaksinya terhadap penurunan N organik ... 86
14. Nilai rata-rata N anorganik pada limbah cair tahu ... 89
15. Rata-rata konsentrasi serta persentase penurunan TDS dan TSS ... 90
1.1. Latar Belakang
Mikrofungi merupakan mikroorganisme tidak berklorofil dan memiliki
sifat saprofit yang berperan penting dalam lingkungan perairan, yaitu sebagai
dekomposer atau pengurai bahan organik yang berasal dari mahluk hidup yang
telah mati (Wong et al. 1998). Mikroorganisme ini menggunakan hifa untuk
melekat pada bahan organik tersebut yang kemudian akan didekomposisi menjadi
bahan anorganik. Bahan organik yang diuraikan oleh mikroorganisme
dekomposer ini merupakan nutrien yang akan digunakan untuk produksi biomassa
mikrofungi itu sendiri. Kemampuan dalam memanfaatkan dan menguraikan
mahluk hidup yang telah mati tersebut menyebabkan mikrofungi berfungsi dalam
regenerasi material yang terurai serta berperan dalam siklus karbon, nitrogen, dan
fosfat di lingkungan perairan danau, sungai, ataupun perairan tawar lainnya
(Davidson et al. 1996; Sigee, 2004).
Mikrofungi perairan tawar memiliki jenis yang beragam. Lebih dari 600
spesies sudah diidentifikasi pada daerah temperate (Wong et al. 1998), sedangkan di daerah tropis, penelitian dan eksplorasi fungi masih relatif minim. Penelitian
untuk mengungkapkan biodiversitas fungi, khususnya penemuan fungi jenis baru
di Indonesia masih dimungkinkan (Ilyas et al. 2006). Salah satu contoh perairan tawar di Indonesia yang belum diketahui keanekaragaman hayati fungi
akuatiknya adalah Telaga Warna. Danau ini terletak di Kecamatan Cisarua
Kabupaten Bogor (6o42’LS;106o,59’BT) dengan ketinggian sekitar 1400 m dpl (Wardiatno et al. 2003). Perairan alami ini berbentuk elips mendekati bundar dengan luas permukaan sebesar 1,04 ha dan kedalaman maksimum 7,8 m (Pratiwi
et al. 2006). Telaga Warna merupakan bagian dari kawasan konservasi cagar alam dan taman wisata alam, sehingga dimungkinkan memiliki potensi
mikrofungi yang dapat dikembangkan.
Setiap fungi di alam memiliki peran dan potensi yang berbeda karena
setiap jenisnya memiliki keunikan sifat dan karakteristik tersendiri. Beberapa
jenis fungi diketahui memiliki nilai ekonomi yang tinggi karena diperlukan dalam
obat-obatan (Zhigiang, 2005 in Paulus, 2006), agen bioleaching (Kisielowskadan Kasińska-Pilut, 2005), penyubur lahan, biopestisida, penghasil enzim, dan bahan organik aktif lainnya (Harman et al. 2004 in Gil, 2006), serta obyek menarik dalam penelitian genetika (Ilyas et al. 2006).
Dewasa ini mikrofungi banyak dikembangkan dalam pengolahan limbah
secara biologis. Hal ini sejalan dengan meningkatnya limbah yang berasal dari
kegiatan manusia, sehingga diperlukan metode yang tepat dalam penanganan
limbah. Limbah banyak mengandung bahan organik seperti protein, karbohidrat,
lemak, dan bila dibuang langsung ke perairan umum dapat menimbulkan
pencemaran. Limbah tersebut di antaranya berasal dari industri rumah tangga,
misalnya industri pembuatan tahu (Saubani, 2006). Limbah yang dihasilkan
industri tahu berupa limbah padat dan cair. Limbah padat dapat ditanggulangi
dengan memanfaatkannya sebagai bahan pembuat oncom dan bahan makanan
ternak (Dhahiyat, 1990), sedangkan limbah cair (whey) kebanyakan dibuang
langsung ke sungai atau badan air lainnya (Warisno, 1994; Rubiyanto, 2000).
Limbah cair tahu mengandung bahan organik yang kompleks serta karbon dan N
yang tinggi. Hal ini akan menurunkan tingkat kualitas air dan akhirnya
berdampak buruk pada ekosistem air yang menerimanya bila limbah cair yang
diterima di perairan melebihi kemampuan daya pulih lingkungan perairan
tersebut.
Bahan organik yang kompleks tersebut dapat diuraikan oleh fungi menjadi
zat-zat kimia yang lebih sederhana yang selanjutnya dapat meningkatkan
kesuburan perairan, serta sebagian bahan-bahan organik tersebut digunakan untuk
kolonisasi mikrofungi itu sendiri. Pemanfaatan mikrofungi dalam pengolahan
limbah dikenal dengan istilah bioremediasi (Gadd, 1993 in Ahmad, 2005). Proses bioremediasi didasari oleh dekomposisi bahan organik di biosfer yang dilakukan
oleh bakteri dan fungi heterotrofik, yang memiliki kemampuan memanfaatkan
senyawa organik alami sebagai sumber karbon dan energi. Penggunaan
mikrofungi dalam pengolahan limbah menjadi salah satu alternatif yang menarik
untuk dikembangkan karena penanganannya efisien dan efektif (Zhang et al.
1.2. Perumusan masalah
Mikrofungi merupakan organisme yang dapat mendekomposisi bahan
organik dari air limbah, dan memanfaatkan senyawa organik di dalamnya sebagai
nutrien untuk proses metabolisme. Proses tersebut akan menyebabkan organisme
mengalami pertumbuhan. Pertumbuhan mikrofungi ada yang cepat atau lambat
tergantung pada jenis mikrofungi itu sendiri.
Pertumbuhan merupakan respon dari kemampuan mikrofungi dalam
memanfaatkan bahan organik. Bahan organik yang dikaji dalam penelitian ini
adalah bahan organik yang berasal dari limbah cair tahu. Limbah cair tahu
mengandung bahan organik, terutama nitrogen, dengan kadar yang cukup tinggi,
yang bila dibuang langsung ke perairan akan mempengaruhi kualitas air di
perairan tersebut.
Peran mikrofungi dalam dekomposisi atau pun bioremediasi dapat
dimanfaatkan untuk mengatasi pencemaran bahan organik. Untuk itu diperlukan
pengujian atau pengukuran terhadap kemampuan mikrofungi dalam menurunkan
kandungan bahan organik yang terdapat dalam limbah cair tahu. Hasil dari
pengujian tersebut dapat bersifat positif, yakni mikrofungi dapat menurunkan
konsentrasi bahan organik dalam air limbah, atau sebaliknya. Bila tidak dapat
menurunkan konsentrasi bahan organik, maka diperlukan pengkajian atau evaluasi
kembali terhadap kondisi bahan organik pada air limbah tersebut atau isolat
mikrofungi yang digunakan (Gambar 1).
1.3. Tujuan
Tujuan dari penelitian ini adalah untuk mengkaji jenis-jenis mikrofungi
dari Telaga Warna serta menjelaskan kemampuan mikrofungi isolat Telaga Warna
dalam memanfaatkan bahan organik yang berasal dari limbah cair tahu.
1.4. Manfaat
Manfaat penelitian ini adalah untuk mendapatkan jenis isolat mikrofungi dari
Telaga Warna yang efektif dalam mengolah limbah bahan organik, serta
1.5. Hipotesis
Mikrofungi dengan jenis yang berbeda akan melakukan dekomposisi bahan
organik dengan kemampuan yang berbeda-beda. Hal tersebut terkait dengan
waktu yang diperlukan oleh mikrofungi itu sendiri dalam mendekomposisi bahan
organik.
2.1. Mikrofungi
2.1.1. Taksonomi mikrofungi
Fungi digolongkan ke dalam kelompok dunia ketiga oleh E. Haeckel yaitu
kelompok protista, yang merupakan kelompok selain hewan dan tumbuhan.
Fungi (kapang) merupakan organisme yang sebagian termasuk fotosintetik dan
sebagian lagi nonfotosintetik; beberapa dapat menyerupai tumbuhan, beberapa
serupa dengan hewan, dan beberapa sama-sama mempunyai sifat yang khusus
bagi kedua dunia tumbuhan dan hewan (Buss 1983; Buchalo et al. 1998). Ciri-ciri
organisme yang dikelompokkan ke dalam kingdom fungi adalah eukariotik, tidak
memiliki klorofil, tumbuh sebagai hifa, memiliki dinding sel yang mengandung
khitin, bersifat heterotrof, menyerap nutrien melalui dinding selnya dan
mengekskresikan enzim-enzim ekstraseluker ke lingkungan, menghasilkan spora
atau konidia, serta melakukan reproduksi seksual dan atau aseksual (Trinci dan
Cutter 1986; Brock et al. 1994; Gandjar et al. 2006).
Taksonomi fungi pada saat ini didasarkan pada morfologi dan pola
perkembangan dari struktur reproduksi seksual yang dihubungkan dengan struktur
biokimia dan molekulnya, termasuk pada analisis rDNA. Deacon (1997) dan
Alexopoulos et al.(1996) in Sigee (2005) membagi fungi dalam kelompok sebagai
berikut:
1. Filum Chitridiomycota
Kelompok ini ada pada habitat akuatik dan tanah, memiliki jenis parasit
ataupun saprofit. Anggota dari filum ini dikenal dengan sebutan chytrid.
Banyak anggota fungi ini yang tidak memiliki miselium; thallus (tubuh)
tereduksi menjadi sebuah single globular structure yang dapat masuk ke
dalam inangnya atau pada substrat. Single globular structure adalah sistem
rhizoid (struktur yang mirip dengan akar) yang tidak beraturan. Beberapa
chytrid merupakan endobiotik; hidup di dalam inangnya. Sementara yang
epibiotik memproduksi organ reproduksi pada permukaan inangnya atau pada
bahan organik yang mati. Filum ini, pada habitat akuatik memiliki empat
a. Ordo Chytridiales
b. Ordo Blastocladiales
c. Ordo Spizellomycetales
d. Ordo Monoblepharidales
2. Filum Zygomycota
Memiliki dua kelas yang mewakili lingkungan perairan tawar, yaitu
Zygomycetes dan Trichomycetes. Zygomycetes bersifat kosmopolitan dan
dapat menggunakan substrat dengan spektrum yang luas (Gandjar et a/.
2006).
3. Filum Ascomycota(fungi tingkat tinggi)
Karakter dari filum ini adalah memiliki miselium yang bersepta dan ascocarp
(tubuh buah seksual; suatu struktur reproduksi seksual yang menghasilkan
askus) dengan bentuk multiselular. Fungi jenis ini jarang ditemukan di
perairan tawar.
4. Filum Basidiomycota
Sama halnya dengan filum Ascomycota, kapang dari kelompok
Basidiomycota jarang ditemukan di lingkungan akuatik tawar. Bila
ditemukan, ada pada kayu dan bahan organik yang ada di dalam atau di sekitar
sungai.
5. Deuteromycota
Menurut Manoharachary et al. (2005), kelompok ini disebut juga anamorf,
fungi imperfect, fungi konidial, fungi mitosporik, atau fungi aseksual. Banyak
spesies yang dimasukkan ke dalam deuteromycota, namun setelah ditemukan
fase seksualnya (teleomorf) dimasukkan ke dalam Ascomycota atau
Basidiomycota. Deuteromycota merupakan kelompok yang khusus bagi
spesies cendawan dengan fase seksual yang belum diketahui.
2.1.2. Morfologi mikrofungi
Bagian penting tubuh mikrofungi adalah hifa. Hifa adalah suatu struktur
fungus berbentuk tabung menyerupai seuntai benang panjang yang terbentuk dari
pertumbuhan spora atau konidia. Kumpulan hifa yang bercabang-cabang tersebut
membentuk suatu jala yang umumnya berwarna putih, dan disebut sebagai
suatu dinding yang kuat. Morfologi mikrofungi dapat dilihat pada Gambar 2.
Berdasarkan morfologi hifa secara mikroskopis, hifa dapat dibedakan menjadi:
a. Aseptat atau senositik
Hifa seperti ini tidak mempunyai septum, sehingga memiliki banyak inti.
b. Monositik
Sekat membagi hifa menjadi ruang-ruang atau sel-sel berisi nukleus tunggal.
Pada setiap septum terdapat pori di tengah-tengah yang memungkinkan
terjadinya perpindahan nukleus dan sitoplasma dari satu ruang ke ruang yang
lain (Trinci dan Cutter, 1986).
a b
Gambar 2. Morfologi mikrofungi Penicilium Viridicatum a: sketsa tubuh mikrofungi (Gandjar, 1999),
b: miselium(www.3phase.com)
2.1.3. Pertumbuhan dan reproduksi mikrofungi 2.1.3.1. Pertumbuhan
Fase pertumbuhan dapat diketahui melalui perubahan luas daerah di
bawah kurva pertumbuhan atau disebut dengan area under the kinetic curve
(AUKC). Kecepatan pertumbuhan mikroorganisme ini tergantung pada
lingkungan fisik dan kimianya. Berdasarkan laju pertumbuhannya, maka
Meletiadis (2001) membagi fase pertumbuhan fungi menjadi lima, yaitu fase
pertumbuhan lambat (lag phase), fase akselerasi (first transition period), fase log
(log phase), fase penurunan (second transition period atau declining phase), dan
fase stasioner (stationer phase). Kurva pertumbuhan fungi dapat dilihat pada
Gambar 3.
Gambar 3. Kurva Pertumbuhan Mikrofungi
(a). fase pertumbuhan lambat, (b) fase akselerasi, (c) fase log, (d) fase penurunan, (e) fase stasioner (sumber: Meletiadis et al. 2001)
Fase pertama adalah fase lag. Pada tahap ini tidak terjadi pertumbuhan sel.
Pengamatan secara mikroskopik yang dilakukan oleh Meletiadis (2001)
menunjukkan bahwa pada fase ini sedang terjadi persiapan pembelahan sel atau
pun persiapan pertumbuhan spora dan konidia. Fase ini dicirikan oleh perubahan
(Δr) AUKC yang kurang dari 5%.
Pembelahan sel akan diikuti oleh persipan perpanjangan hifa, dan hal ini
menunjukkan terjadinya fase akselerasi atau dapat juga disebut first transition
period (Reinhardt 1892 in Trinci dan Cutter 1986). Fase ini dapat dilihat melalui
peningkatan ΔrAUKC hingga 30%. Pada tahap ini, persiapan perpanjangan hifa
sulit ditentukan karena tidak hanya tergantung pada jumlah sel yang
diinokulasikan, tetapi juga tergantung pada karakteristik metaboliknya, seperti
umur dan keadaan fisiologisnya, serta tergantung juga pada jenis nutrien dalam
medianya (Quoreshp et al. 1995). Fase pertumbuhan lambat yang lama
menunjukkan adanya bahan-bahan beracun dan substrat bersifat melawan, kurang
inokulasi, atau pre-kultur tidak sesuai (sel mati inaktif).
Perpanjangan hifa akan terjadi setelah fase akselerasi, yaitu pada fase log.
Fase log memiliki kurva pertumbuhan dengan kemiringan (slope) yang maksimal
(Meletiadis 2001), sehingga laju pertumbuhan spesifik pada fase ini merupakan
nilai maksimum. Laju pertumbuhan eksponensial ini sangat dipengaruhi oleh
Akhir dari fase log (eksponensial) diikuti oleh periode pertumbuhan linier
sebelum berangsur-angsur ke fase stasioner. Pertumbuhan linier disebut juga
sebagai fase penurunan (second transition period atau declining phase). Fase
penurunan di dalam kultur disebabkan oleh habisnya atau terbatasnya beberapa
nutrien dan terdapatnya akumulasi sisa produk. Selama periode transisi, slope
kurva pertumbuhan fungi mengalami perubahan yang cepat dan ΔrAUKC yang
tinggi bila dibandingkan fase-fase lainnya. Kemiringan pada periode transisi ke
dua berkurang secara terus menerus, dan bila dilihat dari ΔrAUKC nilainya
mencapai 70% (Meletiadis et al. 2001).
Setelah fase penurunan, fungi akan mengalami fase stasioner, dengan
ΔrAUKC kurang dari 70% dari nilai maksimal ΔrAUKC (Meletiadis et al. 2001). Pada fase ini fungi akan mulai rusak, yang mengindikasikan bahwa pertumbuhan
fungi telah berhenti atau disebut fase stasioner (Quoreshp et al. 1995; Leung dan
Wu 2007).
2.1.3.2. Reproduksi
Fungi yang sudah dewasa akan membentuk struktur-struktur untuk
melakukan reproduksi agar spesiesnya menyebar dan tidak punah (Gandjar et al.
2006). Ketika kondisi buruk, pembentukan jaringan secara vegetatif
(pembelahan, penguncupan) akan berkurang bahkan tidak akan dilakukan, dan
spora akan terbentuk. Spora ini dapat bertahan pada lingkungan yang buruk
(Lyon et al. 1943).
Secara alamiah mikrofungi berkembang biak dengan berbagai cara, baik
secara aseksual dengan atau tanpa pembentukan spora, maupun secara seksual
dengan peleburan nukleus dari dua sel induknya. Spora aseksual, yang berfungsi
untuk menyebarkan spesies, dibentuk dalam jumlah besar (Gilman 1945). Ada
beberapa tipe spora aseksual, di antaranya:
a. Konidiospora atau konidium
Konidium dibentuk di ujung atau di sisi suatu hifa. Konidium yang kecil dan
bersel satu disebut mikrokonidium. Konidium yang besar dan bersel banyak
dinamakan makrokonidium.
b. Sporangiospora
(sporangium) yang terdapat di ujung hifa khusus. Aplanospora ialah
sporangiospora nonmotil. Zoospora ialah sporangiospora yang motil.
Motilitasnya disebabkan oleh adanya flagelum.
c. Oidium atau artrospora
Spora bersel satu yang terbentuk karena terputusnya sel-sel hifa
d. Klamidiospora
Spora bersel satu yang berdinding tebal, sangat resisten terhadap keadaan
buruk, terbentuk dari sel-sel hifa somatik
e. Blastospora
Tunas atau kuncup pada sei-sel khamir
Spora seksual yang dihasilkan dari peleburan dua nukleus, lebih jarang terbentuk.
Jumlahnya yang lebih sedikit dibandingkan dengan spora aseksual, hanya
terbentuk dalam keadaan tertentu (Gilman 1945). Ada beberapa tipe spora
seksual, yaitu:
a. Askospora, adalah spora bersel satu yang terbentuk dalam kantung yang
(askus). Biasanya terdapat delapan askospora di dalam setiap askus. Contoh
fungi yang menghasilkan aksospora adalah filum Ascomycota (Buchalo et al.
1998).
b. Basidiospora, adalah spora bersel satu yang terbentuk di atas struktur berbentuk
gada yang dinamakan basidium. Contoh fungi yang menghasilkan spora tipe
ini adalah fungi yang berasal dari filum Basidiomycota (Gilman 1945).
c. Zigospora, adalah spora besar berdinding tebal yang terbentuk apabila
ujung-ujung dua hifa yang secara seksual serasi, disebut juga gametangia, dan pada
beberapa fungi, spora ini melebur. Zygospora terbentuk pada fungi tingkat
rendah, yaitu filum Zygomycota (Gandjar et al. 2006).
d. Oospora, adalah spora yang terbentuk di dalam struktur betina khusus yang
disebut ooginium. Pembuahan telur atau oosfer oleh gamet jantan yang
terbentuk di dalam anteredium menghasilkan oospora. Dalam setiap oogonium
terdapat satu atau beberapa oosfer. Oospora terdapat pada fungi tingkat rendah
dari filum Chitridiomycota dihasilkan oospora (Gilman 1945).
Suatu fungi tunggal dapat membentuk spora aseksual dan seksual dengan
Struktur serta metode pembentukan spora-spora tersebut cukup konstan atau tidak
berubah (Pelczar dan Chan 1986).
2.1.4. Metabolisme (absorbsi nutrien) pada mikrofungi
Faktor paling penting yang berhubungan dengan aktivitas fungi adalah
nutrien. Nutrien akan digunakan sebagai energi melalui proses metabolisme,
sehingga organisme dapat melaksanakan fungsi hidupnya. Metabolisme adalah
seluruh proses kimia di dalam organisme hidup untuk memperoleh dan
menggunakan energi (Voet dan Voet 1995 in Gandjar et al. 2006). Ketika sel
melakukan metabolisme, nutrien akan diubah ke dalam bentuk materi sel, energi,
dan produk buangan (Bilgrami dan Verma 1994 in Gandjar et al. 2006). Proses
tersebut akan menyebabkan organisme tumbuh dan berkembang. Proses
metabolisme pada fungi meliputi dua fungsi utama yaitu, fungsi anabolisme
(asimilasi/bioenergi) dan katabolisme (disimilasi/biosintesis). Dalam fungsi
anabolisme nutrien diubah menjadi komponen struktural dan fungsional oleh
mikroorganisme. Dalam fungsi katabolisme energi kimia diambil dari nutrien
untuk menghasilkan energi yang akan digunakan dalam reaksi anabolisme. Proses
anabolisme tergantung pada katabolisme, tidak hanya pada energi yang dalam
bentuk ATP, NADH, dan NADPH, tapi juga produksi senyawa intermediate bagi
berlangsungnya proses biosintesis makromolekul dari struktur hifa (Trinci dan
Cutter 1986; Ayres 1986 in Gandjar et al. 2006).
Pada proses katabolisme, nutrien berfungsi sebagai sumber energi atau
penerima elektron. Proses ini bersifat eksergonik atau eksotermik dengan energi
yang dihasilkan berbentuk energi kimia dan bukan energi panas. Hal tersebut
terjadi karena sel tidak dapat menggunakan energi panas, melainkan
Adenosin-trifosfat (ATP). ATP diperlukan untuk aktivitas sel, misalnya untuk
perkembangbiakan, pembentukan spora, pergerakan, biosintesa, dan sebagainya
(Ayres 1986 in Gandjar et al. 2006).
Proses anabolisme sebagai salah satu kegiatan dalam metabolisme,
memerlukan sumber energi yang didapat dari proses katabolisme. Selama proses
katabolisme berlangsung, produk yang dihasilkan tidak hanya energi bagi
berlangsungnya anabolisme, melainkan juga senyawa yang akan menjadi bahan
oksalasetat, asam suksinat, dan sebagainya. Reaksi anabolisme pada dasarnya
terbagi ke dalam beberapa proses, diantaranya: asimilasi nitrogen dan sulfat,
sintesis mikromolekul (sintesis asam amino), serta sintesis makromolekul (sintesis
DNA, RNA, dan protein) (Trinci dan Cutter 1986).
Secara umum fungi memerlukan nutrien dalam bentuk karbon, nitrogen,
sulfur, kalium, magnesium, natrium, kalsium, nutrien mikro (besi, mangan,
kobalt, molibdenum), dan vitamin. Fungi adalah organisme heterotrof karena
tidak memiliki kemampuan untuk mengoksidasi senyawa karbon anorganik.
Senyawa karbon organik yang dapat dimanfaatkan fungi untuk membuat materi
sel baru dapat berupa molekul sederhana seperti gula sederhana, asam organik,
gula terikat alkohol, polimer rantai pendek dan rantai panjang yang mengandung
karbon (Gadd 1988; Ayres 1986 in Gandjar 2006). Beda halnya dengan karbon,
nitrogen dimanfaatkan oleh fungi dalam bentuk senyawa organik dan anorganik.
Fungi lebih menyukai nitrogen dalam bentuk organik. Nitrogen organik yang
dapat dimanfaatkan oleh fungi adalah dalam bentuk protein (Lyon et al. 1952).
Menurut Gunderson (1967); Guest dan Smith (2007), senyawa nitrogen anorganik
yang dapat dimanfaatkan oleh mikrofungi adalah dalam bentuk ammonium (NH4
-N); nitrat (NO3); dan nitrit (NO2). Nitrit dapat dimanfaatkan oleh mikrofungi
dalam kondisi yang tidak asam. Selain itu, fungi diketahui dapat menghidrolisis
senyawa-senyawa toksik yang sulit diuraikan menjadi senyawa-senyawa lebih
sederhana, sehingga dapat dimanfaatkan oleh organisme itu sendiri atau lainnya
(Quoreshp et al. 1995).
2.2. Karakteristik tahu dan limbah cair tahu 2.2.1. Karakteristik tahu
Tahu merupakan bahan makanan yang terbuat dari kedelai yang
mempunyai nilai gizi yang cukup tinggi. Menurut Soedarma dan Sediaoetma
(1977) in Dhahiyat (1990) di dalam 100 gram kedelai yang merupakan bahan
tahu, terkandung 35 gram protein, 18 gram lemak, dan 10 gram karbohidrat;
sedangkan dalam 100 gram tahu terdapat 7,8 gram protein, 4,6 gram lemak, dan
1,6 gram karbohidrat.
Pengolahan kedelai menjadi tahu umumnya dilakukan secara tradisional,
penggumpal yang lazim digunakan ialah batu tahu (CaSO4) atau cioko, asam cuka
(CH3COOH), dan MgSO4 (Pusbangtepa 1989). Proses pengolahan tahu dapat
dilihat pada Gambar 4.
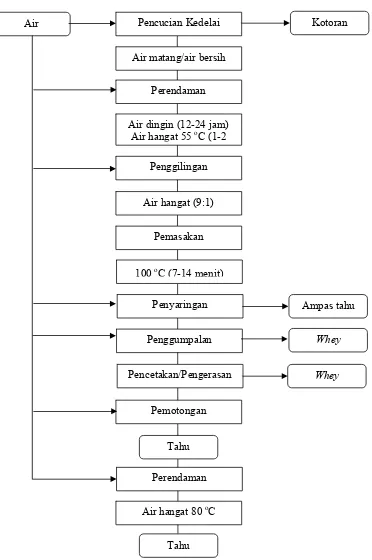
Gambar 4. Bagan Proses Pembuatan Tahu
(Sumber: Nuraida 1985; Pusbangtepa 1989 in Sylvi 2001)
Pencetakan/Pengerasan Pencucian Kedelai
Perendaman
Penggilingan
Pemasakan
Penyaringan
Pemotongan Penggumpalan
Perendaman Tahu
Air matang/air bersih
Air dingin (12-24 jam) Air hangat 55 oC (1-2
Air hangat (9:1)
100oC (7-14 menit)
Tahu Air hangat 80 oC Air
Ampas tahu
Whey
Whey
2.2.2. Karakteristik limbah cair tahu
Limbah tahu adalah limbah yang dihasilkan dalam proses pembuatan tahu
atau pun pada saat pencucian kedelai. Limbah yang dihasilkan dapat berupa
limbah padat dan cair. Pada Gambar 4 terlihat adanya hasil sampingan dari proses
pembuatan tahu yaitu whey. Whey adalah limbah cair yang dihasilkan dari proses
penggumpalan dan pencetakan pada pembuatan tahu. Sebagian pabrik tahu ada
yang menggunakan sebagian kecil whey sebagai biang. Selain whey, limbah cair
tahudapat berupa sisa air tahu yang tidak menggumpal atau berupa potongan tahu
yang hancur pada saat proses karena kurang sempurnanya proses penggumpalan
(Dhahiyat 1990). Setiap kuintal kedelai akan menghasilkan 1,5 - 2 m3 limbah cair. Limbah padat belum dirasakan dampaknya terhadap lingkungan karena
dapat dimanfaatkan sebagai pakan ternak, sedangkan limbah cair pada umumnya
langsung dibuang ke lingkungan sekitar. Limbah cair bila dibiarkan akan
berwarna hitam dan berbau busuk.
Padatan tersuspensi maupun terlarut yang terdapat pada limbah cair
tersebut dapat menjadi media untuk tumbuhnya agen penyakit. Air limbah dapat
meresap ke dalam tanah yang dekat dengan sumur, sehingga air sumur itu tidak
layak dimanfaatkan lagi. Begitu pula bila limbah dialirkan ke sungai, maka akan
mencemari sungai dan bila masih digunakan akan menimbulkan penyakit, seperti
gatal dan diare (Nurhasan dan Pramudyanto 1991). Pencemaran akibat limbah
akan berdampak negatif pada lingkungan di sekitarnya.
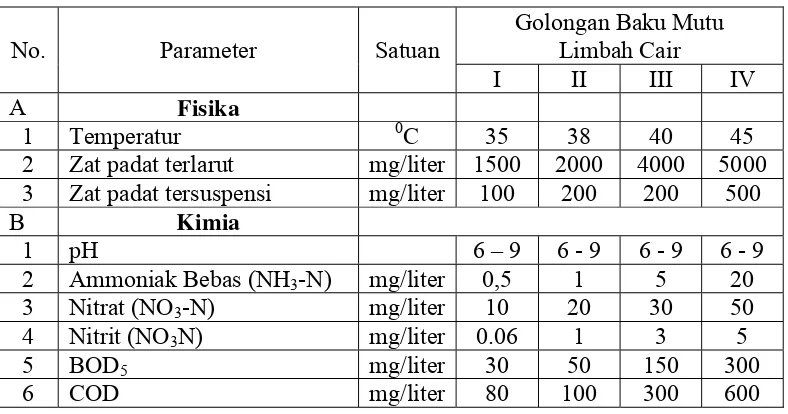
Air buangan industri tahu memiliki karaktersitik fisika dan kimia yang
dapat dilihat pada Tabel 1. Pemahaman tentang karakteristik limbah tahu
merupakan hal yang penting untuk mengetahui tingkat pencemaran serta
penanggulangannya. Selain itu juga untuk menentukan cara pengolahan yang
tepat serta memudahkan penentuan parameter yang akan dianalisis. Berhubungan
dengan hal tersebut, Bapedalda Provinsi Jawa Timur menetapkan baku mutu
limbah cair untuk usaha pembuatan tahu sesuai dengan keputusan Gubernur
Tabel 1. Karakteristik Air Limbah Tahu
Sumber: Nurhasan (1987) in Sylvi (2001)
Tabel 2. Baku mutu limbah cair industri dan kegiatan usaha lainnya (Keputusan Gubernur No.45 Tahun 2002)
No. Parameter Satuan
Golongan Baku Mutu Limbah Cair
I II III IV
A Fisika
1 Temperatur 0C 35 38 40 45
2 Zat padat terlarut mg/liter 1500 2000 4000 5000
3 Zat padat tersuspensi mg/liter 100 200 200 500
B Kimia
Sumber: BPLHD Surabaya in jukungkami.files.wordpress.com (2008)
2.3. Parameter kualitas air 2.3.1. Parameter fisika
a. Suhu
Suhu merupakan salah satu faktor yang mengontrol dekomposisi bahan
organik yang dilakukan oleh fungi. Kondisi temperatur yang rendah dapat
menghambat metabolisme fungi sehingga memperlambat laju dekomposisi bahan
organik yang ada di perairan (Lindblom dan Tranvik 2003).
Karakteristik Hasil Pengukuran
Suhu
Kebutuhan oksigen biologi (BOD) Kebutuhan oksigen kimia (COD)
Pertumbuhan dan kelangsungan hidup mikroorganisme dipengaruhi pula
oleh suhu. Fungi termasuk organisme termofilik yang dapat tumbuh pada suhu
lebih dari 550C. Salah satu contoh, Mucor pusillus, dapat tumbuh dengan suhu minimum 21-23, suhu optimum 45-50, dan suhu maksimum 50-58.
Mikroorganisme seperti fungi dapat tumbuh dalam kisaran suhu yang luas. Bagi
kebanyakan spesies saprofitik berkisar 22 sampai 30°C, sedangkan untuk spesies
patogenik mempunyai suhu optimum lebih tinggi, biasanya mencapai 30-37°C
(Sigee 2004).
b. TSS, TDS, dan kekeruhan
Berdasarkan ukuran padatannya yang terdapat di perairan dapat
diklasifikasikan menjadi: padatan terlarut (< 10-6 mm), koloid (10-6 sampai 10-3 mm), dan padatan tersuspensi (> 10-3 mm). Total Suspendid Solid adalah padatan
yang tertahan pada saringan milipore dengan diameter pori 0,45 μm (Effendi
2003). Total Dissolved Solid adalah bahan-bahan terlarut (diameter <10-6 mm) dan koloid (diameter 10-6 mm-10-3 mm) yang berupa senyawa-senyawa kimia dan bahan-bahan lain, yang tidak tersaring pada kertas saring berdiameter pori 0,45
μm (Rao, 1992 in Effendi 2003). TDS biasanya disebabkan oleh adanya bahan
anorganik yang berupa ion-ion yang biasa ditemukan di perairan. Air buangan
atau limbah, selain banyak mengandung padatan tersuspensi, juga mengandung
bahan-bahan yang bersifat koloid, misalnya protein (Yusuf 2001).
Kekeruhan merupakan sifat optik yang ditentukan berdasarkan banyaknya
cahaya yang diserap dan dipancarkan oleh bahan-bahan yang terdapat di dalam
air, yang dapat diukur dengan turbidimeter. Dengan demikian kekeruhan (optical
density) dari media fungi dapat digunakan untuk memperkirakan laju
pertumbuhan mikrofungi. Padatan tersuspensi berkolerasi positif dengan
kekeruhan. Semakin tinggi nilai padatan tersuspensi, nilai kekeruhannya juga
semakin tinggi. Akan tetapi, tingginya padatan terlarut tidak selalu diikuti dengan
tingginya kekeruhan (Meletiadis et al. 2001; Effendi 2003).
2.3.2. Parameter kimia
a. Dissolved Oxygen (DO)
Keberadaan oksigen menentukan proses dekomposisi bahan organik yang ada di
dekomposisi, serta dapat menghasilkan senyawa-senyawa sampingan, seperti
CH4,CO2,N2, dan H2S. Keadaan ini dapat disebut sebagai anaerob (Lindblom
dan Tranvik 2003; Pagliuso et al. 2002). Menurut Gray (2004), oksigen terlarut
kurang dari 2 mg/l menyebabkan keadaan anaerob.
Burges dan Fenton (1953) in Panseseko (1967), menyebutkan bahwa fungi
dapat dibedakan menjadi tiga kelompok berdasarkan keberadaan oksigen.
Kelompok pertama adalah kelompok fungi yang dapat hidup pada kondisi
aerobik; kelompok kedua adalah kelompok fungi yang memiliki toleransi terhadap
karbondioksida dan sebagian anaerobik; sedangkan kelompok ketiga adalah
mikrofungi yang dapat hidup baik pada kondisi aerob maupun anaerob.
c. Chemical Oxygen Demand (COD)
COD limbah adalah jumlah oksigen yang dibutuhkan untuk mengoksidasi
zat-zat organik yang ada dalam satu liter limbah secara kimiawi. Nilai COD yang
tinggi menunjukkan adanya pencemaran oleh zat-zat organik yang tinggi
(Suhardi, 1991 in Yusuf, 2001). Zat organik dalam limbah dibedakan menjadi
dua, yaitu yang mudah didegradasi oleh mikroba, dan yang sulit didegradasi oleh
mikroba. Parameter COD menunjukkan oksidasi bahan organik, baik yang dapat
didegradasi secara biologis (biodegradable) maupun yang sukar didegradasi
secara biologis (non biodegradable) menjadi CO2 dan H2O (Effendi 2003).
Keberadaan bahan organik dapat berasal dari alam ataupun dari aktivitas
rumah tangga, dan industri. Nilai COD pada perairan yang tidak tercemar
biasanya kurang dari 20 mg/l, sedangkan nilai COD pada perairan yang tercemar
dapat mencapai lebih dari 200 mg/l (UNESCO/WHO/UNEP, 1992 in Effendi
2003).
d. Nilai pH
Nilai pH mencirikan keseimbangan antara asam dan basa dalam limbah,
dan merupakan pengukuran konsentrasi ion hidrogen. pH mempengaruhi
pertumbuhan mikrofungi melalui proses-proses yang terjadi di dalam sel, salah
satunya adalah aktivitas enzim (Busa et al., 1986 in Robson et al. 1996).
Pada umumnya, mikroba dapat tumbuh pada lingkungan yang asam hingga
sangat alkalin (pH 0 - 12), yang dibagi menjadi 3 kelompok, yaitu acidophil (pH 0
tergolong ke dalam kelompok acidophil dan neutrophil, namun biasanya fungi
lebih menyukai pH rendah atau dalam kondisi asam, yaitu antara 4 – 6 (Sigee
2004).
e. Amonia nitrogen
Sumber amonia di perairan dapat berasal dari pemecahan nitrogen organik,
dapat berupa protein atau pun urea. Nitrogen organik terikat pada unsur pokok sel
makhluk hidup, seperti protein. Fungi dan mikroorganisme lainnya
mentransformasi bahan organik tersebut menjadi nitrogen anorganik, yaitu
amonia, nitrit, nitrat, dan gas nitrogen (Lyon et al. 1943). Proses perubahan
nitrogen organik menjadi amonia ini dikenal dengan amonifikasi. Hal ini
ditunjukkan dalam persamaan reaksi sebagai berikut (Effendi 2003):
N organik + O2 NH3-N + O2 N02 -N + O2 N03-N (1)
Amonifikasi nitrifikasi
Amonia yang terukur di perairan berupa amonia total (NH3 dan NH4+).
Amonia (NH3) beserta garam-garamnya bersifat mudah larut dalam air, sedangkan
amonium (NH4+) adalah bentuk transisinya. Amonia bebas yang tidak dapat
terionisasi bersifat toksik terhadap organisme aquatik. Kadar amonia bebas yang
tidak terionisasi (NH3) pada perairan tawar sebaiknya tidak lebih dari 0,02
mg/liter. Jika kadar amonia bebas lebih dari 0,2 mg/liter, perairan bersifat toksik
bagi beberapa biota air (Sawyer dan McCarty, 1978 in Effendi 2003). Kadar
amonia yang tinggi dapat merupakan indikasi adanya pencemaran bahan organik
yang berasal dari limbah domestik, industri, dan run off (Effendi 2003).
f. Nitrat nitrogen dan nitrit nitrogen
Nitrat (N03) adalah bentuk utama nitrogen di perairan alami, dan sangat
mudah larut dalam air. Senyawa ini dihasilkan dari proses oksidasi sempuma
senyawa nitrogen di perairan, dan nitrit merupakan hasil antara dari reduksi
ammonia menjadi nitrat (Gundersen 1967). Nitrit, sebagai hasil antara, memiliki
sifat tidak stabil dan mudah berubah dalam bentuk lainnya (Sedlak 1991 in
Nitrifikasi merupakan proses oksidasi amonia menjadi nitrit dan nitrat
(persamaan 1). Nitrifikasi merupakan proses yang penting dalam siklus nitrogen
dan berlangsung pada kondisi aerob (Effendi 2003). Pada kondisi anaerob, nitrat
dapat berubah menjadi nitrit atau nitrogen dalam bentuk gas (N2), yang biasa
dikenal dengan istilah denitrifikasi. Perubahan nitrat menjadi nitrogen menurut
Gray (2004), dapat dilihat pada persamaan (2) berikut ini:
(2)
Salah satu mikroorganisme yang dapat melakukan nitrifikasi adalah
mikrofungi. Mikrofungi memiliki kemampuan untuk memanfaatkan oksigen
terlarut dalam kondisi aerob, namun dapat juga menggunakan nitrat sebagai
penerima elektron dalam respirasi ketika oksigen terlarut menjadi faktor pembatas
(Sigee 2004).
Kadar nitrat-nitrogen pada perairan alami hampir tidak pernah lebih dari
0,1 mg/liter. Kadar nitrat nitrogen yang lebih dari 0,2 mgl/liter dapat
mengakibatkan terjadinya eutrofikasi perairan (Davis dan Cornwell 1991 in
Effendi 2003).
g. Nitrogen total
Nitrogen total Kjeldahl adalah gambaran nitrogen dalam bentuk organik
dan ammonia pada air limbah (Davis and Cornell, 1991 in Effendi 2000).
Nitrogen total adalah penjumlahan dari nitrogen anorganik yaitu N-NO3, N-NO2,
dan N-NH3 yang bersifat terlarut, dan nitrogen organik yang berbentuk partikulat
dan tidak terlarut dalam air (Mackereth et al. 1989 in Effendi 2000).
2.4. Proses pengolahan limbah secara biologi
Pengolahan limbah dengan cara biologi dapat dilakukan dengan
menggunakan mikroba. Proses biologi yang dilakukan mikroorganisme dalam
mendegradasi bahan-bahan organik diaplikasikan untuk membersihkan
lingkungan yang tercemar dari polutan. Hal ini dapat diistilahkan sebagai
bioremediasi (Hamman 2004). Tujuan dari bioremediasi itu sendiri adalah untuk
NO3 NO2 NO N2O N2
reductase reductase reductase reductase
mereduksi polutan menjadi senyawa yang tidak toksik atau mereduksi hingga
taraf / konsentrasi yang diperbolehkan (Gray 2004).
Salah satu mikroorganisme yang dapat digunakan dalam sistem
pengolahan biologis ini adalah mikrofungi. Penggunaan mikrofungi dalam
bioremediasi dikenal dengan istilah mycoremediation (Hamman 2004).
Beberapa penelitian yang telah dilakukan, misalnya oleh Van Leeuwen
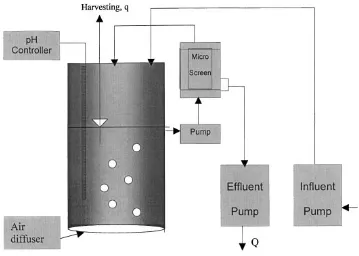
(2004), menggunakan mikrofungi untuk mengolah limbah cair, dengan cara
melewatkan mikrofungi yang ditempatkan pada suatu tempat yang memiliki
screen. Screen tersebut memiliki ukuran pori yang kecil (100 μm), yang bertujuan agar bakteri dapat ikut terbuang saat limbah dialirkan, namun
mikrofungi tetap berada di dalam wadah tersebut. Skema screen pada reaktor
untuk mengolah limbah menggunakan mikrofungi, dapat dilihat pada Gambar 5.
Pertumbuhan mikrofungi dapat dikontrol dengan melakukan pemanenan.
Biomassa mikrofungi yang terbentuk dapat dijadikan sebagai stok inokulan untuk
pengolahan limbah berikutnya dan dapat dijadikan sebagai pupuk tanaman.
Fungi mendegradasi bahan-bahan organik dengan mentransformasi karbon
dan nitrogen ke jaringan fungi itu sendiri dalam proporsi yang lebih banyak
daripada mikroorganisme lainnya. Selain itu, hasil sampingan berupa
karbondioksida dan ammonium relatif lebih sedikit. 50% substansi yang
didekomposisi oleh fungi digunakan untuk pembentukan jaringan (Lyon et al.
1943), sehingga pemulihan lingkungan oleh mikroorganisme ini dianggap
sebagai strategi potensial (Frankenberger dan Losi 1996; Gadd 1992 in Gandjar et
3.1. Waktu dan tempat
Penelitian ini dilakukan dalam dua rangkaian, yaitu penelitian
pendahuluan dan utama. Penelitian pendahuluan terdiri dari dua tahap. Tahap
pertama meliputi pengambilan sampel mikrofungi dari perairan Telaga Warna,
pengisolasian, kultivasi, dan identifikasi mikrofungi. Tahap kedua berupa
penentuan konsentrasi limbah tahu yang akan digunakan untuk media mikrofungi
pada penelitian utama. Penelitian utama merupakan rangkaian kegiatan yang
terdiri dari pengujian jenis-jenis mikrofungi pada konsentrasi limbah hasil
penelitian pendahuluan. Dalam penelitian utama ini juga dilakukan pengukuran
parameter fisika-kimia air serta persentase penutupan mikrofungi.
Pengambilan contoh tersebut dilakukan pada bulan Juli 2006 yang
mewakili musim kemarau dan bulan Februari 2007 yang mewakili musim hujan.
Penelitian pendahuluan dan utama dilakukan pada Mei 2007 di Laboratorium
Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya
Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2. Penelitian pendahuluan 3.2.1. Tahap pertama
3.2.1.1. Pengambilan sampel mikrofungi dari Telaga Warna
Pengambilan sampel mikrofungi dilakukan secara langsung, yaitu dengan
mengambil langsung dari air, serasah, daun, batu, ataupun ranting yang terdapat di
perairan Telaga Warna. Sampel tersebut diambil atau dikerik menggunakan jarum
ose, kemudian digoreskan pada media agar yang telah diperkaya nutrien. Nutrien
yang digunakan adalah Potato Dextrose Agar/PDA (Lampiran 1).
3.2.1.2. Isolasi mikrofungi
Isolat mikrofungi yang telah diambil dari perairan Telaga Warna tersebut
diinkubasi selama 2-5 hari pada suhu kamar. Biakan mikrofungi yang tumbuh
dalam media agar masih heterogen. Biakan ini kemudian diisolasi dan diinkubasi
kembali dalam suhu kamar selama 2-5 hari untuk mendapatkan biakan tunggal
mikroskopis.
3.2.1.3. Identifikasi mikrofungi
Identifikasi mikrofungi bertujuan untuk mengetahui biodiversitas atau
keanekaragaman hayati mikrofungi di perairan Telaga Warna. Identifikasi
dilakukan melalui beberapa tahapan berikut.
a. Pembuatan slide kultur
Bagian bawah dalam cawan petri diberi alas kertas saring. Batang gelas
berbentuk U diletakkan di atas kertas saring, kemudian diletakkan gelas objek
dan gelas penutupnya di atasnya, lalu disterilisasi di autoclave pada suhu
121 0C dengan tekanan 1 atm selama ± 15 menit. Setelah dingin, di atas gelas objek diberi setetes media PDA steril. Kemudian, secara aseptis,
menggunakan jarum ose, mikrofungi target diinokulasi pada permukaan agar
yang sudah membeku. Kemudian ditutup dengan gelas penutup. Di bagian
kertas saring diteteskan 7-10 ml gliserol 10% steril, kemudian diinkubasi pada
suhu kamar selama 3-5 hari.
b. Pengamatan
Untuk menentukan jenis mikrofungi, struktur mikrofungi yang tumbuh
diamati dengan menggunakan mikroskop dengan perbesaran 10x10.
Mikrofungi diidentifikasi dengan menggunakan beberapa acuan, seperti
Gandjar et al. (1999), Fassatiova (1986), dan Gilman (1945).
3.2.1.4. Penyiapan stok mikrofungi
Mikrofungi homogen yang telah diidentifikasi, ditumbuhkan kembali pada
cawan petri dengan media PDA yang disimpan sebagai stok. Stok mikrofungi
tersebut disimpan pada suhu kamar, yang berikutnya dapat digunakan sebagai
mikrofungi uji.
3.2.2. Tahap kedua
3.2.2.1. Penyiapan mikrofungi uji
PDA yang telah ditumbuhi mikrofungi tertentu (dalam hal ini adalah
sembilan bagian (8,72 cm2). Masing-masing bagian PDA tersebut dimasukkan ke dalam limbah cair tahu.
3.2.2.2. Treatment limbah
Limbah tahu yang akan digunakan disaring dan diberi penyinaran UV
terlebih dahulu. Penyaringan dilakukan menggunakan saringan dengan ukuran
pori 30 μm untuk menghilangkan kotoran besar. Penyinaran UV dilakukan untuk menghilangkan mikroorganisme yang ada pada limbah dengan panjang
gelombang 250-270 nm selama 30 menit (Lampiran 2).
3.2.2.3. Penentuan konsentrasi limbah
Penentuan konsentrasi limbah perlu dilakukan untuk melihat viabilitas
atau kelangsungan hidup biakan mikrofungi pada media limbah. Masing-masing
jenis mikrofungi uji yang telah dipotong, dimasukkan ke dalam wadah yang berisi
limbah cair tahu dengan konsentrasi yang berbeda. Pada tahap penentuan
konsentrasi limbah, konsentrasi uji yang digunakan adalah 75% (perlakuan A),
50% (perlakuan B), dan 25% limbah (perlakuan C). Pengencer yang digunakan
adalah akuades. Konsentrasi tersebut akan dibandingkan dengan kontrol, yang
berupa 100% limbah (perlakuan D), dan masing-masing perlakuan mendapatkan
tiga kali pengulangan.
Viabilitas inokulan mikrofungi uji akan dilihat selama enam hari, dengan
asumsi pertumbuhan mikrofungi sudah mencapai fase log, bahkan mencapai fase
stasioner selama rentang waktu tersebut. Berdasarkan penelitian yang dilakukan
Meletiadis (2004), mikrofungi dengan pertumbuhan yang lambat dapat mencapai
fase log dalam waktu 72 jam atau tiga hari masa pertumbuhannya.
3.3. Penelitian utama
Penelitian utama dilakukan setelah didapatkan konsentrasi limbah yang
sesuai untuk viabilitas inokulan mikrofungi. Pada tahap ini, pada limbah dengan
konsentrasi terpilih tersebut dimasukkan mikrofungi uji dengan jenis yang
berbeda-beda (selanjutnya disebut sebagai perlakuan). Limbah cair tahu dengan
mikrofungi uji ditempatkan pada stoples kaca (2,5 l). Kemudian dilakukan
pencatatan pertumbuhan mikrofungi uji pada hari ke- 0; 1; 2; 3; 4; 5; 6. Pada
penelitian ini, masing-masing perlakuan mendapatkan tiga kali ulangan.
3.4. Metode pengumpulan data 3.4.1. Analisis parameter kualitas air
Keberadaan kandungan bahan organik dalam air limbah digambarkan
melalui hasil pengukuran COD (Lampiran 3) serta N organik. Nilai N organik
dihitung melalui selisih antara nilai N total dengan penjumlahan nilai NH3-N,
NO3-N, dan NO2-N. Selain pengukuran bahan organik, dilakukan juga
pengukuran DO, pH, kekeruhan, TDS, suhu, serta penentuan persentase
penutupan untuk melihat pertumbuhan mikrofungi.
3.4.2. Analisis persentase perubahan nilai karakteristik limbah
Analisis persentase perubahan nilai karakteristik limbah dimaksudkan
untuk melihat perubahan nilai limbah yang diukur setiap hari. Hasil perubahan
nilai karakteristik limbah dalam persen ditentukan dengan menggunakan rumus
(Purwati, 1985 in Sukaton, 2007) :
Persentase perubahan nilai karakteristik limbah = a
a = Nilai pengamatan pada hari pertama
b = Nilai pengamatan pada hari terakhir
3.5. Analisis statistik
3.5.1. Penelitian pendahuluan
Pada penelitian pendahuluan, untuk melihat pengaruh perbandingan
konsentrasi limbah terhadap pertumbuhan mikrofungi, digunakan Rancangan
Acak Lengkap (RAL) dengan rumus umum sebagai berikut:
Yij = µ + i + ij
Yij : Laju penurunan bahan organik pada konsentrasi ke-i, pada ulangan ke-k
: Rata-rata laju penurunan bahan organik
τi : Pengaruh konsentrasi ke-i, i = 1, 2, 3, 4
Untuk melihat pengaruh keragaman dari variabel konsentrasi terhadap
pertumbuhan mikrofungi, dalam penelitian ini dilakukan uji satu arah
anova/Analisis of Variance (Tabel 3). Hipotesis yang digunakan adalah : HO : µ i = 0
(Faktor konsentrasi tidak ada pengaruhnya pada pertumbuhan mikrofungi)
H1 : µ i≠ 0
(Faktor waktu ada pengaruhnya pada pertumbuhan mikrofungi)
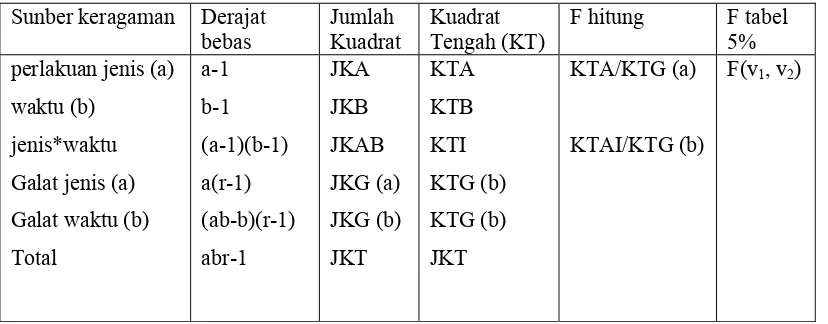
Tabel 3. Tabel sidik ragam RAL
Sunber keragaman
Derajat bebas Jumlah
Kuadrat
Dikutip dari Mattjik dan Sumertajaya (2000)
*) Keterangan: - i adalah total perlakuan
- k adalah total ulangan untuk semua perlakuan
- Bila F hitung < F 5 % tidak ada perbedaan nyata; H0diterima
- Bila F hitung > F 5 % ada perbedaan nyata; H1 diterima
3.5.2. Penelitian utama
a. Pengaruh waktu terhadap penurunan bahan organik
Rancangan Acak Lengkap (RAL) digunakan juga pada penelitian utama
untuk melihat keragaman konsentrasi bahan organik antarwaktu pada
masing-masing jenis mikrofungi yang diujikan. Rumus umum yang digunakan adalah
Yij = µ + τi + ij
Yij : Laju penurunan bahan organik pada waktu ke-i, pada ulangan ke-k
µ : Rata-rata laju penurunan bahan organik
τi : Pengaruh waktu ke-i, i = 1, 2, 3, 4, 5, 6
Untuk melihat pengaruh keragaman dari variabel waktu terhadap
penurunan konsentrasi bahan organik, dalam penelitian ini dilakukan uji satu arah
anova/Analisis of Variance (Tabel 3). Secara umum hipotesis yang digunakan adalah
H0 : µ i = 0
H1 : µ i≠ 0
Hipotesis tersebut menjelaskan bahwa pada limbah cair tahu dengan jenis
mikrofungi tertentu, waktu memberikan pengaruh yang sama terhadap rata-rata
laju penurunan konsentrasi bahan organik (H0). Atau minimal ada satu perlakuan
waktu memberikan pengaruh yang berbeda terhadap rata-rata laju penurunan
konsentrasi bahan organik (H1).
b. Pengaruh jenis mikrofungi terhadap penurunan bahan organik
Untuk melihat jenis mikrofungi yang memberikan pengaruh terhadap
penurunan konsentrasi bahan organik, digunakan Rancangan Acak Lengkap
(RAL) dalam waktu. Rumus umum yang digunakan adalah
Yijk = µ + αi + ij + ωk + jk + αωik + ijk
Yijk : Laju penurunan bahan organik
µ : Rata-rata laju penurunan bahan organik
αi : Pengaruh jenis mikrofungi ke-i, i = 1, 2, 3, 4, 5
ij : Komponen acak perlakuan
ωk : Pengaruh waktu ke-k, k = 1, 2, 3, 4, 5, 6
jk : Komponen acak waktu
αωik : Pengaruh interaksi dari mikrofungi ke-i dan waktu ke-k
ijk : Komponen acak interaksi waktu dan perlakuan
Uji yang digunakan pada tahap ini adalah MANOVA/Multivariate
Analisis of Variance (Tabel 4) dan Profil Plot (grafik rata-rata nilai tengah). Beberapa hipotesis yang diuji adalah pengaruh faktor jenis mikrofungi, waktu,
serta interaksi antara faktor jenis mikrofungi dan waktu, dengan bentuk hipotesis
a. HO : Tidak ada pengaruh dari waktu terhadap penurunan konsentrasi bahan
konsentrasi bahan organik
c. HO : Tidak ada pengaruh dari interaksi faktor jenis mikrofungi dan waktu
pada penurunan konsentrasi bahan organik
H1 : Ada pengaruh dari Interaksi faktor jenis mikrofungi dan waktu
terhadap penurunan konsentrasi bahan organik
Tabel 4. Tabel sidik ragam RAL dalam waktu
Sunber keragaman Derajat bebas
Sumber modifikasi dari Mattjik dan Sumertajaya (2000)
Keterangan: - i adalah total perlakuan
- r adalah total ulangan untuk semua perlajuan
- Bila F hitung < F 5 % tidak ada perbedaan nyata; H0diterima
4.1. Hasil
4.1.1. Penelitian pendahuluan
4.1.1.1. Biodiversitas mikrofungi akuatik dari Telaga Warna
Jenis mikrofungi akuatik yang ditemukan dari perairan Telaga Warna
merupakan fungi jenis kapang. Sebelas spesies mikrofungi ditemukan pada
musim kemarau dan 15 spesies pada musim hujan. Kapang yang ditemukan pada
musim kemarau adalah Mucor hiemalis, Mucor plumbeus, Mucor substilissimus,
Abisidia spinosa, Aspergillus niger, Aspergillus conicus, Penicillium viridicatum, Penicillium rugulosum, Trichoderma koningii, Acremonium strictum, dan
Cephalosporium acremonium. Yang ditemukan pada musim hujan adalah Mucor rouxianus, Mucor ramannianus, Mucor genevensis, Mucor jansseni, Mucor pussilus, Rhizopus cohnii, Rhizopus stolonifer, Rhizopus oryzae, Penicillium rugulosum, Cephalosporium acremonium, Penicillium citrinum, Penicillium urticae, Penicillium spinulosum, Aspergillus amstelodami, dan Monilia humicola.
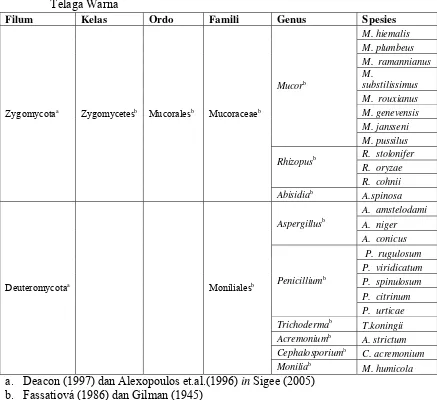
Deacon (1997) dan Alexopoulos et al. (1996) in Sigee (2005) membagi fungi dalam filum Chitrdiomycota, Zygomycota, Ascomycota, Basidiomycota,
dan Deuteromycota. Isolat mikrofungi yang didapat dari perairan Telaga Warna
termasuk ke dalam filum Zygomycota dan Deuteromycota (Tabel 5).
Karakteristik visual mikrofungi yang ditemukan di Perairan Telaga dapat dilihat
pada Lampiran 4.
Jenis-jenis kapang tersebut, sebagian memiliki dampak yang negatif bagi
kesehatan, seperti Aspergillus conicus yang memiliki pertumbuhan sangat cepat.
Spora Aspergillus mudah sekali terbawa udara sehingga mudah terhirup oleh
manusia dan dapat mengganggu kesehatan, diantaranya mengganggu sistem
kekebalan tubuh, dan sistem syaraf (Kuhn dan Ghannoum 2003). Oleh karena itu,
mikroorganisme uji yang digunakan dalam peneltian ini adalah Penicillium
rugulosum, Penicillium viridicatum, Acremonium strictum, Cephalosphorium acremonium, dan Abisidia spinosa. Mikrofungi uji yang digunakan, sebelumnya telah diujikan untuk mendegradasi minyak (Widiyanti 2007), dan dapat digunakan
mampu menghasilkan metabolit yang dapat dimanfaatkan untuk bioleaching; serta menghasilkan antifungal yang digunakan dalam bidang farmasi (Breen 1995;
Kisielowskadan Kasińska-Pilut 2005).
Tabel 5. Pengelompokan jenis-jenis mikrofungi akuatik yang terdapat di Danau Telaga Warna
a. Deacon (1997) dan Alexopoulos et.al.(1996) in Sigee (2005) b. Fassatiová (1986) dan Gilman (1945)
4.1.1.2. Penentuan konsentrasi limbah
Penelitian pendahuluan dilakukan untuk mendapatkan konsentrasi limbah
yang tepat bagi kelangsungan hidup mikrofungi. Konsentrasi uji yang digunakan
adalah 75% (perlakuan A), 50% (perlakuan B), dan 25% limbah (perlakuan C).
Konsentrasi tersebut dibandingkan dengan kontrol, yang berupa 100% limbah
(perlakuan D).
Berdasarkan hasil pengamatan, ternyata semua limbah dengan
konsentrasi yang diujikan dapat mendukung viabilitas inokulan mikrofungi. Hal
Filum Kelas Ordo Famili Genus Spesies
Zygomycotaa Zygomycetesb Mucoralesb Mucoraceaeb
Mucorb
Trichodermab T.koningii
Acremoniumb A. strictum
Cephalosporiumb C. acremonium
ini dicirikan dengan keberadaan inokulan yang tetap bertahan di permukaan
media. Selain itu, mikrofungi uji mampu tumbuh pada media uji tersebut.
Mikrofungi yang diujikan adalah Abisidia spinosa (AS); Cephalosphorium acremonium (CA) dan Penicillium rugulosum (PR). Mikrofungi uji tersebut mengalami pertumbuhan hingga hari keempat. Berdasarkan persentase
penutupan pada tiap perlakuan limbah, pertumbuhan mikrofungi uji tersebut
berbeda. Pertumbuhan mikrofungi tertinggi didapatkan pada perlakuan A,
berturut-turut diikuti oleh perlakuan D, B, dan C. Persentase penutupan
mikrofungi pada hari keempat dapat dilihat pada Lampiran 5.
Lambatnya pertumbuhan mikrofungi pada perlakuan D diduga karena
tingginya konsentrasi bahan organik, sehingga mikrofungi sulit untuk
mendekomposisi bahan organik yang ada dalam waktu singkat. Di samping itu,
mikroorganisme uji dapat mengalami pertumbuhan yang lambat apabila media
hidup kurang sesuai untuk pertumbuhannya, seperti pada perlakuan B dan C. Hal
ini diduga karena berkurangnya konsentrasi bahan organik akibat pengenceran
yang lebih dari 25%.
Hasil analisis statistik menunjukkan bahwa perbedaan konsentrasi limbah
mempengaruhi pertumbuhan mikrofungi (p < 0,05) (Lampiran 6). Hal ini
ditunjukkan melalui nilai rata-rata persentase penutupan masing-masing jenis
mikrofungi pada masing-masing konsentrasi limbah yang berbeda.
Untuk menentukan konsentrasi yang berbeda nyata dalam memberikan
pengaruh terhadap pertumbuhan, dilakukan uji lanjut menggunakan uji Tukey.
Hasil analisis lanjut terhadap pertumbuhan mikrofungi jenis AS dan CA yang
ditumbuhkan pada perlakuan A dan D berbeda dari yang ditumbuhkan pada
perlakuan C dan B. Pertumbuhan mikrofungi jenis PR berbeda pada semua
perlakuan limbah.
Karena pada perlakuan A (75% limbah) terdapat pertumbuhan satu jenis
mikrofungi yang relatif tinggi, maka untuk penelitian utama digunakan
konsentrasi limbah 75%. Selain itu, berdasarkan hasil yang didapat secara visual,
Hari
ke-4.1.2. Penelitian utama
Kemampuan mikrofungi uji (Abisidia spinosa, Cephalosphorium
acremonium, Acremonium strictum, Penicillium rugulosum, dan Penicillium viridicatum) dalam mendekomposisi bahan organik pada limbah cair tahu dapat dilihat dari beberapa parameter kualitas air yang menggambarkan kandungan
bahan organik dan penurunannya selama waktu penelitian. Disamping itu juga
dapat dilihat pengaruh dari keberadaan bahan organik terhadap pertumbuhan
mikrofungi tersebut. Berikut hasil pengukuran beberapa parameter kualitas air
yang digunakan serta pertumbuhan mikrofungi yang diamati.
4.1.2.1. COD (Chemical Oxygen Demand)
Keberadaan bahan organik yang terdapat pada limbah cair tahu dapat
diketahui melalui Chemical Oxygen Demand (COD). Hasil pengukuran
konsentrasi COD serta persentase penurunannya pada berbagai jenis mikrofungi
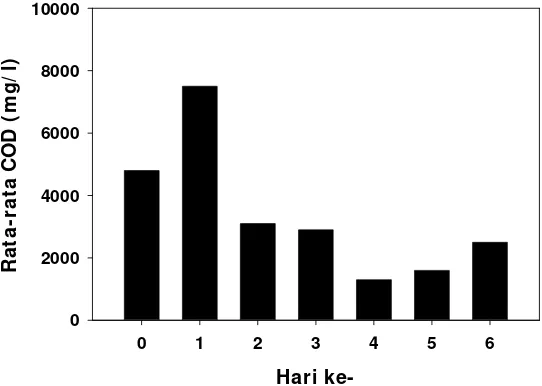
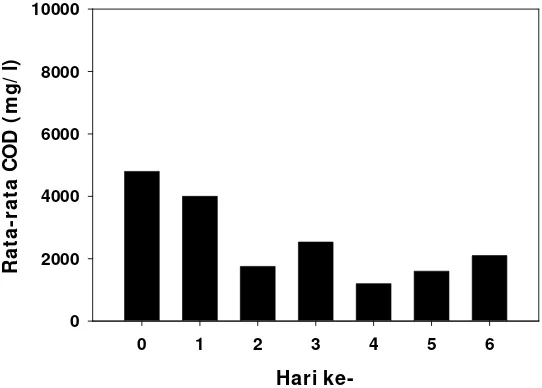
serta kontrol disajikan pada Lampiran 7. Perubahan konsentrasi COD antar waktu
pada masing-masing media (limbah cair tahu) dengan inokulan mikrofungi dan
tanpa inokulan mikrofungi diuraikan sebagai berikut.
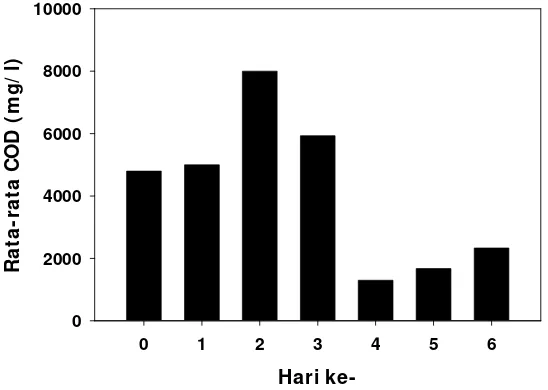
A. Konsentrasi COD pada media dengan inokulan Abisidia spinosa (AS)
Rata-rata konsentrasi COD antar waktu pada media dengan mikrofungi
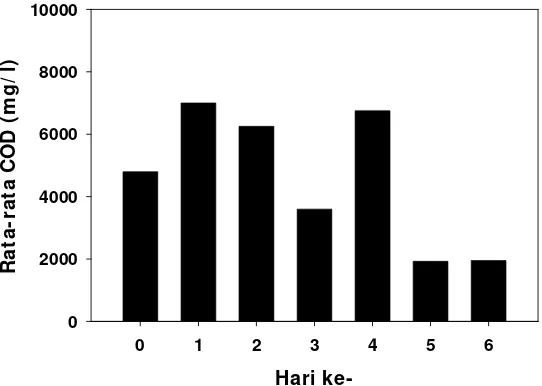
jenis AS berbeda nyata (p < 0,05) (Lampiran 8). Konsentrasi COD pada media
dengan inokulan AS berkisar 1925-7000mg/l, dengan konsentrasi terendah terjadi
pada H5 dan tertinggi pada H1 (Gambar 6).
Gambar 6. Rata-rata konsentrasi COD pada limbah cair tahu dengan mikrofungi