PERILAKU DIFUSI KETOPROFEN MELALUI
MEMBRAN KITOSAN-GOM GUAR
FERI NATA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERILAKU DIFUSI KETOPROFEN MELALUI
MEMBRAN KITOSAN-GOM GUAR
FERI NATA
Skripsi
sebagai salah satu syarat memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FERI NATA. Perilaku Difusi Ketoprofen Melalui Membran Kitosan-Gom Guar.
Dibimbing oleh PURWANTININGSIH SUGITA dan AHMAD SJAHRIZA.
Kemampuan kitosan untuk membentuk gel telah banyak dimodifikasi. Gel kitosan-gom guar berpotensi sebagai membran untuk digunakan dalam sistem pengantaran. Dalam penelitian ini, membran kitosan-gom guar digunakan dalam uji difusi ketoprofen. Membran kitosan-gom guar dibuat dengan mencampurkan 75 ml larutan kitosan 1.5% (b/v), 12.5 ml larutan gom guar 0.33% (b/v), dan 1.25 ml glutaraldehida 4.86%, yang
kemudian dituang ke dalam cetakan. Dibuat juga ragam ketebalan membran (h) dengan
meragamkan volume larutan kitosan yang digunakan. Setelah itu, membran digunakan
dalam uji difusi pada suhu (T) 37 dan 42 oC. Digunakan tiga tingkat konsentrasi sel donor
(Cd): 25, 50, dan 75 mg/l, sedangkan sel resipien diisikan pelarut. Untuk difusi pada T 37
o
C, alikuot diambil setelah difusi berlangsung 30, 60, 90, 120, 150, dan 180 menit.
Sementara untuk difusi pada T 42 oC, alikuot diambil setelah difusi berlangsung 20, 40,
60, 80, 100, dan 120 menit. Alikuot diukur serapannya pada panjang gelombang 258.6 nm.
Pengaruh T terhadap koefisien difusi dalam percobaan ini tidak nyata karena
jumlah dan besar rongga dalam membran yang beragam. Model yang diperoleh untuk
fluks (J) ketoprofen adalah J = 14.6207 + 0.165Cd − 0.398T – 0.2035h – 0.0007h2 −
0.0006Cdh− 0.007Th dengan nilai R2 = 98.4%.
ABSTRACT
FERI NATA. Diffusion Behavior of Ketoprofen Through Chitosan-Guar Gum
Membranes. Supervised by PURWANTININGSIH SUGITA and AHMAD
SJAHRIZA.
The ability of chitosan to form gel has been much modified. Chitosan-guar gum gels are potential for membranes to be used in drug delivery systems. In this research, chitosan-guar gum membranes were used in ketoprofen diffusion assay. Chitosan-guar gum membranes were prepared by mixing 75 ml 1.5% (b/v) chitosan solution, 12.5 ml 0.33% (b/v) guar gum solution, and 1.25 ml 4.86% glutaraldehyde solution, which was
then poured into a mold. Membranes thickness (h) was varied by varying the volume of
chitosan solution that was used. Then, the membranes were used in diffusion assay at
temperatures (T) 37 dan 42 oC. Three degrees of donor concentration (Cd) were used: 25,
50, dan 75 mg/l, whereas receptor compartment was filled with solvent. For diffusion at
37 oC, the aliquots were taken after 30, 60, 90, 120, 150, dan 180 minutes. Whereas for
diffusion at 42 oC, the aliquots were taken after 20, 40, 60, 80, 100, dan 120 minutes.
Absorbances of the aliquots were measured at 258.6 nm.
The influence of T on diffusion coefficient in this research was not significant due
to the varied number and size of hollow space in membranes. The obtained model for
ketoprofen flux (J) was J = 14.6207 + 0.165Cd − 0.398T – 0.2035h – 0.0007h2 −
Judul : Perilaku Difusi Ketoprofen Melalui Membran Kitosan-Gom Guar
Nama : Feri Nata
NIM : G44203002
Menyetujui,
Pembimbing I, Pembimbing II,
Dr. Purwantiningsih Sugita, MS Drs. Ahmad Sjahriza
NIP 131 779 513 NIP 131 842 413
Mengetahui:
Prof. Dr. Ir. Yonny Koesmaryono, MS
NIP 131 473 999
Tanggal lulus:
Kupersembahkan untuk Papa dan Mama yang telah mengajarkan nilai-nilai yang berharga
dan untuk para pendidik
PRAKATA
Puji syukur Penulis panjatkan kepada Allah Tritunggal atas segala berkat yang memampukan Penulis menyelesaikan karya ilmiah ini. Penelitian ini bertujuan mendapatkan model persamaan fluks ketoprofen sebagai fungsi dari konsentrasi ketoprofen dalam sel donor, suhu difusi, dan ketebalan membran, dan dilaksanakan sejak bulan Oktober 2006 sampai Mei 2007 di Laboratorium Kimia Organik dan Laboratorium Bersama, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu Penulis selama penelitian dan juga penyusunan karya ilmiah ini, terutama kepada Ibu Dr. Purwantiningsih Sugita, MS dan Bapak Drs. Ahmad Sjahriza selaku pembimbing yang selalu menyempatkan waktu untuk berkonsultasi; kepada Kak Budi Arifin, S.Si atas arahan-arahan yang sangat berharga selama Penulis menjalani penelitian; serta kepada Papa dan Mama yang selama ini telah berjuang keras agar Penulis bisa tetap sekolah sampai akhirnya dapat menyusun karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Pusat Studi Biofarmaka atas bantuannya dalam analisis FTIR dan pengering-bekuan sampel membran; kepada Bapak Dr. Ir. Ronny Rachman Noor, M.Rur.Cs atas bantuannya dalam analisis SEM; serta kepada Mba Siti Rahma dan para laboran di Kimia Organik atas bantuan teknisnya selama Penulis menjalani penelitian.
Pada kesempatan ini, Penulis juga mengucapkan terima kasih kepada Hibah Bersaing XIV Dikti dan Hibah Penelitian Internal Departemen Kimia sebagai sumber dana bagi penelitian ini.
Akhir kata, semoga karya ilmiah ini dapat bermanfaat.
Bogor, Juni 2007
RIWAYAT HIDUP
Penulis dilahirkan di Manggar, Belitung pada tanggal 25 Desember 1984 sebagai anak bungsu dari enam bersaudara dari pasangan Tet Tjong dan A Moij. Tahun 2003, Penulis lulus dari SMU Negeri 1 Manggar, dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) pada Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL………... viii
DAFTAR GAMBAR……….. viii
DAFTAR LAMPIRAN………... ix
PENDAHULUAN………... 1
TINJAUAN PUSTAKA Kitin dan Kitosan………. 1
Gel Kitosan………... 2
Gom Guar………. 3
Ketoprofen……… 3
Membran………... 4
Difusi Membran………...……… 4
BAHAN DAN METODE Bahan dan Alat……….……… 5
Pembuatan Kitosan ………...………... 5
Pengukuran Derajat Deasetilasi………... 5
Penentuan Bobot Molekul Kitosan ………...………….. 5
Pembuatan Membran Kitosan-Gom Guar ………...……… 5
Uji Difusi Membran Secara In Vitro ...………... 6
Pemodelan Fluks Ketoprofen... 6
HASIL DAN PEMBAHASAN Pencirian Kitosan………... 6
Pencirian Membran………... 6
Pengaruh Suhu Dfusi terhadap Koefisien Difusi...……… 9
Pemodelan Fluks Ketoprofen...……….. 10
SIMPULAN DAN SARAN Simpulan………... 12
Saran………... 12
DAFTAR PUSTAKA………. 12
DAFTAR TABEL
Halaman
1 Spesifikasi kitosan niaga... 2
2 Nilai D dan J yang didapatkan dari uji difusi... 9
DAFTAR GAMBAR
Halaman 1 Struktur kitin (R = -NHCOCH3) dan kitosan (R = -NH2)... 22 Struktur hidrogel kitosan: (a) ikatan silang kitosan-kitosan, (b) jaringan polimer hibrida, (c) jaringan semi-IPN, dan (d) kitosan berikatan silang ionik .. 3 3 Struktur gom guar... 3
4 Struktur ketoprofen... 4
5 Alat uji difusi... 6
6 Kitosan hasil isolasi... 6
7 Gel yang terbentuk pada proses pencampuran... 7
8 Membran kitosan-gom guar (a) kering; (b) basah... 7
9 Membran rapuh yang terbentuk dari campuran yang tidak homogen... 7
10 Foto SEM permukaan membran (a) yang belum diuji; (b) yang digunakan dalam uji difusi ke-9; (c) yang digunakan dalam uji difusi ke-25 pada perbesaran 7500 kali... 7
11 Foto SEM penampang melintang membran (a) yang belum diuji difusi; (b) yang digunakan dalam uji difusi ke-25 pada perbesaran 3500 kali... 8
12 Foto SEM permukaan membran (a) yang digunakan dalam uji difusi ke-9; (b) yang digunakan dalam uji difusi ke-25 pada perbesaran 5000 kali... 8
13 Kurva pengaruh T terhadap D ...……….... 10
14 Kurva pengaruh T terhadap D pada (a) Cd 25 mg/l dan h = 75-82.5 μm; (b) Cd 50 mg/l dan h = 75-88.5 μm………... 10
16 Kurva pengaruh Cddan h terhadap J pada T (a) 37 oC; (b) 42 oC……… 11
17 Kurva pengaruh T dan h terhadap J dengan Cd (a) 25 mg/l; (b) 75 mg/l……… 12
DAFTAR LAMPIRAN
Halaman 1 Diagram alir penelitian... 162 (a) Penetapan kadar air; (b) Penetapan kadar abu... 17
3 Metode pembuatan pereaksi... 17
4 Data hasil pengukuran kadar air dan abu kitin dan kitosan... 17
5 Penentuan bobot molekul kitosan... 18
6 Spektrum FTIR dan derajat deasetilasi kitin dan kitosan... 19
7 Analisis SEM... 20
PERILAKU DIFUSI KETOPROFEN MELALUI
MEMBRAN KITOSAN-GOM GUAR
FERI NATA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERILAKU DIFUSI KETOPROFEN MELALUI
MEMBRAN KITOSAN-GOM GUAR
FERI NATA
Skripsi
sebagai salah satu syarat memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FERI NATA. Perilaku Difusi Ketoprofen Melalui Membran Kitosan-Gom Guar.
Dibimbing oleh PURWANTININGSIH SUGITA dan AHMAD SJAHRIZA.
Kemampuan kitosan untuk membentuk gel telah banyak dimodifikasi. Gel kitosan-gom guar berpotensi sebagai membran untuk digunakan dalam sistem pengantaran. Dalam penelitian ini, membran kitosan-gom guar digunakan dalam uji difusi ketoprofen. Membran kitosan-gom guar dibuat dengan mencampurkan 75 ml larutan kitosan 1.5% (b/v), 12.5 ml larutan gom guar 0.33% (b/v), dan 1.25 ml glutaraldehida 4.86%, yang
kemudian dituang ke dalam cetakan. Dibuat juga ragam ketebalan membran (h) dengan
meragamkan volume larutan kitosan yang digunakan. Setelah itu, membran digunakan
dalam uji difusi pada suhu (T) 37 dan 42 oC. Digunakan tiga tingkat konsentrasi sel donor
(Cd): 25, 50, dan 75 mg/l, sedangkan sel resipien diisikan pelarut. Untuk difusi pada T 37
o
C, alikuot diambil setelah difusi berlangsung 30, 60, 90, 120, 150, dan 180 menit.
Sementara untuk difusi pada T 42 oC, alikuot diambil setelah difusi berlangsung 20, 40,
60, 80, 100, dan 120 menit. Alikuot diukur serapannya pada panjang gelombang 258.6 nm.
Pengaruh T terhadap koefisien difusi dalam percobaan ini tidak nyata karena
jumlah dan besar rongga dalam membran yang beragam. Model yang diperoleh untuk
fluks (J) ketoprofen adalah J = 14.6207 + 0.165Cd − 0.398T – 0.2035h – 0.0007h2 −
0.0006Cdh− 0.007Th dengan nilai R2 = 98.4%.
ABSTRACT
FERI NATA. Diffusion Behavior of Ketoprofen Through Chitosan-Guar Gum
Membranes. Supervised by PURWANTININGSIH SUGITA and AHMAD
SJAHRIZA.
The ability of chitosan to form gel has been much modified. Chitosan-guar gum gels are potential for membranes to be used in drug delivery systems. In this research, chitosan-guar gum membranes were used in ketoprofen diffusion assay. Chitosan-guar gum membranes were prepared by mixing 75 ml 1.5% (b/v) chitosan solution, 12.5 ml 0.33% (b/v) guar gum solution, and 1.25 ml 4.86% glutaraldehyde solution, which was
then poured into a mold. Membranes thickness (h) was varied by varying the volume of
chitosan solution that was used. Then, the membranes were used in diffusion assay at
temperatures (T) 37 dan 42 oC. Three degrees of donor concentration (Cd) were used: 25,
50, dan 75 mg/l, whereas receptor compartment was filled with solvent. For diffusion at
37 oC, the aliquots were taken after 30, 60, 90, 120, 150, dan 180 minutes. Whereas for
diffusion at 42 oC, the aliquots were taken after 20, 40, 60, 80, 100, dan 120 minutes.
Absorbances of the aliquots were measured at 258.6 nm.
The influence of T on diffusion coefficient in this research was not significant due
to the varied number and size of hollow space in membranes. The obtained model for
ketoprofen flux (J) was J = 14.6207 + 0.165Cd − 0.398T – 0.2035h – 0.0007h2 −
Judul : Perilaku Difusi Ketoprofen Melalui Membran Kitosan-Gom Guar
Nama : Feri Nata
NIM : G44203002
Menyetujui,
Pembimbing I, Pembimbing II,
Dr. Purwantiningsih Sugita, MS Drs. Ahmad Sjahriza
NIP 131 779 513 NIP 131 842 413
Mengetahui:
Prof. Dr. Ir. Yonny Koesmaryono, MS
NIP 131 473 999
Tanggal lulus:
Kupersembahkan untuk Papa dan Mama yang telah mengajarkan nilai-nilai yang berharga
dan untuk para pendidik
PRAKATA
Puji syukur Penulis panjatkan kepada Allah Tritunggal atas segala berkat yang memampukan Penulis menyelesaikan karya ilmiah ini. Penelitian ini bertujuan mendapatkan model persamaan fluks ketoprofen sebagai fungsi dari konsentrasi ketoprofen dalam sel donor, suhu difusi, dan ketebalan membran, dan dilaksanakan sejak bulan Oktober 2006 sampai Mei 2007 di Laboratorium Kimia Organik dan Laboratorium Bersama, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu Penulis selama penelitian dan juga penyusunan karya ilmiah ini, terutama kepada Ibu Dr. Purwantiningsih Sugita, MS dan Bapak Drs. Ahmad Sjahriza selaku pembimbing yang selalu menyempatkan waktu untuk berkonsultasi; kepada Kak Budi Arifin, S.Si atas arahan-arahan yang sangat berharga selama Penulis menjalani penelitian; serta kepada Papa dan Mama yang selama ini telah berjuang keras agar Penulis bisa tetap sekolah sampai akhirnya dapat menyusun karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Pusat Studi Biofarmaka atas bantuannya dalam analisis FTIR dan pengering-bekuan sampel membran; kepada Bapak Dr. Ir. Ronny Rachman Noor, M.Rur.Cs atas bantuannya dalam analisis SEM; serta kepada Mba Siti Rahma dan para laboran di Kimia Organik atas bantuan teknisnya selama Penulis menjalani penelitian.
Pada kesempatan ini, Penulis juga mengucapkan terima kasih kepada Hibah Bersaing XIV Dikti dan Hibah Penelitian Internal Departemen Kimia sebagai sumber dana bagi penelitian ini.
Akhir kata, semoga karya ilmiah ini dapat bermanfaat.
Bogor, Juni 2007
RIWAYAT HIDUP
Penulis dilahirkan di Manggar, Belitung pada tanggal 25 Desember 1984 sebagai anak bungsu dari enam bersaudara dari pasangan Tet Tjong dan A Moij. Tahun 2003, Penulis lulus dari SMU Negeri 1 Manggar, dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) pada Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL………... viii
DAFTAR GAMBAR……….. viii
DAFTAR LAMPIRAN………... ix
PENDAHULUAN………... 1
TINJAUAN PUSTAKA Kitin dan Kitosan………. 1
Gel Kitosan………... 2
Gom Guar………. 3
Ketoprofen……… 3
Membran………... 4
Difusi Membran………...……… 4
BAHAN DAN METODE Bahan dan Alat……….……… 5
Pembuatan Kitosan ………...………... 5
Pengukuran Derajat Deasetilasi………... 5
Penentuan Bobot Molekul Kitosan ………...………….. 5
Pembuatan Membran Kitosan-Gom Guar ………...……… 5
Uji Difusi Membran Secara In Vitro ...………... 6
Pemodelan Fluks Ketoprofen... 6
HASIL DAN PEMBAHASAN Pencirian Kitosan………... 6
Pencirian Membran………... 6
Pengaruh Suhu Dfusi terhadap Koefisien Difusi...……… 9
Pemodelan Fluks Ketoprofen...……….. 10
SIMPULAN DAN SARAN Simpulan………... 12
Saran………... 12
DAFTAR PUSTAKA………. 12
DAFTAR TABEL
Halaman
1 Spesifikasi kitosan niaga... 2
2 Nilai D dan J yang didapatkan dari uji difusi... 9
DAFTAR GAMBAR
Halaman 1 Struktur kitin (R = -NHCOCH3) dan kitosan (R = -NH2)... 22 Struktur hidrogel kitosan: (a) ikatan silang kitosan-kitosan, (b) jaringan polimer hibrida, (c) jaringan semi-IPN, dan (d) kitosan berikatan silang ionik .. 3 3 Struktur gom guar... 3
4 Struktur ketoprofen... 4
5 Alat uji difusi... 6
6 Kitosan hasil isolasi... 6
7 Gel yang terbentuk pada proses pencampuran... 7
8 Membran kitosan-gom guar (a) kering; (b) basah... 7
9 Membran rapuh yang terbentuk dari campuran yang tidak homogen... 7
10 Foto SEM permukaan membran (a) yang belum diuji; (b) yang digunakan dalam uji difusi ke-9; (c) yang digunakan dalam uji difusi ke-25 pada perbesaran 7500 kali... 7
11 Foto SEM penampang melintang membran (a) yang belum diuji difusi; (b) yang digunakan dalam uji difusi ke-25 pada perbesaran 3500 kali... 8
12 Foto SEM permukaan membran (a) yang digunakan dalam uji difusi ke-9; (b) yang digunakan dalam uji difusi ke-25 pada perbesaran 5000 kali... 8
13 Kurva pengaruh T terhadap D ...……….... 10
14 Kurva pengaruh T terhadap D pada (a) Cd 25 mg/l dan h = 75-82.5 μm; (b) Cd 50 mg/l dan h = 75-88.5 μm………... 10
16 Kurva pengaruh Cddan h terhadap J pada T (a) 37 oC; (b) 42 oC……… 11
17 Kurva pengaruh T dan h terhadap J dengan Cd (a) 25 mg/l; (b) 75 mg/l……… 12
DAFTAR LAMPIRAN
Halaman 1 Diagram alir penelitian... 162 (a) Penetapan kadar air; (b) Penetapan kadar abu... 17
3 Metode pembuatan pereaksi... 17
4 Data hasil pengukuran kadar air dan abu kitin dan kitosan... 17
5 Penentuan bobot molekul kitosan... 18
6 Spektrum FTIR dan derajat deasetilasi kitin dan kitosan... 19
7 Analisis SEM... 20
PENDAHULUAN
Kemampuan kitosan untuk membentuk gel telah banyak dimodifikasi. Wang et al. (2004) melaporkan pembentukan gel kitosan-polivinil alkohol (PVA) dengan glutaraldehida sebagai penaut-silang. PVA bertindak sebagai interpenetrating agent (IPN). PVA ditambahkan karena sifat mekaniknya yang lebih baik daripada kitosan dan dapat terurai secara alami. Hasil yang diperoleh menunjukkan penambahan PVA dapat memperbaiki sifat gel kitosan, yaitu menurunkan waktu gelasi dan meningkatkan kekuatan mekanis gel. Modifikasi gel kitosan juga dikembangkan dengan menambahkan hidrokoloid alami, di antaranya dengan karboksimetil selulosa (CMC) (Rachmanita 2006), alginat (Wahyono 2006), gom guar (Lestari 2006), dan gom xantan (Utomo 2006). Keempat modifikasi tersebut memiliki potensi untuk digunakan sebagai membran. Namun, gel kitosan yang terbentuk dengan penambahan gom guar memiliki sifat reologi yang lebih baik dibandingkan dengan modifikasi lainnya. Lestari (2006) melaporkan bahwa pada kondisi optimumnya, gel kitosan-gom guar memiliki kekuatan gel, titik pecah (break point), ketegaran (rigidity), pembengkakan (swelling), dan pengerutan (sineresis; shrinking) berturut-turut 553.439
g/cm2; 0.968 cm; 4.147 g/cm; 4.0772 g; dan 1.2738 g. Kondisi optimum yang sesuai untuk
pangantaran obat ini diperoleh dari hasil olah data dengan metode respons permukaan (RSM), yaitu pada konsentrasi glutaraldehida dan gom guar berturut-turut 4.86% dan 0.33% yang ditambahkan ke dalam larutan kitosan 2.5%.
Studi terhadap membran kitosan dan kitosan-termodifikasi telah banyak dilakukan, di antaranya sebagai membran ultrafiltrasi, osmosis balik, dan dialisis, serta untuk pemisahan protein,
pervaporasi, dan pemisahan isomer optik (Krajewska 2001). Dalam penelitian Cardenas et al.
(2003), juga telah dibuat gel kitosan dengan hidrokoloid alami alginat melalui pembentukan membran kompleks polielektrolit (PEC) yang berguna untuk bidang-bidang pangan, kosmetik, dan industri farmasi. Sementara gom guar sendiri telah dimanfaatkan sebagai pembawa untuk memperbaiki sistem pengantaran obat ke dalam usus besar untuk mengobati radang usus besar dan kanker usus besar (Kshirsagar 2000). Namun, membran dari gel kitosan-gom guar praktis belum pernah diteliti.
Gom guar, sebagai bahan saling-tembus (interpenetrating agent), diharapkan dapat menghasilkan gel kitosan dengan ciri-ciri yang lebih baik. Jaringan tiga dimensi terbentuk antara molekul kitosan dan gom guar pada seluruh volume gel, dan memerangkap sejumlah air di dalamnya. Sifat jaringan ini serta interaksi molekular yang mengikat keseluruhan gel menentukan kekuatan, stabilitas, dan tekstur gel. Untuk memperkuat jaringan internal gel biasanya digunakan molekul lain sebagai penaut-silang; dalam penelitian ini, digunakan glutaraldehida. Dengan sifat reologi yang baik, gel kitosan-gom guar (Lestari 2006) diharapkan dapat menghasilkan membran dengan efektivitas pengantaran substrat yang lebih baik dibandingkan dengan membran kitosan yang telah diteliti selama ini.
Ketoprofen adalah obat anti-peradangan kelompok nonsteroidal. Kelarutan ketoprofen dalam air rendah dan penggunaan dalam dosis tinggi dapat menyebabkan pendarahan pada lambung. Kelemahan-kelemahan tersebut diharapkan dapat teratasi dengan menyalut ketoprofen dalam mikrokapsul gel yang mampu mengatur pelepasan obat dalam tubuh (Tiyaboonchai et al. 2003 dan Yamada et al. 2001).
Tujuan penelitian ini adalah menyajikan perilaku difusi ketoprofen melalui membran kitosan-gom guar. Pengaruh suhu difusi (T) terhadap koefisien difusi (D) dikaji dengan metode regresi linear. Sementara fluks (J) ketoprofen dikaji dengan metode respons permukaan (RSM) dengan
faktor-faktor: konsentrasi ketoprofen dalam sel donor (Cd), suhu difusi (T), dan ketebalan
membran (h).
TINJAUAN PUSTAKA
O
R OH CH2OH
O
R OH CH2OH
O
O O
n
Kitin dan Kitosan
Kitin merupakan biopolimer polisakarida terbanyak kedua setelah selulosa. Struktur kimia kitin
berupa unit linear berulang dari 2-asetamido-2-deoksi-D-glukopiranosa yang berikatan β-(1→4)
(Gambar 1) (Thatte 2004). Kitin berupa padatan amorf berwarna putih yang hampir tidak larut dalam air, asam encer, dan basa. Kitin dapat terurai secara alami, tidak beracun, biokompatibel, serta tidak menimbulkan efek alergi, dengan sifat-sifat bahan yang unik dan sifat fungsional yang beragam.
Kitin berasal dari eksoskeleton krustasea, seperti kepiting, udang, dan lobster. Selain dari hewan-hewan tersebut, kitin juga dapat diperoleh dari serangga, jamur, dan cendawan yang jumlahnya beragam. Pada umumnya, kitin tidak berada dalam keadaan bebas, tetapi berikatan dengan protein, mineral, dan berbagai macam pigmen. Kulit udang sendiri mengandung 25–40%
protein, 40–50% CaCO3, dan 15–20% kitin. Jumlah setiap komponen tersebut masih bergantung
pada jenis udangnya (Purwantiningsih 1992).
Gambar 1 Struktur kitin (R = -NHCOCH3) dan kitosan (R = -NH2)
Kitosan merupakan kitin yang terdeasetilasi, yaitu modifikasi struktur kitin melalui hidrolisis gugus asetamido menggunakan larutan basa atau secara biokimia (Gambar 1). Protonasi gugus amino membuat kitosan bersifat polikationik pada suasana asam dan dapat membentuk gel di dalam lambung. Dengan struktur yang mirip selulosa dan kemampuannya membentuk gel dalam suasana asam, kitosan memiliki sifat-sifat sebagai matriks dalam sistem pengantaran obat (Sutriyo et al. 2005).
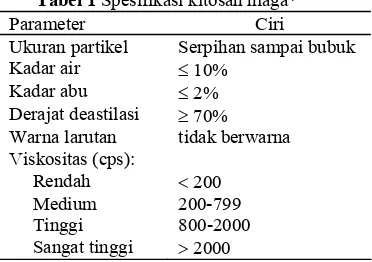
Sifat kitosan bergantung pada sumber (asal), derajat deasetilasi (DD), distribusi gugus asetil, gugus amino, panjang rantai, dan distribusi bobot molekul. Tabel 1 menampilkan spesifikasi untuk kitosan niaga.
Tabel 1 Spesifikasi kitosan niaga*
Parameter Ciri
Ukuran partikel Serpihan sampai bubuk
Kadar air ≤ 10%
Kadar abu ≤ 2%
Derajat deastilasi ≥ 70%
Warna larutan tidak berwarna
Viskositas (cps):
Rendah < 200
Medium 200-799
Tinggi 800-2000
Sangat tinggi > 2000
Pengukuran DD kitosan dapat dilakukan dengan menggunakan metode spektrofotometri turunan pertama, titrimetri dengan HBr, dan spektrofotometri inframerah transformasi Fourier (FTIR). Penentuan DD dengan metode FTIR relatif cepat dan tidak membutuhkan pelarutan kitosan dalam pelarut berair. Penyiapan kitosan, jenis instrumen yang digunakan, dan kondisi analisis akan memengaruhi hasil analisis (Khan et al. 2002).
Gel Kitosan
Gelasi atau pembentukan gel merupakan fenomena yang menarik dan sangat kompleks. Pada prinsipnya, pembentukan gel terjadi karena terbentuknya jaringan tiga dimensi dari molekul primer, yang terentang pada seluruh volume gel dan memerangkap sejumlah pelarut di dalamnya (Oakenfull 1984 dalam Nuraini 1994). Hal serupa juga dinyatakan oleh Tobolsky (1943) dalam Fardiaz (1989), yakni jika terjadi ikatan silang pada rantai-panjang polimer dalam jumlah yang cukup banyak, akan terbentuk bangunan tiga dimensi yang sinambung. Molekul pelarut akan terjebak di antaranya dan terimobilisasi sehingga terbentuk struktur kaku dan tegar yang tahan terhadap gaya atau tekanan tertentu. Glicksman (1984) dalam Fardiaz (1989) juga mengemukakan bahwa fenomena gelasi melibatkan penggabungan atau ikatan-silang antarrantai polimer.
Menurut Depkes (1995), gel merupakan sistem semipadat yang berupa suspensi partikel anorganik yang kecil atau molekul organik yang besar, yang terpenetrasi oleh suatu cairan. Gel yang dapat menahan air di dalam strukturnya disebut hidrogel (Wang et al. 2004). Air dalam gel ini merupakan tipe air imbibisi, yaitu air yang masuk ke dalam suatu bahan dan menyebabkan pengembangan volume, tetapi bukan merupakan komponen penyusun bahan tersebut (Winarno 1997). Hidrogel kitosan dapat digolongkan menjadi hidrogel kimia dan fisika. Hidrogel kimia dibentuk dari reaksi tidak dapat-balik, melibatkan ikatan silang secara kovalen. Sementara hidrogel fisika dibentuk oleh reaksi yang dapat-balik, dengan ikatan-silang terjadi secara ionik (Stevens 2001 dan Berger et al. 2004).
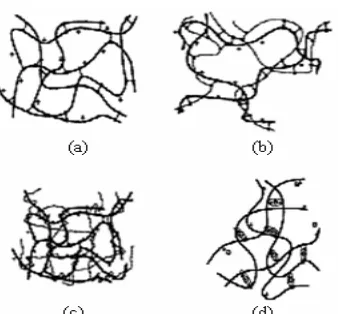
Ikatan-silang kovalen dalam hidrogel kitosan dapat dibedakan menjadi tiga bagian, yaitu (a) ikatan-silang kitosan-kitosan, (b) jaringan polimer hibrida (HPN, hybrid polymer network), dan (c)
jaringan polimer saling-tembus tanggung atau utuh (semi-IPN atau full-IPN, interpenetrating
polymer network) (Gambar 2). Sebagaimana tersirat dari namanya, ikatan silang kitosan-kitosan terjadi antara dua unit struktural pada rantai polimer kitosan yang sama, sementara pada HPN, reaksi penautan silang terjadi antara satu unit dari struktur rantai kitosan dan unit lain dari struktur polimer tambahan. Berbeda dengan HPN, semi-IPN, atau full-IPN terjadi jika ditambahkan polimer lain yang tidak bereaksi dengan larutan kitosan sebelum terjadi ikatan silang. Pada semi-IPN, polimer yang ditambahkan ini hanya melilit, sementara pada full-semi-IPN, ditambahkan dua senyawa penaut-silang yang terlibat pada jaringan (Berger et al. 2004).
Gambar 2 Struktur hidrogel kitosan: (a) ikatan silang kitosan-kitosan, (b) jaringan polimer hibrida, (c) jaringan semi-IPN, dan (d) kitosan berikatan silang ionik (Berger et al. 2004).
Gom Guar
Gom adalah molekul berbobot molekul tinggi yang bersifat koloid (berukuran 10−1000 Å), dan
dalam bahan pengembang yang sesuai dapat membentuk gel, larutan, atau suspensi kental pada konsentrasi sangat rendah (Whistler 1973 dalam Nasution 1999). Selain sebagai bahan pengental dan pembentuk gel, gom mempunyai banyak sifat fungsional sekunder yang berguna bagi produk pangan. Sifat-sifat fungsional tersebut di antaranya adalah sebagai perekat, penaut, penghambat kristalisasi es, penjernih, pengeruh, pelapis, pengemulsi, pembentuk film, pemantap buih, koloid pelindung, pemantap, pensuspensi, dan penghambat pengerutan (Fardiaz 1989).
Gom guar merupakan gom biji yang diperoleh dari biji tanaman Legominos, Cyamopsis
tetragonolobus, dan Cyamopsis psoraloides yang ditemukan di barat laut India dan Pakistan (Nussinovitch 1997). Pengolahan yang dilakukan meliputi pemisahan secara mekanik terhadap kulit biji, lalu lembaganya dibuang, dan endosperma yang mengandung gom digiling menjadi tepung halus (Fardiaz 1989). Dilihat dari strukturnya, gom guar merupakan galaktomanan yang
terdiri atas D-galaktosa yang berikatan α-(1→6) dengan rantai tulang punggung 1,4-β
-D-manopiranosa (Gambar 3) (Chaplin 2005).
HO
H
H
O H
HO H OH CH2OH
H O
O
O CH2
O H
H
CH2OH
H H H OH HO O
H
H HO
H H OH H
n
Gom guar tidak bermuatan sehingga tidak terpengaruh oleh pH dan sangat efektif dalam produk-produk asam. Gom ini juga bersifat kompatibel dengan hampir semua hidrokoloid; secara khusus dengan karaginan atau gom xantan, dapat terjadi interaksi sinergis. Interaksi gom guar tidak menghasilkan gel, tetapi hanya meningkatkan kekentalan, karena derajat substitusi rantai tulang punggungnya yang tinggi mengurangi interaksi (Fardiaz 1989). Gom guar juga telah dimanfaatkan sebagai pembawa untuk memperbaiki sistem pengantaran obat ke dalam usus besar untuk mengobati radang usus besar dan kanker usus besar (Kshirsagar 2000).
Ketoprofen
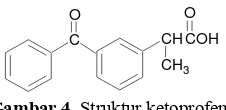
Ketoprofen [asam 2-(3-benzoilfenil)propanoat; Mr = 254.3 g mol
-1
] berupa serbuk hablur yang putih atau hampir putih dan tidak berbau. Zat ini mudah larut dalam etanol, kloroform, dan eter, tetapi taklarut dalam air. Suhu leburnya berkisar antara 93 dan 96 ºC (US Pharmacopeia and National Formulary 2003). Struktur ketoprofen dapat dilihat pada Gambar 4.
C O
CH
CH3
COH O
Gambar 4 Struktur ketoprofen.
Ketoprofen merupakan zat anti peradangan non-steroid (NSAID) dengan daya analgesik, anti-peradangan, dan antipiretik yang bekerja menghambat sintesis prostaglandin. Ketoprofen dieliminasi melalui ginjal. Dosis oral ketoprofen bagi penderita rheumatoid arthritis dan osteo-arthritis adalah 75 mg, 3 kali sehari atau 50 mg, 4 kali sehari (American Medical Association 1991).
Ketoprofen memiliki waktu paruh eliminasi yang kecil dalam plasma darah, yaitu sekitar 1.5-2 jam. Konsentrasi ketoprofen yang bertahan dalam plasma darah setelah 24 jam hanya sekitar 0.07 mg/l. Sementara, konsentrasi maksimum yang dapat dicapai sendiri jauh lebih besar daripada konsentrasi terapi, yaitu 15-25 mg/l. Oleh karena itu, ketoprofen perlu dimikroenkapsulasi untuk memperbaiki pengantaran dalam tubuh (Patil et al. 2005).
Membran
Membran merupakan film tipis yang sering digunakan dalam ultrafiltrasi, osmosis balik, dialisis, pemisahan protein, pervaporasi, dan pemisahan isomer optik. Studi terhadap sifat difusi dari berbagai substrat dan kekuatan fisik dari suatu membran sangat penting bagi pengembangan sistem pelepasan substrat terkendali yang menggunakan membran hidrogel. Sifat difusi pada membran kitosan dapat diatur oleh derajat penautan-silang dengan glutaraldehida dan imobilisasi protein (Krajewska 2001).
Cardenas et al. (2003) melaporkan pembentukan membran kompleks polielektrolit
Membran-membran ini digunakan dalam industri pangan, kosmetik, dan farmasi karena kemampuannya membentuk gel dengan adanya kation divalen (Gaseca 1988 dalam Cardenas et al. 2003).
Difusi Membran
Kecepatan difusi partikel terlarut melalui membran diukur untuk menentukan fungsi membran tersebut (Krajewska 2001). Jika tidak terdapat interaksi kimia antara partikel terlarut dan membran, maka difusi partikel terlarut tersebut melalui membran hidrogel dapat digambarkan oleh persamaan Fick (Martin 1993):
dt S
dM J
⋅
= (1)
dx dC D
J =− (2)
h C C DK dt S dM
J = ( d− r) ⋅
= (3)
dengan J adalah fluks partikel terlarut (g cm-2 det-1), M adalah massa partikel terlarut yang
berdifusi (g), S adalah luas permukaan membran (cm2), t adalah waktu difusi (det),
dt
dM adalah
kemiringan kurva hubungan jumlah partikel terlarut yang melewati membran dengan waktu difusi
(kurva difusi), Cd adalah konsentrasi partikel terlarut dalam sel donor (g cm-3), Cr adalah
konsentrasi partikel terlarut dalam sel resipien (g cm-3), K adalah koefisien partisi partikel terlarut,
dan h adalah ketebalan membran (cm).
Beberapa asumsi digunakan untuk memudahkan penentuan parameter difusi, yaitu (a) nilai K
dianggap sama dengan satu ketika kedua sel difusi diaduk homogen dan (b) nilai (Cd− Cr)≈Cr
selama uji difusi. Dengan dua asumsi ini, Persamaan 3 menjadi
h DSC dt
dM = d (4)
d SC dt h dM D ⋅ ⋅
= (5)
Plot jumlah ketoprofen yang memasuki sel resipien terhadap waktu difusi akan menghasilkan nilai
dt
dM sehingga nilai D dan J dapat dihitung.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah kulit udang pancet yang dibeli dari Muara Angke Jakarta Utara, NaOH teknis, HCl teknis, kertas indikator pH universal, asam asetat teknis, gom guar, glutaraldehida 25%, etanol teknis, etanol absolut, air suling, dan ketoprofen yang diperoleh dari PT Kalbe Farma.
Pembuatan Kitosan (Lestari 2006)
Kulit udang dibersihkan, dikeringkan, dan dipotong-potong kecil. Sebanyak 50 g kulit udang dimasukkan dalam gelas piala yang dilengkapi pengaduk, termometer, dan lempeng pemanas. Setelah itu, ke dalam gelas piala ditambahkan 1000 ml larutan NaOH 3.5% [1:20 (w/v)] untuk
proses deproteinasi. Proses ini dilakukan selama 2 jam pada suhu 65 oC. Residu dicuci dengan
menggunakan akuades sampai pH 7, kemudian dikeringkan dalam oven bersuhu 70 oC.
Residu bebas-protein didemineralisasi dengan menambahkan larutan HCl 3.5% dengan nisbah residu:larutan HCl 3.5% 1:20. Proses ini dilakukan pada suhu kamar selama 2 jam sambil terus diaduk. Residu dicuci dengan menggunakan akuades sampai pH 7 kemudian dikeringkan dalam
oven bersuhu 70 oC. Residu hasil pemisahan ini adalah kitin.
Kitin diubah menjadi kitosan melalui deasetilasi. Sebanyak 50 g kitin dimasukkan ke dalam gelas piala kemudian ditambahkan 1000 ml larutan NaOH 50% (1:20) dan dipanaskan pada suhu
100 oC selama 4 jam sambil terus diaduk. Residu dicuci dengan menggunakan akuades sampai pH
7 kemudian dikeringkan dalam oven bersuhu 70 oC. Residu dari proses ini disebut kitosan.
Pengukuran Derajat Deasetilasi (Domszy & Robert 1985 dalam Khan et al. 2002)
Kitosan yang diperoleh diukur derajat deasetilasinya (DD) menggunakan metode garis-dasar. Kitin dan kitosan dianalisis dengan FTIR. Jika DD kitosan kurang dari 70%, maka proses deasetilasi diulangi sampai DD lebih dari 70%.
Puncak serapan tertinggi dicatat dan diukur dari garis dasar yang dipilih. Nilai absorbans dapat dihitung dengan menggunakan persamaan berikut
A = log
P
P0 (6)
P0 = % transmitans pada puncak maksimum
P = % transmitans pada puncak minimum
Kitin yang terdeasetilasi sempurna (100%) memiliki nilai A1655 = 1.33. Dengan
membandingkan absorbans pada bilangan gelombang 1655 cm-1 (serapan pita amida I) dengan
absorbans pada bilangan gelombang 3450 cm-1 (serapan gugus hidroksil), maka DD dapat dihitung
dengan persamaan berikut
DD (%) = 100%
33 . 1 1 1 3450
1655 ⎥×
⎦ ⎤ ⎢ ⎣ ⎡ ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ × − A
A (7)
Penentuan Bobot Molekul Kitosan (Tarbojevich & Cosani 1996)
Bobot molekul kitosan ditentukan dengan menggunakan viskometer Ostwald-Cannon-Fenske. Dibuat ragam konsentrasi larutan kitosan dalam asam asetat 0.5 M, yaitu 0, 0.02, 0.04, 0.06, dan 0.08% (b/v). Sebanyak 5 ml dan dimasukkan ke dalam viskometer untuk ditentukan waktu alirnya.
Waktu alirnya dibaca sebanyak tiga kali. Kemudian, dibuat kurva hubungan antara lnηsp/c dan C
sehingga didapatkan persamaan
lnηsp/c = ln[η] + KM [η]
2
C (8) [η] = KMa (9)
dengan K = 3.5 × 10-4 dan a = 0.76. Dengan metode regresi linear, akan diperoleh nilai ln[η]
sebagai intersep (a), KM[η]2 sebagai kemiringan (b), dan koefisien regresi (r).
Sebanyak 75 ml larutan kitosan 1.5% ditambahkan 12.5 ml larutan gom guar dengan konsentrasi 0.33% (b/v) sambil diaduk sampai homogen. Kemudian ditambahkan 1.25 ml glutaraldehida 4.86% secara perlahan-lahan sambil terus diaduk. Larutan terus diaduk sampai 10 menit setelah penambahan glutaraldehida. Larutan yang terbentuk dituangkan ke atas cetakan
berukuran 21.40 × 28.25 cm2 pada suhu ruang. Pelarut dibiarkan menguap pada suhu ruang dan
diperoleh membran yang kering. Membran dilepaskan dari cetakan dengan menambahkan larutan NaOH 1 M ke atas membran. Pekerjaan ini diulang dengan meragamkan volume kitosan untuk memperoleh membran dengan ketebalan yang berbeda.
Uji Difusi Membran Secara In Vitro (Brazel & Peppas 2000 dan Peppas et al. 2000)
Pada salah satu sel difusi diisikan larutan berisi larutan ketoprofen dengan konsentrasi 25, 50
dan 75 μg/ml, sementara pada sel lain diisikan pelarut. Alat difusi ini kemudian diletakkan dalam
penangas air bersuhu 37 dan 42 oC untuk menjaga agar suhu sistem konstan. Pengadukan dibantu
oleh aerator yang dipasang pada kedua sel difusi (Gambar 5). Selanjutnya alikuot diambil dari sel yang berisi pelarut untuk diukur konsentrasi ketoprofennya menggunakan spektrofotometer UV/Vis setelah difusi berlangsung 20, 40, 60, 80, 100, dan 120 menit untuk uji difusi pada suhu 42
o
C, sementara untuk uji difusi pada suhu 37 oC, alikuot diambil setelah difusi berlangsung 30, 60,
90, 120, 120, 150, dan 180 menit.
Gambar 5 Alat uji difusi
Pemodelan Fluks Ketoprofen
Model hubungan matematik fluks ketoprofen (J) diturunkan dengan menggunakan metode respons permukaan (RSM) dalam peranti lunak Minitab Release 14 dengan faktor-faktor:
konsentrasi ketoprofen dalam sel donor (Cd), suhu difusi (T), dan ketebalan membran (h).
Keluaran pemodelan ini adalah persamaan dan bentuk respons permukaan secara tiga dimensi.
HASIL DAN PEMBAHASAN
Pencirian Kitosan
Hasil pencirian kitosan hasil isolasi (Gambar 6) dengan parameter kadar air, kadar abu, bobot
molekul, dan derajat deasetilasi adalah berturut-turut 5.59%, 0.12% (Lampiran 5), 1.18 × 104 g
mol-1 (Lampiran 6), dan 74.02% (Lampiran 7). Kadar air ini memenuhi persyaratan spesifikasi
dikurangi (Winarno 1997). Hal ini menjamin kitosan hasil isolasi memiliki kualitas yang sama selama masa penelitian. Nilai derajat deasetilasi juga memenuhi syarat spesifikasi kitosan niaga,
yaitu ≥ 70% (Tabel 1).
Gambar 6Kitosan hasil isolasi
Pencirian Membran
Kondisi optimum gel kitosan-gom guar yang dikembangkan oleh Lestari (2006), yaitu 30 ml larutan kitosan 2.5% dicampur dengan 5 ml larutan gom guar 0.33%, dan 1 ml larutan glutaraldehida 4.86% tidak dapat digunakan untuk pembuatan membran dengan menggunakan kitosan hasil isolasi. Campuran membentuk gel dengan sangat cepat sehingga tidak dapat dituang ke cetakan untuk dibuat membran (Gambar 7). Hal ini disebabkan kitosan hasil isolasi dalam
penelitian ini memiliki bobot molekul (1.18 × 104 g mol-1) lebih besar dibandingkan kitosan yang
digunakan oleh Lestari (2006) (1.53 × 103 g mol-1) sehingga pada konsentrasi yang sama kitosan
ini lebih kental dan lebih cepat mengegel. Oleh karena itu, membran yang digunakan dalam penelitian ini dibuat dengan konsentrasi kitosan yang lebih rendah, yaitu 1.5% (Gambar 8).
Gambar 7 Gel yang terbentuk pada proses pencampuran
Gambar 8 Membran kitosan-gom guar (a) kering; (b) basah
Membran yang dihasilkan akan semakin kuat jika ketiga komponen pembentuk gel bercampur semakin baik. Membran yang terbentuk dari campuran yang kurang homogen bersifat sangat rapuh (Gambar 9).
Gambar 9 Membran rapuh yang terbentuk dari campuran yang tidak homogen
Tabel 2 menampilkan ragam ketebalan membran yang digunakan dalam uji difusi. Sementara
luas permukaan membran yang membatasi cairan sel donor dan sel resipien tetap, yaitu 16.11 cm2.
Porositas Membran
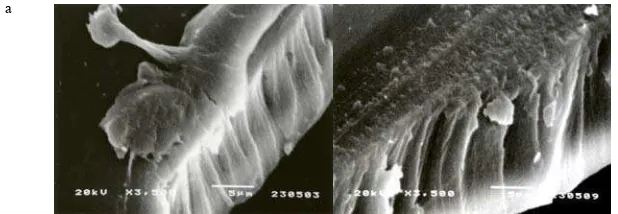
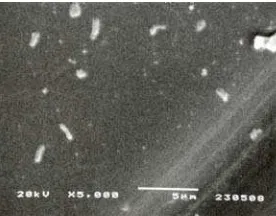
Foto-foto SEM pada Gambar 10 dengan jelas bahwa membran kitosan-gom guar yang terbentuk tidak memiliki pori ataupun porositas yang merata. Secara mikroskopik, pada perbesaran 7500 kali, permukaan membran yang belum diuji difusi tidak memiliki pori-pori (Gambar 10a).
Sementara, membran yang telah digunakan dalam uji difusi ke-9 (Cd = 75 mg/l; T = 37
o
C; h = 31
μm) hanya memiliki lubang-lubang dangkal yang tak menembus membran (Gambar 10b). Karena
[image:30.612.148.461.436.648.2]itu, diduga ikatan silang yang terbentuk antarmolekul kitosan sangat rapat. Lubang-lubang kecil yang terjadi pada membran yang digunakan dalam uji difusi ke-9 sendiri diduga terjadi akibat pembengkakan membran yang didukung oleh adanya gaya dorong akibat perbedaan konsentrasi ketoprofen dan juga pemuaian akibat meningkatnya suhu.
Gambar 10 Foto SEM permukaan membran (a) yang belum diuji; (b) yang digunakan dalam uji
difusi ke-9; (c) yang digunakan dalam uji difusi ke-25 pada perbesaran 7500 kali b
a
Hasil pengamatan terhadap penampang melintang membran juga menunjukkan hal yang serupa (Gambar 11). Terlihat bahwa membran memiliki rongga pada bagian dalam. Namun, seperti ditunjukkan pada Gambar 10a, rongga ini tidak sampai menembus permukaan membran. Pembengkakan membran menyebabkan rongga ini menjadi lebih besar (Gambar 11b) dan pori-pori membran yang merupakan terusan dari rongga tersebut menjadi terbuka (Gambar 10c).
Gambar 11 Foto SEM penampang melintang membran (a) yang belum diuji difusi; (b) yang
digunakan dalam uji difusi ke-25 pada perbesaran 3500 kali
Pembengkakan membran diduga lebih mudah terjadi dengan meningkatnya suhu. Hal ini didukung oleh hasil pengamatan terhadap permukaan membran yang telah digunakan dalam uji
difusi ke-25 (Cd = 75 mg/l; T = 42
o
C; h = 35 μm) yang menjadi berpori, lebih bergelombang, dan
lebih kasar (Gambar 10c). Namun, nilai fluks ketoprofen untuk kedua uji difusi tersebut menunjukkan hasil yang berkebalikan (Tabel 2). Nilai fluks ketoprofen pada difusi ke-9 (15.001 g
cm-2 det-1) lebih besar daripada nilai fluks ketoprofen pada difusi ke-25 (10.6559 g cm-2 det-1). Hal
ini diduga karena membran yang digunakan untuk kedua uji difusi tesebut tidak memiliki jumlah dan besar rongga yang seragam sehingga porositas yang terjadi akibat pembengkakan pun tidak seragam. Lagipula porositas yang terjadi tidak merata pada seluruh permukaan membran. Hal ini dibuktikan oleh hasil pengamatan terhadap membran yang sama, tetapi pada daerah yang berbeda (Gambar 12). Pada daerah yang berbeda dari yang ditampilkan pada Gambar 10b dan 10c, membran yang digunakan dalam uji difusi ke-9 (Gambar 12a) tidak memiliki lubang-lubang kecil, serta membran yang digunakan dalam uji difusi ke-25 tidak memiliki pori-pori (Gambar 12b). Kemungkinan besar membran yang digunakan dalam uji difusi ke-9 memiliki jumlah rongga yang lebih banyak.
a
b
Gambar 12 Foto SEM permukaan membran (a) yang digunakan dalam uji difusi ke-9; (b) yang digunakan dalam uji difusi ke-25 pada perbesaran 5000 kali
Menurut Lestari (2006), pembengkakan gel kitosan-gom guar pada kondisi optimumnya adalah 4.0772 g/g gel. Membran yang digunakan dalam penelitian ini diharapkan memiliki pembengkakan membran yang serupa dengan gel Lestari (2006), karena modifikasi komposisi dalam pembuatan membran hanya dilakukan pada konsentrasi kitosan dan volume larutan glutaraldehida yang digunakan. Penurunan konsentrasi kitosan sendiri dilakukan karena kitosan yang digunakan memiliki bobot molekul yang lebih besar.
Proses pembukaan pori-pori yang unik ini sangat baik untuk digunakan dalam pengantaran obat, misalnya mikroenkapsulasi obat dengan penyalut gel kitosan-gom guar. Proses pembengkakan membran ini dapat membuat obat terlepas ketika mikrokapsul berinteraksi dengan cairan di dalam tubuh.
Pengaruh Suhu Difusi terhadap Koefisien Difusi
Tabel 2 menampilkan koefisien difusi (D) dan fluks (J) ketoprofen sebagai hasil uji difusi. Kedua parameter ini diturunkan dari persamaan matematis Hukum Fick (Persamaan 1-5) dengan memanfaatkan hubungan linear antara waktu pengambilan alikuot dan jumlah ketoprofen yang memasuki sel pelarut.
Ditilik dari Persamaan 5, nilai D seharusnya tidak terpengaruh oleh Cd dan h. Namun, nilai D
bergantung pada T karena kecepatan gerak partikel meningkat dengan naiknya T. Selain itu,
pemuaian membran yang mungkin terjadi dengan meningkatnya T dapat menyebabkan
[image:32.612.133.512.608.679.2]pembengkakan membran lebih cepat dan pori-pori yang terbentuk lebih besar. Menurut Anson & Northrop (1936), nilai D berhubungan linear dengan T. Nilai D NaCl, KCl, dan HCl dilaporkan meningkat dengan naiknya suhu. Hubungan linear ini bahkan digunakan dalam kalibrasi membran difusi. Cardenas et al. (2003) juga melaporkan peningkatan D pada membran polielektrolit kitosan-alginat dengan meningkatnya T. Namun, membran hidrogel yang sensitif-suhu memiliki nilai suhu larutan kritis yang lebih rendah (LCST). Pada suhu di bawah LCST, membran hidrogel tersebut menyerap air dan berada dalam keadaan membengkak dan memiliki koefisien difusi yang tinggi. Sementara pada suhu di atas LCST, membran mengerut sehingga koefisien difusinya rendah (Huang et al. 2006).
Tabel 2 Nilai D dan J yang didapatkan dari uji difusi
No. Difusi ke- Cd (mg/l) T (oC) h (μm) D × 106 (cm2/det) J × 109 (g/cm2det)
1 1 25 37 28.5 0.401 3.5175c
2 2 25 37 32.5 0.6052 4.6555
3 3 25 37 57.5 1.2373 5.3797c
4 4 25 37 57 0.9199 4.0348
5 15 25 37 79 0.9481 3.0002
11 35 25 42 78 1.2266 3.9313
12 36 25 42 82.5 0.9901 3.0002
13 5 50 37 34 0.5347 7.8626
14 6 50 37 36 0.581 8.0695
15 7 50 37 64 0.9534 7.4488
16 8 50 37 60 0.9187 7.6557
17 17 50 37 82.5 0.9047 5.4831
18 18 50 37 75 0.8535 5.69
19 19 50 42 27 0.4246 7.8626
20 20 50 42 31 0.5452 8.7937c
21 21 50 42 61.5 0.7508 6.1039c
22 22 50 42 55.5 0.8727 7.8626
23 23 50 42 83 1.3395 8.0695c
24 24 50 42 88.5 1.0621 6.0004
25 9 75 37 31 0.62 15.001c
26 10 75 37 34.5 0.552 12.0008
27 11 75 37 55 0.7966 10.8628
28 12 75 37 54 0.8492 11.7939c
29 13 75 37 77 0.9134 8.8972
30 14 75 37 72.5 0.8501 8.7937
31 25 75 42 35 0.4973 10.6559
32 26 75 42 37.5 0.5483 10.9663
33 27 75 42 58.5 0.8392 10.7594
34 28 75 42 57.5 0.809 10.5525
35 29 75 42 91 1.0419 8.5868
36 30 75 42 84.5 0.8859 7.8626c
c
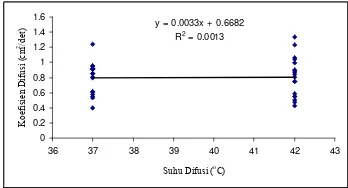
[image:33.612.143.504.81.418.2]Tidak dimasukkan dalam pemodelan RSM karena memiliki galat yang relatif besar Gambar 13 menampilkan kurva pengaruh
T terhadap D. Terlihat pengaruh T terhadap
nilai D sangat tidak nyata. Hasil analisis
parameter statistik, t dan P, menunjukkan T
hanya berpengaruh nyata pada tingkat kepercayaan 12.7%. Hal ini diduga karena ketidakseragaman jumlah rongga dalam setiap membran yang digunakan, meskipun untuk menegaskan ini, diperlukan analisis mikroskopi elektron transmisi (TEM). Membran yang memiliki jumlah rongga lebih banyak akan menghasilkan porositas yang lebih tinggi ketika terjadi pembengkakan sehingga akan memiliki nilai D lebih besar meskipun pada T yang lebih rendah. Schmidt et al. (2005) melaporkan permeabilitas uap air melewati membran poliuretan sebanding dengan porositas membran. Goosen et al. (2004) juga melaporkan ketidaklinearan pengaruh suhu terhadap fluks permeasi larutan
NaCl pada rentang suhu 20-40 oC. Fluks
permeasi larutan NaCl didapatkan paling
tinggi pada suhu 40 oC, tetapi fluks permeasi
pada suhu 20 oC lebih tinggi dibandingkan
pada suhu 30 oC. Goosen et al. (2004)
menambahkan bahwa perilaku ini disebabkan
oleh perubahan sifat fisik membran, seperti ukuran pori atau difusivitas pelarut dalam membran. Selain itu, sedikitnya ragam suhu dalam percobaan ini menyebabkan data yang diperoleh kurang dapat menjelaskan pengaruh T dengan jelas. Ragam suhu dalam percobaan ini dirancang sesuai dengan suhu tubuh
manusia pada keadaan normal (37 oC) dan
sakit (42 oC) sehingga hanya dua ragam suhu
yang dicobakan.
y = 0.0033x + 0.6682 R2 = 0.0013
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
36 37 38 39 40 41 42 43 Suhu Difusi (oC)
[image:33.612.330.504.546.640.2]Ko e fi si e n D ifu si ( c m 2/d et )
Gambar 13 Kurva pengaruh T terhadap D
donor yang tinggi. Perubahan ini juga bergantung pada suhu, tekanan, sifat pelarut, dan sifat kimia difusan. Selain itu, penentuan
nilai D dengan Persamaan 5 menyebabkan
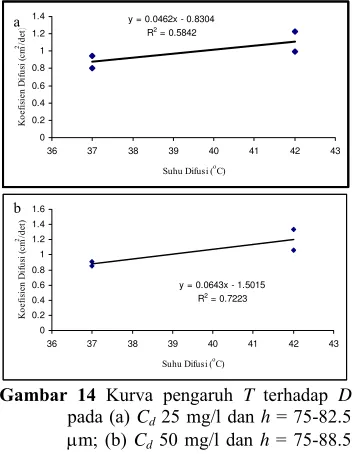
nilai D sebanding dengan h. Perubahan nilai h sangat mempengaruhi nilai D pada persamaan ini. Dengan menganggap sama ketebalan membran pada difusi ke-5, ke-6, ke-11, dan ke-12, dapat dibuat kurva pengaruh T terhadap
D dengan nilai Cd 25 mg/l dan h = 75-82.5 μm
(Gambar 15a). Asumsi yang sama pada difusi ke-17, ke-18, ke-23, dan ke-24 digunakan untuk mendapatkan kurva pengaruh T
terhadap D pada Cd 50 mg/l dan h = 75-88.5
μm (Gambar 15b). Pada kedua kurva ini,
pengaruh Cd dan h dihilangkan sehingga
diharapkan nilai D sebanding dengan T. Terlihat nilai D meningkat dengan naiknya T.
Namun, pada tingkat Cd dan h yang lain
ditemukan hubungan yang kurang baik antara T dan D.
y = 0.0462x - 0.8304 R2 = 0.5842
0 0.2 0.4 0.6 0.8 1 1.2 1.4
36 37 38 39 40 41 42 43 Suhu Difusi (o
C) Ko e fi si e n D ifu si ( c m 2/d et )
y = 0.0643x - 1.5015 R2 = 0.7223
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
36 37 38 39 40 41 42 43 Suhu Difusi (oC)
[image:34.612.133.311.381.608.2]Ko e fi si e n D ifu si ( c m 2/d et )
Gambar 14 Kurva pengaruh T terhadap D
pada (a) Cd 25 mg/l dan h = 75-82.5
μm; (b) Cd 50 mg/l dan h = 75-88.5
μm
Pemodelan Fluks Ketoprofen
Persamaan J yang diperoleh dari metode
respons permukaan adalah J = 14.6207 +
0.165Cd − 0.398T – 0.2035h – 0.0007h2 −
0.0006Cdh − 0.007Th dengan nilai R2 =
98.4%. Dengan nilai R2 = 98.4%, persamaan
h, h, Cdh, dan Th dalam persamaan J
memiliki nilai P<0.01, yang berarti terminologi-terminologi tersebut memberikan pengaruh nyata pada tingkat kepercayaan
99%.
Pengaruh Konsentrasi Ketoprofen dalam Sel Donor terhadap Fluks Ketoprofen
Ditilik dari Persamaan 3 dan 6, nilai J
sebanding dengan nilai Cd karena kenaikan
laju difusi sebanding dengan kenaikan Cd
sehingga diharapkan nilai J meningkat dengan
meningkatnya Cd. Hal ini disebabkan gaya
dorong yang tercipta akibat perbedaan Cd dan
Cr lebih besar. Dengan lebih besarnya gaya
dorong ini, membran akan lebih terdesak, sehingga proses pembengkakan membran akan lebih mudah, dan molekul ketoprofen lebih mudah melewati membran. Hal ini sejalan dengan yang didapatkan dalam percobaan. Gambar 15 dan 16 menunjukkan
nilai J cenderung meningkat dengan
meningkatnya Cd.
Liu et al. (2002) melaporkan hubungan
linear antara fluks tetrametilpirazina dengan konsentrasi sel donor. Sutariya et al. (2005) juga melaporkan hal yang serupa untuk permeasi salbutamol sulfate. Hubungan linear
antara J dan Cd menunjukkan proses yang
terjadi adalah difusi pasif.
Pengaruh Suhu Difusi terhadap Fluks Ketoprofen
Zhu (2006) melaporkan fluks membran pervaporasi meningkat dengan meningkatnya suhu. Namun, hasil dalam percobaan ini menunjukkan nilai J cenderung tetap terhadap
pengaruh T (Gambar 15 dan 17b). Nilai J
bahkan menurun ketika membran uji difusi dilakukan dengan menggunakan membran
tipis dan Cd = 25 mg/l (Gambar 17a).
Penurunan nilai J dengan naiknya T menguatkan dugaan bahwa membran yang digunakan memiliki jumlah dan besar rongga yang beragam. Diduga nilai J memang meningkat dengan meningkatnya T, tetapi karena rentang suhu yang diteliti dalam
percobaan ini tidak terlalu besar (5 oC), maka
pengaruh perubahan T kalah terhadap pengaruh porositas membran yang terjadi.
Yang et al. (2002) melaporkan kenaikan
laju difusi dengan meningkatnya porositas membran. Membran dengan porositas rendah a
porositas 71.6% pada tekanan 2.5%. Dengan asumsi suhu sebanding dengan tekanan, didapatkan pengaruh porositas lebih nyata dibandingkan pengaruh suhu.
Konsent rasi Ket oprofen ( mg/ l)
S u h u D if u s i (C ) 70 60 50 40 30 42 41 40 39 38 37 Hold Values Ketebalan Membr an x 10000 (cm) 27
J x
6 6 - 8 8 - 10 100000000
10 - 12 > 12 (g/ cm2det) < 4 4 -
Contour Plot of J x 1 0 0 0 0 0 0 0 0 0 ( vs Suhu Difusi ( C) ; Konsentrasi Keto
Konsent rasi Ket oprofen ( mg/ l)
S u h u D if u s i (C ) 70 60 50 40 30 42 41 40 39 38 37 Hold Values Ketebalan Membr an x 10000 (cm) 91
J x
3 3 - 4 4 - 5 100000000
5 - 6 6 - 7 7 -
(g/ cm2det)
8 > 8 < 2 2 -
[image:35.612.131.312.180.703.2]Contour Plot of J x 1 0 0 0 0 0 0 0 0 0 ( vs Suhu Difusi ( C) ; Konsentrasi Keto
Gambar 15 Kurva pengaruh Cd dan T
terhadap J dengan h (a) 27 μm;
(b) 91 μm
Konsent rasi Ket oprofen ( mg/ l)
K e te b a la n M e m b ra n x 1 0 0 0 0 ( c m ) 70 60 50 40 30 90 80 70 60 50 40 30 Hold Values Suhu Difusi (C)37
J x
4 4 - 6 6 - 8 1000000000
8 - 10 10 - 12 > 12 (g/ cm2det)
< 2 2 -
Contour Plot of J x 1 0 0 0 0 0 0 0 0 0 ( vs Ketebalan Membra; Konsentrasi Keto
Konsent rasi Ket oprofen ( mg/ l)
K e te b a la n M e m b ra n x 1 0 0 0 0 ( c m ) 70 60 50 40 30 90 80 70 60 50 40 30 Hold Values Suhu Difusi (C)42
J x
6 6 - 8 8 - 10 1000000000
> 10 (g/ cm2det)
< 4 4 -
Contour Plot of J x 1 0 0 0 0 0 0 0 0 0 ( vs Ketebalan Membra; Konsentrasi Keto
terhadap perubahan T sangat logis jika ditilik dari Persamaan 3. Terlihat bahwa jika semua faktor lain dibuat tetap, kedua parameter difusi tersebut akan sebanding satu sama lain. Oleh karena itu, studi pengaruh T terhadap perilaku difusi biasanya hanya diwakili oleh salah satu parameter difusi.
Suhu Difusi ( C)
K e te b a la n M e m b ra n x 1 0 0 0 0 ( c m ) 42 41 40 39 38 37 90 80 70 60 50 40 30 Hold Values Konsentrasi Ketoprofen (mg/ l) 25
J x
2.5 2.5 - 3.0 3.0 - 3.5 1000000000
3.5 - 4.0 4.0 - 4.5 > 4.5 (g/ cm2det) < 2.0 2.0 -
Contour Plot of J x 1 0 0 0 0 0 0 0 0 0 ( vs Ketebalan Membra; Suhu Difusi ( C)
Suhu Difusi ( C)
K e te b a la n M e m b ra n x 1 0 0 0 0 ( c m ) 42 41 40 39 38 37 90 80 70 60 50 40 30 Hold Values Konsentrasi Ketoprofen (mg/ l) 75
J x
9 9 - 10 10 - 11 100000000
11 - 12 > 12 (g/ cm2det) < 8 8 -
[image:35.612.328.507.223.464.2]Contour Plot of J x 1 0 0 0 0 0 0 0 0 0 ( vs Ketebalan Membra; Suhu Difusi ( C)
Gambar 17 Kurva pengaruh T dan h terhadap
J dengan Cd (a) 25 mg/l; (b) 75
mg/l
Pengaruh Ketebalan Membran terhadap Fluks Ketoprofen
Ditilik dari Persaman 3, nilai J berbanding terbalik dengan h. Menurut Li et al. (2006), fluks menurun dengan meningkatnya ketebalan membran pervaporasi komposit kitosan-poli(vinil alkohol)/poliakrilonitil.
Nilai J dalam percobaan menurun dengan
naiknya h, seperti ditunjukkan oleh Gambar
16a dan 17. Namun, nilai J pada suhu 42 oC
cenderung tetap dengan naiknya h (Gambar
SIMPULAN DAN SARAN
Simpulan
Pengaruh T terhadap D dalam percobaan ini tidak nyata karena jumlah dan besar rongga dalam membran yang tidak seragam. Model yang diperoleh untuk fluks ketoprofen
adalah J = 14.6207 + 0.165Cd − 0.398T –
0.2035h – 0.0007h2 − 0.0006Cdh − 0.007Th
dengan nilai R2 = 98.4%. Faktor lain yang
berpengaruh kuat terhadap fluks ketoprofen yang tidak dipelajari dalam penelitian ini adalah jumlah dan besarnya rongga dalam masing-masing membran, serta jumlah pelarut yang menguap.
Saran
Penelitian lebih lanjut untuk mempelajari pengaruh jumlah dan besarnya rongga dalam membran terhadap koefisien difusi dan fluks ketoprofen melewati membran kitosan-gom guar perlu dilakukan untuk memperoleh model yang lebih baik. Selain itu, modifikasi alat perlu dilakukan untuk mencegah penguapan pelarut yang sangat mempengaruhi hasil pengamatan.
DAFTAR PUSTAKA
Anson ML, Northrop JH. 1936. The Calibration of Diffusion Membranes and The Calculation of Molecular Volumes from Diffusion Coefficients. J Genl Physiol 20:575-588.
American Medical Association. 1991. Drug Evaluations. Ed. ke-8.
AOAC. 1999. Official Methods of Analysis of
AOAC International. 5th Revision. Volume
2. Cunnif P (Editor). Maryland: AOAC International.
Berger J et al. 2004. Structure and interactions in covalently and ionically crosslinked chitosan hydrogels for biomedical
applications. Eur J Pharm Biopharm
57:193-194.
Cardenas A, Monal WA, Goycoolea FM, Ciapara IH, Peniche C. 2003. Diffusion through membranes of the polyelectrolyte complex of chitosan and alginate. Macromol Biosci 3:535-539.
Chaplin M. 2005. Guar gum. London: South
Bank University. http://chem.skku.ac.kr/~wkpark/tutor/mirr
or/www.martin.chaplin.btinternet.co.uk/hy
gua.html [3 Agust 2003]
Departemen Kesehatan RI. 1995. Farmakope Indonesia. Ed. ke-4.
Fardiaz D. 1989. Hidrokoloid. Bogor: Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor.
Goosen MFA, Sablani SS, Maskari SS, Al-Belushi RH, Wilf M. 2004. Effect of feed temperature and flow rate on permeate flux in spiral wound reverse osmosis systems. Di dalam: Second LACCEI International Latin American and Caribbean Conference for Engineering and Technology; Miami, 2-4 Juni 2004. Miami: LACCEI. Makalah no 131.
Huang J, Wang X, Yu X. 2006. Solute permeation through the polyurethane-NIPAAm hydrogel membranes with various cross-linking densities. Desalination 192:125-131.
Jamaludin MA. 1994. Isolasi dan pencirian kitosan limbah udang windu (Penaeus monodon fabricus) dan afinitasnya
terhadap ion logam Pb2+, Cr6+, dan Ni2+
[skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Khan TA, Peh KK, Ch’ng HS. 2002. Reporting degree of deacetylation values of chitosan: the influence of analytical
methods. J Pharm Pharmecet Sci
5:205-212.
kitosan-guar gum [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Li BB, Xu ZL, Qusay FA, Li R. 2006. Chitosan-poly (vinyl alcohol)/poly (acrylonitrile) (CS-PVA/PAN) composite pervaporation membranes for the separation of ethanol-water solutions. Desalination 193:171-181.
Liu C, Xu HN, Li XL. 2002. In vitro permeation of tetramethylpyrazine across porcine buccal mucosa. Acta Pharmacol Sin 23:792-796.
Martin A. 1993. Physical Pharmacy. Fourth Edition. Philadelphia: Lea & Febiger.
Nasution IR. 1999. Mempelajari pengaruh pH, penambahan NaCl, dan guar gum terhadap karakteristik gel cincau hijau [skripsi]. Bogor: Fakultas Teknologi Pertanian, Intitut Pertanian Bogor.
Nuraini D. 1994. Pengaruh jenis hidrokoloid terhadap pembentukan gel cincau hitam (Mesona palustris BL) [tesis]. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
Nussinovitch A. 1997. Hydrocolloid applications. Israel: Chapman and Hall.
Patil PR, Praveen S, Rani RHS, Paradkar AR. 2005. Bioavailability assessment of ketoprofen incorporated in gelled self-emulsifying formulation: a technical note. AAPS Pharm Sci Tech 6:E9-E13.
Purwantiningsih. 1992. Isolasi kitin dan komposisi senyawa kimia dari limbah udang windu (Panaeus monodon) [tesis]. Bandung: Program Pascasarjana, Institut Teknologi Bandung.
Rachmanita. 2006. Sintesis dan optimalisasi gel kitosan-karboksimetil selulosa [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Stevens MP. 2001. Kimia Polimer. Sopyan I, penerjemah. Jakarta: PT Pradnya Paramita. Terjemahan dari: Polymer Chemistry: An Introduction.
Sutariya VB, Mashru RC, Sankalia MG, Sankalia JM. 2005. Administracion transbucal del sulfato de salbutamol: Determinacion in vitro de las rutas de transporte bucal. Ars Pharm 46:337-352.
Sutriyo, Joshita D, Indah R. 2005. Perbandingan pelepasan propanolol hidroklorida dari matriks kitosan, etil selulosa, dan hidroksipropil metil selulosa. Majalah Ilmu Kefarmasian 2:145-153.
Tarbojevich M, Cosani A. 1996. Molecular weight determination of chitin and chitosan. Di dalam Muzarelli RAA & Peter MG (Editor) 1997. Chitin Handbook. Grottammare: European Chitin Society 85-108.
Thatte MR. 2004. Synthesis and Antibacterial of Water-Soluble Hydrophobic Chitosan Derivatives Bearing Quaternary Ammonium Functionality [disertasi]. Baton Rouge: The Departement of Chemistry, Louisiana State University and Agricultural and Mechanical College.
Tiyaboonchai W, Ritthidej GC. 2003. Development of indomethacin sustained release microcapsules using
chitosan-carboxymethylcellulose complex
coacervation. Songklanakarin J Sci
Technol 25:245-254.
US Pharmacopeia and National Formulary.
2003. US Pharmacopeia 2003. Maryland:
The United States Pharmacopial Convention, Inc.
Utomo DW. 2006. Sintesis dan optimalisasi gel kitosan-gom xantan [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Selected properties of pH-sensitive, biodegradable chitosan-poly(vinyl alcohol) hydrogel. Society of Chemical Industry. Polym Int 53:911-918.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama.
Yamada T, Onishi H, Machida Y. 2001. In vitro and in vivo evaluation of sustained release chitosan-coated ketoprofen micropartikels. Yakugaku Zasshi 121:239-245.
Yang L, Hsiao WW, Chen P. 2002. Chitosan-cellulose composite membrane for affinity purification of biopolymers and immunoadsorption. J Membr Sci 197:185-197.
Lampiran 1 Diagram alir penelitian
Penelitian Pendahuluan: Pembuatan dan Pencirian Kitin dan Kitosan
NaOH 3.5% HCl 1 N NaOH 50%
↓ ↓ ↓
Kulit udang→ → → Kitin→
(60 oC, 2 jam) (suhu ruang, 2 jam) (100 oC, 4 jam)
↓
← Kitosan
Penelitian Utama: Pembuatan Membran Kitosan-Gom Guar serta Studi Difusi Ketoprofen Melalui Membran Kitosan-Gom Guar
Pembuatan membran kitosan-gom guar [modifikasi Lestari (2006)]
Uji difusi membran: Alat uji difusi Sel 1: pelarut etanol:air (1:1) + ketoprofen
Sel 2: pelarut etanol:air (1:1)
Dalam penangas air; alikuot diambil dan [ketoprofen] diukur dengan spektrofotometer UV/Vis
Deproteinasi Demineralisasi Deasetilasi
Pencirian kitin dan kitosan:
*Kadar air → Gravimetri (AOAC 1999)
*Kadar abu → Gravimettri (AOAC 1999)
*Derajat deasetilasi → FTIR
*Bobot molekul → Viskometer Ostwald
*Pencirian membran (SEM)
Lampiran 2
(a) Penetapan kadar air (AOAC 1999)
Penentuan kadar air kitin/kitosan dilakukan dengan metode gravimetri. Sebanyak
±
0.2000 g kitin/kitosan dimasukkan ke dalam cawan porselen yang telah diketahui bobotnya,kemudian cawan beserta isinya dimasukkan ke dalam oven dengan suhu 105 oC selama 3 jam atau
sampai bobotnya konstan. Setelah itu, dimasukkan ke dalam desikator dan ditimbang. Kadar air kitin/kitosan dihitung dengan persamaan
Kadar air = bobot sampel awal − bobot sampel kering × 100%
bobot sampel awal
(b) Penetapan kadar abu (AOAC 1999)
Penentuan kadar abu kitin/kitosan dilakukan dengan metode gravimetri. Cawan porselen dibersihkan dan dimasukkan ke dalam tanur untuk menghilangkan sisa-sisa kotoran yang menempel dalam cawan, kemudian didinginkan dalam desikator dan ditimbang. Sebanyak
±
0.5000 g kitin/kitosan dimasukkan ke dalam cawan tersebut dan dibakar dalam tanur pengabuandengan suhu 600oC sampai diperoleh abu berwarna putih. Setelah itu, cawan beserta isinya
dimasukkan ke dalam desikator dan ditimbang. Kadar abu kitin/kitosan dihitung dengan persamaan
Kadar abu = bobot abu × 100% bobot sampel
Lampiran 3 Metode pembuatan pereaksi Pembuatan larutan kitosan 1.5%
Sebanyak 1.5888 gram kitosan dilarutkan ke dalam 100 ml asam asetat 1%
Pembuatan larutan glutaraldehida 4.86%
Sebanyak 19.44 mL larutan glutaraldehida 25% dimasukkan ke dalam labu takar 100 ml, kemudian ditera dengan akuades sampai tanda tera.
Pembuatan larutan gom guar 0.33%
Sebanyak 0.33 gram gom guar dilarutkan dengan akuades sampai mencapai volume total 100 mL.
Lampiran 4 Data hasil pengukuran kadar air dan abu kitin dan kitosan.
Kadar air dan abu kitin dan kitosan
Ulangan ke- Sampel Kadar air (%) Kadar abu (%)
1 kitin 5.90 0.20
2 kitin 5.76 0.11
3 kitin 5.87 0.11
Rerata 5.84 0.14
1 kitosan 5.60 0.11
2 kitosan 5.39 0.13
3 kitosan 5.78 0.12
Lampiran 5 Penentuan bobot molekul kitosan
Waktu alir larutan kitosan
Konsentrasi Waktu alir (detik) Rata-rata
0,00 28.06 28.09
28.12 28.09
0,02 44.55 44.66
44.66 44.77
0,04 66.94 66.92
66.91 66.92
0,06 87.85 88.39
88.46 88.87 0,08 99.84 99.54
99.49 99.30
Kemudian dibuat kurva hubungan antara ηsp/c dengan c sehingga diperoleh persamaan:
lnηsp/c =ln [η] + k’ [η]2 c
x y a b
Bobot molekul kitosan dihitung dengan menggunakan persamaan Mark-Houwink:
Viskositas relatif ηr = η/ηo≅ t/to
Viskositas spesifik ηsp =ηr -1
Viskositas intrinsik [η] = (ηsp/c)c=0
[η] = KMα
dengan K = 3.5 x 10-4 mL/g
α = 0.76
t = waktu alir zat
t0 = waktu alir pelarut
η = viskositas zat
η0 = viskositas pelarut
M = bobot molekul zat
Dengan menggunakan mode regresi linear diperoleh persamaan:
ηsp/c = [η]+k’[η]c sama dengan y = -0.8327 + 24.1215 x
Jadi [η] = 0.4349
untuk rumus [η] = KMα, maka 0.4349 = 3.5 × 10-4 × M0.76
Lampiran 6 Spektrum FTIR dan derajat deasetilasi kitin dan kitosan
Spektrum FTIR kitosan
Derajat deasetilasi kitosan dicari dengan rumus:
A = log
P Po
dimana: Po = % transmitansi pada garis dasar P = % transmitansi pada puncak minimum A = absorbansi
% DD = 1 –
1
100
%
33 , 1 3450 1655
×
⎥
⎦
⎤
⎢
⎣
⎡
×
A Adimana: A1655 = absorbansi pada bilangan gelombang 1655 cm
-1
(serapan pita amida)
A3450 = absorbansi pada bilangan gelombang 3450 cm -1 (serapan gugus hidroksil)
A1655 = log
19 , 1 61 . 86 = 1.8618
A3450 = log
39 . 13 93 . 58 = 0,6435
% DD =
⎥ ⎦ ⎤ ⎢ ⎣ ⎡ − ) 33 , 1 1 8618 , 1 6435 , 0 (
1 x x 100 % = 74.02%
P P
Po
Lampiran 7 Analisis SEM
Contoh direndam dalam etanol absolut selama 2×10 menit dan dibiarkan mengering pada suhu ruang. Setelah itu, contoh dipindahkan dengan pinset steril ke dalam botol sebelum dibekukan
pada suhu −20 oC (sebaiknya semalam). Setelah itu, contoh dikering-bekukan.
Sementara itu, pada permukaan atas silinder logam steril yang diameternya lebih besar