PENYERAPAN HARA SORGUM MANIS (Sorghum bicolor
L. Moench)
BEDAH RUPAEDAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi berjudul Peranan Fungi Mikoriza Arbuskular dan Rizobakteri dalam Meningkatkan Produksi Gula dan Efisiensi Penyerapan Hara Sorgum Manis (Sorghum bicolor L. Moench) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
BEDAH RUPAEDAH. Peranan Fungi Mikoriza Arbuskular dan Rizobakteri dalam Meningkatkan Produksi Gula dan Efisiensi Penyerapan Hara Sorgum Manis (Sorghum bicolor L. Moench). Di bawah bimbingan ISWANDI ANAS
CHANIAGO (ketua), DWI ANDREAS SANTOSA, WAHONO
SUMARYONOdanSRI WILARSO BUDI(anggota).
Sorgum manis (Sorghum bicolorL. Moench) merupakan tanaman potensial yang dapat dikembangkan sebagai sumber energi baru dan terbarukan. Sorgum manis memiliki potensi produksi yang cukup tinggi dibandingkan dengan tanaman sumber bioenergi lain dan tanaman ini dapat dikembangkan di lahan-lahan kurang subur atau lahan marjinal, karena memiliki daya adaptasi yang cukup tinggi. Disamping itu, pengembangan sorgum manis sebagai sumber bahan baku bioetanol tidak berkompetisi dengan pengembangan bahan pangan. Pemanfaatan mikrob potensial seperti fungi mikoriza arbuskular (FMA) dan rizobakteri merupakan salah satu solusi tepat untuk mempertahankan tetap tingginya tingkat produktivitas tanaman sorgum manis walaupun dibudidayakan di lahan marjinal, seperti di tanah ultisol.
Penelitian ini terdiri dari tiga bagian penelitian yang satu sama lain saling terkait, yaitu : (1) isolasi, seleksi, karakterisasi dan identifikasi FMA dan rizobakteri yang dapat meningkatkan pertumbuhan dan kandungan klorofil daun sorgum manis; (2) peranan FMA dan rizobakteri dalam meningkatkan proses fotosintesis, pengambilan hara, pertumbuhan dan kandungan gula batang sorgum manis; dan (3) peranan FMA dan rizobakteri dalam meningkatkan efisiensi penyerapan hara oleh sorgum manis.
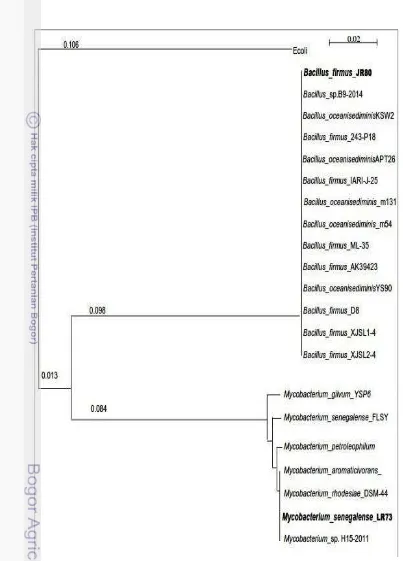
termasuk ke dalam spesiesMycobacterium senegalensedanBacillus firmusdengan tingkat kesamaan 99 dan 100% secara berurutan. Hasil pengujian patogenisitas terhadap kedua rizobakteri menunjukkan bahwa kedua rizobakteri tersebut tidak memiliki sifat patogen terhadap manusia atau hewan melalui pengujian secara in vitro pada media Blood Agar. Demikian pula, hasil pengujian patogenisitas terhadap tanaman, dalam hal ini digunakan tanaman tembakau menunjukkan bahwa kedua isolat bakteri tersebut aman bagi tanaman baik bagi tanaman sorgum manis maupun bagi tanaman lainnya.
Pengaruh inokulasi ganda FMA dan rizobakteri dengan pemberian pupuk kimia terhadap proses fotosintesis dipelajari dengan menganalisis pertukaran gas CO2, kandungan klorofil, kandungan gula, pengambilan hara, pertumbuhan dan produksi biomassa sorgum manis di rumah kaca. Inokulasi FMA saja berpengaruh nyata dalam meningkatkan asimilasi karbon, konduktansi stomata, konsentrasi CO2 interseluler, kandungan hara fosfor, kandungan klorofil, kandungan gula, tinggi tanaman, bobot batang dan derajat kolonisasi mikoriza. Interaksi FMA dan rizobakteri berpengaruh nyata dalam meningkatkan kandungan gula, kandungan hara kalium dan tinggi tanaman, sedangkan interaksinya dengan pupuk kimia berpengaruh nyata dalam meningkatkan kandungan klorofil, kandungan gula dan derajat kolonisasi mikoriza. Sementara itu interaksi antara FMA, rizobakteri dan pupuk kimia berpengaruh nyata dalam meningkatkan kandungan gula, bobot akar serta derajat kolonisasi mikoriza. Dengan kata lain, penggunaan FMA saja maupun interaksinya dengan rizobakteri dan pupuk kimia berpotensi besar dalam meningkatkan proses fotosintesis pada daun sorgum manis, dimana proses ini terkait dengan peningkatan kandungan gula batang sorgum manis.
hara tanaman sorgum manis.
Temuan dari penelitian ini penting artinya sebagai rekomendasi bagi petani atau praktisi pengembang tanaman bioenergi untuk memanfaatkan FMA dan rizobakteri dalam meningkatkan produksi gula batang sorgum manis dan juga berpotensi meningkatkan efisiensi penyerapan hara oleh tanaman tersebut, sehingga diharapkan dapat mengurangi biaya produksi budidaya sorgum manis sebagai sumber bahan baku bioetanol di masa depan.
BEDAH RUPAEDAH. Role of Arbuskular Mycorrhizal Fungi and Rhizobacteria in Improving Sugar Production and Nutrient Absorption Efficiency of Sweet Sorghum (Sorghum bicolorL. Moench). Under the direction ofISWANDI ANAS
CHANIAGO (chairman), DWI ANDREAS SANTOSA, WAHONO
SUMARYONOdanSRI WILARSO BUDI(members).
Sweet sorghum (Sorghum bicolor L. Moench) is a potential source of new and renewable energy. Sweet sorghum was developing in marginal land because it has a fairly high adaptability. In addition, development of sweet sorghum as a source of bioethanol in marginal lands is not competitive with the need for developing foods. Utilization of potential microbes such as arbuscular mycorrhizal fungi (AMF) and rhizobacteria is one of solution to maintain productivity level of sweet sorghum.
This research consisted of three interrelated experiments, namely : (1) isolation, selection, characterization and identification of AMF and rhizobacteria which can enhance growth and chlorophyll content of sweet sorghum; (2) role of AMF and rhizobacteria in order to increase photosynthetic process, nutrient uptake, growth and sugar content of sweet sorghum; and (3) role of AMF and rhizobacteria in improving nutrient absorption efficiency of sweet sorghum.
gas exchange, chlorophyll content, sugar content, nutrient uptake, growth and biomass production of sweet sorghum in greenhouse. AMF inoculation alone had significant effect in increasing carbon assimilation, stomatal conductance, intercellular CO2 concentration, phosphorus content, chlorophyll content, sugar content, plant height, shoot weight and mycorrhizal root colonization. Interaction of AMF and rhizobacteria had significant effect in increasing sugar content, potassium content and plant height, whereas its interaction with chemical fertilizers had significant effect in increasing chlorophyll content, sugar content and mycorrhizal root colonization of sweet sorghum. While interaction of AMF, rhizobacteria and chemical fertilizers had significant effect in increasing sugar content, root weight and mycorrhizal root colonization of sweet sorghum. In other words, using AMF or its interaction with rhizobacteria and chemical fertilizers had great potential in increasing photosynthesis of sweet sorghum, which is associated with increasing sugar content of sweet sorghum stalk.
Tracking nutrients that can be absorbed to increase productivity of plants is a key component to measure nutrient uptake efficiency by plants. Field experiments were conducted to assess effects of inoculating sweet sorghum with AMF and rhizobacteria in various concentrations of chemical fertilizers. Carbon assimilation, chlorophyll content, mycorrhizal root colonization, plant height, biomass weight, sugar content and plant uptake of phosphorus, potassium and nitrogen were analyzed. AMF inoculation had significant effect in increasing plant height, biomass weight, mycorrhizal root colonization, carbon assimilation, chlorophyll content, sugar content and nitrogen content of sweet sorghum. Inoculation Mycobacterium senegalenseLR73 andBacillus firmusJR80 had significant effect in increasing plant height, biomass weight, sugar content, phosphorus content, phosphorus and potassium uptake of sweet sorghum. Meanwhile, interaction of AMF and rhizobacteria had significant effect in increasing plant height, biomass weight, mycorrhizal root colonization, potassium uptake and nitrogen absorption efficiency of sweet sorghum. Overall, effects of inoculation AMF, rhizobacteria and chemical fertilizers as well as their interaction had significant effect in increasing growth, phosphorus and potassium uptake and nitrogen absorption efficiency by sweet sorghum. Finally, using AMF (Gigaspora sp. MDL40 and Glomus sp. MDL38) and rhizobacteria (Mycobacterium senegalense LR73 and Bacillus firmus JR80) had great potential to improve efficiency of chemical fertilizers use.
Results of this study are important as recommendations to farmers or practitioners to utilize AMF and rhizobacteria in increasing sugar production of sweet sorghum and improving nutrient absorption efficiency which is expected to reduce production cost of sweet sorghum as a source of bioethanol in the future. Keywords : arbuscular mycorrhizal fungi (AMF), rhizobacteria, sweet sorghum,
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Tanah
PENYERAPAN HARA SORGUM MANIS (Sorghum bicolor
L. Moench)
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
1. Dr Ir Abdul Munif, MScAgr
(Staf Pengajar Departemen Proteksi Tanaman Fakultas Pertanian, Institut Pertanian Bogor)
2. Dr Rahayu Widyastuti, MSc
(Staf Pengajar Departemen Ilmu Tanah dan Sumberdaya Lahan Fakultas Pertanian, Institut Pertanian Bogor)
Penguji pada Ujian Terbuka: 1. Dr Ir Hariyadi, MS
(Staf Pengajar Departemen Agronomi dan Hortikultur Fakultas Pertanian, Institut Pertanian Bogor)
Sorgum Manis (Sorghum bicolorL. Moench) Nama : Bedah Rupaedah
NIM : A161090031
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Iswandi Anas Chaniago, MSc Ketua
Prof Dr Wahono Sumaryono Anggota
Prof Dr Ir Dwi Andreas Santosa, MS Anggota
Prof Dr Ir Sri Wilarso Budi, MS Anggota
Diketahui oleh
Ketua Program Studi Ilmu Tanah dan Sumberdaya Lahan
Dr Ir Atang Sutandi, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2011 s.d. April 2013 ini ialah pemanfaatan mikrob tanah (Fungi Mikoriza Arbuskular dan Rizobakteri) untuk meningkatkan produktivitas tanaman sorgum manis, dengan judul“Peranan Fungi Mikoriza Arbuskular dan Rizobakteri dalam Meningkatkan Produksi Gula dan Efisiensi Penyerapan Hara Sorgum Manis (Sorghum bicolorL. Moench)”.
Selama melaksanakan penelitian ini, penulis banyak mendapatkan bantuan dan bimbingan dari berbagai pihak. Untuk itu pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih kepada :
1. Prof Dr Ir Iswandi Anas Chaniago, MSc selaku ketua komisi pembimbing dan Prof Dr Dwi Andreas Santosa MS, Prof Dr Wahono Sumaryono serta Prof Dr Ir Sri Wilarso Budi, MS selaku anggota tim pembimbing atas segala bimbingan dan masukan yang sangat berharga yang diberikan mulai penulisan proposal hingga disertasi ini selesai.
2. Kementerian Riset dan Teknologi dan seluruh stafnya yang telah memberikan fasilitas beasiswa bagi penyelesaian pendidikan di Program Doktor Institut Pertanian Bogor.
3. Kepala BPPT dan Deputi Kepala BPPT Bidang Teknologi Agroindustri dan Bioteknologi yang telah memberikan izin melanjutkan studi di Program Doktor Institut Pertanian Bogor.
4. Dr Bambang Marwoto, MEngSc yang telah berkenan memberikan izin bagi penulis untuk mengikuti Program Doktor dan Drs Tarwadi MS selaku Kepala Balai Pengkajian Bioteknologi BPPT atas sarana dan waktu yang diberikan dalam penyelesaian studi ini.
5. Pimpinan Institut Pertanian Bogor, Dekan Sekolah Pascasarjana, Dekan Fakultas Pertanian dan Ketua Program Studi Ilmu Tanah dan Sumber Daya Lahan, yang telah memberikan kesempatan kepada penulis untuk mengikuti Program Doktor ini.
6. Staf Pengajar dan Pegawai di lingkungan Program Studi Ilmu Tanah dan Sumber Daya Lahan Fakultas Pertanian untuk bantuan dan kemudahan administrasi.
7. Ayahanda tercinta Bapak Syamsi Syarbini dan Ibu Atikah Surawisastra yang tidak pernah bosan memberikan do’adan dorongan semangat kepada penulis untuk bisa menjalankan studi ini dengan baik.
dukungannya.
10. Ir Asep Ali, Mahmud Sugianto, Abdul Wahid SE, Taufik Firmansyah SSi dan rekan-rekan di Laboratorium Agromikrobiologi, Analitik dan Rumah Kaca atas semua bantuan dan dukungan dalam penyelesaian studi ini. 11. Teman-teman di Balai Pengkajian Bioteknologi BPPT : Dr Yenni Bakhtiar
MAgSc, Dr Catur Sriherwanto, Nia Asiani SSi, Dr Farida Rosana Mira, Indra Rachmawati SSi, Dr Erwahyuni Endang Prabandari MSi dan teman-teman lainnya atas segala perhatian, diskusi, bantuan, saran, dorongan dan semangat hingga selesainya studi ini.
12. Teman-teman seperjuangan di Program Studi Ilmu Tanah dan Sumber Daya Lahan yang selalu memberikan semangat kepada penulis untuk menyelesaikan studi ini dengan baik.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR TABEL Vi
1.7 Ruang Lingkup Penelitian 6
2 TINJAUAN PUSTAKA 8
2.1 Prospek Pengembangan Sorgum Manis 8
2.2 Pemanfaatan Fungi Mikoriza Arbuskular (FMA) 9 2.3 Pemanfaatan Rizobakteri
2.3.1 Bakteri Penambat N2
11 11
2.3.2 Bakteri Pelarut Fosfat 12
2.4 Produksi Gula dan Kaitannya dengan Fotosintesis 13
2.5 Efisiensi Penyerapan Hara 14
3 METODE 16
3.1 Isolasi, Seleksi, Karakterisasi dan Identifikasi FMA dan
Rizobakteri 16
3.2 Peranan FMA dan Rizobakteri dalam Meningkatkan Proses Fotosintesis, Pengambilan Hara, Pertumbuhan dan Kandungan
Gula Sorgum Manis 24
3.3 Peranan FMA dan Rizobakteri dalam Meningkatkan Efisiensi
Penyerapan Hara Sorgum Manis 28
4 HASIL DAN PEMBAHASAN 32
4.1 Hasil
4.1.1 Isolasi, Seleksi, Karakterisasi dan Identifikasi FMA dan Rizobakteri
4.1.2 Peranan FMA dan Rizobakteri dalam Meningkatkan Proses Fotosintesis, Pengambilan Hara, Pertumbuhan dan Kandungan Gula Sorgum Manis
RIWAYAT HIDUP 99
DAFTAR TABEL
4.1 Jumlah isolat FMA hasil isolasi 32
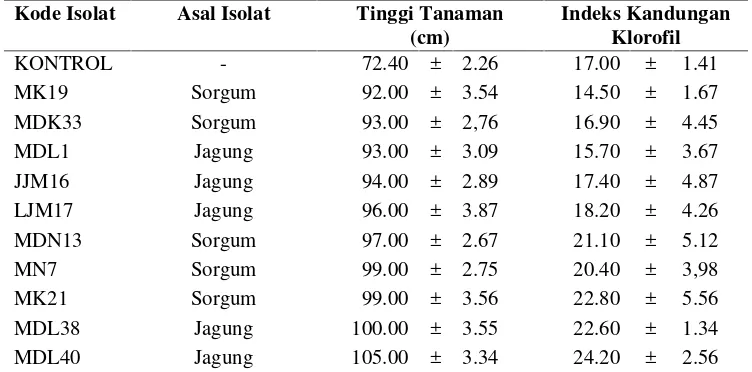
4.2 Jumlah isolat rizobakteri hasil isolasi 32 4.3 Sepuluh isolat FMA yang menunjukkan pengaruh terbaik
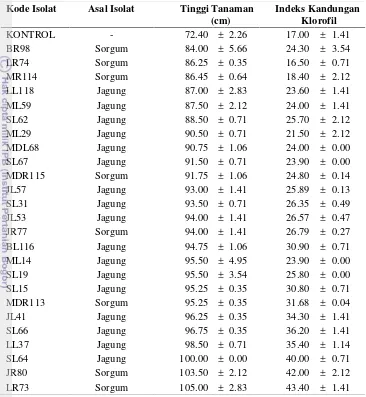
terhadap tinggi tanaman dan kandungan klorofil sorgum manis 33 4.4 Dua puluh lima isolat rizobakteri yang menunjukkan pengaruh
terbaik terhadap tinggi tanaman dan kandungan klorofil daun
sorgum manis 34
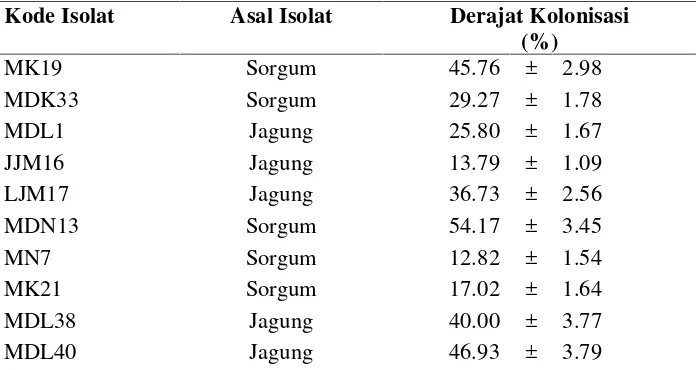
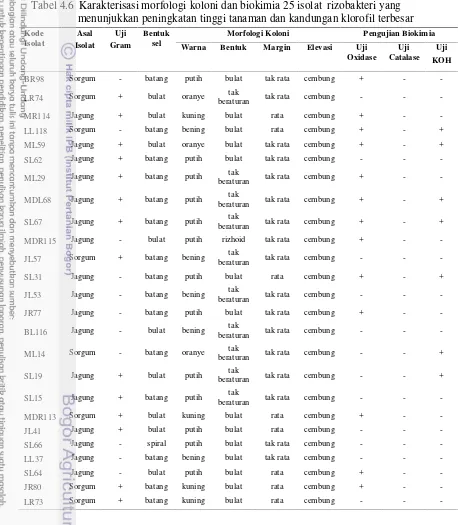
4.5 Derajat kolonisasi 10 isolat FMA pada perakaran sorgum manis 35 4.6 Karakterisasi morfologi koloni dan biokimia terhadap 25 isolat
rizobakteri terpilih 36
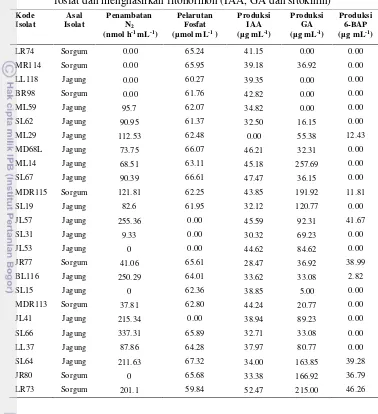
4.7 Kemampuan 25 isolat rizobakteri dalam menambat N2, melarutkan fosfat dan produksi fitohormon (IAA, GA dan
sitokinin) 38
4.8 Identifikasi isolat FMA MDL40 dan MDL38 39 4.9 Rekapitulasi hasil sidik ragam peubah yang diamati pada tanaman
sorgum manis yang diinokulasi FMA (A) dan rizobakteri (B) serta
pemberian pupuk kimia (C) di rumah kaca 46 4.10 Rekapitulasi hasil sidik ragam peubah yang diamati pada tanaman
sorgum manis yang diinokulasi FMA (A), rizobakteri (B) dan
pemberian pupuk kimia (C) di lahan 58
4.11 Rekapitulasi hasil sidik ragam peubah yang diamati pada tanaman sorgum manis yang diinokulasi FMA (A), rizobakteri (B) dan
pemberian pupuk kimia (C) di lahan 59
4.12 Hasil penetapan dan penghitungan kandungan hara dalam pupuk kimia yang digunakan pada penelitian
62 4.13 Rekapitulasi hasil sidik ragam peubah yang diamati pada tanaman
sorgum manis yang diinokulasi FMA (A), rizobakteri (B) dan
1.1 Tahapan dan luaran penelitian 7 2.1 Sorgum manis (Sorghum bicolorL. Moench) 9 4.1 Pohon filogenetikMycobacterium senegalenseLR73 danBacillus
firmusJR80
42 4.2 Sel bakteriMycobacterium senegalenseLR73 berbentuk
batang, Gram positif 43
4.3 Sel bakteriBacillus firmusJR80 berbentuk batang, Gram positif 43 4.4
4.5 4.6
Uji patogenisitas rizobakteriMycobacterium senegalenseLR73 dan Bacillus firmusJR80 pada mediumBlood Agar
Uji patogenisitasMycobacterium senegalenseLR73 terhadap tanaman tembakau
Uji patogenisitasBacillus firmusJR80 terhadap tanaman tembakau
44 44 45 4.7 Pengaruh inokulasi FMA (A) dan pemberian pupuk kimia (C)
terhadap kandungan klorofil daun sorgum manis yang ditanam pada media yang disterilisasi dan yang tak disterilisasi, diukur
pada 75 hari setelah tanam 47
4.8 Pengaruh inokulasi FMA (A) dan rizobakteri (B) terhadap tinggi tanaman sorgum manis yang diukur setiap 2 minggu sekali selama masa tanam. Huruf yang berbeda menunjukkan beda nyata dengan
uji Duncan pada taraf 5% 48
4.9 Pengaruh inokulasi FMA (A) terhadap bobot batang sorgum manis yang diukur pada saat panen. Huruf yang berbeda menunjukkan
beda nyata dengan uji Duncan pada taraf 5% 48 4.10 Pengaruh interaksi FMA (A), rizobakteri (B) dan pupuk kimia (C)
terhadap bobot akar sorgum manis yang diukur pada saat panen 49 4.11 Pengaruh inokulasi FMA (A), rizobakteri (B) dan pemberian
pupuk kimia (C) terhadap derajat kolonisasi mikoriza yang
dihitung setelah panen 50
4.12 Pengaruh inokulasi FMA (A) terhadap kandungan hara fosfor (P) daun sorgum manis yang diukur setelah panen. Huruf yang berbeda menunjukkan beda nyata dengan uji Duncan pada taraf 5% 51 4.13 Pengaruh inokulasi FMA (A) dan rizobakteri (B) terhadap
kandungan hara kalium (K) daun sorgum manis, yang diukur setelah panen. Huruf yang berbeda menunjukkan beda nyata
dengan uji Duncan pada taraf 5% 52
4.14 Pengaruh inokulasi FMA (A) terhadap asimilasi karbon, yang diukur pada hari ke 75 setelah tanam. Huruf yang berbeda
menunjukkan beda nyata dengan uji Duncan pada taraf 5% 52 4.15 Pengaruh inokulasi FMA (A) terhadap konduktansi stomata yang
diukur pada hari ke 75 setelah tanam. Huruf yang berbeda
4.17 Pengaruh inokulasi FMA (A), rizobakteri (B), pemberian pupuk kimia (C) dan interaksinya (ABC) terhadap kandungan gula batang
sorgum manis yang diukur setelah panen 56 4.18 Pengaruh inokulasi FMA (A) terhadap kandungan hara N sorgum
manis 60
4.19 Pengaruh pupuk kimia (C) terhadap kandungan hara N sorgum manis. Huruf yang berbeda menunjukkan beda nyata dengan uji
Duncan pada taraf 5% 60
4.20 Pengaruh inokulasiMycobacterium senegalenseLR73 (A1) dan Bacillus firmusJR80 (A2) terhadap kandungan hara P sorgum manis. Huruf yang berbeda menunjukkan beda nyata dengan uji
Duncan pada taraf 5% 61
4.21 Pengaruh pupuk kimia (C) terhadap kandungan hara P sorgum manis. Huruf yang berbeda menunjukkan beda nyata dengan uji
Duncan pada taraf 5% 61
4.22 Pengaruh inokulasi FMA (A), rizobakteri (B) dan interaksinya (AB) terhadap kandungan hara K sorgum manis. Huruf yang berbeda menunjukkan beda nyata dengan uji Duncan pada taraf
5% 61
4.23 Pengaruh inokulasi rizobakteri (B), pupuk kimia (C) dan
interaksinya (AC) terhadap kandungan hara K sorgum manis. Huruf yang berbeda menunjukkan beda nyata dengan uji Duncan pada
taraf 5% 62
4.24 Pengaruh pupuk kimia (C) terhadap serapan hara N sorgum manis. Huruf yang berbeda menunjukkan beda nyata dengan uji
Duncan pada taraf 5% 64
4.25 Pengaruh inokulasi FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) terhadap serapan hara P sorgum manis. Huruf yang berbeda menunjukkan beda nyata dengan uji Duncan pada
taraf 5% 65
4.26 Pengaruh inokulasi FMA (A), rizobakteri (B) dan interaksinya (AB) terhadap serapan hara K sorgum manis. Huruf yang berbeda
menunjukkan beda nyata dengan uji Duncan pada taraf 5% 65 4.27 Pengaruh inokulasi FMA (A), rizobakteri (B), pupuk kimi (C) dan
interaksinya (ABC) terhadap efisiensi penyerapan hara N sorgum manis. Huruf yang berbeda menunjukkan beda nyata dengan uji
1. Analisis sifat-sifat media tanah yang dipergunakan pada percobaan di
rumah kaca 83
2. Analisis sifat-sifat media tanah yang dipergunakan pada percobaan di
lahan 84
3. Sidik ragam tinggi tanaman sorgum manis yang diinokulasi FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di rumah kaca 85 4. Sidik ragam bobot batang sorgum manis yang diinokulasi FMA (A),
rizobakteri (B) dan pemberian pupuk kimia (C) di rumah kaca 85 5. Sidik ragam bobot akar sorgum manis yang diinokulasi FMA (A),
rizobakteri (B) dan pemberian pupuk kimia (C) di rumah kaca 86 6. Sidik ragam derajat kolonisasi mikoriza yang diinokulasi FMA (A),
rizobakteri (B) dan pemberian pupuk kimia (C) di rumah kaca 86 7. Sidik ragam kandungan N daun sorgum manis yang diinokulasi FMA
(A), rizobakteri (B) dan pemberian pupuk kimia (C) di rumah kaca 87 8. Sidik ragam kandungan P daun sorgum manis yang diinokulasi FMA
(A), rizobakteri (B) dan pemberian pupuk kimia (C) di rumah kaca 87 9. Sidik ragam kandungan K daun sorgum manis yang diinokulasi FMA
(A), rizobakteri (B) dan pemberian pupuk kimia (C) di rumah kaca 88 10. Sidik ragam kandungan Mg daun sorgum manis yang diinokulasi FMA
(A), rizobakteri (B) dan pemberian pupuk kimia (C) di rumah kaca 88 11. Sidik ragam kandungan klorofil sorgum manis yang diinokulasi FMA
(A), rizobakteri (B) dan pemberian pupuk kimia (C) di rumah kaca 89 12. Sidik ragam asimilasi karbon sorgum manis yang diinokulasi FMA
rizobakteri (B) dan pemberian pupuk kimia (C) di rumah kaca 89 13. Sidik ragam konduktansi stomata daun sorgum manis yang diinokulasi
FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di rumah
kaca 90
14. Sidik ragam konsentrasi CO2 interseluler daun sorgum manis yang diinokulasi FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C)
di rumah kaca 90
15. Sidik ragam kandungan gula batang sorgum manis yang diinokulasi FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di rumah
kaca 91
16. Sidik ragam tinggi tanaman sorgum manis yang diinokulasi
FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 91 17. Sidik ragam bobot biomassa sorgum manis yang diinokulasi
FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 92 18. Sidik ragam derajat kolonisasi mikoriza yang diinokulasi
FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 92 19. Sidik ragam kandungan klorofil daun sorgum manis yang diinokulasi
21. Sidik ragam asimilasi karbon daun sorgum manis yang diinokulasi
FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 94 22. Sidik ragam kandungan N tanaman sorgum manis yang diinokulasi
FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 94 23. Sidik ragam kandungan P tanaman sorgum manis yang diinokulasi
FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 95 24. Sidik ragam kandungan K tanaman sorgum manis yang diinokulasi
FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 95 25. Sidik ragam serapan N tanaman sorgum manis yang diinokulasi FMA
(A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 96 26. Sidik ragam serapan P tanaman sorgum manis yang diinokulasi FMA
(A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 96 27. Sidik ragam serapan K tanaman sorgum manis yang diinokulasi FMA
(A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 97 28. Sidik ragam efisiensi penyerapan N sorgum manis yang diinokulasi
FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 97 29. Sidik ragam efisiensi penyerapan P sorgum manis yang diinokulasi
FMA (A), rizobakteri (B) dan pemberian pupuk kimia (C) di lahan 98 30. Sidik ragam efisiensi penyerapan K sorgum manis yang diinokulasi
1.1 Latar Bel
aka
ngSorgum manis (Sorghum bicolorL. Moench) merupakan tanaman potensial untuk dikembangkan, karena memiliki kemampuan adaptasi yang luas, dapat tumbuh di berbagai jenis lahan, toleran terhadap kekeringan serta hanya membutuhkan input energi yang relatif lebih sedikit dibandingkan dengan tanaman Gramineae lain (tebu dan jagung). Sorgum manis kini banyak dimanfaatkan sebagai sumber bahan pangan, pakan ternak, bahan pembuatan gula cair dan gula merah, serta sumber bahan baku bioetanol (Irawan dan Sutrisna 2011; Sirappa 2003; Soeranto 2004; Trikoesoemaningtyas dan Suwarto 2006). Sorgum manis sebagai bahan baku pembuatan bioetanol memiliki karbohidrat terfermentasi tinggi dalam batang (15–25%) yang terdiri dari 3 komponen utama gula, yaitu sukrosa (70%), glukosa (20%) dan fruktosa (10%) (Sarathet al.2008; Prasadet al. 2007). Disamping itu, sorgum manis memerlukan input air yang lebih sedikit tetapi menghasilkan karbohidrat terfermentasi yang lebih tinggi dibandingkan dengan jagung, sehingga dapat dikembangkan di daerah semi arid (Reddy et al. 2007). Menurut Pabendonet al. (2012), produksi etanol dari sorgum manis sebanyak 5600 liter per ha tahun pertama dari 140 ton per ha bobot biomassa pada 2 musim tanam tahun pertama, sebanding dengan produksi etanol dari tebu sebanyak 6500 liter per ha dari 80–90 ton per ha bobot biomassa tanaman. Hasil dan kualitas sorgum manis dan tebu berbeda sesuai dengan kondisi lingkungan dan musim tanam. Pada kondisi yang menguntungkan, sorgum manis dapat menghasilkan hingga 13 ton gula per ha.
Hingga kini, di Indonesia terdapat banyak lahan tidak produktif yang digolongkan ke dalam kelompok lahan marjinal. Sebagian tanah ultisol tergolong tanah marjinal. Prasetyo dan Suriadikarta (2006) mengatakan bahwa tanah ultisol mempunyai sebaran yang sangat luas, meliputi hampir 25% dari total daratan Indonesia. Pada umumnya tanah ultisol memiliki kandungan bahan organik yang rendah. Unsur hara makro seperti fosfor dan kalium yang sering kahat, reaksi tanah masam hingga sangat masam, serta kejenuhan aluminium yang tinggi merupakan sifat-sifat tanah ultisol yang sering menghambat pertumbuhan tanaman. Pengembangan budidaya sorgum manis di lahan marjinal dalam hal ini di tanah ultisol diharapkan dapat meningkatkan produktivitas tanaman penghasil bioetanol tersebut tanpa harus berkompetisi dengan kebutuhan akan pengembangan budidaya tanaman pangan di lahan-lahan yang masih subur.
dan tanaman dapat memodifikasi hubungan hormonal tanaman inangnya, dimana FMA yang menyelimuti jaringan akar bagian luar mempengaruhi organ-organ tanaman yang jauh dari perakaran seperti stomata daun dengan cara merubah aliran informasi hormonal dari akar ke batang dalam transpirasi (Nikolaouet al.2003). Peningkatan serapan air oleh simbiosis tanaman dan FMA berhubungan dengan perubahan morfologi perakaran yang terinfeksi FMA, sehingga secara efektif meningkatkan akses akar ke reservoir air tanah (Marulandaet al. 2003). Inokulasi FMA baik sendiri maupun kombinasi dengan rizobakteri juga mampu meningkatkan stabilitas struktur tanah, aktivitas mikrobial di wilayah rizosfir serta aktivitas fotosintesis tanaman (Kohleret al.2009, Moseki dan Dintwe 2010, Stepan et al. 2013, Tingtinget al.2010, Lebonet al. 2005).
Rizobakteri adalah bakteri yang hidup di wilayah perakaran tanaman dan berinteraksi dengan tanaman melalui perakaran tanaman tersebut. Banyak peneliti yang melaporkan bahwa beberapa rizobakteri mampu meningkatkan pertumbuhan dan produktivitas tanaman tebu, jagung, singkong dan beberapa tanaman lainnya. Rizobakteri tersebut antara lain Azospirillum, Bacillus, Enterobacter, Acinetobacter dan Chryseobacterium (Vessey 2003; Funnell-Haris et al. 2010; Bhromsiri dan Bhromsiri 2010; Bhattacharyya dan Jha 2012; Martinez-Absalonet al. 2012; Sadiq dan Ali 2013; Trujillo-Roldanet al.2013; Yolcuet al.2011).
Penggunaan FMA dan rizobakteri pada budidaya sorgum manis diperkirakan dapat meningkatkan kandungan gula batang sorgum manis. Berbagai faktor dilaporkan mempengaruhi laju produksi gula pada tanaman diantaranya faktor serapan hara (Funnel-Hariset al.2010; El-lattief 2011), kelembaban media tanam (Unlu dan Steduto 2000; Pinheiro dan Chaves 2011; Paul dan Foyer 2001; Goicoechaeaet al.1997) serta faktor lingkungan seperti konsentrasi CO2di udara, suhu udara serta intensitas cahaya matahari (Higgins dan Scheiter 2012; Cravenet al. 2011; Smith dan Dukes 2013). Semua hal tersebut sangat berkaitan dengan proses fotosintesis yang terjadi pada klorofil daun tanaman. Faktor yang secara tidak langsung mempengaruhi proses fotosintesis adalah ketersediaan hara tanaman sebagai prekursor bagi biosintesis organ-organ yang terlibat dalam proses tersebut, seperti protein, klorofil dan molekul pembawa energi (ATP dan NADP) (Baker 2008; Wanget al. 2014).
Telah banyak dilaporkan bahwa pemanfaatan fungi mikoriza arbuskular (FMA) dan bakteri dapat meningkatkan efisiensi penggunaan pupuk kimia. Sebagian kelompok bakteri ini merupakan bakteri penambat N2(Basak dan Biswas 2010; Bhattacharyya dan Jha 2012), bakteri pelarut fosfat (Awasthi et al. 2011; Bhattacharyya dan Jha 2012), bakteri pelarut kalium (Archanaet al. 2013; Basak dan Biswas 2010; ) dan bakteri penghasil fitohormon (Asghar et al. 2002; Benabdellahet al. 2011; Bogaet al. 2012). Hingga kini, banyak jenis bakteri yang mampu meningkatkan efisiensi pemakaian pupuk kimia pada budidaya tanaman seperti Azospirillum brasilense,Streptomyces sp.,Stenotrophomonas maltophilia, Ralstonia pickettiidanBacillus megaterium(Ardakaniet al. 2011; Adesemoye dan Kloepper 2009; Bulut 2013).
Penelitian mengenai pengaruh FMA terhadap peningkatan pertumbuhan sorgum manis dan pertukaran gas fotosintesis sudah dilakukan oleh beberapa peneliti, tetapi masih belum banyak yang meneliti pengaruh interaksi FMA dengan rizobakteri dan pemberian pupuk kimia terhadap produksi gula batang sorgum manis sekaligus dalam meningkatkan efisiensi penggunaan pupuk kimia yang dilakukan di lahan marjinal. Banyaknya jumlah lahan marginal yang belum dimanfaatkan dengan baik di Indonesia dan perlunya pengembangan sorgum manis sebagai sumber bahan baku bioenergi masa depan menjadikan penelitian ini cukup penting untuk dilakukan. Akhirnya hasil riset ini ke depan diharapkan dapat dimanfaatkan secara optimal untuk meningkatkan produksi gula tanaman sorgum manis serta untuk meningkatkan efisiensi penggunaan pupuk kimia, sehingga dapat mengurangi biaya produksi pengembangan tanaman sorgum manis sebagai tanaman penghasil bioenergi masa depan.
1.2 Perumusan Masalah
Di Indonesia lahan marjinal dapat berupa lahan basah maupun lahan kering. Lahan basah berupa lahan gambut, sulfat masam dan rawa pasang surut dengan luas kurang lebih 24 juta ha, sedangkan lahan kering berupa tanah ultisol dengan luas kurang lebih 47.5 juta ha dan oxisol dengan luas 18 juta ha (Suprapto 2002). Lahan-lahan tersebut kondisi kesuburannya rendah, sehingga diperlukan inovasi teknologi untuk memperbaiki produktivitasnya.
Sorgum manis merupakan tanaman sumber bahan baku bioenergi yang potensial untuk dikembangkan di masa depan, karena dapat dibudidayakan di lahan marjinal dan pengembangannya tidak akan berkompetisi dengan kebutuhan akan pengembangan tanaman pangan. Hingga kini, pengembangan budidaya sorgum manis di lahan marjinal masih mengalami kendala, yaitu tingkat produktivitas yang masih rendah. Salah satu pendekatan dalam meningkatkan produktivitas sorgum manis terutama di lahan marjinal adalah pemanfaatan mikrob tanah seperti fungi mikoriza arbuskular (FMA) dan rizobakteri.
sorgum manis berkaitan dengan proses fotosintesis yang terjadi pada klorofil daun. Dengan mempelajari dan memahami faktor-faktor yang paling berpengaruh terhadap peningkatan produksi gula sorgum manis, maka dapat dirancang teknologi budidaya sorgum manis dengan hasil yang optimal terutama bila ditanam di lahan marjinal yang masih belum banyak dimanfaatkan secara optimal di Indonesia.
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut :
1. Mendapatkan isolat fungi mikoriza arbuskular (FMA) dan rizobakteri dari rizosfir tanaman Gramineae (sorgum, padi dan jagung) yang berasal dari beberapa jenis tanah di Indonesia yang dapat meningkatkan pertumbuhan dan kandungan klorofil daun sorgum manis.
2. Mengkaji kemampuan isolat rizobakteri dalam menambat N2, melarutkan fosfat dan menghasilkan fitohormon (Indole-3-acetic acid, Gibberelic acid dan 6-Benzylaminopurine) dan peranannya dalam meningkatkan kandungan gula batang sorgum manis.
3. Mengkaji peranan FMA dan interaksinya dengan rizobakteri dalam meningkatkan proses fotosintesis dan kandungan gula batang sorgum manis. 4. Mengkaji peranan FMA dan rizobakteri dalam meningkatkan efisiensi
penyerapan hara tanaman sorgum manis.
1.4 Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah :
1. Isolat-isolat fungi mikoriza arbuskular (FMA) dan rizobakteri yang berasal dari rizosfir tanamanGramineae(sorgum, padi dan jagung) memiliki kemampuan yang berbeda dalam meningkatkan pertumbuhan dan kandungan klorofil sorgum manis.
2. Kemampuan rizobakteri dalam menambat N2, melarutkan fosfat dan menghasilkan fitohormon berkaitan erat dengan peningkatan kandungan gula batang sorgum manis.
3. FMA secara sinergis dapat berinteraksi dengan rizobakteri dalam meningkatkan kandungan gula batang sorgum manis yang berkaitan erat dengan peningkatan proses fotosintesis yang terjadi pada daun sorgum manis.
1.5 Manfaat Penelitian
Hasil-hasil penelitian berupa isolat fungi mikoriza arbuskular (FMA) dan rizobakteri selanjutnya akan diformulasi menjadi produk biofertilizer yang khusus untuk meningkatkan produktivitas sorgum manis di lahan marjinal dalam hal ini tanah ultisol dan dapat diaplikasikan oleh petani maupun perusahaan perkebunan untuk pengembangan budidaya sorgum manis sebagai bahan baku bioetanol.
Teknologi pengembangan budidaya sorgum manis dengan menggunakan kombinasi perlakuan FMA, rizobakteri dan pemberian pupuk kimia dengan dosis tertentu dalam meningkatkan efisiensi penyerapan hara dapat diterapkan baik oleh petani maupun perusahaan perkebunan yang mengembangkan budidaya tanaman sorgum manis.
Akhirnya hasil riset ini ke depan diharapkan dapat dimanfaatkan secara optimal untuk meningkatkan produksi gula batang sorgum manis yang cukup potensial untuk dikembangkan sebagai penghasil bioenergi masa depan.
1.6 Novelty (Kebaruan)
Berdasarkan hasil-hasil dari penelitian ini diperoleh beberapa kebaruan (novelty) sebagai berikut :
1. Diperoleh isolat Mycobacterium senegalense LR73 yang memiliki kemampuan menambat N2, melarutkan fosfat, menghasilkan fitohormon (Indole-3-acetic acid, Gibberelic acid dan 6-Benzylaminopurine) dan meningkatkan kandungan gula sorgum manis (Sorghum bicolorL. Moech). Berdasarkan penelusuran pustaka, belum ditemukan bahwa spesies Mycobacterium senegalense memiliki kemampuan menambat N2, melarutkan fosfat, menghasilkan fitohormon (Indole-3-acetic acid, Gibberelic acid dan 6-Benzylaminopurine) dan meningkatkan produksi gula batang sorgum manis.
2. Berdasarkan hasil analisis kandungan hara kalium, ditemukan bahwa interaksi antaraMycobacterium senegalenseLR73 dan FMA (Gigasporasp. MDL40 danGlomussp. MDL38) mampu meningkatkan kandungan kalium dengan konsentrasi paling tinggi sebesar kurang lebih 3%. Hasil tersebut menunjukkan bahwa Mycobacterium senegalense LR73 adalah bakteri pelarut kalium. Hasil tersebut merupakan suatu penemuan baru, karena belum ditemukan publikasi yang menunjukkan bahwa terdapat bakteri dengan spesiesMycobacterium senegalenseLR73 yang mampu melarutkan unsur kalium dari bentuk yang terikat menjadi tersedia untuk tanaman. 3. Pada umumnya, bakteri dari genusMycobacteriummerupakan patogen bagi
berpotensi untuk dijadikan sebagai bahan aktif pembuatan biofertilizer. Biofertilizer dengan bahan aktif Mycobacterium senegalense LR73 merupakan biofertilizer jenis baru, karena belum ada produk biofertilizer dengan bahan aktif jenis bakteri tersebut.
1.7 Ruang Lingkup Penelitian
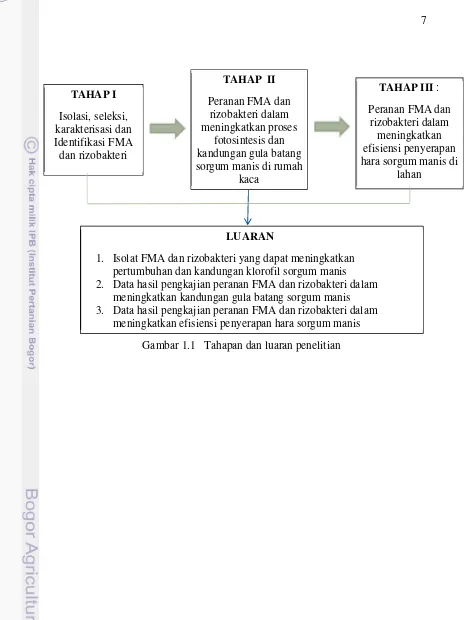
Gambar 1.1 Tahapan dan luaran penelitian
TAHAP I
Isolasi, seleksi, karakterisasi dan Identifikasi FMA dan rizobakteri
TAHAP II
Peranan FMA dan rizobakteri dalam meningkatkan proses
fotosintesis dan kandungan gula batang sorgum manis di rumah
kaca
TAHAP III: Peranan FMA dan
rizobakteri dalam meningkatkan efisiensi penyerapan hara sorgum manis di
lahan
LUARAN
1. Isolat FMA dan rizobakteri yang dapat meningkatkan pertumbuhan dan kandungan klorofil sorgum manis 2. Data hasil pengkajian peranan FMA dan rizobakteri dalam
meningkatkan kandungan gula batang sorgum manis 3. Data hasil pengkajian peranan FMA dan rizobakteri dalam
2 TINJAUAN PUSTAKA
2.1 Prospek Pengembangan Sorgum Manis
Sorgum manis (Sorghum bicolor L. Moench) merupakan tanaman serealia yang memiliki manfaat yang cukup banyak, diantaranya bijinya dapat dijadikan sebagai bahan pangan, batang dan daunnya sebagai pakan ternak, gula yang terkandung dalam biji atau nira batang dapat diproses menjadi bioetanol. Menurut Reddy (2010), sebagai bahan pangan, sorgum manis menempati peringkat kelima di dunia setelah padi, gandum, jagung dan barley. Biji sorgum manis yang mengandung karbohidrat cukup tinggi sering digunakan sebagai bahan baku industri seperti industribeer,pati, gula cair (sirup),jaggery(semacam gula merah), etanol, lem, cat, kertas, degradable plastics dan lain sebagainya. Dibandingkan dengan beras, sorgum manis unggul dari segi kandungan mineral seperti Ca, Fe, P dan kandungan vitamin B1-nya (Betiet al. 1996). Sementara itu, Widowatiet al. (2010) menyatakan bahwa kandungan gizi sorgum tidak kalah dengan beras. Sorgum mengandung protein (8-12%) setara dengan terigu atau lebih tinggi dari beras (6-10%) dan kandungan lemaknya (2-6%) lebih tinggi dibandingkan dengan beras (0.5-1.5%).
Kelemahan sorgum manis sebagai komoditas bahan pangan adalah sorgum mempunyai senyawa antigizi yang cukup banyak yaitu tanin (Widowati et al. 2010). Tanin adalah senyawa polifenolitik yang dapat membentuk kompleks dengan protein maupun pati sehingga kedua komponen tersebut menjadi lebih sulit dicerna (Griffiths dan Moseley 1980; Mueller-Harvey et al. 1986). Hal tersebut menunjukkan bahwa meskipun kandungan zat gizi (protein dan karbohidrat) sorgum cukup tinggi, tetapi nilai gizinya relatif rendah.
Sebagai sumber bahan baku bioetanol, sorgum manis dapat dikonversi menjadi bahan bakar karena batangnya mengandung gula yang dapat difermentasi menjadi bioetanol. Almodares dan Hadi (2009) menyatakan bahwa sorgum manis sebagai penghasil bioetanol memiliki produktivitas yang lebih tinggi dibandingkan tanaman lain seperti tebu dan jagung. Sorgum manis juga menghasilkan etanol lebih tinggi dibandingkan jagung dan sorgum penghasil biji (Smith dan Buxton 1993), karena penggunaan karbohidrat yang tersimpan dalam batang sorgum manis dalam bentuk gula dengan konsentrasi 8-20% lebih menguntungkan daripada pati (Rains et al.1990).
Sorgum manis memiliki daya adaptasi luas mulai dari dataran rendah, sedang sampai dataran tinggi. Sorgum manis dikenal sebagai tanaman yang tahan tumbuh pada kondisi kekeringan. Permukaan daun sorgum manis yang mengandung lapisan lilin dan sistem perakaran yang ekstensif dan dalam cenderung membuat tanaman tersebut efisien dalam penyerapan dan pemanfaatan air (Baheshti dan Fard 2010; Tingting et al. 2010; Unlu dan Steduto 2000; Wang et al. 2014). Disamping itu, sorgum manis memiliki sifat tahan terhadap kadar garam tinggi (Almodareset al. 2008; Netondoet al. 2004) dan keracunan aluminium (Baligaret al.1993; Janssen et al. 2010).
Seiring dengan program yang dicanangkan pemerintah mengenai pencarian dan pengembangan sumber energi baru dan terbarukan, maka pada tahun 2007, Perhutani Jawa Tengah telah mulai melakukan penanaman 4000 ha sorgum manis sebagai bagian dari program alokasi 78000 ha lahan untuk tanaman penghasil bioenergi (www.inaplas.org). Sementara itu, Departemen Pertanian menargetkan pengembangan sorgum manis pada tahun 2007 sebanyak 57000 ton dengan luas lahan 19000 ha dan pada tahun 2009 menargetkan terjadi peningkatan produksi sebanyak 75000 ton. Pada bulan Juni 2008, tim pengembangan Bahan Bakar Nabati (BBN) melaporkan telah dilakukan pengembangan 20 ha lahan budidaya sorgum manis sebagai langkah awal dari program budidaya tanaman bioenergi (www.detikfinance.com). Dengan demikian, pengembangan bididaya tanaman sorgum manis ke depan akan makin terus ditingkatkan seiring kebutuhan akan sumber bahan bakar nabati yang akan terus berkembang.
Gambar 2.1 Sorgum manis (Sorghum bicolorL. Moench)
2.2 Pemanfaatan Fungi Mikoriza Arbuskular (FMA)
tanaman inang dan tidak dapat dikembangbiakan dengan cara fermentasi seperti bakteri atau ektomikoriza. Fungi ini cukup luas penyebarannya di alam dan memiliki jenis tanaman inang yang banyak. FMA relatif penting bagi tanaman yang pertumbuhannya di bawah kondisi kering atau kritis dibandingkan dengan tanah yang subur. Beberapa genus yang tergolong ke dalam FMA adalah: Glomus, Gigaspora,AcaulosporadanScutellospora(Brundrettet al.1996).
Fosfor (P) adalah unsur utama yang dapat diserap oleh tanaman bermikoriza dan beberapa unsur mikro seperti Zn, Cu, Mo dan B. FMA dapat mengeluarkan enzim fosfatase yang dapat merubah P organik tidak tersedia menjadi tersedia bagi tanaman (Augeet al.2007; Hadadet al.2012; Mau dan Utami 2014).
FMA diketahui dapat melindungi akar tanaman dari serangan patogen. Mekanisme perlindungan tersebut sangat berhubungan dengan perubahan pada morfologi, fisiologi atau biokimia dari tanaman inang. Perubahan morfologi seperti lignifikasi dari dinding sel, produksi polisakarida dan peningkatan sistem vaskular dari tanaman dapat melindungi akar dari patogen karena sulitnya penetrasi patogen pada akar. Perubahan fisiologi seperti meningkatnya konsentrasi P dan K pada jaringan tanaman menyebabkan meningkatnya ketahanan akar terhadap patogen (Auge 2004).
Simbiosis FMA juga dapat memodifikasi hubungan hormonal tanaman inangnya. FMA yang menyelimuti jaringan akar bagian luar mempengaruhi organ-organ tanaman yang jauh dari perakaran seperti stomata daun dengan cara merubah aliran informasi hormonal dari akar ke batang dalam transpirasi (Goicoecheaet al. 1997; Nikolaou et al. 2003). Penyerapan air oleh hifa FMA atau peningkatan serapan air oleh simbiosis FMA berhubungan dengan perubahan morfologi perakaran FMA, sehingga secara efektif meningkatkan akses akar ke reservoir air tanah (Marulanda et al. 2003). Hal ini mendukung gagasan bahwa tanaman bermikoriza memiliki akses terhadap air pada saat air tersebut tidak tersedia untuk tanaman-tanaman tak bermikoriza (titik layu permanen) (Auge 2004).
Banyak laporan penelitian yang membandingkan antara struktur tanah pada rizosfir tanaman bermikoriza dan tanaman tak bermikoriza. Menurut Auge (2004), FMA merupakan mikrob tanah paling efektif dalam menstabilkan struktur tanah. Miller dan Jastrow (2000) menyatakan bahwa hifa FMA berkembang di dalam matriks tanah membentuk struktur rangka yang dapat menahan partikel-partikel tanah primer secara bersama-sama melalui interaksi fisik. Struktur tersebut membentuk formasi mikroagregat dan selanjutnya berkembang menjadi struktur makroagregat. FMA menghasilkan sejumlah glomalin glycoprotein, dimana konsentrasi glomalin berhubungan erat dengan stabilitas agregat dalam tanah (Wright dan Upadhyaya 1998; Rilig 2004).
glomalin yang diproduksi mikoriza arbuskular merupakan faktor penting dalam agregasi tanah (Rilig 2004).
Struktur tanah berhubungan erat dengan ruang pori sama halnya dengan ukuran agregat. Jumlah dan dimensi ruang pori diantara partikel-partikel tanah sangat penting dalam fungsi struktur tanah, khususnya dari sudut pandang hubungan air-tanah. Karakteristik kelembaban tanah tergantung pada ukuran dan distribusi pori tersebut (Auge 2004). Karena FMA mempengaruhi struktur tanah, maka dapat diduga bahwa kolonisasi mikoriza arbuskular berpengaruh terhadap retensi kelembaban dan pertumbuhan tanaman, terutama pada tanah-tanah yang relatif kering. Struktur tanah yang baik mengandung lebih banyak air dibandingkan dengan struktur tanah yang kurang baik atau yang sama sekali tidak baik. Tanah-tanah bermikoriza secara nyata memiliki kandungan air yang lebih tinggi daripada tanah-tanah tak bermikoriza.
2.3 Pemanfaatan Rizobakteri
Rizobakteri adalah populasi bakteri yang hidup di wilayah perakaran tanaman dan berinteraksi dengan tanaman melalui perakaran tanaman tersebut. Peningkatan produktivitas tanaman oleh rizobakteri dapat terjadi secara langsung maupun tidak langsung. Mekanisme secara langsung adalah melalui penambatan N2, pelarutan mineral seperti fosfor dan kalium, atau melalui produksi fitohormon. Mekanisme secara tidak langsung adalah melalui produksi senyawa yang dapat mengontrol patogen. Suatu bakteri dapat mempengaruhi pertumbuhan tanaman melalui satu atau lebih mekanisme. Bakteri ini juga dapat memiliki kemampuan yang berbeda pada waktu yang berbeda selama siklus hidup tanaman (Timmusk et al. 2003). Demikian pula cara suatu rizobakteri mempengaruhi pertumbuhan tanaman berbeda antara satu spesies dengan spesies lainnya. Hingga kini, banyak spesies rizobakteri yang mampu mengkolonisasi tanaman tebu, jagung, sorgum dan singkong (Dobereineret al.1997).
2.3.1 Bakteri Penambat N2
Bakteri penambat N2adalah bakteri yang dapat menambat N2dari udara dan berinteraksi dengan tanaman, sehingga dapat membantu menyediakan sumber hara nitrogen bagi tanaman. Disamping itu, bakteri penambat N2pada umumnya dapat memproduksi fitohormon yang membantu meningkatkan pertumbuhan tanaman. Mengingat peranan bakteri penambat N2 yang sangat besar bagi tanaman, maka bakteri ini dapat dijadikan sebagai salah satu alternatif teknologi untuk membantu pertumbuhan, meningkatkan produktivitas dan kualitas tanaman terutama pada lahan-lahan marjinal yang kurang subur.
amonium melalui reduksi elektron dan protonisasi gas N2. Kemampuan Azotobacterdalam menambat N2telah diketahui pertama kali olehBeijerinckpada tahun 1901.KemampuanAzotobacterdalam menambat N2 memiliki keterbatasan, yaitu rendahnya kapasitas penambatan N2olehAzotobacterkarena bakteri tersebut bersifat non simbiotik dengan tanaman. Dari hasil-hasil penelitian, ternyata terdapat faktor lain yang berperan dalam peningkatan pertumbuhan tanaman oleh Azotobacter yaitu produksi fitohormon, pemutusan siklus hama dan penyakit melalui perubahan karakteristik mikrob, fisik, kimia tanah, dan atau melalui peningkatan aktifitas makrofauna tanah seperti cacing tanah (People et al. 1995).
Hasil penelitian yang dilakukan Joseph et al. (2007) menunjukkan 50% pupuk nitrogen dapat dikurangi penggunaannnya dengan inokulasiAzotobactersp. Pada pembibitan, Azotobacter sp. selain mampu menambat N2 juga mampu mensintesa substansi yang secara biologis aktif seperti vitamin B, Indole-3-acetic acid (IAA) dan Gibberelic acid (GA) dalam kultur murni. Azotobacter sp. dapat meningkatkan perkecambahan biji dan pertumbuhan. Beberapa percobaan yang dilakukan di daerah beriklim sedang menunjukkan bahwa penambatan N2 pada tanah yang diinokulasikan denganAzotobactersp. menghasilkan kira-kira 10-15 kg nitrogen ha-1 tahun-1 tergantung dari tersedianya sumber karbon (Rao 1994). Fitohormon yang dihasilkan oleh Azotobacter sp. seperti IAA, GA, kinetin dan vitamin B dapat meningkatkan pertumbuhan tanaman, merangsang perkembangan dan perbanyakan sel-sel lateral, yang pada akhirnya dapat meningkatkan kemampuan tanaman dalam menyerap hara.
Azosprillum sebagai bakteri penambat N2 yang hidup bebas dan dapat berasosiasi dengan tanaman rumput-rumputan (Gramineae) memiliki 4 spesies yaitu A. lipoferum, A. brasilense, A. amazonese dan A. serapedica. Azosprillum dapat diisolasi dalam medium setengah padat yang mengandung malat. Mikrob tersebut dapat menghasilkan fitohormon seperti IAA, GA dan kinetin.A. lipoferum dapat menambat N2pada beberapa rumput pakan tropis seperti digitaria, panicum, brachiaria, sorgum dan gandum. Percobaan lapangan menunjukkan bahwa inokulasi biji-biji Sorghum vulgare, Pennisetum americanum dan Eleusine corocana dapat meningkatkan hasil panen biji dan biomassa dalam kondisi argoklimat yang berbeda-beda di India (Rao 1994).
Intensitas pengaruh Azosprillum terhadap tanaman tergantung pada lingkungan dan kondisi tanah, spesies dan kultivar tanaman, serta konsentrasi optimal inokulum Azosprillum. Pengaruh maksimal dari inokulasi Azosprillum diperoleh dengan kadar inokulan optimal sebesar 107 sel per tanaman dan tergantung dari kompetisi populasi di daerah rizosfir serta kandungan bahan organik tanah (Zahera dan Okon 1993).
2.3.2 Bakteri Pelarut Fosfat
telah jenuh P. P tersebut tidak dapat dimanfaatkan semaksimal mungkin oleh tanaman, karena P berada dalam bentuk terikat dalam tanah, sehingga petani tetap melakukan pemupukan P di lahan sawah walaupun sudah terdapat kandungan P yang cukup memadai. Adanya pengikatan P tersebut menyebabkan pupuk P yang diberikan tidak efisien, sehingga perlu diberikan dalam jumlah yang tinggi.
Salah satu alternatif untuk meningkatkan efisiensi pemupukan P (fosfat) adalah dengan memanfaatkan kelompok bakteri yang dapat melarutkan fosfat tidak tersedia menjadi tersedia, sehingga dapat diserap oleh tanaman. Mikrob yang termasuk ke dalam kelompok bakteri pelarut fosfat antara lain Pseudomonas striata, P. diminuta, P. fluorescens, P. cerevisia, P. aeruginosa, P. putida, P. denitrificans, P. rathonis, Bacillus polymyxa, B. laevolacticus, B. megatherium, Thiobacillus sp., Micrococcus, Flavobacterium, Escherichia freundii, Cunninghamella, Brevibacterium spp., Serratia spp., Alcaligens spp., Achromobacterspp. danThiobacillussp. (Gintinget al. 2007).
Di dalam tanah, fosfat terdapat dalam bentuk organik dan anorganik yang merupakan sumber fosfat penting bagi tanaman. Fosfat organik berasal dari bahan organik, sedangkan fosfat anorganik berasal dari mineral-mineral yang mengandung fosfat. Pelarutan senyawa fosfat oleh bakteri pelarut fosfat berlangsung secara kimia dan biologis baik dalam bentuk fosfat organik maupun anorganik. Premonoet al. (1992) mengatakan bahwa mikrob pelarut fosfat secara nyata mampu mengurangi Fe, Mn, dan Cu yang terserap oleh tanaman jagung yang ditanam pada tanah masam, sehingga berada pada tingkat kandungan yang normal. Dengan demikian, dapat dikatakan bahwa bakteri pelarut fosfat selain dapat melarutkan fosfat yang terikat dalam mineral tanah menjadi tersedia bagi tanaman, juga dapat mengatasi keracunan tanaman oleh hara-hara mikro seperti Fe, Mn dan Cu yang berada dalam jumlah berlebihan dalam tanah.
2.4 Produksi Gula dan Kaitannya dengan Fotosintesis
Produksi gula dalam batang tanaman sorgum manis berkaitan dengan proses fotosintesis yang terjadi pada daun tanaman sorgum manis. Rangkaian reaksi fotosintesis dibagi menjadi dua bagian utama, yaitu reaksi terang dan reaksi gelap. Pada reaksi terang, terjadi konversi energi cahaya menjadi energi kimia dan menghasilkan oksigen (O2), sedangkan pada reaksi gelap terjadi seri reaksi siklik yang membentuk gula dari bahan dasar CO2dan energi. Proses fotosintesis masih terus dipelajari, karena terdapat sejumlah tahap yang masih belum bisa dijelaskan, meskipun telah banyak yang diketahui tentang proses tersebut. Proses fotosintesis sangat kompleks karena melibatkan semua cabang ilmu pengetahuan alam, seperti fisika, kimia dan biologi.
Kloroplas terdapat pada semua bagian tumbuhan yang berwarna hijau terutama daun (O'Keefe 1988). Di dalam kloroplas terdapat pigmen klorofil yang berperan dalam proses fotosintesis (Krause 2008). Kloroplas mempunyai bentuk seperti cakram dengan ruang yang disebut stroma. Stroma dibungkus oleh dua lapisan membran yang disebut tilakoid, dimana didalamnya terdapat ruang-ruang antar membran yang disebut lokuli. Di dalam stroma juga terdapat lamela-lamela yang bertumpuk-tumpuk membentuk grana (kumpulan granum). Granum terdiri atas membran tilakoid yang merupakan tempat terjadinya reaksi terang (O'Keefe 1988). Pengubahan energi cahaya menjadi energi kimia berlangsung dalam tilakoid dengan produk akhir berupa glukosa (gula) yang dibentuk di dalam stroma (Prawirohartono 2005).
Berbagai faktor telah dilaporkan mempengaruhi laju fotosintesis pada tanaman diantaranya faktor serapan hara (Funnel-Hariset al.2010; El-lattief 2011), kelembaban media tanam/kandungan H2O (Unlu dan Steduto 2000; Pinheiro dan Chaves 2011; Paul dan Foyer 2001; Goicoechaea et al. 1997) serta faktor lingkungan seperti konsentrasi CO2 di udara, suhu udara serta intensitas cahaya matahari (Higgins dan Scheiter 2012; Cravenet al.2011; Smith dan Dukes 2013). Faktor yang secara tidak langsung mempengaruhi proses fotosintesis adalah ketersediaan hara tanaman sebagai prekursor bagi biosintesis organ-organ yang terlibat dalam proses tersebut, seperti protein, klorofil, molekul pembawa energi (ATP, NADP), dan lain sebagainya (Baker 2008; Wanget al. 2014).
Pada proses fotosintesis, unsur fosfor berperan penting dalam biosintesis gula, aktivasi enzim Rubisco dan ketersediaan energi seperti ATP dan NADPH. Sementara itu, ketersedian unsur nitrogen merupakan salah satu faktor yang paling penting yang mempengaruhi fisiologi selular (Lardonet al.2009; Chenet al.2011; Forde 2002). Ketidakseimbangan rasio antara karbon dan nitrogen juga mempengaruhi aktivitas metabolik dari enzim-enzim, tidak hanya dalam proses asimilasi nitrogen tetapi juga dalam kapasitas fotosintetik, akumulasi pati dan gula (Ball et al. 1990). Disamping unsur P dan N, unsur K juga sangat berpengaruh terhadap proses fotosintesis. Ketersediaan unsur K mempengaruhi efisiensi penggunaan air, konduktansi stomata dan laju fotosintesis, (Kanai et al. 2011; Gatwardet al. 2012; Jin et al. 2011).
2.5 Efisiensi Penyerapan Hara
Efisiensi penyerapan hara dapat didefinisikan berdasarkan aspek agronomi, ekonomi dan lingkungan. Secara umum, semakin banyak hara yang diserap tanaman untuk meningkatkan hasil panen, maka tingkat efisiensi semakin tinggi. Pelacakan sejauh mana hara yang dapat diserap tanaman dalam rangka meningkatkan produksi adalah komponen kunci untuk mengukur efisiensi penyerapan hara.
kesuburan lahan semakin lama semakin menurun. Pemakaian pupuk kimia dalam jangka waktu lama dan dalam dosis yang berlebihan menyebabkan daya dukung tanah terhadap pertumbuhan tanaman menjadi terganggu. Pada umumnya tanah yang terlalu jenuh dengan bahan-bahan kimia yang berasal dari pemakaian pupuk kimia dan pestisida kimia menyebabkan tanah berkurang kemampuannya dalam mengikat hara-hara yang ditambahkan kemudian. Oleh karena itu, pemakaian pupuk kimia selanjutnya sudah tidak efisien karena sebagian besar pupuk kimia yang ditambahkan akan mudah tercuci bersama aliran air sebelum pupuk kimia tersebut dapat diserap oleh tanaman. Pemakaian pupuk kimia secara intensif yang berkaitan dengan hilangnya hara yang ditambahkan dapat menyebabkan eutrofikasi badan-badan air, pengasaman tanah dan potensi pencemaran air oleh senyawa-senyawa nitrat. Bila hal tersebut dibiarkan, maka tanah, air dan lingkungan di sekitarnya akan mengalami penurunan kualitas dan hal tersebut tentu saja dapat mempengaruhi kualitas kehidupan manusia di sekitarnya. Salah satu solusi untuk mengatasi masalah tersebut adalah perlunya upaya untuk meningkatkan tingkat efisiensi pemakaian pupuk kimia, sehingga dengan pemakaian pupuk kimia secukupnya mampu mempertahankan tingkat produktivitas lahan dan tanaman (Mikkelsen 2005; Liu et al. 2010; Abrol et al. 2012; Adesemoye dan Kloepper 2009; Altomare dan Tringovska 2011; Ardakaniet al.2011).
3 METODE
Penelitian ini terdiri dari tiga bagian penelitian yang satu sama lain saling terkait, yaitu : (1) isolasi, seleksi, karakterisasi dan identifikasi fungi mikoriza arbuskular (FMA) dan rizobakteri yang dapat meningkatkan pertumbuhan dan kandungan klorofil tanaman sorgum manis; (2) peranan FMA dan rizobakteri dalam meningkatkan proses fotosintesis, pengambilan hara, pertumbuhan dan kandungan gula batang sorgum manis; dan (3) peranan FMA dan rizobakteri dalam meningkatkan efisiensi penyerapan hara sorgum manis yang ditanam di Lahan Puspiptek Serpong.
3.1 Isolasi, Seleksi, Karakterisasi dan Identifikasi FMA dan Rizobakteri
3.1.1 Bahan yang Digunakan
Untuk isolasi FMA dan rizobakteri, sampel tanah diperoleh dari beberapa lokasi di Indonesia, yaitu Sulusuban Lampung Tengah, Deli Sumatera Utara, Malang Jawa Timur, Sukabumi Jawa Barat, Jember Jawa Timur dan Jasinga Bogor Jawa Barat. Sampel tanah diambil dari rizosfir tanaman sorgum manis varietas Numbu, RG54 dan Kawali, jagung varietas Lamuru dan padi varietas Ciherang.
Untuk seleksi isolat FMA dan rizobakteri yang dapat meningkatkan pertumbuhan dan kandungan klorofil daun sorgum manis, media tanam yang digunakan adalah tanah ultisol yang diperoleh dari Gajrug, Desa Malangsari, Kecamatan Cipanas, Kabupaten Lebak, Banten. Sebagai campuran media tanam adalah pasir yang diperoleh dari sungai Cisadane, Cisauk, Tangerang, Banten. Berdasarkan analisis terhadap data yang diperoleh, tanah tersebut dapat diklasifikasikan menurut taksonomi tanah (Soil Survey Staff 2010) sebagai Typic HapludultsatauPodsolik Haplik(PPT 1983) dengan ciri-ciri sebagai berikut :
• Memiliki horizon penciri bawah Argilik yang ditunjukkan oleh adanya peningkatan liat pada horizon bawah/horizon iluviasi sebesar lebih dari 8% dibandingkan horizon atas/horizon eluviasi.
• Memiliki ciri-ciri kejenuhan basa < 35%
• KTK liat >16 cmol/kg ((KTK tanah/%liat)x 100%).
Anggraini (1991) melaporkan tanah ultisol gajrug memiliki solum tanah sedang sampai dalam (< 150 cm), atau terdapat horizon BC (horizon peralihan antara horizon B dan C/bahan induk tanah) pada kedalaman < 150 cm. Hal ini menunjukkan ciri-cri dariHapludults.
3.1.2 Alat yang Digunakan
Alat yang digunakan untuk mengukur kandungan klorofil adalahChlorophyll content meter CCM-200. Alat untuk mendeteksi dan mengukur konsentrasi senyawa fitohormon sitokinin adalahThin Layer Chromatography(TLC) danHigh Performance Liquid Chromatography (HPLC) (Waters). Alat yang digunakan untuk mengukur konsentrasi N2yang terfiksasi adalah Gas Chromatography–Mass Spectrophotometer (Shimadzu 18A). Alat untuk mengukur konsentrasi fosfat terlarut serta fitohormon IAA dan GA adalah Spectrophotometer UV- VIS (Shimadzu 160A). Sementara itu, alat yang digunakan untuk identifikasi bakteri adalah PCR (TAKARA TP.600/D-5287) dan Sequencer (Applied Biosystem 3130).
3.1.3 Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Agromikrobiologi, Laboratorium Analisis Kimia, Laboratorium Teknologi Gen Balai Pengkajian Bioteknologi BPPT Serpong Tangerang dan Laboratorium Bioteknologi Tanah, Fakultas Pertanian IPB Bogor, dari bulan Maret 2011 s.d. Nopember 2011.
3.1.4 Prosedur Percobaan
Analisis Kimia Media Tanam
Media tanam yang digunakan adalah tanah ultisol dan pasir dengan perbandingan 1 : 1 (v/v). Sebelum digunakan, media tanam disterilisasi dengan menggunakan bahan kimia Basamid G dan dianalisis sifat-sifat kimianya. Berdasarkan hasil analisis kimia media tanam diketahui bahwa pH H2O 4.5, pH KCl 3.9, kandungan C 0.92%, N 0.09%, rasio C/N 10, P2O5HCl 18 mg per 100g, K2O HCl 12 mg per 100g, P2O5Bray 2.7 ppm, K2O Morgan 63 ppm, Ca 3.05 cmol kg-1, Mg 0.62 cmol kg-1, K 0.12 cmol kg-1, Na 0.06 cmol kg-1, KTK 14.62, KB 26%, kandungan Al+ 2.36 cmol kg-1dan H+ 0.31 cmol kg-1.
Isolasi Fungi Mikoriza Arbuskular (FMA)
FMA diisolasi dengan menggunakan teknik ekstraksi spora (Gerdemann dan Nicolson 1963). Sebanyak 100 g tanah disaring dalam keadaan basah dengan menggunakan saringan bertingkat. Spora diambil dan dipisahkan di bawah mikroskop stereo dan dikumpulkan sesuai dengan karakteristik morfologinya.
Isolasi Rizobakteri
Bakteri yang tumbuh di sekitar perakaran tanaman padi, jagung dan sorgum manis diisolasi dengan menggunakan media TSA (Triptyc Soy Agar). Isolat-isolat yang diperoleh selanjutnya diuji efektivitasnya terhadap pertumbuhan dan kandungan klorofil daun sorgum manis.
Seleksi FMA dan Rizobakteri
yang digunakan adalah campuran tanah ultisol dan pasir dengan perbandingan 1:1 (v/v). Media tanam selanjutnya disterilisasi dengan cara mencampurkannya dengan bahan kimia Basamid-G (10 g per 100 kg media tanam) dan diinkubasi selama seminggu sebelum digunakan. Benih sorgum manis sebelum ditanam disterilisasi terlebih dahulu dengan cara direndam dalam HClO42% selama sepuluh detik, kemudian dibilas dengan akuades sebanyak tiga kali.
Untuk seleksi FMA, rancangan penelitian menggunakan Rancangan Acak Lengkap satu faktor, yaitu jenis FMA (A) yang terdiri dari :
A0 = Tanpa inokulasi FMA (kontrol) A1 = FMA jenis 1
Untuk seleksi rizobakteri, rancangan penelitian menggunakan Rancangan Acak Lengkap satu faktor, yaitu jenis rizobakteri (B) yang terdiri dari :
B0 = Tanpa inokulasi bakteri (kontrol) B1 = Rizobakteri jenis 1
B2 = Rizobakteri jenis 2 sampai dengan B134 = Rizobakteri jenis 134
Setiap perlakuan diulang 2 kali sehingga diperoleh 135 x 2 = 270 satuan penelitian. Pemeliharaan tanaman meliputi penyiraman yang dilakukan 2 kali dalam sehari, pagi dan sore. Setiap 2 minggu sekali diukur peubah tinggi tanaman dan kandungan klorofil daun sorgum manis selama masa percobaan 2 bulan. Setelah 2 bulan derajat kolonisasi mikoriza pada perakaran tanaman diamati di bawah mikroskop.
Penetapan Kemampuan Penambatan N2
Isolat-isolat rizobakteri yang dapat meningkatkan pertumbuhan dan kandungan klorofil sorgum manis selanjutnya diuji kemampuannya dalam menambat N2. Kemampuan penambatan N2ditentukan dengan mengukur aktivitas nitrogenase. Aktivitas nitrogenase secara tidak langsung diukur berdasarkan pengukuran pengurangan gas asetilen menjadi gas etilen atau ARA (Acetylene Reduction Assay) (Bergensen 1980). Pengukuran ARA cukup bisa mewakili aktivitas nitrogenase dibandingkan metode lain secara tidak langsung.
Sebelum dilakukan pengukuran konsentrasi gas etilen dalam sample, terlebih dahulu harus dibuat kurva standar dari gas etilen yang diketahui kadarnya. Kurva standar terdiri dari beberapa konsentrasi gas etilen. Standar gas yang digunakan biasanya lebih dari 4 tingkat konsentrasi agar ketepatannya dapat dipertanggungjawabkan. Untuk itu diperlukan pembuatan deret standar.
penyeimbang. Standar dibuat dalam berbagai konsentrasi. Sebelum gas standar dimasukkan, botol dikosongkan terlebih dahulu sebanyak gas yang akan dimasukkan ke dalam botol.
Pengukuran produksi etilen pada sampel diukur dengan prosedur yang sama dengan pengukuran pada standar. Konsentrasi etilen dalam sampel diperoleh dengan cara ekstrapolasi terhadap kurva standar.
Penetapan Kemampuan Pelarutan Fosfat
Penetapan kemampuan pelarutan fosfat dilakukan dengan menggunakan teknik spektrofotometri (Dick dan Tabatabai 1977). Pembuatan reagen dilakukan dengan cara melarutkan 0.704 g asam askorbat dan 3.268 g asam trikloroasetat dalam 10 mL air dan menambahkan lagi air hingga volume 40 mL (reagen A), melarutkan 2.472 g amonium molibdat dalam 100 mL air dan menambahkan lagi air hingga volume 200 mL (reagen B), serta melarutkan 5.882 g natrium sitrat dalam 10 mL asam asetat glasial dan mengatur volume hingga 200 mL (reagen C).
Untuk menentukan fosfat terlarut dicampurkan 0.32 mL sampel dan buffer/air, 0.40 mL reagen A, 0.08 mL reagen B, dan 0.20 mL reagen C. Absorbansi diukur pada panjang gelombang 850 nm setelah 30 menit inkubasi. Sebagai standar digunakan protein kombinasi dari asam-asam fosfat (sigma).
Penetapan Kemampuan Produksi Fitohormon
Untuk mengukur kemampuan produksi fitohormon IAA, tiap bakteri ditumbuhkan pada media pertumbuhan minimal (5 g glukosa, 0.025 g yeast extract, 0.204 g L-tryptophan) sebanyak 5 mL dalam tabung selama 72 jam pada suhu 20 °C dengan agitasi 120 rpm. Selanjutnya 1 mL suspensi bakteri dipindahkan ke dalam 1.5 mL tabung dan diendapkan pada 16.750 xg selama 10 menit. Sebanyak 90 µL supernatan ditambahkan ke dalam 60 µL reagen Salkowski (0.5 M FeCl3 dan 35% asam perklorat = 1:49) dan diinkubasi selama 30 menit dalam keadaan gelap. Absorbansi dari tiap sampel selanjutnya diukur dengan Spektrofotometer pada panjang gelombang 530 nm (Furnkranz et al. 2009). Sebagai standar digunakan IAA sintetik yang telah diketahui konsentrasinya.
Untuk menentukan konsentrasi GA, sebelumnya dibuat kurva standar. GA sintetik ditimbang sebanyak 200 mg dan dilarutkan dengan 10 mL etanol absolut, selanjutnya ditambahkan dengan air destilasi hingga 100 mL. Konsentrasi standar adalah 2 g L-1yang kemudian diencerkan dengan menambahkan larutan etanol 10% agar menjadi beberapa konsentrasi yang lebih rendah yaitu 0.01 g L-1, 0.025 g L-1, 0.05 g L-1, 0.75 g L-1, 0.125 g L-1, 0.15 g L-1 dan 0.1 g L-1. Dengan perbandingan volume 1:1 pada masing-masing konsentrasi standar ditambahkan HCl 3.75 M. Larutan standar ini selanjutnya diinkubasi selama 75 menit. Setelah inkubasi, masing-masing larutan standar diukur absorbansinya dengan menggunakan Spectrophotometer UV-VISpada panjang gelombang 254 nm.
Pengukuran kemampuan produksi sitokinin dari tiap bakteri dimulai dengan ekstraksi menggunakan metode Hussain & Hasnain (2009). Kultur rizobakteri sebanyak 20 mL diendapkan dengan kecepatan 10000 xg selama 10 menit. Supernatan dinetralkan pH-nya dengan penambahan NaOH 0.1 N (jika terlalu asam) atau HCl 0.1 N (jika terlalu basa). Supernatan yang telah dinetralkan ditambah 5 mL etil asetat dan dibuat homogen dengan menggunakanvortexselama 1 menit. Ekstrak dibiarkan beberapa saat sampai fase air terpisah dari fase etil asetat, selanjutnya fase etil asetat dipisahkan. Pemberian etil asetat dilakukan sebanyak tiga kali secara bertahap, sehingga diperoleh 15 mL fase etil asetat yang siap untuk dievaporasi. Sitokinin yang terlarut dalam etil asetat akan menempel pada dinding tabung kemudian dilarutkan dengan 100μ L metanol.
Sitokinin yang dihasilkan dideteksi dengan TLC (Patelet al. 2012) dengan cara menotolkan fraksi metanol pada pelat TLC silika G60 F254dengan pembanding sitokinin sintetik (6-Benzylaminopurine). Pelat dielusi dengan menggunakan larutan kloroform : metanol (80 : 20 v/v). Hasil elusi dikeringkan dan diperiksa menggunakan sinarultraviolet pada panjang gelombang 254 nm. Deteksi sitokinin secara kualitatif dilakukan dengan cara membandingkan nilairetention factor(Rf) sampel dengan nilai Rf standar. Hasil deteksi selanjutnya dikonfirmasi menggunakan HPLC.
Pengukuran konsentrasi sitokinin dilakukan dengan menggunakan HPLC (Patel et al. 2012). Sampel diinjeksikan sebanyak 20 μ L ke dalam kolom fase terbalik (Dicovery C18, 5 µm, dimensi kolom 25 cm x 3.0 mm). Sampel dianalisis dengan menggunakan fase gerak 40% metanol. Detektor UV ditetapkan pada panjang gelombang 270 nm. Total waktu untuk pemisahan adalah sekitar 15 menit pada laju aliran 1 mL min-1.
Penetapan Derajat Kolonisasi Mikoriza