UJI ANTAGONIS FUNGI YANG DIISOLASI DARI MARKISA UNGU (Passiflora edulis SIMS.) MENGGUNAKAN
BAKTERI KITINOLITIK LOKAL
SKRIPSI
NOERMA ASNITA 060805028
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
UJI ANTAGONIS FUNGI YANG DIISOLASI DARI MARKISA UNGU (Passiflora edulis var edulis) MENGGUNAKAN
BAKTERI KITINOLITIK LOKAL
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
NOERMA ASNITA 060805028
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : UJI ANTAGONIS FUNGI YANG DIISOLASI DARI
MARKISA UNGU (Passiflora edulis SIMS.) MENGGUNAKAN BAKTERI KITINOLITIK LOKAL
Kategori : SKRIPSI
Nama : NOERMA ASNITA
Nomor Induk Mahasiswa : 060805028
Program Studi : SARJANA (S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di Medan, Desember 2010
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Kiki Nurtjahja, M.Sc Prof. Dr. Dwi Suryanto, M.Sc
NIP. 19621211199803 1 003 NIP. 19640409199403 1 003
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
UJI ANTAGONIS YANG DIISOLASI DARI MERKISA UNGU (Passiflora edulis SIMS.) MENGGUNAKAN BAKTERI KITINOLITIK LOKAL
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Desember 2010
PENGHARGAAN
Syukur Alhamdulillah penulis panjatkan kepada Allah SWT atas segala rahmat, perlindungan, ujian dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul : ”Uji Antagonis Fungi yang Diisolasi dari Markisa Ungu (Passiflora edulis SIMS.) Menggunakan Bakteri Kitinolitik Lokal”, dengan berbagai kerja keras sehingga dapat terselesaikan.
Ucapan terimakasih tak terhingga terutama kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc (Dosen Pembimbing I dan selaku Ketua Departemen Biologi FMIPA USU) dan Bapak Drs. Kiki Nurtjahja, M.Sc (Dosen pembimbing II) yang telah banyak memberikan bimbingan, arahan, motivasi, ide, waktu, pemikiran dan tenaganya kepada penulis sampai terselesaikan penelitian ini. Ucapan terima kepada Ibu Dra. Nunuk Priyani, M.Sc (Anggota Penguji dan Selaku Sekretaris Departemen Biologi FMIPA USU) dan Ibu Dr. Suci Rahayu, M.Si (Anggota Penguji dan selaku Dosen Pengajar di Departemen Biologi FMIPA USU), kepada Ibu Mayang Sari Yeanny S.Si., M.Si selaku dosen penasehat akademi, juga kepada seluruh Dosen di Departemen Biologi FMIPA USU yang telah memberikan ilmu serta bimbingan kepada penulis selama belajar di universitas tercinta ini, serta staf pegawai di Departemen Biologi FMIPA USU.
Dengan segenap cinta dan kasih sayang penulis mengucapkan terimakasih kepada orangtua yaitu ayahanda Aziz Sofyan dan ibunda Nur’aida atas segala cinta, kasih sayang, pengorbanan, kepedulian, pengertian dan perhatiannya selama ini, juga kepada adik-adik, Hasanul Fauzi dan Muhammad Faisal atas segala suka duka yang diberikan. Allah memberikan kita ikatan kekeluargaan terbaik di dunia.
Ucapan terima kasih juga penulis sampaikan kepada sahabat-sahabat Biologi 2006 tersayang, Ivo, Ika, Yayan, Siti, Sari, Kasbi, Zulfa, Icha, Afrida, Ami, Jane, Zuki, Zulfan, Umri, Helen, Cristin, Indah, dan lain-lain. Kepada Emil, terima kasih atas perhatian, kepedulian, candaan, ketulusan, pertolongan, semangat dan hati yang selalu disediakan untuk penulis, kepada rekan-rekan asisten di Lab. Biologi Umum LIDA USU, Anti, Maika, Dwi, Aini, Affan, dan Ahri. Rekan-rekan asisten di Lab. Mikrobiologi Umum FMIPA USU, Mirza, Nila, Yanti, Asril, Resti juga rekan asisten di Lab. Struktur dan Fungsi Hewan. Kepada seluruh junior serta senior yang pernah mengukir kenangan di Biologi tercinta.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan sehingga sangat mengharapkan kritik dan saran yang membangun demi kesempurnaan hasil skripsi ini. Akhirnya dengan penuh rasa syukur dan kerendahan hati, penulis berharap karya tulis sederhana ini dapat bermanfaat bagi kita semua.
Medan, Desember 2010
ABSTRAK
Penelitian potensi antagonis bakteri kitinolitik lokal terhadap beberapa fungi patogen yang diisolasi dari tanaman markisa ungu (Passiflora edulis SIMS.) telah dilaksanakan di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara mulai April hingga November 2010. Bakteri kitinolitik lokal yang digunakan berasal dari kultur murni Laboratorium Mikrobiologi FMIPA USU, sedangkan fungi patogen berasal dari tanaman markisa ungu yang tumbuh di Brastagi. Penelitian bertujuan untuk mengetahui potensi bakteri kitinolitik terhadap beberapa fungi patogen yang diisolasi dari tanaman markisa ungu yang menunjukkan gejala penyakit yang disebabkan oleh fungi. Dari hasil isolasi diperoleh 3 jenis fungi patogen yaitu Fusarium sp.1, Fusarium sp.2 dan Alternaria sp. yang kemudian diujikan terhadap bakteri kitinolitik secara in vitro sampai terbentuk zona hambat antara bakteri dan fungi. Hasil penelitian menunjukkan isolat bakteri KM013 sp.2 merupakan isolat yang paling besar daya hambatnya terhadap Fusarium sp.1, Fusarium sp.2 dan Alternaria sp. berturut-turut yaitu 2,67 cm; 2,37 cm, dan 2,78 cm pada inkubasi hari ke-10, sedangkan isolat PP01 sp.2 memiliki daya hambat terkecil terhadap Fusarium sp.1, Fusarium sp.2 dan Alternaria sp. berturut-turut sebesar 1,62 cm; 2,27 cm dan 1,90 cm pada inkubasi hari ke-10. Berdasarkan pengamatan mikroskopik terhadap biakan uji pada inkubasi hari ke-10 ditemukan bahwa miselium fungi mengalami kerusakan seperti miselium menggulung, bengkok, lisis, terlipat dan diameter kecil.
ANTAGONISTIC POTENCY OF LOCAL CHITINOLYTIC BACTERIA ON SOME PATHOGENIC FUNGI ISOLATED FROM THE PURPLE PASSION
FRUIT (Passiflora edulis SIMS.)
NOERMA ASNITA 060805028
ABSTRACT
A study on antagonistic potency of local chitinolytic bacteria on some pathogenic fungi isolated from (Passiflora edulis SIMS.) was conducted at Laboratory of Microbiology, Department of Biology, Faculty of Mathematic and Natural Science of North Sumatera University for April to November 2010. The aim of the research was to know the chitinolytic bacteria potency to inhibit some pathogenic fungi growth of the purple passion fruit (Passiflora edulis SIMS.). The potential pathogenic fungi were isolated i.e Fusarium sp.1. Fusarium sp.2 and Alternaria sp. Antagonistic assay was done in vitro on selective media. Isolate BK15 showed relatively high ability to inhibit Fusarium sp.1. Fusarium sp.2 and Alternaria sp. growth by 1.62 cm; 2.269 cm and 1.906 cm respectively, while isolate BK14 showed small ability to inhibit Fusarium sp.1. Fusarium sp.2 and Alternaria sp. growth by 2.312 cm; 2.056 cm and 3.391 cm respectively. Microscopic observation, hypa damaged causing by the bacterial isolated varied from coil up, curve, lysis, folded and smaller diameter of mycelium.
DAFTAR ISI
Halaman
Persetujuan i
Pernyataan ii
Penghargaan iii
Abstrak iv
Abstract v
Daftar Isi vi
Daftar Tabel vii
Daftar Gambar viii Bab 1 Pendahuluan 1
1.1Permasalahan 6
1.2Tujuan Percobaan 6
1.3Hipotesis 6
1.4Manfaat 6
Bab 2 Bahan dan Metode 8
2.1 Waktu dan Tempat 8
2.2 Isolat Bakteri dan Jamur 8
2.3 Isolasi Jamur Patogen Dari Markisa 8
2.4 Uji Patogenitas Dengan Bakteri Kitinolitik 9
2.5 Pengamatan Struktur Hifa Jamur 9
Bab 3 Hasil dan Pembahasan 10
3.1 Isolasi Jamur Patogen dari Markisa Ungu 10
3.2 Uji Antagonis Bakteri Kitinolitik 13
3.3 Pengamatan Struktur Hifa Fungi Setelah Uji Antagonis 17
Bab 4 Kesimpulan dan Saran 21
4.1 Kesimpulan 21
4.2 Saran 21
DAFTAR LAMPIRAN
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
Gambar 3.1 Tanaman markisa ungu yang terserang penyakit 11
Gambar 3.2 Biakan murni fungi patogen yang diperoleh 12
Gambar 3.2 Uji antagonis bakteri kitinolitik dengan fungi patogen 16
ABSTRAK
Penelitian potensi antagonis bakteri kitinolitik lokal terhadap beberapa fungi patogen yang diisolasi dari tanaman markisa ungu (Passiflora edulis SIMS.) telah dilaksanakan di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara mulai April hingga November 2010. Bakteri kitinolitik lokal yang digunakan berasal dari kultur murni Laboratorium Mikrobiologi FMIPA USU, sedangkan fungi patogen berasal dari tanaman markisa ungu yang tumbuh di Brastagi. Penelitian bertujuan untuk mengetahui potensi bakteri kitinolitik terhadap beberapa fungi patogen yang diisolasi dari tanaman markisa ungu yang menunjukkan gejala penyakit yang disebabkan oleh fungi. Dari hasil isolasi diperoleh 3 jenis fungi patogen yaitu Fusarium sp.1, Fusarium sp.2 dan Alternaria sp. yang kemudian diujikan terhadap bakteri kitinolitik secara in vitro sampai terbentuk zona hambat antara bakteri dan fungi. Hasil penelitian menunjukkan isolat bakteri KM013 sp.2 merupakan isolat yang paling besar daya hambatnya terhadap Fusarium sp.1, Fusarium sp.2 dan Alternaria sp. berturut-turut yaitu 2,67 cm; 2,37 cm, dan 2,78 cm pada inkubasi hari ke-10, sedangkan isolat PP01 sp.2 memiliki daya hambat terkecil terhadap Fusarium sp.1, Fusarium sp.2 dan Alternaria sp. berturut-turut sebesar 1,62 cm; 2,27 cm dan 1,90 cm pada inkubasi hari ke-10. Berdasarkan pengamatan mikroskopik terhadap biakan uji pada inkubasi hari ke-10 ditemukan bahwa miselium fungi mengalami kerusakan seperti miselium menggulung, bengkok, lisis, terlipat dan diameter kecil.
ANTAGONISTIC POTENCY OF LOCAL CHITINOLYTIC BACTERIA ON SOME PATHOGENIC FUNGI ISOLATED FROM THE PURPLE PASSION
FRUIT (Passiflora edulis SIMS.)
NOERMA ASNITA 060805028
ABSTRACT
A study on antagonistic potency of local chitinolytic bacteria on some pathogenic fungi isolated from (Passiflora edulis SIMS.) was conducted at Laboratory of Microbiology, Department of Biology, Faculty of Mathematic and Natural Science of North Sumatera University for April to November 2010. The aim of the research was to know the chitinolytic bacteria potency to inhibit some pathogenic fungi growth of the purple passion fruit (Passiflora edulis SIMS.). The potential pathogenic fungi were isolated i.e Fusarium sp.1. Fusarium sp.2 and Alternaria sp. Antagonistic assay was done in vitro on selective media. Isolate BK15 showed relatively high ability to inhibit Fusarium sp.1. Fusarium sp.2 and Alternaria sp. growth by 1.62 cm; 2.269 cm and 1.906 cm respectively, while isolate BK14 showed small ability to inhibit Fusarium sp.1. Fusarium sp.2 and Alternaria sp. growth by 2.312 cm; 2.056 cm and 3.391 cm respectively. Microscopic observation, hypa damaged causing by the bacterial isolated varied from coil up, curve, lysis, folded and smaller diameter of mycelium.
BAB 1
PENDAHULUAN
Di Indonesia tanaman markisa belum banyak diteliti. Patogen dan penyakit yang menyerang tanaman markisa juga belum banyak diketahui (Semangun, 2000). Munculnya penyakit merupakan hasil interaksi yang terjadi antara patogen dengan tanaman. Jamur patogen dapat masuk ke dalam tumbuhan melalui luka ataupun langsung menembus permukaan tumbuhan (Semangun, 1996).
Salah satu patogen yang ditemukan dapat menginfeksi tanaman markisa yaitu Alternaria passiflorae yang menyebabkan bercak coklat (Hutagalung, 2000). Fungi ini
menyerang semua bagian tanaman markisa. Tanaman yang terinfeksi fungi ini ditandai dengan munculnya bercak kecil pada daun. Bercak tersebut mula-mula berwarna coklat tua, yang kelak membesar dan tengahnya berwarna coklat muda (Semangun, 2000). Serangan pada batang menyebabkan timbulnya bercak berwarna coklat tua, memanjang seperti menggelang dan bagian ujung batang mati. Serangan yang berat menyebabkan tanaman tidak berdaun (gundul) dan jika tidak segera ditanggulangi akan menyebabkan tanaman mati (Rukmana, 2003). Alternaria passiflorae mempunyai konidium berwarna coklat, konidia disebarkan oleh angin atau
hujan. Perkembangan penyakit bercak coklat dipengaruhi oleh cuaca yang lembab dan panas. Tanaman yang tidak dipangkas lebih rentan sehingga pengendalian penyakit dapat dilakukan dengan pemangkasan untuk menghilangkan daun yang terinfeksi (Semangun, 2000).
Phytophthora sp. yang merupakan fungi asal tanah juga dilaporkan menyebabkan busuk pangkal batang (Semangun, 2000). Gejala serangan penyakit dapat ditandai dengan tanaman yang mula-mula layu, daun berguguran dan kulit pangkal batang di atas permukaan tanah pecah-pecah (Rukmana, 2003). Penyakit biasanya terjadi pada kebun yang memiliki drainase yang buruk. Fungi dapat bertahan lama dalam tanah dengan hidup sebagai saprofit. Selain itu, fungi menginfeksi tanaman melalui luka-luka pada pangkal batang yang terkena alat-alat pertanian (Semangun, 2000). Phytophthora biasa ditemukan pada tanah yang tergenang air selama beberapa minggu, sehingga fungi ini sangat cocok berkembang pada suhu dingin. Efek patogenitas fungi dapat menghambat pertumbuhan tunas ataupun menyebabkan tunas tanaman layu dan mati setelah muncul (Baty et al., 2000).
Kondisi lahan yang basah merangsang munculnya penyakit busuk leher akar yang disebabkan oleh Rhizoctonia solani dan penyakit layu Fusarium passiflorae (Sunarjono, 1997). Rhizoctonia solani dapat ditandai dengan kulit akar bagian luar yang berwarna coklat kemerahan. Fungi ini dapat bertahan di dalam tanah dan sisa tanaman dan membentuk sclerotia. Pertumbuhan fungi dipengaruhi oleh nutrisi, kelembaban tanah, suhu, pH dan kompetisi dari mikroorganisme lainnya. Penyakit ini semakin parah jika tanaman tumbuh pada tanah dengan kondisi kekurangan kalsium, besi, magnesium, nitrogen, fosfor, sulfur dan lain-lain. Jika tanah dalam keadaan basah maka sclerotia akan membentuk miselium. Sedangkan Fusarium oxysporum var. Passiflora merupakan patogen tular tanah sehingga semua jenis markisa rentan terhadap Fusarium. Gejala serangan dapat diamati secara visual yaitu daun-daun tanaman memucat, pembuluh batang berwarna coklat, kemudian tanaman layu dan mati (Rukmana, 2003). Fusarium memiliki miselium berwarna merah muda, merah atau ungu (Semangun, 2000).
oxysporum menggunakan enzim selulase untuk menembus jaringan vaskular tanaman
dan menyebabkan layu pada tanaman. Menurut Semangun (1996), mikrokonidium dapat dibentuk di dalam pembuluh kayu dan terangkut ke atas bersama-sama dengan air dan hara tanah. Sedangkan makrokonidium dibentuk pada permukaan badan tanaman (akar dan daun) setelah tanaman mati. Melalui pembuluh, fungi dapat mencapai buah dan menginfeksi biji.
Pertumbuhan patogen dapat ditekan dengan modifikasi lingkungan dan substrat tumbuh sehingga tidak mendukung pertumbuhan patogen. Pengendalian fungi patogen tanaman dapat dilakukan dengan menggunakan agen pengendali hayati. Agen pengendali hayati mikroba lebih aman digunakan karena sedikit kemungkinan merugikan lingkungan dan mempunyai prospek yang baik (Soesanto, 2008) dan menjadi pilihan alternatif dari penggunaan pestisida (Kobayashi et al., 2002). Bakteri sebagai agen biokontrol mempunyai beberapa kelebihan yaitu merupakan mikroorganisme yang banyak terdapat di tanah dan produksi massa bakteri juga lebih mudah dan lebih cepat dari mikroorganisme lainnya (Yuliar, 2008).
Bakteri sebagai agen pengendali hayati biasanya menggunakan hasil metabolit misalnya enzim untuk menekan pertumbuhan mikroorganisme lain. Umumnya, enzim banyak berperan sebagai pengurai dinding sel, salah satunya yaitu enzim pengurai kitin atau kitinolitik yang ekstraseluler. Strain agen pengendali hayati penghasil kitinolitik merupakan strain yang paling efektif untuk pengendalian penyakit tanaman (Soesanto, 2008). Kitinase yang dihasilkan mikroorganisme berperan penting dalam kontrol fungi patogen tanaman secara mikoparasitisme (Nugroho et al., 2003). Metode ini memberikan prospek yang lebih baik dibandingkan kitinase yang diperoleh dari sumber lain karena kemudahan dimanipulasi pada level molekuler (Nasran et al., 2003).
kemampuan kitinolitik tersebut berpotensi besar untuk dimanfaatkan misalnya sebagai penghasil kitinase yang digunakan dalam industri pangan, kosmetik dan farmasi. Selain itu bakteri kitinolitik juga berpotensi sebagai pengendali hayati beberapa jenis fungi patogen (Pujiyanto et al., 2008).
Bakteri antagonis yang diaplikasikan ke lingkungan baru umumnya tidak stabil, dan mudah berubah. Mekanisme yang tampak dari kelompok bakteri ini adalah dengan memanfaatkan metabolit sekunder dari bakteri tersebut. Misalnya, bakteri antagonis mampu menghasilkan kitinase. Enzim ini mampu menghambat pertumbuhan beberapa fungi patogen misalnya Botrytis sp. in vitro, Rhizoctonia sp. dan Fusarium sp. Kitinase dapat diuji dalam medium yang mengandung kitin koloid atau laminarin dengan kitin. Bakteri antagonis melepas enzim kitinolitik yang berperan dalam menguraikan kitin dan laminarin. Kitinase yang dilepas oleh bakteri antagonis ini akan menyebabkan lisis pada ujung hifa yang umumnya peka terhadap penguraian karena enzim (Soesanto, 2008).
Contoh bakteri kitinolitik yaitu dari genus Pseudomonas, Serratia, Bacillus dan Vibrio. Pseudomonas aeruginosa yang menghasilkan kitinase mampu menghambat Fusarium oxysporum dan Rhizoctonia solani (Folders et al., 2001). Bakteri kitinolitik menghasilkan kitinase terutama untuk mendegradasi kitin dan menggunakannya sebagai sumber energi. Kitinase dari bakteri kitinolitik seperti Serratia marcescens dan Enterobacter agglomerans merupakan agen potensial dalam
kontrol biologis penyakit tanaman yang disebabkan oleh berbagai jamur patogen tanaman. Kitinase juga aset terbesar dalam bioteknologi karena diaplikasikan sebagai agen pengawet benih tanaman agar tahan terhadap jamur patogen misalnya Rhizoctonia solani (Kamil et al., 1997).
sehingga bakteri dapat memanfaatkan kitin yang terdapat pada hifa jamur sebagai substrat pertumbuhan (Boer et al., 1997).
Komponen penting dalam dinding sel sebagian besar fungi adalah kitin, suatu polisakarida yang juga merupakan komponen utama dari kerangka luar serangga dan arthropoda lainnya. Kitin adalah polimer dari N-asetil-glukosamin yang
subunit-subunit nya dihubungkan oleh ikatan β-(1-4)-glukosida (Tsigos & Vassilis, 1995; Tsujibo et al., 1998; Folders et al., 2001; Rahayu, 2004; Gandjar et al., 2006,). Semua kitinase yang mampu mendegradasi kitin disebut kitinase total atau kitinase non-spesifik (Nugroho et al., 2003).
Pemanfaatan mikroba kitinolitik merupakan salah satu cara pengendalian hayati yang efektif untuk jamur patogen tanaman, karena mekanisme pengendaliannya tidak tergantung pada ras patogen dan tidak merangsang timbulnya resistensi. Kitinase merupakan enzim ekstraseluler yang dihasilkan oleh cendawan dan bakteri serta berperan penting dalam pemecahan kitin. Kitinase dapat mengkatalisis hidrolisis ikatan β-1,4 homopolimer N-asetilglukosamin menjadi monomer N-asetilglukosamin (Wijaya, 2002; Purwani et al., 2009). Semua jenis kitinase dalam aktivitasnya akan menggunakan koloidal kitin sebagai sumber karbon. Produksi kitinase adalah salah satu cara pemanfaatan limbah atau kulit kerang yang tidak hanya memecahkan masalah pencemaran lingkungan tetapi juga menaikkan nilai ekonomi hasil laut (Wang et al., 1997). Kitinase yang diproduksi mikroba dapat menghidrolisis struktur kitin, senyawa utama penyusun dinding sel tabung kecambah spora dan miselium, sehingga jamur tidak mampu menginfeksi tanaman (Priyatno et al., 2006).
1.2 Permasalahan
Tanaman markisa khususnya markisa ungu (Passiflora edulis var edulis) sering terinfeksi fungi patogen seperti Alternaria passiflorae penyebab bercak coklat, Phythophthora cinnamomi penyebab busuk pangkal batang dan Fusarium oxysporum
penyebab layu fusarium sehingga menghambat pertumbuhan tanaman tersebut. Beberapa cara pengendalian telah dilakukan seperti penggunaan fungisida (Rukmana, 2003). Tetapi penggunaan fungisida menimbulkan dampak negatif bagi kesehatan manusia dan lingkungan. Selain itu residu fungisida juga sulit terurai di lingkungan sehingga menyebabkan produk pertanian tidak aman dikonsumsi. Untuk mencegah dampak buruk tersebut maka pemanfaatan biokontrol dalam pengendalian fungi patogen sangat efektif (Yuliar, 2008). Bakteri kitinolitik yang menghasilkan kitinase diduga mampu mengendalikan fungi patogen karena dapat menguraikan polimer kitin yang terdapat pada dinding sel fungi.
1.2Tujuan
Penelitian ini bertujuan untuk mengetahui potensi bakteri kitinolitik sebagai agen pengendali hayati fungi patogen pada tanaman markisa ungu.
1.3Hipotesis
Bakteri kitinolitik mampu menghambat pertumbuhan fungi patogen yang diisolasi dari tanaman markisa ungu.
1.4Manfaat
BAB 2
BAHAN DAN METODE
2.1Waktu dan Tempat
Penelitian ini dilakukan pada Bulan April hingga November 2010, pengambilan sampel fungi dilakukan pada tanaman markisa ungu di Brastagi sedangkan isolasi dan uji antagonis dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
2.2Isolat Bakteri dan Fungi
Isolat bakteri yang digunakan adalah bakteri kitinolitik koleksi Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara dengan kode KR05, LK08, BK07, BK08, BK09, BK13, BK14, BK15, BK16 dan BK17 yang diremajakan pada media koloidal kitin pada pH 6,8 (Komposisi pada lampiran 1 halaman 26) dan diinkubasi pada suhu 30o C (Kultur bakteri dapat dilihat pada lampiran 3 halaman 28). Sedangkan isolat fungi diperoleh dari isolasi langsung dari bagian-bagian tanaman markisa yang diambil dari daerah Brastagi.
2.3Isolasi Fungi Patogen Dari Markisa
telah disemprot alkohol 70% pada suhu ruang. Menurut Hutagalung (2000) kemudian potongan batang, pangkal batang dan daun tersebut ditumbuhkan pada media potato dextrose agar (PDA) selama 72 jam pada suhu ruang dan selanjutnya diidentifikasi dengan panduan buku identifikasi jamur (Gandjar et al., 1999).
2.4 Uji Antagonis Bakteri Kitinolitik Dengan Fungi Hasil Isolasi
Bakteri kitinolitik diremajakan di media koloidal kitin selama 24 jam pada suhu 32oC. Kemampuan bakteri kitinolitik dalam menghambat pertumbuhan fungi patogen diuji dengan asai antagonisme in vitro dalam cawan petri. Biakan fungi ditumbuhkan pada bagian tengah media koloidal kitin. Selanjutnya kertas cakram yang telah ditetesi suspensi bakteri kitinolitik yang telah dibuat dengan konsentrasi standart Mc. Farland (≈ 108 sel/ml) diletakkan sekitar 3,5 cm dari biakan fungi dan dibuat 2 ulangan cakram. Biakan diinkubasi pada suhu 30oC. Aktivitas kitinolitik ditentukan berdasarkan zona hambat yang terbentuk di sekitar koloni pada medium kitin agar. Pengamatan dilakukan setiap hari dan pengukuran zona hambat dimulai hari ke-2 sampai hari ke-10 (Irawati, 2008).
2.5 Pengamatan Struktur Hifa Jamur Setelah Uji Antagonis
BAB 3
HASIL DAN PEMBAHASAN
3.1 Isolasi Fungi Patogen dari Markisa Ungu
Tanaman markisa ungu (Passiflora edulis var edulis) yang diisolasi menunjukkan gejala penyakit yaitu daun dan tangkai daun menguning, bagian pangkal batang seperti terkikis dan ada benang-benang putih menyerupai miselium fungi. Pada tanaman yang sudah terinfeksi berat, seluruh bagian tanaman layu dan beberapa waktu kemudian mengalami kematian (Gambar 3.1). Tanaman yang terinfeksi penyakit merupakan kendala produksi markisa diseluruh dunia, terutama penyakit yang disebabkan Alternaria passiflorae yang menyebabkan bercak coklat dan Fusarium oxysporum var passiflorae yang menyebabkan layu Fusarium (Hutagalung, 2000).
F. oxysporum var. passiflora merupakan patogen tular tanah sehingga semua jenis markisa rentan terhadap Fusarium. Gejala serangan dapat diamati secara visual yaitu daun-daun tanaman memucat, pembuluh batang berwarna coklat, kemudian tanaman layu dan mati (Rukmana, 2003; Iskandar & Wilesawati, 2005). Fusarium memiliki miselium berwarna merah muda, merah atau ungu (Semangun, 2000).
menyebabkan layu pembuluh dikelompokkan dalam jenis F. oxysporum dan dibagi menjadi forma-forma spesialis (f.sp) yang menyesuaikan diri pada tumbuhan inang yang diinfeksi.
A
B
C
D
A
B
C
Gambar 3.1 Tanaman markisa ungu yang terserang penyakit. A. Daun kuning dan nekrosis; B. Pangkal batang terkikis dan terdapat benang-benang putih seperti miselium fungi; C. Tangkai daun menguning; D. Tanaman layu secara keseluruhan.
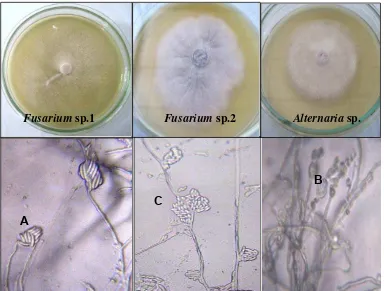
putih, konidia ungu, koloni atas warna ungu, koloni bawah putih, permukaan miselium tebal. Pada pengamatan mikroskopik, hifa bersekat dan spora berbentuk bulan sabit tetapi lebih kecil dari Fusarium sp.1. Alternaria sp. memiliki hifa putih, spora kuning, koloni atas warna kuning, koloni bawah kuning, permukaan miselium tebal. Pada pengamatan mikroskopik, hifa tidak bersekat dan konidia berbentuk elips (Gambar 3.2).
Fusarium sp.1 Fusarium sp.2 Alternaria sp.
B
C
A
D E F
Gambar 3.2 Biakan murni fungi patogen yang diperoleh dan mikroskopis fungi patogen. A. Makrokonidia Fusarium sp.1; B. Konidia Alternaria sp.; C. Mikrokonidia Fusarium sp.2 (Perbesaran 10x40).
(gundul) dan jika tidak segera ditanggulangi akan menyebabkan tanaman mati (Rukmana, 2003).
Konidia A. passiflorae berwarna coklat, konidia disebarkan oleh angin atau hujan. Gandjar et al., (1995) menjelaskan pada medium MEA, konidia berwarna kecoklatan, berbentuk elips dengan sel yang paling ujung menyerupai paruh bebek. Menurut Semangun (1996), genus Alternaria memiliki konidiofor tegak dan pendek. Konidium seperti labu, ataupun seperti buah murbei. Spesies A. passiflorae diketahui menginfeksi tanaman markisa dan menyebabkan bercak pada daun dengan diameter bercak sekitar 5-10 mm disertai lingkaran kuning pucat disekitar jaringan. Daun yang terinfeksi akan gugur dan pada infeksi yang parah, tanaman menjadi layu secara keseluruhan kemudian mati.
3.2 Uji Antagonis Bakteri Kitinolitik
Tabel 3.1 Uji antagonis beberapa bakteri kitinolitik dengan fungi patogen yang diisolasi dari markisa ungu
Is
ol
at Fungi Diameter Zona Hambatan (cm)/hari
4 5 6 7 8 9 10
terhadap miselium Alternaria sp. lebih kecil yaitu sebesar 0,15 cm pada hari ke-4 tetapi meningkat pada hari ke-10 inkubasi yaitu sebesar 2,79 cm. Dari data tersebut dapat diperoleh kesimpulan bahwa isolat BK15 sp.2 memiliki daya hambat yang lebih baik dalam menghambat miselium Fusarium sp.1, Fusarium sp.2 dan Alternaria sp. dibandingkan isolat lainnya.
Isolat BK17 mampu menghambat miselium Fusarium sp.1 dimulai pada hari ke-4 inkubasi sebesar 0,19 cm dan pada inkubasi hari ke-10 sebesar 2,56 cm. Isolat BK17 juga memiliki kemampuan dalam menghambat Fusarium sp.2 yaitu sebesar 0,19 cm pada hari inkubasi ke-4 dan 2,16 cm pada hari ke-10. Daya hambat isolat BK17 lebih besar terhadap miselium Alternaria sp. yaitu sebesar 0,14 cm pada hari ke-4 dan meningkat pada hari ke-10 inkubasi yaitu sebesar 2,6 cm. Dari data tersebut dapat diperoleh kesimpulan bahwa isolat BK17 memiliki daya hambat yang lebih baik terhadap miselium Alternaria sp. dan Fusarium sp.1.
Isolat BK14 mampu menghambat miselium Fusarium sp.1 dimulai pada hari ke-4 inkubasi sebesar 0,51 cm dan pada inkubasi hari ke-10 sebesar 1,62 cm. Isolat BK14 juga memiliki kemampuan dalam menghambat Fusarium sp.2 yaitu sebesar 0,73 cm pada hari inkubasi ke-4 dan 2,27 cm pada hari ke-10. Daya hambat isolat BK14 terhadap miselium Alternaria sp. yaitu sebesar 0,09 cm pada hari ke-4 dan meningkat pada hari ke-10 inkubasi yaitu sebesar 1,91 cm. Dari data tersebut dapat diperoleh kesimpulan bahwa isolat BK14 memiliki daya hambat yang paling kecil terhadap miselium Alternaria sp., Fusarium sp.1. dan Fusarium sp.2 dibanding isolat lainnya.
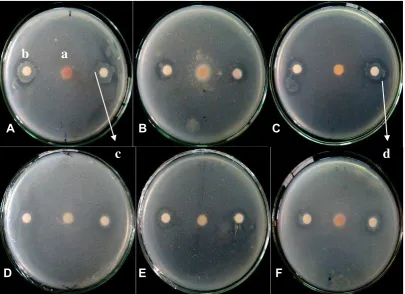
Bakteri kitinolitik jika ditumbuhkan pada media yang mengandung koloidal kitin, akan membentuk zona bening pada media (Gambar 3.3). Zona bening terbentuk jika komponen kitin yang terdapat pada media telah didegradasi oleh kitinase yang dihasilkan bakteri. Menurut Kamil (1997), bakteri kitinolitik menghasilkan kitinase terutama untuk mendegradasi kitin dan menggunakannya sebagai sumber energi. Dewi (2008) dan Muharni (2010) menjelaskan bahwa isolat bakteri yang menghasilkan kitinase ditandai dengan adanya zona bening disekitar koloni, zona bening yang terbentuk diukur diameternya untuk ditentukan indeks kitinolitiknya. Selanjutnya bakteri akan mencari sumber kitin lainnya yaitu pada dinding sel fungi.
A B C
D E F
Gambar 3.3 Uji antagonis bakteri kitinolitik dengan fungi patogen. A. BK15; B.BK16; C. BK14; D. BK07; E. BK17; F. BK13. a. Koloni fungi; b. Koloni bakteri; c. Zona hambat bakteri terhadap koloni fungi; d. Zona bening
Soesanto (2008) menjelaskan kitinase mampu menghambat pertumbuhan beberapa fungi patogen misalnya Botrytis sp. in vitro, Rhizoctonia sp. dan Fusarium sp. Menurut Pudjihartati (2006), kitinase diketahui ikut berperan dalam mekanisme ketahanan terhadap infeksi fungi karena dapat menghidrolisis ikatan β-1,4 di antara
a
b
subunit N-asetilglukosamina (NAcGlc) pada polimer kitin. Degradasi senyawa kitin
pada hifa fungi patogen diharapkan mampu menghambat perkembangan normal hifa
dan selanjutnya mengganggu proses infeksi fungi pada tanaman inang. Kitin merupakan penyusun utama dinding sel fungi dan telah digunakan sebagai kontrol biologis fungi patogen. Aktifitas kitinase yang dihasilkan bakteri lebih tinggi dibandingkan fungi. Setelah inkubasi, zona bening disekitar koloni mengindikasikan bahwa bakteri mampu menghidrolisis kitin (Brzezinska et al, 2007).
Muharni (2010) menjelaskan bahwa zona bening terbentuk karena terjadinya pemutusan ikatan 1, 4 homopolimer N-asetilglukosamin pada kitin oleh kitinase menjadi monomer N-asetilglukosamin. Perbedaan indeks kitinolitik dari isolat disebabkan perbedaan aktivitas enzim kitinase dari masing-masing isolat tersebut. Besarnya zona bening yang dihasilkan tergantung pada jumlah monomer N-asetilglukosamin yang dihasilkan dari proses hidrolisis kitin dengan memutus ikatan 1,4 homopolimer asetilglukosamin. Semakin besar jumlah monomer N-asetiglukosamin yang dihasilkan maka akan semakin besar zona bening yang terbentuk di sekitar koloni.
3.3 Pengamatan Struktur Hifa Fungi Setelah Uji Antagonis
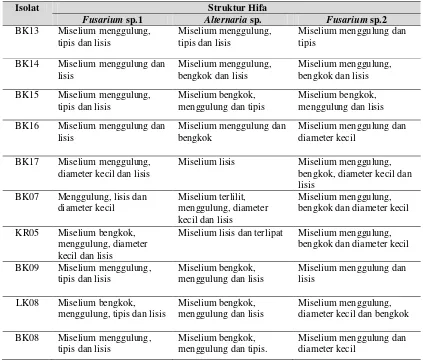
Tabel 3.3 Pengamatan struktur hifa fungi Fusarium sp.1, Altenaria sp., Fusarium sp.2 setelah uji antagonis dengan beberapa isolat bakteri kitinolitik lokal
Isolat Struktur Hifa
Fusarium sp.1 Alternaria sp. Fusarium sp.2
BK13 Miselium menggulung, tipis dan lisis
Miselium menggulung, tipis dan lisis
Miselium menggulung dan tipis
BK14 Miselium menggulung dan lisis
Miselium menggulung, bengkok dan lisis
Miselium menggulung, bengkok dan lisis BK15 Miselium menggulung,
tipis dan lisis
Miselium bengkok, menggulung dan tipis
Miselium bengkok, menggulung dan lisis BK16 Miselium menggulung dan
lisis
Miselium menggulung dan bengkok
Miselium menggulung dan diameter kecil
BK17 Miselium menggulung, diameter kecil dan lisis
Miselium lisis Miselium menggulung, bengkok, diameter kecil dan lisis
BK07 Menggulung, lisis dan diameter kecil
Miselium terlilit, menggulung, diameter kecil dan lisis
Miselium menggulung, bengkok dan diameter kecil
KR05 Miselium bengkok, menggulung, diameter kecil dan lisis
Miselium lisis dan terlipat Miselium menggulung, bengkok dan diameter kecil
BK09 Miselium menggulung, tipis dan lisis
Miselium bengkok, menggulung dan lisis
Miselium menggulung dan lisis
LK08 Miselium bengkok, menggulung, tipis dan lisis
Miselium bengkok, menggulung dan lisis
Miselium menggulung, diameter kecil dan bengkok
BK08 Miselium menggulung, tipis dan lisis
Miselium bengkok, menggulung dan tipis.
Miselium menggulung dan diameter kecil
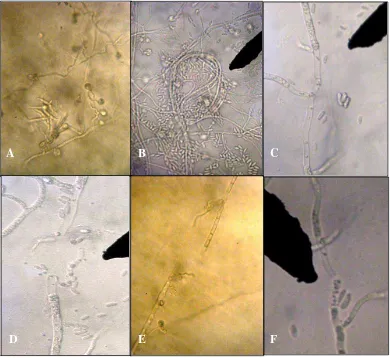
Hasil pengamatan biakan uji setelah inkubasi 10 hari menunjukkan bahwa semua biakan uji mengalami kerusakan dan kelainan pada miselium fungi. Kerusakan tersebut meliputi miselium menggulung, diameter kecil, lisis, bengkok dan terlipat (Gambar 3.4). Hal ini terjadi karena miselium rusak akibat enzim kitinase yang dihasilkan bakteri, enzim ini menghidrolisis atau menguraikan senyawa kitin yang terdapat pada dinding sel fungi.
menghancurkan dinding sel fungi patogen, akibatnya fungi patogen akan mati. Enzim ini menghambat perkecambahan spora, pemanjangan hifa dan menyebabkan kerusakan dinding sel yang ditunjukkan dengan pecahnya sel pada ujung-ujung hifa. Enzim kitinase juga efektif menghambat pembentukan sklerotia Rhizoctonia solani dan mampu melisiskan dinding sklerotia.
A B C
D E F
Gambar 3.4 Pengamatan fungi abnormal secara mikroskopik; A. Miselium bengkok; B. Miselium menggulung; C-F. Miselium lisis (Perbesaran 10x40).
kompetisi. Pada mekanisme parasitisme, agen antagonis akan memanfaatkan secara langsung nutrisi dari fungi patogen dengan melibatkan enzim-enzim pendegradasi dinding sel. Antibiosis merupakan kemampuan agen antagonis untuk menghasilkan metabolik yang bersifat antifungi, sedangkan kompetisi ruang dan nutrien terjadi ketika pertumbuhan fungi antagonis dapat menekan pertumbuhan jamur patogen.
Menurut Gandjar et al., (2006), pertumbuhan hifa berlangsung terus-menerus di bagian apikal, sehingga panjangnya tidak dapat ditentukan secara pasti. Diameter hifa umumnya tetap, yaitu 3-30 µ m. Spesies-spesies yang berbeda memiliki diameter yang berbeda pula dan ukuran diameter tersebut juga dipengaruhi oleh keadaan lingkungan. Fungi membentuk struktur tertentu sebagai perlindungan dalam keadaan yang tidak menguntungkan, misalnya membentuk klamidospora. Klamidospora adalah sel dorman yang akan berkecambah apabila lingkungan sudah kondusif untuk pertumbuhan sedangkan dinding sel hifa akan hancur oleh enzim-enzim litik dari luar sel, misalnya enzim-enzim dari mikroorganisme lain.
BAB 4
KESIMPULAN DAN SARAN
4.1Kesimpulan
Semua isolat bakteri kitinolitik yang diujikan terhadap 3 isolat fungi patogen tanaman markisa yaitu Fusarium sp.1, Fusarium sp.2 dan Alternaria sp. dapat menghambat pertumbuhan fungi-fungi tersebut. Isolat BK15 memiliki diameter zona hambat terbesar dalam mengambat Fusarium sp.1, Fusarium sp.2 dan Alternaria sp. berturut-turut sebesar 2,67 cm, 2,37 cm dan 2,79 cm. Sedangkan isolat BK14 memiliki diameter zona hambat terkecil terhadap Fusarium sp.1, Fusarium sp.2 dan Alternaria sp. berturut-turut yaitu 1,62 cm, 2,27 cm dan 1,91 cm. Dan terhambatnya
pertumbuhan fungi pathogen disebabkan karena hifa fungi mengalami bentuk yang abnormal seperti miselium menggulung, diameter kecil, lisis, bengkok dan terlipat.
4.2Saran
DAFTAR PUSTAKA
Abdul-Allah, S & Salih, O. 2008. First Report for Alternaria sp. Infection of Eucalyptus Globulus in Al-Taif Province at Kingdom of Saudi Arabia. Saudi Journal of Biological Sciences. 15(2) : 231-236.
Abstrak Hasil Penelitian Pertanian Indonesia. Kementrian Pertanian. 2010. 27(1). Baty, A. M., Eastburn, C. C., Diwuzhenjun & Teckhkarjanaruk, S. 2000.
Differentiation of Chitinase-Active and Non-Chitinase-Active Subpopulations of a Marine Bacterium during Chitin Degradation. Applied and Environmental Microbiology. 66(8) : 254.
Boer, W.D., Gunnewiek, P. K., Lafeber, P & Ben, J. D. J. 1997. Anti Jamur Sifat Gundukan Tanah Chitinolitik Bakteri. Biologi dan Biokimia Tanah. 30(2).
Brzezinska, M.S., Lalke, E & Donderski, W. 2007. Chitinolytic activity of bacteria and fungi isolated from shrimp exoskeletons. Journal of Oceanography and Hydrobiology. 36 (3) : 1-11.
Chernin, L. S., Fuente, L. D & S. Vladimir, S. 1997. Molecular Cloning, Structural Analysis, and Expression in Escherichia coli of a Chitinase Gene from Enterobacter agglomerans. Applied and Environmental Microbiology. 63(2).
834-839.
Dewi, I.M. 2009. Isolasi Bakteri dan Uji Aktivitas Kitinase Termofilik Kasar dari Sumber Air Panas Tinggi Raja, Simalungun, Sumatera Utara. Indonesian Journal of Chemistry. 9(1) : 37-47.
Folders, J., Jon, A., Roelofs, M. S & Leendert, C. 2001. Characterization of Pseudomonas aeruginosa Chitinase, a Gradually Secreted Protein. Journal of Bacteriology. 183(24) : 7044-7045.
Gandjar, I., Sjamsuridjal, W & Oetari, A. 2006. Mikologi : Dasar dan Terapan. Edisi Pertama. Jakarta : Yayasan Obor Indonesia. Hlm 10-17.
Gandjar, I., Samson, R.A., Tweel-Vermeulen, K., Oetari, A & Santoso, I. 1999. Pengenalan Kapang Tropik Umum. Jakarta : UI Press. Hlm 14-66.
Hutagalung, L. 2000. Hama dan Penyakit Markisa Serta Musuh Alaminya di Sulawesi Selatan. Jurnal Agrotropika 7(1) : 16-24.
Iskandar, M & Wilesawati. 2005. Uji Efektifitas Jamur (Gliocladium virens dan Trichoderma koningii) pada Berbagai Tingkat Dosis Terhadap Penyakit Busuk Pangkal Batang (Fusarium oxysporum f.sp passiflorae) pada Tanaman Markisah (Passiflora edulis f. edulis) di Lapangan. Jurnal Penelitian Bidang Ilmu Penelitian. 3 (1) : 11-14.
Kamil, Z., Rizk, M., Saleh, M & Moustafa, S.1997. Isolasi dan Identifikasi Bakteri Chitinolytic Rhizosfer Tanah Sebagai Biokontrol. Global Journal of Molecular Sciences. 2(2) : 57-66.
Khikmah, N. 2009. Kajian Isolat Kitinolitik Sebagai Agens Pengendali Hayati Rhizoctonia solani. Thesis. UGM. Yogyakarta.
Kobayashi, D. Y., Reedy, R. M., Bick, J & Oudemans, P. V. 2002. Characterization of a Chitinase Gene from Stenotrophomonas maltophilia Strain 34S1 and Its Involvement in Biological Control. Applied and Environmental Microbiology. 68(3) : 1047-1054.
Lonhienne, T., Mavromatis, K & Vorgias, C. E. 2001. Cloning, Sequences, and Characterization of Two Chitinase Genes from the Antarctic Arthrobacter sp. Strain TAD20: Isolation and Partial Characterization of the Enzymes. Journal of Bacteriology. 183(5) : 1733-1735.
Muharni. 2010. Isolasi dan Identifikasi Bakteri Penghasil Kitinase dari Sumber Air Panas Danau Ranau Sumatera Selatan. Jurnal Penelitian Sains Edisi Khusus Juni. 10 : 6-9.
Muthahanas, I & Listiana, E. 2008. Skrining Streptomyces sp. Isolat Lombok Sebagai Pengendali Hayati Beberapa Jamur Patogen Tanaman. Jurnal CropAgro. 1(2) : 130-136.
Nasran, S., Ariyani, F & Indriati, N. 2003. Produksi Kitinase dan Kitin Deasetilase Dari Vibrio Harveyi. Jurnal Penelitian Perikanan Indonesia. 9(5) : 33-38. Noviendri, D., Chasanah, E & Fawzya, Y.N. 2006. Karakterisasi Enzim Kitinase yang
Diproduksi Oleh Isolat Bakteri JB4 dari Terasi. Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan. 1(2) : 56-59.
Nugroho, T.T., Ali, M., Ginting, C., Wahyuningsih & Dahliaty, A. 2003. Isolasi dan Karakterisasi sebagian Kitinase Trichoderma viride TNJ6I. Jurnal Natur Indonesia. 5(2) : 101-106.
Patonah, S. 2008 Penggunaan Bakteri Kitinolitik Untuk Menghambat Penyakit Layu Fusarium Pada Benih Cabai Merah (Capsicum annuum L.). Skripsi. USU. Medan.
Bogor. Balai Penelitian Bioteknologi Tanaman Pangan. Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman. Hlm 229-235.
Pudjihartati, E., Siswanto., Ilyas, S & Sudarsono. 2006. Aktivitas Enzim Kitinase pada Kacang Tanah yang Sehat dan yang Terinfeksi Sclerotium rolfsii. Jurnal Hayati. 13(2) : 73-78.
Pujiyanto, S. Kusdiayantini, E & Hadi, M., 2007. Isolasi dan Seleksi Bakteri Kitinolitik Isolat Lokal yang Berpotensi untuk Mengendalikan Larva Nyamuk Aedesaegypti L. Biodiversitas. 9(1) : 5-8.
Purwani, E.Y., Toharisman, A., Chasanah, E & Laksmi J.F. 2002. Studi Pendahuluan Enzim Kitinase Extraseluler yang Dihasilkan Oleh Isolat Bakteri Asal Manado. Jurnal Teknologi dan Industri Pangan. 13(2) : 67-73.
Puspawati, N. M & Simpen, I. N. 2010. Optimasi Deasetilasi Kitin dari Kulit Udang dan Cangkang Kepiting Limbah Restoran Seafood Menjadi Kitosan Melalui Variasi konsentrasi NaOH. Jurnal Kimia. 4(1) : 79-90.
Rahayu, S. 2004. Karakteristik Biokimiawi Enzim Termostabil Penghidrolisis Kitin. Makalah Falsafah Sains. Bogor : IPB. Hlm 6-9.
Rukmana, R. 2003. Usaha Tani Markisa. Yogyakarta : Penerbit Kanisius. Hlm 41-43.
Semangun, H. 2000. Penyakit-penyakit Tanaman Hortikultura di Indonesia. Cetakan Keempat. Yogyakarta. UGM Press. Hlm 502-503.
. 1996. Pengantar Ilmu Penyakit Tumbuhan. Cetakan Pertama. Yogyakarta : Gadjah Mada University Press.
Soesanto, L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman. Jakarta. PT. Raja Grafindo Persada. Hlm 340.
Sunarjono, H. 1997. Prospek Berkebun Buah. Cetakan Pertama. Jakarta. PT. Penebar Swadaya. Hlm 100-101.
Suryanto, D., Patonah, S & Munir, E. 2010. Control of Fusarium Wilt of Chili With Chitinolytic Bacteria. Hayati Journal of Biosciences. 17(1) : 5-8.
The American Society for Biochemistry and molecular Biology. 1995. Purification and Characterization of Chitin Deacetylase from Colletotrichum lindemuthianum. 270(44) : 26286-26291.
Wang, S.L & Chang, W. T. 1996. Purification and Characterization of Two Bifunctional Chitinases/Lysozymes Extracellular Produced by Pseudomonas aeruginosa K-187 in a Shrimp and Crab Shell Powder Medium. Applied and Environmental Microbiology. 63(2) : 380-381.
Wijaya, S. 2002. Isolasi Kitinase dari Scleroderma columnare dan Trichoderma harzianum. Jurnal Ilmu Dasar. 3(1) : 30-35.
Yuliar. 2008. Skrining Bioantagonistik Bakteri untuk Agen Biokontrol Rhizoctonia solani dan Kemampuannya dalam Menghasilkan Surfaktin. Biodiversitas. 9(2)
Lampiran 1. Pembuatan Kitin Agar (Suryanto et al, 2010)
Komposisi medium
K2HPO4 0,7 g
KH2PO4 0,3 g
MgSO4.7H2O 0,5 g
FeSO4.7H2O 0,01 g
ZnSO4 0,001g
MnCl2 0,001g
Koloidal kitin 0,2%
Agar 2% (b/v)
Cara Pembuatan
1. Dicampur semua bahan, kemudian ditambahkan akuades sampai volumenya menjadi 1 liter.
2. Diatur pH sampai mencapai 6,8 dengan menambahkan NaOH
Lampiran 2. Gambar Kultur Awal Fungi Hasil Isolasi dari Tanaman Markisa Ungu
A B
C D
E F
Keterangan: A & B : isolasi dari bagian daun
Lampiran 3. Gambar Kultur Bakteri Kitinolitik Lokal pada Media Kitin Agar
A B
C D
E
Keterangan : A. BK15 C. BK16
B. BK13 D. BK14