KERAGAMAN MORFOLOGI, GENETIKA, DAN
PATOGENISITAS
Colletotrichum acutatum
PENYEBAB
ANTRAKNOSA CABAI DARI BERBAGAI DAERAH DI JAWA
DAN SUMATERA
ROY IBRAHIM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman Morfologi, Genetika, dan Patogenisitas Colletotrichum acutatum Penyebab Antraknosa
Cabai dari Berbagai Daerah di Jawa dan Sumatera adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017
RINGKASAN
ROY IBRAHIM. Keragaman Morfologi, Genetika, dan Patogenisitas Colletotrichum acutatum Penyebab Antraknosa Cabai dari Berbagai Daerah di Jawa dan Sumatera. Dibimbing oleh WIDODO dan SRI HENDRASTUTI HIDAYAT.
Penyakit antraknosa merupakan salah satu penyakit penting pada tanaman cabai karena dapat menyebabkan kehilangan hasil yang nyata. Diantara beberapa spesies Colletotrichum, Colletotrichum acutatum merupakan penyebab utama penyakit antraknosa pada tanaman cabai di Indonesia. Pengetahuan tentang keragaman genetika diperlukan untuk mengembangkan varietas tanaman cabai yang tahan terhadap penyakit antraknosa. Akan tetapi informasi tentang keragaman genetika C. acutatum sangat terbatas.
Penelitian ini bertujuan untuk mempelajari keragaman genetika C. acutatum berdasarkan karakter morfologi dan molekuler serta mengevaluasi patogenisitas beberapa isolat C. acutatum yang diperoleh dari beberapa daerah di pulau Jawa dan Sumatera. Masing-masing isolat dikulturkan dengan metode spora tunggal. Pengamatan terhadap karakter morfologi membedakan warna dan diameter masing-masing koloni, serta bentuk dan ukuran konidia. Identifikasi secara molekuler menggunakan metode PCR dengan primer spesifik untuk C. acutatum yaitu CaInt2/ ITS4, dilanjutkan dengan sikuensing produk amplifikasi, dan hasil sikuensing dianalisis dengan menggunakan basic local alignment search tool (BLAST) berdasarkan basis data pada National Center for Biotechnology Information (NCBI). Uji patogenisitas masing-masing isolat terhadap dua spesies cabai (C. annuum dan C. frutescens) dilakukan di laboratorium menggunakan buah cabai.
Hasil penelitian menunjukkan keragaman morfologi diamati dari 40 isolat C. acutatum. Sebagian besar isolat tersebut memiliki koloni putih/krem dengan bentuk konidia fusiform dengan rata-rata panjang 6.11-9.73 µm dan lebar 2.24-2.73 µm. Uji patogenisitas 3 isolat C. acutatum menunjukkan variasi dari sedang sampai tinggi berdasarkan ukuran lesio pada cabai, dan isolat asal BRB 07 menunjukkan tingkat virulensi tertinggi. Berdasarkan perunutan DNA 8 isolat C. acutatum dari Jawa dan Sumatera memiliki homologi yang tinggi.
Pengetahuan awal tentang perbedaan karakter morfologi, genetika, dan tingkat patogenisitas cendawan C. acutatum dapat dimanfaatkan sabagai upaya untuk menyusun strategi pengendalian dalam melakukan program pemuliaan tanaman secara berkelanjutan, sehingga mampu menghasilkan varietas cabai yang tahan terhadap penyakit antraknosa.
SUMMARY
ROY IBRAHIM. Morphology, Genetic, and Pathogenicity Variability of Colletotrichum acutatum causing Anthracnose on Chilli from Several Regions in Java and Sumatera. Supervised by WIDODO and SRI HENDRASTUTI HIDAYAT.
Anthracnose is one of the most important diseases on chilli pepper because it may cause significant yield losses. Among other spesies of Colletotrichum, Colletotrichum acutatum is known as the major causal agent of anthracnose disease of chilli pepper in Indonesia. It is necessary to understand the variability of the pathogen in order to develop resistance varieties of chilli pepper to anthracnose disease. Unfortunately, few is known about the genetic variability of C. acutatum in Indonesia.
This research is aimed to study genetic variability of C. acutatum based on morphological and moleculer characteristic and to evaluate pathogenicity of several isolates of C. acutatum collected from several regions in Java and Sumatera. Each isolate will be cultured based on single-spore isolation method. Observation on morphological characteristic will involve colour and radial growth of each colony, their shape of conidia and size of conidia. Molecular identification approach will consist of (1) amplification of specific DNA using specific primer for C. acutatum i.e. CaInt2/ ITS4, (2) sequencing of the amplification product, and (3) sequence analysis using basic local alignment search tool (BLAST) based on database in national center for biotechnology information (NCBI). Pathogenicity test for each isolate on different type of chilli (C. annuum and C. frutescens) conducted in the laboratory using detached chilli fruits.
Results of this study showed morphology variability was observed from 40 isolates of C. acutatum. Most of the isolates have white/beige colonies with fusiform conidia of 6.11–9.73 µm in length and 2.24–2.73 µm in width. Pathogenicity of 3 C. acutatum isolates varies from moderate to high based on size of lesion on chilli in which isolate BRB 07 from Brebes showed the highest virulence. Sequence analysis of 8 C. acutatum isolates indicated high homology among isolates from Java and Sumatera.
Early information about difference of morphological, genetic, and pathogenicity level of C. acutatum is obtained to construct control strategy in sustainable plant breeding for producing anthracnose resistant chilli cultivars. Key words: diameter colony, DNA amplification, fusiform conidia, sequence
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan mengutip tersebut tidak merugikan kepentingan IPB.
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
KERAGAMAN MORFOLOGI, GENETIKA, DAN
PATOGENISITAS
Colletotrichum acutatum
PENYEBAB
ANTRAKNOSA CABAI DARI BERBAGAI DAERAH DI JAWA
DAN SUMATERA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
PRAKATA
Alhamdulillahirrabbil‟alamin, puji dan syukur penulis ucapkan kepada Allah SWT atas segala karunia-Nya sehingga penelitian ini dapat diselesaikan. Penelitian dengan judul “Keragaman Morfologi, Genetika, dan Patogenisitas Colletotrichum acutatum Penyebab Antraknosa Cabai dari Berbagai Daerah di Jawa dan Sumatera” telah dilaksanakan sejak bulan November 2015 sampai September 2016. Terima kasih penulis ucapkan kepada Dr Ir Widodo, MS dan Prof Dr Ir Sri Hendrastuti Hidayat, M.Sc selaku pembimbing yang memberikan arahan dan bimbingan, saran kepada penulis, serta Prof Dr Muhamad Syukur, SP, M.Si yang telah bersedia bertindak sebagai penguji luar komisi pada ujian tesis. Ungkapan terima kasih juga disampaikan kepada kedua orang tua penulis bapak Darnis L (Alm) dan ibu Muliati, serta seluruh keluarga, atas segala dukungan, doa dan kasih sayangnya.
Penulis menyampaikan banyak terimakasih kepada Muhammad Ridha Alfarabi Istiqlal, SP, M.Si, Ahmad Sutopo, SP, M.Si, Pebriandi, S.Hut, M.Si, Desta Andriani, SP, M.Si, Nela Zahara, SP, M.Si, Widya Sari SP, M.Si, Susana SP, M.Si, Teguh Pamungkas SP, M.Si, Ahmad Nur Hidayat Gena Ari, SP, M.Si, Geubrina Maghfirah, SP, dan Sari Nurulita, SP, M.Si yang telah banyak membantu dan memberi masukan kepada penulis, serta Ikatan Mahasiswa Pascasarjana Asal Sumatera Barat (IMPACS), seluruh anggota Laboratorium Mikologi, Virologi, Bakteri, Nematologi Tumbuhan IPB, Fitopatologi 2013, 2014, 2015, PTN 49 dan seluruh pihak yang tidak bisa disebutkan satu per satu atas segala ilmu dan kebaikan yang diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2017
DAFTAR ISI
Identifikasi Cendawan Colletotrichum berdasarkan Karakter Molekuler 5
Keragaman Patogenisitas Colletotrichum 5
Isolasi Colletotrichum spp. dari Buah Cabai 6
Identifikasi Morfologi C. acutatum 7
Identifikasi Molekuler C. acutatum 7
Uji Patogenisitas Isolat C. acutatum 8
Analisis Data 9
4 HASIL DAN PEMBAHASAN 10
Isolasi dan Identifikasi Cendawan Colletotrichum dari Buah Cabai 10 Identifikasi Molekuler C. acutatum dengan Metode PCR 10
Keragaman Morfologi C. acutatum 11
Analisis Sikuen Nukleotida dan Filogenetika C. acutatum 13
Uji Patogenisitas Isolat C. acutatum 15
DAFTAR TABEL
Isolat C. acutatum koleksi Klinik Tanaman Departemen Proteksi Tanaman IPB yang akan digunakan sebagai bahan penelitian
Skor dan kriteria patogenisitas isolat C. acutatum pada buah cabai
Analisis tabulasi silang antara diameter koloni dengan warna koloni C. acutatum
Tingkat homologi sikuen nukleotida isolat C. acutatum berbagai daerah di Jawa, Sumatera dan negara lain
Skor dan kriteria patogenisitas isolat C. acutatum pada 2 amplifikasi menggunakan pasangan primer CaInt2/ITS4. (M) penanda DNA 1 kb ladder, (K-) kontrol negatif, (1) AGM
Frekuensi jumlah isolat C. acutatum berdasarkan ukuran diameter dan warna koloni. A, putih/krem; B, putih/putih; C, putih/peach; D, putih/olive; E, abu/peach; dan F, abu-abu/olive
Bentuk konidia C. acutatum dari berbagai daerah di Jawa dan Sumatera, yaitu C1, AGM 1535; C2, BGR 1602; C3, BRB 07; C4, KMP 1531; C5, MN 1582; C6, SMG 136; C7, TGM 1101; C8, BL 1603
Pohon filogenetika spesies C. acutatum dari berbagai daerah di Jawa dan Sumatera, yaitu AGM 1535, BGR 1602, BRB 07, KMP 1531, MN 1582, SMG 136, TGM 1101, BL 1603, dan beberapa negara di Asia (Thailand, Cina, Jepang, India, dan Korea). C. capsici (Cc_CHN_EF683602) digunakan sebagai pembanding di luar group
Uji patogenisitas terhadap buah Capsicum annuum varietas Anies IPB. (a) isolat KMP 1531, (b) Isolat TGM 1101, dan (c) BRB 07
DAFTAR LAMPIRAN
1
2
Hasil analisis tabulasi silang antara diameter koloni dengan warna koloni C. acutatum menggunakan program statistik SPSS 16.0
Runutan basa nukleotida beberapa isolat C. acutatum. Tanda *(bintang) menunjukkan basa nukleotida yang identik
1 PENDAHULUAN
Latar Belakang
Cabai merupakan salah satu komoditas sayuran penting dan bernilai ekonomi tinggi di Indonesia. Tanaman cabai dapat dibudidayakan di dataran rendah maupun dataran tinggi. Menurut Badan Pusat Statistik produktivitas cabai nasional Indonesia tahun 2015 adalah 8.65 ton/ha (BPS 2015). Syukur et al. (2010) menyatakan produktivitas cabai mampu mencapai 13.11 ton/ha. Hal ini menandakan bahwa produktivitas cabai di Indonesia masih di bawah potensi yang seharusnya. Salah satu faktor pembatas keberhasilan budidaya cabai adalah adanya gangguan hama dan penyakit.
Salah satu penyakit penting yang dapat menyebabkan rendahnya produksi cabai di Indonesia adalah antraknosa. Penyakit antraknosa dapat menyebabkan kehilangan hasil cabai mencapai 50% (Pakdeevaraporn et al. 2005), bahkan di Indonesia dilaporkan dapat menurunkan hasil cabai 20-90% (Balitbangtan 2016).
Antraknosa pada cabai disebabkan oleh beberapa spesies cendawan Colletotrichum antara lain C. dematium, C. coccodes, C. gloeosporioides, C. capsici, dan C. acutatum (Park et al. 1990; Johnston dan Jones 1997; Kim et al. 1999; Sharma et al. 2005; Kim et al. 2007). Menurut laporan yang dikeluarkan oleh Asian Vegetable Research Development Centre diantara spesies tersebut C. acutatum adalah jenis yang paling dominan di Asia (AVRDC 2009). Lebih lanjut diketahui bahwa diantara isolat Colletotrichum yang berasal dari berbagai daerah di Jawa, Sumatera, dan Bali, sebanyak 58.7% adalah C. acutatum (Widodo 2016 Januari, komunikasi pribadi).
Identifikasi spesies Colletotrichum dapat dilakukan secara morfologi, yaitu berdasarkan warna koloni, diameter koloni, bentuk konidia, dan ukuran konidia (Smith dan Black, 1990; Than et al. 2008). Metode polymerase chain reaction (PCR) dan analisis sikuen nukleotida semakin banyak digunakan dalam proses identifikasi cendawan termasuk Colletotrichum. Ratanacherdchai et al. (2007) menggunakan PCR-RAPD untuk membedakan C. capsici dan C. gloeosporioides penyebab antraknosa pada cabai di Thailand. Johnston dan Jones (1997) menggunakan penanda molekuler 23032/1 dan 28487 untuk membedakan beberapa isolat C. acutatum yang memiliki kesamaan warna koloni. Kemajuan dibidang biologi molekuler menyebabkan keragaman genetika suatu populasi dapat diamati pada tingkat protein, isoenzim, dan tingkat DNA.
Analisis DNA memiliki efisiensi dan keakuratan yang tinggi sehingga dapat membantu dalam identifikasi dan determinasi keragaman genetika suatu cendawan. Menurut Alberts et al. (2002) identifikasi dan determinasi cendawan yang lebih detail dapat menggunakan penciri DNA.
2
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan data dan informasi terkait keragaman genetika C. acutatum berdasarkan karakter morfologi (warna, diameter koloni, bentuk, panjang, dan lebar konidia) maupun genetika (sikuen DNA) dan mengetahui tingkat patogenisitas cendawan tersebut.
Hipotesis Penelitian
Hipotesis dalam penelitian ini adalah:
1. Isolat C. acutatum dari berbagai daerah di Jawa dan Sumatera memiliki perbedaan berdasarkan karakter morfologi maupun genetika.
2. Isolat C. acutatum dari berbagai daerah di Jawa dan Sumatera memiliki perbedaan tingkat patogenisitas terhadap beberapa spesies cabai Capsicum annuum varietas Anies IPB dan C. frutescens varietas Bonita IPB.
Manfaat Penelitian
2 TINJAUAN PUSTAKA
Status Penyakit Antraknosa
Penyakit antraknosa berasal dari bahasa Yunani “antraks” artinya batubara, merupakan nama umum untuk penyakit tanaman yang mempunyai gejala seperti bercak berwarna hitam, memiliki luka yang membentuk cekungan dan mengandung spora. Penyakit ini dapat menyebabkan kerusakan pada daun, batang, buah pra dan pascapanen (Isaac 1992) serta dapat menyebabkan kerugian ekonomi yang cukup tinggi di daerah tropis dan subtropis termasuk Cina, Korea, India, Indonesia, dan Thailand (Voorrips et al. 2004; Kim et al. 2007; Than et al. 2008; Xia et al. 2011).
Penyakit antraknosa merupakan kendala biologis terbesar dalam usahatani cabai, karena disamping dapat menyerang tanaman, juga dapat menyerang buah yang terbentuk, maupun setelah buah dipanen. Cendawan yang menyerang buah merupakan kendala terbesar dalam peningkatan produksi cabai, karena buah dapat gugur sebelum panen atau buah menjadi busuk sebelum dan setelah panen sehingga mengurangi produksi buah yang dapat dipasarkan. Penyakit antraknosa disebabkan oleh cendawan Colletotrichum yang menyerang cabai dan telah menyebabkan kerusakan yang parah pada buah di beberapa daerah tropis (Cerkauskas 2004). Di Indonesia penyakit antraknosa pada cabai mampu menurunkan hasil cabai 20-90% (Balitbangtan 2016).
Penyakit antraknosa pada cabai disebabkan oleh genus Colletotrichum, yang digolongkan menjadi 5 spesies utama yaitu C. dematium, C. coccodes, C. gloeosporioides, C. capsici, dan C. acutatum (Park et al. 1990; Johnston dan Jones 1997; Kim et al. 1999; Sharma et al. 2005; Kim et al. 2007). Menurut laporan yang dikeluarkan oleh Asian Vegetable Research Development Centre diantara spesies tersebut C. acutatum adalah jenis yang paling dominan di Asia (AVRDC 2009).
Gejala Penyakit Antraknosa
Penyakit antraknosa yang disebabkan oleh cendawan Colletotrichum merupakan penyakit penting pada tanaman cabai terutama pada musim hujan dan cendawan ini dapat menginfeksi cabang, ranting, daun, dan buah cabai (Bailey et al. 1992; Suryaningsih et al. 1996). Cendawan menjadi sangat agresif dan gejala mulai muncul pada saat buah mulai matang (Agrios 2005). Gejala pertama muncul berupa bercak kecil basah berwarna kuning atau kehitaman yang membesar dengan cepat. Bercak kemudian berkembang sampai diameter 3-4 cm berwarna dari merah gelap sampai coklat muda dengan jaringan cendawan berwarna gelap yang terdiri atas kumpulan seta atau aservuli yang menghasilkan masa spora berwarna pucat yang tersebar atau berbentuk lingkaran konsentrik pada bercak (Hadden dan Black 1989).
4
kecambah, dan pada tanaman dewasa dapat menimbulkan mati pucuk (Suryaningsih 1996).
Morfologi dan Bioekologi Colletotrichum
Colletotrichum merupakan cendawan anamorfik, termasuk dalam subdivisi Deuteromycotina, kelas Deuteromycetes, subkelas Coelomycetidae, ordo Melanconiales, famili Melanconiaceae dan genus Colletotrichum (Alexopoulos dan Mims 1979). Spesies C. acutatum dalam keadaan tahapan aseksual (anamorf) termasuk dalam kelompok Coelomycetes dan dalam keadaan tahapan seksual (teleomorf) termasuk dalam genus Glomerella dan dimasukkan dalam kelompok Ascomycetes (Wharton dan Uribeondo 2004). Beberapa genus yang termasuk dalam kelompok Ascomycetes, seperti Glomerella, jarang menghasilkan spora seksual (askospora) dan lebih sering menghasilkan spora aseksual (konidia), karena itu genus Glomerella lebih dikenal dalam nama tahapan aseksualnya yaitu Colletotrichum (Agrios 2005).
Spesies C. acutatum memiliki warna koloni putih, merah muda, oranye muda sampai abu-abu (Peres et al. 2005) dan konidia berukuran 8.5-16.5 x 2.5-4 μm (Sutton 1992). Karakteristik utama yang digunakan untuk membedakan cendawan C. acutatum dan C. gloeosporioides adalah bentuk konidia dan laju pertumbuhan. Konidia C. acutatum berbentuk selindrik dengan ujung meruncing dan pertumbuhannya lambat, sedangkan konidia C. gloeosporioides berbentuk selindrik dengan ujung membulat dan pertumbuhannya cepat (Sutton 1992). Martin dan Garcia-Figueres (1999) menyatakan tingkat pertumbuhan cendawan C. acutatum relatif lebih lambat (6.3 mm per hari) dibandingkan dengan cendawan C. gloesporioides (13.7 mm per hari). Konidia dapat tersebar ketika acervuli basah dan biasanya tersebar oleh hembusan air hujan atau bersentuhan dengan serangga, hewan lainnya, dan alat produksi tanaman. C. acutatum tumbuh optimal pada suhu 28 °C dengan laju pertumbuhan sebesar 5.3 (4.0-6.0) mm per hari dan memiliki aktivitas protease yang sangat tinggi dibandingkan dengan C. gloeosporoides dan C. capsici (AVRDC 2004).
Gambar 1 Bentuk konidia C. acutatum, elips dan meruncing pada salah satu ujungnya (Peres et al. 2005)
Namun demikian Nirenberg et al. (2002) menemukan bahwa bentuk dan ukuran konidia bervariasi ketika beberapa spesies Colletotrichum ditumbuhkan. Oleh karena itu, identifikasi berdasarkan metode konvensional tersebut kadang-kadang sulit untuk membedakan antara C. acutatum dengan C. gloeosporioides (Freeman et al. 2001).
Identifikasi Cendawan Colletotrichum berdasarkan Karakter Molekuler
Karakter morfologi suatu cendawan perlu dikaji secara molekuler dikarenakan karakter morfologi sering cukup sulit untuk membedakan antara spesies cendawan (Freeman et al. 2001). Oleh karena itu sejumlah metode molekuler telah banyak digunakan untuk identifikasi cendawan Colletotrichum. Sikuen nukleotida Internal Transcibed Spacer (ITS) dari gen ribosomal RNA (rDNA) telah digunakan untuk membedakan C. acutatum dan C. gloeosporioides. Didasarkan pada sikuen ITS1, primer spesifik PCR dari dua spesies cendawan ini telah dikembangkan (Freeman et al. 2001; Talhinhas et al. 2002). Pasangan primer CgInt/ITS4 dan CaInt2/ITS4 dapat digunakan untuk mengamplifikasi cendawan C. acutatum dan C. gloeosporioides (Brown et al. 1996).
Beberapa genom telah berhasil digunakan dalam identifikasi spesies Colletotrichum. Ratanacherdchai et al. (2007) menggunakan PCR-RAPD untuk membedakan C. capsici dan C. gloeosporioides penyebab antraknosa pada cabai di Thailand. Grahovac et al. (2012) menggunakan forward primer CaInt2, CgInt dan reverse primer ITS4 untuk membedakan spesies C. acutatum dan C. gloeosporioides yang tidak dapat dibedakan berdasarkan karakter morfologi. Photita et al. (2005) telah mengkarakterisasi 34 isolat Colletotrichum spp. dengan menggunakan marka ITS 1 dan ITS 2. Sebanyak 19 isolat C. lupini asal Chile tidak memiliki variasi virulensi antar spesies namun memiliki keragaman genetika yang berbeda berdasarkan hasil PCR-RAPD (Riegel et al. 2010). Sementara itu, Martinez-Culebras et al. (2000) mengidentifikasi 74 isolat Colletotrichum berdasarkan gen ITS1 dan 5.8S rRNA.
Keragaman Patogenisitas Colletotrichum
6
3 METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan, Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman Fakultas Pertanian, dan lahan percobaan di Dramaga-Bogor mulai bulan November 2015 sampai September 2016.
Bahan Penelitian
Bahan yang digunakan adalah koleksi isolat C. acutatum yang diperoleh dari Klinik Tanaman Departemen Proteksi Tanaman IPB, buah cabai yang bergejala antraknosa dari berbagai daerah di Jawa dan Sumatera. Dua varietas cabai, C. annuum varietas Anies IPB dan C. frutescens varietas Bonita IPB, diperoleh dari Laboratorium Pemuliaan Tanaman, Departemen Agronomi dan Hortikultura IPB.
Metode Penelitian
Pengambilan Sampel Buah Terinfeksi
Sampel buah cabai yang terinfeksi antaraknosa diambil dari pertanaman cabai di beberapa kabupaten, yaitu Mandailing Natal (Sumatera Utara); Tanah Datar, Payakumbuh, Agam (Sumatera Barat); Kampar (Riau); Bogor, Cianjur, Bandung Barat (Jawa Barat); Brebes, Tegal (Jawa Tengah); Blitar (Jawa Timur), dan Bangli (Bali). Sampel yang diambil adalah buah cabai dengan gejala penyakit antraknosa, yaitu berupa bercak cokelat kehitaman pada permukaan buah. Sampel buah disimpan dalam kantong plastik secara terpisah dan dimasukkan ke dalam kotak penyimpanan sampel.
Isolasi Colletotrichum spp. dari Buah Cabai
Tabel 1 Isolat C. acutatum koleksi Klinik Tanaman Departemen Proteksi Tanaman IPB yang akan digunakan sebagai bahan penelitian
No Kode isolat Asal isolat
(Kabupaten, Provinsi)
1 TGM 1101 Tanggamus, Lampung
2 TGM 1102 Tanggamus, Lampung
3 HGP 1101 Garut, Jawa Barat
Peremajaan dan Isolasi Cendawan. Koloni cendawan hasil isolasi dan pemurnian diremajakan terlebih dahulu sebelum digunakan dalam percobaan karakterisasi. Masing-masing koloni cendawan C. acutatum (diameter ± 5 mm) dipindahkan ke cawan petri yang berisi media PDA kemudian diinkubasi pada suhu ruang selama 10 hari.
Pengamatan Morfologi. Pengamatan makroskopis morfologi koloni cendawan yang tumbuh dilakukan pada 10 hari setelah isolasi (HSI). Pengamatan dilakukan terhadap warna koloni tampak atas dan bawah, serta diameter koloni pada media PDA. Karakter mikroskopis ditentukan dengan mengamati bentuk, panjang, dan lebar konidia yang dipilih secara acak sebanyak 20 konidia (Than et al. 2008) untuk masing-masing isolat. Pengamatan dilakukan menggunakan slide preparat, kemudian didokumentasikan dengan kamera digital.
Identifikasi Molekuler C. acutatum
8
selama 10 menit. Supernatan dibuang dan pelet dicuci dengan etanol (70%) dan disentrifugasi pada 11 000 rpm selama 10 menit. Etanol dibuang dan pelet dikeringkan dengan vakum. Pelet diresuspensi dalam 100 μL bufer TE dan disimpan pada suhu -20 oC untuk selanjutnya digunakan dalam proses amplifikasi DNA.
Amplifikasi DNA C. acutatum. Amplifikasi DNA dilakukan pada mesin Thermo Cycle PCR. Amplifikasi dilakukan menggunakan primer spesifik untuk C. acutatum yaitu forward primer CaInt2 (5‟-GGGGAAGCCTCTCGCGG-3‟) dan reverse primer ITS4 (5‟-TCCTCCGCTTATTGATATGC-3‟) dengan ukuran target hasil amplifikasi adalah 490 bp. Reaksi amplifikasi DNA dilakukan dengan volume total 25 μL terdiri atas 2 μL DNA, 2.5 μL bufer 10x dan Mg2+, 0.5 μL
dNTP 10 mM, 1 μL masing-masing primer, 0.2 μL Taq DNA (5 unit/μL), dan 17.8 μL H2O. Kondisi amplifikasi dibagi menjadi beberapa tahap yaitu
pradenaturasi 94 oC selama 5 menit, diikuti 30 siklus amplifikasi yang masing-masing siklus terdiri atas pemisahan utas DNA 94 oC selama 1 menit, penempelan primer 45 oC selama 1 menit, sintesis DNA 72 oC selama 2 menit. Khusus untuk siklus terakhir ditambah tahapan sintesis selama 10 menit, kemudian siklus akan berakhir dengan suhu 4 oC.
Elektroforesis DNA. Produk hasil amplifikasi dianalisis dengan 1% gel agarosa (0.5xTris-Borate EDTA/TBE). Elektroforesis dilakukan pada 50 volt selama 50 menit dan selanjutnya gel agarosa diinkubasi pada zat pewarna yang berisi etidium bromida (1%) selama 15 menit, lalu dicuci dengan H2O selama 10
menit. Hasil elektroforesis divisualisasikan dengan transilluminator ultraviolet. Pita DNA yang terbentuk pada hasil elektroforesis tersebut didokumentasikan dengan kamera digital.
Analisis Runutan DNA C. acutatum. Produk amplifikasi dikirim ke 1st
Base (Malaysia) untuk perunutan nukleotida. Hasil perunutan selanjutnya dianalisis menggunakan program basic local alignment search tool (BLAST) dengan program optimasi untuk memperoleh urutan basa DNA yang memiliki homologi dengan sikuen DNA yang terdapat dalam situs National Center for Biotechnology Information (NCBI). Runutan nukleotida yang diperoleh kemudian dianalisis menggunakan penyejajaran berganda ClustalW pada perangkat lunak Bioedit sequence alignment editor versi 7.1.3. Hubungan kekerabatan antar isolat dikonstruksi menggunakan perangkat lunak molecular evolutionery genetic analysis versi 6.06 (MEGA6) dengan bootstrap 1 000 kali ulangan.
Uji Patogenisitas Isolat C. acutatum
Tabel 2 Skor dan kriteria patogenisitas isolat C. acutatum pada buah cabai
Skor Ukuran lesio Tingkat virulensi
0 Tidak ada lesio Tidak virulen
1 Lesio < 3 mm Virulensi rendah
2 Lesio 3-5 mm Virulensi sedang
3 Lesio > 5 mm Virulensi tinggi
Analisis Data
10
4 HASIL DAN PEMBAHASAN
Isolasi dan Identifikasi Cendawan Colletotrichum dari Buah Cabai
Hasil isolasi cendawan Colletotrichum dari pertanaman cabai di beberapa kabupaten, yaitu Mandailing Natal (Sumatera Utara); Tanah Datar, Payakumbuh, Agam (Sumatera Barat); Kampar (Riau); Bogor, Cianjur, Bandung Barat (Jawa Barat); Brebes, Tegal (Jawa Tengah); Blitar (Jawa Timur), dan Bangli (Bali). Sebanyak 42 isolat yang diduga cendawan C. acutatum berhasil diperoleh dari buah cabai yang menunjukkan gejala antraknosa.
Isolat-isolat tersebut menunjukkan ciri-ciri pertumbuhan yang dimiliki C. acutatum, yaitu warna koloni putih dan abu-abu tampak atas, serta pertumbuhan koloni yang lambat, yaitu 3.3-7.3 mm per hari. Peres et al. (2005) menyatakan cendawan C. acutatum memiliki warna koloni putih, merah muda, oranye muda sampai abu-abu. Martin dan Garcia-Figueres (1999) cendawan C. acutatum memiliki tingkat pertumbuhan yang relatif lebih lambat (6.3 mm per hari).
Isolat-isolat yang diperoleh dari buah cabai yang bergejala antraknosa tersebut selanjutnya digunakan untuk identifikasi secara molekuler dengan metode PCR bersama 7 isolat C. acutatum koleksi Klinik Tanaman.
Identifikasi Molekuler C. acutatum dengan Metode PCR
Amplifikasi pita DNA dilakukan menggunakan primer spesifik C. acutatum CaInt2/ITS4. Pita DNA berukuran ± 490 pb berhasil diamplifikasi dari 40 isolat, sementara dari 9 isolat lainnya tidak diperoleh pita DNA (Gambar 2). Berdasarkan hasil amplifikasi, 40 isolat dinyatakan sebagai isolat C. acutatum. Penggunaan primer spesifik untuk mengamplifikasi spesies Colletotrichum telah banyak dilaporkan. Pasangan primer CgInt/ITS4 dan CaInt2/ITS4 dapat digunakan untuk mengamplifikasi cendawan C. acutatum dan C. gloeosporioides (Brown et al. 1996). Sreenivasaprasad et al. (1996) mengidentifikasi spesies cendawan C. acutatum menggunakan primer CaInt2 dan ITS4. Grahovac et al. (2012) menggunakan forward primer CaInt2, CgInt dan reverse primer ITS4 untuk membedakan spesies C. acutatum dan C. gloeosporioides yang tidak dapat dibedakan berdasarkan karakter morfologi.
Gambar 2 Visualisasi pita DNA isolat-isolat C. acutatum asal cabai hasil amplifikasi menggunakan pasangan primer CaInt2/ITS4. (M) penanda DNA 1 kb ladder, (K-) kontrol negatif, (1) AGM 1533, (2) BDG 1524, (3) BDG 1525, (4) HGP 1101, (5) KMP 1531, (6) SMG 136, (7) SMG 137, (8) TD 1532, (9) TD 1534, dan (10) TGM 1101
Grahovac et al. (2012) menyatakan spesies C. acutatum dan C. gloeosporioides tidak dapat dibedakan berdasarkan karakter morfologi. Hal tersebut tidak sejalan dengan hasil penelitian yang diperoleh. Berdasarkan hasil penelitian ini dari 49 isolat yang diduga C. acutatum berdasarkan karakter morfologi, sebesar 81.6% terkonfirmasi secara molekuler dengan menggunakan primer spesifik CaInt2/ITS4. Oleh karena itu identifikasi morfologi masih layak digunakan untuk membedakan C. acutatum dan C. gloeosporioides.
Keragaman Morfologi C. acutatum
Keragaman terhadap morfologi dilakukan terhadap 40 isolat C. acutatum yang telah diidentifikasi secara molekuler sebelumnya. Berdasarkan warna koloni, ditemukan variasi warna yang cukup beragam yaitu putih dan abu-abu untuk warna koloni tampak atas dan krem, putih, peach, olive untuk warna koloni tampak bawah (Gambar 3). Than et al. (2008) melaporkan 7 isolat C. acutatum yang berhasil diisolasi dari cabai memiliki warna koloni oranye dengan sedikit miselium udara (aerial mycelium). Peres et al. (2005) mengemukakan bahwa koloni C. acutatum berwarna putih pada awalnya dan kemudian menjadi warna merah muda atau oranye. Sementara itu, Ivey et al. (2004) mendeskripsikan koloni C. acutatum berwarna putih pada awal perkembangan kemudian menjadi oranye dan abu-abu.
12
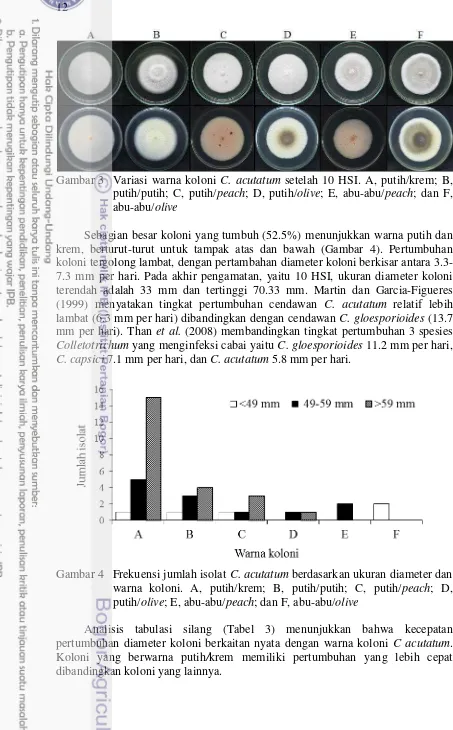
Gambar 3 Variasi warna koloni C. acutatum setelah 10 HSI. A, putih/krem; B, putih/putih; C, putih/peach; D, putih/olive; E, abu-abu/peach; dan F, abu-abu/olive
Sebagian besar koloni yang tumbuh (52.5%) menunjukkan warna putih dan krem, berturut-turut untuk tampak atas dan bawah (Gambar 4). Pertumbuhan koloni tergolong lambat, dengan pertambahan diameter koloni berkisar antara 3.3-7.3 mm per hari. Pada akhir pengamatan, yaitu 10 HSI, ukuran diameter koloni terendah adalah 33 mm dan tertinggi 70.33 mm. Martin dan Garcia-Figueres (1999) menyatakan tingkat pertumbuhan cendawan C. acutatum relatif lebih lambat (6.3 mm per hari) dibandingkan dengan cendawan C. gloesporioides (13.7 mm per hari). Than et al. (2008) membandingkan tingkat pertumbuhan 3 spesies Colletotrichum yang menginfeksi cabai yaitu C. gloesporioides 11.2 mm per hari, C. capsici 7.1 mm per hari, dan C. acutatum 5.8 mm per hari.
Gambar 4 Frekuensi jumlah isolat C. acutatum berdasarkan ukuran diameter dan warna koloni. A, putih/krem; B, putih/putih; C, putih/peach; D, putih/olive; E, abu-abu/peach; dan F, abu-abu/olive
Tabel 3 Analisis tabulasi silang antara diameter koloni dengan warna koloni C. acutatum
Diameter koloni (mm)
Warna koloni (atas/bawah)a
χ2 Pb
A B C D E F
<49 1 1 1 0 0 2
21.81 0.01
49-59 5 3 1 1 2 0
>59 15 4 3 1 0 0
a
A, putih/krem; B, putih/putih; C, putih/peach; D, putih/olive; E, abu-abu/peach; F, abu-abu/olive
b
Nilai P< 0.05 menunjukkan ada hubungan antara diameter koloni dengan warna koloni
Karakteristik utama yang digunakan untuk membedakan cendawan C. acutatum dan C. gloeosporioides adalah bentuk konidia dan laju pertumbuhan. Konidia C. acutatum berbentuk silindris dengan ujung meruncing dan pertumbuhannya lambat, sedangkan konidia C. gloeosporioides berbentuk silindris dengan ujung membulat dan pertumbuhannya lebih cepat dibandingkan C. acutatum (Sutton 1992).
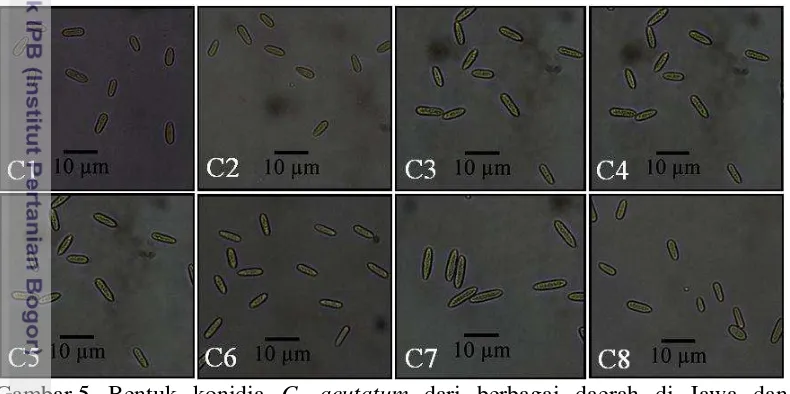
Gambar 5 Bentuk konidia C. acutatum dari berbagai daerah di Jawa dan Sumatera, yaitu C1, AGM 1535; C2, BGR 1602; C3, BRB 07; C4, KMP 1531; C5, MN 1582; C6, SMG 136; C7, TGM 1101; C8, BL 1603
Konidia dari 40 isolat (Gambar 5) pada umumnya berbentuk fusiform dengan rata-rata panjang dan lebar konidia berkisar 6.11-9.73 x 2.24-2.73 µm. Bentuk konidia yang diamati sesuai dengan ciri konidia C. acutatum, yaitu konidia berbentuk elips dan meruncing pada salah satu ujungnya (Peres et al. 2005) dan berukuran 8.5-16.5 x 2.5-4 μm (Sutton 1992).
Analisis Sikuen Nukleotida dan Filogenetika C. acutatum
14
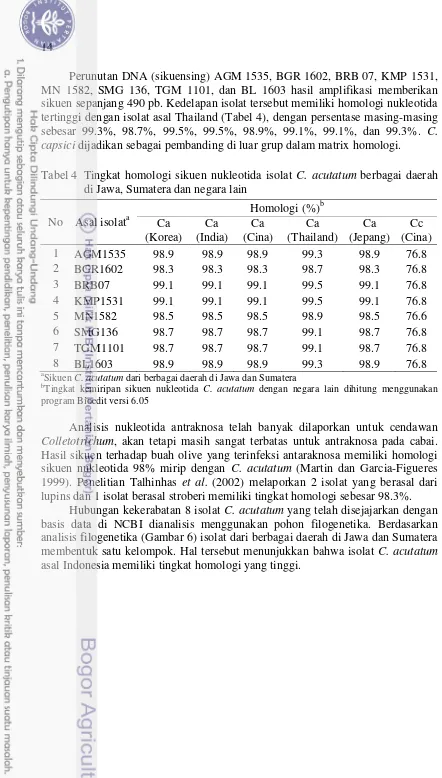
Perunutan DNA (sikuensing) AGM 1535, BGR 1602, BRB 07, KMP 1531, MN 1582, SMG 136, TGM 1101, dan BL 1603 hasil amplifikasi memberikan sikuen sepanjang 490 pb. Kedelapan isolat tersebut memiliki homologi nukleotida tertinggi dengan isolat asal Thailand (Tabel 4), dengan persentase masing-masing sebesar 99.3%, 98.7%, 99.5%, 99.5%, 98.9%, 99.1%, 99.1%, dan 99.3%. C. capsici dijadikan sebagai pembanding di luar grup dalam matrix homologi.
Tabel 4 Tingkat homologi sikuen nukleotida isolat C. acutatum berbagai daerah di Jawa, Sumatera dan negara lain
No Asal isolata
Sikuen C. acutatum dari berbagai daerah di Jawa dan Sumatera
b
Tingkat kemiripan sikuen nukleotida C. acutatum dengan negara lain dihitung menggunakan program Bioedit versi 6.05
Analisis nukleotida antraknosa telah banyak dilaporkan untuk cendawan Colletotrichum, akan tetapi masih sangat terbatas untuk antraknosa pada cabai. Hasil sikuen terhadap buah olive yang terinfeksi antaraknosa memiliki homologi sikuen nukleotida 98% mirip dengan C. acutatum (Martin dan Garcia-Figueres 1999). Penelitian Talhinhas et al. (2002) melaporkan 2 isolat yang berasal dari lupins dan 1 isolat berasal stroberi memiliki tingkat homologi sebesar 98.3%.
AGM1535_IDN (Cc_CHN_EF683602) digunakan sebagai pembanding di luar group Isolat-isolat tersebut menunjukkan hubungan kekerabatan yang paling dekat dengan isolat asal Thailand, diantara isolat-isolat dari negara Asia lainnya (Cina, Jepang, India, dan Korea). Diduga cendawan ini tersebar ke Indonesia melalui aktifitas impor benih. Thailand merupakan negara eksportir cabai dan paprika hijau terbesar di ASEAN dengan kontribusi sebesar 56.94% pada tahun 2008-2012 (Pusdatin 2015). Selain itu satu sikuen outgroup yang dipilih merupakan jenis C. capsici dari yang berpotensi sebagai patogen. Hal tersebut bertujuan membandingkan hubungan kekerabatan jenis spesies yang telah teridentifikasi dengan cendawan patogen lainnya.
Uji Patogenisitas Isolat C. acutatum
16
Tabel 5 Skor dan kriteria patogenisitas isolat C. acutatum pada 2 spesies cabai Isolat Rata-rata ukuran lesio Tingkat virulensi
C. annuum
KMP 1531 4.91 Sedang
TGM 1101 3.66 Sedang
BRB 07 17.00 Tinggi
C. frutescens
KMP 1531 7.33 Tinggi
TGM 1101 11.91 Tinggi
BRB 07 19.08 Tinggi
Inokulasi 3 isolat C. acutatum pada 2 spesies cabai menghasilkan ukuran lesio yang beragam (Tabel 5). Ukuran lesio berkisar antara 3.66-19.08 mm dengan tingkat virulensi sedang dan tinggi. Isolat asal Brebes (BRB 07) menghasilkan ukuran lesio terbesar pada kedua spesies cabai, diikuti oleh isolat asal Tanggamus (TGM 1101) dan isolat asal Kampar (KMP 1531). Perbedaan ukuran lesio, diduga dipengaruhi oleh beberapa faktor diantaranya asal isolat dan genetik cabai. Asal isolat sangat mempengaruhi kemampuan dari setiap isolat untuk melakukan proses infeksi terhadap buah cabai. Hasil yang sama telah dilaporkan oleh Liao et al. (2012) menyatakan bahwa 3 isolat C. acutatum menghasilkan ukuran lesio yang berbeda-beda pada C. annuum, C. baccatum, dan C. chinense.
Gambar 7 Uji patogenisitas terhadap buah Capsicum annuum varietas Anies IPB. (a) isolat KMP 1531, (b) Isolat TGM 1101, dan (c) BRB 07
Gambar 8 Uji patogenisitas terhadap buah Capsicum frutescens varietas Bonita IPB. (a) isolat KMP 1531, (b) Isolat TGM 1101, dan (c) BRB 07
18
5 PEMBAHASAN UMUM
Penyakit antraknosa pada tanaman cabai di Jawa dan Sumatera lebih dominan disebabkan oleh spesies cendawan C. acutatum. Variasi karakter morfologi, genetika, dan patogenisitas perlu dilakukan untuk dapat memberikan informasi terkait terhadap cendawan tersebut. Karakter morfologi dari suatu cendawan seperti ukuran konidia, bentuk konidia, warna koloni dan tingkat pertumbuhan belum mampu memberikan informasi yang cukup. Sutton et al. (1992) menyatakan bahwa identifikasi spesies Colletotrichum berdasarkan morfologi sulit diidentifikasi karena memiliki persamaan konidia maupun warna koloni.
Identifikasi berdasarkan morfologi dirasa kurang memberikan informasi yang akurat sehingga berbagai teknik molekuler telah banyak digunakan untuk mengidentifikasi cendawan dan memiliki akurasi yang tinggi (Freeman dan Katan 1997). Pendekatan molekuler banyak digunakan untuk saat ini karena telah memberikan informasi yang cepat dan tepat. Penggunaan spesifik primer berdasarkan ITS telah banyak digunakan untuk membedakan antara cendawan C. gloeosporioides dan C. acutatum. Identifikasi dengan menggunakan primer spesifik dan sikuen nukleotida berguna untuk membedakan spesies Colletotrichum yang tidak dapat atau sulit jika dilakukan secara morfologi (Ivey et al. 2004). Cannon et al. (2000) menyatakan analisis sikuen nukleotida dapat memberikan informasi yang akurat dikarenakan proses tersebut tidak dipengaruhi oleh faktor lingkungan secara langsung. Abang (2003) menyatakan bahwa informasi tentang keragaman patogen dan distribusi penyebaran patogen merupakan syarat untuk menciptakan varietas yang tahan.
Salah satu aspek teknis penting setelah mengetahui perbedaan spesies maupun genetik suatu patogen diantaranya adalah tingkat virulensinya pada inang tertentu. Than et al. (2008) menemukan cabai spesies C. baccatum genotipe PBC 80 tahan terhadap isolat C. acutatum sedangkan genotipe PBC 81 sangat rentan terhadap isolat C. acutatum tersebut dalam uji patogenisitas. Isolat C. acutatum asal stroberi mampu menginfeksi buah cabai dan memiliki potensi silang pada banyak buah (Freeman et al. 1998). Sanders dan Korsten (2003) menyatakan isolat C. gloeosporioides hasil isolasi dari mangga mampu menghasilkan ukuran lesio pada cabai, pepaya, dan jambu. Uji patogenisitas berguna untuk mengetahui suatu ketahanan cabai terhadap serangan antraknosa dan dapat dijadikan solusi untuk menciptakan varietas yang tahan.
Hubungan karakter morfologi, genetika, dan patogenisitas sampai saat ini belum banyak dilaporkan, dan umumnya hanya dibahas secara terpisah. Karakter morfologi dari suatu cendawan memiliki perbedaan satu sama lain dan banyak faktor yang mempengaruhi karakter morfologi tersebut. Freeman dan Katan (1997) menyatakan bahwa faktor lingkungan sangat berpengaruh terhadap perubahan morfologi dari suatu cendawan. Karakter secara genetika isolat C. acutatum yang berasal dari berbagai daerah dalam penelitian ini menunjukkan tingkat homologi yang tinggi tetapi memiliki variasi virulensi yang ditunjukkan oleh perbedaan ukuran gejala lesio pada buah dalam uji patogenisitas.
20
6 SIMPULAN DAN SARAN
Simpulan
Isolat-isolat C. acutatum yang berasal dari berbagai daerah di Indonesia menunjukkan keragaman morfologi didasarkan pada perbedaan warna dan diameter koloni serta ukuran konidianya. Tingkat virulensi isolat-isolat C. acutatum berkisar antara sedang sampai tinggi dan isolat-isolat tersebut memiliki tingkat homologi yang tinggi berdasarkan analisis sikuen nukleotidanya.
Saran
DAFTAR PUSTAKA
Abang MM. 2003. Genetic diversity of Colletotrichum gloeosporioides Penz. causing anthracnose disease of-yam (Dioscorea spp.) in Nigeria. Biblioth Mycol. 11: 8-11.
Agrios GN. 2005. Plant Pathology. 5rd ed. London (GB): Elsevier Academic. Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. 2002. Molecular
Biology of the Cell. 4th ed. New York (US): Garland Science.
Alexopoulos CJ, Mims CW. 1979. Introduction to Soil Microbiology. 3rd ed. Jhon Willey and Sons. New York.
Alvarez E, Ganan L, Trivino AR, Mejia JF, Liano GA, Gonzalez A. 2014. Diversity and pathogenicity of Colletotrichum species isolated from soursop in Colombia. Eur J Plant Pathol. 139(2): 325-228.doi: 10.1007/s10658-014-0388-7.
[AVRDC] Asian Vegetable Research and Development Center. 2009. Development of Locally Adapted, Multiple Disease-Resistent and High Yielding Chilli (Capsicum annuum) Cultivars for China, India, Indonesia, and Thailand Phase II. Taiwan (TW): AVRDC Publication.
[AVRDC] Asian Vegetable Research Development Centre 2004, „Fact Sheet‟, AVRDC publication 04-174. [Internet]. [diunduh 2015 Sep 14]. Tersedia pada: www.avrdc.org.
Bailey JA, O‟Connell RJ, Pring RJ, Nash C. 1992. Infection strategies of Colletotrichum species. Di dalam: Bailey JA, Jeger MJ, editor. Colletotrichum. Biology, Pathology and Control. CAB International.
[Balitbangtan] Balai Penelitian dan Pengembangan Pertanian. 2016. Pengendalian antraknosa pada tanaman cabai. [Internet]. [diunduh 2016 Okt 11]. Tersedia pada: http://www.litbang.pertanian.go.id/berita/one/2630/.
[BPS] Badan Pusat Statistik. 2015. Produksi cabai besar, cabai rawit, dan bawang merah tahun 2014. [Internet]. [diunduh 2016 Jan 07]. Tersedia pada: http://www.bps.go.id/brs/view/id/1168.
Brown A, Sreenivasaprasad S, Timmer L. 1996. Molecular characterization of slow-growing orange and key lime anthracnose strains of Colletotrichum from citrus as Colletotrichum acutatum. Phytopathology. 86(5):523-527. Cannon PF, Bridge PD, Monte E. 2000. Linking the past, present, and future of
Colletotrichum systematics. Dalam Prusky D, Freeman S, Dickman M. (eds). Colletotrichum: host specificity, pathology, and host-pathogen interaction. St. Paul. APS Press.
Cerkauskas R. 2004. Pepper Diseases : Anthracnose. [Internet]. [diunduh 2015 Des 18]. Tersedia pada : http://www.avrdc.org/LC/pepper/anthracnose.pdf. Choi YW, Hyde KD, Ho WH. 1999. Single spore isolation of fungi. J Fungal
Divers. 3:29-38.
22
Freeman S, Katan T. 1997. Identification of Colletotrichum species responsible for anthracnose and root necrosis of strawberry in Israel. Phytopathology 87(5):516-521.
Freeman S, Katan T, Shabi E. 1998. Characterization of Colletotrichum species responsible for anthracnose diseases of various fruits. Plant dis. 82(6):596-605.
Grahovac M, Indic D, Vukovic S, Hrustc J, Gvozdenac S, Mihajlovic M, Tanovic B. 2012. Morphological and ecological features as differentiation criteria for Colletotrichum species. Zemdirby Agricult. 99(21):89-196.
Hadden JF, Black LL. 1989. Anthracnose of Pepper caused by Colletotrichum spp. Di dalam Green SK, Griggs TD, and Mc Lean (eds). Tomato and Pepper Production in The Tropics. Taiwan. AVRDC.
Hartman JF, Wang TC. 1992. Antrachnose of Pepper - A Review and Report of a Training Course. Taiwan. AVRDC.
Isaac S. 1992. Fungal Plant Interaction. London (UK): Chapman and Hall Press.
Ivey MLL, Nava-Diaz C, Miller SA. 2004. Identification and management of
Colletotrichum acutatum on immature bell peppers. Plant Dis. 88(11):1198-1204.
Johnston PR, Jones D. 1997. Relationships among Colletotrichum isolates from fruit-rots assessed using rDNA sequences. Mycologia. 89(3):420-430. Kim KD, Oh BJ, Yang J. 1999. Differential interaction of a Colletotrichum
gloeosporioides isolate with green and red pepper fruits. Pytoparasit. 27(2):97-106.
Kim SH, Yoon JB, Do JW, Park HG. 2007. Resistance to anthracnose caused by Colletotrichum acutatum in chilli pepper (Capsicum annuum L.). J Crop Sci Biotech. 10(4):277-280.
Liao CY, Chen MY, Chen YK, Wang TC, Sheu ZM, Kuo KC, Chang PFL, Chung KR, Lee MH. 2012. Characterization of three Colletotrichum acutatum isolates from Capsicum spp. Eur J Plant Pathol. 133(3):599-608.doi:10.1007/s10658-011-9935-7.
Martinez-Culebras PV, Barrio E, Garcia MD, Querol A. 2000. Identification of Colletotrichum species responsible for anthracnose of strawberry based on the internal transcribed spacers of the ribosomal region. J FEMS Microbiol Lett. 189(1):97-101.doi:10.1111/j.1574-6968.2000.tb09213.x.
Martin M, Garcia-Figueres F. 1999. Colletotrichum acutatum and Colletotrichum gloeosporioides cause anthracnose on olives. Eur J Plant Pathol.105(8):733-741.doi:10.1023/A:1008785703330.
Nirenberg HI, Feiler U, Hagedorn G. 2002. Description of Colletotrichum lupini comb. nov. in modern terms. Mycologia. 94(2):307-320.
Oh BJ, Kim KD, Kim YS. 1999. Effect of cuticular wax layers of green and red pepper fruits on infection by Colletotrichum gloeosporioides. J Phytopathol. 147(9):547-552.doi:10.1046/j.1439-0434.1999.00407.x.
Park H, Kim B, Lee W. 1990. Inheritance of resistance to anthracnose (Colletotrichum spp.) in pepper (Capsicum annuum L.). II. Genetic analysis of resistance to Colletotrichum dematium [abstrak]. J Kor Soci Hort Scie. 31(3):207-212.
Peres NA, Timmer LW, Adaskaveg JE, Correll JC. 2005. Lifestyles of Colletotrichum acutatum. Plant Dis. 89(8):784-796.
Photita W, Taylor PWJ, Ford R, Hyde KD, Lumyong, S. 2005. Morphological and molecular characterization of Colletotrichum species from herbaceous plants in Thailand. Fungal Divers. 18:117-133.
[Pusdatin] Pusat Data dan Sistem Informasi Pertanian. 2015. Outlook komoditas pertanian subsektor hortikultura cabai [Internet]. [diunduh 2016 Sep 09].
Tersedia pada:
http://epublikasi.setjen.pertanian.go.id/epublikasi/outlook/2015.
Ratanacherdchai K, Wang HK, Lin FC, Soytong K. 2007. RAPD analysis of Colletotrichum species causing chilli anthracnose disease in Thailand. J Agricult Technol. 3(2):211-219.
Riegel R, Veliz D, Von Baer I, Quitral Y, Munoz M. 2010. Genetic diversity and virulence of Colletotrichum lupini isolates collected in Chile. Trop Plant Pathol. 35(3):144-152.doi:10.1590/S1982-56762010000300002.
Sambrook J, Fritsch EF, Maniatis T. 1989. Molecular Cloning: a Laboratory Manual. 3th ed. New York (US): Cold Spring.
Sanders G, Korsten L. 2003. Comparison of cross inoculation potential of South African avocado and mango isolates of Colletotrichum gloeosporioides. Microbiol res. 158(2):143-150.
Sharma P, Kaur M, Sharma O, Sharma P, Pathania A. 2005. Morphological, pathological and molecular variability in Colletotrichum capsici, the cause of fruit rot of chillies in the subtropical region of North‐Western India. J Phytopathol. 153(4):232-237.doi:10.1111/j.1439-0434.2005.00959.x.
Smith BJ, Black LL. 1990. Morphological, cultural and pathogenic variation among Colletotrichum species isolated from strawberry. Plant Dis. 74: 69-76.doi:10.1094/PD-74-0069.
Sreenivasaprasad S, Sharada K, Brown A, Mills P. 1996. PCR‐based detection of Colletotrichum acutatum on strawberry. Plant Pathol. 45(4):650-655.doi: 10.1046/j.1365-3059.1996.d01-3.x.
Suryaningsih ER, Sutarya, Duriat AS. 1996. Penyakit tanaman cabai merah dan pengendaliannya. hal. 64-83. Dalam Duriat AS, Widjaja A, Hadisoeganda W, Soetiarso TA, Prabaningrum L (eds.). Teknologi Produksi Cabai Merah. Lembang. Balai Penelitian Tanaman Sayuran.
Sutton BC. 1992. The genus Glomerella and it‟s anamorph Colletotrichum. Di dalam: Bailey JA, Jeger MJ, editor. Colletotrichum. Biology, Pathology and Control. CAB International.
Syukur M, Sujiprihati S, Yunianti R, Kusumah DA. 2010. Evaluasi daya hasil cabai hibrida dan daya adaptasinya diempat lokasi dalam dua tahun. J Agron Indones. (38)1:43-51.
24
Than PP, Jeewon R, Hyde KD, Pongsupasamit S, Mongkolporn O, Taylor PWJ. 2008. Characterization and pathogenicity of Colletotrichum species associated with anthracnose on chilli (Capsicum spp.) in Thailand. Plant Pathol. 57(3):562-572.doi:10.1111/j.1365-3059.2007.01782.x.
Voorrips RE, Finkers R, Sanjaya L, Groenwold R. 2004. QTL mapping of anthracnose (Colletotrichum spp.) resistance in a cross between Capsicum annuum and Capsicum chinense. Theoret App Gen. 109(6):1275-1282.doi: 10.1007/s00122-004-1738-1.
Waller JM, Bridge PD, Black R, Hakiza G. 1993. Characterization of the coffee berry disease pathogen, Colletotrichum kahawae sp. nov. Mycol Res. 97(8):989-994.doi:10.1016/S0953-7562(09)80867-8.
Wharton PS, Uribeondo JD. 2004. The biology of Colletotrichum acutatum. J Anal del Jard Botan de Madr. 61(1):3-22.doi:10.3989/ajbm.2004.v61.i1.61. Xia H, Wang XL, Zhu HJ, Gao BD. 2011. First report of anthracnose caused by
Glomerella acutata on chilli pepper in China. Plant Dis. 95:219.doi: http://dx.doi.org/10.1094/PDIS-10-10-0727.
Lampiran 1 Hasil analisis tabulasi silang antara diameter koloni dengan warna koloni C. acutatum menggunakan program statistik SPSS 16.0 Diameter koloni * Warna koloni
Pearson Chi-Square 21.811a 10 .016
Likelihood Ratio 16747 10 .051
Linear-by-Linear Association 8.344 1 .049
N of Valid Cases 40
a. 16 cells (88,9%) have expected count less than 5. The minimum expected count is, 25.
Lampiran 2 Runutan basa nukleotida beberapa isolat C. acutatum. Tanda *(bintang) menunjukkan basa nukleotida yang identik
....|....| ....|....| ....|....| ....|....|
5 15 25 35 AGM1535_IDN GGGGAAGCCC TTCGCGGGCC TCCCCTCCCG GCGCCGGCCC
BGR1602_IDN GGGGNNGCCC TTCGCGGGCC TCCCCTCCCG GCGCCGGCCC BRB07_IDN GGGGAAGCCC TTCGCGGGCC TCCCCTCCCG GCGCCGGCCC KMP1531_IDN GGGGAAGCCC TTCGCGGGCC TCCCCTCCCG GCGCCGGCCC MN1582_IDN GGGGAAACCG TTTGCGGGCC TCCCCTCCCG GCGCCGGCCC SMG136_IDN GGGGAAGCCC TTCGCGGGCC TCCCCTCCCG GCGCCGGCCC TGM1101_IDN GGGGAAGCCC CTCGCGGGCC TCCCCTCCCG GCGCCGGCCC BL1603_IDN GGGGAAGCCC TTCGCGGGCC TCCCCTCCCG GCGCCGGCCC Ca_KOR GGGGAAGCCT CTCGCGGGCC TCCCCTCCCG GCGCCGGCCC Ca_IND GGGGAAGCCT CTCGCGGGCC TCCCCTCCCG GCGCCGGCCC Ca_CHN GGGGAAGCCT CTCGCGGGCC TCCCCTCCCG GCGCCGGCCC Ca_THA GGGGAAGCCT CTCGCGGGCC TCCCCTCCCG GCGCCGGCCC Ca_JPN GGGGAAGCCT CTCGCGGGCC TCCCCTCCCG GCGCCGGCCC Cc_CHN ---GGCGTCC CCTAAAAAGG ACGTCTCCCG GCCCT--CTC Clustal Co * * * ****** ** * * *
....|....| ....|....| ....|....| ....|....|
45 55 65 75 AGM1535_IDN CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC
28
Lampiran 2 (Lanjutan)
BRB07_IDN CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC KMP1531_IDN CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC MN1582_IDN CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC SMG136_IDN CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC TGM1101_IDN CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC BL1603_IDN CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC Ca_KOR CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC Ca_IND CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC Ca_CHN CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC Ca_THA CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC Ca_JPN CCACCACGGG GACGGGGCGC CCGCCGGAGG A-AACCAAAC Cc_CHN CCGTC-CGCG GGTGGGGCGC CCGCCGGAGG ATAACCAAAC Clustal Co ** * ** * * ******* ********** * ********
....|....| ....|....| ....|....| ....|....|
85 95 105 115 AGM1535_IDN TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT
BGR1602_IDN TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT BRB07_IDN TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT KMP1531_IDN TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT MN1582_IDN TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT SMG136_IDN TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT TGM1101_IDN TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT BL1603_IDN TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT Ca_KOR TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT Ca_IND TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT Ca_CHN TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT Ca_THA TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT Ca_JPN TCTATTTACA CGACGTCTCT TCTGAGTGGC ACAAGCAAAT Cc_CHN TCTGATTTAA CGACGTTTCT TCTGAGTGAC ACAAGCAAAT Clustal Co *** ** * ****** *** ******** * **********
....|....| ....|....| ....|....| ....|....|
125 135 145 155 AGM1535_IDN AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC
BGR1602_IDN AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC BRB07_IDN AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC KMP1531_IDN AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC MN1582_IDN AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC SMG136_IDN AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC TGM1101_IDN AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC BL1603_IDN AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC Ca_KOR AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC Ca_IND AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC Ca_CHN AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC Ca_THA AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC Ca_JPN AATTAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC Cc_CHN AATCAAAACT TTTAACAACG GATCTCTTGG TTCTGGCATC Clustal Co *** ****** ********** ********** **********
....|....| ....|....| ....|....| ....|....|
165 175 185 195 AGM1535_IDN GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG
Lampiran 2 (Lanjutan)
BRB07_IDN GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG KMP1531_IDN GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG MN1582_IDN GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG SMG136_IDN GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG TGM1101_IDN GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG BL1603_IDN GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG Ca_KOR GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG Ca_IND GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG Ca_CHN GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG Ca_THA GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG Ca_JPN GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG Cc_CHN GATGAAGAAC GCAGCGAAAT GCGATAAGTA ATGTGAATTG Clustal Co ********** ********** ********** **********
....|....| ....|....| ....|....| ....|....|
205 215 225 235 AGM1535_IDN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC
BGR1602_IDN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC BRB07_IDN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC KMP1531_IDN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC MN1582_IDN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC SMG136_IDN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC TGM1101_IDN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC BL1603_IDN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC Ca_KOR CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC Ca_IND CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC Ca_CHN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC Ca_THA CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC Ca_JPN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC Cc_CHN CAGAATTCAG TGAATCATCG AATCTTTGAA CGCACATTGC Clustal Co ********** ********** ********** **********
....|....| ....|....| ....|....| ....|....|
245 255 265 275 AGM1535_IDN GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA
BGR1602_IDN GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA BRB07_IDN GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA KMP1531_IDN GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA MN1582_IDN GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA SMG136_IDN GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA TGM1101_IDN GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA BL1603_IDN GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA Ca_KOR GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA Ca_IND GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA Ca_CHN GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA Ca_THA GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA Ca_JPN GCTCGCCAGC ATTCTGGCGA GCATGCCTGT TCGAGCGTCA Cc_CHN GCCCGCCAGC ATTCTGGCGG GCATGCCTGT TCGAGCGTCA Clustal Co ** ******* ********* ********** **********
....|....| ....|....| ....|....| ....|....|
285 295 305 315 AGM1535_IDN TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG
30
Lampiran 2 (Lanjutan)
BRB07_IDN TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG KMP1531_IDN TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG MN1582_IDN TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG SMG136_IDN TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG TGM1101_IDN TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG BL1603_IDN TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG Ca_KOR TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG Ca_IND TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG Ca_CHN TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG Ca_THA TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG Ca_JPN TTTCAACCCT CAAGCACCGC TTGGTTTTGG GGCCCCACGG Cc_CHN TTTCAACCCT CAAGCTCTGC TTGGTGTTGG GGCTCTACGG Clustal Co ********** ***** * ** ***** **** *** * ****
....|....| ....|....| ....|....| ....|....|
325 335 345 355 AGM1535_IDN CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA
BGR1602_IDN CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA BRB07_IDN CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA KMP1531_IDN CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA MN1582_IDN CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA SMG136_IDN CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA TGM1101_IDN CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA BL1603_IDN CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA Ca_KOR CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA Ca_IND CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA Ca_CHN CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA Ca_THA CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA Ca_JPN CACACGTGGG CCCTTAAAGG TAGTGGCGGA CCCTCCCGGA Cc_CHN TTGACGTAGG CCCTTAAAGG TAGTGGCGGA CCCTCTCGGA Clustal Co **** ** ********** ********** ***** ****
....|....| ....|....| ....|....| ....|....|
365 375 385 395 AGM1535_IDN GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATC
BGR1602_IDN GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATC BRB07_IDN GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATC KMP1531_IDN GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATC MN1582_IDN GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATC SMG136_IDN GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATC TGM1101_IDN GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATC BL1603_IDN GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATC Ca_KOR GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATT Ca_IND GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATT Ca_CHN GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATT Ca_THA GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATC Ca_JPN GCCTCCTTTG CGTAGTAAC- TAACGTCTCG CACTGGGATT Cc_CHN GCCTCCTTTG CGTAGTAACA TTTCGTCTCG CATTGGGATT Clustal Co ********** ********* * ******* ** ******
....|....| ....|....| ....|....| ....|....|
405 415 425 435 AGM1535_IDN CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG
Lampiran 2 (Lanjutan)
BRB07_IDN CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG KMP1531_IDN CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG MN1582_IDN CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG SMG136_IDN CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG TGM1101_ID CGGAGGGACT CTTGCCGTAA AACCCCCCAA TTTTTTACAG BL1603_IDN CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG Ca_KOR CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG Ca_IND CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG Ca_CHN CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG Ca_THA CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG Ca_JPN CGGAGGGACT CTTGCCGTAA AACCCCCAAA TTTTTTACAG Cc_CHN CGGAGGGACT CTAGCCGTAA AACCCCCAAT TTTACTAAG- Clustal Co ********** ** ******* ******* * *** **
....|....| ....|....| ....|....| ....|....|
445 455 465 475 AGM1535_IDN GTTGACCTCG GATCAGGTAG GAATACCCGC TGANCTTAAG
32
RIWAYAT HIDUP
Penulis dilahirkan di kota Pekanbaru, Riau pada tanggal 17 Juli 1990 sebagai anak kedelapan dari delapan bersaudara dari pasangan bapak Darnis L (Alm) dan Ibu Muliati. Tahun 2009, penulis lulus dari SMK YAPPI Pekanbaru dan pada tahun yang sama melanjutkan pendidikan ke Universitas Riau, Fakultas Pertanian, Jurusan Agroteknologi, lulus pada tahun 2014.
Pada tahun 2014, penulis berkesempatan melanjutkan pendidikan Magister pada Program Studi Fitopatologi Sekolah Pascasarjana Institut Pertanian Bogor (IPB) dengan sponsor Beasiswa Fresh Graduate (Kementerian Riset Teknologi dan Pendidikan Tinggi Republik Indonesia).