UJI POTENSI BAKTERI KITINOLITIK DALAM
MENGHAMBAT PERTUMBUHAN Rhizoctonia solani PENYEBAB
REBAH KECAMBAHPADA KENTANG VARIETAS GRANOLA
SKRIPSI
DEWI NOVINA S
080805070
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
UJI POTENSI BAKTERI KITINOLITIK DALAM MENGHAMBAT PERTUMBUHAN Rhizoctonia solani PENYEBAB REBAH KECAMBAHPADA
KENTANG VARIETAS GRANOLA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
DEWI NOVINA S 080805070
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : UJI POTENSI BAKTERI KITINOLITIK DALAM
MENGHAMBAT PERTUMBUHAN Rhizoctonia solani PENYEBAB REBAH KECAMBAHPADA KENTANG VARIETAS GRANOLA
Kategori : SKRIPSI
Nama : DEWI NOVINA S
Nomor Induk Mahasiswa : 080805070
Program Studi : SARJANA (S-1) BIOLOGI Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA Prof. Dr. Dwi Suryanto, M.Sc
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
UJI POTENSI BAKTERI KITINOLITIK DALAM MENGHAMBAT PERTUMBUHAN Rhizoctonia solani PENYEBAB REBAH KECAMBAHPADA
KENTANG VARIETAS GRANOLA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2013
080805070
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Allah SWT Yang Maha Pengasih Lagi Maha Penyayangatas limpahan rahmat kekuatan, kesabaran dan kemudahan sehingga penulis dapat menyelesaikan hasil penelitian yang berjudul “Uji Potensi Bakteri Kitinolitik dalam Menghambat Pertumbuhan Rhizoctonia solani Penyebab Rebah Kecambahpada Kentang Varietas Granola”yang merupakan syarat untuk melengkapi dan memenuhi syarat mencapai gelar Sarjana Sains di Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Ucapan terima kasih penulis sampaikan kepadaBapak Prof. Dr. Dwi Suryanto, M.Sc selaku dosen pembimbing I dan Ibu Dra Elimasni, M.Si selaku dosen pembimbing II yang telah memberikan bimbingan dan arahan serta waktu dan perhatiannya kepada penulis dalam menyelesaikan penelitian ini. Tak lupa juga penulis menyampaikan ucapan terima kasih kepada Bapak Kiki Nurtjahja, M.Sc dan Ibu Dra. Isnaini Nurwahyuni, M.Sc selaku dosen penguji yang telah memberikan banyak masukan demi kesempurnaan penulisan skripsi ini.
Ucapan terima kasih juga penulisucapkan kepadaIbu Dra. Nunuk Priyani, M.Scselaku Pembimbing Akademikdan Kepala Laboratorium Mikrobiologi, Ibu Dr. Nursahara Pasaribu, M.Sc, selaku Ketua Departemen Biologi FMIPA USU dan Bapak Drs. Kiki Nurtjahja, M.Sc selaku Sekretaris Departemen Biologi FMIPA USU, serta seluruh Dosen Departemen Biologi FMIPA USU, Abang Erwin, Kak Rosalina, Ibu Nurhasni Muluk selaku staf pegawai Departemen Biologi FMIPA USU. Juga kepada Balai Proteksi Tanaman Pangan dan Hortikultura Bapak Utema, Pak Norman, Pak Nofit, Kak Naiman, Bang Rasyid, Kak Elvi dan Balai Kesehatan Bapak Sinulingga dan staf yang telah mengijinkan penulis untuk melaksanakan magang dan yang lainnya yang tidak bisa penulis jabarkan satu persatu.
Ungkapan terima kasih yang tidak ternilai juga penulis ucapkan kepada kedua orang tua (Ayahanda Sempakata Sukapiring, pria yang selalu memberi keceriaan, sumber semangat dan Ibunda Violitta br Sembiring, wanita yang tangguh dan sumber inspirasi penulis) yang selalu memberi perhatian dan pengorbanan yang luar biasa serta dukungan baik dari segi moril maupun materil yang tidak ternilai mulai dari kecil hingga penulis bisa menyelesaikan skripsi ini. Semoga penulis bisa menjadi anak yang membanggakan dan menjadi yang ayah-ibu impikan selama ini. Dan juga tak lupa penulis ucapkan terima kasih banyak kepada bibi Sri Ulina dan keluarga yang tak pernah lelah memberi waktu, dukungan yang tidak dapat penulis ungkapkan satu persatu dan penyelamat dalam menyelesaikan skripsi penulis ini. Terima kasih kepada saudara-saudaraku Bang Edi, Firman, dan Rima juga adik-adik sepupuku Aldo, Alda, Nadia, Rehma, Adit yang telah memberi kebahagiaan dan seluruh keluarga yang telah memberikan doa, perhatian, dukungan, cinta dan kasih sayangnya kepada penulis.
terlupakan selama ini. Sahabat sejatiku yang selalu ada Sarifah, Norita, Arni, Dwi yang memberi kebahagiaan dan perjalanan yang tidak terlupakan bagi penulis. Dan teman-temanku angkatan 2008, Ira, Sirma, Dessy, Sari, Frans, Jekmal, Albert, Nina, Nanin,Yuni, Yanti,Rildah, Umi, Santi, Riana, Ahri, Zulfi, Maya, Netti, Dame, Inur, Sister, Destri, Mela, Sari, Yanti, Rani, Hana, Rosima, Rohana,Ika, Asmi, Pesta, Indri, Miduk, Sarah, Ina, Agnes, Oppy, Rini, Intan, Pinta, Eka, Juhardi, Surya, Gilang, Igun, Tombak dan Jhon terima kasih telah mengisi hari-hari penulis dengan kebersamaan. Teman-teman Bengkel Fotografi Sains dan seluruh BFS’Crew (Bang Ayul, Bang Edy, Bang Juned, Bang Zulfan, Kak Dwi, Kak Putri, Kak Laura, Kak Irma, Kak Meika, Kak Resti, Bang Affan, Bang Ncay, Rahmi, Afni, Novi, Wulan, Lisa, Nuri, Nisa, Bobby), terima kasih karena telah memberikan pengalaman, kebersamaan dan wadah bagi penulis untuk berkreativitas. Dan kakak dan abang asuh angkatan 2006, adik-adik angkatan 2009, adik-adik asuh angkatan 2010 dan juga asisten-asisten Mikrobiologi.
Akhirnya dengan penuh ketulusan dan kerendahan hati, penulis menyadari bahwa Penelitian ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun dari semua pihak demi kesempurnaan Penelitian ini. Akhir kata semoga skripsi ini bermanfaat bagi kita semua.
Medan, Januari 2013
UJI POTENSI BAKTERI KITINOLITIK DALAM MENGHAMBAT PERTUMBUHAN Rhizoctonia solaniPENYEBAB REBAH KECAMBAH PADA
TANAMAN KENTANG VARIETAS GRANOLA
ABSTRAK
Penelitian tentang uji potensi bakteri kitinolitik dalam menghambat pertumbuhan
Rhizoctonia solani penyebab rebah kecambah pada tanaman kentang telah dilakukan di Laboratorium Pengamatan Hama dan Penyakit, Medan Johor, UPT Balai Proteksi Tanaman Pangan dan Hortikultura 1, Medan dan Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, Medan. Dua dari enam isolat bakteri yang telah diujikan memiliki potensi paling efektif dalam menghambat pertumbuhan R. solani. Isolat bakteri yang paling efektif menghambat pertumbuhan R. solani adalah Enterobacter
sp. BK15 dan Bacillus sp. BK13dengan zona hambat berturut-turut yaitu 2,05 cm dan 2,35 cm. Dua isolat ini menunjukkan pengurangan serangan jamur secara berturut-turut yaitu 31,25% dan 37,5%.
ASSAY OF POTENTIAL OF CHITINOLYTIC BACTERIALISOLATES TO INHIBIT GROWTH OF Rhizoctonia solaniCAUSAL AGENT OF DAMPING
OFF POTATO PLANTS VARIETY GRANOLA
ABSTRACT
A study on assay of potential of chitinolytic bacterial isolates to inhibit the growth of
Rhizoctonia solanicausal agent of damping-off on potato plants has been conducted in Laboratory of Observation Pest and Disease, Medan Johor, UPT. Protection of Crops and Holticulture 1 and Laboratory of Microbiology, Department of Biology, Faculty of Mathematic and Natural Science ofSumatera Utara University, Medan. Two out of six isolatesof chitinolytic bacteria showed to inhibitof R. solanigrowth. The most effective isolates to inhibit the growth of R. solani was Enterobacter sp. BK15 and
Bacillus sp. BK13 inhibited the fungal growth with inhibition zone of 2.05 and 2.35 cm, respectively. These two isolates also showed to be able to reduce fungal infection by 31.25% and 37.5%,respectively.
DAFTAR ISI
2.1 Produksi Kentang dan Masalahnya 4
2.2 Jamur Rhizoctonia solani 5
2.3 Pengendalian Hayati 6
2.4 Kitin dan Bakteri Kitinolitik 7
BAB 3 BAHAN DAN METODE 9
3.1 Waktu dan Tempat 9
3.2 Alat dan Bahan 9
3.3 Isolasi R. solani 10
3.4 Uji Antagonisme Isolat Bakteri Kitinolitik Terhadap R.solani 10
3.5 Pengamatan Struktur Hifa Abnormal 11
3.6 Potensi Serangan R. solani pada Bibit Kentang 12
3.7 Penghambatan Serangan R.solani pada Bibit Kentang 12
BAB 4 HASIL DAN PEMBAHASAN 14
4.1 Isolasi R. solani 14
4.2 Uji Antagonisme Isolat Bakteri Kitinolitik Terhadap R.solani 15
4.3 Pengamatan Struktur Hifa Abnormal 17
4.4 Potensi Serangan R. solani pada Bibit Kentang 18
4.5 Penghambatan Serangan R.solani pada Bibit Kentang 19
BAB 5 KESIMPULAN DAN SARAN 23
5.1 Kesimpulan 23
DAFTAR PUSTAKA 24
DAFTAR GAMBAR
DAFTAR TABEL
Halama n
Gambar 2.2.1. Umbi Kentang yang Terinfeksi Penyakit Rhizoctonia, Tanaman Kentang Terserang Phytophthora infestan, Tanaman
Kentang Terserang R. solani 6 Gambar 3.4.1. Metode Pengukuran Zona Hambat Bakteri Kitinolitik
Terhadap Koloni Jamur 11
Gambar 4.1.1. Hasil Isolasi 14
Gambar 4.2.1. Hasil Uji Antagonis antara R. solani dengan Bakteri Kitinolitik 15 Gambar 4.3.1. Morfologi Hifa Hasil Uji Antagonis antara R. solani dan Bakteri
Kitinolitik 17
Gambar 4.4.1. Potensi Serangan R. solani Terhadap Kecambah Kentang 18 Gambar 4.5.1. Perbedaan Kecambah Kentang Umur Empat Minggu 19 Gambar 4.5.2. Persentase Tanaman Terserang yang Diinokulasi R. solani
dengan Perlakuan Bakteri Kitinolitik 20 Gambar 4.5.3. Perbedaan Tinggi Kecambah yang Diinokulasi R. solani
dengan Perlakuan Bakteri Kitinolitik 21 Gambar 4.5.4. Perbedaan Jumlah Daun Kecambah yang Diinokulasi R.
Halaman
Tabel 1 Uji Antagonisme Antara Bakteri Kitinolitik Dengan
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Komposisi media MGMK, Penyiapan Media Tanam
28
UJI POTENSI BAKTERI KITINOLITIK DALAM MENGHAMBAT PERTUMBUHAN Rhizoctonia solaniPENYEBAB REBAH KECAMBAH PADA
TANAMAN KENTANG VARIETAS GRANOLA
ABSTRAK
Penelitian tentang uji potensi bakteri kitinolitik dalam menghambat pertumbuhan
Rhizoctonia solani penyebab rebah kecambah pada tanaman kentang telah dilakukan di Laboratorium Pengamatan Hama dan Penyakit, Medan Johor, UPT Balai Proteksi Tanaman Pangan dan Hortikultura 1, Medan dan Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, Medan. Dua dari enam isolat bakteri yang telah diujikan memiliki potensi paling efektif dalam menghambat pertumbuhan R. solani. Isolat bakteri yang paling efektif menghambat pertumbuhan R. solani adalah Enterobacter
sp. BK15 dan Bacillus sp. BK13dengan zona hambat berturut-turut yaitu 2,05 cm dan 2,35 cm. Dua isolat ini menunjukkan pengurangan serangan jamur secara berturut-turut yaitu 31,25% dan 37,5%.
ASSAY OF POTENTIAL OF CHITINOLYTIC BACTERIALISOLATES TO INHIBIT GROWTH OF Rhizoctonia solaniCAUSAL AGENT OF DAMPING
OFF POTATO PLANTS VARIETY GRANOLA
ABSTRACT
A study on assay of potential of chitinolytic bacterial isolates to inhibit the growth of
Rhizoctonia solanicausal agent of damping-off on potato plants has been conducted in Laboratory of Observation Pest and Disease, Medan Johor, UPT. Protection of Crops and Holticulture 1 and Laboratory of Microbiology, Department of Biology, Faculty of Mathematic and Natural Science ofSumatera Utara University, Medan. Two out of six isolatesof chitinolytic bacteria showed to inhibitof R. solanigrowth. The most effective isolates to inhibit the growth of R. solani was Enterobacter sp. BK15 and
Bacillus sp. BK13 inhibited the fungal growth with inhibition zone of 2.05 and 2.35 cm, respectively. These two isolates also showed to be able to reduce fungal infection by 31.25% and 37.5%,respectively.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Kentang termasuk jenis tanaman pangan penting di Indonesia, nilai ekonomi
komoditas ini tergolong tinggi. Meskipun kentang bukan bahan makanan pokok bagi
rakyat Indonesia, tetapi konsumsinya cenderung meningkat dari tahun ke tahun karena
jumlah penduduk makin bertambah, taraf hidup masyarakat yang meningkat dan
meningkatnya wisatawan asing yang tinggal di Indonesia (Soelarso, 1997).
Berdasarkan data FAO produktivitas kentang di Indonesia masih tergolong
rendah dibandingkan dengan produktivitas kentang di negara-negara maju seperti di
negara-negara Eropa Barat dan Amerika Utara yang mencapai angka > 30 ton/ha
(Lutaladio et al., 2009). Menurut Badan Pusat Statistik produksi kentang di Indonesia
pada tahun 2009 sebesar 16,51 ton/ha dan tahun 2010 sebesar 15,94 ton/ha Faktor
rendahnya produktivitas kentang di Indonesia adalah rendahnya mutu benih yang
digunakan, penyimpanan yang kurang baik, iklim, pemodalan, pengetahuan petani
yang terbatas dan serangan organisme penggangu tanaman terutama penyakit.
Serangan hama dan penyakit pada tanaman kentang merupakan salah satu
faktor penting sebagai pembatas produksi kentang. Penyakit pada tanaman kentang
dapat disebabkan oleh bakteri, jamur, virus, dan hama. Dari keempat kelompok
tersebut, jamur menduduki tempat teratas. Jamur yang biasa menyerang tanaman
kentang adalah Alternaria solani penyebab penyakit bercak daun,Fusarium spp.
penyebab penyakit layu,Phytophthora infestan dan Rhizoctonia solani penyebab rebah
kecambah pada tanaman kentang (Soelarso, 1997). Jamur R. solani mempunyai daya
adaptasi yang tinggi, memiliki banyak strain dan mampu bertahan hidup lama di
tidak hanya terbatas pada inang tertentu, menjadikan R.solani sebagai patogen yang
penting secara ekonomi, serta sulit dikendalikan di lapangan (Achmad et al., 1999).
Selama ini pengendalian penyakit yang disebabkan oleh R. solani adalah pengendalian
secara kimiawi dengan menggunakan berbagai jenis pestisida.
Pengendalian secara kimiawi dilakukan karena praktis dalam aplikasinya.
Meskipun demikian, diketahui bahwa residu yang ditinggalkan dapat mencemari
lingkungan dan berbahaya bagi kesehatan manusia. Selain itu pestisida dapat pula
menyebabkan timbulnya strain hama dan penyakit tumbuhan yang resisten terhadap
bahan beracun ini. Pertanian modern menggali berbagai potensi alam terutama
terhadap mikroba yang berperan sebagai pengendali hayati guna meningkatkan hasil
pertanian (Herdiana, 2007).
Sampai saat ini telah banyak agensia pengendali hayati yang berhasil
ditemukan dan menunjukkan mekanisme penghambatan atau pengendalian terhadap
patogen tanaman. Bahkan tidak sedikit agensia pengendali hayati yang dapat
mengendalikan penyakit tanaman dan mempengaruhi pertumbuhan tanaman. Agensia
pengendali hayati dari kelompok jamur dan bakteri. Dari kelompok jamur seperti
Trichoderma harzianum, T. viridae, Gliocladium, Ulocladium atrum dan lain-lain.
Dari kelompok bakteri yaitu Bacillus subtilis, Pseudomonas fluorescens, dan lain-lain
(Soesanto, 2008).
Telah banyak penelitian yang dilakukan tentang mikroorganisme kitinolitik
sebagai agen pengendali hayati diantaranya adalah 5 dari 23 isolat bakteri kitinolitik
lokal asal Sumatera Utara sangat berpotensi dalam menghambat pertumbuhan
beberapa jamur patogen tanaman (Suryanto & Munir 2006), Bacillus spp. dan
Pseudomonas fluorescens bersifat antagonistik terhadap patogen R. solani (Giyanto et
al., 2009). Berdasarkan pemaparan di atas, pencarian bakteri penghasil enzim kitinase
dengan kemampuan yang lebih baik terus dilakukan. Salah satunya adalah dengan
upaya penelitian dan pengujian bakteri kitinolitik dalam mengendalikan penyakit
1.2Permasalahan
Petani masih menggunakan pestisida dalam mengendalikan penyakit rebah
kecambah R. solani pada tanaman kentang. Namun, seperti yang diketahui pestisida
mencemari lingkungan dan membahayakan kesehatan petani itu sendiri. Untuk
menggali berbagai potensi alam terutama terhadap bakteri guna meningkatkan hasil
pertanian perlu dilakukan penelitian untuk mengurangi penggunaan pestisida tersebut.
Oleh karena itu perlu dilakukan penelitian tentang uji potensi bakteri kitinolitik
sebagai pengendali hayati penyakit rebah kecambah R. solani.
1.3Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui potensi isolat bakteri kitinolitik
yang paling efektif menghambat pertumbuhan R. solani penyebab penyakit rebah
kecambah pada tanaman kentang.
1.4Hipotesis
1. Isolat bakteri kitinolitik mampu menghambat pertumbuhan R. solani penyebab
rebah kecambah pada kentang.
2. Adanya perbedaan kemampuan menghambat tiap-tiap isolat bakteri kitinolitik
terhadap pertumbuhan R. solani penyebab rebah kecambah pada kentang.
1.5 Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah untuk mengetahui potensi bakteri
kitinolitik mempengaruhi dan menghambat pertumbuhan jamur patogen R. solani
penyebabkan rebah kecambah tanaman kentang. Selain itu penelitian ini dapat
digunakan sebagai sumber informasi bagi masyarakat umum,instansiyang
BAB 2
TINJAUAN PUSTAKA
2.1 Produksi Kentang dan Masalahnya
Kentang (Solanum tuberosum) sudah dikenal di Indonesia (Pengalengan, Lembang
dan Karo) sejak sebelum perang dunia ke-2. Kentang tergolong ke dalam kingdom
Plantae, divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotiledoneae, ordo
Tubiflorae, famili Solanaceae, genus Solanum, spesies S. tuberosum. Kentang
merupakan bahan pangan yang sudah populer di dunia dan semakin meningkat
permintaannya di Indonesia, karena meningkatnya kebutuhan akan konsumsi
kentangsebagai salah satu makanan pengganti beras maupun bahan baku industri
makanan. Kentang termasuk jenis tanaman hortikultura semusim karena hanya satu
kali beproduksi. Umbi kentang mengandung karbohidrat, vitamin dan mineral yang
cukup tinggi. Komposisi utama umbi kentang adalah protein, air dan karbohidrat,
selain itu juga mengandung kalsium, fosfor, natrium, kalium, zat besi, vitamin Cdan
vitamin B (Hartus, 2001).
Selama ini produksi dan produktivitas kentang Indonesia masih tergolong
rendah. Berdasarkan data Badan Pusat Statistik produktivitas kentang pada tahun 2010
di Sumatera Utara sebesar 16.17 ton/ha dan masih tergolong rendah dibandingkan
dengan Sumatera Barat sebesar 17.35 ton/ha, Sumatera Selatan sebesar 17.82 ton/ha,
Bali sebesar 18.86 ton/ha dan Jawa Barat sebesar 20.89 ton/ha. Serangan hama dan
penyakit pada tanaman kentang merupakan salah satu faktor penting sebagai pembatas
produksi kentang.
Pada tanaman kentang, penyakit umumnya lebih berbahaya dibandingkan
hama. Ini karena kerusakan dan kerugian yang diakibatkan oleh serangan penyakit
musim hujan. Sebaliknya, pada musim kemarau serangan hama meningkat, terutama
dari golongan serangga. Serangan penyakit meningkat pada kondisi suhu udara yang
ekstrim dan iklim yang tidak menentu seperti sekarang ini (Hartus, 2001).
2.2Jamur Rhizoctonia solani
Jamur R. solani merupakan fase anamorf (aseksual) dari jamur Thanatephorus
cucumeris (Ceratobasidiaceae, Ceratobasidiales, Basidiomycetes) yang merupakan
fase telemorfnya (seksual). Memiliki ciri-ciri: koloni jamur tidak berwarna (hialin),
putih, hingga coklat kehitaman, panjang hifa 8-12 μm, memiliki septa. Hifa biasanya
membentuk percabang dengan sudut 90°. Kumpulan hifa membentuk struktur lebih
besar membentuk sklerotia yang mengumpul terpusat pada satu titik, menyebar dan
ada yang tidak membentuk sklerotia, yang tetap infektif sampai lebih dari 21 bulan di
tanah kering. Pembentukan sklerotia dirangsang oleh faktor peningkatan suhu atau
akibat dari banjir. Jamur patogen ini memilikikisaran inang luas yaitu hampir pada
semua kelompokkomoditas tanaman.Serangan jamur ini menyebabkan kerugian besar
(Agrios, 2004; Garcia et al., 2006)
Faktor lingkungan yang berpengaruh terhadap perkembangan dan
pertumbuhan jamur R. solani, diantaranya adalah suhu dan cahaya. Suhu tanah
merupakan faktor penting penyebab penyakit Rhizoctonia pada kentang. Kisaran suhu
optimal untuk pertumbuhan R.solani adalah 6,6-25°C. Suhu dingin, kelembaban tanah
yang tinggi dan pH tanah yang asam dianggap mendukung perkembangan penyakit
Rhizoctonia. Kerusakan paling parah terjadi pada suhu dingin karena tingkat
penurunan perkecambahan dan pertumbuhan batang dan stolons relatif lambat dan
pertumbuhan jamur meningkat. Namun, suhu yang tinggi, terutama selama tahap awal
pengembangan tanaman cenderung meminimalkan dampak dari R.solani, bahkan
ketika inokulum berlimpah. Tanda yang paling mencolok dari penyakit Rhizoctonia
adalah jamur ini akan membentuk massa berwarna coklat kehitaman di permukaan
umbi kentang (Gambar 2.2.1. a), disebut sklerotia yang merupakan bentuk istirahat
Penyakit lain yang menyerang tanaman kentang adalah Phytophthora infestan
yang sama-sama bisa menyebabkan rebah kecambah. R. solani yang termasuk kelas
Deuteromycetes sering disebut penyebab penyakit black scurf (Gambar 2.2.1. a & c)
sedangkan Phytophthora disebut late blight (Gambar 2.2.1. b), menginfeksi dengan
zoospora dengan simptom pertama kali terlihat sebagai noda basah yang pada
umumnya di tepi pangkal batang. Pada musim hujan noda akan membesar menjadi
coklat dan busuk. Pada umbi pertama terlihat sebagai noda berwarna ungu hingga
coklat dengan diameter 5-15 mm hingga ke dalam umbi (Agrios, 2004). Jamur ini
susah untuk diisolasi karena merupakan jamur fakultatif obligat, tidak bisa tumbuh di
PDA dan hanya bisa tumbuh pada media khusus.
Gambar 2.2.1 (a) Umbi kentang yang terinfeksi penyakit Rhizoctonia, (Sumber: Wharton et al., 2007). Tanaman kentang terserang (b) P. infestan, (c) terserang R. solani. (Sumber: Agrios, 2004).
2.3 Pengendalian hayati
Rhizoctonia solani merupakan patogen tular tanah yang menyebabkan rebah
kecambah pada tanaman.Selama ini pengendalian penyakit tanaman ini dilakukan
secara kimiawi. Akan tetapi, penggunaan pestisida kimia yang berlebihan dan dalam
jangka waktu yang lama dapat berdampak negatif pada kesehatan manusia dan
pencemaran lingkungan karena residu yang ditinggalkan dapat menimbulkan
resistensi patogen. Oleh karena itu diperlukan upaya alternatif untuk mengendalikan
mikroba patogen penyebab penyakit tanaman, misalnya dengan memanfaatkan agen
pengendali hayati yang lebih ramah lingkungan (Papuanga, 2009).
c b
Pengendalian hayati adalah pemanfaatan mikroba seperti jamur dan bakteri
untuk mengendalikan penyakit tanaman. Pengendalian hayati jamur penyakit tanaman
sering dilakukan dengan menggunakan mikroorganisme seperti jamur dan bakteri.
Salah satu pemanfaatan mikroorganisme sebagai pengendali hayati adalah bakteri
kitinolitik. Banyak penelitian yang menunjukkan ada kemampuan bakteri kitinolitik
sebagai agen pengendali hayati. Penggunaan agen pengendali hayati semakin
berkembang karena agen pengendali hayati mempunyai keunggulan dalam menjaga
keseimbangan ekosistem lingkungan pertanian (Suryanto & Munir, 2006).
Bakteri kitinolitik digunakan sebagai agen pengendali hayati karena
kemampuannya menghidrolisis kitin menjadi derivat kitin dan dapat mendegradasi
kitin yang merupakan salah satu komponen dinding sel jamur. Kerusakan dinding sel
jamur mengakibatkan gangguan terhadap pertumbuhan jamur. Agen pengendali hayati
dari bakteri yang sudah diketahui adalah Aeromonas,Chromobacterium,Pseudomonas,
Serratia, Vibrio (Chernin et al., 1998),Achromobacter
(Donderski&Swiontek-Brzezińska, 2001),Bacillus (Chienet al., 2004)Agrobacterium radiobacter (Soesanto, 2008) danEnterobacter (Mahata et al., 2008)
2.4 Kitin dan Bakteri Kitinolitik
Kitin merupakan homopolimer dari (1,4)-β-N-asetil-D-glukosamin. Kitin merupakan
salah satu senyawa yang paling melimpah di alam. Distribusi kitin sangat luas karena
merupakan komponen struktural berbagai jenis organisme. Kitin dapat dijumpai pada
prokariot, protista, dan sangat melimpah pada jamur. Seperti pada kulit kepiting dan
udang mengandung kitin sekitar 40-60% sedangkan pada dinding sel jamur 22-44%.
Degradasi kitin ini terutama dilakukan oleh mikroorganisme, karena kitin penting
untuk pertumbuhan mikroorganisme sebagai sumber karbon dan nitrogen. Sehingga,
proses daur ulang merupakan hal yang sangat penting (Gooday,1990).
Kitinase adalah enzim yang mendegradasi kitin menjadi N-asetilglukosamin,
degradasi kitin dapat dilakukan oleh organisme kitinolitik dengan melibatkan enzim
menghasilkan kitinase sebagai proteksi terhadap serangan hama dan penyakit, pada
serangga berperan dalam proses morfogenesis dan bakteri mengeluarkan kitinase
untuk menguraikan kitin menjadi karbon dan nitrogen. Kitinase ini dapat dihasilkan
oleh bakteri dan jamur yang diperoleh dari berbagai sumber dengan cara
menumbuhkannya di media yang mengandung koloidal kitin. Mikroba diisolasi
dengan menggunakan medium garam koloidal kitin disesuaikan dengan kondisi
lingkungan darimana isolat berasal. Pembentukan zona bening disekitar koloni adalah
hasil degradasi kitin (Suryanto & Munir, 2006).
Enzim kitinase yang dihasilkan oleh mikroorganisme kitinolitik memiliki
banyak kegunaan. Enzim kitinase memungkinkan konversi kitin menjadi produk yang
berguna dalam industri pangan, kosmetik, farmasi, dan lain-lain. (Pujiyanto &
Wijanarka, 2004). Kitinase dan kitin deasetilase adalah enzim yang aktif
mendegradasi kitin. Kitinase dapat menghidrolisis kitin secara acak pada ikatan
glikosidiknya, sedangkan kitin deasetilase menghidrolisis kitin menjadi produk yang
mempunyai daya guna yang lebih tinggi seperti kitosan (Nasran et al., 2003).
Aktivitas kitinase dari bakteri kitinolitik sangat potensial digunakan sebagai
agen pengendalian hayati terhadap jamur patogen maupun hama serangga, karena
kedua organisme ini mempunyai komponen kitin pada dinding selnya. Beberapa
laporan menyatakan bahwa aktivitas kitinase dari Enterobacter agglomerans dapat
mengendalikan Phytophthora penyebabdamping off dan busuk akar pada tanaman
kedelai(Chernin et al., 1995).Bacillus sp. dan Bacillus apiaries bersifat antagonis
terhadap pertumbuhan jamur akar putih (Rigidoporus lignosus) (Muharni &
Widjajanti, 2011). Bakteri kitinolitik juga mampu menghambat pertumbuhan
Phytopthora infestan dan Alternaria solani (Purwantisari et al., 2005), Pseudomonas
fluorescensmampu menghambat pertumbuhan R. solani (Bautista et al., 2007), dan
dua isolat bakteri kitinolitik yaitu DS01 dan LKO1 mampu menghambat pertumbuhan
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Januari 2012 sampai dengan September
2012 bertempat di Laboratorium Pengamatan Hama dan Penyakit, Medan Johor, UPT
Balai Proteksi Tanaman Pangan dan Hortikultura 1, Medan dan Laboratorium
Mikrobiologi, Departemen Biologi, FMIPA, Universitas Sumatera Utara Medan.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah: cawan Petri, tabung reaksi, rak
tabung reaksi, Beaker glass, gelas ukur, pipet serologi, karet penghisap, spatula, jarum
ose, autoklaf, oven, mikroskop, jangka sorong, nampan berukuran 38 x 30 x 11 cm,
Bunsen, Erlenmeyer, inkubator, sprayer, hot plate, vortex, cork borer,timbangan,
pipet tetes,gelas objektif, gelas penutup, pinset, meteran kain, gunting, magnetic
stirrer, dan botol selai.
Bahan-bahan yang digunakan dalam penelitian ini antara lain: 6 isolat bakteri
kitinase (Enterobacter sp. KR05,E. cloacae LK08,Enterobacter sp. PB17,Bacillussp.
BK13,Enterobactersp. BK15, dan Bacillus sp. BK17) (gambar dapat dilihat pada
lampiran 2 hlm.29) dari koleksi Laboratorium Mikrobiologi, DepartemenBiologi,
Universitas Sumatera Utara, media potato dextrose agar (PDA), yeast extract
2%,blank disc (Oxoid) dan ketokonazol, kloramfenikol, kertas saring, spiritus,
medium garam minimum kitin (MGMK) (komposisi media dapat dilihat pada
lampiran 1 hlm.28) dengan pH 6,8, media glucose yeast broth(GYB), akuades,
pasar tradisional Berastagi dan isolat jamurR. solani dari tanaman perkebunan kentang
di desa Naman Berastagi. Isolat ditumbuhkan dalam media PDA dan diinkubasi pada
suhu 28-30°C selanjutnya disimpan di dalam kulkas hingga saatnya digunakan.
3.3 Isolasi R. solani
Bagian tanaman yang menunjukkan gejala penyakit yang disebabkan oleh R.
solanidipotong kemudian didesinfeksi dengan larutan 2% NaClO selama 10 detik,
dicuci dengan air steril sebanyak tiga kali dan ditanam pada media PDA. Setelah
miselium tumbuh ditumbuhkan kembali pada media PDA baru untuk mendapatkan
biakan murni. Pengamatan dilakukan secara makroskopis dan mikroskopis.
3.4 Uji Antagonisme Isolat Bakteri Kitinolitik Terhadap R. solani
Suspensi bakterikitinolitik dengan konsentrasi ≈108 sel/ml (standart McFarland)
sebanyak 10 μl diinokulasikan pada cakram dengan diameter 0,6 cm, di letakkan pada
media MGMK + yeast extract 2% dengan jarak 3,5 cm dari tempat isolat jamur dan
dibuat 2 kali pengulangan lalu diinkubasi pada suhu 28-30oC selama 48 jam.
Selanjutnya isolat R. solani ditumbuhkan di tengah media (Gambar 3.4.1.). Akitivitas
penghambatan ditentukan berdasarkan zona hambat yang terbentuk disekitar koloni.
Pengamatan dimulai dari hari ke-2 sampai hari ke-7 (Suryanto et al., 2011). Dua
bakteri dengan zona hambat terbesar dilanjutkan ke uji penghambatan serangan jamur
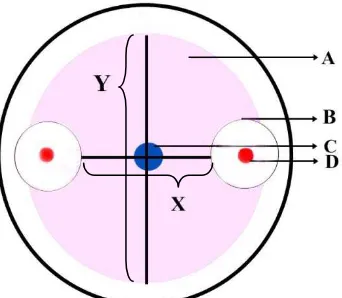
Gambar 3.4.1. Metode pengukuran zona hambat bakteri kitinolitik terhadap koloni jamur; A. koloni jamur; B. zona hambat bakteri kitinolitik terhadap koloni jamur; C. titik tengah jamur diletakkan; D. koloni bakteri kitinolitik; X. diameter koloni jamur yang terhambat pertumbuhannya; Y. diameter koloni jamur normal (Suryanto, 2001)
Pengukuran pertumbuhan jamurdilakukan dengan cara mengukur batas akhir
pertumbuhan dari jamur pada sumbu x dan batas akhir pertumbuhan jamur pada
sumbu y, dilakukan setelah terjadi penghambatan bakteri kitinase terhadap jamur
dengan rumus uji antagonis = hasil.
3.5 Pengamatan Struktur Hifa Abnormal
Pengamatan dilakukan dengan cara mengamati ujung miselium di daerah zona
hambat jamur patogen. Ujung miselium jamur yang tumbuh pada permukaan media
dipotong berbentuk block square, kemudian diletakkan pada gelas objektif dan ditutup
dengan gelas penutup dan diamati di bawah mikroskop. Selanjutnya diamati adanya
abnormalitas pertumbuhan miselium jamur patogen, yaitu pembengkokan ujung
miselium, miselium pecah, miselium kerdil, miselium bercabang, dan miselium lisis
(Lorito et al., 1993).
3.6 Potensi SeranganR. solani pada Bibit Kentang
BiakanR. solani(hifa dan sklerotial) yang telah diremajakan di cawan Petri selama 7
hari diinokulasikan pada 80 ml media GYB di dalam labu Erlenmeyer 250 ml
dandiinkubasi pada suhu 28-30oC selama 10 hari. Biakan jamur tersebut dicampur
dengan 4kg campuran tanah dan kompos steril (nisbah 3:1) (skema pembuatan dapat
dilihat pada lampiran 1 hlm.28) dalam nampan plastik berukuran 30 x 38 x 11 cm.
Dua puluhbibit kentang ditanam ke dalam nampan, bibit yang ditanamdalam nampan
yang tidak dicampur dengan suspensi R. solanidigunakan sebagai kontrol negatif (-).
Ulangan dilakukan sebanyak 4 kali. Parameter yang diamatiadalah tinggi tanaman,
jumlah daun dan tanaman yang terserang selama 30 hari (Suryanto et al., 2010).
Reisolasi dilakukan terhadap R. solani dengan memotong bagian tanaman
yang menunjukkan gejala rebah kecambah. Jaringan tersebut didesinfeksi dengan
larutan 2% NaClO selama 10 detik, dicuci dengan air steril sebanyak tigakali dan
ditanam pada media PDA (Suryanto et al., 2010). Isolat yang diperoleh dibandingkan
dengan isolat sebelum jamur digunakan dalam uji patogenitas.
3.7 Penghambatan Serangan R solani pada Bibit Kentang
Biakan R. solani sebanyak 80 ml dicampur dengan 4kg campuran tanah dan kompos
steril (nisbah 3:1) dalam nampan plastik berukuran 30 x 38 x 11 cm. Bibit
kentangsebanyak 20 ditanam ke dalam tiap nampan yang telah direndam dengan
campuran suspensi bakteri kitinolitik dengan konsentrasi ≈108 sel/ml (standart
McFarland) dan dicampur dengan satu liter akuades steril selama 30 menit. Perlakuan
bibit kentangyang ditanam ke dalam tiap nampan yang hanya direndam dengan
campuran suspensi bakteri kitinolitik untuk mengetahui pengaruh pemberian bakteri
pada tanaman kentang.
Bibit yang direndam pada akuades steril yang tidak diinokulasi bakteri
kitinolitik ditanam ke dalam nampan digunakan sebagai kontrol negatif (-). Bibit yang
sebagai kontrol (+). Ulangan dilakukan sebanyak 4 kali untuk masing-masing
perlakuan. Parameter yang diamati adalah tanaman yang terserang rebah kecambah,
tinggi tanaman dan jumlah daun selama 30 hari. Menurut Suryanto et al. (2010)
pengurangan rebah kecambah dihitung dengan rumus :
Pengurangan rebah kecambah =
Keterangan:
Kontrol (+) = dengan pemberian suspensi R. solani tanpa bakteri kitinolitik
Kontrol (-) = dengan pemberian bakteri kitinolitik tanpa suspensi R. solani
[{∑ (Kontrol(+) - ∑(Kontrol(-)} – ∑ kecambah yang rebah]
BAB 4
HASIL DAN PEMBAHASAN
4.1 Isolasi Rhizoctonia solani
Isolasi dilakukan dengan pemotongan bagian tanaman yang memiliki gejala pangkal
batang berwarna coklat (Gambar 4.1.1. a), kemudian didesinfeksi dan ditanam pada
media PDA, diperoleh R. solani(Gambar 4.1.1. b). Dari hasil isolasi diperoleh R.
solani dengan ciri-ciri hifa muda berwarna putih, hifa tua berwarna coklat hingga
kehitaman, memiliki septa pada hifa, percabangan hifa membentuk sudut 90o,
sklerotium menyebar pada koloni jamur seperti pada Gambar 4.1.1.
Gambar 4.1.1. Hasil isolasi a. tanaman kentang (1) gejala tanaman terserang R. solani, b. isolasi awal (2) R. solani c. biakan murni R. solani(umur 3 hari) d. biakan murni R. solani (umur 5 hari)e. percabangan hifa (3) membentuk sudut 90o, f. sklerotium (perbesaran 10 x 40)
Menurut Dwiatmini & Kardin (1999), koloniRhizoctonia solani berwarna
putih hingga kecokelat-cokelatan, diameter hifa antara 7,5-l0,0 µm, percabangan hifa
membentuk sudut 90o, sklerotium menyebar secara acak dan ada yang terpusat di
merupakan jamur tular tanah padatanaman pertanian dengan kisaran inang luas yaitu
hampir pada semua tanaman, yaitu padi-padian, hortikultura, tanaman perkebunan,
dan lain-lainyang menyebabkan kerugian besar (Agrios, 2004).
4.2Uji Antagonisme Isolat Bakteri Kitinolitik Terhadap R. solani
Hasil uji antagonisme 6 isolat bakteri kitinolitik terhadap jamur R. solani
menunjukkan bahwa 2 isolat bakteri kitinolitik yaitu Bacillus sp. BK13 dan
Enterobacter sp. BK15 paling mampu menghambat pertumbuhan R. solani dengan
kemampuan yang bervariasi. Mekanisme penghambatan yang terjadi pada uji
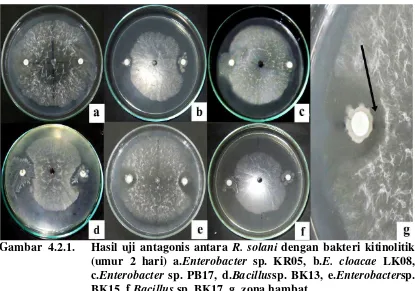
antagonisme dapat diamati dengan terbentuknya zona bening (Gambar 4.2.1.)
Gambar 4.2.1. Hasil uji antagonis antara R. solani dengan bakteri kitinolitik (umur 2 hari) a.Enterobacter sp. KR05, b.E. cloacae LK08, c.Enterobacter sp. PB17, d.Bacillussp. BK13, e.Enterobactersp. BK15, f.Bacillus sp. BK17, g. zona hambat
Zona hambat mulai terlihat pada hari pertama dan pengamatan zona hambat
hanya dapat diamati sampai hari kedua karena pada hari ketiga hifa jamur sudah
penuh pada cawan Petri sehingga tidak dapat diamati lagi zona hambat pada cawan
Petri. Menurut Garcia (2006), kecepatan pertumbuhan R. solani antara 1-100 mm/jam.
Rhizoctoniapada media PDA mempunyai pertumbuhan yang lebih cepat dari pada
mulai membentuk sklerotia (Siregar, 2003). Zona hambat dapat dilihat pada Tabel 1 di
bawah ini:
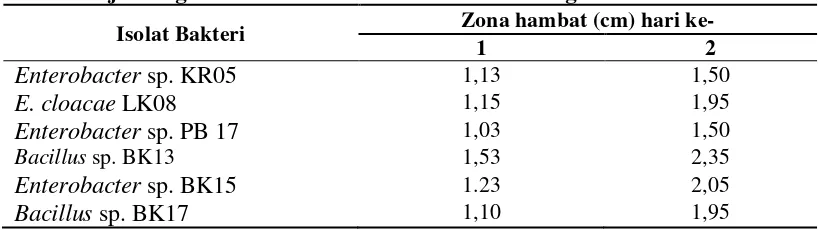
Tabel 1. Uji antagonisme antara bakteri kitinolitik dengan R. solani
Isolat Bakteri Zona hambat (cm) hari ke-
1 2
Dari hasil uji antagonis pada pengamatan hari kedua dari keenam isolat bakteri
kitinolitik tersebut, isolat yang menunjukkan zona hambat paling tinggi dalam
menghambat pertumbuhan R. solani adalah isolat Bacillus sp. BK13 dengan zona
hambat terbesar yaitu 2,35 cm dan Enterobacter sp. BK15 yaitu 2,05 cm. Kedua
bakteri kitinolitik ini yang selanjutnya digunakan untuk uji penghambatan serangan R.
solani pada bibit kentang. Hasil uji antagonis antara bakteri kitinolitik dengan R.
solani menunjukkan kemampuan bakteri dalam menghambat pertumbuhan miselium
jamur berbeda-beda, ditandai dengan terbentuknya zona hambat yang dihasilkan oleh
bakteri kitinolitik.
Adanya kitin pada media menyebabkan produksi kitinase kedua isolat tersebut
terpacu untuk mendegradasi dinding sel jamur. Jika kitin yang ada di media MGMK
sudah terurai maka bakteri kitinase akan menguraikan kitin yang ada pada dinding sel
jamur. Menurut Chernin et al. (1995), aktivitas kitinolitik terjadi ketika bakteri dapat
hidup pada media yang mengandung kitin yang digunakan sebagai sumber karbon dan
mendegradasi kitin menjadi N-asetilglukosamin. Besar zona hambat yang terbentuk
tergantung banyaknya kandungan kitin pada media dan dinding sel jamur
(Rajarathanam et al., 1998).
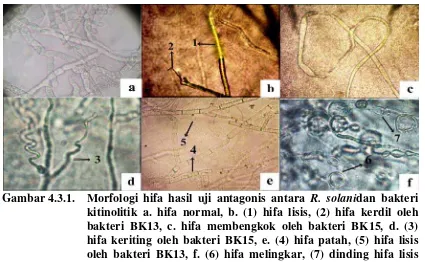
Pengamatan mikroskopis untuk melihat hifa abnormal R. solani dilakukan pada hari
ke-2. Mekanisme antagonis yang terjadi antara bakteri kitinolitik dengan jamur R.
solaniditandai dengan adanyapenghambat pertumbuhan miselium dan penipisan
dinding hifaR. solani. Akibat aktivitas antagonis bakteri kitinolitik yang menyebabkan
hifa R. solanimengalami pertumbuhan yang abnormal yaitu hifa mengalami
pembengkokan, hifa menggulung, hifa kerdil, dinding sel lisis, hifa patah, hifa
keriting, dan hifa mengecil seperti Gambar 4.3.1.
Gambar 4.3.1. Morfologi hifa hasil uji antagonis antara R. solanidan bakteri kitinolitik a. hifa normal, b. (1) hifa lisis, (2) hifa kerdil oleh bakteri BK13, c. hifa membengkok oleh bakteri BK15, d. (3) hifa keriting oleh bakteri BK15, e. (4) hifa patah, (5) hifa lisis oleh bakteri BK13, f. (6) hifa melingkar, (7) dinding hifa lisis oleh bakteri BK13 (perbesaran 10 x 40)
Dari Gambar 4.3.1. dapat dilihat perubahan hifa R. solani akibat berinteraksi
dengan isolat bakteri kitinolitik. Adanya aktivitas antagonisme dari isolat bakteri
kitinolitik terhadap R. solani yang menyebabkan hifa mengalami lisis, pembengkokan,
dan menggulung. Hifa lisis, hifa patah dan hifa kerdil menunjukkan bahwa isolat
bakteri kitinolitik mampu menghidrolisis dinding sel jamur. Hifa jamur yang
mengalami pembengkokan, melingkar dan keriting diduga sebagai bentuk pertahanan
jamur terhadap serangan bakteri kitinolitik.
Gohel et al. (2006) menyatakan bahwa bakteri kitinolitik memiliki beberapa
cara untuk menekan pertumbuhan jamur patogen salah satunya adalah bakteri
hifa menyebabkan dinding sel jamur menjadi terganggu. Menurut Giyanto (2009),
adanya gangguan pada pertumbuhan jamur akibat rusaknya kitin yang termasuk salah
satu komponen penyusun dinding sel jamur.
4.4 Potensi Serangan R. solani pada Tanaman Kentang
Dari hasil uji patogenitas R. solani terhadap bibit kentang diperoleh persentase jumlah
kecambah yang rebah mencapai 80%, menunjukkan bahwa isolat R. solani (Gambar
4.4.1. a) bersifat patogen pada tanaman kentang yang menyebabkan rebah kecambah
(Gambar 4.4.1. b). Menurut Rich (1983), Rhizoctonia merupakan salah satu penyakit
yang paling serius dari kentang dan tanaman lainnya karena dapat mengurangi hasil,
kualitas, ukuran, penampilan dan harga kentang.Gejala-gejala penyakit ini, berwarna
coklat pada pangkal batang yang bersentuhan langsung dengan tanah sehingga
tanaman rebah (Wharton et al., 2007).
Gambar 4.4.1. Potensi serangan R. solani terhadap kecambah kentang a. isolat R. solaniumur 3 hari, b. kecambah kentang yang rebah, c. reisolasi, d. biakan murni hasil reisolasi umur 2 hari
Hasil reisolasi R. solani (Gambar 4.4.1 c) dengan prosedur Postulat Koch
digunakan untuk membuktikan bahwa suatu penyakit pada tanaman disebabkan oleh
mikroba (Pelczar & Chan, 2005). Reisolasi dilakukan dengan memotong jaringan
kecambah yang rebah, melalui pengamatan makroskopis dan mikroskopis. Jamur hasil
reisolasi menunjukkan ciri-ciri yang sama dengan R. solani (Gambar 4.4.1. c & d).
Menurut Blazier & Conway (2004), karakteristik terpenting dari spesies R.solani
adalah tidak memiliki konidia, clamp connections, memiliki sklerotia berwarna coklat
gelap dengan ukuran <1 mm, miselium berwarna coklat, percabangan hifa membentuk
sudut 90o, memiliki septa dan suhu optimum pertumbuhan adalah 20 – 30o
4.5 Penghambatan Serangan R. solani pada Bibit Kentang
Hasil dari setiap perlakuan pada bibit kentang dengan metode bibit direndam dengan
suspensi bakteri kitinolitik dan biakan R. solani dicampur dengan tanah (Gambar
4.5.1.). Pengamatan dilakukan dari minggu ke-0 sampai minggu ke-4, parameter
pengamatan berupa persentase rebah kecambah, tinggi kecambah, dan jumlah daun.
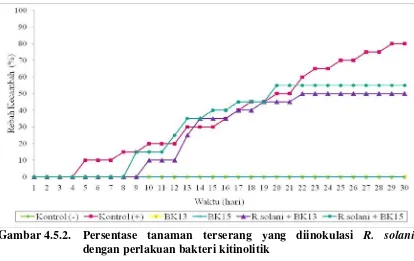
Gambar 4.5.1. Perbedaan kecambah kentang umur 4 minggu a. kontrol (-), b. kontrol (+), c.Bacillus sp. BK13, d. Enterobacter sp. BK15, e.Bacillus sp. BK13 + R. solani, f.Enterobacter sp. BK15 + R. solani
Persentase tanaman terserang mengalami penurunan pada perlakuan bakteri +
R. solani. Persentase tertinggi jumlah kecambah yang rebah yaitu pada kontrol (+)
mencapai 80% dari total kecambah yang tumbuh (Gambar 4.5.1. b), sedangkan pada
perlakuan Enterobacter sp. BK15 + R. solani yaitu 31,25% danBacillus sp. BK13 R.
solani yaitu 37,5% (Gambar 4.5.1. e & f). Ini menunjukkan bahwa bakteri kitinolitik
sebagai mikroorganisme antagonis mampu menghambat pertumbuhan R. solani.
Bibit mulai terserang setelah memasuki hari ke-4 pada kontrol (+) dan pada
perlakuan bakteri + Jamur pada hari ke-8 dan terus meningkat sampai hari ke-30.
Persentase jumlah kecambah yang rebah pada perlakuan BK13 sebesar 50% dan
BK15 sebesar 55%, dan penurunan tertinggi kecambah yang rebah pada perlakuan
bakteri dicapai oleh Bacillus sp. BK13 yaitu 37,5% dan Enterobacter sp. BK15 yaitu
31,25% (Gambar 4.5.2.). Enterobacter agglomerans dapat mengurangi penyakit yang
1995). Sepuluh isolat Bacillus spp.bersifat antagonistik terhadap R. solanidengan daya
hambat sebesar 20% - 36% (Giyanto et al., 2009)dan Enterobacter sp. BK15 dapat
mengurangi persentase tanaman terserang Fusarium oxysporum sebesar 66,66% dan
Bacillus sp. BK13 sebesar 61,11% pada benih cabai (Suryanto et al., 2012).
Gambar 4.5.2. Persentase tanaman terserang yang diinokulasi R. solani dengan perlakuan bakteri kitinolitik
Keterangan:
Kontrol (+) = dengan pemberian suspensi R. solani tanpa bakteri kitinolitik Kontrol (-) = dengan pemberian bakteri kitinolitik tanpa suspensi R. solani
Penurunan jumlah kecambah yang rebah pada perlakuan BK13 adalah yang
paling tinggi, ini menunjukkan bahwa adanya mekanisme antagonis terhadap R. solani
pada bibit kentang, bakteri menghasilkan enzim kitinase yang dapat menghambat
pertumbuhan R. solani sehingga dapat menurunkan persentase tanaman terserang.
Menurut Suryanto et al. (2012), beberapa isolat bakterikitinolitik mampu menghambat
pertumbuhanGanoderma boninense dan Fusariumoxysporum. Meskipun demikian,
kemampuan menghambat pertumbuhan jamur uji bervariasi.Hal ini menunjukkan
bahwa spesifisitas masing-masing bakteri berbeda.
Menurut Gohel et al. (2006),banyak mikroorganisme kitinolitik berpotensi
sebagai biokontrol patogen tanaman tetapi tidak sepenuhnya berhasil karena adanya
kitinolitik memiliki peran penting dalam menghambat jamur patogen dengan
menyerang dinding sel jamur secara langsung.
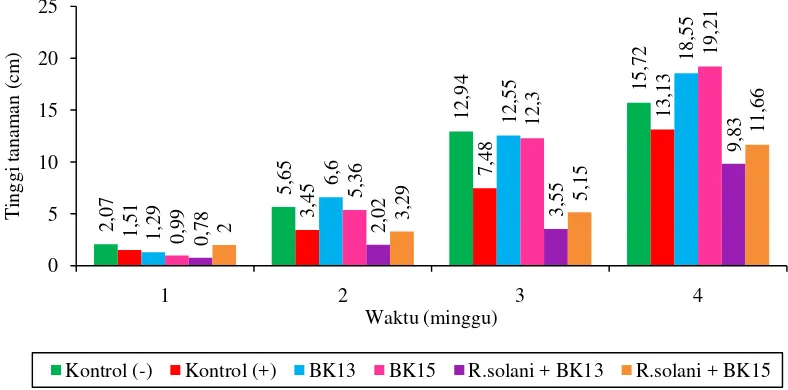
Hasil pengamatan mulai minggu pertama sampai minggu ke-4 menunjukkan
kecambah mengalami penambahan tinggi. Pengamatan tinggi tanaman pada minggu
ke-4 kecambah dengan perlakuan hanya perendaman dengan bakteri, tinggi tanaman
yang paling tinggi adalah Enterobacter sp. BK15 yaitu 19,21 cm dan Bacillus sp.
BK13 yaitu 18,55. Kecambah dengan perlakuan bakteri + jamur tinggi tanaman yang
tertinggi adalah Enterobacter sp. BK15 + R. solani yaitu 11,66 cm dan Bacillus sp.
BK13 + R. solaniyaitu 9,83 cm (Gambar 4.5.3.). Ini karena adanya zat pengatur
tumbuh yang dihasilkan oleh bakteri kitinolitik terhadap tanaman kentang.
Gambar 4.5.3. Perbedaan tinggi kecambah yang diinokulasi R. solani dengan perlakuan bakteri kitinolitik
Menurut Saraswati & Sumarno (2008), penggunaan mikroba sebagai
biopestisida dapat memberikan berbagai manfaat karena selain menghasilkan enzim
juga dapat menghasilkan metabolit pengatur tumbuh, menyediakan hara nutrisi bagi
tanaman dan melindungi tanaman dari gangguan organisme pengganggu tanaman.
Bakteri kitinolitik dapat meningkatkan tinggi tanaman Solanum phureja sebesar
59%-71% (Bautista et al., 2007).
Pada pengamatan jumlah daun diperoleh adanya perbedaan jumlah daun dari
masing-masing perlakuan. Jumlah daun pada minggu ke-4 pengamatan kontrol (-),
2,
BK13 dan BK15 adalah 10 helai, pada perlakuan BK13 + R. solani dan BK15 + R.
solani adalah 8 helai, sedangkan pada kontrol (+) jumlah daun adalah 6 helai (Gambar
4.5.4.). Semangun (2008) menyatakan bahwa pada kondisi yang sesuai R. solani dapat
menyerang tanaman yang sudah besar. Pada bagian pangkal batang berwarna coklat
dan dapat menyerang daun-daun bawah yang menyebabkan matinya daun-daun
(hawar daun).
Gambar 4.5.4. Perbedaan jumlah daun kecambah yang diinokulasi R. solani denganperlakuan bakteri kitinolitik
Salah satu faktor yang mempengaruhi cara bertahan hidup R. solani adalah
suhu.Pengamatan suhu juga menunjukkan kisaran antara 26-32oC. Menurut Blazier &
Conway (2004),suhu optimum pertumbuhan jamur R. solani adalah 20 – 30oC, suhu
minimum 7oC dan suhu maksimum 35oC. Pada suhu yang lebih tinggi Rhizoctonia
akan membentuk sklerotia. Perkecambahan sklerotia yang optimum terjadi pada
kisaran suhu 21−30oC. Pada suhu 0°C hifa akan mati dan tidak dapat membentuk
sklerotia dan pada suhu -10°C sklerotia akan mati.
JamurR. solani banyakditemukan pada musim hujan, terutama pada tanah yang
lembab. Jamur ini dapat membentuk strukturdorman, yaitu sklerotia pada
permukaantanah atau pangkal batang. Sklerotiamempunyai kulit tebal dan keras
sehinggatahan terhadap keadaan lingkungan yang tidak menguntungkan terutama
kekeringandan suhu tinggi. Masa dormanakan berakhir jika kondisi lingkungan cocok
untuk perkembangannya (Sumartini, 2012).
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari semua isolat bakteri kitinolitik yang diuji kemampuan antagonistik ada
dua isolat bakteri kitinolitik yang memiliki potensi paling besar menurunkan
persentase serangan R. solani pada tanaman kentang (uji in vivo) yaitu Bacillus sp.
BK13 sebesar 37,5% dan Enterobacter sp. BK15 sebesar 31,25%. Ke-2 isolat bakteri
tersebut juga memiliki kemampuan menambah tinggi tanaman kentang.
5.2Saran
Perlu adanya penelitian lebih lanjut terhadap isolat kitinolitik ini sehingga bisa
digunakan untuk biopestisida dalam menghambat serangan jamur lain. serta sebagai
salah satu cara untuk mendapatkan bibit kentang yang baik dan tahan terhadap
DAFTAR PUSTAKA
Achmad, Hadi, S., Herlinayana, E. N dan Setiawan, A. 1999. Patogenitas Rhizoctonia solani pada Semai Pinus merkusii dan Acacia mangium. Jurnal Manajemen Hutan Tropika 5(1):11-21.
Agrios, G.N. 2004. Plant Pathology. Fifth Edition. California: Elsevier Academic Press. 593-599.
Badan Pusat Statistik. 2009-2010. Luas Panen, Produksi dan Produktivitas Kentang.
Bautista, G., Henry, M and Daniel. U., 2007. Biocontrol of Rhizoctonia solani in Native Potato (Solanum phureja) Plants Using Native Pseudomonas fluorescens. Acta biol. Colomb. 12(1):19-32.
Blazier, S. W & Conway, K. E. 2004. Characterization of Rhizoctonia solani Isolates Associatedwith Patch Diseases on Turfgrass.Proc. Okla. Acad. Sci.84:41-51.
Chernin, L. S., Ismailov, Z., Haran, S and Chet, I. 1995. Chitinolytic Enterobacter agglomerans Antagonistic toFungal Plant Pathogens. Appl. Environ. Microbiol.61(5):1720-1726.
Chernin, L. S., Michael, K. W., Jacquelyn, M. T., Shoshan, H., Barrie, W. B., Cheat, W and Gordon, S. A. B. 1998. Chitinolytic Activity in Chromobacterium violaceum:Substrate Analysis and Regulation by Quorum Sensing.J. Bacteriol.180(17):4435-4441.
Chien, J. H, Tang KW , Shu C and Chao YC. 2004. Identification of an Antifungal Chitinase from a Potential Biocontrol Agent. Biochem. Mol. Biol.38(1): 82-88.
Donderski, W & M. Swiontek-Brzezińska. 2001. Occurrence of Chitinolytic Bacteria in Waterand Bottom Sediment of Eutrophic Lakesin Ilawskie Lake District.
Polish. J. Environ. Studies. 10(5):331-336.
Garzia, G.V., Onco, M.A.P and Susan, R. 2006. Review. Biology and Systematics of the form genus Rhizoctonia.Span. J. Agric. Res. 4(1):55-79.
Giyanto, Suhendar, A dan Rustam. 2009. Kajian Pembiakan Bakteri Kitinolitik
Pseudomonas fluorescens dan Bacillussp. pada Limbah Organik danFormulasinya Sebagai Pestisida Hayati (BIO-PESTICIDE). Prosiding Seminar Hasil Penelitian IPB:849-858.
Gohel, V., Singh, A. Vimal, M., Ashwini, P and H.S. Chhatpar. 2006. Bioprospecting and antifungal potential of chitinolytic Microorganisms. Afr. J. Biotechnol.
5(2):54-72.
Gooday, G.W. 1990. Physiology of Microbial Degradation of Chitin and Chitosan.
Biodegradation.1:177-190.
Hartus, T. 2001. Usaha Pembibitan Kentang Bebas Virus. Jakarta: Penebar Swadayar. hlm: 1-5,106,117-119.
Herdiana, N. 2007. Uji Pertumbuhan in vitro Patogen Lodoh Rhizoctonia solani Pada Berbagai Tingkatan pH dan Jenis Media Tumbuh. Prosiding Ekspose Hasil-Hasil Penelitian: 155-160.
Lutaladio, N., Ortiz, O., Haverkort, A. and Caldiz, D. 2009. Sustainable Potato Production: Guidelines for Developing Countries. FAO. International Year of The Potato: 1-94.
Lorito, M., G. E. Harman., C. K. Hayes., R. M. Broadway, Tronsmo., S. L. Woo and A. Di Pietro. 1993. Chitinolytic enzymes produced by Trichoderma harzianum: antifungal activity or purified endochitinase and chitobiosidase.
Phytopathol.83(3):302-307.
Mahata, M. E., Abdi, D., Irsan, R and Yose, R. 2008. Characterization of Extracellular Chitinase from BacterialIsolate 99 and Enterobacter sp. G-1 from Matsue City, Japan. Microbiol. Indones. 2(1):34-38.
Muharni & Widjajanti, H. 2011. Skrining Bakteri Kitinolitik Antagonis Terhadap Pertumbuhan Jamur Akar Putih (Rigidoporus lignosus) dari Rizosfir Tanaman Karet. Jurnal Penelitian Sains14(1):51-56.
Papuanga, N. 2009. Aktivitas Penghambatan Senyawa AntimikrobaStreptomyces spp. Terhadap Mikroba Patogen Tular Tanah Secara In Vitro dan In Planta. Tesis. ITB. Bogor.
Pelczar, M.J & E.C.S. Chan. 2005. Dasar - Dasar Mikrobiologi. Jilid 1. Jakarta: Penerbit Universitas Indonesia Press. hlm. 511.
Pujiyanto, S & Wijanarka. 2004. Pemanfaatan Limbah Kulit Udang Sebagai Media Produksi Enzim Kitinase. Laporan Penelitian. UNDIP. Semarang.
Purwantisari, S., Pujiyanto, S. dan Ferniah, R. S. 2005. Uji Efektivitas Bakteri Kitinolitik Sebagai Pengendali Pertumbuhan Kapang Patogen Penyebab Penyakit Utama Tanaman Sayuran dan Potensinya Sebagai Bahan Biofungisida Ramah Lingkungan. Laporan Penelitian. UNDIP. Semarang.
Rajarathanam S. Shashrieka & Bano Z. 1998. Biodegradative and Biosynthetic Capacities of Mushrooms. Present and Future Strategies. Crit. Rev. Biotech. 18:23 – 91.
Rich, A. E. 1983. Potato Diseases. New York : Academic Press. hlm:63-69.
Saraswati & Sumarno. 2008. Pemanfaatan Mikroba Penyubur Tanaman Sebagai Komponen Pertanian. Iptek Tanaman Pangan. 3(1):41-58.
Semangun, H. 2008. Penyakit - Penyakit Tanaman Pangan di Indonesia. Edisi kedua.Cetakan Pertama. Yogyakarta: Gadjah mada University Press. hlm 151-158, 164, 198.
Siregar C. S. 2003. Identifikasi Penyebab Bercak dan Hawar Daun pada Rumput
Zoysia japonica dan Zoysia matrella di Kebun Percobaan Rumput Cikabayan.
Skripsi. IPB. Bogor.
Soelarso, B. 1997. Budidaya Kentang Bebas Penyakit. Yogyakarta: Kanisius. hlm. 49, 64-67.
Soesanto, L. 2008. Pengantar Pengendali Hayati Penyakit Tanaman. Jakarta:PT Raja Grafindo Persada. hlm. 1,75-76,101-160, 245-338.
Suryanto, D. 2001. Selection and Characterization of Bacterial Isolates for Monocyclic Aromatic Degradation. Disertasi. IPB. Bogor.
Suryanto, D & Munir, E. 2006. Potensi pemanfaatan isolat kitinolitik lokal untuk pengendalian hayati jamur. Prosiding Seminar Hasil-hasil Penelitian. FMIPA USU. 15-25.
Suryanto, D., Patonah, S. dan Munir, E. 2010. Control of Fusarium Wilt of Chili With Chitinolytic Bacteria.Hayati J. Biosci. 17(1):5-8.
Suryanto, D., Irawati, N. dan Munir, E. 2011. Potensi Bakteri Kitinolitik Lokal Asal Sumatera Utara dalam Menghambat Pertumbuhan Beberapa Jamur Patogen Tanaman. Microbiol. Indones. 5(3):144-148.
Suryanto, D., Rizky, H. W., Edy, B. M. S. dan Munir, E. 2012. A Possibility of Chitinolytic Bacteria Utilization to Control Basal Stems Disease Caused by
Ganoderma boninense in Oil Palm Seedling. Afr. J. Microbiol. Res.6(9) :2053-2059.
DAFTAR LAMPIRAN
Semua bahan dicampur dan ditambahkan akuades sampai volumenya menjadi
satu liter. Diatur pH sampai 6.8 dengan penambahan NaOH 0,1 N. Setelah dicapai pH
yang diinginkan, medium disterilisasi dengan autoklaf pada suhu 121oC dan tekanan 2
bar selama 15 menit.
Penyiapan Media Tanam
Disaring
Dimasukkan ke dalam plastik tahan panas
Disterilkan dengan menggunakan autoklaf pada suhu 121oC selama 15 menit
Tanah + Kompos 3:1
LAMPIRAN 2
Bakteri Kitinolitik
(a) isolat bakteri kitinolitik, (b) suspensi bakteri BK13 dan BK15, (c) TPC BK13, (d)
TPC BK15.